Область техники, к которой относится изобретение
Группа изобретений относится к биотехнологии и медицине, и представляет собой способ получения хрящеподобных структур из стволовых клеток с индуцированной плюрипотентностью, а также структуры, полученные указанным способом.
Уровень техники
Индуцированные плюрипотентные стволовые клетки (ИПСК) (клетки с индуцированной плюрипотентностью) - тип плюрипотентных стволовых клеток, получаемых из соматических клеток путем их перепрограммирования методами генетической инженерии. ИПСК обладают неограниченным пролиферативным потенциалом и могут дифференцироваться в любые типы клеток.
Мезенхимные стволовые клетки (МСК) - мультипотентные клетки, обладающие способностью дифференцироваться в клетки костной, хрящевой и жировой тканей.
Сфероиды - трехмерные клеточные культуры, которые самопроизвольно собираются (агрегируют) из диспергированных клеток в процессе культивирования в статичных условиях в органоподобные/тканеподобные структуры.
Под хрящеподобными структурами в предлагаемой группе изобретений понимаются хондроцитарные сфероиды с высокой степенью дифференцировки хондроцитов, содержащие внеклеточный матрикс (ВКМ).
Под динамическими условиями (динамической средой) в предлагаемой группе изобретений понимается жидкая среда, перемешиваемая встряхиванием на орбитальном шейкере или перемешиваемая иным способом без разрушения находящихся в этой среде клеток или клеточных структур.
Одним из подходов для решения проблемы восстановления хрящевой ткани является использование клеточных технологий с применением ИПСК, обладающих большим потенциалом к дифференцировке и являющихся неограниченным источником клеточного материала для тканевой инженерии. Однако стандартизированных протоколов хондрогенной дифференцировки ИПСК нет, что свидетельствует о несовершенстве известных способов.
Известно, что ткань гиалинового хряща обладает достаточно низкой способностью к заживлению из-за особенностей своей организации. В связи с этим, большая часть дефектов хряща, вызванных травмами, очаговыми поражениями или процессами дегенерации без должной терапии прогрессирует до таких заболеваний, как, например, артроз, что негативно влияет на качество жизни. Многообещающий подход для решения этой проблемы - применение клеточных технологий, позволяющих компенсировать потерю функционально активных клеток в зоне повреждения ткани и вызывающих эффективное заживление. Такая клеточная терапия в клинике проводится уже более 10 лет компанией CO.DON (ФРГ), в которой лечение поврежденных суставных хрящей реализуется с использованием аутологичных хондроцитов, что позволяет получать фенотипически стабильный хрящ при заживлении [1-3]. Однако трансплантация аутологичных хондроцитов хоть и является доказано успешным методом восстановления повреждений гиалинового хряща, но достаточно инвазивна: для получения донорского материала необходимо проведение биопсии [4, 5]. Кроме того, из-за ограниченного количества клеточного материала требуется длительное культивирование, при котором имеется риск потери клетками хондрогенных свойств и их дифференцировка в фибробласты, что может привести к фиброзу после трансплантации [4, 5]. В связи с этими недостатками выбор альтернативных клеточных ресурсов особенно актуален.
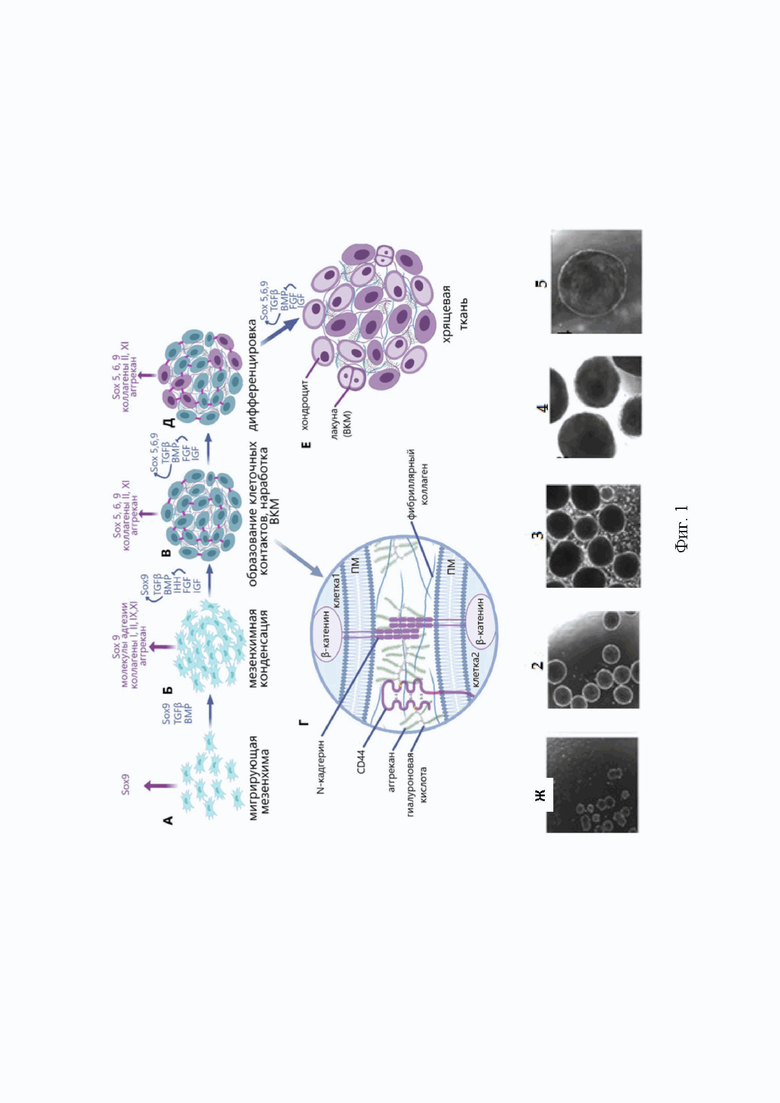
Одним из перспективных клеточных источников на данный момент являются ИПСК. Благодаря таким свойствам, как плюрипотентность, широкий потенциал дифференцировки во все типы соматических клеток, включая хондроциты, а также неограниченная способность к самообновлению, ИПСК имеют сходство с эмбриональными стволовыми клетками (ЭСК), при этом их получение не связано с этическими проблемами [4, 6, 7]. В технологии получения ИПСК могут быть использованы любые соматические клетки организма [5, 8]. Хондроциты, дифференцированные из ИПСК, проявляют ювенильный фенотип, что выражается в высокой скорости пролиферации и усиленной выработке внеклеточного матрикса. Данная особенность способствует более эффективному заживлению суставных дефектов [4, 5]. Таким образом, ИПСК представляют собой перспективный источник клеток, позволяющий получить большое количество биоматериала для клеточных технологий. Однако, несмотря на большое число исследований, отсутствует стандартизированный протокол, обеспечивающий качественную дифференцировку по хондрогенному пути [9]. Активно используется метод направленной дифференцировки, что в грубом приближении воспроизводит события хондрогенеза [10]. При этом чаще применяют рекомбинантные белки, соответствующие основным хондроиндукторам в процессах развития, а также их различные комбинации (Фиг. 1).
Для дифференцировки по хондрогенному пути in vitro широко применяют белки надсемейства трансформирующего фактора роста β (TGFβ), такие как, собственно, TGFβ и семейство костных морфогенетических белков (ВМР2). В исследовании, где в качестве фактора дифференцировки использовали только TGFβ3, в культурах ИПСК наблюдали неполный хондрогенез [11]. Более качественные результаты были получены в работах с применением комбинации TGFβ1 и BMP2 [12]. Еще одним подходом к увеличению эффективности хондрогенеза in vitro является включение предварительного этапа дифференцировки в МСК-подобную популяцию клеток. Эту стратегию использовали в «классическом» протоколе [3] с предварительной индукцией мезенхимных предшественников c помощью Wnt3a и Активина А. Затем проводили хондрогенную индукцию с помощью TGFβ1 и ВМР2, что позволило получить хрящеподобные структуры с высокой экспрессией хондрогенных маркеров и низким уровнем гипертрофии. Тот же протокол, но с увеличенным временем культивирования, тоже привел к результатам, демонстрирующим эффективный хондрогенез, а при подкожной пересадке полученных структур мыши образовывался хрящ ювенильного фенотипа с большим содержанием протеогликанов [4]. Ретиноевая кислота (РК) и ретиноиды необходимы для развития конечностей, поскольку отвечают за активацию Hox-генов, участвующих в определении области формирования зачатка [13]. Так, комбинация ингибитора киназы гликоген-синтазы-3 (GSK-3) Chir 99021 (6-[[2-[[4-(2,4-дихлорфенил)-5-(5-метил-1H-имидазол-2-yl)-2-пиримидинил]амино]этил]амино]-3-пиридинкарбонитрил) и РК in vitro способствовала направленной дифференцировке в хондроциты за короткие сроки [14]. К тому же, низкомолекулярные соединения достаточно просты в использовании, эффективно доставляются в клетки и неиммуногенны [15]. Недостатком стандартного подхода к 2D-культивированию является то, что он не соответствует естественному окружению клеток и значительно ограничивает дифференцировку [16]. Клетки в условиях как in vivo, так и in vitro нуждаются в трехмерном окружении.
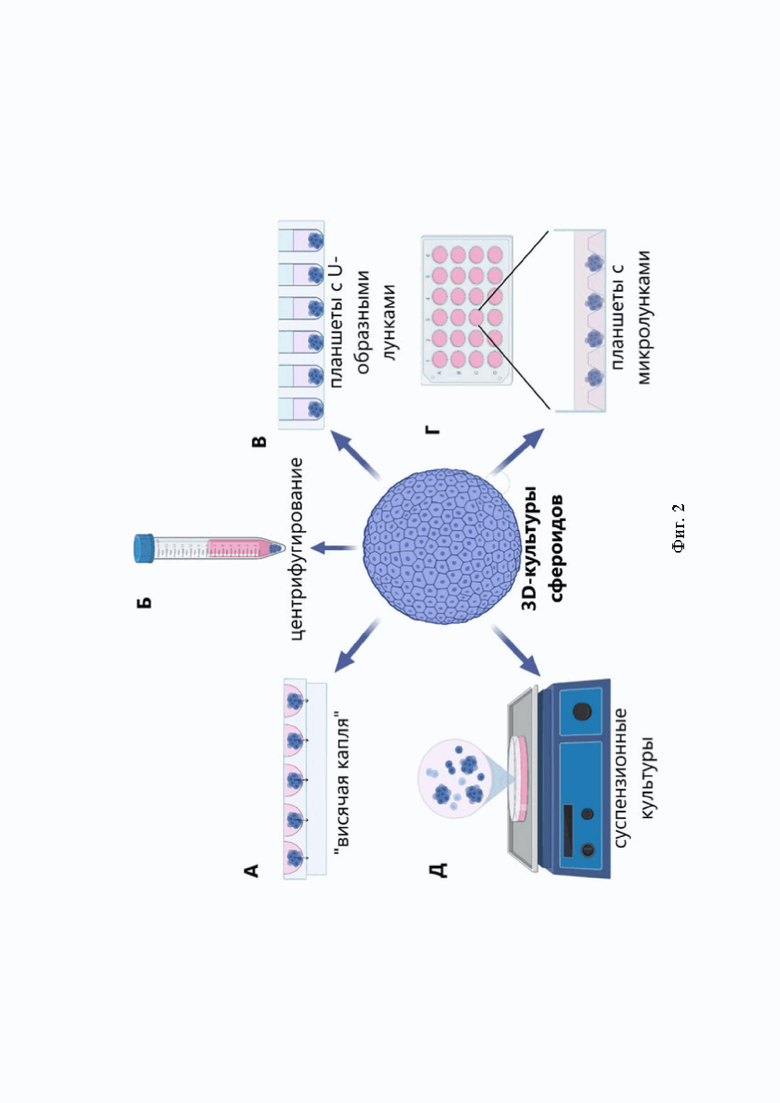
Одним из распространенных методов 3D-культивирования и дифференцировки клеток является получение сфероидов [17, 18]. Было продемонстрировано, что использование культур сфероидов значительно улучшает пролиферацию клеток с сохранением фенотипа и ключевых сигналов [16, 19]. К тому же, данная методика 3D-культивирования имитирует процесс мезенхимной конденсации в раннем развитии хряща [20]. Способы получения сфероидов разнообразны и включают метод висячей капли [21, 22], центрифугирования суспензии клеток определенной плотности [23-25], самоаггрегации в сфероиды в суспензионных культурах [2], с помощью планшетов с U-образными лунками или микролунками [26-28], а также с использованием биоматериалов [29, 30].
Таким образом, задачей настоящего изобретения является создание нового способа получения хрящеподобной ткани, избавленного от недостатков известных способов.
Раскрытие изобретения
Авторы дифференцировали ИПСК по хондрогенному пути с помощью четырех протоколов («долгий», «короткий», «комбинированный», и с кондиционированной средой от первичной культуры аутологичных хондроцитов) при различном сочетании факторов TGFβ1, BMP2, Chir 99021 и РК. Для получения сфероидов использовали планшеты с микролунками. Профили синтеза и экспрессии оценивали с помощью методов иммуноцитохимического окрашивания, ПЦР в реальном времени, а также гистологического окрашивания. Высокие показатели синтеза и экспрессии хондрогенных маркеров Sox9, аггрекана, коллагена II типа наблюдали в сфероидах «долгого», «комбинированного» протоколов и протокола с кондиционированной средой. Хондрогенез наиболее эффективно проходил при использовании «комбинированного» протокола дифференцировки. Высокую эффективность показало также использование кондиционированной среды для индукции и поддержания хондрогенной дифференцировки.
Дифференцировка в монослойных культурах
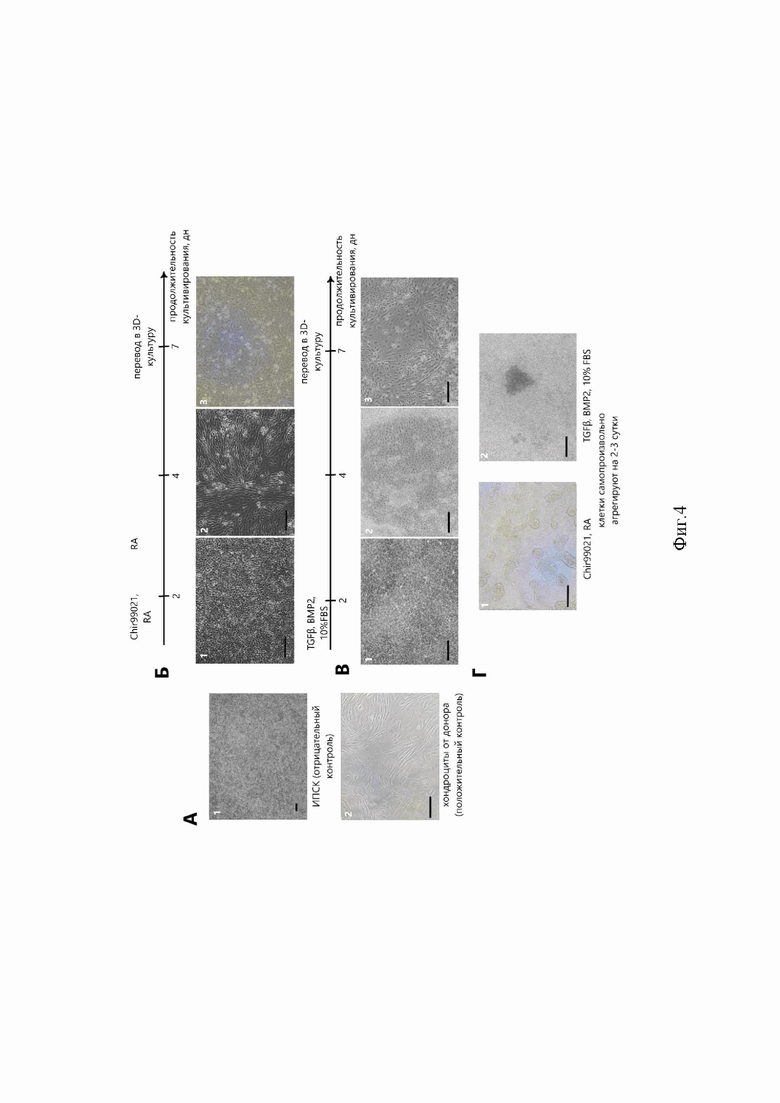
Недифференцированные культуры ИПСК представляли собой плотные колонии мелких клеток с высоким ядерно-цитоплазматическим соотношением, морфология колоний описана ранее [36]. На вторые сутки после начала дифференцировки путем воздействия Chir 99021 и РК или рекомбинантных факторов TGFβ1, BMP2 и 10% эмбриональной бычьей сыворотки (FBS) клетки приняли округлую форму. При этом при дифференцировке по протоколам с Chir 99021 наблюдали усиление клеточной гибели, оцененной с помощью окраски раствором трипанового синего (возрастание мёртвых, включивших краситель, клеток достигало до 30-35% популяции). На 4-е сутки дифференцировки клетки приобрели полигональную и вытянутую форму. На 7-е сутки заметили отдельные популяции хондроцитоподобных клеток, которые имели округлую форму и крупное ядро. Также на 2-3-и сутки в культурах экспериментальных групп наблюдали почкующиеся скопления клеток, что было особенно выражено в культурах, дифференцированных по протоколу с Chir 99021.
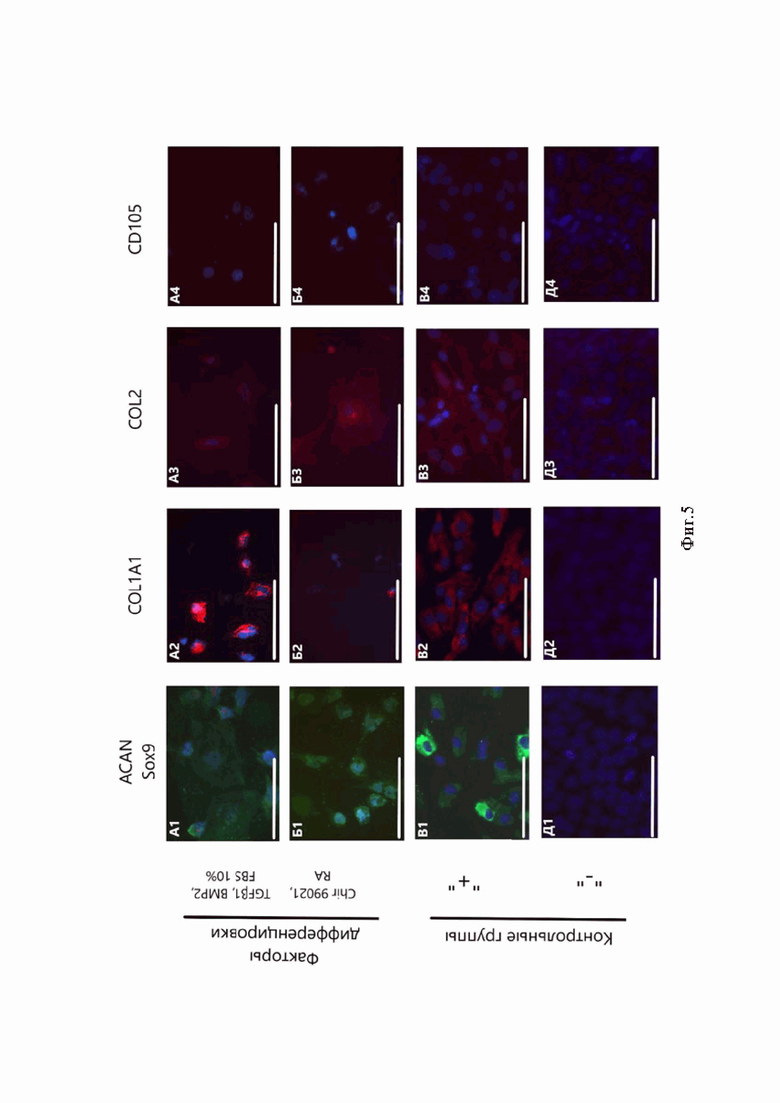
При анализе результатов иммуноцитохимии наблюдали значительную флуоресценцию аггрекана и коллагенов I и II типа в монослойных культурах протоколов как с применением рекомбинантных факторов TGFβ1 и BMP2, так и Chir 99021 и РК (Фиг. 2). Однако синтез Sox9 оказался наиболее выраженным в культурах, дифференцированных с задействованием TGFβ1 и ВМР2 (Фиг. 2А1). Синтез мезодермального маркера CD105 был низким в экспериментальных и контрольных группах (Фиг. 2, А4-Д4), хотя небольшой сигнал наблюдали в культурах, дифференцированных Chir 99021 (Фиг. 2, Б4).
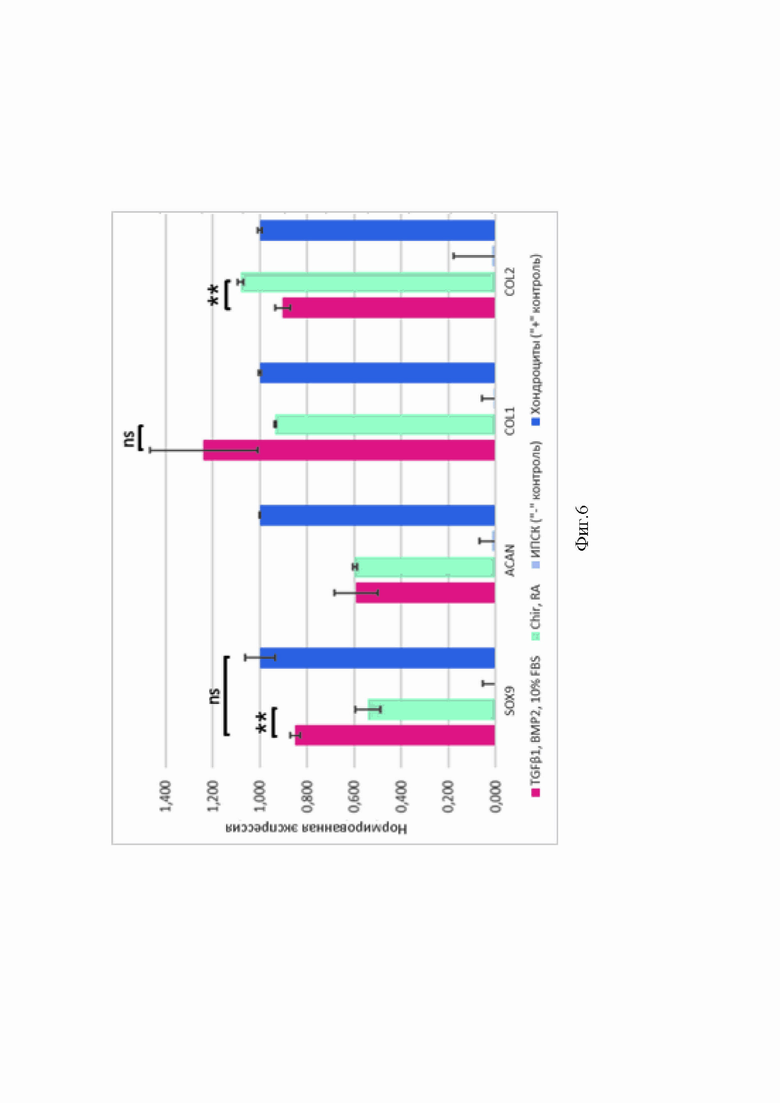
При анализе результатов ПЦР в реальном времени в образцах наблюдали показатели экспрессии хондрогенных маркеров, сопоставимые с таковыми в положительной контрольной группе (культура хондроцитов, полученная из биопсийного материала хрящевой ткани пациентов). При использовании белковых факторов TGFβ1 и BMP2 показатели экспрессии SOX9 были выше, чем при использовании только Chir 99021 и РК (Фиг. 3).
Дифференцировка в культурах сфероидов
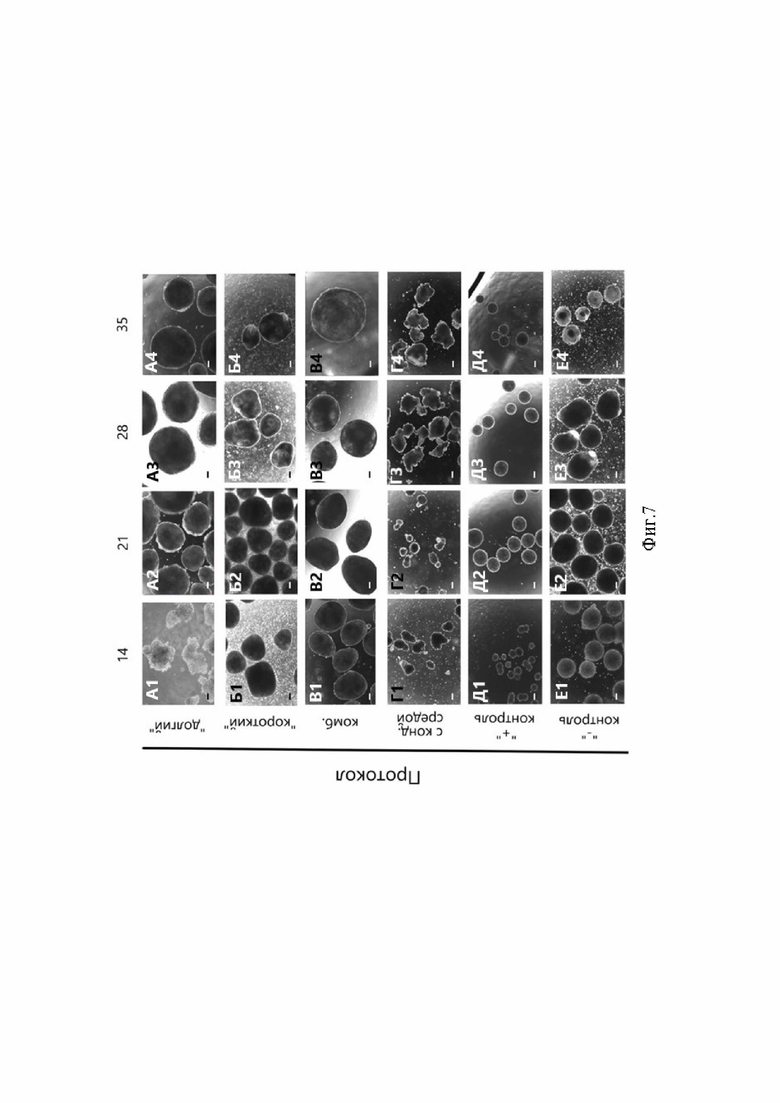
Сразу после перемещения сформированных рыхлых клеточных агрегатов в условия 3D-культивирования в динамических условиях (встряхивание на орбитальном шейкере), они приобретали неправильную форму и неровную поверхность, но на 35-е сутки дифференцировки сфероиды всех протоколов и контрольных групп неожиданно приобретали вид беловатых полупрозрачных конструкций с гладкой блестящей поверхностью (Фиг. 1, Ж), что свидетельствует о полноценной имитации процесса мезенхимной конденсации. Этого не происходило в 3D-культурах протокола с кондиционированной средой. Поскольку полученные авторами агрегаты имели крайне рыхлую структуру, можно было бы ожидать, что они вообще не смогут образовать сфероиды правильной формы, а наоборот, будут разрушаться в динамических условиях, однако авторами было неожиданно обнаружено обратное. В динамической среде удавалось вырастить правильной формы сфероиды, причем в процессе культивирования не происходило их механического истирания или адгезии к поверхности культурального пластика.
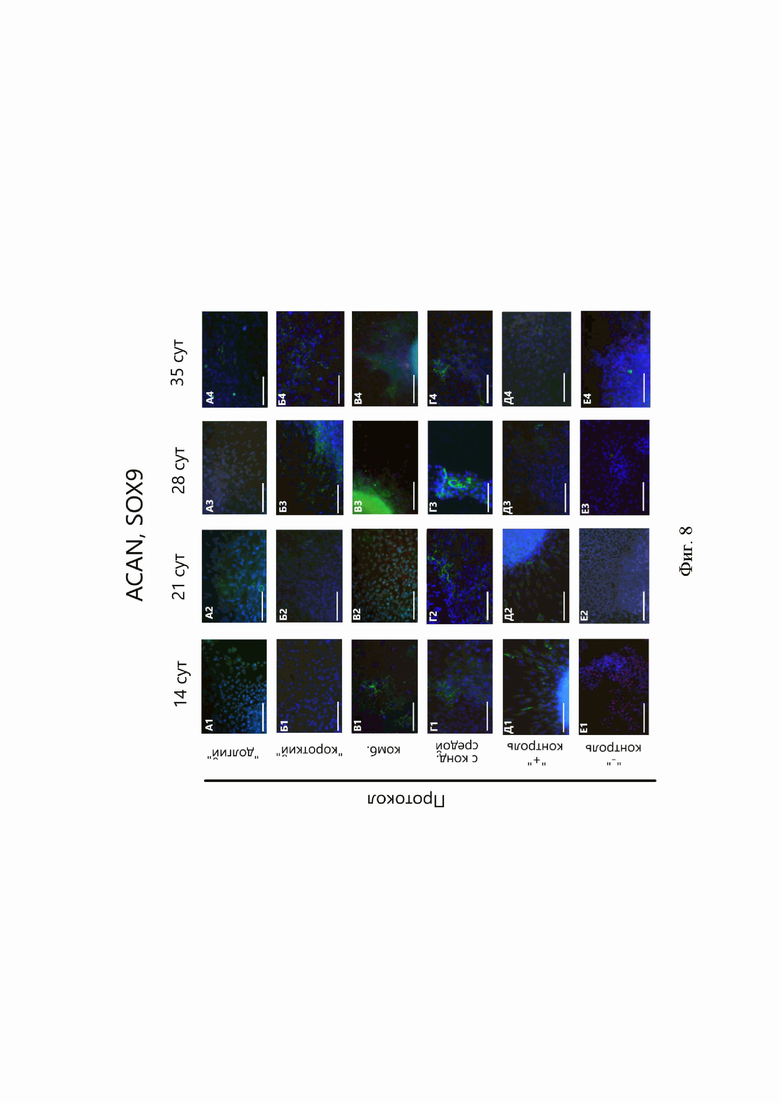
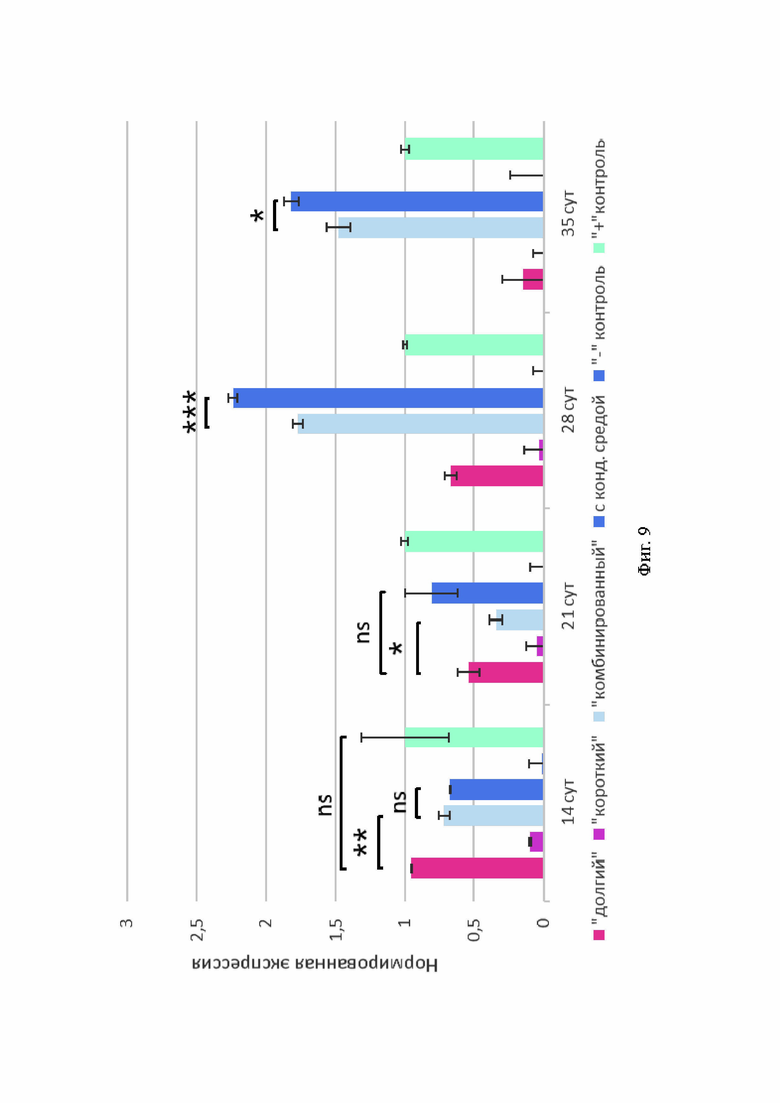
В культурах сфероидов на 14-е и 21-е сутки дифференцировки наблюдали неинтенсивную флуоресценцию аггрекана в конструкциях всех протоколов (Фиг. 8). Наибольшую интенсивность флуоресценции данного маркера фиксировали на 28-е и 35-е сутки в сфероидах «комбинированного» протокола (Фиг. 8, В3, 4). На 21-е и 28-е сутки наблюдали также высокий синтез аггрекана в сфероидах протокола с кондиционированной средой (Фиг. 8, Г1-3). Уровень экспрессии ACAN, сопоставимый с показателями в сфероидах положительной контрольной группы, наблюдали в образцах «долгого», «комбинированного» протоколов и протокола с кондиционированной средой. При этом на 28-е и 35-е сутки дифференцировки экспрессия ACAN значительно увеличилась в сфероидах «комбинированного» протокола и протокола с кондиционированной средой (Фиг. 5, А).
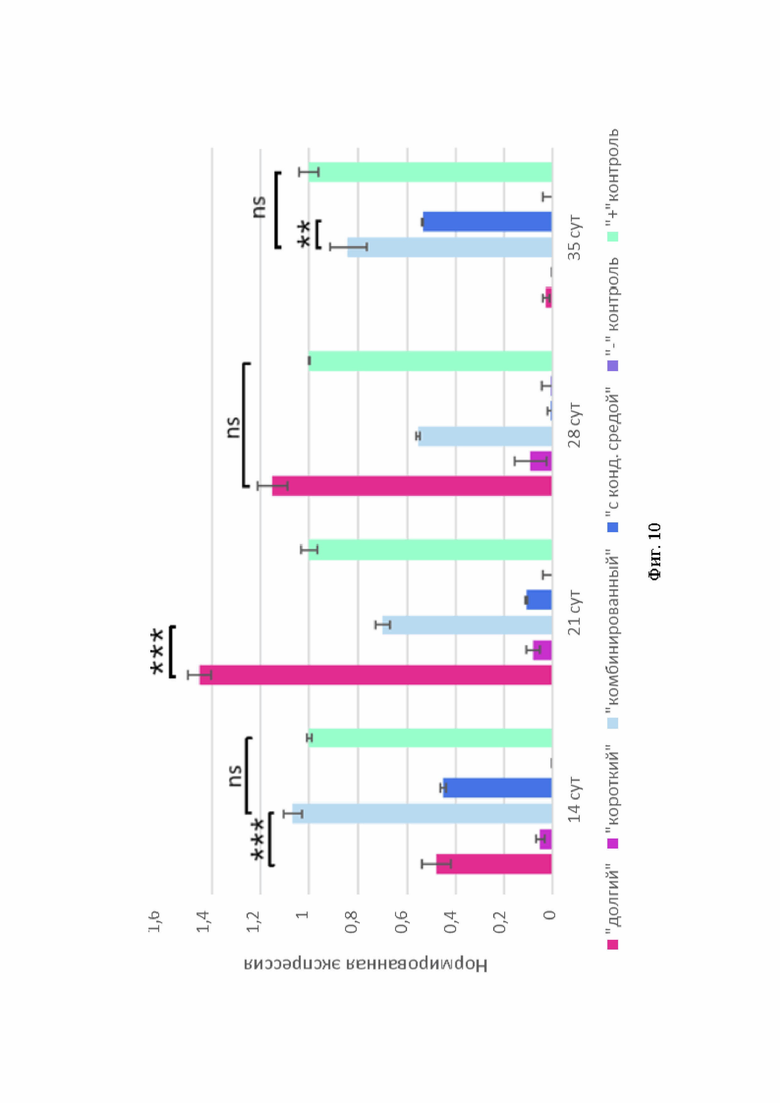
Синтез Sox9 наблюдали в сфероидах «комбинированного» протокола на каждом временном этапе, при этом прослеживалось увеличение интенсивности флуоресценции этого маркера по мере дифференцировки (Фиг. 8, В1-4). Интенсивные флуоресцентные сигналы Sox9 отмечали и на 28-е сутки в сфероидах «долгого» протокола и на 35-е сутки в сфероидах протокола с кондиционированной средой (Фиг. 8, А3 и Г4). В сфероидах группы отрицательного контроля тоже зафиксировали флуоресценцию данного маркера (Фиг. 8, Е1-4). Проведенный ПЦР-анализ экспрессии SOX9 сравним с показателями в группе положительного контроля, что наблюдали в образцах «долгого» и «комбинированного» протоколов (Фиг. 10).
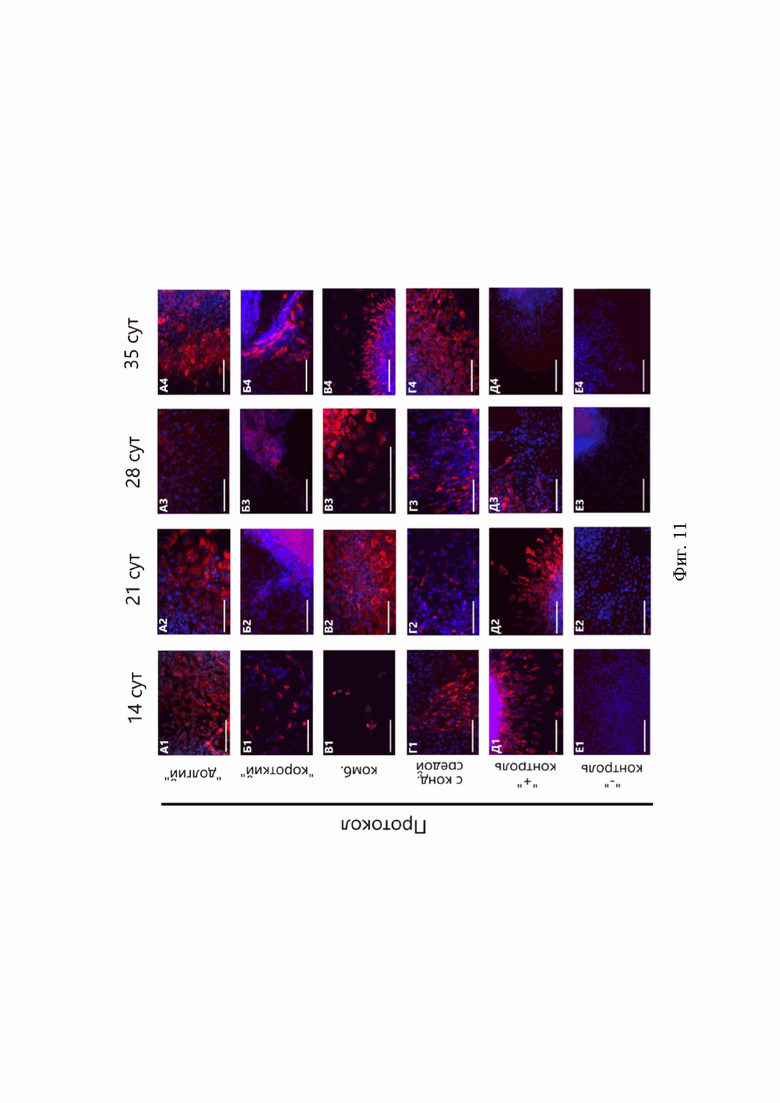
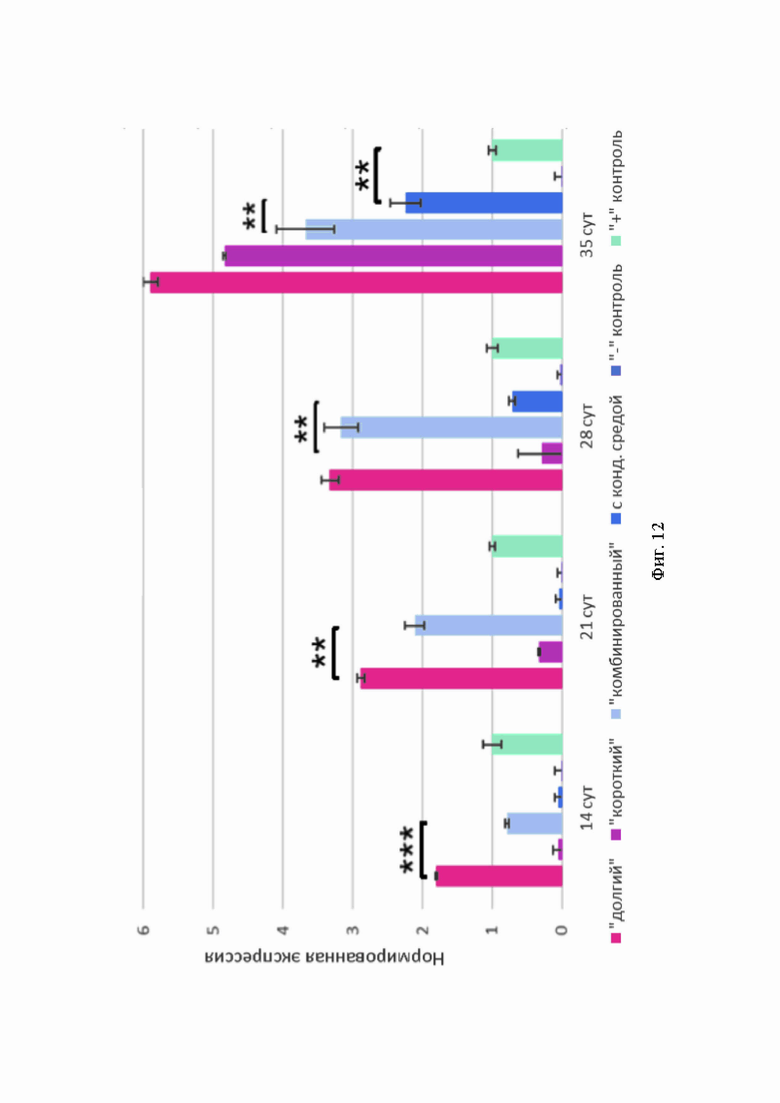
Высокую интенсивность флуоресценции коллагена I типа фиксировали во всех экспериментальных группах, но наибольшую - в сфероидах «долгого» и «комбинированного» протоколов. Экспрессия COL1A2 увеличивалась по мере дифференцировки в сфероидах, полученных по всем протоколам (Фиг. 11, А). Наиболее высокие показатели наблюдали в образцах «долгого» и «комбинированного» протоколов (Фиг. 12).
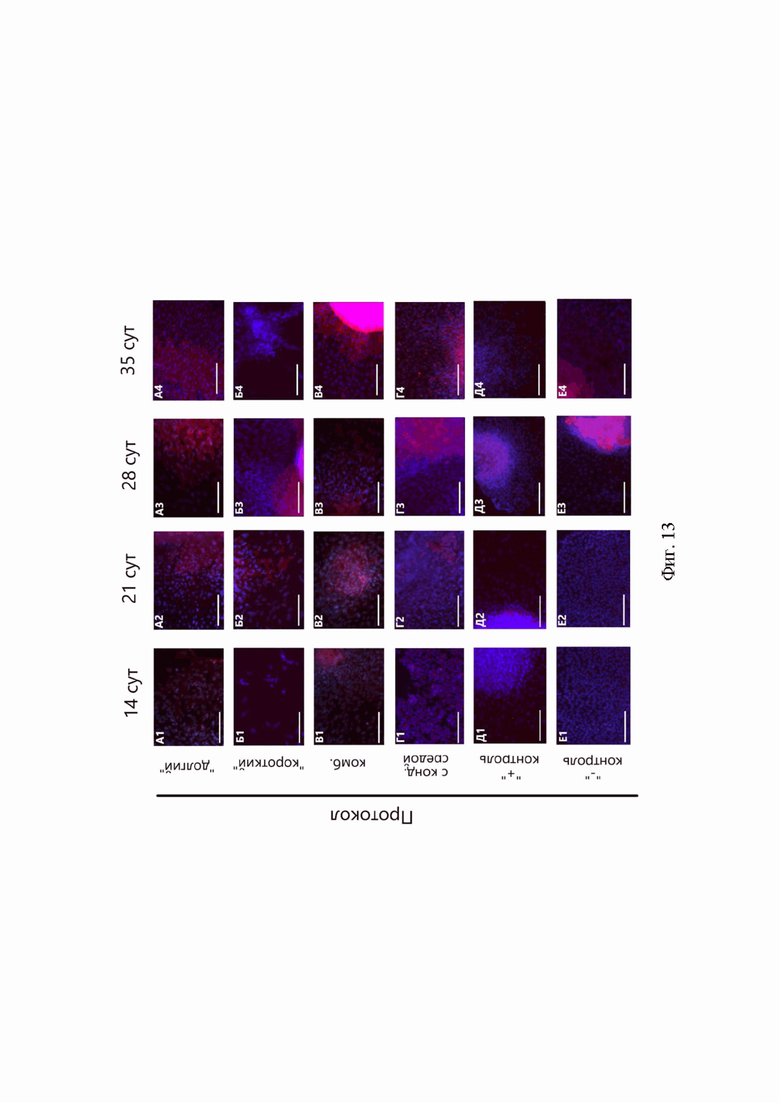
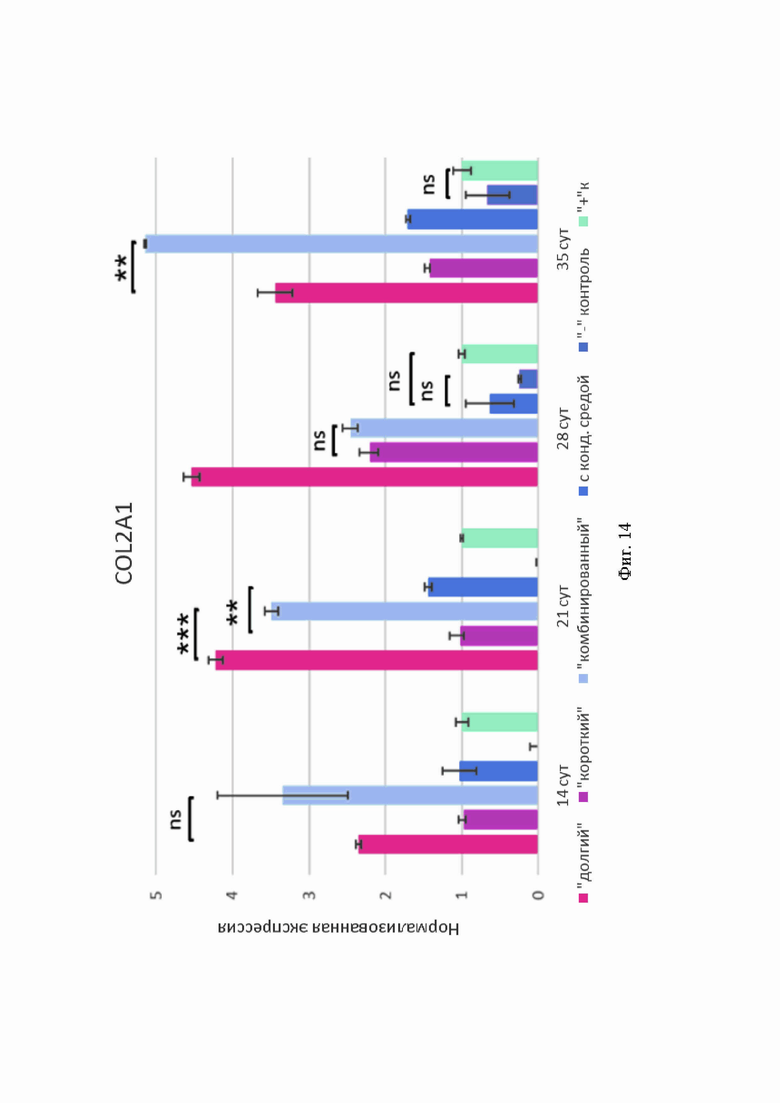
В сфероидах «долгого», «комбинированного» протоколов и протокола с кондиционированной средой наблюдали высокую интенсивность флуоресценции коллагена II типа, при этом можно отметить, что она увеличивалась со временем. Выраженную экспрессию COL2A1 наблюдали в сфероидах всех протоколов дифференцировки (Фиг. 13, Б). Максимальные показатели были отмечены в образцах «долгого» и «комбинированного» протоколов - они превышали экспрессию в положительной контрольной группе в несколько раз.
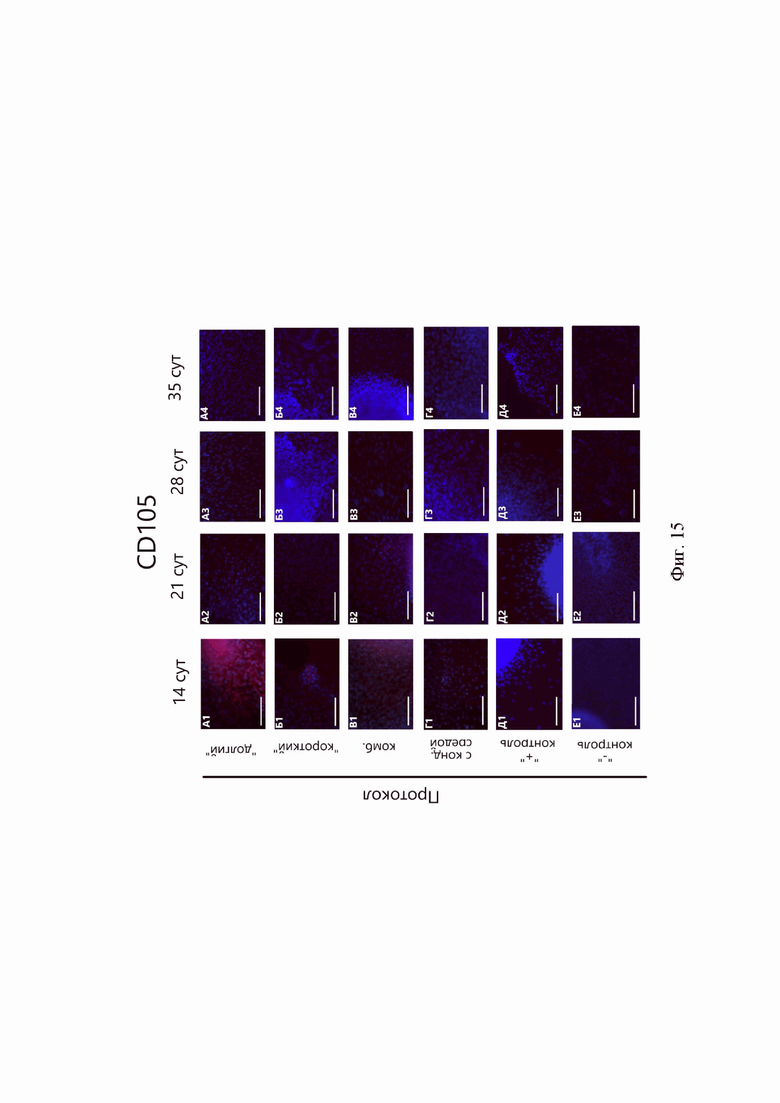
Синтез CD105 выявлен в начале культивирования в 3D-условиях, при этом флуоресценция данного маркера была хорошо выражена в сфероидах «долгого» и «комбинированного» протоколов, но к концу дифференцировки значительно снизилась (Фиг.15).
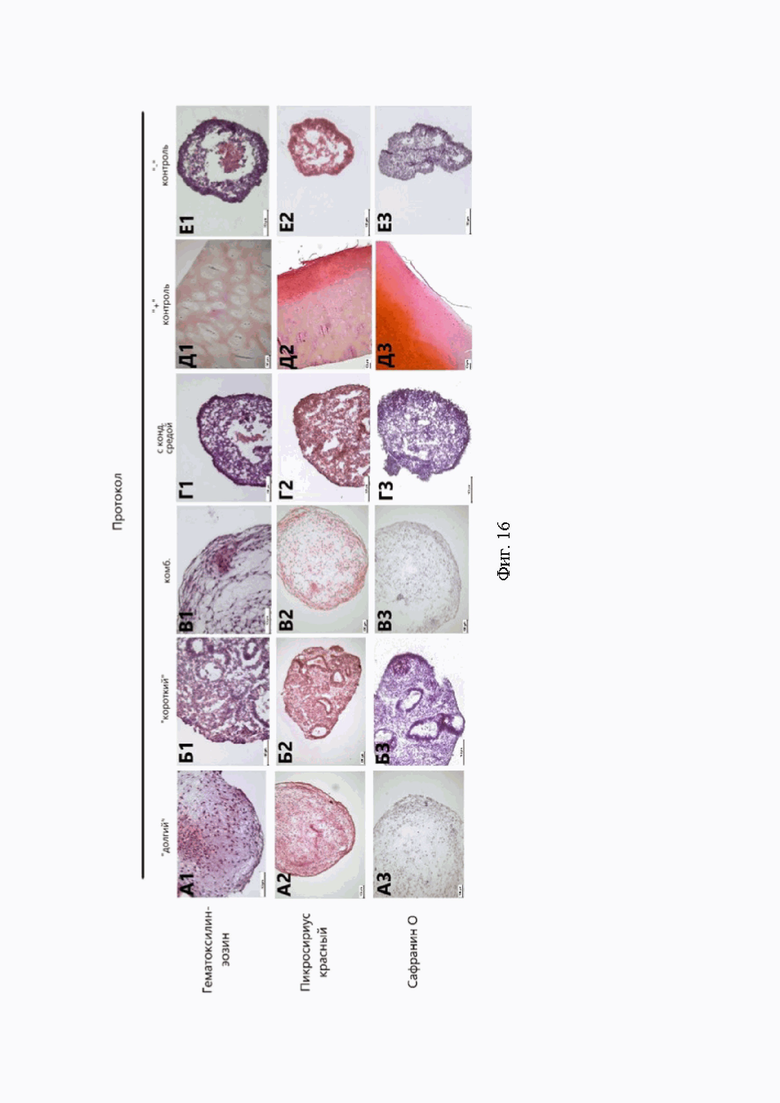
При анализе результатов гистологического окрашивания пикросириусом красным сфероидов, полученных с помощью «долгого» и «комбинированного» протоколов, наблюдали ярко-розовые коллагеновые волокна по всей площади среза (Фиг. 16). Однако окрашивание сфероидов всех протоколов сафранином О было неинтенсивным (Фиг. 16).
При сравнении морфологических характеристик монослойных культур мы отметили, что дифференцировка ИПСК происходит при использовании как Chir 99021 и РК, так и TGFβ, ВМР2 и 10% FBS. Вытянутая полигональная форма клеток на 4-е сутки может говорить о приобретении клетками МСК-подобной морфологии при хондрогенной индукции. Усиленная клеточная гибель, которую мы наблюдали в культурах, диференцированных с помощью Chir 99021 и РК, скорее всего, связана с действием Chir 99021, так как по данным прошлых экспериментов эта молекула усиливает апоптическую активность [14]. Самоагрегирование клеток с образованием гиалиноподобных структур характерно для ранних этапов хондрогенной дифференцировки, когда происходит активное образование и накопление молекул адгезии (10).
Положительное влияние экзогенного присутствия TGFβ1 и ВМР2 на синтез и экспрессию Sox9 в монослойных культурах, скорее всего, связано с участием этих молекул в стимуляции и стабилизации выработки данного транскрипционного фактора [37]. Поскольку Chir имитирует сигналы, индуцирующие мезодерму, присутствие CD105 может быть объяснено соответствием культуры на данной стадии дифференцировки ранней прехондрогенной мезенхиме [1, 14]. Можно заключить, что использование как TGFβ1, BMP2 и 10% FBS, так и Chir 99021 и РК, приводит к достаточно эффективной дифференцировке в монослойных культурах.
Для получения сфероидов использовались планшеты с микролунками. Клетки в таких планшетах агрегируют под действием силы тяжести, образуя клеточные конгломераты, которые иногда могут иметь неправильную форму [27]. Хрящеподобные структуры, которые были получены другими исследователями с помощью культур сфероидов, в итоге имели вид полупрозрачных беловатых структур с гладкой поверхностью [3]. Мы наблюдали подобные характеристики у сфероидов всех протоколов на последних этапах культивирования, кроме протокола с кондиционированной средой. Это может быть связано с тем, что при использовании данного протокола темпы компактизации более медленные, и клетки внешнего слоя не наработали достаточного количества молекул межклеточных контактов.
В нашем исследовании в протоколах с использованием TGFβ1 и ВМР2 мы наблюдали достаточно высокие показатели экспрессии хондрогенных маркеров. Кроме того, мы имели дело с самопроизвольной дифференцировкой ИПСК в сфероидах отрицательного контроля, так как отмечали флуоресцентные сигналы Sox9 и коллагена II типа, а также экспрессию COL2A1. Выработка хрящевого ВКМ - во многом механозависимый процесс, поэтому мы могли наблюдать синтез коллагена II типа в ответ на нахождение клеток в динамических условиях [38, 39].
Синтез CD105 на 14-е и 21-е сутки в культурах сфероидов можно объяснить переходом от МСК-подобного фенотипа к хондроцитарному по мере дифференцировки клеток в сфероидах. In vivo CD105 наряду с другими поверхностными маркерами, такими как CD34, CD44, CD45, служит одним из маркеров, характерных для прехондрогенных мезенхимных клеток [1, 18].
Повышенные синтез и экспрессия коллагена I типа в сфероидах всех протоколов говорят о том, что конечные хрящеподобные структуры обладают смешанным фенотипом, совмещающим гиалиновую и волокнистую ткани. Наиболее сильная экспрессия COL1A2 наблюдается в образцах сфероидов протоколов, в которых использовали 10% FBS. В некоторых исследованиях упоминается фибротический эффект сыворотки, связанный с усилением синтеза коллагена I типа, поэтому вероятно, что высокие показатели этого коллагена могут быть обусловлены ее присутствием в среде для дифференцировки [40, 41].
При гистологическом анализе мы не обнаружили значимого присутствия протеогликанового матрикса в препаратах, окрашенных сафранином О. В связи с этим, можно предположить, что полученные структуры соответствуют хрящам на ранней стадии хондрогенеза. Возможно, для выработки большего количества протеогликанового матрикса, детектируемого сафранином О, возможно, необходимо более длительное время культивирования. Так, в предыдущих работах сфероиды в возрасте 28 суток культивирования слабо окрашивались сафранином О, в то время как в возрасте 42 суток окрашивались интенсивно [3].
Таким образом, в ходе нашего исследования были впервые получены образцы хрящеподобной ткани из ИСПК с использованием четырех протоколов. Сравнительный анализ протоколов показал, что хондрогенез наиболее эффективно протекает в культурах 3D-сфероидов, дифференцированных с использованием «комбинированного» протокола, в котором авторы применили Chir 99021 и РК для дифференцировки монослойных культур и TGFβ1, BMP2 и 10% FBS для дифференцировки культур сфероидов.
Таким образом, наиболее предпочтительным вариантом осуществления настоящего изобретения является способ получения хрящеподобных структур согласно «комбинированному протоколу». К основным техническим результатам предлагаемого способа относятся:
1) возможность использования в качестве «сырьевых» клеток ИСКП пациента, обладающих неограниченным потенциалом к пролиферации дифференцировки в отличие от сфероидов известных из [42] и [43], получаемых из хондроцитов донорского материала;
1) высокий уровень дифференцировки получаемых хондроцитарных сфероидов (хрящеподобных структур) при сроке культивирования 4 недели, выражающийся, в частности, в высокой интенсивности флуоресценции коллагена II типа при выраженной экспрессии COL2A1;
2) низкая степень слияния сфероидов;
3) хорошая масштабируемость способа;
4) отсутствие необходимости использования различных носителей, матриц и прочих биополимерных покрытий (например, агарозы) для предотвращения адгезии сфероидов к поверхности культурального пластика и способных влиять на физиологические и морфологические характеристики клеток;
5) короткий срок созревания - формирования хондроцитарного сфероида из дифференцированных производных (хрящевого импланта), равный 1 дню.
Краткое описание чертежей
Для пояснения сущности заявляемого технического решения к описанию приложены Фиг. 1-16.
Фиг. 1. Общая схема процессов хондрогенеза. А - миграция мезенхимы; Б - прехондрогенная мезенхимная конденсация; В - образование клеточных контактов, синтез ВКМ; Г - межклеточное пространство и микроокружение дифференцирующихся клеток; Д - начало дифференцировки по хондрогенному пути; Е - образование хрящевой ткани.
Фиг. 2. Методы получения 3D-культур сфероидов. А - метод «висячей капли», Б - метод центрифугирования суспензии клеток, В - использование планшетов с U-образными лунками, Г - использование планшетов с микролунками, Д - метод суспензионных культур.
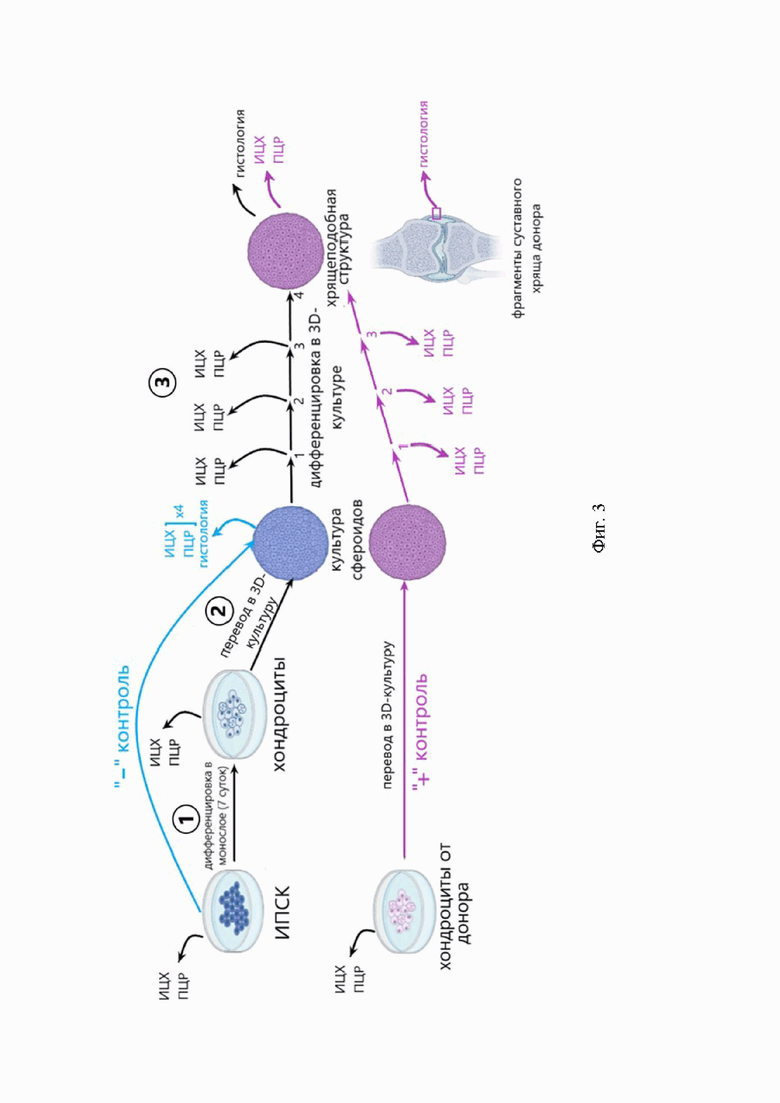
Фиг. 3. Общая схема эксперимента. Можно выделить 3 основных этапа работы: 1 - дифференцировка по хондрогенному пути в монослойных культурах; 2 - перевод монослойных культур в 3D-культуры сфероидов в планшетах с микролунками; 3 - дифференцировка по хондрогенному пути в 3D-культурах сфероидов. В каждой точке эксперимента отбирали образцы для иммуноцитохимического анализа и полимеразной цепной реакции в реальном времени.
Фиг. 4. Морфология монослойных культур в ходе дифференцировки. А - контрольные монослойные культуры (1 - ИПСК линии FD4S, отрицательный контроль, 2 - суставные хондроциты, положительный контроль), Б -дифференцировка клеток с использованием факторов Chir 99021, РК на разных сроках культивирования (1 - 2 суток, 2 - 4 суток, 3 - 7 суток), В - дифференцировка клеток с использованием TGFβ1, BMP2 и 10% FBS на разных сроках культивирования (1 - 2 суток, 2 - 4 суток, 3 - 7 суток), Г - самопроизвольное агрегирование клеток в монослойных культурах при дифференцировке по хондрогенному пути. Масштабный отрезок - 200 мкм.
Фиг. 5. Иммуноцитохимический анализ монослойных культур. А - использование TGFβ1, BMP2 и 10% FBS; Б - использование Chir99021 и РК; В - культура суставных хондроцитов, положительный контроль; Д - культура ИПСК FD4S, отрицательный контроль. 1 - аггрекан (зелёный) и Sox9 (красный), 2 - коллаген I типа (красный), 3 - коллаген II типа (красный), 4 - CD105 (красный). Масштабный отрезок - 200 мкм.
Фиг. 6. Показатели экспрессии генов хондрогенных маркёров в монослойных культурах. По оси абсцисс - хондрогенные маркёры SOX9, ACAN, COL1A2, COL2A1. По оси ординат - нормированная экспрессия.
Фиг. 7. Морфология 3D-культур сфероидов разных протоколов дифференцировки. Масштабный отрезок - 200 мкм.
Фиг. 8. Иммуноцитохимический анализ синтеза аггрекана (зелёный) и Sox9 (красный) в 3D-культурах сфероидов разных протоколов. А-Г - протоколы дифференцировки: А - «долгий», Б - «короткий», В - «комбинированный», Г - с кондиционированной средой, Д - сфероиды положительной контрольной группы, Е - сфероиды отрицательной контрольной группы. 1-4 - продолжительность дифференцировки: 1 - 14 суток, 2 - 21 сутки, 3 - 28 суток, 4 - 35 суток. Масштабный отрезок - 200 мкм.
Фиг. 9. Показатели экспрессии ACAN в 3D-культурах сфероидов различных протоколов. По оси абсцисс - продолжительность дифференцировки, по оси ординат - величина нормированной экспрессии.
Фиг. 10. Показатели экспрессии SOX9 в 3D-культурах сфероидов различных протколов. По оси абсцисс - продолжительность дифференцировки, по оси ординат - величина нормированной экспрессии.
Фиг. 11. Иммуноцитохимический анализ синтеза коллагена I типа (красный) в 3D-культурах сфероидов разных протоколов. А-Г - протоколы дифференцировки: А - «долгий», Б - «короткий», В - «комбинированный», Г - с кондиционированной средой, Д - сфероиды положительной контрольной группы, Е - сфероиды отрицательной контрольной группы. 1-4 - продолжительность дифференцировки: 1 - 14 суток, 2 - 21 сутки, 3 - 28 суток, 4 - 35 суток. Масштабный отрезок - 200 мкм.
Фиг. 12. Показатели экспрессии COL1A2 в 3D-культурах сфероидов различных протоколов. По оси абсцисс - продолжительность дифференцировки, по оси ординат - величина нормированной экспрессии.
Фиг. 13. Иммуноцитохимический анализ синтеза коллагена II типа (красный) в 3D-культурах сфероидов разных протоколов. А-Г - протоколы дифференцировки: А - «долгий», Б - «короткий», В - «комбинированный», Г - с кондиционированной средой, Д - сфероиды положительной контрольной группы, Е - сфероиды отрицательной контрольной группы. 1-4 - продолжительность дифференцировки: 1 - 14 суток, 2 - 21 сутки, 3 - 28 суток, 4 - 35 суток.
Фиг. 14. Показатели экспрессии COL2A1 в 3D-культурах сфероидов различных протоколов. По оси абсцисс - продолжительность дифференцировки, по оси ординат - величина нормированной экспрессии.
Фиг. 15. Иммуноцитохимический анализ синтеза CD105 (красный) в 3D-культурах сфероидов разных протоколов. А-Г - протоколы дифференцировки: А - «долгий», Б - «короткий», В - «комбинированный», Г - с кондиционированной средой, Д - сфероиды положительной контрольной группы, Е - сфероиды отрицательной контрольной группы. 1-4 - продолжительность дифференцировки: 1 - 14 суток, 2 - 21 сутки, 3 - 28 суток, 4 - 35 суток.
Фиг. 16. Гистологический анализ культур сфероидов различных протоколов дифференцировки. Протоколы дифференцировки: А - «долгий», Б - «короткий», В - «комбинированный», Г - с кондиционированной средой. Контрольные группы: Д - положительный контроль (фрагменты суставного хряща), Е - отрицательный контроль. Тип гистологического окрашивания: 1 - гематоксилин-эозин, 2 - пикросириус красный, 3 - сафранин О.
Осуществление изобретения
Возможность осуществления заявленного изобретения иллюстрируется следующими примерами.
Пример 1. Получение монослойной культуры ИПСК
В работе использовали линию ИПСК FD4S, которая ранее была получена из фибробластов кожи человека с применением по методу, описанному в работе (41) с использованием неинтеграционного вектора вируса Сендай, несущего гены транскрипционных факторов OCT3/4, SOX2, KLF4 и C-MYC. Клетки были криоконсервированы при температуре -80 °С. Культивирование проводили при 37 °С и 5% CO2 в смеси ростовых сред без фидера mTeSR1 (STEMCELL Technologies; Канада) и Essential 8 (Thermo Fisher Scientific; США) в соотношении 1 : 3 с добавлением 40 мкг/мл антибиотика гентамицина («ПанЭко»; Россия). Смену среды проводили раз в сутки. При достижении клетками монослоя культуру пассировали в соотношении 1 : 3, для улучшения жизнеспособности клеток после данной процедуры использовали 10 мкМ ингибитора Rock-киназы Y27632 (StemMACS, Miltenyi Biotec; Германия).
Пример 2. Осуществление протоколов дифференцировки
Хондрогенную дифференцировку ИПСК, полученных по Примеру 1, проводили с тестированием четырех протоколов (см. Табл. 1):
1) «долгий» [3];
2) «короткий» [14];
3) «комбинированный»;
4) с кондиционированной средой.
РК около 5 суток Кондиционированная среда из-под хондроцитов, GlutaMAX
В качестве положительного контроля использовали культуры хондроцитов человека из донорского материала, а также фрагменты суставного хряща человека. В качестве отрицательного контроля - культуры ИПСК по Примеру 1 и 3D-структуры из них.
Пример 2А. Дифференцировка по «долгому протоколу»
Данный протокол состоит из двух этапов.
На начальном этапе по «долгому» протоколу монослойные культуры ИПСК дифференцировали в течение около 7 суток при использовании базовой среды Advanced DMEM/F12 или aMEM (Gibco, Thermo Fisher Scientific; США) с добавлением 10 нг/мл FGF2 (STEMCELL Technologies; Канада), 100× GlutaMAX (Gibco, Thermo Fisher Scientific; США), 50x B27 (Gibco, Thermo Fisher Scientific; США), 1% инсулин-трансферрин-селенита (ИТС) («ПанЭко»; Россия), 50 мкг/мл аскорбиновой кислоты (Sigma Aldrich; США), 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина и 40 мкг/мл раствора гентамицина («ПанЭко»; Россия).
На втором этапе, возможны два варианта культивирования в виде 2D культуры, так и в виде 3D (по технологии, описанной в Примере 2В). Для дифференцировки по «долгому» протоколу после культивирования с FGF2 (как описано выше) после отмывки от FGF2 к базовой среде добавляли 10 нг/мл TGFβ1 (Miltenyi Biotec; Германия), 10 нг/мл ВМР2, 10% FBS. На протяжении всего срока культивирования смену среды проводили раз в 3-4 дня. На третьи-четвертые сутки проводили пассирование культур 1 : 3 с использованием 0,25%-го раствора трипсина. Культивировали на протяжении около 28 суток.
Пример 2Б. Дифференцировка по «короткому» протоколу
Культивирование проводили на среде Advanced DMEM/F12 или aMEM (Gibco, Thermo Fisher Scientific; США) с 100× GlutaMAX (Gibco, Thermo Fisher Scientific; США), 50x B27 (Gibco, Thermo Fisher Scientific; США), 1% инсулин-трансферрин-селенита (ИТС) («ПанЭко»; Россия), 50 мкг/мл аскорбиновой кислоты (Sigma Aldrich; США), 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина, и 40 мкг/мл раствора гентамицина («ПанЭко»; Россия). На начальном этапе, в среду добавляли 10 мкМ Chir 99021, и 10 нМ ретиноевой кислоты - на первые 2 суток, затем клетки переводили только на среду с без Chir 99021 на время около 5 суток. После этого культивировали около 28 дней до анализа.
Смену среды проводили раз в сутки. Каждые третьи-четвертые сутки проводили пассирование культур 1 : 3 с использованием 0,25%-го раствора трипсина.
Контрольные клетки: полученную ранее культуру хондроцитов человека размораживали из криобанка ФГБУ ФНКЦ ФХМ им. академика Ю.М. Лопухина ФМБА России. Для этого криовиалу нагревали на водяной бане +37°С до полного исчезновения льда, после чего клетки отмывали от криопротектора DMSO в 10 мл предварительно нагретой до +37 °С чистой среды Advanced DMEM/F12 или aMEM, путем центрифугирования в 15 мл пробирке (Servicebio; Китай) при 1000 об./мин 5 мин. Осадок с хондроцитами разводили для последующего культивирования в среде Advanced DMEM/F12 или aMEM с добавлением 15% FBS или 10% сыворотки человека. Смену среды проводили раз в 3-4 суток, при этом кондиционированную среду отбирали и фильтровали дважды через шприцевые фильтры размера пор 0,45 мкм, затем 0,22 мкм.
Пример 2В. Дифференцировка по «комбинированному» протоколу
На начальном этапе дифференцировку проводили аналогично тому, как описано в Примере 2Б. Культивирование проводили на среде Advanced DMEM/F12 или aMEM (Gibco, Thermo Fisher Scientific; США) с 100× GlutaMAX (Gibco, Thermo Fisher Scientific; США), 50x B27 (Gibco, Thermo Fisher Scientific; США), 1% инсулин-трансферрин-селенита (ИТС) («ПанЭко»; Россия), 50 мкг/мл аскорбиновой кислоты (Sigma Aldrich; США), 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина, и 40 мкг/мл раствора гентамицина («ПанЭко»; Россия). На начальном этапе, в среду добавляли 10 мкМ Chir 99021, и 10 нМ ретиноевой кислоты - на первые 2 суток, затем клетки переводили только на среду без Chir 99021 на время около 5 суток.
На втором этапе для получения хрящеподобных 3D-структур (дифференцированных хондроцитарных сфероидов) использовали монослойные культуры хондроцитов человека (положительный контроль) или дифференцированные производные ИПСК на начальных этапах (первые 7 дней), как описано в примерах 2Б или 2В. Для этой процедуры использовали планшет с микролунками AggreWell 800 (STEMCELL Technologies; Канада) и раствор Anti-Adherence Rinsing Solution (STEMCELL Technologies; Канада) по протоколу производителя [31]. С учетом количества клеток добавляли 1-2 мл среды с добавлением 10 мкМ Y27632, соответствующей протоколу хондрогенной дифференцировки в 3D-культурах, до концентрации 1-1,5 × 106 кл/мл. На одну лунку планшета приходился 1 мл суспензии данной концентрации. Планшеты с равномерно распределенными в микролунках клетками инкубировали при 37 °С и 5% СО2 около 24 ч.
Для изготовления чашек Петри для культивирования сфероидов на 60 мм чашки Петри Ultra Low Attachment (Corning Inc.; США) наносили клей из хлороформа и пластика строго по центру в виде капли диаметром около 1 см. Затем чашки в открытом виде помещали под ультрафиолет на 6 ч. Перед использованием несколько раз ополаскивали поверхность раствором Версена [32].
Полученные через примерно 24 ч инкубирования в планшетах с микролунками рыхлые сферические агрегаты клеток собирали осторожным пипетированием с помощью носиков с отрезанным кончиком для избежания повреждения агрегатов, а затем переносили в заготовленные чашки Петри со средой, соответствующей протоколу дифференцировки: Advanced DMEM/F12 или aMEM (Gibco, Thermo Fisher Scientific; США) с 100× GlutaMAX (Gibco, Thermo Fisher Scientific; США), 50x B27 (Gibco, Thermo Fisher Scientific; США), 1% инсулин-трансферрин-селенита (ИТС) («ПанЭко»; Россия), 50 мкг/мл аскорбиновой кислоты (Sigma Aldrich; США), 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина, и 40 мкг/мл раствора гентамицина («ПанЭко»; Россия) с добавлением 10 нг/мл TGFβ1 (Miltenyi Biotec; Германия), 10 нг/мл ВМР2, 10% FBS. Чашки с агрегатами помещали в динамические условия на орбитальный 3D-шейкер при 37 °С и 5% СО2. Культивировали на протяжении около 28 суток.
Для культивирования сфероидов положительного контроля использовали базовую среду Advanced DMEM/F12 или aMEM, с добавлением 100× GlutaMAX (Gibco, Thermo Fisher Scientific; США), 50× B27 (Gibco, Thermo Fisher Scientific; США), 1% инсулин-трансферрин-селенита (ИТС) («ПанЭко»; Россия), 50 мкг/мл аскорбиновой кислоты (Sigma Aldrich; США), 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина, гентамицина («ПанЭко»; Россия) или 10 мл/л 100х-раствора пенициллина/стрептомицина («ПанЭко»; Россия).
Сфероиды отрицательного контроля культивировали в среде Advanced DMEM/F12 или aMEM с добавлением антибиотиков, эмбриональной бычьей сыворотки и 200× GlutaMAX.
Пример 2Г. Дифференцировка с кондиционированной средой
В протоколе с кондиционированной средой использовали кондиционированную среду от культуры суставных хондроцитов человека (контрольных клеток), с добавлением 200× GlutaMAX.
Дифференцировку и культивирование сфероидов с образованием хрящеподобных структур проводили в течение около 28 суток. Смену среды осуществляли раз в 3-4 суток. Каждые 7 суток оценивали морфологию сфероидов с помощью микроскопа с фазовым контрастом Olympus IX53F (Olympus; Япония) и программного обеспечения для морфометрии CellSens Standart.
Пример 3. Иммунофлуоресцентный анализ
Для иммуноцитохимического окрашивания 3D-культур каждые 7 суток в течение культивирования сфероиды пересаживали в 48-луночные планшеты, дно лунок которых предварительно покрывали 0,1%-м раствором желатина. В течение 1-2 суток сфероиды прикреплялись и распластывались по поверхности.
Фиксированные 4%-м параформальдегидом (PFA) монослойные культуры и прикрепленные органоиды обрабатывали 0,1%-м Triton-Х100: для окрашивания на ядерный маркер - в течение 20 мин, на поверхностные и цитоплазматические - 10 мин. После пермеабилизации культуры обрабатывали блокирующим раствором на основе 0,01М PBS, содержащим 3% козьей сыворотки и 0,1% Tween в течение 30 мин.
Монослойные культуры, а также сфероиды на всех стадиях дифференцировки окрашивали первичными антителами к ядерному маркеру хондрогенеза Sox 9 (Rabbit, 1 : 400, Invitrogen; Thermo Fisher Scientific, США), к маркеру протеогликанового хрящевого ВКМ агрекану (Mouse, 1 : 500, Invitrogen; Thermo Fisher Scientific, США), маркеру фибриллярного ВКМ гиалинового хряща коллагену II типа (Rabbit, 1 : 200; Abcam, Великобритания) и маркеру волокнистого хряща коллагену I типа (Rabbit, 1 : 800, Invitrogen; Thermo Fisher Scientific, США), а также поверхностному маркеру прехондрогенной мезенхимы CD105 (Human, 1 : 500; Sony, Япония). Окрашивали растворами первичных антител на основе блокирующего раствора в течение 1,5 ч при комнатной температуре или 12 ч при 4 °С.
Для окрашивания вторичными антителами использовали Alexa Fluor 488 (Goat, Anti-Mouse, 1 : 500), Alexa Fluor 555 (Goat, Anti-Rabbit, 1 : 500) и Alexa Fluor 546 (Goat, Anti-Human, 1 : 500) (Invitrogen; Thermo Fisher Scientific, США). Окрашивание проводили в течение 1 ч в темноте. Для окрашивания ядер использовали 100 нг/мл DAPI (Sigma Aldrich; США).
Анализ окрашенных препаратов проводили на флуоресцентном микроскопе Olympus IX53F с четырьмя фильтрами флуоресценции (Olympus; Япония), используя программное обеспечение для морфометрии CellSens Standart.
Пример 4. Полимеразная цепная реакция (ПЦР) в реальном времени
Для лизиса клеток в монослойных культурах и сфероидах использовали буфер RLT (QIAGEN; Германия), к которому добавляли 10 мкл/мл β-меркаптоэтанола. Сфероиды по 3-5 штук, в зависимости от размера, а также монослойные культуры лизировали в 600 мкл RLT пипетированием.
Для выделения тотальной РНК использовали RNeasy Plus Mini Kit (QIAGEN; Германия) соответственно с прилагающейся инструкцией [33]. От геномной ДНК тотальную РНК очищали с помощью обработки раствором ДНКазы (СибЭнзим; Россия)
Для синтеза первой цепи кДНК с матрицы РНК использовали MMLV RT kit («Евроген»; Россия) в соответствии с инструкцией [34].
Для проведения ПЦР в реальном времени на одну лунку 96-луночного планшета (SSIbio, Scientific Specialities; США) добавляли 5 мкл 5× qPCRmix-HS SYBR («Евроген»; Россия), 0,8 мкл 10 мкМ праймера (Табл. 2), 18,2 мкл воды и 1 мкл кДНК матрицы. Реакцию проводили при использовании термоциклера для амплификации нуклеиновых кислот 1000 CFX Manager исполнения C10000 Touch (Bio-Rad; США) и программного обеспечения CFX Manager. Количество циклов - 39. В качестве зонда использовали SYBR («Евроген»; Россия). Для увеличения специфичности реакции использовали полимеразу с «горячим стартом» - HS Taq ДНК-полимеразу («Евроген»; Россия), а также подобрали оптимальную температуру отжига праймеров (60 °С). В качестве отрицательного контроля для оценивания специфичности реакции после получения результатов использовали кДНК, выделенную из ИПСК.
Анализ результатов проводили в программе Microsoft Excel по методу ΔΔCt. Показаны средние значения и доверительные интервалы. Для статистического анализа использовали t-критерий Уэлча, учитывающий, что у средних значений двух групп независимых выборок могут быть неодинаковые стандартные отклонения.
Пример 5. Гистологический анализ
Для изготовления парафиновых срезов последовательно проводили процедуры фиксации сфероидов и фрагментов хряща, гистологической проводки через ксилол и этанол концентраций 70, 80, 96 и 100%, а также заливки в жидкий парафин. Затем создавали серии парафиновых срезов толщиной 4 мкм. Криосрезы сфероидов толщиной 7 мкм изготавливали по описанному ранее протоколу [35]. Для создания гистологического блока в этом случае использовали заливочную смолу Shandon Cryotome FSE (Thermo Fisher Scientific; США). Срезы окрашивали гематоксилин-эозином, пикросириусом красным и сафранином О. После окрашивания срезы обезвоживали и заключали в полистирол.
Фотографии срезов получали с использованием микроскопа DM4000 В LED (Leica; Германия).
Пример 6. Масштабирование способа получения хрящеподобных структур
Хрящеподобные структуры по настоящему изобретению получали с использованием комбинированного протокола и анализировали согласно вышеприведенным Примерам. Одна чашка Петри диаметром 35 мм с культивируемыми на ней ИПСК (3-3,5 млн клеток/чашку) позволяла получить примерно от 400 до 800 сфероидов (в зависимости от типа микролуночного планшета) при минимальном расходе питательной среды. При масштабировании культивирование сфероидов проводили в биореакторах, что дополнительно позволило упростить смену среды без потери хрящеподобных структур путем отбора среды сразу со всего объема. Кратное увеличение числа клеток ИПСК позволило получать на выходе кратное количество стандартизированных сфероидов при сохранении прочих технологических параметров процесса (время, концентрации веществ, условия и методы культивирования и т.д.). При любом объеме культивирования, в результате было получено примерно кратное изначальному количеству ИПСК количество хрящеподобных структур, имеющих аналогичные гистологические, иммуноцитохимические и морфологические характеристики.
Авторам не удалось масштабировать хрящеподобные структуры, получаемыми способами, известными из [42] и [43].
R: CACGTCGCGGAAGTCGATAG
R: CCTGACAGATCTGCCTCTCC
R: CCGTTGAGTCCATCTTTGC
R: CCATTGATGGTTTCTCCAAACC
R: CCGCCAGGACAAACCAGTAT
10% human serum (serum pool from voluntary donors)
(не аутологичный подход по получению тканенинженерного конструкта)
10% аутологичной человеческой сыворотки
(аутологичный тканеинженерный конструкт) или неаутологичную сыворотку или 10% FBS.
Литература
1. Diederichs S, Gabler J, Autenrieth J. Differential regulation of SOX9 protein during chondrogenesis of induced pluripotent stem cells versus mesenchymal stromal cells: a shortcoming for cartilage formation. Stem Cells and Development. 2016; (April): 1-34.
2. Tsumaki N, Okada M, Yamashita A. iPS cell technologies and cartilage regeneration. Bone. 2015; 70: 48-54. Available from: http://dx.doi.org/10.1016/j.bone.2014.07.011
3. Yamashita A, Morioka M, Yahara Y, Okada M, Kobayashi T, Kuriyama S, et al. Generation of scaffoldless hyaline cartilaginous tissue from human iPSCs. Stem Cell Reports. 2015; 4 (3): 404-18.
4. Kimura T, Yamashita A, Ozono K, Tsumaki N. Limited Immunogenicity of Human Induced Pluripotent Stem Cell-Derived Cartilages. Tissue Engineering - Part A. 2016; 22 (23-24): 1367-75.
5. Lietman SA. Induced pluripotent stem cells in cartilage repair. World Journal of Orthopedics. 2016; 7 (3): 149-55.
6. Narsinh KH, Plews J, Wu JC. Comparison of human induced pluripotent and embryonic stem cells: Fraternal or identical twins? Molecular Therapy. 2011; 19 (4): 635-8. Available from: http://dx.doi.org/10.1038/mt.2011.41/nature06264
7. Cheng B, Tu T, Shi X, Liu Y, Zhao Y, Zhao Y, et al. A novel construct with biomechanical flexibility for articular cartilage regeneration. Stem Cell Research and Therapy. 2019; 10 (1): 1-16.
8. Limraksasin P, Kosaka Y, Zhang M, Horie N, Kondo T, Okawa H, et al. Shaking culture enhances chondrogenic differentiation of mouse induced pluripotent stem cell constructs. Scientific Reports. 2020; 10 (1): 1-15. Available from: https://doi.org/10.1038/s41598-020-72038-y
9. Suchorska WM, Augustyniak E, Richter M, Trzeciak T. Comparison of Four Protocols to Generate Chondrocyte-Like Cells from Human Induced Pluripotent Stem Cells (hiPSCs). Stem Cell Reviews and Reports. 2017; 13 (2): 299-308.
10. Castro-Viñuelas R, Sanjurjo-Rodríguez C, Piñeiro-Ramil M, Hermida-Gómez T, Fuentes-Boquete IM, de Toro-Santos FJ, et al. Induced pluripotent stem cells for cartilage repair: Current status and future perspectives. European Cells and Materials. 2018; 36 (2006): 96-109.
11. Qu C, Puttonen KA, Lindeberg H, Ruponen M, Hovatta O, Koistinaho J, et al. Chondrogenic differentiation of human pluripotent stem cells in chondrocyte co-culture. International Journal of Biochemistry and Cell Biology. 2013; 45 (8): 1802-12.
12. Chijimatsu R, Ikeya M, Yasui Y, Ikeda Y, Ebina K, Moriguchi Y, et al. Characterization of Mesenchymal Stem Cell-Like Cells Derived from Human iPSCs via Neural Crest Development and Their Application for Osteochondral Repair. Stem Cells International. 2017:1-18.
13. Karen Niederreither JV., Vermot J, Schuhbaur B, Chambon P, Dollé P. Embryonic retinoic acid synthesis is required for forelimb growth andanteroposterior patterning in the mouse. Development. 2002: Aug;129(15):3563-74.
14. Kawata M, Mori D, Kanke K, Hojo H, Ohba S, Chung U il, et al. Simple and Robust Differentiation of Human Pluripotent Stem Cells toward Chondrocytes by Two Small-Molecule Compounds. Stem Cell Reports. 2019; 13 (3): 530-44.
15. Kreuser U, Buchert J, Haase A, Richter W, Diederichs S. Initial WNT/β-Catenin Activation Enhanced Mesoderm Commitment, Extracellular Matrix Expression, Cell Aggregation and Cartilage Tissue Yield From Induced Pluripotent Stem Cells. Frontiers in Cell and Developmental Biology. 2020; 8. Oct 30;8:581331. doi: 10.3389/fcell.2020.581331. eCollection 2020.
16. Lee NH, Bayaraa O, Zechu Z, Kim HS. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Reports. 2021; 54 (7): 356-67.
17. Martin I, Suetterlin R, Baschong W, Heberer M, Vunjak-Novakovic G, Freed LE. Enhanced cartilage tissue engineering by sequential exposure of chondrocytes to FGF-2 during 2D expansion and BMP-2 during 3D cultivation. J Cell Biochem. 2001; 83 (1): 121-8. DOI: 10.1002/jcb.1203.
18. Kim J, Tomida K, Matsumoto T, Adachi T. Spheroid culture for chondrocytes triggers the initial stage of endochondral ossification. Biotechnol Bioeng. 2022; 119 (11): 3311-8. DOI: 10.1002/bit.28203.
19. Sulaiman S, Chowdhury SR, Fauzi MB, Rani RA, Mohamadyahaya NH, Tabata Y, et al. 3d culture of MSCS on a gelatin microsphere in a dynamic culture system enhances chondrogenesis. International Journal of Molecular Sciences. 2020; 21 (8): 1-17.
20. Gionet-Gonzales MA, Leach JK. Engineering principles for guiding spheroid function in the regeneration of bone, cartilage, and skin. Biomedical Materials (Bristol). 2018; 13 (3). Mar 21;13(3):034109. doi: 10.1088/1748-605X/aab0b3.
21. Sridharan BP, Laflin AD, Detamore MS. Generating Chondromimetic Mesenchymal Stem Cell Spheroids by Regulating Media Composition and Surface Coating. Cellular and Molecular Bioengineering. 2018; 11 (2): 99-115.
22. Wang G, An Y, Zhang X, Ding P, Bi H, Zhao Z. Chondrocyte Spheroids Laden in GelMA/HAMA Hybrid Hydrogel for Tissue-Engineered Cartilage with Enhanced Proliferation, Better Phenotype Maintenance, and Natural Morphological Structure. Gels. 2021; 7 (4): 247. Available from: https://www.mdpi.com/2310-2861/7/4/247
23. Jang Y, Jung H, Ju JH. Chondrogenic differentiation induction of adipose-derived stem cells by centrifugal gravity. Journal of Visualized Experiments. 2017; 2017 (120). Feb 24;(120):54934. doi: 10.3791/54934.
24. Jang J, Lee J, Lee E, Lee EA, Son Y. Disc-type hyaline cartilage reconstruction using 3D-cell sheet culture of human bone marrow stromal cells and human costal chondrocytes and maintenance of its shape and phenotype after transplantation. Tissue Engineering and Regenerative Medicine. 2016; 13 (4): 352-63.
25. Salonius E, Kontturi L, Laitinen A, Haaparanta AM, Korhonen M, Nystedt J, et al. Chondrogenic differentiation of human bone marrow-derived mesenchymal stromal cells in a three-dimensional environment. Journal of Cellular Physiology. 2020; 235 (4): 3497-507.
26. Markway BD, Tan GK, Brooke G, Hudson JE, Cooper-White JJ, Doran MR. Enhanced chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells in low oxygen environment micropellet cultures. Cell Transplantation. 2010; 19 (1): 29-42.
27. Rogan H, Ilagan F, Yang F. Comparing Single Cell Versus Pellet Encapsulation of Mesenchymal Stem Cells in Three-Dimensional Hydrogels for Cartilage Regeneration. Tissue Engineering - Part A. 2019; 25 (19-20): 1404-12.
28. Zhang M, Shi J, Xie M, Wen J, Niibe K, Zhang X, et al. Recapitulation of cartilage/bone formation using iPSCs via biomimetic 3D rotary culture approach for developmental engineering. Biomaterials. 2020; 260. Nov;260:120334. doi: 10.1016/j.biomaterials.2020.120334. Epub 2020 Aug 17.
29. Zhang K, Yan S, Li G, Cui L, Yin J. In-situ birth of MSCs multicellular spheroids in poly(L-glutamic acid)/chitosan scaffold for hyaline-like cartilage regeneration. Biomaterials. 2015; 71: 24-34.
30. Stuart MP, Matsui RAM, Santos MFS, Côrtes I, Azevedo MS, Silva KR, et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells International. 2017. 2017:7053465. doi: 10.1155/2017/7053465. Epub 2017 Dec 20.
31. STEMCELL Technologies. Reproducible and Uniform Embryoid Bodies Using AggreWellTM Plates. 2011. https://www.stemcell.com/media/files/brochure/BR29150-AggreWell_Reproducible_Uniform_Embryoid_Bodies.pdf
32. Eremeev AV, Volovikov EA, Shuvalova LD, Davi denko AV, Khomyakova EA, Bogomiakova ME, Lebedeva OS, Zubkova OA, Lagarkova MA. “Necessity is the Mother of Invention” or Inexpensive, Reliable, and Reproducible Protocol for Generating Organoids. Biochemistry (Moscow). 2019; 84 ( 3): 321-28. DOI: 10.1134/S0006297919030143.
33. QIAGEN. RNeasy ® Plus Mini Handbook. 2020. 47p. https://www.qiagen.com/us/resources/resourcedetail?id=16b8f578-d192-4613-ae32-8e02e0b0fa77&lang=en
34. Евроген. MMLV RT kit. 2021. Available from: www.evrogen.ru.
35. Molecular Cellular and Developmental Biology. Cryostat Procedure. 2012. 5p. https://labs.mcdb.ucsb.edu/fisher/steven/Website/protocols/Cryosectioning.pdf
36. Shuvalova LD, Eremeev AV, Bogomazova AN, Novosadova EV, Zerkalenkova EA, Olshanskaya YV, et al. Generation of induced pluripotent stem cell line RCPCMi004-A derived from patient with Parkinson's disease with deletion of the exon 2 in PARK2 gene. Stem Cell Res. 2020; 44: 101733. DOI: 10.1016/j.scr.2020.101733.
37. Goldring MB, Tsuchimochi K, Ijiri K. The control of chondrogenesis. Journal of Cellular Biochemistry. 2006; 97: 33-44.
38. Rutgers M, Saris DB, Vonk LA, van Rijen MH, Akrum V, Langeveld D, et al. Effect of collagen type I or type II on chondrogenesis by cultured human articular chondrocytes. Tissue Engineering - Part A. 2013; 19 (1-2): 59-65.
39. Theodoropoulos JS, DeCroos AJN, Petrera M, Park S, Kandel RA. Mechanical stimulation enhances integration in an in vitro model of cartilage repair. Knee Surgery, Sports Traumatology, Arthroscopy. 2016; 24 (6): 2055-64.
40. Endo K, Fujita N, Nakagawa T, Nishimura R. Effect of Fibroblast Growth Factor-2 and Serum on Canine Mesenchymal Stem Cell Chondrogenesis. Tissue Engineering - Part A. 2019; 25 (11-12): 901-10.
41. Wu CL, Dicks A, Steward N, Tang R, Katz DB, Choi YR et al. Single cell transcriptomic analysis of human pluripotent stem cell chondrogenesis. Nature Communications. 2021; 12 (1), 1-18.
42. M. Lehmann, F. Martin, K. Mannigel, K. Kaltschmidt, U. Sack, and U. Anderer Three-Dimensional Scaffold-Free Fusion Culture: the Way to Enhanced Chondrogenesis of in vitro Propagated Human Articular Chondrocytes Eur J Histochem. 2013 Oct 29; 57(4): e31. Published online 2013 Nov 5. DOI: 10.4081/ejh.2013.e31.
43. Isis Côrtes, Renata A. M. Matsui, Mayra S. Azevedo, Anderson Beatrici, Kleber L.A. Souza, Guilaume Launay, Frédéric Delolme, José M. Granjeiro, Catherine Moali, and Leandra S. Baptista. A Scaffold- and Serum-Free Method to Mimic Human Stable Cartilage Validated by Secretome Tissue Engineering Part A > Vol. 27, No. 5-6. DOI: 10.1089/ten.tea.2018.0311.
Изобретение относится к биотехнологии и представляет собой способ получения хрящеподобных структур. Способ включает следующие стадии: a) получение монослойной культуры индуцированных плюрипотентных стволовых клеток человека; b) дифференцировка полученной монослойной культуры; c) культивирование; d) добавление к монослойной культуре среды с дальнейшим инкубированием монослойной культуры до получения сферических агрегатов; e) культивирование полученных сферических агрегатов в среде и в динамических условиях, включающих орбитальный 3D-шейкер. Настоящее изобретение обеспечивает новый способ получения хрящеподобной ткани, избавленный от недостатков известных способов. 16 ил., 3 табл., 6 пр.
Способ получения хрящеподобных структур, включающий следующие стадии:
a) получение монослойной культуры индуцированных плюрипотентных стволовых клеток человека;
b) дифференцировка полученной монослойной культуры в течение 2 суток в среде Advanced DMEM/F12 или aMEM, содержащей добавки 100× GlutaMAX, 50× B27, 1% инсулин-трансферрин-селенита, 50 мкг/мл аскорбиновой кислоты, 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина, 40 мкг/мл раствора гентамицина, 10 нМ ретиноевой кислоты и 10 мкМ Chir 99021;
c) культивирование в течение 5 суток в среде с добавками, как на стадии b), но не содержащей Chir 99021;
d) добавление к монослойной культуре 1-2 мл среды, включающей Advanced DMEM/F12 или aMEM с 100х GlutaMAX, 50x B27, 1% инсулин-трансферрин-селенита, 50 мкг/мл аскорбиновой кислоты, 50 мкМ β-меркаптоэтанола, 5 мкг/мл плазмоцина и 40 мкг/мл раствора гентамицина, 10 нг/мл TGFβ1, 10 нг/мл ВМР2, 10% FBS, с добавлением 10 мкМ Y27632, до концентрации 1-1,5×106 кл/мл, с дальнейшим инкубированием монослойной культуры в течение 24 ч до получения сферических агрегатов;
e) культивирование полученных сферических агрегатов в среде, аналогичной используемой на стадии d), но без добавления Y27632, и в динамических условиях, включающих орбитальный 3D-шейкер, на протяжении 28 суток.
| DENKER A.E | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| EP 3812457 A1, 28.04.2021 | |||
| WO 2014052912 А1, 03.04.2014 | |||
| DUDA G.N | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2024-02-28—Публикация
2023-04-27—Подача