Область изобретения
Настоящее изобретение относится к способу культивирования in vitro овариальных фолликулов. Более подробно, настоящее изобретение относится к способу получения большого количества зрелых или незрелых фолликулов и/или ооцитов из ткани яичников млекопитающих.
Уровень техники
Некоторые проблемы могут быть идентифицированы при изучении фолликулогенеза и созревания ооцитов у людей и млекопитающих.
При широко распространенном применении созревания ооцитов для скрещивания животных и оплодотворения in vitro человека, большие количества спермы, как правило, собирают и хранят в банке клеточных культур для последующего использования, создавая, по сути, неограниченные запасы спермы. Однако до сих пор не существует практического способа для сбора и хранения большого количества женских яйцеклеток, способных к оплодотворению. Причина подобной ситуации кроется в биологических особенностях женской репродуктивной системы. У самок млекопитающих только определенные клетки в яичниках способны созревать в яйцеклетки. Эти зародышевые клетки, которые в ограниченном количестве представлены при рождении у всех млекопитающих, удерживаются в яичнике на стадии ранней фазы мейоза и на этой стадии не способны к оплодотворению и к развитию в нормальный плод. При нормальных условиях эти клетки начинают развиваться в яичнике с периодичностью, характерной для репродуктивного цикла животных. В определенное время цикла одна либо небольшое количество этих клеток будут высвобождаться из яичника, определяя процесс, известный как овуляция. Сложный процесс, при котором индивидуальная зародышевая клетка развивается до стадии, при которой происходит овуляция, известен как фолликулогенез. Фолликулогенез включает несколько основных стадий и сопровождается координированной активностью других клеток яичника, а также гормонов гипофиза и яичника. Однако in vivo фолликулогенез не является эффективным процессом.
Культивирование фолликулов представляет собой экспериментальную методику, предназначенную для отделения интактных фолликулов от системных воздействий организма, для того чтобы можно было исследовать их метаболизм. Используя культуру фолликулов, можно стимулировать или оптимизировать фолликулогенез. Однако до сих пор не известен способ культивирования фолликулов, который может эффективно обеспечить все стадии развития фолликулов до зрелых фолликулов и ооцитов из примордиальных фолликулов. Описание соответствующих способов представлено в "In vitro culture of ovarian follicles", G.M.Hartshorae, Reviews of Reproduction (1997), 2, 94-104.
Кроме того, почти во всех известных до сих пор успешных способах культивирования фолликулов используют масло для обеспечения защитного барьера от внешних воздействий. Эта практика ограничивает возможности тестирования влияния химических веществ (обычно ксенобиотиков) и, в частности, липофильных соединений на фолликулогенез. Вышеупомянутые химические соединения могут быть как вредными (отрицательное влияние на фолликулогенез), так и полезными (положительное влияние - обнаружение потенциальных лекарств для лечения дефектного фолликулогенеза у людей и млекопитающих). Такое тестирование могло бы быть разработано также для оценки воздействия физических факторов, таких как электромагнитное или ионизирующее излучение, ультразвук и т.д. на фолликулогенез, например, в радиологии/радиотерапии. Существующий уровень техники не позволяет проводить тестирование на какой-либо определенной стадии фолликулогенеза, и обычно невозможно оценить влияние внешнего фактора на фолликулярные клетки на определенной стадии развития, поскольку при культивировании фолликулов обычно стараются имитировать естественную ситуацию с помощью включения их в естественную стадию развития.
Другая потребность состоит в необходимости консервации фолликулов в том случае, если женщина проходит курс химиотерапии, лучевой терапии или при овариоэктомии. В этом случае оплодотворение in vitro или имплантация ооцитов, полученных из вышеупомянутых запасных фолликулов, дали бы возможность этим женщинам иметь детей из их собственных ооцитов, если это невозможно иначе.
Кроме того, ясно, что такой способ консервации фолликулов, приводящий к более эффективному фолликулогенезу, в сочетании с искусственным оплодотворением был бы полезен для обеспечения выживания некоторых редких и исчезающих видов.
Иными словами, существует потребность в новом способе получения большого количества зрелых или незрелых фолликулов и/или ооцитов из ткани яичников млекопитающих.
Цели изобретения
Целью настоящего изобретения является разработка нового способа получения зрелых или незрелых фолликулов или ооцитов из ткани яичников млекопитающих. Более подробно, целью настоящего изобретения является разработка способа получения зрелых или незрелых фолликулов или ооцитов из первичных или вторичных фолликулов, выделенных из ткани яичника млекопитающих.
Еще одна цель изобретения состоит в обеспечении биологического анализа окружающей среды для тестирования внешних воздействий, таких как химические вещества и физические воздействия (электромагнитное или ионизирующее излучение, ультразвук и т.д.) на фолликулогенез и оогенез, в частности, на все стадии фолликулогенеза и оогенеза по отдельности, или на фолликулы и ооциты,находящиеся на определенной стадии развития и изолированные от нормальных системных влияний организма.
Другая цель изобретения состоит в обеспечении способа получения зрелых ооцитов из консервированной ткани яичника.
Краткое содержание изобретения
Настоящее изобретение относится к способу культивирования in vitro овариальных фолликулов млекопитающих, отличающемуся тем, что он включает следующие последовательные стадии:
- обеспечение подходящего сосуда для культивирования in vitro,
- выделение фолликула из яичника млекопитающего, содержащего, по меньшей мере:
- клетки theca (theca, соединительно-тканная оболочка фолликула) или клетки pre-theca,
- гранулезные клетки и
- ооцит,
- при необходимости, первую стадию культивирования с использованием не содержащей масло первой среды, ингибирующей прикрепление,
- вторую стадию культивирования с использованием не содержащей масло второй среды, обеспечивающей прикрепление, и
- получение зрелого фолликула.
Вышеупомянутый овариальный фолликул может быть первичным или вторичным фолликулом. Кроме того, вышеупомянутый овариальный фолликул может представлять собой замороженный и впоследствии размороженный фолликул, полученный из банка овариальных фолликулов или из ткани яичника.
В предпочтительном воплощении способ изобретения дополнительно включает третью стадию культивирования, выполняемую после второй стадии, с использованием не содержащей масло третьей среды для индукции созревания, и приводящую к образованию слизистого ооцит-кумулюсного комплекса. Вышеупомянутая третья стадия предпочтительно включает созревание ооцита и сходный с овуляцией выход упомянутого выше ооцита.
Необязательная первая стадия культивирования в предпочтительном воплощении включает дифференцировку первичных фолликулов во вторичные фолликулы.
Вторая стадия культивирования в предпочтительном воплощении включает прикрепление фолликула к поверхности подходящего сосуда и дифференцировку фолликула в преовуляторный или ему подобный фолликул.
Вышеупомянутый подходящий сосуд предпочтительней представляет собой 96-луночную культуральную плату с уменьшенной плоской поверхностью дна лунок.
Другой аспект настоящего изобретения касается способа оценки воздействий химических или физических факторов на фолликулогенез, включающего следующие стадии:
- культивирование фолликулов согласно способу настоящего изобретения в присутствии вышеуказанных физических или химических факторов в течение, по крайней мере, одной стадии клеточного развития, и
- оценку этих воздействий.
Применение химического или физического воздействия только в определенном коротком периоде в процессе культивирования фолликулов позволяет исследовать их влияние на критические точки дифференцировки фолликулов (например, преантральную, антральную фазы, индукцию овуляции и т.д.). Вышеуказанные химические или физические факторы могут воздействовать также непрерывно в течение всего срока культивирования фолликулов.
Вышеупомянутые воздействия можно оценить, например, путем анализа качества ооцитов с помощью способа, выбранного из группы, включающей определение коэффициента оплодотворения in vitro (IVF), определение степени развития компетентности после оплодотворения и имплантации, окрашивание веретена, анализ органелл, хромосомный анализ или их комбинацию, или путем анализа качества фолликулогенеза способом, выбранным из группы, включающей анализ пролиферации, анализ дифференцировки, анализ продукции стероидов, выделения слизи или их комбинацию. Однако настоящее изобретение не связано с применением этих тестов для анализа ооцитов и оценки качества фолликулогенеза.
Краткое описание чертежей
Фиг.1 представляет общую схему способа получения большого количества зрелых или незрелых фолликулов и/или ооцитов из ткани яичников млекопитающих согласно настоящему изобретению.
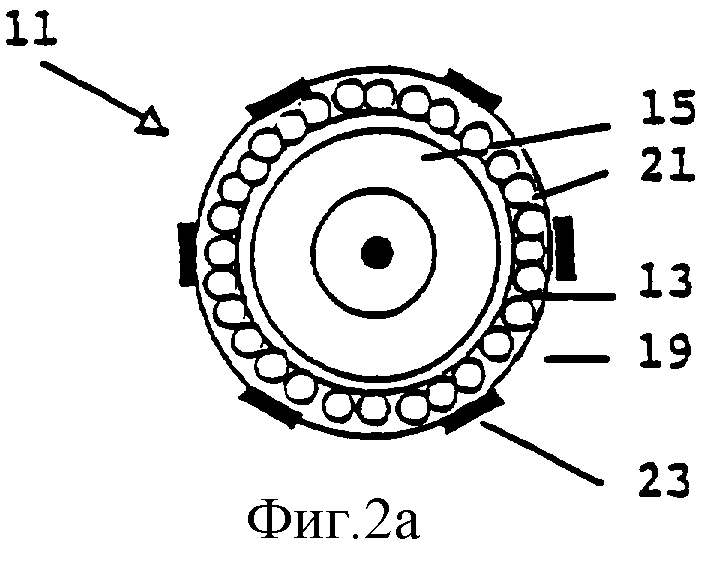
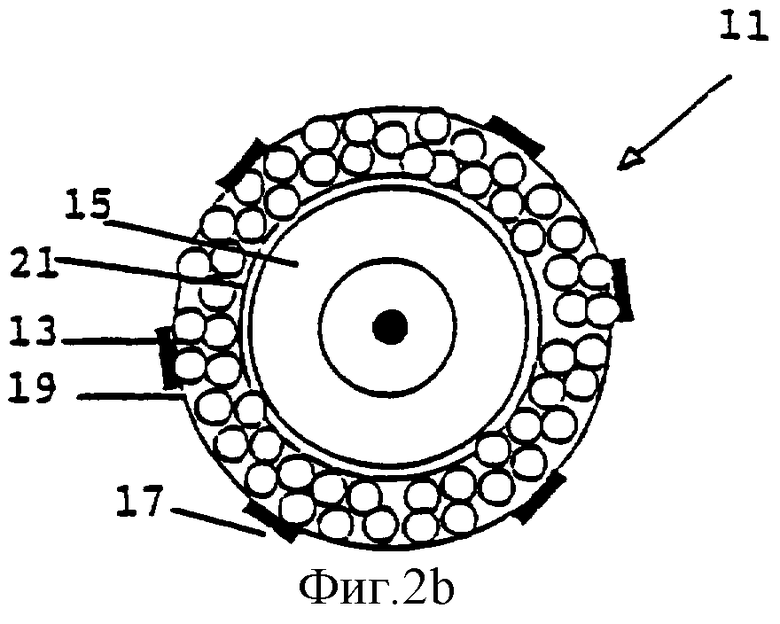
Фиг.2а и 2b представляют фолликул, соответственно, в первичной и в ранней преантральной (вторичной) фазе развития.
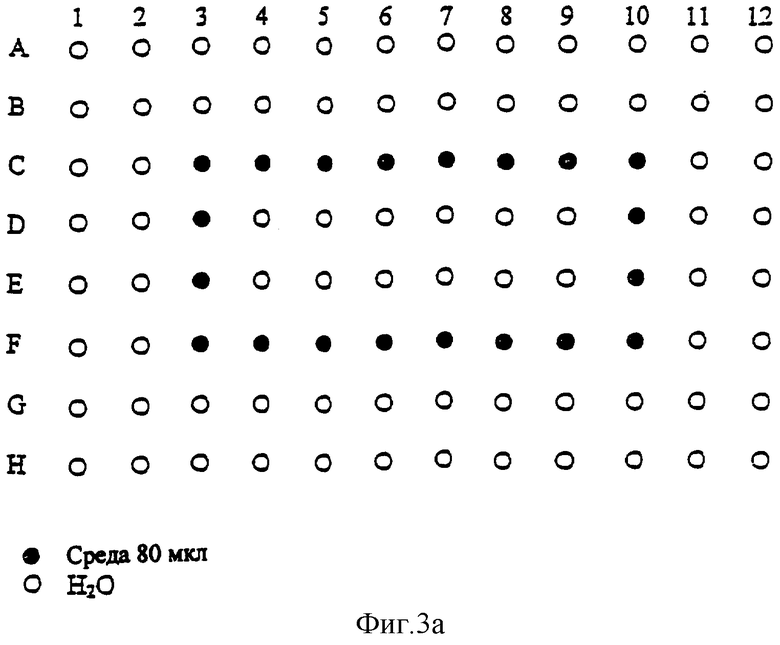
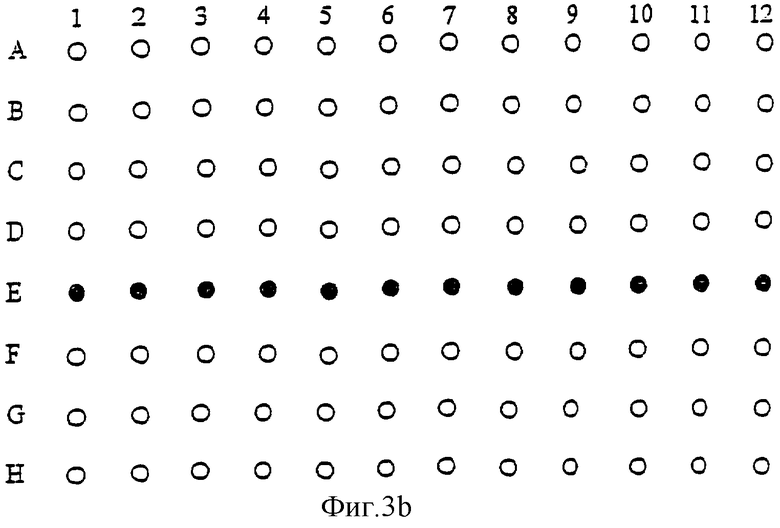
Фиг.3а и 3b показывают предпочтительную схему посева культуры на плате для практического применения способа данного изобретения.
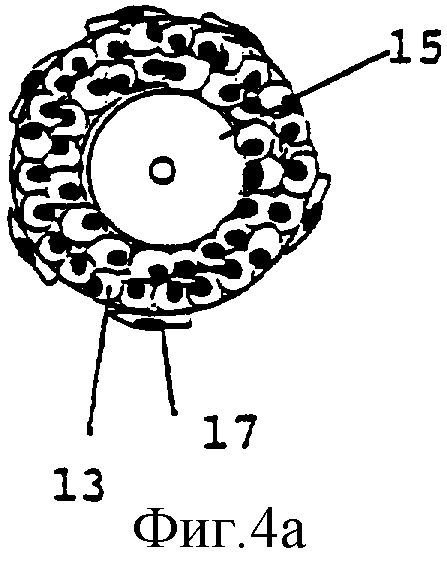
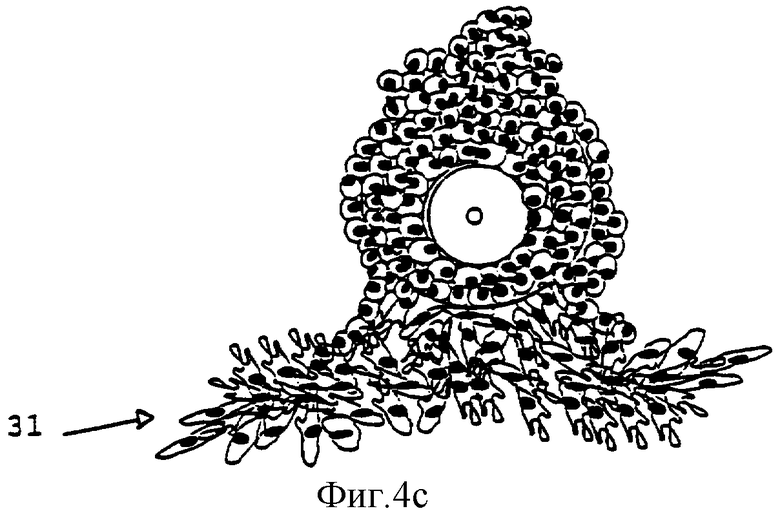
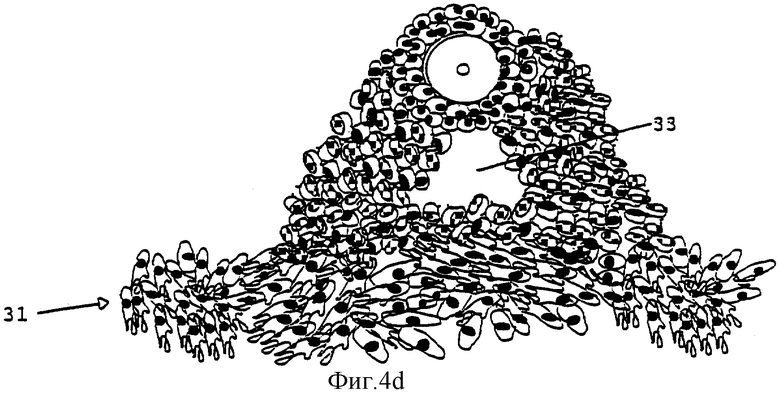
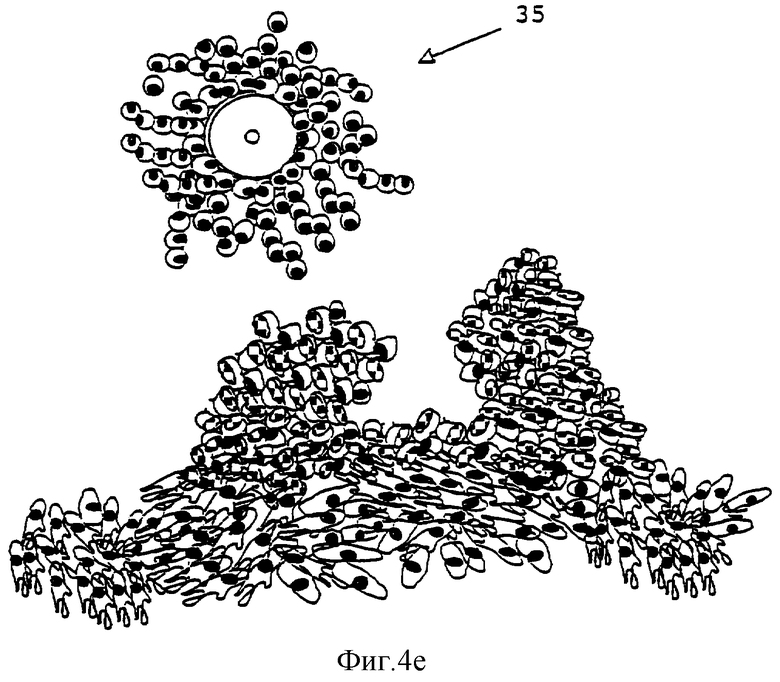
Фиг.4а-4е изображают развитие фолликула, культивирующегося согласно способу данного изобретения.
Подробное описание изобретения
Настоящее изобретение относится к способу получения большого количества зрелых или незрелых фолликулов и/или ооцитов из ткани яичников млекопитающих. Более подробно, изобретение относится к способам развития и созревания in vitro зародышевых клеток, выделенных из ткани яичников млекопитающих, в зрелые или незрелые фолликулы и/или ооциты.
Настоящее изобретение будет ниже пояснено с использованием некоторых, не ограничивающих рамки настоящего изобретения, примеров.
Общую схему способа согласно данному изобретению можно видеть на Фиг.1, где схематично представлены все необходимые стадии получения зрелых фолликулов и ооцитов из фолликулов, выделенных из ткани яичников млекопитающих.
Все эти стадии будут более подробно описаны в последующих Примерах.
Пример 1
Выделение и предварительное культивирование вторичных овариальных фолликулов (стадия 1 на Фиг.1).
Ткань яичника изолируют из 12-14-дневных гибридов F1, полученных после скрещивания мышей линии C57B1/j6 с мышами линии СВАса, и помещают в культуральную чашку в среду L15 Лейбовича, содержащую GlutaMax I™ (Gibco BRL 31415-029), 10% фетальной телячьей сыворотки (FCS), инактивированной нагреванием, и 0,1% смеси пенициллин/стрептомицин (Gibco BRL3032908). При этом ткань яичника следует освободить от яйцевода и жира.
С помощью иглы поверхность яичников надрезают, высвобождая фолликулы в суспензию со средой L15. При нормальных условиях из одного яичника с помощью этого способа выделения можно получить от 30 до 40 подходящих фолликулов.
При необходимости выделения первичных фолликулов можно использовать 7-8-дневных мышей. В этом случае из одного яичника можно получить от 10 до 15 подходящих фолликулов.
Пример 2
Отбор фолликулов для способа настоящего изобретения (стадия 2 на Фиг.1).
Не все фолликулы в суспензии, полученной в Примере 1, подходят для культивирования. Чтобы быть уверенным, что все фолликулы растут приблизительно с одинаковой скоростью, отобранные фолликулы должны иметь сходный диаметр. В этом конкретном случае подходящим является диаметр 100-130 мкм, который соответствует развитию фолликула до ранней преантральной (вторичной) стадии. В этом случае фолликулы 11 должны иметь два слоя гранулезных клеток 13 и ооцит 15 округлой формы, как показано на Фиг.2b. Вышеупомянутые фолликулы, кроме того, содержат интерстициальные клетки 17 theca, базальную мембрану 19 и блестящую оболочку (zone pellucida) 21. Фолликулы наблюдают под стереомикроскопом и измеряют под инвертированным микроскопом. Подходящие фолликулы отбирают, используя соответствующие пастеровские пипетки, и переносят в ампулу для замораживания (для создания банка, см. Пример 3) или в культуральную плату (для культивирования фолликулов, см. Пример 4).
Фолликулы на более ранней, чем вторичная, стадии развития, могут также использоваться для практического применения настоящего изобретения. Наиболее важным фактором в решении, являются ли фолликулы достаточно дифференцированными, является наличие клеток 17 theca или клеток 23 pre-theca, представленных на наружной поверхности фолликула первичной стадии развития, как показано на Фиг.2а. Клетки pre-theca могут еще не экспрессировать на своей поверхности LH-рецепторы. В мышиной модели, использованной в этих Примерах, размер фолликулов на первичной стадии созревания находится в диапазоне от 70 до 100 мкм. Этот размер, однако, специфичен для мышиной модели, и соответствующий размер для других видов животных может быть определен специалистами в данной области техники, относящейся к исследованию стадий клеточного развития, описанных выше.
Пример 3
Создание и использование банка фолликулов (Стадия 3 на Фиг.1).
Банк фолликулов можно создать, используя способы криоконсервации, известные специалистам в данной области. Пример такого способа описан ниже.
Фолликулы, полученные по способу, описанному в Примере 2, собирают в пластиковые криоампулы (Simport, Quebec, Canada). 25 фолликулов на одну ампулу суспендируют в 150 мкл среды L15 с 10% инактивированной нагреванием фетальной телячьей сыворотки и 1,5 М ДМСО. Медленное замораживание осуществляют с помощью программируемого замораживающего аппарата (Cell Freezer R204; Planer, Sunbury-on-Thames, UK). Фолликулы выдерживают в замораживающей смеси в течение 15 минут при 4°С и затем охлаждают до -7°С со скоростью 2°С в минуту. После ручного переноса температуру снижают до -40°С со скоростью -0,3°С в минуту до помещения в жидкий азот, где фолликулы очень быстро охлаждаются до -110°С со скоростью -50°С в минуту.
Фолликулы размораживают очень быстро путем нагревания криоампул до 37°С. Криопротектор растворяют в три этапа (снижают концентрацию ДМСО от 1,5М до 1М и затем до 0,5М) в течение 15 минут при комнатной температуре. Перед культивированием фолликулы выдерживают 15 минут при 37°С в среде для выделения. С этого момента фолликулы можно рассматривать как свежеполученные.
Пример 4
Культивирование фолликулов (стадия 4 на Фиг.1).
Культивирование фолликулов включает, по крайней мере, одну стадию культивирования, которая может обеспечить дифференцировку фолликулов. Дифференцировку индуцируют с помощью соответствующей среды. В способе настоящего изобретения среду разделяют на три группы: первая среда, вторая среда и третья среда. Использование соответствующей среды на соответствующей стадии дифференцировки является решающим моментом для успешного осуществления способа настоящего изобретения.
Два примера проиллюстрируют, как можно использовать способ настоящего изобретения на различных стадиях дифференцировки фолликулов.
При инкубации применяют следующие условия, если не указано иначе:
Температура: 37°С.
Состав воздушной смеси: 5% СО2 в воздухе.
Влажность: 100% насыщения.
Кроме того, периоды инкубации можно изменять с целью получения равноценных результатов при использовании отличных от мышей видов животных. Примеры оптимизированы для мышиной модели.
Обзор функций специфической среды, а также ее примерный состав представлены в следующей таблице:
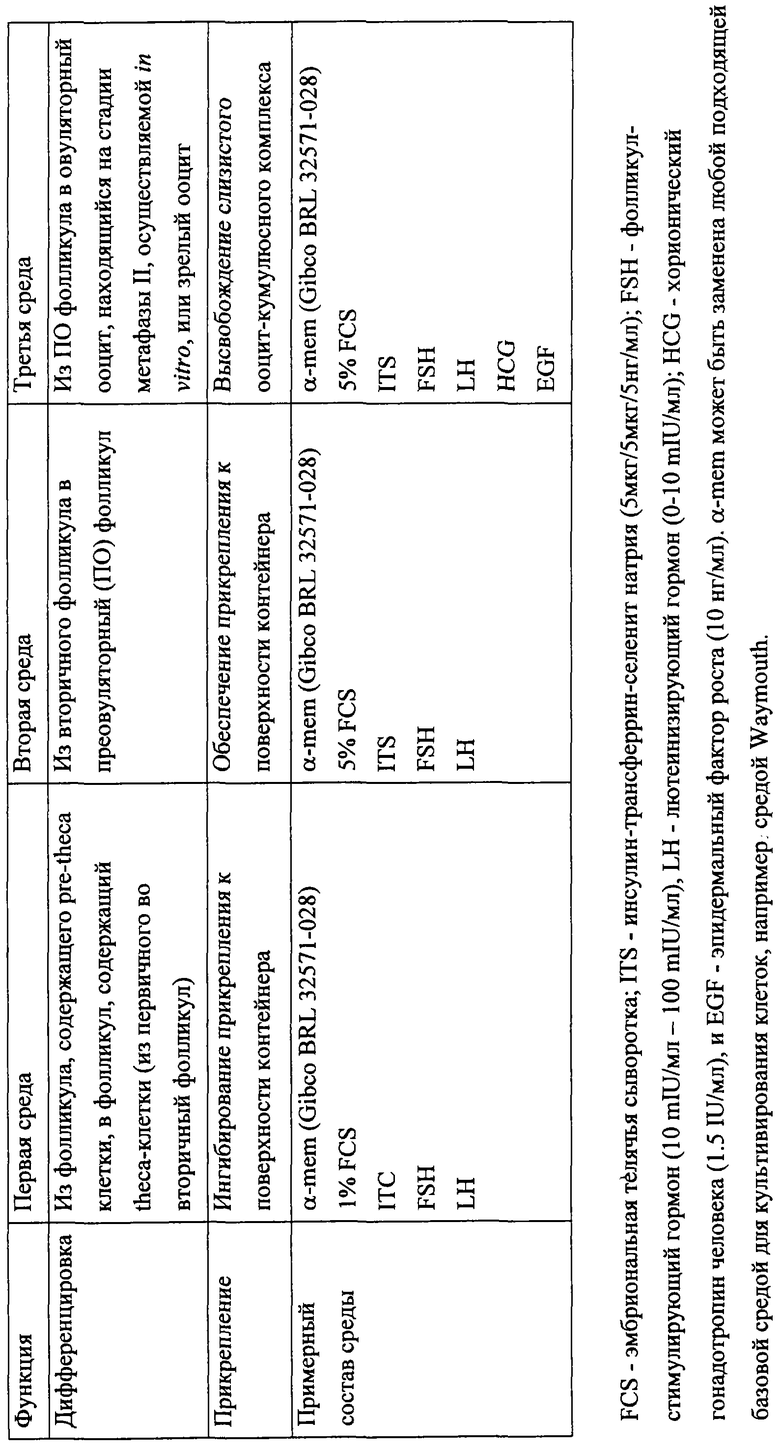
4.А.: Пример с использованием первичных фолликулов
В случае если используют первичные фолликулы (т.е. фолликулы с клетками pre-theca, которые еще полностью не дифференцированы в клетки theca и не экспрессируют LH-рецепторы на своей поверхности), необходима первая стадия культивирования в первой культуральной среде.
На этой стадии используют вышеупомянутую первую среду. Эта среда будет способствовать росту и дифференцировке клеток pre-theca в клетки theca. Например, фолликулы культивируют в 75 мкл среды в течение 4 дней. Через четыре дня фолликулы с исходным размером 90-100 мкм обычно достигают вторичной стадии (преантральной стадии) развития (первичным фолликулам меньшего размера требуется до восьми дней для достижения преантральной стадии). В дальнейшем размер фолликулов увеличится до 130 мкм, причем увеличение размера происходит в основном благодаря пролиферации гранулезных клеток и росту ооцитов. После этого, дальнейшая процедура будет такой же, как и при использовании вторичных фолликулов.
4.Б.: Пример с использованием вторичных фолликулов
При использовании в качестве исходных вторичных фолликулов можно начать непосредственно с культивирования с использованием второй среды. Эта среда обеспечит адгезию культуры к поверхности сосуда. Культуральную среду обновляют каждые четыре дня. На двенадцатый день культуральную среду меняют на третью среду. Эта среда будет способствовать высвобождению слизистого ооцит-кумулюсного комплекса из фолликула в течение ночи, пока завершается созревание ооцитов.
Для практического применения способа изобретения предпочтительней использовать 96-луночную плату с уменьшенной плоской поверхностью дна лунок (А2, Costar). Культуры помещают в 75 мкл культуральной среды. При смене среды 30 мкл использованной среды удаляют и добавляют 30 мкл свежей среды. Схематично обе процедуры можно представить в следующей таблице:
Предпочтительная схема культивирования в 96-луночных платах с уменьшенной плоской поверхностью дна лунок (Costar) представлена на Фиг.3. На Фиг.3а представлена первая возможная схема посева культуры. Черные кружки обозначают лунки с культурой, белые кружки обозначают лунки, заполненные водой.
Другой возможный вариант посева культуры представлен на Фиг.3b. Здесь ряд Е используют для культивирования, тогда как все остальные лунки заполнены водой. Воду добавляют для создания соответствующего микроокружения (100% влажности на уровне платы).
Фиг.4 демонстрирует развитие фолликула при использовании способа настоящего изобретения. Первичные или вторичные фолликулы (а) вносят в культуру. При культивировании во второй среде происходит прикрепление фолликулов к поверхности культурального сосуда. Обеспечивается пролиферация интерстициальных клеток (31) theca, что приводит к прикреплению к поверхности сосуда (b, с). В процессе 12-дневного культивирования фолликул дополнительно развивается и растет (b, c, d). Рост фолликула приводит к разрыву структуры и формированию внутрифолликулярных полостей (d) (33). Вышеуказанные полости и разрывы обеспечивают хорошую циркуляцию среды и увеличивают шансы для выживания ооцита, поскольку он будет достаточно снабжаться питательными веществами и кислородом. Добавление третьей среды приведет к высвобождению ооцит-кумулюсного комплекса (е) (35).
Пример 5
Использование фолликулов, полученных согласно способу изобретения, для тестирования химического воздействия таксола.
Используют тот же способ, что и в Примере 4. Используют вторичные фолликулы. Десять 96-луночных плат с культивируемыми фолликулами в ряду Е использовали для тестирования влияния таксола на фолликулогенез (75 мкл/лунку). Вся среда, используемая на стадиях культивирования, имеет следующий состав:
Культуральную среду обновляют каждые четыре дня путем удаления 30 мкл и последующего добавления 30 мкл свежей среды. Через 13 дней фолликулы оценивают на жизнеспособность, выделение слизи, присутствие полярного тельца (ПТ) и диаметр ооцита. Средние значения со стандартными отклонениями (SD) представлены ниже:
Используя этот способ, можно исследовать влияние веществ на фолликулогенез и созревание ооцитов.
Пример 6
Оплодотворение in vitro (IVF) и перенос эмбриональных клеток (ЕТ) с использованием ооцитов. полученных способом настоящего изобретения.
Среда, используемая для IVF, включает KSOM, содержащую следующие компоненты в воде:
В среду KSOM добавляют 3% некристаллического БСА (бычьего сывороточного альбумина).
Отбирают полностью созревшие ооцит-кумулюсные комплексы, полученные согласно Примеру 4. Сперму собирают из удаленного и препарированного эпидидимиса. Затем сперму активируют путем инкубации в среде KSOM с 3% БСА в течение двух часов, подсчитывают сперматозоиды и оценивают их подвижность. При необходимости, концентрацию сперматозоидов доводят до конечной концентрации 2×106/мл.
Выделенные ооцит-кумулюсные комплексы переносят в 30 мкл среды KSOM с 3% БСА, добавляют 10 мкл активированной спермы и затем инкубируют в течение 2,5 часов.
После стадии инкубации ооциты переносят на платы для культивирования эмбриональных клеток (KSOM+0,5% БСА). Сначала ооциты очищают путем повторного пипетирования 20 мкл пипеткой, что приводит к отделению кумулюсных клеток и сперматозоидов от ооцитов.
После дополнительной инкубации в течение 24 часов оценивают способность к оплодотворению путем обнаружения двухклеточной эмбриональной стадии.
Способ данного изобретения обеспечивает получение ооцитов с эффективностью оплодотворения, достигающей 72%, и коэффициентом развития ооцитов до стадии бластоцист приблизительно 90%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕХНОЛОГИЯ ДОЗРЕВАНИЯ ООЦИТОВ ЧЕЛОВЕКА НА СТАДИИ GV С ПОМОЩЬЮ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ: EV-IVM (EXTRACELLULAR VESICLES IN VITRO MATURATION) | 2023 |
|
RU2807492C1 |
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОГО КУЛЬТИВИРОВАНИЯ ООЦИТОВ КОРОВ | 2009 |
|
RU2410063C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭМБРИОНОВ ОВЕЦ in vitro | 2013 |
|
RU2525714C1 |
| Способ хирургической активации функции яичников при низком овариальном резерве | 2021 |
|
RU2754060C1 |
| СПОСОБЫ СОЗРЕВАНИЯ ФОЛЛИКУЛОВ ЯИЧНИКА IN VITRO | 2009 |
|
RU2492866C2 |
| Способ получения in vitro эмбрионов крупного рогатого скота | 2023 |
|
RU2823596C1 |
| Способ получения эмбрионов крупного рогатого скота in vitro | 2023 |
|
RU2818068C1 |
| СПОСОБ ДИАГНОСТИКИ ГЕНЕРАТИВНОЙ ПОТЕНЦИИ ЯИЧНИКОВ | 2008 |
|
RU2367949C1 |
| Средство для лечения женского бесплодия и бесплодия самок животных | 2017 |
|
RU2740922C2 |
| Питательная среда для культивирования ооцитов крупного рогатого скота in vitro | 2021 |
|
RU2778147C1 |

Изобретение относится к способам культивирования in vitro овариальных фолликулов для биологических исследований. Способ включает последовательные стадии: обеспечение сосуда для культивирования in vitro; выделение фолликула из яичника млекопитающего, содержащего, по меньшей мере: клетки theca или клетки pre-theca, гранулезные клетки и ооцит; при необходимости, первую стадию культивирования с использованием не содержащей масло первой среды, ингибирующей прикрепление; вторую стадию культивирования с использованием не содержащей масло второй среды, обеспечивающей прикрепление; и получение зрелого фолликула. Способ обеспечивает получение ооцитов с высокой эффективностью оплодотворения. Способ позволяет проводить оценку влияния внешних факторов на ооциты. 5 табл., 10 ил.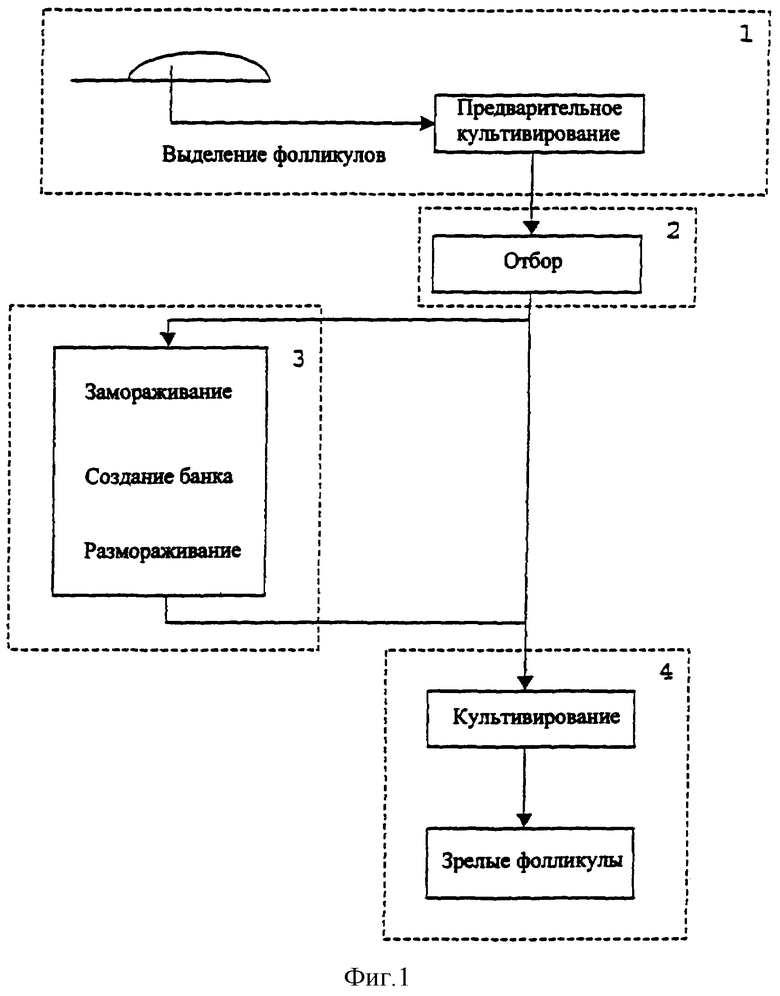
обеспечение сосуда для культивирования in vitro, в котором возможно прикрепление фолликула к стенке этого сосуда;
выделение фолликула, являющегося первичным или вторичным фолликулом, из яичника млекопитающего, содержащего по меньшей мере:
клетки theca или клетки pre-theca,
гранулезные клетки и
ооцит,
вторую стадию культивирования с использованием не содержащей масло второй среды, обеспечивающей прикрепление, и
получение указанного фолликула в зрелом состоянии.
культивирование фолликулов по способу, охарактеризованному в п.1, в присутствии физических или химических факторов, которые, предположительно, влияют на фолликулогенез, где указанные факторы присутствуют в течение, по крайней мере, одной стадии клеточного развития в процессе фолликулогенеза, и
оценку влияний указанных факторов на фолликулогенез.
| HARTSHORNE G.M | |||
| In vitro culture of ovavian follicles, Reviews of Reproduction, 1997, №2, 94-104 | |||
| Способ культивирования ооцитов коров | 1988 |
|
SU1659474A1 |
| СТИМУЛЯЦИЯ МЕЙОЗА | 1996 |
|
RU2188006C2 |
| Устройство для культивированияфОллиКулОВ | 1979 |
|
SU815035A1 |
| US 4987080 A, 22.01.1991. | |||
Авторы
Даты
2006-10-27—Публикация
2001-12-11—Подача