ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к транскрипту для получения слитого белка, слитому гену, обнаруженному в плоскоклеточных карциномах, детектированию реаранжировки и моноклональным антителам, специфическим для SCCA1, SCCA1/A2, SCCA2/A1 и SCCA2.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Антиген плоскоклеточных карцином (SCCA) является серологическим маркером для плоскоклеточных карцином (SCC) шейки матки, легкого, головы и шеи, наружных женских половых органов (вульвы) и пищевода [1, 2]. Он был первоначально очищен из комплекса ТА-4 из плоскоклеточной карциномы шейки матки человека, с молекулярной массой 42-48 кДа [1, 3]. Этот антиген состоит из более чем 10 белков, и изоэлектрическое фокусирование этого антигена выявило две субфракции, кислую (pI<6,25) и нейтральную (pI>6,25) изоформы [4]. Различие в молекулярной массе, возможно, обусловлено модификацией [5].
Клонирование кДНК SCCA показывает, что он принадлежит к семейству ингибиторов сериновых протеаз (серпинов) [6]. Последующее клонирование геномного района на хромосоме 18q21.3 выявило два тандемно расположенных гена [7]. Более теломерный, первоначальный SCCA, был назван SCCA1, тогда как более центромерный был назван SCCA2 (фигура 1). Оба они содержат восемь экзонов, и предположительные границы интрон-экзон, сайты сплайсинга, инициирующие кодоны и кодоны термиации являются идентичными. Они на 98% идентичны на уровне нуклеотидов (фигура 2) и на 92% идентичны на уровне аминокислот (фигура 3). Рассчитанная величина pI показывает, что нейтральная изоформа кодируется SCCA1, а кислая изоформа SCCA2. Было обнаружено, что альтернативно сплайсированная вариантная мРНК из обоих генов приводит к белкам, которые являются на 50 аминокислот и 21 аминокислоту более короткими [5].
У людей серпины картированы в одном из двух хромосомных кластеров. PI6, PI9 и ELNAH2 картированы в 6р25, тогда как PI8, Бомапин, PAI2, SCCA1, SCCA2, Хеадпин и Маспин картированы в 18q21.3 (фигура 1) [7-12]. Предполагается, что эти кластеры возникли посредством двух независимых межхромосомных дупликаций и нескольких раундов внутрихромосомных дупликаций [9]. Часто сообщалось, что район хромосомы 18q является районом с высокой частотой реаранжировок [9, 13-16]. Мишени и функции серпинов не выяснены полностью. Самое большее, что известно, это то, что первичными функциями является регуляция протеолитических событий, связанных со свертыванием, фибринолизом, апоптозом и воспалением, но сообщались и альтернативные функции, такие как транспорт гормонов и регуляция кровяного давления [17-24].
Хотя SCCA1 и SCCA2 являются почти идентичными, они различаются по их петлям реакционно-активных сайтов (фигура 2 и 3). SCCA1 ингибирует папаинподобные цистеиновые протеиназы-катепсин S, К и L [25, 26], тогда как SCCA2 ингибирует химотрипсинподобные сериновые протеазы-катепсин G и химазу мастоцитов [27]. Исследования петли реакционно-активного сайта (RSL) SCCA1 показывают, что RSL является существенной для ингибирования цистеиновых протеиназ [28]. Вариабельная часть RSL диктует специфичность протеиназ-мишеней, обнаруживаемую мутантами обмена RSL SCCA1 и SCCA2 и отдельными мутантами [28, 29]. Возможно, серпины используют общий RSL-зависимый механизм для ингибирования как сериновых, так и цистеиновых протеиназ.
Биологическая роль SCCA1 и SCCA2 не выяснена полностью. Они считаются ингибиторными серпинами. Результаты исследований предполагают, что SCCA1 участвует в апоптозе, и его экспрессия делает раковые клетки устойчивыми к нескольким механизмам гибели посредством ингибирования апоптоза [30]. Роль экспрессии SCCA2 в раковых клетках все еще является неясной. В нормальной ткани антиген SCCA может играть специфическую роль во время созревания эпидермиса [5].
Недавние исследования с использованием дискриминирующих моноклональных антител и полимеразной цепной реакции (ПЦР) показали, что как SCCA1, так и SCCA2 экспрессируются в супрабазальных слоях многослойного плоского цилиндрического эпителия языка, миндалины, пищевода, шейки матки и влагалища, телец Гассаля тимуса, некоторых участков кожи и в многослойном цилиндрическом эпителии верхних дыхательных путей (в которых не происходит газообмен) [31]. В плоскоклеточных карциномах легкого и головы и шеи SCCA1 и SCCA2 коэкспрессируются в умеренно или хорошо дифференцированных опухолях. В противоположность предыдущим исследованиям с использованием недискриминирующих антител, эти результаты показывают, что не было дифферециальной экспрессии между SCCA1 и SCCA2 в нормальной и злокачественной ткани. Предыдущие результаты показали, что SCCA2 обнаруживается только в периферических частях опухоли [32]. Это противоречие может быть обусловлено различиями между иммуногистохимическими способами и специфичностями антител [31]. Сообщалось, что ложноположительные результаты часто обусловлены загрязнением слюной или потом во время процедуры анализа [1]. Cataltepe et al. предполагают, что SCCA в слюне происходят из клеток плоского эпителия, выстилающего поверхности слизистой оболочки верхней части пищеварительного тракта [31].
Обычно SCCA1 и SCCA2 обнаруживаются в цитоплазме клеток плоского эпителия [31], но не в кровотоке [33]. Антиген, который появляется в сыворотке пациентов с SCC, может быть обусловлен сверхпродуцированием SCCA опухолевыми клетками и их нормальным круговоротом (34). Сообщалось, что SCCA, детектируемый в сыворотке с использованием радиоиммуноанализа с антителами или ОТ-ПЦР, является в основном SCCA2 [1, 35, 36], но другие исследования с использованием ПЦР указывают на то, что оба антигена могут быть амплифицированы и обнаружены в пробах пациентов [37].
Концентрации в сыворотке, присутствующие у пациентов с SCC, коррелируют с клинической стадией и со степенью гистологической дифференцировки опухоли (1). Для рака шейки матки некоторые исследования показывают корреляцию между величинами предобработки и клиническим исходом [1, 38-43]. Исследования показывают также корреляцию между высокими уровнями SCCA и объемом опухоли. Рецидив или прогрессирующее заболевание можно было детектировать за несколько месяцев перед клиническим обнаружением [39]. Подобные результаты наблюдают для плоскоклеточных карцином легкого, вульвы, головы и шеи, и пищевода [1, 2, 44 и 45]. Во всех этих исследованиях измеряли общий уровень SCCA. Недавно был разработан новый анализ sELISA с использованием дискриминирующих антител для SCCA1 и SCCA2 [33].
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к транскриптам слитых белков, мРНК, различных генов для обеспечения слитого белка, и, в частности, оно обеспечивает обнаружение слитого гена, состоящего из частей SCCA1 и SCCA2. Такие слитые гены были теперь обнаружены в линиях клеток SCC различного происхождения (шейки матки, легкого и глотки). Данное изобретение обеспечивает также способы для установления специфических иммунологических реагентов для определения/детектирования этих слитых белков.
Один слитый белок определяется следующей аминокислотной последовательностью
MNSLSEANTK FMFDLFQQFR KSKENNIFYS PISITSALGM VLLGAKDNTA QQIKKVLHFD QVTENTTGKA ATYHVDRSGN VHHQFQKLLTE FNKSTDAYE LKIANKLFGE KTYLFLQEYL DAIKKFYQTS VESVDFANAP EESRKKINSW VESQTNEKIK LIPEGNIGS NTTLVLVNAI YFKGQWEKKF NKEDTKEEKF WPNKNTYKSI QMMRQYTSFH FASLEDVQAK VLEIPYKGKD LSMIVLLPNE IDGLQKLEEK LTAEKLMEWT SLQNMRETCV DLHLPRFKME ESYDLKDTLR TMGMVNIFNG DADLSGMTWS HGLSVSKVLH KAFVEVTEEG VEAAAATAVV VVELSSPSTN EEFCCNHPFL FFIRQNKTNS ILFYGRFSSP
основывающейся на последовательности ДНК
ATGAATTCAC TCAGTGAAGC CAACACCAAG TTCATGTTCG ACCTGTTCCA ACAGTTCAGA AAATCAAAAG AGAACAACAT CTTCTATTCC CCTATCAGCA TCACATCAGC ATTAGGGATG GTCCTCTTAG GAGCCAAAGA CAACACTGCA CAACAGATTA AGAAGGTTCT TCACTTTGAT CAAGTCACAG AGAACACCAC AGGAAAAGCT GCAACATATC ATGTTGATAG GTCAGGAAAT GTTCATCACC AGTTTCAAAA GCTTCTGACT GAATTCAACA AATCCACTGA TGCATATGAG CTGAAGATCG CCAACAAGCT CTTCGGAGAA AAAACGTATC TATTTTTACA GGAATATTTA GATGCCATCA AGAAATTTTA CCAGACCAGT GTGGAATCTG TTGATTTTGC AAATGCTCCA GAAGAAAGTC GAAAGAAGAT TAACTCCTGG GTGGAAAGTC AAACGAATGA AAAAATTAAA AACCTAATTC CTGAAGGTAA TATTGGCAGC AATACCACAT TGGTTCTTGT GAACGCAATC TATTTCAAAG GGCAGTGGGA GAAGAAATTT AATAAAGAAG ATACTAAAGA GGAAAAATTT TGGCCAAACA AGAATACATA CAAGTCCATA CAGATGATGA GGCAATACAC ATCTTTTCAT TTTGCCTCGC TGGAGGATGT ACAGGCCAAG GTCCTGGAAA TACCATACAA AGGCAAAGAT CTAAGCATGA TTGTGTTGCT GCCAAATGAA ATCGATGGTC TCCAGAAGCT TGAAGAGAAA CTCACTGCTG AGAAATTGAT GGAATGGACA AGTTTGCAGA ATATGAGAGA GACATGTGTC GATTTACACT TACCTCGGTT CAAAATGGAA GAGAGCTATG ACCTCAAGGA CACGTTGAGA ACCATGGGAA TGGTGAATAT CTTCAATGGG GATGCAGACC TCTCAGGCAT GACCTGGAGC CACGGTCTCT CAGTATCTAA AGTCCTACAC AAGGCCTTTG TGGAGGTCAC TGAGGAGGGA GTGGAAGCTG CAGCTGCCAC CGCTGTAGTA GTAGTCGAAT TATCATCTCC TTCAACTAAT GAAGAGTTCT GTTGTAATCA CCCTTTCCTA TTCTTCATAA GGCAAAATAA GACCAACAGC ATCCTCTTCT ATGGCAGATT CTCATCCCCA TAGATGCAAT TAGTGTGTCA CT
ОПИСАНИЕ ХАРАКТЕРНЫХ ВАРИАНТОВ
Один слитый ген (фигура 4) был обнаружен секвенированием кДНК из клеточных линий SCC.
В соответствии с переключением последовательности от SCCA1 к SCCA2 точка разрыва ДНК должна находиться в интроне 7 (фигура 2). Этот ген будет, следовательно, контролироваться промоторным районом SCCA1, но продуцировать белок с SCCA2-специфичностью.
Дальнейшие исследования показали, что транскрипт слитого белка встречается в различных сайтах при образовании SCCA1/А2 или SCCA2/А1, т.е. различные гены этих антигенов обеспечивают кроссоверные транскрипты, имеющие промоторный район одного гена и петлю реакционно-активного сайта другого гена.
Это приводит к главному изобретению, относящемуся к транскрипту слитого белка двух различных генов, имеющих гомологию нуклеотидов по меньшей мере 80% в определенном районе, районе кроссоверной реакции.
Эти слитые гены клонированы и хранятся в виде плазмидных конструкций, а также трансформированы в различные штаммы Е. coli.
Плазмида, pGEX6P-3 SCCA1/А2, содержащая этот слитый ген, была депонирована Европейской Коллекцией Клеточных Культур 14 марта 2001 года под депозитным номером ЕСАСС 01031315.
Был получен слитый белок, и исследования связывания с образованием комплекса показывают связывание субстрата слитого гена с Катепсином G, но не с Катепсином L (фигура 8).
Слитый ген может быть обнаружен Саузерн-блот-анализом опухолевой ДНК (фигура 9). Слитый ген может быть также обнаружен ПЦР-анализом, а также клонированием и секвенированием кДНК.
ПРИМЕР 1
Клонирование SCCA
1.1. ПЦР-амплификация
мРНК из клеточных линий Caski (шейка матки), C4-I (шейка матки), А549 (легкое), CaLu3 (легкое), SkMes (легкое) и RPMI2650 (глотка) получали с использованием набора для очистки мРНК QuickPrep Micro mRNA Purification kit (Pharmacia) и кДНК получали с использованием набора для синтеза кДНК первой цепи (Pharmacia). Фрагмент ДНК размером 1218 п.н., охватывающий кодирующую последовательность SCCA, был амплифицирован при помощи ПЦР в 100 мкл реакционной смеси, содержащей 10 мМ Трис-HCl рН 8,85, 25 мМ KCl, 5 мМ (NH4)2SO4, 2 мМ MgSO4 (Boehringer), 0,2 мМ dNTP (Pharmacia), 10 мкМ SCCA 1-7F (ДНК-последовательности для всех праймеров показаны в таблице 1), 10 мкМ SCCA 391-397В, 2 мкл кДНК и 2,5 Е Pwo-полимеразы (Boehringer). После денатурации проб в течение 5 минут при 96°С проводили в целом 30 циклов, каждый из которых состоит из денатурации в течение 15 секунд при 96°С, отжига в течение 15 секунд при 60°С и удлинения в течение 30 секунд при 72°С. ПЦР-реакцию завершали конечным удлинением в течение 10 минут при 72°С.

1.2. Детектирование SCCA1 и SCCA2
Присутствие SCCA1 в продуктах ПЦР детектировали расщеплением рестриктазой SacII с получением двух фрагментов размером 245 и 973 п.н., соответственно, или посредством SCCA1-специфической ПЦР с использованием праймеров SCCA 1-7F и SCCA1 323-329В в стандартной ПЦР-реакции (75 мМ Трис-HCl рН 8,8, 20 мМ (NH4)2SO4, 0,01% Твин 20, 2 мМ MgCl2, 0,2 мМ dNTP, 10 мкМ каждого праймера, матрица и 0,025 Е/мкл реакции полимеразы Taq; после денатурации проб в течение 5 минут при 96°С проводили в целом 30 циклов, каждый из которых состоит из денатурации в течение 15 секунд при 96°С, отжига в течение 15 секунд при оптимальной температуре отжига и удлинения в течение 30 секунд при 72°С. ПЦР-реакцию завершали конечным удлинением в течение 10 минут при 72°С, Та=50°С, с получением фрагмента размером 997 п.н. Присутствие SCCA2 детектировали стандартной ПЦР с использованием SCCA 1-7F и SCCA2-специфического праймера, SCCA2 357-363В, Та=60°С, с получением фрагмента размером 1090 п.н.
1.3. Клонирование
Продукты ПЦР клонировали с использованием набора для клонирования PCR-Script Amp (Stratagene). Скрининг колоний выполняли при помощи ПЦР, как описано в 1.2 выше. Плазмидную ДНК получали из отобранных клонов, содержащих SCCA1 или SCCA2, с использованием системы для очистки ДНК Wizard Plus Minipreps DNA Purification System (Promega).
1.4. Секвенирование ДНК
Клоны секвенировали с использованием секвенирования при помощи ABI Prism BigDye Terminator Cycle (PE Biosystems). Пробы подвергали электрофорезу на ABI Prism 310.
1.5. Повторное клонирование
Отобранные клоны повторно клонировали в экспрессирующий вектор pGEX-6P-3 (Pharmacia). Фрагменты вырезали из вектора PCR-Script Amp при помощи BamHI и XhoI и лигировали в экспрессирующий вектор в реакции 10 мкл, содержащей 1×ОРА, 1 мМ АТФ, 50 нг расщепленного вектора, инсерт SCCA, соответствующий отношению молей концов вектора к инсерту 1:5-1:8, и 7,5-10 Е ДНК-лигазы Т4 (все из Pharmacia). Реакционные пробирки инкубировали при 10°С в течение ночи и инактивировали в течение 10 минут при 65°С. 2-4 мкл реакции трансформировали в E.coli JM109 (46). Затем плазмидную ДНК из отобранных клонов трансформировали в E.coli BL21 для экспрессии белка.
1.6. Поддержание клонированного гена
Плазмидную ДНК (pGEX-6P-3, содержащую слитый ген SCCA1/А2) в 10 мМ буферном растворе Трис-HCl рН 8,0, хранят при -80°С. Для возобновления экспрессии белка плазмидные ДНК трансформируют в компетентную E.coli BL21 в соответствии с Sambrook et al. (p.1.82-1.84 в ссылке 45). Для получения большего количества плазмидной ДНК предпочтительной является трансформация в E.coli JM109.
ПРИМЕР 2
Экспрессия и очистка белка
2.1. Экспрессия белка
Условия экспрессии определяли с использованием препаратов для экспрессии небольшого масштаба. Для крупномасштабной экспрессии культуры 500 мл 2×YT и 100 мкг/мл ампициллина инокулировали 5 мл ночной культуры и выращивали при 37°С. Экспрессию белка индуцировали при OD600=0,5-1,3 добавлением IPTG до конечной концентрации 0,1 мМ. Культуры, продуцирующие SSCА1, выращивали в течение 4-16 часов, SCCA1/А2 в течение 16-18 часов. Культуры, продуцирующие белок SCCA2, индуцировали при OD600=1,2-1,4 и выращивали в течение 2-3 часов.
2.2. Очистка белка
Клетки собирали центрифугированием в течение 10 минут при 2000 g, промывали 50 мл ТЭ рН 8,0 и растворяли в 3 мл ТЭ/г бактериального осадка. Добавляли лизоцим до конечной концентрации 800 мкг/г осадка, и смесь инкубировали на льду в течение 30-60 минут и затем замораживали в течение ночи при -70°С. Добавляли хлорид магния и ДНКазу до конечной концентрации 12 мМ и 20 мкг/г осадка, соответственно. После инкубирования на льду в течение 30 минут пробы центрифугировали в течение 30 минут при 40000 g. К каждым 0,5 мл супернатанта добавляли 50% Глутатион-Сефарозу (Pharmacia) и инкубировали в течение 30 минут - 2 часов при комнатной температуре при осторожном встряхивании. Суспензию промывали 5-7 раз с использованием 1×ЗФР. Слитый белок GST-SCCA элюировали с использованием 0,5-1 мл восстановленного глутатиона (Pharmacia) и инкубировали в течение 30-60 минут при комнатной температуре или в течение ночи при 4°С, в обоих случаях при осторожном встряхивании. Белок SCCA элюировали расщеплением между GST и SCCA. Добавляли 0,48 мл буфера для расщепления (50 мМ Трис-HCl рН 7,0, 150 мМ NaCl, 1 мМ ЭДТА, 1 мМ ДТТ) и 20 мкл добавляемой перед разрезанием протеазы, и пробы инкубировали при 4°С при осторожном встряхивании в течение 4 часов или в течение ночи. Белки анализировали с использованием электрофореза в ДСН-ПААГ посредством Phast-системы (Pharmacia).
2.3. Связывание с образованием комплекса
Связывание SCCA с субстратом с образованием комплекса выполняли смешиванием 2 мкг SCCA-белка с 0,5 мкг Катепсина G (Biodesign Int.) или 0,5 мкг или 0,9 мкг Катепсина L (Calbiochem) в 1×ЗФР-буфере в общем объеме 4,5 мкл. Пробы инкубировали при 37°С в течение 30 минут. К каждой пробе добавляли 0,5 мкл 10хбуфера для образования комплекса (20% ДСН, 140 мМ меркаптоэтанол, бромфеноловый синий). Пробы инкубировали в течение 3 минут при 95°С и анализировали на 12,5% ДСН-ПААГ. Слитый белок SCCA1/А2 образует комплекс с Катепсином G, но не с Катепсином L, что свидетельствует о том, что этот слитый белок является функциональным и имеет субстратную специфичность SCCA2 (фигура 8).
ПРИМЕР 3
Анализ ДНК
3.1. Анализ блота по Саузерну
Приблизительно 10 мкг ДНК, полученной из клеточных линий SCC, а также из проб крови нормальных здоровых волонтеров, расщепляли рестриктазами PstI или BamHI. Расщепленную ДНК разделяли на 0,8% агарозе и переносили на мембраны (Hybond N+, Pharmacia). Фильтры предгибридизовали в течение 1 часа и гибридизовали в течение ночи при 60°С в 20 мл раствора, содержащего 5×SSC, 0,1% ДСН, 5% Декстрансульфат, жидкий блок Liquid block (Pharmacia), разведенный 1:20, и ДНК спермы лосося 100 мкг/мл. Концентрация зонда во время гибридизации была 10 нг/мл. После гибридизации фильтры промывали в строгих условиях промывки в течение 15 минут в 1×SSC/0,1% ДСН и в течение 15 минут в 0,2×SSC/1% ДСН, в обоих случаях при 60°С. Гибридизацию зонда детектировали с использованием модуля детектирования Gene Images CDP-Star (Pharmacia) с небольшими модификациями. Фильтры блокировали в течение 1 часа при комнатной температуре в растворе, содержащем жидкий блок, разбавленный 1:7,5. Затем их инкубировали в буфере А (0,1 М Трис, 0,3 М NaCl, рН 9,5)/0,5 БСА в течение 15 минут перед добавлением конъюгата антифлуоресцеин-HRP, разбавленного 1:6800, и затем инкубировали еще в течение 45 минут. Фильтры промывали в течение 3×10 минут в буфере А/0,3% Твин 20 перед добавлением детектирующего реагента. Фильтры инкубировали в течение 2 минут, промывали кратковременно в 2×SSC и завертывали в пластиковую пленку. Пленку Hyperfilm MP экспонировали в течение 35 минут.
3.2. Гибридизационные зонды
Зонды получали и метили при помощи ПЦР в реакции, содержащей 60 мкМ каждого из dATP, dCTP и dGTP, 24 мкМ dTTP, 40 мкМ флуоресцеин-11-dUTP, 2 мМ MgCl2, 3 мкМ прямого праймера, 3 мкМ обратного праймера, 15 нг ДНК-матрицы (SCCA2-содержащей плазмиды), 1 Е полимеразы Taq и 1×ЗФР-буфер (Advanced Biotechnologies). Зонд I: фрагмент размером 393 п.н. экзона 8 (нуклеотиды 802-1194), праймеры SCCA 266-273F и SCCA 391-397В, Та=50°С; зонд II: фрагмент размером 126 п.н. экзона 8 (нуклеотиды 957-1082), праймеры SCCA2 319-324F и SCCA2 357-363В, Та=50°С; зонд III: фрагмент размером 1194 п.н., охватывающий кодирующую последовательность и 22 нуклеотида на 3'-конце этого гена, праймеры SCCA 1-7F и SCCA 391-397В, Та=60°С.
Блот по Саузерну расщепленной PstI ДНК, гибридизованной с зондом I, показал отличающееся распределение полос ДНК из SCC-клеточной линии по сравнению с распределением полос нормальной контрольной ДНК (фигура 9). ДНК, расщепленная BamHI, также показывает отклоняющиеся от нормы полосы по сравнению с нормальной контрольной ДНК.
3.3. ПЦР-анализ
ДНК, выделенная рутинными процедурами из проб, анализируемая при помощи ПЦР с использованием праймеров 7 и 8 (см. таблицу 1) в стандартной ПЦР-реакции, показывает продукт только в пробах, содержащих слитый ген.
ПРИМЕР 4
Гибридомы и моноклональные антитела
4.1. Получение гибридом и получение моноклональных антител, реактивных с SCCA1/А2, SCCA2 и SCCA1
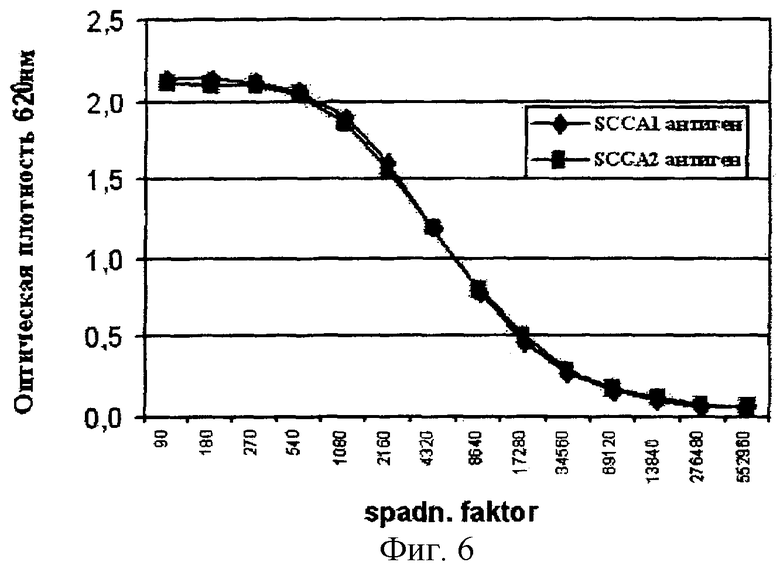
Поликлональные антисыворотки, реактивные с антигеном SCC, получали подкожной иммунизацией кроликов рекомбинантным антигеном SCC и сбором иммунных сывороток в соответствии со стандартными процедурами. Титр поликлональных антисывороток тестировали определением реактивности этих антисывороток с биотинилированными SCCA1/А2 и SCCA1, иммобилизованными в планшетах со стрептавидином (Labsystems Oy, Helsinki, Finland), фигура 6. Рекомбинантные SCCA1/А2 и SCCA1 биотинилировали капроатным эфиром биотин-N-сукцинимида согласно стандартным процедурам.
Моноклональные антитела, реактивные с SCCA1/А2 и SCCA2, получали иммунизацией мышей Balb/c внутрибрюшинно 10-50 мкг рекомбинантного SCCA1/А2 в адъюванте Ribi. После иммунизации и 2-4 бустерных доз на протяжении 60-90 дней клетки селезенки из иммунизированных мышей сливали с клетками миеломы Р3 × 63Ag 8, как описано [47].
Гибридомы, продуцирующие антитела, реагирующие с SCCA1/А2, отбирали с использованием скрининга ELISA супернатантов гибридом в микротитрационных планшетах, покрытых аффинно-очищенной поликлональной антисывороткой против мышиного IgG+M (Jackson Immuno Res Lab, US). Затем эти лунки инкубировали с антигеном SCCA1/А2 и после промывания связанный антиген детектировали инкубированием с поликлональными кроличьими антителами против SCC и HRP-меченым свиным антителом против кроличьего Ig (Dako AS, Copenhagen, Denmark).
4.2. Реактивность отобранных гибридом с антигеном SCC
Реактивность полученных гибридом испытывали в ELISA, подобно процедуре скрининга ELISA. Вкратце, моноклональные антитела, продуцируемые этими гибридомами, иммобилизовали в микротитрационных планшетах, покрытых поликлональной антисывороткой против мышиного IgG+M (Jackson Immuno Res Lab, US). Затем эти лунки инкубировали с 50 мкл различных рекомбинантных антигенов SCC в ЗФР с 1% БСА в течение 1 часа, после промывки планшеты инкубировали с 100 мкл кроличьих антител против SCC, разведенных 1/5000 в ЗФР-1% БСА, и инкубировали еще в течение 1 часа. Затем связанные кроличьи антитела против SCC детектировали инкубированием с HRP-меченым свиным антителом против кроличьего Ig, и визуализировали с помощью субстрата OPD и определения OD при 450 нм.
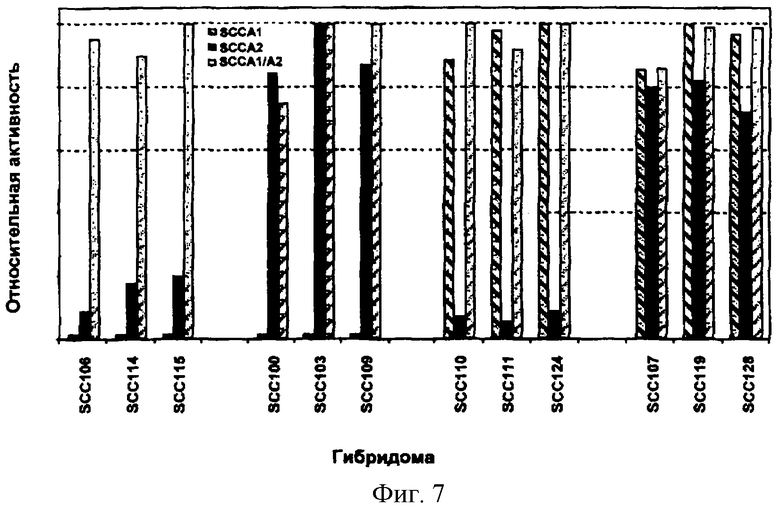
На фигуре 7 показана реактивность отобранных гибридом. SCC106, SCC114, SCC115 реагировали только с SCCA1/А2, что указывает на то, что они являются специфическими для слитого белка SCCA1/А2. SCC100, SCC103 и SCC109 реагировали с SCCA2 и SCCA1/А2, но не с SCCA1, свидетельствуя о том, что они являются специфическими в отношении SCCA2. SCC110, SCC111 и SCC124 реагировали с SCCA1 и SCCA1/А2, но не с SCCA2, что позволяет предположить, что они являются специфическими в отношении SCCA1.
SCC107, SCC119 и SCC128 реагировали со всеми SCC-антигенами, свидетельствуя о том, что они узнают общий эпитоп в SCCA1 и SCCA2.
Клонированные лимитирующим разведением в два раза клоны продуцировали антитела, реагирующие с SCCA1/А2, но отрицательные в отношении SCCA1.
Моноклональные антитела получали культивированием in vitro гибридомных клонов посредством инокуляции 104 клеток/мл в DMEM, 5% фетальной телячьей сыворотке в роллерных флаконах и давали им расти в течение 10-14 дней. Затем эти моноклональные антитела очищали из культуральной среды с использованием Протеин А (Bioprocessing Ltd, Durham, UK) - аффинной хроматографии в соответствии с рекомендациями изготовителей.
ПРИМЕР 5
С использованием полученных моноклональных антител и рекомбинантных белков удалось разработать иммуноанализы для специфического определения слитого белка SCCA1/А2 и анализы, специфические для SCCA2 и SCCA1, соответственно.
5.1. Иммуноанализы для определения слитого белка SCCA1/А2
Анализы, специфические для слитого белка SCCA1/А2, но по существу отрицательные в отношении SCCA1 и SCCA2, были созданы с использованием антител среди SCC106, SCC114 или SCC115 в комбинации с антителами среди SCC107, SCC119 или SCC128, см. фигуру.
В предпочтительной форме анализа антитело SCC107 использовали в качестве улавливающего антитела и SCC106 в качестве детектирующего антитела.
mAB SCC107 биотинилировали капроатным эфиром БиотинNHRS, Sigma Chemical Co, US, с использованием стандартных процедур, и использовали в качестве улавливающего антитела. mAB SCC106 конъюгировали с HRP в соответствии с модификацией процедуры Nakone.
Биотинилированные mAB SCC107 и HRP-конъюгированные mAB SCC106 использовали в двухсайтовом EIA в соответствии со следующим протоколом.
Процедура анализа
1. Добавить 50 мкл рекомбинантного антигена SCCA (0-100 мкг/л в ЗФР, 60 г/л БСА, рН 7,2) + 100 мкл Биотин-mAB SCC107, 2 мкг/мл, в буфере для анализа в покрытых стрептавидином микротитрационных планшетах, Labsystems Oy, Helsinki, Finland.
2. Инкубировать в течение 1 часа±10 минут при встряхивании.
3. Промыть 3 раза 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
4. Добавить 100 мкл HRP-mAB SCC106, 2 мкг/мл, в буфере для анализа.
5. Инкубировать в течение 1 часа±10 минут при встряхивании.
6. Промыть 6 раз 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
7. Добавить 100 мкл ТМВ, ELISA Technology, US.
8. Инкубировать 30 минут ±5 минут.
9. Определить OD 620 нм в ELISA-ридере.
Кривые доза-ответ для антигенов SCCA1, SCCA2 и SCCA1/А2 выявили, что этот анализ был специфическим в отношении рекомбинантного антигена SCCA1/А2 с перекрестной реактивностью с SCCA1 или SCCA2 <5%.
5.2. Анализы для специфического определения SCCA2
Анализы, специфические для SCCA2, без значимой реактивности с SCCA1/А2 и SCCA1 были созданы с использованием антител среди SCC100, SCC103 или SCC109 в комбинации с антителами среди SCC107, SCC119 или SCC128. В предпочтительной форме анализа mAB SCC107 использовали в качестве улавливающего антитела и mAB SCC103 в качестве детектирующего антитела.
mAB SCC107 биотинилировали капроатным эфиром БиотинNHRS, Sigma Chemical Co, US, с использованием стандартных процедур, и использовали в качестве улавливающего антитела. mAB SCC103 конъюгировали с HRP типа V (Sigma Chemical Co, US) в соответствии с модификацией процедуры Nakone.
Биотинилированные mAB SCC107 и HRP-конъюгированные mAB SCC103 использовали в двухсайтовом EIA в соответствии со следующим протоколом.
Процедура анализа
1. Добавить 50 мкл рекомбинантного антигена SCC (0-100 мкг/л в ЗФР, 60 г/л БСА, рН 7,2) + 100 мкл Биотин-mAB SCC107, 2 мкг/мл, в буфере для анализа в покрытых стрептавидином микротитрационных планшетах, Labsystems Oy, Helsinki, Finland.
2. Инкубировать в течение 1 часа ±10 минут при встряхивании.
3. Промыть 3 раза 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
4. Добавить 100 мкл HRP-mAB SCC103, 2 мкг/мл, в буфере для анализа.
5. Инкубировать в течение 1 часа ±10 минут при встряхивании.
6. Промыть 6 раз 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
7. Добавить 100 мкл ТМВ, ELISA Technology, US.
8. Инкубировать 30 минут ±5 минут.
9. Определить OD 620 нм в ELISA-ридере.
На основании кривых доза-ответ для слитых белков SCCA2, SCCA1 и SCCA1/А2 был сделан вывод, что анализ согласно примеру 5.2 был специфическим в отношении SCCA2, с перекрестной реактивностью в отношении SCCA1 и SCCA1/А2 <5%.
5.3. Анализы для специфического определения SCCA
Анализы, специфические для SCCA1, без значимой реактивности с SCCA2 и SCCA1/А2 были созданы с использованием антител среди SCC110, SCC111 или SCC124 в комбинации с антителами среди SCC107, SCC119 или SCC128. В предпочтительной конфигурации mAB SCC107 использовали в качестве улавливающего антитела и mAB SCC124 в качестве детектирующего антитела.
mAB SCC107 биотинилировали капроатным эфиром БиотинNHRS, Sigma Chemical Co, US, с использованием стандартных процедур, и использовали в качестве улавливающего антитела. mAB SCC124 конъюгировали с HRP типа V (Sigma Chemical Co, US) в соответствии с модификацией процедуры Nakone.
Биотинилированные mAB SCC107 и HRP-конъюгированные mAB SCC124 использовали в двухсайтовом EIA в соответствии со следующим протоколом.
Процедура анализа
1. Добавить 50 мкл антигена SCC (0-100 мкг/л в ЗФР, 60 г/л БСА, рН 7,2) + 100 мкл Биотин-mAB SCC107, 2 мкг/мл, в буфере для анализа в покрытых стрептавидином микротитрационных планшетах, Labsystems Oy, Helsinki, Finland.
2. Инкубировать в течение 1 часа ±10 минут при встряхивании.
3. Промыть 3 раза 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
4. Добавить 100 мкл HRP-mAB SCC124, 2 мкг/мл, в буфере для анализа.
5. Инкубировать в течение 1 часа ±10 минут при встряхивании.
6. Промыть 6 раз 5 мМ Трис-буфером, 0,05% Твином 40, рН 7,75.
7. Добавить 100 мкл ТМВ, ELISA Technology, US.
8. Инкубировать 30 минут ±5 минут.
9. Определить OD 620 нм в ELISA-ридере.
На основании антител в соответствии с 5.3 могут быть созданы иммуноанализы, специфические для SCCA1, с перекрестной реактивностью в отношении SCCA2 или SCCA1/A2 <10%.
ПОДПИСИ К ФИГУРАМ
1. Реаранжировка хромосомы 18. При клонировании геномной области хромомсомы 18q21.3 были выявлены два тандемно-расположенных гена. Ген, расположенный ближе к теломерной области, исходный SCCA, был обозначен как SCCA1, тогда как ген, расположенный ближе к центромерной области, был обозначен SCCA2 (фигура 1).
2. Сравнение кодирующих областей ДНК, экзонов 2-8 SCCA1 и SCCA2. Положения интронов указаны как -Ix-. Различия между этими генами выделены полужирным шрифтом. Курсивом выделены области, кодирующие петли реактивных сайтов. Стрелки показывают положения праймеров (таблица 1). Кодирующие области идентичны на нуклеотидном уровне на 98%.
3. Сравнение последовательностей белков SCCA1 и SCCA2. Положения интронов указаны пунктирными линиями. Различия между белками показаны выделены жирным шрифтом. Блоки показывают петли реактивных сайтов. Белки идентичны на аминокислотном уровне на 92%.
4. Нуклеотидные кодирующие области ДНК, экзон 2-8 реаранжированного SCCA1/SCCA2. Последовательности, происходящие из SCCA1, показаны обычным шрифтом, тогда как последовательности, происходящие из SCCA2, показаны жирным шрифтом. Положения интронов указаны как -Ix-. Различия между этими генами показаны серым цветом. Курсив показывает район, кодирующий петлю реактивного сайта.
5. Белковая последовательность слитого белка SCCA1/SCCA2. Аминокислоты, происходящие из SCCA1, показаны обычными буквами. Аминокислоты, происходящие из SCCA2, показаны жирным шрифтом. Положения интронов указаны пунктирными линиями. Различия между белками показаны серым цветом. Блок показывает петлю реактивного сайта.
6. Титр PABan относительно антигена SCC.
7. Реактивность полученных гибридом с различными антигенами SCC.
8. Анализ связывания с образованием комплекса слитого белка SCCA1/A2. Дорожка A: SCCA1/A2, дорожка В: SCCA1/A2, инкубированный с Катепсином G, дорожка С: SCCA1/A2, инкубированный с Катепсином L. Комплекс SCCA1/A2 и Катепсина G показан стрелкой. Указан маркер молекулярной массы.
9. Саузерн-блот-анализ геномной ДНК, расщепленной PstI и гибридизованной с зондом I. Дорожка A: RPMI2650, содержащая слитый ген SCCA1/SCCA2, дорожка В: нормальная ДНК. Отклоняющиеся от нормы полосы указаны стрелками. Указан маркер молекулярной массы.












Изобретение относится к области молекулярной биологии и может быть использовано в медицине. При анализе мДНК клеточных линий плоскоклеточных карцином различного происхождения выявлены последовательности, представляющие собой транскрипты реаранжированных генов SCCA1 и SCCA2. Установлено, что результатом реаранжировки является образование слитого гена, состоящего из экзонов 2-7 гена SCCA1 и экзона 8 гена SCCA2 или из экзонов 2-7 гена SCCA2 и экзона 8 гена SCCA1. Получены экспрессирующие векторы, включающие названные комбинации экзонов двух генов, которые обеспечивают синтез соответствующего слитого белка в клетке-хозяине. Предложенные последовательности нуклеиновых кислот и генетические конструкции на их основе представляют собой новые средства для диагностики плоскоклеточных карцином. 4 н. и 4 з.п. ф-лы., 9 ил., 1 табл.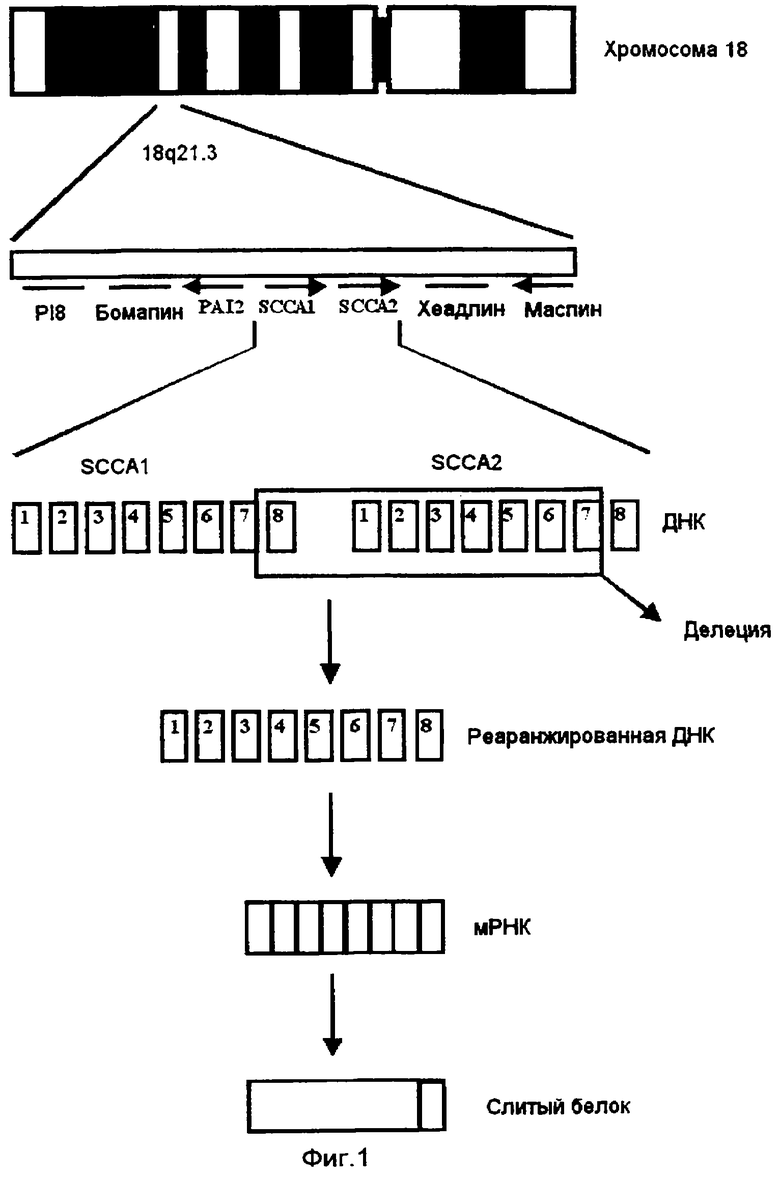
| SCHICK CH | |||
| et al., J.Biol | |||
| Chem., v.272, №3, pp.1849-1855, 1997 | |||
| Возвращающее устройство для тележек локомотивов | 1953 |
|
SU102603A1 |
| DE 19742725 A1, 01.04.1999. | |||
Авторы
Даты
2006-11-27—Публикация
2002-03-15—Подача