Предпосылки изобретения
Настоящее изобретение относится к отработанному раствору при ферментации L-глутаминовой кислоты, который подходит в качестве сырья для удобрения, и удобрению, включающему его.
L-глутаминовую кислоту в основном получают ферментацией с использованием так называемых продуцирующих L-глутаминовую кислоту коринеформных бактерий, относящихся к роду Brevibacterium, Corynebacterium или Microbacterium, или их мутантных штаммов (Amino Acid Fermentation, Gakkai Shuppan Center, pp.195-215, 1986). В качестве способов получения L-глутаминовой кислоты ферментацией с использованием других штаммов бактерий известен способ с использованием микроорганизма, относящегося к роду Bacillus, Streptomyces, Penicillium или тому подобное (патент США №3220929), способ с использованием микроорганизма, относящегося к роду Pseudomonas, Arthrobacter, Serratia, Candida или тому подобное (патент США №3563857), способ с использованием микроорганизма, относящегося к роду Bacillus, Pseudomonas, Serratia, Aerobacter aerogenes (в настоящее время отнесенный к Enterobacter aerogenes) или тому подобное (публикация патента Японии (Kokoku) №32-9393), способ с использованием мутантного штамма Escherichia coli (выложенная заявка на патент Японии (Kokai) №5-244970) и так далее. Кроме того, авторы настоящего изобретения предложили способ получения L-глутаминовой кислоты с использованием микроорганизма, относящегося к роду Klebsiella, Erwinia или Pantoea (выложенная заявка на патент Японии №2000-106869).
Кроме того, раскрыты различные способы улучшения способности продуцировать L-глутаминовую кислоту путем повышения активности ферментов, принимающих участие в биосинтезе L-глутаминовой кислоты, с использованием методов рекомбинантной ДНК. Например, сообщалось, что введение гена, кодирующего цитратсинтазу из Escherichia coli или Corynebacterium glutamicum, было эффективным для усиления способности продуцировать L-глутаминовую кислоту у бактерий Corynebacterium или Brevibacterium (публикация патента Японии (Kokoku) №7-121228). Кроме того, в выложенной заявке на патент Японии №61-268185 раскрывается клетка, содержащая рекомбинантную ДНК, включающую ген глутаматдегидрогеназы из бактерий Corynebacterium. Кроме того, в выложенной заявке на патент Японии №63-214189 раскрывается способ усиления способности продуцировать L-глутаминовую кислоту амплификацией гена глутаматдегидрогеназы, гена изоцитратдегидрогеназы, гена аконитатгидратазы и гена цитратсинтазы.
В отношении способа получения L-глутаминовой кислоты, как описано выше, маточный раствор после извлечения L-глутаминовой кислоты применяется в качестве сырья для удобрения или тому подобного (выложенная заявка на патент Японии №50-129363, публикация патента Японии №35-16965, выложенная заявка на патент Японии №52-7872). Следовательно, в способе получения L-глутаминовой кислоты ферментацией считается желательным не только улучшить продуктивность в отношении L-глутаминовой кислоты, но также получить маточный раствору, который более подходит в качестве сырья для удобрения.
Известен способ, в котором ферментацию проводят таким образом, что L-аминокислота, накапливающаяся в культуре, кристаллизуется (выложенная заявка на патент Японии №62-288). В данном способе концентрация L-аминокислоты в культуре поддерживается ниже определенного уровня осаждением накапливающейся в культуре L-аминокислоты. В частности, L-триптофан, L-тирозин или L-лейцин осаждается во время ферментации доведением температуры и рН культуры или добавлением в среду поверхностно-активного вещества.
Несмотря на то, что известен, как описанный выше, способ проведения ферментации с сопровождающимся осаждением L-аминокислот, аминокислотами, подходящими для данного способа, являются таковые, которые обладают относительно низкой растворимостью в воде, и не известен пример применения способа для хорошо растворимых в воде аминокислот, таких, как L-глутаминовая кислота. Кроме того, среда должна иметь низкое значение рН для осаждения L-глутаминовой кислоты. Однако продуцирующие L-глутаминовую кислоту бактерии, такие, как упоминались выше, не могут расти в кислых условиях, и, следовательно, ферментацию L-глутаминовой кислоты проводят в нейтральных условиях (патенты США №3220929 и 3032474; K.C.Chao & J.W.Foster, J.Bacteriol., 77, pp.715-725 (1959)). Таким образом, получение L-глутаминовой кислоты ферментацией, сопровождаемой осаждением, неизвестно. Кроме того, известно, что рост наиболее ацидофильных бактерий ингибируется под действием органических кислот, таких, как уксусная кислота, молочная кислота и янтарная кислота (Yasuro Oshima Ed., "Extreme Environment Microorganism Handbook", p.231, Science Forum; R.M.Borichewski, J.Bacteriol., 93, pp.597-599 (1967) etc.). Следовательно, полагается, что многие микроорганизмы чувствительны к L-глутаминовой кислоте, которая также является органической кислотой, в кислых условиях, и не сообщалось о попытке поиска микроорганизмов, показывающих способность продуцировать L-глутаминовую кислоту в кислых условиях.
Краткое описание изобретения
В обстоятельствах, описанных выше, целью настоящего изобретения является обеспечение ферментационного маточного раствора, который более подходит для применения в качестве сырья для удобрения или тому подобное, без снижения продуктивности L-глутаминовой кислоты.
Авторы настоящего изобретения установили, что ферментационный маточный раствор, полученный при культивировании микроорганизма, обладающего способностью продуцировать L-глутаминовую кислоту в жидкой среде, рН которой доводится до значения, при котором L-глутаминовая кислота осаждается, при допущении того, что L-глутаминовая кислота продуцируется и накапливается в среде с сопровождаемым осаждением L-глутаминовой кислоты, содержит большое количество органического азота и является подходящим материалом в качестве сырья для удобрения и тому подобного. Таким образом они осуществили настоящее изобретение.
Настоящее изобретение обеспечивает следующее.
(1) Органическую азотсодержащую композицию, содержащую ферментационный маточный раствор, полученный культивированием микроорганизма, обладающего способностью продуцировать L-глутаминовую кислоту в жидкой среде, рН которой доводится до значения, при котором L-глутаминовой кислоте дают возможность осаждаться, при допущении того, что L-глутаминовая кислота продуцируется и накапливается с сопровождаемым осаждением L-глутаминовой кислоты, и последующим отделением L-глутаминовой кислоты от среды.
(2) Органическая азотсодержащая композиция по п. (1), где микроорганизм относится к роду Enterobacter.
(3) Органическая азотсодержащая композиция по п. (2), где микроорганизм является Enterobacter agglomerans.
(4) Органическая азотсодержащая композиция по одному из п.п. (1)-(3), где микроорганизм может метаболизировать источник углерода в жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения и источник углерода, при определенном значении рН и обладает способностью накапливать L-глутаминовую кислоту в количестве, превышающем концентрацию насыщения L-глутаминовой кислоты в жидкой среде при этом значении рН.
(5) Органическая азотсодержащая композиция по п. (4), где определенное значение рН равно 5,0 или ниже.
(6) Органическая азотсодержащая композиция по п. (4) или (5), где значение рН, подходящее для продуцирования L-глутаминовой кислоты микроорганизмом, является значением рН, при котором L-глутаминовая кислота осаждается в среде, и L-глутаминовая кислота продуцируется и накапливается с сопровождаемым осаждением L-глутаминовой кислоты во время культивирования в среде при этом значении рН.
(7) Удобрение, включающее органическую азотсодержащую композицию, как определено по одному из п.п. (1)-(6).
По настоящему изобретению ферментационный маточный раствор, подходящий в качестве сырья для удобрения или тому подобное, можно эффективно получать ферментацией.
Краткое пояснение чертежей
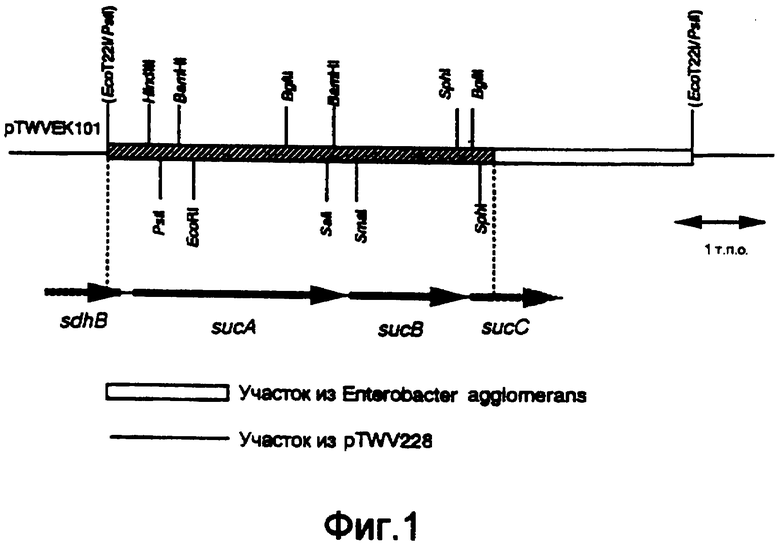
Фиг.1 представляет карту рестрикции ферментами фрагмента ДНК из Enterobacter agglomerans в pTWVEK101.
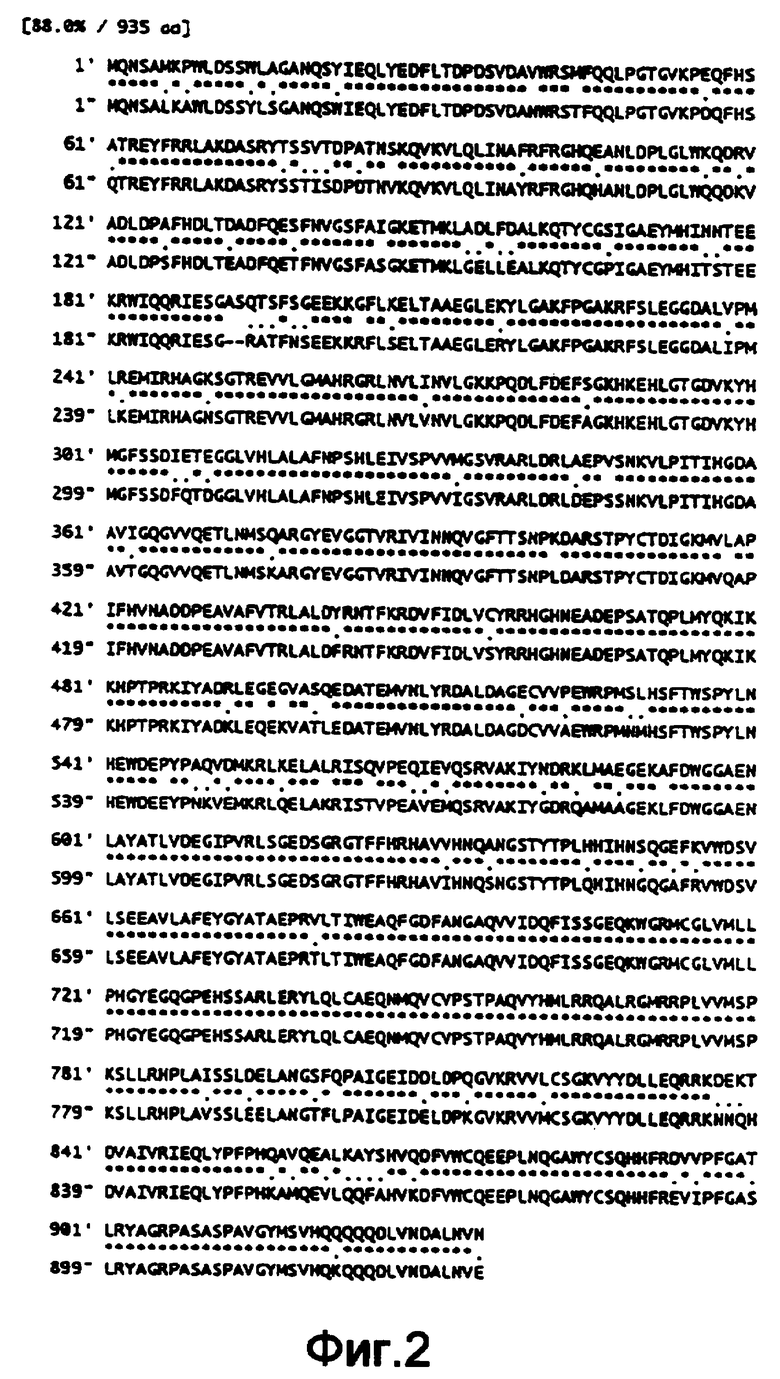
На фиг.2 показано сравнение аминокислотной последовательности, установленной по нуклеотидной последовательности гена sucA из Enterobacter agglomerans и такового из Escherichia coli (вверху: Enterobacter agglomerans, внизу колонка: Escherichia coli, тоже будет относиться к последующему).
На фиг.3 показано сравнение аминокислотной последовательности, установленной по нуклеотидной последовательности гена sucB из Enterobacter agglomerans и такового из Escherichia coli.
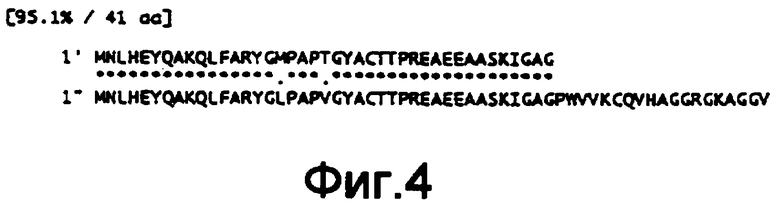
На фиг.4 показано сравнение аминокислотной последовательности, установленной по нуклеотидной последовательности гена sucC из Enterobacter agglomerans и такового из Escherichia coli.
На фиг.5 показано сравнение аминокислотной последовательности, установленной по нуклеотидной последовательности гена sdhB из Enterobacter agglomerans и такового из Escherichia coli.
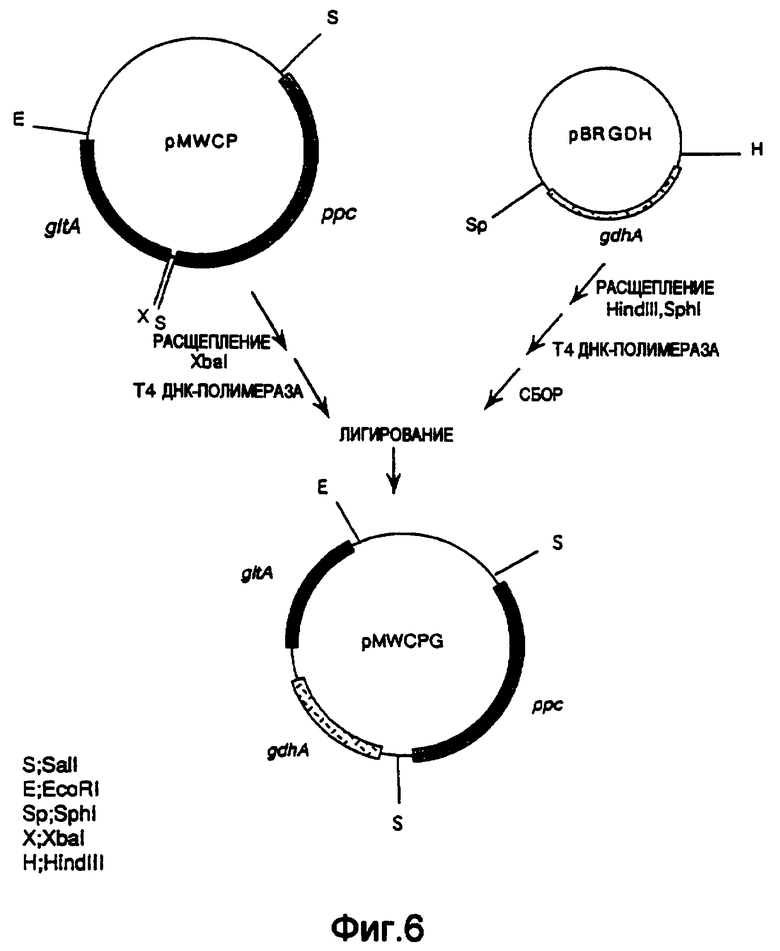
На фиг.6 показана конструкция плазмиды pMWCPG, включающей ген gltA, ген ррс и ген gdhA.
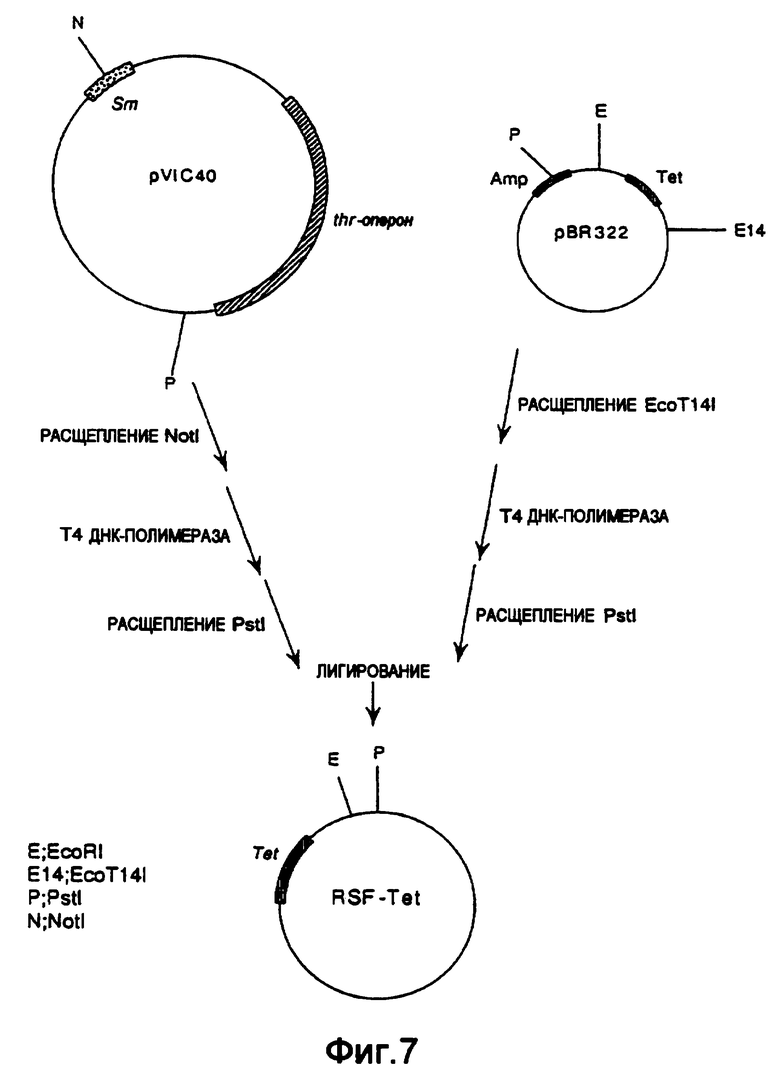
На фиг.7 показана конструкция плазмиды RSF-Tet, включающей репликатор плазмиды RSF1010 для широкого спектра хозяев и ген устойчивости к тетрациклину.
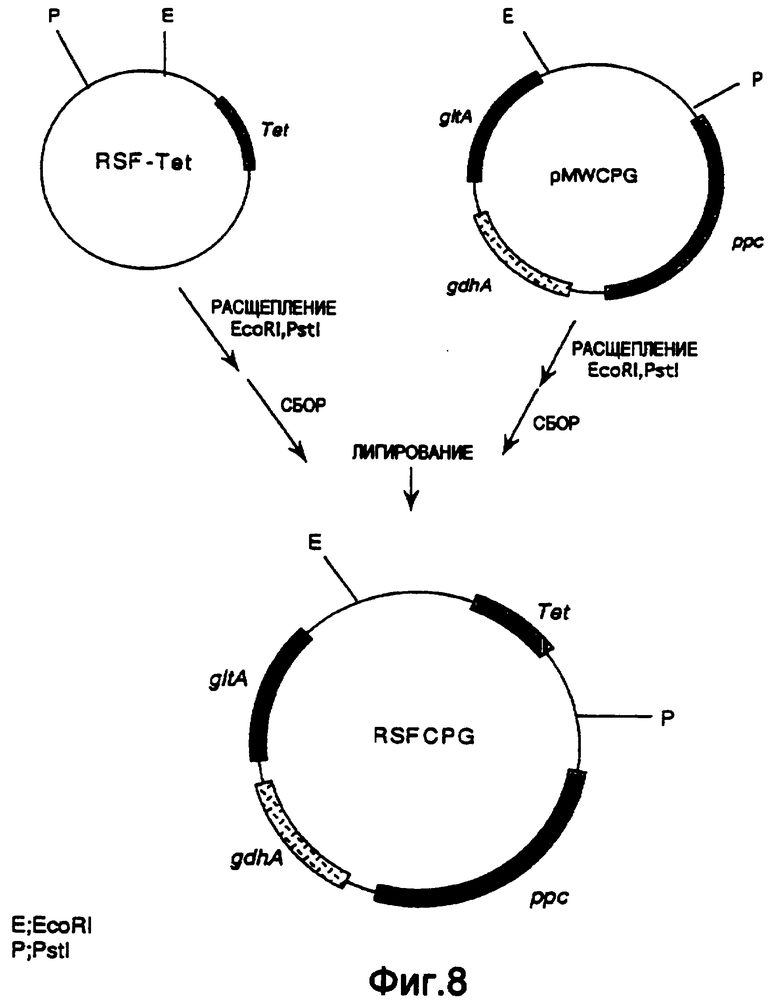
На фиг.8 показана конструкция плазмиды RSFCPG, включающей репликатор плазмиды RSF1010 для широкого спектра хозяев, ген устойчивости к тетрациклину, ген gltA, ген ррс и ген gdhA.
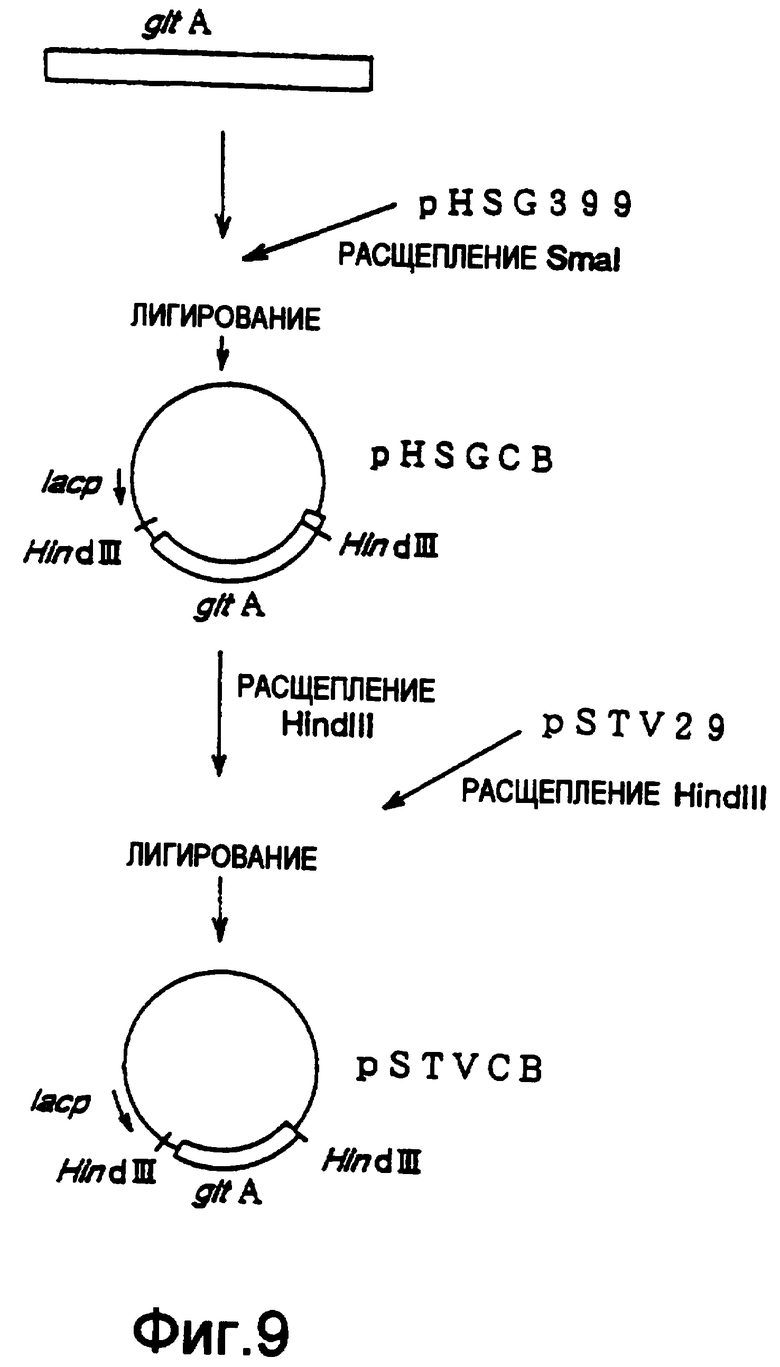
На фиг.9 показана конструкция плазмиды pSTVCB, включающей ген gltA.
Подробное описание изобретения
В последующем настоящее изобретение будет пояснено подробно.
Органический азот означает иной азот, чем аммиачный азот среди общего азота. В основном, это азот, входящий в состав органических веществ, составляющих аминокислоты, пептиды, белки, нуклеиновые кислоты и тому подобное.
Органическую азотсодержащую композицию по настоящему изобретению можно получить в виде ферментационного маточного раствора, полученного культивированием микроорганизма, обладающего способностью продуцировать L-глутаминовую кислоту, в жидкой среде, рН которой доведено до значения, при котором L-глутаминовой кислоте дают возможность осаждаться, при допущении того, что L-глутаминовая кислота продуцируется и накапливается с сопровождаемым осаждением L-глутаминовой кислоты и последующим отделением L-глутаминовой кислоты от среды.
Примеры микроорганизма, обладающего способностью продуцировать L-глутаминовую кислоту, используемые по настоящему изобретению, включают микроорганизмы, относящиеся к роду Enterobacter. Предпочтительным является Enterobacter agglomerans.
Кроме того, микроорганизмом, обладающим способностью продуцировать L-глутаминовую кислоту, используемым в способе получения по настоящему изобретению, предпочтительно является микроорганизм, который может метаболизировать источник углерода в жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения и источник углерода, при определенном значении рН, и обладает способностью накапливать L-глутаминовую кислоту в количестве, превышающем концентрацию насыщения L-глутаминовой кислоты в жидкой среде при вышеуказанном значении рН (далее также относящийся к "накапливающему L-глутаминовую кислоту микроорганизму"). Вышеуказанное определенное значение рН предпочтительно представляет значение рН, при котором L-глутаминовая кислота осаждается в среде, и такое значение рН обычно составляет 5,0 или ниже.
"Концентрация насыщения" означает концентрацию L-глутаминовой кислоты, растворенной в жидкой среде, когда жидкая среда насыщена L-глутаминовой кислотой.
Когда используется накапливающий L-глутаминовую кислоту микроорганизм, значение рН, подходящее для получения L-глутаминовой кислоты, предпочтительно равняется рН, при котором L-глутаминовая кислота осаждается в среде. Осуществляя культивирование при данном значении рН, L-глутаминовая кислота продуцируется и накапливается в среде с сопровождаемым осаждением.
Накапливающий L-глутаминовую кислоту микроорганизм можно получить следующим образом. Пробу, содержащую микроорганизмы, высевают в жидкую среду, содержащую L-глутаминовую кислоту в концентрации насыщения и источник углерода, при определенном значении рН, и отбирается штамм, который метаболизирует источник углерода. Несмотря на то, что определенное значение рН особым образом не ограничивается, обычно оно составляет 5,0 или ниже, предпочтительно примерно 4,5 или ниже, более предпочтительно примерно 4,3 или ниже. Накапливающий L-глутаминовуго кислоту микроорганизм используется для продуцирования L-глутаминовой кислоты ферментацией с сопровождаемым осаждением L-глутаминовой кислоты. Если значение рН является слишком высоким, становится затруднительным для микроорганизма продуцировать L-глутаминовую кислоту в количестве, достаточном для осаждения. Следовательно, значение рН предпочтительно находится в вышеуказанном пределе.
Если значение рН водного раствора, содержащего L-глутаминовую кислоту, понижено, растворимость L-глутаминовой кислоты в значительной мере падает около значения рКа γ-карбоксильной группы (4,25, 25°С). Растворимость становится наименьшей в изоэлектрической точке (рН 3,2), и L-глутаминовая кислота, превышающая количество, соответствующее концентрации насыщения, осаждается. Несмотря на то, что это зависит от состава среды, L-глутаминовая кислота растворяется в количестве 10-20 г/л при рН 3,2, 30-40 г/л при рН 4,0 и 50-60 г/л при рН 4,7 при примерно 30°С. Обычно нет необходимости делать рН 3,0 или ниже, поскольку эффект осаждения L-глутаминовой кислоты достигает своего верхнего предела, когда рН становится ниже определенного значения. Однако значение рН может быть равно 3,0 или ниже.
Кроме того, выражение микроорганизм "может метаболизировать источник углерода" означает, что он может размножаться или потреблять источник углерода, даже если он не может размножаться, т.е. оно указывает, что он катаболизирует источник углерода, такой, как сахара или органические кислоты. В частности, например, если микроорганизм размножается, когда он культивируется в жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения, при рН 5,0-4,0, предпочтительно при рН 4,5-4,0, более предпочтительно при рН 4,3-4,0, особенно предпочтительно при рН 4,0, при соответствующей температуре, например, 28°С, 37°С или 50°С, в течение 2-4 суток, данный микроорганизм может метаболизировать источник углерода в среде. Кроме того, например, если микроорганизм потребляет источник углерода, даже если микроорганизм не размножается, когда он культивируется в синтетической жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения, при рН 5,0-4,0, предпочтительно при рН 4,5-4,0, более предпочтительно при рН 4,3-4,0, особенно предпочтительно при рН 4,0, при соответствующей температуре, например, 28°С, 37°С или 50°С, в течение 2-4 суток, микроорганизм представляет микроорганизм, который может метаболизировать источник углерода в среде.
Микроорганизм, который может метаболизировать источник углерода, включает микроорганизм, который может расти в вышеуказанной жидкой среде.
Кроме того, выражение микроорганизм "может расти" означает, что он может размножаться или может продуцировать L-глутаминовую кислоту, даже если он не может размножаться. В частности, например, если микроорганизм размножается, когда он культивируется в жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения, при рН 5,0-4,0, предпочтительно при рН 4,5-4,0, более предпочтительно при рН 4,3-4,0, особенно предпочтительно при рН 4,0, при соответствующей температуре, например, 28°С, 37°С или 50°С, в течение 2-4 суток, данный микроорганизм может расти в среде. Кроме того, например, если микроорганизм увеличивает количество L-глутаминовой кислоты в синтетической жидкой среде, даже если микроорганизм не размножается, когда микроорганизм культивируется в синтетической жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения, при рН 5,0-4,0, предпочтительно при рН 4,5-4,0, более предпочтительно при рН 4,3-4,0, особенно предпочтительно при рН 4,0, при соответствующей температуре, например, 28°С, 37°С или 50°С, в течение 2-4 суток, данный микроорганизм является микроорганизмом, который может расти в среде.
Описанный выше отбор может повторяться два или более раз в одинаковых условиях или при изменении рН, или концентрации L-глутаминовой кислоты. Отбор на ранней стадии может осуществляться в среде, содержащей L-глутаминовую кислоту в концентрации, ниже чем концентрация насыщения, и затем последующий отбор может проводиться в среде, содержащей L-глутаминовую кислоту в концентрации насыщения. Кроме того, могут быть отобраны штаммы с полезными свойствами, такими, как высшая скорость размножения.
Накапливающий L-глутаминовую кислоту микроорганизм является микроорганизмом, который обладает способностью накапливать L-глутаминовую кислоту в количестве, превышающем количество, соответствующее концентрации насыщения L-глутаминовой кислоты в жидкой среде, в дополнении к свойствам, описанным выше. Значение рН вышеуказанной жидкой среды предпочтительно равняется тому же или близко к таковому значению для среды, использованной для скрининга микроорганизма, обладающего вышеуказанными свойствами. Обычно микроорганизм становится чувствительным к L-глутаминовой кислоте при высокой концентрации, поскольку рН становится ниже. Следовательно, является предпочтительным, чтобы рН не было низким ввиду устойчивости к L-глутаминовой кислоте, но низкое значение рН является предпочтительным ввиду продуцирования L-глутаминовой кислоты с сопровождаемым ее осаждением. Для удовлетворения данных условий значение рН может находиться в пределе 3-5, предпочтительно 4-5, более предпочтительно 4-4,7, еще более предпочтительно 4-4,5, особенно предпочтительно 4,0-4,3.
В качестве накапливающего L-глутаминовую кислоту микроорганизма или продуктов его селекции можно упомянуть, например, микроорганизмы, относящиеся к роду Enterobacter, Klebsiella, Serratia, Pantoea, Erwinia, Escherichia, Corynebacterium, Alicyclobacillus, Bacillus, Saccharomyces или тому подобное. Среди них микроорганизмы, относящиеся к роду Enterobacter, являются предпочтительными. В дальнейшем микроорганизм по настоящему изобретению будет пояснен в основном для микроорганизмов, относящихся к роду Enterobacter. Однако микроорганизм не ограничивается таковыми, относящимися к роду Enterobacter, и подобным образом могут быть использованы таковые, относящиеся к другим родам.
В качестве микроорганизма, относящегося к Enterobacter, особо можно упомянуть Enterobacter agglomerans, предпочтительно штамм Enterobacter agglomerans AJ13355. Данный штамм выделен из почвы в Iwata-shi, Shizuoka, Японии в качестве штамма, который может размножаться в среде, содержащей L-глутаминовую кислоту и источник углерода, при низком значении рН.
Физиологические свойства AJ13355 представлены ниже:
(1) Окрашивание по Граму: отрицательный (результат)
(2) Поведение в отношении кислорода: факультативный анаэроб
(3) Каталаза: положительный
(4) Оксидаза: отрицательный
(5) Способность восстанавливать нитраты: отрицательный
(6) Тест Вогес-Проскауера: положительный
(7) Тест с метиловым красным: отрицательный
(8) Уреаза: отрицательный
(9) Образование индола: положительный
(10) Подвижность: подвижен
(11) Образование H2S в среде TSI: слабоактивен
(12) β-галактозидаза: положительный
(13) Свойство ассимилировать сахариды:
Арабиноза: положительный
Сахароза: положительный
Лактоза: положительный
Ксилоза: положительный
Сорбит: положительный
Инозит: положительный
Трегалоза: положительный
Мальтоза: положительный
Глюкоза: положительный
Адонит: отрицательный
Рафиноза: положительный
Салицин: отрицательный
Мелибиоза: положительный
(14) Свойство ассимилировать глицерозу: положительный
(15) Свойство ассимилировать органическую кислоту:
Лимонная кислота: положительный
Винная кислота: отрицательный
Глюконовая кислота: положительный
Уксусная кислота: положительный
Малоновая кислота: отрицательный
(16) Аргининдегидратаза: отрицательный
(17) Орнитиндекарбоксилаза: отрицательный
(18) Лизиндекарбоксилаза: отрицательный
(19) Фенилаланиндезаминаза: отрицательный
(20) Образование пигмента: желтый
(21) Способность разжижать желатин: положительный
(22) Значение рН роста: рост возможен при рН 4, хороший рост при рН 4,5-7.
(23) Температура роста: хороший рост при 25°С, хороший рост при 30°С, хороший рост при 37°С, рост возможен при 42°С, рост невозможен при 45°С.
Основываясь на данных бактериологических свойствах, AJ13355 был определен, как Enterobacter agglomerans.
Enterobacter agglomerans AJ13355 был депонирован в National Institute Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry (в настоящее время International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology) 19 февраля 1998 г. и получил инвентарный номер FERM P-16644. Затем он был передан на международное хранение по Будапештскому соглашению от 11 января 1999 г. и получил инвентарный номер FERM BP-6614.
Накапливающий L-глутаминовую кислоту микроорганизм может быть микроорганизмом, исходно обладающим способностью продуцировать L-глутаминовую кислоту, или таковым, обладающим способностью продуцировать L-глутаминовую кислоту, наделенной или усиленной в результате селекции с использованием мутагенеза, методов рекомбинантной ДНК или тому подобное.
Способность продуцировать L-глутаминовую кислоту можно придать или усилить, например, повышением активности фермента, который катализирует реакцию биосинтеза L-глутаминовой кислоты. Способность продуцировать L-глутаминовую кислоту также можно усилить снижением или устранением активности фермента, который катализирует реакцию, которая расходится с путем биосинтеза L-глутаминовой кислоты, и в результате которой образуется иное соединение, чем L-глутаминовая кислота.
В качестве примеров фермента, который катализирует реакцию биосинтеза L-глутаминовой кислоты, можно упомянуть глутаматдегидрогеназу (в последующем также упоминаемую как "GDH"), глутаминсинтетазу, глутаматсинтазу, изоцитратдегидрогеназу, аконитатгидратазу, цитратсинтазу (в последующем также упоминаемую как "CS"), фосфоенолпируваткарбоксилазу (в последующем также упоминаумую как "РЕРС"), пируватдегидрогеназу, пируваткиназу, энолазу, фосфоглицеромутазу, фосфоглицераткиназу, глицеральдегид-3-фосфатдегидрогеназу, триозофосфатиуомеразу, фруктозобифосфатальдолазу, фосфофруктокиназу, глюкозофосфатизомеразу и так далее. Среди данных ферментов один, два или три из CS, РЕРС и GDH являются предпочтительными. Кроме того, является предпочтительным, чтобы у накапливающего L-глутаминовую кислоту микроорганизма была повышена активность всех трех ферментов CS, РЕРС и GDH. В частности, CS Brevibacterium lactofermentum является предпочтительным, поскольку он не испытывает ингибирования α-кетоглутаровой кислотой, L-глутаминовой кислотой и NADH.
Для того чтобы повысить активность CS, РЕРС или GDH, например, можно клонировать ген, кодирующий CS, РЕРС или GDH, в соответствующей плазмиде, и микроорганизм-хозяин можно трансформировать полученной плазмидой. Число копий гена, кодирующего CS, РЕРС или GDH (в последующем обозначенные соответственно, как "ген gltA", ген "ррс" и ген "gdhA"), в трансформированной клетке штамма возрастает, приводя к повышению активности CS, РЕРС и GDH.
Клонированные гены gltA, ррс и gdhA вводят в вышеуказанный исходный родительский штамм по отдельности или в комбинации из них произвольных двух или трех видов. Когда вводят два или три вида генов, два или три вида генов можно клонировать в одном виде плазмиды и вводить в хозяина, или клонировать по отдельности в одном или трех видах плазмид, которые могут сосуществовать, и вводить в хозяина.
Два или более видов генов, кодирующих фермент одного и того же вида, но полученные из различных микроорганизмов, можно вводить в одного и того же хозяина.
Описанные выше плазмиды особым образом не ограничиваются при условии, что они воспроизводятся автономно в клетке микроорганизма, относящегося, например, к роду Enterobacter или тому подобное. Однако можно упомянуть, например, pUC19, pUC18, pBR322, pHSG299, pHSG298, pHSG399, pHSG398, RSF1010, pMW119, pMW118, pMW219, pMW218, pACYC177, pACYC184 и так далее. Помимо них можно также использовать фаговые ДНК-векторы.
Трансформацию можно проводить, например, по методу D.M.Morrison (Methods in Enzymology, 68, 326 (1979)), методом, в котором проницаемость клеток бактерий-реципиентов для ДНК увеличивается при обработке клеток хлоридом кальция (Mandel М. and Higa A., J.Mol.Biol., 53, 159 (1970)), электропорацией (Miller J.H., "A Short Course in Bacterial Genetics", Cold Spring Harbor Laboratory Press, U.S.A., 1992) и тому подобное.
Активность CS, РЕРС или GDH также можно увеличить за счет присутствия множественных копий гена gltA, гена ррс или гена gdhA в хромосомной ДНК вышеуказанного исходного родительского штамма, который является хозяином. Для того чтобы ввести множественные копии гена gltA, гена ррс или гена gdhA в хромосомную ДНК микроорганизма, относящегося к роду Enterobacter или тому подобное, можно использовать последовательность этих множественных копий, находящихся в хромосомной ДНК, такую, как повторяющаяся ДНК и инвертированные повторы, находящиеся в конце перемещающегося элемента. Альтернативно, множественные копии генов можно вводить в хромосомную ДНК с использованием перемещения транспозона, включающего ген gltA, ген ррс или ген gdhA. В результате число копий гена gltA, гена ррс или гена gdhA в трансформированной штаммовой клетке увеличивается и, таким образом, увеличивается активность CS, РЕРС или GDH.
Что касается организмов, используемых в качестве источника гена gltA, гена ррс или гена gdhA, чье число копий следует увеличить, то можно использовать любой организм при условии, что он обладает активностью CS, РЕРС или GDH. Кроме того, предпочтительными являются бактерии, которые представляют прокариоты, например, таковые, относящиеся к роду Enterobacter, Klebsiella, Erwinia, Pantoea, Serratia, Escherichia, Corynebacterium, Brevibacterium или Bacillus. В качестве конкретных примеров можно упомянуть Escherichia coli, Brevibacterium lactofermentum и так далее. Ген gltA, ген ррс и ген gdhA можно получить из хромосомной ДНК микроорганизмов, описанных выше.
Ген gltA, ген ррс и ген gdhA можно получить с использованием мутантного штамма, который имеет недостаток активности CS, РЕРС или GDH, с выделением фрагмента ДНК, который усиливает его ауксотрофность, из хромосомной ДНК вышеуказанного микроорганизма. Кроме того, поскольку нуклеотидные последовательности данных генов бактерий Escherichia и Corynebacterium уже установлены (Biochemistry, 22, pp.5243-5249 (1983); J.Biochem., 95, pp.909-916 (1984); Gene, 27, pp.193-199 (1984); Microbiology, 140, pp.1817-1828 (1994); Mol. Gen. Genet., 218, pp.330-339 (1989); Molecular Microbiology, 6, pp.317-326 (1992)), они также могут быть получены ПЦР с использованием праймеров, синтезированных на основе каждой нуклеотидной последовательности и хромосомной ДНК в качестве матрицы.
Активность CS, РЕРС или GDH также можно повысить увеличением экспрессии гена gltA, гена ррс или гена gdhA, ломимо вышеуказанной амплификации генов. Например, экспрессию можно увеличить, заменив промотор гена gltA, гена ррс или гена gdhA на другой более сильный промотор. Например, в качестве более сильных промоторов известны промотор lac, промотор trp, промотор trc, промотор tac, промотор PR и промотор PL лямда-фага и так далее. Ген gltA, ген ррс и ген gdhA, чей промотор замещен, клонируются в плазмиде и вводятся в микроорганизм-хозяин, или вводятся в хромосомную ДНК микроорганизма-хозяина с использованием повторяющейся ДНК, инвертированной повторности, транспозона или тому подобное.
Активность CS, РЕРС или GDH также можно повысить замещением промотора гена gltA, гена ррс или гена gdhA в хромосоме на другой, более сильный промотор (смотри WO 87/03006 и выложенную заявку на патент Японии №61-268183) или вставкой более сильного промотора выше кодирующей последовательности каждого гена (смотри Gene, 29, pp.231-241 (1984)). В частности, можно провести гомологичную рекомбинацию между геном gltA, геном ррс или геном gdhA, чей промотор замещен на более сильный, или ДНК, включающей его часть, и соответствующим геном в хромосоме.
Примеры фермента, который катализирует реакцию, которая расходится с путем биосинтеза L-глутаминовой кислоты и в результате которой образуется иное соединение, чем L-глутаминовая кислота, включают α-кетоглутаратдегидрогеназу (в последующем также именуемую как "αKGDH"), изоцитратлиазу, фосфатацетилтрансферазу, ацетаткиназу, ацетоксигидрокси-(кислота)-синтазу, ацетолактатсинтазу, форматацетилтрансферазу, лактатдегидрогеназу, глутаматдекарбоксилазу, 1-пирролиндегидрогеназу и так далее. Среди данных ферментов предпочтительным является αKGDH.
Для того чтобы уменьшить или устранить активность вышеуказанных ферментов у микроорганизма, относящегося к роду Enterobacter, или тому подобное, можно ввести мутации для уменьшения или устранения внутриклеточной активности ферментов в гены вышеуказанных ферментов обычным методом мутагенеза или генно-инженерным методом.
Примеры метода мутагенеза включают, например, методы, в которых используется облучение рентгеновскими лучами или ультрафиолетовыми лучами, методы, в которых используется обработка мутагенным агентом таким, как N-метил-N'-нитро-N-нитрозогуанидин, и так далее. Сайт гена, куда вводят мутацию, может находиться в кодирующей области, кодирующей фермент-белок, или области, регулирующей экспрессию, такой, как промотор.
Примеры генно-инженерных методов включают, например, методы, в которых используется рекомбинация генов, трансдукция, слияние клеток и так далее. Например, ген резистентности к лекарственному препарату вставляется в клонированный целевой ген с получением гена, который потерял его функцию (дефектный ген). Затем данный дефектный ген вводится в клетку микроорганизма-хозяина, и целевой ген в хромосоме замещается на вышеуказанный дефектный ген с использованием гомологичной рекомбинации (разрыв генов).
Снижение или недостаток внутриклеточной активности целевого фермента и степень снижения активности можно подтвердить определением активности фермента в клеточном экстракте или его очищенной фракции, полученных из штамма-кандидата, и сравнением ее с таковой у дикого штамма. Например, активность αKGDH можно определить методом Reed et al. (Reed L.J. and Mukherjee B.B., Methods in Enzymology, 13, pp.55-61 (1969)).
В зависимости от целевого фермента, целевой мутантный штамм можно отобрать, основываясь на фенотипе мутантного штамма. Например, мутантный штамм, в котором активность αKGDH устранена или понижена, не может размножаться или показывает заметно пониженную скорость размножения в минимальной среде, содержащей глюкозу, или минимальной среде, содержащей уксусную кислоту или L-глутаминовую кислоту, в качестве единственного источника углерода в аэробных условиях культивирования. Однако нормальное размножение делается возможным в тех же условиях при добавлении янтарной кислоты или лизина, метионина и диаминопимелиновой кислоты в минимальную среду, содержащую глюкозу. Используя данные явления в качестве индикаторов, можно отобрать мутантный штамм с пониженной активностью или недостаточной активностью αKGDH.
Способ получения штамма Brevibacterium lactofermentum с дефицитным геном αKGDH с использованием гомологичной рекомбинации подробно описан в WO 95/34672. Подобные методы можно использовать для других микроорганизмов.
Кроме того, такие способы, как клонирование генов и расщепление и лигирование ДНК, трансформация и так далее подробно описаны в Molecular Cloning, 2nd Edition, Cold Spring Harbor Press (1989) и так далее.
В качестве конкретного примера мутантного штамма с недостаточной активностью αKGDH или пониженной активностью αKGDH, полученного как описано выше, можно упомянуть Enterobacter agglomerans AJ13356. Enterobacter agglomerans AJ13356 был депозирован в National Institute Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry (в настоящее время International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology) 19 февраля 1998 г. и получил инвентарный номер FERM Р-16645. Затем он был передан на международное хранение по Будапештскому соглашению от 11 января 1999 г. и получил инвентарный номер FERM BP-6615. Enterobacter agglomerans AJ13356 имеет недостаток активности αKGDH в результате разрыва субъединичного гена αKGDH-E1 (sucA).
Когда Enterobacter agglomerans, который представляет пример микроорганизма, используемого по настоящему изобретению, культивируют в среде, включающей сахарид, внеклеточно секретируется слизь, иногда приводящая к низкой эффективности процесса. Следовательно, когда используется Enterobacter agglomerans, имеющий такое свойство секреции слизи, предпочтительно использовать мутантный штамм, который секретирует меньше слизи по сравнению с диким штаммом. Примеры методов мутагенеза включают, например, методы с использованием облучения рентгеновскими лучами или ультрафиолетовыми лучами, метод с использованием обработки мутагенным агентом, таким, как N-метил-N'-нитро-N-нитрозоглуанидин, и так далее. Мутантный штамм с пониженной секрецией слизи можно отобрать при посеве полученных в результате мутации бактериальных клеток в среду, содержащую сахарид, например, на чашках со средой LB, содержащей 5 г/л глюкозы, культивируя их при наклоне чашки под углом примерно 45° и отбирая колонию, которая не показывает стекания слизи.
В настоящем изобретении придание или усиление способности продуцировать L-глутаминовую кислоту и придание других полезных свойств, таких, как мутация в отношении меньшей секреции слизи, описанная выше, можно провести в произвольном порядке.
Культивированием микроорганизма, обладающего способностью продуцировать L-глутаминовую кислоту, в жидкой среде, рН которой доводится до условия, которое позволяет L-глутаминовой кислоте осаждаться, L-глутаминовую кислоту можно получить и накопить с сопровождаемым ее осаждением в среде.
Предпочтительно культивированием накапливающего L-глутаминовую кислоту микроорганизма в жидкой среде, рН которой доводится до условия, которое позволяет L-глутаминовой кислоте осаждаться, L-глутаминовую кислоту можно получить и накопить с сопровождаемым ее осаждением в среде. Кроме того, возможно, чтобы культивирование начиналось при нейтральном значении рН, и рН становится условием, которое позволяет L-глутаминовой кислоте осаждаться, когда культивирование завершено.
"Условие, которое позволяет L-глутаминовой кислоте осаждаться", упомянутое здесь, означает условие, которое позволяет L-глутаминовой кислоте осаждаться, когда вышеуказанный микроорганизм продуцирует и накапливает L-глутаминовую кислоту. Например, оно обычно равно 3-5, когда микроорганизм представляет бактерию Enterobacter.
Микроорганизм можно культивировать при значении рН, подходящем для его роста в начале, и затем культивировать при условии, которое позволяет L-глутаминовой кислоте осаждаться. Например, когда среда содержит источник сахара, который микроорганизм не может ассимилировать при условии, которое позволяет L-глутаминовой кислоте осаждаться, или органическую кислоту, которая ингибирует рост микроорганизма при условии, которое позволяет L-глутаминовой кислоте осаждаться, микроорганизм можно культивировать при условии, при котором микроорганизм может ассимилировать источник сахара, или рост микроорганизма не ингибируется под действием органической кислоты для того, чтобы микроорганизм потреблял источник сахара или органическую кислоту, и затем культивировался при условии, которое позволяет L-глутаминовой кислоте осаждаться.
В предпочтительном воплощении настоящего изобретения во время культивирования операцию, приводящую к присутствию кристаллов L-глутаминовой кислоты в среде, проводят, когда концентрация L-глутаминовой кислоты в среде ниже, чем концентрация, при которой происходит спонтанная кристаллизация.
Используемый здесь термин "спонтанная кристаллизация" означает, что благодаря накоплению L-глутаминовой кислоты микроорганизмом, обладающим способностью продуцировать L-глутаминовую кислоту, концентрация L-глутаминовой кислоты в среде превышает концентрацию насыщения и L-глутаминовая кислота спонтанно осаждается в среде.
Операция, приводящая к присутствию кристаллов L-глутаминовой кислоты в среде, означает операцию, при которой присутствие кристаллов вызывается искусственно. Примеры операции включают добавление кристаллов к среде и вынужденное осаждение при снижении во время культивирования рН среды, в которой определенное количество L-глутаминовой кислоты было растворено в начале культивирования.
Количество кристаллов, которое должно находиться в среде, обычно составляет от 0,01 до 10 г/л. Время, когда кристаллы должны присутствовать, предпочтительно является тем, когда накопившееся количество L-глутаминовой кислоты в среде возрастает до примерно концентрации насыщения (например, 25 г/л или выше при рН 4,5). Количество кристаллов, присутствующих в среде, и концентрацию L-глутаминовой кислоты можно определить способами, известными специалистам в данной области. Присутствующее количество кристаллов L-глутаминовой кислоты можно определить путем выдерживания среды при стоянии и выделения кристаллов из среды декантацией. Концентрация L-глутаминовой кислоты в среде означает концентрацию растворенной L-глутаминовоЙ кислоты. Когда кристаллы осаждаются в среде, концентрация представляет определенную концентрацию осветленного раствора, полученного отделением твердых частиц центрифугированием (или фильтрованием).
Операция, приводящая к присутствию кристаллов L-глутаминовой кислоты, предпочтительно представляет добавление кристаллов L-глутаминовой кислоты.
Что касается кристаллов L-глутаминовой кислоты, то имеется α-форма и β-форма кристаллов (H.Takahashi, T.Takenishi, N.Nagashima, Bull. Chem. Soc. Japan, 35, 923 (1962); J. D.Bernal, Z.Krist., 78, 363 (1931); S. Hirokawa, Acta Cryst., 8, 637 (1955)). Когда предполагается получить α-форму кристаллов, то предпочтительно добавляются кристаллы α-формы.
Предпочтительное количество кристаллов варьирует в зависимости от условий, таких, как форма кристаллов. Если кристаллы α-формы, то обычно количество составляет 0,2 г/л или выше. Если количество больше, чем эта концентрация, кристаллы α-формы можно получить с хорошей воспроизводимостью. Из-за их формы с кристаллами α-формы легче обращаться по сравнению с кристаллами β-формы.
В качестве среды для культивирования можно использовать обычную питательную среду, содержащую источник углерода, источник азота, минеральные соли и органические питательные вещества в следовых количествах, такие, как аминокислоты и витамины, при условии, что значение рН доведено таким образом, чтобы удовлетворить заранее определенному условию. Можно использовать синтетическую среду или естественную среду. Источник углерода и источник азота, используемые в среде, могут быть любыми, при условии, что они могут использоваться штаммом, который культивируется.
В качестве источника углерода используются сахариды, такие, как глюкоза, глицерин, фруктоза, сахароза, мальтоза, манноза, галактоза, гидролизат крахмала и меласса. Кроме того, можно использовать органические кислоты, такие, как уксусная кислота и лимонная кислота, одни или в сочетании с другим источником углерода.
В качестве источника азота используют аммиак, соли аммония, такие, как сульфат аммония, карбонат аммония, хлорид аммония, фосфат аммония и ацетат аммония и так далее.
В качестве органических питательных веществ в следовых количествах используют аминокислоты, витамины, жирные кислоты, нуклеиновые кислоты, содержащие их вещества, такие, как пептон, касаминокислоты, дрожжевой экстракт и продукты разложения соевого белка. Когда для ауксотрофного мутантного штамма необходима аминокислота и так далее для метаболизма или роста, необходимо добавить требуемый питательный компонент.
В качестве минеральных солей используют фосфаты, соли магния, соли кальция, соли железа, соли марганца и так далее.
Культивирование обычно проводят при аэрации при условии температуры культивирования от 20 до 42°С и рН от 3 до 5, предпочтительно от 4 до 5, более предпочтительно от 4 до 4,7, особенно предпочтительно от 4 до 4,5. Значительное количество L-глутаминовой кислоты обычно накапливается после культивирования в течение примерно от 10 ч до примерно 4 суток. Часть накопившейся L-глутаминовой кислоты, которая превышает концентрацию насыщения, осаждается в среде.
После окончания культивирования осажденную L-глутаминовую кислоту в культуре можно собрать центрифугированием, фильтрованием и тому подобное. Растворенную в среде L-глутаминовую кислоту также можно собрать известными способами. Например, L-глутаминовую кислоту можно выделить концентрированием культурального бульона с ее кристаллизацией или выделением ионообменной хроматографией или тому подобное. Также возможно выкристаллизовать растворенную в среде L-глутаминовую кислоту и затем собрать осажденную L-глутаминовую кислоту в культуральном бульоне вместе с выкристаллизовавшейся L-глутаминовой кислотой.
Ферментационный маточный раствор, полученный при отделении L-глутаминовой кислоты, можно применять в качестве органической азотсодержащей композиции.
В органической азотсодержащей композиции по настоящему изобретению содержание органического азота по отношению к общему азоту является высоким. Процент по массе органического азота по отношению к общему азоту предпочтительно составляет 35% или выше.
Кроме того, по настоящему изобретению, за счет того, что L-глутаминовая кислота продуцируется при низком значении рН, используемое количество аммиака для контроля рН среды становится небольшим, и количество кислоты, используемой для кристаллизации L-глутаминовой кислоты, соответственно становится небольшим, приводя к снижению количества анионов в ферментационном маточном растворе. В основном, кислотой, используемой для этого, является неорганическая кислота, такая, как соляная кислота и серная кислота. Например, если серная кислота используется для кристаллизации L-глутаминовой кислоты, то количество сульфатных групп в ферментационном маточном растворе становится низким. Процент по массе сульфатных групп по отношению к общему азоту предпочтительно составляет 500% или ниже. Что касается удобрения, то предпочтительно, чтобы количество анионов, таких, как сульфатные группы, было низким. Следовательно, органическая азотсодержащая композиция по настоящему изобретению является подходящей в качестве сырья для удобрения.
Органическая азотсодержащая композиция по настоящему изобретению может быть жидкой в виде ферментационного маточного раствора или может быть получена в виде нейтральных сухих гранул нейтрализацией и высушиванием (смотри выложенную заявку на патент Японии №52-7872).
Получение удобрения, включающего органическую азотсодержащую композицию по настоящему изобретению, можно проводить аналогично получению удобрения с использованием обычного ферментационного маточного раствора в качестве сырья. Во время получения можно добавить другой ингредиент удобрения. Поскольку в удобрении по настоящему изобретению используется органическая азотсодержащая композиция по настоящему изобретению в качестве сырья, удобрение может иметь высокое содержание органического азота (в частности, иного органического азота, чем азот L-глутаминовой кислоты) и низкое содержание анионов, таких, как сульфатные группы.
Примеры
В дальнейшем настоящее изобретение будет более конкретно пояснено при обращении к следующим примерам. В примерах аминокислоты являются L-аминокислотами, если не указано иначе.
ССЫЛОЧНЫЙ ПРИМЕР 1
<1> Скрининг микроорганизма, обладающего резистентностью к L-глутаминовой кислоте в кислых условиях
Скрининг микроорганизма, обладающего резистентностью к L-глутаминовой кислоте в кислых условиях, проводили следующим образом. Один (1) г каждой из примерно 500 проб, полученных из природы, включая почву, фрукты, растения, речную воду и так далее, суспендировали в 5 мл стерильной воды и 200 мкл из нее высевали на 20 мл твердой среды с рН, доведенным до 4,0, с помощью HCl. Состав среды был следующим: 3 г/л глюкозы, 1 г/л сульфата аммония, 0,2 г/л сульфата магния гептагидрата, 0,5 г/л первичного кислого фосфата калия, 0,2 г/л хлорида натрия, 0,1 г/л хлорида кальция дигидрата, 0,01 г/л сульфата железа (2) гептагидрата, 0,01 г/л сульфата марганца тетрагидрата, 0,72 мг/л сульфата цинка дигидрата, 0,64 мг/л сульфата меди пентагидрата, 0,72 мг/л хлорида кобальта гексагидрата, 0,4 мг/л борной кислоты, 1,2 мг/л молибдата натрия дигидрата, 50 мкг/л биотина, 50 мкг/л пантотената кальция, 50 мкг/л фолиевой кислоты, 50 мкг/л инозита, 50 мкг/л ниацина, 50 мкг/л п-аминобензойной кислоты, 50 мкг/л пиридоксина гидрохлорида, 50 мкг/л рибофлавина, 50 мкг/л тиамина гидрохлорида, 50 мкг/л циклогексимида и 20 г/л агара.
Засеянные вышеуказанными пробами среды инкубировали при 28°С, 37°С или 50°С в течение 2-4 суток и получали 378 колониеобразующих штаммов.
Затем каждый из штаммов, полученных как описано выше, высевали в культуральную пробирку длиной 16,5 см и диаметром 14 мм, содержащую 3 мл жидкой среды (с рН, доведенным HCl до 4,0), включающей L-глутаминовую кислоту в концентрации насыщения, и культивировали при 28°С, 37°С или 50°С в течение от 24 ч до 3 суток при встряхивании. Затем отбирали выросшие штаммы. Состав вышеуказанной среды был следующим: 40 г/л глюкозы, 20 г/л сульфата аммония, 0,5 г/л сульфата магния гептагидрата, 2 г/л первичного кислого фосфата калия, 0,5 г/л хлорида натрия, 0,25 г/л хлорида кальция дигидрата, 0,02 г/л сульфата железа (2) гептагидрата, 0,02 г/л сульфата марганца тетрагидрата, 0,72 мг/л сульфата цинка дигидрата, 0,64 мг/л сульфата меди пентагидрата, 0,72 мг/л хлорида кобальта гексагидрата, 0,4 мг/л борной кислоты, 1,2 мг/л молибдата натрия дигидрата и 2 г/л дрожжевого экстракта.
Таким образом, с успехом было получено 78 штаммов микроорганизмов, показывающих резистентность к L-глутаминовой кислоте в кислых условиях.
<2> Отбор штаммов, показывающих наибольшую скорость роста, из микроорганизмов, обладающих резистентностью к L-глутаминовой кислоте в кислых условиях
Различные микроорганизмы, обладающие резистентностью к L-глутаминовой кислоте в кислых условиях, полученные как описано выше, высевали в культуральную пробирку длиной 16,5 см и диаметром 14 мм, содержащую 3 мл среды (с рН, доведенным HCl до 4,0), полученную добавлением 20 г/л глутаминовой кислоты и 2 г/л глюкозы к среде М9 (Sambrook, J., Fritsh E.F. and Maniatis Т., "Molecular Cloning", Cold Spring Harbor Laboratory Press, U.S.A., 1989), и во времени определяли мутность среды для отбора штаммов, показывающих подходящую скорость роста. В результате был получен штамм AJ13355 в качестве штамма, показывающего подходящий рост, из почвы в Iwata-shi, Shizuoka, Японии. Данный штамм был определен как Enterobacter agglomerans, основываясь на его бактериологических свойствах, описанных выше.
<3> Получение штамма с наименьшей секрецией слизи из штамма Enterobacter agglomerans AJ13355
Поскольку штамм Enterobacter agglomerans AJ13355 внеклеточно секретирует слизь при культивировании в среде, содержащей сахарид, эффективность процесса является неудовлетворительной. Следовательно, был получен штамм с меньшей секрецией слизи облучением ультрафиолетовыми лучами (Miller J.H. et al., "A Short Course in Bacterial Genetics; Laboratory Manual", p.150, 1992, Cold Spring Harbor Laboratory Press, U.S.A.).
Штамм Enterobacter agglomerans AJ13355 облучали ультрафиолетовыми лучами в течение 2 мин на расстоянии 60 см от ультрафиолетовой лампы 60-W и культивировали в среде LB в течение ночи для фиксированной мутации. Полученный в результате мутации штамм разбавляли и высевали в среду LB, содержащую 5 г/л глюкозы и 20 г/л агара так, чтобы появлялось примерно 100 колоний на чашку, и культивировали при 30°С в течение ночи при наклоне чашки примерно под углом на 45° и затем отбирали 20 колоний, не показывающих стекания слизи.
В качестве штамма, удовлетворяющего условиям о том, чтобы ревертанты не появлялись даже после субкультивирования в течение 5 раз в среде LB, содержащей 5 г/л глюкозы и 20 г/л агара, и чтобы наблюдался рост, эквивалентный родительскому штамму в среде LB, среде LB, содержащей 5 г/л глюкозы, и в среде М9 (Sambrook, J. et al., "Molecular Cloning", 2nd Edition, Cold Spring Harbor Press, U.S.A., 1989) при добавлении 20 г/л L-глутаминовой кислоты и 2 г/л глюкозы и доведении рН с помощью HCl до 4,5 выбрали штамм SC17 из отобранных выше штаммов.
<4> Конструкция продуцирующих L-глутминовую кислоту бактерий из штамма Enterobacter agglomerans SC17
(1) Получение дефицитного по αKGDH штамма из штамма Enterobacter agglomerans SC17
Получили штамм, дефицитный по αKGDH и обладающий повышенным биосинтезом L-глутаминовой кислоты из штамма Enterobacter agglomerans SC17.
(i) Клонирование гена αKGDH (в последующем именуемым как "sucAB") штамма Enterohacter agglomerans AJ13355
Ген sucAB штамма Enterobacter agglomerans AJ13355 клонировали отбором фрагмента ДНК, комплементарного свойству не ассимилировать уксусную кислоту субъединичного гена αKGDH-Е1 (в последующем именуемым как "sucA") - дефицитного штамма Escherichia coli из хромосомной ДНК штамма Enterobacter agglomerans AJ13355.
Хромосомную ДНК штамма Enterobacter agglomerans AJ13355 выделяли методом, обычно используемым для экстракции хромосомной ДНК из Escherichia coli (Text for Bioengineering Experiments, Edited by the Society for Bioscience and Bioengineering, Япония, pp.97-98, Baifukan, 1992). pTWV228 (резистентная к ампициллину), использованная в качестве вектора, представляла коммерческий продукт от Takara Shuzo Co., Ltd.
Хромосомную ДНК штамма AJ13355 расщепляли ЕсоТ221, и pTWV228, расщепленную PstI, лигировали с использованием Т4-лигазы и использовали для трансформации sucA-дефицитного штамма Escherichia coli JRG465 (Herbert, J. et al., Mol. Gen. Genetics, 105, 182 (1969)). Штамм, растущий в ацетатной минимальной среде, отбирали из штаммов-трансформантов, полученных выше, из него выделяли плазмиду и обозначали как pTWVEK101. Штамм Escherichia coli JRG465, включающий pTWVEK101, проявлял ауксотрофность в отношении янтарной кислоты или L-лизина и L-метионина помимо признака свойства не ассимилировать уксусную кислоту. Данное предполагает, что pTWVEK101 включала ген sucA Enterobacter agglomerans.
На фиг.1 представлена карта рестрикции ферментами фрагмента ДНК, выделенного из Enterobacter agglomerans, в pTWVEK101. В нуклеотидной последовательности полученного участка на фиг.1 считается, что нуклеотидные последовательности представляют полные длины ORFs, и считается, что две нуклеотидные последовательности представляют неполные последовательности ORFs. В результате поиска их взаимной гомологии было установлено, что участки, чьи нуклеотидные последовательности были определены, включали 3'-конец неполной последовательности гена сукцинатдегидрогеназы-содержащего железо-серу белка (sdhB), полной длины sucA и субъединичного гена αKGDH-E2 (ген sucB) и 5'-конец неполной последовательности субъединичного гена сукцинил-СоА-синтетазы β (ген sucC). Результаты сравнения аминокислотных последовательностей, полученных по данным нуклеотидных последовательностей, с таковыми, полученными из Escherichia coli (Eur. J. Biochem., 141, pp.351-359 (1984); Eur. J. Biochem., 141, pp.361-374 (1984); Biochemistry, 24, pp.6245-6252 (1985)), представлены на фиг.2-5. Таким образом, аминокислотные последовательности показали очень высокую взаимную гомологию друг к другу. Кроме того, было установлено, что кластер sdhB-sucA-sucB-sucC входил в состав хромосомы Enterobacter agglomerans, как и у Escherichia coli (Eur. J. Biochem., 141, pp.351-359 (1984); Eur. J. Biochem., 141, pp.361-374 (1984); Biochemistry, 24, pp.6245-6252 (1985)).
(ii) Получение дефицитного по αKGDH штамма из штамма Enterobacter agglomerans SC17
Проводили гомологичную рекомбинацию с использованием гена sucAB Enterobacter agglomerans, полученного, как описано выше, с получением дефицитного по αKGDH штамма Enterobacter agglomerans.
После расщепления pTWVEK101 с помощью SphI для вырезания фрагмента, включающего sucA, у фрагмента "затупляли концы" фрагментом Кленова (Takara Shuzo Co., Ltd.) и лигировали с pBR322, расщепленной EcoRI, и "затупляли концы" фрагментом Кленова с использованием Т4 ДНК-лигазы (Takara Shuzo Co., Ltd.). Полученную плазмиду расщепляли в рестрикционном сайте узнавания фермента BglII, расположенном примерно в центре sucA с использованием фермента, "затупляли концы" фрагментом Кленова и затем вновь лигировали с использованием Т4 ДНК-лигазы. Полагалось, что ген sucA, ставший нефункциональным в результате мутации со сдвигом рамки, вводили в sucA вновь сконструированной плазмиды вышеуказанным методом.
Плазмиду, сконструированную как описано выше, расщепляли ферментом рестрикции ApaLI и подвергали электрофорезу в агарозном геле с получением фрагмента ДНК, включающего sucA, в который ввели мутацию со сдвигом рамки и ген резистентности к тетрациклину, полученный из pBR322. Выделенный фрагмент ДНК вновь лигировали с использованием Т4 ДНК-лигазы в целях конструирования плазмиды для разрыва гена αKGDH.
Плазмиду для разрыва гена αKGDH, полученную как описано выше, использовали для трансформации штамма Enterobacter agglomerans SC17 электропорацией (Miller J.H., "A Short Course in Bacterial Genetics; Handbook", p.279, Cold Spring Harbor Laboratory Press, U.S.A., 1992) и получали штамм, в котором sucA в хромосоме замещали одним мутантным типом плазмиды гомологичной рекомбинацией с использованием резистентности к тетрациклину в качестве маркера. Полученный штамм обозначали как штамм SC17sucA.
Для подтверждения того, что штамм SC17sucA является дефицитным по активности αKGDH, определяли активность фермента по методу Reed et al. (Reed L.J. and Mukherjee В.В., Methods in Enzymology, 13, pp.55-61 (1969) с использованием клеток штамма, культивированного в среде LB в логарифмической фазе роста. В результате в штамме SC17 была определена активность αKGDH, равная 0,073 (ΔABS/мин/мг белка), в то время как активность αKGDH не была обнаружена в штамме SC17sucA и таким образом было подтверждено, что sucA был элиминирован, как и предполагалось.
(2) Усиление системы биосинтеза L-глутаминовой кислоты штамма Enterobacter agglomerans SC17sucA
Затем полученные из Escherichia coli ген цитратсинтазы, ген фосфоенолпируваткарбоксилазы и ген глутаматдегидрогеназы вводили в штамм SC17sucA.
(i) Получение плазмиды, включающей ген gltA, ген ррс и ген gdhA из Escherichia coli
Методы получения плазмиды, включающей ген gltA, ген ррс и ген gdhA, будут пояснены при обращении к фиг.6 и 7.
Плазмиду, включающую ген из gdhA Escherichia coli, pBRGDH (выложенная заявка на патент Японии №7-203980), расщепляли Hind III и SphI, оба конца "затупляли" обработкой Т4 ДНК-полимеразой и затем очищали и выделяли фрагмент ДНК, включающий ген gdhA. Отдельно плазмиду, включающую ген gltA и ген ррс из Escherichia coli, pMWCP (WO 97/08294), расщепляли XbaI и затем оба конца "затупляли" с использованием Т4 ДНК-полимеразы. Ее смешивали с выделенным выше фрагментом ДНК, включающим ген gdhA и лигировали с использованием Т4-лигазы с получением плазмиды pMWCPG, которая относится к pMWCP, дополнительно включающей ген gdhA (фиг.6).
В то же время плазмиду pVIC40 (выложенная заявка на патент Японии №8-047397), включающую репликатор плазмиды RSF1010 для широкого спектра хозяев, расщепляли NotI, обрабатывали Т4 ДНК-полимеразой и расщепляли PstI. pBR322 расщепляли ЕсоТ14I, обрабатывали Т4 ДНК-полимеразой и расщепляли Pstl. Оба продукта смешивали и лигировали с использованием Т4-лигазы с получением плазмиды RSF-Tet, включающей репликатор RSF1010 и ген устойчивости к тетрациклину (фиг.7).
Затем pMWCPG расщепляли EcoRI и Pstl и фрагмент ДНК, включающий ген gltA, ген ррс и ген gdhA, очищали и выделяли. RSF-Tet подобным образом расщепляли EcoRI и Pstl и фрагмент ДНК, включающий репликатор RSF1010, очищали и выделяли. Оба продукта смешивали и лигировали с использованием Т4-лигазы с получением плазмиды RSFCPG, которая соответствовала RSF-Tet, включающей ген gltA, ген ррс и ген gdhA (фиг.8). Было подтверждено, что полученная плазмида RSFCPG экспрессировала ген gltA, ген ррс и ген gdhA, основываясь на дополнении ауксотрофности дефицитного по гену gltA, гену ррс или гену gdhA штамма, полученного из Escherichia coli, и определений активности каждого фермента.
(ii) Получение плазмиды, включающей ген gltA, полученный из Brevibacterium lactofermentum
Плазмиду, включающую ген gltA, полученный из Brevibacterium lactofermentum, конструировали следующим образом. Проводили ПЦР с использованием ДНК-праймеров, которые получали на основе нуклеотидной последовательности гена gltA Corynebacterium glutamicum (Microbiology, 140, pp.1817-1828 (1994)) и хромосомной ДНК Brevibacterium lactofermentum АТСС13869 в качестве матрицы для получения фрагмента гена gltA размером примерно 3 т.п.о. Данный фрагмент вставляли в плазмиду pHSG399 (получена от Takara Shuzo Co., Ltd.), расщепленную Smal, с получением плазмиды pHSGCB (фиг.9). Затем pHSGCB расщепляли Hind III и вырезанный фрагмент гена gltA размером примерно 3 т.п.о. вставляли в плазмиду pSTV29 (полученную от Takara Shuzo Co., Ltd.), расщепленную HindIII, с получением плазмиды pSTVCB (фиг.9). Было подтверждено, что полученная плазмида pSTVCB экспрессировала ген gltA по определению активности фермента в штамме Enterobacter agglomerans AJ13355.
(iii) Введение RSFCPG и pSTVCB в штамм SC17sucA
Штамм Enterobacter agglomerans SC17sucA трансформировали с использованием RSFCPG электропорацией с получением штамма-трансформанта SC17sucA/RSFCPG, показывающего резистентность к тетрациклину. Затем штамм SC17sucA/RSFCPG трансформировали pSTVCB электропорацией с получением штамма-трансформанта SC17sucA/RSFCPG+pSTVCB, показывающего резистентность к хлорамфениколу.
<5> Получение штамма с повышенной резистентностью к L-глутаминовой кислоте при низком значении pH
Штамм с повышенной резистентностью к L-глутаминовой кислоте в высокой концентрации при низком значении рН (в последующем также именуемый как "штамм с Glu-резистентностыо в высокой концентрации при низком рН") выделяли из штамма Enterobacter agglomerans SC17sucA/RSFCPG+pSTVCB.
Штамм SC17sucA/RSFCPG+pSTVCB культивировали в течение ночи при 30°С в среде LBG (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 5 г/л глюкозы) и клетки, промытые физиологическим раствором, соответствующим образом разбавляли и высевали на чашки со средой М9-Е (4 г/л глюкозы, 17 г/л Na2HPO4·12H2O, 3 г/л КН2РО4, 0,5 г/л NaCl, 1 г/л NH4Cl, 10 мМ MgSO4, 10 мкМ CaCl2, 50 мг/л L-лизина, 50 мг/л L-метионина, 50 мг/л DL-диаминопимелиновой кислоты, 25 мг/л тетрациклина, 25 мг/л хлорамфеникола, 30 г/л L-глутаминовой кислоты, с рН, доведенным до 4,5 водным раствором аммиака). Колонию, появившуюся после культивирования при 32°С в течение 2 суток, получали в качестве штамма с Glu-резистентностыо в высокой концентрации при низком рН.
Для полученного штамма определяли степень роста в жидкой среде М9-Е и тестировали способность продуцировать L-глутаминовую кислоту в больших культуральных пробирках емкостью 50 мл, содержащих 5 мл опытной среды для продукции L-глутаминовой кислоты (40 г/л глюкозы, 20 г/л сульфата аммония, 0,5 г/л сульфата магния гептагидрата, 2 г/л первичного кислого фосфата калия, 0,5 г/л хлорида натрия, 0,25 г/л хлорида кальция дигидрата, 0,02 г/л сульфата железа (2) гептагидрата, 0,02 г/л сульфата марганца тетрагидрата, 0,72 мг/л сульфата цинка дигидрата, 0,64 мг/л сульфата меди пентагидрата, 0,72 мг/л хлорида кобальта гексагидрата, 0,4 мг/л борной кислоты, 1,2 мг/л молибдата натрия дигидрата, 2 г/л дрожжевого экстракта, 200 мг/л L-лизина гидрохлорида, 200 мг/л L-метионина, 200 мг/л DL-α,ε-диаминопимелиновой кислоты, 25 мг/л тетрациклина гидрохлорида и 25 мг/л хлорамфеникола). Штамм, который показывал наилучшую степень роста и такую же способность продуцировать L-глутаминовую кислоту, как и его родительский штамм, штамм SC17/RSFCPG+pSTVCB, обозначали как Enterobacter agglomerans AJ13601. Штамм был депонирован в National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry (в настоящее время International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology; Central 6, Higashi 1-1-1, Tsukuba-shi, Ibaraki 305-8566, Япония) 18 августа 1999 г. и получил инвентарный номер FERM Р-17516. Затем он был передан на международное хранение по Будапештскому соглашению от 6 июля 2000 г. и получил инвентарный номер FERM BP-7207.
ПРИМЕР 1
Штамм Enterobacter agglomerans AJ13601 культивировали на агаровой среде LBG (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, 5 г/л глюкозы и 15 г/л агара), содержащей 25 мг/л тетрациклина гидрохлорида и 25 мг/л хлорамфеникола, при 30°С в течение 14 ч и собирали клетки на одной чашке (диаметр: 8,5 см), и высевали в 300 мл культуральной среды, содержащей 50 г/л глюкозы, 4 г/л сульфата аммония, 0,4 г/л сульфата магния гептагидрата, 2 г/л первичного кислого фосфата калия, 10 мг/л сульфата железа (2) гептагидрата, 10 мг/л сульфата марганца пентагидрата, 4 г/л дрожжевого экстракта, 400 мг/л L-лизина гидрохлорида, 400 мг/л DL-метионина, 400 мг/л DL-α,ε-диаминопимелиновой кислоты, 25 мг/л тетрациклина гидрохлорида и 25 мг/л хлорамфеникола, в баночном ферментере емкостью 1 л для начала культивирования при 34°С при рН 6,0. Значение рН при культивировании контролировали добавлением газообразного аммиака. Культивирование заканчивали примерно через 16 ч после начала культивирования в фазе, в которой происходило истощение глюкозы.
15 мл культурального бульона, культивированного как описано выше, высевали в 15 л культуральной среды, содержащей 50 г/л глюкозы, 4 г/л сульфата аммония, 0,4 г/л сульфата магния гептагидрата, 2 г/л первичного кислого фосфата калия, 10 мг/л сульфата железа (2) гептагидрата, 10 мг/л сульфата марганца пентагидрата, 4 г/л дрожжевого экстракта, 400 мг/л L-лизина гидрохлорида, 400 мг/л DL-метионина, 400 мг/л DL-α,ε-диаминопимелиновой кислоты, 25 мг/л тетрациклина гидрохлорида и 25 мг/л хлорамфеникола в баночном ферментере емкостью 30 л для начала культивирования при 34°С и при рН 6,0. Значение рН при культивировании контролировали добавлением газообразного аммиака. Культивирование заканчивали примерно через 16 ч после начала культивирования в фазе, в которой была израсходована глюкоза в культуральной среде.
2,8 л культурального бульона, культивированного как описано выше, высевали в 14 л культуральной среды, содержащей 50 г/л глюкозы, 5 г/л сульфата аммония, 0,4 г/л сульфата магния гептагидрата, 5 г/л первичного кислого фосфата калия, 20 мг/л сульфата железа (2) гептагидрата, 20 мг/л сульфата марганца пентагидрата, 6 г/л дрожжевого экстракта, 800 мг/л L-лизина гидрохлорида, 600 мг/л DL-метионина, 600 мг/л DL-α,ε-диаминопимелиновой кислоты, 1,5 г/л хлорида натрия, 0,75 г/л хлорида кальция дигидрата, 25 мг/л тетрациклина гидрохлорида и 25 мг/л хлорамфеникола в баночном ферментере емкостью 30 л для начала культивирования при 34°С и при рН 6,0. Пока культивирование продолжалось, по мере накопления L-глутаминовой кислоты значение рН спонтанно снижалось, достигая рН 4,5. После чего рН при культивировании контролировали до рН 4,5 добавлением газообразного аммиака. После того, как первоначально внесенная глюкоза была израсходована, постепенно добавляли 700 г/л водного раствора глюкозы.
Ферментационное получение L-глутаминовой кислоты продолжали как описано выше. Когда концентрация L-глутаминовой кислоты, накопившейся в культуральном бульоне, достигала 45 г/л, в культуральный бульон добавляли 30 г кристаллов L-глутаминовой кислоты α-формы в виде суспензии кристаллов в 100 мл воды из верхней части баночного ферментера, и культивирование продолжали далее. Культивирование заканчивали в фазе, когда сумма концентрации L-глутаминовой кислоты, накопившейся в виде кристаллов в среде, и концентрации L-глутаминовой кислоты, растворенной в среде, достигала 100 г/л. Значительное количество кристаллов L-глутаминовой кислоты α-формы осаждалось в баночном ферментере. Используя способ добавления серной кислоты в среду, значение рН доводили до 3,2, при котором растворимость L-глутаминовой кислоты становится низкой. Кроме того, кристаллизацию L-глутаминовой кислоты, растворенной в растворе, усиливали охлаждением с получением суспензии кристаллов. Кристаллы L-глутаминовой кислоты, которые осаждались в суспензии кристаллов, отделяли в отстойнике с получением желаемой органической азотсодержащей композиции.
Содержание каждого ингредиента по данным анализа по отношению к общему сухому веществу в полученной органической азотсодержащей композиции представлено в таблице 1.
Аналитические показатели органической азотсодержащей композиции
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1
Культивирование проводили так же, как в примере 1, за исключением того, что условия культивирования в баночном ферментере емкостью 30 л, который содержал 300 мл среды по примеру 1, были изменены следующим образом: культивирование начинали при 34°С и при рН 6,0 и затем рН культуры контролировали с поддержанием рН 6,0 добавлением газообразного аммиака. Из полученной среды получали органическую азотсодержащую композицию так же, как в примере 1.
Содержание каждого ингредиента по отношению к общему сухому веществу в полученной органической азотсодержащей композиции представлено в таблице 2.
Аналитические показатели органической азотсодержащей композиции
Исходя из результатов таблицы 1 и таблицы 2, можно видеть, что органическая азотсодержащая композиция по настоящему изобретению имеет высокое содержание органического азота, который эффективен в качестве удобрения, высокую долю органического азота по отношению к общему азоту и, в частности, высокое содержание органического азота, иного чем азот L-глутаминовой кислоты. Также можно видеть, что количество сульфатных групп является небольшим, и, следовательно, органическая азотсодержащая композиция по настоящему изобретению подходит в качестве сырья для удобрения.








| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 2002 |
|
RU2282662C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 2002 |
|
RU2288271C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 1999 |
|
RU2188236C2 |
| ШТАММ ENTEROBACTER AGGLOMERANS, СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ МИКРООРГАНИЗМА ДЛЯ ВЫРАБОТКИ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 2000 |
|
RU2261272C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 1999 |
|
RU2194076C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2003 |
|
RU2307165C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА ИЛИ L-ВАЛИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2009 |
|
RU2418064C2 |
| СПОСОБ ПРОИЗВОДСТВА L-АМИНОКИСЛОТ | 2007 |
|
RU2422530C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН rcsA | 2006 |
|
RU2359029C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕАРОМАТИЧЕСКИХ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН csrA | 2005 |
|
RU2311453C2 |


Изобретение относится к биотехнологии. Органическая азотсодержащая композиция включает ферментационный маточный раствор, полученный культивированием микроорганизма рода Enterobacter, обладающего способностью продуцировать L-глутаминовую кислоту, в жидкой среде, рН которой доводится до значения, при котором L-глутаминовой кислоте дают возможность осаждаться, при допущении того, что L-глутаминовая кислота продуцируется и накапливается с сопровождаемым осаждением и последующим отделением L-глутаминовой кислоты от среды. Причем микроорганизм может метаболизировать источник углерода в жидкой среде, содержащей L-глутаминовую кислоту в концентрации насыщения и источник углерода, при определенном значении рН, и обладает способностью накапливать L-глутаминовую кислоту в количестве, превышающем концентрацию насыщения L-глутаминовой кислоты в жидкой среде при этом значении рН. Полученная композиция используется в составе удобрения. Заявленное изобретение позволяет расширить ассортимент удобрений. 2 н. и 3 з.п. ф-лы, 9 ил., 2 табл.
| ШТАММ БАКТЕРИЙ CORYNEBACTERIUM GLUTAMICUM В-7198-ПРОДУЦЕНТ L-ГЛЮТАМИНОВОЙ КИСЛОТЫ | 1996 |
|
RU2107723C1 |
| US 3220929, 30.11.1965. | |||
Авторы
Даты
2007-01-10—Публикация
2002-02-19—Подача