Изобретение относится к области медицины, а именно к стимуляторам развития микробных популяций и препаратам для лечения заболеваний желудочно-кишечного тракта, содержащим микроорганизмы, и может быть использовано в прикладной биотехнологии, ветеринарии и смежных отраслях.
Известно использование в качестве стимуляторов роста микроорганизмов производных карбоматов (фруктоолигосахаридов, изомальтоолигосахаридов, циклодекстрина, ациллактамов и т.д.) (А.С. СССР №1746663, 1994, кл. С 07 С 271/58; акц. заявка Японии №59-53834, 1984, кл. C 12 N 1/05; патент США №4782045, 1989, кл. C 12 N 1/00; акц. заявка Японии №63-71171, 1988, кл. C 12 N 1/00).
Недостатками указанных стимуляторов являются сложности синтеза, узкий спектр действия, т.е. проявление стимулирующего эффекта по отношению к узкому спектру микроорганизмов, необходимость введения в культуральную жидкость посторонних веществ.
Известен разработанный авторами стимулятор клеток Escherichia coli (Е.coli), получаемый из клеток микроорганизмов, помещенных в дистиллированную воду на 5-9 суток (патент РФ №1638156, 1991, кл. C 12 N 1/00//1/38).
Недостатком стимулятора являлось нестандартность и неопределенность состава, что не позволяло получить достаточно стабильные результаты при промышленном производстве.
Наиболее близким по технической сущности и достигаемому эффекту к заявляемому стимулятору является стимулятор, представляющий собой смесь водорастворимых солей металлов 1 или 2 групп Периодической системы Д.И.Менделеева или аммония неорганических кислот при следующем молярном соотношении входящих в смесь анионов (мол.%):
Стимулятор, как правило, используют в концентрации от 0.5 до 10% масс. от массы культуральной жидкости. Данный стимулятор позволял стимулировать рост клеток Е.coli как в чистых, так и в смешанных культурах, что открывало возможности для создания препарата, способного вытеснять патогенную микрофлору путем стимулирования роста микроорганизмов, полезных для функционирования желудочно-кишечного тракта (ЖКТ).
Недостатком стимулятора являлось отсутствие эффективного воздействия на такие полезные для жизнедеятельности ЖКТ микроорганизмы, как бифидум- и молочнокислые бактерии, а также сравнительно низкая эффективность при использовании с посевными дозами ниже 105 клеток/мл и при выращивании бактерий на плотных питательных средах.
В настоящее время для решения сходных задач предполагается вводить в организм перорально препараты, содержащие отдельные штаммы микроорганизмов, в частности биопрепараты на основе молочнокислых микроорганизмов (Евр. пат. № 0097484, 1984, кл. А 23 С 1/05; евр. пат. № 0043962, 1980, кл. А 23 С 19/086; пат. США № 4289888, 1979, кл. А 23 С 9/123). Препарат, как правило, содержит клетки бактерий, остатки культуральной жидкости (КЖ), жиры, белки, лактозу, камедь и другие добавки. Состав композиций определяется особенностями используемых микроорганизмов и характером поставленной задачи.
Известны препараты на основе ацидофильных микроорганизмов (пат. РФ №2064269, 1994, кл. А 23 С 9/12, авт. св. СССР №1227145, 1983, кл. А 23 С 9/123), содержащие клетки бактерий и остатки КЖ с некоторыми добавками, улучшающими его эксплуатационные характеристики. Недостатком препаратов является относительно невысокая активность.
Наиболее близким по технической сущности к заявляемому препарату является биопрепарат, описанный в патенте РФ №2080795, 1997, кл. А 23 С 9/12. Данный препарат содержит живые клетки Lactobacillus acidophilus, желатин, сахарозу, обезжиренное молоко, воду, остатки культуральной жидкости.
Недостатком его является ограниченный спектр действия, недостаточно высокая эффективность. В частности, указанный недостаток обусловлен неустойчивостью роста и жизнедеятельности микроорганизмов в ЖКТ в присутствии других видов микроорганизмов, в том числе патогенных, а также токсических веществ, попадающих в организм с пищей или выделяемых организмом в ходе заболеваний.
Задачей, решаемой авторами, являлось создание стимулятора роста микроорганизмов, способного стимулировать рост индигенных кишечных палочек, бифидобактерий и лактобацилл при одновременной минимизации стимулирующего воздействия на патогенные микроорганизмы, что позволяет вытеснять их из микрофлоры организма за счет конкуренции с полезными для ЖКТ бактериями.
Техническая задача решалась созданием нового стимулятора на основе водорастворимых солей щелочных и щелочно-земельных металлов или аммония и ацетат-, лактат-, сукцинат- и глутамат-анионов, который дополнительно содержит формиат-анион и монокарбоновые аминокислоты (МКА) при следующих соотношениях ингредиентов (% масс.):
В качестве МКА используют аланин, валин, глицин, метионин, лейцин, цистеин, лизин, как правило, в концентрации менее 1-3% масс. или их смеси.
Основными техническими отличиями от вышеупомянутого стимулятора являются наличие формиат-аниона, аспартат-аниона и монокарбоновых аминокислот, а также, как правило, более высокое содержание ацетат-аниона и более низкое содержание сукцинат-аниона.
Как правило, препарат вводят в культуру в дозе 10-500 мкг/мл. Использование его в дозах меньше 10 мкг/мл не позволяет получить значительный эффект, в дозе более 500 мкг/мл экономически неэффективно.
Наряду с использованием в качестве стимулятора роста микроорганизмов препарат указанного состава оказался эффективен для нормализации микробиоценоза человека или животных или для повышения эффективности вводимых одновременно с ним микробиологических препаратов при использовании его внутрижелудочно в дозах 20-100 мг/кг веса.
При этом препарат, получивший условное наименование "Полифлор", может дополнительно содержать до 0.1% масс. рибофлавина и/или до 0.1% масс. фолиевой кислоты, используемых в качестве внутреннего стандарта качества препарата, а также добавки других аминокислот или витаминов.
Препарат получали смешением необходимых ингредиентов или смесей искусственного или природного происхождения, содержащих отдельные компоненты, входящие в "Полифлор". Для создания композиций использовались, как правило, натриевые соли уксусной и муравьиной кислот, кальциевая соль молочной кислоты, монозамещенные натриевые соли янтарной, глутаминовой и аспарагиновой кислот и наборы аминокислот. После растворения композиций рН при необходимости доводился до значений 6,9-7,4.
Промышленная применимость препарата "Полифлор" иллюстрируется следующими примерами.
Пример 1. Получение и состав стимуляторов.
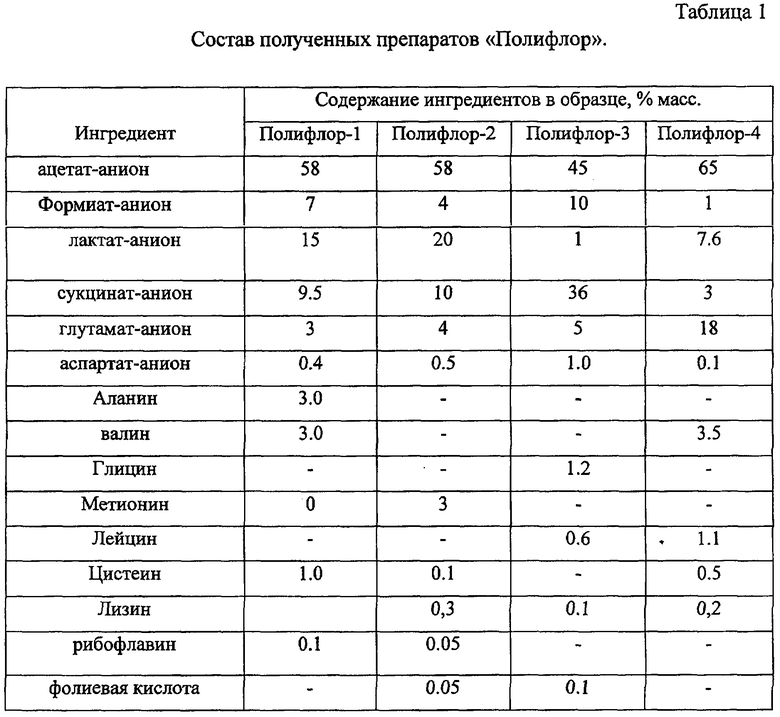
Путем смешения соответствующих количеств натриевых солей уксусной и муравьиной кислот, кальциевой соли молочной кислоты, монозамещенных натриевых солей янтарной, глутаминовой кислот, аммонийной соли аспарагиновой кислоты и наборов аминокислот были получены следующие образцы препаратов "Полифлор", состав которых приведен в таблице 1. После получения препаратов рН был доведен до 7.1±0.1.
Пример 2. Инициация роста культуры при засеве низких концентраций клеток.
Для выращивания культуры Е.coli М-17 использовали среду М-9 с концентрацией глюкозы 0,3-0,5 г/л, в среду добавляли стимуляторы роста АРК-1, АРК-2 (патент РФ №1638156, 1991), стимулятор-прототип, "Полифлор-1", "Полифлор-4". Стимуляторы разводили водой, стерилизовали нагреванием (2 часа при 80°С) и добавляли в требуемых концентрациях в питательную среду. Для определения минимальной действующей концентрации стимуляторов использовали их двукратные разведения. Среды с различными концентрациями стимуляторов разливали в пробирки по 3 мл и засевали Е.coli М-17 в концентрации 102-104 кл/мл.
Рост культуры контролировали по появлению мути через 36-48 часов инкубации в термостате при 37°С в стационарных условиях. Чистоту посевов проверяли по высевам на плотные питательные среды - РКА и Эндо.
Средние по 5 экспериментам минимальные концентрации стимуляторов, инициирующие рост бактерий, оказались следующими (мкг/мл): контроль - рост отсутствовал; стимулятор-прототип - 70; АРК-1 - 60; АРК-2 - 30; "Полифлор-1" - 1; "Полифлор-4" - 5.
Увеличение концентрации "Полифлор-1" от 1 до 500 мкг/мл приводило к сокращению сроков выращивания. При концентрации 500 мкг/мл появление мути регистрировалось через 12-18 часов выращивания.
Пример 3. Выращивание на агаризованной минимальной среде М-9 с 0,4% глюкозы.
Культуру Е.coli М-17 засевали на чашки с минимальной средой с таким расчетом, чтобы на чашке вырастало от 5 до 50 колоний. Концентрация добавленных стимуляторов: АРК-1, АРК-2, стимулятор-прототип, "Полифлор-1", "Полифлор-3" в агаре составляла 50-500 мкг/мл. Чашки инкубировали в термостате при 37°С. Рост колоний контролировали периодически в течение 72 часов после засева. Для определения размера колоний чашки фотографировали специализированной видеокамерой МИКС-480. Анализ изображений осуществляли с использованием программы обработки и анализа изображений "ВидеоТесТ - Морфо 3.2". Через 18 часов роста наличие колоний визуально определялось только на чашках с "Полифлор-1", их диаметр составлял около 0,3 мм.
Средние диаметры колоний, полученные в типичном эксперименте, после 48 часов роста составляли (мм): без добавок - 0,1±0,05; "Актофлор" - 1,4±0,2; "Полифлор-3" - 1,6±0,2. "Полифлор-1" - 2,2±0,2.
Пример 4. Влияние препарата "Полифлор" на рост лактобацилл.
Для определения влияния стимулятора "Полифлор" на рост лактобацилл использовали штамм Lactobacillus plantarum 8PA-3, применив автоматическую систему "Avantage". К культурам, выращенным на среде МРС-4 и доведенным до конечной концентрации 10 микробных клеток/мл, добавляли "Полифлор-1" и "Полифлор-2" в концентрации 10, 25 и 50 мкг/мл и культивировали в анаэробных условиях. О скорости роста микробов судили по оптической плотности, сравнивая опытные и контрольные (без "Полифлора") культуры.
"Полифлор-1" в дозе 10 мкг/мл стимулировал рост бактерий Lactobacillus plantarum 8PA на 12,2%, в дозе 25 мкг/мл на 24,6% и в дозе 50 мкг/мл на 25,6% через 10 ч культивирования.
"Полифлор-2" в дозе 10 мкг/мл стимулировал рост бактерий Lactobacillus plantarum 8PA на 22,4%, в дозе 25 мкг/мл на 34,2% и в дозе 50 мкг/мл на 34,8% через 10 ч культивирования.
Пример 5. Влияние препарата "Полифлор" на рост бифидобактерий.
Для определения влияния стимуляторов "Полифлор" на рост бифидобактерий использовали штамм Bifidobacterium bifidum 1. Смытую с плотной питательной среды Блаурокка взвесь доводили до концентрации 108 кл/мл и культивировали в жидкой питательной среде в анаэробных условиях в системе "Avantage". "Полифлор-1" в дозе 25 мкг/мл стимулировал рост бактерий В.bifidum 1 на 30,8% и в дозе 50 мкг/мл на 42,0% через 18 ч культивирования. "Полифлор-3" в дозе 25 мкг/мл стимулировал рост бактерий В.bifidum 1 на 40,5% и в дозе 50 мкг/мл на 42,8% через 18 ч культивирования.
Пример 6. Влияние препаратов "Полифлор" на рост клеток в смешанной культуре.
Е.coli М-17 выращивали вместе с Salmonella enteritidis на среде М-9 с концентрацией глюкозы 0.25 г/л и добавкой аминопептида 94.8 мл на 1 л среды. Начальная концентрация клеток в среде составляла 6.5×105 кл/мл. Из них 65% составляли клетки Е.coli М-17.
В питательную среду добавляли препараты "Полифлор" в концентрации 25 мкг/мл. Культивирование проводили в стационарных условиях при 37°С в течение 4 часов. Остановку роста осуществляли путем помещения пробирок в ледяную воду на 10 мин. Прирост биомассы оценивали по данным высевов на среду Эндо. Полученные результаты приведены в табл.2.
Пример 7. Изучение безопасности препарата "Полифлор"
Изучение общетоксического действия препарата "Полифлор" показало, что в остром эксперименте ЛД50 при внутрижелудочном введении в зависимости от состава препарата колебалась от 10840 до 12300 мг/кг, что позволяет отнести его к практически нетоксичным лекарственным веществам.
При изучении острой токсичности в случае применения препарата в дозе 5,0 г/кг в/ж было показано, что общее состояние и поведение экспериментальных животных (мыши, крысы, собаки) носили нормальный характер и не отличались от таковых у животных из контрольных групп. Данные морфологического исследования продемонстрировали, что препарат при однократном введении не вызывает патологических изменений головного мозга, внутренних и эндокринных органов.
Таким образом, результаты токсикометрии и некропсии позволяют отнести препараты "Полифлор" к V классу практически нетоксичных лекарственных веществ, а состояние перенесших острую интоксикацию животных свидетельствует о хорошей переносимости препарата.
При изучении подострой и хронической токсичности показано, что ежедневное в течение 90 дней введение препаратов "Полифлор" в дозах 0,05 и 1,0 г/кг перорально крысам и собакам обоего пола не приводит к развитию патологических сдвигов со стороны общего состояния и поведения животных, не оказывает токсического воздействия на сердечно-сосудистую деятельность, морфологический состав, биохимические и другие показатели периферической крови и костного мозга, на функциональное состояние печени и почек, белковый, углеводный, жировой и электролитный виды обмена веществ, не вызывает дистрофических, деструктивных очаговых склеротических изменений в паренхиматозных клетках и строме внутренних органов, а также не сопровождается местно-раздражающим действием.
Доклинические исследования подтвердили отсутствие у "Полифлора" аллергенных, иммунотоксических, мутагенных, эмбриотоксических и тератогенных свойств.
Пример 8. Фармакологическая активность препарата при дисбактериозе, вызванном хронической свинцовой интоксикацией
В качестве модели дисбактериоза при хронической свинцовой интоксикации использовали внутрижелудочное введение белым крысам ацетата свинца в дозе 0,3 мг/кг в пересчете на чистый свинец на протяжении 2 месяцев. С лечебно-профилактической целью за 10 дней до окончания введения свинца крысам также внутрижелудочно вводили "Полифлор-1" в дозах от 1 до 100 мг/кг в виде свежеприготовленной взвеси в дистиллированной воде. У животных исследовали микрофлору кала, навески которого разводили физиологическим раствором от 10-2 до 10-9 при использовании десятичного шага разведения, и по 0,1 мл каждого разведения наносили на чашки Петри с твердой питательной средой и растирали шпателем по ее поверхности.
Для выделения кишечных палочек использовали среду Левина, для энтерококков - среду Калина, для дрожжей - среду Сабуро. Посевы выдерживали в термостате при 37°С в течение 1-2 дней, после чего подсчитывали число выросших колоний. Результаты представлены в таблице 3.
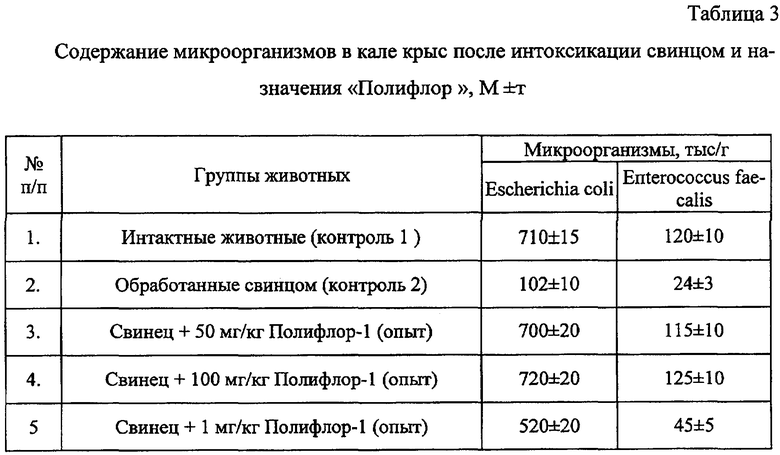
Из приведенных данных следует, что введение свинца сопровождается снижением содержания основных представителей нормофлоры (бифидобактерий, эшерихий, энтерококков и т.д.) в фекалиях, т.е. содействует развитию дисбактериоза кишечника, что, по-видимому, связано с прямым повреждающим действием свинца на аутофлору. Использование "Полифлора" оказывало нормализующее влияние на микрофлору толстой кишки.
Пример 9. Сочетанное использование препаратов "Полифлор" и Lactobacillus acidophilus B-75.
Эффективность сочетанного действия Полифлор-1 и Lactobacillus acidophilus В-75 при экспериментальном язвенном поражении желудочно-кишечного тракта.
Для получения экспериментального язвенного поражения вводили резерпин в дозе 2 мкг/кг внутрибрюшинно один раз в день в течение 3-х дней; при этом у животных образовались эрозивно-язвенные поражения желудка и кишечника, которые самостоятельно восстанавливались через 20 дней после последнего введения препарата.
Препарат "Полифлор-1" вводили внутрижелудочно (в/ж) в дозе 50 мг/кг в виде свежеприготовленной взвеси в дистиллированной воде из содержимого капсул. В процессе эксперимента сопоставляли динамику массы тела животных, картину клинического течения, подсчет среднего числа деструктивных участков желудочно-кишечного тракта, морфологические данные.
Эксперименты проводись на крысах-самцах средним весом 220 г. Всего в эксперименте было использовано 100 животных, разделенных на 5 групп:
1 группа - интактные - 20;
2 группа - резерпиновая язва без лечения - 20;
3 группа - язва + лечение Полифлор-1+L. acidophilus В-75 - 20;
4 группа - язва + лечение L.acidophilus В-75 - 20;
5 группа - язва + лечение Полифлором - 20.
Результаты исследований представлены в таблице 4.
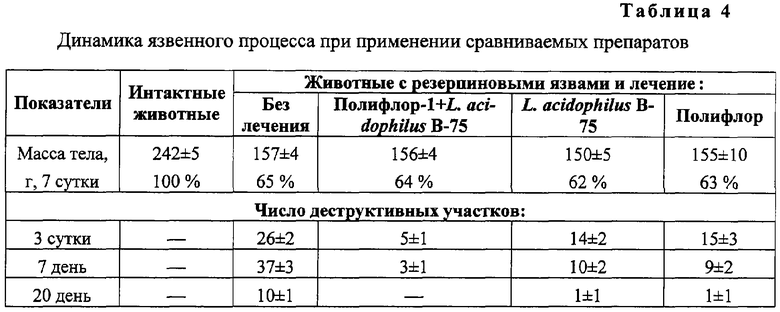
Животные, у которых резерпином был вызван язвенный процесс, становились вялыми, малоподвижными, отказывались от пищи. Масса их прогрессивно падала и к 7 суткам опыта составляла лишь 65% от массы тела интактных животных.
При макроскопическом исследовании слизистой оболочки желудочно-кишечного тракта на 3 сутки опыта отмечались гиперемия, иногда синюшность, отек и нарушение нормального расположения желудочных складок и кишечных крипт. Язвенные дефекты круглой и овальной формы располагались в железистой части по верхушкам складок или бороздах между ними. Поверхность их покрыта серовато-желтым налетом или свернувшейся кровью, отчего они имели вид черных точек различной величины. Число деструктивных участков, приходящихся на одно животное, равнялось на 3 сутки 26±2.
Наиболее значительные нарушения слизистой оболочки наблюдались на 7 день: слизистая гиперемирована, покрыта сгустками крови, складки ее сглажены; на железистой части - язвенные дефекты диаметром от 2 до 5 мм, число которых в среднем равнялось 37±3. Гистологическое исследование желудочной стенки трех погибших крыс выявило глубокие дефекты и обширный некроз слизистой.
К 20 суткам у трети крыс отмечалось полное восстановление дефектов; у остальных же слизистая оболочка все еще была гиперемирована, иногда отечна, покрыта эрозиями и язвами диаметром 1 мм. Среднее число деструктивных участков составляло 10±2.
При лечении резерпиновых язв L.acidophilus B-75 средняя масса крыс была наиболее низкой (150±5 г) на 7 сутки лечения, однако через 20 дней прибавка массы была на 15% выше, чем у животных с резерпиновыми язвами без лечения.
Макроскопическое исследование выявило, что язвенно-деструктивные поражения слизистой локализовались в железистой части желудка и по ходу кишечника. По характеру они были одинаковы, но резко отличались по степени выраженности поражений: среднее число деструкции на 3 сутки равнялось 14±2. К 7 суткам число деструкций, приходящихся на 1 животное, равнялось 10±2. Однако, несмотря на резкое уменьшение числа язвенных поражений, ускорения заживления язв не наступало. На 20 сутки у половины животных слизистая оставалась гиперемированной и имелось по 1-2 изъязвления.
Назначение комплексного лечения Полифлор-1+L.acidophilus B-75 значительно улучшало общее состояние животных: крысы охотно поедали корм, шерсть их оставалась ровной, блестящей, не выпадала. Масса прогрессивно нарастала и на 20 сутки опыта была на 30% выше, чем у нелеченых животных.
Макроскопически на 3 и 7 сутки лечения слизистая желудочно-кишечного тракта имела характерные повреждения, возникающие после 3-дневного внутрибрюшинного введения резерпина. Но следует отметить уменьшение тяжести поражения: число деструктивных участков на 3 сутки равнялось 5±1 и на 7 сутки 3±1. Сохранялась гиперемия слизистой; у части крыс даже при внешнем осмотре отмечалось наличие слизи на желудочных складках. К 10 суткам у большинства крыс слизистая желудка не имела видимых деструктивных поражений, но у некоторых на фоне гиперемии слизистой встречались поверхностные язвы.
При лечении резерпиновых язв Полифлором средняя масса крыс составляла 155±10 г на 7 сутки лечения. Через 20 дней прибавка массы была на 20% выше, чем у животных с резерпиновыми язвами без лечения.
Макроскопическое исследование выявило, что язвенно-деструктивные поражения слизистой локализовались в железистой части желудка и по ходу кишечника. По характеру они были одинаковы, но отличались по степени выраженности поражений: среднее число деструкций на 3 сутки равнялось 15±3. К 7 суткам число деструкций, приходящихся на 1 животное, равнялось 9±2. Несмотря на резкое уменьшение числа язвенных поражений, заживление язв проходило медленнее, чем при комплексном лечении. На 20 сутки у трети животных слизистая оставалась несколько гиперемированной и на ней имелось по 1-2 изъязвления.
Таким образом, наиболее эффективным при лечении язвенных поражений желудочно-кишечного тракта оказался комплексный препарат Полифлор-1+Lactobacillus acidophilus B-75. Полифлор-1 индивидуально был менее активным, а наименьшую активность проявил препарат бактерий Lactobacillus acidophilus B-75.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ СОЧЕТАННЫМ НОРМАЛИЗУЮЩИМ ВОЗДЕЙСТВИЕМ НА ИММУННУЮ И ПИЩЕВАРИТЕЛЬНУЮ СИСТЕМЫ ОРГАНИЗМА | 2015 |
|
RU2611377C2 |
| СТИМУЛЯТОР РОСТА БАКТЕРИАЛЬНОЙ КУЛЬТУРЫ | 1993 |
|
RU2090612C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГАСТРОЗАЩИТНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2432957C2 |
| БИОЛОГИЧЕСКИ АКТИВНЫЙ ПРЕПАРАТ ДЛЯ КОРРЕКЦИИ НАРУШЕНИЙ МИКРОФЛОРЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА И ПОВЫШЕНИЯ ОБЩЕЙ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА | 2003 |
|
RU2246958C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО АНТИЯЗВЕННОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2302253C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ПОДРОСТКОВ ПНЕВМОНИЕЙ | 2009 |
|
RU2414928C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ ЭРОЗИВНЫХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2001 |
|
RU2197266C1 |
| МЕСТНОЕ АНТИМИКРОБНОЕ СРЕДСТВО | 2007 |
|
RU2336877C1 |
| ПЕРОРАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2010 |
|
RU2445965C2 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ ЖИЗНЕДЕЯТЕЛЬНОСТЬ БАКТЕРИЙ Escherichia coli O75 №5557 (ВАРИАНТЫ) | 2012 |
|
RU2524138C2 |
Изобретение относится к биотехнологии и медицине и может быть использовано в прикладной биотехнологии, ветеринарии и смежных отраслях. Стимулятор роста микроорганизмов «Полифлор» на основе водорастворимых солей щелочных и щелочно-земельных металлов или аммония и монокарбоновых аминокислот содержит, % масс: ацетат-анион - 45-65; формиат-анион - 1-10; лактат-анион - 1-20; сукцинат-анион - 3-36; глутамат-анион - 3-18; аспартат-анион - 0,1-1; монокарбоновые аминокислоты - остальное. Препарат вводят в культуру в дозе 10-500 мкг/мл. «Полифлор» при введении его в желудочно-кишечный тракт (ЖКТ) стимулирует рост индигенных кишечных палочек, бифидобактерий и лактобацилл при одновременной минимизации стимулирующего воздействия на патогенные микроорганизмы, что позволяет вытеснять их из микрофлоры организма за счет конкуренции с полезными для ЖКТ бактериями. «Полифлор» может использоваться как самостоятельно в дозе 1-100 мг на кг веса пациента, так и совместно с препаратом, содержащим живые культуры микроорганизмов. Изобретение эффективно для нормализации микробиоценоза человека или животных при одновременной минимизации стимулирующего воздействия на патогенные микроорганизмы. 2 н. и 2 з.п. ф-лы, 4 табл.
| СТИМУЛЯТОР РОСТА КЛЕТОК БАКТЕРИЙ ESCHERICHIA COLI | 2000 |
|
RU2233875C2 |
| Способ получения аутоактиватора роста для культивирования ЕSснеRIснIа coLI | 1988 |
|
SU1638156A1 |
| Стимулятор роста микроорганизмов | 1981 |
|
SU1010124A1 |
| СОСТАВ ДЛЯ ИЗГОТОВЛЕНИЯ ЖЕВАТЕЛЬНЫХ КОНФЕТ | 2001 |
|
RU2202218C2 |
| ИВАНОВА Н.Г | |||
| и др | |||
| Аминовит - многокомпонентный препарат для конструирования продуктов функционального питания. | |||
Авторы
Даты
2007-01-10—Публикация
2005-03-24—Подача