Изобретение относится к биологии и медицине, а именно к способам определения фагоцитарной активности нейтрофилов периферической крови человека.
В клинической практике и экспериментальных исследованиях необходимо знать, какие клетки и в какой степени определяют процессы фагоцитоза. Фракционирование нейтрофилов периферической крови с последующей оценкой их фагоцитарной активности позволяют определить функциональную активность этих клеток. Известно, что в ряде случаев снижение нейтрофильного фагоцитоза тесно ассоциировано с врожденной патологией, приводящей к незавершенному фагоцитозу и персистенции патогенов (Исследование системы крови в клинической практике / Под ред. Г.И.Козинца и В.А. Макарова. - М.: Триада-Х, - 1997. - 480 с). В экспериментальных исследованиях благодаря фракционированию можно идентифицировать специфические регуляторы нейтрофилов и наведенную активность со стороны других лейкоцитов периферической крови. К настоящему времени разработано множество методов оценки фагоцитарной активности лейкоцитов, среди которых наибольшее распространение получили тесты, основанные на регистрации поглощения объектов фагоцитоза. Результаты поглощения объектов фагоцитирующими клетками можно учитывать микроскопически, в частности поглощение формалинизированных эритроцитов барана фагоцитами крови (Каплин В.Н. Нетрадиционная иммунология инфекции, Пермь: Изд.-во Пермской государственной медицинской академии, 1996. 163 с.), или латексных частиц (Selvaraj R.J., Sbarra A.J., Thamas G.B. et al. A Microtechnique for studying chemiluminescence response of phagocytes using whole blood and its application to the evaluation of phagocytes in pregnancy // Journal of the reticuloendothelial society V.31., p.3-16, 1982). Кроме того, с помощью витальных красителей методом проточной цитофлуориметрии оценивается внутриклеточный киллинг дрожжей (Martin E., Bhakdi S. Flow cytometric assay for quantifying opsonophagocytosis and killing of Staphylococcus aureus by peripheral blood leukocytes // J Clin Microbiol., 1992, V.9, P.2246-2255) стафилококка (Nielsen S.L., Black F.T., Storgaard M., Obel N. Evaluation of a method for measurement of intracellular killing of Staphylococcus aureus in human neutrophil granulocytes // APMIS. 1995, V.6, P.460-468; Мазуров Д.В., Дамбаева С. В., Пинегин Б.В. Оценка внутриклеточного Киллинга фагоцитами периферической крови с помощью проточной цитометрии // Иммунология, 2000, №2, С.7-5 9) и других микроорганизмов. Известен метод оценки поглощения бактерий и по включению радиоизотопных меток (Verhoef J., Peterson P.K., Quie P.G. Kinetics of staphylococcal opsonization, attachment, ingestion and killing by human polymorphonuclear leukocytes; a quantitative assay using [3H]thymidine labeled bacteria // J Immunol Methods. 1977; V.3-4, P.303-311.). Недостатком микроскопического метода является трудоемкость, и в ряде случаев - субъективность подсчета, особенно если в качестве объектов фагоцитоза используются отдельные микроорганизмы или частицы латекса. К недостаткам микроскопической оценки фагоцитоза по поглощению латексных частиц или формалинизированных эритроцитов барана является невозможность оценки завершенности фагоцитоза, то есть внутриклеточной деструкции захваченных объектов. Кроме того, существенным ограничением в применении радиоизотопного и цитофлуориметрического методов является высокая стоимость аппаратуры и расходных материалов.
В то же время изучение феномена бактериальной люминесценции в последние десятилетия стало одним из интенсивно разрабатываемых направлений в микробиологии (Roda A., Guardigli M., Michelini E., et al. The possibility of detecting a few molecules using bioluxinescence and chemiluxinescence is exciting, especially in the context of miniaturized analytical devices. // Anal. Chem, 2003. P.462-470.). Разработана серия бактериальных тест-систем под общим названием "Эколюм", представленная не только природными и генно-инженерными конструкциями с генами свечения морских светящихся бактерий, но и рекомбинантным штаммом Е.coli, несущим lux-регулон почвенной люминесцирующей бактерии V.fischeri («Эколюм-5») (Данилов B.C., Егоров Н.С.Бактериальная биолюминесценция. М.: Изд-во МГУ, 1985. 298 с.; Данилов B.C., Зарубина А.П., Ерошников Г.Е. и др. Сенсорные биолюминесцентные системы на основе lux-оперонов разных видов люминесцентных бактерий // Вестник МГУ, 2002. №3. С.20-24.). В то же время клонирование различных lux-оперонов в микроорганизмах вида Е.coli, проявляющих свойства как комменсалов (в толстом кишечнике человека и млекопитающих), так и потенциальных патогенов (при переходе через эндоэкологические барьеры), создало условия для формирования принципиально нового направления использования биолюминесцентного анализа в биологии и медицине - тестирования различных биологических жидкостей и биосред макроорганизма. Однако ранее не применялась оценка фагоцитарной активности нейтрофилов периферической крови с использованием бактериальной люминесценции.
В качестве прототипа нами выбран метод определения фагоцитарной активности нейтрофилов периферической крови, основанный на поглощении объектов фагоцитоза, в качестве которых выступают стафилококки штамма 209 (Лабораторные методы исследования в клинике: Справочник / Меньшиков В.В., Делекторская Л.Н., Золотницкая Р.П. и др.; Под ред. В.В.Меньшикова. - М.: Медицина, 1987. - С.310-311.). Методика способа-аналога не предусматривает оценку завершенности фагоцитоза бактерий, кроме того отсутствует возможность оценки динамики процесса. Показатели фагоцитарной активности лейкоцитарной взвеси не в полной мере отражают функционирования нейтрофилов как фагоцитирующих клеток, т.к. фракционирование нейтрофилов методикой способа-аналога не предусмотрено.
Цель изобретения - совершенствование способа определения фагоцитарной активности нейтрофилов.
Указанная цель достигается путем использования в качестве объектов фагоцитоза бактерий генно-инженерного штамма E.coli lux, обладающих способностью к биолюминесценции и являющихся одновременно комменсалами и потенциальными патогенами.
Способ осуществляется следующим образом.
Оборудование: биолюминометр, например «Биотокс-6» (область спектральной чувствительности 300-800 нм; область максимальной чувствительности 440-490 нм; динамический диапазон измерения светового потока 106-109 квант/сек; диапазон времени измерения реакции 4 сек). Термостат, центрифуга.
Реактивы: фиколл-верографин (ρ 1,077 и ρ 1,112) («Sigma», США; «Спофа», Чехия, соответственно), физиологический раствор (стерильный), дистиллированная вода (стерильная), лиофилизированный штамм E.coli lux+.
Цельную кровь в количестве 2-4 мл забирали из локтевой вены в стерильную пробирку, содержащую гепарин (50 Ед/мл), и тщательно ресуспендировали. В пластиковую пробирку было внесено по 3 мл раствора низкой плотности фиколл-верографина (ρ 1,077 г/мл), затем подслаивалось 3 мл раствора высокой плотности (ρ 1,112 г/мл). Кровь, разбавленная в 2-3 раза физиологическим раствором, наслаивалась на фиколл-верографин и помещалась в центрифугу на 40 мин при 1700 об/мин. Нейтрофилы собирали с нижней интерфазы. Выделенные клетки помещали в пластиковую центрифужную пробирку и дважды отмывали физиологическим раствором. Концентрацию нейтрофилов доводили до 5×106/мл.
Для оценки фагоцитарной активности в качестве объектов фагоцитоза использовали лиофилизированную культуру люминесцентных бактерий генно-инженерного штамма E.coli lux+. Одну ампулу препарата разводили в 1 мл холодной дистиллированной воды, выдерживали 1 час при 4°С, после чего доводили физиологическим раствором до 50 мл, получая рабочую концентрацию бактерий 5×106/мл.
Суспензию нейтрофилов в количестве 100 мкл смешивали с 1000 мкл разведенной культуры (5×106/мл) E.coli lux+, тщательно ресуспендировали, затем измеряли биолюминесценцию на 0, 10, 30 и 60 минутах инкубации при 37°С. Измерения биолюминесценции проводили на приборе "Биотокс-6". Исследование проб проводили в соответствии с методическими рекомендациями "Методика экспрессного определения токсичности воды с помощью люминесцентного бактериального теста "Эколюм"", утвержденными руководителем Департамента Госсанэпиднадзора Минздрава России А.А.Монисовым 08.06.2000 МР №11 1/133-09, сертифицированными Государственным комитетом Российской Федерации по стандартизации и метрологии, Свидетельство №01.19.231/2001.
Пример
Предлагаемым способом была измерена фагоцитарная активность нейтрофилов человека по уровню гашения биолюминесценции. Готовый раствор сенсора (рабочая концентрация бактерий E.coli lux+ 5×106/мл) смешивали с суспензией фракционированных нейтрофилов (5×106/мл), содержащей 25% аутоплазмы, в соотношении 10:1, тщательно ресуспендировали, после чего измеряли биолюминесценцию на 0, 10, 30 и 60 минутах инкубации при 37°С. Параллельно проводились высевы культуры E.coli lux+ на среду Эндо (селективная среда для энтеробактерий) в те же временные периоды контакта бактерий с лейкоцитами цельной крови, после чего спустя сутки под кварцевой лампой оценивали количество жизнеспособных клеток по числу колониеобразующих единиц (КОЭ).
Как видно из фиг.1, нейтрофилы периферической крови на протяжении всего срока наблюдения почти полностью (от 100% до 20%) подавляли биолюминесценцию E.coli lux+, и это проявлялась уже на 10 мин инкубации. Показано, что гашение биолюминесценции опережает снижение числа жизнеспособных клеток (КОЭ) в динамике эксперимента. Возможно, это связано с особенностями адгезии и поглощения бактерий нейтрофилами. Гашение биолюминесценции и снижение числа КОЕ в посевах обусловлено процессом фагоцитирования E.coli lux+ нейтрофилами крови.
Важно отметить, что биолюминесценция E.coli lux+ в отсутствие клеток крови снижалась весьма незначительно в сравнении с экспериментальными пробами, в то время как число КОЭ оставалось неизменным (табл.1).
Изменение активности биолюминесценции и числа живых клеток E.coli lux+ (КОЭ) при разных сроках контакта с моноцитами крови
Для оптимального выражения результатов исследования можно применять расчет индекса антагонистической активности (ИАА), отражающий процент гашения биолюминесценции в сравнении с исходным уровнем. Таким образом, ИАА=100×(X1-X1)/X1, где X1 - интенсивность биолюминесценции контрольной пробы, Х2 - опытной пробы. Установлено, что ИАА значительно увеличивается в динамике эксперимента, достигая после часовой инкубации значения 91,6 (табл.1). Для оценки фагоцитарной активности нейтрофилов можно применять как ИАА, так и рассчитывать процент гашения биолюминесценции в пробах в динамике в сравнении с началом измерения (0 мин). Для клинических исследований преимущественное значение имеет ИАА, в то время как для научных исследований помимо ИАА представляется важным отследить динамику гашения люминесценции.
Параллельно для сравнения полученных результатов оценивали фагоцитарную активность нейтрофилов по поглощению объектов фагоцитоза (частицы латекса; 1,5 мкм «ДиаМ», Россия). Для этого в капроновых пробирках смешивали 100 мкл трижды отмытых в физиологическом растворе объектов фагоцитоза (концентрация 107/мл), и 100 мкл суспензии фракционированных нейтрофилов (106/мл). Пробы инкубировали 20 мин при 37°С. Затем содержимое пробирок ресуспендировали и готовили мазки, которые фиксировали метанолом и окрашивали по Романовскому-Гимзе. Рассчитывали следующие показатели:
1) Процент фагоцитоза - т.е. количество клеток, захвативших 1 и более объектов фагоцитоза из 100 подсчитанных фагоцитов. Такие клетки в дальнейшем именуются «истинными фагоцитами».
2) Фагоцитарное число - количество объектов фагоцитоза, которое в среднем приходится на 1 из 100 подсчитанных фагоцитов.
3) Фагоцитарный индекс - количество объектов фагоцитоза, которое приходится на один «истинный» фагоцит.
Фагоцитарная активность нейтрофилов существенно повышалась в динамике наблюдения, причем повышалось как число «истинных» фагоцитов, так и их поглотительная активность (табл.2).
Изменение фагоцитарной активности лейкоцитов крови в отношении Е.coli lux+ при разных сроках контакта с нейтрофилами крови
(100%)
(100%)
(100%)
(142,8%)
(154,3%)
(108,1%)
(166,3%)
(200,8%)
(118,9%)
Таким образом, чем выше степень фагоцитарной активности нейтрофилов, тем выше степень снижения биолюминесценции и ниже количество КОЭ. Степень гашения биолюминесценции E.coli lux+ в присутствии клеток крови является маркером фагоцитарной активности нейтрофилов и позволяет дифференцировать как снижение, так и повышение фагоцитарной активности клеток. Метод можно использовать в научных и клинических исследованиях, так как изучение фагоцитарной активности моноцитов имеет большое значение в комплексном анализе диагностики различных иммунодефицитных состояний. Приведенные примеры исследований убедительно подтверждают существенные преимущества заявляемого способа в сравнении с прототипом. Заявляемый способ отличается более высокой объективностью, лишен субъективности и трудоемкости микроскопического метода и позволяет оценивать степень завершенности фагоцитоза.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОХЕМИЛЮМИНЕСЦЕНТНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ | 2007 |
|
RU2366953C2 |
| СПОСОБ ОЦЕНКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ | 2023 |
|
RU2824345C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ ПРИ ПОМОЩИ МИКРОБИОЛОГИЧЕСКОГО ПОДХОДА | 2019 |
|
RU2727880C1 |
| Способ определения тактики лечения хронического рецидивирующего бактериального простатита | 2020 |
|
RU2723997C1 |
| Способ сортировки фагоцитирующих клеток | 2024 |
|
RU2835814C1 |
| Способ анализа эффективности фагоцитоза | 2023 |
|
RU2831297C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВАЦИИ ФАГОЦИТИРУЮЩИХ КЛЕТОК | 2010 |
|
RU2428474C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФАГОЦИТОВ ПРИ АЛЛЕРГИИ | 2002 |
|
RU2225984C1 |
| СПОСОБ ОЦЕНКИ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ ИММУННЫХ ПРЕПАРАТОВ | 2005 |
|
RU2291425C1 |
| СРЕДСТВО ГУМИНОВОЙ ПРИРОДЫ, УСИЛИВАЮЩЕЕ ФАГОЦИТИРУЮЩУЮ АКТИВНОСТЬ КЛЕТОК | 2023 |
|
RU2834961C1 |
Изобретение относится к области лабораторной диагностики и может быть использовано для определения фагоцитарной активности нейтрофилов периферической крови человека. Сущность способа состоит в том, что определение фагоцитарной активности нейтрофилов периферической крови человека основано на поглощении объектов фагоцитоза, в качестве которых используется культура люминесцентных бактерий генно-инженерного штамма E.coli lux+. Данные бактерии обладают способностью к биолюминесценции, которая фиксируется при помощи биолюминометра и в процессе их поглощения нейтрофилами периферической крови человека значительно снижается. Техническим результатом является разработка более точного способа определения фагоцитарной активности нейтрофилов. 2 табл., 1 ил.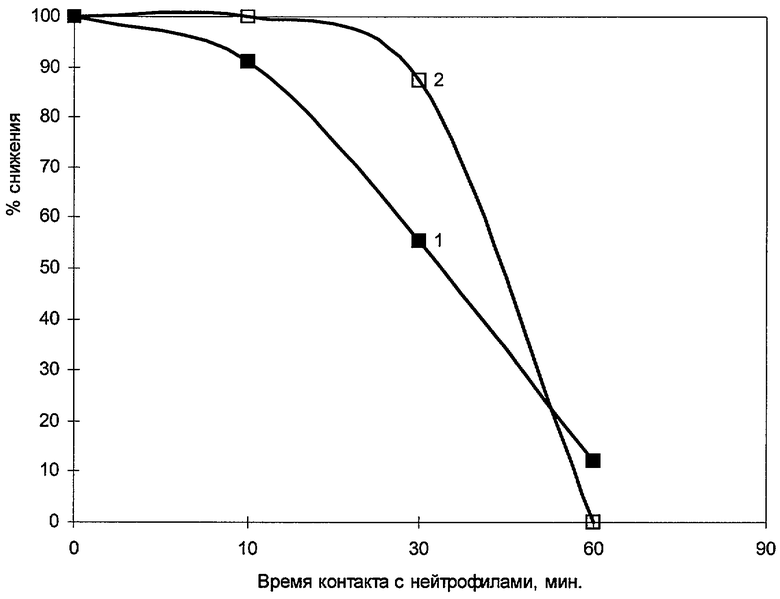
Способ определения фагоцитарной активности нейтрофилов крови, отличающийся тем, что в качестве фагоцитируемого объекта используют лиофилизированную культуру люминесцентных бактерий генно-инженерного штамма Е.coli lux+, разводят холодной дистиллированной водой, выдерживают 1 ч при 4°С, затем разводят физиологическим раствором до концентрации бактерий 5×10 /мл, смешивают с суспензией нейтрофилов в концентрации 5×106/мл, фракционированных на двойном градиенте фиколл-верографина с ρ 1,077 и 1,113, содержащей 25% аутоплазмы, в соотношении 10:1, тщательно ресуспендируют, инкубируют при 37°С, измеряют биолюминисценцию на 0, 10, 30 и 60 мин инкубации и фагоцитарную активность нейтрофилов (ФА) определяют по проценту гашения биолюминесценции по сравнению с исходным уровнем по формуле
ФА=100×(X1-X2)/X1,
где X1 - интенсивность биолюминесценции контрольной пробы;
Х2 - интенсивность биолюминесценции опытной пробы.
| Лабораторные методы исследования в клинике, под ред | |||
| В.В.Меньшикова, Москва, «Медицина», 1987, с.310-311 | |||
| ВЛАДИМИРОВ Ю.А | |||
| "Активированная хемилюминесценция и биолюминесценция как инструмент в медико-биологических исследованиях", Соросовский образовательный журнал, 2001, т.7, №1, с.16-23 | |||
| HAMERS M.N | |||
| et al | |||
| "Kinetics and mechanism of the |
Авторы
Даты
2007-01-27—Публикация
2005-06-10—Подача