Изобретение относится к области биологии, медицины, а именно к клеточной биологии, иммунологии, и может быть использовано для оценки исходного состояния фагоцитирующих клеток (нейтрофилы, моноциты, макрофаги) по способности к активации в норме и при патологии.
Известны способы определения активации фагоцитирующих клеток (фагоцитов) по изменению метаболического сдвига в клетках при поглощении фагоцитируемого объекта с участием ферментных систем и неферментных - лизосомальных катионных белков (Кожемякин Л.А. и др. Оценка иммунного статуса организма в лечебных учреждениях СА и ВМФ. Методическое пособие / Л.А.Кожемякин, А.М.Королюк, В.Г.Морозов, В.Х.Хавинсон, И.Г.Бондаренко. - Ленинград. - 1987. - 62 с.; Хаитов P.M., Пинегин Б.В. Оценка основных этапов фагоцитарного процесса: современные подходы и перспективы исследований // Иммунология. - 1995. - №4. - С.3-9). Широко применяемыми являются тест восстановления нитросинего тетразолия (НСТ-тест) и лизосомно-катионный тест, основанные на исследовании соответственно кислородозависимого и кислородонезависимого механизма активации фагоцитирующих клеток (нейтрофилов, моноцитов, макрофагов).
Известные способы предполагают этапы выделения фагоцитирующих клеток, их взаимодействие с фагоцитируемыми объектами (зимозан, бактерии), дифференциальную гистохимическую окраску, учет результата и расчет показателей активации.
Лизосомно-катионный тест (ЛКТ), характеризующий степень активности кислородонезависимых микробицидных систем фагоцита, заключается в изготовлении мазка крови, красного костного мозга, отпечатка из воспаленной ткани на обезжиренном стерильном предметном стекле, высушивании на воздухе. Мазки, отпечатки фиксируют в смеси формалина с этиловым спиртом (погружают препарат на 15-20 сек в смесь 1 части формалина и 19 частей 96% спирта). Окрашивают в течение 20 мин в забуференном спиртовом растворе прочного зеленого с рН 8,1-8,2. Окрашенные мазки сразу ополаскивают дистиллированной водой, докрашивают в течение 15-20 сек 0,25% водным раствором азура, а смывают дистиллированной водой, высушивают, учитывают результат микроскопированием. При этом просматривают 100 гранулоцитов (нейтрофилов). Внутриклеточное содержание катионных белков крови оценивается полуколичественно по величине среднего цитохимического коэффициента (СЦК), вычисляемого по формуле:
 ,
,
где а-е - количество однотипных клеток с определенной степенью окрашиваемости цитоплазмы прочным зеленым, а цифры показывают степень выраженности и интенсивности окрашивания;
0 - отсутствие окраски цитоплазмы и лизосомальных гранул;
0,5 - наличие в цитоплазме единичных окрашенных гранул;
1 - половина цитоплазмы заполнена светлоокрашенными гранулами;
1,5 - цитоплазма равномерно заполнена гранулами, окрашенными в светло-зеленый цвет (встречаются единичные темно-зеленые гранулы);
2 - цитоплазма содержит 1/3 темно-зеленых гранул;
3 - при содержании их в 2/3 цитоплазмы.
В норме у взрослого человека СЦК равен 1,5-1,7, у детей - около 1,9.
В лизосомно-катионном тесте полуколичественно оценивается состояние микробицидной системы фагоцита, определяющей кислородонезависимое изменение их активности по лизосомным катионным белкам под воздействием микроорганизмов (бактерий).
В качестве прототипа взят наиболее близкий способ изучения активации фагоцитирующих клеток - НСТ-тест, предложенный М.Е.Виксман и А.Н.Маянским в 1979 г., усовершенствованный и широко внедренный в практическое здравоохранение (Кожемякин Л.А. и др. Оценка иммунного статуса организма в лечебных учреждениях СА и ВМФ. Методическое пособие / Л.А.Кожемякин, А.М.Королюк, В.Г.Морозов, В.Х.Хавинсон, И.Г.Бондаренко. - Ленинград. - 1987. - 62 с.). В его основе лежит оценка активации по дыхательному или респираторному взрыву за счет усиления потребления O2 в реакции, катализируемой никотинамиддинуклеотидфосфат ·Н-оксидазой (НАДФ·Н-оксидаза).
Для его выполнения в две агглютинационные пробирки вносят по 0,05 мл капиллярной крови, затем в одну из них добавляют 0,025 мл изотонического фосфатного буфера, в другую - 0,025 мл суспензии зимозана. После этого в пробирки вносят по 0,025 мл 0,15% раствора НСТ (раствор нитросинего тетразолия в 0,1 М изотоническом фосфатном буфере с рН 7,2). Содержимое пробирок осторожно перемешивают и инкубируют на водяной бане при температуре 37°C в течение 30 мин, перемешивая каждые 10 мин. После инкубации содержимое пробирок перемешивают, наносят по одной капле на тщательно вымытые и обезжиренные смесью Никифорова предметные стекла, делают мазки и высушивают на воздухе. Готовые мазки фиксируют метанолом 10 мин, высушивают, окрашивают 2% водным раствором метилового зеленого в течение 20 мин, промывают, высушивают и микроскопируют. В каждом мазке подсчитывают 100 нейтрофилов, среди которых процент клеток, содержащих отложения диформазана (НСТ-позитивные нейтрофилы). Далее рассчитывают индекс активации нейтрофилов (ИАН) по формуле:
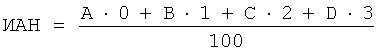 ,
,
где А - количество клеток, не содержащих диформозановых отложений или содержащих их в виде пылевидных немногочисленных включений;
В - количество клеток, в которых площадь отложений диформазана не превышает 1/3 площади ядра;
С - количество клеток, в которых названные отложения занимают от 1/3 до всей величины площади ядра;
D - количество клеток с диформазановыми отложениями, по площади превосходящими площадь ядра.
Величина ИАН колеблется в пределах 0,1-0,15 в базальных условиях и 0,5-1,5 при стимуляции нейтрофилов.
Известные способы предполагают определение активации фагоцитирующих клеток по изменению метаболического сдвига в клетках при поглощении фагоцитируемого объекта с участием ферментных систем (никотинамиддинуклеотидфосфат·Н-оксидаза - НАДФ·Н-оксидаза) и неферментных - лизосомальных катионных белков - основаны на исследовании соответственно кислородозависимого (НСТ-тест) и кислородонезависимого (лизосомно-катионный тест) механизма активации фагоцитирующих клеток (нейтрофилов моноцитов, макрофагов).
Известные способы позволяют оценивать только срочный механизм активации фагоцитирующих клеток при поглощении объекта. Оценивается активация в основном нейтрофилов в связи с тем, что у моноцитов и макрофагов этот механизм в 3 раза менее выражен (Roos D., Reiss М., Balm A.I. е.а. A metabolic comparison between human blood monocytes and neutrophils. - In: Macrophages and lymphocytes. New-York, 1980, p.29-36). Оба способа весьма трудоемки, являются полуколичественными, используются для изучения срочного механизма активации в основном нейтрофилов - одной из популяций фагоцитирующих клеток и ограниченно - моноцитов и макрофагов.
Задача предлагаемого изобретения - разработать эффективный способ количественной оценки активации фагоцитирующих клеток и расширить возможность оценки за счет изучения не только срочной, но и долгосрочной активации как нейтрофилов - одной из популяций фагоцитов, так и моноцитов (макрофагов крови) у здоровых и больных людей.
Технический результат - повышение точности оценки активации фагоцитирующих клеток за счет использования в качестве критерия активации количественной оценки синтеза клеточного лизоцима во времени и при активации клеток зимозаном, а также расширение возможности способа оценки активации фагоцитирующих клеток за счет изучения срочного и долгосрочного механизма активации как нейтрофилов, так и моноцитов (макрофагов крови).
Указанный технический результат достигается тем, что в способе определения активации фагоцитирующих клеток, включающем выделение клеток, взаимодействие с зимозаном, оценку активации по ферментативной активности клеток, в качестве критерия активации фагоцитирующих клеток используют нарастание синтеза клеточного лизоцима; где к выделенным клеткам нейтрофилов или моноцитов добавляют среду 199 с 0,5% L-глутамина и 2,5% смешанной человеческой сывороткой, прогретой в течение 30 мин при 52°C, содержащую 0,01% частиц зимозана (Z) и не содержащую частицы зимозана - равное количество клеточных проб, затем все указанные выше клеточные пробы делят на три равные части, одну третью часть из них с зимозаном и без зимозана замораживают, две другие равные части клеточных проб поровну с зимозаном и без зимозана культивируют при температуре 37°C, причем одну третью часть проб - в течение от 4 до 6 часов и замораживают, а другую - от 18 до 24 часов, далее все клеточные пробы последовательно и многократно (трех-четырехкратно) замораживают при температуре до -10°C и размораживают при комнатной температуре для полного выделения внутриклеточного лизоцима, определяют количество лизоцима (L) микрометодом, затем рассчитывают синтезированный лизоцим (L синт.) и проводят расчет показателя активации фагоцитов (ПАФ) по формуле:
ПАФ=Lсинт с Z - Lсинт без Z,
где Lсинт с Z (L синтезированный при воздействии зимозана (Z)) - разница количества лизоцима в культивированных клетках с частицами зимозана и количества лизоцима в некультивированных клетках с частицами зимозана, определяемого после 3-4-кратного замораживания-оттаивания, в мкг/мл;
Lсинт без Z (Lсинтезированный без зимозана) - разница количества лизоцима в культивированных клетках без частиц зимозана и количества лизоцима в некультивированных клетках без частиц зимозана, определяемого после 3-4-кратного замораживания-оттаивания, в мкг/мл;
при этом показатель активации фагоцитов для оценки срочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 4 до 6 часов, а показатель активации фагоцитов для оценки долгосрочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 18 до 24 часов.
Указанные условия культивирования не нарушают жизнеспособность клеток, что было проверенно экспериментально.
Предлагаемый способ в отличие от прототипа имеет следующие преимущества:
1. Использование количественной оценки разницы синтеза клеточного лизоцима (L), который является конститутивным ферментом лизосом фагоцитирующих клеток - нейтрофилов, моноцитов и макрофагов, до и после 4-6 часов (срочный механизм) и 18-24 часов (долгосрочный механизм) культивирования фагоцитирующих клеток крови в культуральной среде (среде 199 с 0,5% L-глутамина и 2,5% смешанной человеческой сывороткой, прогретой в течение 30 мин при 52°C) без частиц зимозана и с 0,01% частицами зимозана (Z)
2. В качестве критерия активации предлагается использовать лизосомный фермент лизоцим: оценивается нарастание его внутриклеточного количества в фагоцитирующих клетках за счет происходящего усиления синтеза при активации под воздействием частиц зимозана (Шаронов А.С. Фагоциты, лизосомы, мембраны. - Владивосток, изд-во Дальнаука. - 2007. - 127 с.). Лизоцим является маркерным ферментом лизосом и лизосомных мембран наряду с кислой фосфатазой и катепсином Д (Покровский А.А., Тутельян В.А. Лизосомы. - М.: Наука, 1976. - 382 с.). Лизоцим наиболее активно синтезируется фагоцитирующими клетками и входит в состав как первичных, так и вторичных лизосом (Фрейдлин И.С. Система мононуклеарных фагоцитов. - М.: Медицина, 1984. - 272 с.; Ройт А. Основы иммунологии. - М.: Мир, 1991. - 327 с.). Лизоцим обладает широким спектром регуляторного и эффекторного действия, что является важным проявлением активированных фагоцитов (Шаронов А.С. Фагоциты, лизосомы, мембраны. - Владивосток, изд-во Дальнаука. - 2007. - 127 с.).
3. Для расчета концентрации лизоцима, выражающейся в мкг/мл и расчета ПАФ в мкг/мл, авторами разработана таблица-программа, позволяющая производить компьютерную оценку результата, что также повышает точность способа и делает его удобным и доступным в применении.
4. Использование в качестве фагоцитирующих клеток как нейтрофилов, так и моноцитов (макрофаги крови), являющихся основными клетками-продуцентами лизоцима, и определение нарастания синтеза клеточного лизоцима через 4-6 и 18-24 часа для количественной оценки срочного и долгосрочного механизма активации фагоцитирующих клеток под воздействием частиц зимозана, что расширяет возможности способа.
Способ осуществляется следующим образом.
Пример 1. Выделение мононуклеаров крови (лимфоциты и моноциты) производят в градиенте плотности фиколл-верографина по A.Boyum (1968) в описании А.Н.Чередеева (Чередеев А.Н. Количественная и функциональная оценка Т и В систем иммунитета у человека // Общие вопросы патологии. Итоги науки и техники. - М.: ВИНИТИ, 1976. - Т.4. - с.124-160) с дополнительным введением в градиентный раствор с ЭДТА-Na до 0,18%.
Выделенное кольцо мононуклеаров крови отсасывают пипеткой с нижним слоем плазмы крови и частью градиентного раствора переносят в чистую пробирку и средой 199 концентрацию ЭДТА-Na доводят до 0,056% путем смешивания 1 части полученной клеточной взвеси и 2,2 частей среды 199. В 18 плоскодонных 2 мл флаконов вносят по 0,25 мл разведенной клеточной взвеси (концентрация 2×106 кл/мл) и производят прикрепление клеток к стеклу в течение 60 мин при комнатной температуре, после чего не прикрепившиеся клетки (лимфоциты) удаляют 2-кратным отмыванием средой 199. В девять флаконов с прикрепившимися фагоцитирующими клетками добавляют культуральную среду, а именно среду 199 с 0,5% L-глутамина и 2,5% смешанной человеческой сывороткой, прогретой в течение 30 мин при 52°C, и в девять флаконов - 0,01% взвесь частиц зимозана в культуральной среде. Шесть флаконов (по три флакона с клетками в культуральной среде и в культуральной среде с частицами зимозана) сразу замораживают в морозильной камере для последующей оценки исходного содержания внутриклеточного лизоцима. Шесть флаконов с клетками в культуральной среде и в культуральной среде с частицами зимозана культивируют при температуре 37°C в течение от 4 до 6 часов с последующей заморозкой и шесть флаконов с клетками в культуральной среде и в культуральной среде с 0,01% частицами зимозана - в течение от 18 до 24 часов при t=37°C, после чего также замораживают. Все восемнадцать (18) флаконов подвергают одновременному трех-четырехкратному замораживанию до -10°C и оттаиванию при комнатной температуре для разрушения клеток и их лизосом до полного выделения клеточного лизоцима.
Во всех флаконах определяют количество лизоцима микрометодом (Мотавкина Н.С., Шаронов А.С., Ковалев Б.М. Микрометоды в иммунологии. - Владивосток, изд-во ДВГУ. - 1987. - 182 с.): используется индикаторная культура Micrococcus lysodeicticus, для получения которой заранее делают посев на скошенный МПА.
Полученную микробную культуру смывают с косячка 2 мл фосфатного буфера при помощи стеклянной палочки, доводят взвесь до гомогенного состояния. Готовят рабочую концентрацию 5×107 микр./мл.
К 8,0 мл фосфатного буфера в стеклянном стаканчике добавляют навеску агарозы 0,1 г. Взвесь агарозы плавят на плитке, доводят трижды до закипания. Расплавленную агарозу охлаждают до 45°C и смешивают с 2,0 мл взвеси тест-культуры. Смесь перемешивают и заливают в камеру, состоящую из двух фотопластин и П-образной прокладки между ними, скрепленную прищепками. После застывания геля верхнюю пластину скользящим движением снимают и прокладку удаляют. В геле аккуратно гель-пробойником делают лунки на расстоянии 1,0 см друг от друга. В лунки капилляром или микрошприцем вносят по 0,003 мл (объем лунки) исследуемые пробы с лизоцимом. Новый или промытый капилляр используют для внесения последующих проб. Одновременно на эту же пластину вносят стандартный раствор кристаллического лизоцима, взятый в концентрации 0,76; 1,53; 3,06; 6,125; 12,5 мкг/мл. Пластину с заполненными лунками инкубируют в термостате во влажной камере в течение 2-3 часов, после чего пластину замачивают в 5% растворе хлористого натрия на 15-18 часов для остановки реакции, выдерживают в водопроводной воде в течение 2 часов. Производят измерение диаметра колец лизиса тест-культуры сразу и после высушивания геля. На основании полученных результатов со стандартным раствором лизоцима по калибровочному графику производят перевод диаметра колец лизиса в концетрацию лизоцима, выражающуюся в мкг/мл.
Разница между количеством лизоцима после культивирования и до культивирования составляет количество синтезированного лизоцима (Lсинт) и свидетельствует о синтетической активности фагоцитирующих клеток. Разница между синтезированным лизоцимом фагоцитирующих клеток, культивированных с частицами зимозана и без частиц зимозана, оценивается как показатель активации фагоцитов (ПАФ):
ПАФ=Lсинт с Z - Lсинт без Z в мкг/мл, где:
Lсинт с Z - разница количества лизоцима в культивированных клетках с частицами зимозана и количества лизоцима в некультивированных клетках с частицами зимозана, определяемого после 3-4-кратного замораживания-оттаивания, в мкг/мл;
Lсинт без Z - разница количества лизоцима в культивированных клетках без частиц зимозана и количества лизоцима в некультивированных клетках без частиц зимозана, определяемого после 3-4-кратного замораживания-оттаивания, в мкг/мл.
ПАФ для оценки срочного механизма активации рассчитывается по данной формуле по результатам культивирования клеток в течение от 4 до 6 часов.
ПАФ для оценки долгосрочного механизма активации рассчитывается по данной формуле по результатам культивирования клеток в течение от 18 до 24 часов. С использованием разработанной авторами таблицы-программы производится компьютерный перевод диаметров колец лизиса в концентрацию лизоцима, выражающуюся в мкг/мл и расчет ПАФ в мкг/мл, что повышает точность способа и делает его удобным и доступным в применении.
Пример 2. Нейтрофилы выделяют описанным методом (Фрик Г., Прейснер З. Выделение гранулоцитов человека // Иммунологические методы. / Под ред. X.Фрималь. - М.: Мир, 1979. - с.328-332) из смеси клеток (эритроциты, нейтрофилы), прошедших градиент фиколл-верографина при выделении мононуклеаров крови (лимфоциты и моноциты), разрушением эритроцитов пятикратным объемом 0,87% раствора хлористого аммония в течение 10 мин при комнатной температуре и отмыванием от разрушенных эритроцитов физиологическим раствором. Выделенные клетки переносят в чистую пробирку и смешивают со средой 199, доводя концентрацию клеток до 6×106 кл./мл. Последующие этапы исследования проводят аналогично примеру 1.
Результат определения активности фагоцитирующих клеток без активации зимозаном и после активации отражен в таблице 1.
Расчетные данные синтезированного внутриклеточного лизоцима при активации частицами зимозана в процессе культивирования и без активации частицами зимозана представлены в таблице 2.
За временной режим при оценке активации фагоцитирующих клеток - нейтрофилов и моноцитов принят период 4-6 часов для оценки срочного механизма активации и 18-24 часа - долгосрочного, позволяющий оценить в совокупности срочный и долгосрочный результат активации.
Разница между количеством синтезированного лизоцима в активированных и неактивированных фагоцитирующих клетках является показателем активации фагоцитов (ПАФ). ПАФ срочной активации нейтрофилов составляет 0,4 мкг/мл, моноцитов - 0,6 мкг/мл. В результате долгосрочной активации совокупный ПАФ нейтрофилов исходя из представленных данных в таблице 2 составляет 1,2 мкг/мл, ПАФ моноцитов - 1,4 мкг/мл.
Мониторинг временных затрат на выполнение 10 и 100 исследований предлагаемым и известным методом постановки НСТ-теста в соответствии с этапами способов - выделение клеток, взаимодействие с активирующим объектом, оценкой изменения активности фагоцитирующих клеток с расчетом показателя активации, свидетельствующий о повышении производительности в соответствии с предлагаемым способом, отражен в таблице 3.
Результат исследования активации фагоцитирующих клеток известным (по индексу активации нейтрофилов - ИАН) и предлагаемым способом (по показателю активации фагоцитов - ПАФ) при остром и хроническом метроэндометрите свидетельствует о возможностях разных способов, что видно из таблицы 4.
У здоровых людей ИАН составляет 0,1-0,15 усл.ед., ПАФ нейтрофилов - 1,2±0,3 мкг/мл, ПАФ моноцитов - 1,4±0,25 мкг/мл.
Как видно, во-первых, направленность изменений ИАН и ПАФ в зависимости от течения воспалительного заболевания совпадают. Во-вторых, исследование активации фагоцитирующих клеток предлагаемым способом предполагает возможность исследования процесса активации не только нейтрофилов, но и моноцитов.
Изобретение может быть использовано в научных исследованиях для изучения механизма активации фагоцитирующих клеток - важной стадии фагоцитоза и иммунного ответа, поиске и отборе иммунотропных препаратов, а в практическом здравоохранении для диагностики нарушений фагоцитарного звена иммунной системы при заболеваниях, в том числе бесплодия неясного генеза, прогноза их течения, оценки эффективности лечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ инкорпорации биологически активных микро- и наночастиц в нейтрофилы | 2016 |
|
RU2633502C2 |
| ЭКСПЕРИМЕНТАЛЬНЫЙ СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПЕЧЕНИ ВНУТРИПОРТАЛЬНЫМ ВВЕДЕНИЕМ ЗИМОЗАНА, ИНКОРПОРИРОВАННОГО В ФАГОЦИТИРУЮЩИЕ КЛЕТКИ | 2011 |
|
RU2485496C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТИМУЛИРУЮЩЕГО ДЕЙСТВИЯ ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ НА ЗАЩИТНУЮ АКТИВНОСТЬ ФАГОЦИТОВ | 2006 |
|
RU2318202C1 |
| СПОСОБ ОЦЕНКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ | 2023 |
|
RU2824345C1 |
| ИСПОЛЬЗОВАНИЕ ОКСИДА ГРАФЕНА ДЛЯ АКТИВАЦИИ ФАГОЦИТАРНОЙ ФУНКЦИИ МАКРОФАГОВ | 2022 |
|
RU2809372C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ СПОСОБНОСТИ ФАГОЦИТИРУЮЩИХ КЛЕТОК | 2011 |
|
RU2445626C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ В ЭКСПЕРИМЕНТЕ СИНТЕЗ ИММУНОГЛОБУЛИНОВ | 1995 |
|
RU2108096C1 |
| СПОСОБ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ГЕПАТИТА У ДЕТЕЙ | 1997 |
|
RU2131125C1 |
| СПОСОБ ОЦЕНКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ МОНОЦИТОВ КРОВИ ЧЕЛОВЕКА | 1994 |
|
RU2089899C1 |
| Способ определения активности рецепторов нейтрофилов человека | 1988 |
|
SU1686372A1 |
Изобретение относится к биотехнологии и может быть использовано для оценки исходного состояния фагоцитирующих клеток (нейтрофилы, моноциты, макрофаги) по способности к активации в норме и при патологии. Способ предусматривает выделение фагоцитирующих клеток из смеси клеток. Выделенные клетки смешивают со средой 199 в 18 флаконах и производят прикрепление клеток к стеклу при комнатной температуре в течение 60 мин. В 9 флаконов к клеткам добавляют культуральную среду, содержащую среду 199, L-глутамин и смешанную человеческую сыворотку, прогретую в течение 30 мин при 52°С, в заданных количествах с получением клеточных проб. В другие 9 флаконов с клетками вносят культуральную среду вышеуказанного состава с содержанием 0,01% частиц зимозана с получением клеточных проб. Полученные клеточные пробы делят на три части. Одну третью часть проб с зимозаном и без него замораживают. Вторую часть клеточных проб с зимозаном и без него культивируют при температуре 37°С в течение от 4 до 6 ч с последующей заморозкой и третью часть клеточных проб с зимозаном и без него культивируют при температуре 37°С в течение от 18 до 24 ч соответственно с последующей заморозкой. Все 18 флаконов подвергают одновременному многократному замораживанию до -10°С и оттаиванию при комнатной температуре до полного выделения внутриклеточного лизоцима с последующим определением его количества микрометодом и расчетом синтезируемого лизоцима и показателя активации фагоцитов (ПАФ) по формуле:
ПАФ=Lсинт с Z - Lсинт без Z в мкг/мл,
где Lсинт с Z - разница количества лизоцима в культивированных клетках с частицами зимозана и количества лизоцима в некультивированных клетках с частицами зимозана в мкг/мл;
Lсинт без Z - разница количества лизоцима в культивированных клетках без частиц зимозана и количества лизоцима в некультивированных клетках без частиц зимозана в мкг/мл; при этом показатель активации фагоцитов для оценки срочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 4 до 6 часов, а показатель активации фагоцитов для оценки долгосрочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 18 до 24 часов. Изобретение позволяет повысить точность оценки активации фагоцитирующих клеток. 4 табл.
Способ определения активации фагоцитирующих клеток, включающий выделение клеток, взаимодействие с зимозаном, оценку активации по ферментативной активности клеток, отличающийся тем, что в качестве критерия активации фагоцитирующих клеток используют нарастание синтеза клеточного лизоцима, где к выделенным клеткам добавляют среду 199 с 0,5% L-глутамина и 2,5% смешанной человеческой сывороткой, прогретой в течение 30 мин при 52°С, содержащую 0,01% частиц зимозана (Z) и не содержащую частицы зимозана при их равном соотношении количества клеточных проб; далее одну третью часть проб с зимозаном и без него замораживают, а две другие равные части клеточных проб с зимозаном и без него культивируют при температуре 37°С, причем одну часть проб в течение от 4 до 6 ч, и замораживают, другую - от 18 до 24 ч, после этого все клеточные пробы многократно и последовательно замораживают при температуре до -10°С и оттаивают при комнатной температуре до полного выделения внутриклеточного лизоцима (L), затем определяют количество лизоцима микрометодом, рассчитывают количество синтезированного лизоцима (Lсинт) и показатель активации фагоцитов (ПАФ) по формуле:
ПАФ=Lсинт с Z - Lсинт без Z в мкг/мл, где
Lсинт с Z - разница количества лизоцима в культивированных клетках с частицами зимозана и количества лизоцима в некультивированных клетках с частицами зимозана в мкг/мл;
Lсинт без Z - разница количества лизоцима в культивированных клетках без частиц зимозана и количества лизоцима в некультивированных клетках без частиц зимозана в мкг/мл; при этом показатель активации фагоцитов для оценки срочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 4 до 6 ч, а показатель активации фагоцитов для оценки долгосрочного механизма активации рассчитывают по указанной формуле по результатам культивирования клеток в течение от 18 до 24 ч.
| Способ активации лимфоцитов | 1983 |
|
SU1173316A1 |
| Способ активации фагоцитоза макрофагов IN VIтRо | 1985 |
|
SU1326744A1 |
| Способ определения активированных нейтрофильных лейкоцитов | 1984 |
|
SU1394128A1 |
| СПОСОБ АКТИВАЦИИ АЛЬВЕОЛЯРНЫХ МАКРОФАГОВ | 1993 |
|
RU2063226C1 |
| См | |||
| Колесная игрушка | 1983 |
|
SU1183138A1 |
Авторы
Даты
2011-09-10—Публикация
2010-04-16—Подача