Область, к которой относится изобретение
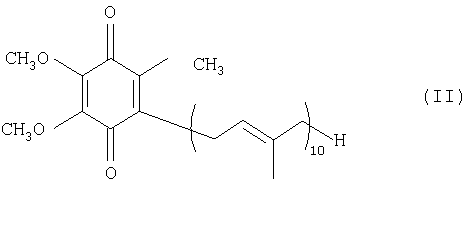
Настоящее изобретение относится к способу получения восстановленного кофермента Q10, представленного нижеследующей формулой (I):

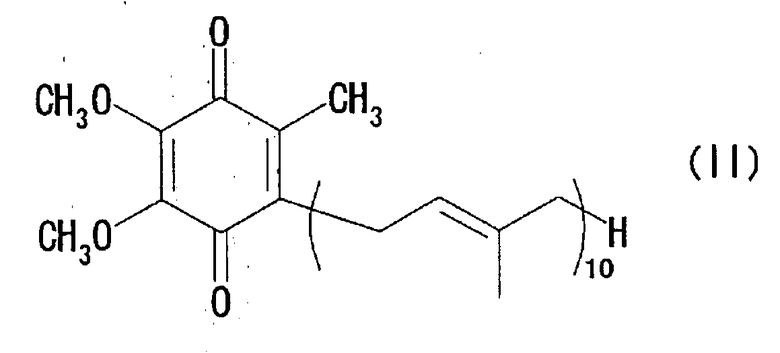
и к способу получения окисленного кофермента Q10, представленного нижеследующей формулой (II):
Более конкретно, настоящее изобретение относится к способу получения восстановленного кофермента Q10, который предусматривает следующее:
культивирование микроорганизмов, продуцирующих восстановленный кофермент Q10, в целях получения микробных клеток, содержащих восстановленный кофермент Q10 в количестве не менее чем 70 мол.% от общего количества коферментов Q10;
необязательно разрушение указанных микробиологических клеток и выделение полученного таким образом восстановленного кофермента Q10.
Настоящее изобретение также относится к способу получения окисленного кофермента Q10, который предусматривает либо выделение окисленного кофермента Q10 после окисления вышеупомянутых микробных клеток или продукта их разрушения, либо выделение восстановленного кофермента Q10 из вышеупомянутых микробных клеток или продукта их разрушения и окисление полученного таким образом восстановленного кофермента Q10.
Предпосылки создания изобретения
Восстановленный кофермент Q10 (I) и окисленный кофермент Q10 (II) представляют собой митохондриальные системные факторы транспорта электронов, присутствующие в клетках живого организма человека и участвующие в качестве носителей электронов в продуцировании АТФ в реакциях окислительного фосфорилирования.
Обычно окисленный кофермент Q10, помимо его применения в фармацевтических продуктах в качестве фармацевтически и физиологически активного вещества для лечения различных заболеваний, широко используется в качестве пищевых добавок и косметических продуктов.
С другой стороны, до настоящего времени восстановленный кофермент Q10 не был объектом особого внимания, однако в последние годы появились сообщения, что восстановленный кофермент Q10 является более эффективным для различных применений, чем окисленный кофермент Q10.
Так, например, в публикации японской заявки Kokai Hei-10-330251 описано средство против гиперхолестеринемии, обладающее превосходной способностью снижать уровни холестерина, средство против гиперлипидемии и средство для лечения и предупреждения артериосклероза, которые содержат восстановленный кофермент Q10 в качестве активного ингредиента. Кроме того, в публикации японской заявки Kokai Hei-10-109933 описана фармацевтическая композиция, которая обладает превосходной абсорбционной способностью при пероральном введении и содержит кофермент Q10, включая восстановленный кофермент Q10, в качестве активного ингредиента.
Кроме того, восстановленный кофермент Q10 является эффективным в качестве антиоксиданта и акцептора радикалов. В работе R. Stocker et al. сообщалось, что восстановленный кофермент Q10 предупреждает перекисное окисление человеческого ЛПНП более эффективно, чем α-токоферол, ликопен и β-каротин (Proceedings of the National Academy of Science of the United States of America, vol. 88, pp.1646-1650, 1991).
Известно, что окисленный кофермент Q10 и восстановленный кофермент Q10 находятся в определенном равновесии в живом организме и что окисленный кофермент Q10/восстановленный кофермент Q10, абсорбируемые в живом организме, подвергаются взаимному окислению/восстановлению.
Восстановленный кофермент Q10 может быть продуцирован методом химического синтеза, аналогичным методу продуцирования окисленного кофермента Q10. Но этот метод синтеза, как предполагается, является более сложным, небезопасным и дорогостоящим. Кроме того, в случае применения методов химического синтеза необходимо минимизировать субгенерирование и продуцирование в качестве примеси (Z)-изомера, который, как подозревают, является небезопасным (Biomedical and Clinical Aspects of Coenzyme Q, vol.3, pp.19-30, 1981). Согласно Европейской фармакопее, считается, что содержание (Z)-изомера в окисленном коферменте Q10 не должно превышать 0,1%.
Другим способом продуцирования восстановленного кофермента Q10 может быть способ утилизации микробных клеток, то есть способ разделения и выделения восстановленного кофермента Q10 из микроорганизмов, продуцирующих восстановленный кофермент Q10. Однако восстановленный кофермент Q10, продуцируемый микробными клетками вышеупомянутых микроорганизмов, содержит большое количество окисленного кофермента Q10, и стандартный метод разделения и выделения восстановленного кофермента Q10 является очень дорогостоящим.
В указанных ниже документах описано присутствие восстановленного кофермента Q10 в микробных клетках, и известны примеры таких бактерий, приведенные ниже. (1) Описан пример, где из всех коферментов Q10 в культуральных клетках фотосинтезирующих бактерий присутствует по меньшей мере 5-10 мас.% и по большей мере 30-60 мас.% восстановленного кофермента Q10 (публикация японской заявки Kokai Sho-57-70834). (2) Описан пример, в котором бактерию рода Pseudomonas подвергают тепловой экстракции органическим растворителем в присутствии гидроксида натрия и пирогаллола, и полученное вещество обрабатывают 5% раствором гидросульфита натрия, а затем подвергают дегидратации и концентрируют для сбора растворимой в ацетоне части, в результате чего получают масло, содержащее восстановленный кофермент Q10 (публикация японской заявки Kokai Sho-60-75294).
Оба метода в вышеуказанных примерах (1) и (2) направлены на превращение смеси полученного восстановленного кофермента Q10 и окисленного кофермента Q10 или превращение полученного восстановленного кофермента Q10 в окисленный кофермент Q10 путем дополнительного окисления. Таким образом, восстановленный кофермент Q10 описан лишь как промежуточное вещество при продуцировании окисленного кофермента Q10.
В вышеуказанном примере (1) используются фотосинтезирующие бактерии, метод культивирования которых является достаточно сложным. Кроме того, нельзя утверждать, что в микробных клетках вышеупомянутых микроорганизмов, в том случае, если планируется продуцирование восстановленного кофермента Q10, отношение количества восстановленного кофермента Q10 к общему количеству коферментов Q10 будет достаточным.
В вышеуказанном примере (2) описан способ превращения окисленного кофермента Q10, содержащегося в гексановой фазе, в восстановленный кофермент Q10 с использованием гидросульфита натрия в качестве восстановителя (см. пример 3 в публикации японской заявки Kokai Sho-60-75294). Таким образом, отношение количества восстановленного кофермента Q10 к общему количеству кофермента Q10 в микробных клетках неизвестно.
Кроме того, в обоих вышеуказанных примерах (1) и (2) не указывается количество продуцированных коферментов Q10 в культуре.
Как описано выше, пока еще не было сообщений о микробных клетках, содержащих высокие уровни восстановленного кофермента Q10. Кроме того, пока еще не разработан способ ферментативного продуцирования восстановленного кофермента Q10 в промышленном масштабе, то есть способ, предусматривающий культивирование микроорганизмов с получением микробных клеток, содержащих высокие уровни восстановленного кофермента Q10 по отношению к общему количеству коферментов Q10, и выделение восстановленного кофермента Q10 с получением восстановленного кофермента Q10 высокой чистоты.
Таким образом, если будет разработан способ получения большого количества кофермента Q10, содержащего высокие уровни восстановленного кофермента Q10, путем культивирования микроорганизмов, то этот способ может быть в высокой степени эффективным для продуцирования восстановленного кофермента Q10.
Краткое описание изобретения
Целью настоящего изобретения является разработка безопасного и эффективного способа продуцирования восстановленного кофермента Q10 в промышленном масштабе путем культивирования микроорганизмов, продуцирующих восстановленный кофермент Q10, с получением микробных клеток, содержащих высокие уровни восстановленного кофермента Q10, и путем соответствующего выделения восстановленного кофермента Q10 из указанных микробных клеток.
Другой целью настоящего изобретения является разработка способа продуцирования окисленного кофермента Q10 в соответствии с простыми процедурами культивирования микроорганизмов, продуцирующих восстановленный кофермент Q10, путем продуцирования микробных клеток, содержащих высокие уровни восстановленного кофермента Q10, и окисления восстановленного кофермента Q10, полученного из указанных микробных клеток, в качестве промежуточного вещества при продуцировании окисленного кофермента Q10.
Таким образом, настоящее изобретение относится к способу продуцирования восстановленного кофермента Q10, представленного нижеследующей формулой (I):

где указанный способ предусматривает следующее:
культивирование микроорганизмов, продуцирующих восстановленный кофермент Q10, в культуральной среде, содержащей источник углерода, источник азота, источник фосфора и микроэлементы, с получением микробных клеток, содержащих восстановленный кофермент Q10 в количестве не менее чем 70 мол.% от общего количества коферментов Q10,
необязательно разрушение указанных микробных клеток и
экстракцию продуцированного таким образом восстановленного кофермента Q10 органическим растворителем.
Кроме того, настоящее изобретение также относится к способу продуцирования окисленного кофермента Q10, представленного нижеследующей формулой (II):

где указанный способ предусматривает
культивирование микроорганизмов, продуцирующих восстановленный кофермент Q10, в культуральной среде, содержащий источник углерода, источник азота, источник фосфора и микроэлементы, с получением микробных клеток, содержащих восстановленный кофермент Q10 в количестве не менее чем 70 мол.% от общего количества коферментов Q10,
необязательно разрушение указанных микробных клеток и
либо окисление полученного таким образом восстановленного кофермента Q10 до окисленного кофермента Q10, а затем экстракцию полученного продукта органическим растворителем, либо экстракцию продуцированного таким образом восстановленного кофермента Q10 органическим растворителем, необязательную очистку и окисление полученного продукта до окисленного кофермента Q10.
В соответствии со способами настоящего изобретения, восстановленный кофермент Q10 может быть получен в промышленном масштабе недорогостоящим способом путем проведения достаточно простых стадий, предусматривающих культивирование микроорганизмов и выделения восстановленного кофермента Q10. Кроме того, окисленный кофермент Q10 также может быть продуцирован простыми способами. Более того, такие продуцируемые микроорганизмами коферменты Q10 обычно не содержат своих (Z)-изомеров, и могут быть получены (все Е)-изомеры, которые идентичны изомерам, содержащимся в мясе, рыбе и т.п.
Подробное описание изобретения
В соответствии с настоящим изобретением, сначала культивируют микроорганизмы, продуцирующие восстановленный кофермент Q10, в результате чего получают микробные клетки, содержащие восстановленный кофермент Q10 в количестве не менее чем 70 мол.%, а предпочтительно не менее чем 75 мол.% от общего количества коферментов Q10 (ферментация).
Микробные клетки, содержащие восстановленный кофермент Q10 на таком высоком уровне по отношению к общему количеству коферментов Q10, могут быть в основном получены путем культивирования микроорганизмов, способных продуцировать восстановленный кофермент Q10 в количестве не менее чем 70 мол.%, а предпочтительно не менее чем 75 мол.% по отношению к общему количеству коферментов Q10.
Уровень продуцирования микроорганизмами восстановленного кофермента Q10 по отношению к общему количеству коферментов Q10 может быть оценен, например, способом, предусматривающим культивирование микроорганизмов со встряхиванием (амплитуда: 2 см, 310 возвратно-поступательных движений/мин) при 25°С в течение 72 часов в 10 мл культуральной среды [(глюкоза: 20 г, пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г)/л, рН: 6,0] с использованием тест-пробирки (внутренний диаметр: 21 мм, вся длина: 200 мм).
Хотя предпочтительные условия культивирования для ферментативного продуцирования в промышленном масштабе будут описаны позже, однако следует отметить, что вышеупомянутые условия культивирования являются одним из методов стандартизации уровня восстановленного кофермента Q10, продуцируемого микроорганизмами, обладающими такой способностью, так, чтобы указанный уровень был установлен в соответствующих пределах без каких-либо значительных отклонений.
В целях настоящего изобретения, при вышеупомянутых условиях культивирования предпочтительно использовать микробные клетки, которые содержат восстановленный кофермент Q10 в количестве не менее чем 70 мол.%, а предпочтительно не менее чем 75 мол.% по отношению к общему количеству коферментов Q10. Еще более предпочтительно использовать микроорганизмы, способные продуцировать восстановленный кофермент Q10 на единицу культуральной среды в количестве, в основном не менее чем 1 мкг/мл, предпочтительно не менее чем 2 мкг/мл в вышеупомянутых условиях культивирования.
Вышеупомянутое содержание восстановленного кофермента Q10 и отношение количества восстановленного кофермента Q10 к общему количеству коферментов Q10 может быть подтверждено путем физического разрушения микробных клеток, экстракции кофермента Q10 органическим растворителем из полученных таким образом клеток и проведения ВЭЖХ-анализа. В частности, такое измерение может быть осуществлено в соответствии с нижеследующими процедурами:
(1) бульон, содержащий микроорганизмы, необязательно концентрируют, а затем 10 объемных частей указанного бульона помещают в тест-пробирку с завинчивающейся крышкой (внутренний диаметр: 16,5 мм, вся длина: 130 мм) и добавляют 10 объемных частей стеклянных сфер (425-600 мкм, изготавливаемых SIGMA Со.);
(2) в атмосфере азота добавляют 3 объемные части изопропанола и 18,5 объемных частей н-гексана на 10 объемных частей указанного бульона;
(3) разрушение и экстракцию микробных клеток осуществляют путем интенсивного встряхивания указанной смеси в течение 3 минут в атмосфере азота и
(4) полученную органическую фазу гидрофобного растворителя (н-гексановую фазу) выпаривают (температура бани: 40°С) при пониженном давлении и анализируют полученное вещество с помощью ВЭЖХ.
Колонка: YMC-Pack 4,6 x 250 мм (изготавливаемая YMC. Co., Ltd.)
Подвижная фаза: метанол/н-гексан = 85/15
Скорость потока: 1 мл/мин,
Детекция: УФ на 275 нм,
Время удерживания: восстановленный кофермент Q10, 13,5 мин,
окисленный кофермент Q10, 22,0 мин.
Вышеописанный метод измерения предусматривает получение результата, указывающего на содержание восстановленного кофермента Q10 и, по возможности, точное отношение количества восстановленного кофермента Q10 к общему количеству коферментов Q10, и стандартизацию указанного содержания и уровня восстановленного кофермента Q10, которые могут быть, как минимум, гарантированы. Этот способ был продемонстрирован несколькими легкими и доступными для осуществления экспериментами, проведенными авторами настоящего изобретения.
В качестве микроорганизмов, продуцирующих вышеупомянутый восстановленный кофермент Q10, применяемый в настоящем изобретении, могут быть использованы любые бактерии, дрожжи и грибки без каких либо ограничений. В качестве конкретных примеров вышеуказанных микроорганизмов, могут быть упомянуты, например, микроорганизмы рода Agrobacterium, рода Aspergillus, рода Acetobacter, рода Aminobacter, рода Agromonas, рода Acidiphilium, рода Bulleromyces, рода Bullera, рода Brevundimonas, рода Cryptococcus, рода Chionosphaera, рода Candida, рода Cerinosterus, рода Exisophiala, рода Exobasidium, рода Fellomyces, рода Filobasidiella, рода Filobasidium, рода Geotrichum, рода Graphiola, рода Gluconobacter, рода Kockovaella, рода Kurtzmanomyces, рода Lalaria, рода Leucosporidium, рода Legionella, рода Methylobacterium, рода Mycoplana, рода Oosporidium, рода Pseudomonas, рода Psedozyma, рода Paracoccus, рода Petromyces, рода Rhodotorula, рода Rhodosporidium, рода Rhizomonas, рода Rhodobium, рода Rhodoplanes, рода Rhodopseudomonas, рода Rhodobacter, рода Sporobolomyces, рода Sporidiobolus, рода Saitoella, рода Schizosaccharomyces, рода Sphingomonas, рода Sporotrichum, рода Sympodiomycopsis, рода Sterigmatosporidium, рода Tapharina, рода Tremella, рода Trichosporon, рода Tilletiaria, рода Tilletia, рода Tolyposporium, рода Tilletiopsis, рода Ustilago, рода Udeniomyces, рода Xanthophilomyces, рода Xanthobacter, рода Paecilomyces, рода Acremonium, рода Hyhomonus и рода Rhizobium.
С точки зрения легкости и продуктивности культивирования, предпочтительными являются бактерии (предпочтительно, нефотосинтезирующие бактерии) и дрожжи. В качестве примеров бактерий могут быть упомянуты бактерии рода Agrobacterium, рода Gluconobacter и т.п. В качестве примеров дрожжей могут быть упомянуты, дрожжи рода Schizosaccharomyces, рода Saitoella и т.п.
В качестве предпочтительных видов могут быть упомянуты, например, Agrobacterium tumefacience IFО13263, Agrobacterium radiobacter ATCC4718, Aspergillus clavatus JCM1718, Acetobacter xylinum IFО15237, Aminobacter aganouensis JCM7854, Agromonas oligotrophica JCM1494, Acidiphilium multivorum JCM8867, Bulleromyces albus IFО1192, Bullera armeniaca IFО10112, Brevundimonas diminuta JCM2788, Cryptococcus laurentii IFO0609, Chionosphaera apobasidialis CBS7430, Candida curvata ATCC10567, Cerinosterus luteoalbus JCM2923, Exisophiala alcalophila JCM12519, Exobasidium gracile IFO7788, Fellomyces fuzhouensis IFO10374, Filobasidiella neoformans CBS132, Filobasidium capsuloigenum CBS1906, Geotrichum capitatum JCM6258, Graphiola cylindrica IFO6426, Gluconobacter suboxydans IFO3257, Kockovaella imperatae JCM7826, Kurtzmanomyces nectairei IFO10118, Lalaria cerasi CBS275.28, Leucosporidium scottii IFO1212, Legionella anisa JCM7573, Methylobacterium extorguens JCM2802, Mycoplana ramosa JCM7822, Oosporidium margaritiferum CBS2531, Pseudomonas denitrificans IAM 12023, Pseudomonas shuylkilliensis IAM 1092, Psedozyma aphidis CBS517.23, Paracoccus denitrificans JCM6892, Petromyces alliaceus IFO7538, Rhodotorula glutinis IFO1125, Rhodotorula minuta IFO0387, Rhodosporidium diobovatum ATCC1830, Rhizomonas suberifaciens IFO15212, Rhodobium orients JCM9337, Rhodoplanes elegans JCM9224, Rhodopseudomonas palustris JCM2524, Rhodobacter capsulatus SB1003, Sporobolomyces holsaticus IFO1034, Sporobolomyces pararoseus IFO0471, Sporidiobolus johnsonii IFO1840, Saitoella complicata IFO10748, Schizosaccharomyces pombe IFO0347, Sphingomonas parapaucimobilis IFO15100, Sporotrichum cellulophilium ATCC20493, Sympodiomycopsis paphiopedili JCM8318, Sterigmatosporidium polymorphum IFO10121, Sphingomonas adhesiva JCM7370, Tapharina caerulescens CBS351.35, Tremella mesenterica ATCC24438, Trichosporon cutaneum IFO1198, Tilletiaria anomala CBS436.72, Tilletia caries JCM1761, Tolyposporium bullatum JCM2006, Tilletiopsis washintonesis CBS544, Ustilago esculenta IFO9887, Udeniomyces megalosporus JCM5269, Xanthophilomyces dendrorhous IFO10129, Xanthobacter flavus JCM1204, Paecilomyces lilacinus ATCC10114, Acremonium chrysogenum ATCC11550, Hyphomonas hirschiana ATCC33886, Rhizobium meliloti АТСС9930, и т.п.
В качестве микроорганизмов, продуцирующих восстановленный кофермент Q10, могут быть использованы не только вышеупомянутые микроорганизмы дикого типа, но также, предпочтительно, микроорганизмы, в которых, например, транскрипционная и трансляционная активность генов, подходящих для биосинтеза восстановленного кофермента Q10 в вышеупомянутых микроорганизмах, или ферментативная активность экспрессированного белка является модифицированной или повышенной.
В качестве средства для модификации или повышения транскрипционной и трансляционной активности генов или ферментативной активности экспрессированного белка может быть упомянута рекомбинация генов (включая собственную модификацию, амплификацию и деструкцию гена, введение чужеродного гена и модификацию и пролиферацию введенных таким образом чужеродных генов) и мутагенез под действием мутагенов. В частности, предпочтительным является мутагенез под действием мутагенов.
Более предпочтительными микроорганизмами, которые могут быть использованы в настоящем изобретении, являются микроорганизмы, содержащие восстановленный кофермент Q10 в количестве не менее чем 70 мол.%, предпочтительно не менее, чем 75 моль%, более предпочтительно, не менее чем 80 мол.%, еще более предпочтительно не менее чем 85 мол.% и наиболее предпочтительно не менее чем 90 мол.% от общего количества коферментов Q10, где оценку вышеупомянутых модифицированных микроорганизмов или микроорганизмов с улучшенными свойствами, предпочтительно микроорганизмов, мутированных мутагенами, проводят вышеупомянутым пролиферативным методом и вышеупомянутым методом измерений. При ферментативном продуцировании в промышленном масштабе предпочтительно используют микроорганизмы, обладающие способностью продуцировать восстановленный кофермент Q10 на единицу культуральной среды в количестве не менее чем 1 мкг/мл, предпочтительно не менее чем 2 мкг/мл, более предпочтительно не менее чем 3 мкг/мл, еще более предпочтительно не менее чем 5 мкг/мл, особенно предпочтительно не менее чем 10 мкг/мл, еще более предпочтительно не менее чем 15 мкг/мл и наиболее предпочтительно не менее чем 20 мкг/мл.
Мутагенез может быть осуществлен методом однократного мутагенеза, однако предпочтительно, чтобы мутагенез был осуществлен не менее 2-х раз. Это обусловлено тем, что, как было установлено, уровень продуцирования восстановленного кофермента Q10 может быть увеличен на соответствующих стадиях мутагенеза. Нет необходимости говорить о том, что кандидатами микробных клеток, предназначенных для мутагенеза, являются клетки, продуцирующие по возможности наиболее высокий уровень восстановленного кофермента Q10, где оценку проводят вышеупомянутым пролиферативным методом и вышеупомянутым методом измерения.
Мутагенез может быть осуществлен с использованием факультативных и истинных мутагенов. В широком смысле термин "мутаген" включает не только химические агенты, обладающие мутагенным действием, но также, например, такую обработку как УФ-облучение, индуцирующее мутагенез. В качестве примеров истинных мутагенов могут быть упомянуты этилметансульфонат, УФ-излучение, N-метил-N'-нитро-N-нитрозогуанидин, аналоги нуклеотидных оснований, такие как бромурацил и акридины, однако эти примеры не имеют конкретных ограничений.
В соответствии со стандартной техникой мутагенеза, успешно применяемой для осуществления мутагенеза, проводят "правильный" отбор микробных клеток, обладающих высокой способностью продуцировать восстановленный кофермент Q10. Для этого культура, полученная из одиночной колонии, должна быть оценена, например, вышеупомянутым пролиферативным методом и вышеупомянутым методом измерения. Поскольку кристаллы восстановленного кофермента Q10 образуют белый твердый слой или бесцветную жидкую фазу, то продуктивность восстановленного кофермента Q10 может быть соответствующим образом оценена вышеупомянутым методом измерения в процессе отбора колоний.
В способах настоящего изобретения высокая степень продуцирования восстановленного кофермента Q10 при ферментативном продуцировании в промышленном масштабе может частично достигаться с использованием микробных клеток, содержащих восстановленный кофермент Q10 в количестве не менее чем 70 мол.% по отношению к общему количеству коферментов Q10, и частично в подходящих условиях культивирования (ферментации), способствующих увеличению уровня продуцирования восстановленного кофермента Q10 на единицу культуральной среды, как описано ниже. Особенно предпочтительным является комбинированное использование подходящих микробных клеток, описанных выше, и подходящих условий культивирования (ферментации), описанных ниже.
Культивирование осуществляют в основном в культуральной среде, содержащей основные питательные вещества и микроэлементы, необходимые для размножения микроорганизмов. В качестве указанных питательных веществ могут быть упомянуты, например, источники углерода (например, углеводы, такие как глюкоза, сахароза, мальтоза, крахмал, кукурузный сироп и мелассы; спирты, такие как метанол и этанол), источники азота (например, жидкий кукурузный экстракт, сульфат аммония, фосфат аммония, гидроксид аммония, мочевина и пептон), источники фосфора (например, фосфат аммония и фосфорная кислота) и микроэлементы (например, минералы, такие как магний, калий, цинк, медь, железо, марганец, молибден, серная кислота и соляная кислота; витамины, такие как биотин, дезтиобиотин и витамин В1; аминокислоты, такие как аланин и гистидин; и природное сырье, содержащее витамины, такие как дрожжевой экстракт и солодовый экстракт); однако могут быть использованы любые питательные элементы без каких-либо ограничений. Иногда в природных компонентах культуральной среды, такой как дрожжевой экстракт, содержатся источники фосфора, такие как фосфаты. Вышеупомянутые питательные элементы могут быть использованы в соответствующих комбинациях.
Культивирование обычно осуществляют при температуре в пределах от 15 до 45°С, а предпочтительно от 20 до 37оС. Если температура составляет ниже 15°С, то скорость размножения микроорганизмов слишком низка для промышленного производства, тогда как высокие температуры, превышающие 45°С, значительно ограничивают жизнеспособность микроорганизмов.
В основном культивирование осуществляют при рН в пределах от 4 до 9, а предпочтительно от 5 до 8. Если рН составляет не более чем 3 или не менее чем 10, то размножение микроорганизмов значительно замедляется.
Хотя ферментативное продуцирование в промышленных масштабах зависит от вида микроорганизмов, однако предпочтительно, чтобы концентрация источников углерода (включая продуцированные спирты) в процессе культивирования регулировалась так, чтобы она не оказывала значительного негативного воздействия на уровни продуцирования восстановленного кофермента Q10. В соответствии с этим данную культуру предпочтительно регулировать так, чтобы концентрация содержащихся в ней источников углерода не оказывала значительного негативного воздействия на уровень продуцирования восстановленного кофермента Q10, то есть так, чтобы концентрация этих источников в бульоне составляла в основном не более чем 20 г/л, предпочтительно не более чем 5 г/л, а более предпочтительно не более чем 2 г/л.
Для регуляции концентрации источников углерода предпочтительно использовать клеточную культуру с подпиткой. Концентрацию источника углерода в бульоне можно регулировать путем скорректированной подачи источников питательных веществ (особенно источников углерода), исходя из контрольных показателей данной культуры, таких как рН, концентрация растворенного кислорода (DO) или остаточная концентрация сахаридов. Хотя такая регуляция зависит от вида микроорганизма, однако подача источников питательных веществ может быть начата в начальной стадии инициирования или в процессе культивирования. Подача источников питательных веществ может осуществляться непрерывно или периодически. Иногда при подаче источников питательных веществ может оказаться предпочтительным вводить вышеупомянутые источники углерода в культуральную среду отдельно от других компонентов.
Культивирование может быть завершено, когда будет продуцировано нужное количество восстановленного кофермента Q10. Время культивирования не имеет конкретных ограничений, и обычно оно составляет 20-200 часов.
Вышеупомянутое культивирование обычно осуществляют в аэробных условиях. Термин "аэробные условия" означает условия, при которых кислород подается так, чтобы в процессе культивирования не было ограничений в поступлении кислорода (его дефицита), а предпочтительно условия, при которых кислород подается в достаточном количестве, так, чтобы в процессе культивирования не наблюдалось какого-либо значительного ограничения его поступления. Такое культивирование обычно осуществляют в условиях аэрации, а предпочтительно в условиях аэрации и перемешивания.
Использование вышеупомянутых микроорганизмов и условий культивирования дает возможность получить микробные клетки, содержащие восстановленный кофермент Q10 в количестве не менее чем 70 мол.%, а предпочтительно не менее чем 75 мол.% от общего количества коферментов Q10. Кроме того, может быть достигнут уровень продуцирования восстановленного кофермента Q10, составляющий не менее чем 1 мкг/мл, предпочтительно не менее чем 2 мкг/мл и еще более предпочтительно не менее чем 3 мкг/мл.
Ниже будет описано выделение восстановленного кофермента Q10, продуцируемого вышеупомянутым методом культивирования.
В соответствии с настоящим изобретением, эффективное продуцирование восстановленного кофермента Q10 в промышленном масштабе может быть осуществлено частично вышеупомянутым подходящим способом культивирования и частично подходящим способом выделения восстановленного кофермента Q10, как описано ниже.
Выделение восстановленного кофермента Q10 осуществляют путем экстракции из микробных клеток, полученных вышеупомянутым способом культивирования с использованием органического растворителя.
При такой экстракции клетки могут быть, но необязательно, подвергнуты разрушению. Разрушение клеток способствует эффективной экстракции восстановленного кофермента Q10, продуцированного и аккумулированного в клетках. Нет необходимости говорить о том, что разрушение и экстракция клеток могут быть осуществлены одновременно.
В некоторых случаях "разрушение" в соответствии с настоящим изобретением может быть осуществлено лишь до определенной степени, при которой разрушается поверхностная структура, такая как клеточная стенка, что позволяет осуществлять экстракцию восстановленного кофермента Q10, а поэтому нет необходимости в проведении стадий лизиса или фрагментации микробных клеток.
В случае бактерий вышеупомянутое разрушение клеток не является обязательным. Однако в случае использования дрожжей или грибов разрушение клеток в основном является необходимым, а если клетки не подвергаются разрушению, то это создает определенные трудности для эффективного выделения восстановленного кофермента Q10, продуцируемого и аккумулируемого в этих клетках.
Вышеупомянутое разрушение микробных клеток может быть осуществлено нижеследующим одним или несколькими методами разрушения, причем порядок их осуществления не имеет существенного значения. В качестве примеров методов разрушения могут быть упомянуты физическая обработка, химическая обработка, ферментативная обработка, а также термообработка, автолиз, осмолизис и плазмоптиз и т.п.
Вышеупомянутая физическая обработка может быть осуществлена, например, с использованием гомогенизатора высокого давления, ультразвукового гомогенизатора, пресса Френча, шаровой мельницы и т.п. или их комбинаций.
Вышеупомянутая химическая обработка может быть осуществлена, например, с использованием кислоты (предпочтительно сильной кислоты), такой как соляная кислота и серная кислота, основания (предпочтительно сильного основания), такого как гидроксид натрия и гидроксид калия и т.п. или их комбинаций.
Вышеупомянутая ферментативная обработка может быть осуществлена, например, с использованием лизоцима, зимолиазы, глюканазы, новозима, протеазы, целлюлазы и т.п. либо с использованием их соответствующих комбинаций.
Вышеупомянутая термообработка может быть осуществлена, например, путем нагревания до температуры в пределах от 60 до 100°С в течение периода времени примерно от 30 минут до 3 часов.
Вышеупомянутый автолиз может быть осуществлен, например, путем обработки растворителем, таким как этилацетат.
Осмолизис или плазмоптиз, применяемый для разрушения клеток и осуществляемый путем обработки клеток раствором, имеющим концентрацию соли, отличающуюся от концентраций, присутствующих в данных клетках, часто проводят путем комбинированного применения физической обработки, химической обработки, ферментативной обработки, термообработки, автолиза и/или т.п., поскольку вышеупомянутые методы лизиса, осуществляемые отдельно, являются недостаточными для эффективного разрушения.
Из вышеупомянутых методов разрушения клеток методом, используемым в качестве предварительной обработки перед экстракцией и выделением восстановленного кофермента Q10, является физическая обработка, химическая обработка (в частности, обработка кислотой, а предпочтительно сильной кислотой (например, кислотой, имеющей значение рКа, не превышающее 2,5, и используемой в виде водного раствора) в условиях, при которых восстановленный кофермент Q10 защищен от реакции окисления, как описано ниже), при этом предпочтительной является термообработка. С точки зрения эффективности разрушения, более предпочтительной является физическая обработка.
Применение стандартного метода разрушения клеток и метода экстракции кофермента Q10, а в частности, метода, предусматривающего экстракцию кофермента Q10 органическим растворителем в присутствии гидроксида натрия и пирогаллола, представляет определенные трудности, связанные с высокими экономическими затратами, необходимостью в обработке отходов, безопасностью эффективной утилизации отработанных микроорганизмов (клеточные отходы), такой как выделение белков и т.п. Однако метод разрушения клеток, в частности, метод физической обработки согласно изобретению, не приводит к субгенерированию больших количеств солей при нейтрализации и является подходящим методом с точки зрения обработки отходов и эффективной утилизации отработанных микроорганизмов (клеточных отходов).
Микробные клетки, применяемые в вышеупомянутом способе разрушения клеток, могут быть использованы в виде бульона, концентрированного бульона, в виде сырых микробных клеток, собранных из этого бульона, в виде продукта, полученного путем их промывки, в виде суспензии сырых клеток в растворителе (включая, например, воду, физиологический раствор, буферы и т.п.), в виде сухих клеток, полученных путем сушки вышеупомянутых сырых клеток, в виде суспензии сухих клеток в растворителе (включая, например, воду, физиологический раствор, буферы и т.п.) и т.п. Предпочтительными являются водные суспензии микробных клеток, а с точки зрения удобства применения и т.п., более предпочтительными являются бульон, концентрированный бульон и продукт, полученный путем их промывки.
Микробные клетки или продукты их разрушения, применяемые для экстракции и выделения восстановленного кофермента Q10, могут быть использованы в форме, аналогичной описанной выше, и не имеют конкретных ограничений, и такими клетками могут быть сырые/сухие клетки указанных микробных клеток или продуктов их разрушения. Предпочтительными являются водные суспензии микробных клеток или продуктов их разрушения, а более предпочтительными являются бульон, концентрированный и/или промывочный бульон или растворы, полученные при разрушении клеток (каждый из них является водной суспензией).
Концентрация клеток в вышеупомянутой суспензии микробных клеток или продукта их разрушения не имеет конкретных ограничений, и обычно она составляет от 1 до 25 мас.% из расчета сухой массы. С точки зрения экономических затрат, предпочтительной является концентрация от 10 до 20 мас.%.
Восстановленный кофермент Q10 может быть выделен путем экстракции микробных клеток и продукта их разрушения, полученных указанным способом с использованием органического растворителя.
В качестве органического растворителя, применяемого для экстракции, могут быть упомянуты углеводороды, эфиры жирной кислоты, простые эфиры, спирты, жирные кислоты, кетоны, азотные соединения (включая нитрилы и амиды), соединения серы и т.п.
В частности, при экстракции восстановленного кофермента Q10, для его защиты от окисления молекулярным кислородом, предпочтительно использовать по меньшей мере один из таких растворителей, как углеводороды, эфиры жирной кислоты, простые эфиры и нитрилы. Из них особенно предпочтительными являются углеводороды и эфиры жирных кислот, а наиболее предпочтительными являются углеводороды.
При продуцировании в промышленном масштабе, где, в отличие от лабораторного продуцирования, остаточный кислород оказывает значительное негативное действие, очень трудно достичь полной элиминации кислорода, а поэтому при проведении отдельных операций могут потребоваться достаточно продолжительные периоды времени. Рассматриваемое окисление непосредственно связано с субгенерированием окисленного кофермента Q10 из восстановленного кофермента Q10. В соответствии с этим при экстракции восстановленного кофермента Q10 использование вышеупомянутого органического растворителя (такого как углеводороды, эфиры жирных кислот, простые эфиры и нитрилы) с высокоэффективной защитой от окисления позволяет осуществлять эффективную экстракцию.
Углеводороды не имеют конкретных ограничений, но в качестве примеров могут быть упомянуты алифатические углеводороды, ароматические углеводороды, галогенированные углеводороды и т.п. Предпочтительными являются алифатические углеводороды и ароматические углеводороды, а более предпочтительными являются алифатические углеводороды.
Алифатические углеводороды не имеют конкретных ограничений, и они могут быть циклическими или ациклическими либо насыщенными или ненасыщенными. Однако в основном предпочтительными являются насыщенные углеводороды. Обычно они содержат от 3 до 20 атомов углерода, предпочтительно от 5 до 12 атомов углерода, а более предпочтительно от 5 до 8 атомов углерода. В качестве конкретных примеров могут быть упомянуты пропан, бутан, изобутан, пентан, 2-метилбутан, гексан, 2-метилпентан, 2,2-диметилбутан, 2,3-диметилбутан, гептан, изомеры гептана (например, 2-метилгексан, 3-метилгексан, 2,3-диметилпентан, 2,4-диметилпентан), октан, 2,2,3-триметилпентан, изооктан, нонан, 2,2,5-триметилгексан, декан, додекан, 2-пентен, 1-гексен, 1-гептен, 1-октен, 1-нонен, 1-децен, циклопентан, метилциклопентан, циклогексан, метилциклогексан, этилциклогексан, п-ментан, циклогексен и т.п. Предпочтительными являются пентан, 2-метилбутан, гексан, 2-метилпентан, 2,2-диметилбутан, 2,3-диметилбутан, гептан, изомеры гептана (например, 2-метилгексан, 3-метилгексан, 2,3-диметилпентан, 2,4-диметилпентан), октан, 2,2,3-триметилпентан, изооктан, нонан, 2,2,5-триметилгексан, декан, додекан, циклопентан, метилциклопентан, циклогексан, метилциклогексан, этилциклогексан, п-ментан и т.п. Более предпочтительными являются пентан, 2-метилбутан, гексан, 2-метилпентан, 2,2-диметилбутан, 2,3-диметилбутан, гептан, изомеры гептана (например, 2-метилгексан, 3-метилгексан, 2,3-диметилпентан, 2,4-диметилпентан), октан, 2,2,3-триметилпентан, изооктан, циклопентан, метилциклопентан, циклогексан, метилциклогексан, этилциклогексан и т.п.
В основном предпочтительно использовать гептаны, но не только гептаны, а также их изомеры, такие как метилциклогексан, имеющий 7 атомов углерода, и их смеси. Более предпочтительными являются пентаны (например, пентан и т.п.), имеющие 5 атомов углерода, гексаны (например, гексан, циклогексан и т.п.), имеющие 6 атомов углерода, и гептаны (например, гептан, метилциклогексан и т.п.), имеющие 7 атомов углерода. С точки зрения высокоэффективной защиты от окисления, особенно предпочтительными являются гептаны (например, гептан, метилциклогексан и т.п.), а наиболее предпочтительным является гептан.
Ароматические углеводороды не имеют конкретных ограничений, но обычно используются углеводороды, содержащие от 6 до 20 атомов углерода, предпочтительно от 6 до 12 атомов углерода и более предпочтительно от 7 до 10 атомов углерода. В качестве конкретных примеров могут быть упомянуты бензол, толуол, ксилол, о-ксилол, м-ксилол, п-ксилол, этилбензол, кумол, мезитилен, тетралин, бутилбензол, п-кумол, циклогексилбензол, диэтилбензол, пентилбензол, дипентилбензол, додецилбензол, стирол и т.п. Предпочтительными являются толуол, ксилол, о-ксилол, м-ксилол, п-ксилол, этилбензол, кумол, мезитилен, тетралин, бутилбензол, п-кумол, циклогексилбензол, диэтилбензол, пентилбензол, и т.п. Более предпочтительными являются толуол, ксилол, о-ксилол, м-ксилол, п-ксилол, кумол, тетралин и т.п., а наиболее предпочтительным является кумол.
Галогенированные углеводороды не имеют конкретных ограничений, и они могут быть циклическими или ациклическими либо насыщенными или ненасыщенными. Однако в основном предпочтительно использовать ациклические углеводороды. Обычно более предпочтительными являются хлорированные углеводороды и фторированные углеводороды, при этом более предпочтительными являются хлорированные углеводороды. Кроме того, подходящими для использования являются углеводороды, содержащие 1-6 атомов углерода, предпочтительно 1-4 атомов углерода, а более предпочтительно 1-2 атомов углерода. В качестве конкретных примеров могут быть упомянуты дихлорметан, хлороформ, тетрахлорметан, 1,1-дихлорэтан, 1,2-дихлорэтан, 1,1,1-трихлорэтан, 1,1,2-трихлорэтан, 1,1,1,2-тетрахлорэтан, 1,1,2,2-тетрахлорэтан, пентахлорэтан, гексахлорэтан, 1,1-дихлорэтилен, 1,2-дихлорэтилен, трихлорэтилен, тетрахлорэтилен, 1,2-дихлорпропан, 1,2,3-трихлорпропан, хлорбензол, 1,1,1,2-тетрафторэтан и т.п. Предпочтительными являются дихлорметан, хлороформ, тетрахлорметан, 1,1-дихлорэтан, 1,2-дихлорэтан, 1,1,1-трихлорэтан, 1,1,2-трихлорэтан, 1,1-дихлорэтилен, 1,2-дихлорэтилен, трихлорэтилен, хлорбензол, 1,1,1,2-тетрафторэтан и т.п. Более предпочтительными являются дихлорметан, хлороформ, 1,2-дихлорэтилен, трихлорэтилен, хлорбензол, 1,1,1,2-тетрафторэтан и т.п.
Эфиры жирных кислот не имеют конкретных ограничений, но в качестве конкретных примеров могут быть упомянуты пропионаты, ацетаты, формиаты и т.п. Предпочтительными являются ацетаты и формиаты, а более предпочтительными являются ацетаты. Функциональные группы сложного эфира не имеют конкретных ограничений, но в основном предпочтительными являются алкиловые эфиры, имеющие от 1 до 8 атомов углерода, и аралкиловые эфиры, имеющие от 7 до 12 атомов углерода, более предпочтительными являются алкиловые эфиры, имеющие от 1 до 6 атомов углерода, а еще более предпочтительными являются алкиловые эфиры, имеющие от 1 до 4 атомов углерода.
В качестве конкретных примеров пропионатов могут быть упомянуты метилпропионат, этилпропионат, бутилпропионат, изопентилпропионат и т.п. Предпочтительными являются этилпропионат и т.п.
В качестве конкретных примеров ацетатов могут быть упомянуты метилацетат, этилацетат, пропилацетат, изопропилацетат, бутилацетат, изобутилацетат, втор-бутилацетат, пентилацетат, изопентилацетат, втор-гексилацетат, циклогексилацетат, бензилацетат и т.п. Предпочтительными являются метилацетат, этилацетат, пропилацетат, изопропилацетат, бутилацетат, изобутилацетат, втор-бутилацетат, пентилацетат, изопентилацетат, втор-гексилацетат, циклогексилацетат и т.п. Более предпочтительными являются метилацетат, этилацетат, пропилацетат, изопропилацетат, бутилацетат, изобутилацетат и т.п. Наиболее предпочтительным является этилацетат.
В качестве конкретных примеров формиатов могут быть упомянуты метилформиат, этилформиат, пропилформиат, изопропилформиат, бутилформиат, изобутилформиат, втор-бутилформиат, пентилформиат и т.п. Предпочтительными являются метилформиат, этилформиат, пропилформиат, бутилформиат, изобутилформиат, пентилформиат и т.п. Наиболее предпочтительным является этилформиат.
Простые эфиры не имеют конкретных ограничений, и они могут быть циклическими или ациклическими либо насыщенными или ненасыщенными. Однако в основном предпочтительными являются насыщенные эфиры. Обычно они содержат от 3 до 20 атомов углерода, предпочтительно от 4 до 12 атомов углерода, а более предпочтительно от 4 до 8 атомов углерода. В качестве конкретных примеров могут быть упомянуты диэтиловый эфир, метилтретбутиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, дигексиловый эфир, этилвиниловый эфир, бутилвиниловый эфир, анизол, фенетол, бутилфениловый эфир, метокситолуол, диоксан, фуран, 2-метилфуран, тетрагидрофуран, тетрагидропиран, диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, дибутиловый эфир этиленгликоля, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, монобутиловый эфир этиленгликоля и т.п. Предпочтительными являются диэтиловый эфир, метил-третбутиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, дигексиловый эфир, анизол, фенетол, бутилфениловый эфир, метокситолуол, диоксан, 2-метилфуран, тетрагидрофуран, тетрагидропиран, диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, дибутиловый эфир этиленгликоля, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля и т.п. Более предпочтительными являются диэтиловый эфир, метил-третбутиловый эфир, анизол, диоксан, тетрагидрофуран, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля и т.п. Еще более предпочтительными являются диэтиловый эфир, метил-трет-бутиловый эфир, анизол и т.п., а наиболее предпочтительным является метил-трет-бутиловый эфир.
Спирты не имеют конкретных ограничений, и они могут быть циклическими или ациклическими либо насыщенными или ненасыщенными. Однако в основном предпочтительными являются насыщенные спирты. Обычно они содержат от 1 до 20 атомов углерода, более предпочтительно от 1 до 12 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. Из них предпочтительными являются одноатомные спирты, содержащие от 1 до 5 атомов углерода, двухатомные спирты, содержащие от 2 до 5 атомов углерода, и трехатомные спирты, содержащие 3 атома углерода.
В качестве конкретных примеров спиртов могут быть упомянуты одноатомные спирты, такие как метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, изопентиловый спирт, трет-пентиловый спирт, 3-метил-2-бутанол, неопентиловый спирт, 1-гексанол, 2-метил-1-пентанол, 4-метил-2-пентанол, 2-этил-1-бутанол, 1-гептанол, 2-гептанол, 3-гептанол, 1-октанол, 2-октанол, 2-этил-1-гексанол, 1-нонанол, 1-деканол, 1-ундеканол, 1-додеканол, алиловый спирт, пропаргиловый спирт, бензиловый спирт, циклогексанол, 1-метилциклогексанол, 2-метилциклогексанол, 3-метилциклогексанол, 4-метилциклогексанол и т.п.; двухатомные спирты, такие как 1,2-этандиол, 1,2-пропандиол, 1,3-пропандиол, 1,2-бутандиол, 1,3-бутандиол, 1,4-бутандиол, 2,3-бутандиол, 1,5-пентандиол и т.п, и трехатомные спирты, такие как глицерин и т.п.
Из одноатомных спиртов предпочтительными являются метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, изопентиловый спирт, трет-пентиловый спирт, 3-метил-2-бутанол, неопентиловый спирт, 1-гексанол, 2-метил-1-пентанол, 4-метил-2-пентанол, 2-этил-1-бутанол, 1-гептанол, 2-гептанол, 3-гептанол, 1-октанол, 2-октанол, 2-этил-1-гексанол, 1-нонанол, 1-деканол, 1-ундеканол, 1-додеканол, бензиловый спирт, циклогексанол, 1-метилциклогексанол, 2-метилциклогексанол, 3-метилциклогексанол, 4-метилциклогексанол и т.п. Более предпочтительными являются метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, изопентиловый спирт, трет-пентиловый спирт, 3-метил-2-бутанол, неопентиловый спирт, 1-гексанол, 2-метил-1-пентанол, 4-метил-2-пентанол, 2-этил-1-бутанол, циклогексанол и т.п. Еще более предпочтительными являются метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, изопентиловый спирт, трет-пентиловый спирт, 3-метил-2-бутанол, неопентиловый спирт и т.п. Особенно предпочтительными являются метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, 2-метил-1-бутанол, изопентиловый спирт и т.п. Наиболее предпочтительным явлется 2-пропанол.
Из двухатомных спиртов предпочтительными являются 1,2-этандиол, 1,2-пропандиол, 1,3-пропандиол и т.п. Наиболее предпочтительным является 1,2-этандиол. Из трехатомных спиртов предпочтительным является глицерин.
В качестве примеров жирных кислот могут быть упомянуты муравьиная кислота, уксусная кислота, пропионовая кислота и т.п. Предпочтительными являются муравьиная кислота и уксусная кислота, а наиболее предпочтительной является уксусная кислота.
Кетоны не имеют конкретных ограничений, но предпочтительно использовать кетоны, имеющие от 3 до 6 атомов углерода. В качестве конкретных примеров могут быть упомянуты ацетон, метилэтилкетон, метилбутилкетон, метилизобутилкетон и т.п. Предпочтительными являются ацетон и метилэтилкетон, а наиболее предпочтительным является ацетон.
Нитрилы не имеют конкретных ограничений, и они могут быть циклическими или ациклическими либо насыщенными или ненасыщенными. Однако в основном предпочтительно использовать насыщенные нитрилы. Обычно они содержат от 2 до 20 атомов углерода, предпочтительно от 2 до 12 атомов углерода, а более предпочтительно от 2 до 8 атомов углерода.
В качестве конкретных примеров могут быть упомянуты ацетонитрил, пропиононитрил, малононитрил, бутиронитрил, изобутиронитрил, сукцинонитрил, валеронитрил, глутаронитрил, гексаннитрил, гептилцианид, октилцианид, ундеканнитрил, додеканнитрил, тридеканнитрил, пентадеканнитрил, стеаронитрил, хлорацетонитрил, бромацетонитрил, хлорпропиононитрил, бромпропиононитрил, метоксиацетонитрил, метилцианоацетат, этилцианоацетат, толуолнитрил, бензонитрил, хлорбензонитрил, бромбензонитрил, цианобензойная кислота, нитробензонитрил, анизонитрил, фталонитрил, бромтолуолнитрил, метилцианобензоат, метоксибензонитрил, ацетилбензонитрил, нафтонитрил, бифенилкарбонитрил, фенилпропиононитрил, фенилбутиронитрил, метилфенилацетонитрил, дифенилацетонитрил, нафтилацетонитрил, нитрофенилацетонитрил, хлорбензилцианид, хлорпропанкарбонитрил, циклогексанкарбонитрил, циклогептанкарбонитрил, фенилциклогексанкарбонитрил, толуолциклогексанкарбонитрил и т.п.
Предпочтительными являются ацетонитрил, пропиононитрил, сукцинонитрил, бутиронитрил, изобутиронитрил, валеронитрил, метилцианоацетат, этилцианоацетат, бензонитрил, толуолнитрил и хлорпропиононитрил. Более предпочтительными являются ацетонитрил, пропиононитрил, бутиронитрил и изобутиронитрил, а наиболее предпочтительным является ацетонитрил.
Из азотных соединений, не являющихся нитрилами, могут быть упомянуты, например, амиды, такие как формамид, N-метилформамид, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, нитрометан, триэтиламин, пиридин и т.п.
В качестве примеров соединений серы могут быть упомянуты диметилсульфоксид, сульфолан и т.п.
При выборе органического растворителя из вышеупомянутых органических растворителей следует учитывать такие свойства, как температура кипения и вязкость (например, этот растворитель должен иметь температуру кипения, которая позволяла бы осуществлять соответствующее нагревание для повышения растворимости и облегчала бы удаление растворителя из сырой массы путем сушки и выделения растворителя из фильтратов после кристаллизации и т.п. (примерно от 30 до 150°С при 1 атм.)); температура плавления, то есть температура, при которой почти не происходит отверждения в случае обработки при комнатной температуре, а также после охлаждения до комнатной температуры или ниже (но не ниже, чем примерно 0°С, предпочтительно не ниже, чем примерно 10°С, а более предпочтительно не ниже, чем примерно 20°С); и низкая вязкость (не выше, чем примерно 10 сП при 20°С и т.п.).
Эффект предотвращения окислительного действия на восстановленный кофермент Q10 в растворителе имеет тенденцию к увеличению уровня восстановленного кофермента Q10 в высоконцентрированном растворе. Восстановленный кофермент Q10 обнаруживает высокую растворимость в вышеупомянутых органических растворителях с высокоэффективной защитой от окисления (например, в углеводородах, эфирах жирных кислот и т.п.). Высокая растворимость позволяет работать с высококонцентрированным раствором и способствует предотвращению окисления. Для предотвращения окисления в процессе экстракции предпочтительная концентрация восстановленного кофермента Q10 в вышеупомянутом органическом растворителе, используемая для предотвращения окисления в процессе экстракции, не имеет конкретных ограничений, но в основном она составляет не менее чем 0,001 мас.%, предпочтительно не менее чем 0,01 мас.%, а более предпочтительно не менее чем 0,1 мас.%. Верхний предел не имеет конкретных ограничений, однако в основном он составляет не более чем 10 мас.%.
Из вышеупомянутых органических растворителей, применяемых для экстракции и выделения восстановленного кофермента Q10 из сырых и сухих микробных клеток или из продукта их разрушения, предпочтительно использовать гидрофильные органические растворители. В частности, могут быть упомянуты ацетон, ацетонитрил, метанол, этанол, 1-пропанол, 2-пропанол и т.п.
Кроме того, из вышеупомянутых органических растворителей, применяемых для экстракции и выделения восстановленного кофермента Q10 из водной суспензии микробных клеток или из продукта их разрушения, предпочтительно использовать гидрофобные органические растворители. Использование таких растворителей способствует удалению водорастворимых веществ, продуцируемых микроорганизмами. Многие гидрофобные органические растворители обладают высокоэффективным действием, предупреждающим окисление, как описано выше, а поэтому они являются наиболее предпочтительными.
Из гидрофобных органических растворителей предпочтительными являются углеводороды, эфиры жирных кислот и простые эфиры.
При осуществлении вышеупомянутой экстракции в том случае, если восстановленный кофермент Q10 экстрагируют из водной суспензии микробных клеток или из продукта их разрушения, в частности, из водной суспензии указанного продукта разрушения, а более конкретно, в том случае, если указанный продукт разрушения подвергают физической обработке органическим растворителем, то имеется тенденция к образованию эмульсии, что частично обусловлено присутствием клеточных компонентов, таких как белки, а поэтому разделение фаз значительно затрудняется. Следовательно, важным фактором является подавление образования вышеупомянутых эмульсий и эффективное осуществление экстракции.
Поэтому в качестве растворителя для экстракции, в дополнение к вышеупомянутым гидрофобным органическим растворителям, предпочтительно использовать гидрофильный органический растворитель в качестве вспомогательного растворителя в данной комбинации.
В этом случае гидрофобный органический растворитель не имеет конкретных ограничений, и могут быть использованы вышеупомянутые органические растворители. Предпочтительными являются углеводороды, а более предпочтительными являются алифатические углеводороды. Из алифатических углеводородов предпочтительно использовать углеводороды, имеющие от 5 до 8 атомов углерода.
В качестве конкретных примеров алифатических углеводородов, содержащих от 5 до 8 атомов углерода, могут быть упомянуты пентан, 2-метилбутан, гексан, 2-метилпентан, 2,2-диметилбутан, 2,3-диметилбутан, гептан, изомеры гептана (например, 2-метилгексан, 3-метилгексан, 2,3-диметилпентан, 2,4-диметилпентан), октан, 2,2,3-триметилпентан, изооктан, циклопентан, метилциклопентан, циклогексан, метилциклогексан, этилциклогексан и т.п. Особенно предпочтительными являются гексан, гептан и метилциклогексан, а наиболее предпочтительными являются гексан и гептан.
Гидрофильные органические растворители, используемые в комбинации с вышеупомянутым гидрофобным органическим растворителем, не имеют конкретных ограничений, и могут быть использованы растворители, упомянутые выше. Предпочтительными являются спирты. Из этих спиртов предпочтительно использовать одноатомные спирты, имеющие от 1 до 5 атомов углерода. В качестве конкретных примеров могут быть упомянуты метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутиловый спирт, трет-бутиловый спирт, 1-пентанол, 2-пентанол, 3-пентанол, 2-метил-1-бутанол, изопентиловый спирт, трет-пентиловый спирт, 3-метил-2-бутанол, неопентиловый спирт и т.п. Особенно предпочтительными являются метанол, этанол, 1-пропанол и 2-пропанол, а наиболее предпочтительным является 2-пропанол.
Количества используемого вышеупомянутого гидрофильного органического растворителя и гидрофобного органического растворителя не имеют конкретных ограничений. Но предпочтительно, чтобы в процессе экстракции концентрация используемого гидрофильного органического растворителя составляла в пределах от 5 до 50% по объему, а концентрация используемого гидрофобного органического растворителя составляла в пределах от 25 до 65 об.% в расчете на полный объем всего раствора.
При выделении восстановленного кофермента Q10 температура в процессе экстракции не имеет конкретных ограничений, но обычно она составляет в пределах от 0 до 60°С, а предпочтительно от 20 до 50°С.
В качестве метода экстракции могут быть использованы периодическая экстракция и непрерывная экстракция (предпочтительно противоточная многостадийная экстракция). Однако с точки зрения продуктивности предпочтительной является непрерывная экстракция (предпочтительно противоточная многостадийная экстракция). Продолжительность размешивания при периодической экстракции не имеет конкретных ограничений, но обычно она составляет не менее чем 5 минут. Среднее время удерживания при непрерывной экстракции конкретно не ограничено, но обычно оно составляет не менее чем 10 минут.
При выделении восстановленного кофермента Q10 предпочтительно соблюдать меры предосторожности во избежание разложения восстановленного кофермента Q10 (например, для того, чтобы восстановленный кофермент Q10 не подвергался окислению до окисленного кофермента Q10). Для этого вышеупомянутую экстракцию (включая разрушение клеток) предпочтительно осуществлять в присутствии кислоты или слабого основания, а более предпочтительно в кислотных или нейтральных условиях. В случае, если в качестве показателя используется рН, то несмотря на то, что он зависит от времени контактирования, значение рН обычно не должно превышать 10, предпочтительно 9, более предпочтительно 8, а еще более предпочтительно 7.
При вышеупомянутых условиях реакция окисления может быть в основном предотвращена, а более конкретно, но необязательно, вышеупомянутое разрушение и/или экстракцию клеток предпочтительно осуществлять в условиях, при которых восстановленный кофермент Q10 будет защищен от реакции окисления. Таким образом, при этих условиях предпочтительно проводить по меньшей мере экстракцию, а более предпочтительно - и разрушение, и экстракцию.
Выражение "условие, при котором восстановленный кофермент Q10 защищен от реакции окисления", означает, например, условия, предусматривающие присутствие дезоксигенированной атмосферы (атмосфера инертного газа, такого как азот, двуокись углерода, гелий, аргон или водород, пониженное давление, кипение); условия с использованием высокой концентрации соли, например, предпочтительно, условия, где содержание солей (например, неорганических солей, таких как хлорид натрия и сульфат натрия) составляет не менее чем примерно 5% в водной фазе; условия в присутствии сильной кислоты (например, кислоты с величиной рКа, не превышающей 2,5 в водном растворе), например, в присутствии не менее чем 0,1 мол.% сильной кислоты в расчете на 1 моль восстановленного кофермента Q10, и условия в присутствии антиоксиданта, например, при одновременном присутствии аскорбиновой кислоты, лимонной кислоты, их солей и сложных эфиров (например, не менее чем 0,1% по массе восстановленного кофермента Q10). При этом могут быть также упомянуты условия восстановления (условия, при которых окисленный кофермент Q10 может быть превращен в восстановленный кофермент Q10), например, условия, предусматривающие контактирование с восстановителем, таким как дитионовая кислота.
При вышеупомянутом культивировании (ферментации) и экстракции может быть соответствующим образом продуцирован и выделен восстановленный кофермент Q10. При этом предпочтительно, чтобы экстракт содержал не менее чем 70 мол.%, а предпочтительно не менее чем 75 мол.% восстановленного кофермента Q10 из общего количества полученных коферментов Q10.
Полученный таким образом экстракт, содержащий восстановленный кофермент Q10, необязательно очищают колоночной хроматографией, обработкой восстановителем или т.п., а затем подвергают кристаллизации с получением кристаллов восстановленного кофермента Q10 высокой чистоты. Иногда, а также в данном случае, предпочтительно осуществлять ряд стадий обработки в вышеупомянутых "условиях, при которых восстановленный кофермент Q10 защищен от реакции окисления".
В соответствии с настоящим изобретением, окисленный кофермент Q10 может быть продуцирован путем окисления вышеупомянутых микробных клеток или продукта их разрушения, с последующей экстракцией окисленного кофермента Q10 органическим растворителем либо экстракцией восстановленного кофермента Q10 из микробных клеток или продукта их разрушения органическим растворителем, и необязательно очистки и окисления полученного продукта с получением окисленного кофермента Q10.
Вышеупомянутое окисление может быть осуществлено, например, путем смешивания восстановленного кофермента Q10 (предпочтительно водной суспензии микробных клеток или продукта их разрушения, содержащей восстановленный кофермент Q10; экстракта, содержащего восстановленный кофермент Q10 или т.п.) с окислителем (например, диоксидом марганца или т.п.), а затем, например, окисления данной смеси при комнатной температуре (например, 30°С) в течение не менее чем 30 минут. В том случае, если микробные клетки или продукты их разрушения являются окисленными, процедура экстракции окисленного кофермента Q10 может быть осуществлена способом, аналогичным вышеупомянутому способу экстракции восстановленного кофермента Q10. Таким образом, может быть эффективно выделен окисленный кофермент Q10. В некоторых случаях нет необходимости осуществлять выделение окисленного кофермента Q10 в "условиях, при которых восстановленный кофермент Q10 защищен от реакции окисления", которое было рекомендовано для выделения восстановленного кофермента Q10, и такое выделение может быть осуществлено с учетом общепринятых норм безопасности и т.п. Полученный таким образом окисленный кофермент Q10 может быть, но необязательно, очищен колоночной хроматографией или т.п., и, наконец, после проведения процедуры кристаллизации могут быть получены кристаллы окисленного кофермента Q10 высокой чистоты.
Краткое описание графического материала
На чертеже представлена схематическая диаграмма устройства аппарата для противоточной 3-стадийной непрерывной экстракции, используемого в Примере 8.
Наилучший способ осуществления настоящего изобретения
Настоящее изобретение более подробно описано в нижеследующих примерах. Однако эти примеры не должны рассматриваться как ограничение объема настоящего изобретения.
(Пример 1)
Различные микроорганизмы, продуцирующие кофермент Q10 и проиллюстрированные в нижеследующих таблицах 1-3, культивировали со встряхиванием (амплитуда: 2 см, 310 возвратно-поступательных движений/мин) при 25°С в течение 72 часов в 10 мл культуральной среды [(глюкоза: 20 г, пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г)/л, рН: 6,0] с использованием тест-пробирки (внутренний диаметр: 21 мм, вся длина: 200 мм), и полученный бульон необязательно концентрировали. В атмосфере азота, при одновременном присутствии 3 объемных частей изопропанола и 18,5 объемных частей н-гексана на 10 объемных частей бульона, полученные растворы интенсивно встряхивали в течение 3 минут с использованием 10 объемных частей стеклянных сфер (425-600 мкм) для осуществления разрушения и экстракции клеток. Полученные гексановые фазы упаривали (при 40°С) при пониженном давлении и анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения отношения и количества продуцированного восстановленного кофермента Q10.
Условия ВЭЖХ:
Колонка: YMC-Pack 4,6 x 250 мм (изготавливаемая YMC. Co., Ltd.)
Подвижная фаза: метанол/н-гексан = 85/15.
Скорость потока: 1 мл/мин.
Детекция: УФ на 275 нм.
Результаты представлены в таблицах 1-3. Содержание восстановленного кофермента Q10 означает величину в молярных процентах отношения количества восстановленного кофермента Q10 к общему количеству окисленного кофермента Q10 и восстановленного кофермента Q10, вычисленного по площади пиков для восстановленного кофермента Q10 и окисленного кофермента Q10, и отношение их коэффициентов молярного поглощения (1:7,5).
Нижняя цифра: продуцированное количество восстановленного кофермента Q10 (мкг/мл)
7
7
2
2
3
2
3
2
7
5
6
2
3
5
3
2
2
2
3
3
4
6
2
Нижняя цифра: продуцированное количество восстановленного кофермента Q10 (мкг/мл)
2
2
6
3
2
2
2
8
6
5
5
2
7
8
4
2
2
2
6
6
9
8
7
9
Нижняя цифра: продуцированное количество восстановленного кофермента Q10 (мкг/мл)
8
7
6
6
2
3
2
3
8
4
3
4
2
2
2
2
2
5
5
3
10
(Пример 2)
Rhodotorula glutinis IFO1125 культивировали в аэробных условиях при 25°С в течение 48 часов в культуральной среде (пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г, глюкоза: 20 г/л, рН: 6,0). После культивирования клетки собирали путем центрифугирования и суспендировали в буферном растворе фосфорной кислоты при рН 7, в который был добавлен N-метил-N'-нитро-N-нитрозогуанидин, так, чтобы его концентрация составляла 200 мкг/мл. После выдерживания раствора при 25°С в течение 1 часа клетки 5 раз промывали раствором 0,9% NaCl, а затем суспендировали в растворе 0,9% NaCl. Полученную клеточную суспензию соответствующим образом разводили, и на агаровой чашке с вышеупомянутой культуральной средой образовывалась колония. Продуцированное количество и содержание восстановленного кофермента Q10 в выделенном мутантном штамме определяли таким же способом, как и в примере 1. Затем штаммы, продуцирующие большее количество и содержание восстановленного кофермента Q10 по сравнению со штаммами дикого типа, подвергали повторной мутации. В результате 10-кратного проведения повторного мутагенеза получали мутантные штаммы с продуктивностью не менее чем 15 мкг/мл. В этом случае содержание восстановленного кофермента Q10 составляло не менее чем 80 мол.%.
(Пример 3)
Saitoella complicata IFO10748 культивировали в аэробных условиях при 25°С в течение 72 часов в 10 л культуральной среды (пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г, глюкоза: 20 г/л, рН: 6,0). Полученные клетки 2 раза подвергали разрушению при давлении разрушения 80 МПа на герметично закрытом гомогенизаторе высокого давления (изготовленном Lanni Co.) в атмосфере газообразного азота, в результате чего получали раствор разрушенных клеток. Этот раствор разрушенных клеток 3 раза подвергали экстракции с использованием 30 объемных частей изопропанола и 40 объемных частей гексана и получали экстракт. Степень экстракции составляла 99%. Содержание восстановленного кофермента Q10 составляло 97 мол.%.
(Пример 4)
При культивировании мутантных штаммов Rhodotorula glutinis IFO1125 в аэробных условиях при 25°С в 10 л культуральной среды (пептон: 10 г, дрожжевой экстракт: 5 г, солодовый экстракт: 3 г, глюкоза: 20 г/л, рН: 6,0), через 48-96 часов подавали глюкозу со скоростью 4 г/ч (количество подаваемой глюкозы: 190 г). Количество продуцированного восстановленного кофермента Q10 на единицу культуральной среды составляло не менее чем 20 мкг/мл, а степень восстановленного кофермента Q10 составляла не менее чем 80 моль%.
(Пример 5)
Экстракт получали, как описано в примере 3, но с заменой растворителя на раствор гексана, а затем полученный раствор адсорбировали на колонке с силикагелем и подвергали проявлению и элюированию раствором н-гексана/диэтилового эфира (9/1) с получением фракции, содержащей восстановленный кофермент Q10. Затем эту фракцию охлаждали, при перемешивании, до 2°С и получали белую взвесь. Все вышеупомянутые процедуры осуществляли в атмосфере азота. Полученную взвесь фильтровали при пониженном давлении, в результате чего получали сырые кристаллы, которые промывали проявляющим раствором, аналогичным раствору, используемому выше (температура растворителя, используемого для промывки, составляла 2°С), и полученные сырые кристаллы сушили при пониженном давлении (20-40°С, 1-30 мм рт.ст.), с получением 81 мг белых сухих кристаллов. Чистота полученных кристаллов составляла 99,9%, а содержание восстановленного кофермента Q10 составляло 90 мол.%.
(Пример 6)
Экстракт получали, как описано в примере 3, но с заменой растворителя на н-гексан, а затем в полученный раствор добавляли 50 мг диоксида марганца и смесь перемешивали при 30°С в течение 30 минут. Полученный таким образом реакционный раствор фракционировали и очищали, как описано в примере 5, с получением 74 мг окисленного кофермента Q10 высокой чистоты.
(Пример 7)
Saitoella complicata IFO 10748 культивировали в аэробных условиях при 25°С в течение 72 часов в 500 мл культуральной среды (пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г, глюкоза: 20 г/л, рН: 6,0). Полученные клетки подвергали разрушению 2 раза при разрушающем клетки давлении 80 МПа, на герметично закрытом гомогенизаторе высокого давления (изготовленном Lanni Co.) в атмосфере азота, в результате чего получали раствор разрушенных клеток. Содержание восстановленного кофермента Q10 в растворе разрушенных клеток по отношению к общему количеству коферментов Q10, включая окисленный кофермент Q10, составляло 97%. 200 мл раствора разрушенных клеток смешивали с изопропанолом и н-гексаном в отношении, указанном в нижеследующей таблице 4, в первой стадии процедуры экстракции, так, чтобы общее количество растворителя составляло 500 мл, и эти смеси перемешивали при 40°С в течение 30 минут для осуществления первой экстракции. После завершения экстракции полученные вещества выдерживали в течение 10 минут и отделенные верхние слои собирали. Отношения объемов нижних слоев (остатков) к общему количеству раствора определяли как показатели разделимости и выражали как положения границы раздела фаз, как показано в таблице 4.
Кроме того, для осуществления второй экстракции измеряли концентрации растворителя в остаточных слоях, а затем добавляли изопропанол и гексан так, чтобы отношения растворителей во всех растворах были такими же, что и отношения, показанные во второй стадии экстракции в таблице 4. Полученные растворы перемешивали при 40°С в течение 30 минут. Затем растворы оставляли на 10 минут для отстаивания и верхние слои собирали способом, описанным выше для определения концентраций растворителя в остаточных слоях. После этого добавляли изопропанол и гексан так, чтобы отношения количества растворителей во всех растворах были такими же, как отношения, показанные в таблице 4, в третьей стадии экстракции, и эти растворы перемешивали при 25°С в течение 30 минут для осуществления третьей стадии экстракции.
Отношения количеств восстановленного кофермента Q10, содержащегося в собранных верхних слоях каждой из первой, второй и третьей стадий, к количеству восстановленного кофермента Q10, содержащемуся в растворе разрушенных клеток или в остатке после экстракции перед последующей экстракцией, определяли как коэффициенты экстракции восстановленного кофермента Q10 в соответствующих стадиях. Результаты вычислений показаны в таблице 4. В этой таблице также показаны суммарные коэффициенты экстракции восстановленного кофермента Q10 во второй и третьей стадиях экстракции. В любых стадиях статическая разделимость была очень высокой, а в случае, когда экстракцию повторяли 3 раза, она составляла не менее 90%, что указывало на высокий выход. В частности, в случае, когда концентрация изопропанола была скорректирована и составляла не менее чем 30%, выход составлял не менее 99%.
фаз
Второй
Третий
19,0
29,7
52,4
41,7
0,624
0,645
47,6
55,5
86,2
93,8
Второй
Третий
37,7
40,6
33,7
30,9
0,549
0,565
83,7
40,1
98,5
99,1
Второй
Третий
34,1
36,8
37,3
34,6
0,553
0,555
85,8
46,6
98,3
99,1
Второй
Третий
34,1
42,4
37,3
29,0
0,553
0,644
85,8
50,0
98,3
99,0
Второй
Третий
40,1
40,7
31,4
30,7
0,595
0,593
88,1
45,3
98,6
99,1
Второй
Третий
40,1
45,8
31,4
25,7
0,595
0,663
88,1
40,7
98,6
99,0
(Пример 8)
Saitoella complicata IFO 10748 культивировали в аэробных условиях при 25°С в течение 72 часов в 750 л культуральной среды (пептон: 5 г, дрожжевой экстракт: 3 г, солодовый экстракт: 3 г, глюкоза: 20 г/л, рН: 6,0). Полученные клетки подвергали 2-кратному разрушению при разрушающем клетки давлении 140 МПа, в герметично закрытом гомогенизаторе высокого давления (изготовленном Lanni Co.) в атмосфере азота, в результате чего получали раствор разрушенных клеток. Этот раствор разрушенных клеток подвергали непрерывной экстракции в экстракционном аппарате для противоточной 3-стадийной непрерывной экстракции, показанной на чертеже. Емкость смесительного чана составляла 630 л, а емкость стационарного делительного чана составляла 200 л. Раствор разрушенных клеток подавали в первый смесительный чан, в который в соответствующих стадиях подавали изопропанол и н-гексан. Скорость подачи раствора разрушенных клеток составляла 2 л/мин, а скорость подачи изопропанола и н-гексана регулировали так, чтобы она составляла 1,3 л/мин для изопропанола и 3,7 л/мин для н-гексана в расчете на общее количество раствора, подаваемого в соответствующих стадиях. В этом случае концентрацию растворителей в соответствующих стадиях корректировали так, чтобы концентрация изопропанола поддерживалась на уровне 5-50 об/об.%, а концентрация н-гексана поддерживалась на уровне 25-65 об/об.%. Температура экстракции составляла 40°С, а время обработки составляло 6 часов. Через 6 часов количество выделенного восстановленного кофермента Q10, экстрагированного из раствора разрушенных клеток, вычисляли, исходя из количества восстановленного кофермента Q10, оставшегося после экстракции в стационарном делительном чане в третьей стадии, и, как было установлено, это количество составляло 98,9%. Стационарное разделение было успешно осуществлено в процессе всего периода эксперимента, и может быть осуществлена стабильная непрерывная экстракция.
Промышленное применение
В соответствии со способами настоящего изобретения, восстановленный кофермент Q10 может быть получен в промышленном масштабе недорогостоящим способом путем осуществления в основном простых стадий, предусматривающих культивирование микроорганизмов и выделение восстановленного кофермента Q10. Кроме того, окисленный кофермент Q10 также может быть продуцирован простыми способами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВОССТАНОВЛЕННОЙ ФОРМЫ КОЭНЗИМА Q10 | 2016 |
|
RU2613103C1 |
| СПОСОБ СТАБИЛИЗАЦИИ ВОССТАНОВЛЕННОГО КОФЕРМЕНТА Q И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2003 |
|
RU2304573C2 |
| КОЖНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОФЕРМЕНТ Q В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2001 |
|
RU2283098C2 |
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2009 |
|
RU2508290C2 |
| Способ получения протеина | 1977 |
|
SU837329A3 |
| СПОСОБ ПОЛУЧЕНИЯ L-АЛАНИЛ-L-ГЛУТАМИНА | 2002 |
|
RU2279440C2 |
| МИКРОБИОЛОГИЧЕСКАЯ КОНВЕРСИЯ МЕТАНА | 2014 |
|
RU2658440C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 1994 |
|
RU2182173C2 |
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2010 |
|
RU2539983C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛЮТАМАТА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2002 |
|
RU2280078C2 |
Настоящее изобретение относится к биотехнологии. Способ предусматривает культивирование микроорганизмов в аэробных условиях при 15-45°С и рН 4-9, необязательно разрушение клеток и экстрагирование восстановленного кофермента Q10. Восстановленный кофермент Q10 окисляют до или после экстрагирования и получают окисленный кофермент Q10. Таким образом, восстановленный кофермент Q10 и окисленный кофермент Q10 могут быть получены простыми способами в промышленном масштабе. 2 н. и 47 з.п. ф-лы, 1 ил., 4 табл.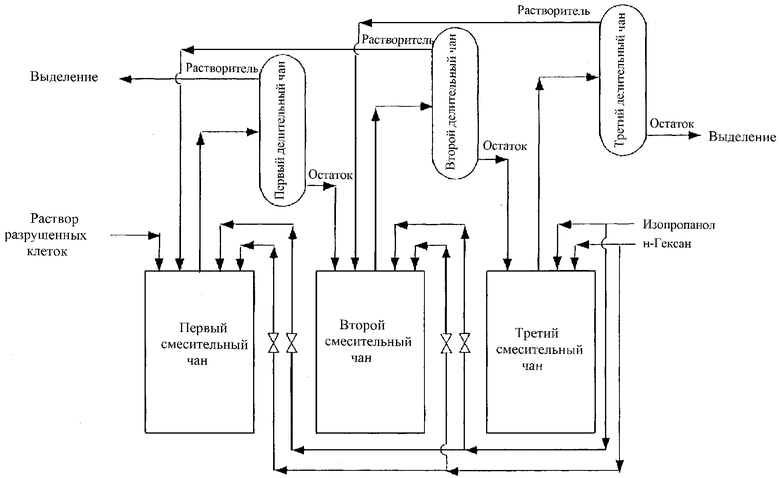

где указанный способ предусматривает
культивирование микроорганизмов, продуцирующих восстановленный кофермент Q10, в культуральной среде, содержащей источник углерода, источник азота, источник фосфора и микроэлементы,
причем указанное культивирование осуществляют в аэробных условиях при температуре от 15 до 45°С и при рН от 4 до 9,
необязательно разрушение указанных микробных клеток и
экстракцию продуцированного таким образом восстановленного кофермента Q10 органическим растворителем в условиях, при которых восстановленный кофермент Q10 защищен от реакции окисления.
где указанный способ предусматривает
культивирование микроорганизмов, продуцирующих восстановленный кофермент Q10, в культуральной среде, содержащей источник углерода, источник азота, источник фосфора и микроэлементы, причем указанное культивирование осуществляют в аэробных условиях при температуре от 15 до 45°С и при рН от 4 до 9,
необязательно разрушение указанных микробных клеток и либо окисление полученного таким образом восстановленного кофермента Q10 до окисленного кофермента Q10, а затем экстракцию полученного продукта органическим растворителем либо экстракцию продуцированного таким образом восстановленного кофермента Q10 органическим растворителем и окисление полученного продукта до окисленного кофермента Q10.
| Аварийный стопор | 1983 |
|
SU1123979A2 |
| СТЕНД ДЛЯ ВЫДАВЛИВАНИЯ СТАКАНЧИКОВ СТАЛЕРАЗЛИВОЧНЫХ КОВШЕЙ | 0 |
|
SU376170A1 |
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
Авторы
Даты
2007-04-27—Публикация
2002-12-27—Подача