Изобретение относится к области микробиологии, а в частности к пол чению протеина путем микробиосинтеза. Известен способ получения белка с помощью аэробного культивирования при температуре 45-65°С в водной ср де, содержащей источники углерода азота и .миниральных веществ и .Penlcillium notatum-chrysogenumCl. Недостатком известного способа является невысокий выхсад протеина. . Целью изобретения является повыш ние выхода протеина. Поставленная цель достигается те что g качестве исходной культуры микроорганизма для получения протеина используют термофильную смешанную культуру NRRL В-8158. Термофильная смешанная культура бактерий состоит из трех отдельны видов бактерий. Эти бактерии классифицируются (1) крупные грамположительные изогнутые палочки, подтип бактерии, класс SchTzomycet отряд Enbacteriales, семейство Bacillaceae род Bacillus,- (2) крупные грамотрицательные палочки, подтип бактерии, класс Schii omycete -гряд Enbacteriales, семейство Ва- , cillaceae, род Bacillus; (3) мелкие грс1мотрицательные папочки, подтип бактерии, класс Schizomycetes. Смешанная тремофильная культура проявляет ценные свойства. Эта- смешанная: культура (Мр) растет лучше при высоких температурах, чем при обычных, с большим выходом клеток и уменьшейной тенденцией к пенообразованию в условиях ферментации. Эта смешанная культура является термофильной, растет эффективно с высокой продуктивностью на сырье из окисленных угпеводородов, в часчастности, низших спиртов, наиболее предпочтительно из метанола или. этанола, при таких температурах, при которых большинство других известных видов бактерий либо относительно непродуктивны, либо просто не могут существовать, либо непродуктивны и нетолеранты к сырью из окисленных углеводородов. Термофильная смешанная культура сдана на хранение в Министерство сельского хозяйства США, Служба сельскохозяйственных исследований, Северно-центральный район. Северный региональный .исслеловательский центр,. 1815 North University Street Peoria, Ollinois 61604, в количестве тридцати лиофильных препаратов смешанной культуры до подачи настоящей заявки, и ей присвоен номер NRRL В-8158/ Эта смешанная культура М является высокопродуктивной при сравнитель «о высоких температурах ферментации и продуцирует требуемые и ценные одноклеточные протеиновые продукты с .высоким содержанием протеина в виде, аминокислот требуемого типа и в требуемом соотношении. Термофильная смешанная культура имеет постоянный состав. Смешенная культура, применяемая для лиофилизации, была выделена из серии фермента ционных испытаний и лиофилизована пр обычных условиях, которые заключаются в быстройм замораживании микробны клеток при. очень низкой температуре с последующим быстрым обезвоживанием в высоком вакууме.и хранении при ком натной температуре . С целью определения жизнеспособности некоторых лио филизированных образцов лиофилизированные смешанные культуры были зате реактивированы и подвергнуты выращиванию в таких же условиях, которые применялись ранее. Последующая ферf jjHTauHH с применением реактивирован ной Mg культуры показала, что в вос становленной культуре имеются те же три разновидности микроорганизмов в той же форме и в той же взаимосвязи, как и в источнике ферментации. Культура обеспечивает достижение больших скоростей получения одноклеточного протеина при уменьшенной пот ребности в охлаждении, при выращивании на питательной среде, которая в качестве источников углерода и энергии представляет собой окислен ный углеводород,предпочтительно низший спиртJ более предпочтительно метанол или этанол, лучше предпочтителен метанол или содержащая в основ ном метанол питательная среда. При использовании смешанной культуры достигается большой выход клето который определяется в граммах полученных клеток на 100 г использованного источника углерода и энергии, например метанола. Смешанная культура способна продуцировать одноклеточный протеин, который представляет собой смесь нескольких разновидностей клеток, поэтому получаемые из М, микробные клетки характеризуются лучшими соотношениями аминокислот, чем продукты, получаемые из одной чистой культуры. Был взят образец почвы на глубине 6Д см от поверхности земли, покрывающей паропровод в Bartlesville, Oklahoma, Research Center of phillips Petro,leum Co. Была применена обычная методика обогащения в присутствии метанола для выделения отдельных или особых культур. Получена стабильная по сЬставу смешанная культура термофильных микроорганизмов. Термофильная смешанная культура состоит из трех отдельных микроорганизмов. Три типа бактерий в стабильной по составу термофильной смешанной культуре описаны как (1) крупные грамположительные изогнутые палочки, (2) крупные грамотрицательные палочки и (3) мелкие грамотрицательные палочки. На рифленых пластинах получили изолированные колонии всех трех микроорганизмов на минеральном агаре, содержащем метанол. Однако, когда выделенные колонии были перенесены в водные среды для дальнейшего роста с метанод},ом в качестве источника углерода и энергии, роста культуры не было. Совместный рост этой смешанной культуры указывает на симбиотическую смесь всех трех видов микроорганизмов. По-видимому, продукт или продукты обмена микроорганизмов по меньшей мере одного вида служат питательной средой, необходимой для роста микроорганизмов другого или других видов. Природа этого продукта обмена в точности пока еще не известьГа. Можно предположить, что этот продукт обмена токсичен для микроорганизма, .которые его вырабатывает, поэтому для продолжения нормального роста этого микроорганизма необходимо присутствие другого микроорганизма, который потребляет этот токсичный для первого микроорганизма продукт обмена . Другим подтверждением такого симбиоза является тот факт, что при ферментации с применением М., образуется значительно меньше пены в типовых условиях аэробной ферментации по сравнению с количеством пены, образующейся обычно в равноценных типичных условиях аэробной ферментации , но с применением чистых термофильных бактерий рода Bacillus. Возможно, что М не образует такого большого количества пены, которое следовало бы ожидать, потому что при ферментации с применением М внеклеточный продукт, вероятно протеиновог о характера, поглощается микроорганизмами, по меньшей мере, одного из симбиотических видов, таким образом этот продукт, являющийся пенообразователем, непрерывно выводится из ферментационной смеси. Источником углерода и энергии (или питатель.ной средой) является окисленный углеводород. Окисленные углеводороды включают спирты, кетоны, сложные и простые эфиры, кислоты и адельгиды, которые в основном явл ются водорастворимыми и предпочтительно содержат до 10 атомов углеро да в молекуле. Например, метанол, этанол, пропа , бутанол, пентанол, гексанол, 1,7-пентандиол 2-гептанол, 2-метил 4-пентанол, пентановая кислота, 2-метил-бутановая кислота, 2-пентанол, 2-метил-2-пропанол, 2-пропанол муравьиная кислота, уксусная кислот пропановая кислота, формальдегид, ацетальдегид, пропаналь, бутаналь, 2-метилпропаналь, бутановая кислота 2-метилпропановая кислота, пентановая кислота, глутаровая кислота, ге сановая кислота, 2-метилпентановая кислота, гептандикарбоновая кислота гептановая кислота, 4-гептанон, 2-гептанон, окатановая кислота, 2-этилгексановая кислота, глицероль, этиленгликоль, пропиленгликояь, 2.-пропанон, 2-бутанон, диэтиловый эфир, метилэтиловый эфир, диметилов эфир, ди-п-пропиловый эфир, п-пропил изопропиловый эфир, включая смеси лю бых двух или более из этих веществ. Нефтяные газы, например природный газ, метан, иЛи другие газы, например этан, могут быть окислены для получения смесей с преобладающим содержанием соответствующих спиртов, а также, небольимх количество кетонов альдегидов, простых эфиров и кислот Предпочтительны спирты с С, -Cj в молекуле. К ним относятся спирты как с линейной, так и с разветвленной цепью, первичные, вторичные и третичные, одноатомные и многоатомные . В качестве примеров спиртов можно привести метанол, этанол, пропанол, бутанол, пентанол, гексанол, 1,7-гептандиол, 2-гептанол, 2-метил-4-пентанол, 2-пентанол, 2-метанол-4-б танол, 2-метиЛ-З-бутанол, 2-бутачол, 2-метил-1-пропанол, 2-метил-2-пропанол, 2-пропанол, глицероль, этиленгликоль, пропиленгликоль, вклю чая, смеси любых двух или более иэ этих веществ . Наиболее предпочтительными спирта ми являются спирты,содержащие в молекуле,.особенно одноатомные спирты, вследствие их доступности, водорастворимости и экономичности. Особенно предпочителен метанол, потому что относительно дешев,легко доступен.1 и растворим в воде, Как правило, подвод молекулярного кислорода к водной ферментационной реакционной смеси может быть осуществлен путем пропускания адекватны объемов воздуха или обогащенного кис лородом воздуха или отдельно воздуха и чистого кислорода в возрастающем количестве через ферментационный сосуд. Отходящие газы могут быть регенерированы и при необходимости поданы на рециркуляцию с целью максимального использования кислорода, например, путем отгонки углекислого газа и отходящих газов и рециркуляции. .Расход подаваемого в ферментационную смесь воздуха 0,1-10, чаще 0,72,5 объемов воздуха в 1 мин на объем жидкости в ферментационном аппарате, или, в пересчете на кислород соответственно 0,02-2,1 и 0,14-0,55. Давление может изменяться в очень широком интервале, например 0,1100 атм/10,13-10132 кПа/, чаще 130 атм/101,3-3039 кПа/, предпочтительно 1-5 атм/101,3-506,5 кПа/. Давление выше атмосферного имеет то преимущество , что оно приводит к увеличению содержания растворенного кислорода в водной ферментационной среде, что в свою очередь способствует ускоренному росту микроорганизмов. Целесообразно применять давление выше атмосферного особенно так, как высокая температура, при которой ведется термофильная ферментация, вызьгеает понижение растворимости кислорода в водной ферментационной среде. Выраицивание М, смешанных бактерий из сырья из окисленн 1лх углеводородов может быть успешно осуществлено при 45-65°С,, предпочтительно, для достижения оптимальной скорости роста, 50-60с. Более низкие температуры подавляют рост бактерий. Высокие концентрации некоторых из описанных источников углерода и энергии, например метанола, могут подавлять нормальный рост микроорганизмов или быть даже токсичными для микроорганизмов, примен.яемых для ферментации с использованием смешанной культуры, и их следует избегать. : Процесс ферментации может быть осуществлен периодически или непрерывным способом. Непрерывный способ особенно выгоден, когда источником углерода и энергии является низший спирт, например метанол или этано/ расход которого может быть легко автоматизирован. Применение таких микроорганизмов и такого сырья в периодическом ферментационном процессе считается неэкономичным. Однако при непрерывном процессе ферментации такие питательные среды высокоэффективны и экономичны. При ферментации, после того как в ферментаторе надлежащим образом произведен посев смешанной культуры, окисленный углеводород может быть добавлен в виде отдельного потока, либо он может быть смешан с водой в виде водного потока с целью ее стерилизации или с минеральной средой с целью ее стерилизации или же могут быть осуществлены всеэти варианты сразу. Обычно окисленный углеводород подается отдельно для удобства регулирования концентрации в поступающем в ферментатор потоке в интервале 2,5-35 вес.%, чаще 10-15 вес.%.
Рост микроорганизмов осуществляется в ВОДНОЙ питательной среде, содержащей водный раствор минеральной соли, источник углерода и энергии, молекулярный кислород и исходный посевной материал смешанной культуры
MO.
Скорость ферментационного роста
можно регулировать путем регулирования подачи окисленного углеводорода. Скорость подачи источников углерода и энергии в ферментатор следует регулировать так, чтобы она в основном была равна скорости потребления его микроорганизмами во избежании значительного накопления в ферментаторе, в частности, каких-нибудь токсически веществ, Удовлетворительный контроль может быть достигнут также путем гфоверки содержания непрореагированного питательного материала в выходящем из ферментаторов потоке, оно долно составлягь 0-0,2 вес.%.
Обычно, при вышеприведенных условиях, время-нахождения микробных клеток в ферментаторе при непрерывном процессе составляет приблизительно 2-4 ч , хотя оно не имеет решающего значения.
Кроме вьаиеописан ных молекулярного кислорода и источника углерода и энергии, культуре М требуются также минеральные питательные вещества и источник усвояемого азота. Источником азота может быть любое азотсодержащее соединение, способное выделять азот в виде, удобном для обменного поглощения организмами. Хотя могут применять различные органические источники азота, например другие протеины, мочевина или т.п., но обычно неорганические источники азота более экономичны и удобны для практического применения. В качестве примера таких неорганических азотсодержащих соединений можно привести аммиак или гйдроксид аммония, а также различные соли аммония, например карбонат аммония, цитрит аммония, фосфат аммония, сульфат аммония и пирофосфат аммония.. Удобно применять газообразный аммоний, который можно барботировать в соответст.вующих количествах через водную ферментационную среду.
рН водной микробной ферментационной смеси 5,5-7,5 предпочтительно 6-7. Подача аммиака способствует поддержанию требуемых значений рН, так как иначе водная среда становится слабо кислой. Вообще интервал препочтительнь х значений рН для микроорганизмов в какой-то степени зави сит от применяемой среды, поэтому предпочтительный интервал значений
рН может изменяться незначительно при изменении минеральной среды.
Кроме источников кислорода, азота и углерода и энергии, необходимо к питательной среде добавлять выбранные минеральные питательные вещества в необходимых количествах и соотношениях, чтобы обеспечить правильный рост микроорганизмов и максимальное усвоение окисленного углеводорода клетками в процессе микробной конверсии.
Источники фосфат-ионов или других ионов фосфора, а также ионов магния, кальция, натрия, маргагЩа, молибдена и меди обеспечивают потребность
5 в основных минеральных веществах. Для ферментационного процесса целесообразно применять приведенную ниже минеральную питательную среду (ГМ-12), которая содержит еще в ка
0,честве компонента раствор, содержавший следы минеральных веществ.
Количество
Компонент
35 Раствор, содержащий следы минеральных веществ
Дистиллированная 40 вода
Раствор, содержащий следы минеральных веществ, приведенниже.
Количество
Компонент
Дистиллированная
До 1 л 65
Могут применяться- также и другие концентрации минеральной среды. Значения которых приведены в примерах.
До начала работы либо в периодическом либо в непрерывном режиме все оборудование - реакторы или устройство для ферментации, сосуды или сборники, циркуляционные или охладительные устройства и т.п. - должно быть стериализовано, например, паром при температуре по меньшей мер IZl-C в течение нескольких минут, например 15 мин. Затем стерилизованный реактор засевается культурой в присутствии всех требуемых питательных веществ, включая подачу молекулярного кислорода и окисленfioro углеводорода.
Могут применяться контрольноизмерительные приборы для изменения плотности клеток, рН, содержания растворенного кислорода, концентрации окисленного углеводорода в ферментаторе, температуры , скоростей подачи и т.п. Предпочтительно чтобы подаваемые в ферментатор материалы были стерилизованы до поступлени в ферментатор. Если окисленныйуглеводород представляет собой вещество, способное стерилизовать другие матералы, например этанол или метанол, то целесообразно добавлять его в другие потоки,например в минеральную среду в достаточном для стерилизации количестве.
Следует избегать добавления противопенных веществ к ферментационной смеси, так как противопенные добавки, например силиконы, могут оказывать вредное д-ействие на содержание растворенного кислорода при рекомендемых повышенных температурах ферментции и могут вызвать замедление роста микроорганизмов или их гибель. Пена, образуемая культурой М(, не вредит росту и определенно благоприятствует поддержанию микроорганизмов в cpiCTeMe с высоким содержанием растворенного кислорода. Пена способствует поддержанию относительно большой поверхности раздела на границе газ/ жидкость. Таким образом, ферментация улучшается и улучшается теплопередача ее регулирование, равномерность и отсутствие точек перегрева.
При желании можно применять пенообразователи, например детергенты, предпочтительно неионные.
Выделение микробных клеток может быть осуществлено обычными способами , например путем подкисле.ния вытекающего из- ферментатора потока до рН приблизительно 4 и 1 агрева подкисленного потока до температуры убивающей микроорганизмы, например приблизительно до. , причем нагревать следует медленно, чтобы не повредить протеиновый продукт.
Затем вытекающий поток можно центрифугировать,, промыть, снова центрифугировать для отделения микробных гклеток от вытекающего из ферментатора потока. Клетки М9гут быть обработаны, чтобы вызвать разложение с целью облегчения извлечения из,них протеина и других веществ. В tlpoцессе ферментации образуются также нужные побочные продуктьз, которые могут быть извлечены из вытекающей
0 из ферментатора жидкости. Эти внеклеточные продукты могут повысить экономичность процесса в целом, так как среди них имеются ценных продукты, например полисахариды, амино5кислоты, например глутаминовая кислота, энзимы, витамины и т.п.
Одноклеточный протеиновый продукт является ценным источником протеина как для людей, так и для животных. Для питания людей клетки при
0 желании можно обработать с целью уменьшения содержания нуклеиновой кислоты, но для питания животных в такой обработке нет необходимости.
Пример 1. Проведена опыт5ная непрерывная ферментация с применением термофильной смешанной культуры. В ферментатор емкостью 7л, оборудованный аэратором, мешалкой, прибором для регулирования подачи
0 кислорода и устройствами для изменения и регулирования температуры и рН ферментационной смеси, загрузили в качестве посевного материала около 500 мл ферментационной реакцион5ной смеси из предыдущей опытной - ферментации с применением термофильной минеральной питательной среды М-12.
В ходе опыта поддерживают скорости перемешивания 1000 об/мин и рН 6,206,35 путем добавления при необходи- мости раствора гидроксида аммония. Расход подаваемого в ферментатор воздуха бьш 2 л/мин во время опыта. Через б ч в ферментатор стали подавать
5 также в основном чистый кислород со скоростью 0,5 л/мин,через 11В часов расход довели до 0,75 л/мин, через 174ч - до 1,5 л/мин и через 190 ч - до 2 л/мин.
0
Через 22 ч минеральнуюсреду заменили водным составом, содержащим 7,5 об.% метанола в дополнение к среде FM-12 плюс 0,75 г хлорида калия,
5 удвоенное против нормального колигчества следов минеральных веществ, утроенное против нормального коли чёства марганца (все дается в расчете на 1 л) и не содержащим хлорида натрия. После 166 ч питательная г
0 среда была згиленена водным средством, содержащим 10 об.% метанола, 2,5. мл фосфорной кислоты (85%) на 1 л 2 г/л.хлорида калия, 1,75 г/л MgSQ4.7HgO, 0,25 г/л ,
5
20 мл/л водного раствора (О Зг/л) ,jO и 35 мл/л ранее описанного раствора, содержащего следы минеральных веществ.
Скорость подачи среды составляла of 700 мл/ч в первые 22 часа до 817 мл/ч через 118 ч, 781 мп/ч через 166 ч и 763 мл/ч через 382 ч.
Пробы вытекающей ферментационной жидкости отбирались время от времени для извлечения из них клеток. Полученные значения содержания клеток в расчете на сухой вес клеток в граммах иа 1 л, вычисленные значения продуктивности в граммах клеток на 1 л в 1 ч, вычисленный выход предоставлены в табл. 1.
Таблица 1







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения биомассы | 1976 |
|
SU701545A3 |
| Штамм Methylococcus capsulatus - продуцент высокобелковой биомассы | 2022 |
|
RU2787202C1 |
| Способ получения биомассы | 1980 |
|
SU1015831A3 |
| Способ получения биомассы | 1973 |
|
SU578901A3 |
| ШТАММ БАКТЕРИЙ METHYLOBACILLUS METHANOLIVORANS GSA - ПРОДУЦЕНТ КОРМОВОГО БЕЛКА | 2023 |
|
RU2808127C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ | 1969 |
|
SU421199A3 |
| Способ получения биомассы микроорганизмов | 1977 |
|
SU923374A3 |
| Штамм гетеротрофных бактерий Cupriavidus gilardii - ассоциант для получения микробной белковой массы | 2018 |
|
RU2687135C1 |
| Способ утилизации навозной жижи свиней на корм | 1979 |
|
SU1058484A3 |
| СПОСОБ ФЕРМЕНТАЦИИ ГАЗООБРАЗНОГО СУБСТРАТА, СОДЕРЖАЩЕГО МОНООКСИД УГЛЕРОДА И ВОДОРОД | 2011 |
|
RU2566565C2 |

2,36 26,36 27,13 27,04 35,21 35,53 35,57
Твердые вещест-
на, г/л26,82 27,66. 27,87 35,5 36,66 36,76
Приблизительно через 126 ч были отобраны пробы ферментационной смеси которые были подготовлены для лиофилизации микробных клеток по известно методике. Затем эти лиофилизованные пробы хранились для последующего испол эования в опытной ферментации и для передачи на хранение образцов НТВ-53 хранителю микроорганизмов, уполномоченному Министерством сельского хозяства США. Северная региональная исследовательская лаборатория в Пеории штат Иллинойс
Периодически пробы отбирались так же из ферментационной реакционной смеси с целью микроскопического ис- следования морфологии клеток. Такое микроскопическое исследование показало, что культура М состоит из крупных грамположительных изогнутых палочек, крупных грамотрицательных палочек и мелких грамотрицательных палочек. Изредка наблюдались также крупные грамположительные (не изогнутые) палочки, но можно думать, что это временный вариант крупных изогнутых грамположительных палочек.
а) Значение получено путем выпаривания при 10. мл пробы вытека.ю щей из ферментатора жидкости и вычитания веса минеральных твердых веществ, содержащихся в 10 мл среды:
в) значение получено путем центрифугирования 100 мл пробы вытекающей из ферментатора жидкости, повторного суспендирования твердых веществ в дистиллированной воде и повторного центрифугирования для отделения твердых веществ, которые затем высушивались в течение ночи при
2,27 2,38 2,83 2,33 2,43
c)значение получено путем деления количества извлеченных твердых веществ (г/л) на количество введенного метанола (г/л к 100;
d)значение получено путем деления извлечейных твердых веществ (г/л на продолжительность нахождения смеси в ферментаторе (ч).
Пример 2. Приблизительно через 1 мес. одна ампула с диофилизированной микробной культурой НТВ-58, полученной при опытной ферментации, описанной вшве в примере 1, была вскрыта обычнЕФи способом в асептических условиях и добавлена к 100 мл ферментационной среды, обозначенной 1М2, которая тоже содержала 0,5% метанола. Состав среды 1М2 приведен ниже.
Раствор, содержащий следы минеральных веществ Дистиллированная Колбу, загруженную оживленной диофилиэированной культурой, подвергали инкубации при при встряхивании. Через 24 ч в колбе наблюдался хороший рост культуры и 5 мл.этой смеси перенесли в 10 мл среды 1М2, содержащей тоже 1,5 об.% метанола. Через 24 ч наблюдался хороший рост и был сделан третий перенос в ту же среду в две колбы, каждая из которых содержала 500 мл среды 1М2 плюс 1,5 об.% метанола. Третий перенос заключался в том что в каждую из этих колб ввели по 100 мл культуры. Культуру оставили расти в течение 32 ч и затем использовсши как посевной материал для опыт ной непрерывной ферментации в устройстве, описанном выше в примере 1, В ферментатор загрузили 100 мл среды FM-12 и 1000 мл посевного материала, к которому было добавлено 10 мл метанола. Поддерживали температуру , в рН 6,25-6,4 регулировали путе непрерывного добавления раствора гид
Продолжительность роксида аммония, как описано раньше. Сначала, пока культура была оставлена в ферментатора для акклиматизации, мешалка работала со скоростью 300 об/мин, а воздух подавался со скоростью 0,5 л/мин, ерез 7 ч началась непрерывная подача питательной среды в вышеприведенном примере 1, Кроме того,расход воздуха увеличили до 2 л/мин, а скорость мешалки увеличили до 1000 об/мин. Спустя 30 ч расход воздуха уменьшили до 1,75 л/мин и стали подавать кислород в количестве 0,75 л/мин, затем после 54 ч довели количество кислорода до 1 л/мин, после 198 ч - до 1,5 л/мин. Из вытекающей фермен ационной жидкости периодически отбирали пробы для определения содержания клеток в граммах на 1 л в расчете на сухой вес, а также выхода и продуктивности процесса ферментации. Данные, полученные при проведении опыта, представлены в табл. 2. Таблица2
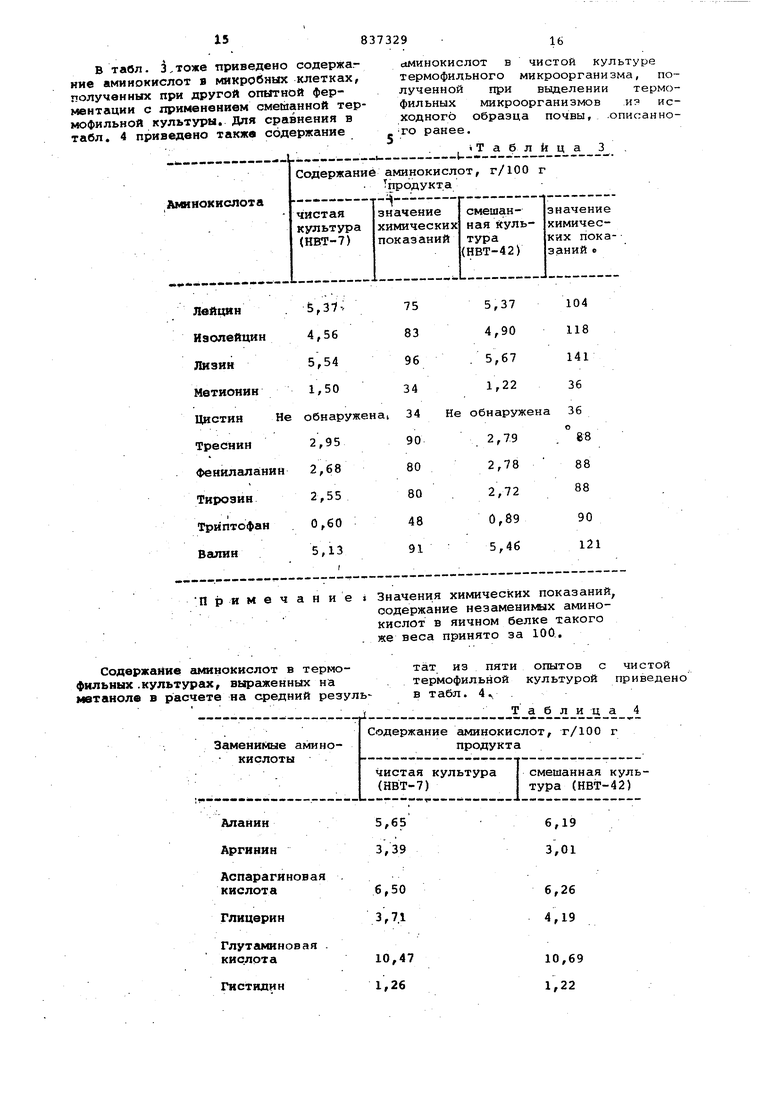
В тавл. приведено содержа.ние аминокислот в микробных клетках, полученных при другой опытной ферментации с применением смешанной термофильной культуры. Для сравнения в табл. 4 приведено также содержание
Примечание Значения химических показаний,
Содержание аминокислот в термофильных .культурах, выраженных на метаноле в расчете на средний резуль-«:,.-4-. Заменимые амино-продукта
йминокислот в чистой культуре термофильного микроорганизма, полученной при выделении термофильных микроорганизмов из исходного образца почвы, .опис;анного ранее.
содержание незаменимых аминокислот в яичном белке такого же веса принято за 100..
тат из пяти опытов с чистой термофильной культурой приведено в табл. 4 .
Содержание аминокислот, г/100 г
Содержание аминокислот, г/100 г
SEOffiKja
Пролин
Серин
Общее содержание незаменимых аминокислот
Общее содержание аминокислот
.сырой протеин
Можно видеть, что общее содержа-ние незаменимых аминокислот несколько выше у продукта смешанной культуры (47%), чем у продукта полученного из чистой культуры (46%). Далее если 11|езаменимые с ер у содержащие аминокислоты вводится путем добавления син тётического метионина, то значения химических-показаний указывают на то, что продукт, полученный на смешанной культуре, вдвое лучшес точки зрения питательной ценности продукта, полученного на чистой культуре в расчете на ближайшее низшее значение химических показаний для незаменимых аминокислот.
Продолжение табл. 4
I
смешанная кульчистая культура (НВТ-7) тура {НВТ-42)
2,38 1,75
32, Id
67,88 84,4
Формула изобретения
Способ получения протеина с помощью аэробного культивирования культуры микроорганизма в водной среде, содержащей источники углерода, азота и минеральные питательные вещества, отличающийся тем, что, с цепью повышения выхода протеина, в качестве исходной культуры микроорганизма используют термофильную УЛЬТУРУ NRRL В-8158.
Источники информации, принятые во внимание при эксперти е

Авторы
Даты
1981-06-07—Публикация
1977-12-30—Подача