Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения (R)-1-арил-2-тетразолилэтилового эфира карбаминовой кислоты. Точнее, настоящее изобретение относится к способу получения (R)-1-арил-2-тетразолилэтилового эфира карбаминовой кислоты, включающему энантиоселективное ферментативное восстановление арилкетона.
Уровень техники
Как описано в Публикации Заявки на Патент США 2006/0258718 A1, (R)-1-арил-2-тетразолилэтиловые эфиры карбаминовой кислоты (далее в описании определены как «карбаминовые соединения») с противосудорожной активностью применимы в лечении расстройств центральной нервной системы, включающих, в частности, тревогу, депрессию, судороги, эпилепсию, мигрень, биполярное расстройство, токсикоманию, курение, СДВГ, ожирение, расстройства сна, невропатическую боль, инсульты, когнитивные нарушения, нейродегенеративные расстройства, инсульты и мышечные спазмы.
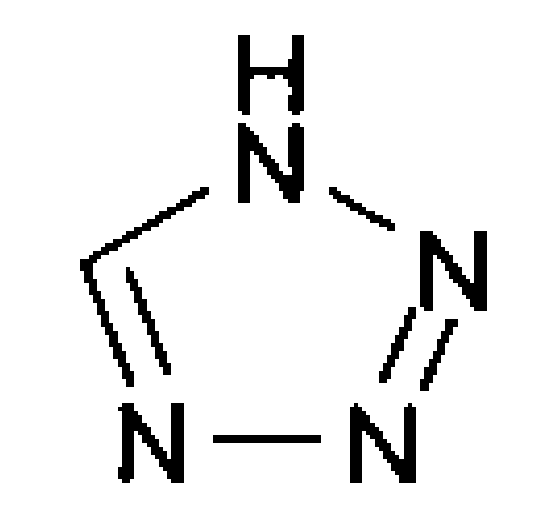
В зависимости от положения N в тетразольном фрагменте карбаматные соединения подразделяют на две группы изомеров положения: тетразол-1-ил (далее в описании определенный как «1N тетразол») и тетразол-2-ил (далее в описании определенный как «2N тетразол»). Введение тетразола для получения карбаматных соединений приводит к получению смеси 1:1 двух изомеров положения, которые при фармацевтическом применении необходимо разделить на индивидуальные изомеры.
Карбаматные соединения, обладающие хиральностью, должны иметь высокую оптическую чистоту, а также химическую чистоту при применении в качестве лекарственных средств.
Поэтому в Публикации Заявки на Патент США № 2006/0258718 A1 в качестве исходного вещества используется чистый энантиомерный (R)-арилоксиран, который подвергается превращению в промежуточный спирт через реакцию раскрытия цикла с помощью тетразола в присутствии подходящего основания в растворителе с последующим введением карбамоильной группы в промежуточный спирт. Для выделения и очистки полученных таким образом 1N- и 2N-изомеров положения после образования промежуточного спирта или карбамата проводят колоночную хроматографию.
Для применения в способе получения (R)-2-арилоксиран может синтезироваться из оптически активного вещества, такого как замещенное производное (R)-миндальной кислоты, различными путями или может быть получен асимметрическим восстановлением-реакцией образования цикла α-галогенарилкетона или разделением рацемической смеси 2-арилоксирана на отдельные энантиомеры. Сам по себе (R)-2-арилоксиран является дорогостоящим соединением.
Кроме того, реакция раскрытия цикла (R)-арилоксирана с тетразолом проводится при относительно высоких температурах вследствие низкой нуклеофильности тетразола. Однако реакция раскрытия цикла включает весьма вероятный риск неконтролируемой реакции, поскольку тетразолы начинают самопроизвольно разлагаться при 110~120°C.
С точки зрения выбора реакции, поскольку в каждом из (R)-2-арилоксиране и тетразоле есть два реакционноспособных сайта, реакция раскрытия цикла между ними приводит к замещению 1N- или 2N-тетразола в бензильном или концевом положении, что приводит к получению смеси 4 изомеров положения. Поэтому выход отдельных изомеров положения является низким, и индивидуальные изомеры трудно выделить и очистить.
Описание изобретения
Техническая задача
Один аспект настоящего изобретения предоставляет новый способ получения (R)-1-арил-2-тетразолилэтилового эфира.
Решение задачи
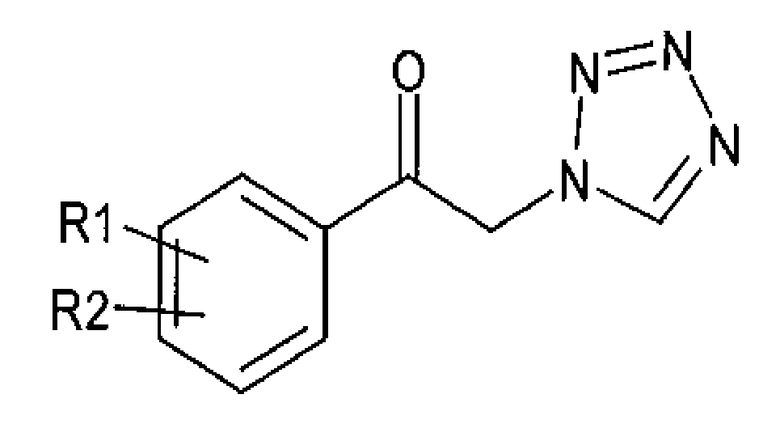
Для достижения указанного выше аспекта настоящее изобретение предоставляет способ получения (R)-1-арил-2-тетразолилэтилового эфира карбаминовой кислоты, представленного химической формулой 1, который включает энантиоселективное ферментативное восстановление алкилкетона, представленного химической формулой 2; и карбаминирование спирта (R)-конфигурации, представленного химической формулой 3:
Химическая формула 1

Химическая формула 2
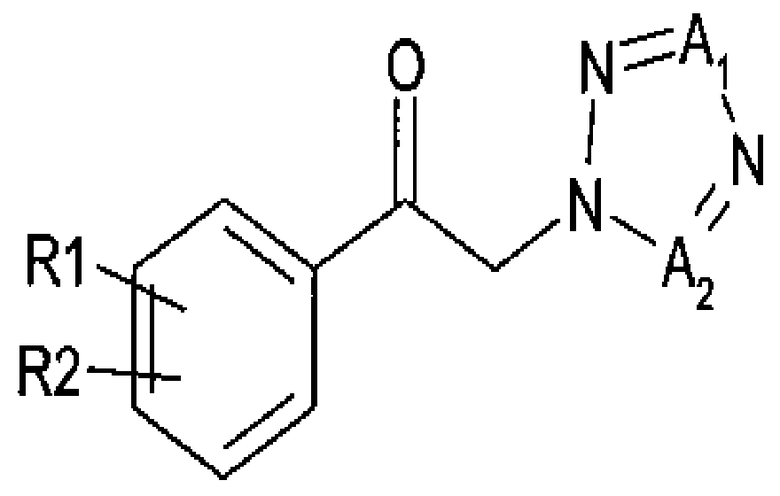
Химическая формула 3
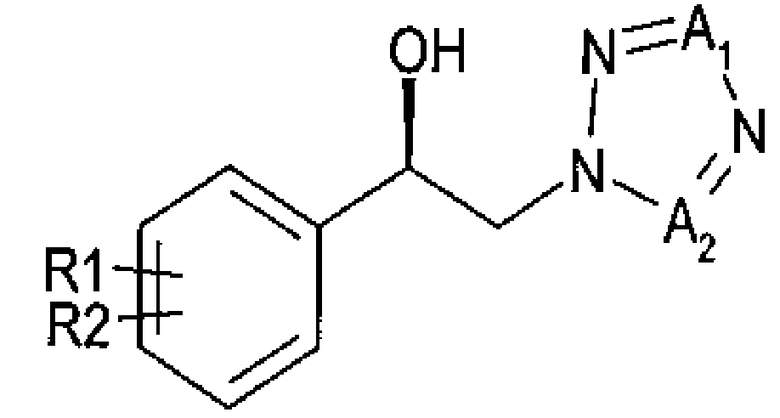
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигрупу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, содержащую от 1 до 8 атомов углерода;
один из А1 и А2 представляет собой СН, а другой представляет собой N.
Полезные эффекты изобретения
В соответствии с одним аспектом настоящего изобретения карбаматное соединение высокой оптической чистоты и высокой химической чистоты может производиться экономически выгодным образом.
Наилучший вариант осуществления изобретения
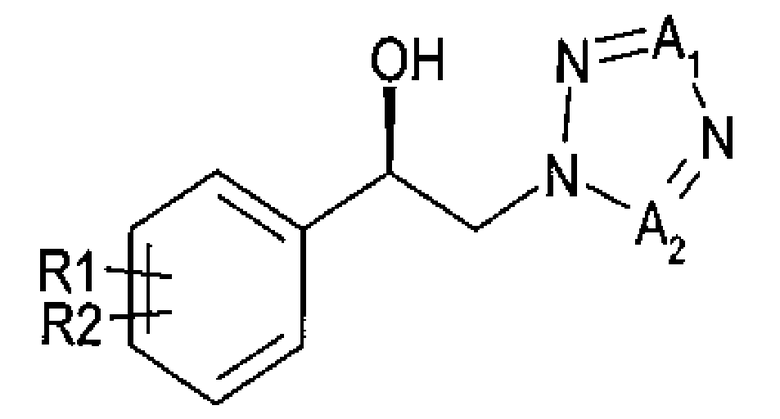
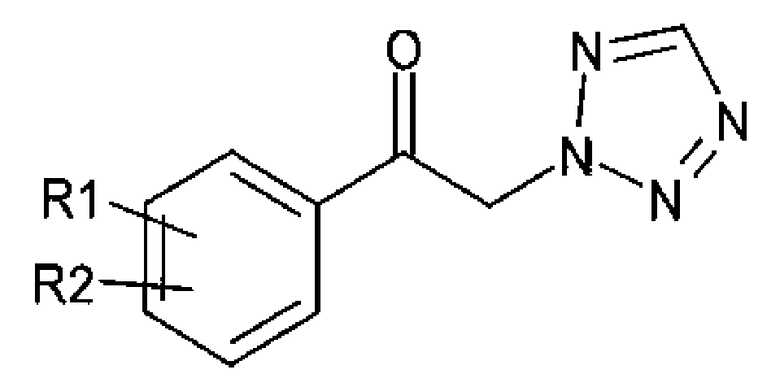
Другой аспект настоящего изобретения предоставляет новый способ получения спирта, представленного приведенной далее химической формулой 3, посредством энантиоселективного ферментативного восстановления арилкетона, представленного приведенной далее химической формулой 2
Химическая формула 2
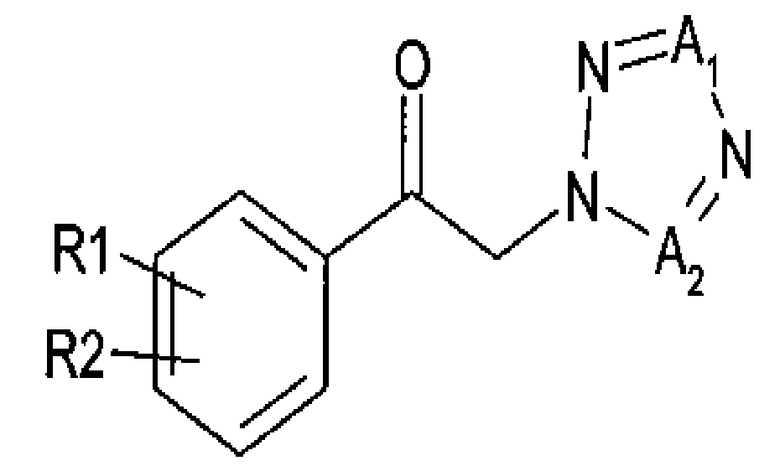
Химическая формула 3
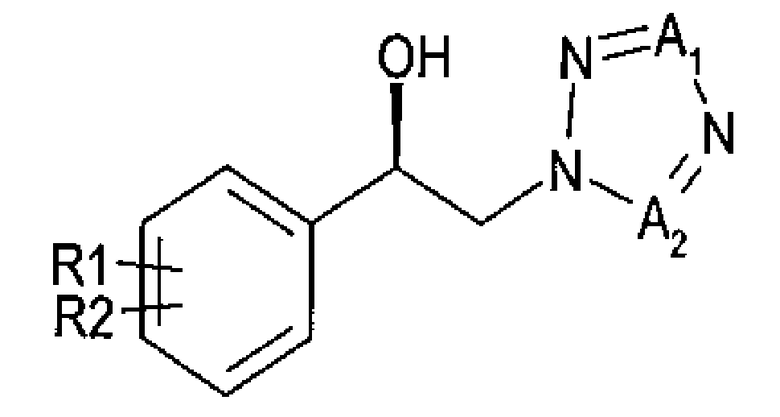
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигруппу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, содержащую от 1 до 8 атомов углерода;
один из А1 и А2 представляет собой СН, а другой представляет собой N; и
указанное восстановление проводится в реакционной смеси, включающей указанное соединение химической формулы 2, оксидоредуктазу, имеющую по меньшей мере 60% гомологию с аминокислотными последовательностями SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4, NADH или NADPH в качестве кофактора, который окисляется в процессе восстановления и постоянно регенерируется, косубстрат, включающий вторичный спирт, представленный формулой RxRyCHOH, где Rx представляет собой углерод и х представляет собой целое число от 1 до 10, Ry представляет собой водород и у представляет собой целое число, равное удвоенному значению х плюс два, и подходящий буфер.
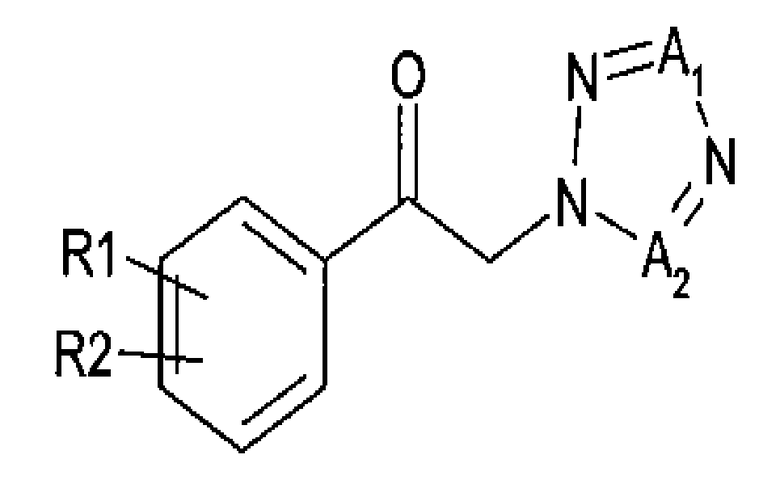
В соответствии с вариантом осуществления настоящего изобретения, способ, включающий энантиоселективное ферментативное восстановление арилкетона, представленного приведенной далее химической формулой 2, и карбаминирование спирта, представленного приведенной далее химической формулой 3, предоставлен для получения (R)-1-арил-2-тетразолилэтилового эфира карбаминовой кислоты, представленного приведенной далее химической формулой 1.
Химическая формула 1
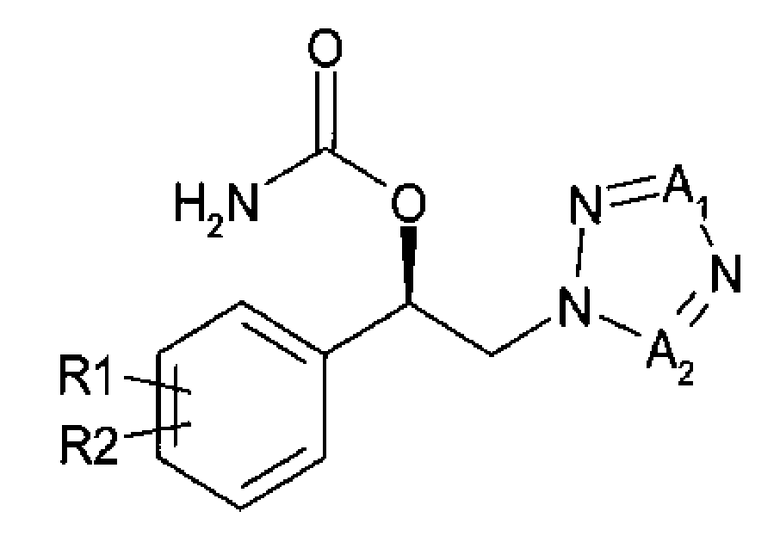
Химическая формула 2
Химическая формула 3
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигруппу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, содержащую от 1 до 8 атомов углерода;
один из А1 и А2 представляет собой СН, а другой представляет собой N.
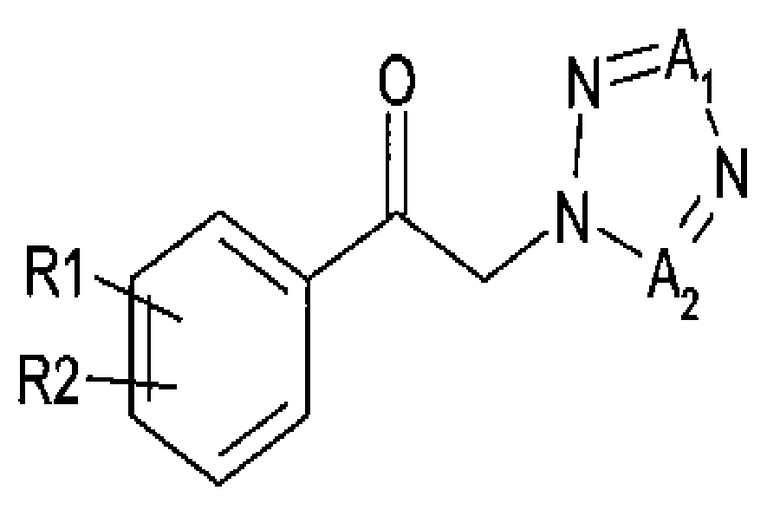
Алкилкетон химической формулы 2, применимый в качестве исходного вещества в способе получения, согласно настоящему изобретению может синтезироваться, например, реакцией замещения между алкилкетоном химической формулы 4 и тетразолом химической формулы 5:
Химическая формула 4
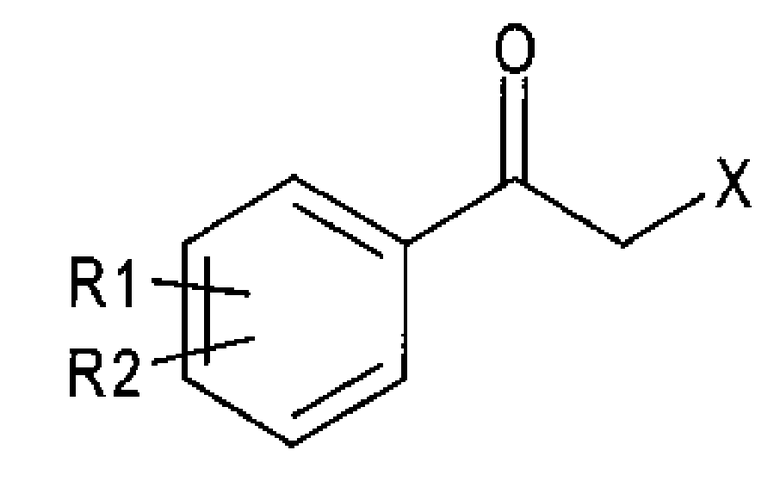
Химическая формула 5
где
R1 и R2 принимают значения, определенные выше; и
Х представляет собой удаляемую группу, такую как галогенид или сульфонат.
Синтез арилкетона химической формулы 2 из соединений, представленных химическими формулами 4 и 5, является экономически выгодным, поскольку указанные соединения являются коммерчески доступными, недорогими соединениями. Кроме того, реакция замещения может проводиться в относительно мягких условиях по сравнению с реакцией раскрытия цикла между (R)-2-арилоксираном и тетразолом. Таким образом, способ согласно настоящему изобретению представляет собой в определенной степени безопасный способ, несмотря на применение потенциально взрывоопасного тетразола, и гарантирует высокий производственный выход и легкую очистку без получения нежелательных изомеров в бензильных положениях.
Арилкетон, представленный химической формулой 2, который может быть синтезирован реакцией замещения с тетразолом, может представлять собой смесь изомеров положения, включая 1N арилкетон представленной далее химической формулы 2а и 2N арилкетон представленной далее химической формулы 2b, которые могут разделяться и очищаться с помощью коммерчески доступной кристаллизации.
Химическая формула 2а
Химическая формула 2b
Кристаллизация, применимая в данном изобретении, может включать добавление солюбилизирующего агента к продукту реакции замещения, то есть к смеси изомеров положения, и затем добавление осаждающего вещества. Необязательно, кристаллизация может после осаждения дополнительно включать выделение осадка фильтрацией, концентрирование фильтрата и добавление дополнительного осаждающего вещества.
Иллюстративные примеры солюбилизирующего агента согласно настоящему изобретению включают, но без ограничения, ацетон, ацетонитрил, тетрагидрофуран, этилацетат, дихлорметан, хлороформ, 1,4-диоксан и низшие спирты, содержащие от 1 до 4 атомов углерода, или их комбинации. Солюбилизирующий агент может применяться в количестве от 0 до 20 мл (об./масс.) из расчета на массу (г) смеси изомеров положения. Подразумевается, что выражение «добавление солюбилизирующего агента в количестве, равном нулю мл (об./масс.)», когда используется в данном описании означает немедленное добавление следующего осаждающего вещества без разбавления фильтрата.
Примеры осаждающего вещества согласно изобретению включают, но без ограничения, воду, С1-С4 низший спирт, диэтилэфир, пентан, гексан, циклогексан, гептан или их комбинации. Осаждающее вещество может медленно добавляться в количестве от нуля до 40 мл (об./масс.) из расчета на массу (г) смеси изомеров положения. Подразумевается, что выражение «добавление осаждающего вещества в количестве, равном нулю мл», когда используется в данном описании, означает оставление или охлаждение для получения осадка без добавления осаждающего вещества.
Выделение осадка, полученного в результате добавления осаждающего вещества, фильтрацией приводит к получению 1N алкилкетона химической формулы 2а в виде кристаллического вещества высокой чистоты.
С другой стороны, фильтрат, полученный таким образом после стадии фильтрации, может подвергаться концентрированию для повышения доли осаждающего вещества относительно солюбилизирующего вещества, что приводит к получению 2N арилкетона химической формулы 2b высокой чистоты. Доля концентрирования фильтрата может подходящим образом определяться специалистом данной области техники. Например, концентрация проводится до тех пор, пока растворитель не удалится полностью. Затем добавляются солюбилизирующий агент и осаждающее вещество, как описано выше.
В отличие от колоночной хроматографии описанная кристаллизация может коммерчески применяться без особого труда.
Энантиоселективное фенментативное восстановление позволяет превращать арилкетон химической формулы 2 в спиртовое производное (R)-конфигурации, представленное химической формулой 3.
Химическая формула 2
Химическая формула 3
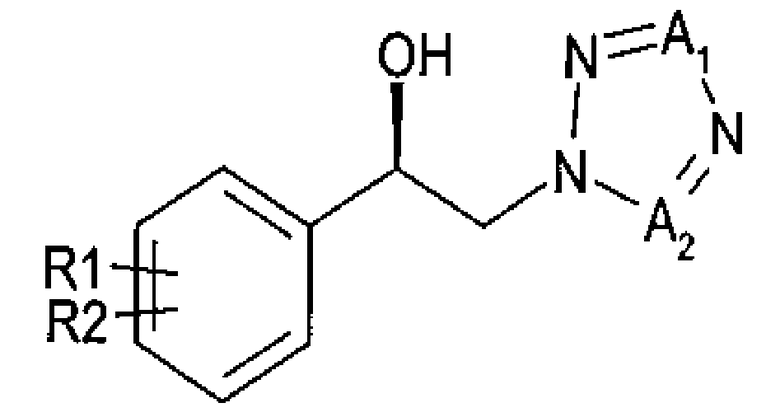
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигрупу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, включающую от 1 до 8 атомов углерода;
один из А1 и А2 представляет собой СН, а другой представляет собой N.
Энантиоселективное ферментативное восстановление может проводиться с использованием оксидоредуктазного фермента, суспендированного в реакционной смеси или иммобилизованного подходящим образом. Фермент может применяться в полностью очищенном состоянии, в частично очищенном состоянии или в клетках микроорганизмов, где он экспрессирован. Сами клетки могут быть в нативном состоянии, в состоянии с нарушенной проницаемостью мембраны или в лизированном состоянии. Специалист данной области техники по достоинству оценит, что применение этого фермента в клетках является предпочтительным для практики способа изобретения, поскольку оно обеспечивает значительную экономию затрат. Наиболее предпочтительно, фермент экспрессирован в E. coli и используется в виде суспензии нативных клеток.
Способ ферментативного восстановления арилкетоновых соединений формулы 2 может выполняться в реакционной смеси, включающей указанное соединение формулы 2, оксидоредуктазу, NADH или NADPH в качестве кофактора, ко-субстрат и подходящий буфер, где оксидоредуктаза включает аминокислотную последовательность, содержащую по меньшей мере 60% аминокислот, идентичных с одной из аминокислотных последовательностей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4.
Было установлено, что полипептиды, включающие одну из аминокислотных последовательностей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4, или полипептиды, включающие аминокислотную последовательность, которая идентична по меньшей мере на 60%, предпочтительно по меньшей мере на 90%, одной из аминокислотных последовательностей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4 и обладает оксидоредуктазной активностью, может применяться для восстановления соединения формулы 2 до соединения формулы 3 (R-конфигурации) с высокой степенью конверсии и высокой энантиомерной селективностью. Энантиомерный избыток R-спирта, полученного в результате энантиоселективного ферментативного синтеза, составляет по меньшей мере примерно 89%, предпочтительно по меньшей мере примерно 95% и наиболее предпочтительно по меньшей мере примерно 99%.
Организм, продуцирующий оксидоредуктазные полипептиды, применимые в энантиоселективном ферментативном восстановлении, может представлять собой дикий штамм или вариант и предпочтительно выбран из Candida magnolia, Candida vaccinii и Oryctolagus cuniculus. Дрожжи рода Candida предпочтительны для получения оксиредуктазных ферментов, применимых в данном способе. Производные полипептидов представляют собой производные, имеющие по меньшей мере шестидесятипроцентную гомологию с указанными выше последовательностями SEQ ID и обладающие оксидоредуктазной активностью. Специалистам данной области техники известно, что существуют системы и технологии для точного определения гомологии последовательностей.
Полипептид, включающий SEQ ID NO: 1, может кодироваться ДНК последовательностью SEQ ID NO: 5, которая может быть получена, например, из организма Oryctolagus cuniculus, хранимого в соответствии с условиями Будапештского договора с Deutsche Sammlung fur Mikroorganismen und Zellkulturen, Mascheroder Weg 1b, 38124 под номером 22167 DSMZ, в частности, из DSMZ 22167 кролика, или последовательностью нуклеиновых кислот, которая гибридизуется с ней. Полипептид, включающей SEQ ID NO: 2, может кодироваться ДНК последовательностью SEQ ID NO: 6, которую можно получить, например, из организма Candida magnoliae DSMZ 22052, или последовательностью нуклеиновых кислот, которая гибридизуется с ней.
Полипептид, включающий SEQ ID NO: 3, может кодироваться ДНК последовательностью SEQ ID NO: 7, которая может быть получена, например, из организма Candida vaccinii CBS7318 или последовательностью нуклеиновых кислот, которая гибридизуется с ней. Полипептид, включающий SEQ ID NO: 4, может кодироваться ДНК последовательностью SEQ ID NO: 8, которая может быть получена, например, из организма Candida magnoliae CBS6396, или последовательностью нуклеиновых кислот, которая гибридизуется с ней.
Оксидоредуктазу, содержащую одну из полипептидных последовательностей, указанных выше, получают в применимых количествах стандартными методами, известными специалистам данной области техники. Полинуклеотид, кодирующий аминокислотную последовательность, клонируется в подходящий вектор, после чего вводится в организм-хозяин, способный экспрессировать ген, кодирующий последовательность. Микроорганизмы, чувствительные к трансформированию, для того, чтобы стать способными экспрессировать такой пептид, хорошо известны в данной области техники. Предпочтительным микроорганизмом является Escherichia coli. Как заявлено выше, оксидоредуктаза, экспрессированная трансформированным E. coli, может экстрагироваться из клеток E. Coli и подвергаться частичной или полной очистке для применения в способе или может применяться в самих клетках, которые могут представлять собой клетки в природном состоянии, клети с нарушенной проницаемостью мембраны или клетки в лизированном состоянии. В предпочтительном варианте осуществления энантиоселективного ферментативного восстановления используется суспензия оксидоредуктазы в виде клеток в природном состоянии. Любая из этих форм может применяться в свободной или иммобилизованной форме.
Реакция восстановления может проводиться в однофазной системе, содержащей клетки, включающие фермент, суспендированный в них. Альтернативно, реакция может проводиться в двухфазной системе «водный растворитель/органический растворитель», как описано в Заявке на Патент США № 2009/0017510 и в Патенте США № 7371903. Реакция может проводиться как стандартная периодическая реакция или как непрерывный процесс. Следует иметь в виду, что одним из существенных преимуществ энантиоселективного ферментативного восстановления для коммерческого применения является то, что оно может осуществляться в виде непрерывного процесса.
Реакционная смесь предпочтительно включает примерно от 35 г до 350 г клеток на кг добавленного реагента. Суспензия представляет собой водную часть реакционной смеси, которая также содержит буфер, например, ТЭА (триэтаноламин), фосфат, Tris/HCl или глициновый буфер. Буфер может дополнительно включать ионы для стабилизации фермента, например, источник ионов магния. Дополнительные добавки, которые могут присутствовать в буфере для стабилизации ферментов, могут включать многоатомный спирт, такой как глицерин, сорбиты и т.п., серосодержащие соединения, такие как 1,4-DL-дитиотреитол, глютатион, цистеин или т.п., аминокислоты и пептиды или детергенты, такие как ДМСО. Предпочтительным стабилизатором для фермента является многоатомный спирт, в частности глицерин, который может присутствовать в количестве примерно от 10% до 80% по массе, предпочтительно примерно 50% по массе, из расчета на массу клеточной суспензии.
Способ энантиоселективного ферментативного восстановления преимущественно проводится с использованием принципа связанного субстрата, где в реакционной смеси используется косубстрат для регенерации кофактора или кофермента, который функционирует для обеспечения водорода для восстановления арилкетонового субстрата. Кофактор предпочтительно представляет собой никотиоамидадениндинуклеотидфосфат (nicotineamide adenine dinucleotide phosphate - NADP) или никотинамидадениндинуклеотид (nicotineamide adenine dinucleotide - NAD), которые применяются в восстановленном состоянии, т.е. NADPH или NADH, соответственно. Кофактор присутствует в реакционной смеси в концентрации от примерно 0,01 мМ до 5 мМ, предпочтительно от 0,05 мМ до 0,5 мМ. В реакции косубстрат функционирует, подвергаясь окислению при регенерации в NADPH или NADH кофакторе. Косубстрат представляет собой вторичный спирт, представленный формулой RxRyCHOH, где Rx представляет собой углерод, х представляет собой целое число от 1 до 10, Ry представляет собой водород и y представляет собой целое число, равное удвоенному значению х плюс два. Примеры подходящих косубстратов включают 2-пропанол, 2-бутанол, 4-метил-2-пентанол, 2-пентанол, 2-гептанол, 2-октанол и т.п. Предпочтительным косубстратом является 2-бутанол. Косубстрат присутствует в реакционной смеси в количестве, составляющей примерно от 10% до 80% по объему, предпочтительно от примерно 40% до 60% по объему, наиболее предпочтительно примерно 50% по объему.
Окисленный кофактор, образованный в процессе восстановления арилкетона, регенерируется окислением косубстрата, которое также может катализироваться оксидоредуктазой. Таким образом, особое экономическое преимущество данного способа состоит в том, что оксидоредуктаза влияет как на восстановление алкилкетона формулы 1, так и на окисление косубстрата, следовательно, дополнительный фермент не нужно применять для регенерации кофактора. Кроме того, к настоящему изобретению относится добавление еще одного фермента в реакционную смесь для регенерации кофактора для повышения скорости восстановления арилкетона.
В еще одном дополнительном варианте осуществления изобретения органический растворитель, который не вовлечен в регенерацию кофактора, может добавляться в реакционную смесь, и процесс восстановления может проводится в двухфазной водно-органической системе. Примеры таких растворителей включают, но без ограничения, диэтиловый эфир, трет-бутилметиловый эфир, диизопропиловый эфир, дибутиловый эфир, этилацетат, бутилацетат, гептан, гексан или циклогексан. Такой растворитель может составлять от примерно 1% до 50% по объему из расчета на объем реакционной смеси.
Количество арилкетонового субстрата в реакционной смеси предпочтительно составляет более примерно 0,1% по массе и может повышаться до примерно 50% по массе, причем предпочтительная концентрация составляет от примерно 5 до 30% по массе. Количество субстрата будет изменяться в зависимости от его чистоты, поскольку способ может проводиться с субстратом в очищенном состоянии или в виде сырого продукта, содержащего различные количества и типы примесей. Значение рН реакционной смеси после добавления всех компонентов будет находиться в интервале от 5 до 10, предпочтительно от 7 до 9, оптимально равно примерно 8. Ферментативное восстановление согласно настоящему изобретению проводится при температуре примерно 10-45°С, предпочтительно примерно 20-40°С, наиболее предпочтительно примерно 25-35°С.
Помимо того, что способ энантиоселективного восстановления приводит к получению спиртов формулы 3 с высоким выходом и очень высокой энантиоселективностью, он является экономически эффективным и экологичным. Таким образом, спиртовое производное (R)-конфигурации высокой оптической чистоты может быть получено в присутствии фермента в описанных выше условиях реакции в течение от примерно 12 до 96 часов, предпочтительно от примерно 24 до 48 часов. В течение инкубационного периода значение рН смеси поддерживается в интервалах, указанных выше, посредством периодического тестирования и добавления стандартного кислотного или основного реагента, например, карбоната натрия и гидроксида натрия, соответственно. Эффективность энантиоселективного ферментативного восстановления может выражаться общим числом оборотов (total turnover number - TTN), которое равно числу молей хирального спирта формулы 2, полученных на моль первоначально добавленного кофактора. TTN энантиоселективного ферментативного восстановления составляет от примерно 102 до 105, предпочтительно ≥103.
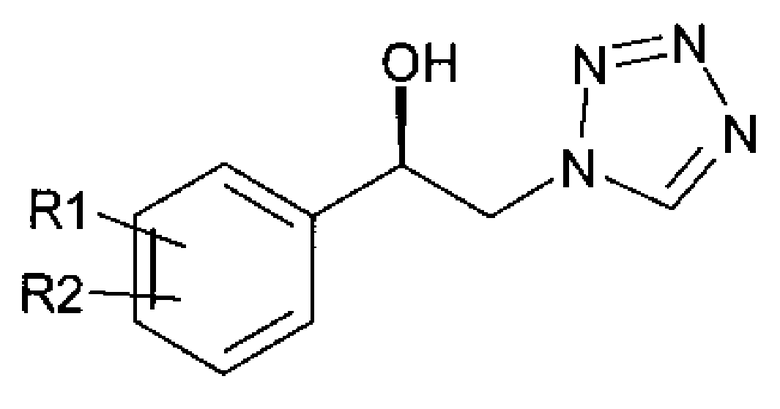
Когда спиртовое производное, полученное посредством энантиоселективного ферментативного восстановления, представлено в виде смеси изомеров положения 1N спирта химической формулы 3а и 2N спирта химической формулы 3b, он может выделяться и разделяться на отдельные изомеры положения высокой чистоты посредством кристаллизации:
Химическая формула 3а
[87] Химическая формула 3b
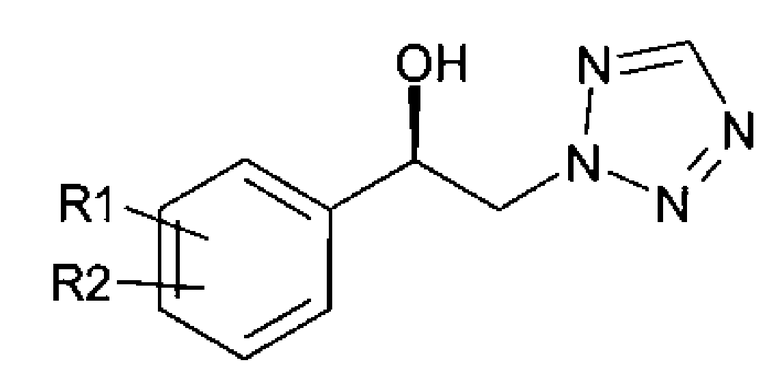
[89] Кристаллизация может включать добавление солюбилизирующего агента к смеси изомеров положения, полученной в результате восстановления; добавление осаждающего вещества и, необязательно, выделение осадка фильтрацией; концентрирование фильтрата и добавление дополнительного осаждающего вещества.
[90] Примеры солюбилизирующего агента, применимого в кристаллизации, включают, но не ограничиваются только ими, ацетон, ацетонитрил, тетрагидрофуран, этилацетат, дихлорметан, хлороформ, 1,4-диоксан, низший спирт, содержащий от 1 до 4 атомов углерода, и их смеси. Солюбилизирующий агент может добавляться в количестве от нуля до 20 мл (об./масс.) из расчета на массу (г) смеси изомеров положения.
Примеры осаждающего вещества включают, но без ограничения, низший спирт, содержащий от 1 до 4 атомов углерода, диэтиловый эфир, пентан, гексан, циклогексан, гептан и их смеси. Осаждающее вещество может медленно добавляться в количестве от нуля до 40 мл (об./масс.) из расчета на массу (г) смеси изомеров положения.
После добавления осаждающего вещества фильтрация может приводить к получению 1N спирта (3а) в виде осадка высокой чистоты.
Кроме того, 2N спирт (3b) может быть получен в кристаллической форме очень высокой чистоты посредством концентрирования фильтрата и повышения соотношения осаждающего вещества к солюбилизирующему агенту.
Указанные стадии кристаллизации могут быть опущены, когда изомеры положения арилкетона химической формулы 2 уже выделены и очищены.
Введение карбамоильного фрагмента в спиртовое производное (R)-конфигурации химической формулы 3 приводит к получению карбамата (R)-конфигурации, представленного химической формулой 1:
Химическая формула 3
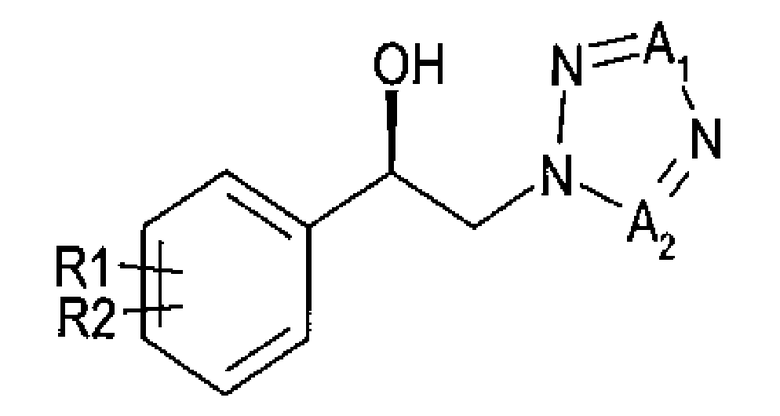
Химическая формула 1
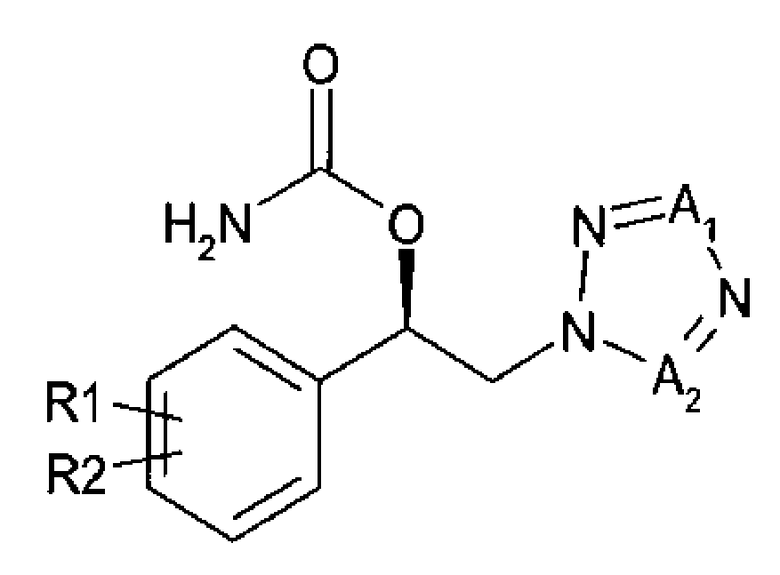
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигрупу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, содержащую от 1 до 8 атомов углерода; и один из А1 и А2 представляет собой СН, а другой представляет собой N.
На стадии карбаминирования для введения карбамоильного фрагмента могут применяться, например, неорганический цианат-органическая кислота, изоцианат-вода или карбонильное соединение-аммиак.
Для карбаминирования с помощью смеси неорганический цианат-органическая кислота спиртовое производное (R)-конфигурации химической формулы 3 растворяется в органическом растворителе, например диэтилэфире, тетрагидрофуране, 1,4-диоксане, ацетонитриле, дихлорметане, хлороформе или их смеси, и полученный раствор смешивается с от 1 до 4 эквивалентами неорганического цианата, такого как цианат натрия, и органической кислотой, такой как метансульфоновая кислота или уксусная кислота с последующим взаимодействием при температуре примерно от -10 до 70°С.
Что касается применения смеси изоцианат-вода, к раствору спиртового производного (R)-конфигурации химической формулы 3 в органическом растворителе, например диэтиловом эфире, тетрагидрофуране, 1,4-диоксане, ацетонитриле, дихлорметане, хлороформе и их смеси, добавляют от 1 до 4 эквивалентов изоцианата, например, хлорсульфонилизоцианата, трихлорацетилизоцианата, триметилсилилизоцианата, и полученная смесь взаимодействует при температуре в интервале примерно от -50 до 40°С. После этого без очистки к смеси добавляют от 1 до 20 эквивалентов воды для индуцирования гидролиза.
Что касается применения смеси карбонильное соединение-аммиак, к раствору спиртового соединения (R)-конфигурации химической формулы 3 в органическом растворителе, например, диэтилэфире, тетрагидрофуране, 1,4-диоксане, ацетонитриле, дихлорметане, хлороформе или их смеси, добавляют от 1 до 4 эквивалентов карбонильного соединения, например 1,1'-карбонилдиимидазола, карбамоилхлорида, дисукцинилкарбоната, фосгена, трифосфена или хлорформиата, и полученная смесь взаимодействует при температуре примерно от -10 до 70°С с последующим добавлением от 1 до 10 эквивалентов аммиака без очистки.
После карбаминирования карбаматное соединение химической формулы 1, полученное таким образом, может подвергаться очистке до высокой оптической и химической чистоты с помощью кристаллизации. Кристаллизация включает добавление солибилизирующего агента к продукту карбаминирования; последующее добавление осаждающего вещества необязательно, выделение осадка фильтрацией; концентрирование фильтрата и добавление дополнительного осаждающего вещества. Для фармацевтического применения предпочтительна всегда конечная очистка карбаминированного продукта перед применением, но стадия кристаллизации может быть в процессе и ранее.
Примеры солюбилизирующего агента включают, но без ограничения, ацетон, ацетонитрил, тетрагидрофуран, этилацетат, дихлорметан, хлороформ, 1,4-диоксан, низший спирт, содержащий от 1 до 4 атомов углерода, а также их смеси. Солюбилизирующий агент может быть использован в количестве от нуля до 20 мл (об./масс.) из расчета на массу (г) продукта реакции.
Примеры осаждающего вещества включают, но без ограничения, воду, низшие спирты, содержащие от 1 до 4 атомов углерода, диэтиловый эфир, пентан, гексан, циклогексан, гептан и их смеси. Осаждающее вещество может медленно добавляться в количестве от нуля до 40 мл (об./масс.) из расчета на массу продукта реакции.
Способ согласно настоящему изобретению, включающий энантиоселективное ферментативное восстановление, может предоставлять карбаматные соединения высокой оптической чистоты. Кроме того, мягкие условия реакции, которые необходимы для способа согласно настоящему изобретению, гарантируют безопасность процесса. Далее, стадия кристаллизации, которая может применяться в крупномасштабном производстве до или после энантиоселективного ферментативного восстановления или после карбаминирования, приводит получению карбаматных соединений более высокой химической чистоты. Карбаматные соединения, полученные в соответствии с настоящим изобретением, являются весьма полезными в лечении расстройств ЦНС, таких как судороги.
Способ осуществления изобретения
Лучше понять настоящее изобретение можно с помощью представленных далее примеров, которые являются иллюстративными, но не должны рассматриваться как ограничивающие область настоящего изобретения.
Пример получения 1: Получение 1-(2-хлорфенил)-2- (1,2,3,4-тетразол-1-ил)этан-1-она
К суспензии 2-бром-2'-хлорацетофенона (228,3 г, 0,978 моль) и карбоната калия (161,6 г, 1,170 моль) в ацетонитриле (2000 мл) при комнатной температуре добавляют 35% (масс./масс.) раствор 1Н-тетразолдиметилформамида (215,1 г, 1,080 моль). Реакционную смесь перемешивают в течение 2 часов при 45°С и упаривают при пониженном давлении для удаления примерно 1500 мл растворителя. Полученный концентрат разбавляют этилацетатом (2000 мл) и промывают 10% раствором соли (3×2000 мл). Органический слой, выделенный таким образом, упаривают при пониженном давлении, получая 216,4 г маслянистого твердого остатка. К раствору твердого остатка в этилацетате (432 мл) медленно добавляют гептан (600 мл). Образовавшийся осадок собирают фильтрацией при комнатной температуре и промывают, получая 90,1 г (0,405 моль) 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-1-ил)этан-1-она (далее в описании называемый «1N кетон»).
1H-ЯМР (CDCl3) 8,87 (с, 1H), д7,77 (д, 1H), д7,39-7,62 (м, 3H), д5,98 (с, 2Н).
Пример получения 2: Получение 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-она
Фильтрат, полученный после фильтрации продукта примера 1, концентрируют, затем растворяют в изопропаноле (100 мл) и к полученному раствору добавляют гептан (400 мл) для завершения кристаллизации. Выпавшие кристаллы собирают фильтрацией и промывают при 5°С, получая 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-он (далее в описании называемый «2N кетон») в виде твердого вещества (94,7 г, 0,425 моль).
1H-ЯМР (CDCl3) д8,62 (с, 1H), д7,72 (д, 1H), д7,35-7,55 (м, 3H), д6,17 (с, 2Н).
Пример получения 3: Получение спиртового производного (R)-конфигурации энантиоселективным ферментативным восстановлением с помощью различных оксидоредуктаз.
Приготавливают четыре раствора, описанных ниже:
Ферментный раствор 1
Компетентные клетки E. coli StarBL21 (DE3) (Invitrogen) трансформируют с конструкторами экспрессии pET21-MIX, кодирующими оксидоредуктазную SEQ ID NO: 1. После этого E. coli колонии, трансформированные с конструкторами результирующей экспрессии, выращивают в 200 мл LB среды (1% триптон, 0,5% дрожжи и 1% раствор хлорида натрия) с 50 мкг/мл ампициллина или 40 мкг/мл канамицина, соответственно, до достижения оптической плотности 0,5, измеренной при 550 нм. Экспрессию желаемого рекомбинантного белка индуцируют добавлением изопропилтиогалактосида (isopropylthiogalactoside - IPTG) до концентрации 0,1 мМ. После 16 часов индукции при 25°С и 220 оборотах в минуту клетки собирают и замораживают при -20°С. В ходе получения растворов ферментов 30 г клеток снова суспендируют в 150 мл триэтаноламинного буфера (TEA 100 нм, 2 мМ MgCl2, 10% глицерина, рН 8) и гомогенизируют в гомогенизаторе высокого давления. Полученный ферментный раствор смешивают с 150 мл глицерина и хранят при температуре -20°С.
Ферментный раствор 2
RB791 клетки (генетический источник E.coli, Yale, США) трансформируют с конструктами экспрессии pET21-MIX, кодирующими оксидоредуктазную SEQ ID NO: 2. E. coli колонии, трансформированные с конструкторами результирующей экспрессии, после этого выращивают в 200 мл LB среды (1% триптон, 0,5% дрожжей и 1% хлорида натрия) с 50 мкг/мл ампициллина или 40 мкг/мл канамицина, соответственно, до достижения оптической плотности 0,5, измеренной при 550 нм. Экспрессию желаемого рекомбинантного белка индуцируют добавлением изопропилтиогалактосида (isopropylthiogalactoside - IPTG) до концентрации 0,1 мМ. После 16 часов индукции при 25°С и 220 оборотах в минуту клетки собирают и замораживают при -20°С. В ходе получения растворов ферментов 30 г клеток снова суспендируют в 150 мл триэтаноламинного буфера (TEA 100 нм, 2 мМ MgCl2, 10% глицерина, рН 8) и гомогенизируют в гомогенизаторе высокого давления. Полученный ферментный раствор смешивают с 150 мл глицерина и хранят при температуре -20°С.
Ферментный раствор 3
Ферментный раствор 3 получают в соответствии с методикой получения ферментного раствора 1, но с тем отличием, что конструкторы экспрессии pET21-MIX, кодирующие оксидоредуктазную SEQ ID NO: 3, используют вместо конструкторов экспрессии pET21-MIX, кодирующих оксидоредуктазную SEQ ID NO: 1.
Ферментный раствор 4
Ферментный раствор 4 получают в соответствии с методикой получения ферментного раствора 2, но с тем отличием, что конструкторы экспрессии pET21-MIX, кодирующие оксидоредуктазную SEQ ID NO: 4, используют вместо конструкторов экспрессии pET21-MIX, кодирующих оксидоредуктазную SEQ ID NO: 2.
Различные оксидоредуктазы, содержащиеся в каждом ферментном растворе с 1 по 4, исследуют описанным далее образом для превращения 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-1-ил)этан-1-она (1N кетон) и 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-она (2N кетон) в соответствующий 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-1-ил)этан-1-ол (называемый далее «1N спирт») и 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-ол (называемый далее «2N спирт»), соответственно.
Реакционный раствор А
160 мкл буфера (TEA 100 нМ, 2 мМ MgCl2, 10% глицерина, рН 8)
100 мкл NADPH (40 мг/мл)
40 мкл 2-пропанола
50 мкл ферментного раствора 1
2 мг 1N кетона или 2N кетона
Реакционный раствор B
160 мкл буфера (TEA 100 нМ, 2 мМ MgCl2, 10% глицерина, рН 8)
100 мкл NADPH (40 мг/мл)
40 мкл 2-пропанола
50 мкл ферментного раствора 2
2 мг 1N кетона или 2N кетона
Реакционный раствор C
350 мкл буфера (TEA 100 нм, 2 мМ MgCl2, 10% глицерина, рН 8)
0,05 мг NADP
50 мкл ферментного раствора 3
10 мг 1N кетона или 2N кетона
250 мкл 4-метил-2-пентанола
50 мкл ферментного (оксидоредуктаза из Thermoanerobium brockii) раствора для регенерации кофактора.
Реакционный раствор D
350 мкл буфера (TEA 100 нМ, 2 мМ MgCl2, 10% глицерина, рН 8)
0,05 мг NADP
50 мкл ферментного раствора 4
10 мг 1N кетона или 2N кетона
250 мкл 4-метил-2-пентанола
50 мкл ферментного (оксидоредуктаза из Thermoanerobium brockii) раствора для регенерации кофактора.
После 24-часового инкубирования каждого реакционного раствора A, B, C и D к каждому реакционному раствору добавляют 1 мл ацетонитрила, после чего каждый реакционный раствор центрифугируют и переносят емкость для ВЭЖХ анализа на энантиомерный избыток и степень конверсии. Конверсия и значения энантиомерных избытков (ЭИ значения) продуктов, приведенные в таблице 1 ниже, рассчитывают по следующим формулам:
Коэффициент конверсии (%) = [(Площадь продукта)/ (Площадь реагента + площадь продукта)]×100
Значение ЭИ (%) = [(Площадь R-конфигурации - площадь S-конфигурации)/(Площадь R-конфигурации + площадь S-конфигурации)]×100
% ЭИ (энантиомер)
Пример получения 4: Ферментативное восстановление с использованием оксидоредуктазы SEQ NO: 2
Для превращения 1N/2N кетонов в R-1N/R-2N спирт 30 мкл раствора фермента 2, содержащего оксидоредуктазу SEQ NO 2, добавляют в смесь 300 мкл буфера (100 мМ TEA, рН 8, 1 мМ MgCl2, 10% глицерина), 100 мг смеси 1N и 2N кетонов (1N:2N=14%:86%), 0,04 мг NADF и 300 мкл 2-бутанола. Реакционную смесь выдерживают при комнатной температуре при тщательном перемешивании. Спустя 48 часов более 98% кетонов было восстановлено до смеси следующего состава: 80% R-2N спирта, 0% S-2N спирта, 20% R-1N спирта, 0% S-1N спирта; 0% 1N кетона; 0% 2N кетона.
После общей обработки смеси и перекристаллизации продукта из смеси этилацетат/гексан получают оптически чистые спирты, которые показаны ниже:
(R)-1-(2-хлорфенил)-2-(1,2,3,4-тетразол-1-ил)этан-1-ол (1N спирт)
1H-ЯМР (CDCl3) д8,74 (с, 1H), д7,21-7,63 (м, 4H), д5,57 (м, 1H), д4,90 (д, 1H), д4,50 (д, 1H), д3,18 (д, 1H);
(R)-1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-ол (2N спирт)
1H-ЯМР (CDCl3) д8,55 (с, 1H), д7,28-7,66 (м, 4H), д5,73 (д, 1H), д4,98 (д, 1H), д4,83 (д, 1H), д3,38 (уш., 1H).
Получение карбамата
Пример получения 5: Получение (R)-1-(2-хлорфенил)-2-(тетразол-2-ил)этилового эфира карбаминовой кислоты
50 мл раствора фермента 2, содержащего оксидоредуктазную SEQ NO: 2, добавляют в смесь 250 мл буфера (100 мМ TEA, рН 8, 1 мМ MgCl2, 10% глицерина), 50 г (225 ммоль) 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-она (2N кетон), 4 мг NAD, 300 мл 2-пропанола и 150 мл бутилацетата. Реакционную смесь перемешивают при комнатной температуре. Спустя 48 часов более 98% 2N кетона восстановлено до соответствующего (R)-1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-ола (R-2N спирт) с величиной ЭИ>99%. К полученной смеси добавляют 500 мл этилацетата. После разделения слоев органический слой промывают 10% раствором соли (3х500 мл). Полученный таким образом органический слой сушат над сульфатом магния, фильтруют и фильтрат упаривают при пониженном давлении, получая 50,4 г (224 ммоль) 1-(2-хлорфенил)-2-(1,2,3,4-тетразол-2-ил)этан-1-ола (R-2N спирт, оптическая чистота 99,9%) в виде маслянистого остатка. К полученному сырому продукту добавляют 450 мл тетрагидрофурана. Смесь охлаждают до -15°С, к смеси медленно добавляют 38 г (267 ммоль) хлорсульфонилизоцианата и полученную смесь перемешивают при температуре от -10°С в течение 2 часов. Реакцию гасят медленным добавлением воды. Полученный раствор концентрируют при пониженном давлении, отгоняя примерно 300 мл растворителя. Концентрат разбавляют 600 мл этилацетата и промывают 10% раствором соли (3×500 мл). Органический слой концентрируют при пониженном давлении, полученный концентрат растворяют в изопропаноле (90 мл) и к раствору медленно добавляют гептан (180 мл), что приводит к завершению кристаллизации. Полученный таким образом осадок собирают фильтрацией и промывают, получая 51,8 г (194 ммоль) (R)-1-(2-хлорфенил)-2-(тетразол-2-ил)этилового эфира карбаминовой кислоты (оптическая чистота 99,9%).
1H-ЯМР (ацетон-d6) д8,74 (с, 1H), д7,38-7,54 (м, 4H), д6,59 (м, 1H), д6,16 (уш., 2Н), д4,90 (д, 1H), д5,09 (м, 2H).
Как отмечалось ранее, карбаматные соединения высокой оптической и химической чистоты могут быть получены экономически эффективно в соответствии с настоящим изобретением.
Хотя предпочтительные варианты осуществления настоящего изобретения были раскрыты для иллюстративных целей, специалистам данной области техники будет понятно, что возможны различные модификации, дополнения и замещения без выхода за пределы существа и объема изобретения, которые описаны в прилагаемой формулы изобретения.
Текст с перечнем последовательностей
Аминокислотные последовательности
SEQ ID NO: 1: Oryctolagus cuniculus из DSMZ 22167 кролика

SEQ ID NO: 2: последовательность карбонилредуктазы белка Candida magnoliae DSMZ 22052

SEQ ID NO: 3: последовательность карбонилредуктазы белка Candida vaccinii CBS7318

SEQ ID NO: 4: последовательность карбонилредуктазы белка Candida magnoliae CBS6396

ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВЫХ КИСЛОТ
SEQ ID NO: 5: Oryctolagus cuniculus из DSMZ 22167 кролика

SEQ ID NO: 6: Последовательность нуклеиновой кислоты карбонилредуктазы Candida magnoliae DSMZ 22052

SEQ ID NO: 7: Последовательность нуклеиновой кислоты карбонилредуктазы Candida vaccinii CBS7318

SEQ ID NO: 8: Последовательность нуклеиновой кислоты карбонилредуктазы Candida magnoliae CBS6396

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2009 |
|
RU2508290C2 |
| ПОЛИПЕПТИДЫ ДЛЯ ЭНАНТИОСЕЛЕКТИВНОГО ФЕРМЕНТАТИВНОГО ВОССТАНОВЛЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2008 |
|
RU2486239C2 |
| СПОСОБ ПОЛУЧЕНИЯ АРИЛ-2-ТЕТРАЗОЛ-2-ИЛКЕТОНА C УЛУЧШЕННОЙ СЕЛЕКТИВНОСТЬЮ | 2020 |
|
RU2808087C1 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНЫХ АЛКЕНОВ С ПОМОЩЬЮ ФЕРМЕНТАТИВНОГО ДЕКАРБОКСИЛИРОВАНИЯ 3-ГИДРОКСИАЛКАНОЕВЫХ КИСЛОТ | 2009 |
|
RU2571933C2 |
| ХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ СПИРОИНДОЛОНОВ И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2013 |
|
RU2662815C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ 2-АРИЛМОРФОЛИНОВ | 2014 |
|
RU2677328C1 |
| КОМПОЗИЦИЯ И МИКРОСФЕРА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ ЭКЗЕНДИНА И СПОСОБ ПОЛУЧЕНИЯ МИКРОСФЕРЫ | 2008 |
|
RU2463040C2 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ 4’-ЭТИНИЛНУКЛЕОЗИДНЫХ АНАЛОГОВ | 2019 |
|
RU2816846C2 |
| ПЕПТИДЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ БОЛЕЗНЕЙ | 2019 |
|
RU2819399C2 |
| СТИМУЛЯТОРЫ sGC | 2011 |
|
RU2582679C2 |







Изобретение относится к способу получения (R)-1-арил-2-тетразолилэтилового эфира карбаминовой кислоты, включающий энантиоселективное ферментативное восстановление арилкетона в реакционной смеси, содержащей оксидоредуктазу, и карбаминирование полученного спирта. 2 н. и 17 з.п. ф-лы, 1 табл., 5 пр.
1. Способ получения арил-2-тетразолилэтилового эфира карбаминовой кислоты, представленного химической формулой 1, включающий
энантиоселективное ферментативное восстановление арилкетона, представленного химической формулой 2, до спиртового производного (R)-конфигурации, представленного химической формулой 3; и
карбаминирование указанного спирта
Химическая формула 1
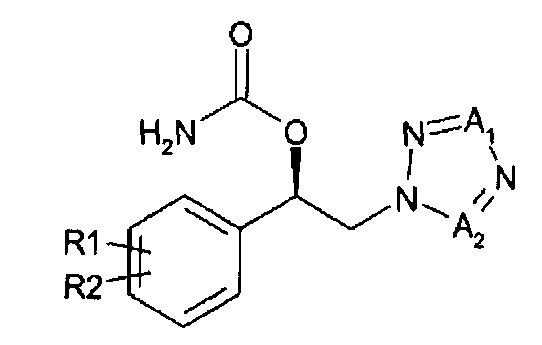
Химическая формула 2
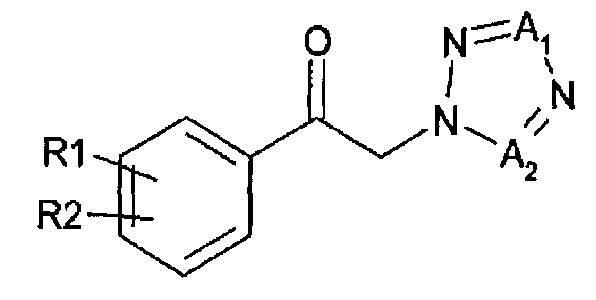
Химическая формула 3
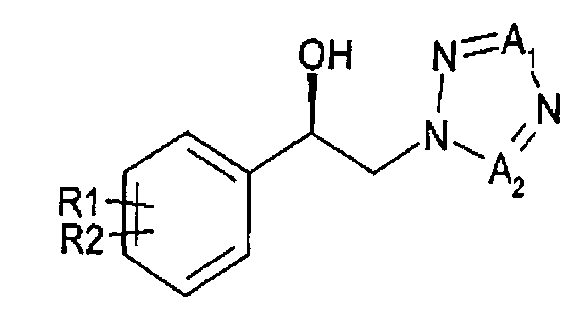
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигруппу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, содержащую от 1 до 8 атомов углерода;
один из A1 и А2 представляет собой СН, а другой представляет собой N,
указанное энантиоселективное ферментативное восстановление проводится в реакционной смеси, включающей указанное соединение Химической формулы 2, оксидоредуктазу, имеющую по меньшей мере 90% гомологию с аминокислотными последовательностями SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4, NADH или NADPH в качестве кофактора, который окисляется в процессе восстановления и постоянно регенерируется, косубстрат, включающий вторичный спирт, представленный формулой RxRyCHOH, где Rx представляет собой углерод и х представляет собой целое число от 1 до 10 и Ry представляет собой водород и у представляет собой целое число, равное удвоенному значению х плюс два, и подходящий буфер.
2. Способ по п.1, где оксидоредуктаза инкодирована, соответственно, последовательностью нуклеиновой кислоты SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8 или последовательностью нуклеиновой кислоты, которая гибридизуется до SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8.
3. Способ по п.2, где оксидоредуктаза может быть выделена из Candida magnolia, Candida vaccinii или Oryctolagus cuniculus.
4 . Способ по п.1, где оксидоредуктаза присутствует в реакционной смеси в полностью очищенном состоянии, частично очищенном состоянии или в клетках микроорганизмов, которые ее экспрессируют.
5. Способ по п.4, где оксидоредуктаза присутствует в клетках микроорганизмов, которые ее экспрессируют, и где указанные клетки представляют собой клетки в нативном состоянии, клетки с нарушенной проницаемостью мембраны или клетки в лизированном состоянии.
6. Способ по п.5, где клетки микроорганизмов представляют собой трансформированные клетки Escherichia coli.
7. Способ по п.1, где регенерация оксисленного кофактора является результатом окисления указанного косубстрата.
8. Способ по п.1, где указанный косубстрат представляет собой вторичный спирт, выбранный из группы, включающей 2-пропанол, 2-бутанол, 2-пентанол, 4-метил-2-пентанол, 2-гептанол и 2-октанол.
9. Способ по п.1, где указанная оксидоредуктаза оказывает влияние как на восстановление арилкетона химической формулы 2, так и на окисление косубстрата.
10. Способ по п.1, где стадия карбаминирования проводится посредством взаимодействия спиртового производного (R)-конфигурации химической формулы 3 с неорганическим цианатом и органической кислотой.
11. Способ по п.1, где стадия карбаминирования проводится посредством гидролиза продукта, полученного в результате взаимодействия спиртового производного (R)-конфигурации химической формулы 3 с изоцианатным соединением, выбранным из группы, включающей хлорсульфонилизоцианат, трихлорацетилизоцианат и триметилсилилизоцианат.
12. Способ по п.1, где стадия карбамирования проводится посредством введения аммиака в продукт, полученный в результате взаимодействия спиртового производного (R)-конфигурации химической формулы 3 с карбонильным соединением, включая 1,1-карбодиимидазол, карбамоилгалогенид, дисукцинилкарбонат, фосген, трифосген или хлорформиат.
13. Способ по п.1, дополнительно включающий стадию кристаллизации после по меньшей мере одной стадии энантиоселективного ферментативного восстановления и стадии карбамирования.
14. Способ по п.13, где стадия кристаллизации включает
добавление к продукту реакции солюбилизирующего агента, выбранного из ацетона, ацетонитрила, тетрагидрофурана, этилацетата, дихлорметана, хлороформа, 1,4-диоксана, низшего спирта, содержащего от 1 до 4 атомов углерода, и их смеси;
добавление осаждающего вещества, выбранного из группы, включающей воду, низший спирт, содержащий от 1 до 4 атомов углерода, диэтиловый эфир, пентан, гексан, циклогексан, гептан и их смесь.
15. Способ по п.1, дополнительно включающий стадию получения арилкетона химической формулы 2 взаимодействием согласно реакции замещения арилкетона, представленного ниже химической формулой 4, с тетразолом, представленным химической формулой 5:
Химическая формула 4
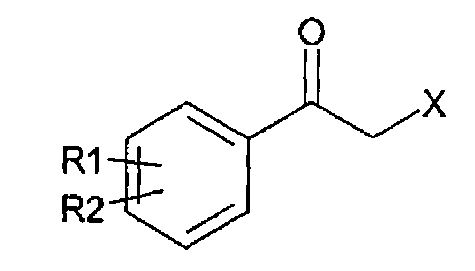
Химическая формула 5
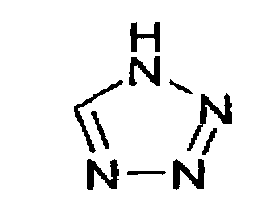
где R1 и R2 принимают значения, определенные в п.1; и
X представляет собой удаляемую группу, выбранную из галогенида и сульфоната.
16. Способ по п.15, дополнительно включающий стадию кристаллизации, которая включает
добавление солюбилизирующего агента, выбранного из ацетона, ацетонитрила, тетрагидрофурана, этилацетата, дихлорметана, хлороформа, 1,4-диоксана, низшего спирта, содержащего от 1 до 4 атомов углерода, и их смеси, к продукту, полученному реакцией замещения; и
добавление осаждающего вещества, выбранного из воды, низшего спирта, содержащего от 1 до 4 атомов углерода, диэтилового эфира, пентана, гексана, циклогексана, гептанов и их смеси.
17. Способ получения спиртового производного, представленного химической формулой 3, энантиоселективным ферментативным восстановлением арилкетона, представленного химической формулой 2:
Химическая формула 2

Химическая формула 3
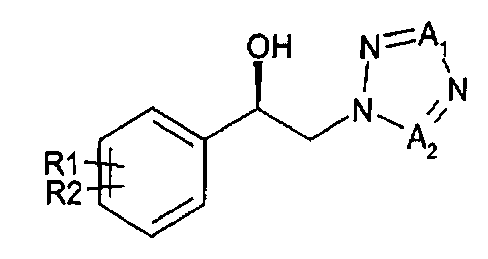
где
R1 и R2 независимо выбраны из группы, включающей водород, галоген, перфторалкил, алкил, содержащий от 1 до 8 атомов углерода, тиоалкоксигруппу, содержащую от 1 до 8 атомов углерода, и алкоксигруппу, включающую от 1 до 8 атомов углерода;
один из А1 и А2 представляет собой СН, а другой представляет собой N; и
указанное восстановление проводится в реакционной смеси, содержащей указанное соединение химической формулы 2, оксидоредуктазу, имеющую по меньшей мере 90% гомологию с аминокислотными последовательностями SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:4, NADH или NADPH в качестве кофактора, который окисляется в процессе восстановления и постоянно регенерируется, косубстрат, содержащий вторичный спирт, представленный формулой RxRyCHOH, где Rx представляет собой углерод и х представляет собой целое число от 1 до 10, Ry представляет собой водород и y представляет собой целое число, равное удвоенному значению х плюс два, и подходящий буфер.
18. Способ по п.17, где оксидоредуктаза кодируется, соответственно, последовательностью нуклеиновой кислоты SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8 или последовательности нуклеиновой кислоты, которая гибридизуется до SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7 или SEQ ID NO:8, соответственно.
19. Способ по п.17, где оксидоредуктаза может быть выделена из Candida magnolia, Candida vaccinii или Oryctolagus cuniculus.
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2009 |
|
RU2508290C2 |
| WO 2006112685 A1, 26.10.2006 | |||
| US 20030130521 A1, 10.07.2003 | |||
| US 20060211099 A1, 21.09.2006 | |||
| SHERIF A.F | |||
| ROSTOM ET AL.: 'Azole antimicrobial pharmacophore-based tetrazoles: Synthesis and biological evaluation as potential antimicrobial and anticonvulsant agents' BIOORGANIC & MEDICINAL CHEMISTRY,2009, vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2015-01-27—Публикация
2010-10-15—Подача