Изобретение относится к химии производных адамантана, а именно к новому способу получения 3-галоген-1-(этоксикарбонил)алкиладамантанов общей формулы:
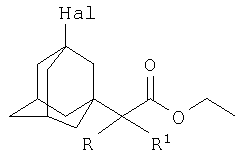
где Hal=Br, R=H: R1=H, СН3, С2Н5, С3Н7;
Hal=Br, R=СН3: R1=СН3; Hal=Cl, R=Cl: R1=Cl;
которые могут представлять интерес в качестве полупродуктов в синтезе некоторых биологически активных веществ.
Известен способ получения бромпроизводных адамантилалкилкарбоновых кислот, в которых атом брома находится не в 3-м положении адамант-1-ильного фрагмента, а в α-положении боковой углеводородной цепи, заключающийся в обработке 1-адамантилуксусной кислоты тионилхлоридом и взаимодействии полученного хлорангидрида с бромом и последующим гидролизом хлорангидрида α-бром-1-адамантилуксусной кислоты. При этом получают α-бром-1-адамантилуксусную кислоту [а.с. 910605 С07С 101/04. Опубл. 07.03.82 г.]. Выход данного продукта достигает 70%.
Недостатком данного метода является то, что с его помощью можно получить только одно производное (α-бром-1-адамантилуксусную кислоту), причем данный метод не приводит к получению веществ заявляемой структурной формулы.
Известен способ получения α-амино-(адамантил-1)-уксусной кислоты и α-амино-(адамантил-1)-пропионовой кислоты при использовании α-бром-1-адамантилуксусной кислоты и (адамантил-1)-пропионовой кислоты. Аналогично предыдущему, после галогенирования исходных галогенангидридов J2(Br2) и последующего аммонолиза 19% раствором NH4OH в метиловом спирте получают продукты с выходом 75-85% [Синтез, расщепление и химическое превращение α-аминокислот адамантанового ряда / Красуцкий П.А., Новикова М.И., Семенова И.Г.//Химия и технология элементоорганических полупродуктов и полимеров. Тез. докл. Научн. Конференции, Волгоград, 1984 г./ВолгПИ. - Волгоград, 1984. - С.138-141].
Данный метод не приводит к получению веществ заявляемой структурной формулы.
Известно использование (адамантил-2)-уксусной кислоты для получения α-амино-(адамантил-2)-уксусной кислоты. Из исходной (адамантил-2)-уксусной кислоты получают ее этиловый эфир, который затем галогенируют, получая α-бром-(адамантил-2)-уксусную кислоту. Полученное бромпроизводное взаимодействует с аммиаком, в результате чего получается α-амино-(адамантил-2)-уксусная кислота [Hromadko Soja. α-Amino-2-adamantylessigsaure und verhafren zu ihrer herstellung // Patent DE 2521895. - 1976].
Данный метод также не приводит к получению веществ заявляемой структурной формулы.
Наиболее близким к предлагаемому изобретению является способ синтеза 3-бром-1-адамантанкарбоновой [Stetter H., Mayer J. Chem. Ber. 1962, 95, 667] и 3-бром-1-адамантилуксусной кислоты [Bott К. Chem. Ber. 1968, 101, 564-573] путем прямого бромирования 1-адамантанкарбоновой или 1-адамантилуксусной кислот в присутствии или в отсутствие катализатора.
Недостатком этого метода является как ограниченное число синтезируемых соединений, так и то, что этим способом невозможно получить соединения заявляемой структурной формулы.
Задачей предлагаемого изобретения является разработка технологичного малостадийного метода синтеза 3-галоген-1-(этоксикарбонил)алкиладамантанов, протекающего с высоким выходом по исходному адамантану.
Техническим результатом является расширение ассортимента химических соединений, в частности получение новых 3-галоген-1-(этоксикарбонил)алкиладамантанов с высоким выходом.
Поставленный технический результат достигается в новом способе получения 3-галоген-1-(этоксикарбонил)алкиладамантанов общей формулы

где Hal=Br, R=H: R1=H, СН3, С2Н5, С3Н7;
Hal=Br, R=СН3: R1=CH3; Hal=Cl, R=C1: R1=Cl.
путем взаимодействия 1,3-дегидроадамантана с этиловыми эфирами α-галогеналканкарбоновых кислот из ряда: этил 2-бромацетат, этил 2-бромпропионат, этил 2-бромбутират, этил 2-бромвалерат, этил 2-бром-2-метилпропионат, этил 2,2,2-трихлорацетат при мольных соотношениях реагентов, равном соответственно 1:3-5, в среде исходных этиловых эфиров α-галогеналканкарбоновых кислот, при температуре 50-60°С в течение 4-6 часов.
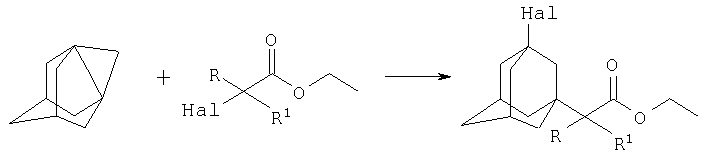
где Hal=Br, R=H: R1=H, СН3, С2Н5, С3Н7;
Hal=Br, R=СН3: R1=CH3; Hal=Cl, R=Cl: R1=Cl.
Сущностью метода является реакция получения 3-галоген-1-(этоксикарбонил)алкиладамантанов по реакции присоединения к 1,3-дегидроадамантану (1,3-ДГА) соответствующих этиловых эфиров α-галогеналканкарбоновых кислот.
Реакция основана на ранее неизвестных свойствах 1,3-дегидроадамантана взаимодействовать по связи углерод-галоген в этиловых эфирах α-галогеналканкарбоновых кислот. Реакция является неизвестной, так как в литературе отсутствуют сведения о взаимодействии 1,3-дегидроадамантана с этиловыми эфирами α-галогеналканкарбоновых кислот или родственным им соединений. Взаимодействие является возможным благодаря значительной подвижности галогена в эфирах α-галогеналканкарбоновых кислот, создаваемой электронно-акцепторным влиянием расположенного у ближайшей метиленовой (метиновой) группы карбоксильного фрагмента. Высокая нуклеофильность 1,3-дегидроадамантана позволяет получать продукты присоединения с высокими выходами в достаточно мягких условиях.
Способ осуществляется следующим образом.
К 3-5-кратному мольному избытку этилового эфира α-галогеналканкарбоновой кислоты приливают раствор 1,3-дегидроадамантана в легкокипящем инертном растворителе (диэтиловый эфир), который затем удаляется из реакционной смеси отгонкой. Смесь 1,3-дегидроадамантана и этилового эфира α-галогеналканкарбоновой кислоты нагревают в течение 4-6 часов при температуре 50-60°С, после чего избыток исходного этилового эфира α-галогеналканкарбоновой кислоты отгоняют. Возможна регенерация исходных этиловых эфиров α-галогеналканкарбоновых кислот путем их отгонки из реакционной смеси и организация рецикла с добавлением рассчитанного количества свежего этилового эфира α-галогеналканкарбоновой кислоты. Синтезированные 3-галоген-1-(этоксикарбонил)алкиладамантаны очищают вакуумной перегонкой. Выходы данных продуктов составляют 75-87%.
Нами изучен ряд закономерностей протекания взаимодействия 1,3-дегидроадамантана с этиловыми эфирами α-галогеналканкарбоновых кислот. Как показали проведенные исследования, оптимальным и технологичным условием проведения реакции присоединения этиловых эфиров α-галогеналканкарбоновых кислот к 1,3-дегидроадамантану является ее осуществление в среде избытка самих исходных этиловых эфиров α-галогеналканкарбоновых кислот при мольном соотношении 1,3-дегидроадамантан:этиловый эфир α-галогеналканкарбоновой кислоты=1:3-5. Меньший избыток приводил к некоторому снижению выхода целевых продуктов за счет возможной гомополимеризации 1,3-дегидроадамантана и его неполной конверсии. Дальнейшее увеличение содержания этилового эфира α-галогеналканкарбоновой кислоты не влияло на выход целевых продуктов и являлось нецелесообразным. Оптимальной температурой реакции является 50-60°С. Снижение температуры до комнатной приводит к сильному увеличению продолжительности данного взаимодействия и снижению выхода целевых продуктов, в то время как ее дальнейшее повышение наряду с ускорением реакции приводит к побочной реакции присоединения 1,3-дегидроадамантана к этиловому эфиру α-галогеналканкарбоновой кислоты не по связи C-Br, а по связи С-Н α-углеродного атома. Оптимальной продолжительностью процесса является 4-6 часов. Снижение времени реакции приводит к неполной конверсии 1,3-дегидроадамантана и снижению выхода целевого продукта. Увеличение времени реакции нецелесообразно в связи с полной конверсией 1,3-дегидроадамантана.
Строение синтезированных соединений подтверждено ЯМР Н-, масс-спектроскопией, а также элементным анализом.
Изобретение иллюстрируется следующими примерами:
Пример 1.
Этиловый эфир α-(3-бром-1-адамантил)уксусной кислоты
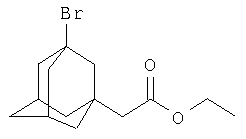
К 14.7 г (0.088 моль) этилового эфира α-бромуксусной кислоты (этил 2-бромацетата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-ДГА: этиловый эфир α-бромуксусной кислоты=1:4) в 20 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 55-60°С в течение 5 часов, после чего избыток этилового эфира α-бромуксусной кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 5.27 г (0.075 моль, 79.6%) этилового эфира α-(3-бром-1-адамантил)уксусной кислоты. Ткип=146-147°С / 2 мм рт. ст. n20 D) 1.5310. Спектр ЯМР 1H, δ, м.д.: 1.25 т (3Н, СН3), 1.35-2.30 (14Н, адамантил-1,3), 2.5 с (2Н, СН2С(O)), 4.11 кв (2Н, -ОСН2-). Масс-спектр, m/e, I, %: 272, 15% [M-C2H5]; 214, 8%, [AdBr]; 193, 1% [AdCH2COO]; 134, 100%, [1,3-Ad], 79-80, 29%, [Br]. Найдено, %: С 55.45, Н 6.98, Br 26.64. C14H21O2Br. Вычислено, %: С 55.81, Н 6.97, Br 26.58.
Пример 2.
Этиловый эфир α-(3-бром-1-адамантил)пропионовой кислоты.
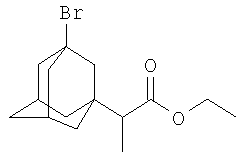
К 16.72 г (0.0924 моль) этилового эфира α-бромпропионовой кислоты (этил 2-бромпропионата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-ДГА:этиловый эфир α-бромпропионовой кислоты=1:4.2) в 20 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 60°С в течение 4.5 часа, после чего избыток этилового эфира α-бромпропионовой кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 5.61 г (0.0178 моль, 81%) этилового эфира α-(3-бром-1-адамантил)пропионовой кислоты. Ткип=144-145°С/0.5 мм рт.ст. n20 D 1.5218. Спектр ЯМР 1H, δ, м.д.: 1.00 т (3Н, СН3); 1.20 т (3H, СН3(эф.)); 1.40-2.30 (14Н, 1,3-адамантил, 1Н, СНС(О)), 4.07 кв (2H, -ОСН2-). Найдено, %: С 57.15, Н 7.28, Br 25.34. С15H23O2Br. Вычислено, %: С 57.14, Н 7.30, Br 25.39.
Пример 3.
Этиловый эфир α-(3-бром-1-адамантил)масляной кислоты.
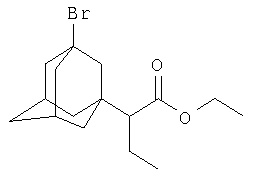
К 14.62 г (0.075 моль) этилового эфира α-броммасляной кислоты (этил-2-бромбутирата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 2 г (0.015 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-ДГА: этиловый эфир α-броммасляной кислоты=1:5) в 15 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 60°С в течение 6 часов, избыток этилового эфира α-броммасляной кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 3.74 г (0.0114 моль, 75.8%) этилового эфира α-(3-бром-1-адамантил)масляной кислоты. Ткип=170-172°С/3 мм рт.ст. n20 D 1.5199. Спектр ЯМР 1Н, δ, м.д.: 0.77 т (3Н, СН3); 1.29 т (3Н, СН3(эф.)); 1.35-2.3 (14Н, 1,3-адамантил; 1Н, СНС(О); 2H, -СН2-), 4.20 кв (2H, -ОСН2-). Найдено, %: С 58.33, Н 7.58, Br 24.37. С16H25O2Br. Вычислено, %: С 58.36, Н 7.60, Br 24.32.
Пример 4. Этиловый эфир α-(3-бром-1-адамантил)валериановой кислоты.
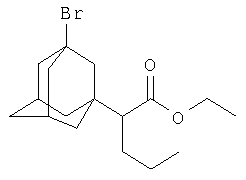
К 13.8 г (0.066 моль) этилового эфира α-бромвалериановой кислоты (этил 2-бромвалерата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана в 15 мл абсолютного диэтилового эфира (соотношение 1,3-ДГА: этиловый эфир α-бромвалериановой кислоты=1:3), после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 55-60°С в течение 5 часов, после чего избыток этилового эфира α-бромвалериановой кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 5.7 г (0.0166 моль, 75.5%) этилового эфира α-(3-бром-1-адамантил)валериановой кислоты. Ткип=178-179°С / 2 мм рт.ст. n20 D 1.5182. Спектр ЯМР 1Н, δ, м.д.: 0.88 т (3Н, СН3); 1.21 т (3Н, СН3(эф.)); 1.35-2.30 (14Н, 1,3-адамантил, 1Н, СНС(О); 4Н, -(СН2)2-), 4.10 кв (2H, -ОСН2-). Найдено, %: С 59.50, Н 9.59, Br 23.33. С17Н27O2Br. Вычислено, %: С 59.47, Н 9.62, Br 23.32.
Пример 5.
Этиловый эфир α-(3-бром-1-адамантил)-2-метилпропионовой кислоты
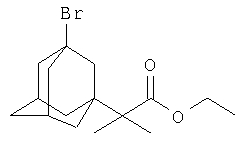
К 17.92 г (0.11 моль) этилового эфира α-бром-2-метилпропионовой кислоты (этил 2-бром-2-метилпропионата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-ДГА; этиловый эфир α-бром-2-метилпропионовой кислоты=1:5) в 20 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 50-60°С в течение 5 часов, после чего избыток этилового эфира α-бром-1-метилпропионовой кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 6.06 г (0.0192 моль, 87.5%), этилового эфира α-(3-бром-1-адамантил)-2-метилпропионовой кислоты. Ткип=159-160°С/2 мм рт.ст. n20 D 1.5240. Спектр ЯМР 1Н, δ, м.д.: 1.05 с (6Н, 2СН3); 1.20 т (3Н, СН3(эф.)); 1.52-2.35 (14Н, 1,3-адамантил), 4.08 кв (2H, -ОСН2-). Найдено, %: С 58.32, Н 7.57, Br 24.35. C16H25O2Br. Вычислено, %: С 58.36, Н 7.60, Br 24.32.
Пример 6.
Этиловый эфир α-(3-хлор-1-адамантил)-2,2-дихлоруксусиой кислоты
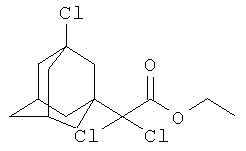
К 16.8 г (0.088 моль) этилового эфира трихлоруксусной кислоты (этил 2,2,2-трихлорацетата) в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл абсолютного диэтилового эфира (соотношение 1,3-ДГА:этиловый эфир трихлоруксусной кислоты=1:4). При смешении наблюдается незначительный экзотермический эффект. По окончании реакции растворитель отгоняют, реакционную смесь выдерживают при температуре 60°С в течение 4 часов, после чего избыток этилового эфира трихлоруксусной кислоты удаляют перегонкой, остаток перегоняют в вакууме и получают 5.96 г (0.0183 моль, 83.2%) этилового эфира α-(3-хлор-1-адамантил)-2,2-дихлоруксусной кислоты. Ткип=181-183°С/5 мм рт.ст. n20 D 1.5332. Спектр ЯМР 1H δ, м.д.: 1.27 т (3Н, СН3(эф.)); 1.50-2.30 (14Н, 1,3-адамантил), 4.34 кв (2H, -ОСН2-). Масс-спектр, m/e, 1,%: 133, 26%, [1,3-Ad]; 169, 100%, [ClAd]; 253, 15%, [ClAdCCl2]; 289, 12%, [М-Cl]. Найдено, %: С 51.64, Н 5.82, Cl 32.76. C14H19O2Cl3. Вычислено, %: С 51.61, Н 5.84, Cl 32.72.
Выводы
Разработан новый одностадийный способ получения 3-галоген-1-(этоксикарбонил)алкиладамантанов, позволяющий получать соединения заявляемой структурной формулы с высокими выходами. Структура полученных соединений подтверждена масс-, ЯМР1Н-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИАЛКИЛАМИДОВ 3-БРОМ-1-АДАМАНТИЛАЛКАНКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2344122C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-БРОМАДАМАНТИЛ-1-АЛКИЛ(АРИЛ)КЕТОНОВ | 2006 |
|
RU2309937C1 |
| СПОСОБ ПОЛУЧЕНИЯ α-АДАМАНТИЛСОДЕРЖАЩИХ АЛИФАТИЧЕСКИХ И ЖИРНОАРОМАТИЧЕСКИХ КЕТОНОВ | 2000 |
|
RU2186760C2 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-ДИАЛКИЛЗАМЕЩЕННЫХ АМИДОВ АДАМАНТИЛАЛКИЛКАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2348611C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(4-R-АРИЛ)АДАМАНТАНОВ ИЛИ ИХ ПРОИЗВОДНЫХ | 2006 |
|
RU2307116C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ НИТРИЛОВ | 2003 |
|
RU2240310C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ β-ДИКЕТОНОВ И КЕТОЭФИРОВ | 2000 |
|
RU2187493C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ФТАЛИМИДОАЛКИЛАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2003 |
|
RU2247114C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ АЛЬДЕГИДОВ | 2003 |
|
RU2240303C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АДАМАНТИЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ ТРИМЕТИЛБИЦИКЛО[2.2.1]ГЕПТАН-2-ОНА | 2006 |
|
RU2311401C1 |
Изобретение относится к химии производных адамантана, а именно к новому способу получения 3-галоген-1-(этоксикарбонил)алкиладамантанов общей формулы:
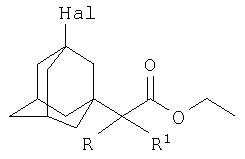
где Hal=Br, R=H: R1=H, СН3, C2H5, С3Н7; Hal=Br, R=СН3: R1=CH3; Hal=Cl, R=Cl: R1=Cl, которые могут представлять интерес в качестве полупродуктов в синтезе некоторых биологически активных веществ. Техническим результатом является расширение ассортимента химических соединений, в частности получение новых 3-галоген-1-(этоксикарбонил)алкиладамантанов с высоким выходом. Способ заключается во взаимодействии 1,3-дегидроадамантана с этиловыми эфирами α-галогеналканкарбоновых кислот из ряда: этил 2-бромацетат, этил 2-бромпропионат, этил 2-бромбутират, этил 2-бромвалерат, этил 2-бром-2-метилпропионат, этил 2,2,2-трихлорацетат при мольных соотношениях реагентов, равных соответственно 1:3-5, в среде исходных этиловых эфиров α-галогеналканкарбоновых кислот, при температуре 50-60°С в течение 4-6 часов.
Способ получения 3-галоген-1-(этоксикарбонил)алкиладамантанов общей формулы:
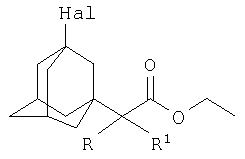
где Hal=Br, R=H:R1=H, СН3, C2H3, С3Н7;
Hal=Br, R=СН3:R1=CH3; Hal=Cl, R=Cl:R1=Cl,
заключающийся во взаимодействии 1,3-дегидроадамантана с этиловыми эфирами α-галогеналканкарбоновых кислот из ряда: этил 2-бромацетат, этил 2-бромпропионат, этил 2-бромбутират, этил 2-бромвалерат, этил 2-бром-2-метилпропионат, этил 2,2,2-трихлорацетат при мольных соотношениях реагентов, равных соответственно 1:3-5, в среде исходных этиловых эфиров α-галогеналканкарбоновых кислот, при температуре 50-60°С в течение 4-6 ч.
| МОХОВ М.В.и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Тезисы докладов | |||
| - Волгоград, Политехник, 5-7 июня, 2001, с.92-93 | |||
| ПРЕДОХРАНИТЕЛЬНОЕ УСТРОЙСТВО ДЛЯ ЛИФТА | 2012 |
|
RU2521895C2 |
| Способ получения @ -амино-1-адамантилуксусной кислоты | 1980 |
|
SU910605A1 |
Авторы
Даты
2007-06-27—Публикация
2006-04-17—Подача