Настоящее изобретение относится к соединениям, модулирующим рецепторы прогестерона, а также к применению этих соединений в терапии.
Внутриклеточные рецепторы представляют собой класс структурно родственных белков, вовлеченных в регуляцию генных белков. Стероидные рецепторы представляют собой подмножество этих рецепторов, включающее в себя рецептор прогестерона (PR), рецептор андрогена (AR), рецептор эстрогена (ER), глюкокортикоидный рецептор (GR) и минералокортикоидный рецептор (MR). Регуляция гена такими факторами требует внутриклеточного рецептора и соответствующего лиганда, который обладает способностью к селективному связыванию с рецептором таким способом, который воздействует на транскрипцию гена.
Модуляторы рецепторов прогестерона (прогестагены), как известно, играют важную роль в обеспечении здоровья женщины. Природный лиганд для рецептора PR представляет собой стероидный гормон прогестерон, но получены и синтетические соединения, которые также могут служить в качестве лигандов (смотри, например, Jones et al., патент США № 5688810).
Прогестагены в настоящее время широко используются для гормональной контрацепции и при HRT (гормон-заместительной терапии). Другими важными клиническими применениями прогестагенов являются лечение гинекологических расстройств (например, эндометриоза, дисменореи, дисфункциональных маточных кровотечений, острого предменструального синдрома), рака груди и лютиальная поддержка во время IVF (экстракорпорального оплодотворения). Агонисты PR используются в препаратах для контроля рождаемости, в то время как антагонисты PR могут использоваться при контрацепции, гормонально зависимых раковых заболеваниях, гормон-заместительной терапии, эндометриозе и тому подобное.
Используемые в настоящее время стероидные прогестагены, как показано, являются абсолютно безопасными и хорошо переносятся. Временами, однако, сообщается о побочных эффектах (например, болезненности груди, головных болях, депрессии и увеличении веса), которые приписываются этим стероидным прогестагенам, либо самим по себе, либо в сочетании с эстрогенными соединениями.
Стероидные лиганды к одному из рецепторов часто демонстрируют перекрестную реакционную способность к взаимодействию с другими стероидными рецепторами. Многие прогестагены также связываются, например, с глюкокортикоидным рецептором. Нестероидные прогестагены не имеют сходства молекулярных структур со стероидами, и по этой причине можно также ожидать различий в физико-химических свойствах, фармакокинетических (PK) параметрах, в распределении в тканях (например, в центральной и периферической нервной системе), и, что более важно, нестероидные прогестагены могут демонстрировать меньшую перекрестную реакционную способность по отношению к другим стероидным рецепторам или ее отсутствие. По этой причине, с этих точек зрения, нестероидные прогестагены будут оцениваться по-разному.
Настоящее изобретение предлагает нестероидные соединения, которые модулируют активность рецептора прогестерона. Более конкретно, настоящее изобретение предлагает нестероидные соединения с высокой аффиностью, которые являются агонистами, частичными агонистами или антагонистами рецептора прогестерона. Предпочтительно, эти соединения являются высокоспецифичными по отношению к рецептору прогестерона. В соответствии с настоящим изобретением предлагаются соединения, имеющие общую формулу I, их пролекарства или фармацевтически приемлемые соли, либо соединения, либо пролекарства.
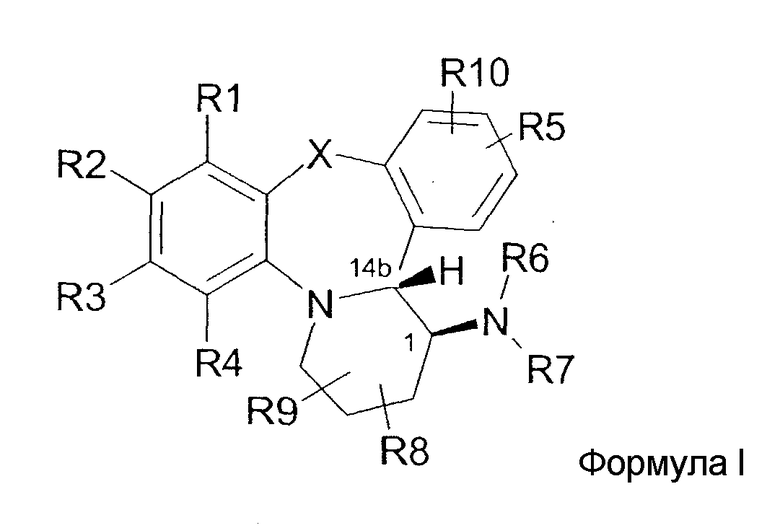
где R1, R3, R4, R5 и R10 независимо выбираются из группы, состоящей из H, галогена, (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила, OH, CN, O(1-4C)алкила, S(O)m(1-4C)алкила (необязательно замещенного одним или несколькими атомами галогена), C(O)(1-4C)алкила, OC(O)(1-4C)алкила и NR19R20,
R2 выбирается из группы, состоящей из H, галогена, NO2, NR11R12, (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила, OH, О(1-4C)алкила, S(1-4C)алкила и OC(O)(1-4C)алкила,
R6 выбирается из группы, состоящей из H, C(Y)R15, C(O)OR16, C(S)NR17, (1-6C)алкила, (1-6C)алкокси-замещенного (1-4C)алкила и (CH2)nC(O)OR21,
R7 выбирается из группы, состоящей из (1-4C)алкила, (2-4C)алкенила и (2-4C)алкинила, причем все они необязательно замещены одним или несколькими атомами галогена, или R7 представляет собой H,
R8 и R9 независимо выбираются из группы, состоящей из H и (1-4C)алкила,
R11 и R12 независимо выбираются из группы, состоящей из H, (1-4C)алкила, (2-4C)алкенила или (2-4C)алкинила, (1-6C)алкоксикарбонила, (1-4C)алкилсульфонила и (6-10C)арилсульфонила,
R15 представляет собой H или R15 выбирается из группы, состоящей из (1-6C)алкила, (3-6C)циклоалкила, (2-4C)алкенила, (2-4C)алкинила, (6-10C)арила, 1,4-бисарила, амино(1-4C)алкила, гидрокси(1-4C)алкила и карбокси(1-4C)алкила, причем все они необязательно замещены одним или несколькими атомами галогена,
R16 представляет собой (1-6C)алкил, необязательно замещенный одним или несколькими атомами галогена,
R17 выбирается из группы, состоящей из (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила и (3-6C)циклоалкила, причем все они необязательно замещены одним или несколькими атомами галогена,
X выбирается из группы, состоящей из O, S, CH2 и NR18,
Y выбирается из группы, состоящей из O, S, и NH,
R18 выбирается из группы, состоящей из H и (1-4C)алкила,
R19 выбирается из группы, состоящей из H и (1-4C)алкила,
R20 выбирается из группы, состоящей из H, (1-4C)алкила, CH2(6-10C)арила, C(O)(1-6C)алкила и C(O)NH(1-4C)алкила,
R21 выбирается из группы, состоящей из H и (1-6C)алкила,
m равно 0, 1 или 2,
n равно 1, 2 или 3, при условии, что
(i) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой этил или C(O)CH3, тогда R7 не является H;
(ii) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой метил, тогда R7 не является метилом;
(iii) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой H, тогда R7 не является H, этилом или (CO)CH3.
Термин «(1-4C)алкил», как используется в определении настоящего изобретения, обозначает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-4 атома углерода, например метил, этил, пропил, изопропил, бутил, втор-бтил и трет-бутил.
Термин «(1-6C)алкил», как используется в определении настоящего изобретения, обозначает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, втор-бтил, трет-бутил и гексил. (1-5C)Алкильные группы являются предпочтительными, (1-4C)алкил является наиболее предпочтительным.
Термин «галоген» обозначает фтор, хлор, бром или йод.
Термин «(1-6C)алкокси» обозначает алкоксигруппу, имеющую 1-6 атомов углерода, причем алкильный остаток имеет такую же формулу, как определено ранее. (1-2C)Алкоксигруппы являются предпочтительными.
Термин «(1-6C)алкоксикарбонил» обозначает алкоксикарбонильную группу, причем алкоксигруппа в ней содержит 1-6 атомов углерода и имеет такое же значение, как определено ранее. (1-4C)Алкоксикарбонильные группы являются предпочтительными.
Термин «(1-4C)алкилсульфонил» обозначает алкилсульфонильную группу, алкильная группа в которой содержит 1-4 атомов углерода и имеет такое же значение, как определено ранее. (1-2C)Алкилсульфонильные группы являются предпочтительными.
Термин «(6-10C)арил» обозначает ароматическую углеводородную группу, имеющую 6-10 атомов углерода, такую как фенил, нафтил, тетрагидронафтил или инденил, которая может необязательно быть замещена одним или несколькими заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано или (1-4C)алкила, причем алкильный остаток имеет такое же значение, как определено ранее. Предпочтительная ароматическая углеводородная группа представляет собой фенил.
Термин «(6-10)арилсульфонил» обозначает арилсульфонильную группу, арильная группа в которой содержит 6-10 атомов углерода и имеет такое же значение, как определено ранее. Фенилсульфонил является предпочтительным.
Термин «(2-4C)алкенил» обозначает алкенильную группу с разветвленной или неразветвленной цепью, имеющую 2-4 атома углерода, такую как этенил и 2-бутенил.
Термин «(2-4C)алкинил» обозначает алкинильную группу с разветвленной или неразветвленной цепью, имеющую 2-4 атома углерода, такую как этинил и пропинил.
Термин «амино(1-4C)алкил» обозначает аминоалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Амино(1-2C)алкильные группы являются предпочтительными.
Термин «гидрокси(1-4C)алкил» обозначает гидроксиалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Гидрокси(1-2C)алкильные группы являются предпочтительными.
Термин «1,4-бисарил» обозначает две фенильные группы, в которых вторая фенильная группа присоединена в 4-положении первой фенильной группы.
Термин «карбокси(1-4C)алкил» обозначает карбоксиалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Карбокси(1-2C)алкильные группы являются предпочтительными.
Термин «(3-6C)циклоалкил» обозначает циклоалкильную группу, имеющую 3-6 атомов углерода, представляющую собой циклопропил, циклобутил, циклопентил и циклогексил.
Термин «фармацевтически приемлемая соль» представляет те соли, которые, в рамках медицинского суждения, являются пригодными для использования в контакте с тканями людей и/или животных без излишней токсичности, раздражения, аллергической реакции и тому подобное, и соотносятся с разумным отношением выигрыш/риск. Фармацевтически приемлемые соли являются хорошо известными в данной области. Они могут быть получены во время конечного выделения и очистки соединений по настоящему изобретению или отдельно, путем взаимодействия функциональной группы свободного основания с соответствующей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой, например, как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Функциональная группа кислоты может взаимодействовать с органическим или минеральным основанием, подобным гидроксиду натрия, гидроксиду калия или гидроксиду лития.
Для целей настоящего изобретения термин «транс», когда он используется для названия конденсированных полициклических соединений, понимается, как обозначающий такую относительную стереохимию, где заместитель на кольце в положении 1, в формуле I, находится на стороне указанного кольца, противоположной по отношению к связи кольца с аннелированной кольцевой системой в положении 14b. Как следствие, заместитель в положении 1 находится на той же стороне кольцевой системы, что и являющийся частью мостика атом водорода, занимающий положение 14b. В дополнение к этому, использование термина «транс» будет понятно специалистам в данной области по иллюстрациям в различных диаграммах, фигурах и схемах реакций.
Пролекарства представляют собой соединения, которые быстро преобразуются in vivo в исходное соединение указанной выше формулы, например путем гидролиза в крови.
Соединения формулы I существуют как смеси стереохимических изомеров; предпочтительной является абсолютная стереохимия (1S,14bR).
Предпочтительными соединениями являются такие соединения, где R2 выбирается из группы, состоящей из H, галогена, NO2 и NR11R12, где R11 и R12 независимо выбираются из группы, состоящей из H, (1-6C)алкоксикарбонила, (1-4C)алкилсульфонила и (6-10C)арилсульфонила.
Особенно предпочтительными являются соединения формулы I, где R1 и R5 представляют собой H и R3 и R4 являются независимо выбранными из H или галогена.
X предпочтительно представляет собой O, S или CH2, более предпочтительно O или CH2. Другие представляющие интерес соединения представляют собой такие соединения, где R6 представляет собой H или C(Y)R15 и R15 представляет собой H или (1-4C)алкил, предпочтительно (1-2C)алкил, причем алкильные группы необязательно замещены одним или несколькими атомами галогена.
Также предпочтительными являются соединения, где R2 представляет собой H, галоген или NO2. Наиболее предпочтительными, в качестве R2, являются H и F.
Наиболее предпочтительными соединениями являются соединения, где R11 представляет собой H и R12 представляет собой (1-6C)алкоксикарбонил, (1-4C)алкилсульфонил или (6-10C)арилсульфонил.
Также в высшей степени предпочтительными являются соединения, где R2 представляет собой H, R3 представляет собой галоген, R15 представляет собой метил, необязательно замещенный 1-3 атомами галогена, и Y представляет собой O или S, более конкретно, те соединения, где R4 представляет собой H и X представляет собой O. Соединения, имеющие некоторые из предпочтений, указанных выше в связи с общей формулой I, или дополнительных, являются в высшей степени предпочтительными.
Дополнительными предпочтительными соединениями являются такие, где R2 представляет собой H или галоген, R3 и/или R4 являются независимо выбранными из группы, состоящей из H, CN, галогена, (2-4C)алкенила и C(O)(1-4C)алкила и R5 и/или R10 являются независимо выбранными из H или галогена.
Более предпочтительными являются соединения, где X выбирается из группы, состоящей из O, S и NCH3.
Также предпочтительными являются соединения, где R8 и R9 представляют собой H.
Кроме того, предпочтительными являются соединения, где R6 представляет собой H или C(Y)R15 и R15 представляет собой H или (1-4C)алкил, необязательно замещенный одним или несколькими атомами галогена.
Также предпочтительными являются соединения, где Y представляет собой O или S и R15 представляет собой метил, необязательно замещенный одним или несколькими атомами галогена.
Схема I
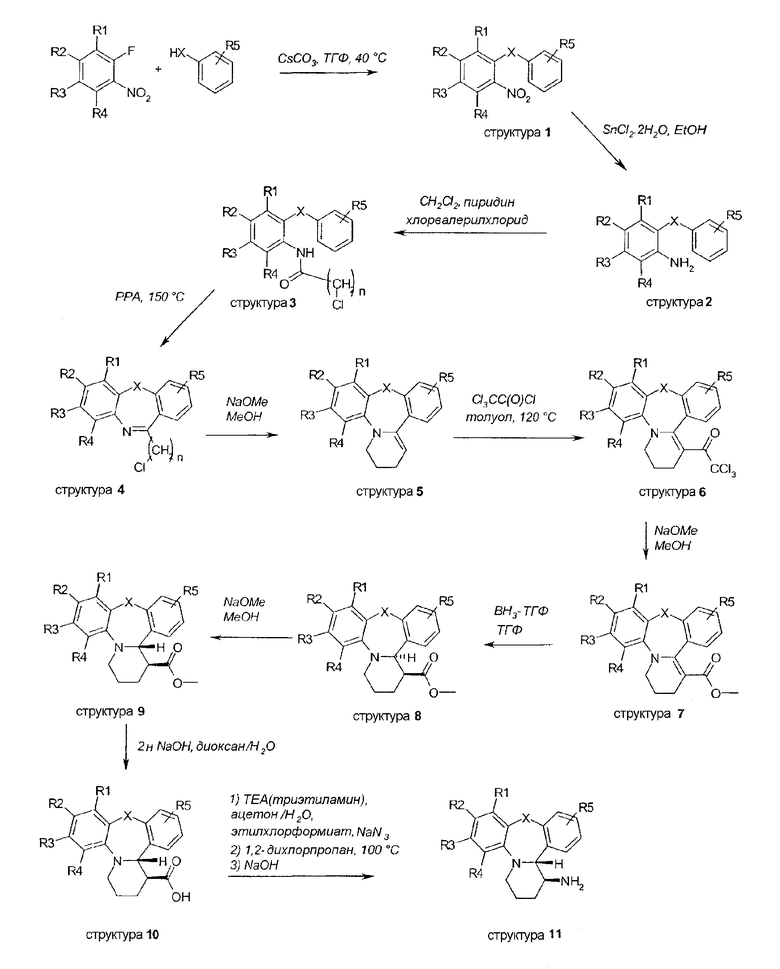
Последовательности стадий для синтеза соединений по настоящему изобретению показаны на схемах I-XVIII. В каждой из схем группы R соответствуют структурам замещения, отмеченным в примерах и формуле I.
Тетрациклическая система (такая как структура 11) создается с помощью рутинных способов синтеза, как описывается в схеме I. Нуклеофильное ароматическое замещение 2-фторнитрофенилов соответственно замещенными фенолами, тиофенолами или анилинами дает диариловые простые эфиры, простые тиоэфиры или амины 1 соответственно. В случае X = CH2 структура 1 является коммерчески доступной. Восстановление нитрогруппы с помощью SnCl2 дает производные анилина 2. Ацилирование функциональной группы анилина 5-хлорвалерилхлоридом дает амиды 3. Следующее далее замыкание кольца осуществляется путем обработки амида PPA (полипарабановой кислотой) при 150°C. Обработка иминовых структур 4 метоксидом натрия приводит к внутримолекулярной циклизации и дает тетрациклические системы 5. Взаимодействие енаминовой функциональной группы с трихлорацетилхлоридом дает трихлорацетильные производные 6. Трихлорацетильная функциональная группа преобразуется в производные сложного метилового эфира 7 при обработке метоксидом натрия. Последующее восстановление алкеновой функциональной группы ненасыщенных карбоксилатов 7 бораном дает исключительно цис-изомеры, такие как структуры 8. Эпимеризация до транс-изомеров 9 осуществляется при обработке 8 метоксидом натрия. Омыление сложного эфира дает карбоксилат 10, который впоследствии преобразуется посредством классической реакции Курциуса в аминовую функциональную группу, приводит к получению производных транс-1-амино-тетрагидропиридодибензо(окс/ти/ди)азепина 11. Рацемическая смесь разделяется на ее чистые энантиомеры посредством хиральной ВЭЖХ (колонка OJ (25 x 0,46 см)).
Тетрациклические соединения (11) используются в качестве исходных материалов в схемах II и III. На схеме II показано ацилирование аминовой функциональной группы структуры 11, которое осуществляется посредством многочисленных различных рутинных способов синтеза (например, хлорангидридов, ангидридов, карбоновых кислот со связывающими реагентами или амидирования). Полученные амидные структуры 12 являются мишенью для следующей далее модификации. Обработка амидов, таких как структура 12, пентасульфидом фосфора дает тиоамиды 13. Алкилирование амида в структуре 12 алкилирующими агентами в присутствии гидрида натрия дает структуры 14. Структуры 15 получают посредством образования амидина аминовой функциональной группы 11 путем обработки нитриловыми производными, такими как трифторацетонитрил.
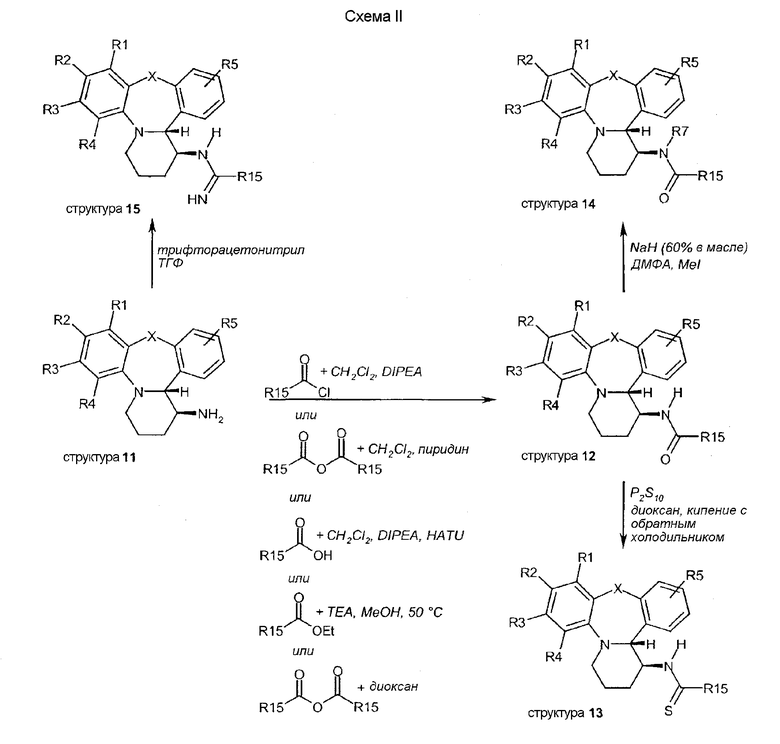
Схема III описывает образование уретановых структур 16, исходя из структур 11, посредством взаимодействия с хлорформиатами в присутствии бикарбоната натрия. Обработка структуры 11 изотиоцианатами дает производные тиомочевины структуры 17. Восстановительное алкилирование аминовой функциональной группы в структуре 11 альдегидами в присутствии триацетоксиборгидрида натрия дает структуры 18. Алкилирование аминовой функциональной группы 2-метоксиэтилбромидом дает структуры 26. Структуры 27 получают путем обработки трет-бтилбромацетатом.
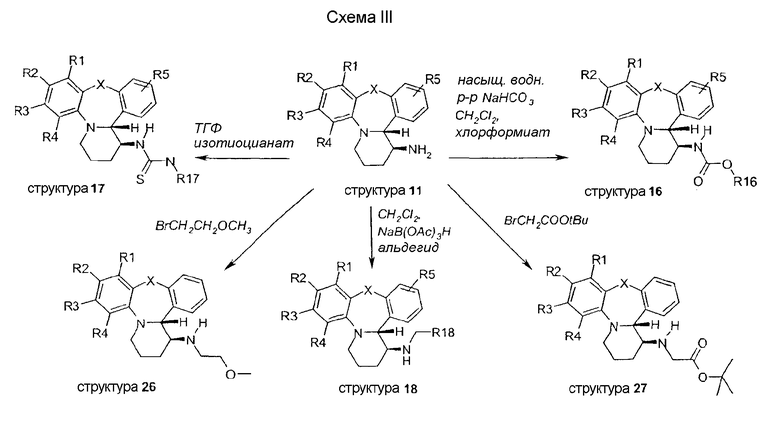
Прямые электрофильные ароматические замещения в структурах каркаса дают различные альтернативные ароматические замещенные производные (схемы IV-V).
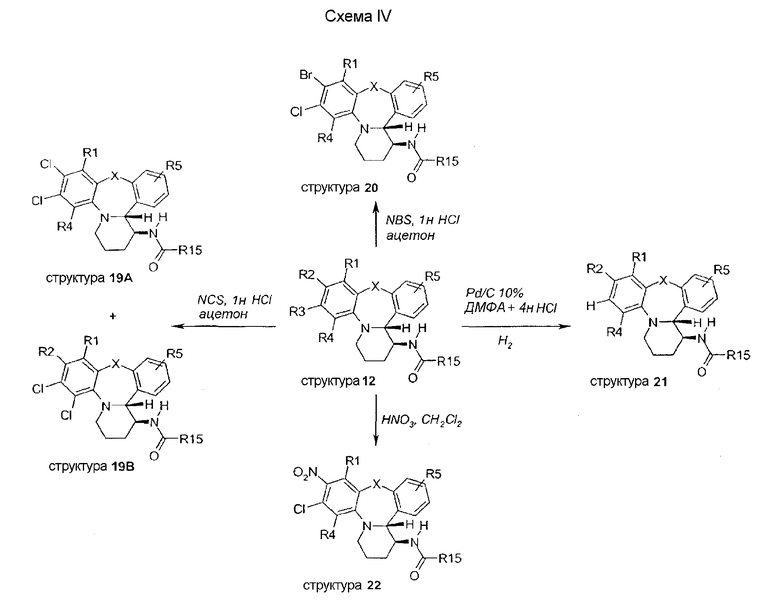
В схеме IV описывается хлорирование структуры 12, где R3 представляет собой Cl, N-хлорсукцинимидом в присутствии каталитического количества HCl; это приводит к образованию двух различных замещенных структур 19A и 19B, которые легко разделяются. В противоположность этому, бромирование структуры 12 N-бромсукцинимидом при идентичных условиях дает только соединение со структурой 20. Восстановительное дегалогенирование хлор-замещенного соединения (12) достигается путем обработки водородом в присутствии Pd/C и HCl, с получением водород-замещенного производного 21. Нитрирование структуры 12 азотной кислотой дает совершенно селективно моно-замещенное производное 22.
Прямое хлорирование на структуре 21 (схема V) N-хорсукцинимидом дает два региоизомера 23A и 23B, два соединения, которые легко разделяются с помощью хроматографических методов.
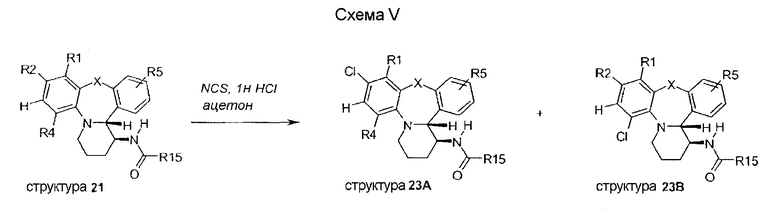
Как показано на схеме VI, восстановление нитро функциональной группы структур, таких как структуры 22, SnCl2·2H2O в этаноле, дает анилиновые производные 24. Сульфонирование или ацилирование этой анилиновой функциональной группы дает замещенные соединения, такие как структура 25.
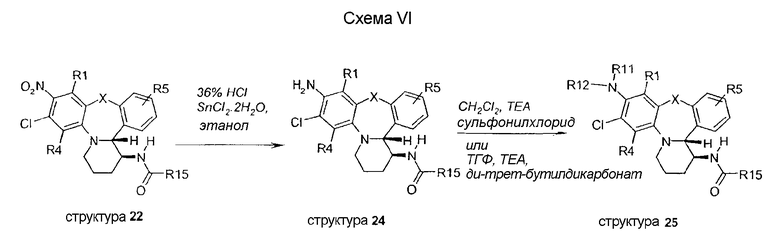
Как изображено на схеме VII, обработка дихлорсоединения 19B K2CO3 приводит к образованию соответствующего амина 28, и последующее формилирование этилформиатом дает структуру 29.
Схемы VIII и IX описывают синтез бромпроизводных 36, где R4 = Br. Образование имина путем обработки смеси амина и салицилальдегида п-толуолсульфоновой кислотой и последующее замыкание кольца путем этерификации дает трициклические промежуточные соединения 31.
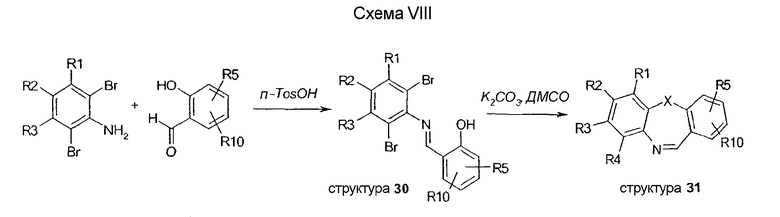
Схема IX описывает последовательности стадий синтеза соединения 36, исходя из трициклических промежуточных соединений, таких как соединения 31. Обработка трициклического имина 31 глутаровым ангидридом дает тетрациклы 32. Перегруппировка Курциуса с помощью DPPA и спирта приводит к образованию уретановых структур 33. Восстановление амидной функциональной группы осуществляется путем применения борана в ТГФ. Обработка уретановых структур 34 HBr в уксусной кислоте дает амины 35. Ацилирование аминовой функциональной группы трифторуксусным ангидридом дает соответствующие амиды 36.
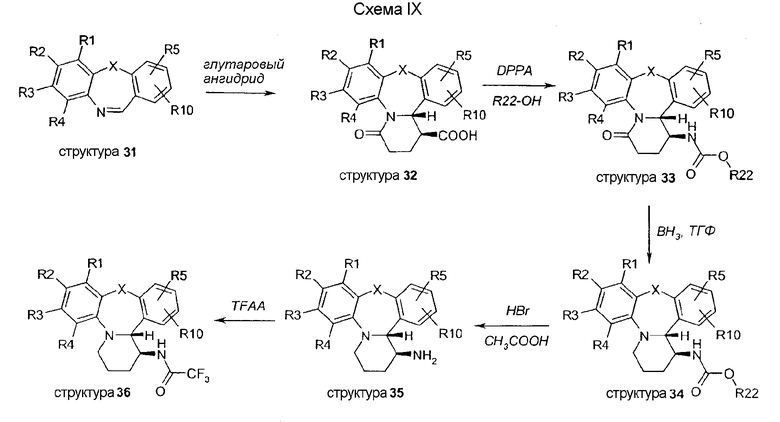
Бромпроизводные 36 используют в качестве исходных материалов в схеме X. Реакции Штилле дают соединения с ацетильной (структуры 37) или винильной функциональной группой (структуры 39). Обработка бромпроизводных 36 CuCN дает соответствующие цианосоединения 38. Соединение 40 синтезируют с помощью реакции Негиши с палладиевым катализатором и метилцинкхлоридом. Обработка бромпроизводных 36 CuI и NaOMe дает метоксипроизводные 41.
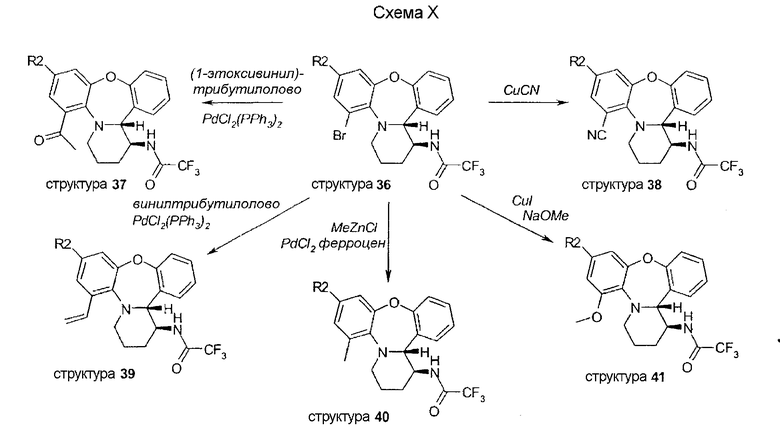
Синтез соединений 46 осуществляют аналогично способу, описанному для бромпроизводных 36. Трициклическое промежуточное соединение 45 синтезируют способом, иным, чем описано на схеме XI. Синтез начинается с этерификации, с последующим восстановлением нитро функциональной группы и формилированием амина 43. Затем обработка PPA осуществляет замыкание кольца до трициклического соединения 45.
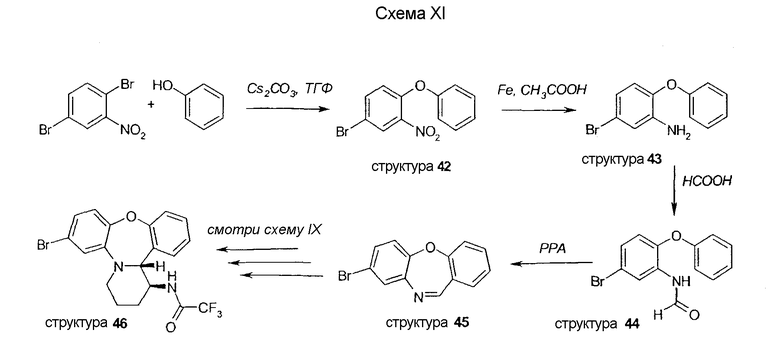
Бромпроизводное 46 используется в качестве исходного материала в схеме XII, где винильное (структура 49) и ацетильное производное (структура 47) образуется с помощью реакции Штилле. Нитрильная функциональная группа вводится путем обработки CuCN. Бензиламин вводится с помощью реакции Бухвальда; следующее далее гидрирование этого продукта генерирует амин 51. Взаимодействие с пропионилхлоридом дает соответствующий амид (структура 52).
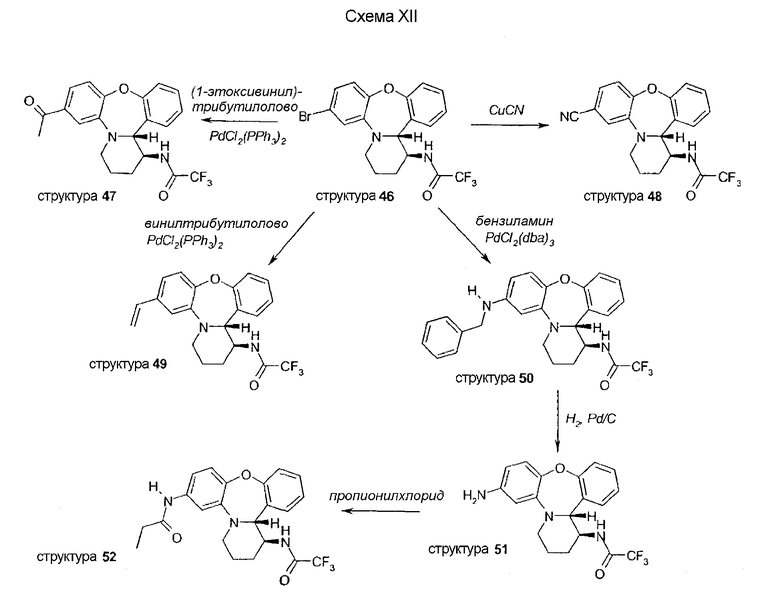
Синтез производных при R5 ≠ H описывается в схемах XIII и XIV. Трициклическое промежуточное соединение получают путем образования имина и следующего далее замыкания кольца посредством этерификации.
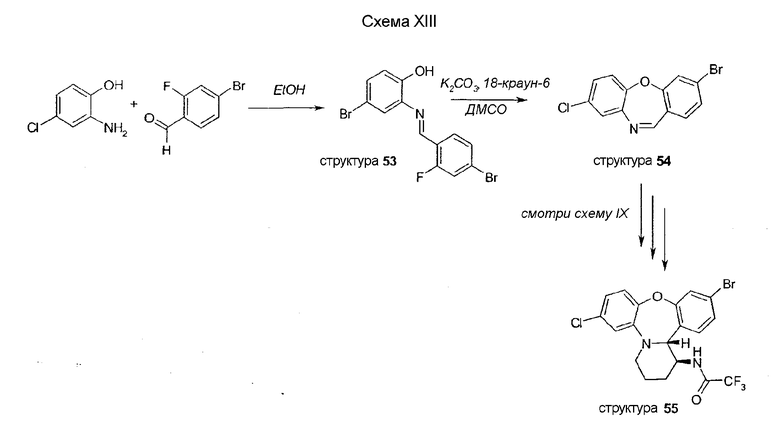
Цианопроизводное 56, метиловое производное 57 и дихлорсоединение 58 получают путем обработки соединения 55 CuCN, метилцинкхлоридом или NCS соответственно, как описано на схеме X.
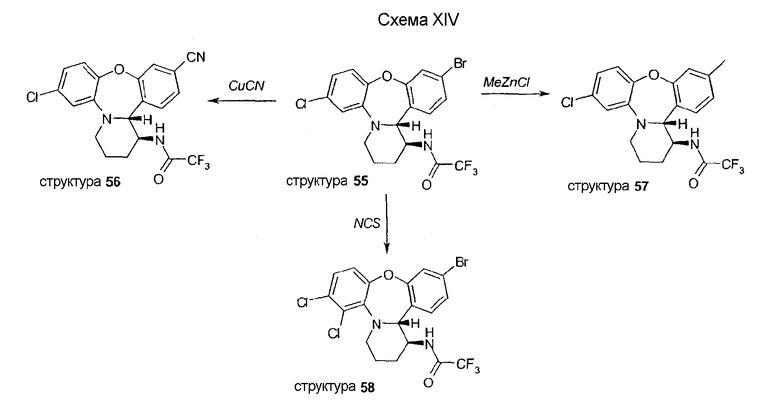
Способ синтеза с получением фторпроизводных 61 (R5 и/или R10 = F) изображен на схеме XV и подобен способу синтеза с получением производных с R5 ≠ H (схема XIII). В этом случае замыкание кольца путем этерификации осуществляется с помощью использования микроволновой печи.
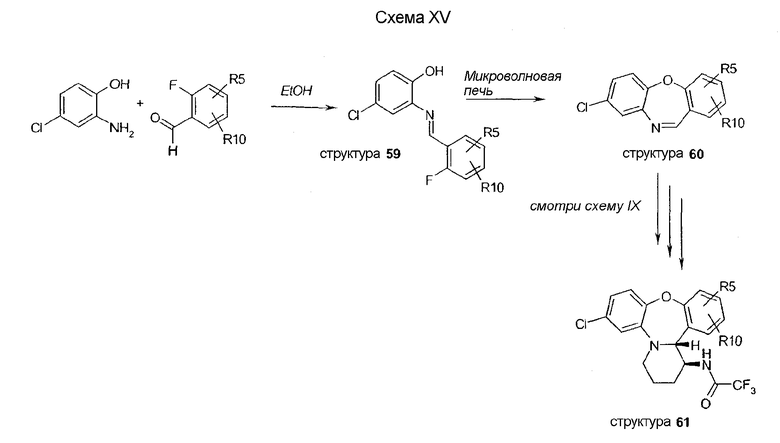
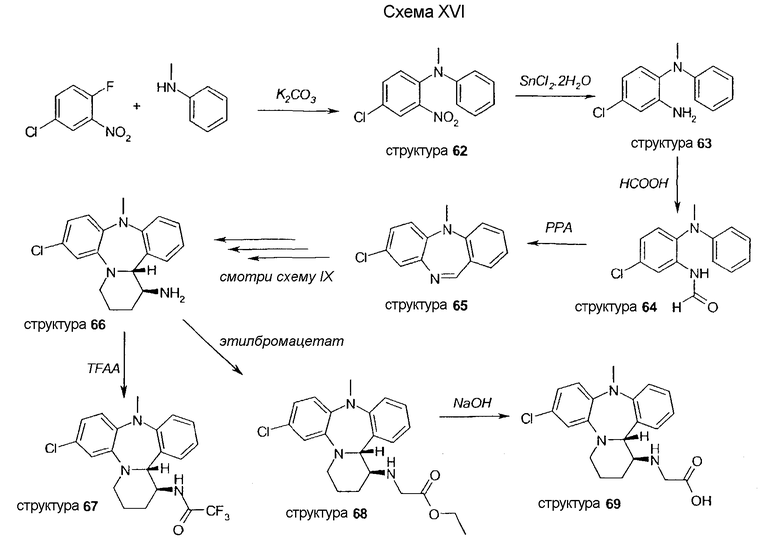
Производные с X = N-Me (структуры 67, 68 и 69) синтезируют в соответствии со схемой XVI. Трициклическое промежуточное соединение 65 синтезируют путем сочетания 4-хлор-1-фтор-2-нитробензола и N-метиланилина, с последующим восстановлением нитро функциональной группы и формилированием амина. Замыкание кольца с получением промежуточного соединения 65 осуществляется путем обработки PPA. Последовательности стадий синтеза соединения 66 из соединения 65 описаны на схеме IX. Аминовая функциональная группа соединения 66 ацилируется, с получением амида 67, или алкилируется с получением соединения 68. Следующее далее омыление дает соединение 69.
Способ с получением производных с X = N-H осуществляют через трициклический амид 72, который получают путем внутримолекулярной конденсации. Восстановление с помощью LiAlH4 и следующее затем окисление с помощью MnO2 дает трициклическое промежуточное соединение 74. Соответствующий амид 75 синтезируют, как описано на схеме IX.

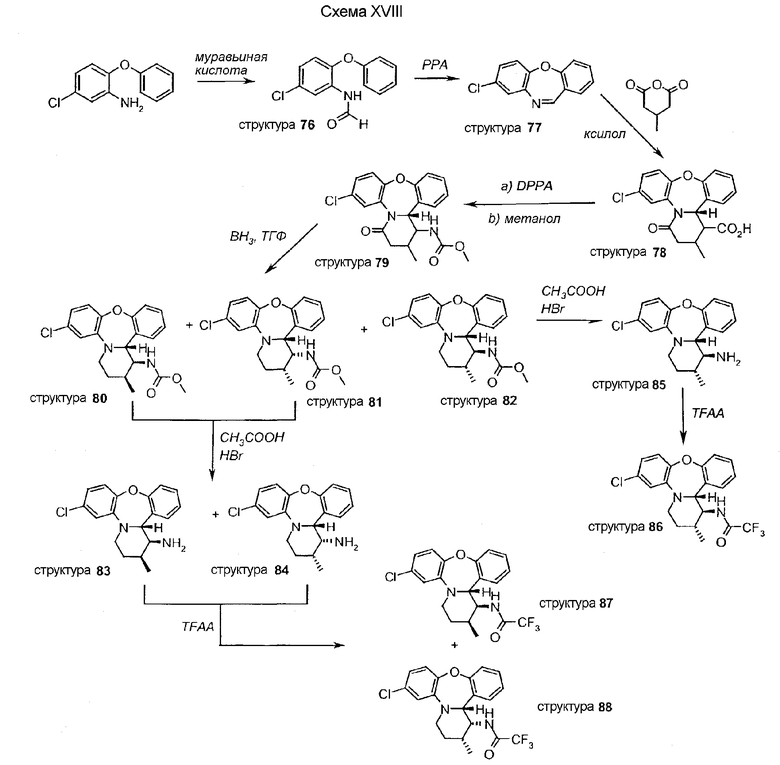
Применение 3-метилглутарового ангидрида при получении тетрациклического промежуточного соединения 78 и при следующем далее получении уретана приводит к получению смеси изомеров 80, 81 и 82, как показано на схеме XVIII. Обработка HBr в уксусной кислоте, со следующим далее ацилированием и разделением изомеров, приводит к получению амидов 86, 87 и 88.
Способы для определения связывания с рецептором, а также анализы in vitro и in vivo для определения биологической активности соединений хорошо известны. Как правило, экспрессированный рецептор обрабатывают соединением по настоящему изобретению и определяют связывание, или стимулирование, или ингибирование функциональной реакции.
Для измерения функциональной реакции изолированная ДНК, кодирующая ген рецептора прогестерона, предпочтительно рецептора человека, экспрессируется в соответствующие клетки хозяина. Такая клетка может представлять собой клетку яичника китайского хомячка (CHO), но и другие клетки также являются пригодными для использования. Предпочтительно клетки берутся у млекопитающих.
Способы конструирования рекомбинантных линий клеток, экспрессирующих рецепторы прогестерона, хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, самое последнее издание). Экспрессия рецептора достигается путем экспрессии ДНК, кодирующей желаемый белок.
Методики для сайт-ориентированного мутагенеза, лигирования дополнительных последовательностей, PCR (полимеразной цепной реакции) и конструирования соответствующих систем экспрессии сегодня являются, все, хорошо известными в данной области. Части ДНК или вся ДНК, кодирующая желаемый белок, может конструироваться синтетически, с использованием стандартных твердофазных методик, предпочтительно с включением сайтов рестрикции для простоты лигирования. Соответствующие элементы контроля для транскрипции и трансляции включенной кодирующей последовательности могут создаваться посредством кодирующих последовательностей ДНК. Как хорошо известно, сейчас доступны системы экспрессии, которые совместимы с широким множеством хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и тому подобное.
Клетки, экспрессирующие рецептор, затем приводятся в контакт с соединением по настоящему изобретению для наблюдения связывания, или стимулирования, или ингибирования функциональной реакции.
Альтернативно, выделенный цитозоль, содержащий экспрессированный рецептор, может использоваться для измерения связывания соединения по настоящему изобретению.
Для измерения связывания могут использоваться радиоактивные или флуоресцентномеченные соединения. В качестве эталонного соединения может использоваться нативный гормон или другие соединения, связывающиеся с рецептором. В качестве альтернативы могут осуществляться также анализы конкурентного связывания.
Другой анализ включает в себя скрининг на соединения - агонисты рецептора прогестерона по настоящему изобретению путем определения регуляции природной мРНК целевого гена, медиируемой рецептором, то есть генов, регулируемых рецептором посредством связывания рецептора в промоторной области гена. Уровни мРНК целевого гена будут понижаться или повышаться, в зависимости от ингибирующего или стимулирующего эффекта соединения по настоящему изобретению при связывании с рецептором.
В дополнение к непосредственному измерению уровней мРНК в подвергающихся воздействию клетках могут быть использованы клетки, которые, в дополнение к трансфицированию ДНК, кодирующей рецептор, трансфицируются также второй ДНК, кодирующей репортерный ген, экспрессия которого отвечает связыванию рецептора с чувствительными элементами в промоторе конкретного репортерного гена. Такие чувствительные элементы могут представлять собой классические гормон-чувствительные элементы, хорошо известные в данной области и описанные, например, в Beato, M., Chalepakis, G., Schauer, M., Slater, E.P. (1989) J. Steroid Biochem. 5:737-47 или могут конструироваться таким образом, что они соединяются с новыми чувствительными элементами. Как правило, экспрессия репортерного гена может контролироваться любым чувствительным элементом, реагирующим на связывание рецептора прогестерона. Соответствующие репортерные гены представляют собой, например, LacZ, щелочную фосфатазу, люциферазу светлячка и белок с зеленой флуоресценцией (GFP).
Для выбора активных соединений агонистов рецептора прогестерона исследование при 10-5 M должно приводить к получению активности, большей, чем 30% от максимальной активности, когда (16α)-16-этил-21-гидрокси-19-норпрегн-4-ен-3,20-дион (Org 2058) используется в качестве эталона. Для выбора соединений - антагонистов рецептора прогестерона исследование при 10-5 M должно приводить к активности, превышающей более чем на 10% максимальную активность, когда (6β,11β,17β)-11-[4-(диметиламино)фенил]-4',5'-дигидро-6-метилспиро[эстра-4,9-диен-17,2'(3'H)-фуран]-3-он (Org 31710) используется в качестве эталона. Другой критерий может представлять собой значение EC50, которое должно составлять <10-5 M, предпочтительно <10-7 M.
Специалист в данной области заметит, что желаемые значения EC50 зависят от того, какие соединения по настоящему изобретению исследуются. Например, соединение с EC50, которое меньше, чем 10-5 M, как правило, рассматривается как кандидат на выбор лекарственного средства. Предпочтительно, это значение, меньше, чем 10-7 M. Однако соединение, которое имеет более высокое значение EC50, но является селективным к конкретному рецептору, по-прежнему может быть кандидатом на поиск лекарственного средства.
В основном, любой анализ трансактивирования клеток млекопитающих (линии клеток или первичной культуры), который может дать информацию о возможном активировании рецептора, может использоваться для целей выбора сильнодействующих лигандов. Суммарное значение при использовании нескольких систем клеток с клетками, которые происходят от различных органов, может предоставлять нужную информацию по потенциальной тканевой специфичности лигандов, которая получается при этом. Примеры клеток, часто используемых для этой цели, представляют собой, наряду с клетками CHO, клетки, среди прочих, T47D, клетки MCF7, клетки ECC-1, клетки HeLa, первичные культуры эндометриальных клеток и гипофизарные клетки.
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение общей формулы I или его соль.
Таким образом, соединения по настоящему изобретению могут использоваться в терапии.
Соединения по настоящему изобретению могут использоваться клинически в тех режимах, где используют прогестагены.
Следовательно, настоящее изобретение заключается в использовании соединения, имеющего общую формулу I, для изготовления медикамента для модуляции состояний здоровья у женщин, медиируемых рецептором прогестерона, более конкретно гормонально зависимых раковых заболеваний, таких как рак груди, яичников и матки; контроля эндометриоза и рождаемости. Настоящее изобретение также относится к лечению состояний, определенных выше, путем введения соединения по настоящему изобретению.
Соответствующие способы введения соединений формулы I или их фармацевтически приемлемых солей, также упоминаемых здесь как активный ингредиент, представляют собой внутримышечные инъекции, подкожные инъекции, внутривенные инъекции или внутрибрюшинные инъекции, пероральное и интраназальное введение. Предпочтительно соединения могут вводиться перорально. Конкретная доза и режим введения активного ингредиента или его фармацевтической композиции обязательно будет зависеть от терапевтического воздействия, которое должно быть достигнуто (например, лечение бесплодия; контрацепция, эндометриоз), и могут изменяться вместе с конкретным соединением, способом введения и возрастом и состоянием индивидуального субъекта, которому должен вводиться медикамент.
Как правило, парентеральное введение требует более низких доз, чем другие способы введения, которые сильнее зависят от поглощения. Однако дозировка для людей предпочтительно содержит 0,0001-25 мг на кг массы тела. Желаемая доза может быть представлена как однократная доза или как множество поддоз, вводимых через соответствующие интервалы, в течение дня или, в случае пациентов женского пола, как дозы, которые должны вводиться через соответствующие (дневные) интервалы в течение менструального цикла. Дозировка, как и режим введения, могут различаться для пациентов мужского и женского пола.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение формулы I в смеси с фармацевтически приемлемыми вспомогательными веществами и, необязательно, другими терапевтическими веществами. Вспомогательные вещества должны быть "приемлемыми", в смысле, быть совместимыми с другими ингредиентами композиции и быть безвредными для пациентов.
Фармацевтические композиции включают в себя композиции, пригодные для перорального, ректального, назального, местного (включая трансдермальное, буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и чрезкожное) введения или введения посредством имплантанта. Композиции могут быть получены с помощью любого способа, хорошо известного в области фармации, например, с использованием таких способов, как описаны в Gennaro et al., Remington's Pharmaceutical Sciences (18th ed., Mack Publishing company, 1990, смотри конкретно Part 8: Pharmaceutical Preparations and Their Manufacture).
Такие способы включают в себя стадию приведения в ассоциированное состояние активного ингредиента с любым вспомогательным веществом. Вспомогательное вещество (вещества), также именуемые дополнительные ингредиенты, включают в себя ингредиенты, обычные в данной области (Gennaro, выше), такие как наполнители, связующие, разбавители, дезинтеграторы, лубриканты, красители, ароматизаторы и смачивающие вещества.
Фармацевтические композиции, пригодные для перорального введения, могут быть представлены как дискретные дозированные единицы, такие как пилюли, таблетки или капсулы, или как порошок или гранулы, или как раствор или суспензия. Активный ингредиент также может быть представлен как болюс или паста. Кроме того, композиции могут включаться в суппозиторий или клизму, для ректального введения.
Кроме того, настоящее изобретение включает в себя фармацевтическую композицию, как описано выше, в сочетании с упаковочным материалом, включая инструкции для применения композиции, для такого использования, как описано выше.
Для парентерального введения соответствующие композиции включают в себя водные и неводные стерильные растворы для инъекций. Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например в герметичных флаконах и ампулах, и могут храниться в высушенном вымораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды, перед использованием.
Композиции или препараты, пригодные для введения путем назальной ингаляции, включают в себя мелкодисперсные порошки или аэрозоли, которые могут генерироваться посредством аэрозольных ингаляторов, небулайзеров или инсуффляторов высокого давления с отмеряемыми дозами.
Производные по настоящему изобретению могут также вводиться в форме устройств, состоящих из сердцевины из активного материала, окруженной мембраной, регулирующей скорость высвобождения. Такие имплантанты должны применяться подкожно или местным образом, они будут высвобождать активный ингредиент примерно при постоянной скорости в течение относительно длительных периодов времени, например от недель до лет. Способы для изготовления имплантируемых фармацевтических устройств как таковых известны в данной области, например, как описано в Европейском патенте 0303306 (AKZO N.V.).
Настоящее изобретение иллюстрируется с помощью следующих далее примеров.
ПРИМЕРЫ
Пример 1
транс-7-Фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = F, R4 = H, R5 = H, R6 = H, R7 = H, X = O)
5-Фтор-2-феноксинитробензол
Cs2CO3 (12,1 г, 62,9 ммоль) добавляют к раствору фенола (5,9 г, 62,9 ммоль) в 400 мл ТГФ, в атмосфере N2. После перемешивания в течение 15 минут добавляют 2,5-дифторнитробензол (6,82 мл, 62,9 ммоль) в 50 мл ТГФ. Полученную смесь нагревают при 40°C в течение 25 часов. Реакцию отслеживают с помощью ВЭЖХ, до детектирования исчезновения 2,5-дифторнитробензола. Добавляют воду и этилацетат, с последующей экстракцией этилацетатом (2x). Объединенные органические слои последовательно промывают насыщенным водным раствором бикарбоната натрия (3x), водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. Сырое соединение подвергают хроматографии на силикагеле для удаления избытка фенола. Элюирование с помощью толуола/этилацетата, 95:5, дает указанное в заголовке соединение (12,6 г, 86%). Данные: (m/z) = 234 (M+H)+.
5-Фтор-2-феноксианилин
Общий способ 1: Восстановление нитросоединения структуры 1 до анилина структуры 2.
SnCl2·2H2O (88,0 г, 390 ммоль) добавляют к раствору 5-фтор-2-феноксинитробензола (22,3 г, 95,7 ммоль) в 450 мл этанола, в атмосфере N2. Полученную смесь перемешивают при 40°C, в течение 30 минут, и дополнительно при охлаждении в течение 2 часов. Этанол удаляют путем выпаривания при пониженном давлении и добавляют 300 мл этилацетата. Органический слой промывают водой и холодным 1 н. NaOH. Эмульсию фильтруют через декалит, промывают водой, экстрагируют этилацетатом, сушат (Na2SO4) и выпаривают с получением сырого соединения в виде темно-коричневого масла (19,6 г, 100%). Данные: (m/z) = 204 (M+H)+.
5-Хлор-N-(5-фтор-2-феноксифенил)пентанамид
Общий способ 2: Ацилирование анилина структуры 2 до амида структуры 3.
Раствор 5-хлорпентаноилхлорида (13,0 мл, 100 ммоль) в 13 мл CH2Cl2 добавляют в течение 30 минут к раствору 5-фтор-2-феноксианилина (19,6 г, 95,7 ммоль) в 88 мл CH2Cl2 и 7 мл пиридина при <25°C. После перемешивания смеси в течение 1 часа при комнатной температуре добавляют100 мл воды со льдом при 0°C. После 18 часов перемешивания при комнатной температуре два слоя разделяются. Органический слой промывают холодным 2 н. NaOH и водой, сушат (Na2SO4) и выпаривают, с получением сырого соединения в виде коричневого масла (31,0 г, 100%). Данные: (m/z) = 322 (M+H)+.
8-Фтор-11-(4-хлорбутил)дибензо[b,f][1,4]оксазепин
Общий способ 3: Замыкание кольца амида структуры 3 до имина структуры 4.
PPA (190 г, 84%) добавляют к раствору 5-хлор-N-(5-фтор-2-феноксифенил)пентанамида (31,0 г, 95,7 ммоль). Полученную смесь перемешивают при 150°C, в течение 2,5 часа, а затем охлаждают до 50°C. Добавляют 500 мл этилацетата и 300 мл воды со льдом. Смесь перемешивают в течение 1 часа. Органический слой промывают холодным 1 н. NaOH и водой, сушат (Na2SO4) и выпаривают, с получением сырого соединения в виде черного масла (26,3 г, 90%). Данные: (m/z) = 304 (M+H)+.
7-Фтор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин
Общий способ 4: Замыкание кольца имина структуры 4 до тетрацикла структуры 5.
Раствор 8-фтор-11-(4-хлорбутил)дибензо[b,f][1,4]оксазепина (26,3 г, 86,6 ммоль) в 45 мл метанола добавляют к раствору метоксида натрия (9,6 г, 177 ммоль) в 115 мл метанола, в атмосфере N2. Полученную смесь нагревают при кипении с обратным холодильником в течение 5 часов, охлаждают до комнатной температуры и перемешивают в течение ночи. Добавляют воду и CH2Cl2 и смесь выливают в 500 мл воды и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (Na2SO4) и выпаривают и сырое соединение подвергают хроматографии на силикагеле. Элюирование с помощью толуола дает указанное в заголовке соединение в виде коричневого масла (16,5 г, 77%). Данные: (m/z) = 268 (M+H)+.
7-Фтор-1-(трихлорацетил)-3,4-дигидро-2H-d]дибензо[b,f]пиридо[1,2-d][1,4]оксазепин
Общий способ 5: Преобразование енамина структуры 5 до трихлорацетилпроизводного структуры 6.
Трихлорацетилхлорид (8,75 мл, 78,5 ммоль) добавляют к раствору 7-фтор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепина (16,5 г, 61,9 ммоль) в 125 мл толуола, в атмосфере N2. После перемешивания в течение 15 минут в течение 15 минут добавляют триэтиламин (7,7 мл). Полученную коричневую суспензию нагревают до 120°C, в течение 75 мин. После охлаждения до 5°C добавляют 100 мл воды со льдом. После перемешивания в течение 1 часа смесь выливают в 500 мл воды и экстрагируют этилацетатом. Органический слой промывают холодным насыщенным водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и выпаривают, с получением сырого соединения в виде черной пены (19,1 г, 75%). Данные: (m/z) = 412 (M+H)+.
Метил-7-фтор-3,4-дигидро-2H-d]дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Общий способ 6: Преобразование трихлорацетилсоединения структуры 6 до сложного метилового эфира структуры 7.
Раствор метоксида натрия (7,64 г, 141,6 ммоль) в 60 мл метанола добавляют к суспензии 7-фтор-1-(трихлорацетил)-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепина (19,1 г, 46,4 ммоль) в 60 мл метанола. Полученную смесь перемешивают в течение 30 мин, при комнатной температуре, и нагревают при кипении с обратным холодильником в течение 1 часа. После охлаждения до комнатной температуры смесь выливают в 700 мл воды со льдом и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (Na2SO4) и выпаривают, с получением указанного в заголовке соединения в виде черной пены (13,9 г, 92%). Данные: (m/z) = 326 (M+H)+.
Метил-цис-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Общий способ 7: Восстановление ненасыщенного карбоксилата структуры 7 до насыщенного карбоксилата структуры 8.
Комплекс BH3-ТГФ (1 M, 40 мл, 40,0 ммоль) добавляют в течение 45 минут к раствору метил-7-фтор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилата (14,0 г, 42,8 ммоль) в 84 мл ТГФ, в атмосфере N2 (T<5°C). Полученную смесь перемешивают в течение 105 минут при 20°C. После охлаждения до 0°C, через 2 часа, добавляют 20 мл уксусной кислоты. Реакционную смесь выливают в 500 мл воды со льдом, экстрагируют CH2Cl2, промывают водой, сушат (Na2SO4) и выпаривают. Сырой продукт подвергают хроматографии на силикагеле. Элюирование с помощью гептана/этилацетата, 7:3, дает указанное в заголовке соединение в виде светло-коричневой пены (10,0 г, 71%). Данные: (m/z) = 328 (M+H)+.
Метил-транс-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Общий способ 8: Эпимеризация цис-карбоксилата структуры 8 до транс-карбоксилата структуры 9.
Метоксид натрия (1,00 г, 1,85 моль) добавляют к суспензии метил-цис-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилата (10,0 г, 30,6 ммоль) в 100 мл метанола, в атмосфере N2. Полученную смесь в течение 4,5 часов нагревают при кипении с обратным холодильником. После охлаждения прозрачный коричневый раствор выливают в 700 мл воды со льдом и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (Na2SO4) и выпаривают, с получением указанного в заголовке соединения (9,1 г, 91%). Данные: (m/z) = 328 (M+H)+.
транс-3-Фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
Общий способ 9: Омыление карбоксилата структуры 9 до карбоновой кислоты структуры 10.
65 мл 2 н. NaOH добавляют к раствору метил-транс-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилата (9,10 г, 27,8 ммоль) в 280 мл диоксана и 110 мл воды. Полученную смесь в течение 2 часов нагревают до 70°C. Охлажденную смесь выливают в 1,5 л воды со льдом и 100 мл 2 н. HCl и экстрагируют CH2Cl2 (3x). Органический слой промывают водой, сушат (Na2SO4) и выпаривают. Кристаллизация из CH2Cl2/простого эфира, 1:3, дает указанное в заголовке соединение (5,3 г, 61%). Данные: (m/z) = 314 (M+H)+.
транс-7-Фтор-2,3,4,14b-тетрагидро-1H-d]-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 11 схемы 1, где R1 = H, R2 = H, R3 = F, R4 = H, R5 = H, R6 = H, R7 = H, X = O)
Общий способ 10: Аминирование карбоновой кислоты структуры 10 до амина структуры 11.
2,60 мл триэтиламина добавляют в течение 5 минут при 0°C, в атмосфере N2, к суспензии транс-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновой кислоты (4,0 г, 12,8 ммоль) в 30 мл ацетона и 1 мл воды. Дополнительно добавляют 1,80 мл этилхлорформиата и смесь перемешивают при 0°C в течение 30 мин. Добавляют к полученной эмульсии азид натрия (1,65 г, 26,3 ммоль) в 8 мл воды и продолжают перемешивание в течение 2,5 часа при 0°C. Смесь выливают в 500 мл воды и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (Na2SO4) и выпаривают с получением сырого соединения. Этот сырой продукт растворяют в 90 мл 1,2-дихлорпропана и нагревают до 100°C, в течение 4 часов. Затем смесь выпаривают при пониженном давлении. Остаток растворяют в 45 мл метоксиэтанола. Добавляют раствор гидроксида натрия (2,72 г, 84,7 ммоль) в 6 мл воды. Полученную смесь нагревают до 120°C в течение 2,5 часа, после чего ее охлаждают и выливают в 400 мл воды со льдом. Водный слой экстрагируют CH2Cl2 и органический слой промывают водой, сушат (Na2SO4), выпаривают и подвергают хроматографии на окиси алюминия. Элюирование с помощью толуола/этилацетата, 3:7, дает указанное в заголовке соединение в виде коричневого масла (1,45 г, 34%). Данные: (m/z) = 285 (M+H)+.
Пример 2
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R6 = H, R7 = H, X = S)
5-Хлор-2-(фенилтио)анилин
Это соединение получают с помощью общего способа 1 при комнатной температуре, с получением 5-хлор-2-(фенилтио)анилина (6,8 г, 77%). Данные: (m/z) = 236 (M+H)+.
5-Хлор-N-[5-хлор-2-(фенилтио)фенил]пентанамид
Это соединение получают с помощью общего способа 2, с получением 5-хлор-N-[5-хлор-2-(фенилтио)фенил]пентанамида (11,0 г, 100%). Данные: (m/z) = 354 (M+H)+.
8-Хлор-11-(4-хлорбутил)дибензо[b,f][1,4]тиазепин
Это соединение получают с помощью общего способа 3, с получением 8-хлор-11-(4-хлорбутил)дибензо[b,f][1,4]тиазепина в виде черной смолы (4,0 г, 45%). Данные: (m/z) = 338 (M+H)+.
7-Хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин
Это соединение получают с помощью общего способа 4, с последующей хроматографией на силикагеле. Элюирование толуолом дает 7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин в виде красно-коричневого масла (1,2 г, 47%). Данные: (m/z) = 300 (M+H)+.
7-Хлор-1-(трихлорацетил)-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин
Это соединение получают с помощью общего способа 5, с получением 7-хлор-1-(трихлорацетил)-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепина в виде черной смолы (1,6 г, 93%). Данные: (m/z) = 446 (M+H)+.
Метил-7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилат
Это соединение получают с помощью общего способа 6, с получением метил-7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилата в виде черной пены (1,2 г, 94%).
Метил-цис-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилат
Это соединение получают с помощью общего способа 7, с получением метил-цис-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилата в виде коричневой пены (1,0 г, 100%). Данные: (m/z) = 360 (M+H)+.
Метил-транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилат
Это соединение получают с помощью общего способа 8, с получением метил-транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоксилата (0,77 г, 73%). Данные: (m/z) = 360 (M+H)+.
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоновая кислота
Это соединение получают с помощью общего способа 9, с получением транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-карбоновой кислоты (0,24 г, 32%). Данные: (m/z) = 346 (M+H)+.
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R6 = H, R7 = H, X = S)
Это соединение получают с помощью общего способа 10, с получением транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]тиазепин-1-амина в виде коричневого твердого продукта (165 мг, 75%). Данные: (m/z) = 317 (M+H)+.
Пример 3
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, X = O)
5-Хлор-N-(5-хлор-2-феноксифенил)пентанамид
Это соединение получают с помощью общего способа 2, с получением 5-хлор-N-(5-хлор-2-феноксифенил)пентанамида в виде коричневого масла (24,1 г, 100 %). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,83 (м, 4H), 2,40 (т, J=7,0, 2H), 3,54 (т, J=7,0, 2H), 6,76 (д, J=8,0, 1H), 6,97 (дд, J=8,0, 2,0, 1H), 6,99 (с, 1H), 7,02 (с, 1H), 7,17 (т, J=8,0, 1H), 7,37 (д, J=8,0, 1H), 7,39 (д, J=8,0, 1H), 7,72 (ушир., 1H), 8,54 (д, J=2,0, 1H). (m/z) = 338 (M+H)+.
8-Хлор-11-(4-хлорбутил)дибензо[b,f][1,4]оксазепин
Это соединение получают с помощью общего способа 3, с получением 8-хлор-11-(4-хлорбутил)дибензо[b,f][1,4]оксазепина в виде густого коричнево-зеленоватого масла (21,6 г, 94%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,90 (м, 4H), 2,96 (т, J=8,0, 2H), 3,58 (т, J=8,0, 2H), 7,04-7,48 (7 аром.H). (m/z) = 320 (M+H)+.
7-Хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин
Это соединение получают с помощью общего способа 4, с последующей хроматографией на окиси алюминия. Элюирование толуолом дает 7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин в виде темно-коричневого масла (3,92 г, 83%). Данные: 1H-ЯМР (400 МГц, CDCl3) 2,06 (дт, J=16,0, 8,0, 2H), 2,32 (м, 2H), 3,69 (т, J=8,0, 2H), 4,87 (т, J=4,0, 1H), 6,73 (дд, J=8,0, 3,0, 1H), 6,90 (д, J=3,0, 1H), 7,02 (д, J=8,0, 1H), 7,09 (м, 2H), 7,22 (м, 1H), 7,36 (дд, J=8,0, 2,0, 1H). (m/z) = 284 (M+H)+.
7-Хлор-1-(трихлорацетил)-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин
Это соединение получают с помощью общего способа 5, с получением 7-хлор-1-(трихлорацетил)-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепина в виде черной смолы (5,70 г, >100% сырого). Данные: 1H-ЯМР (400 МГц, CDCl3) 2,19 (дт, J=16,0, 8,0, 2H), 2,95 (м, 2H), 3,90 (м, 2H), 6,96 (дд, J=8,0, 3,0, 1H), 7,04-7,37 (7 аром.H). (m/z) = 430 (M+H)+.
Метил-7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Это соединение получают с помощью общего способа 6, с последующей хроматографией на силикагеле. Элюирование толуолом/этилацетатом, 9:1, дает метил-7-хлор-3,4-дигидро-2H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат (2,75 г, 65%). Данные:1H-ЯМР (400 МГц, CDCl3) 2,11 (дт, J=16,0, 8,0, 2H), 2,65 (м, 2H), 3,38 (с, 3H), 3,82 (м, 2H), 6,88 (дд, J=8,0, 3,0, 1H), 7,06 (м, 3H), 7,14 (д, J=8,0, 1H), 7,23 (дд, J=8,0, 2,0, 1H), 7,30 (дт, J=8,0, 2,0, 1H). (m/z) = 342 (M+H)+.
Метил-цис-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Это соединение получают с помощью общего способа 7, с получением метил-цис-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилата в виде желто-коричневой пены (10,2 г, 100%). Данные: 1H-ЯМР (400 МГц, CDCl3) 2,27 (м, 4H), 3,02 (дт, J=12,0, 4,0, 1H), 3,16 (м, 2H), 3,53 (с, 3H), 5,06 (ушир., 1H), 6,75 (дд, J=8,0, 3,0, 1H), 6,90 (д, J=3,0, 1H), 7,00 (д, J=8,0, 1H), 7,05 (дт, J=8,0, 2,0, 1H), 7,17 (дт, J=8,0, 2,0, 2H), 7,20 (дт, J=8,0, 2,0, 1H). (m/z) = 344 (M+H)+.
Метил-транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилат
Это соединение получают с помощью общего способа 8, с получением метил-транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоксилата (9,5 г, 93%). Данные: (m/z) = 344 (M+H)+.
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
Это соединение получают с помощью общего способа 9. Кристаллизация из CH2Cl2/простого эфира, 1:3, дает транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновую кислоту (3,89 г, 51%) Данные: (m/z) = 302 (M+H)+.
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, X = O)
Это соединение получают с помощью общего способа 10. Кристаллизация из простого эфира дает транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин в виде беловатого твердого продукта (2,97 г, 68%). Данные: (m/z) = 301 (M+H)+.
Пример 4
транс-7-Хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R6 = H, R7 = H, X = CH2)
5-Хлор-N-[5-хлор-2-(фенилметил)фенил]пентанамид
Это соединение получают с помощью общего способа 2, с получением 5-хлор-N-[5-хлор-2-(фенилметил)фенил]пентанамида в виде беловатого твердого продукта (2,90 г, 100%). Данные: (m/z) = 336 (M+H)+.
3-Хлор-6-(4-хлорбутил)-11H-дибензо[b,e]азепин
Это соединение получают с помощью общего способа 3, с получением 3-хлор-6-(4-хлорбутил)-11H-дибензо[b,e]азепина (схема I, структура 4, где R1 = R2 = R4 = R5 = H, R3 = Cl, X = CH2 и n = 4) в виде черной смолы (2,60 г, 97%). Данные: (m/z) = 318 (M+H)+.
7-Хлор-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепин
Это соединение получают с помощью общего способа 4, с последующей хроматографией на силикагеле. Элюирование толуолом дает 7-хлор-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепин в виде оранжево-коричневого масла (0,89 г, 39%). Данные: (m/z) = 282 (M+H)+.
7-Хлор-1-(трихлорацетил)-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепин
Это соединение получают с помощью общего способа 5, с получением 7-хлор-1-(трихлорацетил)-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепина в виде темно-коричневой пены (1,34 г, 99%).
Метил-7-хлор-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилат
Это соединение получают с помощью общего способа 6, с получением метил-7-хлор-2,3,4,10-тетрагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилата в виде темно-коричневой пены (1,01 г, 95%). Данные: (m/z) = 340 (M+H)+.
Метил-цис-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилат
Это соединение получают с помощью общего способа 7, с получением метил-цис-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилата в виде темно-коричневой пены (1,00 г, 98%). Данные: (m/z) = 342 (M+H)+.
Метил-транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилат
Это соединение получают с помощью общего способа 8, с получением метил-транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоксилата (0,93 г, 93%).
транс-7-Хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоновая кислота
Это соединение получают с помощью общего способа 9. Кристаллизация из CH2Cl2/простого эфира, 1:3, дает транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-карбоновую кислоту (3,89 г, 51%) Данные: (m/z) = 302 (M+H)+.
транс-7-Хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R6 = H, R7 = H, X = CH2)
Это соединение получают с помощью общего способа 10, с получением транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-амина (104 мг, 86%). Данные: (m/z) = 299 (M+H)+.
Пример 5
транс-2,2,2-Трифтор-N-(7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 12 схемы II, где R1 = H, R2 = H, R3 = F, R4 = H, R5 = H, R15 = CF3, X = O)
Общий способ 11: N-ацилирование амина структуры 11 до трифторамида структуры 12.
Трифторуксусный ангидрид (1 мл) добавляют к транс-7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (0,6 г, 2,1 ммоль) в 5 мл CH2Cl2 и 2 мл пиридина. Полученную суспензию перемешивают в течение 18 часов при комнатной температуре. Коричневый раствор выливают в 100 мл воды со льдом и экстрагируют CH2Cl2. Органический слой промывают водой, сушат (Na2SO4) и выпаривают. К полученному твердому продукту добавляют простой диэтиловый эфир и нагревают при кипении с обратным холодильником в течение 30 минут. Остаток растворяют в CH2Cl2 и нагревают при кипении с обратным холодильником в течение 30 минут. Осадок отфильтровывают, промывают CH2Cl2 и сушат, с получением транс-2,2,2-трифтор-N-(7-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамида в виде беловатого твердого продукта (0,2 г, 25,6%). Данные: (m/z) = 381 (M+H)+.
Пример 6
транс-2,2,2-Трифтор-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-ил)ацетамид
(Структура 13 схемы II, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R15 = CF3, X = S)
Это соединение получают с помощью общего способа 11, с последующей хроматографией на силикагеле. Элюирование толуолом → толуолом/этилацетатом, 95:5, с последующей кристаллизацией из простого эфира, которая дает транс-2,2,2-трифтор-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-ил)ацетамид в виде беловатого твердого продукта (3,0 мг, 12%). Данные: (m/z) = 413 (M+H)+.
Пример 7
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 12 схемы II, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R15 = CF3, X = O)
Последовательно добавляют этилтрифторацетат (1,41 мл, 11,8 ммоль) и триэтиламин (628 мкл, 4,5 ммоль) к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (291 мг, 0,97 ммоль) в 11,8 мл метанола. Полученную смесь нагревают до 50°C в течение 18 час. Образуется осадок. Смесь выпаривают при пониженном давлении, для удаления летучих реагентов, и добавляют 5 мл метанола. После 30 минут перемешивания осадок отфильтровывают, промывают простым диэтиловым эфиром и сушат, с получением транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида в виде беловатого твердого продукта (330 мг, 86%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,85 (м, 2H), 2,26 (м, 1H), 3,12 (м, 1H), 3,20 (м, 1H), 3,62 (дт, J=12,0, 4,0, 1H), 4,38 (д, J=8,0, 1H), 4,68 (м, 1H), 6,76 (дд, J=8,0, 3,0, 1H), 6,93 (д, J=3,0, 1H), 7,04 (д, J=8,0, 1H), 7,08 (дт, J=8,0, 2,0, 1H), 7,17 (дд, J=8,0, 2,0, 2H), 7,29 (дт, J=8,0, 2,0, 1H). (m/z) = 397 (M+H)+.
Пример 8
транс-N-(7-Хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]-пиридо[1,2-a]азепин-1-ил)-2,2,2-трифторацетамид
(Структура 12 схемы II, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R15 = CF3, X = CH2)
Это соединение получают с помощью общего способа 11, с последующей хроматографией на силикагеле. Элюирование толуолом → толуолом/этилацетатом, 95:5, дает транс-N-(7-хлор-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-ил)-2,2,2-трифторацетамид (34,0 мг, 12%). Данные: (m/z) = 395 (M+H)+.
Пример 9
транс-N-(1,2,3,4,10,14b-Гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-ил)-2,2,2-трифторацетамид
(Структура 12 схемы II, где R1 = H, R2 = H, R3 = H, R4 = H, R5 = H, R15 = CF3, X = CH2)
Это соединение получают с помощью общего способа 11, исходя из транс-1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-аминмалеата, с последующей хроматографией на силикагеле. Элюирование толуолом → толуолом/этилацетатом, 9:1, дает транс-N-(1,2,3,4,10,14b-гексагидродибензо[c,f]пиридо[1,2-a]азепин-1-ил)-2,2,2-трифторацетамид (3,6 мг, 76%). Данные: (m/z) = 359 (M+H)+.
Пример 10
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = CH3, X = O)
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-аминмалеат (10 мг, 0,02 ммоль), 50 мкл пиридина и 25 мкл уксусного ангидрида в 1 мл CH2Cl2 перемешивают в течение 18 часов при комнатной температуре. Смесь промывают 5% водным раствором бикарбоната натрия и H2O, сушат (Na2SO4) и выпаривают, с получением транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамида (9,0 мг, 65%). Данные: (m/z) = 343 (M+H)+.
Пример 11
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2-фторацетамид
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = CH2F, X = O)
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин (10 мг, 0,03 ммоль) растворяют в 1 мл этилфторацетата. Полученную смесь нагревают при кипении с обратным холодильником в течение 2 часов. Выпаривание с последующей кристаллизацией из метанола дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2-фторацетамид (4,7 мг, 39 %). Данные: (m/z) = 361 (M+H)+.
Пример 12
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-4-фенилбензамид
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = C6H4C6H5, X = O)
Общий способ 12: N-ацилирование амина структуры 11 до амида структуры 12.
DIPEA (18,6 мкл, 0,14 ммоль) и 4-фенилбензоилхлорид (15,2 мг, 0,07 ммоль) добавляют к раствору транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-аминмалеата (9,6 мг, 0,02 ммоль) в 1 мл CH2Cl2. Полученную смесь перемешивают в течение 18 часов при комнатной температуре. Органический слой промывают 5% водным раствором бикарбоната натрия и H2O, сушат (Na2SO4) и выпаривают. Дополнительная хроматография на силикагеле (элюирование толуолом/этилацетатом, 9:1 → толуолом/этилацетатом, 1:1) дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-4-фенилбензамид (4,6 мг, 44%). Данные: (m/z) = 350 (M+H)+.
Следующие амиды, перечисленные в таблице 1, получают в основном с помощью общего способа 12, с использованием соответствующих исходных материалов. Для примера 15 вместо DIPEA используется триэтиламин и соединение кристаллизуют из простого диэтилового эфира.
Пример 16
транс-2-Амино-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = CH2NH2, X = O)
Сложный 1,1-диметилэтиловый эфир [[[(транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)амино]карбонил]метил]карбаминовой кислоты
Общий способ 13: N-ацилирование амина структуры 11 до амида структуры 12.
DIPEA добавляют (pH=9) к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (10 мг, 0,03 ммоль) в 1 мл CH2Cl2 с HATU (12,5 мг, 0,03 ммоль) и Boc-Gly-OH (10,3 мг, 0,03 ммоль). Полученную смесь перемешивают в течение 3 часов, промывают 5% водным раствором бикарбоната натрия и H2O, сушат (Na2SO4) и выпаривают, с получением сложного 1,1-диметилэтилового эфира [[[(транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)амино]карбонил]метил]карбаминовой кислоты (14,3 мг, 100%). Данные: (m/z) = 405 (M+H)+.
транс-2-Амино-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = CH2NH2, X = O)
Сложный 1,1-диметилэтиловыйэфир [[[(транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)амино]карбонил]метил]карбаминовой кислоты (10 мг, 0,02 ммоль) в 2 мл этилацетата продувают газообразным HCl при 0°C в течение 2 часов. Смесь выпаривают при пониженном давлении, с получением транс-2-амино-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамида (9,2 мг, 100%). Данные: (m/z) = 358 (M+H)+.
Пример 17
транс-4-[(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)амино]-2,2,3,3-тетрафтор-4-оксобутановая кислота
(Структура 12 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = CF2CF2C(O)OH, X = O)
Тетрафторянтарный ангидрид (5,35 мкл, 0,05 ммоль) добавляют к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (10 мг, 0,03 ммоль) в 1 мл диоксана. Полученную смесь перемешивают при комнатной температуре в течение 30 минут. Диоксан удаляют путем выпаривания при пониженном давлении и добавляют этилацетат и 2% лимонную кислоту. Органический слой промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением транс-4-[(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)амино]-2,2,3,3-тетрафтор-4-оксобутановой кислоты (10,6 мг, 51%). Данные: (m/z) = 472 (M+H)+.
Пример 18
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)метантиоамид
(Структура 13 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = H, X = O)
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)формамид
транс-7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин (10 мг, 0,03 ммоль) растворяют в 1 мл этилформиата. Полученную смесь нагревают при кипении с обратным холодильником в течение 18 час. Охлажденную смесь выпаривают, с получением транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)формамида (12,0 мг, 100 %). Данные: (m/z) = 329 (M+H)+.
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)метантиоамид
(Структура 13 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R15 = H, X = O)
Общий способ 14: Сульфонилирование амида структуры 12 до тиоамида структуры 13.
Пентасульфид фосфора (5 мг, 0,01 ммоль) добавляют к транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)формамиду (5 мг, 0,015 ммоль) в диоксане. Полученную смесь нагревают при кипении с обратным холодильником в течение 3 часов. После выпаривания при пониженном давлении сыроесоединение подвергают хроматографии на силикагеле. Элюирование толуолом/этилацетатом, 85:15, дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)метантиоамид (2,8 мг, 51%). Данные: (m/z) = 345 (M+H)+.
Следующие тиоамиды, перечисленные в таблице 2, получают в целом с помощью общего способа 14, с использованием соответствующих исходных материалов. Они указаны как примеры 19-27.
Пример 28
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифтор-N-метилацетамид
(Структура 14 схемы II, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R7 = CH3, R15 = CF3, X = O)
Гидрид натрия (1,6 мг, 60% в масле) добавляют к транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d]-[1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (15 мг, 0,04 ммоль) в 1 мл ДМФА. После 10 минут перемешивания, добавляют метилйодид (2,47 мкл, 0,04 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 18 часов. После выпаривания сырое соединение очищают с помощью хроматографии на силикагеле. Элюирование толуолом/этилацетатом, 7:3, дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифтор-N-метилацетамид (14 мг, 90%). Данные: (m/z) = 411 (M+H)+.
Пример 29
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетимидамид
(Структура 15 схемы II, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R15 = CF3, X = O)
Трифторацетонитрил в течение 2 часов добавляют к раствору транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (10 мг, 0,03 ммоль) в 2 мл ТГФ. Смесь перемешивают при комнатной температуре в течение 16 часов. После выпаривания сыроесоединение подвергают хроматографии на силикагеле. Элюирование толуолом дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетимидамид (7,14 мг, 55%). Данные: (m/z) = 396 (M+H)+.
Пример 30
Сложный хлорметиловый эфир транс-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 16 схемы III, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R16 = CH2Cl, X = O)
Общий способ 15: N-ацилирование амина структуры 11 до карбамата структуры 16.
100 мкл насыщенного водного раствора бикарбоната натрия добавляют к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-амину (9,5 мг, 0,03 ммоль) и хлорметилхлорформиату (64,2 мкл, 0,42 ммоль) в 250 мкл CH2Cl2. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. После этого добавляют этилацетат и органический слой промывают водой, сушат (Na2SO4) и выпаривают с получением сложногохлорметиловогоэфира транс-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (9,9 мг, 88%). Данные: (m/z) = 393 (M+H)+.
Пример 31
Сложный 2-бромэтиловый эфир транс-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 16 схемы III, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R16 = CH2CH2Br, X = O)
Это соединение получают с помощью общего способа 15, с получением сложного 2-бромэтилового эфира транс-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (выход 80%). Данные: (m/z) = 452 (M+H)+.
Пример 32
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-N'-(2-метилпропил)тиомочевина
(Структура 17 схемы III, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R17 = CH2CH(Me)2, X = O)
Общий способ 16: Изобутилизотиоцианат (3,35 мг, 0,03 ммоль) добавляют к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (5 мг, 0,02 ммоль) в 1 мл ТГФ. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Смесь выпаривают при пониженном давлении. Кристаллизация из метанола дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-N'-(2-метилпропил)тиомочевину (1 мг, 12%). Данные: (m/z) = 416 (M+H)+.
Следующие тиомочевины, перечисленные в таблице 3, получают в целом с помощью общего способа 16, с использованием соответствующих исходных материалов. Они указаны как примеры 33-35.
(%)
Пример 36
транс-N-(2-Метилпропил)-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 18 схемы III, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R18 = CH(CH3)2, X = O)
Общий способ 17: N-алкилирование амина структуры 11 до N-акила структуры 18.
После 10 мин перемешивания триацетоксиборгидрид натрия (11 мг, 0,05 ммоль) добавляют к транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амину (10 мг, 0,03 ммоль) и изобутировому альдегиду (3,45 мг, 0,03 ммоль) в 1 мл CH2Cl2 (pH=4). Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Смесь выпаривают и подвергают хроматографии на силикагеле. Элюирование CH2Cl2/метанолом, 8:2, дает транс-N-(2-метилпропил)-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин (13 мг, 100%). Данные: (m/z) = 357 (M+H)+.
Пример 37
транс-N-Пропил-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 18 схемы III, где R1 = R2 = H, R3 = Cl, R4 = R5 = H, R18 = CH2CH3, X = O)
Это соединение получают с помощью общего способа 17, с получением транс-N-пропил-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (10 мг, 97%). Данные: (m/z) = 343 (M+H)+.
Примеры 38A и B
транс-N-(7,8-Дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (Пример 38A)
(Структура 19A схемы IV, где R1 = H, R4 = R5 = H, R15 = CF3, X = O)
транс-N-(6,7-Дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (Пример 38B)
(Структура 19B схемы IV, где R1 = R2 = H, R5 = H, R15 = CF3, X = O)
N-хлорсукцинимид (6,87 мг, 0,05 ммоль) и 0,5 мкл 1 н. HCl добавляют к транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (20 мг, 0,05 ммоль) в 102 мкл ацетона. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Никакой реакции не наблюдают. Реакцию повторяют при таких же условиях. Полученную смесь перемешивают при комнатной температуре в течение 1,5 часов. Органический слой промывают насыщенным водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и выпаривают и сырое соединение очищают с помощью препаративной ВЭЖХ, с получением транс-N-(6,7-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (3,6 мг, 17%) и транс-N-(7,8-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (1,6 мг, 7%). Данные: (m/z) = 431 (M+H)+.
Пример 39
транс-N-(8-Бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 20 схемы IV, где R1 = H, R4 = H, R5 = H, R15 = CF3, X = O)
N-бромсукцинимид (9,2 мг, 0,05 ммоль) и 0,5 мкл 1 н. HCl добавляют к транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (20 мг, 0,05 ммоль) в 512 мкл ацетона. Полученную смесь перемешивают при комнатной температуре в течение 30 мин. Смесь разбавляют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия и водой, сушат (Na2SO4) и выпаривают, с получением транс-N-(8-бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида в виде белого твердого продукта (31 мг, 100%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,85 (м, 4H), 2,27 (м, 2H), 3,20 (м, 1H), 3,64 (м, 1H), 4,44 (д, J=8,0, 1H), 4,65 (м, 1H), 6,26 (ушир., 1H), 7,02 (с, 1H), 7,10 (дт, J=8,0, 2,0, 1H), 7,16 (м, 2H), 7,30 (дт, J=8,0, 3,0, 1H), 7,35 (с, 1H). (m/z) = 477 (M+H)+.
Пример 40
транс-N-(2,3,4,14b-Тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 21 схемы IV, где R1 = R2 = R4 = R5 = H, R15 = CF3, X = O)
10 мг Pd/C 10% добавляют к раствору транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (100 мг, 0,25 ммоль) в 5 мл ДМФА. Суспензию встряхивают в атмосфере H2 в течение 2 дней. Смесь фильтруют, выливают в воду и экстрагируют простым диэтиловым эфиром. Органический слой промывают водой, сушат (Na2SO4) и выпаривают, с получением транс-N-(2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (89 мг, 98%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,85 (м, 3H), 2,99 (м, 1H), 3,18 (м, 1H), 3,75 (м, 1H), 4,50 (д, J=8, 1H), 4,72 (м, 1H), 6,62 (ушир., 1H), 6,84-7,30 (8 аром.H). (m/z) = 362 (M+H)+.
Пример 41
транс-N-(7-Хлор-8-нитро-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 22 схемы IV, где R1 = H, R4 = H, R5 = H, R15 = CF3, X = O)
Азотную кислоту (50 мкл, 1,10 ммоль) добавляют при 0°C к суспензии транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (210 мг, 0,53 ммоль) в 4 мл CH2Cl2. После перемешивания смесь экстрагируют этилацетатом и органический слой промывают 5% водным раствором бикарбоната натрия, сушат (Na2SO4) и выпаривают, с получением транс-N-(7-хлор-8-нитро-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (219 мг, 90%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,64-1,94 (м, 3H), 2,05 (ушир., 1H), 3,26 (т, J=8,0, 1H), 4,20 (д, J=8,0, 1H), 4,35 (д, J=8,0, 1H), 4,60 (дкв., J=8,0, 3,0, 1H), 7,15 (м, 1H), 7,11-9,21 (6 аром.H). (m/z) = 443 (M+H)+.
Примеры 42A и B
транс-N-(6-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (Пример 42A)
(Структура 23A схемы V, где R1 = H, R4 = R5 = H, R15 = CF3, X = O)
транс-N-(8-Хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (Пример 42B)
(Структура 23B схемы V, где R1 = R2 = R5 = H, R15 = CF3, X = O)
N-хлорсукцинимид (8,52 мг, 0,06 ммоль) и 0,67 мкл 1н HCl добавляют к транс-N-(2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (21 мг, 0,06 ммоль) в 1 мл ацетона. Полученную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором бикарбоната натрия и выпаривают. Сырое соединение подвергают хроматографии на силикагеле. Элюирование с помощью гептана/этилацетата, 8:2, дает два соединения, одно из которых представляет собой транс-N-(6-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (9,8 мг, 41%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,84 (м, 3H), 2,22 (м, 1H), 3,17 (м, 1H), 3,52 (м, 1H), 4,44 (д, J=8,0, 1H), 4,69 (м, 1H), 6,48 (ушир., 1H), 6,90 (д, J=8,0, 1H), 6,97 (дд, J=8,0, 3,0, 1H), 7,10 (дт, J=8,0, 2,0, 1H), 7,13 (д, J=3,0, 1H), 7,19 (д, J=8,0, 2H), 7,29 (дт, J=8,0, 2,0, 1H). (m/z) = 397 (M+H)+.
8-Хлорзамещенное соединение, содержащее 6,8-дихлорзамещенное соединение, очищают с помощью препаративной ВЭЖХ, с получением транс-N-(8-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (1,2 мг, 5%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,84 (м, 3H), 2,00 (м, 1H), 2,93 (дд, J=8,0, 3,0, 1H), 3,28 (дт, J=8,0, 3,0, 1H), 4,39 (с, 1H), 4,89 (м, 1H), 7,07-7,33 (7 аром.H), 8,07 (ушир., 1H). (m/z) = 397 (M+H)+.
Пример 43
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-8-[бис(фенилсульфонил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 25 схемы VI, где R1 = H, R4 = H, R5 = H, R11 = R12 = S(O)2Ph, R15 = CF3, X = O)
транс-N-(8-Амино-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
80 мкл 36% HCl и SnCl2·2H2O (600 мг, 2,66 ммоль) добавляют к транс-N-(7-хлор-8-нитро-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (215 мг, 0,49 ммоль) в 10 мл этанола. Полученную смесь перемешивают при 60°C в течение 18 час. После охлаждения смесь выпаривают и растворяют в этилацетате. Водный раствор бикарбоната натрия добавляют к раствору (образуются соли Sn), а затем декалит и смесь фильтруют. Фильтрат экстрагируют этилацетатом и органический слой промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением указанного в заголовке соединения (194 мг, 82%). Данные: (m/z) = 413 (M+H)+.
транс-2,2,2-Трифтор-N-(7-хлор-2,3,4,14b-тетрагидро-8-[бис(фенилсульфонил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 25 схемы VI, где R1 = H, R4 = H, R5 = H, R11 = R12 = S(O)2Ph, R15 = CF3, X = O)
Общий способ 18: N-ацилирование амина структуры 25 до амида структуры 26.
Бензолсульфонилхлорид (5 мкл, 0,04 ммоль) добавляют в атмосфере N2 к транс-N-(8-амино-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (5,0 мг, 0,01 ммоль) в смеси 1 мл CH2Cl2 и 25 мкл триэтиламина. Полученную смесь перемешивают при 40°C в течение 4 часов. После охлаждения смесь выпаривают и сырое соединение очищают путем хроматографии на силикагеле. Элюирование толуолом/этилацетатом, 1:0 → 0:1 (градиент), дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-8-[бис(фенилсульфонил)-амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (7,3 мг, 83%). Данные: (m/z) = 692 (M+H)+.
Пример 44
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-8-[бис(метилсульфонил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 25 схемы VI, где R1 = H, R4 = H, R5 = H, R11 = R12 = S(O)2CH3, R15 = CF3, X = O)
Это соединение получают с помощью общего способа 18, с использованием соответствующего исходного материала, с получением транс-N-(7-хлор-2,3,4,14b-тетрагидро-8-[бис(метилсульфонил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (6,8 мг, 92%). Данные: (m/z) = 568 (M+H)+.
Пример 45
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-8-[(фенилсульфонил)-амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 25 схемы VI, где R1 = H, R4 = H, R5 = H, R11 = H, R12 = S(O)2Ph, R15 = CF3, X = O)
Бензолсульфонилхлорид (10 мкл, 0,08 ммоль) добавляют в атмосфере N2 к транс-N-(8-амино-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (5,0 мг, 0,01 ммоль) в 1 мл CH2Cl2 и 2 мкл (1,1 экв.) триэтиламина. Полученную смесь перемешивают при 35°C в течение 4 часов. После охлаждения смесь выпаривают и сырое соединение очищают путем хроматографии на силикагеле. Элюирование толуолом/этилацетатом, 1:0 → 0:1 (градиент), дает транс-N-(7-хлор-2,3,4,14b-тетрагидро-8-[(фенилсульфонил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (2,4 мг, 32%). Данные: (m/z) = 552 (M+H)+.
Пример 46
Сложный1,1-диметилэтиловый эфир транс-N-(7-хлор-2,3,4,14b-тетрагидро-1-(2,2,2-трифторацетиламино)-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-8-ил)карбаминовой кислоты
(Структура 25 схемы VI, где R1 = H, R4 = H, R5 = H, R11 = H, R12 = C(O)OC(CH3)3, R15 = CF3, X = O)
Ди-трет-бутилдикарбонат (20,55 мг, 0,09 ммоль) добавляют при 5°C, в атмосфере N2, к транс-N-(8-амино-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамиду (10,8 мг, 0,03 ммоль) в 1 мл ТГФ и 6 мкл (1,1 экв.) триэтиламина. Полученную смесь перемешивают при 50°C в течение 72 часов. После охлаждения смесь выпаривают и подвергают хроматографии на силикагеле. Элюирование с помощью гептана/этилацетата, 1:0 → 0:1 (градиент), дает указанное в заголовке соединение (2,7 мг, 15%). Данные: (m/z) = 512 (M+H)+.
Пример 47
транс-N-(6,7-Дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 19B схемы IV, где X = O, R1 = H, R2 = H, R5 = H, R15 = CH3).
К раствору транс-N-(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамида (структура 12 схемы II, где R1 = H, R2 = H, R3 = Cl, R4 = R5 = H, R15 = CH3, X = O) (0,63 г, 1,84 ммоль) в ацетоне (15 мл) добавляют N-хлорсукцинимид (246 мг, 1,84 ммоль) и 6 н. (водн. раствор) HCl (3,1 мл). Полученную суспензию перемешивают при комнатной температуре в течение 20 часов. Добавляют вторую часть N-хлорсукцинимида (246 мг, 1,84 ммоль), а затем реакционную смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь экстрагируют этилацетатом (3x), промывают насыщенным (водн. раствором) NaHCO3 (3x), 10% (водн. раствором) NaCl (2x) и сушат (Na2SO4). Растворители удаляют при пониженном давлении. Твердый продукт очищают с помощью колоночной хроматографии (силикагель, толуол/этанол = 9/1). Последующая очистка с помощью ВЭЖХ дает указанное в заголовке соединение (137 мг, 36,4%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,55 (м, 1H), 1,82 (м, 2H), 1,94-2,20 (м, 1H), 2,10 (с, 3H), 2,92 (м, 1H), 3,11 (тд, J=12,6, 4,2, 1H), 4,39 (д, J=1,9, 1H), 4,86 (м, 1H), 7,02-7,36 (м, 6 аром.H).
Пример 48
транс-7-Хлор-2,3,4,14b-тетрагидро-N-(2-метоксиэтил)-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 26 схемы III, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H)
К раствору транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (84 мг, 0,28 ммоль) в ДМФА (400 мкл) добавляют 2-метоксиэтилбромид (37 мкл, 0,39 ммоль) и триэтиламин (47 мкл, 0,36 ммоль). Полученную реакционную смесь перемешивают при 60°C в течение 18 часов. После охлаждения добавляют этилацетат. Смесь промывают насыщенным (водн. раствором) NaHCO3 и водой. Органический слой сушат и выпаривают. Сырое соединение очищают с помощью ВЭЖХ и сушат вымораживанием (лиофилизируют), с получением указанного в заголовке соединения (32 мг, 32 %). Данные (m/z) = 359 (M+H)+.
Пример 49
1,1-Диметилэтил-транс-2-[(7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-ил)амино]ацетат
(Структура 27 схемы III, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H).
К раствору соли HBr и транс-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]тиазепин-1-амина (200 мг, 0,5 ммоль) в ДМФА (10 мл) добавляют DIPEA (219 мкл, 1,3 ммоль) и трет-бутилбромацетат (89 мкл, 0,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5,5 часов. После выливания реакционной смеси в воду ее экстрагируют этилацетатом (3x). Объединенные органические слои промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. Сырой продукт очищают на силикагеле гептаном/этилацетатом, 8:2, с получением чистого продукта (90 мг, 41%). Данные: (m/z) = 431 (M+H)+.
Пример 50
транс-N-(6,7-Дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)формамид
(Структура 29 схемы VII)
транс-6,7-Дихлор-2,3,4,14b-тетрагидро-N-(2-метоксиэтил)-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 28 схемы VII)
K2CO3 (537 мг, 3,9 ммоль) добавляют к раствору транс-N-(6,7-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (322 мг, 0,75 ммоль) в метаноле (28 мл) и воде (1,7 мл). Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 2 часов, после чего метанол удаляют при пониженном давлении. Воду добавляют к оставшемуся продукту и водный слой экстрагируют CH2Cl2 (3x). Объединенные органические слои промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением сырого указанного в заголовке соединения (266 мг, 100%).
транс-N-(6,7-Дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)формамид
(Структура 29 схемы VII)
Раствор транс-6,7-дихлор-2,3,4,14b-тетрагидро-N-(2-метоксиэтил)-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (122 мг, 0,36 ммоль) в этилформиате перемешивают в течение ночи при температуре кипения с обратным холодильником. После удаления растворителя при пониженном давлении оставшийся продукт очищают с помощью препаративной ЖХ-МС, с получением указанного в заголовке соединения (40 мг, 30%). Данные (m/z) = 397 (M+H)+.
Пример 51
транс-N-(6-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 36 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H)
2-[(2,6-Дибромфенил)иминометил]фенол
(Структура 30 схемы VIII, где R2 = H)
Общий способ 19: Образование имина структуры 30 из амина и альдегида.
Раствор 2,6-диброманилина (9 г, 35,9 ммоль), салицилальдегида (2,79 мл, 35,9 ммоль) и п-толуолсульфоновой кислоты (20 мг, 0,1 ммоль) в толуоле (180 мл) нагревают при кипении с обратным холодильником в аппарате Дина-Старка в течение 2 часов. После добавления некоторого количества триэтиламина реакционную смесь выпаривают, с получением сырого соединения 2-[(2,6-дибромфенил)иминометил]фенола (14 г, 100%).
9-Бромдибензо[b,f][1,4]оксазепин
(Структура 31 схемы VIII, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H)
Общий способ 20: Замыкание кольца путем этерификации до структуры 31.
К раствору 2-[(2,6-дибромфенил)иминометил]фенола (14,1 г, 35,9 ммоль) в 350 мл ДМСО добавляют K2CO3 (9,9 г, 71,8 ммоль) и 18-краун-6 (95 мг, 0,36 ммоль). Полученную смесь перемешивают при 140°C в течение 1,5 часов, а затем дают возможность охладитьсядо температуры окружающей среды в течение ночи. Смесь выливают в воду со льдом и экстрагируют этилацетатом (3x). Органический раствор промывают водой и насыщенным солевым раствором, а затем сушат (MgSO4). Удаление растворителя в вакууме приводит к получению сырого 9-бромдибензо[b,f][1,4]оксазепина (9,79 г, 99%). Данные: (m/z) = 274 + 276 (M+H)+.
транс-6-Бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H)
Общий способ 21: Присоединение глутарового ангидрида к циклическому амину, приводящее к образованию тетрацикла структуры 32.
Глутаровый ангидрид (5,22 г, 45,8 ммоль) добавляют к перемешиваемому раствору 9-бромдибензо[b,f][1,4]оксазепина (9,29 г, 33,9 ммоль) в ксилоле (9 мл). Смесь нагревают до 140°C в течение 72 час. Добавляют равные части простого эфира и этилацетата, после чего продукт собирают путем фильтрования. Кристаллы сушат при 50°C при пониженном давлении, с получением указанного в заголовке соединения в виде одного изомера (5,5 г, 39%, транс). Элюент экстрагируют 2 н. NaOH (водн. раствором). С помощью добавления 3 н. HCl (водн. раствор) к водному слою pH доводят до pH 2. Водный слой экстрагируют этилацетатом, промывают насыщенным солевым раствором и сушат. После удаления этилацетата при пониженном давлении получают смесь изомеров (6,1 г, 47%). Данные: (m/z) = 388 + 390 (M+H)+.
Сложный 1-этилпропиловый эфир (транс-6-бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H, R22 = CH(C2H5)2 )
Общий способ 22: Перегруппировка Курциуса и последующее образование карбамата структуры 33.
К раствору транс-6-бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновой кислоты (5,1 г, 13,1 ммоль) в толуоле (185 мл), добавляют триэтиламин (3,3 мл, 23,6 ммоль) и DPPA (3,67 мл, 17,0 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 1 часа. После этого добавляют 3-пентанол (2,8 мл, 26,2 ммоль) и перемешивание продолжают в течение 1,5 часов при 110°C. После охлаждения реакционную смесь выливают в воду со льдом, экстрагируют этилацетатом, промывают водой и насыщенным солевым раствором, сушат (MgSO4) и выпаривают, что приводит к получению сырого указанного в заголовке соединения (7,4 г, 100%). Данные: (m/z) = 473 + 475 (M+H)+.
Сложный 1-этилпропиловый эфир (транс-6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H, и R22 = CH(C2H5)2)
Общий способ 23: Образование структуры 34 путем восстановления бораном амидной функциональной группы.
Боран (1,0 M в ТГФ, 60 мл, 60 ммоль) добавляют по каплям к перемешиваемому раствору сложного 1-этилпропилового эфира транс-(6-бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (7,4 г, 13,1 ммоль) в ТГФ (90 мл). Полученную смесь перемешивают при температуре окружающей среды в течение 1 часа. После этого по каплям добавляют хлористоводородную кислоту (1 н. водн. раствор) до тех пор, пока не прекратится выделение газа. К смеси добавляют раствор гидроксида натрия (2 н. водн. раствор) для доведения pH до 8. Полученную реакционную смесь экстрагируют этилацетатом и после этого экстракт промывают водой и насыщенным солевым раствором. После сушки (MgSO4) растворитель выпаривают при пониженном давлении, с получением сырого указанного в заголовке соединения (7 г, 100%). Данные: (m/z) = 459 + 461 (M+H)+.
транс-6-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-иламин
(Структура 35 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H)
Общий способ 24: Гидролиз амидной функциональной группы, приводящий к получению амина структуры 35.
Смесь уксусной кислоты (100 мл) и бромистого водорода(48%, 50 мл) добавляют к сложному 1-этилпропиловому эфиру транс-(6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты и перемешивают в течение 1 часа при 100°C. После охлаждения реакционную смесь выливают в холодный раствор 1 н. NaOH (водн.). Его экстрагируют этилацетатом и органический слой промывают 1 н. NaOH (водн. раствор) 4x, насыщенным NaHCO3 (водн. раствор), сушат (MgSO4) и растворитель выпаривают. Сырое соединение очищают на силикагеле толуолом/ацетоном, 9:1, с получением указанного в заголовке соединения (2,4 г, 53%). Данные: (m/z) = 345 + 347 (M+H)+.
транс-N-(6-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 36 схемы IX, где X = O, R1 = H, R2 = H, R3 = H, R4 = Br, R5 = H, R10 = H)
Общий способ 25: Присоединение трифторуксусного ангидрида к амину с получением трифторацетамида структуры 36.
К раствору транс-6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-иламина (2,4 г, 6,95 ммоль) в смеси CH2Cl2 (10 мл) и пиридина (10 мл), добавляют трифторуксусный ангидрид (5 мл, 35,4 ммоль). Полученную реакционную смесь перемешивают при температуре окружающей среды в течение 0,5 часа. После этого добавляют воду при охлаждении на ледяной бане. Смесь экстрагируют CH2Cl2 (2x). Объединенные органические слои промывают насыщенным солевым раствором, сушат (MgSO4), выпаривают и экстрагируют толуолом (2x) с получением указанного в заголовке соединения (1,54 г, 50%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,59-2,05 (м, 4H), 3,09-3,17 (м, 1H), 3,87 (д, J=14,0, 1H), 4,14 (д, J=10, 1H), 4,40-4,49 (м, 1H), 6,70-7,28 (м, 7 аром.H), 9,13 (д, J=10, 1 NH). (m/z) = 441 + 443 (M+H)+.
Пример 52
транс-N-(6-Ацетил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 37 схемы X, где R2 = H)
Общий способ 26: Преобразование бромида в ацетил структуры 37.
(1-Этоксивинил)трибутилолово (182 мкл, 0,54 ммоль) добавляют к раствору транс-N-(6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (200 мг, 0,45 ммоль) и PdCl2(PPh3)2 (6 мг, 9 мкмоль) в толуоле (12 мл), в атмосфере N2. Реакционную смесь нагревают при кипении с обратным холодильником и перемешивают в течение 3 часов. Медленно добавляют при комнатной температуре 3 н. (водн. раствор) HCl и реакционную смесь перемешивают в течение дополнительных десяти минут. Затем ее выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным NaHCO3 (водн. раствор) и насыщенным солевым раствором, сушат (MgSO4) и растворители выпаривают. Сырой продукт очищают, растворяют в ТГФ (10 мл), а затем добавляют 3 н. HCl (водн. раствор) (4 мл). Смесь перемешивают при комнатной температуре в течение 1 часа, выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным NaHCO3 и насыщенным солевым раствором, сушат и выпаривают. После очистки с помощью ВЭЖХ получают указанное в заголовке соединение (49 мг, 27%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,50 (м, 1H), 1,65-1,75 (м, 1H), 1,79-1,93 (м, 2H), 2,50 (д, J=3, 3H), 2,82 (м, 1H), 3,38 (дт, J=12,4, 1H), 4,5 (д, J=3, 1H), 4,83 (м, 1H), 7,09-7,34 (7 аром.H).
Пример 53
транс-2,3,4,14b-Тетрагидро-1-[(трифторацетил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-6-карбонитрил
(Структура 38 схемы X, где R2 = H)
Общий способ 27: Преобразование бромида в циано-производное структуры 38.
Цианид меди (I) (142 мг, 1,6 ммоль) добавляют к раствору транс-N-(6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (700 мг, 1,6 ммоль) в 1-метил-2-пирролидиноне (28 мл) и нагревают до 200°C и перемешивают в течение 24 часов при 190°C. При комнатной температуре добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют при пониженном давлении. Очистка на силикагеле гептаном/этилацетатом, 1:1, дает указанное в заголовке соединение (450 мг, 75 %). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,69-1,75 (м, 1H), 1,87-1,93 (м, 1H), 2,01-2,16 (м, 2H), 3,14-3,29 (м, 2H), 4,61 (д, J=3,2, 1H), 4,91 (м, 1H), 7,11-7,37 (7 аром.H).
Пример 54
транс-N-(6-Этенил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 39 схемы X, где R2 = H)
Общий способ 28: Преобразование бромида в винил-производное структуры 39.
К раствору транс-N-(6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (50 мг, 0,11 ммоль) в толуоле (3 мл) добавляют PdCl2(PPh3)2 и винилтрибутилолово (38 мкл, 0,13 ммоль). Полученную реакционную смесь нагревают до 110°C и перемешивают в течение 2 часов при 110°C. После охлаждения до комнатной температуры добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным солевым раствором, сушат (MgSO4), и растворитель выпаривают. После очистки с помощью ВЭЖХ получают указанное в заголовке соединение (23 мг, 52%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,60 (м, 1H), 1,78 (м, 1H), 1,83-1,96 (м, 2H), 2,93 (м, 1H), 3,43 (дт, J=12, 4, 1H), 4,35 (д, J=2,5, 1H), 4,84 (м, 1H), 5,40 (д, J=11, 1H), 5,67 (дд, J=18, 1,8, 1H), 7,07-7,31 (7 аром.H), 7,55 (NH, 1H).
Пример 55
транс-N-(2,3,4,14b-Тетрагидро-6-метокси-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 41 схемы X, где R2 = H)
Йодид меди (I) (21 мг, 0,11 ммоль) добавляют к перемешиваемому раствору транс-N-(6-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (100 мг, 0,22 ммоль) в ДМФА (1,5 мл), в аппарате Дина-Старка. После этого добавляют раствор NaOMe (1,2 мл, 1,2 ммоль) в метаноле и перемешивание продолжают при 135°C в течение 4 часов. После охлаждения реакционную смесь выливают в насыщенный (водн. раствор) NH4Cl и экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат (MgSO4) и выпаривают. После очистки на колонке SPE (с твердофазной экстракцией) и с помощью ВЭЖХ получают указанное в заголовке соединение (11 мг, 13%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,50 (м, 1H), 1,76 (м, 1H), 1,87 (м, 1H), 1,94 (м, 1H), 2,87 (м, 1H), 3,29 (дт, J=12, 3,2, 1H), 3,86 (с, 3H), 4,28 (д, J=3,2, 1H), 4,81 (м, 1H), (аром.) 6,66 (д, J=12, 1H), 6,78 (д, J=12, 1H), 7,10 (м, 1H), 7,20-7,31 (м, 4H), 8,18 (м, 1H, NH).
Пример 56
транс-N-(6-Бром-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 36 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
2-[(2,6-Дибром-4-фторфенил)иминометил]фенол
(Структура 30 схемы VIII, где R2 = F)
Это соединение получают с помощью общего способа 19, с получением сырого указанного в заголовке соединения (15,2 г, 100%). Данные: (m/z) = 372 + 374 + 376 (M+H)+.
9-Бром-7-фтордибензо[b,f][1,4]оксазепин
(Структура 31 схемы VIII, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 20. 9-Бром-7-фтордибензо[b,f][1,4]оксазепин (6,7 г, 64%) собирают путем фильтрования после выливания реакционной смеси в воду со льдом. Данные: (m/z) = 292 + 294 (M+H)+.
транс-6-Бром-8-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 21, с получением указанного в заголовке соединения в виде кристаллов только одного изомера (4,2 г, 45%). Данные: (m/z) = 406 + 408 (M+H)+.
Сложный 1-этилпропиловый эфир (транс-6-бром-8-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 22, с получением указанного в заголовке соединения (4,6 г, 100%). Данные: (m/z) = 435 + 437 (M+H)+.
Сложный 1-этилпропиловый эфир (транс-6-бром-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 23. Продукт (1,2 г, 30%) получают путем кристаллизации из диэтилового простого эфира. Данные: (m/z) = 421 + 423 (M+H)+.
транс-6-Бром-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 35 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 24, с получением чистого указанного в заголовке соединения (2,1 г, 72%) после очистки на колонке SPE. Данные: (m/z) = 363 + 365 (M+H)+.
транс-N-(6-Бром-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 36 схемы IX, где X = O, R1 = H, R2 = F, R3 = H, R4 = Br, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 25, с получением указанного в заголовке соединения. После очистки с помощью ВЭЖХ получают 79 мг (91%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,54-1,61 (м, 1H), 1,67-1,77 (м, 1H), 1,82-1,90 (м, 1H), 1,93-2,06 (м, 1H), 2,85-2,92 (дд, J=12,2, J=5,0, 1H), 3,27-3,35 (тд, J=12,0, J=3,0, 1H), 4,33-4,35 (д, J=2,2, 1H), 4,87-4,92 (м, 1H), 6,88-7,34 (6 аром.H), (ушир., 1H). (m/z) = 459 + 461 (M+H)+.
Пример 57
транс-N-(6-Ацетил-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 37 схемы X, где R2 = F)
Это соединение получают с помощью общего способа 26, с получением указанного в заголовке соединения (103 мг, 42,9%) после очистки с помощью ВЭЖХ. Данные: 1H-ЯМР (400 МГц, CDCl3) 1,46-1,69 (м, 2H), 1,76-1,93 (м, 2H), 2,58 (с, 3H), 2,76-2,82 (м, 1H), 3,34-3,43 (тд, J=12,0, 3,2, 1H), 4,44-4,47 (д, J=2,2, 1H), 4,80-4,86 (м, 1H), 6,99-7,32 (6 аром.H), 8,5-8,58 (ушир., 1H). (m/z) = 423 (M+H)+.
Пример 58
транс-8-Фтор-2,3,4,14b-тетрагидро-1-[(трифторацетил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-6-карбонитрил
(Структура 38 схемы X, где R2 = F)
Это соединение получают с помощью общего способа 27. После очистки с помощью ВЭЖХ получают указанное в заголовке соединение (78 мг, 55,7%, транс). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,65-1,72 (м, 1H), 1,85-1,92 (м, 1H), 1,95-2,02 (м, 1H), 2,05-2,14 (м, 1H), 3,06-3,11 (м, 1Н), 3,17-3,23 (тд, J=8,0, J=2,0, 1H), 4,55-4,57 (д, J=1,7, 1H), 4,90-4,94 (м, 1H), 7,06-7,36 (6 аром.H), 7,47-7,56 (ушир., 1H). (m/z) = 406 (M+H)+.
Пример 59
транс-N-(6-Этенил-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 39 схемы X, где R2 = F)
Это соединение получают с помощью общего способа 28, с получением указанного в заголовке соединения (141 мг, 53%) после очистки с помощью ВЭЖХ. Данные: 1H-ЯМР (400 МГц, CDCl3) 1,57-1,77 (м, 2H), 1,82-1,95 (м, 2H), 2,86-2,92 (м, 1H), 3,40-3,48 (тд, J=12,0, J=3,0, 1H), 4,27-4,30 (д, J=2,5, 1H), 4,82-4,87 (м, 1H), 5,43-5,47 (д, J=11,4, 1H), 5,64-5,70 (дд, J=18,0, 1,1, 1H), 6,81-7,32 (6 аром.H + 1H), 7,49-7,57 (ушир., 1H). (m/z) = 407 (M+H)+.
Пример 60
транс-2,2,2-Трифтор-N-(8-фтор-2,3,4,14b-тетрагидро-6-метил-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)ацетамид
(Структура 40 схемы X, где R2 = F)
К раствору транс-N-(6-бром-8-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (300 мг, 0,65 ммоль) в ТГФ (7 мл) добавляют ферроцен PdCl2 (10 мг, 14 мкмоль) и реакционную смесь перемешивают в течение 10 минут. Добавляют по каплям метилцинкхлорид (0,81 мл), после чего реакционную смесь нагревают до 60°C. Через 3 часа добавляют ферроцен PdCl2 (20 мг, 28 мкмоль) и метилцинкхлорид (0,3 мл) и реакционную смесь нагревают при 80°C в течение еще одного часа. Воду добавляют при комнатной температуре и реакционную смесь экстрагируют простым эфиром и водой. Растворв простом эфире промывают насыщенным солевым раствором, сушат (Na2SO4) и летучие продукты удаляют при пониженном давлении. После очистки с помощью ВЭЖХ, получают указанное в заголовке соединение (108 мг, 39%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,56-1,72 (м, 2H), 1,79-1,93 (м, 2H), 2,37 (с, 3Н), 2,79-2,86, (м, 1H), 3,44-3,52 (тд, J=12,0, J=3,0, 1H), 4,27-4,29 (д, J=2,5, 1H), 4,85-4,91 (м, 1H), 6,70-7,32 (6 аром.H), 7,63-7,70 (ушир., 1H). (m/z) = 395 (M+H)+.
Пример 61
транс-N-(7-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 46 схемы XI)
4-Бром-2-нитро-1-феноксибензол
(Структура 42 схемы XI)
Cs2CO3 (4 г, 12,3 ммоль) добавляют к раствору фенола (1 г, 10,6 ммоль) в 50 мл ТГФ, в атмосфере N2. После перемешивания в течение 15 минут добавляют 1,4-дибром-2-нитробензол (2,81 г, 10 ммоль). Полученную смесь нагревают до температуры кипения с обратным холодильником и перемешивают в течение ночи при температуре кипения с обратным холодильником. Добавляют воду и этилацетат, с последующей экстракцией этилацетатом (3x). Объединенные органические слои промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением сырого соединения (3,2 г, 75%).
5-Бром-2-феноксибензоламин
(Структура 43 схемы XI)
Порошок железа (3 г, 53,4 ммоль) и уксусную кислоту (10 мл) добавляют к перемешиваемой суспензии 4-бром-2-нитро-1-феноксибензола (3,1 г, 9,5 ммоль) в воде (25 мл) при 60°C. Реакционную смесь нагревают до 80°C и перемешивают в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь фильтруют и экстрагируют толуолом. Раствор толуола промывают водой (3x) и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением сырого соединения (2,3 г, 87%). Данные: (m/z) = 264 + 266 (M+H)+.
N-(5-Бром-2-феноксифенил)формамид
(Структура 44 схемы XI)
Общий способ 29: Присоединение муравьиной кислоты к амину с получением формамидов структуры 44.
Смесь 5-бром-2-феноксибензоламина (68,4 г, 260 ммоль) и муравьиной кислоты (180 мл) нагревают при кипении с обратным холодильником и перемешивают в течение 2 часов. Продукт собирают путем фильтрования и сушат при 50°C, при пониженном давлении, с получением соединения в виде беловатых кристаллов (60 г, 79%). Данные: (m/z) = 292 + 294 (M+H)+.
8-Бромдибензо[b,f][1,4]оксазепин
(Структура 45 схемы XI)
Общий способ 30: Замыкание кольца с помощью PPA, с получением производных структуры 45.
PPA (207,5 г) добавляют к N-(5-бром-2-феноксифенил)формамиду (20 г, 68,7 ммоль) и реакционную смесь нагревают до 140°C, с энергичным перемешиванием в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду со льдом. Смесь фильтруют и твердый продукт промывают водой и 25% аммонием и сушат при 50°C, при пониженном давлении, с получением указанного в заголовке соединения (9,9 г, 52%). Данные: (m/z) = 274 + 276 (M+H)+.
транс-7-Бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = O, R1 = H, R2 = H, R3 = Br, R4 = H, R5 = H, R10 = H)
Глутаровый ангидрид (5,48 г, 48,1 ммоль) добавляют к перемешиваемому раствору 8-бромдибензо[b,f][1,4]оксазепина (8,1 г, 29,6 ммоль) в ксилоле (20 мл). К реакционной смеси добавляют CH2Cl2 и все это экстрагируют 2 н. (водн. раствор) NaOH (3x). Все водные слои нейтрализуют путем добавления 2 н. (водн. раствор) HCl и экстрагируют CH2Cl2. Объединенные органические слои сушат (Na2SO4) и выпаривают, с получением указанного в заголовке соединения (9,7 г, 85%) в виде смеси транс и цис-изомеров. Данные: (m/z) = 388 + 390 (M+H)+.
Сложный 1-этилпропиловый эфир транс-(7-бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = O, R1 = H, R2 = H, R3 = Br, R4 = H, R5 = H, R10 = H, R22 = CH(C2H5)2)
Путем применения общего способа 22 и путем использования 3-пентанола в качестве спирта получают указанное в заголовке соединение (6,0 г, 99%). Данные: (m/z) = 470 + 472 (M+H)+.
Сложный 1-этилпропиловый эфир транс-(7-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = O, R1 = H, R2 = H, R3 = Br, R4 = H, R5 = H, R10 = H, R22 = CH(C2H5)2)
Боран (1,0 M в ТГФ, 55 мл, 55 ммоль) добавляют по каплям к перемешиваемому раствору сложного 1-этилпропилового эфира транс-(7-бром-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (6,01 г, 12,7 ммоль) в ТГФ (63 мл). Полученную смесь перемешивают при температуре окружающей среды в течение 1 часа. После этого добавляют воду и полученную смесь экстрагируют этилацетатом. Органические слои промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. Сырой продукт подвергают хроматографии на силикагеле гептаном/этилацетатом, 1:1, что дает указанный в заголовке продукт в виде смеси цис- и транс-изомеров. После добавления этилацетата к этой смеси чистый транс-продукт (1,41 г, 24,2%) может быть собран посредством фильтрования. Данные: (m/z) = 459 + 461 (M+H)+
транс-7-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 35 схемы IX, где X = O, R1 = H, R2 = H, R3 = Br, R4 = H, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 24, с получением указанного в заголовке соединения (1,05 г, 99%). Данные: (m/z) = 345 + 347 (M+H)+.
транс-N-(7-Бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 46 схемы XI)
Это соединение получают с помощью общего способа 25, с получением указанного в заголовке соединения (76 мг, 92%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,58-2,09 (м, 4H), 3,08 (т, J=12,8, 1H), 3,81 (д, J=14,0, 1H), 4,11 (д, J=10,4, 1H), 4,38 (м, 1H), 6,83-7,28 (7 аром.H), 9,13 (д, J=10,0, 1H). (m/z) = 441 + 443 (M+H)+.
Пример 62
транс-N-(7-Ацетил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 47 схемы XII)
(1-Этоксивинил)трибутилолово (90 мкл, 0,23 ммоль) добавляют к раствору транс-N-(7-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (100 мг, 0,23 ммоль) и PdCl2(PPh3)2 (3 мг, 4,3 мкмоль) в толуоле (6 мл), в атмосфере N2. Реакционную смесь нагревают до 140°C и перемешивают в течение 3 часов. После охлаждения до комнатной температуры добавляют 2 н. (водн. раствор) HCl (450 мкл) и реакционную смесь перемешивают в течение 1 часа. Реакцию гасят насыщенным NaHCO3 (водн. раствор) и экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. Сырое соединение подвергают хроматографии гептаном/этилацетатом, 1:1. Очистка с помощью ВЭЖХ дает указанное в заголовке соединение (43 мг, 47%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,60-2,09 (м, 4H), 3,21 (т, J=11,2, 1H), 3,90 (д, J=14,0, 1H), 4,16 (д, J=10,4, 1H), 4,44 (м, 1H), 7,04-7,54 (м, 10H), 9,20 (д, J=10,0, 1H). (m/z) = 405 (M+H)+.
Пример 63
транс-2,3,4,14b-Тетрагидро-1-[(трифторацетил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-7-карбонитрил
(Структура 48 схемы XII)
Это соединение получают с помощью общего способа 27, что дает указанное в заголовке соединение (491 мг, 50%). Данные: 1H-ЯР (400 МГц, ДМСО) 1,58-2,09 (м, 4H), 3,16 (т, J=13,2, 1H), 3,96 (д, J=13,6, 1H), 4,18 (д, J=10,4, 1H), 4,47 (м, 1H), 7,06-7,53 (м, 7 аром.H), 9,18 (д, J=9,6, 1H). (m/z) = 388 (M+H)+.
Пример 64
транс-N-(7-Этенил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 49 схемы XII)
Это соединение получают с помощью общего способа 28, что дает указанное в заголовке соединение (15 мг, 34%). Данные: 1H-ЯР (400 МГц, ДМСО) 1,59-2,07 (м, 4H), 3,14 (т, J=12, 1H), 3,90 (д, J=13,6, 1H), 4,23 (д, J=10,0, 1H), 4,44 (м, 1H), 5,15 (д, J=12,0, 1H), 5,50 (д, J=18,4, 1H), 6,60 (кв., 1H) 6,84-7,26 (м, 7 аром.H), 9,17 (д, J=9,6, 1H). (m/z) = 389 (M+H)+.
Пример 65
транс-2,2,2-Трифтор-N-[2,3,4,14b-тетрагидро-7-[(фенилметил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил]ацетамид
(Структура 50 схемы XII)
К раствору транс-N-(7-бром-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (0,5 г, 1,1 ммоль) в DME (16 мл), добавляют Pd2(dba)3 (12,5 мг, 13,5 мкмоль), 2-(ди-трет-бутилфосфино)бифенил (25 мг, 80 мкмоль), трет-бутоксид натрия (218 мг, 2,3 ммоль) и бензиламин (243 мг, 2,3 ммоль). Полученную реакционную смесь нагревают до 75°C и перемешивают при этой температуре в течение 48 часов. Реакционную смесь гасят насыщенным NaHCO3 (водн. раствор) и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. Сырой продукт подвергают хроматографии гептаном/этилацетатом, 8:2, и очищают с помощью ВЭЖХ, с получением указанного в заголовке соединения (21 мг, 32%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,54-2,02 (м, 4H), 2,95 (т, J=9,2, 1H), 3,68 (д, J=14,0, 1H), 4,02 (д, J=10,0, 1H), 4,17 (д, J=6,0, 2H), 4,37 (м, 1H), 5,90-7,33 (12 аром.H, 1 NH), 9,11 (д, J=10,0, 1H). (m/z) = 468 (M+H)+.
Пример 66
транс-N-(7-Амино-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 51 схемы XII)
К раствору транс-2,2,2-трифтор-N-[2,3,4,14b-тетрагидро-7-[(фенилметил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил]ацетамида (944 мг, 2,0 ммоль) в этаноле (16 мл) добавляют Pd/C 10% (111 мг) и раствор 4 M HCl в диоксане (778 мкл, 3,11 ммоль). Полученную реакционную смесь гидрируют при 3 бар в течение 6 часов. Реакционную смесь гасят насыщенным NaHCO3 (водн. раствор) и разбавляют этанолом. После фильтрования через декалит и тщательной промывки этилацетатом летучие продукты удаляют в вакууме. Часть сырого продукта очищают с помощью ВЭЖХ, с получением указанного в заголовке соединения (29 мг, 53%). Данные (m/z) = 378 (M+H)+.
Пример 67
транс-N-[2,3,4,14b-Тетрагидро-7-[(1-оксопропил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил]-2,2,2-трифторацетамид
(Структура 52 схемы XII)
К раствору транс-N-(7-амино-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (50 мг, 0,13 ммоль) в CH2Cl2 (2 мл) добавляют пропионилхлорид (11 мкл, 0,13 ммоль) и триэтиламин (20 мкл, 0,14 ммоль). Реакционную смесь перемешивают в течение 1,5 часов при комнатной температуре. Реакционную смесь гасят насыщенным NaHCO3 (водн. раствор) и экстрагируют CH2Cl2. Органический слой сушат и выпаривают. Сырой продукт очищают на силикагеле и с помощью ВЭЖХ, с получением указанного в заголовке соединения (27 мг, 48%). Данные (m/z) = 434 (M+H)+.
Пример 68
транс-N-(12-Бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 55 схемы XIII)
4-Бром-2-[(4-бром-2-фторфенил)метиленамино]фенол
(Структура 53 схемы XIII)
5-Хлор-2-гидроксианилин (9,8 г, 48 ммоль) и 4-бром-2-фторбензальдегид (7,0 г, 48 ммоль) растворяют в этаноле (400 мл). Реакционную смесь нагревают до 60°C и перемешивают в течение 1 часа. После этого этанол выпаривают и получают указанное в заголовке соединение (17,4 г, 100%).
3-Бром-8-хлордибензо[b,f][1,4]оксазепин
(Структура 54 схемы XIII)
К раствору 4-бром-2-[(4-бром-2-фторфенил)метиленамино]-фенола (17,4 г, 48,5 ммоль) в ДМСО (200 мл) добавляют K2CO3 (13,4 г, 97,1 ммоль). Полученную реакционную смесь перемешивают при 140°C в течение 1 часа. Добавляют воду при 45°C. Продукт собирают путем фильтрования в виде беловатого твердого продукта. Твердый продукт промывают водой, растворяют в этилацетате и промывают насыщенным (водн. раствором) NaCl и сушат (Na2SO4). Летучие продукты выпаривают, с получением указанного в заголовке соединения (14,3 г, 95,5%).
транс-12-Бром-7-хлор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 12-Br, R10 = H)
Это соединение получают с помощью общего способа 21, с получением кристаллов в виде смеси цис- и транс-изомеров, 1/1 (16,4 г, 83,6%), а также, после экстракции элюента, в виде смеси цис- и транс-изомеров, 1/1 (1,91 г, 9,7%).
Сложный 1-метилэтиловый эфир транс-(12-бром-7-хлор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 12-Br, R10 = H, R22 = CH(CH3)2)
К раствору транс-12-бром-7-хлор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновой кислоты (18,3 г, 43,3 ммоль) в толуоле добавляют триэтиламин (10,8 мл, 77,9 ммоль) и DPPA (12,2 мл, 56,3 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 3 часов. При 100°C добавляют 2-пропанол (6,6 мл, 86,5 ммоль) и перемешивание продолжают в течение 3 часов при 110°C. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, что приводит к получению сырого указанного в заголовке соединения (25,4 г, 100%) в виде смеси цис- и транс-изомеров, 20:80. Данные: (m/z) = 479 + 481 (M+H)+.
Сложный 1-метилэтиловый эфир транс-(12-Бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 12-Br, R10 = H, R22 = CH(CH3)2)
Боран (1,0 M в ТГФ, 216,5 мл, 216,5 ммоль) добавляют по каплям к перемешиваемому раствору сложного 1-метилэтилового эфира транс-(12-бром-7-хлор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (25,4 г, 43,3 ммоль) в ТГФ. Полученную смесь перемешивают при температуре окружающей среды в течение 1 часа. Воду добавляют к смеси до тех пор, пока не прекратится выделение газа. Добавляют еще воды и продукт собирают путем фильтрования. Твердый продукт сушат при 40°C, при пониженном давлении, в течение 48 часов с получением кристаллов в виде смеси транс (86%) и цис (14%). Фильтрат экстрагируют CH2Cl2. Органический слой промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением сырого продукта (9,5 г, 47,2%) в виде смеси изомеров, цис/транс = 1/2. CH2Cl2 добавляют ккристаллам, рассмотренным выше, и чистый транс-изомер (5,9 г, 29,3%) собирают путем фильтрования и сушат при пониженном давлении. Элюент концентрируют с получением смеси цис- и транс-продуктов (7,9 г, 39,2%). Данные: (m/z) = 465 + 467 (M+H)+.
транс-12-Бром-7-хлор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 35 схемы VIII, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 12-Br, R10 = H)
Смесь уксусной кислоты (30 мл) и бромистого водорода(48%, 15 мл) добавляют к сложному 1-метилэтиловому эфиру транс-(12-бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (5,9 г, 12,7 ммоль, чистый транс-изомер) и перемешивают в течение 1 часа при 100°C, в атмосфере азота. После охлаждения продукт собирают путем фильтрования и растворяют в CH2Cl2. Органический слой промывают 2 н. NaOH (водн. раствор), насыщенным NaHCO3 (водн. раствор), насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением указанного в заголовке соединения (4,0 г, 83%).
транс-N-(12-Бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 55 схемы XIII)
Это соединение получают с помощью общего способа 25, с получением указанного в заголовке соединения (2,45 г, 90%). Данные:1H-ЯМР (400 МГц, ДМСО) 1,6-1,86 (м, 4H), 2,1 (м, 1H), 3,12 (тд, J=2,8, 13,4, 1H), 3,86 (д, J=14, 1H), 4,12 (д, J= 10,4, 1H), 4,4 (м, 1H), 6,73-7,49 (6 аром.H), 9,21 (д, J=10, 1 NH). (m/z) = 475 + 477 (M+H)+.
Пример 69
транс-7-Хлор-2,3,4,14b-тетрагидро-1-[(трифторацетил)амино]-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-12-карбонитрил
(Структура 56 схемы XIV)
Это соединение получают с помощью общего способа 27, с получением указанного в заголовке соединения (4,7 мг, 3,5%). Данные:1H-ЯМР (400 МГц, ДМСО) 1,60-1,88 (м, 4H), 2,03 (м, 1H), 3,14 (тд, J=3,2, 13,2, 1H), 3,85 (д, J=13,6, 1H), 4,21 (д, J=10, 1H), 4,4 (м, 1H), 6,77-7,70 (7 аром.H), 9,26 (д, J=9,6, 1 NH).
Пример 70
транс-N-(7-Хлор-2,3,4,14b-тетрагидро-12-метил-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 57 схемы XIV)
К раствору транс-N-(12-бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (80 мг, 0,17 ммоль) в ТГФ (2 мл) добавляют ферроцен PdCl2 (5 мг, 7 мкмоль) и реакционную смесь перемешивают в течение 5 минут. Добавляют метилцинкхлорид по каплям, после чего реакционную смесь нагревают до 60°C и перемешивают в течение ночи при 60°C. Смесь выливают в насыщенный (водн. раствор) NH4Cl и экстрагируют этилацетатом (3x). Объединенные органические слои промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. После очистки на силикагеле и с помощью ВЭЖХ получают указанное в заголовке соединение (13,2 мг, 19%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,60-1,85 (м, 3H), 2,0 (м, 1H), 2,23 (с, 3H), 3,11 (тд, J=2,8, 13,2, 1Н), 3,85 (д, J=14, 1H), 4,10 (д, J=10, 1H), 4,40 (м, 1H), 6,69-7,10 (6 аром.H), 9,16 (д, J=10, 1H).
Пример 71
транс-N-(12-Бром-6,7-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 58 схемы XIV)
К суспензии транс-N-(12-бром-7-хлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (100 мг, 0,21 ммоль) в ацетоне добавляют NCS (28,7 мг, 0,21 ммоль) и 6 н. (водн. раствор) HCl (0,4 мл, 2,4 ммоль). Полученную реакционную смесь перемешивают в течение ночи. Добавляют вторую порцию NCS (28,7 мг, 0,21 ммоль) и продолжают перемешивание в течение ночи. Добавляют дополнительное количество NCS (28,7 мг, 0,21 ммоль) и перемешивание продолжают в течение 5 часов. Реакционную смесь выливают в насыщенный (водн. раствор) NaHCO3 и экстрагируют этилацетатом (2x). Объединенные органические слои промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. После очистки сырого продукта с помощью ВЭЖХ получают три продукта: транс-N-(12-бром-6,7-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (структура 53 схемы XIII) (13,9 мг, 13%), транс-N-(12-бром-7,8-дихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (15,7 мг, 14,1%) и транс-N-(12-бром-6,7,8-трихлор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (20,4 мг, 17,8%). Данные (структура 53): 1H-ЯМР (400 МГц, ДМСО) 1,55 (м, 1H), 1,78 (м, 2H), 1,99 (м, 1H), 3,20 (т, J=12, 1H), 3,46 (д, J=14, 1H), 4,30 (д, J=8,8, 1H), 4,45 (ушир.с, 1H), 7,16-7,55 (6 аром.H), 9,26 (д, J=6, 1 NH).
Пример 72
транс-N-(7-Хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R5 = 11-F, R10 = H)
4-Бром-2-[(2,3-дифторфенил)метиленамино]фенол
(Структура 59 схемы XV, где R5 = 3-F и R10 = H)
2,3-Дифторбензальдегид (0,55 мл, 5 ммоль) добавляют к перемешиваемому раствору 5-хлор-2-гидроксианилина (0,72 г, 5 ммоль) в этаноле (5 мл). В течение нескольких минут образуется твердый продукт и добавляют дополнительное количество этанола (10 мл). Твердый продукт выделяют путем фильтрования и сушат, с получением указанного в заголовке соединения (1,09 г, 81%).
8-Хлор-4-фтордибензо[b,f][1,4]оксазепин
(Структура 60 со схемы XV, где R5 = 4-F, R10 = H)
Раствор 4-бром-2-[(2,3-дифторфенил)метиленамино]фенола (1,09 г, 4,1 ммоль) в ДМСО (2,4 мл) и диэтиламине (1,2 мл) нагревают в микроволновой печи при 160°C. В течение 5 минут реакционной смеси дают возможность охладиться и добавляют воду. Фильтрование и сушка дают указанное в заголовке соединение (0,59 г, 57%).
транс-7-Хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 11-F, R10 = H)
Раствор 8-хлор-4-фтордибензо[b,f][1,4]оксазепина (0,59 г, 2,4 ммоль) и глутаровый ангидрид (0,36 г, 3,2 ммоль) в ксилоле (1,3 мл) перемешивают при 140°C. Через 72 часа реакционной смеси дают возможность охладиться до комнатной температуры и добавляют простой эфир. Фильтрование дает твердый материал. Этот твердый продукт растворяют в этилацетате и экстрагируют водным раствором 2 н. гидроксида натрия. К водному экстракту добавляют 3 н. хлористоводородную кислоту до получения pH3, а затем экстрагируют этилацетатом. Органический экстракт промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и концентрируют, с получением указанного в заголовке соединения (0,44 г, 50%).
Сложный 1-метилэтиловый эфир транс-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 11-F, R10 = H, R22 = CH(CH3)2)
В общем способе 22 применяют транс-7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновую кислоту (0,44 г, 1,2 ммоль), и использование 2-попанола вместо 3-пентанола дает сложный 1-метилэтиловый эфир транс-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (0,63 г, 82%).
Сложный 1-метилэтиловый эфир транс-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 11-F, R10 = H, R22 = CH(CH3)2)
Общий способ 23 применяют для сложного 1-метилэтилового эфира транс-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (0,63 г, 0,98 ммоль), с получением сырого указанного в заголовке соединения. Очистка с помощью колоночной хроматографии на силикагеле гептаном/этилацетатом (гептан/этилацетат = 4/1) дает указанное в заголовке соединение (0,14 г, 35%).
транс-7-Хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 35 схемы VIII, где X = O, R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 11-F, R10 = H)
Общий способ 24 применяют для сложного 1-метилэтилового эфира транс-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (0,14 г, 0,35 ммоль), с получением сырого указанного в заголовке соединения. Очистка с помощью колоночной хроматографии на силикагеле гептаном/этилацетатом дает транс-7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин (0,14 г, 35%).
транс-N-(7-Хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R5 = 11-F и R10 = H)
Получение в соответствии с общим способом 25 с использованием транс-7-хлор-11-фтор-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (94 мг, 0,29 ммоль) дает сырое указанное в заголовке соединение. Это соединение очищают с помощью колоночной хроматографии на силикагеле гептаном/этилацетатом, с последующей колоночной хроматографией на силикагеле толуолом/этилацетатом (толуол/этилацетат = 9/1), с получением указанного в заголовке соединения (58 мг, 48%). Данные: 1H-ЯМР (400 МГц, ДМСО d6) 1,60-1,92 (м, 3H), 1,99-2,07 (м, 1H), 3,10-3,18 (м, 1H), 3,90 (ушир.д, J=14, 1H), 4,19 (д, J=10 Гц, 1H), 4,39-4,49 (м, 1H), 6,75 (дд, J=3, 9, 1H), 6,98-7,11 (м, 4H), 7,20-7,27 (м, 1H), 9,22 (д, J=9, 1H).
Пример 73
транс-N-(7-Хлор-14-фтор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R5 = 14-F и R10 = H)
Получение в соответствии с процедурами, описанными в примере 72, для транс-N-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида, исходя из 2,6-дифторбензальдегида (0,54 мл, 5 ммоль), даетсырое указанное в заголовке соединение. Это соединение очищают с помощью колоночной хроматографии на силикагеле гептаном/этилацетатом, колоночной хроматографии на силикагеле толуолом/этилацетатом (толуол/этилацетат = 9/1), и конечной кристаллизации из ацетонитрила, с получением указанного в заголовке соединения (136 мг, 6% общий выход). Данные: 1H-ЯМР (400 МГц, ДМСО d6) 1,57-1,76 (м, 2H), 1,89-2,04 (м, 2H), 3,09-3,18 (м, 1H), 3,93 (ушир.д, J=14, 1H), 4,42 (д, J=10, 1H), 4,52-4,62 (м, 1H), 6,74 (дд, J=9, 3, 1H), 6,95-7,16 (м, 4H), 7,27-7,33 (м, 1H), 9,30 (д, J=9, 1H).
Пример 74
транс-N-(7-Хлор-12-фтор-2,3,4,14b-тетрагидро-1H-дибензо-[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R5 = 12-F и R10 = H)
Получение в соответствии с процедурами, описанными в примере 72, для транс-N-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида, исходя из 2,4-дифторбензальдегида (0,55 мл, 5 ммоль), даетсырое указанное в заголовке соединение. Это соединение очищают с помощью колоночной хроматографии на силикагеле гептаном/этилацетатом и ВЭЖХ на колонкеLuna (10u C(18(2), 250x50 мм) с использованием градиента, от ацетонитрила/воды до ацетонитрила, в течение 30 минут, при скорости потока 50 мл/мин, с получением указанного в заголовке соединения (62 мг, 3% общий выход). Данные: 1H-ЯМР (400 МГц, ДМСО d6) 1,59-1,86 (м, 3H), 1,98-2,06 (м, 1H), 3,08-3,17 (м, 1H), 3,87 (ушир.д, J=13, 1H), 4,13 (д, J=10, 1H), 4,35-4,45 (м, 1H), 6,76 (дд, J=8, 3, 1H), 6,92-6,98 (м, 1H), 7,08 (с, 1H), 7,12-7,23 (м, 3H), 9,18 (д, J=9, 1H).
Пример 75
транс-N-(7-Хлор-12,13-дифтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = 12-F, R10 = 13-F)
4-Бром-2-[(2,4,5-трифторфенил)метиленамино]фенол
(Структура 59 схемы XV, где R5 = 4-F, R10 = 5-F)
2,4,5-Трифторбензальдегид (0,56 мл, 5 ммоль) добавляют к перемешиваемому раствору 5-хлор-2-гидроксианилина (0,72 г, 5 ммоль) в этаноле (5 мл). В течение нескольких минут образуется твердый продукт, и добавляют дополнительное количество этанола (10 мл). Твердый продукт выделяют путем фильтрования и сушат с получением желаемого продукта (1,17 г, 82%)
8-Хлор-2,3-дифтордибензо[b,f][1,4]оксазепин
(Структура 60 схемы XV, где R5 = 3-F, R10 = 2-F)
Раствор 4-бром-2-[(2,4,5-трифторфенил)метиленамино]фенола (1,17 г, 4,1 ммоль) в ДМСО (2,4 мл) и N,N-диизопропилэтиламин (1,2 мл) нагревают в микроволновой печи при 160°C. Через 5 минут реакционной смеси дают возможность охладиться и добавляют воду. Фильтрование и сушка дает указанное в заголовке соединение (1,03 г, 95%).
транс-N-(7-Хлор-12,13-дифтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 61 схемы XV, где R5 = 12-F и R10 = 13-F)
Процедура, описанная в примере 72, для получения транс-N-(7-хлор-11-фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамида (структура 61 схемы XV, где R5 = 11-F, R10 = H) из промежуточного соединения 8-хлор-4-фтордибензо[b,f][1,4]оксазепина (структура 60 схемы XV), применяется для 8-хлор-2,3-дифтордибензо[b,f][1,4]оксазепина (структура 60 схемы XV, где R5 = 3-F и R10 = 2-F) (1,03 г, 3,87 ммоль). Сырой продукт очищают с помощью колоночной хроматографии на силикагеле толуолом/этилацетатом (толуол/этилацетат = 9/1), с получением указанного в заголовке соединения (44 мг, 3% общий выход). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,66 (дкв., J=12, 4,5, 1H), 1,80-1,92 (м, 2H), 2,28-2,34 (м, 1H), 3,19 (м, 1H), 3,86 (м, 1H), 4,30 (д, J=10, 1H), 4,66 (м, 1H), 6,02 (м, 1H), 6,59 (м, 1H), 6,72 (дд, J=8,8, 3,2, 1H), 6,79 (м, 1H), 6,90 (д, J=3,2, 1H), 7,02 (д, J=8, 1H).
Пример 76
транс-N-(7-Хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)-2,2,2-трифторацетамид
(Структура 67 схемы XVI)
4-Хлор-N-метил-2-нитро-N-фенилфениламин
(Структура 62 схемы XVI)
4-Хлор-1-фтор-2-нитробензол (20,0 г, 0,11 моль) и K2CO3 (15,7 г, 0,11 моль) растворяют в N-метиланилине (37 мл, 0,34 моль), а затем нагревают до 180°C. Через 5 часов реакционную смесь охлаждают до комнатной температуры, разбавляют CH2Cl2 (750 мл) и промывают H2O (500 мл), водным раствором лимонной кислоты (5%, 500 мл) и насыщенным солевым раствором (500 мл). Органический слой сушат (Na2SO4) и концентрируют при пониженном давлении. Оставшееся масло подвергают хроматографии на силикагеле (циклогексан/CH2Cl2, 9/1, объем/объем), с получением указанного в заголовке соединения, содержащего ˜30% исходного материала. Соединение после этого перемешивают в холодном гексане и полученные красные кристаллы отфильтровывают, что приводит к получению чистого кристаллического продукта (16,5 г, 57% выход). Данные: температура плавления: 59-62°C, Rf 0,65 (циклогексан/ этилацетат, 4/1, объем/объем).
4-Хлор-N1-метил-N1-фенилбензол-1,2-диамин
(Структура 63 схемы XVI)
К раствору 4-хлор-N-метил-2-нитро-N-фенилфениламина (12,5 г, 46,3 ммоль) в этаноле (250 мл) добавляют SnCl2·2H2O (37,5 г, 0,17 моль). Раствор нагревают до 40°C и перемешивают в течение 6 часов. Реакционную смесь концентрируют в вакууме, а затем разбавляют этилацетатом (500 мл) и промывают H2O (500 мл), холодным (0°C) водным раствором NaOH (1 M, 200 мл), H2O (500 мл) и насыщенным солевым раствором (500 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении. Сырое соединение помещают на колонку с силикагелем и элюируют гептаном/этилацетатом (8/2, объем/объем), получая указанное в заголовке соединение (9,3 г, 87% выход). Данные: Rf 0,65 (гептан/этилацетат, 7/3, объем/объем). (m/z) = 233 (M+H)+.
N-[5-хлор-2-(метилфениламино)фенил]формамид
(Структура 64 схемы XVI)
4-Хлор-N1-метил-N1-фенилбензол-1,2-диамин (9,3 г, 40,1 ммоль) растворяют в муравьиной кислоте (60 мл) и нагревают при кипении с обратным холодильником. Через 2 часа реакционную смесь концентрируют в вакууме. Остаток растворяют в этилацетате (500 мл) и промывают водным раствором NaHCO3 (5%, 500 мл). Органический слой сушат, фильтруют и концентрируют при пониженном давлении. Оставшееся масло подвергают хроматографии на силикагеле (циклогексан/CH2Cl2, 9/1, объем/объем), с получением чистого указанного в заголовке соединения (10,4 г, 100% выход). Данные: Rf 0,25 (гептан/этилацетат, 3/1, объем/объем). (m/z) = 261 (M+H)+.
3-Хлор-5-метил-5H-дибензо[b,f][1,4]диазепин
(Структура 65 схемы XVI)
В трехгорлую колбу добавляют PPA (150 г), который после этого нагревают до 120°C и энергично перемешивают. POCl3 добавляют по каплям в течение 90 минут (осторожно: пенообразование), после чего добавляют в реакционную смесь формамид (10,4 г, 40,1 ммоль) в виде 4 последовательных порций. Реакционную смесь перемешивают в течение 2 часов при 120°C, а затем охлаждают до комнатной температуры, осторожно добавляют в реакционную смесь водный раствор NaHCO3 (300 мл) и нейтрализуют реакционную смесь путем дополнительного добавления NaHCO3 (насыщенный) до тех пор, пока не будет получен pH ˜ 8. После этого добавляют этилацетат (1 л) и удаляют соли путем фильтрования. Органический слой промывают H2O (500 мл) и насыщенным солевым раствором (500 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме. Очистка с помощью колоночной хроматографии на силикагеле (гептан/этилацетат, 8/2, объем/объем) дает чистый 3-хлор-5-метил-5H-дибензо[b,f][1,4]диазепин (8,8 г, 91% выход). (m/z) = 243 (M+H)+.
транс-7-Хлор-1,2,3,4,10,14b-гексагидро-10-метил-4-оксодибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = N(Me), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H)
Раствор 3-хлор-5-метил-5H-дибензо[b,f][1,4]диазепина (1,0 г, 4,1 ммоль) и глутаровый ангидрид (0,64 г, 5,6 ммоль) в ксилоле (2,5 мл) перемешивают при 140°C. Через 48 часов реакционной смеси дают возможность охладиться до комнатной температуры и добавляют простой эфир. Фильтрование дает указанное в заголовке соединение (1,1 г, 72%) в виде твердого продукта.
Сложный метиловый эфир транс-(7-хлор-1,2,3,4,10,14b-гексагидро-10-метил-4-оксодибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = N(Me), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H, R22 = CH3)
Общий способ 22 применяют для транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метил-4-оксодибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-карбоновой кислоты (1,1 г, 3,0 ммоль), и использование метанола в качестве спирта дает сырое указанное в заголовке соединение (1,4 г, 100%), которое используется на следующей стадии синтеза без дополнительной очистки.
Сложный метиловый эфир транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = N(Me), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H, R22 = CH3)
Общий способ 23 применяют для сложного метилового эфира транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метил-4-оксодибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты (1,4 г, 100%), с получением сырого указанного в заголовке соединения. Этот остаток растирают с простым эфиром, с получением указанного в заголовке соединения (0,67 г, 61%) в виде твердого продукта.
транс-7-Хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-амин
(Структура 35 схемы IX, где X = N(Me), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H)
Общий способ 24 применяют для сложного метилового эфира транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]-пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты (0,67 г, 1,8 ммоль), с получением сырого указанного в заголовке соединения в виде раствора в этилацетате (100 мл). Твердый материал образуется при хранении при 5°C в течение 16 часов. Этот твердый продукт выделяют (0,15 г, 21%) и маточную жидкость концентрируют. Остаток обрабатывают простым эфиром. Полученные твердые продукты удаляют путем фильтрования и фильтрат концентрируют, с получением дополнительного количества указанного в заголовке соединения (0,32 г, 56%). Обе части указанного в заголовке соединения используют на следующей стадии без дополнительной очистки.
транс-N-(7-Хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо-[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)-2,2,2-трифторацетамид
(Структура 67 схемы XVI)
Получениев соответствии с общим способом 25, с использованием транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-амина (0,25 г, 0,69 ммоль), дает сырое указанное в заголовке соединение. Этот остаток растирают с простым эфиром, с получением указанного в заголовке соединения (0,17 г, 60%) в виде твердого продукта. Данные: 1H-ЯМР (400 МГц, CDCl3) 1,62-1,89 (м, 3H), 2,27 (дкв., J=5,0, 5,0, 12,4, 1H), 3,20 (м, 1H), 3,30 (с, 3H), 3,63 (м, 1H), 4,08 (м, 1H), 4,80 (м, 1H), 6,07 (ушир., 1 NH), 6,71 -7,27 (м, 7 аром.H).
Пример 77
транс-[(7-Хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо-[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)амино]уксусная кислота
(Структура 69 схемы XVI)
Этил-транс-[(7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)амино]ацетат
(Структура 68 схемы XVI)
К суспензии транс-7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-иламина (100 мг, 0,25 ммоль) в ДМФА (2 мл) добавляют этилбромацетат (56 мкл, 0,51 ммоль) и триэтиламин (107 мкл, 0,76 ммоль). Полученную реакционную смесь нагревают до 60°C и перемешивают в течение 5 часов. Смесь выливают в воду и экстрагируют этилацетатом (3x). Органические слои промывают насыщенным (водн. раствор) NaHCO3 и насыщенным солевым раствором. После сушки (MgSO4) растворители удаляют при пониженном давлении. Сырой продукт очищают на силикагеле гептаном/этилацетатом, 8:2, с получением 80 мг (80%) указанного в заголовке соединения.
транс-[(7-Хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо-[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)амино]уксусная кислота
(Структура 69 схемы XVI)
К раствору этил-транс-[(7-хлор-1,2,3,4,10,14b-гексагидро-10-метилдибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)амино]ацетата (35 мг, 0,09 ммоль) в диоксане (1 мл) добавляют 4 н. (водн. раствор) NaOH (250 мкл). Реакционную смесь перемешивают при 65°C в течение 1,5 часов. Ее разбавляют водой (25 мл), после чего pH доводят до pH 2 2 н. (водн. раствор) HCl. Смесь экстрагируют этилацетатом (2x), промывают водой и насыщенным солевым раствором, сушат (MgSO4) и выпаривают. Сырой продукт очищают LC-MS, с получением указанного в заголовке соединения (4 мг, 12%). Данные (m/z) = 372 (M+H)+.
Пример 78
транс-N-(7-хлор-1,2,3,4,10,14b-гексагидродибензо[b,f]-пиридо[1,2-d][1,4]диазепин-1-ил)-2,2,2-трифторацетамид
(Структура 75 схемы XVII)
2-[(4-Хлор-2-нитрофенил)амино]бензойная кислота
(Структура 70 схемы XVII)
Раствор 4-хлор-1-фтор-2-нитробензола (20 г, 114 ммоль) и антраниловой кислоты (17,4 г, 127 ммоль) в пентаноле (250 мл) нагревают до 120°C в аппарате Дина-Старка. Добавляют медь (126 мг, 2 ммоль), а затем карбонат калия (12,7 г, 92 ммоль). Полученную реакционную смесь перемешивают при 120°C в течение 0,5 часа и при 140°C в течение 2 часов. После этого добавляют воду и 1 н. (водн. раствор) NaOH для растворения продукта. Затем pH доводят до pH 5 и водный слой экстрагируют этилацетатом (3x). Объединенные органические слои промывают водой и насыщенным солевым раствором, сушат и выпаривают. К полученному продукту добавляют этанол. Указанное в заголовке соединение (14,4 г, 43%) собирают путем фильтрования этанольной смеси.
2-[(2-Амино-4-хлорфенил)амино]бензойная кислота
(Структура 71 схемы XVI)
К раствору 2-[(4-хлор-2-нитрофенил)амино]бензойной кислоты (12,8 г, 43,7 ммоль) в этилацетате (300 мл) добавляют 5% платину на сульфидном угле. Реакционную смесь гидрируют при 2 бар в течение 5 часов. После фильтрования через декалит, промывки этилацетатом и удаления растворителя при пониженном давлении, получают указанное в заголовке соединение (11,8 г, 100%).
8-Хлор-5,10-дигидродибензо[b,f][1,4]диазепин-11-он
(Структура 72 схемы XVII)
Раствор 2-[(2-амино-4-хлорфенил)амино]бензойной кислоты (11,8 г, 45 ммоль) в ксилоле (150 мл) нагревают при кипении с обратным холодильником в аппарате Дина-Старка. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 31 часа. После удаления ксилола в вакууме получают указанное в заголовке соединение. При этом все еще присутствует исходный материал. По этой причине продукт опять растворяют в ксилоле (150 мл) и продолжают перемешивание в течение ночи при температуре кипения с обратным холодильником в аппарате Дина-Старка. После удаления ксилола при пониженном давлении получают указанное в заголовке соединение (12,4 г, 50,6 ммоль).
8-Хлор-10,11-дигидро-5H-дибензо[b,f][1,4]диазепин
(Структура 73 схемы XVII)
ТГФ (250 мл) охлаждают до 0°C, после чего добавляют порциями LiAlH4 (6,7 г, 177 ммоль). После этого добавляют порциями 8-хлор-5,10-дигидродибензо[b,f][1,4]диазепин-11-он (12,4 г, 45 ммоль), а затем ТГФ (100 мл). Полученную реакционную смесь нагревают при кипении с обратным холодильником и перемешивают в течение ночи при температуре кипения с обратным холодильником. После охлаждения смеси до 0°C добавляют по каплям насыщенный (водн. раствор) Na2SO4. Перемешивание продолжают в течение 15 минут, после чего реакционную смесь фильтруют через декалит. Летучие продукты удаляют при пониженном давлении, с получением сырого продукта. К сырому продукту добавляют смесь толуола и этилацетата. Твердый материал (5,4 г, 52%) собирают посредством фильтрования, с последующей сушкой в течение ночи при 40°C, при пониженном давлении.
8-Хлор-5H-дибензо[b,f][1,4]диазепин
(Структура 74 схемы XVII)
К раствору 8-хлор-10,11-дигидро-5H-дибензо[b,f]-[1,4]диазепина (8,75 г, 37,9 ммоль) в CH2Cl2 (375 мл) добавляют MnO2 (14,5 г, 166 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов. После фильтрования через декалит, промывки CH2Cl2 летучие продукты удаляют в вакууме. Сырой продукт растворяют в этаноле (250 мл), после чего добавляют 2 н. (водн. раствор) NaOH (20 мл). Эту смесь перемешивают при комнатной температуре в течение 2,5 часов. Реакционную смесь фильтруют через декалит и промывают CH2Cl2. После удаления растворителя при пониженном давлении остаток растворяют в этаноле (350 мл). Добавляют NaOH (2 н., 20 мл) и перемешивают смесь в течение 3 часов. Добавляют воду и смесь экстрагируют этилацетатом (3x). Объединенные органические слои промывают насыщенным солевым раствором, сушат и выпаривают, с получением указанного в заголовке соединения (8,9 г, 38,9 ммоль).
транс-7-Хлор-1,2,3,4,10,14b-гексагидро-4-оксодибензо[b,f]-пиридо[1,2-d][1,4]диазепин-1-карбоновая кислота
(Структура 32 схемы IX, где X = N(H), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H)
Это соединение получают с помощью общего способа 21, после кислотно/основной экстракции реакционной смеси получают сырое указанное в заголовке соединение (4,4 г, 34%).
Сложный метиловый эфир транс-7-хлор-1,2,3,4,10,14b-гексагидро-4-оксодибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты
(Структура 33 схемы IX, где X = N(H), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H, R22 = CH3)
Это соединение получают с помощью общего способа 22. В качестве спирта используется метанол, с получением сырого указанного в заголовке соединения (437 мг, >100%).
Сложный метиловый эфир транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты
(Структура 34 схемы IX, где X = N(H), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H, R22 = CH3)
Это соединение получают с помощью общего способа 23, с получением сырого указанного в заголовке соединения (0,51 г, 100%).
транс-7-Хлор-1,2,3,4,10,14b-гексагидродибензо[b,f]пиридо-[1,2-d][1,4]диазепин-1-амин
(Структура 35 схемы IX, где X = N(H), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H)
К раствору сложного метилового эфира транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо[b,f]пиридо[1,2-d][1,4]диазепин-1-ил)карбаминовой кислоты (0,51 г, 0,95 ммоль) в этиленгликоле (6 мл) добавляют KOH (0,37 г, 6,6 ммоль). Реакционную смесь нагревают до 100°C и перемешивают в течение ночи при 140°C. После охлаждения реакционной смеси добавляют воду и этилацетат. Смесь экстрагируют этилацетатом (3x). Органические слои промывают водой и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают, с получением сырого продукта (350 мг, 100%).
транс-N-(7-Хлор-1,2,3,4,10,14b-гексагидродибензо[b,f]-пиридо[1,2-d][1,4]диазепин-1-ил)-2,2,2-трифторацетамид
(Структура 75 схемы XVII)
К раствору транс-7-хлор-1,2,3,4,10,14b-гексагидродибензо-[b,f]пиридо[1,2-d][1,4]диазепин-1-амина (структура 35 схемы IX, где X = N(H), R1 = H, R2 = H, R3 = Cl, R4 = H, R5 = H, R10 = H) (350 мг, 1,17 ммоль) в метаноле (22 мл) и триэтиламине (0,7 мл) добавляют этилтрифторацетат (1,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Добавляют воду и экстрагируют смесь этилацетатом (3x). Органические слои промывают насыщенным солевым раствором, сушат (Na2SO4) и выпаривают. После очистки на силикагеле гептаном/этилацетатом, 6:4, получают указанное в заголовке соединение (90 мг, 19%). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,69 (м, 1H), 1,86-1,94 (м, 2H), 2,11 (м, 1H), 2,99-3,09 (м, 2H), 4,47 (д, 1H), 4,86 (м, 1H), 5,79 (с, 1H, NH), 6,62 (д, J=8,2, 1H), 6,75 (дд, J=7,8, 1H), 6,89 (т, J=7,8, 1H), 6,91 (дд, J=8,2, J=2,7, 1H), 7,10 (д, J=2,7, 1H), 7,18 (т, J=7,8, 1H), 7,24 (д, J=7,8, 1H).
Примеры 79A и B
(1α,2β,14bα)-N-(7-Хлор-2,3,4,14b-тетрагидро-2-метил-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (структура 86 схемы XVIII)
(1α,2α,14bα)-N-(7-Хлор-2,3,4,14b-тетрагидро-2-метил-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид (структура 87 схемы XVIII)
N-(5-Хлор-2-феноксифенил)формамид
(Структура 76 схемы XVIII)
Это соединение получают с помощью общего способа 29 из 5-хор-2-феноксибензоламина, с получением N-(5-хлор-2-феноксифенил)формамида (29,5 г, 94%). (m/z) = 248 (M+H)+.
8-Хлордибензо[b,f][1,4]оксазепин
(Структура 77 схемы XVIII)
Это соединение получают с помощью общего способа 30, с получением 8-хлордибензо[b,f][1,4]оксазепина (24,5 г, 89%). (m/z) = 230 (M+H)+.
транс-7-Хлор-2-метил-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-карбоновая кислота
(Структура 78 схемы XVIII)
Это соединение получают с помощью общего способа 21, путем использования 3-метилглутарового ангидрида (4). Смесь двух изомеров (1/1) (2,2 г, 66%) получают путем кристаллизации из простого диэтилового эфира. Данные: (m/z) = 358 (M+H)+.
Сложный метиловый эфир транс-(7-хлор-2-метил-2,3,4,14b-тетрагидро-4-оксо-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структура 79 схемы XVIII)
Это соединение получают с помощью общего способа 22, путем использования метанола в качестве спирта, с получением сырого указанного в заголовке соединения (2,6 г, >100%). (m/z) = 387 (M+H)+.
Сложный метиловый эфир транс-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты
(Структуры 80, 81 и 82 схемы XVIII)
Это соединение получают с помощью общего способа 23. Сырой продукт подвергают хроматографии гептаном/этилацетатом, 6:4, с получением сложного метилового эфира (1α,2β,14bα)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (структура 82 схемы XVII) (301 мг, 11%, транс) и смеси двух других изомеров сложного метилового эфира (1α,2α,14bα)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (структура 80 схемы XVIII) и сложного метилового эфира (1α,2α,14bβ)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (структура 81 схемы XVIII) (1,6 г, 63%, транс и цис). (m/z) = 373 (M+H)+.
транс-7-Хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]-пиридо[1,2-d][1,4]оксазепин-1-амин
(Структуры 83 и 84 схемы XVIII)
Это соединение получают с помощью общего способа 24, начиная со смеси сложного метилового эфира (1α,2α,14bα)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (структура 80 схемы XVII) и сложного метилового эфира (1α,2α,14bβ)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты (структура 81 схемы XVII), с получением смеси двух изомеров (1α,2α,14bα)-7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (структура 83 схемы XVII) и (1α,2α,14bβ)-7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амина (структура 84 схемы XVII) (1,3 г, 96%).
(1α,2β,14bα)-7-Хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 85 схемы XVII)
Это соединение получают из сложного метилового эфира (1α,2β,14bα)-(7-хлор-2-метил-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)карбаминовой кислоты с помощью общего способа 24, с получением указанного в заголовке соединения (структура 85 из схемы XVII) (130 мг, 51%, транс).
(1α,2β,14bα)-N-(7-Хлор-2,3,4,14b-тетрагидро-2-метил-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 86 со схемы XVII)
Это соединение получают с помощью общего способа 25, исходя из соединения 85, с получением указанного в заголовке соединения. После очистки с помощью ВЭЖХ получают (53 мг, 31%, транс). Данные: 1H-ЯМР (400 МГц, CDCl3) 1,02-1,04 (д, J=6,4, 3H), 1,58 (м, 1H), 1,78 (м, 1H), 1,98 (м, 1H), 3,22-3,31 (тд, J=12,2, J=2,2, 1H), 3,91 (м, 1H), 4,13-4,18 (д, J=10,0, 1H), 4,23-4,30 (т, J=10,0, 1H), 6,64-7,27 (7 аром.H). (m/z) = 411 (M+H)+.
(1α,2α,14bα)-N-(7-Хлор-2,3,4,14b-тетрагидро-2-метил-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-ил)-2,2,2-трифторацетамид
(Структура 87 из схемы XVII)
Это соединение получают с помощью общего способа 25, исходя изсмеси изомеров 83 и 84, с получением смеси продуктов 87 и 88. После очистки с помощью ВЭЖХ получают указанное в заголовке соединение (115 мг, 13%). Данные: 1H-ЯМР (400 МГц, ДМСО) 1,00-1,04 (д, J=7,0, 3H), 1,73-1,79 (кв., J=6,0, 2H), 2,24-2,35 (м, 1H), 3,31-3,52 (м, 2H), 4,55-4,60 (д, J=8,3, 1H), 4,65-4,72 (м, 1H), 6,71-7,38 (7 аром.H), 9,07-9,12 (д, J=9,8, NH). (m/z) = 411 (M+H)+.
Пример 80
Активность рецептора-B прогестерона при трансактивировании
(Анти-)прогестагенная активность соединения по настоящему изобретению (EC50 и собственная активность) определяется в биологическом анализе in vitro клеток яичников китайского хомячка (CHO), стабильно трансфицированных плазмидой, экспрессирующей рецептор-B прогестерона человека, и репортерной плазмидой, в которой MMTV-промотор связан с репортерным геном люциферазы. Эта линия клеток известна под названием CHO-PRB-pMMTV-LUC 1E2-A2 (Dijkema R et al. (1998) J. Steroid Biochem. Mol. Biol., 64:147-56). Клетки культивируют в модифицированной среде Дульбеко-Игла/питательной смеси F-12 (DMEM/HAM F12, с отношением 1:1) от Gibco (Paisley, UK), дополненной очищенной телячьей сывороткой, обработанной активированным древесным углем, от Hyclone (Utah, USA).
Антипрогестагенная активность соединения по настоящему изобретению определяется по ингибированию трансактивации посредством рецептора-B прогестерона фермента люциферазы в присутствии 1 нМ (16α)-16-этил-21-гидрокси-19-норпрегн-4-ен-3,20-диона и сравнивается с эталонным антипрогестагеном (6β,11β,17β)-11-[4-(диметиламино)фенил]-4',5'-дигидро-6-метилспиро[эстра-4,9-диен-17,2'(3'H)-фуран]-3-оном, активность которого принимается за 100%. Агонистические лиганды не ингибируют трансактивацию активности люциферазы, индуцируемую 0,1 нМ Org 2058, в то время как сильные и слабые антипрогестагены могут ингибировать трансактивацию, в зависимости от уровня используемой дозы.
Прогестагенная активность с EC50 в пределах между 10000 и 100 нМ обнаружена для соединений примеров 1, 3, 5, 9, 10, 12, 14, 15, 16, 17, 18, 27, 28, 30, 31, 36, 37, 39, 40, 42B, 43, 44, 48, 49, 50, 56, 64 и 67. Соединения примеров 11, 13, 21, 24, 29, 38A, 45, 46, 55, 62, 68, 69, 70, 72, 74, 78 и 79B демонстрируют EC50 в пределах между 100 и 10 нМ, в то время как соединения примеров 6, 7, 8, 13 (1S,14bR изомер), 19, 20, 22, 23, 25, 26, 38B, 41, 42A, 47, 51, 52, 53, 54, 57, 58, 59, 60, 61, 63, 71, 73, 75, 76 и 79A демонстрируют EC50 < 10 нМ. Собственная активность по отношению к (16α)-16-этил-21-гидрокси-19-норпрегн-4-ен-3,20-диону составляет >10% у всех исследуемых соединений.
Антипрогестагенная активность с EC50 в пределах между 10000 и 100 нМ обнаружена для соединений примеров 5, 9, 10, 15, 21, 32, 33, 35, 38A, 39 и 41. Соединения примеров 7, 8, 11, 22 (1S,14bR изомер), 29, 48 и 49 демонстрируют EC50 в пределах между 100 и 10 нМ, в то время как соединение примера 13 (1S,14bR изомер) демонстрирует EC50 < 10 нМ. Собственная активность по отношению к (6β,11β,17β)-11-[4-(диметиламино)фенил]-4',5'-дигидро-6-метилспиро[эстра-4,9-диен-17,2'(3'H)-фуран]-3-ону составляет >15% у всех исследуемых соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3K И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2600927C2 |
| АМИНОЗАМЕЩЕННЫЕ АНАЛОГИ ДИАРИЛ [a,d] ЦИКЛОГЕПТЕНА В КАЧЕСТВЕ МУСКАРИНОВЫХ АГОНИСТОВ И СПОСОБЫ ЛЕЧЕНИЯ ПСИХОНЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2394030C2 |
| НЕСТЕРОИДНЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ | 2006 |
|
RU2409577C2 |
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ВАЗОПРЕССИНА | 1994 |
|
RU2149160C1 |
| 2,5,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-3-ИЛАМИНЫ ИЛИ 2,3,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-5-ИЛАМИНЫ | 2011 |
|
RU2570796C2 |
| ИНГИБИТОР, СОДЕРЖАЩИЙ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800543C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2654068C1 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ГРИППА, СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2737190C2 |
| ПРОИЗВОДНЫЕ ДИБЕНЗ(B, F) (1,4)ОКСАЗЕПИН-11-ОНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ УМЕНЬШЕНИЯ МУЛЬТИЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ РАКОВЫХ КЛЕТОК К ЦИТОТОКСИЧЕСКОМУ ЛЕКАРСТВУ | 1992 |
|
RU2086545C1 |
| ПРОИЗВОДНЫЕ (ПИРИДО/ТИЕНО)[f]ОКСАЗЕПИН-5-ОНА, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ ИЛИ ПСИХИЧЕСКИХ РАССТРОЙСТВ | 2002 |
|
RU2286347C2 |
Изобретение относится к нестероидным модуляторам рецептора прогестерона, имеющим общую формулу
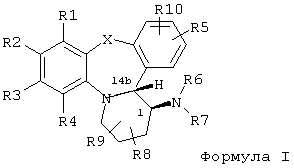
или его фармацевтической приемлемой соли,
где R1, R3, R4, R5 и R10 независимо выбираются из группы, состоящей из Н, галогена, (1-4С)алкила, (2-4С)алкенила, CN, O(1-4С)алкила, С(O)(1-4С)алкила и NR19R20, R2 выбирается из группы, состоящей из Н, галогена, NO2 и NR11R12, R6 выбирается из группы, состоящей из Н, C(Y)R15, C(O)OR16, C(S)NR17, (1-6С)алкила, (1-6С)алкокси-замещенного (1-4С)алкила и (CH2)nC(O)OR21, R7 представляет собой Н или R7 выбирается из группы, состоящей из (1-4С)алкила и (2-4С)алкенила, причем все они необязательно замещены одним или несколькими атомами галогена, R8 и R9 представляют собой Н, R11 и R12 независимо выбираются из группы, состоящей из Н, (1-6С)алкоксикарбонила, (1-4С)алкилсульфонила и (6-10С)арилсульфонила, R15 представляет собой Н или R15 выбирается из группы, состоящей из (1-6С)алкила, (6-10С)арила, 1,4-бисарила, амино(1-4С)алкила, гидрокси(1-4С)алкила и карбокси(1-4С)алкила, причем все они необязательно замещены одним или несколькими атомами галогена, R16 представляет собой (1-6С)алкил, необязательно замещенный одним или несколькими атомами галогена, R17 выбирается из группы, состоящей из (1-4С)алкила, (2-4С)алкенила, (2-4С)алкинила и (3-6С)циклоалкила, причем все они необязательно замещены одним или несколькими атомами галогена, Х выбирается из группы, состоящей из О, S, CH2 и NR18, Y выбирается из группы, состоящей из О, S и NH, R18 выбирается из группы, состоящей из Н и (1-4С)алкила, R19 выбирается из группы, состоящей из Н и (1-4С)алкила, R20 выбирается из группы, состоящей из Н, СН2(6-10С)арила и С(O)(1-6С)алкила, R21 представляет собой Н, m равно 0, 1 или 2, и n равно 1, 2 или 3, при условии, что (i) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой этил или С(O)СН3, тогда R7 не является Н; (ii) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой метил, тогда R7 не является метилом; и (iii) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой Н, тогда R7 не является Н, этилом или (СО)СН3. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами, которые могут найти свое применение в качестве лекарственного средства, обладающего активностью в отношении рецептора прогестерона. 14 з.п. ф-лы, 3 табл.
или его фармацевтически приемлемая соль,
где R1, R3, R4, R5 и R10 независимо выбираются из группы, состоящей из Н, галогена, (1-4С)алкила, (2-4С)алкенила, CN, O(1-4С)алкила, С(O)(1-4С)алкила и NR19R20,
R2 выбирается из группы, состоящей из Н, галогена, NO2 и NR11R12,
R6 выбирается из группы, состоящей из Н, C(Y)R15, C(O)OR16, C(S)NR17, (1-6С)алкила, (1-6С)алкокси-замещенного (1-4С)алкила и (CH2)nC(O)OR21,
R7 представляет собой Н или R7 выбирается из группы, состоящей из (1-4С)алкила и (2-4С)алкенила, причем все они необязательно замещены одним или несколькими атомами галогена,
R8 и R9 представляют собой Н,
R11 и R12 независимо выбираются из группы, состоящей из Н, (1-6С)алкоксикарбонила, (1-4С)алкилсульфонила и (6-10С)арилсульфонила,
R15 представляет собой Н или R15 выбирается из группы, состоящей из (1-6С)алкила, (6-10С)арила, 1,4-бисарила, амино(1-4С)алкила, гидрокси(1-4С)алкила и карбокси(1-4С)алкила, причем все они необязательно замещены одним или несколькими атомами галогена,
R16 представляет собой (1-6С)алкил, необязательно замещенный одним или несколькими атомами галогена,
R17 выбирается из группы, состоящей из (1-4С)алкила, (2-4С)алкенила,
(2-4С)алкинила и (3-6С)циклоалкила, причем все они необязательно замещены одним или несколькими атомами галогена,
Х выбирается из группы, состоящей из О, S, CH2 и NR18,
Y выбирается из группы, состоящей из О, S, и NH,
R18 выбирается из группы, состоящей из Н и (1-4С)алкила,
R19 выбирается из группы, состоящей из Н и (1-4С)алкила,
R20 выбирается из группы, состоящей из Н, СН2(6-10С)арила и С(O)(1-6С)алкила,
R21 представляет собой Н,
m равно 0, 1 или 2, и
n равно 1, 2 или 3, при условии, что
(i) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н, R6 представляет собой этил или С(O)СН3, тогда R7 не является Н;
(ii) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н, R6 представляет собой метил, тогда R7 не является метилом;
(iii) когда X представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н, и R6 представляет собой Н, тогда R7 не является Н, этилом или (СО)СН3.
R11 и R12 независимо выбираются из группы, состоящей из Н, (1-6С)алкоксикарбонила, (1-4С)алкилсульфонила и (6-10С)арилсульфонила.
R3 и/или R4 независимо выбирают из группы, состоящей из Н, CN, галогена, (2-4С)алкенила и С(O)(1-4С)алкила, R5 и/или R10 независимо выбирают из Н или галогена.
| НАСОС | 1972 |
|
SU421802A1 |
| RU 2000104831 А, 10.03.2002 | |||
| Производные 5,6-дигидро-11 @ -дибензо @ , @ -азепин-6-она,обладающие противосудорожной активностью | 1983 |
|
SU1301830A1 |
Авторы
Даты
2007-10-27—Публикация
2003-04-01—Подача