Родственная заявка
[0001] В данной заявке испрашивается приоритет и преимущества заявки на патент №201510908329.2 Китайской Народной Республики, зарегистрированной в Государственном ведомстве по интеллектуальной собственности 9 декабря 2015 г., полное содержание которой включено в настоящий документ посредством ссылки.
Область техники, к которой относится изобретение
[0002] Изобретение относится к фармацевтической области, более точно, к новым соединениям, используемым в качестве ингибиторов репликации вируса гриппа, способам получения таких соединений, и использованию таких соединений и содержащих их фармацевтических композиций в лечении гриппа. Более конкретно, соединения согласно изобретению могут быть использованы в качестве ингибиторов РНК-полимеразы вируса гриппа.
Предпосылки создания изобретения
[0003] Грипп - острое респираторное инфекционное заболевание, вредное для здоровья человека, которое вызывает вирус гриппа и которое характеризуется высокой заболеваемостью, широкой распространенностью и быстрым распространением. Вирус гриппа может вызывать серьезные симптомы у пожилых людей и детей с более слабой иммунной системой и у пациентов со сниженным иммунитетом, например, с пневмонией или сердечно-легочной недостаточностью. Вирус гриппа был открыт англичанином Вилсоном Смитом, который присвоил вирусу гриппа обозначение H1N1. «Н» означает гемагглютинин, «N» означает нейраминидазу, а цифрами показаны разные типы. После открытия вирус гриппа многократно вызывал глобальные пандемии, и вспышки вирусного гриппа, вызывающие огромные потери во всем мире, случаются приблизительно в каждом десятилетии. Во время ежегодной вспышки грипп распространяется по всему миру, приводя к приблизительно 250000-500000 случаям смерти, приблизительно от трех до пяти миллионов случаев тяжелого заболевания и инфицированию приблизительно от 5% до 15% населения во всем мире. Во всех случаях пандемии ее возникновение было вызвано возникновением новых штаммов у людей. Обычно появление этих новых штаммов вызвано распространением существующих вирусов гриппа от других видов животных на человека.
[0004] Вирусы гриппа являются РНК-содержащими вирусами гриппа, принадлежащими к семейству ортомиксовирусов, которое относится к роду вируса гриппа. В соответствии с различиями антигенных характеристик нуклеопротеина (NP) и белка матрикса (М) вириона гриппа и генетическими характеристиками, вирусы гриппа подразделяют на три типа: А, В и С. Три типа вируса гриппа имеют сходные биохимические и биологические характеристики. Вирусная частица имеет диаметр 80-120 нанометров, и обычно приблизительно сферическую форму, хотя могут встречаться и филаментные формы. Вирус состоит из трех слоев, и внутренним слоем является вирусный нуклеокапсид, содержащий нуклеопротеин (NP), протеин Р и РНК. NP это растворимый антиген (S-антиген), обладающий типоспецифичностью и антигенной стабильностью. Протеин Р (P1, Р2, Р3) может быть полимеразой, требуемой для транскрипции и репликации РНК. Средняя вирусная оболочка состоит из липидного слоя и слоя мембранного белка (MP), MP обладает антигенной стабильностью и типоспецифичностью. Поверхностный слой представлен радиальными выростами, состоящими из шипов, образованных двумя гликопротеинами: гемагглютинином (Н) и нейраминидазой (N). Н является инструментом для фиксации и поглощения вируса поверхностью чувствительной клетки, которые могут приводить к агглютинации эритроцита, N - инструмент для разрыва клеточной поверхности после завершения репликации вируса, который может осуществлять гидролиз белка защитной слизи и N-ацетилнейраминовой кислоты, которая находится на конце гликопротеинового рецептора, специфичного для клеточной поверхности. Н и N характеризуются изменчивостью и обладают только штаммоспецифичным антигеном, антитело к которому оказывает защитный эффект.
[0005] Вирус гриппа А включает один вид, вирус гриппа А. Естественными хозяевами разнообразных вирусов гриппа А являются дикие водные птицы. Время от времени вирусы передаются других видам и могут затем вызывать губительные вспышки среди домашней птицы или являться причиной пандемий гриппа среди людей. Вирус гриппа А является самым вирулентным для человека патогеном среди трех типов вируса гриппа, вызывает тяжелейшее заболевание и может передаваться другим видам и вызывать пандемии гриппа у людей. Вирус гриппа А можно подразделить на разные серотипы на основании образования антител в ответ на эти вирусы. Серотипы, подтвержденные у людей и перечисленные в порядке убывания количества известных случаев смерти во время вызванных этими серотипами пандемий, включают: H1N1, вызвавший испанский грипп в 1918 г.; H2N2, вызвавший азиатский грипп в 1957 г.; H3N2, вызвавший гонконгский грипп в 1968 г.; H5N1, ставший причиной угрозы пандемии в эпидемическом сезоне гриппа в 2007-2008 г.; H7N7, обладающий необычным зоонозным потенциалом; H1N2, эндемичный для человека и свиньи; H9N2; H7N2; H7N3; и H10N7.
[0006] Вирус гриппа В включает один вид, вирус гриппа В, который вызывает локальные эпидемии гриппа и не может вызывать мировых пандемий гриппа. К инфекции, вызываемой вирусом гриппа В, чувствительны лишь два вида животных -человек и тюлень. Этот тип вируса гриппа мутирует в 2-3 раза реже, чем вирус типа А и, следовательно, он отличается меньшим генетическим разнообразием, и существованием лишь одного серотипа вируса гриппа В. В результате такого отсутствия антигенного разнообразия некоторый иммунитет к гриппу В обычно приобретается в раннем возрасте. Однако вирус гриппа В мутирует в достаточной степени, делающей невозможным продолжительный иммунитет. Такая сниженная частота изменения антигенов в сочетании с ограниченным спектром хозяев (подавляющим межвидовый антигенный сдвиг) обеспечивает отсутствие пандемий гриппа В.
[0007] Вирус гриппа С включает один вид, вирус гриппа С, который существует в спорадической форме и обычно вызывает только легкое заболевание у детей. Вирус гриппа С не может вызывать пандемии гриппа и инфицирует человека и свинью.
[0008] Необычная особенность вируса заключается в том, что его геном не является цельной нуклеиновой кислотой; вместо этого он представляет собой семь или восемь сегментированных отрицательно-полярных РНК. Геном вируса гриппа А кодирует 11 белков: гемагглютинин (Н), нейраминидазу (N), нуклеопротеин (N), M1, М2, NS1, NS2 (NEP), PA, PB1 (основной полимеразный белок 1), PB1-F2 и РВ2. Гемагглютинин (Н) и нейраминидаза (N) - два крупных гликопротеина, расположенные с внешней стороны вирусных частиц. НА - это лектин, которым опосредовано связывание вируса с клетками-мишенями и проникновение вирусного генома в клетку-мишень, тогда как NA участвует в высвобождение вирусного потомства из инфицированных клеток, расщепляя сахара, связывающие зрелые вирусные частицы. Таким образом, эти белки являются мишенями для противирусных лекарств. Кроме того, они являются антигенами, в ответ на которые могут образовываться антитела. Вирусы гриппа А классифицируют по подтипам, основываясь на образованию антител к Н и N. Эти различные типы НА и NA образуют основу для различения Н и N, например, H5N1.
[0009] Вакцинация и использование противовирусных лекарственных препаратов являются важными инструментами для ответа на пандемии гриппа. Вследствие высокой частоты мутации антигена вируса гриппа крупномасштабное производство вакцины до пандемии гриппа невозможно. Два класса противовирусных лекарственных средств, используемых против гриппа, включают ингибиторы белка М2 (амантадин и ремантадин) и ингибиторы нейраминидазы (осельтамивир, занамивир, перамивир и Ланинамивир). Однако у вирусов гриппа развилась резистентность во всем этим лекарствам. Поэтому сохраняется потребность в новых противогриппозных лечебных агентах.
[0010] На рынке появился фальпиравир, новое противовирусное средство, обладающее новым механизмом, антивирусное действие которого заключается в ингибировании РНК-полимеразы вируса гриппа для подавления репликации вирусных генов, но терапевтический эффект и резистентность вирусов гриппа к лекарственному средству необходимо доказать. Таким образом, по-прежнему сохраняется потребность в исследовании других соединений в качестве противовирусных агентов.
Краткое изложение сущности изобретения
[0011] В изобретении описан новый класс соединений, используемых в качестве ингибиторов РНК-полимеразы вируса гриппа. Эти соединения и содержащие их композиции могут использоваться в производстве лекарственных средства для профилактики, контроля, лечения или уменьшения тяжести вирусной инфекции у пациентов.
[0012] Согласно одной особенности настоящего изобретения, предложено соединение по Формуле (I) или стереоизомер, таутомер, N-оксид, сольват, метаболит, фармацевтически приемлемая соль или пролекарство,
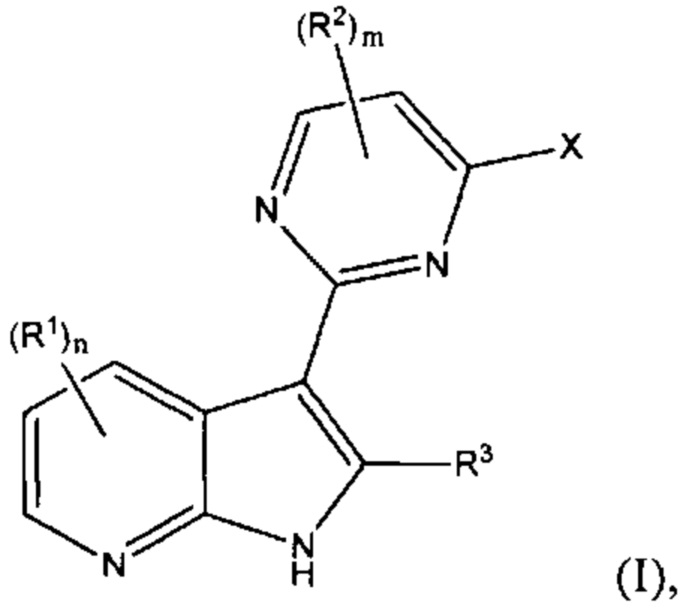
где R1, R2, R3, X, m и n соответствуют определениям в данном документе.
[0013] В определенных вариантах осуществления изобретения каждый R1 и R3 независимо представляет собой Н, F, Cl, Br, CN, NO2, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, ORb, -NRcRd, RbO-C1-4 алкилен, RdRcN-C1-4 алкилен, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, С3-8 циклоалкил, С3-8 циклоалкил-C1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-C1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил или (от 5- до 10-членный гетероарил)-С1-4 алкилен, где каждый C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-8 циклоалкил, С3-8 циклоалкил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил и (от 5- до 10-членный гетероарил)-С1-4 алкилен независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, ORb, -NRcRd, С1-6 алкил, C1-6 галоалкил, RbO-C1-4 алкилен или RdRcN-C1-4 алкилен;
n равен 0, 1, 2 или 3;
каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-12 карбоциклил, С3-12 карбоциклил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 14-членный гетероарил, (от 5- до 14-членный гетероарил)-С1-4 алкилен; или два соседних R2, вместе с атомами, с которыми они связаны, образуют С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо, и где каждый С2-6 алкинил, С3-12 карбоциклил, С3-12 карбоциклил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 14-членный гетероарил, (от 5- до 14-членный гетероарил)-С1-4 алкилен, С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо и от 5- до 10-членное гетероароматическое кольцо, независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F;
каждый R' независимо представляет собой F, Cl, Br, CN, NO2, оксо (=O), ORb, -NRcRd, RbO-C1-4 алкилен, RdRcN-C1-4 алкилен, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, 5-6-членный гетероарил или (5-6-членный гетероарил)-С1-4 алкилен, и где каждый С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, 5-6-членный гетероарил и (5-6-членный гетероарил)-С1-4 алкилен независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, NO2, ORb, -NRcRd, С1-6 алкил, C1-6 галоалкил, RbO-C1-4 алкилен или RdRcN-C1-4 алкилен;
m равен 1 или 2;
X имеет одну из следующих подформул:
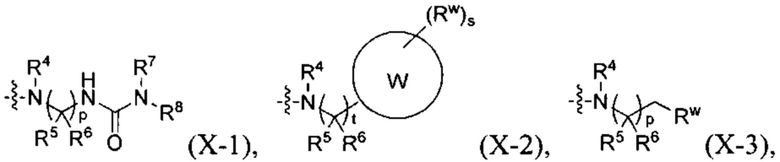

где R4 представляет собой Н или С1-6 алкил, и где C1-6 алкил при необходимости замещен одним, двумя, тремя или четырьмя U;
каждый R5, R6, R7 и R8 независимо представляет собой Н или C1-6 алкил; или R5 и R6, совместно с атомом углерода, с которым они связаны, образуют С3-8 циклоалкильную группу, от 3- до 6-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5-до 10-членное гетероароматическое кольцо; или R7 и R8, совместно с атомом азота, с которым они связаны, образуют от 3- до 6-членное гетероциклическое кольцо или от 5- до 10-членное гетероароматическое кольцо, и где каждый C1-6 алкил, С3-8 циклоалкил, от 3- до 6-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя U;
W представляет собой С3-12 карбоциклическое кольцо или от 3- до 12-членное гетероциклическое кольцо;
каждый V и V' независимо представляет собой С3-12 циклоалкановое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо;
каждый Rw независимо представляет собой F, Cl, Br, CN, NO2, оксо (=O), -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, -S(=O)2Re, -S(=O)2NRcC(=O)Ra, -S(=O)2NRcRd, (RbO)2P(=O)-C0-2 алкилен, ORb, -NRcRd, RbO-C1-2 алкилен, RdRcN-C1-2 алкилен, C1-6 алкил, 5-6-членный гетероарил или 5-6-членный гетероциклил, и где каждый C1-6 алкил, 5-6-членный гетероарил или 5-6-членный гетероциклил независимо не замещен или замещен одним, двумя, тремя или четырьмя U;
каждый U независимо представляет собой F, Cl, Br, NO2, CN, оксо (=O), N3, ORb, -NRcRd, С1-6 алкил или C1-6 галоалкил;
каждый s и t независимо равен 0, 1, 2 или 3;
р равен 1, 2 или 3; и
каждый Ra, Rb, Rc, Rd и Re независимо представляет собой Н, С1-6 алкил, С1-6 галоалкил, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил, (от 5- до 10-членный гетероарил)-С1-4 алкилен; или Rc и Rd, совместно с атомом азота, с которым они связаны, образуют от 3- до 6-членное гетероциклическое кольцо, и где каждый C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил, (от 5- до 10-членный гетероарил)-С1-4 алкилен и от 3- до 6-членное гетероциклическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, CN, ОН, NH2, C1-6 алкил, C1-6 галоалкил, C1-6 алкокси или C1-6 алкиламино.
[0014] В других вариантах осуществления изобретение относится к соединению по формуле (II), или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,
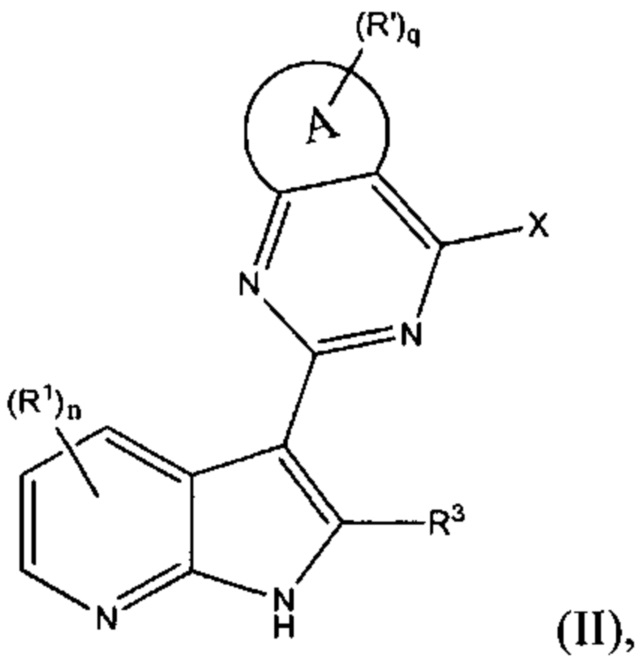
где A, R1, R3, X, R', n и q соответствуют определениям в данном документе.
[0015] В других вариантах осуществления изобретения, А представляет собой С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо; и
q равен 0, 1, 2, 3, 4 или 5.
[0016] В других вариантах осуществления изобретения, каждый R1 и R3 независимо представляет собой Н, F, Cl, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, ORb, -NRcRd, C1-3 алкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил или 5-6-членный гетероарил, и где каждый С1-3 алкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил или 5-6-членный гетероарил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, ORb, -NRcRd, C1-3 алкила, C1-3 галоалкила или RbO-C1-2 алкилена.
[0017] В других вариантах осуществления изобретения, каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-6 карбоциклил, С3-6 карбоциклил-С1-2 алкилен, 5-6-членный гетероциклил, (5-6-членный гетероциклил)-С1-2 алкилен, фенил, нафтил, фенил-С1-2 алкилен, 5-6-членный гетероарил, (5-6-членный гетероарил)-С1-2 алкилен; или два соседних R2, вместе с атомами, с которыми они связаны, образуют С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо, и где каждый С2-6 алкинил, С3-6 карбоциклил, С3-6 карбоциклил-С1-2 алкилен, 5-6-членный гетероциклил, (5-6-членный гетероциклил)-С1-2 алкилен, фенил, нафтил, фенил-С1-2 алкилен, 5-6-членный гетероарил, (5-6-членный гетероарил)-С1-2 алкилен, С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо и 5-6-членное гетероароматическое кольцо независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
[0018] В других вариантах осуществления изобретения, каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, -NRcRd, -C(=O)Ra, -C(=O)NRcRd, С1-9 алкил, C1-3 галоалкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил, фенил-C1-2 алкилен или 5-6-членный гетероарил, и где каждый С1-9 алкил, С1-3 галоалкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил, фенил-С1-4 алкилен и 5-6-членный гетероарил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, NO2, ORb, -NRcRd, метила, этила, n-пропила или изопропила.
[0019] В других вариантах осуществления изобретения, каждый Ra, Rb, Rc, Rd и Re независимо представляет собой Н, метил, этил, изопропил, n-пропил, н-бутил, трет-бутил, C1-3 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-C1-2 алкилен, от 3- до 6-членный гетероциклил, фенил, фенил-С1-2 алкилен; или Rc и Rd, совместно с атомом азота, с которым они связаны, образуют 5-6-членное гетероциклическое кольцо, и где каждый метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, С3-6 циклоалкил, С3-6 циклоалкил-С1-2 алкилен, от 3- до 6-членный гетероциклил, фенил, фенил-С1-2 алкилен и 5-6-членное гетероциклическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, CN, ОН, NH2, С1-3 алкила, C1-3 галоалкила или метокси.
[0020] В других вариантах осуществления изобретения, X имеет одну из следующих подформул:

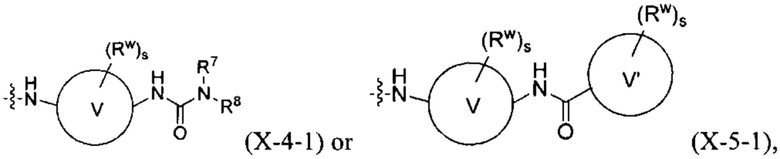
где W, V, V', R5, R6, R7, R8, Rw и s соответствуют определениям в данном документе.
[0021] В других вариантах осуществления изобретения, W представляет собой С6-8 карбоциклическое кольцо или 6-8-членное гетероциклическое кольцо.
[0022] В других вариантах осуществления изобретения, V представляет собой С3-8 циклоалкановое кольцо, 3-8-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо.
[0023] В других вариантах осуществления изобретения, V' представляет собой С3-8 циклоалкановое кольцо, 3-8-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо.
[0024] В других вариантах осуществления изобретения, каждый Rw независимо представляет собой F, Cl, Br, CN, NO2, оксо (=О), -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, -S(=O)2Re, -S(=O)2NRcC(=O)Ra, -S(=O)2NRcRd, (RbO)2P(=O)-C0-2 алкилен, ORb, -NRcRd, RbO-C1-2 алкилен, RdRcN-C1-2 алкилен, метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, тетразолил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил или пиразолил, где каждый метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, тетразолил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил и пиразолил независимо не замещен или замещен одним, двумя, тремя или четырьмя U.
[0025] В других вариантах осуществления изобретения, каждый U независимо представляет собой F, Cl, Br, CF3, NO2, CN, оксо (=O), N3, ORb, -NRcRd, метил, этил, изопропил, n-пропил, n-бутил или трет-бутил.
[0026] В других вариантах осуществления изобретения, A is а С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо, нафталиновое кольцо или 5-6-членное гетероароматическое кольцо.
[0027] В других вариантах осуществления изобретения, каждый R2 независимо представляет собой F, этинил, пропинил, ORb, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,  или
или  , и где каждый этинил, пропинил, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,
, и где каждый этинил, пропинил, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,  и
и  независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
[0028] В других вариантах осуществления изобретения, X имеет одну из следующих подформул:

где Rw, s и V' соответствуют определениям в данном документе.
[0029] В других вариантах осуществления изобретения, А представляет собой С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензол, нафталин, фуран, бензофуран, пиррол, пиридин, пиразол, имидазол, бензоимидазол, триазол, тетразол, оксазол, оксадиазол, 1,3,5-триазин, тиазол, тиофен, бензотифен, пиразин, пиридазин, пиримидин, индол, пурин, хинолин или изохинолин.
[0030] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (III) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n и Rw соответствуют определениям в данном документе.
[0031] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (IV) или или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,
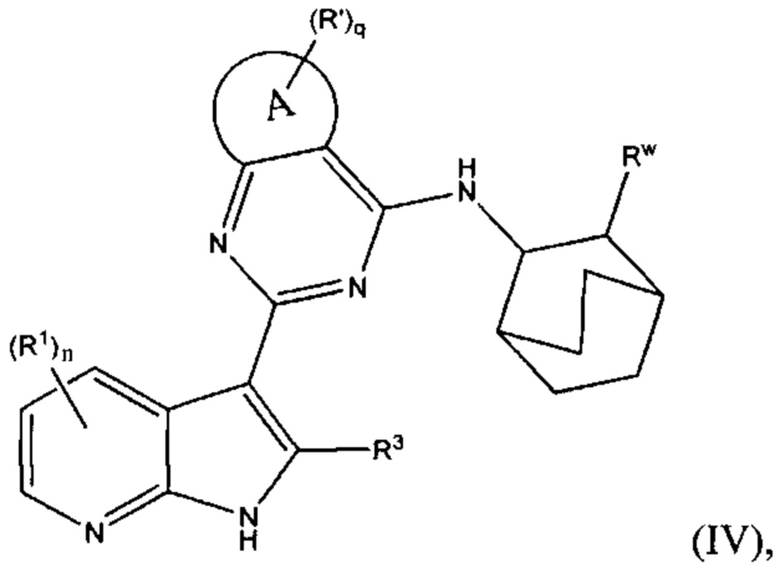
где A, R1, R3, R', n, q и Rw соответствуют определениям в данном документе.
[0032] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (V) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n и Rw соответствуют определениям в данном документе.
[0033] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (VI) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, R', n, q и Rw соответствуют определениям в данном документе.
[0034] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (VII) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n, s, V' и Rw соответствуют определениям в данном документе.
[0035] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (VIII) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, R', n, q, s, V' и Rw соответствуют определениям в данном документе.
[0036] Согласно одной особенности настоящего изобретения, предложена фармацевтическая композиция, содержащая предложенное в настоящем изобретении соединение.
[0037] В определенных вариантах осуществления изобретения предложенная фармацевтическая композиция, дополнительно включает фармацевтически приемлемый наполнитель, адъювант, носитель или их комбинацию.
[0038] В определенных вариантах осуществления изобретения, предложенная фармацевтическая композиция, дополнительно включает один или несколько терапевтических агентов.
[0039] В других вариантах осуществления изобретения, терапевтический агент, предложенный в настоящем изобретении, является противогриппозным агентом или противогриппозной вакциной.
[0040] В других вариантах осуществления изобретения фармацевтическая композиция имеет форму жидкости, твердого вещества, полутвердого вещества или аэрозоля.
[0041] В других вариантах осуществления изобретения предложенная фармацевтическая композиция, отличается тем, что терапевтический агент является амантадином, ремантадином, осельтамивиром, занамивиром, перамивиром, ланинамивиром, ланинамивира октаноатом гидратом, фавипиравиром, арбидолом, рибавирином, стахифлином, ингавирином, флудазой, веществом с номерами CAS1422050-75-6, JNJ-872, AL-794, противогриппозной вакциной vaccine (FluMist Quadrivalent®, Fluarix® Quadrivalent, Fluzone® Quadrivalent, Flucelvax® или FluBlok®) или их комбинацией.
[0042] Другой особенностью настоящего изобретения является использование соединения или фармацевтической композиции, предложенной в настоящем изобретении, для производства лекарственного средства для профилактики, контроля, лечения или уменьшения тяжести нарушения или заболевания, вызванного вирусной инфекцией у пациента.
[0043] В определенных вариантах осуществления изобретения вирусная инфекция, предложенная в настоящем изобретении, является вирусным гриппом.
[0044] Другой особенностью настоящего изобретения является использование соединения или фармацевтической композиции, предложенной в настоящем изобретении, для производства лекарственного средства для ингибирования РНК-полимеразы вируса гриппа.
[0045] Другой особенностью настоящего изобретения является соединение или фармацевтическая композиция, предложенные в настоящем изобретении, для использования при профилактике, контроле, лечении или уменьшении тяжести нарушения или заболевания, вызванного вирусной инфекцией.
[0046] В определенных вариантах осуществления изобретения вирусная инфекция, предложенная в настоящем изобретении, является вирусным гриппом.
[0047] Другой особенностью настоящего изобретения является соединение или фармацевтическая композиция, предложенные в настоящем изобретения, для использования при ингибировании РНК-полимеразы вируса гриппа.
[0048] Другой особенностью настоящего изобретения является способ профилактики, контроля, лечения или уменьшения тяжести нарушения или заболевания, вызванного вирусной инфекцией у пациента, включающий введение пациенту в терапевтически эффективном количестве соединения или фармацевтической композиции, предложенной в настоящем изобретении.
[0049] В определенных вариантах осуществления изобретения вирусная инфекция, предложенная в настоящем изобретении, является вирусным гриппом.
[0050] Другой особенностью настоящего изобретения является способ ингибирования РНК-полимеразы вируса гриппа у пациента, включающий введение пациенту в терапевтически эффективном количестве соединения или фармацевтической композиции, предложенной в настоящем изобретении.
[0051] Все стереоизомеры, геометрические изомеры, таутомеры, сольваты, гидраты, метаболиты и фармакологически приемлемые пролекарства соединений, предложенных в настоящем изобретении, входят в объем изобретения.
[0052] В одном варианте осуществления изобретения солью является фармацевтически приемлемая соль. Фраза «фармацевтически приемлемый» означает, что вещество или композиция должны быть химически и/или токсикологически совместимы с другими ингредиентами, содержащимися в композиции, и/или с млекопитающим, которого ими лечат.
[0053] В другом варианте осуществления изобретения соли не обязательно являются фармацевтически приемлемыми солями, и могут использоваться в качестве промежуточного вещества для приготовления и/или очистки соединений по настоящему изобретению и/или для разделения энантиомеров соединений по настоящему изобретению.
[0054] Кроме того, предложенные в настоящем изобретении соединения, включая их соли, могут быть также получены в форме гидратов или включать другие растворители, используемые для их кристаллизации. Соединения по настоящему изобретению могут по своей природе или в соответствии с замыслом образовывать сольваты с фармацевтически приемлемыми растворителями (включая воду); таким образом, предполагается, что изобретение охватывает как сольватированные, так и несольватированные формы.
[0055] В другом варианте осуществления изобретения предложенное в настоящем изобретении соединение может включать несколько асимметричных центров и поэтому существовать в форме описанной в общем виде рацемической смеси. Кроме того, это означает, что вся рацемическая смесь, части рацемической смеси и энантиомер, и диастероизмеры, очищенные путем разделения, образуют часть настоящего изобретения.
[0056] Предложенные в настоящем изобретении соединения могут существовать в форме возможных изомеров, включая ротамеры, атропизомеры, таутомеры или их смесь. Это означает, что смеси изомеров, включая ротамеры, атропизомеры, таутомеры, части смесей изомеров, ротамеров, атропизомеров, таутомеров и изомеры, включая ротамеры, атропизомеры, таутомеры, очищенные путем разделения, образуют часть настоящего изобретения.
[0057] Согласно другой особенности изобретения соединения по изобретению включают изотопно обогащенные соединения, предложенные в настоящем изобретении, например, те, в которых присутствуют радиоактивные изотопы, такие как 3Н, 14С и 18F, или те, в которых присутствуют нерадиоактивные изотопы, такие как 2Н и 13С.
[0058] Другой особенности настоящего изобретения является предложенный способ получения, разделения или очистки соединения по формуле (I).
[0059] Вышеизложенное лишь обобщает определенные особенности, предложенные в настоящем изобретении, не имея в виду ограничения. Ниже эти особенности и варианты осуществления изобретения описаны более полно.
Подробное описание изобретения. Определения и общая терминология
[0060] Далее будут приведены ссылки на определенные варианты осуществления изобретения, примеры которых проиллюстрированы прилагаемыми структурами и формулами. Подразумевается, что изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения, как определено в формуле изобретения. Специалисту в данной области известны многие способы и материалы, аналогичные или эквивалентные описанным в данном документе, которые могут быть использованы при практическом осуществлении настоящего изобретения. Настоящее изобретение не ограничивается изложенными в данном документе способами и материалами. В случае, если один или несколько из включенных литературных ссылок, патентов и аналогичных материалов отличается от или противоречит данной заявке, включая, в частности, определенные термины, использование терминов, описанные приемы и т.п., преимущественную силу имеет настоящая заявка.
[0061] Далее следует принять во внимание, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления изобретения, могут быть представлены также совместно в одном варианте. И наоборот, разнообразные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления изобретения, могут быть представлены отдельно или в любой подходящей подкомбинации.
[0062] Все технические и научные термины, использованные в данном документе, имеют такое значение, какое обычно понимается специалистами в области, к которой относится изобретение, если не указано иное. Все патенты и публикации, на которые имеются ссылки в данном документе, полностью включены в изобретение посредством ссылки.
[0063] В контексте данного документа будут применяться следующие определения, если не указано иное. В целях предложенного изобретения химические элементы обозначены в соответствии с Периодической таблицей элементов, версия CAS, и Справочником по химии и физике, 75-й выпуск, 1994. Дополнительно общие принципы органической химии описаны в публикациях авторов Томаса Соррел с сотр. «Органическая химия», Юниверсити Сайнс Букс, Саусалито: 1999, и Майкл Б. Смит с сотр. «Марч: Высшая органическая химия», Джон Уайли энд Санс, Нью-Йорк: 2007 (Thomas Sorrell et al., "Organic Chemistry", University Science Books, Sausalito: 1999, и Michael B. Smith et al., "March's Advanced Organic Chemistry", John Wiley & Sons, New York: 2007), все эти публикации полностью включены в данный документ посредством ссылок.
[0064] В контексте данного документа термин «субъект» относится к животному. Как правило, животным является млекопитающее. Термин «субъект» относится также, например, к приматам (в частности, к людям), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и т.п. В определенных вариантах осуществления изобретения субъектом является примат. В других вариантах осуществления изобретения субъектом является человек.
[0065] В данном изобретении термин «субъект» может применяться взаимозаменяемо с термином «пациент». Термин «субъект» и «пациент» относятся в животным (в частности, птицам, таким как курица, куропатка или индейка, или млекопитающим), особенно млекопитающим, включая не принадлежащих к отряду приматов (крупный рогатый скот, свиньи, лошади, овцы, кролики, морские свинки, крысы, собаки, кошки и мыши) и приматам (в частности, обезьяны, шимпанзе и люди) и в особенности к людям. В некоторых вариантах осуществления изобретения субъектом является животное, отличное от человека, (в частности, лошади, крупный рогатый скот, свиньи или овцы) или домашние животные (в частности, собаки, кошки, морские свинки или кролики). В некоторых других вариантах осуществления изобретения термин "пациент» относится к человеку.
[0066] Любая формула в данном изобретении относится также к изотопно обогащенным формах и также к изотопно обогащенным формам соединений. Изотопно обогащенные соединения имеют структуры, соответствующие формулам, представленным в данном документе, за исключением того, что один или несколько атомов у изотопно обогащенного соединения замещены атомом с определенной атомной массой или массовым числом. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают водород, углерод, азот, кислород, фосфор, серу, фтор и хлор, такие как 2Н, 3Н, 13С, 14С, 15N, 16O, 17O, 31Р, 32Р, 36S, 18F и 37Cl, соответственно.
[0067] Соединения, предложенные в настоящем изобретении и содержащие изотопы, описанные выше или другие изотопы атомов, и их фармацевтические соли, включены в объем настоящего изобретения. Определенные изотопно-меченые соединения по настоящему изобретению, например, с включенными радиоактивными изотопами, такими как 3Н или 14С, используются в анализах распределения лекарственного вещества и/или субстрата в тканях. Благодаря легкому получению и обнаружению изотопы, например, тритированные, т.е. 3Н, и углерод-14, т.е. 14С, являются предпочтительными. Далее замещение более тяжелыми изотопами, в частности, дейтерием (т.е. 2Н или D) может обеспечивать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенный период полувыведения in vivo или потребность в сниженной дозе, или улучшенный терапевтический индекс. Таким образом, в некоторых случаях более тяжелые изотопы могут быть более предпочтительными.
[0068] Используемые в настоящем документе стереохимические определения и обозначения, в целом, соответствуют используемым в публикациях под ред. С.П. Паркера Словарь химических терминов Магроу-Хилл (1984) Макгроу-Хилл Бук Компани, Нью-Йорк; и Элиел И. и Уайлен С. «Стереохимия органических соединений», Джон Уайли энд Санс, Инк., Нью-Йорк, 1994 (S.P. Parker, Ed., McGraw-Hill  of Chemical Terms (1984), McGraw-Hill Book Company, New York; и Eliel, E. и Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994). Предложенные в изобретении соединения могут включать асимметрические или хиральные центры и, таким образом, существовать в разных стереоизомерных формах. Это означает, что все стереоизомерные формы предложенных в изобретении соединений, включая помимо прочего диастереоизомеры, энантиомеры и атропизомеры, и также их смеси, такие как рацемические смеси, являются частью настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е. обладают способностью вращать плоскость плоско-поляризованного света. При описании оптических активных соединений для обозначения абсолютной конфигурации молекулы относительного ее хирального центра(-ов), используются префиксы D и L, или R и S. Префиксы d и l или (+) и (-) применяются для обозначения признака вращения соединением плоско-поляризованного света, при этом (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Конкретный стереоизомер может быть назван энантиомером, и смесь таких стереоизомеров называют энантиомерной смесью. Конкретный стереоизомер обозначают, как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 называют рацемической смесью или рацематом, такое возможно в случае отсутствия стереоселективности или стереоспецифичности при химической реакции или процессе.
of Chemical Terms (1984), McGraw-Hill Book Company, New York; и Eliel, E. и Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994). Предложенные в изобретении соединения могут включать асимметрические или хиральные центры и, таким образом, существовать в разных стереоизомерных формах. Это означает, что все стереоизомерные формы предложенных в изобретении соединений, включая помимо прочего диастереоизомеры, энантиомеры и атропизомеры, и также их смеси, такие как рацемические смеси, являются частью настоящего изобретения. Многие органические соединения существуют в оптически активных формах, т.е. обладают способностью вращать плоскость плоско-поляризованного света. При описании оптических активных соединений для обозначения абсолютной конфигурации молекулы относительного ее хирального центра(-ов), используются префиксы D и L, или R и S. Префиксы d и l или (+) и (-) применяются для обозначения признака вращения соединением плоско-поляризованного света, при этом (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Конкретный стереоизомер может быть назван энантиомером, и смесь таких стереоизомеров называют энантиомерной смесью. Конкретный стереоизомер обозначают, как энантиомер, и смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров в соотношении 50:50 называют рацемической смесью или рацематом, такое возможно в случае отсутствия стереоселективности или стереоспецифичности при химической реакции или процессе.
[0069] В зависимости от выбора исходных материалов и процедур соединения могут быть представлены в форме одного или одного из возможных стереоизомеров или их смесей, таких как рацематы и смеси диастереоизомеров, в зависимости от количества асимметричных атомов углерода. Оптически активные (R)- и (S)-изомеры могут быть получены при использовании хиральных синтонов или хиральных реагентов или разделены с помощью общепринятых методов. Если соединение содержит двойную связь, заместитель может иметь Е или Z конфигурацию. Если соединение содержит двузамещенную циклоалкильную группу, циклоалкильный заместитель может иметь цис- или транс-конфигурацию.
[0070] Предложенные в настоящем изобретения соединения могут включать асимметричные или хиральные центры, и поэтому существовать в разных стереоизомерных формах. Это означает, что все стерео изомерные формы предложенных в изобретении соединений, включая, в частности, диастереоизомеры, энантиомеры, атропизомеры и геометрические (конформационные) изомеры, и также их смеси, например, рацемические смеси, являются частью настоящего изобретения.
[0071] Описанные в настоящем изобретении формула также включает все ее измомерные формы (такие как энантиомеры, диастереоизомеры, атропизомеры и геометрические (конформационные) изомеры; такие как все (R)- и (S)-изомеры, (Z) и (Е) изомеры вокруг двойной связи, (Z) и (Е) конформационные изомеры, если не указано иное. Таким образом, отдельные стереохимические изомеры и также энантиомерные, диастереоизомерные смеси и смеси геометрических изомеров соединений по настоящему изобретению, входят в объем предложенного изобретения.
[0072] Термин «таутомер» или «таутомерная форма» относится к структурным изомерам с различной энергией, которые являются взаимопревращаемыми с низким энергетическим барьером. В тех случаях, когда возможна таутомеризация (например, в растворе), может достигаться химическое равновесие таутомеров. Например, протонные таутомеры (называемые также прототропными таутомерами) включают взаимопревращения посредством миграции протона, такие как кето-енольная и имин-энаминная изомеризация. Таутомеры валентности включают взаимные превращения посредством реорганизации некоторых связывающих электронов. Отдельным примером кето-енольной таутомеризации является взаимное превращение таутомеров пентан-2,4-диона и 4-гидроксипент-3-ен-2-она. Другим примером таутомеризации является кето-фенольная таутомеризация. Конкретным примером кето-фенольной таутомерии являются пиридин-4-ол и пиридин-4(1H)-он. Все таутомерные формы соединений по настоящему изобретению входят в объем изобретения, если не указано иное.
[0073] Термин «N-оксид» относится к одному или нескольким атомам азота, окисленным с образованием N-оксида, где соединение включает несколько функциональных аминных групп. Частными примерами N-оксидов являются N-оксиды третичного амина или атом азота в азот-содержащем гетероцикле. N-оксиды могут быть получены при обработке соответствующего амина окисляющим веществом, таким как пероксид водорода или перкислота (например, пероксикарбоновая кислота) (См. публикацию Высшая органическая химия, Джерри Марч, 4-е издание, Уайли Интерсайнс, стр. (Advanced Organic Chemistry, by Jerry March, 4th Edition, Wiley Interscience). Более конкретно, N-оксиды могут быть получены при использовании процедуры L.W. Deady (Syn. Comm. 1977, 7, 509-514) в соответствии с которой аминное соединение взаимодействует с м-хлорпероксибензойной кислотой (МСРВА), например, в инертном растворителе, таком как дихлорметан.
[0074] Термин «сольват» относится к ассоциации или комплексу одной или нескольких сольватных молекул и соединению, предложенному в изобретении. Не имеющие ограничительного характера примеры растворителей, образующих сольваты, включают воду, изопропанол, этанол, метанол, диметилсульфоксид, этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, в котором молекулой растворителя является вода.
[0075] «Метаболит» - это продукт, образовавшийся в результате метаболизма в организме указанного соединения или его соли. Метаболиты соединения могут быть идентифицированы при использовании стандартных приемов, известных специалисту, и их активность определяют при использовании испытаний, таких как описанные в настоящем документе. Такие продукты могут образовываться, например, в результате окисления, восстановления, гидролиза, амидирования, деамидирования, этерификации, де-этерификации, ферментативного гидролиза и т.п. введенного соединения. Соответственно, изобретение включает метаболиты предложенных в настоящем документе соединений, в т.ч. метаболиты, полученные при контакте в течение достаточного периода времени предложенного в изобретении соединения с млекопитающим.
[0076] Термин «фармацевтически приемлемые соли» относится к органическим или неорганическим солям предложенного в настоящем изобретении соединения. Фармацевтически приемлемые соли хорошо известны специалистам. Например, S.М. Berge et al., подробно описывает фармацевтически приемлемые соли в публикации в журнале J. Pharmaceutical Sciences, 1977, 66: 1-19, включенной в настоящее изобретение в форме ссылки. Некоторые неисчерпывающие примеры фармацевтически приемлемых и нетоксичных солей включают соли аминогрупп, образовавшиеся при взаимодействии с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота и малоновая кислота, или при использовании других методов, применяемых в данной области, например, ионного обмена. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, соль камфановой кислоты, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малонат, лактобионат, лактат, лаурат метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, стеарат, тиоцианат, p-толуолсульфонат, ундеканоат, соли валериановой кислоты и т.п. Соли, полученные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+(С1-4алкил)4. Настоящее изобретение также предусматривает кватернизацию любых основных азот-содержащих групп соединения, предложенного в изобретении. При такой кватернизации могут быть получены продукты растворимые или диспергируемые в воде или масле. Типичные соли щелочных или щелочноземельных металлов включают натрий, литий, калий, кальций, магний и т.п. Далее, фармацевтически приемлемые соли включают, при необходимости, нетоксичные катионы аммония, четвертичного аммония и амины, образовавшиеся при использовании противоионов, таких как галид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, C1-8 сульфонат или арил сульфонат.
[0077] Термин «пролекарство» относится к соединению, которое превращается in vivo в соединение по формуле (I). Такое превращение может осуществляться в результате, например, гидролиза пролекарства в крови или ферментативного превращения исходной формы в крови или тканях. Пролекарствами соединений, предложенных в настоящем изобретении, могут быть, например, сложные эфиры. Некоторыми распространенными сложными эфирами, которые были использованы в качестве пролекарств, являются фениловые эфиры, сложные эфиры алифатических кислот (С1-24), ацилоксиметиловые эфиры, карбонаты, карбаматы и эфиры аминокислот. Например, соединение, предложенное в изобретении и содержащее гидроксильную группу, может быть ацилировано в этом положении его пролекарственной формы. Другие пролекарственные формы включают фосфаты, такие как фосфатные соединения, полученные в результате фосфатирования гидроксильной группы исходного соединения. Всестороннее обсуждение пролекарств представлено в публикации Т. Хигучи и В. Стелла Пролекарства, как инновационные системы доставки, Том 14 серии Симпозиум А.К.С., под редакцией Эдварда Б. Рош, Биообратимые носители в разработке лекарственных средств, Американская фармацевтическая ассоциация и Пергамон Пресс, 1987, Дж. Рауцио с сотр. Пролекарства: разработка и клиническое применение, Nature Review Drug  , 2008, 7, 255-270, и С.Дж. Хекер с сотр., Пролекарства, представляющие собой фосфаты и фосфонаты, Journal of
, 2008, 7, 255-270, и С.Дж. Хекер с сотр., Пролекарства, представляющие собой фосфаты и фосфонаты, Journal of  Chemistry, 2008, 51, 2328-2345 (Т. Higuchi и V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, Edward B. Roche, ed.,
Chemistry, 2008, 51, 2328-2345 (Т. Higuchi и V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, Edward B. Roche, ed.,  Carriers in Drug Design, American Pharmaceutical Association и Pergamon Press, 1987, J. Rautio et al., Prodrugs: Design и Clinical Applications, Nature Review Drug
Carriers in Drug Design, American Pharmaceutical Association и Pergamon Press, 1987, J. Rautio et al., Prodrugs: Design и Clinical Applications, Nature Review Drug  , 2008, 7, 255-270, и S.J. Hecker et al., Prodrugs of Phosphates и Phosphonates, Journal of
, 2008, 7, 255-270, и S.J. Hecker et al., Prodrugs of Phosphates и Phosphonates, Journal of  Chemistry, 2008, 51, 2328-2345), все эти публикации полностью включены в настоящее изобретение в форме ссылки.
Chemistry, 2008, 51, 2328-2345), все эти публикации полностью включены в настоящее изобретение в форме ссылки.
[0078] Любой асимметричный атом (в частности, углерода и т.п.) в молекуле предложенных в настоящем изобретении соединений может быть представлен в рацемической или энантиомерно обогащенной форме, например, (R)-, (S)- или (R,S)-конфигурации. В определенных вариантах осуществления изобретения каждый асимметричный атом обладает не менее чем 50% энантиомерной чистотой, не менее чем 60% энантиомерной чистотой, не менее чем 90% энантиомерной чистотой, не менее чем 95% энантиомерной чистотой не менее чем 99% энантиомерной чистотой в (R)- или (S)-конфигурации. Если соединение содержит двойную связь, заместитель может иметь цис-(Т) или транс-(Е) конфигурацию.
[0079] Таким образом, как описано в изобретении, предложенное в изобретении соединение может существовать в форме любого возможного изомера, таких как ротамер, атропизомер, таутомер или их в форме их смеси, т.е. практически чистого геометрического (цис- или транс-) изомера, диастереоизомера, оптического изомера, (энантиомера), рацемата или их смеси.
[0080] Любые полученные в результате смеси стереоизомеров могут быть разделены на основании физико-химических различий их составных частей, на чистые или практически чистые геометрические изомеры, оптические изомеры, диастереоизомеры, рацематы, например, методами хроматографии и/или фракционной кристаллизации.
[0081] Любые полученные в результате рацематы конечных или промежуточных продуктов могут быть разделены на оптические антиподы при использовании известных специалисту методов, например, посредством разделения их диастереомерных солей. Рацемические продукты могут быть разделены также с помощью хиральной хроматографии, например, высокоэффективной жидкостной хроматографии (ВЭЖХ) при использовании хирального адсорбента. Предпочтительные энантиомеры могут быть получены также методами асимметричного синтеза. См. например, публикации Джекес с сотр., Энантиомеры, рацематы и их разделение (Уайли Интерсайнс, Нью-Йорк, 1981), Принципы асимметричного синтеза (2-е издание, Роберт И. Гоули, Джеффри Обе, Эльзевир, Оксфорд, Соединенное Королевство, 2012), Илайел И.Л., Стереохимия соединений углерода (Макгроу-Хилл, Нью-Йорк, 1962); Уайлен С.Х. Таблицы разделяющих веществ и оптическое разделение, стр. 268 (под ред. И.Л. Илайел, Университет Нотр-Дам Пресс, Нотр-Дам, Индия 1972 (Jacques, et ah, Enantiomers, Racemates и Resolutions (Wiley Interscience, New York, 1981); Principles of Asymmempuc Synthesis (2nd Ed. Robert E. Gawley, Jeffrey  , Elsevier, Oxford, UK, 2012); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen, S.H. Tables of Resolving Agents и Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972)).
, Elsevier, Oxford, UK, 2012); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen, S.H. Tables of Resolving Agents и Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972)).
[0082] Как описано в настоящем документе, предложенные в настоящем изобретении соединения могут быть при необходимости замещены одним или несколькими заместителями, такими как проиллюстрированы в общем виде ниже или приведены в качестве примеров с указанием конкретных классов, подклассов и видов. Следует иметь в виду, что фраза «при необходимости замещены» используется взаимозаменяемо с фразой «замещенные или незамещенные». Термин «при необходимости» означает, что описанное далее событие или обстоятельство может, но не обязательно должно возникнуть, и что описание включает случаи, в которых событие или обстоятельство возникает, и случаи, в котором оно не возникает. В целом, термин «при необходимости» перед термином «замещен» относится к замене одного или нескольких водородных радикалов в указанной структуре радикалом указанного заместителя. При необходимости замещенная группа может иметь заместитель в каждом замещаемом положении группы, если не указано иное. Если в указанной структуре замещение возможно в нескольких положениях несколькими заместителями, выбранными из заданной группы, в каждом положении может быть один и тот же заместитель, или могут быть разные заместители. Заместителями, описанными в настоящем документе, могут быть, в частности, F, Cl, Br, CN, N3, ОН, NH2, NO2, оксо (=O), -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, -S(=O)2Re, -S(=O)2NRcC(=O)Ra, -S(=O)2NRcRd, (RbO)2P(=O)-C0-2 алкилен, ORb, -NRcRd, RbO-C1-4 алкилен, RdRcN-C1-4 алкилен, C1-6 алкил, С1-6 алифатический радикал, C1-6 галоалкил, C1-6 алкокси, C1-6 алкиламино, С2-6 алкенил, С2-6 алкинил, С3-8 циклоалкил, С3-8 циклоалкил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 14-членный гетероарил или (от 5- до 14-членный гетероарил)-С1-4 алкилен, где Ra, Rb, Rc, Rd и Re соответствуют определениям в данном документе.
[0083] Далее, необходимо разъяснить, что фразу «каждый … независимо» и «каждый (из) … и … независимо» следует понимать широко, если не указано иное. Конкретные варианты, выраженные одним и тем же символом, не зависят друг от друга в разных группах; или конкретные варианты, выраженные одним и тем же символом, не зависят друг от друга в одних и тех же группах.
[0084] В разных местах настоящего описания изобретения предложены заместители соединений по настоящему изобретению, в группах или с указанием диапазонов. Это означает конкретно, что изобретение включает все и каждую отдельную субкомбинацию членов таких групп и диапазонов. Например, термин «C1-6 алкил» конкретно означает, что в изобретении отдельно предложены метил, этил, С3-алкил, С4-алкил, C5-алкил, и С6-алкил.
[0085] В разных местах настоящего описания изобретения описаны связующие заместители. Если структура явно требует связующей группы, то очевидно, что связующими группами являются переменные Маркуша, перечисленные для этой группы. Например, если структура требует связующей группы, и определение группы Маркуша для такой группы включает «алкил» или «арил», то очевидно, что «алкил» или «арил» представляет собой связующую алкиленовую группу или ариленовую группу, соответственно.
[0086] Термин «алкильная» или «арильная» группа относится к насыщенному линейному разветвленному одновалентному углеводородному радикалу, состоящему из 1-20 атомов углерода. Алкильная группа содержит от 1 до 20 атомов углерода, если не указано иное. В некоторых вариантах осуществления изобретения алкильная группа содержит от 1 до 10 атомов углерода. В других вариантах осуществления изобретения алкильная группа содержит от 1 до 9 атомов углерода. В других вариантах осуществления изобретения алкильная группа содержит от 1 до 8 атомов углерода. В других вариантах осуществления изобретения алкильная группа содержит от 1 до 6 атомов углерода. В иных вариантах осуществления изобретения алкильная группа содержит от 1 до 4 атомов углерода. В дополнительных других вариантах осуществления изобретения алкильная группа содержит от 1 до 3 атомов углерода.
[0087] Некоторые из не имеющих ограничительного характера примеры алкильной группы включают метил (Me, -СН3), этил (Et, -СН2СН3), n-пропил (n-Pr, -СН2СН2СН3), изопропил (i-Pr, -СН(СН3)2), н-бутил (n-Bu, -СН2СН2СН2СН3), изобутил (i-Bu, -СН2СН(СН3)2), сек-бутил (s-Bu, -СН(СН3)СН2СН3), трет-бутил (t-Bu, -С(СН3)3), н-пентил (-СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-CH(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), н-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3, н-гептил и н-октил и т.п., где алкильная группа может быть независимо не замещена или замещена одним или несколькими описанными в настоящем документе заместителями.
[0088] Термин «алкил» или префикс «алк-« как прямую, так и разветвленную насыщенную углеродную цепь.
[0089] Термин «алкилен» относится к насыщенной бивалентной углеводородной группе, полученной из прямой или разветвленной цепи насыщенного углеводорода путем удаления двух атомов водорода. Алкиленовая группа содержит 1-10 атомов углерода, если не указано иное. В других вариантах осуществления изобретения алкиленовая группа содержит 1-6 атомов углерода. В дополнительных вариантах осуществления изобретения алкиленовая группа содержит 1-4 атома углерода. В иных вариантах осуществления изобретения алкиленовая группа содержит 1-2 атома углерода. Примером такой алкиленовой группы является метилен (-СН2-), этилен (-СН2СН2-), изопропилен (-СН(СН3)СН2-), и т.п., алкиленовая группа может быть независимо не замещена или замещена одним или несколькими описанными в настоящем документе заместителями.
[0090] Термин «алкенил» относится к линейной или разветвленной цепи одновалентное углеводородного радикала, содержащего от 2 до 12 атомов углерода, или от 2 до 8 атомов углерода, или от 2 до 6 атомов углерода, или от 2 до 4 атомов углерода, в которой имеется, по меньшей мере, один центр ненасыщенности, т.е. углерод-углеродная двойная sp2-связь, где алкенильный радикал может быть независимо не замещен или замещен одним или несколькими описанными в настоящем документе заместителями и включает радикалы, имеющие «цис» и «транс» ориентацию, или альтернативно, «E» и «Z» ориентацию. Примеры алкенильной группы включают, помимо прочего, винил (-СН=СН2), аллил (-СН2СН=СН2) и т.п.
[0091] Термин «алкинил» относится к линейной или разветвленной цепи одновалентно углеводородного радикала, содержащего от 2 до 12 атомов углерода, или от 2 до 8 атомов углерода, или от 2 до 6 атомов углерода, или от 2 до 4 атомов углерода, в котором имеется, по меньшей мере, один центр ненасыщенности, т.е. углерод-углеродная тройная sp-связь, где алкинильный радикал может быть независимо не замещен или замещен одним или несколькими описанными в настоящем документе заместителями. Примеры алкенильной группы включают, помимо прочего, ацетинил (-С≡СН), прпаргил (-СН2С≡СН), 1-пропинил (-C≡С-СН3) и т.п.
[0092] Термин «алкокси» относится к алкильной группе, которая была определена ранее, соединенной с исходным молекулярным фрагментом через атом кислорода. Алкоксигруппа содержит от 1 до 20 атомов углерода, если не указано иное. В некоторых вариантах осуществления изобретения алкоксигруппа содержит 1-10 атомов углерода. В других вариантах осуществления изобретения алкоксигруппа содержит 1-8 атомов углерода. В иных вариантах осуществления изобретения алкоксигруппа содержит 1-6 атомов углерода. В дополнительных вариантах осуществления изобретения алкоксигруппа содержит 1-4 атома углерода, и в других вариантах осуществления изобретения алкоксигруппа содержит 1 -3 атома углерода.
[0093] Некоторые не имеющие ограничительного характера примеры алкоксигруппы включают метокси (МеО, -ОСН3), этокси (EtO, -ОСН2СН3), 1-пропокси (n-PrO, н-пропокси, -ОСН2СН2СН3), 2-пропокси (i-PrO, u-пропокси, -ОСН(СН3)2), 1-бутокси (n-BuO, н-бутокси, -ОСН2СН2СН2СН3), 2-метил-1-пропокси (i-BuO, u-бутокси, -ОСН2СН(СН3)2), 2-бутокси (s-BuO, с-бутокси, -ОСН(СН3)СН2СН3), 2-метил-2-пропокси (t-BuO, m-бутокси, -ОС(СН3)3), 1-пентокси (н-пентокси, -ОСН2СН2СН2СН2СН3), 2-пентокси (-ОСН(СН3)СН2СН2СН3), 3-пентокси (-ОСН(СН2СН3)2), 2-метил-2-бутокси (-ОС(СН3)2СН2СН3), 3-метил-2-бутокси (-ОСН(СН3)СН(СН3)2), 3-метил-1-бутокси (-ОСН2СН2СН(СН3)2), 2-метил-1-бутокси (-ОСН2СН(СН3)СН2СН3) и т.п, где алкоксигруппа независимо не замещена или замещена одним или несколькими описанными в настоящем документе заместителями.
[0094] Термины «галоалкил», «галоалкенил» или «галоалкокси» относятся к алкильной, алкенильной или алкоксигруппе, которые в соответствующих случаях замещены одним или несколькими атомами галогенов. Некоторые не имеющие ограничительного характера примеры «галоалкила», «галоалкенила» или «галоалкоксигруппы» включают трифторметил, трифторметокси и т.п.
[0095] Термины «карбоцикл», «карбоциклил», «карбоциклический» или «карбоциклическое кольцо», используемые взаимозаменяемо в настоящем документе, относятся к кольцу, содержащему от 3 до 14 кольцевых атомов углерода, которое может быть насыщенным или содержать один или несколько центров ненасыщенности. В некоторых вариантах осуществления изобретения количество атомов углерода составляет от 3 до 12; в других вариантах осуществления изобретения количество атомов углерода составляет от 3 до 10; в других вариантах осуществления изобретения количество атомов углерода составляет от 3 до 8; в других вариантах осуществления изобретения количество атомов углерода составляет от 5 до 6; в других вариантах осуществления изобретения количество атомов углерода составляет от 6 до 8. Термин «карбоциклил» включает моноциклическую, бициклическую или полициклическую конденсированную систему, спирокольцевую систему или кольцевую систему с мостиковыми связями, и полициклическая кольцевая система содержит одно карбоциклическое кольцо, конденсированное с одним или несколькими неароматическими карбоциклическими кольцами или гетероциклическим кольцом, или с одним или несколькими ароматическими кольцами или с их комбинацией, где на карбоциклическом кольце находится связующая группа или точка. Бициклические карбоциклильные группы включают бициклический карбоциклил с мостиковыми связями, конденсированный бициклический карбоциклил и спиробициклическую карбоциклильную группу, и конденсированная бициклическая система включает два кольца с двумя общими соседними кольцевыми атомами. Бициклическая система с мостиковыми связями включает два кольца с тремя или четырьмя общими соседними кольцевыми атомами. Спиробициклическая система включает два кольца с одним общим кольцевым атомом. Некоторые не имеющие ограничительного характера примеры карбоциклильной группы включают циклоалкил, циклоалкенил и циклоалкинил. Дополнительные, не имеющие ограничительного характера примеры карбоциклильных групп включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.п. Бициклические карбоциклильные группы с мостиковыми связями включают, в частности, бицикло[2,2,2]октил, бицикло[2,2,1]гептил, бицикло[3,3,1]нонил, бицикло[3,2,3]нонил, и т.п.
[0096] Термин «циклоалкил» относится к насыщенному кольцу, имеющему от 3 до 12 атомов углерода в моноциклической, бициклической или трициклической системе, которая имеет одно или несколько мест соединения с остальной молекулой. В некоторых вариантах осуществления изобретения, циклоалкильная группа содержит от 3 до 10 кольцевых атомов углерода. В других вариантах осуществления изобретения циклоалкилная группа содержит от 3 до 8 атомов углерода. В иных вариантах осуществления изобретения циклоалкильная группа содержит от 3 до 6 атомов углерода. В других дополнительных вариантах осуществления изобретения циклоалкильная группа содержит от 5 до 6 атомов углерода. Циклоалкильный радикал может быть независимо не замещен или замещен одним или несколькими описанными в настоящем документе заместителями.
[0097] Термин «гетероцикл», «гетероциклил» или «гетероциклическое кольцо», используемые взаимозаменяемо в настоящем документе, относятся к насыщенному или частично ненасыщенному неароматическому, бициклическому или трициклическому кольцу, содержащему 3-12 кольцевых атомов, среди которых, по меньшей мере, один кольцевой атом выбирают из азота, серы и кислорода, и среди которых может быть одно или несколько мест соединения с остальной молекулой. Термин «гетероциклил» включает моноциклическую, бициклическую или полициклическую конденсированную, спиросоединенную, с мостиковыми связями гетероциклическую кольцевую систему, и полициклическая кольцевая система включает одно гетероциклическое кольцо, конденсированное с одним или несколькими неароматическими карбоциклическими кольцами или гетероциклическим кольцом, или с одним или несколькими ароматическими кольцами, или с их комбинацией, где на гетероциклическом кольце находится связующая группа или место соединения. Бигетероциклиьный радикал включает бигетероциклил с мостиковыми связями, конденсированный бигетероциклил и спиробигетероциклил. Гетероциклильная группа может быть связана по атому углерода или азота, и -СН2- группа может быть при необходимости замещена -С(=O)-группой, если не указано иное. В которой сера может быть при необходимости окислена до S-оксида и азот может быть при необходимоси окислен до N-оксида. В некоторых вариантах осуществления изобретения гетероциклильная группа представляет собой 3-8-членную моно- или бициклическую гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой от 3- до 6-членную моно- или бициклическую гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 6-8-членную моно- или бициклическую гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 5-6-членную моно- или бициклическую гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 4-членную гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 5-членную гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 6-членную гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 7-членную гетероциклильную группу; в других вариантах осуществления изобретения гетероциклильная группа представляет собой 8-членную гетероциклильную группу.
[0098] Некоторые не имеющие ограничительного характера примеры геетроциклильной группы включают оксиранил, азетидинил, оксетинил, оксетанил, тиетанил, пирролидинил, 2-пирролинил, 3-пирролинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, дигидротиенил 1,3-диоксоланил, дитиоланил, тетрагидропиранил, дигидропиранил, 2H-пиранил, 4H-пиранил, тетрагидротиопиранил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил, диоксанил, дитианил, тиоксанил, гомопиперазинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, индолинил, 1,2,3,4-тетрагидроизохинолил, 1,3-бензодиоксолил, 2-окса-5-азабицикло [2,2,1]гепт-5-ил. Некоторые не имеющие ограничительного характера примеры гетероциклила, отличающегося тем, что -СН2- группа замещена фрагментом -С(=O)-, включают 2-оксопирролидинил, оксо-1,3-тиазолидинил, 2-пиперидинонил, 3,5-диоксопиперидинил, пиримидиндион-ил. Некоторые не имеющие ограничительного характера примеры гетероциклила, отличающегося тем, что кольцевой атом серы окислен, представляют собой сульфоанил и 1,1-диоксо-тиоморфолинил. Некоторые не имеющие ограничительного характера примеры гетероциклила с мостиковыми связями включают 2-оксабицикло[2,2,2]октил, 1-азабицикло[2,2,2]октил, 3-азабицикло[3,2,1]октил и т.п. Гетероциклильная группа может быть при необходимости замещена одним или несколькими описанными в настоящем документе заместителями.
[0099] Термин «мостиковый» относится к связи, атому или неразветвленной цепи атомов, соединяющей две разных части молекулы. Два атома (обычно, но не всегда, два третичных атома углерода), связанные с мостиком «мостиковыми атомами».
[00100] Термин «спиро» относится к кольцевой системе, содержащей один атом, который является единственным общим атомом (обычно четвертичный углерод) между двумя кольцами.
[00101] Термин «n-членный», где n - целое число, обычно описывают, как число кольцеобразующих атомов во фрагменте, где число кольцеобразующих атомов равно n. Например, пиперидил является примером 6-членного гетероциклила и 1,2,3,4-тетрагидро-нафтильная группа является примером 10-членной карбоциклильной группы.
[00102] Термин «гетероатом» относится к кислороду (О), сере (S), азоту (N), фосфору (Р) и кремнию (Si), включая любые окисленные формы азота, серы или фосфора; квартернизированную форму любого основного азота; или замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR (как в N-замещенном пирролидиниле).
[00103] Термин «галоген» относится к фтору (F), хлору (Cl), брому (Br) или иоду (I).
[00104] Термин «азидо» или «N3» относится к азидному фрагменту. Этот радикал может соединяться, например, с метальной группой с образованием азидометана (метилазид, MeN3); или соединяться с фенильной группой с образованием фенилазида (PhN3).
[00105] Термин «арил» используемый отдельно или как большая часть терминов «арилалкил», «арилалкокси», относится к моноциклическим, бициклическим и трициклическим кольцевым системам, содержащим суммарно от шести до четырнадцати кольцевых членов, или от шести до двадцати кольцевых членов, или от шести до десяти кольцевых членов, где, по меньшей мере, одно кольцо в системе является ароматическим, где каждое кольцо в системе содержит от 3 до 7 кольцевых членов, и имеется одна точка или несколько точек соединения с остальной молекулой. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо» или «ароматическое кольцо». Некоторые не имеющие ограничительного характера примеры арильной группы включают фенил, нафтил и антрил. Арильная группа может быть не замещена или замещена одним или несколькими описанными в настоящем документе заместителями.
[00106] Термин «гетероарил» используемый отдельно или как большая часть термино «гетероарилалкил» или «гетероарилалкокси», относится к моноциклической, бициклической и трициклической кольцевым системам, имеющим суммарно от пяти до четырнадцати кольцевых членов, или от пяти до двенадцати кольцевых членов, или от пяти до десяти кольцевых членов, или от пяти до шести кольцевых членов, где, по меньшей мере, одно кольцо в системе является ароматическим, и в которой, по меньшей мере, один кольцевой член выбираю из гетероатома, и где каждое кольцо в системе содержит от 5 до 7 кольцевых членов, и имеется одна точка или несколько точек соединения с остальной молекулой. Гетероарильная группа может быть связанной с углеродом или азотом, и -CH2-группа может быть при необходимости замещена на группу -С(=O)-,если не указано иное. В которой сера может быть при необходимости окислена до S-оксида, и азот может быть при необходимости окислен до N-оксида. Термин «гетероарил» и «гетероароматическое кольцо» или «гетероароматическое соединение» может быть использован взаимозаменяемо в настоящем изобретении. В одном варианте осуществления изобретения гетероарильной группой является 5-12-членный гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранных из О, S и N. В другом варианте осуществления изобретения гетероарильной группой является от 5- до 10-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из О, S и N. В другом варианте осуществления изобретения, гетероарильной группой является 5-6-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из О, S и N. В другом варианте осуществления изобретения гетероарильной группой является 5-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из О, S и N. В другом варианте осуществления изобретения гетероарильной группой является 6-членный гетероарил, включающий 1, 2, 3 или 4 гетероатома, независимо выбранных из О, S и N.
[00107] Некоторые не имеющие ограничительного характера примеры гетероарильной группы включают следующее: моноциклическое кольцо, 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, N-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, пиридазинил (в частности, 3-пиридазинил), 2-тиазолил, 4-тиазолил, 5-тиазолил, тетразолил (в частности, 5H-тетразолил, 2H-тетразолил), триазолил (в частности, 2-триазолил, 5-триазолил, 4H-1,2,4-триазолил, 1H-1,2,4-триазолил и 1,2,3-триазолил), 2-тиенил, 3-тиенил, пиразолил (в частности, 2-пиразолил и 3-пиразолил), изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пиразинил, 1,3,5-триазинил и следующие бициклы, не ограничиваясь перечисленным: бензимидазолил, бензофурил, бензотиофенил, индолил (в частности, 2-индолил), пуринил, хинолинил (в частности, 2-хинолинил, 3-хинолинил, 4-хинолинил), изохинолинил (в частности, 1-изохинолинил, 3-изохинолинил или 4-изохинолинил), оксатианил,  и
и  . Гетероарильная группа при необходимости может быть замещена одним или несколькими заместителями, предложенными в настоящем изобретении.
. Гетероарильная группа при необходимости может быть замещена одним или несколькими заместителями, предложенными в настоящем изобретении.
[00108] Термины «карбокси» или «карбоксильный» при использовании отдельно или с другими терминами, такими как «карбоксиалкил», относятся к -СО2Н. Термин «карбонил», при использовании отдельно или с другими терминами, такими как «аминокарбонил», «ацилокси», означает -(С=O)-.
[00109] Термин «алкиламино» относится к «N-алкиламино» и «N,N-диалкиламино», где аминогруппы независимо замещены одним алкильным радикалом или двумя алкильными радикалами, соответственно. В некоторых вариантах осуществления изобретения алкиламиногруппой является низкая алкиламиногруппа, в которой одна или две C1-6 алкильные группы соединены с атомом азота. В других вариантах осуществления изобретения алкиламиногруппой является низшая C1-3 алкиламиногруппа. Подходящим алкиламинным радикалом может быть моноалкиламино или диалкиламино. Примеры алкиламинных радикалов включают, помимо прочего, N-метиламино, N-этиламино, N,N-диметиламино, N,N-диэтиламино и т.п.
[00110] Термин «ариламино» относится к аминогруппе, замещенной одним или двумя арильными группами. Некоторые не имеющие ограничительного характера примеры такой группы включают N-фениламиногруппу. В некоторых вариантах осуществления изобретения арильная группа ариламиногруппы может быть дополнительно замещена.
[00111] Термин «аминоалкил» относится к С1-10 линейной или имеющей разветвленную цепь алкильной группе, замещенной одной или несколькими аминогруппами. В некоторых вариантах осуществления изобретения аминоалкилом является низший C1-6 аминоалкил, замещенный одной или несколькими аминогруппами. Некоторые не имеющие ограничительного характера примеры аминоалкильной группы включают аминометил, аминоэтил, аминопропил, аминобутил и аминогексил.
[00112] В контексте настоящего изобретения связь, прочерченная от заместителя к центру одного кольца кольцевой системы представляет собой замещение заместителей в любом замещаемом положении колец, где кольцевая система включает моно-, би- или полициклическую кольцевую систему. Например, формула а показывает замещение заместителей в любом замещаемом положении бициклической кольцевой системы, включающей кольцо А и кольцо В, т.е. от формулы b-1 до формулы b-8 (formula=формула):



[00113] В контексте настоящего изобретения связь, прочерченная от заместителя к центру одного кольца кольцевой системы представляет собой связь, которая может соединять с остальной молекулой в любом присоединяемом положении на кольцах. Например, формула с показывает замещение заместителей в любом замещаемом положении колец, т.е. формулу d-1 и формулу d-2.
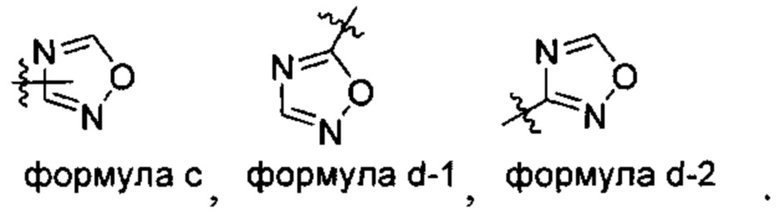
[00114] Термин «ненасыщенный» относится к фрагменту, имеющему один или несколько центров ненасыщенности.
[00115] Предполагается, что термин «содержащий» или «содержать» является неограничивающим, включающим указанный компонент, но не исключающим другим элементы.
[00116] В контексте настоящего изобретения термин «фармацевтически приемлемый носитель» включает любые растворители, диспергирующие среды, покрывающие агенты, поверхностно-активные вещества, антиокислители, консерванты (в частности, противобактериальные агенты), изотонические агенты, соль, стабилизаторы лекарственного вещества, связывающие вещества, диспергирующие агенты, смазывающие вещества, подсластители, вкусовые вещества, красители или их комбинацию, все из которых хорошо известны специалисту (в частности, Ремингтон, Фармацевтические науки, 18-е издание, Мак Принтинг Компани, 1990, стр. 1289-1329; Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329, включены в настоящее изобретение в форме ссылки). За исключением случаев, когда общепринятый носитель несовместим с действующим веществом, фармацевтически приемлемые носители эффективно используются в лечении или в фармацевтических композициях.
[00117] В контексте настоящего изобретения термин «подавление репликации вирусов гриппа» включает, как уменьшение количества вирусной репликации (в частности, уменьшение не менее чем на 10%), так и полное прекращение вирусной репликации (т.е. уменьшение количества вирусной репликации на 100%). В некоторых вариантах осуществления изобретения репликация вирусов гриппа подавлена не менее чем на 50%, не менее чем на 65%, не менее чем на 75%, не менее чем на 85%, не менее чем на 90%, или не менее чем на 95%.
[00118] В контексте настоящего изобретения термин «эффективное количество» относится к количеству, достаточному для того чтобы вызывать желаемый биологический ответ. В настоящем изобретении желаемый биологический ответ заключается в подавлении репликации вируса гриппа, уменьшении количества вирусов гриппа или уменьшения или устранении тяжести, продолжительности, прогрессирования или начала вирусной инфекции, предотвращении распространения вирусного гриппа, предотвращении рецидива, развития, начала или прогрессирования симптома, ассоциированного с вирусным гриппом, усилении или улучшении профилактического или терапевтического эффекта(ов) другой терапии, используемой против заболеваний гриппом. Точное количество вводимого пациенту соединения будет зависеть от способа введения, типа и тяжести инфекции и от характеристик субъекта, таких как общее состояние здоровья, возраст, пол, масса тела и устойчивость к лекарственным средствам. Квалифицированный специалист сможет определить надлежащие дозировки с учетом этих и других факторов. При назначении одновременно с другими противовирусными агентами, например, при назначении одновременно с противогриппозным лекарственным средством, «эффективное количество» второго агента будет зависеть от типа используемого лекарственного средства. Подходящие дозировки одобренных агентов известны и могут быть скорректированы квалифицированным специалистом в соответствии с состоянием субъекта, типом состояния(ий), по поводу которых проводится лечение, и количеством используемого соединения, описанного в настоящем изобретении. В случаях, когда количество явным образом не указано, следует исходить из предположения об эффективном количестве. Например, описанные в настоящем изобретении соединения для терапевтического или профилактического лечения могут быть введены субъекту в диапазоне доз между приблизительно 0,01 и 100 мг/кг массы тела/сутки.
[00119] В контексте настоящего изобретения термины «лечить» и «лечение» относятся и к терапевтическому, и к профилактическому лечению. Например, терапевтическое лечение включает уменьшение или устранение прогрессирования, тяжести и/или продолжительность состояний, опосредованных вирусами гриппа, или улучшением одного или нескольких симптомов (конкретно, одного или нескольких воспринимаемых симптомов) состояний, опосредованных вирусами гриппа, в результате назначения одного или нескольких видов терапии (в частности, одного или нескольких терапевтических агентов, таких как соединение или композиция по настоящему изобретению). В определенных вариантах осуществления изобретения терапевтическое лечение включает улучшение, по меньшей мере, одного измеримого физического параметра состояния, опосредованного вирусом гриппа. В других вариантах осуществления изобретения терапевтическое лечение включает подавление прогрессирования состояния, опосредованного вирусом гриппа, физически, например, путем стабилизации воспринимаемого симптома, либо физиологически, путем, например, стабилизации физического параметра, или обоими способами. В других вариантах осуществления изобретения терапевтическое лечение включает уменьшение или стабилизацию инфекций, опосредованных вирусами гриппа. Противовирусные лекарственные средства могут использоваться в амбулаторных условиях для лечения людей, уже заболевших гриппом, чтобы уменьшить тяжесть симптомов и сократить количество дней с плохим самочувствием.
[00120] Термин «защитная группа» или «PG» относится к заместителю, который обычно применяется для блокирования или защиты определенной функции, взаимодействуя с другими функциональными группами соединения. Например, «амино-защитная группа» - это заместитель, соединенный с аминогруппой, который блокирует или защищает аминную функцию соединения. Подходящие амино-защитные группы включают ацетил, трифторацетил, t-бутоксикарбонил (ВОС, Вос), бензилоксикарбонил (CBZ, Cbz) и 9-флулоренилметиленокси-карбонил (Fmoc). Аналогично, термин «гидрокси-защитная группа» относится к заместителью гидроксигруппы, который блокирует или защищает гидроксильную функцию. Подходящие защитные группы включают ацетил и силил. Термин «карбокси-защитная группа» относится к заместителю карбоксигруппы, который блокирует или защищает карбоксильную функцию. Обычно применяемые карбозащитные группы включают -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этокси-метил, 2-(н-толуолсульфонил)этил, 2-(н-нитрофенилсульфонил)-этил, 2-(дифенилфосфино)-этил, нитроэтил и т.п. Общее описание и использование защитных групп см. в публикации Т.Ц, Грин, Защитные группы в органическом синтезе, Джон Уайли энд Санс, Нью-Йорк, 1991; и П.Дж. Косински, Защитные группы, Тиеме, Штутгарт, 2005 (Т.W. Greene, Protective Groups in organic Synthesis, John Wiley & Sons, New York, 1991; и P.J. Kocienski, Protecting Groups, Thieme, Stuttgart, 2005).
Описание соединений, предложенных в изобретении
[00121] В изобретении предложены новые соединения, используемые в качестве ингибиторов репликации вируса гриппа и РНК-полимеразы вируса гриппа. Эти соединения и содержащие их композиции могут быть использованы в качестве терапевтических агентов для профилактики, контроля, лечения или уменьшения тяжести нарушения или заболевания, вызванного вирусной инфекцией у пациентов.
[00122] Одной особенностью предложенного изобретения является соединение по формуле (I) или его стереоизомер, таутомер, N-оксид, сольват, метаболит, фармацевтически приемлемая соль или пролекарство,
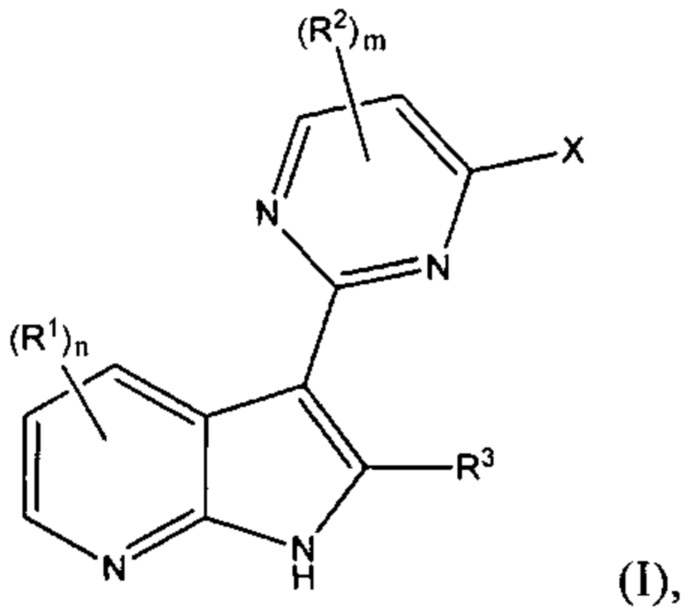
где R1, R2, R3, X, m и n соответствуют определениям в данном документе.
[00123] В определенных вариантах осуществления изобретения, каждый R1 и R3 независимо представляет собой Н, F, Cl, Br, CN, NO2, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, ORb, -NRcRd, RbO-C1-4 алкилен, RdRcN-C1-4 алкилен, C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-8 циклоалкил, С3-8 циклоалкил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил или (от 5- до 10-членный гетероарил)-C1-4 алкилен, где каждый C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-8 циклоалкил, С3-8 циклоалкил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 10-членный гетероарил и (от 5- до 10-членный гетероарил)-С1-4 алкилен независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, ORb, -NRcRd, С1-6 алкила, C1-6 галоалкила, RbO-C1-4 алкилена или RdRcN-C1-4 алкилена;
n равен 0, 1, 2 или 3;
каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-12 карбоциклил, С3-12 карбоциклил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 14-членный гетероарил, (от 5- до 14-членный гетероарил)-С1-4 алкилен; или два соседних R2, вместе с атомами, с которыми они связаны, образуют С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо, и где каждый С2-6 алкинил, С3-12 карбоциклил, С3-12 карбоциклил-С1-4 алкилен, от 3- до 12-членный гетероциклил, (от 3- до 12-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, от 5- до 14-членный гетероарил, (от 5- до 14-членный гетероарил)-С1-4 алкилен, С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо и от 5- до 10-членное гетероароматическое кольцо независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F;
каждый R' независимо представляет собой F, Cl, Br, CN, NO2, оксо (=O), ORb, -NRcRd, RbO-C1-4 алкилен, RdRcN-C1-4 алкилен, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, C1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, 5-6-членный гетероарил или (5-6-членный гетероарил)-С1-4 алкилен, и где каждый С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-С1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-С1-4 алкилен, 5-6-членный гетероарил и (5-6-членный гетероарил)-C1-4 алкилен независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, NO2, ORb, -NRcRd, С1-6 алкила, C1-6 галоалкила, RbO-C1-4 алкилена или RdRcN-С1-4алкилена;
m равен 1 или 2;
X имеет одну из следующих подформул:


где R4 представляет собой Н или C1-6 алкил, и где C1-6 алкил при необходимости замещен одним, двумя, тремя или четырьмя U;
каждый R5, R6, R7 и R8 независимо представляет собой Н или C1-6 алкил; или R5 и R6, совместно с атомом углерода, с которым они связаны, образуют С3-8 циклоалкильную группу, от 3- до 6-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5-до 10-членное гетероароматическое кольцо; или R7 и R8, совместно с атомом азота, с которым они связаны, образуют от 3- до 6-членное гетероциклическое кольцо или от 5- до 10-членное гетероароматическое кольцо, и где каждый C1-6 алкил, С3-8 циклоалкил, от 3-до 6-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя U;
W представляет собой С3-12 карбоциклическое кольцо или от 3- до 12-членное гетероциклическое кольцо;
каждый V и V' независимо представляет собой С3-12 циклоалкановое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо;
каждый Rw независимо представляет собой F, Cl, Br, CN, NO2, оксо (=O), -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, -S(=O)2Re, -S(=O)2NRcC(=O)Ra, -S(=O)2NRcRd, (RbO)2P(=O)-C0-2 алкилен, ORb, -NRcRd, RbO-C1-2 алкилен, RdRcN-C1-2 алкилен, C1-6 алкил, 5-6-членный гетероарил или 5-6-членный гетероциклил, где каждый C1-6 алкил, 5-6-членный гетероарил или 5-6-членный гетероциклил независимо не замещен или замещен одним, двумя, тремя или четырьмя U;
каждый U независимо представляет собой F, Cl, Br, NO2, CN, оксо (=O), N3, ORb, -NRcRd, С1-6 алкил или C1-6 галоалкил;
каждый s и t независимо равен 0, 1, 2 или 3;
р равен 1, 2 или 3; и
каждый Ra, Rb, Rc, Rd и Re независимо представляет собой Н, C1-6 алкил, C1-6 галоалкил, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил, С3-6 циклоалкил-C1-4 алкилен, от 3-до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-С1-4 алкилен, С6-10 арил, С6-10 арил-C1-4 алкилен, от 5- до 10-членный гетероарил, (от 5- до 10-членный гетероарил)-С1-4 алкилен; или Rc и Rd, совместно с атомом азота, с которым они связаны, образуют от 3- до 6-членное гетероциклическое кольцо, и где каждый C1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-6 циклоалкил, С3-6 циклоалкил-C1-4 алкилен, от 3- до 6-членный гетероциклил, (от 3- до 6-членный гетероциклил)-C1-4 алкилен, С6-10 арил, С6-10 арил-C1-4 алкилен, от 5- до 10-членный гетероарил, (от 5- до 10-членный гетероарил)-C1-4 алкилен и от 3- до 6-членное гетероциклическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, CN, ОН, NH2, C1-6 алкила, C1-6 галоалкила, C1-6 алкокси или C1-6 алкиламино.
[00124] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (II) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, X, R', n и q соответствуют определениям в данном документе.
[00125] В других вариантах осуществления изобретения А представляет собой С3-12 карбоциклическое кольцо, от 3- до 12-членное гетероциклическое кольцо, С6-10 ароматическое кольцо или от 5- до 10-членное гетероароматическое кольцо; и
q равен 0, 1, 2, 3, 4 или 5.
[00126] В других вариантах осуществления изобретения, каждый R1 и R3 независимо представляет собой Н, F, Cl, -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, ORb, -NRcRd, С1-3 алкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил или 5-6-членный гетероарил, и где каждый С1-3 алкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил или 5-6-членный гетероарил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, ORb, -NRcRd, С1-3 алкила, C1-3 галоалкила или RbO-C1-2 алкилена.
[00127] В других вариантах осуществления изобретения каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-6 карбоциклил, С3-6 карбоциклил-С1-2 алкилен, 5-6-членный гетероциклил, (5-6-членный гетероциклил)-С1-2 алкилен, фенил, нафтил, фенил-С1-2 алкилен, 5-6-членный гетероарил, (5-6-членный гетероарил)-С1-2 алкилен; или два соседних R2, вместе с атомами, с которыми они связаны, образуют С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо, и где каждый С2-6 алкинил, С3-6 карбоциклил, С3-6 карбоциклил-С1-2 алкилен, 5-6-членный гетероциклил, (5-6-членный гетероциклил)-С1-2 алкилен, фенил, нафтил, фенил-С1-2 алкилен, 5-6-членный гетероарил, (5-6-членный гетероарил)-С1-2 алкилен, С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо и 5-6-членное гетероароматическое кольцо независимо незаметен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
[00128] В других вариантах осуществления изобретения каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, -NRcRd, -C(=O)Ra, -C(=O)NRcRd, С1-9 алкил, C1-3 галоалкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил, фенил-С1-2 алкилен или 5-6-членный гетероарил, где каждый С1-9 алкил, С1-3 галоалкил, С3-6 циклоалкил, 5-6-членный гетероциклил, фенил, фенил-С1-4 алкилен и 5-6-членный гетероарил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, Br, CN, NO2, ORb, -NRcRd, метила, этила, n-пропила или изопропила.
[00129] В других вариантах осуществления изобретения каждый Ra, Rb, Rc, Rd и Re независимо представляет собой Н, метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, C1-3 галоалкил, С3-6 циклоалкил, С3-6 циклоалкил-С1-2 алкилен, от 3- до 6-членный гетероциклил, фенил, фенил-С1-2 алкилен; или Rc и Rd, совместно с атомом азота, с которым они связаны, образуют 5-6-членное гетероциклическое кольцо, и где каждый метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, С3-6 циклоалкил, С3-6 циклоалкил-С1-2 алкилен, от 3- до 6-членный гетероциклил, фенил, фенил-С1-2 алкилен и 5-6-членное гетероциклическое кольцо независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, которые независимо выбирают из F, Cl, CN, ОН, NH2, С1-3 алкила, С1-3 галоалкила или метокси.
[00130] В других вариантах осуществления изобретения X имеет одну из следующих подформул:


где W, V, V', R5, R6, R7, R8, Rw и s соответствуют определениям в данном документе.
[00131] В других вариантах осуществления изобретения, W представляет собой С6-8 карбоциклическое кольцо или 6-8-членное гетероциклическое кольцо.
[00132] В других вариантах осуществления изобретения V представляет собой С3-8 циклоалкановое кольцо, 3-8-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо.
[00133] В других вариантах осуществления изобретения V' представляет собой С3-8 циклоалкановое кольцо, 3-8-членное гетероциклическое кольцо, бензольное кольцо или 5-6-членное гетероароматическое кольцо.
[00134] В других вариантах осуществления изобретения каждый Rw независимо представляет собой F, Cl, Br, CN, NO2, оксо (=O), -C(=O)Ra, -C(=O)ORb, -C(=O)NRcRd, -S(=O)2Re, -S(=O)2NRcC(=O)Ra, -S(=O)2NRcRd, (RbO)2P(=O)-C0-2 алкилен, ORb, -NRcRd, RbO-C1-2 алкилен, RdRcN-C1-2 алкилен, метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, тетразолил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил или пиразолил, и где каждый метил, этил, изопропил, n-пропил, n-бутил, трет-бутил, тетразолил, изоксазолил, оксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил и пиразолил независимо не замещен или замещен одним, двумя, тремя или четырьмя U.
[00135] В других вариантах осуществления изобретения каждый U независимо представляет собой F, Cl, Br, CF3, NO2, CN, оксо (=O), N3, ORb, -NRcRd, метил, этил, изопропил, n-пропил, n-бутил или трет-бутил.
[00136] В других вариантах осуществления изобретения А представляет собой С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензольное кольцо, нафталиновое кольцо или 5-6-членное гетероароматическое кольцо.
[00137] В других вариантах осуществления изобретения каждый R2 независимо представляет собой F, этинил, пропинил, ORb, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,  или
или  , и где каждый этинил, пропинил, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,
, и где каждый этинил, пропинил, С3-6 карбоциклил, 5-6-членный гетероциклил, фенил, нафтил, фенил-С1-2 алкилен, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокстинил,  и
и  независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', при условии, что когда m равен 1, R2 не является F.
[00138] В других вариантах осуществления изобретения X имеет одну из следующих подформул:

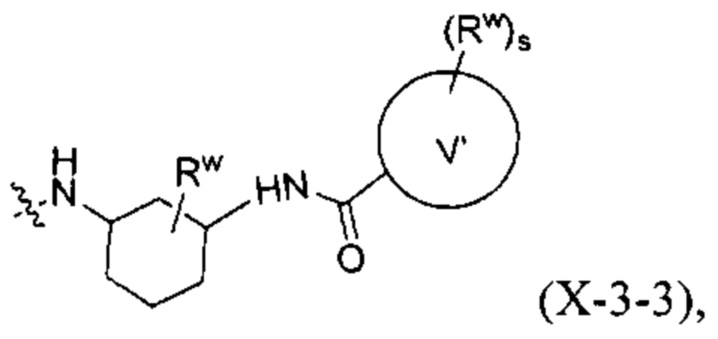
где Rw, s и V' соответствуют определениям в данном документе
[00139] В других вариантах осуществления изобретения А представляет собой С5-6 карбоциклическое кольцо, 5-6-членное гетероциклическое кольцо, бензол, нафталин, фуран, бензофуран, пиррол, пиридин, пиразол, имидазол, бензоимидазол, триазол, тетразол, оксазол, оксадиазол, 1,3,5-триазин, тиазол, тиофен, бензотифен, пиразин, пиридазин, пиримидин, индол, пурин, хинолин или изохинолин.
[00140] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (III) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n и Rw соответствуют определениям в данном документе.
[00141] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (IV) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, R', n, q и Rw соответствуют определениям в данном документе.
[00142] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (V) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n и Rw соответствуют определениям в данном документе.
[00143] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (VI) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, R', n, q и Rw соответствуют определениям в данном документе.
[00144] В других вариантах осуществления изобретения изобретение относится к соединению по формуле (VII) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где R1, R2, R3, m, n, s, V' и Rw соответствуют определениям в данном документе.
[00145] В других вариантах осуществления изобретения, изобретение относится к соединению по формуле (VIII) или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству,

где A, R1, R3, R', n, q, s, V' и Rw соответствуют определениям в данном документе.
[00146] В других вариантах осуществления изобретение относится к соединению с одной из следующих структур, или его стереоизомеру, таутомеру, N-оксиду, сольвату, метаболиту, фармацевтически приемлемой соли или пролекарству, но соединение не ограничивается этими структурами:



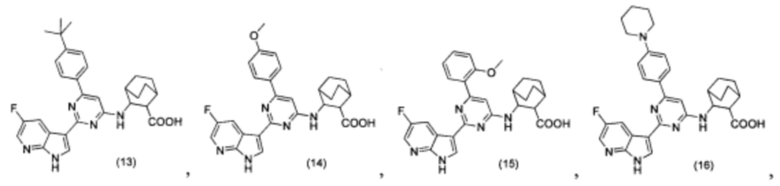




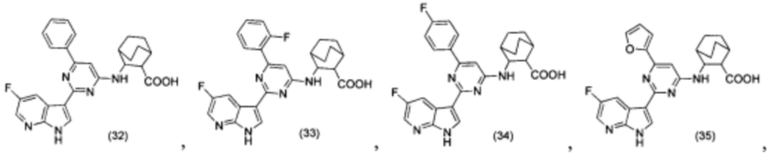
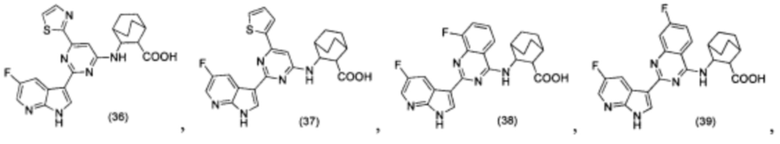

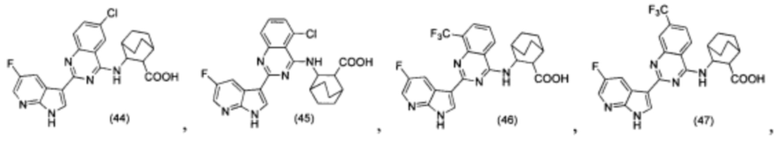

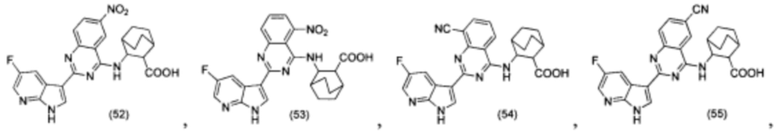



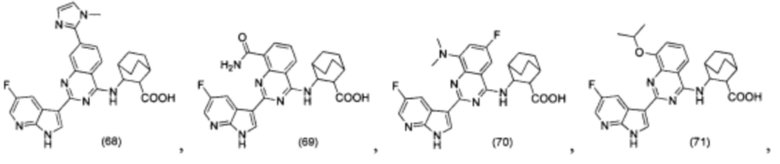










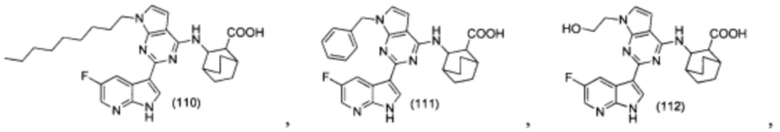


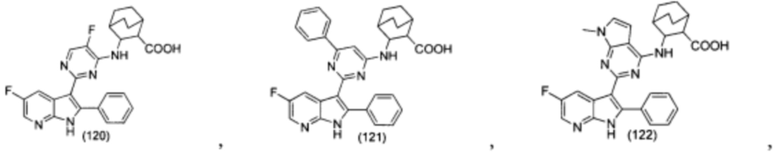


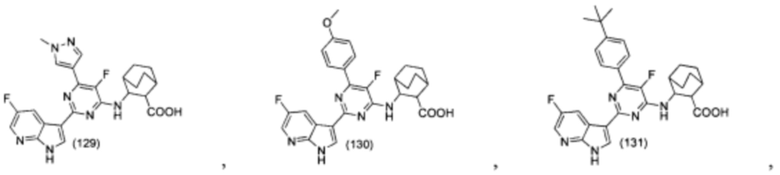


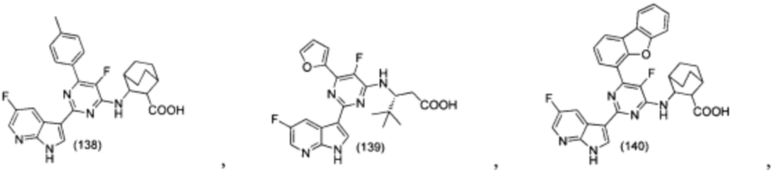
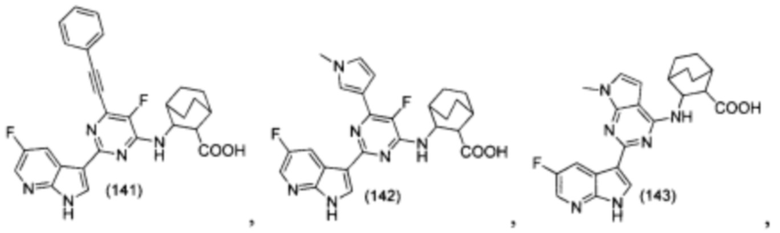





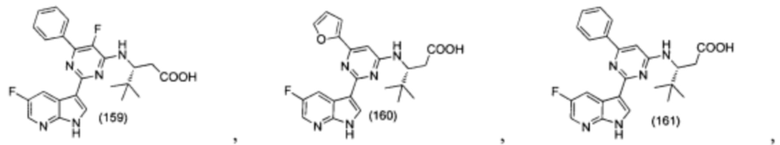
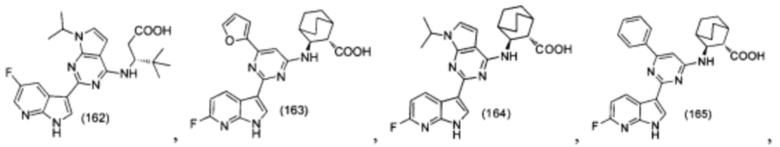
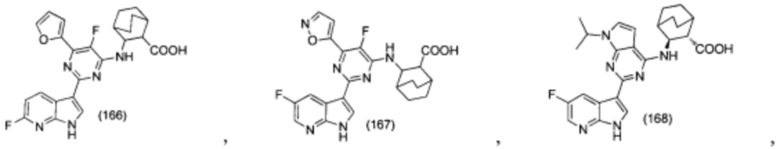

[00147] Одной особенностью настоящего изобретения является фармацевтическая композиция, включающая соединение согласно настоящему изобретению.
[00148] В определенных вариантах осуществления изобретения предложенная фармацевтическая композиция дополнительно включает фармацевтически приемлемый наполнитель, адъювант, носитель или их комбинацию.
[00149] В определенных вариантах осуществления изобретения предложенная фармацевтическая композиция дополнительно включает один или несколько терапевтических агентов.
[00150] В других вариантах осуществления изобретения предложенным терапевтическим агентом являются противогриппозный агент или противогриппозная вакцина.
[00151] В других вариантах осуществления изобретения фармацевтическая композиция имеет форму жидкости, твердого вещества, полутвердого вещества или аэрозоля.
[00152] В других вариантах осуществления изобретения предложенная фармацевтическая композиция отличается тем, что терапевтическим агентом является амантадин, ремантадин, осельтамивир, занамивир, перамивир, ланинамивир, ланинамивира октаноат гидрат, фавипиравир, арбидол, рибавирин, стахифлин, ингавирин, флудаза, вещество с номерами CAS1422050-75-6, JNJ-872, AL-794, противогриппозная вакцина (FluMist Quadrivalent®, Fluarix® Quadrivalent, Fluzone® Quadrivalent, Flucelvax® или FluBlok®) или их комбинация.
[00153] Другой особенностью настоящего изобретения является использование предложенного соединения или фармацевтической композиции в производстве лекарственного средства для профилактики, контроля, лечения или уменьшения тяжести нарушения или заболевания, вызванного вирусной инфекцией у пациентов.
[00154] В определенных вариантах осуществления изобретения вирусная инфекция, предложенная в настоящем изобретении, является вирусным гриппом.
[00155] Другой особенностью предложенного изобретения является использование предложенного соединения или фармацевтической композиции в производстве лекарственного средства для ингибирования РНК-полимеразы вируса гриппа.
[00156] В одном варианте осуществления изобретения солью является фармацевтически приемлемая соль. Фраза «фармацевтически приемлемый» означает, что соединение или композиция должны быть химически и/или токсикологически совместимыми с другими ингредиентами, содержащимися в композиции, и/или с млекопитающим, которого ими лечат.
[00157] В другом варианте осуществления изобретения соли не обязательно являются фармацевтически приемлемыми солями, и могут использоваться в качестве промежуточных веществ для приготовления и/или очистки соединений по настоящему изобретению и/или для разделения энантиомеров соединений по настоящему изобретению.
[00158] При взаимодействии с неорганическими кислотами и органическими кислотами могут образовываться фармацевтически приемлемые соли присоединения кислоты, в частности, ацетат, аспартат, бензоат, безилат, бромид/гидробромид, бикарбонат/карбонат, бисульфат/сульфат, камфорсульфонат, хлорид/гидрохлорид, хлортеофиллонат, цитрат, этандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гиппурат, гидроиодид/иодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, нафтоат, напзилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/диггидрофосфат, полигалактуронат, пропионат, стеарат, сукцинат, субсалицилат, тартрат, тозилат и трифторацетат.
[00159] Неорганические кислоты, из которых могут быть получены соли, включают, например, соляную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п.
[00160] Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, манделовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и т.п.
[00161] При взаимодействии с неорганическими и органическими основаниями могут образовываться соли присоединения основания.
[00162] Неорганические основания, из которых могут быть получены соли, включают, например, соли аммония и металлы из столбцов I-XII периодической таблицы. В определенных вариантах осуществления изобретения соли получены из натрия, калия, аммония, кальция, магния, железа, серебра, цинка и меди; особенно подходящими солями являются соли аммония, калия, натрия, кальция и магния.
[00163] Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая замещенные амины природного происхождения, циклические амины, основные ионообменные смолы и т.п. Определенные органические амины включают изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглумин, пиперазин и трометамин.
[00164] Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из основного или кислотного фрагмента с помощью стандартных химических методов. В целом, такие соли могут быть получены при взаимодействии свободных кислых форм этих соединений с соответствующим основанием, взятом в стехиометрическом количестве (таким как гидроксид карбонат, бикарбонат Na, Са, Mg или K и т.п.), или при взаимодействии свободных основных форм этих соединений с соответствующей кислотой, взятой в стехиометрическом количестве. Такие реакции обычно проводятся в воде или органическом растворителе или в смеси эти двух веществ. Как правило, желательно по возможности использовать неводные среды, наподобие эфира, этилацетата, этанола, изопропанола или ацетонитрила. Перечни дополнительных подходящих солей см., например, в публикациях «Ремингтон, Фармацевтические науки», 20-е издание, Мак Паблишинг Компани, Истон, Пенсильвания (1985) и «Справочник по фармацевтическим солям: свойства, выбор и использование» авторов Стал и Вермут (Уайли-ВСХ, Вайнхайм, Германия, 2002) ("Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); "Handbook of Pharmaceutical Salts: Properties, Selection, и Use" by Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002)).
[00165] Кроме того, соединения, предложенные в настоящем изобретении, включая их соли, могут быть получены также в форме гидратов или включать другие растворители, используемые для их кристаллизации. Соединения по настоящему изобретению могут по своей природе или в соответствии с замыслом образовывать сольваты с фармацевтически приемлемыми растворителями (включая воду); таким образом, предполагается, что изобретение охватывает как сольватированные, так и несольватированные формы
[00166] Любая формула в настоящем документе, предназначена для представления как изотопно необогащенных форм, так и изотопно обогащенных форм соединений. Изотопно обогащенные соединения имеют структуры, соответствующие формулам, представленным в данном документе, за исключением того, что один или несколько атомов у изотопно обогащенного соединения замещены атомом с определенной атомной массой или массовым числом. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают водород, углерод, азот, кислород, фосфор, серу, фтор и хлор, такие как 2Н, 3Н, 13С, 14С, 15N, 16O, 17O, 31Р, 32Р, 36S, 18F и 37Cl, соответственно
[00167] Согласно другой особенности настоящего изобретения соединения по изобретению включают изотопно-обогащенные соединения, согласно определению в данном документе, например, соединения, в которых присутствуют радиоактивные изотопы, такие как 3Н, 14С и 18F, или нерадиоактивные изотопы, такие как 2Н и 13С. Такие изотопно-обогащенные соединения используются в метаболических исследованиях (14С), исследованиях кинетики реакций (например, 2Н или 3Н), методах обнаружения или визуализации, таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОЭКТ), включающих анализы распределения лекарственного вещества или субстрата в тканях, и при лечении радиоактивными препаратами пациентов. В частности, 18F-обогащенное соединение может быть особенно желательным для исследований ПЭТ или ОЭКТ. Изотопно-обогащенные соединения по формуле (I) могут быть, в целом, получены с помощью стандартных методов, известных специалисту, или с использованием процессов, аналогичных описанным в разделе Примеры и препараты, при использовании соответствующего меченого радиоактивного реагента вместо ранее применяемого немеченого реагента.
[00168] Далее замещение более тяжелыми изотопами, в частности, дейтерием (т.е. 2Н или D) может обеспечивать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенный период полувыведения in vivo или потребность в сниженной дозе, или улучшенный терапевтический индекс. Предполагается, что в контексте настоящего изобретения дейтерий рассматривается, как заместитель в соединении по формуле (I). Концентрация такого тяжелого изотопа, конкретно, дейтерия, может быть определена фактором изотопного обогащения. Термин «фактор изотопного обогащения» в контексте настоящего изобретения означает, что отношение между распространенностью изотопа и распространенностью конкретного изотопа в природе. Если заместитель в соединении согласно настоящему изобретению обозначен, как дейтерий, такое соединение характеризуется фактором изотопного обогащения не менее 3500 для каждого обозначенного атома дейтерия (включение дейтерия в каждый обозначенный атом дейтерия составляет 52,5%), не менее 4000 (включение дейтерия в каждый обозначенный атом дейтерия составляет 60%), не менее 4500 (включение дейтерия в каждый обозначенный атом дейтерия составляет 67,5%), не менее 5000 (включение дейтерия в каждый обозначенный атом дейтерия составляет 75%), не менее 5500 (включение дейтерия в каждый обозначенный атом дейтерия составляет 82,5%), не менее 6000 (включение дейтерия в каждый обозначенный атом дейтерия составляет 90%), не менее 6333,3 (включение дейтерия в каждый обозначенный атом дейтерия составляет 95%), не менее 6466,7 (включение дейтерия в каждый обозначенный атом дейтерия составляет 97%), не менее 6600 (включение дейтерия в каждый обозначенный атом дейтерия составляет 99%) или не менее 6633,3 (включение дейтерия в каждый обозначенный атом дейтерия составляет 99,5%). Фармацевтически приемлемые сольваты согласно изобретению включают сольваты, в которых используемый для кристаллизации растворитель может изотопно-замещенным, например, D2O, d6-ацетон, DMSO-d6.
Фармацевтическая композиция, содержащая соединение согласно изобретению, способы получения и введение таких композиций
[00169] В изобретении предложена фармацевтическая композиция, содержащая в терапевтически эффективном количестве соединение согласно изобретению или его стереоизомер. В одном варианте осуществления изобретения фармацевтическая композиция дополнительно включает, по меньшей мере, один фармацевтически приемлемый наполнитель, разбавитель, адъювант или вспомогательное вещество и при необходимости другие лечебные или профилактические ингредиенты. В одном варианте осуществления изобретения фармацевтическая композиция включает в эффективном количестве, по меньшей мере, один фармацевтически приемлемый наполнитель, разбавитель, адъювант или вспомогательное вещество.
[00170] Фармацевтически приемлемый наполнитель может содержать инертные ингредиенты, которые не подавляют ненадлежащим образом биологическую активность соединения, предложенного в настоящем изобретении. Фармацевтически приемлемые наполнители должны быть биосовместимыми, т.е. нетоксичными, не вызывающими воспаления, неиммуногенными и не вызывающими нежелательных реакций при введении субъекту. Могут применяться стандартные методы составления рецептуры лекарственного средства.
[00171] Как было описано выше, фармацевтически приемлемые композиции, предложенные в настоящем изобретении, дополнительно включают фармацевтически приемлемый наполнитель, адъювант или носитель, которые, в контексте настоящего изобретения, включают любые возможные растворители, разбавители или другой жидкий носитель, диспергирующие или суспендирующие вещества, поверхностно-активные вещества, изотонические агенты, сгущающие или эмульгирующие вещества, консерванты, твердые связующие вещества, смазывающие вещества и т.п., подходящие для конкретной желаемой лекарственной формы. В публикациях Ремингтон: Наука и практика аптечного дела, 21-е издание, 2005, по ред. Д.Б. Трой, Липпинкотт Уилльямс энд Уилкинс Филадельфия, и Энциклопедия фармацевтической технологии, под ред. Дж. Сварбрик и Дж.С. Бойлан, 1988-1999, Марсел Деккер, Нью-Йорк (Remington: The Science и Practice of Pharmacy, 21st  , 2005, ed. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia, и
, 2005, ed. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia, и  of Pharmaceutical Technology, eds. J. Swarbrick и J. C. Boylan, 1988-1999, Marcel Dekker, New York), содержание каждой из которых включено в настоящее изобретение в форме ссылки, описаны разнообразные наполнители, используемые при составлении фармацевтически приемлемых композиций, и известные методы их получения. Кроме случаев, когда среда любого стандартного наполнителя несовместима с предложенными соединениями, например, из-за того, что вызывает нежелательный биологический эффект или иным образом отрицательным образом взаимодействует с любыми другими компонентами фармацевтически приемлемой композиции, его предполагается использовать в объеме настоящего изобретения.
of Pharmaceutical Technology, eds. J. Swarbrick и J. C. Boylan, 1988-1999, Marcel Dekker, New York), содержание каждой из которых включено в настоящее изобретение в форме ссылки, описаны разнообразные наполнители, используемые при составлении фармацевтически приемлемых композиций, и известные методы их получения. Кроме случаев, когда среда любого стандартного наполнителя несовместима с предложенными соединениями, например, из-за того, что вызывает нежелательный биологический эффект или иным образом отрицательным образом взаимодействует с любыми другими компонентами фармацевтически приемлемой композиции, его предполагается использовать в объеме настоящего изобретения.
[00172] Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми наполнителями, включают, в числе прочего, ионообменные смолы, алюминий, алюминия стеарат, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или калия сорбат, смеси неполных глицеридов насыщенных растительных жирных кислот, вода, соли или элетролиты, такие как протамина сульфат, динатрия гидрофосфат, калия гидрофосфат, натрия хлорид, соли цинка, коллоидный окид кремния, магния трисиликат, поливинилпирролидон, полиакрилаты, воска, блок-сополимеры полиэтилена и полиоксипропилена, метилцеллюлоза, гидроксипропил метилцеллюлоза, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрия карбоксиметилцеллюлоза, этилцеллюлоза и ацетилцеллюлоза; порошкообразный трагакант; мальт; желатин; тальк; вспомогательные вещества, такие как масло какао и суппозиторные воска; масла, такие как арахисовое масло; льняное масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; например, пропиленгликоль или полиэтиленгликоль; сложные эфиры, например, этилолеат и этиллаурат; агар; буферные агенты, такие как магния гидроксид и алюминия гидроксид, альгиновая кислота; беспирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, и также другие нетоксичные совместимые смазывающие вещества, такие как натрия лаурилсульфат и магния стеарат, а также красящие вещества, антиадгезивные вещества, покрывающие вещества, подсластители, вкусовые вещества и ароматизирующие вещества, консерванты и антиоксиданты тоже могут присутствовать в композиции, согласно суждению разработчика рецептуры.
[00173] Фармацевтически приемлемые композиции могут быть введены людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, наружно (в виде порошков, мазей, капель или пластыря), буккально, в форме перорального или назального аэрозоля и т.п., в зависимости от тяжести инфекции, по поводу которой проводится лечение.
[00174] Жидкие лекарственные формы для перорального введения включают, в числе прочего, фармацевтически приемлемые эмульсии, микроэмульсию, раствор, суспензию, сироп и эликсир. В дополнение к действующему веществу жидкая лекарственная форма может содержать инертный разбавить, традиционно используемый в данном области, такой как, например, вода или другие растворители, солюбилизирущие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое и кунжутное), глицерол, тетрагидрофуриловый спирт, полиэтиленгилколи и сложные эфиры сорбитана и жирных кислот, и их смеси. Помимо инертных разбавителей композиции для перорального введения могут включать также адъюванты, такие как смачивающие вещества, эмульгаторы или суспендирующие вещества, подсластители, вкусовые вещества и ароматические вещества.
[00175] Инъекционные лекарственные формы, например, стерильные инъекционные водные или масляные суспензии могут быть составлены в соответствии с известным уровнем техники с использованием подходящих диспергирующих и смачивающих веществ и супендирующих веществ. Стерильной инъекционной лекарственной формой может также быть стерильный инъекционный раствор, суспензия или эмульсия в нетоксичном приемлемом разбавителе или растворителе, каким является, например, раствор 1,3-бутандиола. В число приемлемых носителей и растворителей, которые могут быть использованы, входят вода, раствор Рингера, Фарм. США, и изотонический раствор натрия хлорида. Дополнительно в качестве растворителя или суспендирующей среды традиционно используются стерильные нелетучие масла. С этой целью может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Дополнительно, для получения инъекционных лекарственных форм используются жирные кислоты, например, олеиновая кислота.
[00176] Инъекционные лекарственные формы могут быть стерилизованы, например, посредством фильтрования через удерживающий бактерии фильтр или включения стерилизующих веществ в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде перед использованием.
[00177] Для продления эффекта предложенного соединения или композиции часто бывает желательно замедлить всасывание соединения из подкожной или внутримышечной инъекции. Такого результата можно достичь, используя жидкую суспензию кристаллического или аморфного материала, который плохо растворяется в воде. Тогда скорость всасывание лекарственного вещества будет зависеть от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание парентерально введенного соединения достигается растворением или суспендированием соединения в масляном носителе. Для получения инъекционных форм-депо создают матрицы для микроинкапсулирования соединения в биоразлагаемые полимеры, такие как сополимер полилактида и полигликолевой кислоты. Скорость высвобождения соединения можно контролировать в зависимости от соотношения соединения и полимера и природы конкретного используемого полимера. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные формы-депо получают также, заключая соединение в липосомы или микроэмульсии, совместимые с тканями организма.
[00178] Композиции для ректального или вагинального введения представляют собой суппозитории, которые можно получить путем приготовления смесей. Описанные в настоящем документе суппозитории с подходящими, не вызывающими раздражения вспомогательными веществами или наполнителями, такими как масло какао, полиэтиленгликоль или суппозиторный воск, являются твердыми веществами при температуре окружающей среды, но жидкими при температуре тела, и поэтому плавятся в прямой кишке или влагалище и высвобождают действующее вещество.
[00179] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах действующие вещества смешаны, по меньшей мере, с одним фармацевтически приемлемым инертным вспомогательным веществом или наполнителем, таким как натрия цитрат или кальция фосфат и/или (а) наполнителями и веществами, вызывающими набухание, такими как крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; (b) адгезивными веществами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, полиэтиленпирролкетон, сахароза и сомла акации; (с) увлажняющими веществами, такими как глицерол; (d) веществами для улучшения распадаемости, такими как агар, кальция карбонат, картофельный крахмал или тапиоковый крахмал, альгиновая кислота, определенные силикаты и натрия карбонат; (е) блокирующими растворами, такими как парафин; (f) стимуляторами всасывания, такими как соединения четвертичного аммония; (g) смачивающими веществами, такими как цетиловый спирт и глицерол моностеарат; (h) абсорбентами, такими как каолин и бентонит, (i) смазывающими веществами, такими как тальк, кальция стеарат, магния стеарат, твердый полиэтиленгликоль, натрия лаурилсульфат и их смеси. В случае капсул, таблеток и пилюль фармацевтические композиции могут также включать буферные вещества.
[00180] Твердые композиции аналогичного типа могут также применяться в качестве наполнителей в желатиновых капсулах с мягким и твердым содержимым при использовании таких вспомогательных веществ, как лактоза или молочный сахар и таких, как полиэтиленгликоли с высокой молекулярной массой и т.п. Твердые лекарственные формы, включающие таблетки, драже, капсулы, пилюли и гранулы могут быть изготовлены с покрытиями и оболочками, такими как кишечнорастворимые покрытия и другие покрытия, хорошо известные в области разработки фармацевтических форм. Они могут при необходимости содержать вещества, придающие непрозрачность, и могут иметь такой состав, что будут обеспечивать высвобождение толко действующих веществ(а) или, предпочтительно, высвобождение в определенной части кишечного тракта, при необходимости, замедленное. Примеры заливочных композиций, которые могут применяться, включают полимерные вещества и воска. Твердые композиции аналогичного типа могут также применяться в качестве наполнителей в желатиновых капсулах с мягким и твердым содержимым, при использовании таких вспомогательных веществ, как лактоза или молочный сахар, и также высокомолекулярных полиэтиленгликолей и т.п.
[00181] Как отмечено выше, действующие вещества могут быть также в инкапсулированной форме с одним или несколькими вспомогательными веществами. Твердые лекарственные формы, включающие таблетки, драже, капсулы, пилюли и гранулы могут быть изготовлены с покрытиями и оболочками, такими как кишечнорастворимые покрытия и другие покрытия, хорошо известные в области разработки фармацевтических форм. В таких твердых лекарственных формах действующие вещества могут быть смешаны, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут содержать, как в обычной практике, дополнительные вещества, кроме инертных разбавителей, в частности, смазывающие вещества для таблетирования и другие добавки для таблетирования, такие как магния стеарат и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы могут также включать буферные вещества. Они могут при необходимости содержать вещества, придающие непрозрачность, и могут иметь такой состав, что будут обеспечивать высвобождение толко действующих веществ(а) или, предпочтительно, высвобождение в определенной части кишечного тракта, при необходимости, замедленное. Примеры заливочных композиций, которые могут применяться, включают полимерные вещества и воска.
[00182] Лекарственные формы для наружного или трансдермального введения описанного в изобретении соединения включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, аэрозоли, ингаляторы и пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым наполнителем и необходимыми консервантами или буферными веществами, которые могут потребоваться. Офтальмологические лекарственные формы и глазные капли также рассматриваются, как принадлежащие к объему настоящего изобретения. Дополнительно настоящее изобретение предусматривает использование трансдермальных пластырей, дополнительным преимуществом которых является обеспечение контролируемой доставки соединения в организм. Такие лекарственные формы могут быть получены при растворении или распределении соединения в надлежащей среде. Также могут применяться стимуляторы всасывания, чтобы увеличить поток соединения через кожу. Скорость потока можно контролировать, либо обеспечив мембрану, контролирующую скорость высвобождения, либо диспергируя соединение в полимерном матриксе или геле.
[00183] Композиции, описанные в настоящем изобретении, могут быть введены перорально, парентерально, с помощью ингаляции аэрозоля, наружно, ректально, назально, буккально, вагинально или посредством имплантированного депо. Термин «парентерально» в контексте настоящего изобретения включает, помимо прочего, приемы подкожной, внутривенной, внутримышечной, внутрисуставной, внутрисиновиальной, интрастернальной, интратекальной, внутрипеченочной, внутриочаговой и внутричерепной инъекции или инфузии. Более конкретно, композиции вводят перорально, внутрибрюшинно или внутривенно. Конкретно, композиции вводят перорально, внутрибрюшинно или внутривенно.
[00184] Стерильные инъекционные формы описанной в настоящем изобретении композиции могут быть водными или масляными суспензиями. Эти суспензии могут быть получены с помощью известных специалисту приемов при использовании подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильным инъекционным препаратом может быть также стерильный инъекционный раствор или суспензия в нетоксичном парентерально приемлемом разбавителе или растворителе, например, растворе 1,3-бутандиола. В число приемлемых носителей и растворителей, которые могу быть использованы, входят вода, раствор Рингера и изотонический раствор натрия хлорида. Дополнительно в качестве растворителя или суспендирующей среды трандиционно применяются стерильные нелетучие масла. С этой целью может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Для получения инъекционных форм используют жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, поскольку они являются натуральными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно в полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержат длинноцепочечный спиртовой разбавитель или диспергатор, такой как карбоксиметилцеллюлоза или аналогичные диспергирующие агенты, которые широко применяются в рецептурах фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Также в целях составления рецептуры могут быть использованы другие часто используемые поверхностно-активные вещества, такие как Твины, Спэны и другие эмульгирующие вещества или усилители биодоступности, которые широко применяются в производстве фармацевтически приемлемых твердых, жидких и других лекарственных форм.
[00185] Описанные в настоящем изобретении композиции могут быть введены перорально в любой перорально доступной лекарственной форме, включая, в числе прочего, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения часто используемые наполнители включают, в числе прочего, лактозу и кукурузный крахмал. Также в большинстве случаев добавляют смазывающие вещества, такие как магния стеарат. Полезные разбавители для перорального введения в форме капсул включают лактозу и высушенный кукурузный крахмал. Когда требуются водные суспензии для перорального применения, действующее вещество объединяют с эмульгирующими и суспендирующими веществами. Если желательно, могут быть добавлены определенные подслащивающие, вкусовые или красящие вещества.
[00186] Альтернативно, описанные в настоящем изобретении композиции могут быть введены в форме суппозиториев для ректального введения. Такие суппозитории могут быть получены путем смешивания вещества с подходящим не вызывающим раздражения вспомогательным веществом, твердым при комнатной температуре, но жидким при ректальной температуре, которое поэтому будет плавиться в прямой кишке с высвобождением лекарственного вещества. Такие материалы включают, помимо прочего, масло какое, пчелиный воск и полиэтиленгилколи.
[00187] Описанные в настоящем изобретении композиции могут применяться наружно, особенно, когда цель лечения включает участки или органы, легко достижимые при наружном применении, включая заболевания глаз, кожи или нижнего отдела кишечного тракта. Для каждого такого участка или органа легко получают лекарственные формы для наружного применения.
[00188] Для наружного применения в нижнем отделе кишечного тракта могут применяться лекарственные формы, представляющие собой ректальные суппозитории (см. выше) или подходящие клизмы. Также могут быть использованы наружно-трансдермальные пластыри.
[00189] Фармацевтические композиции для наружного могут быть получены в форме подходящей мази, содержащей действующее вещество, суспендированное или растворенное в одном или нескольких наполнителях. Наполнители для наружного применения соединений по данному изобретению включают, помимо прочего, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции для наружного применения могут быть получены в форме подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых наполнителях. Подходящие наполнители включают, помимо прочего, минеральное масло, сорбитана моностеарат, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
[00190] Для офтальмологического применения фармацевтические композиции могут быть получены в форме микронизованных суспензий в изотоническом стерильном физиологическом растворе с отрегулированным рН, или, конкретно, в форме растворов в изотоническом, стерильном физиологическом растворе с отрегулированным рН, с консервантом, например, бензалькония хлоридом, или без консерванта. Альтернативно, для офтальмологического применения фармацевтические композиции могут быть получены в форме мази, такой как вазелин.
[00191] Фармацевтические композиции могут быть также введены в форме назального аэрозоля или ингаляции. Такие композиции получают с помощью способов, хорошо известных специалистам в области разработки лекарственных форм, и могут быть получены в форме растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, стимуляторов всасывания для повышения биодоступности, фторуглеродов и/или других традиционных солюбилизирущих или диспергирующих веществ.
[00192] Соединения для использования с помощью методов по изобретению могут быть получены в виде единичной дозированной формы. Термин «единичная дозированная форма» относится к физические дискретным единицам, подходящим для использования в качестве единичной дозировки для пациентов, которым проводится лечения, при этом каждая единица содержит предопределенное количество активного материала, рассчитанное для того чтобы вызвать желаемый эффект, при необходимости в сочетании с подходящим фармацевтическим наполнителем. Единичная дозированная форма может применяться, как однократная суточная доза или как одна из многократных суточных доз (например, приблизительно от 1 до 4 приемов в сутки). Когда применяются многократные суточные дозы, единичная дозированная форма может быть одинаковой или разной для каждой дозы.
Использование соединений и фармацевтических композиций
[00193] Соединения и фармацевтические композиции, предложенные в настоящем изобретении, могут быть использованы в производстве лекарственных средств для профилактики, контроля, лечения или уменьшения тяжести нарушения или заболевания, вызванного вирусной инфекцией у пациента. В некоторых вариантах осуществления изобретения вирусной инфекцией является вирусный грипп.
[00194] В настоящем изобретении предложено также использование описанных выше соединений и фармацевтических композиций в производстве лекарственных средств, которые являются ингибиторами РНК-полимеразы вируса гриппа.
[00195] В настоящем изобретении предложен способ лечения, профилактики или сдерживания инфекций, вызванных вирусами, где способ включает введение терапевтически эффективного количества соединения или фармацевтической композиции, описанной в настоящем документе, пациенту, нуждающемуся в лечении. Отличающийся тем, что вирусом является вирус гриппа. И соединения или содержащая их фармацевтическая композиция могут применяться совместно с другими способами лечения или терапевтическими агентами. Совместное применение может выполняться одновременно, последовательно или через определенный интервал времени.
[00196] Дозы соединения или фармацевтической композиции, необходимые для выполнения функций лечения, профилактики или сдерживания обычно зависят от конкретного соединения, которое будет введено, пациента, конкретного заболевания или нарушения и их тяжести, способа и частоты введения и т.д. и должны определяться лечащим врачом в соответствии с конкретными условиями. Например, когда соединение или фармацевтическую композицию по настоящему изобретению вводят внутривенно, такое введение может производиться один раз в неделю или даже через более длительные интервалы.
[00197] Как описано выше, в настоящем изобретении предложен новый класс соединений, отличающийся тем, что соединения могут быть использованы в качестве ингибиторов РНК-полимеразы вируса гриппа. Соединения по изобретения подходят для получения лекарственных средств, имеющих разные лекарственные формы, которые могут быть использованы для лечения сезонного гриппа, птичьего гриппа, свиного гриппа и также гриппа, вызванного резистентного к тамифлю мутантными вирусами.
[00198] Помимо использования для лечения людей эти соединения могут быть также полезными для ветеринарного лечения животных, таких как животные-компаньоны, экзотические животные и сельскохозяйственные животные. В других вариантах осуществления животные согласно изобретению включают лошадей, собак и кошек. В контексте настоящего изобретения предложенные соединения включают свои фармацевтически приемлемые производные.
Общие методы синтеза
[00199] Следующие примеры приводятся в целях описания изобретения. Следует понимать, что изобретение не ограничивается этими примерами, и в настоящем изобретении лишь представлен способ практического использования изобретения.
[00200] В целом, предложенные в настоящем изобретении соединения могу быть получены с помощью описанных в изобретении способов, где заместители соответствуют определениям для формулы (I), если дополнительно не указано иное. Следующие не имеющие ограничительного характера схемы и приемы представлены, для того чтобы дополнительно проиллюстрировать изобретение.
[00201] Специалистам в данной области техники известно, что описанные химические реакции могут быть легко адаптированы для получения ряде других соединений, предложенных в изобретении, и представленные альтернативные способы получения предложенных соединений являются частью предложенного изобретения. Например, синтез не проиллюстрированные соединений согласно изобретению может быть успешно выполнен с помощью модификаций, очевидных для специалиста, например, посредством соответствующей защиты интерферирующих групп, использования других подходящих реагентов, известных из уровня техники и отличных от описанных, и/или путем рутинных изменений условий реакции. Альтернативно, другие реакции, описанные в настоящем изобретении или известные из уровня техники, будут признаны применимыми для получения соединений, предложенных в настоящем изобретении.
[00202] В описанных ниже примерах все значения температуры указаны в градусах Цельсия, если не указано иное. Реактивы были приобретены у частных поставщиков, таких как Aldrich Chemical Company, Arco Chemical Company, Alfa Chemical Company и J&K Scientific Ltd. и были использованы без дополнительной очистки, если не указано иное. Обычные растворители были приобретены у частных поставщиков, таких как Shantou XiLong Chemical Factory, Guangdong Guanghua Reagent Chemical Factory Co. Ltd., Guangzhou Reagent Chemical Factory, Tianjin YuYu Fine Chemical Ltd., Tianjing Fuchen Chemical Reagent Factory, Wuhan XinHuayuan technology development со., LTD., Qingdao Tenglong Reagent Chemical Ltd., Qingdao Ocean Chemical Factory, Beijin Ouhe Technology Co., Ltd., Shanghai  Technology Co., Ltd, и Accela
Technology Co., Ltd, и Accela  Co., Ltd.
Co., Ltd.
[00203] Безводный THF, 1,4-диоксан, толуол и эфир были получены при нагревании растворителя с натрием в колбе с обратным холодильником. Безводные CH2Cl2 и CHCl3 были получены при нагревании растворителя с кальция гидридом в колбе с обратным холодильником. EtOAc, РЕ, н-гексан, N,N-диметилацетамид и N,N-диметилформамид перед использованием были обработаны безводным Na2SO4.
[00204] Представленные ниже реакции проводились, в основном, при положительном давлении азота или аргона или с осушительной трубкой (если не указано иное) в безводных растворителях и реакционные сосуды были, как правило, оснащены резиновой диафрагмой для введения субстратов и реактивов с помощью шприца. Стеклянную лабораторную посуды сушили в сушильном шкафу и/или при нагревании.
[00205] Колоночная хроматография проводилась с использованием колонки с силикагелем. Силикагель (300-400 меш) приобретали у поставщика Qingdao Ocean Chemical Factory.
[00206] 1H ЯМР спектры регистрировали при к.т. с помощью спектрометра Bruker 400 МГц или 600 МГц, используя в качестве растворителя CDCl3, d6-DMSO, CD6OD или d6-ацетон (представлено в ppm) и используя TMS (0 ppm) или хлороформ (7,26 ppm) в качестве стандартного образца. При представлении мультиплетности пиков использовали следующие сокращения: s (синглет), d (дублет), t (триплет), m (мультиплет), br (широкий мультиплет), dd (двойной дублет) и dt (двойной триплет). Константы взаимодействия, если они указаны, выражены в герцах (Гц).
[00207] Масс-спектральные (МС) данные низкого разрешения были определены на квадрупольном ВЭЖХ-МС спектрометре Agilent 6120 Quadrupole, оснащенном колонкой Agilent Zorbax SB-C18 (2,1×30 мм, 3,5 мкм). Скорость потока составляла 0,6 мл/мин; подвижные фазы состояли из комбинации фазы А (0,1% муравьиная кислота в CH3CN) и фазы В (0,1% муравьиная кислота в Н2О) в градиентном режиме (от 5% до 95%), и использовали источник ионизации электрораспылением (ИЭР), пик на ВЭЖХ-хроматограмме регистрировали по результатам детекции в УФ-видимом диапазоне при 210/254 нм.
[00208] Очистка соединения методом препаративной хроматографии была выполнена на высокоэффективном жидкостном хроматографе Agilent 1260 Series (пре-ВЭЖХ) или высокоэффективном жидкостном хроматографе Calesep Pump 250 Series (пре-ВЭЖХ) с УФ-детекцией при длине волны 210/254 нм (колонка: NOVASEP, 50/80 мм, DAC).
[00209] В тексте описания изобретения используются следующие сокращения:
АсОН, НАс, НОАс, СН3СООН уксусная кислота
AcOK, KOAc, CH3COOK калия ацетат
BnOH фенилкарбинол
Bu4NF тетрабутиламмония фторид
ВОС, Boc трет-бутоксикарбонил
(Вос)2О ди-трет-бутилдикарбонат
n-BuOH н-бутиловый спирт
CHCl3 хлороформ
CDCl3 хлороформ-d
CD3OD метиловый спирт - d4
DCM, CH2Cl2 дихлорметан
CH3CN, MeCN ацетонитрил
CH3Cl хлорметан
CH3I иодометан
CH3SO2Cl, MsCl метилсульфонил хлорид
Cbz бензилоксикарбонил
CL клиренс
ДИЕА, DIPEA, iPr2Net N,N-диизопропилэтиламин
DMF N,N-диметилформамид, диметилформамид
DMF-DMA N,N-диметилформамид диметилацеталь
DME диметиловый эфир
DMAP 4-диметиламинопиридин
DMSO диметилсульфоксид
DMSO-d6 диметил сульфоксид-d6, дейтерированный DMSO
DPPA дифенилфосфорил азид
ЕА, EtOAc этилацетат
Et3N, TEA триэтиламин
Et2O диэтиловый эфир
EtOH этиловый спирт
ЕС50 полумаксимальная эффективная концентрация
g (г) грамм
wt (вес. %) весовая концентрация
h (ч) час, часы
Н2 водород
H2O вода
HCl хлороводород
H2O2 пероксид водорода
Н3РО4 фосфорная кислота
H2SO4 серная кислота
HNO3 азотная кислота
HCOOK калия формиат
HCOONH4 аммония формиат
HPLC (ВЭЖХ) высокоэффективная жидкостная хроматография
HPTLC (ВЭТСХ) высокоэффективная тонкослойная хроматография
HRMS масс-спектр высокого разрешения
I2 иод
Fe железо
MgSO4 сульфат магния сульфат
СН3ОН, МеОН метанол
MeI, CH3I иодометан
мл, мл (мл) миллилитр
min (мин) минута, минуты
N2 азот
NH3 аммоний
NMP N-метилпирролидон
NaHCO3 натрия бикарбонат
NaBH4 натрия борогидрид
NaBH3CN натрия цианоборогидрид
NaOMe, NaOCH3, CH3ONa натрия метоксид
NaOH натрия гидроксид
NaCl натрия хлорид
NaH2PO4 натрия дигидрофосфат
NaH натрия гидрид
NaI натрия иодид
Na2SO4 натрия сульфат
Na2S2O3 натрия тиосульфат
NBS N-бромсукцинимид
NIS N-иодсукцинимид
NCS N-хлорсукцинимид
NH4Cl аммония хлорид
NH2OH⋅HCl гидроксиламина гидрохлорид
psi фунтов на квадратный дюйм
Pd/C палладий на активированном угле
Pd(OAc)2 палладия диацетат
Pd(OH)2 палладия гидроксид
Pd(PPh3)4 тетракис (трифенилфосфин)палладий
Pd(PPh3)2Cl2 бис(трифенилфосфин)палладия (II) хлорид
Pd(dppf)Cl2, PdCl2(dppf) [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II)
Pd(dppf)Cl2⋅CH2Cl2 комплексное соединение 1,1'-бис(дифенилфосфино)ферроцен-палладия (II)дихлорида с дихлорметаном
Pd(dtbpi)Cl2 [1,1'-бис(ди-трет-бутилфосфино)ферроцен]дихлорпалладия (II)
Pd2(dba)3 трис(либензилиденацетон)дипалладия
Р(t-Bu)3 три-трет-бутилфосфин
РЕ петролейный эфир (60-90°С)
POCl3 фосфора оксихлорид
K2CO3 калия карбонат
K3PO4 калия фосфат
KOH калия гидроксид
RT, rt, к.т. (к.т.) комнатная температура
Rt время удерживания
SOCl2 тионил хлорид
SI (ТИ) терапевтический индекс
t-BuOK калия трет-бутоксид
THF тетрагидрофуран
TFA трифторуксусная кислота
TBAI тетрабутиламмония иодид
TBS трис(гидроксиметил)аминометан солевой буфер
TsCl тозила хлорид
Ts Тозил
Vss кажущийся объем распределения
X-Phos 2-(дициклогексилфосфино)-2',4',6'-три-изопропил-1,1'-бифенил
Zn цинк
μL (мкл) микролитр
[00210] На следующих схемах показаны стадии синтеза соединений согласно изобретению, где R1, R2, R3, Rw, R', n, q, s, V' и А соответствуют определениям в данном документе, Rh представляет собой Н или F, и Rg is ОН или Cl.
Схема 1

[00211] Промежуточный продукт по формуле (6) может быть получен способом, проиллюстрированным на Схеме 1. Вначале соединение (1) может вступить в реакцию с агентом бромирования (например, бромом, NBS, и т.д.) при к.т. в полярном растворителе (например, N,N-диметилформамиде) или растворителе со средней полярностью (например, дихлорметане) с образованием соединения (2). Соединение (2) может вступить в реакцию n-тозил хлоридом (3) с образованием соединения (4). Соединение (4) может вступить в реакцию с соединением (5) в присутствии палладиевого катализатора (например, Pd(dppf)Cl2, Pd(PPh3)4, и т.д.) с образованием промежуточного продукта (6).
Схема 2

[00212] Соединение по формуле (17) может быть получено способом, проиллюстрированным на Схеме 2. Вначале соединение (7) может вступить в реакцию с соединением (8) в отсутствие света с образованием соединения (9). Соединение (9) может вступить в реакцию раскрытия кольца в присутствии основания (например, натрия метоксида и т.п.) с образованием соединения (10). Затем соединение (10) может вступить в реакцию с DPPA и фенилкарбинолом (11) с последующей перегруппировкой в щелочных условиях собразованием соединения (12). Аминозащитная группа в соединении (12) может быть удалена в восстановительных условиях с образованием соединения (13). Между соединением (13) и соединением (14) в щелочных условиях может произойти реакция сочетания с образованием соединения (15). Между соединением (15) и соединением (6) в присутствии палладиевого катализатора может произойти реакция перекрестного сочетания Сузуки с образованием соединения (16). В заключение, защитная группа на соединении (16) может быть удалена в присутствии основания с образованием соединения (17).
Схема 3

[00213] Соединение по формуле (24) может быть получено способом, проиллюстрированным на Схеме 3. Вначале соединение (18) может вступить в реакцию с мочевиной (19) в условиях нагревания с образованием соединения (20). Соединение (20) может подвергнуться реакции хлорирования в присутствии фосфора оксихлорида с образованием соединения (21). Затем соединение (21) может вступить в реакцию с соединением (13) в щелочных условиях с образованием соединения (22). Между соединением (22) и соединением (6) в присутствии палладиевого катализатора может произойти реакция перекрестного сочетания Сузуки с образованием соединения (23). В заключение, защитная группа на соединении (23) может быть удалена в присутствии основания с образованием соединения (24).
Схема 4
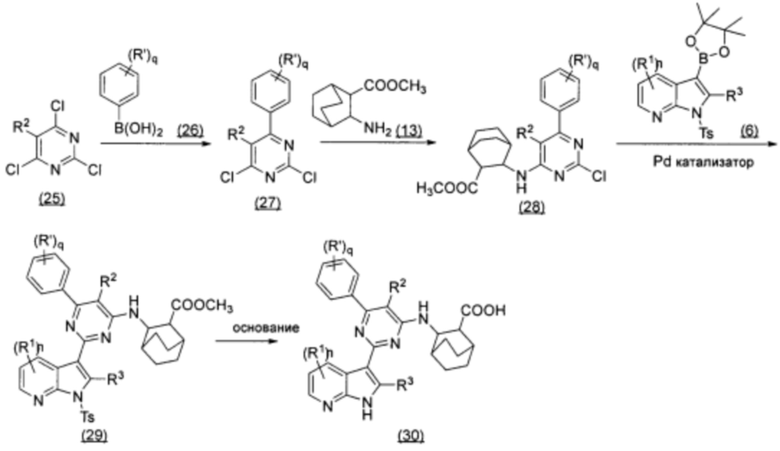
[00214] Соединение по формуле (30) может быть получено способом, проиллюстрированным на Схеме 4. Вначале может произойти перекрестного сочетания Сузуки между соединением (25) и соединением борной кислоты (26) с образованием соединения (27). Затем соединение (27) может вступить в реакцию с соединением (13) в щелочных условиях с образованием соединения (28), и между соединением (28) и соединением (6) в присутствии палладиевого катализатора может произойти реакция перекрестного сочетания Сузуки с образованием соединения (29). В заключение, защитная группа на соединении (29) может быть удалена в присутствии основания с образованием соединения (30).
Схема 5
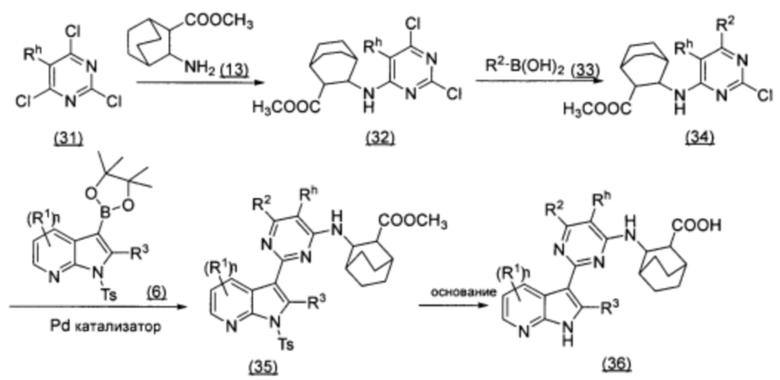
[00215] Соединение по формуле (36) может быть получено способом, проиллюстрированным на Схеме 5. Вначале соединение (31) может вступить в реакцию с соединением (13) в щелочных условиях с образованием соединения (32). Затем может произойти перекрестного сочетания Сузуки между соединением (32) и соединением борной кислоты (33) с образованием соединения (34). И реакция перекрестного сочетания Сузуки может произойти между соединением (34) и соединением (6) в присутствии палладиевого катализатора с образованием соединения (35). В заключение, защитная группа на соединении (35) может быть удалена в присутствии основания с образованием соединения (36).
Схема 6
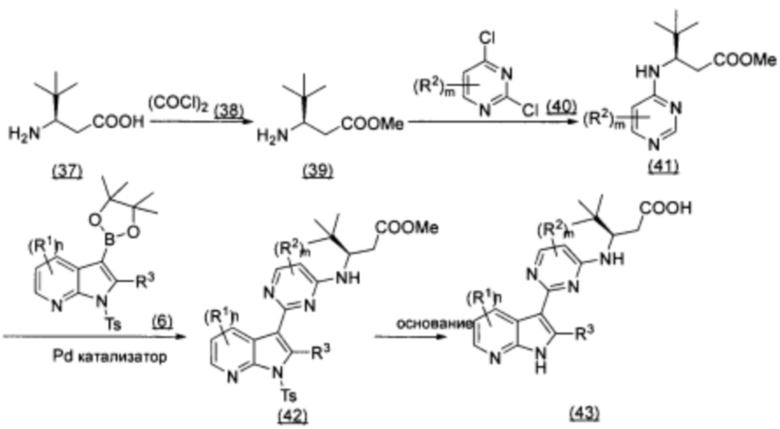
[00216] Соединение по формуле (43) может быть получено способом, проиллюстрированным на Схеме 6. Вначале соединение (37) может вступить в реакцию с соединением (38) с образованием соединения (39). Затем соединение (39) и соединение (40) могут подвергнуться конденсации с образованием соединения (41). И между соединением (41) и соединением (6) в присутствии палладиевого катализатора может произойти реакция перекрестного сочетания Сузуки с образованием соединения (42). В заключение, защитная группа на соединении (42) может быть удалена в присутствии основания с образованием соединения (43).
Схема 7

[00217] Соединение по формуле (53) может быть получено способом, проиллюстрированным на Схеме 7. Вначале соединение (44) может вступить в реакцию с DPPA и соединением (11) в щелочных условиях с образованием соединения (45). Затем соединение (45) может в определенных условиях (например, в присутствии катализатора Pd/C catalyst и в атмосфере водорода) подвергнуться восстановлению с образованием соединения (46). Соединение (46) в щелочных условиях может вступить в реакцию с соединением (47) с образованием соединения (48). Затем в кислой среде может быть удалена защитная аминогруппа на соединении (48) с образованием соединения (49). Соединение (49) и соединение (50) могут вступить в реакцию конденсации с образованием соединения (51). И между соединением (51) и соединением (6) в присутствии палладиевого катализатора может произойти перекрестного сочетания Сузуки с образованием соединения (52). В заключение можно было в щелочных условиях удалить защитную группу на соединении (52), чтобы получить соединение (53).
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[00218] Представленные ниже примеры использованы для иллюстрации изобретения, но не могут быть истолкованы в целях ограничения объема изобретения.
Примеры получения
[00219] Получение соединений по настоящему изобретению подробно описано в следующих примерах при использовании частей соединение по изобретению в качестве примеров.
Пример 1: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: мезо-эндо-тетрагидро-4,7-этанизобензофуран-1,3-дион
[00220] В высушенную колбу вместимостью 2000 мл последовательно вносили малеиновый ангидрид (100 г, 1,02 моль) и хлороформ (1000,0 мл), затем смесь охладили до 0°С, и по каплям добавили 1,3-циклогексадиен (112,5 мл, 1,12 моль). После добавления смесь согревали до к.т. и перемешивали в течение ночи в темноте. После завершения реакции смесь концентрировали под вакуумом для удаления растворителя. К остатку добавляли метанол (700,0 мл), и полученную смесь нагревали до 50°С и перемешивали в течение 10 мин, затем охлаждали до 0°С и перемешивали в течение 30 мин. Смесь фильтровали, и осадок на фильтре сушили под вакуумом при 45°С, чтобы получить указанное в заголовке соединение в виде белого твердого вещества (147 г, 81%).
MS (ИЭР, пол. ион) m/z: 179,1 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 6,28 (dd, J=4,2, 3,4 Гц, 2H), 3,29 (s, 2Н), 3,04 (s, 2Н), 1,61 (d, J=7,9 Гц, 2Н), 1,22 (d, J=7,6 Гц, 2Н).
Стадия 2: (+/-)-транс-3-(метоксикарбонил)бицикло[2,2,2]окт-5-ен-2-карбоновая кислота
[00221] В высушенную колбу внесли мезо-эндо-тетрагидро-4,7-этаноизобензофуран-1,3-дион (33,50 г, 188,01 ммоль), затем по каплям добавили раствор натрия метоксида в метаноле (5 М, 300,8 мл) при 0°С. После добавления смесь согрели до к.т. и перемешивали в течение 4 суток, затем концентрировали под вакуумом, чтобы частично удалить метанол (приблизительно 120 мл). Остаток медленно внесли в водный раствор соляной кислоты (277 мл, 18 вес. %) при 0°С, и выпал белый твердый осадок. Для того чтобы удалить метанол, смесь концентрировали под вакуумом, и остаток перемешивали при 0°С в течение 30 мин, затем фильтровали при пониженном давлении. Осадок на фильтре троекратно промывали водой и сушили под вакуумом, чтобы получить указанное в заголовке соединение в виде белого твердого вещества (37,19 г, 94%).
МС (ИЭР, отр. ион) m/z: 209,0 [М-Н]-;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1Н), 6,34 (s, 1H), 6,17 (s, 1H), 3,65 (s, 3H), 2,94 (s, 1H), 2,91 (d, J=4,4 Гц, 1H), 2,86 (d, J=2,4 Гц, 1H), 2,72 (s, 1H), 1,48-1,58 (m, 1H), 1,34-1,44 (m, 1H), 1,26-1,16 (m, 1H), 1,09-0,99 (m, 1H).
Стадия 3: метил (+/-)-транс-3-(((бензилокси)карбонил)амино)бицикло[2,2,2]окт-5-ен-2-карбоксилат
[00222] Раствор (+/-)-транс-3-(метоксикарбонил)бицикло[2,2,2]окт-5-ен-2-карбоновой кислоты (6,0 г, 29 ммоль) в толуоле (50 мл) дегазировали и троекретно заполняли азотом, затем последовательно добавляли шприцом дифенилазидофосфат (7,0 мл, 32 ммоль) и триэтиламин (4,0 мл, 29 ммоль). Смесь нагревали до 90°С и перемешивали в течение 2 часов, затем шприцом по каплям добавляли фенилкарбинол (3,0 мл, 29 ммоль). Смесь перемешивали в течение следующих 3 суток, поддерживая при этой температуре. Реакционную смесь охлаждали до к.т., и для разбавления смеси добавляли этилацетат (60 мл). Полученную смесь промывали последовательно насыщенным водным раствором натрия бикарбоната (60 мл × 2) и насыщенным раствором соли (50 мл), и органический слой сушили над безводным натрия сульфатом, фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде желтого масла (8,25 г, 92%).
МС (ИЭР, пол. ион) m/z: 316,1 [М+Н]+.
Стадия 4: метил (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат
[00223] В автоклав последовательно вносили (+/-)-транс-метил 3-(((бензилокси)карбонил)амино) бицикло[2,2,2]окт-5-ен-2-карбоксилат (8,21 г, 26,0 ммоль), тетрагидрофуран (20 мл) и метанол (20 мл). К раствору добавляли Pd/C (10 вес. % Pd, 1,40 г), и смесь перемешивали при к.т. в течение ночи под давление водорода 2,76 бар. Для удаления катализатора реакционную смесь фильтровали через целитовую прокладку, затем осадок на фильтре последовательно промывали метанолом (20 мл) и этилацетатом (20 мл). Объединенные фильтраты концентрировали под вакуумом, получая бесцветное масло, которое очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=20/1-10/1), чтобы получить указанное в заголовке соединение в виде бесцветного масла (3,95 г, 83%).
МС (ИЭР, пол. ион) m/z: 184,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 3,68 (s, 3Н), 3,31 (d, J=6,7 Гц, 1Н), 2,11 (d, J=6,7 Гц, 1Н), 1,98-1,91 (m, 1Н), 1,83-1,71 (m, 1Н), 1,60-1,33 (m, 10Н).
Стадия 5: (+/-)-транс-метил 3-((2-хлорхиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00224] К THF (20 мл) добавляли (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (1,83 г, 9,99 ммоль), 2,4-дихлорхиназолин (2,5 г, 15 ммоль) и DIPEA (8,7 мл, 50 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакцию останавливали добавлением воды (100 мл). Полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (3,13 г, 95%).
МС (ИЭР, пол. ион) m/z: 356,8 [М+Н]+.
Стадия 6: 3-бром-5-фтор-1H-пирроло[2,3-b]пиридин
[00225] К раствору 5-фтор-1H-пирроло[2,3-6]пиридина (1 г, 7,34 ммоль) в DMF (10 мл) добавляли бром (0,75 мл, 14,5 ммоль). Смесь перемешивали при к.т. в течение 4 часов. Реакцию останавливали насыщенным водным раствором натрия тиосульфата (100 мл). Полученную смесь экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (100 мл × 3), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и омстаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде желтого порошка (0,6 г, 40%).
МС (ИЭР, пол. ион) m/z: 216,9 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,23 (s, 1Н), 8,35-8,21 (m, 1H), 7,81 (d, J=2,7 Гц, 1Н), 7,71 (dd, J=8,9, 2,6 Гц, 1Н).
Стадия 7: 3-бром-5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин
[00226] К раствору 3-бром-5-фтор-1H-пирроло[2,3-b]пиридина (0,74 г, 2,0 ммоль) в THF (5 мл) добавляли NaH (127 мг, 3,0 ммоль) при 0°С, и смесь перемешивали в течение 30 мин, поддерживая при этой температуре, затем добавляли TsCl (458 мг, 2,4 ммоль). Полученную смесь согревали до к.т. и перемешивали в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом, и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAC (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (740 мг, 90%).
МС (ИЭР, пол. ион) m/z: 370,8 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,32 (s, 1Н), 8,06 (d, J=8,3 Гц, 2H), 7,84 (s, 1H), 7,47 (dd, J =7,8, 2,6 Гц, 1H), 7,29 (d, J=8,3 Гц, 2H), 2,38 (s, 3H).
Стадия 8:
5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00227] К DME (5 мл) добавляли 3-бром-5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин (175 мг, 0,22 ммоль), Pd(dppf)Cl2 (70 мг, 0,09 ммоль) и KOAc (144 мг, 0,47 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем к смеси добавили бис(пинаколато)дибор (190 мг, 0,71 ммоль). Пробирку со смесью запаивали, и смесь перемешивали при 105°С в течение 2 ч под микроволновым излучением. После завершения реакции реакционную смесь разбавляли этилацетатом (20 мл). Затем смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (20 мл × 2). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (130 мг, 65,9%).
МС (ИЭР, пол. ион) m/z: 417,9 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,27 (d, J=1,2 Гц, 1H), 8,19 (s, 1H), 8,08 (d, J=8,3 Гц, 2H), 7,89 (dd, J=8,5, 2,7 Гц, 1H), 7,30 (s, 1H), 7,28 (s, 1H), 2,39 (s, 3H), 1,37 (s, 12H).
Стадия 9: (+/-)-транс-метил
3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00228] К смеси растворителя 2-метилтетрагидрофурана (8 мл) с водой (1 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (305 мг, 0,73 ммоль), K3PO4 (276 мг, 1,31 ммоль), Pd2(dba)3 (46 мг, 0,1 ммоль), метил 3-((2-хлорхиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (150 мг, 0,43 ммоль) и X-phos (23 мг, 0,1 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаивали, и смесь перемешивали при 110°С в течение 3 часов. Смесь разбавляли этилацетатом (20 мл) и затем фильтровали через целитовую прокладку. Фильтрат разделяли на фракции и органический слой концентрировали под вакуумом, затем остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (255 мг, 97%).
МС (ИЭР, пол. ион) m/z: 600,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,86 (dd, J=9,0, 2,8 Гц, 1Н), 8,78 (s, 1H), 8,33 (d, J=1,9 Гц, 1H), 8,16 (d, J=8,4 Гц, 2H), 7,89 (d, J=8,2 Гц, 1H), 7,73 (dd, J=15,8, 7,6 Гц, 2H), 7,44 (t, J=7,2 Гц, 1H), 7,29 (d, J=8,9 Гц, 3H), 5,87 (d, J=6,3 Гц, 1H), 4,98 (s, 1H), 3,76 (s, 3H), 2,39 (s, 3H), 2,16-2,08 (m, 2H), 1,81-1,69 (m, 6H), 1,29-1,24 (m, 2H).
Стадия 10:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00229] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (150 мг, 0,25 ммоль) в THF/MeOH (отношение объемов=1/1, 8 мл) добавляли водный водный раствор гидроксида натрия (4 М, 0,2 мл, 0,8 ммоль). Смесь перемешивали при 30°С в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6,0, затем экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (80 мг,74%).
МС (ИЭР, пол. ион) m/z: 432,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 432,1831 [М+Н]+, (C24H23FN5O2)[M+H]+ теоретическое значение: 432,1836;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 13,18 (s, 1Н), 9,49 (s, 1Н), 8,92 (s, 1Н), 8,63 (d, J=7,9 Гц, 1Н), 8,57 (d, J=8,4 Гц, 1Н), 8,43 (s, 1Н), 8,00 (s, 1Н), 7,88 (s, 1Н), 7,69 (s, 1Н), 5,19 (s, 1Н), 3,16 (s, 1Н), 2,14 (s, 1Н), 2,06 (s, 1Н), 1,85 (s, 3H), 1,57 (m, 6Н).
Пример 2:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5,6,7,8-тетрагидро хиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00230] К THF (15 мл) добавляли (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (0,68 г, 3,69 ммоль), 2,4-дихлор-5,6,7,8-тетрагидрохиназолин (1,13 г, 2,46 ммоль) и DIPEA (4,5 мл, 24,6 ммоль). Смесь перемешивали при 65°С в течение ночи. Реакцию останавливали добавлением воды (100 мл). Полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов=4/1)), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (862 мг, 17%).
МС (ИЭР, пол. ион) m/z: 350,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 4,75 (d, J=5,1 Гц, 1H), 4,43 (t, J=5,3 Гц, 1H), 3,77 (s, 3H), 2,68 (t, J=5,9 Гц, 2H), 2,35 (d, J=5,7 Гц, 1H), 2,29-2,23 (m, 2H), 2,05 (s, 1H), 1,96 (d, J=2,5 Гц, 1H), 1,89-1,76 (m, 6H), 1,67-1,54 (m, 5H), 1,26 (d, J=7,1 Гц, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00231] К смеси растворителя 2-метилтетрагидрофурана (8 мл) с водой (1 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (251 мг, 0,59 ммоль), K3PO4 (253 мг, 1,18 ммоль), Pd2(dba)3 (83 мг, 0,1 ммоль), (+/-)-транс-метил
3-((2-хлор-5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (150 мг, 0,43 ммоль) и X-phos (43 мг, 0,1 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаивали, и смесь перемешивали при 110°С в течение 3 часов. Смесь разбавляли этилацетатом (20 мл), и полученную смесь фильтровали через целитовую прокладку. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (245 мг, 98%).
МС (ИЭР, пол. ион) m/z: 605,3 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,66 (dd, J=9,0, 2,8 Гц, 1Н), 8,61 (s, 1Н), 8,12 (d, J=8,4 Гц, 2Н), 7,28 (s, 3H), 3,71 (s, 3H), 2,78 (t, J=5,6 Гц, 2Н), 2,39 (d, J=3,2 Гц, 4Н), 2,06 (s, 1Н), 2,01 (s, 1Н), 1,89 (d, J=5,6 Гц, 5Н), 1,76-1,67 (m, 5Н), 1,37 (s, 3H), 1,27 (d, J=6,0 Гц, 3H).
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5,6,7,8-тетрагидрохиназолин-4-ил) амино)бицикло[2,2,2]октан-2-карбоксилат
[00232] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (295 мг, 0,49 ммоль) в ацетонитриле (3 мл) добавляли раствор хлороводорода в 1,4-диоксане (4 М, 0,3 мл, 1,2 ммоль). Смесь перемешивали при 65°С в течение 6,5 часа, и затем разбавляли водой (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Объединенные органические слои промывали насыщенным раствором соли (30 мл ×2), сушили над безводным натрия сульфатом, фильтровали и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (143 мг, 65%).
МС (ИЭР, пол. ион) m/z: 450,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 10,58 (s, 1Н), 8,70 (dd, J=9,4, 2,6 Гц, 1H), 8,36 (s, 1H), 8,23 (s, 1H), 4,81 (t, J=5,7 Гц, 1H), 4,66 (d, J=6,6 Гц, 1H), 3,64 (s, 3H), 2,81 (d, J=5,6 Гц, 2H), 2,41 (d, J=5,7 Гц, 1H), 2,35 (d, J=6,0 Гц, 2H), 2,05 (s, 2H), 1,88 (d, J=5,2 Гц, 5H), 1,73-1,49 (m, 7H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00233] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5,6,7,8-тетрагидрохиназолин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (105 мг, 0,27 ммоль) в THF/MeOH (отношение объемов=1/1, 8 мл) добавляли водный раствор гидроксида натрия (4 М, 0,6 мл, 2,4 ммоль). Смесь перемешивали при 30°С в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6,0, затем экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (105 мг, 88%).
МС (ИЭР, пол. ион) m/z: 436,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 436,2143 [М+Н]+, (C24H26FN5O2)[M+H]+ теоретическое значение: 436,2149;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,35 (s, 1Н), 8,57 (dd, J=9,7, 2,6 Гц, 1H), 8,41 (s, 1H), 8,26 (s, 1H), 6,68 (s, 1H), 4,78 (s, 1H), 2,97 (d, J=6,4 Гц, 1H), 2,68 (s, 2H), 2,51 (s, 3H), 2,41 (s, 1H), 2,00 (s, 1H), 1,92 (s, 1H), 1,77 (s, 6H), 1,33 (d, J=7,2 Гц, 2H), 1,21 (s, 2H).
Пример 3:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(4-метоксифенил)пиримидин
[00234] К раствору 2,4,6-трихлорпиримидина (5,5 мл, 48 ммоль) в THF (70 мл) добавляли палладия ацетат (0,147 г, 0,64 ммоль), трифенилфосфин (0,353 г, 1,28 ммоль), 4-метоксибензолборную кислоту (5 г, 31,9 ммоль) и водный раствор натрия карбоната (1 М, 64 мл, 64 ммоль). Смесь перемешивали при 60°С в течение 6 ч. После завершения реакции смесь охлаждали до к.т., и концентрировали для удаления растворителя. К остатку добавляли Н2О (100 мл), и смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (5,58 г, 68%).
МС (ИЭР, пол. ион) m/z: 255,0 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,07 (dd, J=9,4, 2,4 Гц, 2Н), 7,60 (s, 1Н), 7,08-6,99 (m, 2H), 3,91 (s, 3H).
Стадия 2: (+/-)-транс-метил 3-((2-хлор-6-(4-метоксифенл)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00235] К раствору 2,4-дихлор-6-(4-метоксифенил)пиримидина (1 г, 3,92 ммоль) и (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (1 г, 5,88 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (0,813 г, 5,88 ммоль). Смесь перемешивали при 50°С в течение ночи. После завершения реакции смесь разбавляли водой (70 мл), и полученную смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=20/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (1,01 г, 64%).
МС (ИЭР, пол. ион) m/z: 402,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,98 (d, J=8,7 Гц, 2H), 6,98 (d, J=8,9 Гц, 2H), 6,72 (s, 1Н), 5,46 (d, J=6,3 Гц, 1H), 4,32 (s, 1H), 3,88 (s, 4H), 3,74 (s, 3H), 2,39 (d, J=5,1 Гц, 1H), 2,08 (s, 1H), 1,90-1,84 (m, 1H), 1,78-1,71 (m, 2H), 1,70-1,63 (m, 4H), 1,58 (d, J=10,2 Гц, 2H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00236] В пробирку для проведения реакций под воздействием микроволнового излучения вносили (+/-)-транс-метил 3-((2-хлор-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (550 мг, 1,368 ммоль), 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (630 мг, 1,513 ммоль), карбонат калия (380 мг, 2,75 ммоль), Pd(dppf)Cl2 (120 мг, 0,147 ммоль), 1,4-диоксан (15 мл) и Н2О (0,5 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С в процессе реакции под воздействием микроволнового излучения в течение 2 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом. Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (816 мг, 91%).
МС (ИЭР, пол. ион) m/z: 656,2 [М+Н]+;
1H ЯМР (600 МГц, CDCl3) δ (ppm): 8,70 (s, 1H), 8,32 (d, J=1,8 Гц, 1H), 8,13 (s, 1H), 8,11 (s, 1H), 8,08 (s, 1H), 8,06 (s, 1H), 7,29 (s, 1H), 7,28 (s, 1H), 7,06 (s, 1H), 7,04 (s, 1H), 6,68 (s, 1H), 5,25 (s, 1H), 3,91 (s, 3H), 3,73 (s, 3H), 2,45 (d, J=5,3 Гц, 1H), 2,38 (s, 3H), 1,98 (s, 1H), 1,84 (d, J=11,8 Гц, 2H), 1,75-1,65 (m, 6H), 1,62-1,53 (m, 2H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00237] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (816 мг, 1,244 ммоль) в 1,4-диоксане (10 мл) добавляли раствор хлороводорода в диоксане (4 М, 10 мл, 40 ммоль). Смесь перемешивали при 65°С в течение ночи. После завершения реакции смесь разбавляли этилацетатом (20 мл), и полученную смесь промывали насыщенным водным раствором натрия бикарбоната (20 мл). Органический слой сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (350 мг, 56%).
МС (ИЭР, пол. ион) m/z: 502,2 [М+Н]+.
Стадия 5: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил) пиримидин-4-ил)амино)бицикло[2,2,21октан-2-карбоновая кислота
[00238] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (350 мг, 0,69 ммоль) в смешанном растворителей МеОН (5 мл), THF (5 мл) и H2O (5 мл) добавляли гидроксид натрия (280 мг, 7,00 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции смесь разбавляли 2-метилтетрагидрофураном (20 мл) и корректировали рН смеси разбавленной соляной кислотой (1 М) до рН 6,0. Полученную смесь экстрагировали 2-метилтетрагидрофураном (20 мл × 3). Объединенные органические слои сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (270 мг, 79%).
МС (ИЭР, пол. ион) m/z: 476,4 [М+Н]+;
1H ЯМР (400 МГц, CD3OD) δ (ppm): 8,78 (dd, J=9,5, 2,5 Гц, 1Н), 8,40 (s, 1H), 8,17 (s, 1H), 8,04 (s, 1H), 8,02 (s, 1H), 7,09 (s, 1H), 7,07 (s, 1H), 6,68 (s, 1H), 3,89 (s, 3H), 2,56 (d, J=5,9 Гц, 1H), 2,09 (s, 1H), 2,03 (s, 1H), 1,91 (d, J=11,4 Гц, 2H), 1,80-1,70 (m, 4H), 1,57 (s, 1H), 1,54 (s, 1H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,05, 163,07, 162,34, 161,21, 156,85, 155,26, 146,46, 131,73, 131,53, 130,62, 128,21, 119,09, 119,03, 115,16, 114,56, 114,33, 60,24, 55,72, 28,80, 28,57, 26,02, 24,17, 21,38, 19,42, 14,53.
Пример 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-фенилпиримидин
[00239] К раствору 2,4,6-трихлорпиримидин (0,29 мл, 2,5 ммоль) в THF (5 мл) добавляли палладия ацетат (8 мг, 0,035 ммоль), трифенилфосфин (18 мг, 0,065 ммоль), фенилборную кислоту (0,20 г, 1,6 ммоль) и водный раствор натрия карбоната (1 М, 3,3 мл, 3,3 ммоль). Смесь перемешивали при 60°С в течение 6 ч в защитной атмосфере азота. После завершения реакции смесь охлаждали до к.т., и концентрировали под вакуумом чтобы удалить органический растворитель. К остатку добавляли Н2О (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (10 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (0,225 г, 61%).
МС (ИЭР, пол. ион) m/z: 225,0 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,15-8,04 (m, 2Н), 7,70 (s, 1Н), 7,63-7,50 (m, 3H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00240] К раствору 2,4-дихлор-6-фенилпиримидин (1,52 г, 6,7 ммоль) и (±)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (1,84 г, 10,0 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (0,92 г, 6,f7 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции смесь разбавляли водой (50 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=20/1-10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (1,65 г, 66%).
МС (ИЭР, пол. ион) m/z: 372,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,04-7,91 (m, 2Н), 7,51-7,41 (m, 3H), 6,78 (s, 1Н), 5,41 (s, 1H), 4,32 (s, 1H), 3,73 (s, 3H), 2,38 (d, J=5,l Гц, 1H), 2,07 (s, 1H), 1,86 (m, 1H), 1,73 (m, 1H), 1,70-1,60 (m, 4H), 1,57 (m, 2H), 1,51-1,41 (m, 1H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00241] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (240 мг, 0,57 ммоль), (+/-)-транс-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (220 мг, 0,59 ммоль), карбонат калия (160 мг, 1,16 ммоль), Pd(dppf)Cl2 (43 мг, 0,06 ммоль), 1,4-диоксан (4 мл) и Н2О (0,5 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С в процессе реакции под воздействием микроволнового излучения в течение 1 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (30 мл). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (218 мг, 60%).
МС (ИЭР, пол. ион) m/z: 626,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,78-8,65 (m, 2Н), 8,33 (d, J=1,8 Гц, 1Н), 8,14 (d, J=8,4 Гц, 2H), 8,11 (d, J=8,2 Гц, 2Н), 7,60-7,47 (m, 3H), 7,31 (s, 2Н), 6,75 (s, 1H), 5,19 (s, 1H), 4,56 (s, 1H), 3,75 (s, 3H), 2,46 (d, J=5,4 Гц, 1H), 2,39 (s, 3H), 2,11 (d, J=2,3 Гц, 1H), 1,99 (s, 1H), 1,92-1,78 (m, 2H), 1,77-1,60 (m, 5H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00242] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (215 мг, 0,3 ммоль) в 1,4-диоксане (5 мл) добавляли раствор хлороводорода в 1,4-диоксане (4 М, 0,6 мл, 2,4 ммоль). Смесь перемешивали при 70°С в течение ночи. После завершения реакции смесь разбавляли этилацетатом (10 мл), смесь промывали насыщенным водным раствором натрия бикарбоната (20 мл). Органический слой сушили над безводным натрия сульфатом и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (125 мг, 77%).
МС (ИЭР, пол. ион) m/z: 472,2 [М+Н]+;
1H ЯМР (400 МГц, CD3OD) δ (ppm): 8,78 (s, 1Н), 8,64 (d, J=9,3 Гц, 1H), 8,34 (s, 1H), 7,84 (d, J=4,8 Гц, 2H), 7,64 (s, 3H), 6,74 (s, 1H), 5,12 (s, 1H), 3,66 (s, 3H), 2,74 (d, J=5,7 Гц, 1H), 2,12 (s, 1H), 1,77 (m, 9H), 1,30 (s, 2H).
Стадия 5: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00243] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1Н-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (285 мг, 0,60 ммоль) в смешанном растворителе, содержащем метанол (2 мл), THF (2 мл) и воду (2 мл), добавляли гидроксид натрия (250 мг, 6,25 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции смесь концентрировали под вакуумом, чтобы удалить органический растворитель. Остаток разбавляли 2-метилтетрагидрофураном (10 мл), и рН смеси доводили разбавленной соляной кислотой (1 М) до рН 5,5-6,0. Полученную смесь экстрагировали 2-метилтетрагидрофураном (15 мл × 3). Объединенные органические слои сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=50/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (120 мг, 43%).
МС (ИЭР, пол. ион) m/z: 458,3 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,64 (s, 1H), 8,39 (d, J=2,2 Гц, 1H), 8,29 (s, 1H), 8,11 (s, 2H), 7,64-7,41 (m, 4H), 6,76 (s, 1H), 4,65 (s, 1H), 2,01 (m, 2H), 1,81 (m, 2H), 1,46 (m, 8H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 175,94, 162,91, 162,39, 156,77, 155,25, 154,46, 146,46, 138,34, 131,76, 131,36, 130,31, 129,23, 126,76, 119,05, 115,41, 114,21, 98,26, 31,75, 29,54, 28,51, 24,18, 22,56, 21,38, 19,43.
Пример 4a:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00244] Указанное в заголовке соединение может быть получено методом синтеза, предложенным в заявке на патент WO 2015073491.
Стадия 2: (2S,3S-этил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00245] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 2 Примера 4, при использовании (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорида (316 мг, 1,35 ммоль), 2,4-дихлор-6-фенилпиримидина (334 мг, 1,49 ммоль), карбоната калия (560 мг, 4,05 ммоль) в качестве реагентов и DMF (6 мл) в качестве растворителя. Указанное в заголовке соединение представляло собой светло-желтое твердое вещество (291 мг, 56%).
Стадия 3:
(2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00246] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 3 Примера 4, при использовании (2S,3S)-этил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло [2,2,2]октан-2-карбоксилата (291 мг, 0,75 ммоль), 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (437 мг, 1,05 ммоль), карбоната калия (207 мг, 1,50 ммоль), Pd(dppf)Cl2 (58 мг, 0,08 ммоль), 1,4-диоксана (5 мл) и воды (0,5 мл); указанное в заголовке соединение представляет собой светло-желтое твердое вещество (249 мг, 52%).
Стадия 4:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00247] К раствору (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (249 мг, 0,39 ммоль) в THF/MeOH (отношение объемов=1/1, 6 мл) добавляли водный раствор гидроксида натрия (4 М, 0,98 мл, 3,90 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (109 мг, 61%).
МС (ИЭР, пол. ион) m/z: 458,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 458,1983[М+Н]+, (C26H25FN5O2)[M+H]+ теоретическое значение: 458,1992;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,63 (s, 1H), 8,39 (s, 1H), 8,29 (s, 1H), 8,10 (s, 2H), 7,53 (m, 4H), 6,77 (s, 1H), 4,65 (s, 1H), 1,99 (s, 2H), 1,81 (s, 2H), 1,74-1,54 (m, 4H), 1,47-1,39 (m, 2H).
Пример 5:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил)пиримидин-4-ил) амино)бицикло[2,2,2]октан-2-карбоновая кислота
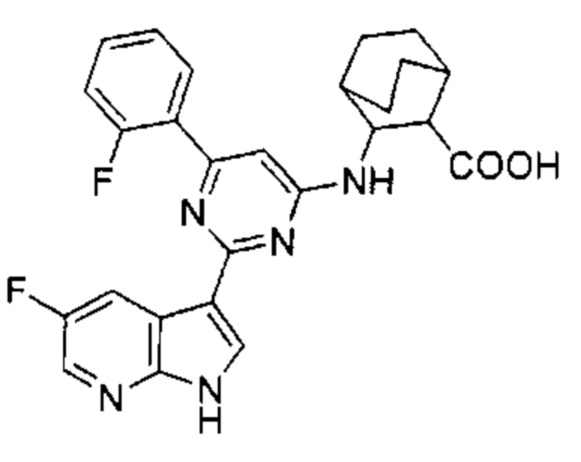
Стадия 1: 2,4-дихлор-6-(2-фторфенил)пиримидин
[00248] К раствору 2,4,6-трихлорпиримидина (3,0 мл, 25,57 ммоль) в THF (20 мл) добавляли палладия ацетат (0,1 г, 0,4 ммоль), трифенилфосфин (0,24 г, 0,87 ммоль), 2-фторфенилбьрную кислоту (3 г, 21 ммоль) и водный раствор натрия карбоната (1 М, 43 мл, 43 ммоль). Смесь перемешивали при 60°С в течение 4 ч в защитной атмосфере азота. После завершения реакции смесь охлаждали до к.т., и концентрировали под вакуумом. К остатку добавляли H2O (100 мл), и полученную смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (3,5 г, 67%).
МС (ИЭР, пол. ион) m/z: 243,1 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(2-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилат
[00249] К раствору 2,4-дихлор-6-(2-фторфенил)пиримидина (2,01 г, 8,2 ммоль) и (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (1,50 г, 8,2 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (1,10 г, 8 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции, к смеси добавляли Н2О (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (2,26 г, 71%).
МС (ИЭР, пол. ион) m/z: 390,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,11 (td, J=7,8, 1,6 Гц, 1Н), 7,44 (td, J=7,3, 1,7 Гц, 1H), 7,26 (d, J=7,5 Гц, 1H), 7,16 (dd, J=11,6, 8,3 Гц, 1H), 6,89 (s, 1H), 5,37 (d, J=4,5 Гц, 1H), 4,38-4,28 (m, 1H), 3,76 (s, 3H), 2,39 (d, J=5,3 Гц, 1H), 2,06 (s, 1H), 1,88 (d, J=2,6 Гц, 1H), 1,82-1,61 (m, 8H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00250] К смеси растворителя 1,4-диоксана (15 мл) и Н2О (0,5 мл) добавляли (+/-)-транс-метил 3-((2-хлор-6-(2-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (590 мг, 1,51 ммоль), 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (630 мг, 1,51 ммоль), карбонат калия (419 мг, 3,03 ммоль) и Pd(dppf)Cl2 (124 мг, 0,15 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и затем перемешивали при 110°С под воздействием микроволнового излучения в течение 1 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (20 мл).
Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (500 мг, 51%).
МС (ИЭР, пол. ион) m/z: 644,2 [М+Н]+;
1H ЯМР (600 МГц, CDCl3) δ (ppm): 8,71 (s, 1Н), 8,66 (dd, J=8,8, 2,6 Гц, 1H), 8,33 (d, J=1,9 Гц, 1H), 8,22-8,18 (m, 1H), 8,13 (d, J=8,1 Гц, 2H), 7,46 (dd, J=12,2, 6,5 Гц, 1H), 7,39 (s, 1H), 7,36 (s, 2H), 7,35 (s, 1H), 7,30 (s, 1H), 6,83 (s, 1H), 4,95 (s, 1H), 4,73 (s, 1H), 3,81 (s, 3H), 3,75 (s, 3H), 3,62 (s, 1H), 2,46 (d, J=4,9 Гц, 1H), 2,42 (d, J=5,0 Гц, 1H), 2,10 (d, J=2,1 Гц, 1H), 2,00 (s, 1H), 1,60 (d, J=14,8 Гц, 1H), 1,53-1,47 (m, 1H), 1,41-1,38 (m, 1H), 1,37 (d, J=l,3 Гц, 1H), 1,19 (s, 1H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00251] К раствору хлористого водорода в 1,4-диоксане (4 М, 10 мл, 40 ммоль) добавляли (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (380 мг, 0,59 ммоль). Смесь перемешивали при 65°С в течение 4 ч. После завершения реакции смесь концентрировали, и остаток разбавляли этилацетатом (10 мл). Смесь промывали насыщенным водным раствором натрия бикарбоната (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушили над безводным натрия сульфатом и фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (352 мг, 75%).
МС (ИЭР, пол. ион) m/z: 490,3 [М+Н]+.
Стадия 5:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00252] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (130 мг, 0,26 ммоль) в смешанном растворителе, содержащем метанол (3 мл), THF (3 мл) и воду (3 мл), добавляли гидроксид натрия (107 мг, 2,67 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции смесь концентрировали под вакуумом, чтобы удалить органический растворитель, и остаток разбавляли 2-метилтетрагидрофураном (10 мл). рН смеси доводили до рН 5,5 разбавленной соляной кислотой (1 моль/л). Полученную смесь экстрагировали 2-метилтетрагидрофураном (15 мл × 3). Объединенные органические слои сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (93 мг, 74%).
МС (ИЭР, пол. ион) m/z: 476,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 11,13 (s, 1Н), 8,70 (dd, J=9,2, 2,4 Гц, 1H), 8,59 (s, 1H), 8,25 (t, J=7,1 Гц, 1H), 8,04 (s, 1H), 7,45 (dd, J=12,9, 5,8 Гц, 1H), 7,35 (t, J=7,6 Гц, 1H), 7,18 (dd, J=11,5, 8,3 Гц, 1H), 6,78 (s, 1H), 5,30 (s, 1H), 4,90 (s, 1H), 2,56 (s, 1H), 2,20 (s, 1H), 1,95-1,65 (m, 10H).
Пример 6:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(4-фторфенил)пиримидин
[00253] К раствору 2,4,6-трихлорпиримидина (6,3 мл, 54 ммоль) в THF (35 мл) добавляли палладия ацетат (0,16 г, 0,70 ммоль), трифенилфосфин (0,39 г, 1,4 ммоль), p-фторфенилборную кислоту (5 г, 36 ммоль) и водный раствор натрия карбоната (1 моль/л, 71 мл, 71 ммоль). Смесь перемешивали при 60°С в защитной атмосфере азота в течение 6 ч. После завершения реакции смесь охлаждали до к.т., и концентрировали под вакуумом. К остатку добавляли H2O (100 мл), и полученную смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (300 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (8,01 г, 92%).
МС (ИЭР, пол. ион) m/z: 242,9 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00254] К раствору 2,4-дихлор-6-(4-фторфенил)пиримидина (2,01 г, 8,2 ммоль) и (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (1,50 г, 8,2 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (1,10 г, 8 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (1,75 г, 55%).
МС (ИЭР, пол. ион) m/z: 390,1 [М+Н]+.
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00255] К смеси растворителя 1,4-диоксана (15 мл) с Н2О (0,5 мл) добавляли (+/-)-транс-метил 3-((2-хлор-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан -2-карбоксилат (600 мг, 1,54 ммоль), 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (640 мг, 1,53 ммоль), карбонат калия (426 мг, 3,08 ммоль), Pd(dppf)Cl2 (126 мг, 0,15 ммоль). Смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С в процессе реакции под воздействием микроволнового излучения в течение 1 ч в защитной атмосфере азота. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (20 мл). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (500 мг, 51%).
МС (ИЭР, пол. ион) m/z: 644,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,72 (s, 1Н), 8,66 (dd, J=8,8, 2,7 Гц, 1H), 8,34 (s, 1H), 8,17-8,06 (m, 4H), 7,31 (s, 2H), 7,23 (t, J=8,6 Гц, 2H), 6,70 (s, 1H), 3,74 (s, 3H), 3,51 (s, 1H), 2,45 (d, J=5,1 Гц, 1H), 2,43 (d, J=3,8 Гц, 1H), 2,39 (s, 3H), 2,13 (s, 2H), 1,99 (s, 2H), 1,93 (s, 2H), 1,85 (d, J=11,3 Гц, 2H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00256] К раствору хлористого водорода в 1,4-диоксане (4 М, 10 мл, 40 ммоль) добавляли (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (620 мг, 0,96 ммоль). Смесь перемешивали при 65°С в течение 4 ч. После завершения реакции смесь концентрировали под вакуумом, и остаток разбавляли этилацетатом (20 мл). Полученную смесь промывали насыщенным водным раствором натрия бикарбоната (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушили над безводным натрия сульфатом и фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (352 мг, 75%).
МС (ИЭР, пол. ион) m/z: 490,3 [М+Н]+.
Стадия 5:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00257] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-фторфенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (352 мг, 0,72 ммоль) в смешанном растворителе, содержащем метанол (5 мл), THF (5 мл) и воду (2 мл), добавляли гидроксид натрия (290 мг, 7,25 ммоль). Смесь перемешивали при к.т. в течение ночи. После завершения реакции смесь концентрировали под вакуумом, и остаток разбавляли 2-метилтетрагидрофураном (10 мл). рН смеси доводили до рН 5,5 разбавленной соляной кислотой (1 М). Полученную смесь экстрагировали 2-метилтетрагидрофураном (15 мл × 3). Объединенные органические слои сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (241 мг, 70%).
МС (ИЭР, пол. ион) m/z: 476,4 [М+Н]+;
1Н ЯМР (400 МГц, CD3OD) δ (ppm): 8,77 (dd, J=9,6, 2,5 Гц, 1Н), 8,41 (s, 1Н), 8,18 (s, 1Н), 8,12 (dd, J=8,7, 5,5 Гц, 2Н), 7,26 (t, J=8,7 Гц, 2Н), 6,74 (s, 1Н), 2,59 (d, J=4,5 Гц, 1Н), 2,09 (s, 1Н), 2,04 (d, J=6,0 Гц, 2Н), 1,93-1,54 (m, 8Н);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 175,72, 165,03, 163,23, 162,76, 158,21, 157,11, 155,48, 151,94, 146,36, 139,67, 130,12, 128,51, 125,38, 118,92, 116,40, 116,26, 73,99, 60,43, 50,98, 49,45, 34,85, 30,89, 25,42, 21,50.
Пример 7: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиридо [2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлорпиридо[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00258] К ацетонитрилу (15 мл) добавляли (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (405 мг, 2,21 ммоль), 2,4-дихлорпиридо[2,3-d]пиримидин (401 мг, 2,00 ммоль) и калия фосфат (1,28 г, 6,03 ммоль). Смесь перемешивали при 80°С в течение ночи в защитной атмосфере азота. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (30 мл). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/МеОН (отношение объемов)=2/1-1/2), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (676 мг, 97%).
МС (ИЭР, пол. ион) m/z: 347,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,97-8,89 (m, 1Н), 8,48 (d, J=1,2 Гц, 1H), 7,32 (dd, 7=8,2, 4,4 Гц, 1H), 7,11 (s, 1H), 4,71 (s, 1H), 3,76 (s, 3H), 2,65 (d, J=4,3 Гц, 1H), 2,05 (d, J=2,3 Гц, 1H), 1,99 (s, 1H), 1,85 (d, J=11,0 Гц, 2H), 1,73-1,54 (m, 5H), 1,45 (m, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиридо[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00259] К смеси растворителя 2-метилтетрагидрофурана (5 мл) и воды (1 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (223 мг, 0,53 ммоль), K3PO4 (190 мг, 0,90 ммоль), Pd2(dba)3 (42 мг, 0,05 ммоль), (+/-)-транс-метил 3-((2-хлорпиридо[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (155 мг, 0,45 ммоль) и X-phos (22 мг, 0,05 ммоль). Смесь перемешивали при 78°С в течение ночи в защитной атмосфере азота. Смесь разбавляли этилацетатом (40 мл), и полученную смесь фильтровали через целитовую прокладку. Фильтрат разделяли на фракции, органический слой концентрировали под вакуумом, и затем остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=50/1-20/1), чтобы получить указанное в заголовке соединение в виде светло-желтой пены (96 мг, 36%).
МС (ИЭР, пол. ион) m/z: 601,3 [М+Н]+;
1H ЯМР (600 МГц, CDCl3) δ (ppm): 9,07 (dd, J=4,3, 1,6 Гц, 1Н), 8,93 (dd, J=8,7, 2,8 Гц, 1H), 8,90 (s, 1H), 8,33 (d, J=2,1 Гц, 1H), 8,17 (d, J=8,4 Гц, 2H), 8,14 (dd, J=8,1, 1,5 Гц, 1H), 7,38 (dd, J=8,1, 4,4 Гц, 1H), 7,31 (d, J=8,2 Гц, 2H), 5,99 (d, J=6,4 Гц, 1H), 5,01 (s, 1H), 3,75 (s, 3H), 2,54 (d, J=5,5 Гц, 1H), 2,40 (s, 3H), 2,17-2,11 (m, 2H), 2,02-1,97 (m, 1H), 1,77-1,72 (m, 3H), 1,65 (m, 4H).
Стадия 3:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиридо[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00260] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиридо[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (92 мг, 0,15 ммоль) в THF/MeOH/H2O (отношение объемов/v=1/1/1, 3 мл) добавляли гидроксид натрия (62 мг, 1,55 ммоль). Смесь перемешивали при к.т. в течение ночи, затем смесь разбавляли водой (15 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6,0. Смесь перемешивали при к.т. в течение 30 мин, и фильтровали чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (45 мг, 68%).
МС (ИЭР, пол. ион) m/z: 433,2 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,48 (s, 1Н), 8,93 (d, J=5,7 Гц, 2H), 8,71 (d, J=7,7 Гц, 1H), 8,49 (s, 1H), 8,41 (s, 1H), 8,32 (s, 1H), 7,46 (d, J=5,1 Гц, 1H), 4,94 (s, 1H), 3,01 (d, J=5,9 Гц, 1H), 2,07 (s, 2H), 1,92-1,80 (m, 3H), 1,72-1,40 (m, 5H).
Пример 8: (R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)-4,4-диметилвалериановая кислота
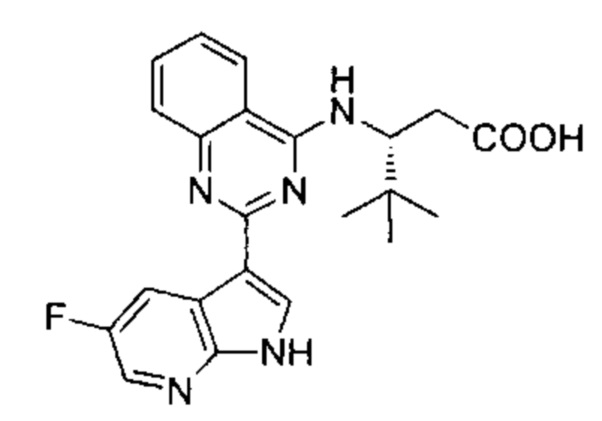
Стадия 1: (R)-метил 3-амино-4,4-диметилпентаноат
[00261] К раствору (R)-3-амино-4,4-диметилвалериановой кислоты (1,01 г, 6,96 ммоль) в метаноле (60 мл) медленно, по каплям добавляли оксалилхлорид (0,9 мл, 10 ммоль) при 0°С, и Смесь перемешивали в течение 1 ч поддерживая при этой температуре. Смесь нагревали до 65°С и перемешивали в течение 2 ч. Смесь концентрировали под вакуумом досуха, затем остаток промывали толуолом (30 мл × 3) и фильтровали, чтобы получить указанное в заголовке соединение в виде белого твердого вещества (1,11 г, 99%).
МС (ИЭР, пол. ион) m/z: 160,3 [М+Н]+.
Стадия 2: (R)-метил 3-((2-хлорхиназолин-4-ил)амино)-4,4-диметилпентаноат
[00262] К раствору (R)-метил 3-амино-4,4-диметилпентаноата (700 мг, 4,39 ммоль) в тетрагидрофуране (20 мл) добавляли DIPEA (3,63 мл, 22,0 ммоль) и 2,4-дихлорхиназолин (875 мг, 4,39 ммоль). Смесь перемешивали при к.т. в течение ночи. Смесь концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (907 мг, 64%).
МС (ИЭР, пол. ион) m/z: 322,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,77-7,74 (m, 2Н), 7,48 (dd, J=11,3, 5,0 Гц, 1H), 6,93 (d, J=9,5 Гц, 1H), 4,85 (ddd, J=9,7, 6,8, 4,9 Гц, 1H), 3,68 (s, 3H), 2,74 (dd, J=15,1, 4,8 Гц, 1H), 2,64 (dd, J=15,1, 6,9 Гц, 1H), 1,05 (s, 9H).
Стадия 3:
(R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)-4,4-диметилпентаноат
[00263] К смеси растворителя 1,4-диоксана (8 мл) и воды (1 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1Н-пирроло[2,3-b]пиридин (400 мг, 0,62 ммоль), карбонат калия (155 мг, 1,12 ммоль), Pd(dppf)Cl2 (45 мг, 0,05 ммоль) и (R)-метил 3-((2-хлорхиназолин-4-ил)амино)-4,4-диметилпентаноат (180 мг, 0,56 ммоль). Для дегазирования смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаивали, и смесь перемешивали при 110°С в течение 2 часов. Смесь разбавляли этилацетатом (20 мл), и полученную смесь фильтровали через целитовую прокладку. Фильтрат разделяли на фракции, органический слой концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=6/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (200 мг, 62%).
МС (ИЭР, пол. ион) m/z: 644,2 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,85 (dd, J=9,0, 2,8 Гц, 1H), 8,34 (d, J=1,9 Гц, 1H), 8,14 (d, J=8,3 Гц, 2H), 7,89 (d, J=8,0 Гц, 1H), 7,76 (t, J=7,6 Гц, 2H), 7,46 (t, J=7,5 Гц, 1H), 7,30 (d, J=8,3 Гц, 2H), 6,37 (d, J=9,4 Гц, 1H), 5,06 (ddd, J=9,2, 7,5, 5,1 Гц, 1H), 3,59 (s, 3H), 2,82 (dd, J=14,8, 4,9 Гц, 1H), 2,68 (dd, J=14,8, 7,5 Гц, 1H), 2,39 (s, 3H), 1,12 (s, 9H).
Стадия 4:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)-4,4-диметилвалериановая кислота
[00264] К раствору (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)хиназолин-4-ил)амино)-4,4-диметилпентаноата (190 мг, 0,33 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли водный раствор гидроксида натрия (4 М, 0,83 мл, 3,33 ммоль). Смесь перемешивали при 30°С в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6,0, затем экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом, фильтровали и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (55 мг,41%).
МС (ИЭР, пол. ион) m/z: 408,3 [М+Н]+;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,33 (s, 1Н), 8,82 (d, J=9,6 Гц, 1H), 8,42 (d, J=7,5 Гц, 2H), 8,31 (s, 1H), 7,75 (s, 2H), 7,43 (s, 1H), 5,16 (m, 1H), 2,75 (d, J=14,6 Гц, 1H), 2,70-2,63 (m, 1H), 1,03 (s, 9H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 173,83, 160,54, 158,60, 156,92, 155,33, 146,52, 133,17, 131,90, 131,71, 124,61, 123,58, 119,17, 119,12, 116,21, 116,07, 113,52, 55,86, 36,15, 35,86, 27,14.
Пример 9: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
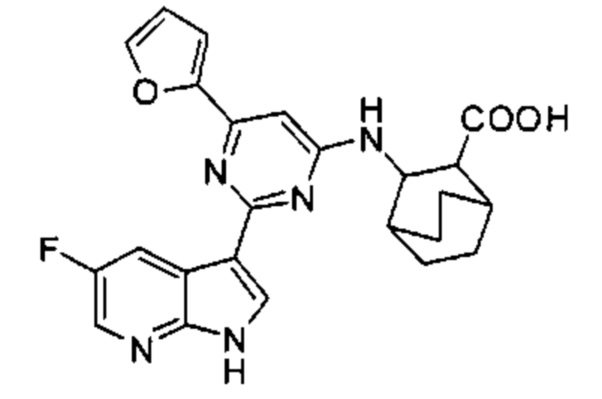
Стадия 1: 2,4-дихлор-6-(фуран-2-ил)пиримидин
[00265] К раствору 2,4,6-трихлорпиримидина (100 мг, 0,55 ммоль) в THF (4 мл) добавляли тетракис(трифенилфосфин)палладий (43 мг, 0,05 ммоль), 2-фурилборную кислоту (61 мг, 0,55 моль) и водный раствор натрия бикарбоната (1 М, 1,64 мл, 1,64 ммоль). Смесь перемешивали при 80°С в течение ночи в защитной атмосфере азота. В реакционную смесь добавляли воду (50 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде зеленого твердого вещества (42 мг, 36%).
МС (ИЭР, пол. ион) m/z: 215,0 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,67 (d, J=0,7 Гц, 1H), 7,58 (s, 1H), 7,43 (d, J=3,4 Гц, 1H), 6,65 (dd, J=3,4, 1,6 Гц, 1H).
Стадия 2:
(+/-)транс-метил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00266] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (429 мг, 2,34 ммоль) и 2,4-дихлор-6-(фуран-2-ил)пиримидина (420 мг, 1,95 ммоль) в ДМФ (5 мл) добавляли карбонат калия (809 мг, 5,86 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4 и фильтровали, затем фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (383 мг, 54%).
МС (ИЭР, пол. ион) m/z: 362,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,56 (s, 1Н), 7,22 (s, 1H), 6,93 (s, 1H), 6,55 (d, J=1,6 Гц, 1H), 5,47 (d, J=5,5 Гц, 1H), 4,44 (s, 1H), 3,70 (s, 3H), 2,44-2,33 (m, 1H), 1,96 (d, J=2,5 Гц, 1H), 1,88 (s, 1H), 1,84-1,58 (m, 8H).
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00267] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (276 мг, 0,33 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2- карбоксилат (100 мг, 0,28 ммоль), карбонат калия (114 мг, 0,83 ммоль), Pd(dppf)Cl2 (45 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и Н2О (0,2 мл). Для удаления воздуха из полученного раствора выполняли барботирование азотом в течение 10 мин и затем проводили реакцию в пробирке под воздействием микроволнового излучения при 110°С в течение 2 ч. Реакционную смесь пропускали через целит, и осадок на фильтре промывали EtOAc (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (72 мг, 42%).
МС (ИЭР, пол. ион) m/z: 616,2[М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,70-8,64 (m, 2Н), 8,33 (d, J=2,0 Гц, 1Н), 8,12 (d, J=8,3 Гц, 2H), 7,59 (s, 1Н), 7,30 (s, 1H), 7,26 (d, J=3,2 Гц, 1H), 6,67 (s, 1H), 6,60 (dd, J=3,3, 1,7 Гц, 1H), 4,76 (s, 1H), 3,75 (s, 3H), 2,45 (s, 1H), 2,39 (s, 3H), 2,10 (s, 1H), 1,98 (s, 1H), 1,42 (m, 8Н).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил) амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00268] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (75 мг, 0,12 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли водный раствор NaOH (4 М, 0,30 мл, 1,20 ммоль), и полученную смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН смеси доводили до 5,5 соляной кислотой (1 М). Затем смесь экстрагировали EtOAc (20 мл × 3). Органические слои объединяли, промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (35 мг, 64%).
МС (ИЭР, пол. ион) m/z: 472,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 448,1776 [М+Н]+, (C24H23FN5O3)[M+H]+ теоретическое значение: 448,1785;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,60 (s, 1H), 8,32 (s, 1H), 8,28 (s, 1H), 7,88 (s, 1H), 7,55 (s, 1H), 7,24 (s, 1H), 6,69 (s, 1H), 6,63 (s, 1H), 4,62 (s, 1H), 1,99 (s, 2H), 1,83-1,33 (m, 10H).
Пример 9a:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2- карбоксилат гидрохлорид
[00269] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2:
(2S,3S)-этил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00270] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 2 Примера 9, при использовании (2S,3S)-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата гидрохлорида (331 мг, 1,42 ммоль), 2,4-дихлор-6-(фуран-2-ил)пиримидина (278 мг, 1,29 ммоль), карбоната калия (590 мг, 4,26 ммоль) в качестве реагентов и DMF (6 мл) в качестве растворителя. Указанное в заголовке соединение представляло собой светло-желтое твердое вещество (247 мг, 51%).
Стадия 3:
(2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00271] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 3 Примера 9, при использовании (2S,3S)-этил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилата (78 мг, 0,21 ммоль), 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (203 мг, 0,29 ммоль, 60%), карбоната калия (87 мг, 0,63 ммоль), Pd(dppf)Cl2 (15 мг, 0,02 ммоль), 1,4-диоксана (3 мл) и воды (0,2 мл). Указанное в заголовке соединение представляло собой светло-желтое твердое вещество (81 мг, 61%).
Стадия 4:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00272] К раствору (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (81 мг, 0,13 ммоль) в THF/EtOH (отношение объемов=1/1, 4 мл) добавляли водный раствор гидроксида натрия (4 М, 0,33 мл, 1,30 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали в вакууме, и осадок очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1) с получением указанного в заголовке соединения в виде твердого желтого вещества (35 мг, 64%).
МС (ИЭР, пол. ион) m/z: 448,5 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 448,1763 [М+Н]+, (C24H23FN5O3)[M+H]+ теоретическое значение: 448,1785;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,29 (s, 1Н), 8,62 (s, 1H), 8,33 (s, 1H), 8,28 (s, 1H), 7,88 (s, 1H), 7,58 (s, 1H), 7,24 (s, 1H), 6,69 (s, 1H), 6,65 (s, 1H), 4,63 (s, 1H), 1,99 (s, 2H), 1,80-1,38 (m, 8H).
Пример 10:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(2-фенилэтинил)пиримидин
[00273] К раствору 2,4,6-трихлорпиримидина (101 мг, 0,55 ммоль) в толуоле (3 мл) добавляли трибутил(2-фенилэтинил)станнан (259 мг, 0,66 ммоль), трифениларсин (67 мг, 0,22 ммоль), Pd(PPh3)Cl2 (40 мг, 0,06 ммоль). Реакционную смесь нагревали до 80°С и перемешивали в течение 6 ч в защитной атмосфере азота. Смесь концентрировали под вакуумом, и полученный остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (129 мг, 94%).
МС (ИЭР, пол. ион) m/z: 249,3 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,40 (t, J=7,9 Гц, 2Н), 8,29 (d, J=8,7 Гц, 1Н), 7,88-7,74 (m, 2H).
Стадия 2:
(+/-)-транс-метил 3-(2-хлор-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00274] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (405 мг, 2,21 ммоль) и 2,4-дихлор-6-(фенилэтинил)пиримидина (500 мг, 2,01 ммоль) в DMF (5 мл) добавляли карбонат калия (306 мг, 2,21 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (470 мг, 59%).
МС (ИЭР, пол. ион) m/z: 396,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,59 (d, J=6,8 Гц, 2Н), 7,41-7,37 (m, 3H), 6,55 (s, 1Н), 5,50 (s, 1H), 3,76 (s, 3H), 2,36 (d, J=5,3 Гц, 1H), 1,84 (s, 1H), 1,70-1,42 (m, 10H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00275] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (253 мг, 0,30 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2- карбоксилат (100 мг, 0,25 ммоль), карбонат калия (105 мг, 0,76 ммоль), Pd(dppf)Cl2 (42 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и Н2О (0,2 мл). Для удаления воздуха из полученной смеси выполняли барботирование азотом в течение 3 мин и затем проводили реакцию в пробирке под воздействием микроволнового излучения при 110°С в течение 2 ч. Реакционную смесь пропускали через целит, и осадок на фильтре промывали EtOAc (50 мл). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (37 мг, 23%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,70 (s, 1H), 8,65 (dd, J=8,8, 2,7 Гц, 1H), 8,32 (s, 1H), 8,12 (d, J=8,3 Гц, 2H), 7,73 (dd, J=5,6, 3,4 Гц, 2H), 7,69-7,63 (m, 2H), 7,55 (dd, J=5,6, 3,3 Гц, 2H), 7,43 (s, 1H), 7,31 (s, 1H), 6,52 (s, 1H), 3,81 (s, 1H), 3,75 (s, 3H), 2,42 (s, 1H), 2,39 (s, 3H), 2,11 (s, 1H), 1,97 (s, 1H), 1,80-1,64 (m, 8H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00276] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (37 мг, 0,06 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор NaOH (4 М, 0,15 мл, 0,60 ммоль), смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН полученной смеси доводили соляной кислотой (1 М) до 5,5, затем экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным Na2SO4 и фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (19 мг, 69%).
МС (ИЭР, пол. ион) m/z: 482,5 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,33 (s, 1Н), 8,60 (s, 1H), 8,43 (s, 1H), 8,38 (t, J=9,5 Гц, 4H), 8,30 (s, 1H), 7,66 (s, 1H), 6,88 (s, 1H), 4,71 (s, 1H), 2,67 (s, 1H), 2,33 (s, 1H), 1,44 (s, 8H).
Пример 10a: (2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фенилэтинил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00277] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2:
(2S,3S)-этил 3-((2-хлор-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00278] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 2 Примера 10, при использовании (2S,3S)-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорида (386 мг, 1,65 ммоль), 2,4-дихлор-6-(фенилэтинил)пиримидина (410 мг, 1,65 ммоль), карбоната калия (684 мг, 4,95 ммоль) в качестве реагентов и DMF (5 мл) в качестве растворителя. Указанное в заголовке соединение представляло собой желтое твердое вещество (458 мг, 68%).
МС (ИЭР, пол. ион) m/z: 410,3 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,63-7,57 (m, 2Н), 7,43-7,36 (m, 3H), 6,57 (s, 1Н), 5,50 (s, 1H), 4,22 (q, J=7,1 Гц, 2H), 2,34 (d, J=5,1 Гц, 1H), 2,09 (s, 1H), 1,85 (d, J=2,4 Гц, 1H), 1,78-1,63 (m, 6H), 1,57 (d, J=9,8 Гц, 2H), 1,29 (t, J=7,1 Гц, 3H).
Стадия 3:
(2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил) пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00279] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 3 Примера 10, при использовании 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1Н-пирроло[2,3-b]пиридина (541 мг, 0,59 ммоль, 45%), (2S,3S)-этил 3-((2-хлор-6-(фенилэтинил пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,49 ммоль), карбоната калия (202 мг, 1,46 ммоль) и Pd(dppf)Cl2 (79 мг, 0,10 ммоль) в качестве реагентов, и смесь 1,4-диоксана (3 мл) и воды (0,2 мл) в качестве смешанного растворителя. Указанное в заголовке соединение представляло собой желтое твердое вещество (46 мг, 14%).
МС (ИЭР, пол. ион) m/z: 664,2 [М+Н]+.
Стадия 4:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(2-фенилэтинил)пиримидин-4-ил) амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00280] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 4 Примера 10, при использовании (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (46 мг, 0,07 ммоль), водного раствора NaOH (4 М, 0,18 мл, 0,70 ммоль), и смешанного растворителя THF/MeOH (отношение объемов=1/1, 2 мл). Указанное в заголовке соединение представляло собой желтое твердое вещество (10 мг, 30%).
МС (ИЭР, пол. ион) m/z: 482,1 [М+Н]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,35 (s, 1Н), 8,56 (d, J=8,6 Гц, 1H), 8,28 (s, 2H), 7,93 (s, 1H), 7,64 (s, 2H), 7,49 (s, 3H), 6,58 (s, 1H), 4,64 (s, 1H), 2,56 (s, 1H), 1,87-1,49 (m, 10H).
Пример 11:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-феноксипиримидин
[00281] К раствору 2,4,6-трихлорпиримидина (500 мг, 2,73 ммоль) в ацетоне (6 мл) медленно, по каплям добавляли смесь фенола (257 мг, 2,73 ммоль) и NaOH (112 мг, 2,78 ммоль) при 0°С. Смесь перемешивали в течение 3 ч при комнатной температуре. Затем к смеси добавляли 30 мл H2O. Полученную смесь экстрагировали EtOAc (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде бесцветного масла (569 мг, 87%).
МС (ИЭР, пол. ион) m/z: 249,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,48 (t, J=8,0 Гц, 2H), 7,34 (t, J=7,5 Гц, 1H), 7,18-7,14 (m, 2H), 6,80 (s, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00282] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (460 мг, 2,51 ммоль) и 2,4-дихлор-6-фенокси-пиримидина (550 мг, 2,28 ммоль) в ДМФ (5 мл) добавляли карбонат калия (346 мг, 2,51 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (386 мг, 44%).
МС (ИЭР, пол. ион) m/z: 388,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,59 (d, J=6,8 Гц, 2Н), 7,41-7,37 (m, 3H), 6,55 (s, 1H), 5,50 (s, 1H), 3,76 (s, 3H), 2,36 (d, J=5,3 Гц, 1H), 1,84 (s, 1H), 1,70-1,42 (m, 10H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00283] В запаянную трубку вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (258 мг, 0,31 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,26 ммоль), карбонат калия (106 мг, 0,77 ммоль), Pd(dppf)Cl2 (42 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и H2O (0,2 мл). Полученную смесь в запаянной трубке перемешивали при 110°С в течение 3 ч в защитной атмосфере азота. Реакционную смесь пропускали через целит, и осадок на фильтре промывали EtOAc (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (80 мг, 48%).
МС (ИЭР, пол. ион) m/z: 642,6[М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,45 (s, 1Н), 8,34 (s, 1H), 8,28 (s, 1H), 8,10 (d, J=8,3 Гц, 2H), 7,46 (t, J=7,8 Гц, 2H), 7,31 (d, J=8,3 Гц, 3H), 7,20 (d, J=7,8 Гц, 2H), 6,39 (s, 1H), 5,16 (s, 1H), 4,64 (s, 1H), 3,64 (s, 3H), 2,40 (s, 3H), 2,32 (d, J=6,3 Гц, 1H), 2,01 (s, 1H), 1,71 (d, J=11,5 Гц, 2H), 1,55-1,30 (m, 6H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00284] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-феноксипиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (173 мг, 0,27 ммоль) в смешанном растворителе THF/MeOH (отношение объемов=1/1, 3 мл) добавляли водный раствор NaOH (4 М, 0,67 мл, 2,70 ммоль), и смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН полученной смеси доводили до рН 5,5 соляной кислотой (1 М). Затем смесь экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным Na2SO4 и фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (70 мг, 55%).
МС (ИЭР, пол. ион) m/z: 474,1 [М+Н]+;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,37 (s, 1Н), 12,20 (s, 1H), 8,50 (s, 1H), 8,29 (s, 1H), 7,43 (s, 2H), 7,29-7,17 (m, 3H), 7,10 (d, J=5,0 Гц, 1H), 6,73 (s, 1H), 4,55 (s, 1H), 3,60 (s, 1H), 3,36 (s, 3H), 2,68 (s, 1H), 1,77 (m, 8H).
Пример 12: (+/-)-транс-3-((2-(5-фтор-1Н-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
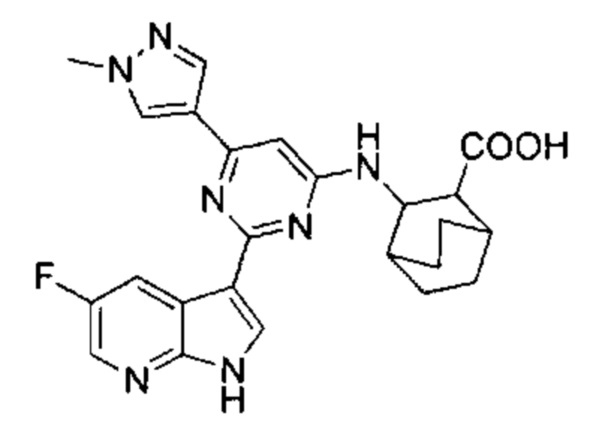
Стадия 1: 2,4-дихлор-6-(1-метил-1H-пиразол-4-ил)пиримидин
[00285] К раствору 2,4,6-трихлорпиримидина (100 мг, 0,55 ммоль) в THF (4 мл) добавляли Pd(PPh3)2Cl2 (38 мг, 0,05 ммоль), (1-метилпиразол-4-ил)борную кислоту (68 мг, 0,55 моль) и водный раствор Na2CO3 (1 М, 1,10 мл, 1,10 ммоль). Реакционную смесь нагревали до 70°С в защитной атмосфере азота и перемешивали в течение 4 ч. Затем к смеси добавляли воду (50 мл). Смесь экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали, затем фильтрат концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (94 мг, 75%).
МС (ИЭР, пол. ион) m/z: 229,0 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,12 (s, 1Н), 8,03 (s, 1H), 7,34 (s, 1H), 4,00 (s, 3H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00286] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (88 мг, 0,48 ммоль), 2,4-дихлор-6-(1-метил-1H-пиразол-4-ил)пиримидина (92 мг, 0,40 ммоль) в ДМФ (2 мл) добавляли карбонат калия (167 мг, 1,20 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (87 мг, 58%).
МС (ИЭР, пол. ион) m/z: 376,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,02 (s, 1Н), 7,94 (s, 1H), 6,52 (s, 1H), 5,37 (s, 1H), 3,96 (s, 3H), 3,75 (s, 3H), 2,38 (d, J=5,0 Гц, 1H), 2,07 (d, J=5,7 Гц, 1H), 1,86 (d, J=2,6 Гц, 1H), 1,49 (m, 8H).
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00287] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (231 мг, 0,28 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-(1-метилпиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (87 мг, 0,23 ммоль), калия ацетат (95 мг, 0,69 ммоль), Pd(dppf)Cl2 (37 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и H2O (0,2 мл). Для удаления воздуха из полученной смеси выполняли барботирование азотом в течение 10 мин, и затем смесь перемешивали при 110°С при нагревании в микроволновой печи в течение 2 ч. Реакционную смесь фильтровали через целитовую прокладку и осадок на фильтре промывали EtOAc (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (54 мг, 37%).
МС (ИЭР, пол. ион) m/z: 630,2[М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,66 (s, 1Н), 8,63 (dd, J=8,9, 2,6 Гц, 1H), 8,33 (s, 1H), 8,12 (d, J=8,2 Гц, 2H), 8,06 (s, 1H), 8,01 (s, 1H), 7,30 (s, 1H), 6,47 (s, 1H), 5,15 (s, 1H), 4,49 (s, 1H), 4,03 (s, 3H), 3,74 (s, 3H), 2,43 (d, J=5,1 Гц, 1H), 2,39 (s, 3H), 2,10 (s, 1H), 1,97 (s, 1H), 1,52-1,39 (m, 8H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00288] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (54 мг, 0,09 ммоль) в THF/MeOH (отношение объемов=1/1, 3 мл) добавляли водный раствор NaOH (4 М, 0,23 мл, 0,90 ммоль), и смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН смеси доводили до рН 5,5 соляной кислотой (1 М). Затем смесь экстрагировали EtOAc (20 мл × 3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (17 мг, 43%).
МС (ИЭР, пол. ион) m/z. 462,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 462,2062 [М+Н]+, (C24H25FN7O2) [М+Н]+ теоретическое значение: 462,2054;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,23 (s, 1Н), 8,63 (s, 1Н), 8,32 (s, 1Н), 8,27 (s, 1Н), 7,99 (s, 1Н), 7,31 (s, 1H), 6,43 (s, 1Н), 4,61 (s, 1Н), 3,92 (s, 3Н), 1,98 (s, 1Н), 1,79 (s, 1Н), 1,74-1,26 (m, 8Н).
Пример 13: (+/-)-транс-3-((2-(5-фтор-1H-пирроло [2,3-b]пиридин-3-ил)-6-(1-метил-1Н-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(1-метил-1H-пиррол-3-ил)пиримидин
[00289] К раствору 2,4,6-трихлорпиримидина (500 мг, 2,73 ммоль) в THF (20 мл) добавляли Pd(PPh3)2Cl2 (191 мг, 0,27 ммоль), (1-метилпиррол-3-ил)борную кислоту (627 мг, 2,73 моль) и водный раствор Na2CO3 (1 М, 5,45 мл, 5,45 ммоль). Реакционную смесь нагревали до 70°С и перемешивали в течение 4 ч в защитной атмосфере азота. К смеси добавляли воду (50 мл). Полученную смесь экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4 и фильтровали, затем фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (484 мг, 78%).
МС (ИЭР, пол. ион) m/z: 228,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,48 (s, 1Н), 7,25 (s, 1H), 6,70-6,58 (m, 2H), 3,73 (s, 3H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00290] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (466 мг, 2,54 ммоль), 2,4-дихлор-6-(1-метилпиррол-3-ил)пиримидина (484 мг, 2,12 ммоль) в ДМФ (6 мл) добавляли карбонат калия (879 мг, 6,36 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (234 мг, 29%).
МС (ИЭР, пол. ион) m/z: 375,1 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,39 (s, 1H), 6,62 (s, 1H), 6,57 (s, 1H), 6,44 (s, 1H), 5,32 (s, 2H), 4,24 (d, J=5,8 Гц, 1H), 3,74 (s, 3H), 3,69 (s, 3H), 2,37 (d, J=4,8 Гц, 1H), 1,86 (d, J=2,5 Гц, 1H), 1,71-1,40 (m, 8H).
Стадия 3: (
+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00291] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (647 мг; 0,78 ммоль),
(+/-)-транс-метил
3-((2-хлор-6-(1-метилпиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (243 мг, 0,65 ммоль), калия ацетат (268 мг, 1,95 ммоль), Pd(dppf)Cl2 (105 мг, 0,13 ммоль), 1,4-диоксан (3 мл) и Н2О (0,2 мл). Для удаления воздуха из полученной смеси выполняли барботирование азотом в течение 10 мин и перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 ч. Реакционную смесь фильтровали через целитовую прокладку и осадок на фильтре промывали EtOAc (50 мл). Полученный фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (330 мг, 81%).
МС (ИЭР, пол. ион) m/z: 629,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,70-8,61 (m, 2Н), 8,31 (s, 1H), 8,10 (d, J=8,2 Гц, 2Н), 7,42 (s, 1Н), 7,27 (s, 1Н), 6,67 (s, 2Н), 6,43 (s, 1H), 5,32 (s, 1Н), 3,80 (s, 3Н), 3,76 (s, 3Н), 2,43 (d, J=5,0 Гц, 1Н), 2,38 (s, 3Н), 1,96 (s, 1Н), 1,73 (s, 10Н).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00292] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (330 мг, 0,52 ммоль) в THF/MeOH (отношение объемов=1/1, 3 мл) добавляли водный раствор NaOH (4 М, 1,30 мл, 5,20 ммоль), и полученную смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН смеси доводили до рН 5,5 соляной кислотой (1 М). Затем смесь экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (42 мг, 17%).
МС (ИЭР, пол. ион) m/z: 461,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 461,2114 [М+Н]+, (C24H23FN5O3) [М+Н]+ теоретическое значение: 461,2101;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,63 (s, 1H), 8,27 (s, 2H), 7,51 (s, 1H), 7,28 (s, 1H), 6,81 (s, 1H), 6,55 (s, 1H), 6,41 (s, 1H), 4,60 (s, 1H), 3,62 (s, 3H), 2,03-1,30 (m, 10H).
Пример 14:
(+/-)-/транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-[4,5'-бипиримидин]-6-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
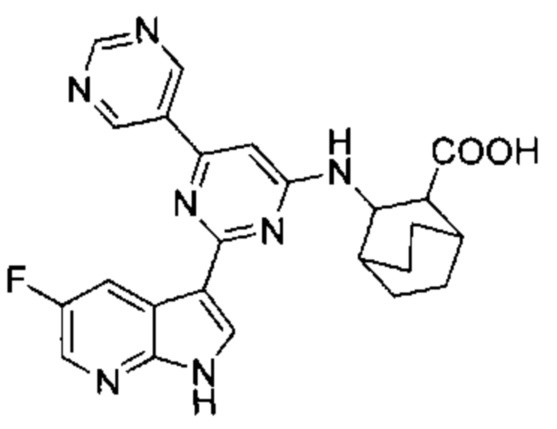
Стадия 1: 2,6-дихлор-4,5'-бипиримидин
[00293] К раствору 2,4,6-трихлорпиримидина (100 мг, 0,55 ммоль) в ацетонитриле (4 мл) добавляли Pd(dppf)Cl2 (89 мг, 0,11 ммоль), пиримидин-5-ил-борную кислоту (67 мг, 0,55 моль), CsCO3 (266 мг, 0,82 ммоль) и H2O (0,5 мл). Реакционную смесь нагревали до 95°С в защитной атмосфере азота и перемешивали в течение 5 ч. Затем к смеси добавляли 50 мл воды. Смесь экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде красного твердого вещества (44 мг, 36%).
МС (ИЭР, пол. ион) m/z: 228,0 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 9,41 (s, 3Н), 7,76 (s, 1Н).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-[4,5'-бипиримидин]-6-ил)амино)бицикло [2,2,2]октан-2-карбоксилат
[00294] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (73 мг, 0,40 ммоль), 2,6-дихлор-4,5'-бипиримидин (76 мг, 0,33 ммоль) в ДМФ (2 мл) добавляли карбонат калия (138 мг, 1,00 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=1/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (65 мг, 52%).
МС (ИЭР, пол. ион) m/z: 374,4 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 9,32 (s, 3Н), 6,95 (s, 1Н), 5,77 (s, 1H), 4,36 (s, 1H), 3,77 (s, 3H), 2,41 (d, J=3,4 Гц, 1H), 1,88 (s, 1H), 1,83-1,65 (m, 8H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-[4,5'-бипиримидин]-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00295] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (173 мг, 0,21 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-[4,5'-бипиримидин]-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (65 мг, 0,17 ммоль), калия ацетат (72 мг, 0,52 ммоль), Pd(dppf)Cl2 (28 мг, 0,03 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из полученного раствора выполняли барботирование азотом в течение 10 мин и затем перемешивали при 110°С в течение 2 ч при нагревании под воздействием микроволнового излучения. Реакционную смесь фильтровали через целитовую прокладку и осадок на фильтре промывали EtOAc (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (50 мг, 46%).
МС (ИЭР, пол. ион) m/z: 628,7 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 9,41 (s, 2Н), 9,35 (s, 1Н), 8,73 (s, 1H), 8,35 (s, 1H), 8,15 (d, J=8,3 Гц, 2H), 5,37 (s, 1H), 3,76 (s, 3H), 2,46 (s, 1H), 2,40 (s, 3H), 2,14 (s, 1H), 2,05-1,99 (m, 2H), 1,49-1,41 (m, 8H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-[4,5'-бипиримидин]-6-ил)бицикло[2,2,2]октан-2-карбоксилат
[00296] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-[4,5'-бипиримидин]-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (50 мг, 0,08 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор NaOH (4 М, 0,2 мл, 0,80 ммоль) и смесь перемешивали в течение ночи при 30°С. К смеси добавляли воду (10 мл), и рН смеси доводили до рН 5,5 соляной кислотой (1 М). Затем смесь экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (20 мг, 55%).
МС (ИЭР, пол. ион) m/z: 460,5 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 460,1905 [М+Н]+, (C24H23FN7O2) [M+H]+ теоретическое значение: 460,1897;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,36 (s, 1Н), 9,60 (s, 1H), 9,44 (s, 1H), 9,31 (s, 1H), 8,60 (s, 1H), 8,48 (s, 1H), 8,29 (s, 1H), 7,78 (s, 1H), 6,88 (s, 1H), 4,69 (s, 1H), 2,01 (s, 2H), 1,88-1,32 (m, 8H).
Пример 15: (+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
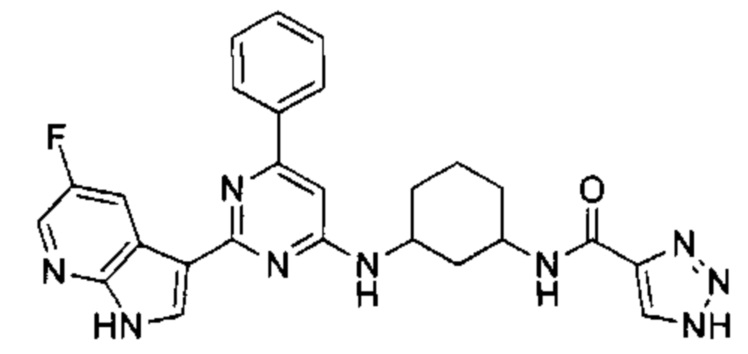
Стадия 1:
(+/-)-цис-3-трет-бутоксикарбониламино-1-бензилоксикарбониламиноциклогексан
[00297] К раствору (+/-)-цис-3-((трет-бутоксикарбонил)амино)циклогексанкарбоновой кислоты (5 г, 20,6 ммоль) в толуоле (60 мл) добавляли триэтиламин (4,6 мл, 33,0 ммоль) и дифенилфосфорил азид (5,32 мл, 24,7 ммоль), и смесь перемешивали в течение 3 ч при к.т. Затем добавляли бензиловый спирт (4,27 мл, 41,1 ммоль), и полученную смесь перемешивали при 100°С в течение ночи в защитной атмосфере азота. Реакционную смесь разбавляли этилацетатом (60 мл), и полученную смесь промывали насыщенным раствором соли (60 мл). Органический слой сушили над безводным натрия сульфатом и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде темно-желтого масала (7,16 г, 100%).
Стадия 2:
(+/-)-цис-N-трет-бутоксикарбонил-1,3-циклогександиамин
[00298] Раствор (+/-)-цис-3-трет-бутоксикарбониламино-1-бензилоксикарбониламиноциклогексана (7,2 г, 21 ммоль) в метаноле (100 мл) помещали в автоклав, и к раствору добавляли Pd/C (10% Pd, 2 г). Полученную смесь перемешивали при к.т. в течение ночи в атмосфере азота под давлением 2 МПа. Реакционную смесь фильтровали через целитовую прокладку, чтобы удалить катализатор, затем осадок на фильтре промывали смесью метанола (200 мл) и этилацетата (200 мл). Фильтрат концентрировали под вакуумом досуха, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=20/1-10/1), чтобы получить указанное в заголовке соединение в виде бесцветного масла (1,65 г, 37%).
МС (ИЭР, пол. ион) m/z: 215,1 [М+Н]+.
Стадия 3: 2,4-дихлор-6-фенилпиримидин
[00299] К раствору 2,4,6-трихлорпиримидина (0,29 мл, 2,5 ммоль) в тетрагидрофуране (5 мл) добавляли палладия ацетат (8 мг, 0,035 ммоль), трифенилфосфин (18 мг, 0,065 ммоль), фенилборную кислоту (0,20 г, 1,6 ммоль) и водный раствор натрия карбоната (1 М, 3,3 мл, 3,3 ммоль). Смесь перемешивали при 60°С в течение 6 ч, затем охлаждали до к.т. и концентрировали, чтобы удалить органический растворитель. К остатку добавляли Н2О (10 мл), и смесь экстрагировали EtOAc (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (0,225 г, 61%).
МС (ИЭР, пол. ион) m/z: 224,95 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,15-8,04 (m, 2Н), 7,70 (s, 1Н), 7,63-7,50 (m, 3Н).
Стадия 4:
(+/-)-цис-трет-бутил (3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)карбамат
[00300] К раствору 2,4-дихлор-6-фенилпиримидина (727 мг, 3,23 ммоль) и (+/-)-цис-N-трет-бутоксикарбонил-1,3-циклогександиамина (630 мг, 2,94 ммоль) в N,N-диметилформамиде (5 мл) добавляли карбонат калия (1,22 г, 8,82 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (50 мл) и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4, и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (516 мг, 43%).
MS-ИЭР: (ИЭР, пол. ион) m/z: 403,1 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,02-7,93 (m, 2Н), 7,53-7,44 (m, 3Н), 6,59 (s, 1Н), 4,45 (s, 1H), 3,60 (s, 1H), 2,43 (d, J=11,8 Гц, 1H), 2,10 (d, J=14,5 Гц, 2H), 1,89 (d, J=14,0 Гц, 1H), 1,63 (s, 4H), 1,57-1,43 (m, 11H).
Стадия 5: N1-(2-хлор-6-фенилпиримидин-4-ил)циклогексан-1,3-диамин
[00301] К раствору соляной кислоты в 1,4-диоксане (1,1 мл, 5,5 ммоль, 5 моль/л) добавляли (+/-)-цис-трет-бутил (3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)карбамат (220 мг, 0,55 ммоль), и смесь перемешивали при к.т. в течение ночи. Реакционную смесь концентрировали под вакуумом для удаления растворителя и к остатку добавляли необходимое количество воды. Полученную смесь корректировали насыщенным водным раствором натрия бикарбоната до рН 9. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом досуха чтобы получить указанное в заголовке соединение в виде белого твердого вещества (144 мг, 87%).
МС (ИЭР, пол. ион) m/z: 303,1 [М+Н]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,99-7,89 (m, 2Н), 7,58-7,41 (m, 3Н), 6,57 (s, 1Н), 5,74 (s, 1H), 2,25-2,14 (m, 1H), 2,00 (d, J=13,2 Гц, 1H), 1,88 (d, J=9,8 Гц, 2H), 1,58-1,37 (m, 2H), 1,30-1,12 (m, 4H).
Стадия 6:
(+/-)-цис-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
[00302] К раствору N1-(2-хлор-6-фенилпиримидин-4-ил)циклогексан-1,3-диамина (65 мг, 0,21 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметилсульфоксид (1 мл) добавляли N,N-диизопропилэтиламин (0,11 мл, 0,7 ммоль) и 1H-1,2,3-триазол-4-карбоновую кислоту (48 мг, 0,42 ммоль). Смесь перемешивали при к.т. в течение 10 мин, затем добавляли HATU (163 мг, 0,43 ммоль), и полученную смесь перемешивали при к.т. в течение 3 часов. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, чтобы получить указанное в заголовке соединение в виде бесцветного твердого вещества (85 мг, 100%).
МС (ИЭР, пол. ион) m/z: 398,5 [М+Н]+.
Стадия 7:
(+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1Н-1,2,3-триазол-4-карбоксамид
[00303] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (652 мг, 0,55 ммоль, 50%), (+/-)-цис-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид (85 мг, 0,21 ммоль), карбонат калия (88 мг, 0,64 ммоль), Pd(dppf)Cl2 (34 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (139 мг, 100%).
МС (ИЭР, пол. ион) m/z: 652,2 [М+Н]+.
Стадия 8:
(+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
[00304] К раствору (+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамида (192 мг, 0,29 ммоль) в метаноле (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,6 мл, 2,9 ммоль). Смесь перемешивали при 30°С в течение ночи. Реакционную смесь концентрировали под вакуумом досуха, и к остатку добавляли воду (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (25 мг, 60%).
МС (ИЭР, пол. ион) m/z: 498,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 498,2169 [М+Н]+, (C26H25FN9O) [M+H]+ теоретическое значение: 498,2166;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,29 (s, 1Н), 8,58 (s, 1H), 8,41 (s, 2H), 8,29 (s, 1H), 8,11 (s, 2H), 7,58-7,48 (m, 3H), 7,42 (s, 1H), 6,76 (s, 1H), 4,15 (s, 1H), 4,04 (s, 1H), 2,30-1,79 (m, 6H).
Пример 16:
(+/-)-транс-3-((6-(бензофуран-2-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 4-(бензофуран-2-ил)-2,6-дихлорпиримидин
[00305] К раствору 2,4,6-трихлорпиримидина (50 мг, 0,27 ммоль) в смешанном растворителе, содержащем толуол (3 мл) и этанол (1 мл) добавляли тетракис(трифенилфосфин)палладий (31 мг, 0,03 ммоль), бензофуран-2-ил-борную кислоту (44 мг, 0,28 ммоль) и водный раствор натрия карбоната (1 М, 0,82 мл, 0,82 ммоль). Смесь перемешивали при 85°С в течение 4 ч в защитной атмосфере азота. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (26 мг, 36%).
МС (ИЭР, пол. ион) m/z: 265,0 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,80 (d, J=4,1 Гц, 2H), 7,73 (d, J=7,8 Гц, 1H), 7,60 (d, J=8,4 Гц, 1H), 7,48 (t, J=7,8 Гц, 1H), 7,35 (t, J=7,5 Гц, 1H).
Стадия 2:
(+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-хлорпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00306] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (628 мг, 3,43 ммоль) и 4-(бензофуран-2-ил)-2,6-дихлорпиримидин (758 мг, 2,86 ммоль) растворяли в ДМФ (5 мл), затем добавляли карбонат калия (1,19 г, 8,58 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (553 мг, 47%).
МС (ИЭР, пол. ион) m/z: 412,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,68 (d, J=7,5 Гц, 1H), 7,62-7,54 (m, 2H), 7,40 (dd, 7=9,4, 5,9 Гц, 2H), 6,91 (s, 1H), 5,57 (s, 1H), 4,36 (s, 1H), 3,78 (s, 3H), 2,40 (d, J=5,2 Гц, 1H), 2,34 (d, J=3,7 Гц, 1H), 1,90 (d, J=2,6 Гц, 1H), 1,85-1,69 (m, 8H).
Стадия 3: (+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00307] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (455 мг, 0,44 ммоль, 50%), (+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-хлорпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (166 мг, 0,40 ммоль), карбонат калия (165 мг, 1,20 ммоль), Pd(dppf)Cl2 (65 мг, 0,08 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (57 мг, 35%).
МС (ИЭР, пол. ион) m/z: 666,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,77-8,67 (m, 2Н), 8,35 (d, J=1,7 Гц, 1H), 8,15 (d, J=8,3 Гц, 2H), 7,74 (d, J=7,7 Гц, 1H), 7,65 (s, 1H), 7,59 (d, J=8,2 Гц, 1H), 7,40 (d, J=8,4 Гц, 1H), 7,32 (t, J=8,2 Гц, 3H), 6,89 (s, 1H), 5,24 (s, 1H), 4,60 (s, 1H), 3,77 (s, 3H), 2,47 (d, J=5,5 Гц, 1H), 2,40 (s, 3H), 2,12 (s, 1H), 2,01 (s, 1H), 1,97-1,62 (m, 8H).
Стадия 4: (+/-)-транс-3-((6-(бензофуран-2-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00308] К раствору (+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (57 мг, 0,09 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор гидроксида натрия (4 М, 0,23 мл, 0,90 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (22 мг, 52%).
МС (ИЭР, пол. ион) m/z: 498,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 498,1931 [М+Н]+, (C28H25FN5O3) [M+H]+ теоретическое значение: 498,1941;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,33 (s, 1Н), 8,60 (s, 1H), 8,43 (s, 1H), 8,38 (t, J=9,5 Гц, 4H), 8,30 (s, 1H), 7,66 (s, 1H), 6,88 (s, 1H), 4,71 (s, 1H), 2,67 (s, 1H), 2,33 (s, 1H), 1,79-1,41 (m, 8H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 185,05, 162,79, 162,67, 155,32, 155,14, 154,87, 152,39, 146,48, 131,92, 131,87, 131,66, 128,61, 126,28, 123,98, 122,63, 119,01, 111,88, 106,59, 67,49, 50,06, 29,49, 28,75, 28,45, 25,60, 24,20, 21,38, 19,43.
Пример 17:
(+/-)-транс-3-((6-(бензо[b]тиофен-2-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 4-(бензо[b]тиофен-2-ил)-2,6-дихлорпиримидин
[00309] К раствору 2,4,6-трихлорпиримидина (50 мг, 0,27 ммоль) в смешанном растворителе, содержащем толуол (3 мл) и этанол (1 мл), добавляли тетракис(трифенилфосфин)палладий (31 мг, 0,03 ммоль), бензо[b]тиофен-2-ил-борную кислоту (49 мг, 0,28 ммоль) и водный раствор натрия карбоната (1 М, 0,82 мл, 0,82 ммоль). Смесь перемешивали при 85°С в течение 4 ч в защитной атмосфере азота. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (24 мг, 31%).
МС (ИЭР, пол. ион) m/z: 280,9 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,17 (s, 1Н), 7,91 (t, J=6,4 Гц, 2H), 7,64 (s, 1H), 7,51-7,43 (m, 2H).
Стадия 2:
(+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-хлорпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00310] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (409 мг, 2,23 ммоль) и 4-(бензо[b]тиофен-2-ил)-2,6-дихлорпиримидин (523 мг, 1,86 ммоль) растворяли в ДМФ (5 мл), затем добавляли карбонат калия (771 мг, 5,58 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (357 мг, 45%).
МС (ИЭР, пол. ион) m/z: 428,6 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,05 (s, 1H), 7,91-7,81 (m, 2H), 7,43-7,36 (m, 2H), 6,80 (s, 1H), 5,50 (s, 1H), 4,35 (s, 1H), 3,78 (s, 3H), 2,41 (d, J=4,9 Гц, 1H), 2,10 (s, 1H), 1,90 (d, J=2,6 Гц, 1H), 1,84-1,63 (m, 6H), 1,58-1,43 (m, 2H).
Стадия 3:
(+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00311] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (233 мг, 0,28 ммоль), (+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-хлорпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,23 ммоль), карбонат калия (96 мг, 0,70 ммоль), Pd(dppf)Cl2 (38 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (147 мг, 92%).
МС (ИЭР, пол. ион) m/z: 682,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,79 (dd, 7=9,0, 2,8 Гц, 1H), 8,71 (s, 1H), 8,35 (d, 7=1,8 Гц, 1H), 8,14 (d, 7=8,3 Гц, 2H), 7,99 (s, 1H), 7,96-7,92 (m, 1H), 7,90-7,85 (m, 1H), 7,44-7,39 (m, 2H), 7,30 (d, 7=8,3 Гц, 2H), 6,80 (s, 1H), 5,28 (s, 1H), 4,55 (s, 1H), 3,77 (s, 3H), 2,47 (d, 7=5,2 Гц, 1H), 2,40 (s, 3H), 2,12 (s, 1H), 1,99 (s, 1H), 1,92-1,63 (m, 8H).
Стадия 4:
(+/-)-транс-3-((6-(бензо[b]тиофен-2-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00312] К раствору (+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (147 мг, 0,22 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор гидроксида натрия (4 М, 0,55 мл, 2,20 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл) и сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (54 мг, 49%).
МС (ИЭР, пол. ион) m/z: 514,2 [М+1]+;
МСВР (ИЭР, пол. ион) m/z: 514,1710 [М+Н]+, (C24H25FN7O2) [M+H]+ теоретическое значение: 514,1713;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,32 (s, 1Н), 8,69 (s, 1H), 8,34 (s, 1H), 8,32 (s, 1H), 8,11 (s, 1H), 8,09-8,05 (m, 1H), 7,97 (s, 1H), 7,60 (s, 1H), 7,43 (dd, J=5,8, 3,1 Гц, 2H), 6,85 (s, 1H), 4,62 (s, 1H), 1,99 (s, 2H), 1,84-1,40 (m, 8H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 175,97, 162,74, 162,41, 157,35, 154,96, 146,50, 144,31, 140,47, 140,21, 131,98, 131,69, 125,96, 125,21, 124,98, 123,21, 119,04, 118,97, 114,52, 50,72, 28,75, 28,56, 26,01, 25,59, 24,22, 21,37, 19,45.
Пример 18: (+/-)-транс-3-((6-(дибензо[b,d]фуран-4-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(дибензо[b,d]фуран-4-ил)пиримидин
[00313] К раствору 2,4,6-трихлорпиримидина (500 мг, 2,73 ммоль) в 1,2-диметоксиэтане (32 мл) добавляли тетракис(трифенилфосфин)палладий (316 мг, 0,27 ммоль), дибензо[b,d]фуран-4-ил-борную кислоту (583 мг, 2,75 ммоль) и водный раствор натрия карбоната (1 М, 8,18 мл, 8,18 ммоль). Смесь перемешивали при 80°С в течение 2 ч. В реакционную смесь добавляли воду (30 мл), и полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (550 мг, 31%).
МС (ИЭР, пол. ион) m/z: 315,0 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,58 (s, 1Н), 8,56-8,51 (m, 1H), 8,19-8,15 (m, 1H), 8,04 (d, J=1,1 Гц, 1H), 7,74 (d, J=8,3 Гц, 1H), 7,57 (dt, J=15,4, 4,4 Гц, 2H), 7,46 (t, J=7,5 Гц, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(дибензо[b,d]фуран-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00314] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (418 мг, 2,28 ммоль) и 2,4-дихлор-6-(дибензо[b,d]фуран-4-ил)пиримидин (600 мг, 1,90 ммоль) растворяли в ДМФ (6 мл), затем добавляли карбонат калия (789 мг, 5,71 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (586 мг, 67%).
МС (ИЭР, пол. ион) m/z: 462,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,45 (d, J=7,6 Гц, 1H), 8,07 (d, J=7,4 Гц, 1H), 8,01 (d, J=7,6 Гц, 1H), 7,55-7,38 (m, 5H), 5,54 (s, 1H), 4,46 (s, 1H), 3,72 (s, 3H), 2,46 (d, J=5,3 Гц, 1H), 2,10 (s, 1H), 2,03 (s, 1H), 1,94-1,67 (m, 8H).
Стадия 3:
(+/-)-транс-метил 3-((6-(дибензо[b,d]фуран-4-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00315] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (237 мг, 0,29 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-(дибензо[b,d]фуран-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (110 мг, 0,24 ммоль), карбонат калия (98 мг, 0,71 ммоль), Pd(dppf)Cl2 (38 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (91 мг, 53%).
МС (ИЭР, пол. ион) m/z: 716,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,81 (dd, J=8,9, 2,7 Гц, 1Н), 8,77 (s, 1Н), 8,53 (d, J=7,8 Гц, 1Н), 8,35 (s, 1H), 8,15 (d, J=8,1 Гц, 2H), 8,11 (d, J=7,7 Гц, 1H), 8,04 (d, J=7,4 Гц, 1H), 7,77 (d, J=8,5 Гц, 1H), 7,55 (dd, J=14,7, 9,1 Гц, 2H), 7,44 (d, J=7,5 Гц, 1H), 7,39 (d, J=4,3 Гц, 2H), 7,31 (s, 1H), 5,28 (s, 1H), 4,73 (d, J=4,7 Гц, 1H), 3,73 (s, 3H), 2,52 (d, J=5,7 Гц, 1H), 2,40 (s, 3H), 2,13 (s, 2H), 1,74 (m, 8H).
Стадия 4:
(+/-)-транс-3-((6-(дибензо[b,d]фуран-4-ил)-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2.2,2]октан-2-карбоновая кислота
[00316] К раствору (+/-)-транс-метил 3-((6-(дибензо[b,d]фуран-4-ил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (91 мг, 0,13 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор гидроксида натрия (4 М, 0,33 мл, 1,30 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл) и сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (45 мг, 65%).
МС (ИЭР, пол. ион) m/z: 548,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 548,2118 [М+Н]+, (C32H26FN5O3) [M+H]+ теоретическое значение: 548,2098;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,30 (s, 1Н), 8,71 (d, J=7,6 Гц, 1H), 8,52 (d, J=7,0 Гц, 1H), 8,44 (s, 1H), 8,30 (d, J=7,2 Гц, 2H), 8,25 (d, J=7,6 Гц, 1H), 7,81 (d, J=7,2 Гц, 1H), 7,73 (s, 1H), 7,62 (t, J=7,6 Гц, 2H), 7,48 (t, J=7,5 Гц, 1H), 7,43 (s, 1H), 4,71 (s, 1H), 2,58 (s, 1H), 1,93-1,37 (m, 10H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,04, 172,49, 163,00, 162,42, 156,90, 156,75, 155,86, 155,30, 153,79, 146,50, 131,80, 131,72, 131,61, 128,44, 127,44, 125,15, 123,96, 123,92, 123,72, 123,22, 122,94, 121,79, 119,12, 119,06, 115,75, 115,11, 112,07, 102,42, 67,48, 50,65, 49,82, 29,49, 28,83, 28,53, 26,07, 25,59, 24,25, 21,52, 21,45, 19,52.
Пример 19: (+/-)цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид

Стадия 1:
N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид [00317] К раствору N1-(2-хлор-6-фенилпиримидин-4-ил)циклогексан-1,3-диамина (75 мг, 0,25 ммоль) в тетрагидрофуране (4 мл) добавляли N,N-диизопропилэтиламин (0,12 мл, 0,74 ммоль) и пирролидин-1-карбонил хлорид (49 мг, 0,37 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха, чтобы получить указанное в заголовке соединение в виде бесцветного твердого вещества (99 мг, 100%).
МС (ИЭР, пол. ион) m/z: 400,3 [М+Н]+;
1Н ЯМР (400 МГц, CD3OD) δ (ppm): 7,91 (s, 2Н), 7,49 (d, J=2,1 Гц, 3Н), 6,75 (s, 1Н), 1,96-1,85 (m, 5Н), 1,42 (s, 1H), 1,25 (m, 8Н).
Стадия 2:
(+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид
[00318] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (249 мг, 0,30 ммоль, 50%), N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид (100 мг, 0,25 ммоль), карбонат калия (103 мг, 0,75 ммоль), Pd(dppf)Cl2 (40 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Смесь в пробирке для проведения реакций под воздействием микроволнового излучени перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (83 мг, 51%).
МС (ИЭР, пол. ион) m/z: 654,3 [М+Н]+;
1Н ЯМР (400 МГц, CD3OD) δ (ppm): 8,66 (s, 1Н), 8,29 (s, 1H), 8,09 (t, J=7,5 Гц, 4H), 7,52 (d, J=7,5 Гц, 4H), 7,40 (d, J=8,2 Гц, 2H), 6,77 (s, 1H), 5,88 (d, J=7,9 Гц, 1H), 4,59 (s, 2H), 3,80 (s, 1H), 2,39 (s, 3H), 1,85-1,92 (m, 6H), 1,34 (m, 8H).
Стадия 3:
(+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид
[00319] К раствору (+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)пирролидин-1-карбоксамид (83 мг, 0,13 ммоль) в метаноле (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,26 мл, 1,3 ммоль). Смесь перемешивали при 30°С в течение ночи. Реакционную смесь концентрировали под вакуумом досуха и к остатку добавляли воду (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (32 мг, 50%).
МС (ИЭР, пол. ион) m/z: 500,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 500,2568 [М+Н]+, (C28H31FN7O) [M+H]+ теоретическое значение: 500,2574;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1Н), 8,58 (s, 1H), 8,39 (s, 1H), 8,29 (s, 1H), 8,11 (s, 2H), 7,55-7,50 (m, 3H), 7,36 (s, 1H), 6,76 (s, 1H), 5,84 (d, J=7,9 Гц, 1H), 4,11 (s, 1H), 3,66 (d, J=7,8 Гц, 1H), 3,19 (d, J=6,4 Гц, 4H), 2,16 (s, 2H), 1,80 (s, 6H), 1,53-1,24 (m, 4H);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 162,78, 162,43, 156,85, 156,37, 155,26, 146,48, 138,46, 131,76, 131,56, 130,28, 129,19, 126,77, 119,08, 119,03, 115,08, 56,50, 49,14, 48,61, 45,76, 33,01, 32,36, 29,43, 25,47, 25,42, 23,50, 22,54, 19,01.
Пример 20: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
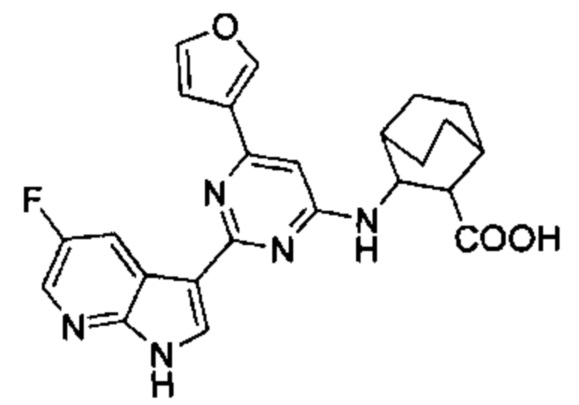
Стадия 1: 2,4-дихлор-6-(фуран-3-ил)пиримидин
[00320] К раствору 2,4,6-трихлорпиримидина (500 мг, 2,73 ммоль) в 1,2-диметоксиэтане (32 мл) добавляли тетракис(трифенилфосфин)палладий (317 мг, 0,27 ммоль), 3-фурилборную кислоту (308 мг, 2,75 ммоль) и водный раствор натрия карбоната (1 М, 8,18 мл, 8,18 ммоль). Смесь перемешивали при 80°С в течение 1 ч. В реакционную смесь добавляли воду (30 мл), и полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (60 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (317 мг, 31%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,26 (s, 1Н), 7,57 (s, 1H), 7,36 (s, 1H), 6,89 (s, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00321] (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (324 мг, 1,77 ммоль) и 2,4-дихлор-6-(фуран-3-ил)пиримидин (317 мг, 1,47 ммоль) растворяли в ДМФ (6 мл), затем добавляли карбонат калия (611 мг, 4,42 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (353 мг, 66%).
МС (ИЭР, пол. ион) m/z: 362,1 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00322] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (290 мг, 0,35 ммоль, 50%), (+/-)-транс-метил 3-((2-хлор-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (105 мг, 0,29 ммоль), карбонат калия (120 мг, 0,85 ммоль), Pd(dppf)Cl2 (47 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучени перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (179 мг, 100%).
МС (ИЭР, пол. ион) m/z: 616,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,66 (s, 1H), 8,63 (dd, J=8,9, 2,7 Гц, 1H), 8,32 (s, 1H), 8,19 (s, 1H), 8,12 (d, J=8,2 Гц, 2H), 7,55 (s, 1H), 7,39 (d, J=4,6 Гц, 2H), 7,30 (s, 1H), 6,91 (s, 1H), 5,21 (s, 1H), 4,72 (s, 1H), 3,74 (s, 3H), 2,45-2,42 (m, 1H), 2,39 (s, 3H), 2,10 (s, 1H), 1,96 (s, 1H), 1,81 (m, 8H).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00323] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (180 мг, 0,29 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли водный раствор гидроксида натрия (4 М, 0,73 мл, 2,90 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (62 мг, 47%).
МС (ИЭР, пол. ион) m/z: 448,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 448,1785 [М+Н]+, (C24H23FN7O3) [M+H]+ теоретическое значение: 448,1784;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,25 (s, 1Н), 8,62 (s, 1H), 8,41 (s, 1H), 8,35 (s, 1H), 8,27 (s, 1H), 7,81 (s, 1H), 7,43 (s, 1H), 6,98 (s, 1H), 6,48 (s, 1H), 4,63 (s, 1H), 3,17 (s, 1H), 1,99 (s, 2H), 1,88-1,44 (m, 8H);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 175,99, 172,43, 162,82, 162,39, 157,27, 154,88, 146,46, 144,88, 143,19, 131,75, 131,60, 131,46, 126,56, 119,05, 118,97, 116,07, 114,90, 108,96, 56,50, 50,48, 49,74, 49,05, 28,78, 28,60, 25,99, 24,13, 21,50, 21,40, 19,41.
Пример 21: (+/-)-цис-2-амино-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид

Стадия 1: 2-амино-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00324] К раствору N1-(2-хлор-6-фенилпиримидин-4-ил)циклогексан-1,3-диамина (63 мг, 0,21 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметилсульфоксид (1 мл) добавляли N,N-диизопропилэтиламин (0,08 мл, 0,62 ммоль) и 2-аминотиазол-4-карбоновую кислоту (59 мг, 0,42 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (10 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом чтобы получить указанное в заголовке соединение в виде белого твердого вещества (89 мг, 100%).
МС (ИЭР, пол. ион) m/z: 429,2 [М+Н]+;
1Н ЯМР (400 МГц, CD3OD) δ (ppm): 7,92 (s, 2Н), 7,49 (s, 3Н), 7,26 (s, 1Н), 6,77 (s, 1H), 4,59 (s, 1H), 2,68 (s, 1H), 2,32 (d, J=11,1 Гц, 1H), 2,11-1,90 (m, 4H), 1,59 (d, J13,1 Гц, 1H).
Стадия 2: (+/-)-цис-2-амино-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00325] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (209 мг, 0,25 ммоль, 50%), (+/-)-цис-2-амино-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид (90 мг, 0,21 ммоль), калия фосфат (133 мг, 0,63 ммоль), Pd2(dba)3 (20 мг, 0,02 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (43 мг, 30%).
Стадия 3:
(+/-)-цис-2-амино-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин -4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00326] К раствору (+/-)-цис-2-амино-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамида (43 мг, 0,06 ммоль) в метаноле (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,12 мл, 0,6 ммоль). Смесь перемешивали при 30°С в течение ночи. Реакционную смесь концентрировали под вакуумом, и к остатку добавляли воду (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (32 мг, 50%).
МС (ИЭР, пол. ион) m/z: 529,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 529,1940 [М+Н]+, (C27H26FN8OS) [М+Н]+ теоретическое значение: 529,1934;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1Н), 8,60 (s, 1H), 8,40 (s, 1H), 8,29 (s, 1H), 8,11 (s, 2H), 7,58-7,48 (m, 4H), 7,38 (s, 1H), 7,18 (s, 1H), 7,08 (s, 2H), 6,77 (s, 1H), 4,12 (s, 1H), 3,94 (s, 1H), 1,86 (s, 2H), 1,44 (m, 6H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 168,62, 162,43, 160,44, 156,86, 155,27, 146,48, 146,21, 138,44, 131,77, 131,58, 130,31, 130,12, 129,20, 126,80, 119,07, 119,02, 115,10, 111,69, 48,86, 32,08, 31,75, 30,86, 29,47, 29,15, 22,55, 14,42.
Пример 22: (+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид

Стадия 1:
(+/-)-цис-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00327] К раствору N1-(2-хлор-6-фенилпиримидин-4-ил)циклогексан-1,3-диамина (221 мг, 0,73 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметилсульфоксид (1 мл), добавляли N,N-диизопропилэтиламин (0,11 мл, 0,7 ммоль) и 1-метил-1H-имидазол-4-карбоновую кислоту (184 мг, 1,46 ммоль). Смесь перемешивали при к.т. в течение 10 мин, затем добавляли HATU (555 мг, 1,46 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, чтобы получить указанное в заголовке соединение в виде бесцветного твердого вещества (180 мг, 60%).
МС (ИЭР, пол. ион) m/z: 411,2 [М+Н]+.
Стадия 2:
(+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00328] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (162 мг, 0,23 ммоль, 60%), (+/-)-цис-N-(3-((2-хлор-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид (80 мг, 0,19 ммоль), карбонат калия (80 мг, 0,58 ммоль), Pd(dppf)Cl2 (31 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (20 мг, 15%).
МС (ИЭР, пол. ион) m/z: 665,2 [М+Н]+;
1Н ЯМР (400 МГц, CD3OD) δ (ppm): 8,73 (d, J=3,2 Гц, 1Н), 8,68 (s, 1Н), 8,40 (d, J=8,7 Гц, 1Н), 8,29 (s, 1Н), 8,10 (d, J=8,2 Гц, 4Н), 7,63 (s, 2Н), 7,53 (d, J=7,5 Гц, 2Н), 7,39 (d, J=7,9 Гц, 2Н), 6,79 (s, 1Н), 4,10 (s, 1Н), 3,77 (s, 3Н), 2,45 (s, 1Н), 2,39 (s, 3Н), 2,27-2,17 (m, 2Н), 2,10-1,97 (m, 4Н), 1,62 (s, 2Н).
Стадия 3:
(+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00329] К раствору (+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамида (20 мг, 0,03 ммоль) в метаноле (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,06 мл, 0,3 ммоль). Смесь перемешивали при 30°С в течение ночи. Реакционную смесь концентрировали под вакуумом, и к остатку добавляли воду (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (10 мг, 65%).
МСВР (ИЭР, пол. ион) m/z: 511,2385 [М+Н]+, (C28H28FN8O) [M+H]+ теоретическое значение: 511,2370;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,59 (s, 1H), 8,40 (s, 1H), 8,29 (s, 1H), 8,11 (s, 1H), 7,72 (d, J=8,4 Гц, 1H), 7,64 (s, 1H), 7,61 (s, 1H), 7,57-7,50 (m, 2H), 7,37 (s, 1H), 6,75 (s, 1H), 4,14 (s, 1H), 3,68 (s, 3H), 2,20 (s, 2H), 1,84 (s, 2H), 1,55-1,33 (m, 4H).
Пример 23:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-6-(тиофен-2-ил)пиримидин
[00330] К раствору тиофена (500 мг, 5,94 ммоль) в безводном тетрагидрофуране (20 мл) добавляли н-бутиллитий (2,4 мл, 6,0 ммоль, 2,5 моль/л) при -15°С, и смесь перемешивали в течение 1 ч при -15°С. Затем к смеси добавляли ZnCl-TMEDA (495 мг, 1,96 ммоль), и полученную смесь перемешивали в течение 1 ч. Затем к смеси последовательно добавляли палладий дихлорид (105 мг, 0,59 ммоль), трифенилфосфин (658 мг, 1,19 ммоль) и 2,4,6-трихлорпиримидин (1,09 г, 5,94 ммоль). Полученную смесь нагревали до 55°С в защитной атмосфере азота, и затем перемешивали при этой температуре в течение ночи. В реакционную смесь добавляли воду (50 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (616 мг, 45%).
МС (ИЭР, пол. ион) m/z: 230,2 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,86 (d, J=3,7 Гц, 1H), 7,66 (d, J=4,9 Гц, 1H), 7,51 (s, 1H), 7,24-7,17 (m, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00331] (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (586 мг, 3,20 ммоль) и 2,4-дихлор-6-(тиофен-2-ил)пиримидин (616 мг, 2,67 ммоль) растворяли в ДМФ (6 мл), затем добавляли карбонат калия (1,11 г, 8,00 ммоль). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (180 мг, 18%).
МС (ИЭР, пол. ион) m/z: 378,1 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,74 (d, J=3,1 Гц, 1H), 7,50 (d, J=4,9 Гц, 1H), 7,17-7,10 (m, 1H), 6,68 (s, 1H), 5,47 (s, 1H), 4,30 (s, 1H), 3,76 (s, 3H), 2,39 (d, J=4,6 Гц, 1H), 2,08 (s, 1H), 1,87 (d, J=2,5 Гц, 1H), 1,82-1,65 (m, 8H).
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00332] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (176 мг, 0,25 ммоль, 60%), метил 3-((2-хлор-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (80 мг, 0,21 ммоль), карбонат калия (87 мг, 0,64 ммоль), Pd(dppf)Cl2 (34 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°С при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (40 мг, 30%).
МС (ИЭР, пол. ион) m/z: 632,3 [М+Н]+.
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00333] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(тиофен-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (40 мг, 0,06 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор гидроксида натрия (4 М, 0,15 мл, 0,60 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (20 мг, 68%).
МС (ИЭР, пол. ион) m/z: 464,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 464,1526 [М+Н]+, (C24H23FN5O2S) [M+H]+ теоретическое значение: 464,1556;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1H), 8,67 (s, 1H), 8,29 (s, 2H), 7,73 (d, J=4,8 Гц, 2H), 7,48 (s, 1H), 7,26-7,17 (m, 1H), 6,68 (s, 1H), 4,58 (s, 1H), 1,98-1,91 (m, 2H), 1,84-1,38 (m, 8H).
Пример 24:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
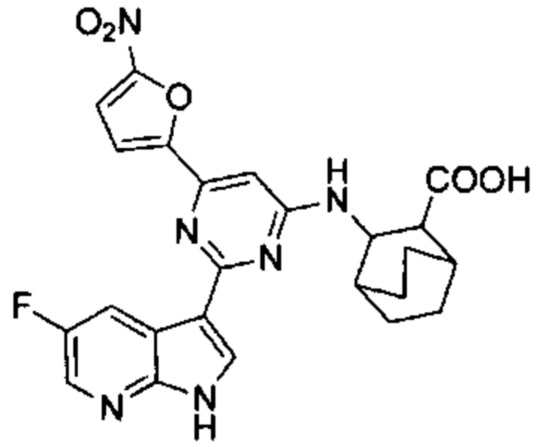
Стадия 1:_2,4-дихлор-6-(5-нитрофуран-2-ил)пиримидин
[00334] К концентрированной серной кислоте (10 мл) добавляли 2,4-дихлор-6-(фуран-2-ил)пиримидин (2,15 г, 10,00 ммоль). Смесь помещали на ледяную баню и перемешивали, затем к смеси медленно, по каплям добавляли концентрированную азотную кислоту (0,85 мл, 12 ммоль). Затем полученную смесь нагревали до комнатной температуры и продолжали перемешивание. Реакцию останавливали, и реакционную смесь добавляли медленно, по каплям в ледяную воду (50 мл), чтобы остановить реакцию. Полученную смесь экстрагировали этилацетатом (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого порошка (1,02 г, 39%).
МС (ИЭР, пол. ион) m/z: 260,10 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm) 7,81 (s, 1Н), 7,57 (d, J=3,8 Гц, 1H), 7,48 (d, J=3,8 Гц, 1H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00335] Суспензию 2,4-дихлор-6-(5-нитрофуран-2-ил)пиримидина (300 мг, 1,15 ммоль), (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (280 мг, 1,38 ммоль) и K2CO3 (320 мг, 2,31 ммоль) в ДМФ (10 мл) перемешивали при к.т. в течение ночи. Реакцию останавливали добавлением воды (100 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (344 мг, 73%).
МС (ИЭР, пол. ион) m/z: 407,20 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,42 (d, J=3,7 Гц, 1H), 7,36 (d, J=3,2 Гц, 1H), 6,89 (s, 1H), 4,33 (s, 1H), 3,80 (s, 3H), 2,40 (d, J=4,4 Гц, 1H), 2,06 (s, 1H), 1,87 (s, 1H), 1,81-1,56 (m, 9H).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00336] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (170 мг, 0,41 ммоль), K2CO3 (154 мг, 1,11 ммоль), PdCl2(dppf) (30 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (150 мг, 0,37 ммоль). Затем к смеси добавляли Н2О (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаяли, и перемешивали смесь в течение 3 ч при 115°С. Смесь фильтровали для удаления твердых примесей, и фильтрат концентрировали для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (126 мг, 52%).
МС (ИЭР, пол. ион) m/z: 661,0 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm) 8,70 (s, 1H), 8,59 (dd, J=8,8, 2,7 Гц, 1H), 8,34 (d, J=1,7 Гц, 1H), 8,15 (d, J=8,2 Гц, 2H), 7,49 (d, J=3,8 Гц, 1H), 7,41 (d, J=3,7 Гц, 1H), 7,31 (d, J=8,2 Гц, 2H), 6,85 (s, 1H), 5,37 (s, 1H), 3,78 (s, 3H), 2,44 (s, 1H), 2,40 (s, 3H), 2,13 (s, 1H), 2,07 (s, 1H), 2,00 (s, 1H), 1,75-1,61 (m, 8H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00337] К раствору хлористого водорода в 1,4-диоксане (4 моль/л, 0,20 мл) добавляли (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (43 мг, 0,07 ммоль), и смесь перемешивали при 55°С. Реакцию останавливали, и реакционную смесь концентрировали под вакуумом для удаления растворителя и HCl с образованием светло-желтого твердого вещества (32 мг, 97%), которое использовали на следующей стадии без дополнительной очистки.
МС (ИЭР, пол. ион) m/z: 507,30 [М+Н]+.
Стадия 5:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00338] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (20 мг, 0,04 ммоль) в THF (5 мл) добавляли раствор LiOH (5 мг, 0,16 ммоль) в воде (0,5 мл). Смесь перемешивали при 50°С в течение ночи, затем подкисляли соляной кислотой (1 М) до рН ≈ 6. Полученную смесь экстрагировали 2-метилтетрагидрофураном (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (20 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (6 мг, 31%).
МС (ИЭР, пол. ион) m/z: 493,20 [М+Н]+;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm) 12,36 (s, 1Н), 8,60 (d, J=9,0 Гц, 1H), 8,41 (s, 1H), 8,30 (s, 1H), 7,88 (s, 1H), 7,81 (d, J=6,5 Гц, 1H), 7,59 (s, 1H), 6,86 (s, 1H), 5,33 (s, 1H), 4,64 (s, 1H), 2,03-1,96 (m, 2H), 1,61 (m, 9H).
Пример 24a:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00339] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2:
(2S,3S)-этил 3-((2-хлор-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00340] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 2 Примера 24, при использовании 2,4-дихлор-6-(5-нитрофуран-2-ил)пиримидина (300 мг, 1,15 ммоль), (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилата гидрохлорида (328 мг, 1,40 ммоль), карбоната калия (477 мг, 3,45 ммоль) в качестве реагентов и DMF (10 мл) в качестве растворителя. Указанное в заголовке соединение представляло собой белое твердое вещество (271 мг, 56%).
МС (ИЭР, пол. ион) m/z: 421,1 [М+Н]+.
Стадия 3:
(2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00341] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 3 Примера 24, при использовании 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (298 мг, 0,43 ммоль, 60%), K2CO3 (155 мг, 1,11 ммоль), Pd(dppf)Cl2 (29 мг, 0,04 ммоль) и (2S,3S)-этил 3-((2-хлор-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (148 мг, 0,35 ммоль) в качестве реагентов и смесь 1,4-диоксана (8 мл) и Н2О (1 мл) в качестве смешанного растворителя. Указанное в заголовке соединение представляло собой белое твердое вещество (125 мг, 53%).
Стадия 4:
(2S,3S)-этил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00342] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 4 Примера 24, при использовании (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1Р-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (125 мг, 0,19 ммоль) и раствора HCl в 1,4-диоксане (4 моль/л, 0,50 мл). Указанное в заголовке соединение представляло собой светло-желтое твердое вещество (95 мг, 99%), которое использовали на следующей стадии без дополнительной очистки.
МС (ИЭР, пол. ион) m/z: 521,1 [М+Н]+.
Стадия 5:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00343] Указанное в заголовке соединение может быть получено методом синтеза, описанным для Стадии 5 Примера 24, при использовании (2S,3S)-этил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(5-нитрофуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (95 мг, 0,18 ммоль), раствора LiOH (17 мг, 0,72 ммоль) в воде (0,5 мл), и растворителя THF (5 мл). Указанное в заголовке соединение представляло собой белое твердое вещество (27 мг, 30%).
МСВР (ИЭР, пол. ион) m/z: 493,1638 [М+Н]+, (C24H22FN6O5) [M+H]+ теоретическое значение: 493,1636;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,35 (s, 1Н), 8,59 (d, J=8,7 Гц, 1H), 8,40 (s, 1H), 8,30 (s, 1H), 7,86 (d, J=3,7 Гц, 1H), 7,80 (d, J=6,7 Гц, 1H), 7,57 (d, J=3,2 Гц, 1H), 6,85 (s, 1H), 4,64 (s, 1H), 2,44 (s, 1H), 1,99 (s, 1H), 1,96 (s, 1H), 1,77-1,39 (m, 8H);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 175,82, 162,93, 162,64, 154,77, 152,13, 150,63, 146,48, 132,19, 131,96, 131,71, 118,94, 115,82, 115,10, 113,30, 110,03, 98,24, 50,58, 50,03, 28,69, 28,41, 25,98, 24,15, 21,28, 19,36.
Пример 25:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:_2,4-дихлор-7-изопропил-7H-пирроло[2,3-d]пиримидин
[00344] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидина (500 мг, 2,66 ммоль) в ДМФ (5 мл) добавляли NaH (130 мг, 3,19 ммоль, 60%) при 0°С, и смесь перемешивали при этой температуре в течение 30 мин. Затем к смеси добавляли 2-иодпропан (904 мг, 5,32 ммоль), и полученную смесь перемешивали при к.т. в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (356 мг, 58%).
МС (ИЭР, пол. ион) m/z: 231,05 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00345] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (390 мг, 1,96 ммоль) и 2,4-дихлор-7-изопропил-7H-пирроло[2,3-d]пиримидин (410 мг, 1,78 ммоль) растворяли в тетрагидрофуране (5 мл), затем добавляли карбонат калия (493 мг, 3,56 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакцию прекращали, и в реакционную смесь добавляли воду (50 мл), чтобы остановить реакцию. Полученную смесь разделяли на фракции, и водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (333 мг, 50%).
МС (ИЭР, пол. ион) m/z: 425,15 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,39 (d, J=4,2 Гц, 1H), 7,02 (d, J=3,6 Гц, 1H), 6,43 (s, 1H), 5,25 (s, 1H), 5,04 (dt, J=13,5, 6,8 Гц, 1H), 4,62 (s, 1H), 3,76 (s, 3H), 2,42 (d, J=5,4 Гц, 1H), 2,02 (s, 1H), 1,95 (d, J=2,3 Гц, 1H), 1,88-1,74 (m, 2H), 1,69-1,62 (m, 5H), 1,45-1,49 (m, 6H)
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00346] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (200 мг, 0,48 ммоль), K2CO3 (166 мг, 1,19 ммоль), Pd(dppf)Cl2 (32 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (150 мг, 0,40 ммоль) в 1,4-диоксане (8,0 мл) добавляли Н2О (1 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаивали, и смесь перемешивали при 110°С в течение 1,5 ч. После завершения реакции смесь фильтровали для удаления твердых примесей. Затем фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1-5/1), чтобы получить белое твердое вещество (124 мг, 49%).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00347] Раствор гидроксида натрия (78 мг, 1,97 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (124 мг, 0,20 ммоль) в THF/MeOH (отношение объемов=5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Добавляли воду (10 мл). рН реакционной смеси доводили соляной кислотой (1 М) до рН ≈ 6. Полученную смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным Na2SO4 и фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (38 мг, 42%).
МС (ИЭР, пол. ион) m/z: 463,55 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 463,2262 [М+Н]+, (C25H28FN7O2) [M+H]+ теоретическое значение: 463,2258;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,08 (s, 1Н), 8,68 (d, J=8,8 Гц, 1H), 8,31-8,18 (m, 2H), 7,21 (d, J=2,5 Гц, 2H), 6,64 (s, 1H), 5,08-4,96 (m, 1H), 4,79 (s, 1H), 2,72 (d, J=6,3 Гц, 1H), 2,03 (d, J=12,3 Гц, 2H), 1,88-1,69 (m, 3H), 1,68-1,53 (m, 3H), 1,49 (dd, J=6,3, 3,3 Гц, 6H), 1,38 (d, J=10,9 Гц, 2H), 1,19 (m, 1H).
Пример 26: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-5-метил-5H-пирроло[3,2-d]пиримидин
[00348] К раствору 2,4-дихлор-5H-пирроло[3,2-d]пиримидина (500 мг, 2,66 ммоль) в ДМФ (8 мл) добавляли NaH (127 мг, 3,19 ммоль, 60%) при 0°С. Реакционную смесь перемешивали в течение 30 мин при 0°С, затем добавляли иодометан (3,78 г, 26,60 ммоль). Реакционную смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (275 мг, 51%).
МС (ИЭР, пол. ион) m/z: 202,00 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,47 (d, J=3,1 Гц, 1Н), 6,64 (d, J=3,0 Гц, 1H), 4,16 (s, 3Н).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00349] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (236 мг, 1,17 ммоль) и 2,4-дихлор-5-метил-5H-пирроло[3,2-d]пиримидина (301 мг, 2,13 ммоль) в THF (5 мл) добавляли K2CO3 (301 мг, 2,16 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2), и объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕЮАс (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (122 мг, 33%).
МС (ИЭР, пол. ион) m/z: 350,15 [М+Н]+.
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00350] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (153 мг, 0,43 ммоль), K2CO3 (156 мг, 1,13 ммоль), Pd(dppf)Cl2 (28 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (136 мг, 0,39 ммоль) в 1,4-диоксане (8,0 мл) добавляли Н2О (1 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и затем смесь перемешивали при 110°С в течение 1,5 ч при нагревании под воздействием микроволнового излучения. Реакционную смесь фильтровали через целитовую прокладку для удаления твердых примесей, и фильтрат концентрировали под вакуумом для удаления растворителя. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (75 мг, 32%).
МС (ИЭР, пол. ион) m/z: 604,40 [М+Н]+.
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00351] Раствор гидроксида натрия (51 мг, 1,24 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-5-метил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (75 мг, 0,12 ммоль) в THF/MeOH (отношение объемов=5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Добавляли воду (10 мл). рН смеси доводили до рН ≈ 6 водным раствором соляной кислоты (1 М). Полученную смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (21 мг, 39%).
МС (ИЭР, пол. ион) m/z: 435,20 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 435,1944 [М+Н]+, (C23H24FN6O2) [M+H]+ теоретическое значение: 435,1945;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,72 (s, 1H), 8,65-8,56 (m, 2Н), 8,38 (s, 1Н), 7,64 (s, 1H), 7,11 (s, 1H), 6,47 (d, J=2,6 Гц, 1H), 5,14 (s, 1H), 4,15 (s, 3H), 2,08 (s, 1H), 2,03 (s, 1H), 1,83 (d, J=8,2 Гц, 3Н), 1,58-1,48 (m, 5H).
Пример 27: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-7-фенил-7H-пирроло[2,3-d]]пиримидин
[00352] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидина (300 мг, 1,60 ммоль) в DCM (5 мл) добавляли фенилборную кислоту (215 мг, 1,76 ммоль), Cu(ОАс)2 (580 мг, 3,19 ммоль) и Et3N (1,61 г, 15,95 ммоль). Смесь перемешивали при к.т. в атмосфере кислорода в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (296 мг, 70%).
МС (ИЭР, пол. ион) m/z: 265,35 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00353] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (245 мг, 1,23 ммоль) и 2,4-дихлор-7-фенил-7H-пирроло[2,3-d]пиримидин (296 мг, 1,12 ммоль) растворяли в ДМФ (10 мл), затем добавляли карбонат калия (310 мг, 2,24 ммоль). Смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (156 мг, 34%).
МС (ИЭР, пол. ион) m/z: 412,15 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00354] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (185 мг, 0,42 ммоль), K2CO3 (160 мг, 1,14 ммоль), PdCl2(dppf) (30 мг, 0,04 ммоль) и (+/-)-/транс-метил 3-((2-хлор-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (156 мг, 0,38 ммоль). Затем к смеси добавляли Н2О (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Пробирку со смесью запаивали, и смесь перемешивали в течение 1,5 ч при 110°С. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1-5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (135 мг, 53%).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00355] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-фенил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбокси лат (120 мг, 0,18 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли раствор гидроксида натрия (78 мг, 1,81 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6. Смесь экстрагировали этилацетатом (15 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (61 мг, 68%).
МС (ИЭР, пол. ион) m/z: 497,15 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 497,2106[М+Н]+, (C28H26FN6O2)[M+H]+ теоретическое значение: 497,2101;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,12 (s, 1Н), 8,62 (d, J=8,1 Гц, 1H), 8,26 (s, 1H), 8,22 (d, J=2,4 Гц, 1H), 7,95 (d, J=7,8 Гц, 2H), 7,60 (t, J=7,8 Гц, 2H), 7,52 (d, J=3,4 Гц, 1H), 7,45-7,38 (m, 2H), 6,90 (s, 1H), 4,81 (s, 1H), 2,74 (d, J=6,3 Гц, 1H), 2,04 (d, J=15,2 Гц, 2H), 1,87-1,73 (m, 3H), 1,67-1,55 (m, 3H), 1,49-1,39 (m, 3H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,15, 156,76, 156,24, 155,12, 150,20, 146,42, 138,64, 131,65, 131,44, 130,44, 129,64, 126,48, 123,68, 123,25, 118,99, 118,86, 115,71, 101,44, 50,64, 49,04, 28,93, 28,81, 26,05, 24,25, 21,55, 19,53.
Пример 28:
(+/-)-транс-3-((7-циклопропил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-7-циклопропил-7H-пирроло[2,3-d]пиримидин
[00356] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидин (500 мг, 2,66 ммоль) в ДМФ (5 мл) добавляли NaH (130 мг, 3,25 ммоль, 60%) при 0°С, и смесь перемешивали при этой температуре в течение 30 мин. Затем к смеси добавляли циклопропил бромид (643 мг, 5,32 ммоль) и иодид меди (3,19 г, 16,7 ммоль), и полученную смесь перемешивали при 120°С в течение ночи. В реакционную смесь добавляли воду (50 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (453 мг, 75%).
МС (ИЭР, пол. ион) m/z: 229,10 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,25 (d, J=3,6 Гц, 1H), 6,64 (d, J=3,6 Гц, 1H), 6,00 (ddd, J=16,2, 10,9, 5,8 Гц, 1H), 5,31 (d, J=10,2 Гц, 1H), 5,19 (d, J=17,1 Гц, 1H), 4,87 (d, J=5,7 Гц, 2H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-7-циклопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00357] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (360 мг, 1,80 ммоль) и 2,4-дихлор-7-циклопропил-7H-пирроло[2,3-d]пиримидин (374 мг, 1,64 ммоль) растворяли в ДМФ (5 мл), затем добавляли карбонат калия (453 мг, 3,28 ммоль). Смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду реакционную смесь добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (370 мг, 60%).
МС (ИЭР, пол. ион) m/z: 376,15 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((7-циклопропил-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00358] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (172 мг, 0,41 ммоль), K2CO3 (156 мг, 1,39 ммоль), Pd(dppf)Cl2 (28 мг, 0,05 ммоль) и (+/-)-транс-метил 3-((2-хлор-7-циклопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (174 мг, 0,46 ммоль). Затем к смеси добавляли Н2О (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1,5 ч при 110°С при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (120 мг, 41%).
Стадия 4:
(+/-)-транс-3-((7-циклопропил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00359] К раствору (+/-)-транс-метил 3-((7-циклопропил-2-(5-фтор-1-тозил-1H-пирроло [2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (120 мг, 0,19 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли раствор NaOH (78 мг, 1,91 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи, затем подкисляли разбавленной соляной кислотой (1 М) до рН≈6. Полученную смесь экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (43 мг, 49%).
МС (ИЭР, пол. ион) m/z: 461,15 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 461,2113[М+Н]+, (C25H26FN6O2)[M+H]+ теоретическое значение: 461,2101;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,17 (s, 1Н), 8,65 (d, J=7,6 Гц, 1Н), 8,28 (s, 2Н), 7,45 (s, 1Н), 7,09 (s, 1Н), 6,71 (s, 1Н), 6,07 (s, 1Н), 5,19 (d, J=9,3 Гц, 1Н), 5,08 (d, J=16,9 Гц, 1H), 4,87 (s, 2Н), 2,72 (s, 2Н), 2,02 (s, 2Н), 1,87-1,73 (m, 3Н), 1,48-1,40 (m, 5Н).
Пример 29: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-5-фенил-5H-пирроло[3,2-d]пиримидин
[00360] К раствору 2,4-дихлор-5H-пирроло[3,2-d]пиримидин (1,00 г, 5,26 ммоль) в DCM (5 мл) добавляли фенилборную кислоту (710 мг, 5,79 ммоль), ацетат меди (1,82 г, 10,52 ммоль), Et3N (5,32 г, 53,62 ммоль). Затем реакционную смесь перемешивали в атмосфере кислорода при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (1,03 г, 74%).
МС (ИЭР, пол. ион) m/z: 265,20 [М]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00361] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (267 мг, 1,3 ммоль), 2,4-дихлор-5-фенил-5H-пирроло[3,2-d]пиримидин (322 мг, 1,22 ммоль) в THF (5 мл) добавляли K2CO3 (337 мг, 2,44 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2), и объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (150 мг, 30%).
МС (ИЭР, пол. ион) m/z: 411,10 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00362] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (150 мг, 0,36 ммоль), K2CO3 (140 мг, 0,99 ммоль), Pd(dppf)Cl2 (25 мг, 0,02 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (136 мг, 0,33 ммоль) в 1,4-диоксане (8,0 мл) добавляли воду (1 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и затем смесь перемешивали при 110°С в течение 1,5 ч при нагревании под воздействием микроволнового излучения. Реакционную смесь фильтровали через целитовую прокладку для удаления твердых примесей, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (185 мг, 84%).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00363] Раствор NaOH (123 мг, 2,78 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил
3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-5-фенил-5H-пирроло[3,2-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (185 мг, 0,28 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Добавляли воду (10 мл), и рН полученной смеси доводили до рН ≈ 6 водным раствором соляной кислоты (1 М). Смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (63 мг, 46%).
МС (ИЭР, пол. ион) m/z: 497,10 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 497,2094[М+Н]+, (C28H26FN7O2)[M+H]+ теоретическое значение: 497,2101;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,13 (s, 1Н), 8,69 (dd, J=9,8, 2,7 Гц, 1H), 8,30 (d, J=2,4 Гц, 1H), 8,26 (d, J=1,3 Гц, 1H), 7,68 (d, J=3,0 Гц, 1H), 7,66-7,61 (m, 3H), 7,59 (d, J=7,6 Гц, 3H), 6,66 (d, J=3,1 Гц, 1H), 4,74 (s, 1H), 2,03 (s, 1H), 1,88 (d, J=2,4 Гц, 1H), 1,83 (s, 1H), 1,68 (d, J=9,2 Гц, 1H), 1,53 (m, 4H), 1,34 (m, 4H).
Пример 30:
(+/-)-траис-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
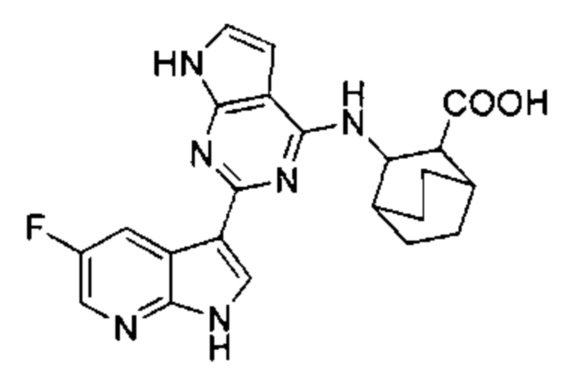
Стадия 1) 2,4-дихлор-7-тозил-7H-пирроло[2,3-d]пиримидин
[00364] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидин (500 мг, 2,66 ммоль) в ДМФ (5 мл) добавляли NaH (120 мг, 2,93 ммоль, 60%) при 0°С, и смесь перемешивали при этой температуре в течение 30 мин. Затем к смеси добавляли пара-толуолсульфонил хлорид (608 мг, 3,19 ммоль) добавляли к смеси, и полученную смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (780 мг, 86%).
МС (ИЭР, пол. ион) m/z: 343,90 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,13 (d, J=8,3 Гц, 2Н), 7,77 (d, J=4,0 Гц, 1Н), 7,38 (d, J=8,2 Гц, 2H), 6,70 (d, J=4,0 Гц, 1H), 2,45 (s, 3H).
Стадия 2: (+/-)-транс-метил 3-((2-хлор-7-тозил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00365] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (500 мг, 2,51 ммоль) и 2,4-дихлор-7-тозил-7H-пирроло[2,3-d]пиримидин (780 мг, 2,28 ммоль) растворяли в ДМФ (10 мл), затем добавляли карбонат калия (630 мг, 4,56 ммоль). Смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (803 мг, 72%).
МС (ИЭР, пол. ион) m/z: 490,50 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,09 (d, J=8,2 Гц, 2H), 7,44 (d, J=3,9 Гц, 1H), 7,32 (d, J=8,1 Гц, 2H), 6,48 (s, 1H), 4,52 (t, J=5,8 Гц, 1H), 3,73 (s, 3H), 2,42 (s, 3H), 1,99 (s, 1H), 1,86 (s, 1H), 1,73 (s, 2H), 1,70-1,37 (m, 9H).
Стадия 3:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-тозил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00366] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (187 мг, 0,45 ммоль), K2CO3 (170 мг,1,23 ммоль), Pd(dppf)Cl2 (30 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-7-тозил-7H-пирроло[2,3-d]пиримидин-4-ил) амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,41 ммоль) в 1,4-диоксане (8,0 мл) добавляли воду (1 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и смесь перемешивали при 110°С в течение 1,5 ч. Реакционную смесь фильтровали через целитовую прокладку для удаления твердых примесей, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (292 мг, 96%).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00367] Раствор NaOH (120 мг, 2,84 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил
3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-тозил-7H-пирроло [2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (212 мг, 0,28 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Добавляли воду (10 мл), и рН реакционной смеси доводили до рН ≈ 6 водным раствором соляной кислоты (1 М). Смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (51 мг, 43%).
МС (ИЭР, пол. ион) m/z: 421,10 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 421,1800[М+Н]+, (C22H23FN6O2)[M+H]+ теоретическое значение: 421,1788;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,04 (s, 1Н), 11,32 (s, 1H), 8,73 (d, J=10,2 Гц, 1H), 8,25 (s, 1H), 8,15 (s, 1H), 7,19 (d, J=6,5 Гц, 1H), 7,03 (s, 1H), 6,61 (s, 1H), 4,80 (s, 1H), 2,73 (d, J=6,1 Гц, 1H), 2,02 (s, 1H), 1,93-1,33 (m, 7H), 1,23 (s, 2H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,16, 156,73, 155,99, 155,07, 146,29, 131,48, 131,23, 130,08, 129,91, 129,48, 120,66, 119,06, 115,95, 100,99, 99,44, 50,45, 48,94, 29,01, 28,87, 26,00, 24,14, 21,53, 19,43.
Пример 31: (+/-)-транс-3-((6-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 4,6-дихлор-1-метил-1H-пиразоло[3,4-d]пиримидин
[00368] К раствору 4,6-дихлор-1H-пиразоло[3,4-d]пиримидина (110 мг, 0,58 ммоль) в ДМФ (8 мл) добавляли K2CO3 (160 мг 1,16 ммоль). Реакционную смесь перемешивали в течение 30 мин при к.т., и добавляли иодометан (3,78 г, 26,60 ммоль). Реакционную смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (48 мг, 41%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,16 (s, 1Н), 4,13 (s, 3Н).
Стадия 2:
(+/-)-транс-метил 3-((6-хлор-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00369] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (132 мг, 0,67 ммоль) и 4,6-дихлор-1-метил-1H-пиразоло[3,4-d]пиримидина (123 мг, 0,61 ммоль) в THF (5 мл) добавляли K2CO3 (167 мг, 1,21 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (201 мг, 95%).
МС (ИЭР, пол. ион) m/z: 351,10 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,00 (s, 1Н), 4,62 (t, J=6,3 Гц, 1H), 3,99 (s, 3H), 3,74 (s, 3H), 2,44 (s, 1H), 1,94 (s, 1H), 1,88-1,37 (m, 10H).
Стадия 3:
(+/-)-транс-метил 3-((6-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00370] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (86 мг, 0,21 ммоль), K2CO3 (78 мг, 0,57 ммоль), Pd(dppf)Cl2 (15 мг, 0,02 ммоль) и (+/-)-транс-метил 3-((6-хлор-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карб оксилата (66 мг, 0,19 ммоль) в 1,4-диоксане (8,0 мл) добавляли воду (1 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и затем смесь перемешивали при 110°С в течение 1,5 ч. Реакционную смесь фильтровали через целитовую прокладку для удаления твердых примесей. Затем фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (53 мг, 47%).
МС (ИЭР, пол. ион) m/z: 605,10 [М+Н]+.
Стадия 4:
(+/-)-транс-3-((6-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00371] Раствор NaOH (41 мг, 0,94 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил
3-((6-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (57 мг, 0,09 ммоль) в THF/MeOH (отношение объемов=5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и рН полученной смеси доводили до рН ≈ 6 водным раствором соляной кислоты (1 М). Смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (33 мг, 80%).
МС (ИЭР, пол. ион) m/z: 436,10 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 436,1910[М+Н]+, (C22H23FN7O2)[M+H]+ теоретическое значение: 436,1897;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1Н), 8,68 (d, J=9,3 Гц, 1Н), 8,34 (s, 1Н), 8,28 (s, 1Н), 8,10 (s, 1Н), 7,99 (d, J=6,4 Гц, 1H), 4,83 (s, 1Н), 3,96 (s, 3Н), 2,67 (s, 1H), 2,03 (s, 2Н), 1,84-1,41 (m, 9Н).
Пример 32: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-нонил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 2,4-дихлор-7-нонил-7H-пирроло[2,3-d]пиримидин
[00372] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидина (500 мг, 2,66 ммоль) в ДМФ (5 мл) добавляли NaH (130 мг, 3,19 ммоль) при 0°С, и смесь перемешивали при этой температуре в течение 30 мин. Затем к смеси добавляли бромнонан (1,03 мг, 5,32 ммоль), и полученную смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (821 мг, 98%).
МС (ИЭР, пол. ион) m/z: 315,10 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,24 (d, J=3,6 Гц, 1Н), 6,59 (d, J=3,5 Гц, 1Н), 4,23 (t, J=7,3 Гц, 2Н), 1,84 (dt, J=14,1, 7,2 Гц, 2Н), 1,31-1,23 (m, 12Н), 0,87 (t, J=7,0 Гц, 3Н).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-7-нонил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00373] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (572 мг, 2,87 ммоль) и 2,4-дихлор-7-нонил-7H-пирроло[2,3-d]пиримидина (821 мг, 2,61 ммоль) в THF (5 мл) добавляли DIPEA (4,6 мл, 26,13 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (174 мг, 14%).
МС (ИЭР, пол. ион) m/z: 462,15 [М+Н]+.
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-нонил-7H-пирроло[2,3-d)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00374] К смеси 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридина (172 мг, 0,42 ммоль), K2CO3(156 мг, 1,13 ммоль), Pd(dppf)Cl2 (28 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-7-нонил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (174 мг, 0,38 ммоль) в 1,4-диоксане (8,0 мл) добавляли H2O (1 мл) в атмосфере азота. Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь перемешивали при 110°С в течение 1,5 ч при нагревании под воздействием микроволнового излучения. Реакционную смесь фильтровали через целитовую прокладку для удаления твердых примесей. Затем фильтрат концентрировали под вакуумом для удаления растворителя. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (216 мг, 80%).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-нонил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00375] Раствор NaOH (79 мг, 1,58 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил
3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-нонил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (113 мг, 0,16 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл). Реакционную смесь перемешивали при к.т.в течение ночи. В реакционную смесь добавляли воду (10 мл), и рН полученной смеси доводили до рН ≈ 6 водным раствором соляной кислоты (1 М). Смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (31 мг, 36%).
МС (ИЭР, пол. ион) m/z: 547,70 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 421,1800[М+Н]+, (C31H40FN6O2)[M+H]+ теоретическое значение: 421,1788;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,06 (s, 1Н), 8,70 (dd, J=9,8, 2,3 Гц, 1H), 8,25 (s, 1H), 8,21 (d, J=2,5 Гц, 1H), 7,70-7,63 (m, 1H), 7,21 (d, J=6,4 Гц, 1H), 7,06 (d, J=3,2 Гц, 1H), 6,62 (s, 1H), 4,78 (s, 1H), 4,16 (t, J=6,6 Гц, 2H), 4,13-4,09 (m, 1H), 2,71 (d, J=6,7 Гц, 1H), 2,02 (d, J=11,4 Гц, 2H), 1,89-1,71 (m, 5H), 1,58 (m, 4H), 1,37-1,17 (m, 12H), 0,74 (t, J=6,6 Гц, 3H).
Пример 33: (+/-)-транс-3-((7-бензил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
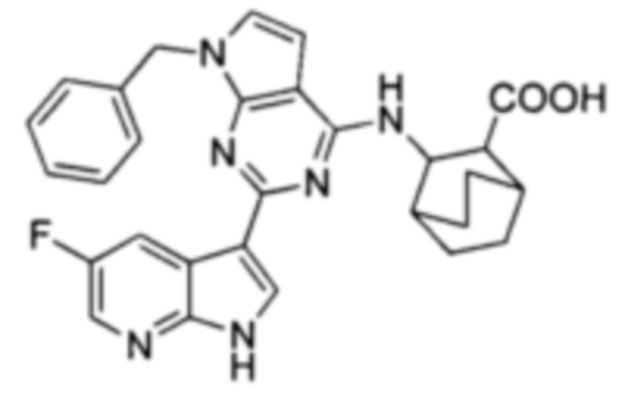
Стадия 1: 7-бензил-2,4-дихлор-7H-пирроло[2,3-d]пиримидин
[00376] К раствору 2,4-дихлор-7H-пирроло[2,3-d]пиримидин (500 мг, 2,66 ммоль) в ДМФ (5 мл) добавляли NaH (130 мг, 3,19 ммоль, 60%) при 0°С, и смесь перемешивали при этой температуре в течение 30 мин. Затем к смеси добавляли бензилбромид (904 мг, 5,32 ммоль), и полученную смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (50 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (683 мг, 92%).
МС (ИЭР, пол. ион) m/z: 279,30 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,39-7,32 (m, 3Н), 7,24 (d, J=7,6 Гц, 2H), 7,19 (d, J=3,6 Гц, 1H), 6,62 (d, J=3,6 Гц, 1H), 5,43 (s, 2H).
Стадия 2:
(+/-)-транс-метил 3-((7-бензил-2-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00377] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (236 мг, 1,19 ммоль) и 2,4-дихлор-7-нонил-7H-пирроло[2,3-d]пиримидина (300 мг, 1,08 ммоль) в THF (5 мл) добавляли K2CO3 (301 мг, 2,16 ммоль). Затем смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали добавлением воды (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc(отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (250 мг, 55%).
МС (ИЭР, пол. ион) m/z: 425,15 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,39-7,36 (m, 1Н), 7,31 (dd, J=11,7, 4,5 Гц, 3H), 7,20 (d, J=7,3 Гц, 2H), 6,90-6,79 (m, 1H), 6,42 (s, 1H), 5,33 (d, J=8,4 Гц, 2H), 4,60 (d, J=6,0 Гц, 1H), 3,76 (s, 3H), 2,43 (d, J=5,2 Гц, 1H), 2,06 (s, 1H), 2,02 (s, 1H), 1,94 (d, J=2,3 Гц, 1H), 1,71 (m, 8H).
Стадия 3:
(+/-)-транс-метил 3-((7-бензил-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00378] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (172 мг, 0,41 ммоль), K2CO3 (156 мг, 1,13 ммоль), PdCl2(dppf) (28 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((7-бензил-2-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (174 мг, 0,38 ммоль). Затем к смеси добавляли Н2О (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1,5 ч при 110°С при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (89 мг, 32%).
Стадия 4:
(+/-)-транс-3-((7-бензил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00379] Раствор NaOH (56 мг, 1,31 ммоль) в воде (1 мл) добавляли к раствору (+/-)-транс-метил
3-((7-бензил-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (89 мг, 0,13 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл). Реакционную смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и рН полученной смеси доводили до рН≈6 водным раствором соляной кислоты (1 М). Смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (20 мг, 30%).
МС (ИЭР, пол. ион) m/z: 511,60 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 511,2257[М+Н]+, (C29H28FN6O2)[M+H]+ теоретическое значение: 511,2258;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,09 (s, 1Н), 8,65 (d, J=8,2 Гц, 1H), 8,28-8,21 (m, 2H), 7,72-7,66 (m, 4H), 7,31 (s, 2H), 7,17 (d, J=3,1 Гц, 1H), 6,67 (s, 1H), 5,43 (s, 2H), 4,79 (s, 1H), 2,72 (d, J=6,6 Гц, 1H), 2,02 (s, 2H), 1,84-1,47 (m, 9H).
Пример 34:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-(2-гидроксиэтил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
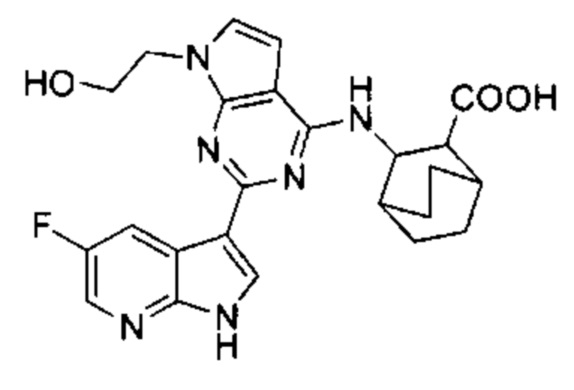
Стадия 1:
7-(2-((трет-бутилдиметилсилил)оху)этил)-2,4-дихлор-7H-пирроло[2,3-d]пиримидин
[00380] Раствор 2,4-дихлор-7H-пирроло[2,3-d]пиримидина (500 мг, 2,66 ммоль) в ДМФ (5 мл) перемешивали при 0°С в течение 5 мин, затем к раствору по каплям добавляли раствор натрия гидрида (130 мг, 3,19 ммоль, 60%). Полученную смесь перемешивали в течение 15 мин при 0°С, затем добавляли (2-бромэтокси)(трет-бутил)диметилсилан (904 мг, 5,32 ммоль). Смесь согрели до к.т. и перемешивали в течение ночи. Для того чтобы остановить реакцию в реакционную смесь добавляли воду (100 мл), и полученную смесь экстрагировали этилацетатом (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (516 мг, 56%).
МС (ИЭР, пол. ион) m/z: 346,95 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,35 (d, J=3,6 Гц, 1Н), 6,57 (d, J=3,3 Гц, 1Н), 4,36 (t, J=4,9 Гц, 2Н), 3,92 (t, J=4,9 Гц, 2Н), 0,83 (s, 9Н), 0,08 (s, 6Н).
Стадия 2:
(+/-)-транс-метил 3-((7-(2-((трет-бутилдиметилсилил)оху)этил)-2-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00381] Суспензию 7-(2-((трет-бутилдиметилсилил)оху)этил)-2,4-дихлор-7H-пирроло[2,3-d]пиримидина (516 мг, 1,49 ммоль), (+/-)-транс-метил 3-аминобицикло[2,2,2] октан-2-карбоксилата (330 мг, 1,64 ммоль) и K2CO3 (411 мг, 2,98 ммоль) в ДМФ (10 мл) перемешивали при к.т. в течение ночи, затем реакцию останавливали добавлением воды (100 мл). Смесь экстрагировали этилацетатом (50 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (80 мл × 3), сушили над безводным натрия сульфат и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=3/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (138 мг, 19%).
МС (ИЭР, пол. ион) m/z: 494,10 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((7-(2-((трет-бутилдиметилсилил)оху)этил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00382] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (129 мг, 0,31 ммоль), K2CO3 (120 мг, 0,84 ммоль), PdCl2(dppf) (22 мг, 0,03 ммоль) и (+/-)-транс-метил 3-((7-(2-((трет-бутилдиметилсилил)оху)этил)-2-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбок силат (128 мг, 0,38 ммоль). Затем к смеси добавляли H2O (1 мл),, и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1,5 ч при 110°С при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (188 мг, 90%).
МС (ИЭР, пол. ион) m/z: 748,15 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,75-8,69 (m, 1Н), 8,67 (s, 1H), 8,32 (d, J=1,7 Гц, 1H), 8,14 (d, J=8,3 Гц, 2H), 7,30 (s, 2H), 7,08 (d, J=3,4 Гц, 1H), 6,36 (d, J=3,3 Гц, 1H), 5,10 (d, J=6,9 Гц, 1H), 4,90 (s, 1H), 4,38 (t, J=5,4 Гц, 2H), 3,99 (t, J=5,4 Гц, 2H), 3,73 (s, 3H), 2,48 (d, J=5,5 Гц, 1H), 2,39 (s, 3H), 2,08 (s, 2H), 1,98-1,70 (m, 6H), 1,64 (s, 6H), 1,53 (d, J=14,8 Гц, 2H), 0,88 (s, 9H).
Стадия 4:
(+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-(2-гидроксиэтил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00383] К раствору соляной кислоты в 1,4-диоксане (0,26 мл, 5 моль/л) добавляли (+/-)-транс-метил
3-((7-(2-((трет-бутилдиметилсилил)оху)этил)-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-кар боксилат (188 мг, 0,25 ммоль), и смесь перемешивали при к.т. в течение ночи. Реакционную смесь концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (142 мг, 89%).
МС (ИЭР, пол. ион) m/z: 633,20 [М+Н]+.
Стадия 5: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-(2-гидроксиэтил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00384] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-(2-гидроксиэтил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (188 мг, 0,25 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли, раствор гидроксида натрия (93 мг, 2,24 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6. Смесь экстрагировали этилацетатом (15 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (66 мг, 63%).
МС (ИЭР, пол. ион) m/z: 465,10 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 465,2042[М+Н]+, (C24H26FN6O3)[M+H]+ теоретическое значение: 465,2050;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,08 (s, 1Н), 8,69 (dd, J=9,7, 2,3 Гц, 1H), 8,26 (d, J=1,0 Гц, 1H), 8,21 (d, J=2,6 Гц, 1H), 7,23 (d, J=6,7 Гц, 1H), 7,12 (d, J=3,3 Гц, 1H), 6,61 (d, J=2,4 Гц, 1H), 5,00 (s, 1H), 4,79 (s, 1H), 4,26 (dd, J=10,3, 5,6 Гц, 2H), 3,79 (t, J=5,7 Гц, 2H), 2,72 (d, J=6,7 Гц, 1H), 2,02 (s, 2H), 1,87-1,71 (m, 3H), 1,51 (m, 5H), 1,25-1,17 (m, 1H);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,11, 157,13, 156,02, 155,79, 154,76, 150,37, 146,42, 131,53, 131,25, 130,00, 124,59, 119,03, 118,96, 116,00, 115,79, 98,73, 60,74, 50,60, 49,08, 47,01, 28,95, 26,07, 24,24, 21,57, 19,51.
Пример 35: (+/-)-цис-7N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
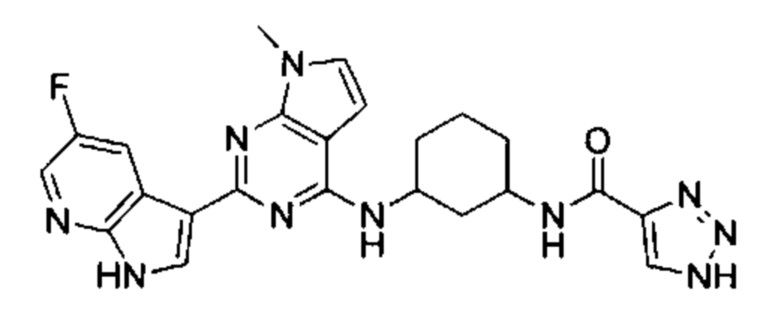
Стадия 1:
(+/-)-цис-трет-бутил (3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)карбамат
[00385] К раствору 2,4-дихлор-7-метил-7H-пирроло[2,3-d]пиримидина (362 мг, 1,80 ммоль) и (+/-)-цис-N-трет-бутоксикарбонил-1,3-циклогександиамина (350 мг, 1,63 ммоль) в N,N-диметилформамиде (3 мл) добавляли карбонат калия (677 мг, 4,90 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакционную смесь разбавляли водой (50 мл) и полученную смесь экстрагировали EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (100 мл), сушили над безводным Na2SO4, и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (436 мг, 70%).
МС (ИЭР, пол. ион) m/z: 378,1 [М+Н]+.
Стадия 2:
(+/-)-цис-N1-(2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)циклогексан-1,3-диамин
[00386] К раствору соляной кислоты в 1,4-диоксане (0,78 мл, 3,9 ммоль, 5 моль/л) добавляли (+/-)-цис-трет-бутил (3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)карбамат (150 мг, 0,39 ммоль), и смесь перемешивали при к.т. в течение ночи. Реакционную смесь концентрировали под вакуумом для удаления растворителя и к остатку добавляли требуемое количество воды,. Полученную смесь корректировали насыщенным водным раствором натрия бикарбоната до рН 9. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и концентрировали под вакуумом досуха и получали указанное в заголовке соединение, в виде бесцветного твердого вещества (110 мг, 100%).
МС (ИЭР, пол. ион) m/z: 280,1 [М+Н]+.
Стадия 3:
(+/-)-цис-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1Н-1,2,3-триазол-4-карбоксамид
[00387] К раствору (+/-)-цис-N1-(2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил) циклогексан-1,3-диамина (60 мг, 0,21 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметил сульфоксид (1 мл), добавляли N,N-диизопропилэтиламин (0,11 мл, 0,64 ммоль) и 1H-1,2,3-триазол-4-карбоновую кислоту (48 мг, 0,43 ммоль). Смесь перемешивали при к.т. в течение 10 минут, и затем добавляли HATU (163 мг, 0,43 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха и получали указанное в заголовке соединение в виде бесцветного твердого вещества (83 мг, 100%).
МС (ИЭР, пол. ион) m/z: 375,2 [М+Н]+.
Стадия 4:
(+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
[00388] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (213 мг, 0,26 ммоль, 50%), (+/-)-цис-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид (80 мг, 0,21 ммоль), карбонат калия (88 мг, 0,64 ммоль), Pd(dppf)Cl2 (34 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (37 мг, 28%).
МС (ИЭР, пол. ион) m/z: 629,2[М+Н]+.
Стадия 5:
(+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамид
[00389] К раствору (+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1H-1,2,3-триазол-4-карбоксамида (37 мг, 0,06 ммоль) в метаноле (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,12 мл, 0,6 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (9 мг, 32%).
МС (ИЭР, пол. ион) m/z: 475,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 475,2100[М+Н]+, (C23H24FN10O)[M+H]+ теоретическое значение: 475,2119;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,13 (s, 1Н), 8,66 (d, J=8,5 Гц, 1H), 8,43 (s, 1H), 8,27 (s, 1H), 7,34 (s, 1H), 7,06 (s, 1H), 6,61 (s, 1H), 4,31 (s, 1H), 4,05 (s, 1H), 3,69 (s, 3H), 2,25 (s, 1H), 2,10 (s, 1H), 1,87 (s, 2H), 1,61-1,33 (m, 4H).
Пример 36:
(+/-)-цис-2-амино-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид

Стадия 1:
(+/-)-цис-2-амино-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00390] К раствору (+/-)-цис-N1-(2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)циклогексан-1,3-диамина (62 мг, 0,22 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметилсульфоксид (1 мл) добавляли N,N-диизопропилэтиламин (0,11 мл, 0,66 ммоль) и 2-аминотиазол-4-карбоновую кислоту (63 мг, 0,44 ммоль). Смесь перемешивали при к.т. в течение 10 минут, и затем добавляли HATU (168 мг, 0,44 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха чтобы получить указанное в заголовке соединение в виде бесцветного твердого вещества (89,9 мг, 100%).
МС (ИЭР, пол. ион) m/z: 406,5[М+Н]+.
Стадия 2:
(+/-)-цис-2-амино-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00391] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (221 мг, 0,27 ммоль, 50%), (+/-)-цис-2-амино-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид (90 мг, 0,22 ммоль), карбонат калия (91 мг, 0,67 ммоль), Pd(dppf)Cl2 (36 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (56 мг, 38%).
МС (ИЭР, пол. ион) m/z: 629,2[М+Н]+;
1Н ЯМР (400 МГц, MeOD) δ (ppm): 8,80 (d, J=8,8 Гц, 1H), 8,58 (s, 1H), 8,29 (s, 1H), 8,08 (d, J=8,5 Гц, 2H), 7,38 (d, J=8,3 Гц, 2Н), 7,25 (s, 1Н), 7,04 (d, J=3,1 Гц, 1H), 6,58 (d, J=3,4 Гц, 1H), 3,86 (s, 3H), 2,83 (s, 3H), 2,39 (s, 2H), 1,31 (s, 8H).
Стадия 3:
(+/-)-цис-2-амино-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамид
[00392] К раствору (+/-)-цис-2-амино-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)тиазол-4-карбоксамида (88 мг, 0,08 ммоль) в МеОН (1 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,16 мл, 0,8 ммоль). Смесь перемешивали при к.т. в течение ночи, затем концентрировали под вакуумом, и остаток разбавляли водой (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (26 мг, 62%).
МС (ИЭР, пол. ион) m/z: 506,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 506,1877[М+Н]+, (C24H25FN9OS)[M+H]+ теоретическое значение: 506,1887;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,13 (s, 1H), 8,66 (d, J=8,5 Гц, 1H), 8,43 (s, 1Н), 8,27 (s, 1H), 7,34 (s, 1Н), 7,06 (s, 1Н), 6,61 (s, 1Н), 4,31 (s, 1Н), 4,05 (s, 1Н), 3,69 (s, 3Н), 2,25 (s, 1Н), 2,10 (s, 1H), 1,87 (s, 2Н), 1,61-1,33 (m, 4Н);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 168,62, 160,44, 156,72, 156,03, 155,54, 155,13, 146,44, 146,19, 131,47, 131,27, 130,19, 124,68, 118,97, 116,03, 115,88, 111,66, 99,02, 47,64, 32,27, 32,15, 31,09, 29,44, 23,52, 14,42.
Пример 37: (+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
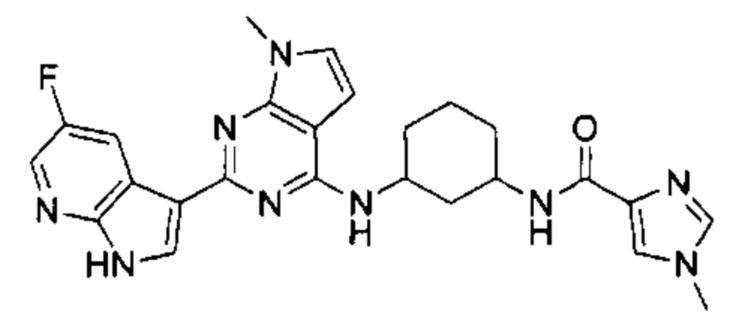
Стадия 1:
(+/-)цис-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00393] К раствору (+/-)-цис-N1-(2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)циклогексан-1,3-диамина (110,5 мг, 9 ммоль) в смешанном растворителе, содержащем тетрагидрофуран (4 мл) и диметил сульфоксид (1 мл), добавляли N,N-диизопропилэтиламин (0,16 мл, 1,19 ммоль) и 1-метил-1H-имидазол-4-карбоновую кислоту (99 мг, 0,78 ммоль). Смесь перемешивали при к.т. в течение 10 минут, и затем добавляли HATU (300 мг, 0,79 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (10 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и концентрировали под вакуумом чтобы получить указанное в заголовке соединение в виде бесцветного твердого вещества (86 мг, 56%).
МС (ИЭР, пол. ион) m/z: 388,2 [М+Н]+;
1Н ЯМР (400 МГц, MeOD) (ppm) δ: 7,65 (d, J=6,1 Гц, 2Н), 6,99 (d, J=3,3 Гц, 1Н), 6,56 (d, J=3,4 Гц, 1H), 3,78 (s, 3H), 3,72 (s, 3H), 2,68 (s, 2H), 2,34 (d, J=11,6 Гц, 1H), 2,06 (s, 2H), 1,93 (d, J=13,6 Гц, 1H), 1,61 (d, J=13,5 Гц, 1H), 1,44 (d, J=11,7 Гц, 1H), 1,39 (d, J=3,6 Гц, 2H).
Стадия 2: (+/-)-цис-N1-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00394] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (249 мг, 0,30 ммоль, 50%), (+/-)-цис-N-(3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид (97 мг, 0,25 ммоль), карбонат калия (103 мг, 0,75 ммоль), Pd(dppf)Cl2 (40 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 120°С при нагревании под воздействием микроволнового излучения в течение 4 часов. Реакционную смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (130 мг, 81%).
МС (ИЭР, пол. ион) m/z: 642,3 [М+Н]+.
Стадия 3:
(+/-)-цис-N-(3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамид
[00395] К раствору (+/-)-цис-N-(3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-b]пиримидин-4-ил)амино)циклогексил)-1-метил-1H-имидазол-4-карбоксамида (130 мг, 0,20 ммоль) в метаноле (2 мл) добавляли раствор натрия метоксида в метаноле (5 М, 0,40 мл, 2,00 ммоль). Смесь перемешивали при 30°С в течение ночи, затем концентрировали под вакуумом досуха. В реакционную смесь добавляли воду (10 мл), и полученную смесь экстрагировали этилацетатом (20 мл × 3), и Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (70 мг, 71%).
МС (ИЭР, пол. ион) m/z: 488,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 488,2345 [М+Н]+, (C25H27FN9O)[M+H]+ теоретическое значение: 488,2323;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,10 (s, 1Н), 8,68 (d, J=7,9 Гц, 1H), 8,34-8,20 (m, 2Н), 7,73 (d, J=8,4 Гц, 1Н), 7,63 (d, J=11,7 Гц, 2H), 7,28 (d, J=7,4 Гц, 1H), 7,05 (d, J=3,1 Гц, 1H), 6,59 (d, J=3,2 Гц, 1H), 4,31 (s, 1H), 3,98 (d, J=8,3 Гц, 1H), 3,78 (s, 3H), 3,67 (s, 3H), 2,26 (d, J=10,6 Гц, 1H), 2,12 (d, J=10,7 Гц, 1H), 1,87 (d, J=10,3 Гц, 2H), 1,54-1,21 (m, 4H).
Пример 38:
(+/-)-транс-3-((5-фтор-2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 3-бром-2-метил-1H-пирроло[2,3-b]пиридин
[00396] К раствору 2-метил-1H-пирроло[2,3-b]пиридина (500 мг, 3,78 ммоль) в ДМФ (8 мл) добавляли бром (0,22 мл, 4,16 ммоль). Реакционную смесь перемешивали при к.т. в течение 4 ч. Добавляли насыщенный водный раствор Na2S2O3 (100 мл), и полученную смесь экстрагировали EtOAc (100 мл × 2). Объединенные органические фазы промывали насыщенным раствором соли (100 мл × 3), сушили над Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=4/1), получая указанное в заголовке соединение в виде желтого твердого вещества (679 мг, 85%).
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,19 (s, 1H), 8,27 (d, J=4,8 Гц, 1H), 7,82 (d, J=7,8 Гц, 1H), 7,15 (dd, J=7,8, 4,9 Гц, 1H), 2,56 (s, 3H).
Стадия 2: 3-бром-2-метил-1-тозил-1H-пирроло[2,3-b]пиридин
[00397] К раствору 3-бром-2-метил-1H-пирроло[2,3-b]пиридина (100 мг, 0,47 ммоль) в THF (5 мл) добавляли NaH (22 мг, 0,57 ммоль, 60%) при 0°С. Затем реакционную смесь перемешивали в течение 30 мин при 0°С. Добавляли TsCl (100 мг, 0,52 ммоль), и реакционную смесь перемешивали при к.т. в течение ночи. Для того чтобы остановить реакцию, добавляли воду (50 мл), и полученную смесь разделяли на фракции. Водный слой экстрагировали EtOAc (50 мл × 2). Объединенные органические фазы промывали насыщенным раствором соли (80 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (100 мг, 58%).
МС (ИЭР, пол. ион) m/z: 365,95 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,44 (d, J=4,7 Гц, 1Н), 8,04 (d, J=8,3 Гц, 2Н), 7,72 (d, J=7,8 Гц, 1H), 7,29 (s, 1Н), 7,27 (s, 1H), 7,24 (dd, J=7,8, 4,9 Гц, 1Н), 2,79 (s, 3Н), 2,39 (s, 3Н).
Стадия 3:
2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00398] Воздух в суспензии 3-бром-2-метил-1-тозил-1H-пирроло[2,3-b]пиридина (100 мг, 0,27 ммоль), Pd(dppf)Cl2(20 мг, 0,03 ммоль) и KOAc (80 мг, 0,82 ммоль) в DME (5 мл) обменивали на азот, и затем к смеси добавляли бис(пинаколато)дибор (104 мг, 0,41 ммоль). Для удаления воздуха через смесь продували азот в течение 10 мин, затем смесь перемешивали при 105°С в течение 2 ч при нагревании под воздействием микроволнового излучения. В реакционную смесь добавляли этилацетат (20 мл), и смесь фильтровали через целитовую прокладку. Осадок на фильтре промывали этилацетатом (20 мл × 2). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=4/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (60 мг, 53%).
МС (ИЭР, пол. ион) m/z: 413,45 [М+Н]+.
Стадия 4:
(+/-)-транс-метил 3-((5-фтор-2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00399] К 1,4-диоксану (10 мл) добавляли 2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (50 мг, 0,12 ммоль), K2CO3 (50 мг, 0,36 ммоль), PdCl2(dppf) (10 мг, 0,01 ммоль) и метил 3-((2-хлор-5-фторпиримидин-4-ил)амино) бицикло[2,2,2]октан-2-карбоксилат (41 мг, 0,13 ммоль). Затем к смеси добавляли Н2О (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1,5 ч при 110°С при нагревании под воздействием микроволнового излучения в течение 10 мин. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (18 мг, 26%).
Стадия 5:
(+/-)-транс-3-((5-фтор-2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00400] К раствору (+/-)-транометил 3-((5-фтор-2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (130 мг, 0,23 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли раствор NaOH (95 мг, 2,31 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6. Полученную смесь экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (32 мг, 35%).
МС (ИЭР, пол. ион) m/z: 396,15 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 396,1836[М+Н]+, (C21H23FN5O2)[M+H]+ теоретическое значение:396,1836;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,49 (s, 1Н), 8,61 (d, J=7,7 Гц, 1H), 8,43 (d, J=4,9 Гц, 1H), 8,34 (d, J=4,5 Гц, 1H), 8,28 (s, 1H), 7,24 (dd, J=7,5, 4,8 Гц, 1H), 4,76 (t, J=6,6 Гц, 1H), 2,90 (d, J=6,8 Гц, 1H), 2,81 (s, 3H), 2,02 (s, 1H), 1,89 (s, 1H), 1,76 (d, J=8,2 Гц, 2H), 1,66 (d, J=10,6 Гц, 1H), 1,59 (d, J=6,2 Гц, 1H), 1,54-1,31 (m, 5H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 175,75, 156,88, 152,63, 146,57, 143,67, 142,67, 142,10, 141,59, 130,17, 120,33, 117,15, 107,09, 51,22, 47,55, 29,18, 28,65, 25,58, 24,18, 21,48, 19,49, 14,49.
Пример 39:
(+/-)-транс-3-((2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
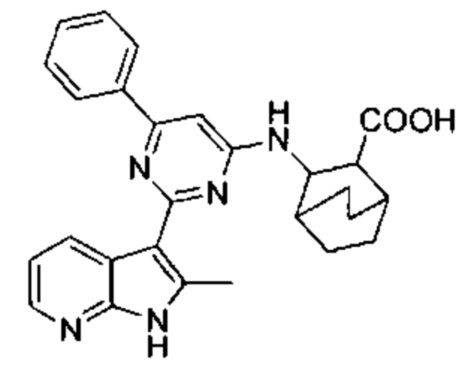
Стадия 1:
(+/-)-транс-метил 3-((2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00401] К 1,4-диоксану (10 мл) добавляли 2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (100 мг, 0,24 ммоль), K2CO3 (100 мг, 0,73 ммоль), Pd(dppf)Cl2 (18 мг, 0,03 ммоль) и (+/-)-транс-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (99 мг, 0,27 ммоль). Затем к смеси добавляли H2O (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 3 ч при 110°С при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (130 мг, 86%).
МС (ИЭР, пол. ион) m/z: 623,15 [М+Н]+.
Стадия 2:
(+/-)-транс-3-((2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00402] К раствору (+/-)-транс-метил 3-((2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (130 мг, 0,21 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли раствор гидроксида натрия (85 мг, 2,09 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 6. Смесь экстрагировали этилацетатом (15 мл × 3), и Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (38 мг, 40%).
МС (ИЭР, пол. ион) m/z: 454,20 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 454,2261 [М+Н]+, (C27H28N5O2)[M+H]+ теоретическое значение: 454,2243;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 11,91 (s, 1Н), 8,90 (d, J=7,1 Гц, 1H), 8,21-8,15 (m, 1H), 8,09 (d, J=6,6 Гц, 2H), 7,58-7,48 (m, 3H), 7,40 (d, J=5,5 Гц, 1H), 7,14 (dd, J=7,8, 4,7 Гц, 1H), 6,71 (s, 1H), 3,94 (s, 1H), 2,96 (s, 3H), 1,85-1,51 (m, 8H), 1,23 (d, J=3,1 Гц, 4H).
Пример 40: (+/-)-транс-3-((7-метил-2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((7-метил-2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[23-b]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00403] К 1,4-диоксану (8 мл) добавляли 2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (100 мг, 0,24 ммоль), K2CO3 (100 мг, 0,73 ммоль), Pd(dppf)Cl2 (24 мг, 0,02 ммоль) и (+/-)-транс-метил 3-((2-хлор-7-метил-7H-пирроло[2,3-b]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (99 мг,0,27 ммоль). Затем к смеси добавляли H2O (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1,5 ч при 110°С при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (112 мг, 77%).
МС (ИЭР, пол. ион) m/z: 599,20 [М+Н]+.
Стадия 2:
(+/-)-транс-3-((7-метил-2-(2-метил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00404] К раствору (+/-)-транс-метил 3-((7-метил-2-(2-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7H-пирроло[2,3-b]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (113 мг, 0,19 ммоль) в THF/MeOH (отношение объемов = 5 мл/5 мл) добавляли раствор гидроксида натрия (79 мг, 1,89 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой до рН ≈ 6. Смесь экстрагировали этилацетатом (15 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (31 мг, 38%).
МС (ИЭР, пол. ион) m/z: 431,15 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 431,2201 [М+Н]+, (C24H27N6O2)[M+H]+ теоретическое значение: 431,2195;
1Н ЯМР (600 МГц, DMSC-d6) δ (ppm) 11,73 (s, 1Н), 8,95 (d, J=7,7 Гц, 1Н), 8,15 (d, J=4,4 Гц, 1Н), 7,16 (d, J=7,1 Гц, 1Н), 7,10 (dd, J=7,8, 4,7 Гц, 1Н), 7,06 (d, J=3,2 Гц, 1Н), 6,60 (s, 1Н), 4,83 (s, 1Н), 3,77 (s, 3Н), 2,94 (s, 3Н), 2,74 (d, J=6,7 Гц, 1Н), 2,00 (d, J=15,2 Гц, 2Н), 1,76 (d, J=10,5 Гц, 2Н), 1,62-1,34 (m, 5Н), 1,24 (s, 2Н).
Пример 41: (+/-)-транс-3-((5-фтор-2-(5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 3-бром-5-фторпиридин-2-амин
[00405] К раствору 5-фторпиридин-2-амина (6 г, 53,52 ммоль) в ацетонитриле (120 мл) медленно добавляли NBS (12,64 г, 69,60 ммоль), и смесь перемешивали при к.т. в течение 2 ч, затем концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (5,4 г, 53%).
МС (ИЭР, пол. ион) m/z: 193,0[М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,95 (d, J=2,5 Гц, 1H), 7,52 (dd, J=7,3, 2,6 Гц, 1H), 4,84 (s, 2H).
Стадия 2: 5-фтор-3-((4-фторфенил)этинил)пиридин-2-амин
[00406] К раствору 3-бром-5-фторпиридин-2-амина (1,33 г, 6,96 ммоль) в ацетонитриле (14 мл) последовательно добавляли триэтиламин (14 мл), 1-этинил-4-фторбензол (850 мг, 7,08 ммоль) и Pd(PPh3)2Cl2 (496 мг, 0,70 ммоль), и смесь перемешивали при 75°С в течение 6 ч в защитной атмосфере азота, затем концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (770 мг, 48,0%).
МС (ИЭР, пол. ион) m/z: 231,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm):7,95 (d, J=2,9 Гц, 1Н), 7,56-7,48 (m, 2H), 7,38 (dd, J=8,3, 2,9 Гц, 1H), 7,09 (dd, J=11,0, 4,3 Гц, 2H), 4,96 (s, 2H).
Стадия 3: 5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридин
[00407] К раствору 5-фтор-3-((4-фторфенил)этинил)пиридин-2-амина (50 мг, 0,22 ммоль) в ДМФ (1 мл) добавляли калия трет-бутоксид (73 мг, 0,65 ммоль), и смесь перемешивали при 80°С в течение 3 ч в защитной атмосфере азота, затем охлаждали до к.т.. В реакционную смесь добавляли воду (25 мл), и полученную смесь экстрагировали этилацетатом (25 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (30 мг, 60%).
МС (ИЭР, пол. ион) m/z: 231,1 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 12,29 (s, 1Н), 8,19 (s, 1H), 8,00 (dd, J=8,6, 5,4 Гц, 2H), 7,83 (dd, J=9,5, 2,6 Гц, 1H), 7,34 (t, J=8,8 Гц, 2H), 6,92 (s, 1H).
Стадия 4: 3-бром-5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридин
[00408] К раствору 5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридина (30 мг, 0,13 ммоль) в ДМФ (1 мл) добавляли бромин (0,02 мл, 0,26 ммоль). Реакционную смесь перемешивали при к.т. в течение 2 ч. Добавляли насыщенный водный раствор Na2S2O3 (20 мл), и полученную смесь экстрагировали EtOAc (20 мл × 2). Объединенные органические фазы промывали насыщенным раствором соли (20 мл × 3), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (15 мг, 37%).
МС (ИЭР, пол. ион) m/z: 311,0 [М+Н]+;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,65 (s, 1Н), 8,32 (s, 1H), 7,94 (dd, J=8,6, 5,5 Гц, 2H), 7,76 (dd, J=8,8, 2,5 Гц, 1H), 7,43 (t, J=8,8 Гц, 2H).
Стадия 5: 3-бром-5-фтор-2-(4-фторфенил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00409] К высушенному тетрагидрофурану (10 мл) добавляли 3-бром-5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридин (0,74 г, 2,0 ммоль). К раствору добавили натрия гидрид (232 мг, 5,80 ммоль, 60%) при 0°С, и полученную смесь перемешивали при 0°С в течение 30 мин. Затем к смеси добавили n-толуолсульфонил хлорид (667 мг, 3,50 ммоль), смесь согрели до к.т. и перемешивали в течение 3 ч. Для того чтобы остановить реакцию, добавляли воду (100 мл), и полученную смесь экстрагировали EtOAc (100 мл × 2). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (360 мг, 27%).
МС (ИЭР, пол. ион) m/z: 463,1 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,42 (d, J=1,2 Гц, 1Н), 7,76 (d, J=8,2 Гц, 2H), 7,53-7,47 (m, 3Н), 7,28-7,19 (m, 4H).
Стадия 6:
5-фтор-2-(4-фторфенил)-1-тозил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)пирроло[2,3-b]пиридин
[00410] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 3-бром-5-фтор-2-(4-фторфенил)-1-(n-толилсульфонил)пирроло[2,3-b]пиридин (300 мг, 0,65 ммоль), бис(пинаколато)дибор (247 мг, 0,97 ммоль), калия ацетат (128 мг, 1,30 ммоль), Pd(dppf)Cl2 (53 мг, 0,06 ммоль) и диметоксиэтан (4 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и перемешивали при 130°С в течение 2 ч при нагревании под воздействием микроволнового излучения. Смесь охлаждали до к.т. и фильтровали через целитовую прокладку. Остатком на фильтре являлся этилацетат (10 мл), объединенные фильтраты сушили под вакуумом досуха. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого масла (220 мг, 67%).
МС (ИЭР, пол. ион) m/z: 511,4 [М+Н]+.
Стадия 7:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-2-(4-фторфенил)-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2.2.2]октан-2-карбоксилат
[00411] В запаянную трубку вносили
-фтор-2-(4-фторфенил)-1-тозил-3-(4,4,5,5-тетраметил
-1,3,2-диоксоборолан-2-ил)пирроло[2,3-b]пиридин (200 мг, 0,38 ммоль), (+/-)-транс-метил
3-((2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,32 ммоль), карбонат калия (132 мг, 0,96 ммоль), Pd(dppf)Cl2 (52 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Смесь перемешивали при 110°С в течение 3 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (204 мг, 97%).
МС (ИЭР, пол. ион) m/z: 662,1[М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,40 (d, J=2,0 Гц, 1H), 8,19 (dd, J=8,8, 2,8 Гц, 1H), 7,96 (d, J=3,1 Гц, 1H), 7,79 (s, 1H), 7,77 (s, 1H), 7,43 (s, 2H), 7,13 (t, J=8,5 Гц, 2H), 3,81 (s, 1H), 3,60 (s, 3H), 2,37 (s, 3H), 2,25 (d, J=7,1 Гц, 1H), 1,58 (m, 8H).
Стадия 8:
(+/-)-транс-3-((5-фтор-2-(5-фтор-2-(4-фторфенил)-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00412] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-2-(4-фторфенил)-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,30 ммоль) в THF/MeOH (отношение объемов = 1/1, 3 мл) добавляли водный раствор гидроксида натрия (4 М, 0,75 мл, 3,00 ммоль). Смесь перемешивали при 30°С в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5, затем экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (74 мг, 50%).
МСВР (ИЭР, пол. ион) m/z: 494,1824 [М+Н]+, (C26H23F3N5O2)[М+Н]+ теоретическое значение: 494,1804;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,35 (s, 1Н), 8,41 (dd, J=9,9, 2,6 Гц, 1H), 8,26 (s, 1H), 8,11 (d, J=3,6 Гц, 1H), 7,95 (s, 1H), 7,67 (dd, J=8,3, 5,6 Гц, 2H), 7,48 (d, J=7,0 Гц, 1H), 7,26 (t, J=8,8 Гц, 2H), 4,24 (t, J=7,1 Гц, 1H), 2,76 (d, J=7,3 Гц, 1H), 1,94 (s, 1H), 1,66 (d, J=8,5 Гц, 2H), 1,50 (s, 1H), 1,37-1,20 (m, 6H).
Пример 42:
(+/-)-транс-3-((5-фтор-2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
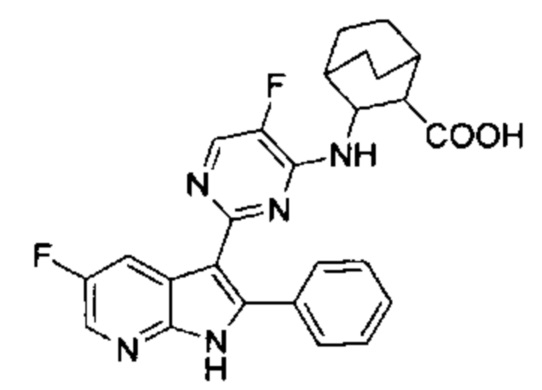
Стадия 1: 5-фтор-3-(2-фенилэтинил)пиридин-2-амин
[00413] К раствору 3-бром-5-фторпиридин-2-амина (3,8 г, 20 ммоль) в ацетонитриле (40 мл) последовательно добавляли триэтиламин (40 мл), фенилацетилен (2,2 г, 22 ммоль) и Pd(PPh3)2Cl2 (1,5 г, 2,1 ммоль), и смесь перемешивали при 75°С в течение 5 ч в защитной атмосфере азота, затем концентрировали под вакуумом досуха. Остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (2,9 г, 69%).
МС (ИЭР, пол. ион) m/z: 213,3 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,95 (d, J=2,9 Гц, 1Н), 7,56-7,48 (m, 2Н), 7,38 (dd, J=8,3, 2,9 Гц, 1Н), 7,09 (dd, J=11,0, 4,3 Гц, 2Н), 4,96 (s, 2Н).
Стадия 2: 5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин
[00414] К раствору 5-фтор-3-(2-фенилэтинил)пиридин-2-амина (2,8 г, 13 ммоль) в ДМФ (30 мл) добавляли калия трет-бутоксид (4,4 г, 39 ммоль), и смесь перемешивали при 80°С в течение 3 ч в защитной атмосфере азота, затем охлаждали до к.т.. В реакционную смесь добавляли воду (25 мл), и полученную смесь экстрагировали этилацетатом (25 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (2,5 г, 89%).
МС (ИЭР, пол. ион) m/z: 213,1 [М+Н]+.
Стадия 3: 3-бром-5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин
[00415] К раствору 5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин (2,5 г, 30 ммоль) в ДМФ (30 мл) добавляли бром (1,2 мл, 23 ммоль). Реакционную смесь перемешивали при к.т. в течение 2 ч. Для того чтобы остановить реакцию, добавляли насыщенный водный раствор Na2S2O3 (50 мл), и полученную смесь экстрагировали EtOAc (50 мл × 2). Объединенные органические фазы промывали насыщенным раствором соли (20 мл × 3), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (3,20 г, 93%).
МС (ИЭР, пол. ион) m/z: 291,0 [М+Н]+;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 10,92 (s, 1Н), 8,14 (s, 1H), 7,94 (d, J=7,3 Гц, 2H), 7,65 (dd, J=8,4, 2,4 Гц, 1H), 7,60 (t, J=7,5 Гц, 2H), 7,53 (d, J=7,4 Гц, 1H).
Стадия 4: 3-бром-5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин
[00416] К раствору 3-бром-5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин (3,84 г, 13,2 ммоль) в высушенном тетрагидрофуране (40 мл) добавляли натрия гидрид (1,07 г, 26,8 ммоль, 60%). Реакционную смесь перемешивали при 0°С в течение 30 мин, затем добавляли п-толуолсульфонил хлорид (3,03 г, 15,9 ммоль). Полученную смесь перемешивали при к.т. в течение 3 ч, затем реакцию останавливали, добавляя воду (100 мл), и смесь разделяли на фракции. Водный слой экстрагировали EtOAc (100 мл × 2). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом досуха. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (1,42 г, 24%).
МС (ИЭР, пол. ион) m/z: 444,9 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,41 (d, J=1,3 Гц, 1Н), 7,79 (s, 1H), 7,77 (s, 1H), 7,56-7,49 (m, 6H), 7,23 (d, J=8,1 Гц, 2H), 2,39 (s, 3H).
Стадия 5:
5-фтор-2-фенил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00417] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 3-бром-5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин (1,35 г, 3,03 ммоль), бис(пинаколато)дибор (1,15 г, 4,53 ммоль), калия ацетат (596 мг, 6,07 ммоль), Pd(dppf)Cl2 (249 мг, 0,30 ммоль) и диметоксиэтан (10 мл). Смесь перемешивали при 130°С в течение 2 ч при нагревании под воздействием микроволнового излучения. Смесь охлаждали до к.т. и фильтровали через целитовую прокладку. Осадок на фильтре промывали этилацетатом (10 мл), и объединенные фильтраты сушили под вакуумом досуха. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (1,14 г, 76%).
МС (ИЭР, пол. ион) m/z: 493,1 [М+Н]+.
Стадия 6:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00418] В запаянную трубку вносили 5-фтор-2-фенил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (158 мг, 0,31 ммоль), (+/-)-транс-метил 3-((2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (80 мг, 0,25 ммоль), карбонат калия (106 мг, 0,77 ммоль), Pd(dppf)Cl2 (42 мг, 0,05 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и смесь перемешивали при 110°С в течение 2 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (29 мг, 18%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,40 (d, J=1,8 Гц, 1H), 8,19 (dd, J=8,7, 2,8 Гц, 1H), 7,95 (d, J=3,0 Гц, 1H), 7,80 (d, J=8,3 Гц, 2H), 7,44 (d, J=6,0 Гц, 5H), 7,21 (d, J=8,0 Гц, 2H), 4,85 (d, J=7,4 Гц, 1H), 4,08 (t, J=6,8 Гц, 1H), 3,59 (s, 3H), 2,37 (s, 3H), 2,22 (d, J=6,6 Гц, 1H), 2,04 (s, 2H), 1,57-1,28 (m, 8H).
Стадия 7:
(+/-)-транс-3-((5-фтор-2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00419] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (29 мг, 0,05 ммоль) в THF/MeOH (отношение объемов = 1/1, 3 мл) добавляли водный раствор гидроксида натрия (4 М, 0,13 мл, 0,50 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (19 мг, 89%).
МС (ИЭР, пол. ион) m/z: 476,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 476,1900 [М+Н]+, (C26H24F2N5O2)[M+H]+ теоретическое значение: 476,1898;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,31 (s, 1Н), 8,38 (dd, J=9,9, 2,7 Гц, 1H), 8,26 (s, 1H), 8,08 (d, J=3,7 Гц, 1H), 7,61 (d, J=6,9 Гц, 2H), 7,51-7,37 (m, 4H), 4,28 (s, 1H), 2,76 (d, J=6,8 Гц, 1H), 1,93 (s, 1H), 1,66 (d, J=8,5 Гц, 2H), 1,57-1,28 (m, 8H).
Пример 43:
(+/-)-транс-3-((2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
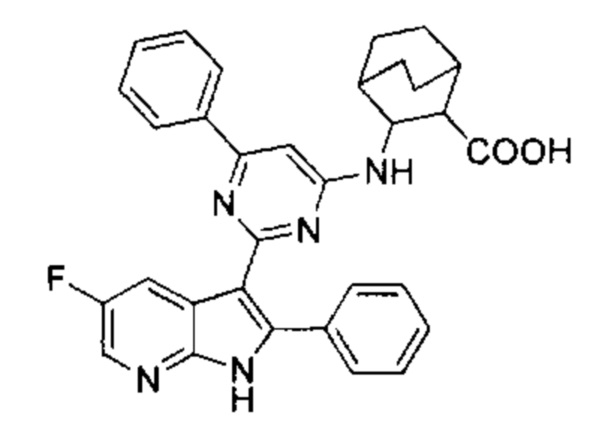
Стадия 1: (+/-)-транс-метил
3-((2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00420] В запаянную трубку вносили 5-фтор-2-фенил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (133 мг, 0,26 ммоль), (+/-)-транс-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (80 мг, 0,22 ммоль), карбонат калия (90 мг, 0,65 ммоль), Pd(dppf)Cl2 (36 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем в запаянной трубке перемешивали при 110°С в течение 3 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (57 мг, 38%).
МС (ИЭР, пол. ион) m/z: 702,2[М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,48 (d, J=9,0 Гц, 1Н), 8,43 (s, 1Н), 7,85 (d, J=8,2 Гц, 2Н), 7,55-7,47 (m, 6Н), 7,39 (d, J=6,8 Гц, 1Н), 7,36-7,31 (m, 2Н), 7,22 (d, J=8,1 Гц, 2Н), 6,63 (s, 1Н), 4,92 (s, 1H), 4,35 (s, 1Н), 3,67 (s, 3Н), 2,41-2,31 (m, 4Н), 1,88 (s, 1Н), 1,83-1,59 (m, 8Н).
Стадия 2:
(+/-)-транс-3-((2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00421] К раствору (+/-)-транс-метил 3-((2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (51 мг, 0,07 ммоль) в THF/MeOH (отношение объемов = 1/1, 1,0 мл) добавляли водный раствор гидроксида натрия (4 М, 0,15 мл, 0,70 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (35 мг, 90%).
МС (ИЭР, пол. ион) m/z: 534,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 534,2317 [М+Н]+, (C32H29FN5O2)[M+H]+ теоретическое значение: 534,2305;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,38 (s, 1H), 8,63 (s, 1H), 8,28 (s, 1H), 7,72-7,63 (m, 2H), 7,60 (d, J=7,4 Гц, 2H), 7,50-7,31 (m, 7H), 6,71 (s, 1H), 4,50 (s, 1H), 2,89 (s, 1H), 2,73 (s, 1H), 1,99 (s, 1H), 1,79 (s, 1H), 1,76-1,40 (m, 8H).
Пример 44:
(+/-)-транс-3-((2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00422] В запаянную трубку вносили 5-фтор-2-фенил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (174 мг, 0,34 ммоль), (+/-)-транс-метил 3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,29 ммоль), карбонат калия (118 мг, 0,86 ммоль), Pd(dppf)Cl2 (47 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и смесь перемешивали при 110°С в течение 3 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (58 мг, 30%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,52 (dd, J=9,0, 2,8 Гц, 1Н), 8,41 (d, J=2,0 Гц, 1Н), 7,87 (s, 1Н), 7,85 (s, 1Н), 7,52 (d, J=6,6 Гц, 2Н), 7,47 - 7,39 (m, 3H), 7,23 (s, 1Н), 7,21 (s, 1Н), 6,84 (d, J=3,4 Гц, 1Н), 6,32 (d, J=3,2 Гц, 1Н), 4,80 (d, J=7,6 Гц, 1Н), 4,62 (t, J=7,1 Гц, 1Н), 3,59 (s, 3H), 3,41 (s, 3H), 2,38 (s, 3H), 2,33 (d, J=6,6 Гц, 1Н), 1,92 (s, 2Н), 1,71-1,63 (m, 6H), 1,49 (d, J=10,6 Гц, 2Н).
Стадия 2: (+/-)-транс-3-((2-(5-фтор-2-фенил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H -пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00423] К раствору (+/-)-транс-метил 3-((2-(5-фтор-2-фенил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (58 мг, 0,09 ммоль) в THF/MeOH (отношение объемов=1/1, 1,0 мл) добавляли раствор гидроксида натрия в воде (4 M, 0,23 мл, 0,90 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 M) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (29 мг, 66%).
МС (ИЭР, пол. ион) m/z: 511,2 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 511,2267 [М+Н]+, (C29H28FN6O2) [M+H]+ теоретическое значение: 511,2258;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,21 (s, 1Н), 8,61 (d, J=8,0 Гц, 1Н), 8,25 (s, 1Н), 7,71 (d, J=6,8 Гц, 2Н), 7,48 - 7,37 (m, 3H), 7,18 (d, J=6,9 Гц, 1Н), 7,04 (d, J=3,3 Гц, 1Н), 6,58 (d, J=2.9 Гц, 1Н), 4,53 (t, J=6,9 Гц, 1Н), 3,49 (s, 3H), 2,66 (d, J=7,1 Гц, 1Н), 1,97 (s, 1H), 1,79-1,66 (m, 4H), 1,49 - 1,29 (m, 6H).
Пример 45:
(+/-)-транс-3-((5-фтор-2-(5-фтор-4-метил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 5-фтор-3-иод-4-метилпиридин-2-амин
[00424] К раствору 5-фтор-4-метилпиридин-2-амина (2,00 г, 15,9 ммоль) в ледяной уксусной кислоте (13 мл) добавляли трифторуксусную кислоту (0,13 мл) и NIS (3,75 г, 16,2 ммоль). Смесь перемешивали при к.т. в течение ночи, затем выливали в ледяную воду (50 мл). рН полученной смеси доводили до рН 9 концентрированным аммиаком, смесь фильтровали. Осадок на фильтре промывали водой и сушили под вакуумом, чтобы получить твердое желтое вещество (2,87 г, 72%).
МС (ИЭР, пол. ион) m/z: 252,9[М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,83 (s, 1H), 4,89 (s, 3H), 2,37 (d, J=2,0 Гц, 2Н).
Стадия 2: 5-фтор-4-метил-3-((триметилсилил)этинил)пиридин-2-амин
[00425] К раствору 5-фтор-3-иод-4-метилпиридин-2-амина (2,88 г, 11,4 ммоль) в смешанном растворителе, содержащем триэтиламин (58 мл) и тетрагидрофуран (11,6 мл) добавляли Pd(PPh3)2Cl2 (810 мг, 1,14 ммоль), иодид меди (435 мг, 2,28 ммоль) и триметилсилилацетилен (3,23 мл, 22,9 ммоль). Смесь перемешивали при к.т. в течение ночи в защитной атмосфере азота и разбавляли насыщенным водным раствором хлорида аммония (100 мл). Полученную смесь экстрагировали этилацетатом (100 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (200 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде темного твердого вещества (1,72 г, 68%).
МС (ИЭР, пол. ион) m/z: 223,1 [М+Н]+;.
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 7,83 (s, 1H), 2,33 (d, J=1,4 Гц, 3Н), 0,30 (s, 9H).
Стадия 3: 5-фтор-4-метил-1H-пирроло[2,3-b]пиридин
[00426] К раствору 5-фтор-4-метил-3-((триметилсилил)этинил)пиридин-2-амина (1,72 г, 7,74 ммоль) в ДМФ (16 мл) добавляли калия трет-бутоксид (2,60 г, 23,2 ммоль), и смесь перемешивали при 80°С в течение 1 ч в защитной атмосфере азота, затем охлаждали до к.т. В реакционную смесь добавляли воду (100 мл), и полученную смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/ЕА (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (550 мг, 47%).
МС (ИЭР, пол. ион) m/z: 151,1 [М+Н]+
1Н ЯМР (600 МГц, CDCl3) δ (ppm): 9,62 (s, 1H), 8.16 (d, J=2,2 Гц, 1H), 7,42 - 7,33 (m, 1H),
6,53 (dd, J=3,1, 2,1 Гц, 1H), 2,53 (d, J=1,0 Гц, 3Н).
Стадия 4: 3-бром-5-фтор-4-метил-1H-пирроло[2,3-b]пиридин
[00427] К раствору 5-фтор-4-метил-1H-пирроло[2,3-b]пиридина (540 мг, 3,60 ммоль) в ДМФ (8 мл) добавляли бром (0,37 мл, 7,19 ммоль). Реакционную смесь перемешивали при к.т. в течение 2 ч. Для того чтобы остановить реакцию, добавляли насыщенный водный раствор Na2S2O3 (50 мл), и полученную смесь экстрагировали EtOAc (50 мл × 3). Объединенные органические фазы промывали насыщенным раствором соли (50 мл × 3), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (760 мг, 92%).
МС (ИЭР, пол. ион) m/z: 231,2 [М+Н]+
1Н ЯМР (400 МГц, DMSO-d6) × (ppm): 12,13 (s, 1H), 8,20 (d, J=1,7 Гц, 1H), 7,72 (d, J=2,6 Гц,1Н), 2,66(s, 3H).
Стадия 5: 3-бром-5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин
[00428] К высушенному тетрагидрофурану (10 мл) добавляли 3-бром-5-фтор-4-метил-1H-пирроло[2,3-b]пиридин (760 мг, 3,32 ммоль). К раствору добавляли натрия гидрид (265 мг, 6,63 ммоль, 60%) добавляли при 0°С, и полученную смесь перемешивали при 0°С в течение 30 мин. Затем к смеси добавляли n-толуолсульфонил хлорид (759 мг, 3,98 ммоль), смесь согревали до к.т. и перемешивали в течение ночи. Для того чтобы остановить реакцию, добавляли воду (100 мл), и полученную смесь экстрагировали EtOAc (100 мл × 3). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (840 мг, 66%).
МС (ИЭР, пол. ион) m/z: 382,9 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,24 (s, 1H), 8,06 (d, J=8,3 Гц, 2Н), 7,81 (s, 1H), 7,31 (d, J=8,2 Гц, 2Н), 2,68 (d, J=1,3 Гц, 3Н), 2,40 (s, 3Н).
Стадия 6:
5-фтор-4-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло [2,3-b]пиридин
[00429] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 3-бром-5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин (400 мг, 1,04 ммоль), бис(пинаколато)дибор (397 мг, 1,56 ммоль), калия ацетат (204 мг, 2,08 ммоль), Pd(dppf)Cl2 (85 мг, 0,10 ммоль) и диметоксиэтан (5 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и смесь перемешивали при 130°С в течение 2 ч при нагревании под воздействием микроволнового излучения. Смесь охлаждали до к.т. и фильтровали через целитовую прокладку. Осадок на фильтре промывали этилацетатом (10 мл), и объединенные фильтраты концентрировали под вакуумом досуха. Полученный остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (352 мг, 78%).
МС (ИЭР, пол. ион) m/z: 431,0 [М+Н]+.
Стадия 7: (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00430] В запаянную трубку вносили 5-фтор-4-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (163 мг, 0,38 ммоль), (+/-)-транс-метил 3-((2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,32 ммоль), карбонат калия (132 мг, 0,96 ммоль), Pd(dppf)Cl2 (52 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и смесь перемешивали при 110°С в течение 3 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (120 мг, 65%).
МС (ИЭР, пол. ион) m/z: 582,1[M+H]+;
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,25 (d, J=9,4 Гц, 2Н), 8,10 (dd, J=11,7, 5,7 Гц, 3Н), 7,30 (s, 1H), 5,19 (d, J=5,5 Гц, 1Н), 4,68 (s, 1H), 3,52 (s, 3Н), 2,62 (d, J=1,9 Гц, 3Н), 2,45 (d, J=5,5 Гц, 1H), 2,39 (s, 3Н), 2,04 (s, 1H), 1,95 (s, 2Н), 1,87 - 1,62 (m, 8H).
Стадия 8:
(+/-)-транс-3-((5-фтор-2-(5-фтор-4-метил-1H-пирроло [2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00431] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-4-метил-1-тозил-1H-пирроло [2,3-b] пиридин-3-ил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоксилата (120 мг, 0,21 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли водный раствор гидроксида натрия (4 M, 0,53 мл, 2,10 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 M) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (32 мг, 38%).
МС (ИЭР, пол. ион) m/z: 414,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 414,1750 [М+Н]+, (C21H22F2N5O2) [М+Н]+ теоретическое значение: 414,1742;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,31 (s, 1H), 12,07 (s, 1H), 8,55 (s, 1H), 8,27 (d, J=2,0 Гц, 1H), 8,10 (s, 2H), 7,60 - 7,38 (m, 4H), 6,76 (s, 1H), 4,64 (s, 1H), 2,53 (d, J=2,5 Гц, 4Н), 1,99 (s, 2H), 1,86 - 1,39 (m, 8H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 175,93, 167,43, 158,37, 158,31, 156,07, 153,72, 151,71, 151,60, 146,15, 138,48, 138,31, 132,21, 132,02, 131,80, 131,45, 131,14, 129,11, 126,98, 126,81, 117,69, 67,90, 50,33, 48,21, 38,59, 30,28, 29,08, 28,83, 28.74, 25,74, 24,27, 23,74, 22,84, 21,48, 19,43, 14,32, 13,61, 13,56, 11,25.
Пример 46:
(+/-)-транс-3-((2-(5-фтор-4-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-(5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00432] В запаянную трубку вносили 5-фтор-4-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (112 мг, 0,26 ммоль), (+/-)-транс-метил3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (80 мг, 0,22 ммоль), карбонат калия (89 мг, 0,65 ммоль), Pd(dppf)Cl2 (35 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и смесь перемешивали при 110°С в течение 3 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (92 мг, 67%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,37 (s, 1H), 8,26 (s, 1H), 8,12 (d, J=8,3 Гц, 2Н), 8,07 (d, J=5,6 Гц, 2Н), 7,54 - 7,46 (m, 3H), 7,30 (s, 1H), 6,83 (s, 1H), 5,29 (s, 1H), 4,46 (s, 1H), 3,69 (s, 3Н), 2,67 (s, 3H), 2,46 (d, J=5,1 Гц, 1H), 2,40 (s, 3H), 2,10 (s, 1H), 1,96-1,94 (m, 1H), 1,71 (m, 8H).
Стадия 2:
(+/-)-транс-3-((2-(5-фтор-4-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00433] К раствору (+/-)-транс-метил3-((2-(5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (92 мг, 0,14 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли водный раствор гидроксида натрия (4 M, 0,33 мл, 1,40 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 M) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (49 мг, 72%).
МС (ИЭР, пол. ион) m/z: 472.5 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 472,2147 [М+Н]+, (C27H27FN5O2) [М+Н]+ теоретическое значение: 472,2149;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,13 (s, 1H), 8,18 (s, 1H), 8,14 (s, 1H), 8,04 (s, 2Н), 7,51 (d, J=7,6 Гц, 4Н), 6,81 (s, 1H), 4,61 (s. 1H), 2,84 (s, 3Н), 1,96 (s, 1H), 1,83-1,39 (m, 10Н).
Пример 47:
(+/-)-транс-3-((2-(5-фтор-4-метил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил3-((2-(5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00434] В запаянную трубку вносили 5-фтор-4-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (91 мг, 0,21 ммоль), (+/-)-транс-метил3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (60 мг, 0,17 ммоль), карбонат калия (71 мг, 0,51 ммоль), Pd(dppf)Cl2 (28 мг, 0,03 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и смесь перемешивали при 110°С в течение 4 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (77 мг, 73%).
1Н ЯМР (400 МГц, CDCl3) δ (ppm): 8,32 (s, 1H), 8,24 (s, 1H), 8,13 (d, J=8,2 Гц, 2Н), 6,96 (d, J=3,4 Гц, 1H), 6,45 (s, 1H), 5,18 (s, 1H), 4,78 (s, 1H), 3,82 (s, 3H), 3,77 (s, 1H), 3,54 (s, 3Н), 2,68 (s, 3Н), 2,47 (d, J=5,1 Гц, 1H), 2,39 (s, 3Н), 2,03 (s, 2Н), 1,90 - 1,62 (m, 8H).
Стадия 2: (+/-)-транс-3-((2-(5-фтор-4-метил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00435] К раствору (+/-)-транс-метил3-((2-(5-фтор-4-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (75 мг, 0,12 ммоль) в THF/MeOH (отношение объемов=1/1, 4 мл) добавляли раствор гидроксида натрия в воде (4 М, 0,30 мл, 1,20 ммоль). Смесь перемешивали при 30°С в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (19 мг, 35%).
МС (ИЭР, пол. ион) m/z: 449,5 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 449,2115 [М+Н]+, (C24H26FN6O2)[M+H]+ теоретическое значение: 449,2101;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,09 (s, 1H), 8,26 - 8,07 (m, 2H), 7,96 (d, J=2,1 Гц, 1Н), 7,78 - 7,59 (m, 1H), 7,50 (d, J=6,8 Гц, 1H), 4,64 (s, 1H), 4,14 (s, 1H), 2,79 (s, 4H), 1,97 (s, 1H), l,63(m, 8H).
Пример 48:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенил пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00436] В реакционную колбу вносили 2,4,6-трихлор-5-фторпиримидин (10,00 г, 49,65 ммоль), карбонат калия (21,00 г, 148,90 ммоль), (+/-)-транс-метл 3-аминобицикло[2,2,2]октан-2-карбоксилат (10,00 г, 54,61 ммоль) и DMF (50 мл). Смесь перемешивали при к.т. в течение 5 ч. После завершения реакции в реакционную смесь добавляли воду (100 мл), и полученную смесь экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (12,00 г, 69%).
МС (ИЭР, пол. ион) m/z: 348,10[M+H]+.
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00437] К ацетонитрилу (100 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (2,00 г, 5,74 ммоль), фенилборную кислоту (0,70 г, 5,74 ммоль), калия ацетат (1,70 г, 17,2 ммоль) и Pd(dppf)Cl2 (0,50 г, 0,57 ммоль), затем к смеси добавляли воду (5 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (430 мг, 19%).
МС (ИЭР, пол. ион) m/z: 390,1 [М+Н]+.
Стадия 3:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00438] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (670 мг, 0,97 ммоль, 60%), карбонат калия (570 мг, 4,10 ммоль), палладия ацетат (23 мг, 0,10 ммоль), X-Phos (100 мг, 0,20 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (400 мг, 1,02 ммоль). Затем к смеси добавляли H2O (1 мл), и смесь нагревали до 110°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (200 мг, 30%).
МС (ИЭР, пол. ион) m/z: 644,3 [М+Н]+.
Стадия 4:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00439] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b] пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,31 ммоль) в смешанном растворителе, содержащем THF (8 мл) и МеОН (4 мл), добавляли раствор NaOH (124 мг, 3,10 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (100 мг, 68%).
МС (ИЭР, пол. ион) m/z: 476,1 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 476,1816 [М+Н]+, (C26H24F2N5O2) [М+Н]+ теоретическое значение: 476,1898;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,52 (s, 1H), 12,26 (s, 1H), 8,68 (d, J=8,0 Гц, 1Н), 8,37 (d, J=7,6 Гц, 3Н), 8,25 (s, 1H), 7,53 (m, 4H), 4,70 (s, 1H), 3,58 (s, 2H), 2,89 (d, J=6,2 Гц, 1H), 2,17 (s, 1H), 2,01 (s, 1H), 1,95 (s, 1H), 1,50 (m, 5H).
Пример 49:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоновая кислота
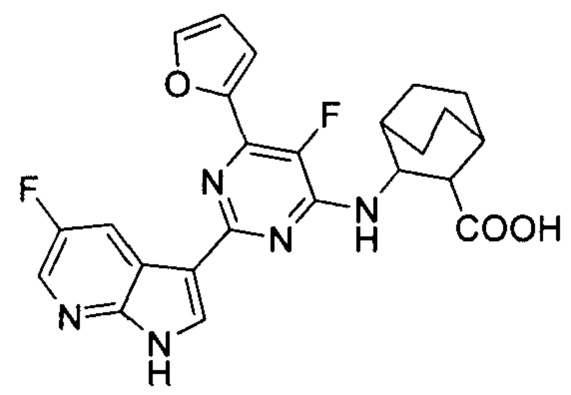
Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00440] К ацетонитрилу (100 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (2,00 г, 5,74 ммоль), 2-фуранборную кислоту (0,65 г, 5,74 ммоль), калия ацетат (1,70 г, 17,2 ммоль) и Pd(dppf)Cl2 (0,50 г, 0,57 ммоль), затем к смеси добавляли воду (5 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (700 мг, 30%).
МС (ИЭР, пол. ион) т/г.380,2[M+H]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00441] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (390 мг, 0,55 ммоль, 60%), карбонат калия (290 мг, 2,10 ммоль), палладия ацетат (11 мг, 0,05 ммоль), X-Phos (50 мг, 0,10 ммоль) и (+/-)-транс-метил3-((2-хлор-5-фтор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (200 мг, 1,02 ммоль). Затем к смеси добавляли H2O (1 мл), и смесь нагревали до 100°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (250 мг, 75%).
МС (ИЭР, пол. ион) m/z: 634,2 [М+Н]+.
Стадия 3:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00442] К раствору (+/-)-транс-метил3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (250 мг, 0,40 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (140 мг, 4,00 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (120 мг, 54%).
МС (ИЭР, пол. ион) m/z: 466,3 [М+Н]+;
МСВР (ИЭР. пол. ион) m/z: 466,1699 [M+H]+, (C24H22F2N5O3S) [М+Н]+ теоретическое значение: 466,1691;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1H), 8,60 (d, J=8,4 Гц, 1Н), 8,27 (d, J=8,8 Гц, 2Н), 8,00 (s, 1H), 7,61 (d, J=5,8 Гц, 1H), 7,24 (s, 1H), 6,75 (s, 1H), 4,71 (s, 1H), 2,88 (d, J=5,5 Гц, 1H), 2,01 (s, 1H), 1,98 (s, 1H), 1,77 (m, 3H), 1,50 (m, 5H);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,04, 157,58, 157,32, 154,93, 152,60, 148,55, 146,40, 145,65, 140,32, 137,72, 137,24, 131,91, 131,62, 131,24, 118,82, 115,48, 114,30, 112.64, 51,14, 48,29, 40,40, 40,20, 39,99, 39,78.
Пример 50:
(+/-)-транс-3-((6-([1,1'-бифенил]-4-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((6-([1,1'-бифенил1-4-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00443] К ацетонитрилу (50 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (1,00 г, 2,87 ммоль), [1,1'-бифенил]-4-ил-борную кислоту (0,57 г, 2,87 ммоль), калия ацетат (0,85 г, 8,62 ммоль) и Pd(dppf)Cl2 (0,25 г, 0,28 ммоль), затем к смеси добавляли воду (2 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (600 мг, 45%).
МС (ИЭР, пол. ион) m/z: 466,0 [М+Н]+.
Стадия 2: (+/-)-транс-метил 3-((6-[1,1'-бифенил]-4-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00444] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (450 мг, 0,64 ммоль, 60%), карбонат калия (355 мг, 2,57 ммоль), палладия ацетат (14 мг, 0,06 ммоль), X-Phos (61 мг, 0,12 ммоль) и (+/-)-транс-метил 3-((6-([1,1'-бифенил]-4-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (300 мг, 0,64 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (300 мг, 65%).
МС (ИЭР, пол. ион) m/z: 720,1 [М+Н]+.
Стадия 3:
(+/-)-транс-3-((6-([1,1'-бифенил]-4-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00445] К раствору (+/-)-транс-метил 3-((6-([1,1'-бифенил]-4-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (300 мг, 0,42 ммоль) в смешанном растворителе, содержащем THF (8 мл) и МеОН (4 мл), добавляли раствор NaOH (184 мг, 4,20 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (103 мг, 45%).
МС (ИЭР, пол. ион) m/z: 552,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 552,2221 [М+Н]+, (C32H28F2N5O2) [М+Н]+ теоретическое значение: 552,2211;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,31 (s, 1H), 8,58 (d, J=7,7 Гц, 1Н), 8,31 (d, J=10,0 Гц, 2Н), 8,18 (d, J=7,9 Гц, 2Н), 7,88 (d, J=8,1 Гц, 2Н), 7,78 (d, J=7,5 Гц, 2Н), 7,65 (d, J=5,9 Гц, 1H), 7,51 (t, J=7,4 Гц, 2Н), 7,41 (t, J=7,1 Гц, 1H), 4,76 (s, 1H), 2,93 (d, J=6,0 Гц, 1H), 2,03 (s, 2Н), 1,90 - 1,74 (m, 3H), 1.52 (m, 5H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,07, 157,52, 157,43, 157,30, 154,91, 152,99, 152,86, 151,95, 146,43, 144,74, 144,68, 142,89, 141,88, 140,31, 139,87, 139,62, 133,69, 133,64, 131,90, 131,61, 131,30, 130,06, 129,60, 129,54, 129,48, 128,35, 127,24, 125,35, 118,86, 118,79, 115,55, 115,33, 114,42, 114,38, 40,44, 40,23, 40,02, 39,81, 39,60, 30,89.
Пример 51: (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00446] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), (1-метил-1H-пиразол-4-ил)борную кислоту (0,18 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (190 мг, 34%).
МС (ИЭР, пол. ион) m/z: 394,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00447] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан2-ил)-1-тозил-1H-пирроло[2,3-b] пиридин (422 мг, 0,61 ммоль, 60%), карбонат калия (280 мг, 2,03 ммоль), палладия ацетат (22 мг, 0,10 ммоль), X-Phos (100 мг, 0,20 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (200 мг, 0,51 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (280 мг, 85%).
МС (ИЭР, пол. ион) m/z: 648,3 [М+H]+.
Стадия 3:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло [2,3-b]пиридин-3-ил)-6-(1-метил-1Н-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00448] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиразол-4-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (280 мг, 0,43 ммоль) в смешанном растворителе, содержащем THF (8 мл) и МеОН (4 мл) добавляли раствор NaOH (172 мг, 4,30 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем добавляли воду (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (180 мг, 87%).
МС (ИЭР, пол. ион) m/z: 480, [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 480,1964 [М+Н]+, (C24H24F2N7O2)[M+H]+ теоретическое значение: 480,1960;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,26 (s, 1H), 8,56 (dd, J=9,6, 2,4 Гц, 1Н), 8,39 (s, 1H), 8,35 - 8,25 (m, 2H), 8,10 (s, 1H), 7,48 (d, J=6,5 Гц, 1H), 4,71 (s, 1H), 3,97 (s, 3Н), 2,89 (d, J=6,5 Гц, 1H), 2,01 (d, J=10,8 Гц, 2H), 1,79 (m, 3Н), 1,56 (m, 4H), 1,19 (s, 2H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,06, 157,51, 154,90, 152,16, 146,40, 140,65, 139,00, 131,99, 131,79, 131,27, 130,04, 125,35, 118,75, 116,78, 115,61, 115,40, 114,45, 51,00, 40,42, 40,21, 40,00, 39,79, 39,58, 28,84.
Пример 52: (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло [2,3-b] пиридин-3-ил)-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
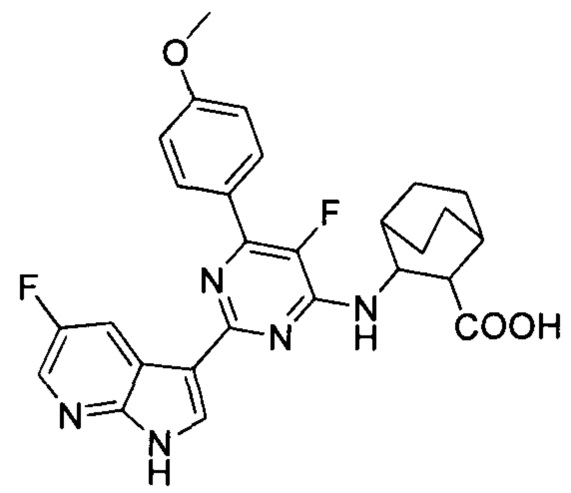
Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00449] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), p-метоксифенилборную кислоту (0,22 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (200 мг, 33%).
МС (ИЭР, пол. ион) m/z: 420,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00450] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (363 мг, 0,52 ммоль, 60%), карбонат калия (263 мг, 1,90 ммоль), палладия ацетат (21 мг, 0,09 ммоль), X-Phos (100 мг, 0,20 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло [2,2,2]октан-2-карбоксилат (200 мг, 0,47 ммоль). Затем H2O (0,5 мл) добавляли к смеси, и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (230 мг, 72%).
МС (ИЭР, пол. ион) m/z: 674,2 [М+Н]+.
Стадия 3: (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метокси фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00451] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-метоксифенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (230 мг, 0,34 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (136 мг, 3,40 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (130 мг, 75%).
МС (ИЭР, пол. ион) m/z: 506,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 506,2014 [М+Н]+, (C27H26F2N5O3)[M+H]+ теоретическое значение: 506,2004;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1H), 8,55 (d, J=8,6 Гц, 1H), 8,30 (s, 2H), 8,07 (d, J=7,8 Гц, 2H), 7,54 (d, J=5,1 Гц, 1H), 7,13 (d, J=8,0 Гц, 2H), 4,73 (s, 1H), 3,85 (s, 3H), 2,90 (d, J=5,0 Гц, 1H), 2,02 (s, 2H), 1,80 (d, J=9,9 Гц, 3H), 1,70 - 1,42 (m, 5H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,06, 161,00, 157,22, 154,89, 152,91, 152,81, 151,92, 146,41, 139,61, 131,84, 131,55, 131,19, 130,56, 130,50, 128,48, 126,89, 125,35, 118,86, 115,53, 114,48, 55,74, 40,42, 40,22, 40,01, 39,80, 39,59, 30,88.
Пример 53:
(+/-)-транс-3-((6-(4-(трет-бутил)фенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((6-(4-(трет-бутил)фенил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00452] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), (4-(трет-бутил)фенил)борную кислоту (0,26 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (180 мг, 28%).
МС (ИЭР, пол. ион) m/z: 446,2 [М+Н]+.
Стадия 2: (+/-)-транс-метил 3-((6-(4-(трет-бутил)фенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00453] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (308 мг, 0,44 ммоль, 60%), карбонат калия (223 мг, 1,61 ммоль), палладия ацетат (18 мг, 0,08 ммоль), X-Phos (76 мг, 0,16 ммоль) и (+/-)-транс-метил 3-((6-(4-(трет-бутил)фенил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (180 мг, 0,40 ммоль). Затем к смеси добавляли H2O (0,5 мл), смесь нагревали до 80°С в защитной атмосфере азота и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (110 мг, 39%).
Стадия 3:
(+/-)-транс-3-((6-(4-(трет-бутил)фенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00454] К раствору (+/-)-транс-метил 3-((6-(4-трет-бутил)фенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (110 мг, 0,16 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (62 мг, 1,60 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (51 мг, 61%).
МС (ИЭР, пол. ион) m/z: 532,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 532,2523 [М+Н]+, (C30H32F2N5O2) [М+Н]+ теоретическое значение: 532,2524;
1Н ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,52 (s, 1H), 12,27 (s, 1H), 8,70 (dd, J=9,7, 2,5 Гц, 1H), 8,37 (s, 1H), 8,29 (d, J=8,2 Гц, 2Н), 8,24 (s, 1H), 7,58 (d, J=8,3 Гц, 2Н), 7,54 (d, J=6,6 Гц, 1H), 4,69 (t, J=6,6 Гц, 1H), 2,88 (d, J=6,9 Гц, 1H), 2,01 (s, 1H), 1,95 (s, 1H), 1,84 - 1,72 (m, 3Н), 1,64 - 1,40 (т, 5Н), 1,34 (s, 9H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,11, 158,23, 155,11, 153,03, 151,94, 145,84, 139,65, 135,85, 133,10, 132,59, 132,40, 132,14, 132,03, 128,49, 127,75, 125,81, 125,37, 118,81, 116,27, 108,31, 50,90, 48,00, 40,24, 40,10, 39,96, 39,82, 39,68, 34,84, 31,52, 30,88.
Пример 54: (+/-)-транс-3-((6-(беизофуран-2-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00455] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), бензофуран-2-ил-борную кислоту (0,23 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (230 мг, 37%).
МС (ИЭР, пол. ион) m/z: 430,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((6-(бензофуран-2-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00456] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (445 мг, 0,64 ммоль, 60%), карбонат калия (300 мг, 2,14 ммоль), палладия ацетат (24 мг, 0,10 ммоль), X-Phos (102 мг, 0,20 ммоль) и (+/-)-транс-метил 3-((6-(бензофуран-2-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилат (230 мг, 0,54 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 110°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом для удаления растворителя, остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (180 мг, 49%).
Стадия 3:
(+/-)-транс-3-((6-(бензофуран-2-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00457] К раствору (+/-)-транс-метил 3-((6-(бензофуран-2-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (180 мг, 0,26 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (105 мг, 2,63 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (91 мг, 67%).
МС (ИЭР, пол. ион) m/z: 516,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 516,1845 [М+Н]+, (C28H24F2N5O3)[M+H]+ теоретическое значение: 516,1847;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm):12,35 (s, 1H), 8,62 (dd, J=9,7, 2,5 Гц, 1Н), 8,38 - 8,29 (m, 2Н), 7,84 (d, J=7,7 Гц, 1H), 7,80 (d, J=6,5 Гц, 1H), 7,78 - 7,72 (m, 2Н), 7,47 (t, J=7,6 Гц, 1H), 7,36 (t, J=7,4 Гц, 1H), 4,74 (s, 1H). 2,92 (d, J=6,4 Гц, 1H), 2,06 - 1,98 (m, 2Н), 1,80 (m, 3Н), 1,64-1,36(m,5Н);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,04, 155,35, 155,09, 152,73, 151,93, 150,50, 146,40, 139,64, 131,50, 128,49, 128,24, 126,63, 125,37, 124,03, 122,68, 118,85, 118,80, 115,64, 115,50, 112,08, 110,33, 110,27, 40,24, 40,10, 39,96, 39,82, 39,68, 30,87.
Пример 55: (+/-)-транс-3-((6-(бензо[b]тиофен-2-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00458] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), бензо[b]тиофен-2-ил-борную кислоту (0,25 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (300 мг, 47%).
МС (ИЭР, пол. ион) m/z: 446,0 [М+Н]+.
Стадия 2: (+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00459] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (513 мг, 0,74 ммоль, 60%), карбонат калия (371 мг, 2,69 ммоль), палладия ацетат (30 мг, 0,13 ммоль), X-Phos (128 мг, 0,26 ммоль) и (+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (300 мг, 0,67 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (200 мг, 42%).
Стадия 3:
(+/-)-транс-3-((6-(бензо[b]тиофен-2-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00460] К раствору (+/-)-транс-метил 3-((6-(бензо[b]тиофен-2-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,28 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (114 мг, 2,80 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (91 мг, 60%).
МС (ИЭР, пол. ион) m/z: 532,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 532,1608[М+H]+, (C28H24F2N5O2S)[M+H]+ теоретическое значение: 532,1619;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,34 (s, 1Н), 8,63 (dd, J=9,6, 2,4 Гц, 1Н), 8,32 (s, 1H), 8,27 (d. J=2,4 Гц, 1Н), 8,17 (s, 1Н), 8,13 - 8,08 (m, 1Н), 8,05 - 8,00 (m, 1Н), 7,77 (d, J=6,4 Гц, 1Н), 7,49 - 7,43 (т, 2Н), 4,72 (s, 1Н), 2,90 (d, J=6,4 Гц, 1Н), 2,02 (d, J=9,4 Гц, 2Н), 1,87-1,75 (m, 3Н), 1,65 - 1,42 (m, 5Н);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,07, 155,37, 151,94, 146,43, 140,73, 139,65, 131,47, 128,50, 126,35, 125,37, 125,27, 123,00, 119,13, 118,75, 118,72, 118,70, 115,54, 115,47, 115,40, 114,32, 113,87, 113,84, 40,25, 40,11, 39,97, 39,83, 39,69, 30,88.
Пример 56: (+/-)-транс-3-((6-(4-цианофенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (+/-)-транс-метил 3-((2-хлор-6-(4-цианофенил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00461] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), (4-цианофенил)борную кислоту (0,22 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (250 мг, 42%).
МС (ИЭР, пол. ион) m/z: 415,1 [М+H]+.
Стадия 2: (+/-)-транс-метил 3-((6-(4-цианофенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00462] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (460 мг, 0,66 ммоль, 60%), карбонат калия (333 мг, 2,41 ммоль), палладия ацетат (27 мг, 0,12 ммоль), X-Phos (114 мг, 0,24 ммоль) и (+/-)-транс-метил 3-((2-хлор-6-(4-цианофенил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилат (250 мг, 0,60 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (250 мг, 62%).
Стадия 3:
(+/-)-транс-3-((6-(4-цианофенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00463] К раствору (+/-)-транс-метил 3-((6-(4-цианофенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (250 мг, 0,37 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (149 мг, 3,70 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (120 мг, 64%).
МС (ИЭР, пол. ион) m/z: 501,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 501,1846 [М+Н]+, (C27H23F2N6O2)[M+H]+ теоретическое значение: 501,1851;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,31 (s, 1H), 8,50 (dd, J=9,5, 2,2 Гц, 1Н), 8,32 (d, J=2,2 Гц, 1H), 8,28 (s, 1H), 8,23 (d, J=8,l Гц, 2H), 8,02 (d, J=8,2 Гц, 2H), 7,76 (d, J=6,2 Гц, 1H), 4,75 (s, 1H), 2,92 (d, J=6,2 Гц, 1H), 2,02 (d, J=ll,4 Гц, 2H), 1,80 (m, 3Н), 1,69 - 1,40 (m, 5Н);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,05, 157,69, 157,64, 156,89, 155,29, 153,00, 152,92, 151,93, 146,38, 140,98, 139,64, 139,06, 139,03, 132,96, 131,72, 131,55, 129,83, 129,79, 128,49, 125,37, 119,09, 112,65, 40,24, 40,10, 39,96, 39,82, 39,68, 30,87.
Пример 57: (+/-)-транс-3-((6-(3,4-дифторфенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-6-(3,4-дифторфенил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00464] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), (3,4-дифторфенил)борную кислоту (0,23 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (290 мг, 47%).
МС (ИЭР, пол. ион) m/z: 426,1 [М+Н]+.
Стадия 2: (+/-)-транс-метил 3-((6-(3,4-дифторфенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00465] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (520 мг, 0,74 ммоль, 60%), карбонат калия (376 мг, 2,72 ммоль), палладия ацетат (30 мг, 0,14 ммоль), X-Phos (130 мг, 0,28 ммоль) и (+/-)-транс-метил 3-((2-хлор-6-(3,4-дифторфенил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (290 мг, 0,68 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (240 мг, 52%).
МС (ИЭР, пол. ион) m/z: 680,1 [М+Н]+.
Стадия 3:
(+/-)-транс-3-((6-(3,4-дифторфенил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00466] К раствору (+/-)-транс-метил 3-((6-(3,4-дифторфенил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (240 мг, 0,35 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (141 мг, 3,40 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (97 мг, 54%).
МС (ИЭР, пол. ион) m/z: 512,2[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 512,1699 [М+Н]+, (C26H22F4N5O2)[M+H]+ теоретическое значение: 512,1710;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm):12,30 (s, 1H), 8,51 (dd, J=9,7, 2,5 Гц, 1Н), 8,36 (d, J=2,6 Гц, 1H), 8,28 (s, 1H), 8,10 (dd, J=10,1, 8,5 Гц, 1H), 7,93 (s, 1H), 7,70 (d, J=6,5 Гц, 1Н), 7,62 (d, J=8,7 Гц, 1H), 4,74 (t, J=6,1 Гц, 1H), 2,92 (d, J=6,6 Гц, 1H), 2,02 (d,.7=12,5 Гц, 2Н), 1,87 - 1,73 (m, 3H), 1,69 - 1,40 (m, 5H);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,04, 158,28, 157,52, 157,46, 157,03, 156,88, 155,29, 152,99, 152,90, 151,93, 146,39, 140,60, 139,64, 131,63, 128,49, 126,29, 125,36, 118,72, 118,29, 118,17, 114,11, 40,23, 40,09, 39,95, 39,81, 39,68, 30,86.
Пример 58:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло [2,2,2]октан-2-карбоксилат
[00467] К ацетонитрилу добавляли (+/-)-транс-метил-3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), фуран-3-ил-борную кислоту (0,16 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (140 мг, 30%).
МС (ИЭР, пол. ион) m/z: 380,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00468] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (442 мг, 0,63 ммоль, 60%), карбонат калия (203 мг, 1,46 ммоль), палладия ацетат (16 мг, 0,07 ммоль), X-Phos (70 мг, 0,14 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилат (140 мг, 0,36 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (198 мг, 85%).
МС (ИЭР, пол. ион) m/z: 634,2 [М+Н]+.
Стадия 3:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00469] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (198 мг, 0,31 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (125 мг, 3,10 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (130 мг, 89%).
МС (ИЭР, пол. ион) m/z: 466,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 466,1689 [М+Н]+, (C24H22F2N5O3)[M+H]+ теоретическое значение: 466,1691;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1H), 8,54 (dd, J=9,6, 2,1 Гц, 1Н), 8,40 (s, 1H), 8,33 (d, J=2,2 Гц, 1H), 8,29 (s, 1H), 7,89 (s, 1H), 7,57 (d, J=6,4 Гц, 1H), 7,16 (s, 1H), 4,72 (s, 1H), 2,89 (d, J=6,4 Гц, 1H), 2,00 (d, J=12,4 Гц, 2Н), 1,79 (m, 3H), 1,51 (m, 5H);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,07, 157,61, 156,88, 155,29, 152,23, 151,93, 146,39, 144,92, 144,61, 139,64, 131,47, 128,50, 125,37, 121,30, 118,72, 115,52, 114,24, 109,92, 55,36, 51,03, 48,15, 34,83, 30,87, 28,81.
Пример 59; (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
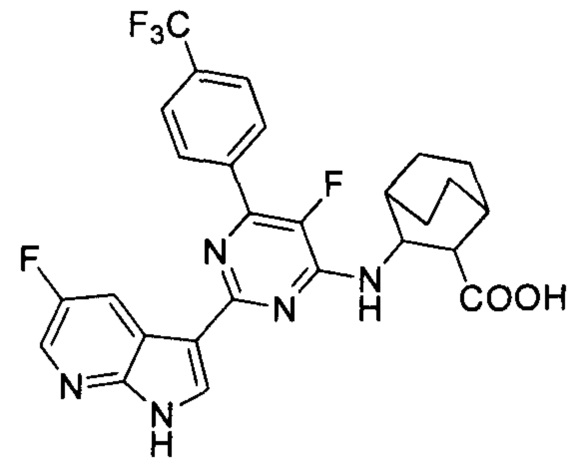
Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00470] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), (4-(трифторметил)фенил)борную кислоту (0,27 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (230 мг, 45%).
МС (ИЭР, пол. ион) m/z: 458,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00471] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (383 мг, 0,55 ммоль, 60%), карбонат калия (277 мг, 2,01 ммоль), палладия ацетат (22 мг, 0,10 ммоль), X-Phos (95 мг, 0,20 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (230 мг, 0,50 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (180 мг, 50%).
Стадия 3:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00472] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-(трифторметил)фенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (180 мг, 0,25 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (101 мг, 2,50 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (90 мг, 65%).
МС (ИЭР, пол. ион) m/z: 544,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 544,1770 [М+H]+, (C26H24F2N5O2)[M+H]+ теоретическое значение: 544,1772;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,54 (s, 1H), 8,60 (d, J=8,0 Гц, 1Н), 8,51 (d, J=7,9 Гц, 2Н), 8,35 (s, 1H), 8,24 (s, 1H), 7,91 (d, J=8,0 Гц, 2Н), 7,66 (d, J=6,1 Гц, 1H), 4,68 (s, 1H), 2,87 (d, J=6,2 Гц, 1H), 2,00 (s, 1H), 1,93 (s, 1H), 1,76 (m, 3Н), 1,49 (m, 5H);
13С ЯМР (151 МГц, DMSO-d6) δ (ppm): 176,12, 156,79, 155,12, 152,12, 145,84, 143,49, 142,22, 142,02, 140,30, 132,67, 132,47, 132,37, 132,27, 130,27, 126,04, 125,88, 124,21, 118,69, 116,05, 108,45, 51,04, 48,07, 28,81, 25,82, 24,30, 21,58.
Пример 60:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(n-толил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоновая кислота
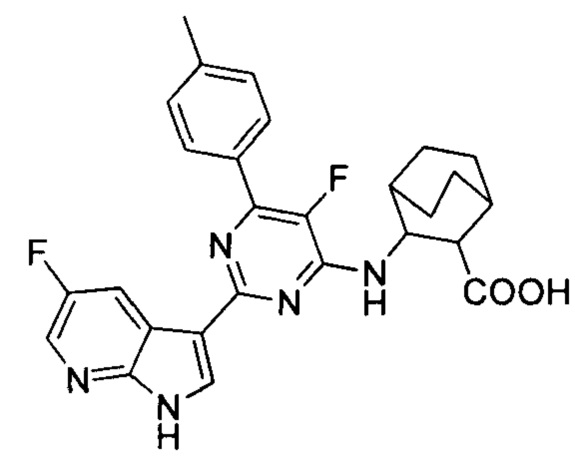
Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(n-толил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00473] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил-3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,50 г, 1,44 ммоль), n-метилфенилборную кислоту (0,20 г, 1,44 ммоль), калия ацетат (0,42 г, 4,31 ммоль) и Pd(dppf)Cl2 (0,13 г, 0,14 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (300 мг, 52%).
МС (ИЭР, пол. ион) m/z: 404,2 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(n-толил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00474] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (550 мг, 0,81 ммоль, 60%), карбонат калия (410 мг, 2,97 ммоль), палладия ацетат (33 мг, 0,14 ммоль), X-Phos (141 мг, 0,28 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(n-толил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (300 мг, 0,74 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (300 мг, 61%).
МС (ИЭР, пол. ион) m/z: 658,1 [M+H]+.
Стадия 3:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(n-толил)пиримидин -4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00475] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(n-толил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (300 мг, 0,45 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (182 мг, 4,50 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (140 мг, 63%).
МС (ИЭР, пол. ион) m/z: 490,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 490,2053 [М+Н]+, (C27H26F2N5O2)[M+H]+ теоретическое значение: 490,2055;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,27 (s, 1H), 8,56 (d, J=8,6 Гц, 1H), 8,29 (s, 2H), 7,97 (d, J=7,4 Гц, 2H), 7,56 (d, J=5,6 Гц, 1H), 7,36 (d, J=7,6 Гц, 2H), 4,74 (s, 1H), 2,91 (d, J=5,6 Гц, 1H), 2,00 (d, J=15,6 Гц, 2H), 1,88 - 1,73 (m, 3H), 1,53 (m, 5H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,06, 157,33, 154,90, 152,94, 151,93, 146,42, 145,13, 142,66, 139,98, 139,59, 131,84, 131,19, 129,59, 128,92, 128,86, 125,34, 118,88, 118,81, 115,56, 115,34, 114,42, 51,17, 48,26, 34,80, 30,86, 28,84, 21,39, 19,50.
Пример 61: (R)-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота

Стадия 1: (R)-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)-4,4-диметилпентаноат
[00476] В реакционную колбу вносили 2,4,6-трихлор-5-фторпиримидин (0,64 г, 3,16 ммоль), DIPEA (1,02 г, 7,91 ммоль), (R)-метил 3-амино-4,4-диметилпентаноат (0,42 г, 2,63 ммоль) и дихлорметан (10 мл). Смесь перемешивали при к.т. в течение 24 ч. После завершения реакции к смеси добавляли воду (20 мл). Полученную смесь экстрагировали DCM (20 мл). Органический слой промывали насыщенным раствором соли (10 мл), сушили над безводным Na2SO4 и концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем в условиях элюции PE/EtOAc (отношение объемов=20/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (420 мг, 49%).
МС (ИЭР, пол. ион) m/z: 324,10 [М+Н]+.
Стадия 2: (R)-метил 3-((2-хлор-5-фтор-6-(фуран-2-ил)пиримидин-4-ил)амино)4,4-диметил пентаноат
[00477] К ацетонитрилу (25 мл) добавляли (R)-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)-4,4-диметилпентаноат (420 мг, 1,29 ммоль), фуран-2-ил-борную кислоту (145 мг, 1,29 ммоль), калия ацетат (381 мг, 3,88 ммоль) и Pd(dppf)Cl2 (105 мг, 0,13 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (180 мг, 39%).
МС (ИЭР, пол. ион) m/z: 356,2 [М+H]+.
Стадия 3:
(R)-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00478] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (386 мг, 0,56 ммоль, 60%), карбонат калия (280 мг, 2,02 ммоль), палладия ацетат (22 мг, 0,10 ммоль), X-Phos (100 мг, 0,20 ммоль) и (R)-метил 3-((2-хлор-5-фтор-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноат (180 мг, 0,50 ммоль). Затем к смеси добавляли H2O (1 мл), и смесь нагревали до 100°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (230 мг, 74%).
МС (ИЭР, пол. ион) m/z: 610,2 [М+Н]+.
Стадия 4:
(R)-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
[00479] К раствору (R)-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноата (230 мг, 0,37 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (150 мг, 3,70 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (20 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (110 мг, 66%).
МС (ИЭР, пол. ион) m/z: 442,3 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 442,1687 [М+Н]+, (C22H22F2N5O3)[M+H]+ теоретическое значение: 442,1691;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,26 (s, 1Н), 12,05 (s, 1H), 8,65 (d, J=8,0 Гц, 1Н), 8,29 (s, 1Н), 8,25 (s, 1Н), 8,02 (s, 1Н), 7,45 (d, J=8,7 Гц, 1Н), 7,25 (s, 1Н), 6,77 (s, 1Н), 4,84 (t, J=8,4 Гц, 1Н), 2,73 - 2,56 (m, 2H), 0,99 (s, 9H).
Пример 62: (+/-)-транс-3-((6-(дибензо[b,d]фуран-4-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-6-(дибензо[b,d]фуран-4-ил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00480] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,40 г, 1,15 ммоль), дибензо[b,d]фуран-4-ил-борную кислоту (0,244 г, 1,15 ммоль), калия ацетат (0,33 г, 3,45 ммоль) и Pd(dppf)Cl2 (0,09 г, 0,11 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (170 мг, 31%).
МС (ИЭР, пол. ион) m/z: 480,1 [М+Н]+.
Стадия 2: (+/-)-транс-метил 3-((6-(дибензо[b,d]фуран-4-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00481] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (286 мг, 0,41 ммоль, 60%), карбонат калия (207 мг, 1,50 ммоль), палладия ацетат (16 мг, 0,07 ммоль), X-Phos (71 мг, 0,14 ммоль) и (+/-)-транс-метил 3-((2-хлор-6-(дибензо[b,d]фуран-4-ил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (180 мг, 0,37 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (200 мг, 73%).
МС (ИЭР, пол. ион) m/z: 734,1[M+H]+.
Стадия 3: (+/-)-транс-3-((6-(дибензо[b,d]фуран-4-ил)-5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00482] К раствору (+/-)-транс-метил 3-((6-(дибензо[b,d]фуран-4-ил)-5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,27 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (109 мг, 2,72 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (130 мг, 84%).
МС (ИЭР, пол. ион) m/z: 566,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 566,1982 [М+Н]+, (C32H26F2N5O3) [М+Н]+ теоретическое значение: 566,2004;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,30 (s, 1H), 8,61 (d, J=8,3 Гц, 1Н), 8,29 (s, 3H), 8,22 (d, J=6,5 Гц, 1H), 7,91 (d, J=6,3 Гц, 1H), 7,80 (s, 1H), 7,75 (d, J=7,4 Гц, 1H), 7,64 - 7,51 (m, 2H), 7,44 (s, 1H), 4,80 (s, 1H), 2,93 (s, 1H), 2,06 (s, 2H), 1,65 (m, 8H);
13С ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,08, 157,96, 157,88, 156,03, 154,95, 153,30, 152,53, 152,41, 151,93, 146,43, 143,29, 143,18, 140,09, 139,61, 131,96, 131,67, 131,26, 128,61, 128,48, 128,43, 125,35, 124,73, 123,76, 122,95, 121,77, 119,62, 118,95, 118,87, 115,68, 115,46, 114,33, 112,13, 51,22, 48,25, 34,80, 30,87, 28,83, 28,75, 22,30, 22,04.
Пример 63:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилэтинил)пиримидин-4-ил)амино)бицикло [2,2,2] октан-2-карбоновая кислота
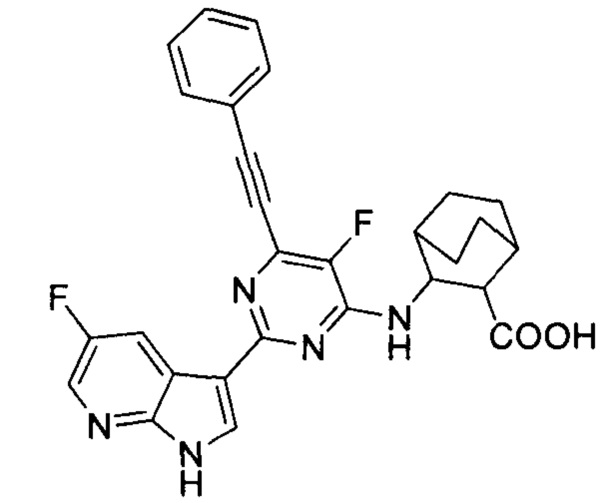
Стадия 1: 2,4-дихлор-5-фтор-6-(фенилэтинил)пиримидин
[00483] К THF (20 мл) добавляли 2,4,6-трихлор-5-фторпиримидин (1,00 г, 4,96 ммоль), иодид меди (0,19 г, 9,92 ммоль), бис(трифенилфосфин)палладий(II) хлорид (0,35 г, 0,49 ммоль) и триэтиламин (1,51 г, 14,9 ммоль). Затем к смеси медленно, по каплям добавляли фенилацетилен (0,48 г, 4,70 ммоль) в защитной атмосфере азота, и смесь перемешивали при к.т. в течение 4 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (550 мг, 42%).
МС (ИЭР, пол. ион) m/z: 266,9 [М+H]+.
Стадия 2: (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00484] В реакционную колбу вносили 2,4-дихлор-5-фтор-6-(фенилэтинил)пиримидин (0,55 г, 2,05 ммоль), DIPEA (0,53 г, 4,11 ммоль), (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (0,46 г, 2,47 ммоль) и DCM (10 мл). Смесь перемешивали при к.т. в течение 18 ч. После завершения реакции в реакционную смесь добавляли воду (20 мл), и полученную смесь экстрагировали DCM (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (10 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (0,58 г, 68%).
МС (ИЭР, пол. ион) m/z: 414,3[M+H]+.
Стадия 3:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00485] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (400 мг, 0,58 ммоль, 60%), карбонат калия (267 мг, 1,93 ммоль), палладия ацетат (21 мг, 0,09 ммоль), X-Phos (92 мг, 0,18 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (200 мг, 0,48 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (162 мг, 50%).
Стадия 4:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00486] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фенилэтинил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (162 мг, 0,24 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (97 мг, 2,40 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (99 мг, 82%).
МС (ИЭР, пол. ион) m/z: 500,1 [М+Н]+;
МСВР (ИЭР, пол. ион) m/z: 500,1892 [М+Н]+, (C28H24F2N5O2)[M+H]+ теоретическое значение: 500,1898;
1Н ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,32 (s, 1H), 8,51 (dd, J=9,6, 2,2 Гц, 1Н), 8,31 - 8,25 (m, 2Н), 7,80 (d, J=6,6 Гц, 1H), 7,70 - 7,64 (m, 2Н), 7,50 (d, J=6,7 Гц, 3Н), 4,74 (s, 1H), 2,90 (d, J=6,4 Гц, 1H), 2,03 (s, 1H), 1,98 (s, 1H), 1,80 (m, 3Н), 1,69-1,41 (m, 5Н).
Пример 64: (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-5-фтор-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)мин.о)бицикло[2,2,2]октан-2-карбоксилат
[00487] К ацетонитрилу (25 мл) добавляли (+/-)-транс-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (0,40 г, 1,14 ммоль), (1-метил-1H-пиррол-3-ил)борную кислоту (0,23 г, 1,14 ммоль), калия ацетат (0,34 г, 3,46 ммоль) и Pd(dppf)Cl2 (0,09 г, 0,11 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°С в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (РЕ/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (150 мг, 33%).
МС (ИЭР, пол. ион) m/z: 393,1 [М+Н]+.
Стадия 2:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00488] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (423 мг, 0,46 ммоль, 45%), карбонат калия (211 мг, 1,52 ммоль), палладия ацетат (17 мг, 0,07 ммоль), X-Phos (72 мг, 0,14 ммоль) и (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (150 мг, 0,38 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (230 мг, 93%).
МС (ИЭР, пол. ион) m/z: 647,1 [М+Н]+.
Стадия 3: (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил1Н-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00489] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(1-метил-1H-пиррол-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (230 мг, 0,35 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор гидроксида натрия (142 мг, 3,55 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до рН ≈ 3-4. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (120 мг, 71%).
МС (ИЭР, пол. ион) m/z: 479,l[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 479,2024 [М+Н]+, (C26H24F2N5O2)[M+H]+ теоретическое значение: 479,2007;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,21 (s, 1H), 8,58 (d, J=8,8 Гц, 1H), 8,27 (s, 2H), 7,52 (s, 1H), 7,28 (d, J=4,1 Гц, 1H), 6,87 (s, 2H), 4,69 (s, 1H), 3,74 (s, 3H), 2,87 (d, J=3,9 Гц, 1H), 2,00 (s, 2H), 1,80 (m, 3H), 1,67-1,45 (m, 5H).
Пример 65: (+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
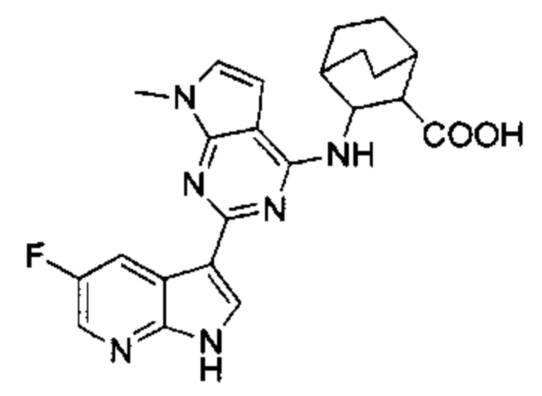
Стадия 1:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00490] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (347 мг, 0,50 ммоль, 60%), (+/-)-транс-метил 3-((2-хлор-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (146 мг, 0,41 ммоль), карбонат калия (114 мг, 0,82 ммоль), Pd(dppf)Cl2 (30 мг, 0,04 ммоль), 1,4-диоксан (5 мл) и воду (0,5 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, затем смесь в пробирке для проведения реакций под воздействием микроволнового излучения перемешивали при 110°C при нагревании под воздействием микроволнового излучения в течение 2 часов. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (214 мг, 56%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,75 (dd, J=9,0, 2,8 Гц, 1H), 8,67 (s, 1H), 8,31 (d, J=1,8 Гц, 1H), 8,13 (d, J=8,3 Гц, 2H), 7,27 (d, J=6,1 Гц, 2H), 6,92 (d, J=3,4 Гц, 1H), 6,38 (d, J=3,3 Гц, 1H), 5,13 (d, J=6,9 Гц, 1H), 4,90 (d, J=5,9 Гц, 1H), 3,86 (s, 3H), 3,75 (s, 3H), 2,48 (d, J=5,6 Гц, 1H), 2,37 (s, 3H), 2,07 (d, J=2,0 Гц, 2H), 2,01 (s, 1H), 1,94 (m, 1H), 1,79 (m, 8H).
Стадия 2:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00491] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (197 мг, 0,33 ммоль) в смешанном растворителе, содержащем THF и MeOH (отношение объемов=1/1, 6 мл), добавляли а водный раствор гидроксида натрия (4 М, 0,90 мл, 3,60 ммоль). Смесь перемешивали при 30°C в течение ночи. В реакционную смесь добавляли воду (10 мл), и полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 5,5. Смесь экстрагировали этилацетатом (20 мл × 3), и объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, затем фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (80 мг, 56%).
МС (ИЭР, пол. ион) m/z: 435,2[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 435,1941 [M+H]+, (C23H24FN6O2)[M+H]+ теоретическое значение: 435,1945;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1H), 12,09 (s, 1H), 8,73 (d, J=8,5 Гц, 1H), 8,27 (s, 1H), 8,24 (s, 1H), 7,22 (d, J=5,7 Гц, 1H), 7,08 (s, 1H), 6,62 (s, 1H), 4,80 (s, 1H), 3,78 (s, 3H), 2,72 (d, J=5,7 Гц, 1H), 2,03 (d, J=15,2 Гц, 2Н), 1,80 (m, 3H), 1,49 (m, 5Н);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,22, 157,13, 156,03, 154,75, 150,65, 146,43, 131,51, 131,22, 130,00, 124,76, 119,07, 118,99, 116,07, 115,99, 115,95, 115,86, 101,15, 98,95, 50,63, 49,11, 31,05, 28,98, 28,87, 26,09, 24,23, 21,59, 19,52.
Пример 66: (+/-)-транс-3-((5-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)тиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
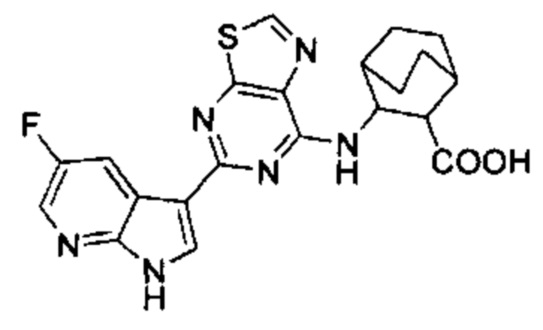
Стадия 1:
(+/-)-транс-метил3-((5-хлортиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00492] (+/-)-транс-Метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (284 мг, 1,55 ммоль) и 5,7-дихлортиазоло[5,4-d]пиримидин (352 мг, 1,71 ммоль) растворяли в ДМФ (5 мл), затем добавляли карбонат калия (428 мг, 3,10 ммоль). Смесь перемешивали при к.т. в течение ночи. Реакцию останавливали, и в реакционную смесь добавляли воду (50 мл). Полученную смесь экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (317 мг, 58%).
МС (ИЭР, пол. ион) m/z: 353,0 [M+H]+;
1H ЯМР (600 МГц, CDCl3) δ (ppm): 8,75 (s, 1H), 6,49 (d, J=4,7 Гц, 1H), 4,63 (s, 1H), 3,76 (s, 3H), 2,50 (d, J=5,6 Гц, 1H), 2,01 (d, J=1,8 Гц, 1H), 1,95 (d, J=2,5 Гц, 1H), 1,88-1,76 (m, 2Н), 1,73-1,53 (m, 6Н).
Стадия 2:
(+/-)-транс-метил 3-((5-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)тиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00493] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (180 мг, 0,21 ммоль, 50%), K2CO3 (39 мг, 0,28 ммоль), PdCl2(dppf) (8 мг, 0,01 ммоль) и (+/-)-транс-метил 3-((5-хлортиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (51 мг, 0,14 ммоль). Затем H2O (1 мл) добавляли к смеси, и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 2 ч при 110°C при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (61 мг, 70%).
Стадия 3:
(+/-)-транс-3-((5-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)тиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00494] К смеси растворителей THF и MeOH (отношение объемов=2 мл/2 мл) добавляли (+/-)-транс-метил 3-((5-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)тиазоло[5,4-d]пиримидин-7-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (61 мг, 0,10 ммоль), затем добавляли раствор NaOH (40 мг, 1,00 ммоль) в воде (1 мл). Полученную смесь перемешивали в течение ночи при к.т., затем добавляли воду (10 мл). Смесь подкисляли соляной кислотой (1 М) до pH ≈ 6, затем экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (16 мг, 36%).
МС (ИЭР, пол. ион) m/z: 439,1 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 439,1329, (C21H20FN6O2S)[M+H]+ теоретическое значение: 439,1352;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,38 (s, 1H), 9,13 (s, 1H), 8,63 (d, J=9,4 Гц, 1H), 8,35 (s, 1H), 8,29 (s, 1H), 8,21 (d, J=6,5 Гц, 1H), 4,89 (s, 1H), 3,03 (d, J=5,4 Гц, 1H), 2,03 (s, 2H), 1,83 (m, 3H), 1,70-1,43 (m, 5H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 162,39, 159,26, 155,57, 155,35, 150,28, 146,39, 132,01, 131,87, 131,82, 128,61, 118,97, 118,92, 115,79, 115,65, 114,35, 114,32, 51,02, 47,92, 28,90, 28,77, 25,62, 24,34, 21,64, 19,59.
Пример 67:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
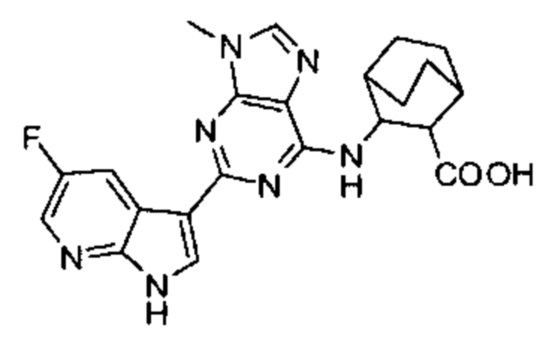
Стадия 1:
(+/-)-транс-метил 3-((2-хлор-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00495] (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилат (400 мг, 2,18 ммоль) и 2,6-дихлор-9-метил-9H-пурин (400 мг, 1,97 ммоль) растворяли в ацетонитриле (8 мл), затем добавляли DIPEA (1,75 мл, 9,95 ммоль). Смесь перемешивали при 50°C в течение ночи в защитной атмосфере азота. В реакционную смесь добавляли воду (50 мл), и полученную разделяли на фракции. Водный слой экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промывали насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=3/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (457 мг, 66%).
МС (ИЭР, пол. ион) m/z: 350,1 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,66 (s, 1H), 6,37 (s, 1H), 4,55 (s, 1H), 3,74 (s, 3H), 3,72 (s, 3H), 3,21 (s, 1H), 2,43 (s, 1H), 1,94 (s, 1H), 1,88 (d, J=2,5 Гц, 1H), 1,78 (d, J=10,6 Гц, 2H), 1,66-1,44 (m, 5H).
Стадия 2:
(+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00496] К 1,4-диоксану (8 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (540 мг, 0,52 ммоль, 40%), K2CO3 (119 мг, 0,86 ммоль), PdCl2(dppf) (29 мг, 0,04 ммоль) и (+/-)-транс-метил 3-((2-хлор-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (151 мг, 0,43 ммоль). Затем к смеси добавляли H2O (1 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 2 ч при 110°C при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 2/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (166 мг, 64%).
Стадия 3:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00497] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-9-метил-9H-пурин-6-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (166 мг, 0,28 ммоль) в THF/MeOH (отношение объемов=3 мл/3 мл) добавляли раствор NaOH (112 мг, 2,8 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем подкисляли соляной кислотой (1 М) до pH ≈ 6. Полученную смесь экстрагировали этил ацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (71 мг, 59%).
МС (ИЭР, пол. ион) m/z: 436,1 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 436,1874, (C22H23FN7O2)[M+H]+ теоретическое значение: 436,1897;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,26 (s, 2Н), 8,70 (s, 1H), 8,25 (d, J=10,4 Гц, 2Н), 8,06 (s, 1H), 7,67 (s, 1H), 4,83 (s, 1H), 3,79 (s, 3H), 2,95 (s, 1H), 2,00 (s, 2Н), 1,84-1,74 (m, 3H), 1,50 (m, 5Н);
13C ЯМР (101 МГц, DMSO-d6) δ (ppm): 176,19, 157,22, 157,08, 154,84, 146,36, 141,10, 131,67, 131,38, 130,58, 119,01, 118,93, 115,33, 110,00, 61,82, 50,56, 48,35, 29,69, 28,89, 25,80, 24,28, 21,63, 19,50.
Пример 68:
(+/-)-транс-3-((6-циклопропил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((2-хлор-6-циклопропилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00498] К раствору (+/-)-транс-метил 3-((2,6-дихлорпиримидин-4-ил)амино)бицикло[2,2,2] октан-2-карбоксилата (100 мг, 0,30 ммоль) в тетрагидрофуране (5 мл) добавляли Pd(dppf)Cl2 (25 мг, 0,03 ммоль), калия фосфат (160 мг, 0,75 ммоль) и циклопропилборную кислоту (27 мг, 0,31 ммоль). Смесь нагревали в колбе с обратным холодильником в течение ночи в защитной атмосфере азота. Реакционную смесь охлаждали до к.т. и концентрировали под вакуумом досуха. К остатку добавляли этилацетат (20 мл), и смесь промывали насыщенным водным раствором натрия бикарбоната (20 мл) и насыщенным раствором соли (20 мл). Органический слой сушили над безводным натрия сульфатом, и фильтровали. Фильтрат концентрировали под вакуумом досуха, и остаток очищали хроматографией на колонке с силикагелем (PE/ЕА (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде бесцветного масла (59 мг, 58%).
МС (ИЭР, пол. ион) m/z: 336,2 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 6,18 (s, 1H), 5,37-5,13 (m, 1H), 4,17 (d, J=19,1 Гц, 1H), 3,76-3,73 (m, 3H), 2,35-2,31 (m, 1H), 2,07-2,03 (m, 1H), 1,84-1,79 (m, 2H), 1,70 (d, J=7,3 Гц, 2H), 1,65 (d, J=7,0 Гц, 2H), 1,54 (d, J=10,7 Гц, 2H), 1,46 (d, J=7,3 Гц, 1H), 1,36-1,23 (m, 1H), 1,08 (tt, J=9,1, 4,5 Гц, 2H), 1,02-0,96 (m, 2H).
Стадия 2:
(+/-)-транс-метил 3-((6-циклопропил-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00499] В пробирку для проведения реакций под воздействием микроволнового излучения вносили добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (1,03 г, 1,49 ммоль, 60%), (+/-)-транс-метил 3-((2-хлор-6-циклопропилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (400 мг, 1,191 ммоль), воду (0,5 мл), 1,4-диоксан (15 мл), карбонат калия (442 мг, 3,20 ммоль) и Pd(dppf)Cl2 (130 мг, 0,16 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 1 ч при 110°C при нагревании под воздействием микроволнового излучения. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/ЕА (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде светло-желтого масла (251 мг, 36%).
МС (ИЭР, пол. ион) m/z: 590,5 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,57 (s, 1H), 8,49 (dd, J=9,0, 2,7 Гц, 1H), 8,32 (s, 1H), 8,30 (s, 1H), 8,10 (d, J=6,1 Гц, 2H), 8,09 (s, 2H), 6,20 (s, 1H), 5,03 (s, 1H), 3,77 (s, 1H), 3,74 (s, 3H), 2,38 (s, 3H), 1,95-1,87 (m, 4H), 1,79 (s, 4H), 1,01 (dt, J=11,3, 5,5 Гц, 4H).
Стадия 3:
(+/-)-транс-3-((6-циклопропил-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00500] К раствору (+/-)-транс-метил 3-((6-циклопропил-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (250 мг, 0,42 ммоль) в смешанном растворителе, содержащем THF (5 мл), метанол (5 мл) и воду (5 мл), порциями добавляли NaOH (170 мг, 4,25 ммоль). Смесь перемешивали при к.т. в течение ночи и концентрировали под вакуумом, чтобы удалить органический растворитель. К остатку добавляли воду (15 мл), и полученную смесь подкисляли разбавленной соляной кислотой (1 моль/л) до pH ≈ 6. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=30/1 - 10/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (90 мг, 50%).
МС (ИЭР, пол. ион) m/z: 422,2 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 422,1964 [M+H]+, (C23H26FN5O2)[M+H]+ теоретическое значение: 422,1992;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,96 (s, 1H), 8,79 (s, 1H), 8,40 (s, 1H), 7,26 (s, 1H), 7,18 (s, 1H), 7,09 (s, 1H), 6,07 (s, 1H), 4,78 (s, 1H), 2,55 (s, 1H), 2,12 (s, 1H), 2,04 (s, 1H), 1,91 (s, 1H), 1,73-1,39 (m, 8H), 1,12 (d, J=4,3 Гц, 2H), 1,00 (s, 2H);
13C ЯМР (151 МГц, DMSO-d6) δ (ppm): 175,37, 162,36, 159,01, 158,81, 157,35, 155,74, 146,17, 134,80, 133,52, 133,33, 118,79, 118,74, 115,81, 115,67, 95,75, 51,41, 48,79, 29,07, 28,45, 25,60, 24,09, 21,50, 21,20, 19,33, 12,87, 10,50, 10,34.
Пример 69:
(R)-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилвалериановая кислота

Стадия 1: (R)-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)-4,4-диметилпентаноат
[00501] В реакционную колбу вносили 2,4,6-трихлор-5-фторпиримидин (0,64 г, 3,16 ммоль), DIPEA (1,02 г, 7,91 ммоль), (R)-метил 3-амино-4,4-диметилпентаноат (0,42 г, 2,63 ммоль) и дихлорметан (10 мл), и реакционную смесь перемешивали при к.т. в течение 24 ч. В реакционную смесь добавляли воду (20 мл), и полученную смесь экстрагировали дихлорметаном (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (30 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (420 мг, 49%).
МС (ИЭР, пол. ион) m/z: 324,10[M+H]+.
Стадия 2:
(R)-метил 3-((2-хлор-5-фтор-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноат
[00502] К ацетонитрилу (25 мл) добавляли (R)-метил 3-((2,6-дихлор-5-фторпиримидин-4-ил)амино)-4,4-диметилпентаноат (420 мг, 1,29 ммоль), фенилборную кислоту (680 мг, 2,09 ммоль), калия ацетат (617 мг, 6,29 ммоль) и Pd(dppf)Cl2 (171 мг, 0,21 ммоль), затем к смеси добавляли воду (1 мл). Полученную смесь перемешивали при 80°C в течение 12 ч в защитной атмосфере азота. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (480 мг, 63%).
МС (ИЭР, пол. ион) m/z: 366,2[M+H]+.
Стадия 3:
(R)-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенил пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00503] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (695 мг, 0,75 ммоль, 45%), карбонат калия (337 мг, 2,73 ммоль), палладия ацетат (30 мг, 0,14 ммоль), X-Phos (130 мг, 0,27 ммоль) и (R)-метил 3-((2-хлор-5-фтор-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноат (250 мг, 0,68 ммоль). Затем к смеси добавляли H2O (1 мл), и смесь нагревали до 100°C в защитной атмосфере азота и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (200 мг, 47%).
МС (ИЭР, пол. ион) m/z: 620,2 [M+H]+.
Стадия 4:
(R)-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
[00504] К раствору (R)-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноата (200 мг, 0,33 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (129 мг, 3,22 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (40 мг, 27%).
МС (ИЭР, пол. ион) m/z: 452,1 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 452,1896 [M+H]+, (C24H24F2N5O2)[M+H]+ теоретическое значение: 452,1898;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,38 (s, 1H), 8,62 (d, J=9,0 Гц, 1H), 8,37 (s, 1H), 8,31 (s, 1H), 8,04 (d, J=6,6 Гц, 2H), 7,68 (s, 1H), 7,59 (d, J=7,5 Гц, 3H), 4,89 (s, 1H), 2,76-2,58 (m, 2H), 1,22 (s, 1H), 1,00 (s, 9H).
Пример 70:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
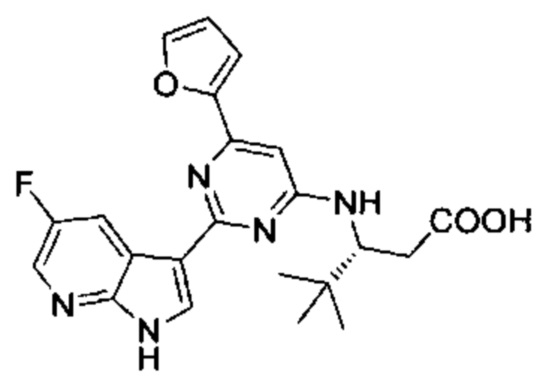
Стадия 1:
(R)-метил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00505] Суспензию 2,4-дихлор-6-(фуран-2-ил)пиримидина (0,30 г, 1,40 ммоль), карбоната калия (0,39 г, 2,80 ммоль), (R)-метил 3-амино-4,4-диметилпентаноат (0,48 г, 1,80 ммоль) в ДМФ (10 мл) перемешивали при 80°C в течение 24 ч. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде белесого твердого вещества (300 мг, 64%).
МС (ИЭР, пол. ион) m/z: 338,2[M+H]+.
Стадия 2: (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил) пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00506] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (821 мг, 0,88 ммоль, 45%), карбонат калия (491 мг, 3,55 ммоль), палладия ацетат (39 мг, 0,17 ммоль), X-Phos (169 мг, 0,35 ммоль) и (R)-метил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноат (300 мг, 0,88 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 100°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (300 мг, 57%).
МС (ИЭР, пол. ион) m/z: 592,2 [M+H]+.
Стадия 3:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
[00507] К раствору (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)-4,4-диметилпентаноата (300 мг, 0,50 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (202 мг, 5,07 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (180 мг, 83%).
МС (ИЭР, пол. ион) m/z: 424,3 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 424,1793[M+H]+, (C22H23FN5O3)[M+H]+ теоретическое значение: 424,1785;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,25 (s, 1H), 12,05 (s, 1H), 8,67 (d, J=9,0 Гц, 1H), 8,30 (d, J=10,6 Гц, 2H), 7,88 (s, 1H), 7,34 (d, J=9,4 Гц, 1H), 7,23 (s, 1H), 6,70 (s, 1H), 6,66 (s, 1H), 4,82 (s, 1H), 2,68 (d, J=12,7 Гц, 1H), 2,35-2,23 (m, 1H), 0,98 (s, 9H).
Пример 71:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилвалериановая кислота

Стадия 1: (R)-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноат
[00508] В реакционную колбу вносили 2,4-дихлор-6-фенилпиримидин (0,30 г, 1,30 ммоль), карбонат калия (0,37 г, 2,70 ммоль), (R)-метил 3-амино-4,4-диметилпентаноат (0,46 г, 1,70 ммоль) и DMF (10 мл). Смесь перемешивали при 80°C в течение 24 ч. Добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (30 мл × 3). Объединенные органические фазы промывали насыщенным раствором соли (60 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (120 мг, 26%).
МС (ИЭР, пол. ион) m/z: 348,1[M+H]+.
Стадия 2:
(R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноат
[00509] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (383 мг, 0,41 ммоль, 45%), карбонат калия (190 мг, 1,38 ммоль), палладия ацетат (15 мг, 0,07 ммоль), X-Phos (65 мг, 0,14 ммоль) и (R)-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноат (120 мг, 0,34 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 100°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (180 мг, 86%).
МС (ИЭР, пол. ион) m/z: 602,3 [M+H]+.
Стадия 3:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
[00510] К раствору (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)-4,4-диметилпентаноата (180 мг, 0,30 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (120 мг, 2,99 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (94 мг, 72%).
МС (ИЭР, пол. ион) m/z: 434,2[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 434,2013[M+H]+, (C24H25FN5O2)[M+H]+ теоретическое значение: 434,1992;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,26 (s, 1H), 12,05 (s, 1H), 8,70 (d, J=9,3 Гц, 1H), 8,37 (s, 1H), 8,29 (s, 1H), 8,09 (d, J=6,6 Гц, 2H), 7,54 (dt, J=13,2, 6,8 Гц, 3H), 7,30 (d, J=9,0 Гц, 1H), 6,82 (s, 1H), 4,86 (s, 1H), 2,70 (d, J=12,8 Гц, 1H), 2,38-2,24 (m, 1H), 0,99 (s, 9H).
Пример 72:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота

Стадия 1: (R)-метил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00511] В реакционную колбу вносили 2,4-дихлор-7-изопропил-7H-пирроло[2,3-d]пиримидин (0,30 г, 1,30 ммоль), карбонат калия (0,36 г, 2,61 ммоль), (R)-метил 3-амино-4,4-диметилпентаноат (0,42 г, 1,56 ммоль) и DMF (10 мл), и смесь перемешивали при 80°C в течение 24 ч. После завершения реакции в реакционную смесь добавляли воду (20 мл), и полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (60 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов) =15/1), чтобы получить указанное в заголовке соединение в виде белесого твердого вещесвта (260 мг, 56%).
МС (ИЭР, пол. ион) m/z: 353,10[M+H]+.
Стадия 2: (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметилпентаноат
[00512] К THF (10 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (749 мг, 0,81 ммоль, 45%), карбонат калия (407 мг, 2,95 ммоль), палладия ацетат (33 мг, 0,15 ммоль), X-Phos (140 мг, 0,30 ммоль) и (R)-метил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметил пентаноат (260 мг, 0,74 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 100°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (310 мг, 69%).
МС (ИЭР, пол. ион) m/z: 607,3 [M+H]+.
Стадия 3:
(R)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметилвалериановая кислота
[00513] К раствору (R)-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)-4,4-диметилпентаноата (300 мг, 0,49 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (197 мг, 4,95 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (180 мг, 83%).
МС (ИЭР, пол. ион) m/z: 439,3[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 439,2271[M+H]+, (C23H28FN6O2)[M+H]+ теоретическое значение: 439,2258;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,06 (s, 1H), 11,94 (s, 1H), 8,74 (d, J=9,4 Гц, 1H), 8,23 (d, J=18,8 Гц, 2H), 7,18 (d, J=3,0 Гц, 1H), 7,04 (d, J=8,9 Гц, 1H), 6,70 (d, J=3,0 Гц, 1H), 5,09-4,96 (m, 2H), 2,70 (d, J=12,7 Гц, 1H), 1,50 (dd, J=6,2, 3,5 Гц, 6H), 1,24 (s, 2H), 1,00 (s, 9H).
Пример 73: (2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00514] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2:
(2S,3S)-этил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00515] В реакционную колбу вносили 2,4-дихлор-6-(фуран-2-ил)пиримидин (0,50 г, 2,30 ммоль), карбонат калия (0,83 г, 6,00 ммоль), (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид (0,70 г, 3,00 ммоль) и DMF (10 мл). Смесь перемешивали при 50°C в течение 24 ч. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (60 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде белесого твердого вещества (610 мг, 70%).
МС (ИЭР, пол. ион) m/z: 376,0[M+H]+.
Стадия 3: 3-бром-6-фтор-1H-пирроло[2,3-b]пиридин
[00516] К раствору 6-фтор-1H-пирроло[2,3-b]пиридина (2,50 г, 18,36 ммоль) в ДМФ (50 мл) добавляли раствор брома (3,20 г, 20,00 ммоль) в ДМФ (20 мл) при 0°C. После добавления смесь перемешивали при к.т. в течение 2 ч. К смеси добавляли воду (100 мл), затем выпадал обильный твердый осадок. Смесь фильтровали при сниженном давлении, и осадок на фильтре дважды промывали водой (30 мл) и затем сушили под вакуумом при 60°C в течение 24 ч, чтобы получить указанное в заголовке соединение в виде белого твердого вещества (3,44 г, 87%).
МС (ИЭР, пол. ион) m/z: 217,1 [M+H]+;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,20 (s, 1H), 8,04-7,95 (m, 1H), 7,67 (d, J=2,5 Гц, 1H), 6,94 (t, J=9,7 Гц, 1H).
Стадия 4: 3-бром-6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин
[00517] К раствору 3-бром-6-фтор-1H-пирроло[2,3-b]пиридина (3,44 г, 16,00 ммоль) в THF (68 мл) добавляли натрия гидрид (1,30 г, 32,00 ммоль, 60%) при 0°C. Затем реакционную смесь перемешивали в течение 30 мин при 0°C. Добавляли TsCl (4,58 г, 24,00 ммоль), и реакционную смесь перемешивали при к.т. в течение 3 ч. Для того чтобы остановить реакцию, добавляли воду (200 мл), и полученную смесь экстрагировали EtOAc (100 мл × 2). Объединенные органические фазы промывали насыщенным раствором соли (200 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем, чтобы получить указанное в заголовке соединение в виде коричневого твердого вещества (5,70 г, 97%).
МС (ИЭР, пол. ион) m/z: 369,0 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,11 (d, J=8,2 Гц, 2H), 7,88 (t, J=7,8 Гц, 1H), 7,75 (s, 1H), 7,34 (d, J=7,8 Гц, 2H), 6,91 (d, J=8,3 Гц, 1H), 2,41 (s, 3H).
Стадия 5:
6-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00518] К суспензии 3-бром-6-фтор-1-тозил-1H-пирроло[2,3-b]пиридина (5,70 г, 15,00 ммоль), тетракис(трифенилфосфин)платины (1,80 г, 1,50 ммоль) и калия ацетата (4,50 г, 46,00 ммоль) в 1,4-диоксане (120 мл) добавляли бис(пинаколато)дибор (5,90 г, 23,00 ммоль). Смесь перемешивали при 100°C в течение 24 ч в защитной атмосфере азота. В реакционную смесь добавляли этилацетат (50 мл), и смесь фильтровали через целитовую прокладку. Осадок на фильтре промывали этилацетатом (20 мл × 2). Объединенные фильтраты концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=40/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (3,50 г, 54%).
МС (ИЭР, пол. ион) m/z: 417,30 [M+H]+.
Стадия 6:
(2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-илУ6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00519] К THF (10 мл) добавляли 6-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (610 мг, 0,64 ммоль, 45%), карбонат калия (338 мг, 2,45 ммоль), палладия ацетат (27 мг, 0,12 ммоль), X-Phos (116 мг, 0,24 ммоль) и (2S,3S)-этил 3-((2-хлор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (230 мг, 0,61 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (260 мг, 67%).
МС (ИЭР, пол. ион) m/z: 630,1 [M+H]+.
Стадия 7:
(2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00520] К раствору (2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (260 мг, 0,41 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (146 мг, 4,12 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (150 мг, 81%).
МС (ИЭР, пол. ион) m/z: 448,1[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 448,1793[M+H]+, (C24H23FN5O3)[M+H]+ теоретическое значение: 448,1785;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,21 (s, 1H), 9,00 (s, 1H), 8,20 (s, 1H), 7,88 (s, 1H), 7,55 (s, 1H), 7,28 (s, 1H), 6,98 (d, J=8,4 Гц, 1H), 6,70 (s, 1H), 6,66 (s, 1H), 4,59 (s, 1H), 2,51 (s, 1H), 1,94 (s, 1H), 1,80-1,71 (m, 2H), 1,68 (s, 1H), 1,62-1,53 (m, 3H), 1,48-1,36 (m, 3H).
Пример 74: (2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00521] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2: (2S,3S)-этил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00522] В реакционную колбу вносили 2,4-дихлор-7-изопропил-7H-пирроло[2,3-d]пиримидин (0,60 г, 2,61 ммоль), карбонат калия (1,01 г, 7,31 ммоль), (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид (0,85 г, 3,65 ммоль) и DMF (10 мл), и смесь перемешивали при 50°C в течение 24 ч. Для того чтобы остановить реакцию, добавляли воду (20 мл), и полученную смесь экстрагировали EtOAc (30 мл × 3). Объединенные органические фазы промывали насыщенным раствором соли (60 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде белесого твердого вещества (732 мг, 71%).
МС (ИЭР, пол. ион) m/z: 391,10[M+H]+.
Стадия 3:
(2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00523] К THF (10 мл) добавляли 6-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (580 мг, 0,56 ммоль, 40%), карбонат калия (282 мг, 2,05 ммоль), палладия ацетат (22 мг, 0,10 ммоль), X-Phos (97 мг, 0,20 ммоль) и (2S,3S)-этил
3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (200 мг, 0,51 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (280 мг, 84%).
МС (ИЭР, пол. ион) m/z: 645,3 [M+H]+.
Стадия 4:
(2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00524] К раствору (2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (280 мг, 0,43 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (173 мг, 4,34 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (180 мг, 89%).
МС (ИЭР, пол. ион) m/z: 463,2[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 463,2268[M+H]+, (C25H28FN6O2)[M+H]+ теоретическое значение: 463,2258;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,04 (s, 1H), 9,04 (t, J=8,1 Гц, 1H), 8,05 (s, 1H), 7,22 (d, J=6,3 Гц, 1H), 7,19 (s, 1H), 6,94 (d, J=8,6 Гц, 1H), 6,66 (s, 1H), 5,01 (d, J=6,6 Гц, 1H), 4,75 (s, 1H), 2,68 (s, 1H), 1,98 (s, 1H), 1,75 (m, 3H), 1,51 (m, 11H).
Пример 75:
(2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00525] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2: (2S,3S)-этил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00526] В реакционную колбу вносили 2,4-дихлор-6-фенилпиримидин (0,76 г, 3,40 ммоль), карбонат калия (0,93 г, 6,80 ммоль), (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид (0,96 г, 4,10 ммоль) и DMF (10 мл). Смесь перемешивали при 50°C в течение 24 ч. Для того чтобы остановить реакцию, добавляли воду (40 мл), и полученную смесь экстрагировали EtOAc (30 мл × 3). Объединенные органические фазы промывали насыщенным раствором соли (60 мл), сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (0,70 г, 50%).
МС (ИЭР, пол. ион) m/z: 386,1[M+H]+.
Стадия 3:
(2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00527] К THF (10 мл) добавляли 6-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (503 мг, 0,54 ммоль, 45%), карбонат калия (286 мг, 2,07 ммоль), палладия ацетат (23 мг, 0,10 ммоль), X-Phos (98 мг, 0,20 ммоль) и (2S,3S)-этил
3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (200 мг, 0,52 ммоль). Затем к смеси добавляли H2O (0,5 мл), и смесь нагревали до 80°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде бледно-желтого твердого вещества (240 мг, 72%).
МС (ИЭР, пол. ион) m/z: 640,2 [M+H]+.
Стадия 4:
(2S,3S)-3-((2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00528] К раствору (2S,3S)-этил 3-((2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (240 мг, 0,37 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (150 мг, 3,75 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 3-4. Полученную смесь экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (150 мг, 87%).
МС (ИЭР, пол. ион) m/z: 458,1 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 458,2003[M+H]+, (C26H25FN5O2)[M+H]+ теоретическое значение: 458,1992;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,36-12,25 (m, 1H), 12,21 (s, 1H), 9,03 (s, 1H), 8,23 (s, 1H), 8,12 (s, 2H), 7,61-7,48 (m, 4H), 7,00 (d, J=8,3 Гц, 1H), 6,79 (s, 1H), 4,62 (s, 1H), 1,99 (s, 3H), 1,69 (m, 8H).
Пример 76:
(+/-)-транс-3-((5-фтор-2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1:
(+/-)-транс-метил 3-((5-фтор-2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00529] К THF (10 мл) добавляли 6-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (517 мг, 0,49 ммоль, 40%), карбонат калия (262 мг, 1,89 ммоль), палладия ацетат (21 мг, 0,09 ммоль), X-Phos (90 мг, 0,18 ммоль) и (+/-)-транс-метил
3-((2-хлор-5-фтор-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (180 мг, 0,47 ммоль). Затем к смеси добавляли H2O (1 мл), и смесь нагревали до 80°C и перемешивали в течение 12 ч. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=8/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (240 мг, 79%).
МС (ИЭР, пол. ион) m/z: 634,1 [M+H]+.
Стадия 2:
(+/-)-транс-3-((5-фтор-2-(6-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00530] К раствору (+/-)-транс-метил 3-((5-фтор-2-(6-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(фуран-2-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (240 мг, 0,38 ммоль) в THF/MeOH (отношение объемов=8 мл/4 мл) добавляли раствор NaOH (150 мг, 3,75 ммоль) в воде (2 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈3-4. Полученную смесь экстрагировали этил ацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (150 мг, 85%).
МС (ИЭР, пол. ион) m/z: 466,3[M+H]+;
МСВР (ИЭР, пол. ион) m/z: 466,1702 [M+H]+, (C24H22F2N5O3)[M+H]+ теоретическое значение: 466,1691;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,29 (s, 1H), 12,20 (s, 1H), 8,96 (t, J=8,4 Гц, 1H), 8,09 (d, J=2,1 Гц, 1H), 8,02 (s, 1H), 7,61 (d, J=6,8 Гц, 1H), 7,27 (s, 1H), 7,00 (d, J=8,4 Гц, 1H), 6,77 (s, 1H), 4,67 (s, 1H), 2,86 (d, J=6,8 Гц, 1H), 2,01 (s, 1H), 1,97 (s, 1H), 1,78 (s, 3H), 1,65-1,39 (m, 5H).
Пример 77:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 1-(2,6-дихлор-5-фторпиримидин-4-ил)этанон
[00531] К смеси ледяной уксусной кислоты (40 мл) и раствора серной кислоты (64 мл, 1,5 моль/л) добавляли 2,4-дихлор-5-фторпиримидин (2,00 г, 12,00 ммоль). К смеси последовательно, по каплям добавляли водный раствор ацетальдегида (16 мл, 100 ммоль, 40 вес. %), затем раствор аммония сульфата (24 мл, 24 ммоль, 1 моль/л) и сульфата железа (II) (24 мл, 36 ммоль, 1,5 моль/л). Полученную смесь перемешивали при 10°C в течение 2 ч. Смесь фильтровали чтобы получить указанное в заголовке соединение в виде серо-белого твердого вещества (436 мг, 17%).
МС (ИЭР, пол. ион) m/z: 210,9 [M+H]+;
1Р ЯМР (400 МГц, CDCl3) δ (ppm): 2,72 (s, 3H).
Стадия 2:
(+/-)-транс-метил 3-((6-ацетил-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00532] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (53 мг, 0,29 ммоль) и 1-(2,6-дихлор-5-фторпиримидин-4-ил)этанона (50 мг, 0,24 ммоль) в THF (5 мл) добавляли DIPEA (0,2 мл, 0,96 ммоль), и смесь перемешивали при к.т. в течение ночи. Смесь разбавляли водой (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (33 мг, 39%).
МС (ИЭР, пол. ион) m/z: 356,2 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 5,56 (s, 1H), 4,51 (s, 1H), 3,78 (s, 3H), 2,62 (s, 3H), 2,40 (d, J=5,8 Гц, 1H), 2,03 (s, 1H), 1,90 (s, 1H), 1,67 (d, J=11,0 Гц, 8H).
Стадия 3:
(+/-)-транс-метил 3-((2-хлор-6-((E)-3-(диметиламино)акрилоил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00533] Раствор (+/-)-транс-метил 3-((6-ацетил-2-хлор-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (33 мг, 0,09 ммоль) в ДМФ-DMA (1 мл) перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (25 мл), и полученную смесь экстрагировали этилацетатом (25 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (20 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого масла (33 мг, 87%).
МС (ИЭР, пол. ион) m/z: 411,2 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,84 (s, 1H), 5,87 (s, 1H), 5,46 (s, 1H), 4,49 (s, 1H), 3,77 (s, 3H), 3,19 (s, 3H), 2,97 (s, 3H), 2,40 (d, J=5,8 Гц, 1H), 2,01 (s, 1H), 1,89 (s, 1H), 1,67 (s, 8H).
Стадия 4: (+/-)-транс-метил 3-((2-хлор-5-фтор-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00534] К раствору (+/-)-транс-метил 3-((2-хлор-6-((Е)-3-(диметиламино)акрилоил)-5-фторпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (200 мг, 0,4867 ммоль) в этаноле (3 мл) добавляли гидроксиламмония хлорид (67 мг, 0,96 ммоль). Реакционную смесь перемешивали при 78°C в течение ночи. Смесь концентрировали под вакуумом для удаления растворителя и остаток растворяли в этилацетате (20 мл). Смесь промывали насыщенным раствором соли (20 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде красного твердого вещества (35 мг, 19%).
МС (ИЭР, пол. ион) m/z: 381,2 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,40 (d, J=1,6 Гц, 1H), 6,99 (s, 1H), 5,63 (d, J=3,8 Гц, 1H), 4,55 (t, J=4,9 Гц, 1H), 3,78 (s, 3H), 2,45 (d, J=5,8 Гц, 1H), 2,04 (d, J=2,2 Гц, 1H), 1,93 (d, J=2,2 Гц, 1H), 1,77-1,60 (m, 8H).
Стадия 5:
(+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00535] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (170 мг, 0,25 ммоль), (+/-)-транс-метил
3-((2-хлор-5-фтор-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (78 мг, 0,21 ммоль), воде (0,2 мл), 1,4-диоксан (3 мл), карбонат калия (84 мг, 0,61 ммоль) и X-phos (19 мг, 0,04 ммоль). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 3 ч при 110°C при нагревании под воздействием микроволнового излучения. Фильтрат концентрировали под вакуумом досуха, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc(отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде желтого масла (28 мг, 22%).
МС (ИЭР, пол. ион) m/z: 637,2 [M+H]+.
Стадия 6:
(+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00536] К раствору (+/-)-транс-метил 3-((5-фтор-2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(изоксазол-5-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (27 мг, 0,04 ммоль) в THF/MeOH (отношение объемов=1/1, 2 мл) добавляли водный раствор гидроксида натрия (4 М, 0,10 мл, 0,40 ммоль). Смесь перемешивали при 30°C в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 5,5, затем экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (15 мг, 76%).
МС (ИЭР, пол. ион) m/z: 467,2 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 467,1644 [M+H]+, (C23H21F2N6O3)[M+H]+ теоретическое значение: 467,1643;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,39 (s, 1H), 9,19 (s, 1H), 8,53 (d, J=9,5 Гц, 1H), 8,33 (s, 1H), 8,30 (s, 1H), 7,88 (d, J=6,2 Гц, 1H), 7,24 (s, 1H), 4,75 (s, 1H), 2,89 (s, 1H), 2,03 (s, 1H), 1,87-1,73 (m, 3H), 1,70-1,42 (m, 6H).
Пример 78:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
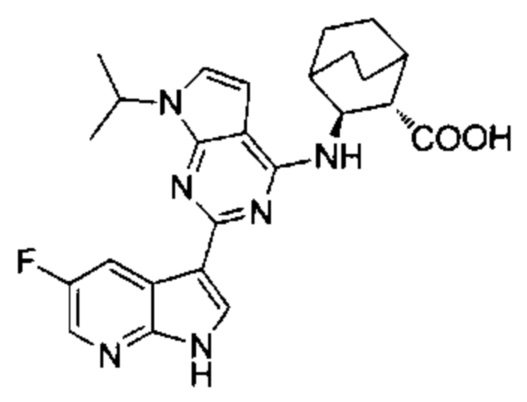
Стадия 1: (2S,3S)этил 3-аминобицикло[2,2,2]октан-2-карбоксилат гидрохлорид
[00537] Указанное в заголовке соединение может быть получено методом синтеза, описанным в заявке на патент WO 2015073491.
Стадия 2:
(2S,3S)-этил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00538] К раствору (2S,3S)-этил 3-аминобицикло[2,2,2]октан-2-карбоксилата гидрохлорида (458 мг, 1,96 ммоль), 2,4-дихлор-7-изопропил-7H-пирроло[2,3-d]пиримидин (410 мг, 1,78 ммоль) в дихлорметане (15 мл) медленно добавляли DIPEA (0,97 мл, 5,88 ммоль). Смесь перемешивали при 30°C в течение ночи в защитной атмосфере азота. Реакционную смесь последовательно промывали водой (10 мл), 5% водным раствором натрия бисульфита (10 мл) и насыщенным раствором соли (10 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (333 мг, 50%).
Стадия 3: (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00539] К 1,4-диоксану (3 мл) добавляли 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (284 мг, 0,31 ммоль, 45 вес. %), карбонат калия (106 мг, 0,77 ммоль), PdCl2(dppf) (41 мг, 0,05 ммоль) и (2S,3S)-этил 3-((2-хлор-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (100 мг, 0,26 ммоль). Затем к смеси добавляли H2O (0,2 мл), и для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин. Смесь перемешивали в течение 2 ч при 110°C при нагревании под воздействием микроволнового излучения. Смесь фильтровали для удаления твердых примесей. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (146 мг, 89%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,73 (dd, J=9,1, 2,7 Гц, 1H), 8,66 (s, 1H), 8,32 (s, 1H), 8,13 (d, J=8,2 Гц, 2H), 7,30 (s, 2H), 7,06 (d, J=3,5 Гц, 1H), 6,41 (d, J=2,9 Гц, 1H), 4,90 (s, 1H), 2,45 (d, J=5,2 Гц, 1H), 2,38 (s, 3H), 2,08 (s, 2H), 2,00-1,66 (m, 8H), 1,57 (d, J=6,1 Гц, 6H), 1,28 (s, 5H).
Стадия 4:
(2S,3S)-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00540] К раствору (2S,3S)-этил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-7-изопропил-7H-пирроло[2,3-d]пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (146 мг, 0,23 ммоль) в THF/MeOH (отношение объемов=5 мл/5 мл) добавляли раствор NaOH (90 мг, 2,26 ммоль) в воде (1 мл). Смесь перемешивали при к.т. в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈ 6. Полученную смесь экстрагировали этилацетатом (15 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (40 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом для удаления растворителя, и остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1 - 5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (65 мг, 62%).
МС (ИЭР, пол. ион) m/z: 463,4 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 463,2264 [M+H]+, (C25H28FN6O2)[M+H]+ теоретическое значение: 463,2258;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,28 (s, 1H), 12,08 (s, 1H), 8,68 (d, J=8,8 Гц, 1H), 8,26 (s, 1H), 8,22 (d, J=2,1 Гц, 1H), 7,21 (d, J=2,5 Гц, 2H), 6,64 (s, 1H), 5,02 (m, 1H), 4,79 (s, 1H), 2,72 (d, J=6,3 Гц, 1H), 2,03 (d, J=12,3 Гц, 2H), 1,79 (m, 3H), 1,54 (m, 11H).
Пример 79:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
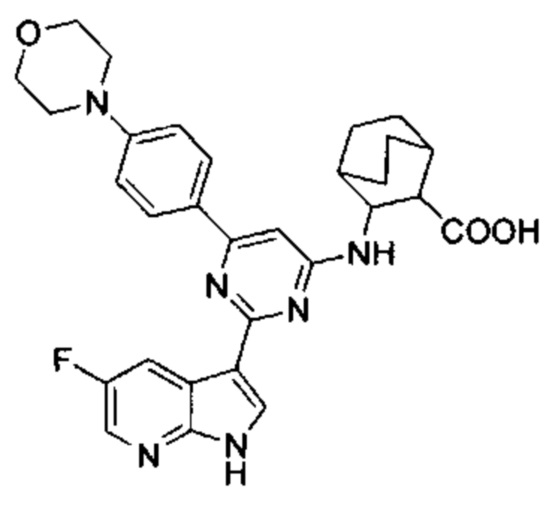
Стадия 1: 4-(4-(2,6-дихлорпиримидин-4-ил)фенил)морфолин
[00541] К раствору 2,4,6-трихлорпиримидина (500 мг, 2,73 ммоль) в тетрагидрофуране (8,18 мл) добавляли палладия ацетат (63 мг, 0,28 ммоль), трифенилфосфин (150 мг, 0,548 ммоль), (4-морфолинофенил)борную кислоту (570 мг, 2,75 ммоль) и водный раствор натрия карбоната (1 М, 8,18 мл, 8,18 ммоль). Смесь перемешивали при 70°C в течение 6 ч в защитной атмосфере азота, затем добавляли воду (50 мл). Смесь экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (374 мг, 44%).
МС (ИЭР, пол. ион) m/z: 310,0 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,04 (d, J=9,1 Гц, 2Н), 7,56 (s, 1H), 6,96 (d, J=9,1 Гц, 2H), 3,92-3,88 (m, 4H), 3,37-3,33 (m, 4H).
Стадия 2:
(+/-)-транс-метил 3-((2-хлор-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00542] К раствору (+/-)-транс-метил 3-аминобицикло[2,2,2]октан-2-карбоксилата (230 мг, 1,25 ммоль) и 4-(4-(2,6-дихлорпиримидин-4-ил)фенил)морфолина (353 мг, 1,14 ммоль) в ДМФ (5 мл) добавляли карбонат калия (173 мг, 1,25 ммоль), и смесь перемешивали при к.т. в течение ночи. В реакционную смесь добавляли воду (40 мл), и полученную смесь экстрагировали этилацетатом (40 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом досуха, и остаток очищали хроматографией на колонке с силикагелем (PE/ЕА (отношение объемов)=20/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (192 мг, 37%).
МС (ИЭР, пол. ион) m/z: 457,3 [M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,96 (d, J=8,8 Гц, 2Н), 6,96 (d, J=8,9 Гц, 2Н), 6,71 (s, 1H), 5,41-5,34 (m, 1H), 4,32 (s, 1H), 3,92-3,86 (m, 4Н), 3,75 (s, 3H), 3,32-3,25 (m, 4Н), 2,39 (d, J=4,8 Гц, 1H), 2,07 (d, J=3,3 Гц, 1H), 1,88 (d, J=2,7 Гц, 1H), 1,81-1,62 (m, 6Н), 1,53-1,41 (m, 2Н).
Стадия 3: (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00543] В запаянную трубку вносили 5-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (396 мг, 0,38 ммоль), (+/-)-транс-метил
3-((2-хлор-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбокси лат (145 мг, 0,32 ммоль), карбонат калия (131 мг, 0,95 ммоль), Pd(dppf)Cl2 (51 мг, 0,06 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин и смесь в запаянной трубке перемешивали при 110°C в течение 2 ч. Реакционную смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc(отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (148 мг, 66%).
МС (ИЭР, пол. ион) m/z: 712,2[M+H]+;
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,71 (dd, J=8,1, 3,6 Гц, 2Н), 8,33 (d, J=1,8 Гц, 1H), 8,13 (d, J=8,3 Гц, 2Н), 8,07 (d, J=8,8 Гц, 2Н), 7,30 (s, 2Н), 7,04 (d, J=8,9 Гц, 2Н), 6,67 (s, 1H), 5,12 (s, 1H), 4,52 (s, 1H), 3,96-3,87 (m, 4Н), 3,35-3,26 (m, 4Н), 2,45 (d, J=4,9 Гц, 1H), 2,39 (s, 3H), 2,10 (s, 1H), 1,98 (s, 1H), 1,84 (d, J=10,1 Гц, 2Н), 1,69 (m, 6Н).
Стадия 4:
(+/-)-транс-3-((2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00544] К раствору (+/-)-транс-метил 3-((2-(5-фтор-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-(4-морфолинофенил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (144 мг, 0,20 ммоль) в THF/MeOH (отношение объемов=1/1, 3 мл) добавляли водный раствор гидроксида натрия (4 М, 0,5 мл, 2 ммоль). Смесь перемешивали при 30°C в течение ночи, затем разбавляли водой (10 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH 5,5, затем экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (36 мг, 33%).
МС (ИЭР, пол. ион) m/z: 543,2 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 543,2513 [M+H]+, (C30H32FN6O3)[M+H]+ теоретическое значение: 543,2520;
1H ЯМР (600 МГц, DMSO-d6) δ (ppm): 12,24 (s, 1H), 8,65 (s, 1H), 8,36 (s, 1H), 8,29 (s, 1H), 8,01 (s, 2H), 7,33 (s, 1H), 7,09 (d, J=7,9 Гц, 2H), 6,67 (s, 1H), 4,63 (s, 1H), 4,03 (d, J=7,0 Гц, 1H), 3,77 (s, 4H), 3,60 (s, 1H), 3,24 (s, 4H), 1,93-1,29 (m, 10H).
Пример 80:
(+/-)-транс-3-((2-(5-фтор-6-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота

Стадия 1: 3-бром-5-фтор-6-метилпиридин-2-амин
[00545] К раствору 5-фтор-6-метилпиридин-2-амина (1,55 г, 12,3 ммоль) в ацетонитриле (16 мл) порциями добавляли NBS (2,83 г, 15,9 ммоль) при -5°C. После добавления смесь перемешивали при -5°C в течение 1,5 ч. К смеси добавляли этилацетат (80 мл), и полученную смесь промывали водой (80 мл) и насыщенным раствором соли (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=10/1 - 3/1), чтобы получить указанное в заголовке соединение в виде светло-желтого твердого вещества (1,72 г, 68%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,41 (d, J=7,9 Гц, 1H), 4,78 (s, 2H), 2,34 (d, J=2,9 Гц, 3H).
Стадия 2: 5-фтор-6-метил-3-((триметилсилил)этинил)пиридин-2-амин
[00546] В двухгорлую колбу вносили 3-бром-5-фтор-6-метилпиридин-2-амин (1,50 г, 7,32 ммоль), бис(трифенилфосфин)палладий(II) хлорид (513 мг, 0,73 ммоль), иодид меди (263 мг, 1,38 ммоль), триэтиламин (6,0 мл, 43,2 ммоль) и тетрагидрофуран (1,0 мл). К смеси медленно, по каплям добавляли триметилсилилацетилен (1,95 мл, 13,8 ммоль) при к.т. и в защитной атмосфере азота, и полученную смесь нагревали до 50°C и перемешивали в течение 4 ч. Реакционную смесь охлаждали до к.т., и добавляли насыщенный водный раствор аммония хлорида (30 мл). Полученную смесь экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали насыщенным водным раствором натрия хлорида (80 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=15/1 - 4/1), чтобы получить указанное в заголовке соединение серого твердого вещества (1,30 г, 80%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 7,23 (d, J=9,1 Гц, 1H), 4,84 (s, 2H), 2,37 (d, J=2,9 Гц, 3H), 0,28 (s, 9Н).
Стадия 3: 5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b]пиридин
[00547] К суспензии калия трет-бутоксида (855 мг, 7,62 ммоль) в NMP (15 мл) порциями добавляли 5-фтор-6-метил-3-((триметилсилил)этинил)пиридин-2-амин (1,30 г, 5,85 ммоль) при 50°C. После добавления смесь нагревали до 80°C в защитной атмосфере азота и перемешивали в течение 3 ч. Реакционную смесь охлаждали до к.т. и порциями добавляли TsCl (1,35 г, 7,08 ммоль). После добавления смесь перемешивали при 30°C в течение 2 ч. К смеси добавляли воду (40 мл), и полученную смесь фильтровали. Осадок на фильтре очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=20/1 - 6/1), чтобы получить указанное в заголовке соединение в виде белого твердого вещества (820 мг, 46%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,11 (d, J=8,3 Гц, 2Н), 7,70 (d, J=3,9 Гц, 1H), 7,44 (d, J=9,3 Гц, 1H), 7,31 (s, 2Н), 6,51 (d, J=4,0 Гц, 1H), 2,61 (d, J=3,2 Гц, 3H), 2,40 (s, 3H).
Стадия 4: 3-бром-5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b]пиридин
[00548] Раствор 5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b]пиридина (590 мг, 1,94 ммоль) в ДМФ (8 мл) охлаждали до 0°C, и в раствор медленно, по каплям добавляли бром (0,3 мл, 6 ммоль). После добавления смесь перемешивали при к.т. в течение 2 ч. Смесь вносили по каплям в насыщенный водный раствор тиосульфата (30 мл), и полученную смесь экстрагировали EtOAc (30 мл × 3). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали под вакуумом. Полученный остаток очищали хроматографией на колонке с силикагелем (PE/EtOAc (отношение объемов)=5/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (468 мг, 63%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,10 (d, J=8,3 Гц, 2H), 7,76 (s, 1H), 7,41 (d, J=8,7 Гц, 1H), 7,31 (d, J=8,1 Гц, 2H), 2,63 (d, J=3,2 Гц, 3H), 2,41 (s, 3H).
Стадия 5:
5-фтор-6-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин
[00549] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 3-бром-5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b] пиридин (468 мг, 1,23 ммоль), бис(пинаколато)дибор (483 мг, 1,90 ммоль), калия ацетат (248 мг, 2,53 ммоль), Pd(dppf)Cl2 (95 мг, 0,13 ммоль) и DME (5 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и затем смесь перемешивали при 130°C в течение 2 ч при нагревании микроволновым излучением. Реакционную смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (30 мл). Фильтрат концентрировали под вакуумом, и остаток использовали на следующей стадии без дополнительной очистки.
МС (ИЭР, пол. ион) m/z: 431,1 [M+H]+.
Стадия 6:
(+/-)-транс-метил 3-((2-(5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат
[00550] В пробирку для проведения реакций под воздействием микроволнового излучения вносили 5-фтор-6-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин (187 мг, 0,26 ммоль, 60%), (+/-)-транс-метил 3-((2-хлор-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилат (80 мг, 0,22 ммоль), карбонат калия (89 мг, 0,65 ммоль), Pd(dppf)Cl2 (35 мг, 0,04 ммоль), 1,4-диоксан (3 мл) и воду (0,2 мл). Для удаления воздуха из смеси выполняли барботирование азотом в течение 10 мин, и смесь в запаянной трубке перемешивали при 110°C в течение 3 ч. Смесь фильтровали через целитовую прокладку, и осадок на фильтре промывали этилацетатом (50 мл). Фильтрат промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом и фильтровали. Фильтрат концентрировали под вакуумом, и остаток очищали хроматографией на колонке с силикагелем (н-гексан/EtOAc (отношение объемов)=2/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (77 мг, 56%).
1H ЯМР (400 МГц, CDCl3) δ (ppm): 8,64 (s, 1H), 8,57 (d, J=9,9 Гц, 1H), 8,17 (d, J=8,2 Гц, 2H), 8,11 (d, J=6,8 Гц, 2H), 7,54 (dd, J=14,6, 7,0 Гц, 3H), 7,39 (d, J=4,3 Гц, 1H), 7,31 (s, 1H), 6,73 (s, 1H), 5,18 (s, 1H), 4,54 (s, 1H), 3,74 (s, 3H), 2,64 (d, J=3,0 Гц, 3H), 2,45 (d, J=4,8 Гц, 1H), 2,40 (s, 3H), 2,10 (s, 1H), 1,99 (s, 1H), 1,92-1,62 (m, 8H).
Стадия 7:
(+/-)-транс-3-((2-(5-фтор-6-метил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота
[00551] К раствору (+/-)-транс-метил 3-((2-(5-фтор-6-метил-1-тозил-1H-пирроло[2,3-b]пиридин-3-ил)-6-фенилпиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоксилата (77 мг, 0,12 ммоль) в THF/MeOH (отношение объемов=1/1, 3 мл) добавляли водный раствор гидроксида натрия (4 М, 0,30 мл, 1,20 ммоль). Смесь перемешивали при 30°C в течение ночи, затем разбавляли водой (20 мл). Полученную смесь подкисляли соляной кислотой (1 М) до pH ≈5,5, затем экстрагировали этилацетатом (20 мл × 3).
Объединенные органические слои промывали насыщенным раствором соли (50 мл), сушили над безводным натрия сульфатом, фильтровали, и фильтрат концентрировали под вакуумом для удаления растворителя. Остаток очищали хроматографией на колонке с силикагелем (DCM/MeOH (отношение объемов)=10/1), чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (25 мг, 44%).
МС (ИЭР, пол. ион) m/z: 472,5 [M+H]+;
МСВР (ИЭР, пол. ион) m/z: 472,2156[M+H]+, (C27H27FN5O2)[M+H]+ теоретическое значение: 472,2149;
1H ЯМР (400 МГц, DMSO-d6) δ (ppm): 12,31 (s, 1H), 12,07 (s, 1H), 8,55 (s, 1H), 8,27 (d, J=2,0 Гц, 1H), 8,10 (s, 2H), 7,60-7,38 (m, 4H), 6,76 (s, 1H), 4,64 (s, 1H), 2,53 (d, J=2,5 Гц, 4H), 1,99 (s, 2H), 1,86-1,39 (m, 8H).
Примеры биологического анализа
[00552] Используя части соединений по изобретению в качестве примеров, изобретатели обнаружили антивирусную и цитотоксичную активность и фармкокинетические свойства соединений по изобретению в следующих примерах.
Пример А: Анализ цитопатического действия (анализ ЦПД)
[00553] Обнаружение ингибирующего действия соединения по изобретению против цитопатического действия (ЦПД) вируса гриппа H1N1 A/Weiss/43 на клеточном уровне in vitro.
[00554] Схема 1: Клетки MDCK (клетки почки собаки Мадин-Дарби) вносили в 384-луночный планшет по 2000 клеток в лунку и выращивали их при 37°C и 5% CO2 в течение ночи. На следующий день клеточную культуральную среду дополняли свежей средой, содержащей соответствующие концентрации исследуемых соединений и вирус H1N1 A/Weiss/43 при множественности заражения, обеспечивающей 80-95% ЦПД (либо титр составлял 1 ЦПД90/лунка). Максимальная конечная концентрация исследуемых соединений составляла 100 мкМ; затем готовили 3-кратные серийные разведения до 8 концентраций 100 мкМ, 33,33 мкМ, 11,11 мкМ, 3,70 мкМ, 1,23 мкМ, 0,41 мкМ, 0,14 мкМ, 0,05 мкМ. В группе тестирования цитотоксичности условия были такими же, как описаны выше, за исключением того, что клеточная культуральная среда в группе тестирования цитотоксичности не содержала вирус гриппа. Одновременно проводили эксперименты с контрольной группой, содержащей вирус без добавления лекарственного вещества, и контрольной группой с неинфицированными вирусом клетками без добавления лекарственного вещества. В каждой группе эксперимент проводили в двух повторностях, и выполняли инкубацию при 37°C в атмосфере 5% CO2 в течение 5 суток. Для обнаружения клеточной активности использовали диагностические наборы CCK-8, и полученные данные использовали для расчета противовирусного эффекта соединений и цитотоксичности против инфицированных вирусом клеток. Для анализа данных использовали программное обеспечение GraphPad Prism, и рассчитывали показатель ингибирования ЦПД, и показатель выживаемости клеток. Значения ЕС50 и СС50 получали методом аппроксимации кривых.
[00555] Показатель ингибирования ЦПД=[(оптическая плотность в лунке с дозой соединения - оптическая плотность в лунке контроля вируса) / (оптическая плотность в лунке контроля клеток - оптическая плотность в лунке контроля вируса)] × 100%
[00556] Показатель выживаемости клеток=[(оптическая плотность в лунке с дозой соединения - оптическая плотность в лунке контроля среды) / (оптическая плотность в лунке контроля клеток - оптическая плотность в лунке контроля среды)] × 100%
[00557] В Таблице 1 показана ингибирующая активность соединений по изобретению против вируса гриппа (A/Weiss/43(H1N1))

[00558] Результатыт анализа показывают хорошую активность соединений по изобретению против вируса гриппа.
[00559] Схема 2: Клетки MDCK (клетки почки собаки Мадин-Дарби) вносили в 384-луночный планшет по 2000 клеток в лунку и выращивали их при 37°C и 5% СО2 в течение ночи. На следующий день клеточную культуральную среду дополняли свежей средой, содержащей соответствующие концентрации исследуемых соединений и вирус H1N1 A/Weiss/43 при множественности заражения, обеспечивающей 80-95% ЦПД (либо титр составлял 1 ЦПД90/лунка). Максимальная конечная концентрация исследуемых соединений составляла 50 нМ; затем готовили 3-кратные серийные разведения до 8 концентраций 50 нМ, 16,67 нМ, 5,56 нМ, 1,85 нМ, 0,62 нМ, 0,21 нМ, 0,068 нМ, 0,023 нМ. В группе тестирования цитотоксичности условия были такими же, как описаны выше, за исключением того, что клеточная культуральная среда в группе тестирования цитотоксичности не содержала вирус гриппа. Одновременно проводили эксперименты с контрольной группой, содержащей вирус без добавления лекарственного вещества, и контрольной группой с неинфицированными вирусом клетками без добавления лекарственного вещества. В каждой группе эксперимент проводили в двух повторностях, и выполняли инкубацию при 37°C в атмосфере 5% СО2 в течение 5 суток. Для обнаружения клеточной активности использовали диагностические наборы CCK-8, и полученные данные использовали для расчета противовирусного эффекта соединений и цитотоксичности против инфицированных вирусом клеток. Для анализа данных использовали программное обеспечение GraphPad Prism, и рассчитывали показатель ингибирования ЦПД, и показатель выживаемости клеток. Значения ЕС50 и СС50 получали методом аппроксимации кривых.
[00560] Показатель выживаемости клеток=Показатель ингибирования ЦПД=[(оптическая плотность в лунке с дозой соединения - оптическая плотность в лунке контроля вируса)/ (оптическая плотность в лунке контроля клеток - оптическая плотность в лунке контроля вируса)] × 100%
[00561] Показатель выживаемости клеток=[(оптическая плотность в лунке с дозой соединения - оптическая плотность в лунке контроля среды) / (оптическая плотность в лунке контроля клеток - оптическая плотность в лунке контроля среды)] × 100%
[00562] В Таблице 2 показана ингибирующая активность соединений по изобретению против вируса гриппа (A/Weiss/43(H1N1))

[00563] Результаты анализа показывают хорошую активность соединений по изобретению против вируса гриппа.
Пример В: Фармакокинетическая оценка после введения определенного количества соединения по изобретению внутривенно или перорально крысам, собакам или обезьянам
[00564] Выполнена оценка фармакокинетических характеристик соединений по изобретению и контрольного соединения VX-787 (также известного, как соединение JNJ-872, структура которого показана ниже) у крыс SD собак и обезьян. Соединения, предложенные в настоящем изобретении, вводили в форме физиологического раствора, содержащего 5% DMSO, 5% Kolliphor HS 15 и 90% физиологического раствора. При внутривенном (в/в) введении животным вводили дозу 1 мг/кг, и получали образцы крови (0,3 мл) через 0,083, 0,25, 0,5, 1,0, 2,0, 5,0, 7,0 и 24 ч после введения лекарственного препарата, затем из каждого образца отделяли плазму путем центрифугирования при скорости вращения 3000 об/мин или 4000 об/мин в течение 10 минут. При пероральном введении (п/о) животным вводили дозу 5 мг/кг, и получали образцы крови (0,3 мл) через 0,25, 0,5, 1,0, 2,0, 5,0, 7,0 и 24 ч после введения лекарственного препарата, затем из каждого образца отделяли плазму путем центрифугирования при скорости вращения 3000 об/мин или 4000 об/мин в течение 10 минут. Образцы плазмы хранили при -20°C или -70°C до проведения анализа методом ЖХ/МС/МС.

Анализ показал высокий уровень воздействия и хорошее всасывание соединений по изобретению у животных in vivo, и значимые преимущества фармакокинетических свойств соединений по изобретению.
[00565] В Таблице 3 показаны фармакокинетические данные соединения по изобретения, полученные in vivo после введения крысе SD


Примечания: Контрольное соединение - (+/-)-транс-3-((5-фтор-2-(5-фтор-1H-пирроло[2,3-b]пиридин-3-ил)пиримидин-4-ил)амино)бицикло[2,2,2]октан-2-карбоновая кислота (Методика синтеза описана в патенте WO 2010148197);
AUCпосл - AUC от до 24 ч;
AUC∞ - AUC от 0 до бесконечности.
[00566] Из Таблицы 3 видно, что значения Cmax, AUCпосл и AUC∞, полученные для соединений по изобретению крысе SD, были выше, чем соответствующие значения, полученные для соединения VX-787, как после внутривенного, так и после перорального введения. Это указывает на то, что соединения по изобретению характеризуются боеле высоким уровнем воздействия и хорошим всасыванием у крысы SD, и что фармакокинетические свойства соединений по изобретению значимо лучше свойств контрольного соединения VX-787.
[00567] Ссылки на «вариант осуществления изобретения», «некоторые варианты осуществления изобретения», «один вариант осуществления изобретения», «другой Пример», «определенные Примеры» или «некоторые Примеры» в тексте настоящего описания изобретения означают, что определенное свойство, структура, материал или характеристика, описанные в связи с вариантом осуществления или примером изобретения, включены, по меньшей мере, в один вариант осуществления или пример настоящего изобретения. Таким образом, присутствие фраз, таких как «В некоторых вариантах осуществления изобретения», «В одном варианте осуществления изобретения», «в варианте осуществления изобретения», «в другом Примере», «в Примере», «в определенных Примерах», или «в некоторых Примерах» в разных местах настоящего описания изобретения, не обязательно относятся к тому же самому варианту осуществления или Примеру настоящего изобретения. Кроме того, частные свойства, структуры, материалы или характеристики могут сочетаться любым подходящим образом в одном или нескольких вариантах осуществления или Примерах изобретения.
[00568] Хотя в документы показаны и описаны разъясняющие варианты осуществления изобретения, специалистам в данной области техники должно быть понятно, что вышеперечисленные варианты осуществления изобретения не следует истолковывать, как ограничивающие настоящее изобретение, и возможны изменения, альтернативы и модификации вариантов осуществления изобретения без отступления от существа, принципов и объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| ИНГИБИТОРЫ HPK1 И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2839132C2 |
| ТРИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ЯНУС-КИНАЗЫ 1, ИХ КОМПОЗИЦИИ, СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2824349C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| МОДУЛЯТОРЫ ИНТЕГРИРОВАННОГО СИГНАЛЬНОГО ПУТИ СТРЕССА | 2017 |
|
RU2769327C2 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| Имидазопирролопиразиновые производные, полезные для лечения заболеваний, вызванных аномальной активностью протеинкиназ Jak1, Jak3 или Syk | 2010 |
|
RU2711869C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-3Н-ПИРАЗОЛО[3,4-D]ПИРИМИДИН-3-ОНЫ | 2019 |
|
RU2812726C2 |
| ПРОИЗВОДНЫЕ 5-(7Н-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)-5-АЗАСПИРО[2.5]ОКТАН-8-КАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ НОВЫХ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2018 |
|
RU2761626C2 |
Изобретение относится к соединению формулы (I), или его стереоизомеру, или его фармацевтически приемлемой соли, которые обладают активностью в отношении РНК-полимеразы вируса гриппа. В формуле (I) каждый R1 и R3 независимо представляет собой Н, F, Cl, Br, C1-6 алкил или С6 арил и где С6 арил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, независимо выбранными из F, Cl или Br; n равен 0, 1, 2 или 3; каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-12 карбоциклил, С6 арил или от 5- до 14-членный гетероарил, включающий от 1 до 4 гетероатомов, независимо выбранных из N, О и S, или два соседних R2 совместно с атомами, с которыми они связаны, образуют С5-8 карбоциклическое кольцо, С6 ароматическое кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, и где каждый из С2-6 алкинила, С6 арила, от 5- до 14-членного гетероарила, С6 ароматического кольца и от 5- до 6-членного гетероароматического кольца независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой С6 арил; при условии, что, когда m равен 1, R2 не является F и, когда m равен 2, два из R2 не являются F одновременно; каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, RbO-C1-4 алкилен, С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С6 арил, С6-10 арил-С1-4 алкилен или 6-членный гетероциклил, включающий от 1 до 2 гетероатомов, независимо выбранных из N, О и S, где Rb представляет собой Н, С1-6 алкил или С6 арил; m равен 1 или 2; X имеет одну из подформул (X-2), (X-3) и (X-5), где R4 представляет собой Н; каждый R5 и R6 независимо представляют собой Н или С1-6 алкил; W представляет собой С6-8 моно- или бикарбоциклическую систему; каждый V и V' независимо представляют собой С5-8 циклоалкановое кольцо, от 5- до 6-членное гетероциклическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N и S; каждый Rw независимо представляет собой -C(=O)ORb, -NRcRd или C1-6 алкил, где каждый Rb, Rc и Rd независимо представляет собой Н, С1-6 алкил или С6 арил; s равен 0 или 1; t равен 0; р равен 1. Изобретение также относится к фармацевтической композиции для применения в ингибировании РНК-полимеразы вируса гриппа, содержащей эффективное количество указанного соединения и опционально дополнительно содержащей фармацевтически приемлемый наполнитель, адъювант, носитель или их комбинацию. 4 н. и 14 з.п. ф-лы, 3 табл., 80 пр.
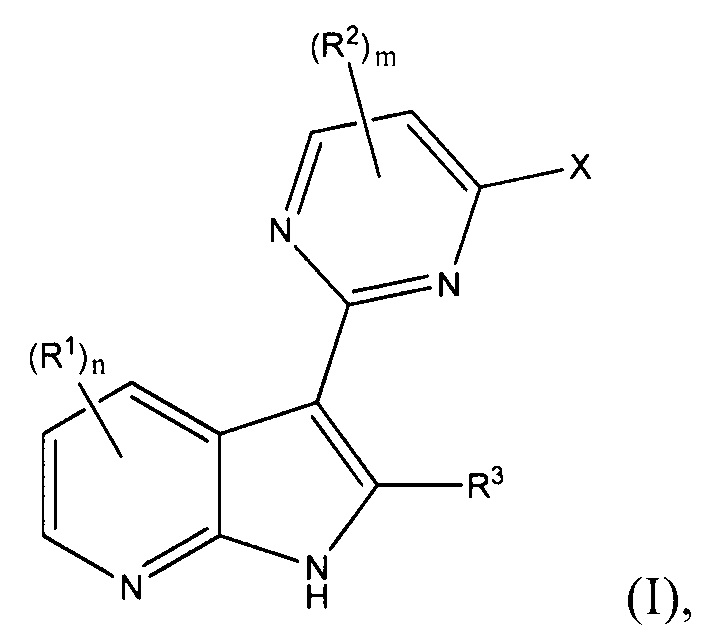

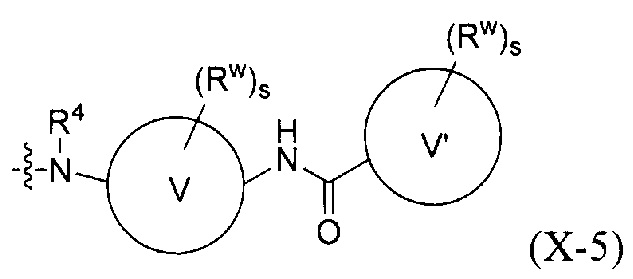
1. Соединение по формуле (I), или его стереоизомер, или фармацевтически приемлемая соль

где каждый R1 и R3 независимо представляет собой Н, F, Cl, Br, C1-6 алкил или С6 арил и где С6 арил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, независимо выбранными из F, Cl или Br;
n равен 0, 1, 2 или 3;
каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-12 карбоциклил, С6 арил или от 5- до 14-членный гетероарил, включающий от 1 до 4 гетероатомов, независимо выбранных из N, О и S, или два соседних R2 совместно с атомами, с которыми они связаны, образуют С5-8 карбоциклическое кольцо, С6 ароматическое кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, и где каждый из С2-6 алкинила, С6 арила, от 5- до 14-членного гетероарила, С6 ароматического кольца и от 5- до 6-членного гетероароматического кольца независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой С6 арил;
при условии, что, когда m равен 1, R2 не является F и, когда m равен 2, два из R2 не являются F одновременно;
каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, RbO-C1-4 алкилен, С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С6 арил, С6-10 арил-С1-4 алкилен или 6-членный гетероциклил, включающий от 1 до 2 гетероатомов, независимо выбранных из N, О и S; где Rb представляет собой Н, С1-6 алкил или С6 арил;
m равен 1 или 2;
X имеет одну из следующих подформул:
 или
или 
где R4 представляет собой Н;
каждый R5 и R6 независимо представляет собой Н или С1-6 алкил;
W представляет собой С6-8 моно- или бикарбоциклическую систему;
каждый V и V' независимо представляет собой С5-8 циклоалкановое кольцо, от 5- до 6-членное гетероциклическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N и S;
каждый Rw независимо представляет собой -C(=O)ORb, -NRcRd или C1-6 алкил, где каждый Rb, Rc и Rd независимо представляет собой Н, С1-6 алкил или С6 арил;
s равен 0 или 1;
t равен 0;
р равен 1.
2. Соединение по п. 1 с формулой (II)

где А представляет собой С5-8 карбоциклическое кольцо, С6 ароматическое кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S; и
q равен 0, 1, 2, 3, 4 или 5.
3. Соединение по п. 1 или 2, где каждый R1 и R3 независимо представляет собой Н, F, Cl, С1-3 алкил или фенил и где фенил независимо не замещен или замещен одним, двумя, тремя или четырьмя заместителями, независимо выбранными из F или Cl.
4. Соединение по п. 1, где каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-6 карбоциклил, фенил или от 5- до 6-членный гетероарил, включающий от 1 до 4 гетероатомов, независимо выбранных из N, О и S; или два соседних R2 совместно с атомами, с которыми они связаны, образуют С5-6 карбоциклическое кольцо, бензольное кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О, и S, и где каждый из С2-6 алкинила, фенила, от 5- до 6-членного гетероарила, бензольного кольца и от 5- до 6-членного гетероароматического кольца независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой С6 арил; при условии, что, когда m равен 1, R2 не является F и, когда m равен 2, два из R2 не являются F одновременно.
5. Соединение по п. 1 или 2, где каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, С1-9 алкил, C1-3 галоалкил, С3-6 циклоалкил, фенил, фенил-С1-2 алкилен или 6-членный гетероциклил, включающий от 1 до 2 гетероатомов, независимо выбранных из N, О и S, где Rb независимо представляет собой Н, C1-6 алкил или С6 арил.
6. Соединение по п. 1 или 2, где каждый R2 независимо представляет собой F, С2-6 алкинил, ORb, С3-12 карбоциклил, С6 арил или от 5- до 14-членный гетероарил, включающий от 1 до 4 гетероатомов, независимо выбранных из N, О и S; или два смежных R2 вместе с атомами, к которым они прикреплены, образуют С5-8 карбоциклическое кольцо, С6 ароматическое кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, и где каждый С2-6 алкинил, С6 арил, от 5- до 14-членный гетероарил, С6 ароматическое кольцо и от 5- до 6-членное гетероароматическое кольцо является независимо незамещенным или замещенным одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой фенил; при условии, что, когда m равен 1, R2 не является F и, когда m равен 2, два R2 не являются F одновременно;
каждый R' независимо представляет собой F, Cl, Br, CN, NO2, ORb, RbO-C1-4 алкилен, С1-10 алкил, C1-6 галоалкил, С3-6 циклоалкил, С6 арил, С6-10 арил-С1-4 алкилен или 6-членый гетероциклил, включающий от 1 до 2 гетероатомов, независимо выбранных из N, О и S, где Rb независимо представляет собой Н, метил, этил, i-пропил, n-пропил, n-бутил, t-бутил или фенил;
каждый Rw независимо представляет собой -C(=O)ORb, -NRcRd или C1-6 алкил, где каждый Rb, Rc и Rd независимо представляет собой Н, метил, этил, i-пропил, n-пропил, n-бутил, t-бутил или фенил.
7. Соединение по п. 1 или 2, где X имеет одну из следующих подформул:
 или
или 
где W представляет собой С6-8 моно- или бикарбоциклическую систему;
каждый V и V' независимо представляет собой С5-8 циклоалкановое кольцо, 5-6-членное гетероциклическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N и S;
каждый Rw независимо представляет собой -C(=O)ORb, -NRcRd, метил, этил, i-пропил, n-пропил, n-бутил или t-бутил, где каждый Rb, Rc, Rd независимо представляет собой Н, C1-6 алкил или С6-10 арил.
8. Соединение по п. 2, где А представляет собой С5-6 карбоциклическое кольцо, бензольное кольцо или от 5- до 6-членное гетероароматическое кольцо, включающее от 1 до 4 гетероатомов, независимо выбранных из N, О и S.
9. Соединение по п. 1, где каждый R2 независимо представляет собой F, этинил, пропинил, ORb, С3-6 карбоциклил, фенил, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокситинил,  или
или  и где каждый этинил, пропинил, фенил, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокситинил,
и где каждый этинил, пропинил, фенил, фурил, бензофурил, пирролил, пиридил, пиразолил, имидазолил, бензимидазолил, триазолил, тетразолил, оксазолил, оксадиазолил, 1,3,5-триазинил, тиазолил, тиенил, бензотиенил, пиразинил, пиридазинил, пиримидил, индолил, пуринил, хинолил, изохинолил, фенокситинил,  и
и  независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой С6 арил;
независимо не замещен или замещен одним, двумя, тремя, четырьмя или пятью R', где Rb представляет собой С6 арил;
при условии, что, когда m равен 1, R2 не является F и, когда m равен 2, два из R2 не являются F одновременно.
10. Соединение по п. 7, где X имеет одну из следующих подформул:
 или
или 
11. Соединение по п. 2, где А представляет собой С5-6 карбоциклическое кольцо, бензол, фуран, бензофуран, пиррол, пиридин, пиразол, имидазол, бензоимидазол, триазол, тетразол, оксазол, оксадиазол, 1,3,5-триазин, тиазол, тиофен, бензотифен, пиразин, пиридазин, пиримидин, индол, пурин, хинолин или изохинолин.
12. Соединение по п. 7, имеющее формулу (III), (IV), (V), (VI), (VII) или (VIII),
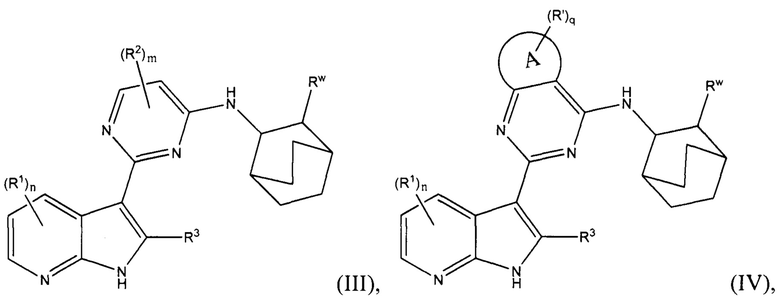



13. Соединение по п. 1, имеющее одну из следующих структур:



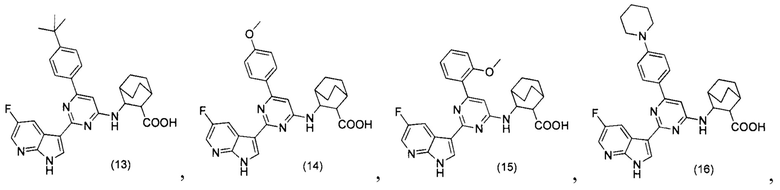

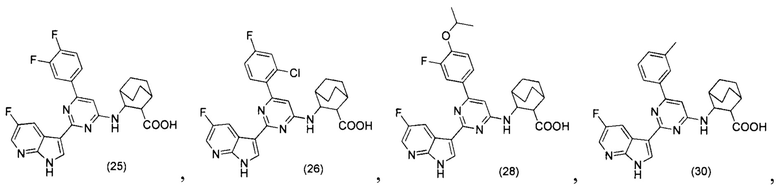



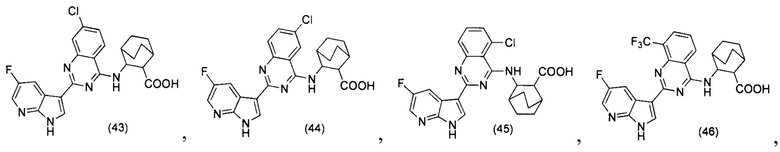
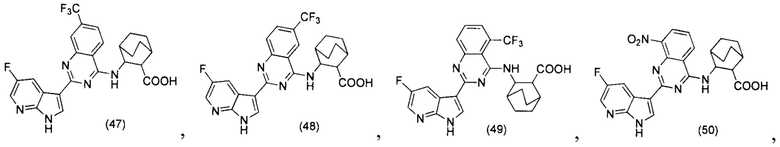


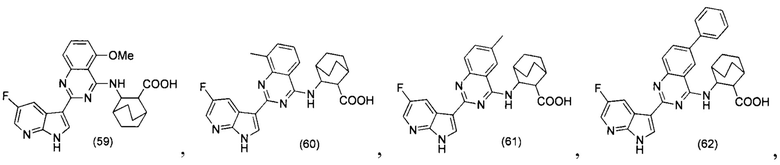

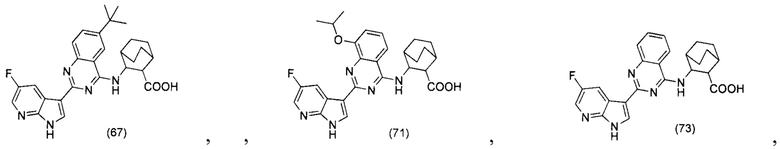
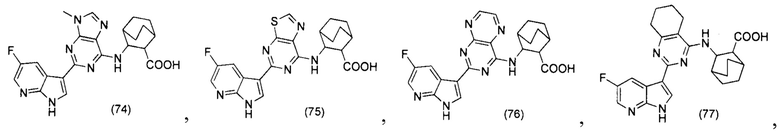










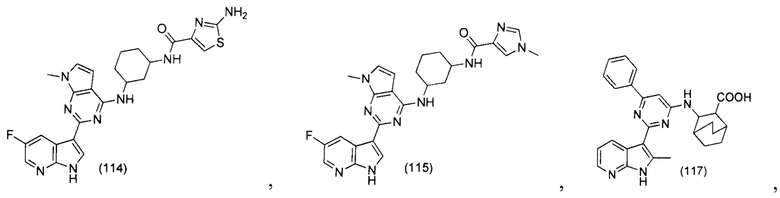

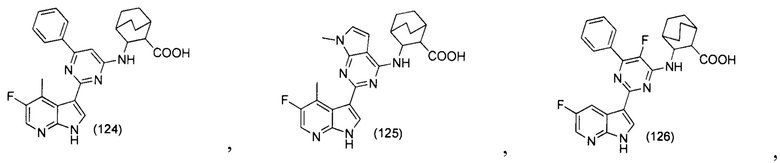


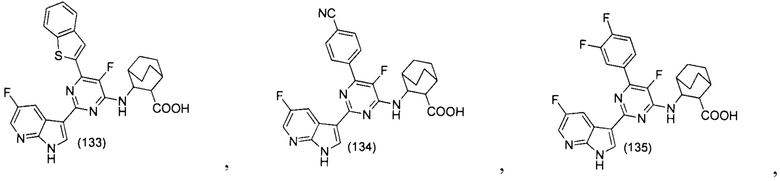






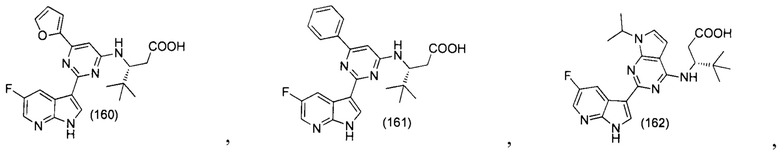


 или
или 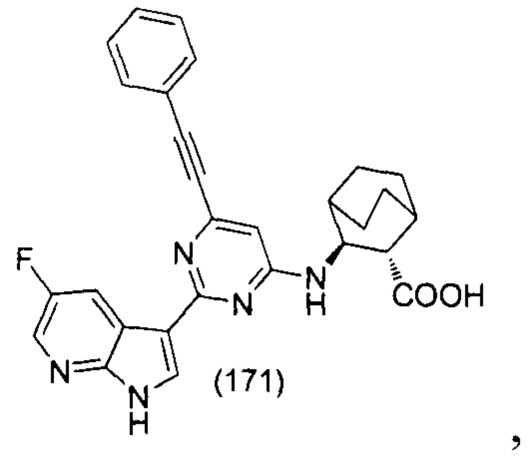
или его стереоизомер, или фармацевтически приемлемая соль.
14. Фармацевтическая композиция для применения в ингибировании РНК-полимеразы вируса гриппа, содержащая эффективное количество соединения по любому из пп. 1-13, опционально дополнительно содержащая фармацевтически приемлемый наполнитель, адъювант, носитель или их комбинацию.
15. Соединение по любому из пп. 1-13 для использования при профилактике, контроле, лечении или уменьшении тяжести нарушения или заболевания, вызванного вирусной инфекцией, где вирусной инфекцией является вирусная инфекция гриппа.
16. Соединение по любому из пп. 1-13 для использования с целью ингибирования РНК-полимеразы вируса гриппа.
17. Фармацевтическая композиция по п. 14 для использования при профилактике, контроле, лечении или уменьшении тяжести нарушения или заболевания, вызванного вирусной инфекцией, где вирусной инфекцией является вирусная инфекция гриппа.
18. Фармацевтическая композиция по п. 14 для использования при ингибировании РНК-полимеразы вируса гриппа.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| J | |||
| BOYD et al., Isosteric replacements of the carboxylic acid of drug candidate VX-787: Effect of charge on antiviral potency and kinase activity of azaindole-based influenza PB2 inhibitors, BIOORG | |||
| MED | |||
| CHEM | |||
| LETT., 2015, V.25, p | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| RU | |||
Авторы
Даты
2020-11-25—Публикация
2016-12-08—Подача