Изобретение относится к области аналитической химии, конкретно к способам электрохимического определения иридия.
Известен способ определения иридия при его электрохимическом (амперометрическом) определении, заключающийся в том, что в известном способе навеску исходного материала плавят с пероксидом натрия, плав выщелачивают в растворе соляной кислоты, затем раствор помещают в электролитическую ячейку, на электроды которой подают электрический заряд, при этом иридий (IV) восстанавливается до иридия (III), после чего количество иридия (П1) определяют титрованием неорганическим окислителем. (О.А.Сонгина, В.А.Захаров. Амперометрическое титрование. М.: Химия, 1979, с.173),
Недостатком указанного способа является неполное окисление иридия (III) неорганическим окислителем, что подтверждено результатами количественного химического определения иридия, полученными в условиях повторяемости.
Наиболее близким по технической сущности и достигаемому техническому результату является способ определения иридия, включающий окисление иридия (III) кипячением с каким-либо окислителем (Гинзбург С.И. и др. Аналитическая химия платиновых металлов. М.: Наука, 1972, с.224, 227). Навеску материала, содержащего иридий, переводят в раствор тем или иным способом, затем иридий окисляют каким-либо окислителем, например хлорной водой, азотной кислотой, перекисью водорода в растворе разбавленной соляной кислоты, полученный раствор иридия (IV) титруют солью Мора.
Недостатком описанного способа является неполное окисление иридия (III), что подтверждено результатами электрохимического определения иридия, полученными в условиях повторяемости.
Задача изобретения заключается в установлении условий количественного окисления иридия (III) до состояния иридий (IV), что позволит исключить его потери при выполнении количественного химического анализа.
Технический результат от использования изобретения заключается в обеспечении полного окисления иридия (III) до состояния (IV), чем исключаются его потери при выполнении количественного химического анализа.
Сущность изобретения заключается в том, что в способе определения иридия в растворе хлоридных комплексов, включающем растворение материала, содержащего иридий, окисление иридия (III) до иридия (IV) при повышенной температуре с последующим охлаждением и электрохимическим титрованием иридия (IV), согласно изобретению окисление иридия (III) до иридия (IV) осуществляют в автоклаве при повышенном давлении и обработке полем СВЧ в условиях полного окисления атомарным хлором, образующимся при взаимодействии солей или оксидов металлов с соляной кислотой.
Материалы, содержащие иридий, как правило, плавят с пероксидом натрия, плав растворяют в разбавленной соляной кислоте. При этом гидратированный оксид иридия (IV) растворяется с образованием хлоридного комплекса [IrCl6]2-. При нейтрализации раствора и неизбежном разогревании реакционной смеси от 10% до 50% иридия (IV) восстанавливается, вероятно, по реакции:
4Na2[IrCl6]+2Н2O=4Na3[IrCl6]+O2↑
(Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. Химические свойства неорганических веществ. М.: КолосС, 2003, с.453). Вследствие этого в водных растворах комплексные соединения иридия присутствуют в формах иридий (III) и иридий (IV). Наличие двух форм иридия вносит погрешность в результаты количественного химического анализа вследствие нарушения стехиометрии химических реакций.
Вследствие того, что иридий (III) очень трудно количественно окисляется до иридия (IV), окисление иридия (III), описанное в заявленном способе, происходит сильным окислителем - атомарным хлором, образующимся непосредственно в растворе, в условиях повышенных температуры и давления при обработке полем СВЧ.
Известно, что атомарный хлор может быть получен непосредственно в зоне реакции взаимодействием солей или оксидов металлов с соляной кислотой, а его избыток легко удаляется из реакционной смеси.
4HCl+MnO2=MnCl2+2Н2O+Cl2↑
4HCl+PbO2=PbCl2+2Н2O+Cl2↑
16HCl+2КMnO4=2 MnCl2+5Cl2↑+8 Н2O+2KCl
14HCl+К2Cr2O7=CrCl3+3Cl2↑+7Н2O+2KCl
4HCl+Са(ClO)2=2Cl2↑+CaCl2+2Н2O
6HCl+KclO3=3Cl2↑+KCl+3Н2O
(Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. Химические свойства неорганических веществ. М.: КолосС, 2003, с.255).
Установлено, что иридий (III) окисляется хлором (образующимся взаимодействием солей или оксидов металлов с соляной кислотой) в нормальных условиях не полностью, вероятно, из-за того, что выделение газообразного хлора из реакционной смеси происходит до полного окисление иридия (III). Для полного окисления иридия (III) необходимо создать условия повышенных температуры и давления. Для этого раствор помещают в герметичный пластиковый автоклав, вносят компоненты для образования газообразного хлора, раствор обрабатывают полем СВЧ, т.к. известно, что применение поля СВЧ существенно ускоряет процесс разложения материалов (Л.В.Джесси и др. Пробоподготовка в микроволновых печах. М.: Мир, 1991, с.7-10).
Экспериментально установлено, что полное окисление иридия (III) до иридия (IV) происходит при условиях:
Указанные условия протекания реакции окисления являются достаточно «жесткими» и обеспечивают полное окисление иридия (III), что подтверждают результаты электрохимического определения иридия, полученные в условиях повторяемости.
Соответствие изобретения критерию «изобретательский уровень» доказывается следующим образом.
Известен способ окисления иридия (III) в токе хлора при температуре 400-500°С по реакции:

(Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. Химические свойства неорганических веществ. М.: КолосС, 2003, с.453). Однако реализация подобного способа в лабораторных условиях весьма проблематична из-за сложности аппаратурного оформления и проблем утилизации непрерывного потока газообразного хлора.
В заявленном способе используют достоинства известных способов, проводя операцию получения газообразного хлора в анализируемом растворе, для чего соль или оксид металла вносят в раствор, содержащий соляную кислоту, затем раствор обрабатывают в автоклаве полем СВЧ.
Установлено, что для окисления 20-100 мг иридия (III) в указанных условиях необходимо 25-30 мг хлора, для получения которого в раствор соляной кислоты вносят 0,80 см3 3% раствора соли. При этом в растворе всегда остается небольшой избыток окислителя (хлора), что гарантирует полноту окисления.
При использовании 0,7 см3 раствора соли возможно неполное окисление иридия (III), что подтверждают результаты электрохимического определения иридия, полученные в условиях повторяемости.
При использовании 0,9 см3 раствора соли иридий (III) окисляется полностью, но для разрушения большего избытка окислителя необходимо дополнительное количество восстановителя - соли Мора, что увеличивает время установления конечной точки титрования и расход титранта.
Таким образом, использование комбинации известных способов и нового приема обеспечивают новый результат - полное окисление иридия (III) в растворе, что позволяет определять его электрохимическим методом с высокими метрологическими характеристиками.
Способ определения иридия осуществляли следующим образом.
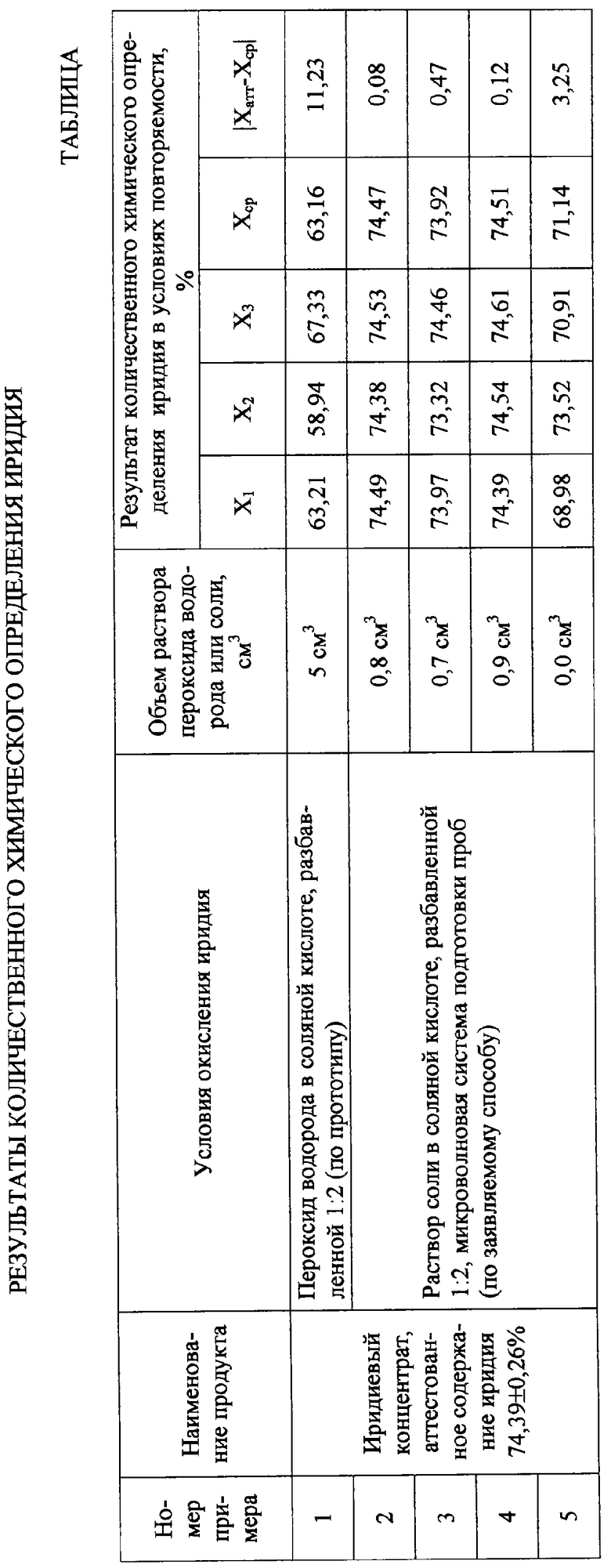
Пример 1 (прототип). Навеску иридиевого концентрата массой 0,1000 г плавили с пероксидом натрия, растворили плав в соляной кислоте, разбавленной 1:2, охладили раствор, перенесли его в мерную колбу вместимостью 100 см3. Аликвотную часть раствора объемом 15 см3 поместили в стакан, прилили 5 см3 пероксида водорода, кипятили несколько минут, охладили и электрохимически титровали иридий (IV) раствором соли Мора. Избыток окислителя титровали отдельным скачком. Результат определения иридия приведен в таблице 1.
Пример 2 (заявляемый способ). Навеску иридиевого концентрата массой 0,2200-0,2400 г плавили с пероксидом натрия, растворили плав в соляной кислоте, разбавленной 1:2, раствор перенесли в автоклав микроволновой системы подготовки проб, прилили 0,8 см3 3% раствора соли, обработали полем СВЧ в соответствии с инструкцией по эксплуатации системы. После охлаждения электрохимически титровали иридий (IV) раствором соли Мора. Избыток окислителя титровали отдельным скачком.
Пример 3, аналогичный примеру 2, но отличающийся тем, что для окисления иридия (III) использовали 0,7 см3 3% раствора соли.
Пример 4, аналогичный примеру 2, но отличающийся тем, что для окисления иридия использовали 0,9 см3 3% раствора соли.
Пример 5, аналогичный примеру 2, но отличающийся тем, что обработку раствора иридия (III) в автоклаве полем СВЧ проводили без добавления раствора соли
Как видно из таблицы примеров:
- по способу-прототипу (пример 1) окисление иридия (III) неполное, что подтверждают результаты количественного электрохимического анализа иридиевого концентрата, полученные в условиях повторяемости;
- при соблюдении заявляемых условий (пример 2) обеспечивается полное окисление иридия (III), что подтверждают результаты электрохимического определения иридия в иридиевом концентрате, полученные в условиях повторяемости;
- при окислении иридия (III) меньшим объемом соли (пример 3) возможно неполное окисление иридия (III), что подтверждают результаты электрохимического определения иридия в иридиевом концентрате, полученные в условиях повторяемости;
- при окислении иридия (III) большим объемом соли (пример 4) в растворе остается чрезмерный избыток растворенного хлора, на реакцию с которым расходуется дополнительный объем раствора соли Мора, а также увеличивается время установления конечной точки титрования;
- при обработке раствора полем СВЧ без добавления соли (пример 5) происходит неполное окисление иридия (III), что подтверждают результаты электрохимического определения иридия в иридиевом концентрате, полученные в условиях повторяемости.
Таким образом, совокупность признаков заявляемого способа является оптимальной и характеризуется высокими метрологическими характеристиками, что является следствием количественного окисления 20-100 мг иридия (III).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗВЛЕЧЕНИЯ ИРИДИЯ (III) ИЗ ХЛОРИДНЫХ РАСТВОРОВ | 2014 |
|
RU2550460C1 |
| Способ определения массовой доли урана (III) и урана (IV) при их совместном присутствии в урансодержащих хлоридных расплавах щелочных металлов | 2023 |
|
RU2802629C1 |
| Способ селективного выделения родия Rh, рутения Ru и иридия Ir из солянокислых растворов хлорокомплексов платины Pt(IV), палладия Pd(II), золота Au(III), серебра Ag(I), родия Rh(III), рутения Ru(IV) и иридия Ir(IV) | 2020 |
|
RU2742994C1 |
| Способ переработки маточных растворов аффинажа платины и палладия | 2021 |
|
RU2768070C1 |
| Способ определения иридия | 1981 |
|
SU1000402A1 |
| ПРИМЕНЕНИЕ ИНДИЯ В КАЧЕСТВЕ СТАБИЛИЗАТОРА КАТАЛИТИЧЕСКОЙ СИСТЕМЫ В СПОСОБЕ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 2003 |
|
RU2413714C2 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ | 2004 |
|
RU2336262C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ | 2011 |
|
RU2494159C1 |
| ЭЛЕКТРОЛИТ ДЛЯ ЭЛЕКТРОХИМИЧЕСКОГО ОСАЖДЕНИЯ ИРИДИЯ НА АРСЕНИД ГАЛЛИЯ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2013 |
|
RU2530963C2 |
| Способ кулонометрического определения иридия в промышленных материалах | 1983 |
|
SU1187064A1 |
Изобретение относится к области аналитической химии, конкретно к способам электрохимического определения иридия. Способ определения иридия в растворе хлоридных комплексов включает растворение материала, содержащего иридий, окисление иридия (III) до иридия (IV) при повышенной температуре с последующим охлаждением и электрохимическим титрованием, причем окисление иридия (III) проводят атомарным хлором, образующимся взаимодействием солей или оксидов металлов с соляной кислотой при повышенных температуре и давлении в автоклаве. При этом обработку раствора проводят полем СВЧ. Достигается исключение потерь иридия при проведении анализа за счет обеспечения более полного его окисления. 1 табл.
Способ определения иридия в растворе хлоридных комплексов, включающий растворение материала, содержащего иридий, окисление иридия (III) до иридия (IV) при повышенной температуре с последующим охлаждением и электрохимическим титрованием иридия (IV), отличающийся тем, что окисление иридия (III) до иридия (IV) осуществляют в автоклаве при повышенном давлении и обработке полем СВЧ в условиях полного окисления атомарным хлором, образующимся при взаимодействии солей или оксидов металлов с соляной кислотой.
| ГИНЗБУРГ С.И | |||
| и др | |||
| Аналитическая химия платиновых металлов | |||
| - М.: Наука, 1972, с.224,227 | |||
| Способ кулонометрического определения иридия | 1981 |
|
SU1038870A1 |
| Полярографичский способ определения иридия | 1974 |
|
SU483616A1 |
| Способ определения иридия | 1981 |
|
SU1000402A1 |
| Способ кулонометрического определения иридия в промышленных материалах | 1983 |
|
SU1187064A1 |
| Способ подготовки иридийсодержащих растворов к титрованию | 1986 |
|
SU1394100A1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНГЛЕТНОГО КИСЛОРОДА | 1993 |
|
RU2069931C1 |
| Способ получения -аргинина | 1972 |
|
SU567722A1 |
| Изотермический реактор каталитического дожигания | 1988 |
|
SU1629085A1 |
Авторы
Даты
2007-11-27—Публикация
2006-06-19—Подача