Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированные in vitro рекомбинантные плазмидные ДНК, содержащие полученные генно-инженерными методами искусственные гены легкой и тяжелой цепей полноразмерного человеческого антитела, созданные на основе вариабельных фрагментов легких и тяжелых цепей рекомбинантного антитела 1F4 из фаговой библиотеки одноцепочечных антител человека, и константных генов IgG1 человека, цитомегаловирусного промотора и сайга полиаденилирования BGH, обусловливающих биосинтез в клетках человека НЕК 293 Т рекомбинантных полноразмерных человеческих антител класса IgG1, специфически взаимодействующих с вирусом осповакцины. Константа аффинности для полученных рекомбинантных антител составляет 3,54·109±0,38·109M-1.
В настоящее время отсутствуют средства эффективного лечения ортопоксвирусных инфекций. Единственным способом борьбы с ними является вакцинация вирусом осповакцины. Прививка осповакцины дает достаточно надежную защиту, но сопровождается местной реакцией воспалительно-некротического характера с последующим рубцеванием и выраженной общей реакцией организма (повышенная температура, недомогание, лимфадениты и т.д.) [1, 2]. Кроме того, оспопрививание нередко сопровождается серьезными поствакцинальными осложнениями, вероятность возникновения которых особенно велика среди лиц со сниженным иммунным статусом [1, 3]. Часть поствакцинальных осложнений можно предупредить применением человеческого вакцинного иммуноглобулина [4], но этот препарат дорог и малодоступен, к тому же использование препаратов, полученных из человеческой крови, всегда сопровождается известным биологическим риском. Альтернативу вакцинному иммуноглобулину могли бы составить человеческие моноклональные антитела (МКА), специфические к ортопоксвирусам. Однако гибридомная технология не гарантирует получение стабильных клеточных линий.
Один из современных подходов - конструирование этих МКА из вариабельных специфических доменов IgG человека, отобранных из комбинаторных фаговых библиотек антител человека и константных доменов иммуноглобулина человека. К настоящему времени такие антитела сконструированы против ряда антигенов, включая и вирусные агенты [5, 6, 7].
Опубликованы сведения о получении полноразмерного антитела человека против ортопоксвирусов с константой аффинности около 1·108 М-1 [8, прототип]. Следует отметить, что для использования в лечебной практике необходимо выбирать антитела с как можно более высокой аффинностью. Это позволяет уменьшить терапевтические дозы препарата иммуноглобулинов, что приводит к снижению нежелательного побочного иммунного ответа на вводимый препарат у пациентов.
Технической задачей изобретения является получение двух полипептидов со свойствами полноразмерных легкой и тяжелой цепей иммуноглобулина человека, образующих в клетках млекопитающих антитело класса IgG1, взаимодействующее с вирусом осповакцины, имеющее величину константы аффинности более 1·108M-1.
Поставленная задача решается путем конструирования двух рекомбинантных плазмидных ДНК, одна из которых, pcL37, кодирует синтез полипептида со свойствами легкой цепи полноразмерного моноклонального человеческого антитела, другая, рсН37, - кодирует синтез полипептида со свойствами тяжелой цепи полноразмерного моноклонального человеческого антитела. Совместная трансфекция плазмидами pcL37 и рсН37 клеток человека линии НЕК 293 Т обеспечивает синтез полипептида со свойствами полноразмерного человеческого антитела класса IgG1, специфически взаимодействующего с вирусом осповакцины. Величина константы аффинности для полученного полноразмерного антитела человека 1F4 составляет 3,54·109±0,38·109 М-1.
Транзиентный биосинтез целевых полипептидов обеспечивается наличием в плазмидах pcL37 и рсН37 цитомегаловирусного промотора и сайта полиаденилирования BGH.
Исходным генетическим материалом для конструирования целевых плазмид служат следующие генно-инженерные исходные конструкции:
а) фагмида pHen1F4, содержащая ген одноцепочечного человеческого антитела, взаимодействующего с вирусом осповакцины [9];
б) плазмиды pBVK14a2 и pBVK1-6, содержащие лидерные последовательности соответственно тяжелой и легкой цепей моноклональных мышиных антител МКА F10 [10];
в) плазмида pCIgG1, содержащая ген СН1-СН2-СН3-доменов тяжелой цепи IgG1 человека, клонированный между сайтами Ара I и XhoI [11];
г) плазмида pCkap, содержащая ген каппа-домена легкой цепи IgG человека [11].
Впервые была установлена первичная последовательность вариабельных участков одноцепочечного антитела в фагмиде pHen1F4. С помощью полимеразной цепной реакции (ПЦР) в присутствии соответствующих олигонуклеотидных праймеров осуществлено объединение лидерной последовательности из легкой цепи МКА F10 и каппа-домена легкой цепи IgG человека с вариабельным фрагментом легкой цепи клона 1F4 и аналогичное объединение лидерной последовательности из тяжелой цепи МКА F10 и константных человеческих СН1-СН2-СН3-доменов IgG1 с вариабельной областью тяжелой цепи одноцепочечного антитела 1F4.
Олигонуклеотидные праймеры для конструирования генов легкой и тяжелой цепи антитела человека против вируса осповакцины (в направлении 5′-3′).
1. CCTTCCCTAGGTCGGACTGTGGCTG
2. CTCATGGGTCTTCTGAGCTGACTC
3. CTCAGAAGACCCATGAGCACCAG
4. AAGCTGGCTAGCCACTTCTTAG
5. AAGCTGGCTAGCAGGCAAGG
6. CCTTCGGGCCCTTGGTGGAGGCACTCGAGACGGTGACC
7. CCAAGCACAGGTGCAGCTGGTGGAG
8. CTGCACCTGTGCTTGGGCACTTTG
9. CCATTCAGATCCTCTTCTGA
Сборка гена легкой цепи состоит из следующих этапов:
1. Объединение вариабельной области легкой цепи одноцепочечного антитела 1F4 с лидерной последовательностью легкой цепи мышиных антител F10.
Для этого в первой ступени ПЦР амплифицируют лидерную последовательность, используя в качестве матрицы pBVK1-6 [10] в присутствии праймеров 3 и 5, а также вариабельную область легкой цепи одноцепочечного антитела 1F4, кодируемую плазмидой pHen1F4, в присутствии праймеров 2 и 9. Продукты амплификации после выделения на агарозе объединяют и используют качестве матрицы для второй струпени ПЦР в присутствии праймеров 5 и 9. Полученный фрагмент, содержащий вариабельную область с лидерной последовательностью, обрабатывают эндонуклеазой рестрикции XmaJI.
2. Клонирование гена каппа-домена легкой цепи IgG человека в плазмиду pSK (+) c одновременным введением сайта Xma JI в 5-конец гена.
Ген каппа-домена, клонированный в плазмиду pcDNA3.1, содержит сайт XhoI на 3′-конце. Для его объединения с геном, кодирующим вариабельную область легкой цепи, встроенного в фагмиду pHen1F4, необходимо ввести сайт XmaJI в 5′-конец, так как этим уникальным сайтом заканчивается вариабельная область. Амплификацию проводят в присутствии праймеров 1 и BGH (Invitrogen), продукты амплификации обрабатывают эндонуклеазой рестрикции XhoI и встраивают в плазмиду pSK (+) по сайтам EcoRV и XhoI. В результате получают плазмиду pSKCl.
3. Сборка полноразмерного гена легкой цепи.
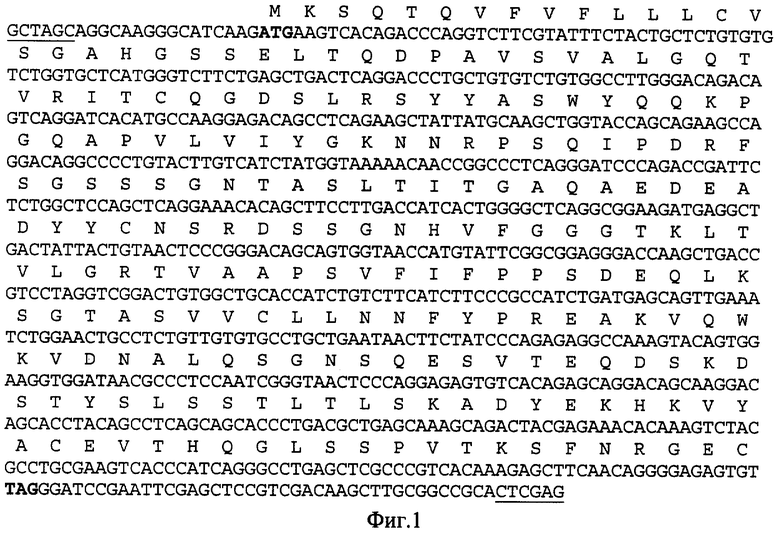
Плазмиду pSKCl обрабатывают рестриктазами SmaI и XmaJI и объединяют в реакции лигирования с фрагментом, полученным в этапе 1. Полученной плазмидой pSKl-l трансформируют клетки E.coli. Скрининг клонов проводят с помощью рестрикционного анализа. Клоны, содержащие полноразмерный ген легкой цепи, анализируют секвенированием. Далее из полученной таким образом промежуточной плазмиды pSKl-l при обработке ее эндонуклеазами рестрикции NheI и XhoI получают фрагмент ДНК, содержащий полноразмерный ген легкой цепи, и встраивают его в экспрессионную плазмиду pcDNA3.1 (+) (Invitrogen), обработанную этими же рестриктазами. Полученную в результате целевую рекомбинантную плазмиду pcL37 анализируют гидролизом эндонуклеазами HaeIII, NheI, XmaJI и XhoI. Нуклеотидная последовательность гена, кодирующего гибридный белок, подтверждалась секвенированием, которое проводят по методике и с использованием набора Cycle ReaderTM DNA Sequencing Kit (Fermentas, Литва) [12]. Нуклеотидная последовательность гена легкой цепи и кодируемая ею аминокислотная последовательность рекомбинантного полипептида приведены на фиг.1.
Рекомбинантная плазмидная ДНК pcL37, кодирующая синтез в клетках млекопитающих полипептида со свойствами легкой цепи полноразмерного моноклонального человеческого антитела, взаимодействующего с вирусом осповакцины, характеризуется следующими признаками:
- имеет молекулярную массу 4,03 МДа и размер 6108 п.о.;
- кодирует гибридный белок, в котором вариабельный домен легкой цепи одноцепочечного антитела человека 1F4 объединен с константным доменом каппа-цепи IgG человека;
- состоит из следующих элементов:
а) NheI/XhoI - векторного фрагмента плазмиды pcDNA3.1(+) (Invitrogen) размером 5338 п.о., содержащего промотор-энхансер CMV, сайт полиаденилирования и участок терминации транскрипции BGH, ген β-лактамазы (bla), ген устойчивости к неомицину;
б) NheI/XhoI - фрагмента промежуточной плазмиды pSKI размером 770 п.о., включающего искусственный ген, кодирующий полипептид со свойствами легкой цепи полноразмерного моноклонального человеческого антитела, взаимодействующего с вирусом осповакцины;
- содержит:
а) цитомегаловирусный (CMV) промотор и энхансер транскрипции;
б) искусственный ген, кодирующий гибридный белок, в котором вариабельный домен легкой цепи одноцепочечного антитела человека 1F4 объединен с константным доменом каппа-цепи IgG человека;
г) уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Bg1II - 12, NheI - 895, XmaJI - 1294, XhoI - 1665.
Сборку гена тяжелой цепи проводят следующим образом:
1. На первом этапе амплифицируют лидерную последовательность тяжелой цепи МКА F10 в присутствии праймеров 8 и 4, а также вариабельную область тяжелой цепи антитела 1F4, используя в качестве матрицы фагмиду pHen1F4, в присутствии праймеров 7 и 6 (Ара) с одновременным введением сайга для эндонуклеазы рестрикции ApaI, который имеется на 5′-конце константной области IgG1. Продукты амплификации анализируют электрофорезом в агарозном геле; полосы нужного размера вырезают, ДНК экстрагируют из геля, объединяют и используют в качестве матрицы для второй ступени ПЦР в присутствии праймеров 4 и 6. Полученный фрагмент, содержащий вариабельную область с лидерной последовательностью, обрабатывают эндонуклеазами рестрикции NheI и ApaI, очищают электрофорезом в агарозном геле и после выделения из агарозного геля используют в дальнейшей реакции лигирования.
2. Полноразмерный ген тяжелой цепи получают трехкомпонентным лигированием фрагмента, полученного на предыдущем этапе, с ApaI-XhoI-фрагментом плазмиды pCIgG1, содержащим ген, кодирующий СН1-СН2-СН3-домены IgG1 человека, ограниченным сайтами ApaI и XhoI, с векторной частью плазмиды pcDNA3.1, обработанной эндонуклеазами рестрикции NheI и XhoI.
Полученную целевую рекомбинантную плазмиду рсН37 анализируют гидролизом эндонуклеазами рестрикции HaeIII, NheI, ApaI и XhoI. Структуру гена, кодирующего гибридный белок, подтверждают секвенированием, которое проводят по методике и с использованием набора Cycle ReaderTM DNA Sequencing Kit (Fermentas, Литва). Нуклеотидная последовательность гена тяжелой цепи и кодируемая ею аминокислотная последовательность рекомбинантного полипептида приведены на фиг.2.
Рекомбинантная плазмидная ДНК рсН37, кодирующая синтез в клетках млекопитающих полипептида со свойствами тяжелой цепи полноразмерного моноклонального человеческого антитела, взаимодействующего с вирусом осповакцины, характеризуется следующими признаками:
- имеет молекулярную массу 4,57 МДа и размер 6911 п.о.;
- кодирует гибридный белок, в котором вариабельный домен тяжелой цепи одноцепочечного антитела человека 1F4 объединен с константным доменом тяжелой цепи IgG человека;
- состоит из следующих элементов:
а) NheI/XhoI - векторного фрагмента плазмиды pcDNA3.1 (+) (Invitrogen) размером 5338 п.о., содержащего промотор-энхансер CMV, сайт полиаденилирования и участок терминации транскрипции BGH, ген β-лактамазы (bla), ген устойчивости к неомицину;
б) ApaI/XhoI - фрагмента промежуточной плазмиды pCIgG1 размером 1126 п.о., включающего ген CH1-CH2-CH3-доменов IgG1 человека;
в) NheI/ApaI - фрагмента размером 447 п.о., полученного в результате амплификации и кодирующего лидерную последовательность тяжелой цепи антитела F10 и вариабельную область тяжелой цепи антитела 1F4;
- содержит:
а) цитомегаловирусный (CMV) промотор и энхансер транскрипции;
б) искусственный ген, кодирующий гибридный белок, в котором вариабельный домен тяжелой цепи одноцепочечного антитела человека 1F4 объединен с константным доменом IgG1 человека;
- в качестве генетических маркеров ген β-лактамазы (bla), определяющий устойчивость трансформированных плазмидой pсН37 клеток бактерий к ампициллину, и ген устойчивости к неомицину для селекции трансфецированных плазмидой pсН37 клеток млекопитающих;
- уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Bg1II - 12, NheI - 895, ApaI - 1338, XhoI - 1320 и 2468.
Сущность изобретения заключается в следующем:
- Генно-инженерными методами получены плазмиды pсL37 и pсH37, кодирующие искусственные гены легкой и тяжелой цепей полноразмерного антитела человека, созданные на основе вариабельных фрагментов легких и тяжелых цепей одноцепочечного антитела человека 1F4, константных генов IgG1 человека, цитомегаловирусного промотора и сайта полиаденилирования BGH4.
- Сконструированные гены обусловливают биосинтез в клетках млекопитающих полипептидов со свойствами легкой и тяжелой цепей антитела человека, которые объединяются в антитело класса IgG1, направленное против вируса осповакцины.
Для получения рекомбинантных полипептидов со свойствами полноразмерных легкой и тяжелой цепей иммуноглобулина человека, образующих антитело класса IgG1, взаимодействующее с вирусом осповакцины, плазмидами pcL37 и рсН37, трансфецируют НЕК 293Т клетки человека с последующим выделением методом аффинной хроматографии на колонке с носителем Protein G Sepharose (Amersham) целевого белка. Специфичность полученного полноразмерного антитела человека была продемонстрирована методом иммуноблот анализа белков вируса осповакцины (см. пример 5). Аффинность полученного антитела в реакции связывания с вирусом осповакцины определена методом ИФА и имеет величину константы 3,54·109±0,38·109 М-1, что в 30 раз выше, чем в прототипе (см. пример 6).
Изобретение иллюстрируется следующими фигурами:
Фиг.1. Нуклеотидная последовательности и кодируемая ею аминокислотная последовательность NheI/XhoI-фрагмента плазмиды pcL37, кодирующая полипептид со свойствами легкой цепи антитела человека против вируса осповакцины. Подчеркнуты сайты узнавания эндонуклеаз рестрикции. Инициирующий и терминирующий кодоны выделены жирным шрифтом.
Фиг.2. Нуклеотидная последовательность и кодируемая ею аминокислотная последовательность NheI/XhoI-фрагмента плазмиды рсН37, кодирующая полипептид со свойствами тяжелой цепи антитела человека против вируса осповакцины. Подчеркнуты сайты узнавания эндонуклеаз рестрикции. Инициирующий и терминирующий кодоны выделены жирным шрифтом.
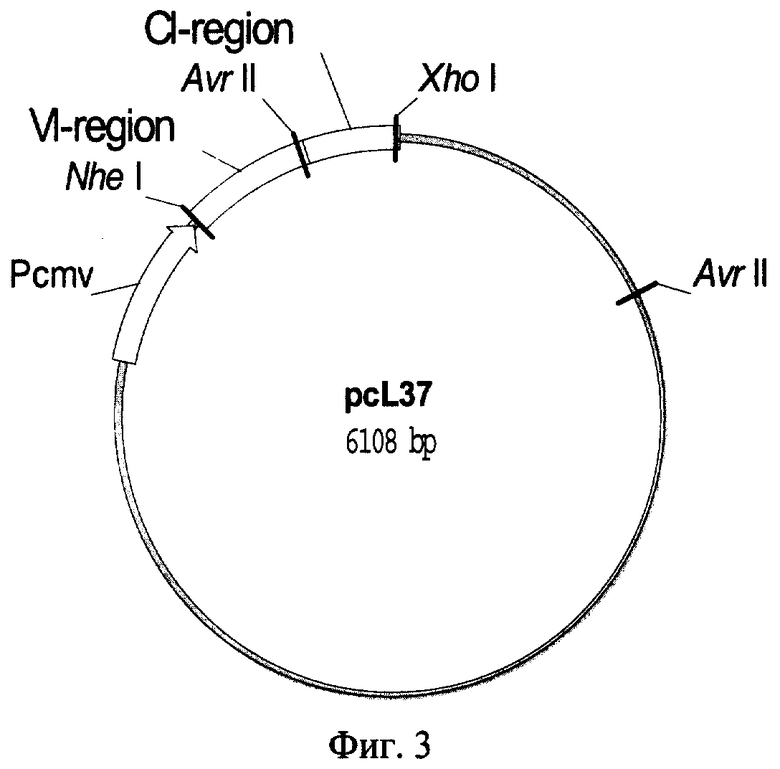
Фиг.3. Физическая карта плазмиды pcL37. Указаны сайты узнавания эндонуклеаз рестрикции. Pcmv - цитомегаловирусный промотор; S - сигнальная последовательность; Vl, k - вариабельный и константный участки гена легкой цепи рекомбинантного антитела; BGHpA - сайт полиаденилирования бычьего гормона роста.
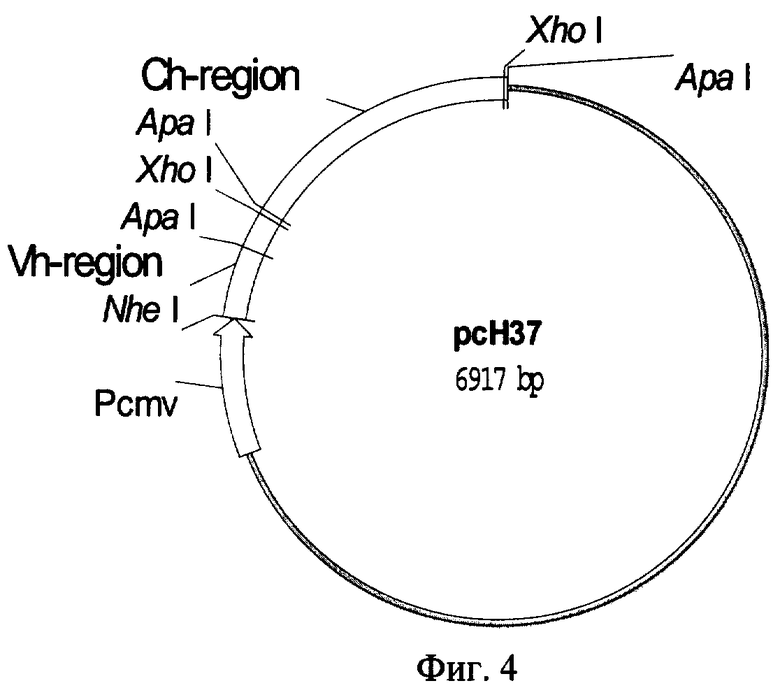
Фиг.4. Физическая карта плазмиды рсН37. Указаны сайты эндонуклеаз рестрикции. Pcmv - цитомегаловирусный промотор; S - сигнальная последовательность; Vh, const. - вариабельный и константный участки гена тяжелой цепи рекомбинантного антитела; BGHpA - сайт полиаденилирования бычьего гормона роста.
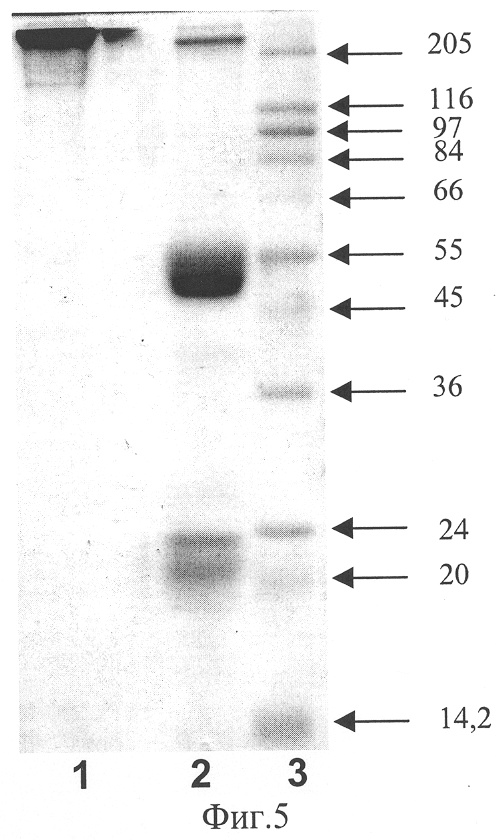
Фиг.5. Электрофореграмма очищенного целевого антитела в 13% полиакриламидном геле. Дорожки: 1 - полноразмерное антитело 1F4, не обработанное 2-меркаптоэтанолом; 2 - полноразмерное антитело 1F4, обработанное 2-меркаптоэтанолом; 3 - стандарты молекулярных масс.
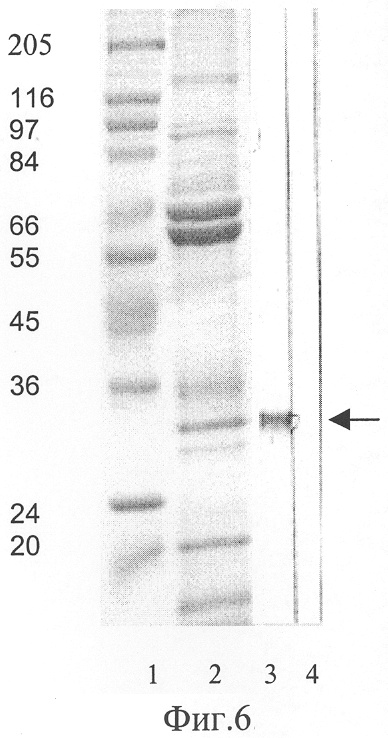
Фиг.6. Электрофореграмма белков вируса осповакцины, разделенных электрофоретически в денатурирующем 12% полиакриламидном геле: А - окраска белков вируса осповакцины Кумасси R-250 (1), Б - иммуноблотинг с рек-МКА 1F4 (2), с конъюгатом антивидовых антител (anti-human) со щелочной фосфатазой (3), М - стандарты молекулярных масс.
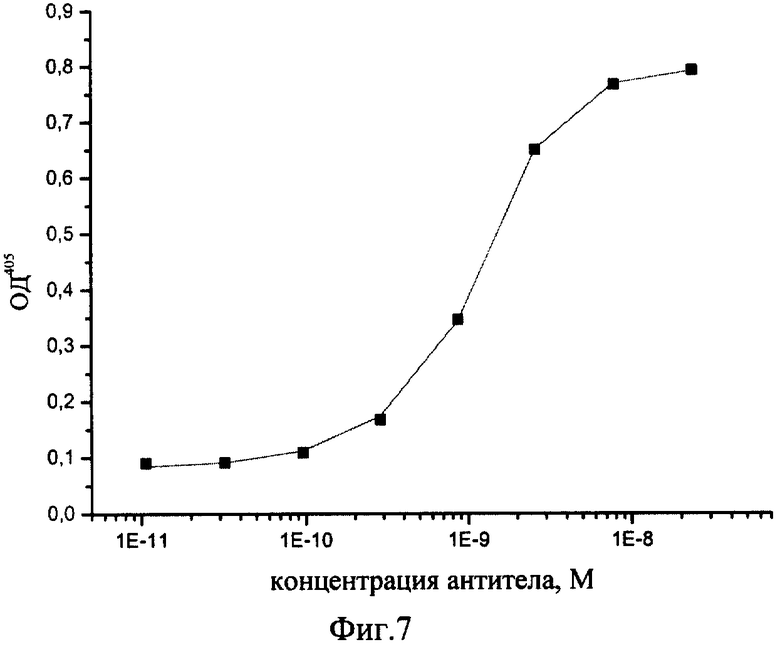
Фиг.7. Определение константы аффинности с использованием непрямого иммуноферментного анализа. Приведен график титрования полученного рекомбинантного антитела. На твердую фазу сорбирован вирус осповакцины в концентрации 2,5 мкг/мл. Рекомбинантное антитело человека нанесено в последовательных разведениях с шагом 1:3, исходная концентрация 5.5 мкг/мл, и проявлено антивидовым конъюгатом щелочной фосфатазы в разведении 1/10000. Величина константы аффинности составила: Каф=3,54×109±0,38×109 М-1.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pсL37.
а) Объединение вариабельной области легкой цепи одноцепочечного антитела 1F4 с лидерной последовательностью легкой цепи мышиных МКА F10.
Амплификацию лидерной последовательности проводят в объеме 100 мкл. Реакционная смесь содержит 100 нг pBVK1-6, по 50 пмолей праймеров 3 и 5, смесь dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, pH 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (фирмы Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (фирмы Fermentas). Проводят 25 циклов по схеме: 95°С/40 сек, 45°С/40 сек, 72°С/1 мин. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле; полосу длиной около 96 п.о. вырезают, ДНК экстрагируют из геля. Амплификацию вариабельной области легкой цепи проводят в объеме 100 мкл в присутствии 100 нг pHen1F4, 50 пмолей праймеров 2 и 9, смеси dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, pH 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (фирмы Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (фирмы Fermentas). Проводят 25 циклов по схеме: 95°С/40 сек, 45°С/40 сек, 72°С/1 мин. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле; полосу длиной около 360 п.о. вырезают, ДНК экстрагируют из геля, объединяют с полученным ранее фрагментом и используют в качестве матрицы во второй ступени ПЦР, которую проводят в тех же условиях в присутствии праймеров 5 и 9. Продукт амплификации длиной около 450 п.о. обрабатывают эндонуклеазой рестрикции XmaJI в соответствии с методикой, описанной в работе [13]. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле; полосу нужной длины вырезают, ДНК экстрагируют из геля.
б) Клонирование гена каппа-домена легкой цепи IgG человека в плазмиду pSK (+) c одновременным введением сайта XmaJI в 5′-конец гена.
Ген каппа-домена амплифицируют в 100 мкл реакционной смеси в присутствии 100 нг pCkap, по 50 пмолей праймеров 1 и BGH, смеси dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, pH 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (фирмы Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (фирмы Fermentas). Проводят 25 циклов по схеме: 95°С/40 сек, 43°С/40 сек, 72°С/1 мин. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле; полосу длиной около 440 п.о. вырезают, ДНК экстрагируют из геля и обрабатывают эндонуклеазой рестрикции XhoI. Затем 5 мкг плазмидной ДНК pSK (+) (Stratagene, США) обрабатывают эндонуклеазами рестрикции EcoRV и XhoI, продукты реакции анализируют электрофорезом в 0,8%-ном агарозном геле, полосу с векторной ДНК вырезают и ДНК экстрагируют из геля. Полученный ПЦР-фрагмент длиной 440 п.о. и векторную часть плазмиды pSK (+) объединяют в реакции лигирования в 20 мкл реакционной смеси в стандартных условиях [13]. 5 мкл реакционной смеси используют для трансформации компетентных клеток XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-агар, содержащий 100 мкг\мл ампициллина. В процессе рассева клеток на поверхность агара добавляют 100 мкл 0,1 М раствора ИПТГ и 20 мкл 4%-ного раствора X-Gal. Из выросших белых клонов выделяют плазмидную ДНК и анализируют ее эндонуклеазами рестрикции EcoRV, XmaJI и XhoI. Нуклеотидную последовательность встроенного фрагмента в отобранных клонах подтверждают секвенированием с использованием набора Cycle ReaderTM DNA Sequencing Kit (Fermentas, Литва) как описано в руководстве [12]. В результате получают промежуточную плазмиду pSKCl.
в) Сборка полноразмерного гена легкой цепи.
5 мкг плазмиды pSKCl обрабатывают рестриктазами SmaI и XmaJI, продукты реакции анализируют электрофорезом в 0,8%-ном агарозном геле. Полосу с линеаризированной векторной частью плазмиды вырезают, ДНК экстрагируют из геля и объединяют в реакции лигирования с 1 мкг фрагмента, полученного на этапе а) в 15 мкл реакционной смеси по стандартной методике [13]. 5 мкл реакционной смеси используют для трансформации компетентных клеток E. coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Скрининг плазмидных ДНК из клонов проводят рестрикционным анализом с использованием эндонуклеаз рестрикции XmaJI, NheI и XhoI. Клоны, содержащие полноразмерный ген легкой цепи, анализируют секвенированием как описано выше. 10 мкг полученной таким образом промежуточной плазмиды pSKl-1 обрабатывают эндонуклеазами рестрикции NheI и XhoI, продукты реакции анализируют электрофорезом в 1%-ном агарозном геле, полосу с ДНК длиной около 775 п.о. вырезают и ДНК экстрагируют из геля. Полученный фрагмент ДНК объединяют в реакции лигирования с 1 мкг ДНК экспрессионной плазмиды pcDNA3.1 (+) (Invitrogen), обработанной этими же эндонуклеазами рестрикции. Трансформацию и анализ клонов проводят как описано выше. Полученную в результате рекомбинантную плазмиду pсL37 (фиг.3) анализируют гидролизом эндонуклеазами HaeIII, NheI, XmaJI и XhoI. Структура гена, кодирующего гибридный белок, подтверждают секвенированием (фиг.1).
Пример 2. Конструирование рекомбинантной плазмидной ДНК pсН37.
а) Объединение вариабельной области тяжелой цепи антитела 1F4 с лидерной последовательностью тяжелой цепи мышиных МКА F10. Амплификацию лидерной последовательности проводят в объеме 100 мкл. Реакционная смесь содержит 100 нг pBVK14a2, по 50 пмолей праймеров 8 и 4, смесь dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, pH 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (Fermentas). Всего проводят 25 циклов по схеме: 95°С/40 сек, 45°С/40 сек, 72°С/1 мин. Продукты реакции анализируют в 1%-ном агарозном геле; полосу длиной около 90 п.о. вырезают, ДНК экстрагируют из геля. Амплификацию вариабельной области тяжелой цепи проводят в объеме 100 мкл в присутствии 100 нг pHen1, 50 пмолей праймеров 6 и 7, смеси dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, pH 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (фирмы Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (Fermentas). Проводят 25 циклов по схеме: 95°С/40 сек, 45°С/40 сек, 72°С/1 мин. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле; полосу длиной около 390 п.о. вырезают, ДНК экстрагируют из геля, объединяют с полученным ранее фрагментом и используют в качестве матрицы во второй ступени ПЦР, которую проводят в тех же условиях в присутствии праймеров 4 и 6. Продукт амплификации длиной около 465 п.о. обрабатывают эндонуклеазами рестрикции NheI и ApaI, продукты реакции анализируют электрофорезом в агарозном геле. Полосу размером около 460 п.о вырезают, ДНК экстрагируют из геля.
б) Сборка полноразмерного гена тяжелой цепи. 10 мкг плазмиды pCIgG1 обрабатывают рестриктазами ApaI и XhoI, продукты реакции анализируют электрофорезом в 1%-ном агарозном геле. Полосу длиной около 1130 п.о., содержащую ген CH1-CH2-CH3-доменов IgG1 человека вырезают, ДНК экстрагируют из геля. Затем 5 мкг плазмиды pcDNA3.1 (+) (Invitrogen) обрабатывают эндонуклеазами рестрикции NheI и XhoI, продукты реакции анализируют электрофорезом в 0.8%-ном агарозном геле, полосу с линеаризированной векторной частью плазмиды вырезают, ДНК экстрагируют из геля. Далее 1 мгк ApaI-XhoI - фрагмента, 1 мкг. линеаризированной векторной части и 0,5 мкг ПЦР-фрагмента, полученного на этапе а), объединяют в реакции лигирования в 20 мкл по стандартной методике [13]. 5 мкл реакционной смеси используют для трансформации компетентных клеток E.coli XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Скрининг клонов проводят рестрикционным анализом с использованием эндонуклеаз рестрикции ApaI, NheI и XhoI. Полученную в результате рекомбинантную плазмиду pcН37 (фиг. 4) анализируют эндонуклеазами рестрикции HaeIII, NheI и XhoI. Клоны, содержащие полноразмерный ген тяжелой цепи, анализируют секвенированием как описано выше.
Пример 3. Экспрессия полноразмерных человеческих антител в клеточной линии человека.
Транзиентную экспрессию полноразмерных человеческих антител против вируса осповакцины осуществляют в результате трансфекции клеток человека линии HEK293Т, полученных экспрессионными плазмидами, содержащими гены легкой и тяжелой цепей антител. Для этого перед проведением трансфекции клетки HEK293Т культивируют при 37°С в атмосфере 5% СО2 в среде DMEM (Gibco BRL), содержащей 10% бычьей фетальной сыворотки. Клетки высевают на 60 мм чашки и выращивают до плотности 90-95%, после чего проводят трансфекцию.
Трансфекцию осуществляют следующим образом. Десять микрограмм плазмидной ДНК (5 мкг ДНК плазмиды pcL37 и 5 мкг ДНК плазмиды pcH37) разводят в 500 мкл среды DMEM. Одновременно смешивают 25 мкл раствора LipofectAmine 2000 Reagent (Gibco BRL) c 500 мкл среды DMEM. Оба полученных раствора объединяют и инкубируют 20 мин при комнатной температуре. После инкубации раствор ДНК-LipofectAmine вносят в среду DMEM и полученную смесь используют в качестве культуральной среды для клеток HEK293Т.
После трансфекции клетки выращивают 72 ч без замены культуральной среды. По завершении инкубации культуральную среду собирают и центрифугируют 5 мин при 1,500 rpm. Супернатант отделяют и используют в дальнейшем для выделения антител.
Пример 4. Выделение рекомбинантных антител с помощью аффинной хроматографии.
150 мл культуральной жидкости наносят на колонку, содержащую 1 мл носителя Protein G Sepharose (Amersham), уравновешенную буфером PBS. Колонку промывают 10 мл этого же буфера и рекомбинантный белок элюируют 0,1 М глицин-HCl, pH 2,7, собирая фракции по 0,5 мл. В каждую фракцию немедленно добавляют по 50 мкл 2 М Tris-HCl, pH 8,0 для нейтрализации. Фракции, содержащие рекомбинантный белок, анализируют с помощью электрофореза в полиакриламидном геле, объединяют и диализуют против буфера PBS. Очищенные рекомбинантные антитела характеризуют фракционированием в 12% ПААГ с SDS, приготавливая образцы для нанесения на гель в присутствии и отсутствии 2-меркаптоэтанола (фиг.5).
Пример 5. Специфичность полученного рекомбинантного антитела подтверждают с помощью иммуноблот-анализа белков вируса осповакцины (фиг.6). Белки вируса осповакцины разделяют электрофоретически в 12% полиакриламидном геле с SDS, переносят на нитроцеллюлозный фильтр 0,45 мкм ("Millipore", США), который после блокирования сайтов неспецифического связывания раствором 3% БСА ("Sigma", США) инкубируют с исследуемым антителом. Связавшиеся антитела выявляют добавлением конъюгата щелочной фосфатазы ("Sigma", США) в разведении 1:10000. Визуализцию иммунного комплекса проводят, добавляя 5-бромо-3-индоло фосфат ("Carl Roth GmbH", Германия) и нитротетразолевый синий ("Sigma", США). Результаты показывают специфичность связывания сконструированного полноразмерного антитела с белком размером около 27 кДа вируса осповакцины (фиг.6).
Пример 6. Определение константы аффинности полученного рекомбинантного полноразмерного антитела в реакции связывания с вирусом осповакцины. Константу аффинности определяют методом ИФА. На твердую фазу сорбируют вирусный препарат в концентрации 250 нг/лунку и после блокировки мест неспецифического связывания раствором 2% бычьего сывороточного альбумина (БСА, "Sigma", США) инкубируют с полученным рекомбинантным антителом, добавленным в последовательных разведениях, начиная с концентрации 5.5 мкг/мл с шагом разведения 1:3. Иммунный комплекс выявляют добавлением антивидового конъюгата щелочной фосфатазы ("Sigma", США) в разведении 1:10000. В качестве хромогена используют пара-нитофенилфосфат ("ICN", США). В качестве отрицательного контроля в параллельных экспериментах тестируют связывание полученного рекомбинантного антитела с БСА. Результаты экспериментов показывают способность полученного рекомбинантного антитела связывать вирус осповакцины и отсутствие взаимодействия между полученным антителом и БСА. Величину константы аффинности рассчитывают методом наименьших квадратов по формуле:
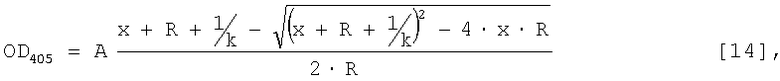
где х - концентрация антител в растворе, R - концентрация сорбированного антигена, k - константа аффинности, А - нормировочный множитель. Величина константы аффинности для рекомбинантного антитела человека 1F4 составляет 3,54×109±0,38×109 M-1 (фиг.7). Такое антитело можно считать высокоаффинным.
Таким образом, сконструированы плазмиды, содержащие искусственные гены легкой и тяжелой цепей полноразмерного человеческого антитела, созданные на основе вариабельных фрагментов легких и тяжелых цепей одноцепочечного антитела человека 1F4, константных генов IgG1 человека, цитомегаловирусного промотора и сайта полиаденилирования BGH4. Транзиентная трансформация эукариотических клеток линии HEK293Т обусловливает биосинтез в полипептидов со свойствами легкой и тяжелой цепей антитела человека, которые объединяются в антитело класса IgG1, специфически взаимодействующее с белком 27 кДа вируса осповакцины, с Каф=3,54×109±0,38×109 М-1, что в 30 раз выше, чем в прототипе.
Полученное полноразмерное рекомбинантное антитело против белка 27 кДа вируса осповакцины может служить основой для создания фармацевтических препаратов для диагностики и лечения ряда поствакцинальных осложнений, вызываемых вирусом осповакцины. При этом препараты будут содержать уменьшенные терапевтические дозы иммуноглобулинов, что обеспечит сведение к минимуму нежелательного иммунного ответа на вводимый препарат у пациентов.
Источники информации
1. Воробьев А.А., Подкуйко В.Н., Максимов В.А. Оральная вакцинация против оспы (возвращение вакцинации против оспы). Вести. РАМН. 2003. N 1. С.5-9.
2. Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы - М., 1998.
3. Dumbel К. and Hug F. The virology of variola minor. Correlation of laboratory tests with the geographic distribution and human virulence of variola isolates. Amer. J. Epidemiol. - 1986. - Vol.123. - P.403-415.
4. Fenner P., Wittek R., Dumbell K.R. The Orthopoxviruses. Acad. Press, Inc., San Diego, 1989.
5. Kim S., Jang М., Stapleton J., Yoon S., Kim K-S., Jeong E-S., Hong H. Neutralizing human monoclonal antibodies to hepatitis A virus recovered by phage display. Virology. 2004. Vol.318. P.598-607.
6. Kausmally L., Waalen K., Lobersli I., Hvattum E., Bemtsen G., Michaelsen Т., Brekke O.H. Neutralizing human antibodies to varicella-zoster virus (VZV) derived from a VZV patient recombinant antibody library. J. Gen. Virol. 2004. Vol.85. P.3493-3500.
7. Williamson R.A., Burioni R., Sanna P.P., Partridge L.J., Barbas C.F., Burton D.R. Human monoclonal antibodies against a plethora of viral pathogens from single combinatorial libraries. Proc. Natl. Acad. Sci. 1993. Vol.90. P.4141-4145
8. Международная заявка WO №03068151, кл. С07К 16/08, опубл. 21.08.2003.
9. Морозова В.В., Тикунова Н.В., Батанова Т.А., Юн Т.Э., Бовшик Е.И., Жираковская Е.В., Воронина В.В., Бобко Д.И., Беланов Е.Ф., Ильичев А.А., Сандахчиев Л.С. Мини-антитела человека против ортопоксвирусов. Вестник РАМН, 2004, №8. с.22-27.
10. Radko B.V., Boitchenko V.E., Nedospasov S.A. and Korobko V.G. Characterization of the genes encoding variable light and heavy chains of the high-affinity monoclonal antibody against human tumor necrosis factor. Russian Journal of Immunology, 2002, v.7(4), p.371-374.
11. Aliev Т.К., Panina А.А., Petrovskaya L.E., Shingarova L.N., Radko B.V., Nedospasov S.A., Korobko V.G., Zavyalova G.A., Zavyalov V.P. Design and Expression of Humanized Monoclonal Antibody F10 that Neutralizes Human Tumor Necrosis Factor-a. Clinical Immunology, 2002, v.103 (3), Part 2, p.S90.
12. CycleReader DNA Sequencing Kit #K1711, Fermentas. Sequencing Protocol.
13. Sambrook J., Fritsch E., Maniatis T. Molecular Cloning. A Laboratory manual. 2nd ed. Cold Spring Harbor, NY, 1989.
14. Варфоломеев С.Д., Гуревич К.Г. Биокинетика: Практический курс. М.: ФАИР-ПРЕСС, 1999.

Изобретение относится к биотехнологии, в частности к генетической инженерии. Сконструированные in vitro рекомбинантные плазмидные ДНК содержат полученные генно-инженерными методами искусственные гены легкой и тяжелой цепей полноразмерного человеческого антитела. Гены созданы на основе вариабельных фрагментов легких и тяжелых цепей рекомбинантного антитела 1F4 и константных генов IgG1 человека, цитомегаловирусного промотора и сайта полиаденилирования BGH. Плазмиды обусловливают биосинтез в клетках млекопитающих рекомбинантных полноразмерных человеческих антител класса IgG1. Данные антитела специфически взаимодействуют с вирусом осповакцины. Константа аффинности для полученных рекомбинантных антител составляет 3,54·109±0,38·109 М-1. Плазмиды применяются путем совместной котрансфекции клеток человека НЕК 293Т. Полученное полноразмерное рекомбинантное антитело против белка 27 кДа вируса осповакцины может стать основой для создания фармацевтических препаратов для диагностики ряда поствакцинальных осложнений, вызываемых вирусом осповакцины. При этом препараты будут содержать уменьшенные терапевтически дозы иммуноглобулинов, что обеспечит сведение к минимуму нежелательного иммунного ответа на вводимый препарат у пациентов. 3 н.п. ф-лы, 7 ил.
NheI/XhoI - векторный фрагмент плазмиды pcDNA3.1(+) (Invitrogen) размером 5338 п.о., содержащий цитомегаловирусный (CMV) промотор и энхансер транскрипции, сайт полиаденилирования и участок терминации транскрипции BGH, ген β-лактамазы (bla) и ген устойчивости к неомицину;
NheI/XhoI - фрагмент размером 770 п.о., содержащий искусственный ген, кодирующий гибридный полипептид, в котором вариабельный домен легкой цепи одноцепочечного антитела 1F4, полученного из комбинаторной фаговой библиотеки одноцепочечных антител человека, соединен с константным доменом каппа-цепи IgG человека, имеющий нуклеотидную последовательность, приведенную на фиг.1;
генетические маркеры:
ген β-лактамазы (bla), определяющий устойчивость трансформированных плазмидой pcL37 клеток бактерий к ампициллину;
ген устойчивости к неомицину для селекции трансфецированных плазмидой pсL37 клеток млекопитающих;
уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: Bg1II - 12, NheI - 895, XmaJI - 1294, XhoI - 1665.
NheI/XhoI - векторный фрагмент плазмиды pcDNA3.1(+) (Invitrogen) размером 5338 п.о., содержащий цитомегаловирусный (CMV) промотор и энхансер транскрипции, сайт полиаденилирования, участок терминации транскрипции BGH, ген β-лактамазы (bla) и ген устойчивости к неомицину;
ApaI/XhoI - фрагмент промежуточной плазмиды рСIgC1 размером 1126 п.о., включающий ген Сн1-Сн2-Сн3-доменов IgG1 человека;
NheI/ApaI - фрагмент размером 447 п.о., содержащий искусственный ген, кодирующий лидерную последовательность тяжелой цепи антитела F10 и вариабельную область тяжелой цепи одноцепочечного антитела 1F4, полученного из комбинаторной фаговой библиотеки одноцепочечных антител человека, имеющий нуклеотидную последовательность, приведенную на фиг.2;
генетические маркеры:
ген β-лактамазы (bla), определяющий устойчивость трансформированных плазмидой рсН37 клеток бактерий к ампициллину;
ген устойчивости к неомицину для селекции трансформированных плазмидой рсН37 клеток млекопитающих;
уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: Bg1II - 12, NheI - 895, ApaI - 1338, XhoI - 1320 и 2468.
| ФРАГМЕНТ ДНК И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 1994 |
|
RU2218400C2 |
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| WO 03068151, 21.08.2003. | |||
Авторы
Даты
2008-02-20—Публикация
2006-01-16—Подача