Изобретение относится к биологии и может быть использовано в эмбриологии, генетике и биотехнологии при культивировании пыльников гибридных растений с целью получения константных гибридных линий для создания нового исходного селекционного материала.
Известен способ культивирования пыльников, при котором соцветия, собранные с растений рапса, помещали в водопроводную воду и ставили в темноту на 14 суток в холодильник при температуре 4°С (Dunwel J.M., Cornish M. Influence of preculture varifbles on microspore embryo production in Brassica napus ssp. oleifera cv. Duplo/Annals of Botany. - 1986. Vol.56. P.281-289).
Недостатком этого способа является то, что пыльники, изолируемые из таких бутонов, культивируемые на питательных средах, формируют малое количество эмбриоидов, а длительный период хранения бутонов приводит к снижению выхода эмбриоидов из пыльников.
Известен способ получения гаплоидных растений ярового рапса, включающий отбор ценных донорных растений, сбор бутонов, соцветий, обработку пониженной положительной температурой 4°С в чашках Петри с раствором сахарозы 0.35М и 800 мг L-глютамином в течение 1-3 суток, стерилизацию поверхности бутонов в 7% водном растворе гипохлорита натрия, трехкратную промывку стерильной дистиллированной водой, затем вычленяют пыльники из бутонов и помещают на агаризованную среду для эмбриоидогенеза. Модифицированная питательная среда Nitsch, Nitsch (1967), содержащая фитогормоны: 3 мг/л 2,4-Д, 3 мг/л НУК и 3 мг/л 6-БАП с добавлением 7% сахарозы и 1% глюкозы, L-глютамина 800 мг/л, L-серина 100 мг/л, картофельный экстракт Difco 2,5 г/л, инкубация в темноте при 30°С в течение 14 суток с последующим культивированием при 26°С, через 3-4 недели на поверхности появляются матовые вторичные структуры (эмбриоиды), пыльники с эбриоидами переносили в условия 16 часового освещения, через 3-4 суток зеленые эмбриоиды пересаживают на безгормональную среду MS (Murashige and Skoog) с уменьшенным содержанием сахарозы до 1%. По мере развития эмбриоидов в растения-регенеранты на этой среде и появления 2-3 настоящих листьев и корней их пересаживали в стерильный компост (Lichter R.Anther culture of Brassica napus in a liquid culture medium /Z.Pflanzenphysiol. 1981. Vol.103. P.229-237).
Однако и в этой работе наблюдается низкий выход эмбриоидов в культуре пыльников ярового рапса в условиях in vitro.
Наиболее близким к заявленному является способ культивирования пыльников, при котором на бутоны воздействуют пониженными положительными температурами (4-5°С) в течение 4-7 суток, пыльники помещают на искусственную питательную среду и выращивают до образования эмбриоидов (Методические рекомендации по получению андроклинных растений ярового рапса. - М.: Типография Россельхозакадемия, 1999. - 23 с.).
Однако и данный способ не позволяет значительно увеличить выход эмбриоидов.
Целью изобретения является увеличение выхода эмбриоидных структур.
Поставленная цель достигается тем, что бутоны размером 1,5-3,5 мм помещают в водные растворы фитогормонов, в качестве которых может быть использована или 2,4-дихлорфеноксиуксусная кислота (2,4-Д), или кинетин, или гиббериллиновая кислота (ГК).
В ходе проведения патентного поиска автором не обнаружено совокупности аналогичных признаков.
Не является очевидным для достижения цели изобретения использование в качестве предобработки (хранение) бутонов в интервале пониженных положительных температур (4-5°С) в растворах предложенных фитогормонов в течение 2-3 суток перед изолированием пыльников из бутонов.
Изобретение иллюстрируется таблицей N 1 и графиками 1, 2, 3.
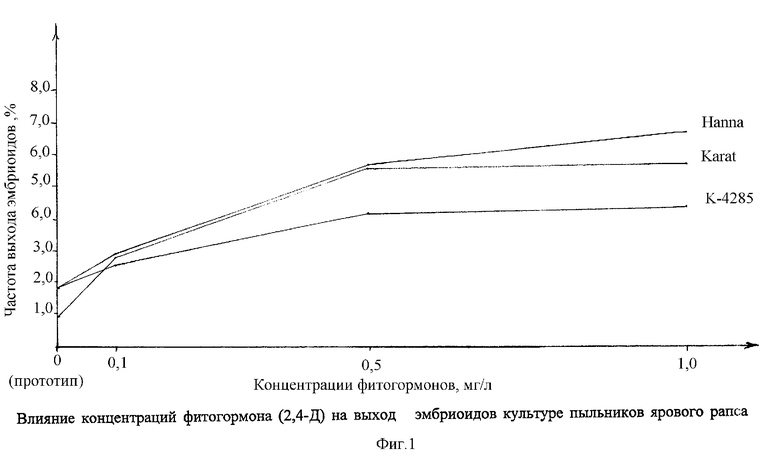
На графике 1 показано влияние предобработки бутонов в различных концентрациях от 0,1 до 1,0 мг/л 2,4-Д на выход (сбор) эмбриоидов в культуре пыльников ярового рапса в условиях in vitro.
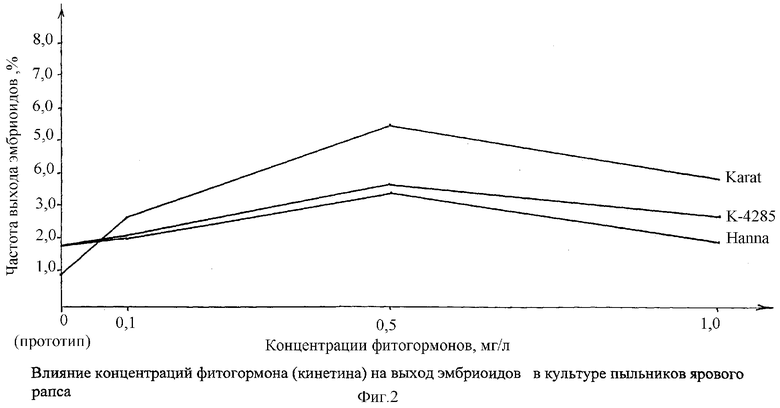
На графике 2 показано влияние предобработки бутонов в различных концентрациях от 0,1 до 1,0 мг/л кинетина на выход (сбор) эмбриоидов в культуре пыльников ярового рапса в условиях in vitro.
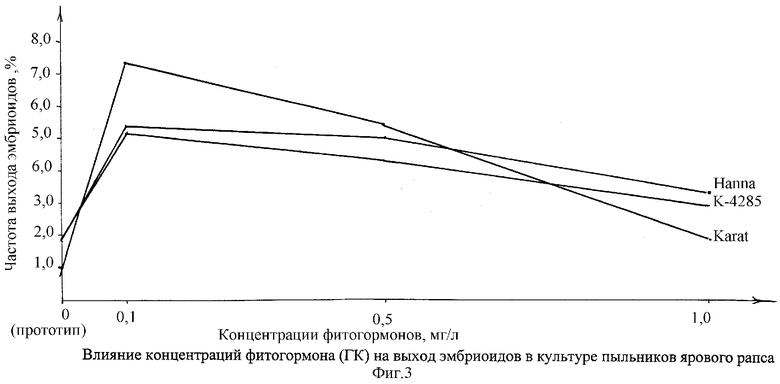
На графике 3 показано влияние предобработки бутонов в различных концентрациях от 0,1 до 1,0 мг/л ГК на выход (сбор) эмбриоидов в культуре пыльников ярового рапса в условиях in vitro.
Способ осуществляют следующим образом.
Для получения гаплоидных растений ярового рапса использовали в качестве материнских, маточных, донорных растений сортов Karat (Канада), Наппа (Швеция), К-4285 (Чехословакия). Растения выращивали в контролируемых условиях теплицы при температурах 15-20°С днем, 10-15°С ночью в 16 часовом освещении. С цветущих растений собирали бутоны размерами 1,5-3,5 мм и по 40-60 штук помещали в чашки Петри диаметром 60 мм, в которые заранее наливали 2 мл водного раствора одного из фитогормона в концентрациях 0,1, 0,5 и 1,0 мг/л. Стерилизовали бутоны, например, в 5-10% водном растворе domestos в течение 7 минут с последующим 3-5 кратным промыванием стерильной дистиллированной водой. Пыльники извлекали из бутонов и по 18 штук помещали в пробирки на агаризованную индукционную питательную по прописи среду 1 (табл.2). Материал инкубировали в темноте до получения вторичных структур (эмбриоидов) матового цвета, например, 3-4 недели при начальном культивировании пыльников в температуре 35°С в течение 2-3 суток с последующим инкубированием в условиях 26°С. Развившиеся из пыльников эмбриоиды переносили на свет до появления хлорофилла, затем пересаживали на регенерационную среду, т.е. среду 2 по прописи (таблица 2). Пересадку проростков в почву (смесь почвы и песка в соотношении 3:1) проводили при формировании 2-3 листьев и корневой системы и предварительно выращивали в течение 2 недель при оптимальных условиях влажности воздуха, например под стеклянными стаканами, для лучшей акклиматизации проростков. Периодически растения поливали и рыхлили землю, в фазу цветения изолировали соцветия, а по окончании вегетационного периода срезали и обмолачивали.
Пример использования фитогормонов. Обработка бутонов раствором 2,4-Д во всех концентрациях стимулирует образование эмбриоидов (табл.1). Максимальный их выход 6,6% получен на пыльниках сорта Наппа при выдерживании бутонов в растворе 1,0 мг/л. У других генотипов при увеличении концентрации фитогормона сохранялась тенденция повышения выхода эмбриоидов (график 1).
Предварительная обработка бутонов растворами кинетина (табл.1), особенно в концентрации 0,5 мг/л, увеличивала формирование эмбриоидов на пыльниках сорта Наппа 1,8 по прототипу до 3,5% в варианте, у образца К-4285 с 2,1 по прототипу до 3,5%. Максимальный выход эмбриоидов получен на сорте Karat, с 0,9 (прототип) до 5,5% после обработки бутонов в концентрации 0,5 мг/л. Повышение концентрации фитогормона до 1 мг/л ингибировало их образование (график 2).
Обработка бутонов раствором ГК в минимальной (0,1 мг/л) концентрации стимулировала индукцию эмбриоидов у всех изучаемых сортов (табл.1). Максимальное образование эмбриоидов получили у сорта Karat с 0,9 (прототип) до 7,4% в лучшем варианте, у образца К-4285 с 1,8 в контроле (прототипе) до 5,3% в варианте. Увеличение концентрации ГК ингибировало индукцию эбриоидов у всех генотипов (график 3).
Оценивая в целом эффективность использования фитогормонов для проведения предобработки бутонов ярового рапса в культуре пыльников, можно сделать вывод, что наибольший эффект получен при использовании ГК, затем 2,4-Д и кинетина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОЗДАНИЯ ВОССТАНОВИТЕЛЕЙ ФЕРТИЛЬНОСТИ ЯРОВОГО РАПСА (BRASSICA NAPUS L.) | 2007 |
|
RU2366705C2 |
| Способ получения растений-регенерантов Brassica oleracea L. in vitro | 2021 |
|
RU2759735C1 |
| Способ получения растений-регенерантов рода Brassica in vitro | 2020 |
|
RU2741647C1 |
| Способ размножения растений | 1985 |
|
SU1335205A1 |
| Способ получения растений - регенерантов пшеницы из пыльцы в культуре пыльников | 1988 |
|
SU1650051A1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ РАПСА IN VITRO | 2008 |
|
RU2374834C1 |
| Способ регенерации растенийлюцЕРНы | 1979 |
|
SU852275A1 |
| Способ получения дигаплоидных растений озимой пшеницы | 2023 |
|
RU2821696C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАПЛОИДНЫХ РАСТЕНИЙ-РЕГЕНЕРАНТОВ ИЗ РЕПРОДУКТИВНЫХ ОРГАНОВ BRASSICA OLERACEA L. IN VITRO | 2015 |
|
RU2607007C1 |
| Способ получения растений злаковых культур из пыльцы | 1985 |
|
SU1276309A1 |
Изобретение относится к области биотехнологии и может быть использовано для создания нового исходного селекционного материала. Собранные бутоны растений рапса помещают в растворы фитогормонов и выдерживают в холодильнике в течение 2-3 суток при температуре 4-5°С. Такая обработка позволяет увеличить выход эмбриоидных структур. В качестве фитогормонов могут быть использованы, например, 2,4-Д, кинетин или гиббереллиновая кислота (ГК). При использовании 2,4-Д в концентрации не менее 1,0 мг/л наибольший выход эмбриоидов составляет 6,6%. При использовании кинетина в концентрации 0,4-0,6 мг/л выход эмбриоидов составляет 5,5%. Обработка бутонов ГК стимулирует выход эмбриоидов до 7,4% в концентрации до 0,1 мг/л. 3 з.п. ф-лы, 3 ил., 2 табл.
| PLANT PHYSIOLOGY, 1990, v.94, №3, p.875-881 | |||
| NEW PHYTOLOGY, 1983, 95, p.349 | |||
| Способ культивирования изолированных пыльников злаковых растений | 1990 |
|
SU1724688A1 |
Авторы
Даты
2008-01-20—Публикация
2006-01-24—Подача