Изобретение относится к биотехнологии, в частности к генетической инженерии, и может быть использовано в медицине для выявления генетического материала вируса краснухи в клинических образцах.
Метод обратной транскрипции - полимеразной цепной реакции (ОТ-ПЦР) является прямым методом выявления РНК вируса и имеет высокую степень чувствительности. В основе ОТ-ПЦР лежит получение кДНК на матрице вирусной РНК с помощью фермента, именуемого ревертазой (РНК-зависимая-ДНК-полимераза) и многократное копирование с помощью фермента ДНК-полимеразы определенного фрагмента кДНК, являющегося маркерным для данного вида возбудителя инфекционного заболевания. Для эффективного проведения ОТ-ПЦР необходимы праймеры - синтетические олигодезоксирибонуклеотиды (или сокращенно - олигонуклеотиды) определенного размера, строго специфичные для конкретного микроорганизма. Ограниченность использования праймеров обусловлена их видоспецифичностью. Праймеры должны быть комплементарны последовательностям ДНК на левой и правой границах выбранного фрагмента и ориентированы таким образом, чтобы синтез ДНК, осуществляемый ДНК-полимеразой, протекал только между ними. В результате происходит экспоненциальное увеличение количества копий специфичного фрагмента. От правильно выбранных праймеров, определяющих специфичность ПЦР, зависит точность диагностирования исследуемого вируса.
Известен зарубежный аналог, представляющий собой набор праймеров, обеспечивающих специфичный синтез фрагментов кДНК на матрице геномной РНК вируса краснухи (Bosma T.J., Corbett K.M., O'Shea S.,et al. PCR for detection of Rubella virus RNA in clinical Samples., J. of Clin. Microbiol., 1995. P.1075-1079) [1]. Данный набор праймеров разработан на основе структуры РНК штаммов и изолятов вируса краснухи, циркулирующего за пределами России и других стран СНГ, отличающихся по строению генома от вируса, циркулирующего на территории стран СНГ, что не всегда обеспечит надежное выявление генетического материала вируса краснухи в пробах, отобранных на указанных территориях.
Наиболее близким аналогом (прототипом) является отечественный аналог, который представляет набор праймеров, разработанных с учетом данных по структуре генома вируса краснухи, циркулирующего в России (Патент РФ №2217501, МПК7 С12Q 1/68, опубл. 27.11.2003) [2]. Однако накопление данных по геномному разнообразию вируса краснухи в различных регионах мира, в том числе и на территории Российской Федерации, и детальный анализ этих данных показали, что и этот набор праймеров в ряде случаев не может обеспечить надежной идентификации вируса краснухи, поскольку были выявлены геноварианты вируса, для которых вышеназванные наборы праймеров не обладают достаточной специфичностью, чтобы обеспечить надежный синтез целевых фрагментов ДНК.
Техническим результатом заявляемого изобретения является разработка набора праймеров для индикации генетического материала вируса краснухи с учетом вариаций в строении генома всех известных на данный момент географических изолятов вируса в мире, в том числе и на территории различных регионов России.
Указанный результат достигается разработкой набора олигонуклеотидов-праймеров для идентификации РНК вируса краснухи, содержащего 2 пары олигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции, имеющих следующую структуру:
RF1:5'CGT(C,T)CTTAC(G,C)GCCCGCCCCG3' (20 н.)
RR2:5'GCGAGGCGCACGGGGACAGG3' (20 н.)
RF3:5'CCC(C,A)GAACTGGTGAGCCCCATGGG3' (24 н.)
RR4:5'CGCACCCCGG(C,T)GCAGTGC3' (18 н.)
В рамках заявляемого технического решения разработана схема выбора праймеров с учетом вариаций в строении генома всех известных изолятов вируса краснухи, а также с учетом нуклеотидных гомологий между вирусом краснухи и всеми известными последовательностями в базах данных GenBank и EMBL с основным упором на геном человека и распространенных микробных патогенов. Апробация праймеров была осуществлена с использованием культуры клеток Vero, зараженной вирусом краснухи, и клинического материала (моча, сыворотка крови, носоглоточный смыв и амниотическая жидкость). Было показано, что применение данных праймеров в ОТ-ПЦР для индикации РНК вируса краснухи в пробах обеспечивает надежный синтез фрагментов ДНК рассчитанного размера. Специфичность продуктов амплификации во всех случаях была подтверждена методом их прямого секвенирования.
Характеристика набора праймеров и участка амплифицируемой геномной РНК. Праймеры фланкируют участок, представляющий собой 3'-конец гена Е2 и 5'-конец гена Е1. В первом раунде ПЦР амплифицируется фрагмент ДНК, соответствующий позициям генома с 7963 по 8328 нуклеотид, во втором раунде синтезируется целевой фрагмент, подлежащий визуализации после проведения электрофореза, длиной 266 п.н., соответствующий позициям генома с 8032 по 8297 нуклеотид (фиг.1).
Важно отметить, что разработка условий проведения ОТ-ПЦР осуществлена нами исключительно с использованием коммерчески доступных ферментов и прибора для амплификации отечественного производства, предназначенных для массового применения в диагностических лабораториях России. Ферменты - производства НПО "СибЭнзим" (г.Новосибирск), амплификатор - модель Терцик МС2, "ДНК-технология" (г.Москва). Этот факт позволяет просто, быстро и надежно применить данное изобретение в медицинской практике.
Технический результат. Разработан набор олигонуклеотидных праймеров, обеспечивающих надежную индикацию различных геновариантов вируса краснухи в клинических образцах.
Перечень графических материалов
На фиг.1 представлен фрагмент нуклеотидной последовательности кДНК вируса краснухи, штамм F-Therien, содержащий амплифицируемые фрагменты 1-го и 2-го раундов ПЦР. Справа и слева цифры указывают геномные позиции, жирным шрифтом выделены места гибридизации заявляемых праймеров, сверху приведено их обозначение. Первый нуклеотид кодона белка Е1 подчеркнут (сверху дано обозначение: E1-start).
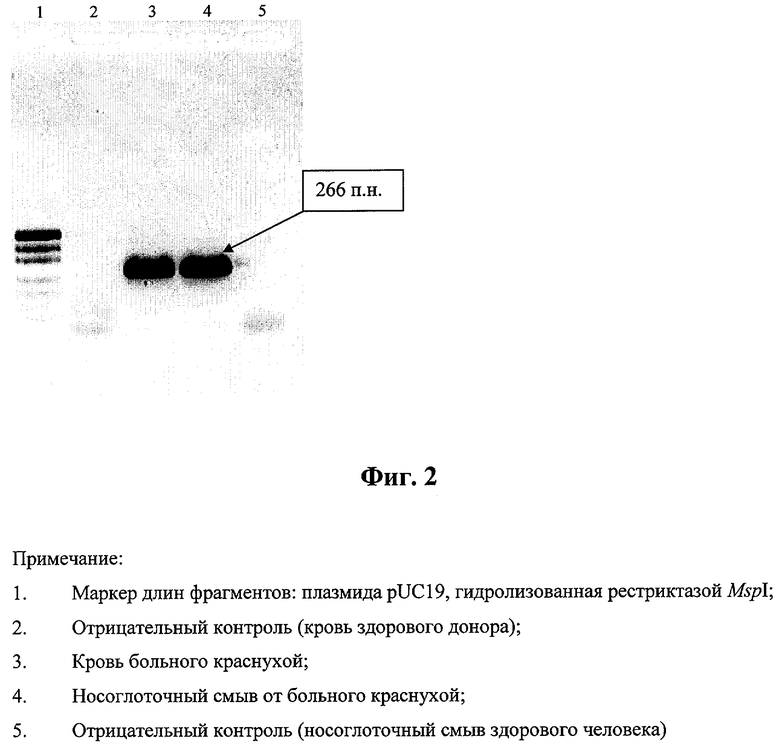
На фиг.2 приведена типичная электрофореграмма продуктов ОТ-ПЦР с использованием набора патентуемых праймеров (1,5% агарозный гель).
Пример 1. Методика получения набора праймеров для выявления вируса краснухи в клинических образцах.
На основе теоретического изучения структуры генома различных географических изолятов вируса краснухи были рассчитаны и синтезированы праймеры для проведения обратной транскрипции и полимеразной цепной реакции (таблица 1).
В качестве контрольных праймеров синтезировали праймеры (таблица 2), соответствующие по первичной структуре, используемые в прототипе [2]:
Отработка условий амплификации проводилась при использовании в качестве модельного образца культуры клеток Vero, зараженных вирусом краснухи, штамм М-33, полученным в 1985 г. в Институте вирусологии им. Д.И.Ивановского РАМН (г.Москва). Кроме этого, использовали штаммы RVI Kem6R-6.RUS/05, RVI Nvk13-23.RUS/04, RVI Tom9R-48. RUS/05, выделенные в лаборатории ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора во время эпидемических вспышек 2004-2005 г. Отработанные условия амплификации были использованы для обнаружения генетического материала вируса краснухи в клинических образцах (препараты крови, мочи, носоглоточные смывы заболевших и контактных с больными). В качестве положительного контроля использовали вышеназванный штамм вируса и другие музейные штаммы вируса краснухи из коллекции ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора, адаптированные к культуре клеток Vero. В качестве отрицательного контроля использовали незараженную вирусом клеточную культуру и клинические образцы здоровых людей.
Ниже в примерах (2-6) приведена методика индикации генетического материала вируса краснухи в пробах.
Пример 2. Выделение РНК вируса краснухи из сыворотки крови.
1) 50 мкл пробы смешивают со 150 мкл раствора Д+ и выдерживают 5 мин во льду.
2) Добавляют 200 мкл смеси фенол/хлороформ/изоамиловый спирт (24/24/1), встряхивают вручную в течение 1 мин.
3) Центрифугируют при +4°С 30 мин при 15000g.
4) Отбирают водную (верхнюю) фазу и помещают в новую пробирку, содержащую 200 мкл охлажденного изопропанола.
5) Образец замораживают при - 70°С в течение 15 мин.
6) Центрифугируют 10 мин при комнатной температуре при 15000g, супернатант декантируют.
7) Осадок дважды промывают 75% этанолом (по 500 мкл) и 1 раз 96% этанолом с центрифугированием 1 мин при 12000g при комнатной температуре.
8) Этанол сливают, пробирку переворачивают вверх дном и высушивают осадок при комнатной температуре в течение 20 мин.
Примечание: состав растворов:
Д-4М гуанидинизоцианат
25 мМ цитрат натрия, рН 7,0
0,5% саркозил
0,1 М 2-меркаптоэтанол
Хранится при комнатной температуре или при +4 до 1 года.
Д+ - это раствор Д, содержащий 0,2 М ацетат натрия, рН 4,0.
Пример 3. Получение кДНК методом обратной транскрипции. К осадку РНК добавляют 11,4 мкл воды и по 2 мкл праймеров RF1 и RR2 (концентрация исходных растворов праймеров - 10 пмоль/мкл), энергично всряхивают и прогревают в течение 3 мин при 96°С, охлаждают 3 мин во льду и сбрасывают конденсат со стенок пробирок центрифугированием в течение 5 с.
Затем готовят реакционную смесь следующего состава:
Раствор РНК с праймерами - 15,4 мкл,
Раствор суммарный dNTP (25 мМ) - 0,8 мкл,
Буфер × 10 для ревертазы - 2 мкл,
Раствор 0,1 М хлорида марганца - 0,6 мкл,
Ингибитор РНКаз - 0,2 мкл,
Ревертаза - 1 мкл (активность 50 е.а./мкл).
Условия проведения реакции: 37°С - 1 ч; 99°С - 7 мин; 37°С - 7мин.
Пример 4. 1 раунд ОТ-ПЦР.
Готовят реакционную смесь следующего состава:
Вода - 28,4 мкл,
Буфер × 10 для полимеразы - 5 мкл,
Раствор суммарный dNTP (25 мМ) - 0,6 мкл,
Праймер RF1 (10 пмоль/мкл) - 5 мкл,
Праймер RR2 (10 пмоль/мкл) - 5 мкл,
кДНК - 5 мкл,
taq-ДНК-полимераза - 1 мкл (5 е.а./мкл).
Условия проведения реакции:
95°С - 1,0 мин; 50°С - 1,0 мин; 72°С - 0,7 мин - 5 циклов;
95°С - 0,5 мин; 55°С - 0,7 мин; 72°С - 0,5 мин - 35 циклов;
72°С - 5 мин.
Пример 5. 2 раунд ОТ-ПЦР.
Готовят реакционную смесь следующего состава:
Вода - 35,4 мкл,
Буфер × 10 для полимеразы - 5 мкл,
Раствор суммарный dNTP (0,25 мМ) - 0,6 мкл,
Праймер RF3 (10 пмоль/мкл) - 3 мкл,
Праймер RR4 (10 пмоль/мкл) - 3 мкл,
Реакционная смесь 1 раунда - 2 мкл,
Taq-ДНК-полимераза - 1 мкл (5 е.а./мкл).
Условия проведения реакции те же, что приведены в примере 4 для 1 раунда ПЦР.
Пример 6. Анализ продуктов амплификации.
Анализ продуктов амплификации проводят в 1,5% агарозном геле (фиг.2). Длина полученного после двух раундов ПЦР-фрагмента в случаях исследуемых образцов соответствует расчетной (266 п.н.), а в отрицательном контроле продукты амплификации отсутствуют.
Заявляемый набор праймеров апробирован для индикации вируса краснухи в сыворотке больных и показал высокую надежность и достоверность.

Изобретение относится к биотехнологии, в частности к генетической инженерии. Разработан набор праймеров для надежной индикации генетического материала вируса краснухи с учетом вариаций в строении генома всех известных на данный момент географических изолятов вируса, в том числе и на территории различных регионов России. Набор олигонуклеотидных праймеров для идентификации РНК вируса краснухи содержит 2 пары олигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции, имеющих следующую структуру:
RF1:5'CGT(C,T)CTTAC(G,C)GCCCGCCCCG3' (20 н.)
RR2:5'GCGAGGCGCACGGGGACAGG3' (20 н.)
RF3:5'CCC(C,A)GAACTGGTGAGCCCCATGGG3' (24 н.)
RR4:5'CGCACCCCGG(C,T)GCAGTGC3' (18 н.)
Изобретение может быть использовано в медицине для выявления генетического материала вируса краснухи в клинических образцах. 2 ил., 2 табл.
Набор олигодезоксирибонуклеотидных праймеров для идентификации вируса краснухи в клинических образцах, содержащий 2 пары олигонуклеотидов, обладающих активностью прямого и обратного праймеров в реакции обратной транскрипции и полимеразной цепной реакции, имеющих следующую структуру:
RF1:5'CGT(C,T)CTTAC(G,C)GCCCGCCCCG3' (20 н.)
RR2:5'GCGAGGCGCACGGGGACAGG3' (20 н.)
RF3:5'CCC(C,A)GAACTGGTGAGCCCCATGGG3' (24 н.)
RR4:5'CGCACCCCGG(C,T)GCAGTGC3' (18 н.)
| НАБОР ОЛИГОНУКЛЕОТИДОВ-ПРАЙМЕРОВ ДЛЯ ИДЕНТИФИКАЦИИ ВИРУСА КРАСНУХИ | 2002 |
|
RU2217501C2 |
| BOSMA T.J, CORBETT K.M, O'SHEA S, BANATVANA J.E, BEST J.M.PCR for detection of rubella virus RNA in clinical samples | |||
| J Clin Microbiol | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| COORAY S, WARRENER L, JIN L | |||
| Improved RT-PCR for diagnosis and epidemiological surveillance of rubella | |||
| J Clin Virol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2008-02-20—Публикация
2006-02-01—Подача