Область техники
Настоящее изобретение относится к абсолютной стереоконфигурации 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты, предназначенной для подавления старения и стресса, к способу ее получения, и к эффекту спящей личинки при ее использовании. Конкретнее, настоящее изобретение относится к определению трехмерной стереохимии 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты, которая представляет собой феромон, впервые выделенный из Caenorhabditis elegance, к промежуточному веществу, требуемому для ее синтеза, к способу получения и к эффекту спящей личинки при использовании феромона.
Предшествующий уровень техники
Феромоны, ставшие известными как физиологически активные вещества, определяются как вещества, которые создаются в организме животных и выделяются из организма для воздействия на других индивидуумов того же вида, вызывая посредством этого специфическую активацию или изменение физиологических феноменов.
В соответствии с предыдущими исследованиями, феромоны, выделяемые из C. elegance, существуют в крайне низкой концентрации, составляющей менее чем 1000 дальтон (Да). Феромон известен как индивидуальное вещество или родственное соединение, которое является очень устойчивым и нелетучим, имея при этом такие же хроматографические свойства, как гидроокись короткоцепочечной жирной кислоты (Riddle, D.L., Science, 218:578-580, 1982).
В диссертации Riddle указано, что хотя феромоновый остаток частично очищен, точная химическая конфигурация и физические свойства чистого феромона еще не известны. Кроме того, поскольку экстракт феромона из C. elegance, использованный исследователями, представляет собой частично очищенный сырой экстракт, нет способа изучения для обнаружения точной физиологической мишени и биологических механизмов.
Поэтому авторы настоящего изобретения провели массовое культивирование содержащей феромон C. elegance, в самом крупном состоянии, у которой может быть индуцирована стадия спящей личинки, вследствие стресса или ухудшения условий окружающей среды. А затем авторы изобретения выделили и очистили феромон, секретируемый из C. elegance, и определили химическую конфигурацию очищенного феромона. В результате было отмечено, что очищенный феромон представляет собой 6-(3,5-дигидрокси-6-метилтетрагидропиран-2-илокси)гептановую кислоту, имеющую следующую двухмерную плоскостную структурную формулу (Paik et al, заявка на патент Кореи № 10-2002-0070591 и заявка РСТ № РСТ/KR03/02059)
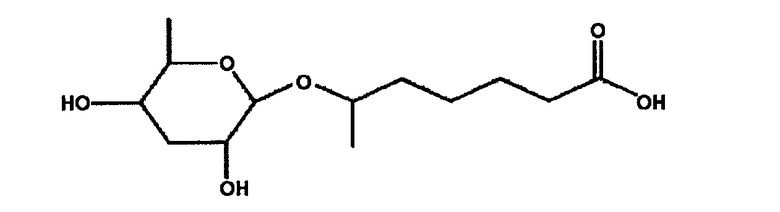
Однако трехмерная химическая конфигурация указанного выше двухмерного феромонового соединения и полный синтез пока неизвестны. Поскольку новое феромоновое соединение имеет 5 асимметричных атомов углерода, стереохимическая конфигурация феромонового соединения, вероятно, может включать 36 стереоизомеров. Поэтому стереохимическую конфигурацию необходимо определить для синтеза феромонового соединения, идентичного естественному феромону, имеющему правильную стереохимию.
Кроме того, для исследования старения, стресса, метаболизма, системы передачи сигналов in vivo, для разработки противоопухолевых лекарственных средств, средств против ожирения и препаратов, подавляющих старение и стресс, а также для исследования активного белка-мишени для феромона в организме, неизбежно требуется разработать способ полного синтеза для массового производства феромона.
Поэтому авторы изобретения определили трехмерную стереохимическую конфигурацию феромона, выделенного из C. elegance, для синтеза феромона, идентичного естественному феромону, с использованием спектроскопических технологий. Кроме того, авторы изобретения успешно выполнили стереоспецифический полный синтез, получив посредством этого феромон, полностью идентичный естественному феромону. Данный способ обеспечивает массовое производство феромона, преодолевая недостатки, имевшие место из-за ограниченного количества естественного феромона. Кроме того, выявлено, что феромон, полученный в соответствии с настоящим изобретением, дает эффект формирования спящей личинки при испытании in vivo с использованием C. elegance.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническое решение
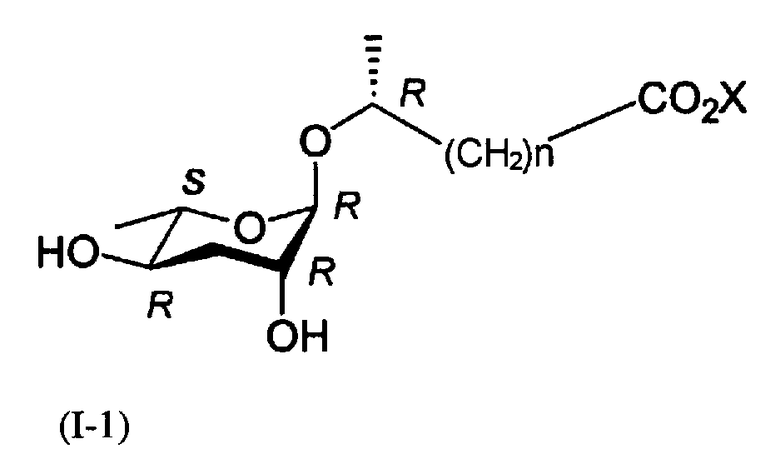
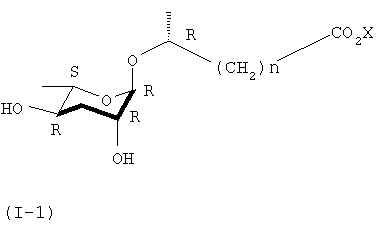
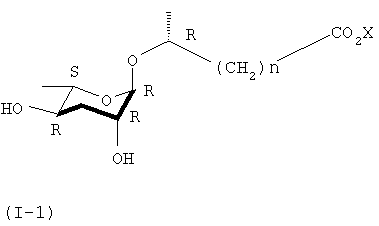
Задачей настоящего изобретения является получение феромонового соединения, имеющего стереохимическую формулу (I-1).
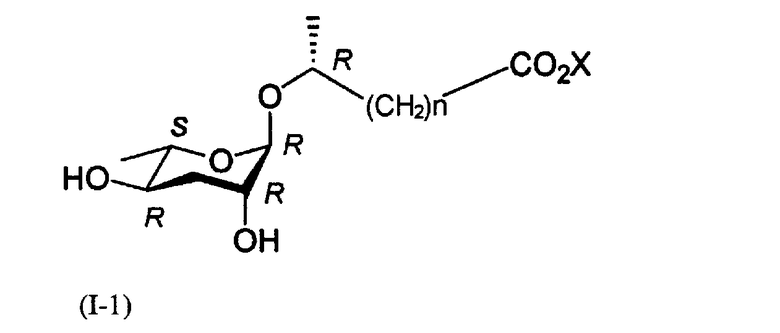
где Х представляет собой водород, щелочной или щелочноземельный металл и n равно целому числу от 1 до 6.
Другой задачей настоящего изобретения является разработка способа массового производства феромона с высоким выходом.
Еще одной задачей настоящего изобретения является определение трехмерной стереохимической конфигурации для точного синтеза феромона.
Следующей задачей настоящего изобретения является получение промежуточного соединения для массового производства феромона с высоким выходом.
Еще одной задачей настоящего изобретения является использование феромона в качестве лекарственного средства для излечения заболеваний, связанных со старением и стрессом.
Краткое описание чертежей
Фиг.1 представляет собой спектр HR-MS-FMB феромона стереохимической формулы (I) в соответствии с настоящим изобретением;
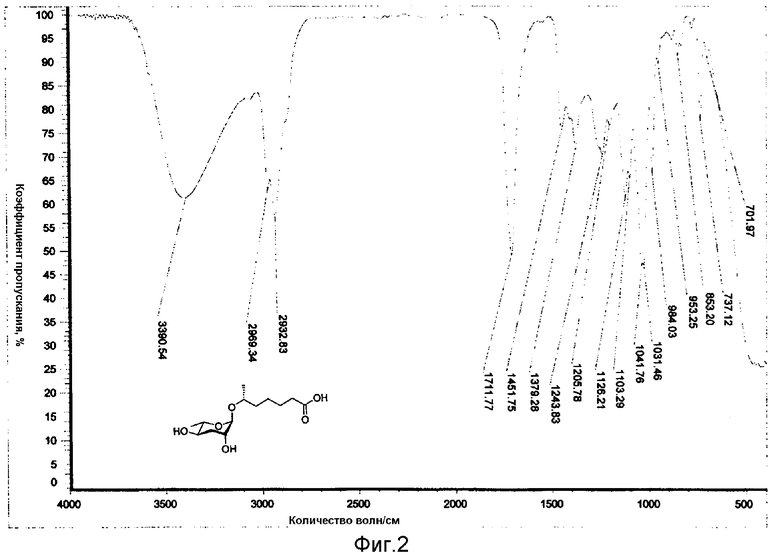
Фиг.2 представляет собой IR (инфракрасный) спектр феромона в соответствии с настоящим изобретением;
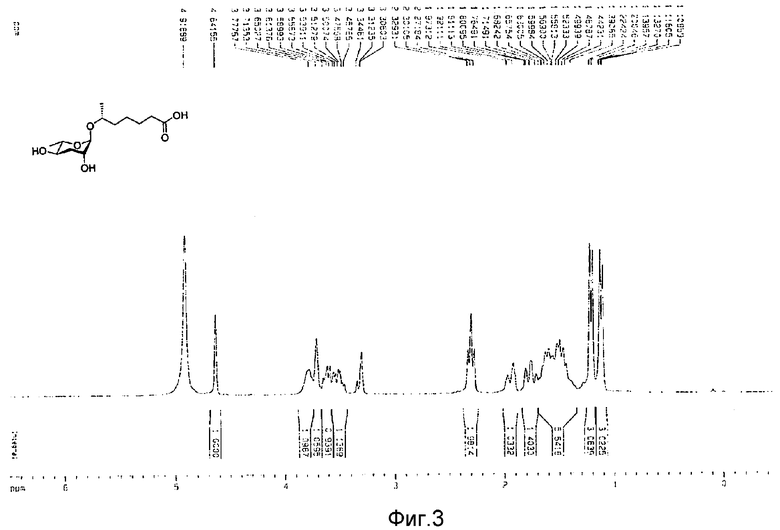
Фиг.3 представляет собой 1Н-ЯМР спектр феромона в соответствии с настоящим изобретением;
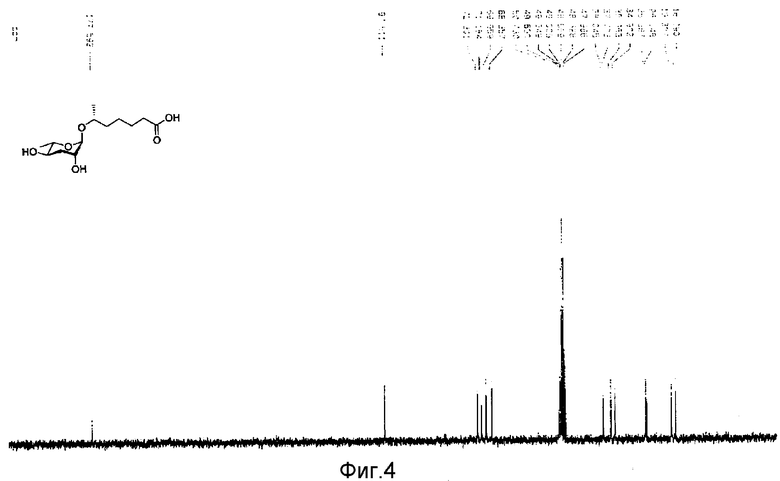
Фиг.4 представляет собой 13С-ЯМР спектр феромона в соответствии с настоящим изобретением;
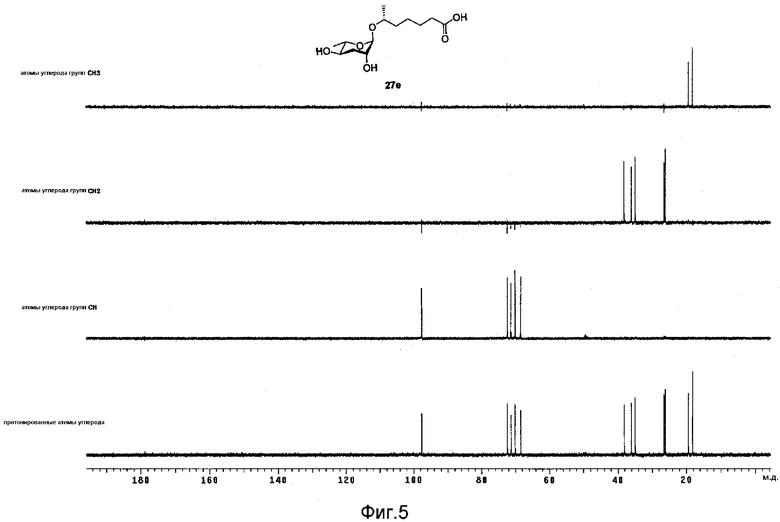
Фиг.5 представляет собой 13С-ЯМР DEPT спектр феромона в соответствии с настоящим изобретением;
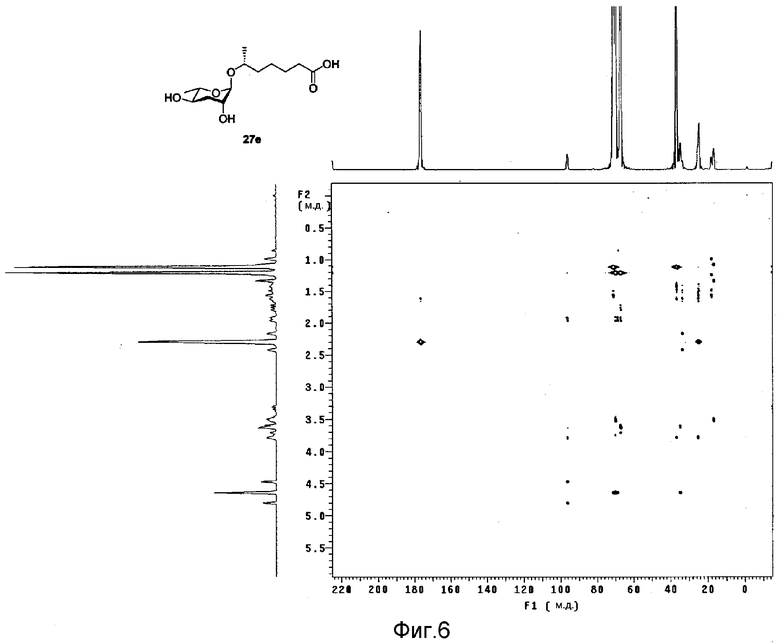
Фиг.6 представляет собой двухмерный ЯМР НМВС спектр феромона в соответствии с настоящим изобретением;
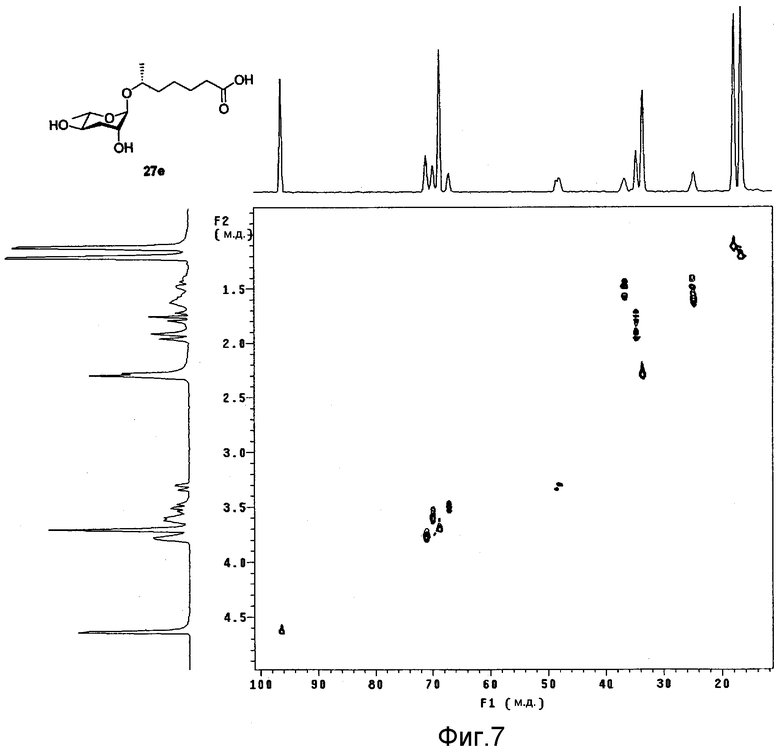
Фиг.7 представляет собой двухмерный ЯМР HMQC спектр феромона в соответствии с настоящим изобретением;
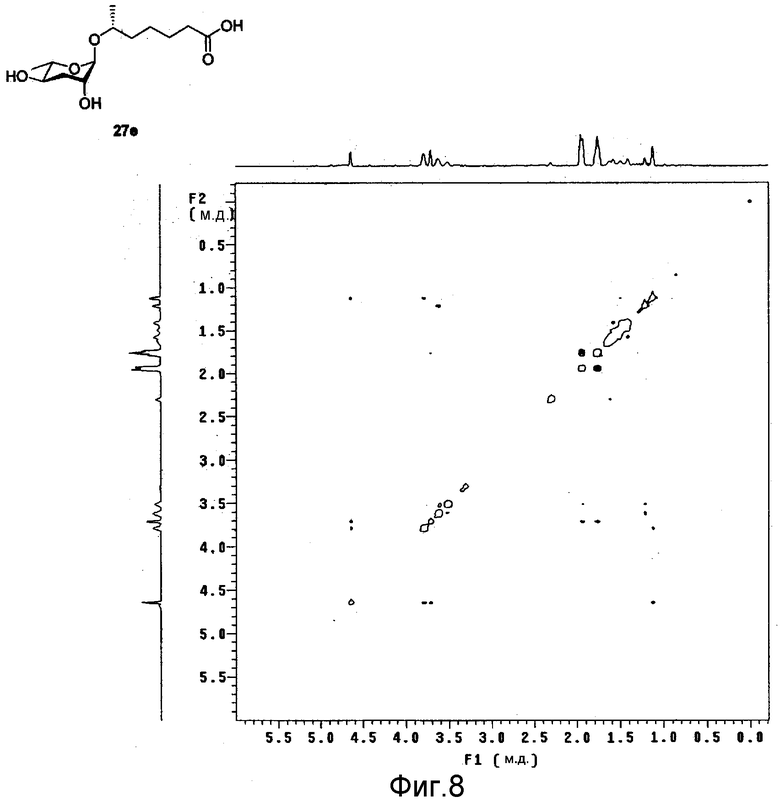
Фиг.8 представляет собой двухмерный ЯМР ROESY спектр феромона в соответствии с настоящим изобретением;
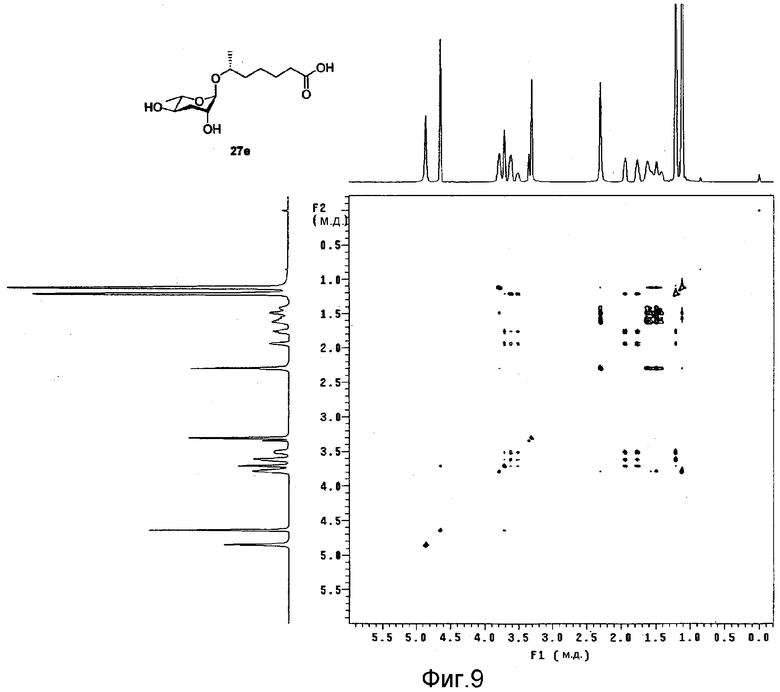
Фиг.9 представляет собой двухмерный ЯМР TOCSY спектр феромона в соответствии с настоящим изобретением;
Фиг.10 представляет собой двухмерный ЯМР NOE(1) спектр феромона в соответствии с настоящим изобретением;
Фиг.11 представляет собой двухмерный ЯМР NOE(2) спектр феромона в соответствии с настоящим изобретением;
Фиг.12 представляет собой двухмерный ЯМР NOE(3) спектр феромона в соответствии с настоящим изобретением;
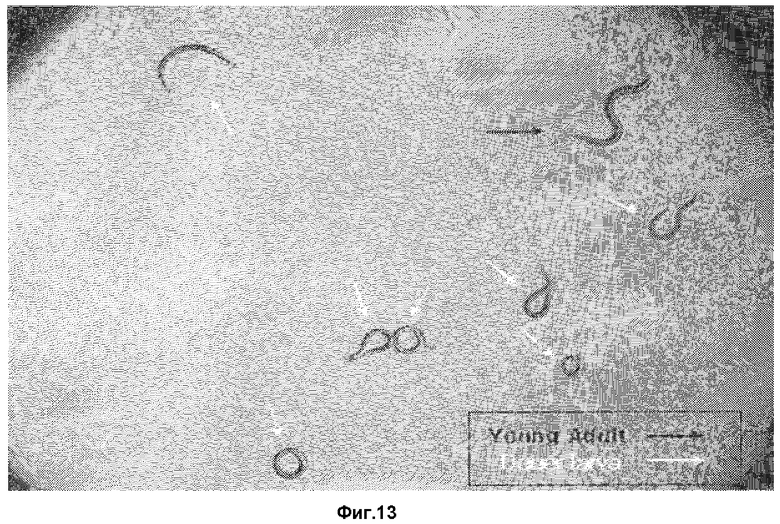
Фиг.13 представляет собой фотографию 1. C.elegance в стадии спящей личинки и взрослая особь C.elegance после обработки синтетическим феромоном (I);
Фиг.14 представляет собой фотографию 2, где показано изображение, иллюстрирующее то, что C.elegance переходит в стадию спящей личинки.
Вариант реализации изобретения
Трехмерную стереохимическую формулу (I) 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты в качестве феромонового соединения, выделенного из C.elegance, определяют в соответствии со спектроскопическим анализом, таким как HR-MASS, IR, DEPT, 2D-NMR(HMBC, HMQC, NOE, ROESY и TOCSY).
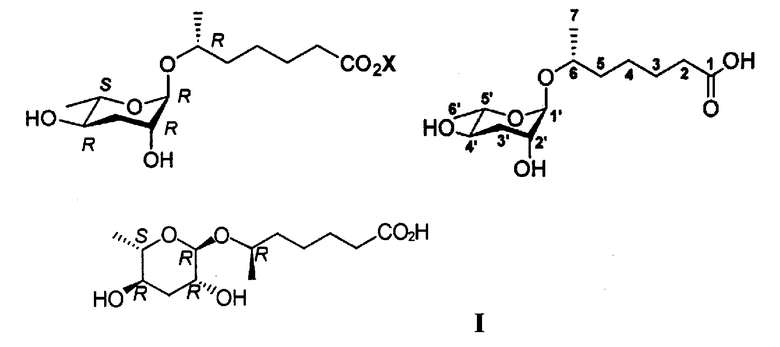
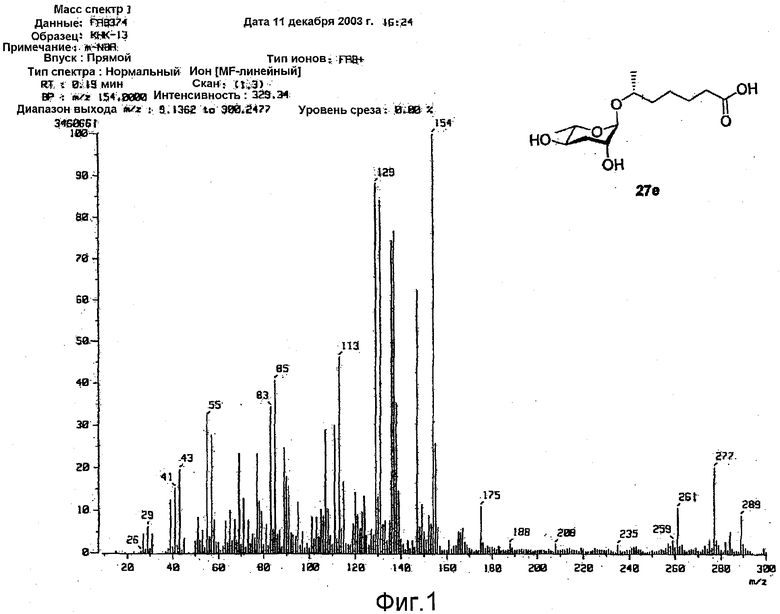
Фактическая молекулярная масса феромона, 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты составляет 276 дальтон, а монокулярная формула феромона представляет собой С13Н24О6. Рассчитанное массовое число высокого разрешения феромона составляет 276,1651. Отмечено, что массовое число высокого разрешения, измеренное высоко разрешающей FAB, составляет 276,1652, и данное массовое число почти идентично рассчитанному массовому числу (см. фиг.1). Функциональные группы относительных карбонильных и гидрокси групп молекулы феромона идентифицированы инфракрасным (IR) анализом (см фиг.2).
Для определения трехмерной стереохимической конфигурации нового феромонового соединения формулы (I) двухмерный протонный ядерный магнитно-резонансный спектр (1Н-ЯМР) измеряют использованием дутрометанола (CD3OD) в качестве растворителя. С-13 ядерный магнитно-резонансный спектр (13С-ЯМР) также измеряют использованием дутрометанола (CD3OD) в качестве растворителя. Химический сдвиг представлен м.д.
После идентификации расположения каждого атома углерода 1Н-ЯМР (см. фиг.3), 13С-ЯМР (см. фиг.4) и DEPT (см. фиг.5), химический сдвиг 1Н и 13С измеряют использованием спектров НМВС (см. фиг.6), HMQC (см. фиг.7), ROESY (см. фиг.8) и TOCSY (см. фиг.9) для идентификации точной связи 1Н и 13С. В таблице 4 показан результат спектра НМВС.
Для измерения стереохимической взаимосвязи в трехмерном пространстве используют технологию двухмерного ЯМР NOE. На фиг.10-12 показан полученный NOE спектр.
6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановую кислоту стереохимической формулы (I) получают реакцией соединения реагентов, представленных формулами (II) и (III).
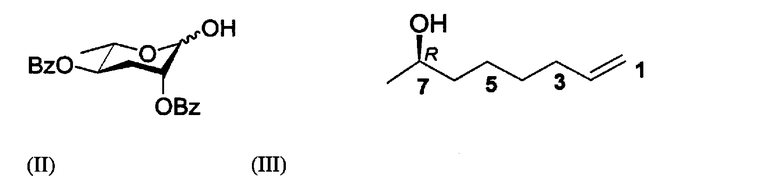
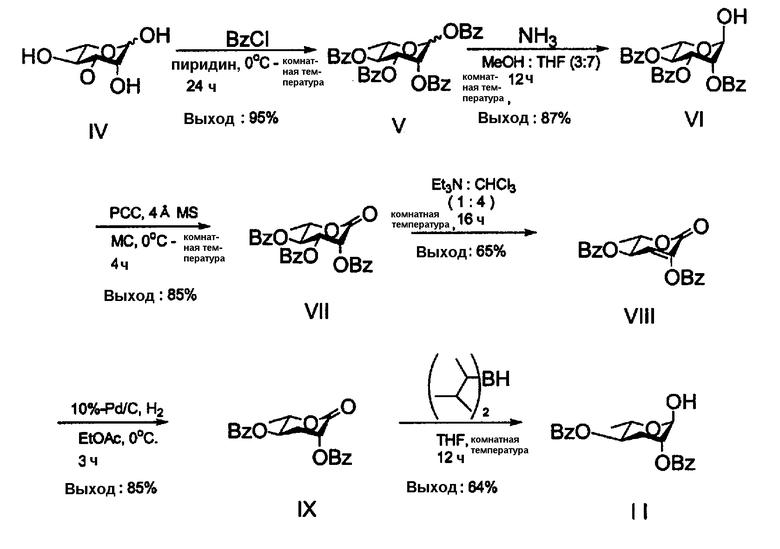
2,4-ди-О-бензоил-3,6-дидезокси-L-арабиногексопиранозу формулы (II) синтезируют, как показано в следующей последовательности реакций 1 из моногидрата L-рамнозы формулы (IV).
(Последовательность реакций 1)
где Bz представляет собой бензоильную или бензильную группу.
Соединение формулы (V) получают из соединения формулы (IV) защитой 4 гидроксильных групп соединения (IV) с использованием бензоилхлорида.
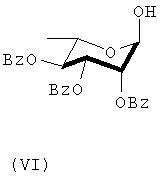
Соединение формулы (VI) получают селективным устранением С-1 бензоильной группы соединения (V) с использованием аммиака.
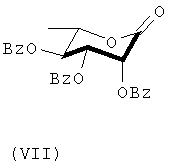
Кетоновое соединение формулы (VII) получают окислением С-1 гидроксильной группы соединения (VI) с использованием хлорохломата пиридиния (РСС). Соединение формулы (VIII) получают селективным отщеплением С-3 бензоильной группы соединения формулы (VII). Соединение формулы (IX) получают из соединения формулы (VIII) посредством гидрирования в присутствии 10% палладиево/углеродного катализатора. В данной точке С-2 О-бензоильная группа соединения формулы (IX) имеет β-направление.
Наконец, восстановлением С-1 кетоновой группы соединения формулы (IX) с использованием хирального диизоамилборгидрида получают α-аномер 2,4-ди-О-бензоил-3,6-дидезокси-L-арабиногексопиранозы (II) в виде стереоспецифического промежуточного соединения С-1.
Другой реагент, соединение формулы (III) получают в соответствии со следующей последовательностью реакций 2 из (R)-(+)-1,2-эпоксипропана в качестве сырьевого материала.
(Последовательность реакций 2)
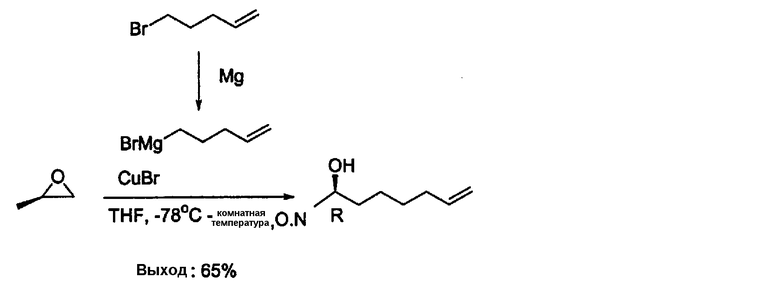
Как показано в последовательности реакций 2, (R)-(+)-1,2-эпоксипропан добавляют к отдельно синтезированному 1М 4-пентенилбромиду магния, получая (2R)-7-октен-2-ол (III).
Соединение формулы (I) получают взаимодействием соединений формул (II) и (III) посредством следующей последовательности реакций 3.
(Последовательность реакций 3)
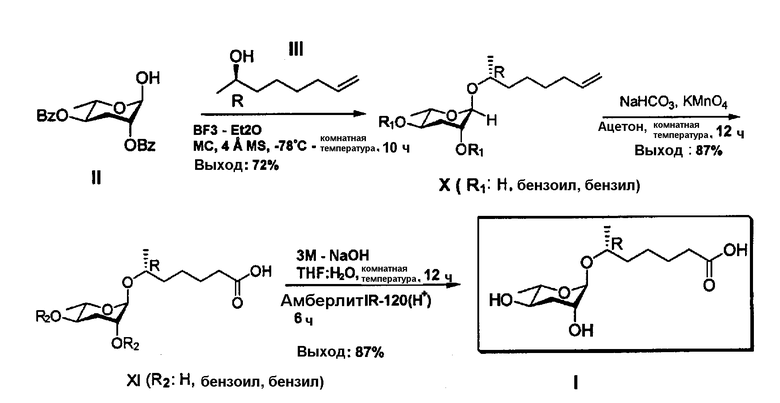
Соединяющее вещество, (2R)-окт-7-ен-2-ил-2,4-ди-О-бензил-3,6-дидезокси-α-L-арабиногексопиранозид (X) получают посредством ацетилирования соединений формул (II) и (III) в присутствии кислоты Льюиса в качестве катализатора. (6R)-6-(2,4-ди-О-бензил-3,6-дидезокси-α-L-арабиногексопиранозил)гептановую кислоту (XI) в виде органической кислоты получают посредством одной реакции концевой алифатической двойной связи соединения формулы (Х) с использованием перманганата калия в качестве окислителя. Наконец, соединение формулы (I) получают отщеплением С-2 и С-4 бензоильных групп соединения формулы (XI) гидроксидом натрия и подкисления с использованием амберлита.
Кроме того, соединение формулы (I) взаимодействует с основанием для образования аддитивных солей соединения формулы (I-1). В качестве основания можно использовать соль щелочного или щелочноземельного металла, которая может быть фармацевтические допустима.
где Х представляет собой водород, щелочной или щелочноземельный металл и n равно целому числу от 1 до 6.
Посредством спектрометрии (двухмерный ЯМР, С-13 ЯМР, IR, HRMS, удельное вращение =[α]D20=-81,0 (c=0,1, MeOH)) отмечено, что спектр полностью синтетического соединения формулы (I) идентичен спектру естественного феромона.
Поскольку общий синтез начинается с L-рамнозы, абсолютная стереоконфигурация которой хорошо известна, а измеренная величина всего спектра соединения формулы (I) идентична таковой естественного феромона, можно отметить, что абсолютная стереоконфигурация естественного феромона, выделенного из C.elegance, представляет собой формулу (I).
Кроме того, в ходе реакций синтеза формулы 3 разнообразные производные формулы (I-1) получают соединением другой алкилорганической кислоты, имеющей 1-6 углеродную цепь, вместо соединения формулы (III).
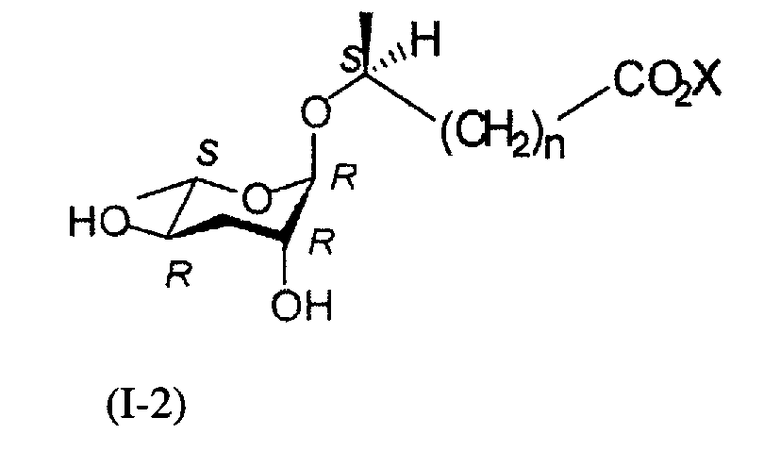
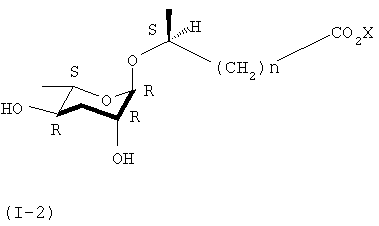
Кроме того, в ходе реакций синтеза формулы 3, когда вступает во взаимодействие 7S-стереоизомер формулы (II), можно синтезировать 6S-стереоизомер (I-2) соединения (I).
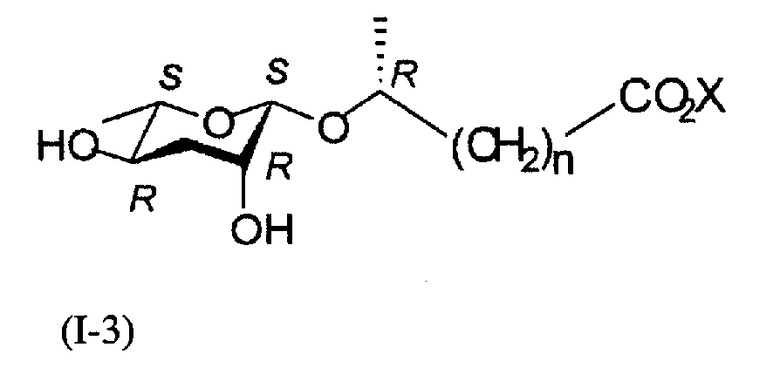
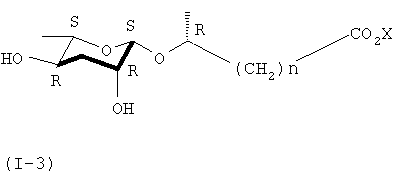
В ходе получения соединения формулы (II) из соединения формулы (IX) в реакции формулы 1, когда используется С-1'β-эпимер соединения формулы (II), можно синтезировать соединение формулы (I-3), имеющее С-1'S-стереоизомер.
где n представляет собой целое число от 1 до 6, а Х представляет собой щелочной или щелочноземельный металл.
С помощью указанного выше синтеза можно осуществить массовое производство феромона (I) согласно изобретению и его производных. Поэтому становится возможным исследовать структуру активного белка-мишени и лекарственную эффективность, в отношении подавления старения и стресса.
Также, было количественно исследовано воздействие 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты (I), синтезированной в соответствии с настоящим способом согласно изобретению, на формирование спящей личинки у C.elegance.
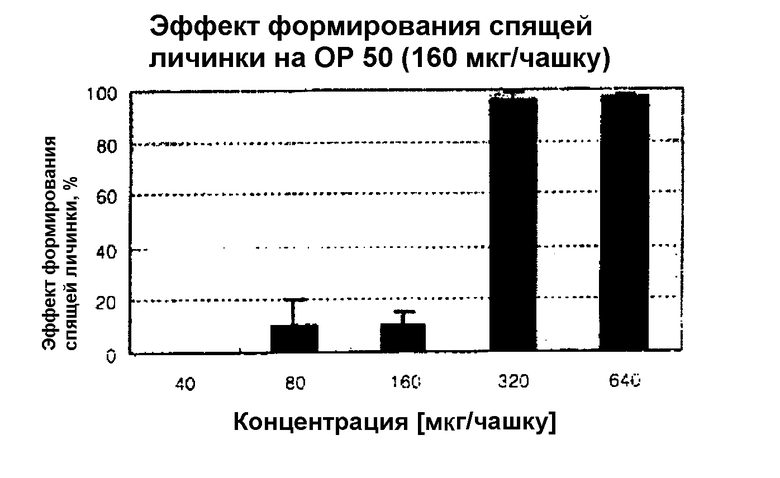
При этом эффект формирования спящей личинки при воздействии синтетического феромона измеряли с использованием C.elegance в отличающихся друг от друга условиях кормления, температуры и плотности выращивания.
Хотя при надлежащих условиях кормления и температуре (15-25°С), и низкой плотности выращивания C.elegance должна перейти из первой половины стадии L2 или второй половины стадии L3 во взрослую стадию, при подмешивании синтетического феромона данные стадии переходят в стадию спящей личинки.
C.elegance в стадии спящей личинки не ест и не двигается, приобретая кольцевидную форму. Для сравнения, наблюдаются 7 C.elegance в стадии спящей личинки и 1 C.elegance на стадии взрослой особи. В результате отмечено, что синтетический феромон в значительной степени воздействует на эффект формирования спящей личинки. На фотографии 1 можно отметить, что C.elegance не растет без движения.
При этом, как показано в таблице 3, можно отметить, что 100% эффекта формирования спящей личинки можно получить, когда используется 320 мкг/чашку синтетического феромона.
Такой результат становится основой для продолжения исследования, и для разнообразных поисков требуется большое количество феромона. Поэтому указанные данные показывают, что синтетический феромон имеет важное значение. То есть, поскольку синтез большого количества феромона и разнообразия производных становится возможным в соответствии с настоящим изобретением, можно ожидать более предпочтительных исследований.
Осуществление изобретения
Далее настоящее изобретение будет описано конкретнее посредством описания иллюстративных вариантов его реализации.
Вариант реализации 1
Синтез 1,2,3,4-тетра-О-бензоил-L-рамнопиранозы (V)
Моногидрат L-рамнозы (IV) (7,5 г, 41,2 ммоль) растворяют в сухом пиридине (100 мл), а затем к нему добавляют бензилхлорид (28,7 мл, 0,247 ммоль) в состоянии, когда температура снижена до 0°С. Температуру реагента постепенно повышают до комнатной температуры и через 16 ч добавляют воду (15 мл), завершая реакцию.
Полученный продукт экстрагируют CH2Cl2 (50 мл × 2). Его промывают 1М HCl (40 мл × 2) и насыщенным раствором NaHCO3 (40 мл) и сушат MgSO4. Раствор концентрируют в вакууме, а затем выделяют соединение (V) (22,7 г, 95%, α:β=2:1) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
V α; аморфное твердое вещество, Rf=0,58 (толуол/EtOAc, 10:1, об./об.);
[α]D22=+82,0 (c=1,5, CHCl3) [расчетная величина 41[α]D=+80,0 (c=1,5, CHCl3)];
IR (пленка) Vmax 3066, 3032, 2986, 1730, 1601, 1452, 1260, 1176, 1094, 1068, 1027, 956 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,22-7,25 (м, 20Н, ароматический Н), 6,57 (д, 1Н, J=1,6 Гц, H-1), 6,01 (дд, 1H, J=3,4, 10,2 Гц, H-3), 5,89 (дд, 1Н, J=1,9, 3,2 Гц, Н-2), 5,82 (т, 1H, J=10,0 Гц, Н-4), 4,41-4,35 (М, 1H, H-5), 1,42 (д, 3H, J=6,2 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 165,8(2), 165,4, 164,1, 134,0, 133,8, 133,6, 133,4, 130,2(2), 130,1(2), 129,8(4), 129,1(2), 129,0(2), 128,8(2), 128,7(2), 128,6(2), 128,4(2), 91,4(С-1,α), 71,3, 70,0, 69,8, 69,4, 17,8(С-6);
Рассчитанная величина HRMS(FAB) для C34H28NaO9 (M++Na) m/z составляет 603,1631, действительно измеренная величина составляет 603,1637.
Вариант реализации 2
Синтез 2,3,4-три-О-бензоил-L-рамнопиранозы (VI)
Соединение (V) (22,4 г, 38,6 ммоль) растворяют в MeOH:THF (3:7, 400 мл), а затем барботируют газообразным NH3 в течение 15 мин при 0°С и перемешивают при 0°С в течение 1 ч. Процесс реакции идентифицируют тонкослойной хроматографией, в то же самое время повторяя описанный выше процесс. Растворитель концентрируют в вакууме и затем выделяют соединение (VI) (16 г, 87%, α:β=14:1) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
VIα; твердое белое вещество, Rf=0,18 (толуол/EtOAc, 10:1, об./об.);
[α]D23=+236,0 (c=1,0, CHCl3);
IR (пленка) Vmax 3458, 3062, 2985, 2935, 1727, 1601, 1451, 1348, 1264, 1102, 1069, 1027 см-1;
1Н ЯМР (250 МГц CDCl3) δ 8,12-7,22 (м, 15Н, ароматический Н), 5,95 (дд, 1Н, J=3,2, 10,1 Гц, H-3), 5,74-5,62 (м, 2Н), 5,49-5,48 (м, 1Н), 4,54-4,43 (м, 1Н, H-5), 4,21 (д, 1Н, J=4,0 Гц, -О), 1,37 (д, 3H, J=6,2 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 166,0, 165,9, 165,8, 133,6, 133,5, 133,3, 130,0(2), 129,9(2), 129,8(2), 129,4, 129,3, 129,2, 128,7(2), 128,5(2), 128,4(2), 92,3(С-1,α), 72,1, 71,5 69,9, 66,7, 17,8(С-6);
Рассчитанная величина HRMS(FAB) для C27H24NaO8 (M++Na) m/z составляет 488,1369, а действительно измеренная величина составляет 499,1372.
Вариант реализации 3
Синтез 2,3,4-три-О-бензоил-L-рамноно-1,5-лактона (VII)
РСС (30 г, 0,139 ммоль) и хорошо высушенные молекулярные сита 4 Å (25 г) добавляют в колбу под потоком N2. Сухой CH2Cl2 (250 мл) добавляют в колбу и содержимое колбы перемешивают в течение 1 ч при комнатной температуре и охлаждают до 0°С. Добавляют соединение (VI) (16 г, 33,6 ммоль), растворенное в сухом CH2Cl2 (250 мл), и перемешивают 4 ч при комнатной температуре. Реакцию заканчивают добавлением холодного Et2O (200 мл) и фильтруют силикагелем. Растворитель концентрируют в вакууме, а затем выделяют соединение (VII) (13,54 г, 85%) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
VII; аморфное белое твердое вещество, Rf=0,51 (толуол/EtOAc, 10:1, об./об.);
[α]D22=-10,0 (c=0,5, CHCl3);
IR (пленка) Vmax 3064, 3031, 2983, 2936, 1784, 1730, 1601, 1452, 1393, 1259, 1096, 1026 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,10-7,29 (м, 15Н, ароматический Н), 6,28 (д, 1Н, J=3,8 Гц), 6,05 (дд, 1Н, J=1,4 3,8 Гц), 5,34 (дд, 1Н, J=1,4, 11,0 Гц), 4,96-4,85 (м, 1Н, Н-5), 1,61 (д, 3Н, J=6,3 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 165,9(С-1), 165,1, 164,9, 164,8, 134,0, 133,9, 133,8, 130,1(4), 130,0(2), 128,7(5), 128,5(3), 128,4, 74,8, 74,1, 71,8, 67,6, 19,0(С-6).
Рассчитанная величина HRMS(FAB) для C27H23O8 (M++Н) m/z составляет 475,1393, а действительно измеренная величина составляет 475,1393.
Вариант реализации 4
Синтез 2,4-ди-О-бензоил-3,6-дидезокси-L-эритрогекс-2-еноно-1,5-лактона (VIII)
Соединение (VII) (13,2 г, 27,8 ммоль) растворяют в Et3N:CHCl3 (1:4, 500 мл) под потоком N2 и содержимое колбы перемешивают в течение 16 ч при комнатной температуре. После окончания реакции реакционную смесь промывают водой. Органический слой сушат с использованием безводного MgSO4. Раствор концентрируют в вакууме, а затем выделяют соединение (VIII) (6,37 г, 65%) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
VIII; кристаллическое белое твердое вещество, Rf=0,53 (толуол/EtOAc, 10:1, об./об.);
Точка плавления 108-112°С (расчетн. [40] точка плавления 107-110°С);
[α]D21=-93,1 (c=1,0, CHCl3) [расчетная величина [43] [α]D20=-93,0 (c=1,0, CHCl3)];
IR (пленка) Vmax 3069, 3007, 2936, 2920, 1738, 1674, 1598, 1452, 1355, 1257, 1155, 1115, 1060 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,13-7,44 (м, 10Н, ароматический Н), 6,71 (д, 1Н, J=4,3 Гц, Н-3), 5,69 (т, 1Н, J=4,7 Гц, Н-4), 5,00-4,90 (м, 1Н, Н-5), 1,64 (д, 3Н, J=6,7 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 165,5, 164,3, 158,0(С-2), 140,8, 134,3, 133,9, 130,5(2), 130,0(2), 128,7(5), 127,9, 125,6, 77,4, 68,6, 18,4(С-6);
Рассчитанная величина HRMS(FAB) для C20H17O6 (M++Н) m/z составляет 353,1025, а действительно измеренная величина составляет 353,1023.
Вариант реализации 5
Синтез 2,4-ди-О-бензоил-3,6-дидезокси-L-арабиногексон-1,5-лактона (IX)
Соединение (VIII) (6,1 г, 17,31 ммоль) растворяют в EtOAc (300 мл), а затем добавляют 10%-Pd/C (400 мг) и перемешивают в течение 3 ч при комнатной температуре после замещения газообразным водородом. Реагент фильтруют с использованием целита 545. Раствор концентрируют в вакууме, а затем выделяют соединение (IX) (5,2 г, 85%) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
IX; белое твердое вещество, Rf=0,45 (толуол/EtOAc, 10:1, об./об.);
[α]D21=+18,4 (c=1,0, CHCl3) [расчетная величина [43] [α]D20=+18,2 (c=1,0, CHCl3)];
IR (пленка) Vmax 3031, 2982, 2939, 1724, 1601, 1452, 1383, 1273, 1114, 1070, 1028 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,11-7,43 (м, 10Н, ароматический Н), 5,90 (дд, 1Н, J=7,6, 12,0 Гц, Н-2), 5,30-5,25 (м, 1Н, Н-4), 4,87-4,77 (м, 1Н, Н-5), 2,78-2,52 (м, 2Н, Н-3экв., 3акс.), 1,58 (д, 3Н, J=6,5 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 168,0(С-1), 165,5(2), 133,9, 133,8, 130,2(2), 129,9(2), 129,1, 129,0, 128,8(2), 128,6(2) 76,9, 70,5, 65,0, 30,2(С-3), 19,3(С-6);
Рассчитанная величина HRMS(FAB) для C20H19O6 (M+ +Н) m/z составляет 355,1182, а действительно измеренная величина составляет 355,1178.
Вариант реализации 6
Синтез 2,4-ди-О-бензоил-3,6-дидезокси-L-арабиногексопиранозы (II)
(1) Получение 0,5 М диизоамилборгидрида
1М BH3-THF (65 мл) охлаждают до -10°С под потоком N2, а затем постепенно добавляют 2М 2,3-диметил-2-бутена (65 мл). Раствор перемешивают в течение 2 ч при 0°С и используют в реакции (2).
(2) Синтез 2,4-ди-О-бензоил-3,6-дидезокси-L-арабиногексопиранозы (II)
Соединение (IX) (5 г, 14,11 ммоль), растворенное в сухом THF (ТГФ) (15 мл) добавляют к 0,5М диизоамилборгидрида (127 мл), полученного в реакции (1). Затем его перемешивают в течение 20 ч при комнатной температуре. После окончания реакции добавляют воду (3 мл) и затем перемешивают в течение 30 мин. Реакционную смесь охлаждают до 0°С, и затем добавляют 30% Н2О2 (15 мл) и добавляют 3N NaOH для поддержания рН 7-8. Растворитель THF концентрируют в вакууме и затем его растворяют в CH2Cl2 (100 мл) и промывают водой (50 мл). Органический слой сушат с использованием MgSO4. Раствор концентрируют в вакууме и затем выделяют соединение (II) (4,72 г, 93,8%, α:β=4,6:1) с использованием колоночной флэш-хроматографии (толуол/EtOAc, 10:1, об./об.).
II α; бесцветный сироп, Rf=0,23 (толуол/EtOAc, 10:1, об./об.);
[α]D24=+51,4 (c=1,0, CHCl3);
IR (пленка) Vmax 3448, 3065, 3027, 2979, 1720, 1601, 1452, 1270, 1112, 1095, 1068, 1025 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,15-7,43 (м, 10Н, ароматический Н), 5,29 (с, 1Н, Н-1), 5,25-5,15 (м, 2Н, H-2, Н-4), 4,39-4,28 (м, 1Н, Н-5), 3,51 (д, 1Н, J=3,6 Гц, -ОН), 2,44 (тд, 1Н, J=3,8, 13,5 Гц, Н-3экв.), 2,29 (ддд, 1Н, J=3,1, 11,0, 13,7 Гц, Н-3акс.), 1,30 (д, 3Н, J=6,2 Гц, -CH3);
13С ЯМР (62,9 МГц, CDCl3) δ 166,0 165,8, 133,5, 133,4, 130,0(3), 129,8(3), 128,6(4), 91,1(С-1, α), 71,0(С-2), 70,7(С-4), 67,0(С-5), 29,2(С-3), 18,0(С-6);
Рассчитанная величина HRMS(FAB) для C20H21O6 (M++Н) m/z составляет 357,1338, а действительно измеренная величина составляет 357,1334.
Вариант реализации 7
Синтез (2R)-7-октен-2-ола (III)
(1) Синтез бромида 4-пентенилмагния
5-бром-1-пентен (2,8 мл, 23,5 ммоль), растворенный в сухом THF (20 мл), по каплям добавляют к суспензии Mg (571 мг, 23,5 ммоль), растворенного в сухом THF (3 мл) в течение более 30 мин. Реакционную смесь кипятят с обратным холодильником в течение 3 ч при 60°С, после чего ее охлаждают до комнатной температуры, получая посредством этого раствор Гриньяра.
(2) Синтез (2R)-7-О-октен-2-ола (III)
(R)-(+)-1,2-эпоксипропан (1,12 мл, 16,0 ммоль) растворяют в сухом THF (23 мл) и в него добавляют CuBr (230 мг, 1,6 ммоль), после чего температуру снижают до -78°С. В реакционную смесь добавляют 1М раствор бромида 4-пентенилмагния (23 мл, 23,5 ммоль), полученный в реакции (1). Температуру постепенно повышают до комнатной температуры, и смесь перемешивают в течение 4 ч. Реакцию заканчивают насыщенным раствором NH4Cl (10 мл). Полученный продукт экстрагируют Et2O (20 мл × 2), и его промывают водой (10 мл). Органический слой сушат с использованием безводного MgSO4. Раствор концентрируют в вакууме, а затем выделяют соединение (III) (1,3 г, 65%) с использованием колоночной флэш-хроматографии (Et2O/н-пентен, 5:1, об./об.).
III; бесцветная жидкость, Rf=0,15 (Et2O/н-пентен, 5:1, об./об.);
[α]D23=-10,7 (c=0,28, CHCl3);
IR (пленка) Vmax 3357, 2969, 2930, 2858, 1641, 1460, 1416, 1374, 1305, 1122 см-1;
1Н ЯМР (250 МГц CDCl3) δ 5,89-5,73 (м, 1Н, Н-2), 5,03-4,92 (м, 2Н, Н-1), 3,80-3,78 (м, 1Н, H-7), 2,07 (м, 2Н, Н-3), 1,43-1,39 (м, 6Н, H-4, 5, 6), 1,18 (д, 3Н, J=6,1 Гц, -CH3);
13С ЯМР (62,9 МГц CDCl3) δ 138,9(С-2), 114,4(С-1), 68,0(С-7), 39,2(С-6), 33,8(С-3), 29,0(С-4), 25,3(С-5), 23,5(С-8);
Вариант реализации 8
Синтез (2R)-окт-7-ен-2-ил-2,4-ди-О-бензил-3,6-дидезокси-α-L-арабино-гексопиранозида (Х)
Соединение (II) (2,0 г, 5,61 ммоль, 1 эквивалент), соединение (III) (1,08 г, 8,42 ммоль) и молекулярные сита 4 Å (200 г) растворяют в сухом CH2Cl2 (30 мл) в потоке N2, после чего температуру понижают до 0°С. Постепенно добавляют BF3-Et2O (2,85 мл, 16,8 ммоль, 4 эквивалента) и перемешивают в течение 10 ч, после чего добавляют Et3N (5 мл), и реакцию заканчивают и реакционную смесь фильтруют. Раствор концентрируют в вакууме, а затем выделяют соединение (Х) (1,89 г, 72%) с использованием колоночной флэш-хроматографии (н-гексан/EtOAc, 5:1, об./об.).
VII; бесцветный сироп, Rf=0,55 (н-гексан/EtOAc, 5:1, об./об.);
[α]D22=+0,9 (c=1,0, CHCl3);
IR (пленка) Vmax 3069, 2974, 2933, 2859, 1723, 1602, 1451, 1316, 1267, 1152, 1108, 1068, 1025 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 8,14-7,42 (м, 10Н, ароматический Н), 5,93-5,76 (м, 1Н), 5,26-5,16 (м, 2Н, H-2, Н-4), 5,07-5,00 (м, 3Н, Н-1), 4,20-4,09 (м, 1Н, Н-5), 3,85 (м, 1Н), 2,48-2,41 (м, 1Н, Н-3′экв.), 2,28-2,17 (м, 1Н, Н-3′экв.), 2,11 (м, 2Н), 1,68-1,37 (м, 6Н), 1,30 (д, 3Н, J=6,2 Гц), 1,20 (д, 3Н, J=6,1 Гц);
13С ЯМР (62,9 МГц, CDCl3) δ 165,9 165,7, 138,9, 133,3, 133,2, 129,9(3), 129,6(2), 128,5(4), 114,5, 93,8(С-1′, α), 72,5, 71,3, 70,7, 67,0, 37,0, 33,8, 29,8, 28,8, 25,3, 19,2, 17,9;
Рассчитанная величина HRMS(FAB) для C28H35O6 (M++Н) m/z составляет 467,2434, а действительно измеренная величина составляет 467,2438.
Вариант реализации 9
Синтез (6R)-6-(2,4-ди-О-бензоил-3,6-дидезокси-α-L-арабиногексопиранозил)гептановой кислоты (XI)
Соединение (Х) (1,8 г, 3,86 ммоль) растворяют в ацетоне, а затем к нему добавляют NaHCO3 (972 мг, 11,57 ммоль). Затем постепенно добавляют KMnO4 (3 г, 19,29 ммоль), и раствор перемешивают в течение 12 ч. После окончания реакции реакционную смесь подкисляют с использованием 10% HCl (20 мл). Полученный продукт экстрагируют EtOAc (100 мл × 2) и промывают соляным раствором (70 мл). Органический слой сушат с использованием безводного MgSO4. Раствор концентрируют в вакууме, а затем выделяют соединение (XI) (1,51 г, 87%) с использованием колоночной флэш-хроматографии (н-гексан/EtOAc, 5:1, об./об.).
XI; бесцветный сироп, Rf=0,13 (гексан/EtOAc, 5:1, об./об.);
[α]D22=-1,9 (c=1,0, CHCl3);
IR (пленка) Vmax 3063, 2973, 2935, 1721, 1602, 1451, 1316, 1267, 1109, 1068, 1025 см-1;
1Н ЯМР (250 МГц, CDCl3) δ 10,69 (шир.с, 1Н, ОН), 8,14-7,42 (м, 10Н, ароматический Н), 5,26-5,17 (м, 2Н, H-2′, Н-4′), 4,98 (с, 1Н, Н-1′), 4,19-4,08 (м, 1Н, Н-5′), 3,87 (м, 1Н), 2,47-2,36 (м, 3Н), 2,28-2,17 (м, 1Н, Н-3′акс.), 1,72-1,45 (м, 6Н), 1,31 (д, 3Н, J=6,2 Гц), 1,21 (д, 3Н, J=6,0 Гц);
13С ЯМР (62,9 МГц, CDCl3) δ 179,8 165,8, 165,7, 133,3, 133,2, 130,0, 129,9(2), 129,8, 129,7(2), 128,5(4), 93,8(С-1′, α), 72,4, 71,2, 70,7, 67,1, 36,7, 34,0, 29,7, 25,2, 24,6, 19,1, 17,9;
Рассчитанная величина HRMS(FAB) для C27H33O8 (M++Н) m/z составляет 485,2175, а действительно измеренная величина составляет 485,2165.
Вариант реализации 10
Синтез (6R)-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты (I)
Соединение (XI) (472,9 мг, 0,976 ммоль) растворяют в MeOH (20 мл). NaOMe (52,7 мг, 0,976 ммоль) добавляют при 0°С. Температуру постепенно повышают до комнатной температуры, и смесь перемешивают в течение 12 ч. После окончания реакции MeOH концентрируют в вакууме. Затем для удаления побочного продукта метилбензоата, его растворяют в воде (20 мл) и промывают CH2Cl2 (20 мл × 5). рН слоя раствора доводят с использованием амберлита IR-120(H+) (500 мг). После фильтрации воду удаляют из слоя раствора способом лиофилизации, а затем выделяют соединение (I) (234,6 мг, 87%) с использованием колоночной флэш-хроматографии (EtOAc/MeOH, 11:1, об./об.).
I; бесцветное масло, Rf=0,43 (EtOAc/MeOH, 11:1, об./об.);
[α]D20=-81,0 (c=0,1, MeOH);
IR (пленка) Vmax 3391, 2969, 2933, 1712, 1452, 1379, 1244, 1126, 1103, 1042, 1031 см-1;
1Н ЯМР (500 МГц, CD3OD) δ 4,64 (с, 1Н, Н-1′), 3,80-3,77 (м, 1Н, Н-6), 3,72-3,71 (м, 1Н, H-2′), 3,63-3,59 (м, 1Н, Н-5′), 3,54-3,49 (м, 1Н, Н-4′), 2,30 (т, 2Н, J=7,5 Гц, Н-2), 1,96-1,92 (м, 1Н, Н-3′экв.), 1,79-1,74 (м, 1Н, Н-3′акс.), 1,61 (м, 2Н, Н-3), 1,56-1,50 (м, 2Н, Н-5), 1,47 (м, 2Н, H-4), 1,21 (д, 3Н, J=6,5 Гц, Н-6′), 1,12 (д, 3Н, J=6,5 Гц, Н-7);
13С ЯМР (125,7 МГц, CD3OD) δ 177,7(С-1) 97,6(С-1′, α), 72,4(С-6), 71,3(С-5′), 70,1(С-2′), 68,5(С-4′), 38,2(С-5), 36,1(С-3′), 35,0(С-2), 26,5(С-3), 26,1(С-4), 19,4(С-7), 18,2(С-6');
Рассчитанная величина HRMS(FAB) для C13H25O6 (M++Н) m/z составляет 277,1651, а действительно измеренная величина составляет 277,1652.
Вариант реализации 11
Синтез основно-аддитивных солей (I-1; n=4, X=Na) 6R-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты (I)
Соединение (I) (267 мг, 1,0 ммоль) растворяют в MeOH (10 мл). NaOMe (40,0 мг, 1,0 ммоль) добавляют при 0°С. Затем температуру постепенно повышают до комнатной температуры, и смесь перемешивают в течение 1 ч. После окончания реакции MeOH концентрируют в вакууме и фильтруют. Затем воду удаляют из слоя раствора способом лиофилизации, и выделяют соединение (I-1) (271 мг, 95%).
Пример испытания
Измерение активности в отношении эффекта формирования спящей личинки
Для идентификации эффекта формирования спящей личинки, достигаемого при использовании феромона согласно изобретению, активность измеряют после доставки феромонового соединения в S. основную агаровую среду для культивирования без пептона (Vowels and Thomas, Genetics 130: 105-123, 1992).
Активность в отношении эффекта формирования спящей личинки при использовании соединения согласно изобретению в отношении C.elegance показана в виде таблицы 3.
Промышленная применимость
Как описано выше, в настоящем изобретении впервые определена стереохимическая конфигурация (6R)-6-(3,6-дидезокси-L-арабиногексопиранозилокси)гептановой кислоты и ее солей. На основании данного факта, был успешно выполнен эффективный полный синтез, таким образом, преодолевающий недостатки, связанные с небольшим выделением феромона, получаемого из C.elegance, для обеспечения возможности массового производства феромона.
Соответственно, становится возможной разработка лекарственных средств, содержащих данный феромон, воздействующих на старение, стресс, метаболизм, систему передачи сигналов in vivo, средства против рака, ожирения, а также средств, подавляющих старение и стресс. Кроме того, становится также возможным исследование структуры активного белка-мишени для феромона в организме.
Хотя настоящее изобретение было конкретно показано и описано со ссылкой на иллюстративные варианты его реализации, средним специалистам в данной области будет понятно, что в него можно внести различные изменения по форме и деталям без отхода от сущности и объема настоящего изобретения, определенных следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАКОЛОГИЧЕСКИ АКТИВНОЕ СОЕДИНЕНИЕ НОВОГО ДАУЭР-ФЕРОМОНА СПЯЩЕГО СОСТОЯНИЯ, СПОСОБ ДЛЯ ЕГО ВЫДЕЛЕНИЯ И ОПРЕДЕЛЕНИЯ (ХАРАКТЕРИЗАЦИИ) | 2003 |
|
RU2303596C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ У МЛЕКОПИТАЮЩИХ | 2004 |
|
RU2344121C2 |
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ИМИДАЗО[4,5-с]ПИРИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕЦЕПТОРА ГИСТАМИНА 4 (hH4R) | 2012 |
|
RU2628074C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БИЦИКЛО [3.1.0]ГЕКСАНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ЭТОЙ ЦЕЛИ | 2004 |
|
RU2388747C2 |
| ПРОИЗВОДНЫЕ ГАЛАНТАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2241001C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2366659C2 |
| СПОСОБ ПОЛУЧЕНИЯ (3S,4S)-4-((R)-2-(БЕНЗИЛОКСИ)ТРИДЕЦИЛ)-3-ГЕКСИЛ-2-ОКСЕТАНОНА И ИСПОЛЬЗУЕМОГО ДЛЯ ЭТОГО НОВОГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2009 |
|
RU2471790C1 |
| СИНТЕЗ ЭПОТИЛОНОВ, ИХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ, АНАЛОГОВ И ИХ ПРИМЕНЕНИЯ | 2003 |
|
RU2462463C2 |
| СИНТЕЗ ЭПОТИЛОНОВ, ИХ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ, АНАЛОГОВ И ИХ ПРИМЕНЕНИЯ | 2003 |
|
RU2311415C2 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |

Изобретение относится к новым феромоновым соединениям
где X представляет собой водород или щелочной металл, а n равно целому числу от 1 до 6; к новым промежуточным соединениям, а также к способу получения феромонового соединения, имеющего стереохимическую формулу (I-1). Становится возможной разработка лекарственных веществ с использованием феромона, воздействующих на старение, стресс, метаболизм, систему передачи сигналов in vivo, а также средств против рака, ожирения и средств, подавляющих старение и стресс. 6 н. и 7 з.п. ф-лы, 14 ил., 4 табл.
где Х представляет собой водород или щелочной металл, а n равно целому числу от 1 до 6.
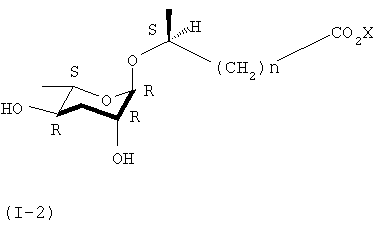
где Х представляет собой водород или щелочной металл, а n равно целому числу от 1 до 6.
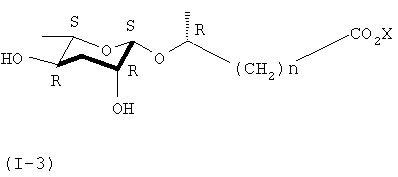
где Х представляет собой водород или щелочной металл, а n равно целому числу от 1 до 6.
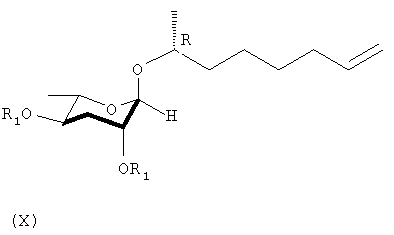
где R1 представляет собой бензоильную группу.
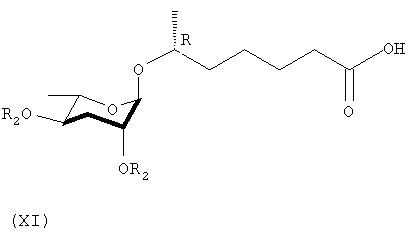
где R2 представляет собой бензоильную группу.

который включает этапы ацеталирования соединения формулы (II), где Bz представляет собой бензоильную группу
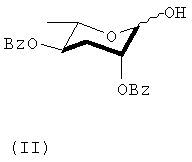
соединением формулы (III)
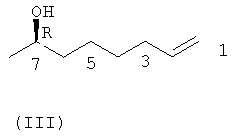
в присутствии катализатора, представляющего собой кислоту Льюиса, с получением соединения формулы (X) по п.6;
превращения алифатической концевой двойной связи полученного продукта сочетания формулы (X) в органическую кислоту формулы (XI) по п.7 с использованием окислителя; и
отщепления О-бензоильной защитной группы от дезоксирамнозильной группы основанием и подкислением кислотой.
| Swinderen В | |||
| et al | |||
| «A C | |||
| Elegans pheromone antagonizes volatile anesthetic action through a go-coupled pathway», Genetics, 2002, v.161(1), p.109-119 | |||
| СПОСОБ СТИМУЛИРОВАНИЯ РОСТА И РАЗВИТИЯ ПЧЕЛИНЫХ СЕМЕЙ | 1997 |
|
RU2146866C1 |
| АНТИГЛЮКОКОРТИКОИДНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2125446C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОЯЗВЕННЫМ, КАРДИОПРОТЕКТИВНЫМ И ПРОТИВОШОКОВЫМ ДЕЙСТВИЕМ | 2001 |
|
RU2211213C2 |
Авторы
Даты
2008-03-27—Публикация
2004-11-15—Подача