Область техники изобретения
Настоящее изобретение относится к новым производным пиридина, обладающим ингибиторной активностью в отношении продуцирования цитокинов, которые, как известно, вовлечены в воспалительные реакции, и поэтому указанные производные могут быть использованы в качестве терапевтических средств при лечении заболеваний, связанных с воспалением, иммунным, хроническим воспалением, а также в качестве средства, обладающего противовоспалительным и анальгезирующим действием. Кроме того, настоящее изобретение относится к способу получения вышеуказанных производных и к содержащей их фармацевтической композиции.
Предпосылки изобретения
Воспалительная реакция, защитный механизм организма состоит из крайне сложной передачи биологических сигналов, запускаемой при иммунологическим восприятием воспалений или поражений и вызываемой различными цитокинами воспаления. Обычно заболевание, разрушающее нормальные ткани в результате расстройств при такой воспалительной реакции, называют “воспалительным заболеванием” и для выяснения деталей этого механизма по всему миру проводились обширные исследования. Кроме того, повышение количества воспалительных цитокинов связано с различными аутоиммунными заболеваниями.
Система передачи сигналов, связанная с воспалением, представляет собой серии цепных реакций фосфорилирование-дефосфорилирование и, в основном, делится на три стадии: 1) начальная стадия передачи воспалительного сигнала в биомембране с биомембранным рецептором, запуская таким образом серию цепных реакций передачи сигналов; 2) терминальная стадия контроля экспрессии генов, кодирующих белок, связанный с воспалением, с помощью транскрипционных факторов ядра; и 3) промежуточная стадия, которая включает серию цепных реакций передачи сигналов, которая является звеном между начальной стадией и терминальной стадией.
Примерами хорошо известного воспалительного сигнального фактора в начальной стадии являются фактор некроза опухоли (TNF; также называемый TNF-α) и интерлейкин-1 (IL-1). Примерами хорошо известного воспалительного сигнального фактора в терминальной стадии являются активирующий белок-1 (AP-1; активирующий белок-1), транскрипционный фактор каппа B ядра (NFκB) и фактор активированных T-клеток ядра (NFAT). Цепные реакции в промежуточной стадии не достаточно изучены, но очевидно, что липокортин, циклооксигеназа-1,2 и PLA2 включены в эту стадию.
Что касается факторов воспаления, то TNF-α, продуцируемый, главным образом, активированными макрофагами и T-клетками, является наиболее эффективным цитокином и стимулирует продуцирование других таких воспалительных цитокинов, как IL-1, IL-6 и IL-8, а также продукцию таких транскрипционных факторов, как NK-κB и с-jun/Ap-1. На самом деле, TNF-α связан с развитием воспалительных заболеваний или таких иммунных заболеваний, как токсический шок, инсулинозависимый сахарный диабет, рассеянный склероз, ревматоидный артрит, остеоартрит, болезнь Крона и язвенный колит. В частности, TNF-α также связан с хроническими воспалительными заболеваниями, такими как псориатический артрит, псориаз, анкилозирующий спондилит, болезнь Стилла у взрослых, полимиозит, дерматомиозит и васкулит, такой как болезнь Бехчета и грануломатоз Вегенера. IL-1 также представляет собой сильный воспалительный цитокин, сопоставимый с TNF-α и усиливающий экспрессию таких генов, как PLA2 2, COX-2 и iNOS, и в результате, повышает продукцию PAF, PGE2 и NO, таким образом индуцируя воспалительные реакции. IL-1α и IL-1β оба связаны с аутоиммунными заболеваниями, такими как ревматоидный артрит и инсулинозависимый сахарный диабет. IL-1β, подобно TNF-α, также является важным медиатором септического шока и сердечно-легочной недостаточности, острого респираторного синдрома и полиорганной недостаточности. IL-6 представляет собой многофункциональный цитокин, продуцируемый различными клетками, и связан с заболеваниям, таким как множественная миелома, псориаз, постклимактерический остеопороз, травма ЦНС, вирусный и бактериальный минингит, болезнь Кастлемана, гломерулонефрит, деменция при СПИДе, некоторые нервные заболевания, такие как болезнь Альцгеймера, специфическая лейкемия и системная красная волчанка. IFN-γ первоначально продуцируется T-клетками и NK-клетками и связан с реакцией “трансплантат против хозяина”, астмой и другими воспалительными заболеваниями, такими как атопическое заболевание. Кроме того, IL-8 связан с такими заболеваниями, как инсульт, инфаркт миокарда, острый респираторный дистресс синдром, посттравматическое полиорганное поражение, острый гломерулонефрит, дерматит, гнойный менингит или другие поражения ЦНС, парагемодиализ и некротический энтероколит.
Кроме того, простагландины, как известно, играют важную роль в воспалительной реакции. Ингибирование продукции простагландинов, главным образом, PGG2, PGH2 и PGE2, играет основную роль в разработке противовоспалительных средств. Например, продукция простагландинов может быть ингибирована путем ингибирования циклооксигеназы (COX), которая индуцирована воспалительными цитокинами. Следовательно, продукция простагландинов может быть ингибирована путем ингибирования цитокинов.
Таким образом, как указано выше, уменьшение количества цитокинов может быть эффективным способом лечения воспалительных заболеваний, а также иммунных заболеваний.
Недавно авторам настоящего изобретения удалось синтезировать производные пиридина с новой структурой, также они обнаружили, что эти новые производные ингибируют продукцию цитокинов, вовлеченных в воспалительные реакции, в частности, что они обладают превосходным ингибирующим действием в отношении продукции TNF-α, IL-1, IL-6, IFN-γ и PGE2. Таким образом, авторы настоящего изобретения обнаружили, что новые соединения, синтезированные ими, обладают превосходным терапевтическим действием в отношении таких заболеваний, как воспалительные заболевания, иммунные заболевания и хронические воспалительные заболевания, а также могут использоваться в качестве средств, обладающих противовоспалительным и анальгезирующим действием, и, таким образом, осуществили настоящее изобретение.
Следовательно, в предпочтительном варианте осуществления, настоящее изобретение относится к новым производным пиридина.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения вышеуказанных производных пиридина.
Еще в другом предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции, которая может использоваться для лечения таких заболеваний, вызванных цитокинами, как воспалительные заболевания, иммунные заболевания, хронические воспалительные заболевания, и также может использоваться в качестве противовоспалительного и анальгезирующего средства.
Подробное описание изобретения
Настоящее изобретение относится к производным пиридина, представленным следующей формулой 1, и их фармацевтически приемлемым солям
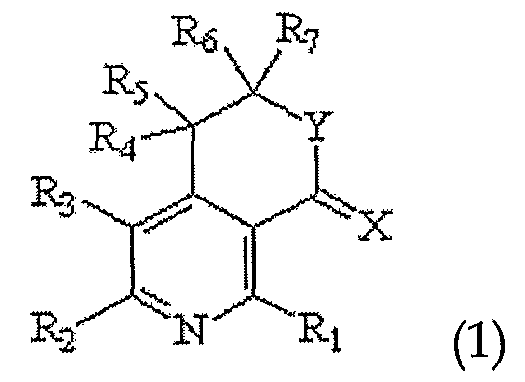
где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, циано, нитро, ацил, гидрокси, амино, C1-C6низший алкил, C2-C6низший алкенил, C1-C6низший алкокси, C1-C6алкилтио, C1-C10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, C1-C10аралкиламино, ариламино, ациламино, насыщенную гетероциклическую группу, ацилокси, C1-C6алкилсульфинил, C1-C6алкилсульфонил, C1-C6алкилсульфониламино, арилсульфинил, арилсульфонил, арилсульфониламино, арил, гетероарил, C1-C10аралкил, C1-C10гетероаралкил, арилокси и гетероарилокси группу; или R1, R2, R3, R4, R5, R6 и R7 независимо образуют кольцо путем связывания с соседней группой заместителя;
X представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода, C1-C6низший алкил, ацил, арил, гетероарил, C1-C10аралкил и C1-C10гетероаралкильную группу; или образует кольцо путем связывания с соседней группой заместителя R6 или R7;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильная и насыщенная гетероциклическая группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 3 гетероатомов, выбранных из атома кислорода, азота и серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильная и гетероарильная группы являются такими, что от 1 до 4 групп заместителей, выбранных из группы, включающей галоген, гидрокси, C1-C6низший алкил, низший C1-C6алкокси, амино, циано, нитро, карбонил и карбоксильную группу, являются замещенными.
Производные пиридина, представленные вышеуказанной формулой 1, могут образовывать фармацевтически приемлемые соли путем взаимодействия с кислотой, такой как соляная кислота, бромистая кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, уксусная кислота, лимонная кислота, фумаровая кислота, молочная кислота, малеиновая кислота, янтарная кислота и винная кислота.
Кроме того, производные пиридина, представленные вышеуказанной формулой 1, могут образовывать фармацевтически приемлемые соли путем взаимодействия с ионами такого щелочного металла, как натрий и калий, или ионом аммония. Таким образом, новые соединения, полученные в соответствии с настоящим изобретением, охватывают также фармацевтически приемлемые соли производных пиридина, представленных вышеуказанной формулой 1.
В предпочтительном варианте осуществления настоящего изобретения производные пиридина, представленные вышеуказанной формулой 1, являются такими, как указано далее:
таким образом, в вышеуказанной формуле 1, R1, R2 и R3 независимо выбраны из группы, включающей атом водорода, галоген, гидрокси, C1-C6низший алкил, C2-C6низший алкенил, C1-C6низший алкокси, арилокси, амино, C1-C6алкиламино,
C1-C10аралкиламино, ариламино, ациламино, насыщенную гетероциклическую группу, арил, гетероарил и C1-C10гетероаралкильную группу; или соседние R2 и R3 образуют кольцо путем связывания друг с другом;
R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, C1-C6низший алкил и арильную группу; или R4, R5, R6 и R7 независимо образуют кольцо путем связывания с соседней группой заместителя;
X представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода, C1-C6низший алкил, арил и C1-C10аралкильную группу;
арильная группа представляет собой фенильную группу;
гетероарильная и насыщенная гетероциклическая группы выбраны из фурана, тиофена, пиридина, пиперидина, пиперазина, морфолина, пиролидина и бензодиоксола; и
арильная и гетероарильная группы являются такими, что от 1 до 4 групп заместителей, выбранных из группы, включающей галоген, гидрокси, C1-C6низший алкил, C1-C6низший алкокси, амино, циано, нитро, карбонил и карбоксильную группу, являются замещенными.
Более конкретно, производные пиридина, представленные вышеуказанной формулой 1, могут быть дополнительно определены следующим образом. То есть, производные пиридина, представленные вышеуказанной формулой 1, представляют собой:
3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
5-винил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-дихлор-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-дигидрокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 6-метил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-метокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6,8-диметил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-тиофен-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-пиридин-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-хлорфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-морфолин-4-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-(4-метилпиперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-(4-пиримидин-2-илпиперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-хлорфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-трифторметилфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-п-толиламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фениламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенетиламино-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-[(бензо[1,3]диоксол-5-илметил)амино]-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-8-фенокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензиламино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-ацетамидо-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензамидо-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 1-оксо-6-фенил-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-метокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-диметиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-морфолин-4-ил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-фенил-8-пиролидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-фторфениламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-ацетамидо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-бензамидо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-гидрокси-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-метил-6-(тиофен-2-ил)-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(фуран-2-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(бензо[d][1,3]диоксол-6-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-(4-(диметиламино)фенил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-пропил-6-хлор-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-морфолин-4-ил-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
сложный эфир 1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
N-(1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил)ацетамид,
3,4-дигидро-2-окса-аза-фенантрен-1-он,
3,4-дигидропирано[3,4-c]пиридин-1-тион,
2-(4-метоксибензил)-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2-бензил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
3-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он,
3-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2,8-диметил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
2-бензил-8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он,
6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-он,
метиловый эфир 6-циклогексил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-хлор-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-циклогексил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-амино-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-он,
8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
метиловый эфир 6-изопропил-1-оксо-3,4-дигидро-1H-пирано-[3,4-c]пиридин-8-илуксусной кислоты,
8-хлор-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-он,
6-изопропил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-он; и
их фармацевтически приемлемые соли.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения производных пиридина, представленных вышеуказанной формулой 1.
Производные пиридина по настоящему изобретению, представленные вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода, могут быть получены 3-мя различными способами в соответствии со следующими реакционными схемами 1, 2 и 3.
На реакционной схеме 1 вкратце показан первый способ получения производных пиридина по настоящему изобретению, представленных вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 1
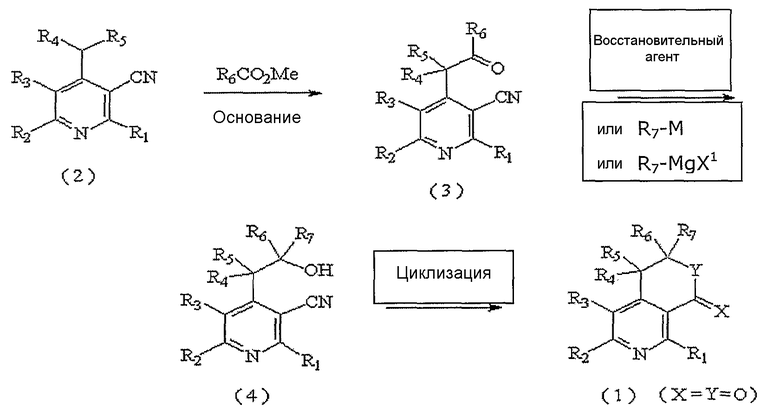
На вышеуказанной реакционной схеме 1, R1, R2, R3, R4, R5, R6,
R7, X и Y являются такими, как определено выше, и M представляет собой атом щелочного металла, и X1 представляет собой атом галогена.
Соединение, представленное вышеуказанной формулой 2, которое используется в качестве исходного продукта в вышеописанном способе, может быть легко получено известным способом (J. Org. Chem., Vol. 41, No. 15,2542,1976; Pharmazie, 38(9), 591,1983)).
В соответствии со способом, показанным на вышеуказанной реакционной схеме 1, соединение, представленное вышеуказанной формулой 2, сначала растворяют в безводном инертном апротонном растворителе, после добавления по каплям основания, перемешивают при температуре от около -100°C до около -40°C, снова по каплям добавляют алкиловый эфир, предпочтительно, метиловый эфир (R6COOMe), и оставляют взаимодействовать от около 2 до около 8 часов при температуре от -78°C до комнатной и получают соединение, представленное вышеуказанной формулой 3.
В вышеуказанной реакции используемый апротонный растворитель включает: тетрагидрофуран (ТГФ), диэтиловый эфир, диоксан и, предпочтительно, ТГФ. Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, к соединению вышеуказанной формулы 3 добавляют восстановитель или металлический реагент, содержащий R7, и оставляют взаимодействовать при температуре от 0°C до комнатной при перемешивании от 6 до 12 часов и получают соединение спирта, представленное вышеуказанной формулой 4.
Примеры используемого восстановителя включают боргидрид натрия (NaBH4) или боргидрид лития (LiBН4).
Примеры используемого металлического реагента, содержащего R7, включают реагент щелочного металла, представленный формулой R7M, или реагент Гриньяра, представленный формулой R7MgX1, где R7 является таким же, как определено выше, M представляет собой щелочной металл, такой как литий, калий и натрий, X1 представляет собой атом галогена.
Далее, спиртовое соединение, представленное вышеуказанной формулой 4, подвергают циклизации нагреванием с обратным холодильником от 6 до 12 часов в присутствии концентрированной HCl, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
На следующей реакционной схеме 2 вкратце показан второй способ получения соединения, представленного вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 2
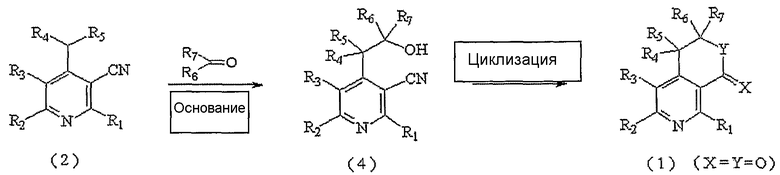
На вышеописанной реакционной схеме 2, R1, R2, R3, R4, R5, R6, R7, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 2, соединение, представленное вышеуказанной формулой 2, сначала подвергают взаимодействию с алкилкарбонильным соединением, представленным R6COR7 (R6 и R7 являются такими, как определено выше), вместе с основанием в присутствии безводного инертного апротонного растворителя, и получают соединение, представленное вышеуказанной формулой 4.
В вышеописанной реакции примеры апротонного растворителя включают: тетрагидрофуран (ТГФ), диэтиловый эфир и диоксан, и, предпочтительно, ТГФ.
Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, спиртовое соединение, представленное вышеуказанной формулой 4, подвергают циклизации аналогичным образом, как показано выше на реакционной схеме 1, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляет собой атом кислорода.
На следующей реакционной схеме 3 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
Схема 3
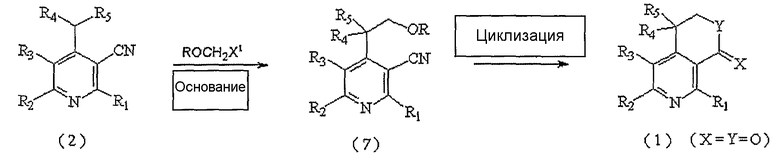
На вышеописанной реакционной схеме 3, R1, R2, R3, R4, R5, X и Y являются такими, как определено выше, и X1 представляет собой атом галогена.
В соответствии со способом, показанным на вышеуказанной реакционной схеме 3, соединение, представленное вышеуказанной формулой 2, сначала подвергают взаимодействию с алкоксиметильным соединением, представленным ROCH2X1 (R представляет собой C1-C6низший алкил, арил или аралкильную группу, предпочтительно, метил, этил или бензильную группу, X1 представляет собой атом галогена), вместе с основанием в присутствии безводного инертного апротонного растворителя, и получают соединение, представленное вышеуказанной формулой 7.
В вышеописанной реакции примеры апротонного растворителя включают: тетрагидрофуран (ТГФ), диэтиловый эфир и диоксан, и, предпочтительно, ТГФ.
Примеры используемого основания включают: бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS), диизопропиламид лития (LDA), гидрид натрия (NaH), гидрид калия (KH) и гидрид лития (LiH), и, предпочтительно, LHMDS.
Далее, соединение, представленное вышеуказанной формулой 7, подвергают циклизации аналогичным образом, как показано выше на реакционной схеме 1, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляют собой атом кислорода.
На следующей реакционной схеме 3 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где R6 и R7, каждый в отдельности, представляют собой атом водорода, и X и Y, каждый в отдельности, представляют собой атом кислорода.
Производные пиридина по настоящему изобретению, представленные вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8, могут быть получены 4-мя различными способами в соответствии со следующими реакционными схемами 4, 5, 6 и 7.
На реакционной схеме 4 вкратце показан первый способ получения производных пиридина по настоящему изобретению, представленных вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 4
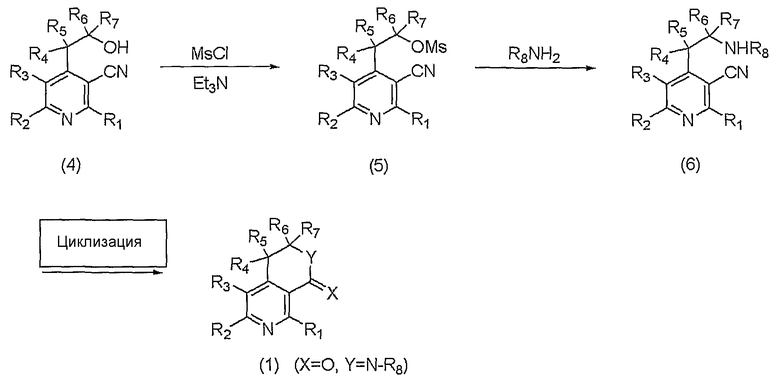
На вышеописанной реакционной схеме 4, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 4, соединение, представленное вышеуказанной формулой 4, сначала подвергают взаимодействию с метансульфонилхлоридом (MsCl) или п-толуолсульфонилхлоридом вместе с основанием, таким как пиридин или триэтиламин (Et3N), в присутствии органического растворителя, и получают соединение, представленное вышеуказанной формулой 5.
В вышеописанной реакции предпочтительные примеры органического растворителя представляют собой метиленхлорид (CH2Cl2) или хлороформ (CHCl3).
Далее, соединение, представленное вышеуказанной формулой 5, подвергают взаимодействию с соединением амина, представленным R8NH2, где R8 является таким же, как определено выше, с получением соединения, представленного вышеуказанной формулой 6, которое затем циклизуют в кислой среде, например в спиртовом растворе, содержащем соляную кислоту или серную кислоту, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
На следующей реакционной схеме 5 вкратце показан второй способ получения соединения, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 5
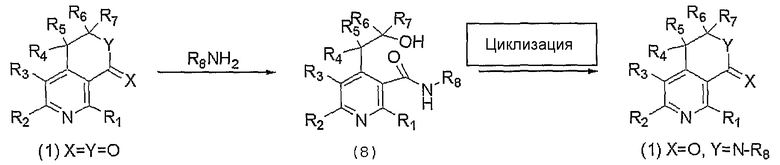
На вышеописанной реакционной схеме 5, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показаным на вышеуказанной реакционной схеме 5, соединение, представленное вышеуказанной формулой 1, где X и Y, каждый в отдельности, представляет собой атом кислорода, сначала подвергают взаимодействию с соединением амина, представленного R8NH2, где R8 является таким же, как определено выше, с получением соединения вышеуказанной формулы 8, которое затем циклизуют, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
В вышеописанной реакции циклизацию выполняют взаимодействием с трифенилфосфином и диэтилазодикарбоксилатом в присутствии органического растворителя, такого как тетрагидрофуран.
На следующей реакционной схеме 6 вкратце показан третий способ получения соединения, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
На вышеописанной реакционной схеме 6, R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено выше, и R9 представляет собой бензильную или 4-метоксибензильную группу.
В соответствии со способом, показанным на вышеуказанной реакционной схеме 6, соединение, представленное вышеуказанной формулой 1, где R9 представляет собой бензильную или 4-метоксибензильную группу, сначала подвергают восстановлению с помощью катализатора на основе палладия в присутствии спиртового растворителя, или подвергают взаимодействию с кислотным реагентом, таким как п-толуолсульфоновая кислота или трифторацетат, в присутствии органического растворителя, такого как толуол или метиленхлорид, с получением соединения вышеуказанной формулы 1, которое затем циклизуют и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой NH.
Далее, вышеуказанное соединение формулы 1, где X представляет собой атом кислорода и Y представляет собой NH, подвергают взаимодействию с алкилирующим агентом, представленным R8X (R8 является таким же, как определено выше и X представляет собой атом галогена), вместе с таким основанием, как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии такого органического растворителя, как тетрагидрофуран или диметилформамид, и, наконец, получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
На следующей реакционной схеме 7 вкратце показан четвертый способ получения производного пиридина, представленного вышеуказанной формулой 1, где X представляет собой атом кислорода и Y представляет собой N-R8.
Схема 7
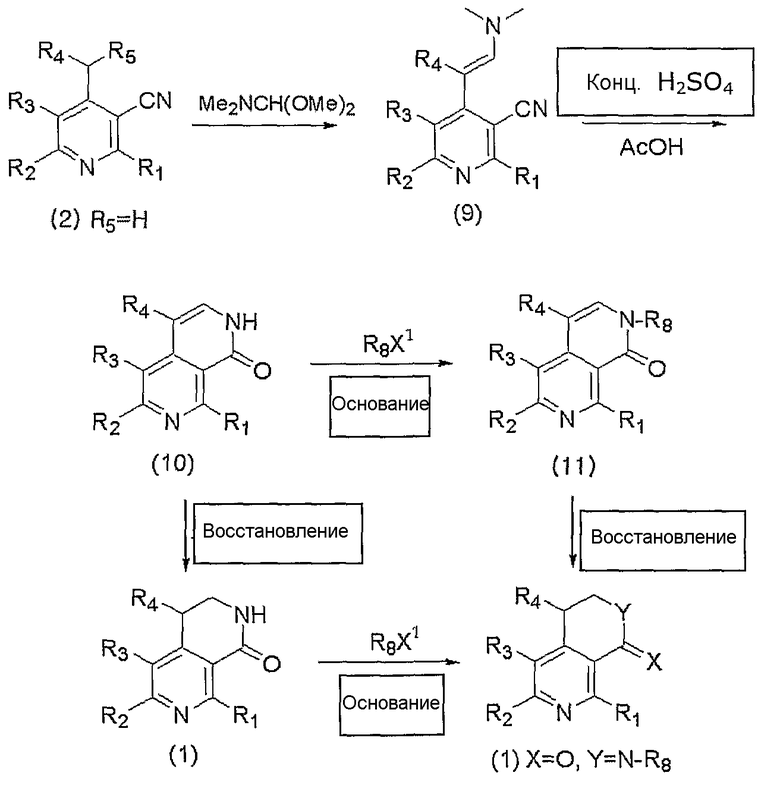
На вышеописанной реакционной схеме 7, R1, R2, R3, R4, R5, R8, X и Y являются такими, как определено выше, и X1 представляет собой атом галогена.
В соответствии со способом, показанным на вышеописанной реакционной схеме 7, соединение, представленное вышеуказанной формулой 1, где R5 представляет собой атом водорода, сначала подвергают взаимодействию с N,N-диметилформамиддиметилацеталем в присутствии апротонного растворителя, такого как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 9, которое затем циклизуют в кислой среде, такой как серная кислота или уксусная кислота, и получают соединение, представленное вышеуказанной формулой 10.
Далее, вышеуказанное соединение, представленное формулой 10, подвергают взаимодействию с алкилирующим реагентом, представленным R8X1 (R8 является таким же, как определено выше и X1 представляет собой атом галогена), вместе с основанием, таким как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии органического растворителя, такого как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 11.
Далее, вышеуказанное соединение, представленное формулой 11, подвергают восстановлению с помощью катализатора на основе палладия и газообразного водорода в присутствии спиртового растворителя и получают соединение, представленное вышеуказанной формулой 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
Между тем, в соответствии с вышеуказанной реакционной схемой 7, когда вышеуказанное соединение, представленное формулой 1, подвергают восстановлению с помощью катализатора на основе палладия и газообразного водорода в присутствии спиртового растворителя, также получают соединение вышеописанной формулы 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
Далее, вышеуказанное соединение, представленное формулой 1, где Y представляет собой NH, подвергают взаимодействию с алкилирующим агентом, представленным R8X1 (R8 является таким же, как определено выше и X1 представляет собой атом галогена), вместе с таким основанием, как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, в присутствии такого органического растворителя, как тетрагидрофуран или диметилформамид, и получают соединение, представленное вышеуказанной формулой 1, где R5, R6 и R7, каждый в отдельности, представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой N-R8.
На следующей реакционной схеме 8 вкратце показан способ одновременного получения производных пиридина, представленных вышеуказанной формулой 1, где R5 представляет собой атом водорода и X и Y, каждый в отдельности, представляют собой атом кислорода, а также производных пиридина, представленных вышеуказанной формулой 1, где R5 представляет собой атом водорода, X представляет собой атом кислорода, X представляет собой атом кислорода и Y представляет собой NH.
Схема 8
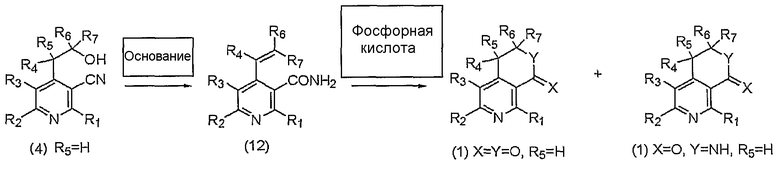
На вышеописанной реакционной схеме 8, R1, R2, R3, R4, R6, R7, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 8, соединение, представленное вышеуказанной формулой 4, где R5 представляет собой атом водорода, сначала подвергают взаимодействию с таким основанием, как гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия, в присутствии спиртового растворителя и получают соединение, представленное вышеуказанной формулой 12.
Затем вышеуказанное соединение, представленное формулой 12, подвергают циклизации в кислой среде, такой как фосфорная кислота, и одновременно получают производные пиридина, представленные вышеуказанной формулой 1, где R5 представляет собой атом водорода и X и Y каждый в отдельности представляет собой атом кислорода, а также производные пиридина, представленные вышеуказанной формулой 1, где R5 представляет собой атом водорода, X представляет собой атом кислорода и Y представляет собой NH.
На следующей реакционной схеме 9 вкратце показан способ получения производных пиридина, представленных вышеуказанной формулой 1, где X представляет собой атом серы, Y представляет собой атом кислорода или N-R8.
Схема 9
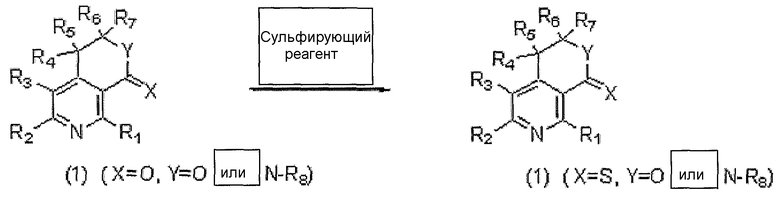
На вышеописанной реакционной схеме 9, R1, R2, R3, R4, R6, R7, R8, X и Y являются такими, как определено выше.
В соответствии со способом, показанным на вышеописанной реакционной схеме 9, соединение, представленное вышеуказанной формулой 1, где X представляет собой атом кислорода, подвергают взаимодействию с сульфирующим реагентом, например, реагентом Лавессона (Lawesson), при относительно высокой температуре и легко получают соединение, представленное вышеуказанной формулой 1, где X представляет собой атом серы.
Далее, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амино, С1-С10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, ариламино, ациламино, C1-C6алкилсульфониламино и арилсульфониламино группу, может быть получено следующим способом. Так, соединение, представленное формулой 1, где R1,
R2 или R3, каждый в отдельности, представляют собой атом галогена, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амино, C1-C10алкиламино, C4-C9циклоалкиламино, C4-C9гетероциклоалкиламино, ариламино, ациламино, C1-C6алкилсульфониламино и арилсульфониламино группу, взаимодействием его с соответствующим соединением амина в присутствии органического растворителя. В вышеуказанной реакции аминирования в качестве катализатора реакции предпочтительно использовать триэтиламин и в качестве реакционного растворителя этанол или ацетонитрил.
Кроме того, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой бензиламино или 4-метоксибензиламино, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой амины, восстановлением. Вышеуказанное восстановление может быть проведено с использованием катализатора на основе палладия в присутствии спиртового растворителя, или, альтернативно, с использованием кислотного реагента, такого как п-толуолсульфоновая кислота или трифторуксусная кислота, в присутствии органического растворителя, такого как толуол или метиленхлорид.
Далее, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой аминогруппы, может быть пребразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой ациламино, C1-C6алкилсульфониламино или арилсульфониламино группу. Вышеуказанные реакции ацилирования или сульфонилирования могут быть выполнены с использованием ацилирующего агента или сульфонирующего агента вместе с таким основанием, как триэтиламин, в присутствии органического растворителя. Примерами вышеуказанного ацилирующего агента являются ацилгалогенид и ацилангидрид, и примерами вышеуказанного сульфонирующего агента являются алкилсульфонгалогенид и арилсульфонгалогенид. Примерами вышеуказанного органического растворителя являются метиленхлорид, ацетонитрил, диметилформамид и тетрагидрофуран.
Далее, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой атом галогена,
С1-C6низший алкокси, арилокси или ацилокси группу, может быть получено следующим образом.
Так, соединение, представленное формулой 1, где R1, R2 или R3, каждый в отдельности, представляют собой гидроксильную группу, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3, каждый в отдельности, представляют собой атом галогена, взаимодействием с галогенирующим реагентом. Примерами вышеуказанного галогенирующего реагента являются: оксихлорид фосфора, тионилхлорид, трибромид фосфора, N-хлорсукцинимид и N-иодсукцинимид.
Далее, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой гидроксигруппу, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой C1-C6низший алкокси, арилокси или ацилоксигруппу, путем соответствующего алкилирования. Способ вышеуказанного алкилирования представляет собой взаимодействие вышеуказанного соединения с таким основанием, как гидрид натрия, гидрид калия, гидрид лития, карбонат калия и карбонат натрия, вместе с соответствующим алкилирующим агентом в присутствии органического растворителя, такого как тетрагидрофуран или диметилформамид. Кроме того, указанная выше реакция алкилирования может быть проведена взаимодействием подходящего ацилирующего реагента с таким основанием, как триэтиламин, в таком органическом растворителе, как метиленхлорид, хлороформ, ацетонитрил, диметилформамид и тетрагидрофуран.
Примерами используемых реагентов в указанной выше реакции алкилирования являются: алкилгалогенид в качестве алкилирующего агента; алкилгалогенидный агент может быть использован вместе с кислотным агентом вместо основания; и в качестве ацилирующего реагента могут быть использованы ацилгалогенид и ацилангидрид.
Далее, из производных пиридина по настоящему изобретению, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой C1-C6низший алкил, C2-C6низший алкенил, C4-C9циклоалкил, C4-C9гетероциклоалкил, арил, гетероарил, С1-C10аралкил или C1-C10гетероаралкил, может быть получено из соединения, представленного следующей формулой 1, где R1, R2 или R3 представляют собой атом галогена, следующим способом. Так, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой C1-C6низший алкил, C2-С6низший алкенил, C4-C9циклоалкил, C4-C9гетероциклоалкил, арил, гетероарил, С1-C10аралкил или C1-C10гетероаралкильную группу, может быть получено взаимодействием соединения, представленного формулой 1, где R1, R2 или R3 представляют собой атом галогена, с катализатором на основе железа, таким как Fe(acac)3, и алкилирующего агента или арилирующего агента в присутствии органического растворителя.
Вышеуказанные алкилирующий агент или арилирующий агент представляют собой, предпочтительно, реагент Гриньяра, представленный формулой RMgX1, где R представляет собой C1-C6низший алкил, C2-C6низший алкенил, C4-C9циклоалкил, C4-C9гетероциклоалкил, арил, гетероарил, C1-C10аралкил или С1-C10гетероаралкильную группу, X1 представляет собой атом галогена.
Далее, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой гидроксигруппу, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой C2-C6низший алкенил, арил или гетероарильную группу, используя такой катализатор на основе палладия,
как Pd(PPh3)4, вместе с соответствующим алкилирующим реагентом или арилирующим реагентом в присутствии органического растворителя.
В вышеописанной реакции алкилирующий агент или арилирующий агент представляют собой алкенильное соединение олова, арильное соединение олова или гетероарильное соединение олова, представленные формулой RSnR′3, где R представляет собой C2-C6низший алкенил, арил или гетероарильную группу, R' представляет собой группу C1-C6низшего алкила, предпочтительно, бутильную группу.
Далее, соединение, представленное формулой 1, где R1, R2 или R3 представляют собой гидроксигруппу, может быть преобразовано в соединение, представленное формулой 1, где R1, R2 или R3 представляют собой арил или гетероарильную группу, используя катализатор на основе палладия, такой как Pd(PPh3)4, вместе с таким основанием, как карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидроксид калия, а также соответствующий алкилирующий агент или арилирующий агент в присутствии такого органического растворителя, как толуол и бензол. Вышеуказанный арилирующий реагент представляет собой, предпочтительно, арильное соединение бора или гетероарильное соединение бора, представленное RB(OH)2, где R представляет собой арильную или гетероарильную группу.
В другом варианте осуществления настоящее изобретение относится к соединению, представленному вышеуказанной формулой 1, и его фармацевтически приемлемым солям в качестве эффективного терапевтического компонента.
Фармацевтическая композиция по настоящему изобретению может быть получена в лекарственной форме, подходящей для перорального и парентерального введения, путем объединения соединения, представленного вышеуказанной формулой 1, или его фармацевтически приемлемых солей вместе с обычным носителем, адьювантом или разбавителем. В случае лекарственного препарата для перорального введения соединение может быть включено в состав таблеток, капсул, растворов, сиропов и суспензий. В случае лекарственного препарата для парентерального введения соединение может быть представлено в виде лекарственных препаратов для внутрибрюшинных, подкожных, внутримышечных и чрезкожных инъекций.
Эффективная суточная доза фармацевтической композиции по настоящему изобретению в качестве противовоспалительного и болеутоляющего средства для взрослых людей составляет от около 0,01 до 1,000 мг/день, и она может изменяться в зависимости от возраста, массы тела, пола, способа введения, состояния здоровья и степени любого имеющегося заболевания. Введение может проводиться соответствующими аликвотами один раз в сутки или несколько раз в сутки после консультации с врачом или фармацевтом.
Еще в другом варианте осуществления настоящее изобретение относится к применению фармацевтической композиции, содержащей соединение, представленное вышеуказанной формулой 1 или его фармацевтически приемлемые соли, при лечении и профилактике заболеваний.
Таким образом, настоящее изобретение относится к соединению, представленному вышеуказанной формулой 1, или его фармацевтически приемлемым солям для использования в качестве терапевтического средства при лечении воспалительных заболеваний, иммунопатологических заболеваний, хронических воспалительных заболеваний, и для использования в качестве противовоспалительного и болеутоляющего средства, и к медицинскому применению фармацевтической композиции, содержащей вышеуказанные соединения.
Фармацевтическая композиция по настоящему изобретению является эффективной при лечении заболеваний, вызываемых TNF-α, IL-1α, IL-1β и IFN-γ. Более конкретно, композиция эффективна при лечении таких заболеваний, как (i) воспалительные заболевания или иммунопатологические заболевания, такие как ревматоидный артрит, рассеянный склероз, болезнь Крона, инфекционные желудочно-кишечные заболевания, такие как язвенный колит, реакция “трансплантат против хозяина”, системный эритематозный туберкулез кожи, токсический шок, остеоартрит и инсулинозависимый сахарный диабет; (ii) такие хронические воспалительные заболевания, как псориатический артрит, псориатит, алкилозирующий спондилоартрит, появляющаяся с возрастом болезнь Стилла, полимиозит, дерматомиозит, васкулит, такой как болезнь Бехчета и гранулематоз Вегенера; и является также эффективной в качестве (iii) противовоспалительного и болеутоляющего средства. Кроме того, она эффективна при лечении таких заболеваний, как гломерулонефрит, дерматит, астма, инсульт, инфаркт миокарда, синдром острой дыхательной недостаточности, посттравматическая полиорганная недостаточность, гнойный менингит, некротический энтероколит, парагемодиализный синдром, септический шок и пост-климактерический остеопороз.
ПРИМЕРЫ
Лучшее понимание настоящего изобретения может быть достигнуто в свете следующих примеров, которые представлены для иллюстрации, но не должны рассматриваться как ограничивающие настоящее изобретение.
Пример 1
Синтез метилового эфира (3-цианопиридин-4-ил)уксусной кислоты
В 15 мл безводного ТГФ растворяли 2,52 г 4-метилникотинoнитрила и по каплям добавляли 45 мл 1M LHMDS при температуре -78°C и перемешивали в течение около 1 часа. К смеси при вышеуказанной температуре по каплям добавляли 1,98 мл диметилкарбоната, перемешивали в течение около 1 часа. Затем смесь нагревали до 0°C и перемешивали в течение еще около 2 часов. К вышеуказанной смеси добавляли 5 мл насыщенного раствора хлорида аммония, разбавляли 300 мл этилацетата. Затем слой органического растворителя промывали водой и насыщенным раствором хлорида натрия, сушили с помощью безводного сульфата натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и выполняли очистку полученного остатка хроматографией на колонке с силикагелем, используя смешанный элюент из этилацетата и гексана, где этилацетат и гексан смешаны в объемном соотношении 1:3, и получали 3,21 г (85%) метилового эфира (3-цианопиридин-4-ил)уксусной кислоты в виде бесцветного масла.
1H ЯМР (300 MГц, CDCl3) δ 8,87 (c, 1H), 8,75 (д, 1H, J=5,1 Гц), 7,41 (д 1H, J=5,1 Гц), 3,89 (c, 2H), 3,77 (c, 3H).
Пример 2
Синтез 4-(2-гидроксиэтил)никотинoнитрила
В 18 мл этанола растворяли 1,58 г метилового эфира (3-цианопиридин-4-ил)уксусной кислоты и медленно добавляли при -0°C 682 мг боргидрида натрия и перемешивали в течение около 2 часов. К вышеуказанной смеси добавляли 3 мл насыщенного раствора хлорида аммония, разбавляли 200 мл этилацетата. Затем слой органического растворителя промывали водой и насыщенным раствором хлорида натрия, сушили безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и выполняли очистку полученного остатка хроматографией на колонке с силикагелем, используя смешанный элюент из метиленхлорида и метанола, где метиленхлорид и метанол смешаны в объемном соотношении 50:1, и получали 1,02 г (74%) 4-(2-гидроксиэтил)никотинoнитрила в виде бесцветного масла.
1H ЯМР (300 MГц, CDCl3) δ 8,82 (c, 1H), 8,69 (д, 1H, J=5,4 Гц), 7,39 (д, 1H, J=5,4Гц), 3,99 (т, 2H, J=6,3 Гц), 3,10 (т, 2H, J=6,3 Гц).
Пример 3
Синтез 3,4-дигидропирано[3,4-c]пиридин-1-она
К 765 мг 4-(2-гидроксиэтил)никотинoнитрила добавляли 13,6 мл концентрированную HCl и перемешивали в течение около 12 часов при нагревании с обратным холодильником. Для удаления растворителя вышеуказанную смесь концентрировали при пониженном давлении. Фильтрат растворяли в воде, и водный слой подщелачивали насыщенным раствором гидрокарбоната натрия, и затем экстрагировали, используя этилацетат. Потом слой органического растворителя промывали насыщенным раствором хлорида натрия, сушили безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали с помощью колоночной хроматографии, используя смешанный элюент из этилацетата и гексана, где этилацетат и гексан смешаны в объемном соотношении 1:2, и получали 760 мг (98%) 3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 MГц, CDCl3) δ 9,25 (c, 1H), 8,72 (д, 1H, J=4,8 Гц), 7,22 (д, 1H, J=5,1 Гц), 4,58(т, 2H, J=6,0 Гц), 3,08 (т, 2H, J=6,0Гц).
Пример 4
Синтез метилового эфира (5-циано-2-метилпиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 3,2 г (77%) метилового эфира (5-циано-2-метилпиридин-4-ил)уксусной кислоты в виде бесцветного масла, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,88 г 4,6-диметилникотинoнитрила.
1H ЯМР (300 MГц, CDCl3) δ 8,75 (с,1H), 7,25 (c, 1H), 3,83 (c, 2H), 3,76 (c, 3H), 2,63 (c, 3H).
Пример 5
Синтез 4-(2-гидроксиэтил)-6-метилникотинoнитрила
Используя такой же способ, как в примере 2, получали 1,5 г (65%) 4-(2-гидроксиэтил)-6-метилникотинoнитрила в виде бесцветного масла, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 2,7 г метилового эфира (5-циано-2-метилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 MГц, CDCl3) δ 8,71 (c, 1H), 7,23 (c, 1H), 3,97 (т, 2H, J=6,3Гц), 3,04 (т, 2H, J=6,3Гц), 2,61 (c, 3H).
Пример 6
Синтез 6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она
Используя такой же способ, как в примере 3, получали 1,19 г (99,4%) 6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 981 мг 4-(2-гидроксиэтил)-6-метилникотинoнитрила.
1H ЯМР (300 MГц, CDCl3) δ 9,01 (с,1H), 7,79 (c, 1H), 4,60(т, 2H, J=6,0 Гц), 3,26 (т, 2H, J=6,0Гц), 2,70 (с, 3H).
Пример 7
Синтез метилового эфира (3-циано-5-винилпиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 2,5 г (74%) метилового эфира (3-циано-5-винилпиридин-4-ил)уксусной кислоты в виде бесцветного масла, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,42 г 4-метил-5-винилникотинoнитрила.
1H ЯМР (300 MГц, CDCl3) δ 8,83 (c, 1H), 8,77 (c, 1H), 6,81 (дд, 1H, J=17,4 Гц, 11,1 Гц), 5,78 (д, 1H, J=17,4Гц), 5,60 (д, 1H, J=11,1 Гц), 3,95 (c, 2H), 3,74 (c, 3H).
Пример 8
Синтез 4-(2-гидроксиэтил)-5-винилникотинoнитрила
Используя такой же способ, как в примере 2, получали 1,04 г (60%) 4-(2-гидроксиэтил)-5-винилникотинoнитрила в виде твердого продукта белого цвета, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 2,0 г метилового эфира (3-циано-5-винилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 8,92 (c, 1H), 8,84 (c, 1H), 7,05 (дд, 1H, J=17,4 Гц, 11,1 Гц), 5,96 (д, 1Н, J=17,4 Гц), 5,55 (д, 1Н, J=11,1 Гц), 3,61 (т, 1Н, J=6,6 Гц), 3,04 (т, 2H, J=6,6 Гц).
Пример 9
Синтез 5-винил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 3, получали 817 мг (85%) 5-винил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 780 мг 4-(2-гидроксиэтил)-5-винилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 9,17 (c, 1Н), 8,84 (c, 1Н), 6,81 (дд, 1Н, J=17,7 Гц, 11,1 Гц), 5,81 (д, 1Н, J=17,7 Гц), 5,59 (д, 1Н, J=11,1 Гц), 4,56 (т, 2H, J=6,0 Гц), 3,09 (т, 2H, J=6,0 Гц).
Пример 10
Синтез метилового эфира (2,6-дихлор-3-цианопиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 1,8 г (54%) метилового эфира (2,6-дихлор-3-цианопиридин-4-ил)уксусной кислоты в виде бесцветного масла, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,57 г 2,6-дихлор-4-метилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,40 (c, 1H), 3,88 (c, 2H), 3,78 (c, 3H).
Пример 11
Синтез 2,6-дихлор-4-(2-гидроксиэтил)никотинoнитрила
Используя такой же способ, как в примере 2, получали 600 мг (68%) 2,6-дихлор-4-(2-гидроксиэтил)никотинoнитрила в виде бесцветного масла, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 1,0 г метилового эфира 2,6-дихлор-(3-цианопиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 7,40 (c, 1H), 3,88 (c, 2H), 3,78 (c, 3H).
1H ЯМР (300 МГц, CDCl3) δ 7,40 (c, 1H), 3,98 (т, 2H, J=6,0 Гц), 3,09 (т, 2H, J=6,0 Гц).
Пример 12
Синтез 6,8-дихлор-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 3, получали 270 мг (90%) 6,8-дихлор-3,4-дигидропирано[3,4-с]пиридин-1-она в виде твердого вещества светло-желтого цвета, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 300 мг 2,6-дихлор-4-(2-гидроксиэтил)никотинoнитрила.
1Н ЯМР (300 МГц, CDCl3) δ 7,40 (c, 1Н), 4,60 (т, 2H, J=6,0 Гц), 3,10 (т, 2H, J=6,0 Гц).
Пример 13
Синтез метилового эфира (2,6-бис-бензилокси-3-цианопиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 840 мг (35%) метилового эфира (2,6-бис-бензилокси-3-цианопиридин-4-ил)уксусной кислоты в виде бесцветного масла, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,05 г 2,6-бис-бензилокси-4-метилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,45-7,31 (м, 10H), 6,41 (с, 1H), 5,46 (c, 2H), 5,35 (c, 2H), 3,78 (c, 2H), 3,74 (c, 3H).
Пример 14
Синтез 2,6-бис-бензилокси-4-(2-гидроксиэтил)никотинoнитрила
Используя такой же способ, как в примере 2, получали 285 мг (62%) 2,6-бис-бензилокси-4-(2-гидроксиэтил)никотинoнитрила в виде бесцветного масла, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 500 мг метилового эфира (2,6-бис-бензилокси-3-цианопиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 7,44-7,30 (м, 10H), 6,41 (c, 1H), 5,44 (c, 2H), 5,35 (c, 2H), 3,97 (т, 2H, J=6,3 Гц), 3,10 (т, 2H, J=6,3 Гц).
Пример 15
Синтез 6,8-дигидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 3,получали 98 мг (98%) 6,8-дигидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она в виде густого масла, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 200 мг 2,6-бис-бензилокси-4-(2-гидроксиэтил)никотинoнитрила.
1Н ЯМР (300 МГц, CDCl3) δ 5,48 (c, 1H), 4,44 (т, 2H, J=6,3 Гц), 2,88 (т, 2H, J=6,3 Гц).
Пример 16
Синтез 2-метокси-4,6-диметилникотинoнитрила
2-Хлор-4,6-диметилникотинoнитрил (2,5 г, 15,01 ммоль) растворяли в безводном метаноле (70 мл), добавляли метоксид натрия (4,27 г, 75,03 ммоль) при 0°C и перемешивали в течение около 10 часов в атмосфере азота. Вышеуказанную смесь концентрировали при пониженном давлении и затем нейтрализовали насыщенным раствором хлорида аммония и потом дважды экстрагировали 150 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (20% EtOAc/гексан) и получали 2,41 г (99%) 2-метокси-4,6-диметилникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,44 (c, 3H), 2,45 (c, 3H), 4,01 (с,3H), 6,68 (c, 1H).
Пример 17
Синтез метилового эфира (3-циано-2-метокси-6-метилпиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 3,03 г (97%) метилового эфира (3-циано-2-метокси-6-метилпиридин-4-ил)уксусной кислоты, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,3 г 2-метокси-4,6-диметилникотинoнитрила.
1Н ЯМР (300 МГц, CDCl3) δ 2,49 (c, 3H), 3,75 (с, 3H), 3,78 (c, 2H), 4,03 (c, 3H), 6,79 (c, 1H).
Пример 18
Синтез 4-(2-гидроксиэтил)-2-метокси-6-метилникотинoнитрила
Используя такой же способ, как в примере 2, получали 2,04 г (88%) 4-(2-гидроксиэтил)-2-метокси-6-метилникотинoнитрила, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 2,65 г метилового эфира (3-циано-2-метокси-6-метилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 1,55 (шир.т, 1H, J=5,4 Гц), 2,48 (c, 3H), 3,00 (т, 2H, J=6,3 Гц), 3,92-3,97 (м, 2H), 4,02 (c, 3H), 6,78 (c, 1Н).
Пример 19
Синтез 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 3, получали 337 мг (84%) 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 430 мг 4-(2-гидроксиэтил)-2-метокси-6-метилникотинoнитрила.
1H ЯМР (300 МГц, ДМСО-d6) δ 2,30 (c, 3H), 2,63 (т, 2H, J=6,0 Гц), 4,44 (т, 2H, J=6,0 Гц), 6,67 (c, 1Н), 12,26 (шир.с, 1Н).
Пример 20
Синтез 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
В оксихлориде фосфора (POCl3, 2,5 мл) растворяли 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (280 мг, 1,561 ммоль) и нагревали до кипения с обратным холодильником в течение около 15 часов в атмосфере азота. Вышеуказанную смесь добавляли к 20 мл дистиллированной воды и нейтрализовали, медленно добавляя насыщенный раствор карбоната натрия, перемешивая при 0°C, и затем экстрагировали дважды, используя 100 мл метиленхлорида (MC). Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (2% MeOH/MC) и получали 273 мг (89%) 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,59 (c, 3H), 3,03 (т, 2H, J=6,0 Гц), 4,48 (т, 2H, J=6,0 Гц), 7,03 (с, 1H).
Пример 21
Синтез эфира 6-метил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
В безводном диметилформамиде (ДМФ, 6 мл) суспендировали 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (280 мг, 1,561 ммоль) и затем по каплям добавляли триэтиламин (0,65 мл, 4,683 ммоль) и уксусный ангидрид (0,44 мл, 4,683 ммоль), в данном порядке, и перемешивали в течение около 24 часов при 70°C в атмосфере азота. Смесь концентрировали при пониженном давлении, добавляли 20 мл дистиллированной воды и затем экстрагировали дважды 30 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (2% MeOH/MC) и получали 224 мг (65%) эфира 6-метил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,40 (c, 3H), 2,58 (c, 3H), 3,05 (т, 2H, J=6,0 Гц), 4,51 (т, 2H, J=6,0 Гц), 7,05 (c, 1Н).
Пример 22
Синтез 8-метокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
В безводном диметилформамиде (ДМФ, 10 мл) суспендировали 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (324 мг, 1,809 ммоль) и безводный карбонат калия и затем по каплям добавляли иодметан (1,13 мл, 18,09 ммоль) и перемешивали в течение около 4 часов при 70°C в атмосфере азота. Смесь концентрировали при пониженном давлении, добавляли 50 мл дистиллированной воды и затем экстрагировали шесть раз 40 мл 10% MeOH/MC. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (10% MeOH/MC) и получали 215 мг (62%) 8-метокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета.
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,41 (с, 3H), 2,82 (т, 2H, J=6,0 Гц), 3,42 (c, 3H), 4,29 (т, 2H, J=6,0 Гц), 6,20 (c, 1H).
Пример 23
Синтез 2,4,6-триметилникотинoнитрила
В 20 мл безводного ТГФ растворяли 2-хлор-4,6-диметилникотинoнитрил (700 мг, 4,201 ммоль) и Pd(PPh3)4 (243 мг, 0,210 ммоль), добавляли хлорид метилцинка (2M CH3ZnCl/ТГФ, 12,6 мл, 25,21 ммоль), нагревали с обратным холодильником в течение около 40 часов в атмосфере азота. Смесь добавляли к насыщенному раствору EDTA (50 мл) и нейтрализовали карбонатом калия при перемешивании при 0°C, и затем экстрагировали дважды 150 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (25% EtOAc/гексан) и получали 535 мг (87%) 2,4,6-триметилникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,48 (c, 3H), 2,54 (c, 3H), 2,72 (c, 3H), 6,95 (c, 1H).
Пример 24
Синтез метилового эфира (3-циано-2,6-диметилпиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 592 мг (80%) метилового эфира (3-циано-2,6-диметилпиридин-4-ил)уксусной кислоты в виде масла светло-желтого цвета, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,4,6-триметилникотинoнитрил (530 мг, 3,625 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 2,57 (c, 3H), 2,74 (c, 3H), 3,75 (c, 3H), 3,80 (c, 2 H), 7,06 (с, 1H).
Пример 25
Синтез 4-(2-гидроксиэтил)-2,6-диметилникотинoнитрила
Используя такой же способ, как в примере 2, получали 433 мг (87%) 4-(2-гидроксиэтил)-2,6-диметилникотинoнитрила в виде твердого продукта белого цвета за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали метиловый эфир (3-циано-2,6-диметилпиридин-4-ил)уксусной кислоты (580 мг, 2,840 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 1,70 (т, 1Н, J=5,7 Гц), 2,56 (c, 3H), 2,73 (c, 3H), 3,03 (т, 2H, J=6,3 Гц), 3,97 (кв, 2H, J=6,0 Гц), 7,05 (c, 1Н).
Пример 26
Синтез 6,8-диметил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 3,получали 274 мг (97%) 6,8-диметил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 4-(2-гидроксиэтил)-2,6-диметилникотинoнитрил (280 мг, 1,589 ммоль).
1Н ЯМР (300 МГц, CDCl3) δ 2,56 (c, 3H), 2,87 (c, 3H), 2,97 (т, 2H, J=6,0 Гц), 4,45 (т, 2H, J=6,0 Гц), 6,92 (c, 1Н).
Пример 27
Синтез 6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
В 12 мл безводного толуола растворяли 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,265 ммоль) и Pd(PPh3)4 (146 мг, 0,127 ммоль), по каплям добавляли 2-(трибутилстаннил)фуран (0,80 мл, 2,530 ммоль) и затем нагревали до кипения с обратным холодильником в течение около 15 часов в атмосфере азота. При перемешивании при 0°C к смеси добавляли 15 мл 2%-ного раствора KF и 20 мл дистиллированной воды и затем экстрагировали дважды 50 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (5% EtOAc/MC) и получали 225 мг (78%) 6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1Н ЯМР (300 МГц, CDCl3) δ 2,63 (c, 3H), 3,01 (т, 2H, J=5,7 Гц), 4,52 (т, 2H, J=5,7 Гц), 6,54 (дд, 1H, J=3,6, 1,8 Гц), 6,97 (c, 1H), 7,12 (дд, 1H, J=3,6, 0,6 Гц), 7,57 (дд, 1H, J=1,8, 0,6 Гц).
Пример 28
Синтез 6-метил-8-тиофен-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 27, получали 247 мг (80%) 6-метил-8-тиофен-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета за исключением того, что вместо 2-(трибутилстаннил)фурана использовали 2-(трибутилстаннил)тиофен.
1Н ЯМР (300 МГц, CDCl3) δ 2,59 (c, 3H), 3,00 (т, 2H, J=5,7 Гц), 4,51 (т, 2H, J=5,7 Гц), 6,92 (c, 1H), 7,07 (дд, 1H, J=5,1, 3,9 Гц), 7,45 (дд, 1H, J=5,1, 1,2 Гц), 7,70 (дд, 1H, J=3,9, 1,2 Гц).
Пример 29
Синтез 6-метил-8-пиридин-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 27, получали 228 мг (75%) 6-метил-8-пиридин-2-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 2-(трибутилстаннил)фурана использовали 2-(трибутилстаннил)пиридин.
1Н ЯМР (300 МГц, CDCl3) δ 2,66 (c, 3H), 3,05 (т, 2H, J=5,7 Гц), 4,58 (т, 2H, J=5,7 Гц), 7,12 (с,1H), 7,31-7,35 (м, 1H), 7,67-7,70 (м, 1H), 7,80-7,85 (м, 1H), 8,62-8,64 (м, 1H).
Пример 30
Синтез 8-(4-фторфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
В 10 мл безводного толуола суспендировали 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,265 ммоль), 4-фторфенилборную кислоту (265 мг, 1,898 ммоль), Pd(PPh3)4 (146 мг, 0,127 ммоль) и безводный карбонат калия (350 мг, 2,530 ммоль) и затем нагревали с обратным холодильником в течение около 15 часов в атмосфере азота. При перемешивании при 0°C к смеси добавляли 20 мл насыщенного раствора хлорида аммония и 10 мл дистиллированной воды, и затем экстрагировали дважды 60 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток подвергали хроматографии на колонке с силикагелем (5% EtOAc/MC) и получали 135 мг (42%) 8-(4-фторфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,64 (c, 3H), 3,04 (т, 2H, J=6,0 Гц), 4,56 (т, 2H, J=6,0 Гц), 7,05 (с,1H), 7,08-7,14 (м, 2H), 7,51-7,55 (м, 2H).
Пример 31
Синтез 8-(4-хлорфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 30, получали 95 мг (27%) 8-(4-хлорфенил)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета, за исключением того, что вместо 4-фторфенил бороновой кислоты использовали 4-хлорфенил бороновую кислоту.
1H ЯМР (300 МГц, CDCl3) δ 2,64 (c, 3H), 3,05 (т, 2 H, J=5,7 Гц), 4,56 (т, 2H, J=5,7 Гц), 7,06 (с,1H), 7,38-7,41 (м, 2H), 7,46-7,50 (м, 2H).
Пример 32
Синтез 6-метил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
В 8 мл безводного ацетонитрила суспендировали 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,265 ммоль) и затем по каплям добавляли 1,0 мл триэтиламина и пиперидин (0,19 мл, 1,898 ммоль), в данном порядке, и нагревали до кипения с обратным холодильником в течение около 3 часов в атмосфере азота. Смесь концентрировали при пониженном давлении, добавляли 10 мл насыщенного раствора хлорида аммония и 10 мл дистиллированной воды и затем экстрагировали дважды 30 мл метиленхлорида. Полученный органический слой сушили, используя безводный сульфат натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (10% EtOAc/MC) и получали 296 мг (95%) 6-метил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1Н ЯМР (300 МГц, CDCl3) δ 1,66 (шир.с, 6H), 2,37 (c, 3H), 2,86 (т, 2H, J=5,7 Гц), 3,48 (шир.с, 4H), 4,39 (т, 2H, J=5,7 Гц), 6,32 (c, 1H).
Пример 33
Синтез 6-метил-8-морфолин-4-ил-3,4-дигидропирано[3,4-с]пиридин-1-она
Используя такой же способ, как в примере 32 получали 284 мг (90%) 6-метил-8-морфолин-4-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета за исключением того, что к 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-ону добавляли морфолин вместо пиперидина.
1H ЯМР (300 МГц, CDCl3) δ 2,39 (c, 3H), 2,90 (т, 2H, J=5,7 Гц), 3,53 (дд, 4H, J=5,1, 4,2 Гц), 3,82 (дд, 4H, 1=5,1, 4,2 Гц), 4,41 (т, 2H, J=5,7 Гц), 6,42 (c, 1Н).
Пример 34
Синтез 6-метил-8-(4-метилпиперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 32, получали 323 мг (98%) 6-метил-8-(4-метилпиперазин-1-ил)-3,4-дигидропирано[3,4-с] пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо пиперидина к 8-хлор-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-ону добавляли 1-метилпиперазин.
1Н ЯМР (300 МГц, CDCl3) δ 2,35 (c, 3H), 2,38 (c, 3H), 2,54 (дд, 4H, J=5,1, 4,8 Гц), 2,88 (т, 2H, J=5,7 Гц), 3,57 (дд, 4H, J=5,1, 4,8 Гц), 4,40 (т, 2H, J=5,7 Гц), 6,38 (c, 1Н).
Пример 35
Синтез 8-(4-фторфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
В 5 мл этанола растворяли 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (200 мг, 1,012 ммоль) и затем добавляли 4-фторанилин (224,9 мг, 2,024 ммоль), и перемешивали при 80°C в течение ночи. Смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (20% EtOAc/Гексан) и получали 250 мг (90%) 8-(4-фторфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 10,37 (c, 1H), 7,73-7,68 (м, 2H), 7,04-6,98 (м, 2H), 6,42 (c, 1H), 4,50 (т, J=6,0 Гц, 2H), 2,93 (т, J=6,0 Гц, 2H), 2,42 (с, 3H).
Пример 36
Синтез 6-метил-8-(4-пиримидин-2-ил-пеперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 170 мг (70%) 6-метил-8-(4-пиримидин-2-ил-пеперазин-1-ил)-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-фторанилина к 150 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли 1-(2-пиримидил)пиперазин·2HCl.
1Н ЯМР (300 МГц, CDCl3) δ 8,31 (с, 1H), 8,30 (c, 1H), 7,02 (д, J=7,2 Гц, 1H), 6,48 (т, J=4,8 Гц, 1H), 6,41 (с,1H), 4,44 (т, J=6,0 Гц, 2H), 3,95 (м, 4H), 3,63 (м, 4H), 2,57 (c, 3H), 3,01 (т, J=6,0 Гц, 2H).
Пример 37
Синтез 8-(4-хлорфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 342 мг (94%) 8-(4-хлорфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-фторанилина к 200 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли 4-хлоранилин.
1H ЯМР (300 МГц, CDCl3) δ 10,45 (с, 1H), 7,74-7,70 (м, 2H), 7,28-7,24 (м, 2H), 4,50 (т, J=6,0 Гц, 2H), 2,94 (т, J=6,0 Гц, 2H), 2,46 (c, 3H).
Пример 38
Синтез 8-(4-трифторметилфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 130 мг (67%) 8-(4-трифторметилфениламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-фторанилина к 120 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли 4-трифторметиланилин.
1H ЯМР (300 МГц, CDCl3) δ 10,67 (c, 1H), 7,91 (д, J=8,5 Гц, 2H), 7,57 (д, J=8,5 Гц, 2H), 6,51 (c, 1Н), 4,51 (т, J=6,3 Гц, 2H), 2,96 (т, J=6,3 Гц, 2H), 2,49 (c, 3H).
Пример 39
Синтез 6-метил-8-п-толиламино-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 188 мг (92%) 6-метил-8-п-толиламино-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета, за исключением того, что вместо 4-фторанилина к 150 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли 4-метиланилин.
1Н ЯМР (300 МГц, CDCl3) δ 10,34 (c, 1H), 7,64 (д, J=8,7 Гц, 2H), 7,13 (д, J=8,7 Гц, 2H), 6,38 (c, 1Н), 4,49 (т, J=6,3 Гц, 2H), 2,92 (т, J=6,3 Гц, 2H), 2,44 (c, 3H), 2,32 (c, 3H).
Пример 40
Синтез 6-метил-8-фениламино-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 145 мг (87%) 6-метил-8-фениламино-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого вещества светло-желтого цвета, за исключением того, что вместо 4-фторанилина к 130 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли анилин.
1H ЯМР (300 МГц, CDCl3) δ 10,44 (с, 1H), 7,79-7,76 (м, 2H), 7,35-7,30 (м, 2H), 7,07-7,01 (м, 1H), 6,41 (c, 1H), 4,49 (т, J=6,0 Гц, 2H), 2,93 (т, J=6,0 Гц, 2H), 2,46 (c, 3H).
Пример 41
Синтез 6-метил-8-фенетиламино-3,4-дигидропирано[3,4-c]пиридин-1-она
Используя такой же способ, как в примере 35, получали 175 мг (61%) 6-метил-8-фенетиламино-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, за исключением того, что вместо 4-фторанилина к 200 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она добавляли фенетиламин.
1H ЯМР (300 МГц, CDCl3) δ 8,27 (c, 1H), 7,33-7,18 (м, 5H), 6,21 (c, 1H), 4,42 (т, J=6,0 Гц, 2H), 3,77 (дт, J=7,5, 1,8 Гц, 2H), 2,94 (т, J=7,5 Гц, 2H), 2,84 (т, J=6,0 Гц, 2H).
Пример 42
Синтез 8-[(бензо[1,3]диоксол-5-илметил)амино]-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 139 мг (74%) 8-[(бензо[1,3]диоксол-5-илметил)амино]-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина вместе с пиперониламином добавляли 120 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1Н ЯМР (300 МГц, CDCl3) δ 8,47 (c, 1H), 6,87-6,72 (м, 3H), 6,23 (c, 1H), 5,91 (c, 2H), 4,66 (д, J=6,0 Гц, 2H), 4,42 (т, J=6,0 Гц, 2H), 2,85 (т, J=6,0 Гц, 2H), 2,38 (c, 3H).
Пример 43
Синтез 4,6-диметил-2-фенилникотинoнитрила
Получали 752 мг (100%) 4,6-диметил-2-фенилникотинoнитрил в виде масла желтого цвета, используя такой же способ, как в примере 30, за исключением того, что вместо 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 600 мг 2-хлор-4,6-диметилникотинoнитрил и вместо 4-фторфенилборной кислоты использовали фенилборную кислоту.
1H ЯМР (300 МГц, CDCl3) δ 7,87-7,83 (м, 2H), 7,50-7,48 (м, 3H), 7,10 (c, 1H), 2,63 (c, 3H), 2,58 (c, 3H).
Пример 44
Синтез метилового эфира (3-циано-6-метил-2-фенилпиридин-4-ил)уксусной кислоты
Получали 705 мг (90%) метилового эфира (3-циано-6-метил-2-фенилпиридин-4-ил)уксусной кислоты в виде твердого продукта желтого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 618 мг 4,6-диметил-2-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,88-7,85 (м, 2H), 7,51-7,49 (м, 3H), 7,20 (c, 1H), 3,93 (c, 2H), 3,78 (c, 3H), 2,67 (c, 3H).
Пример 45
Синтез 4-(2-гидроксиэтил)-6-метил-2-фенилникотинoнитрила
Получали 542 мг (100%) 4-(2-гидроксиэтил)-6-метил-2-фенилникотинoнитрила в виде бесцветного масла, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 606 мг метилового эфира (3-циано-6-метил-2-фенилпиридин-4-ил)уксусной кислоты.
1Н ЯМР (300 МГц, CDCl3) δ 7,85-7,82 (м, 2H), 7,50-7,48 (м, 3H), 7,18 (c, 1H), 3,95 (т, J=6,3 Гц, 2H), 3,09 (т, J=6,3 Гц, 2H), 2,64 (c, 3H).
Пример 46
Синтез 6-метил-8-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 380 мг (83%) 6-метил-8-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 405 мг 4-(2-гидроксиэтил)-6-метил-2-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,54-7,52 (м, 2H), 7,42-7,40 (м, 3H), 7,04 (с, 1H), 4,55 (т, J=6,0 Гц, 2H), 3,03 (J=6,0 Гц, 2H), 2,63 (c, 3H).
Пример 47
Синтез 4,6-диметил-2-феноксиникотинoнитрила
4,6-Диметил-2-хлорникотинoнитрил (600 мг, 3,60 ммоль) растворяли в 30 мл безводного ТГФ и затем добавляли тригидрат феноксида натрия (3,06 г, 18,00 ммоль), и перемешивали при 80°C в течение ночи. Смесь экстрагировали метиленхлоридом, сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (10% EtOAc/гексан), и получали 730 мг (90%) 4,6-диметил-2-феноксиникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 7,39-7,36 (м, 2H), 7,22-7,15 (м, 3H), 6,80 (c, 1H), 2,52 (c, 3H), 2,35 (c, 3H).
Пример 48
Синтез метилового эфира (3-циано-6-метил-2-феноксипиридин-4-ил)уксусной кислоты
Получали 580 мг (83%) метилового эфира (3-циано-6-метил-2-феноксипиридин-4-ил)уксусной кислоты в виде твердого продукта желтого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 556 мг 4,6-диметил-2-феноксиникотинонитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,43-7,37 (м, 2H), 7,25-7,16 (м, 3H), 6,90 (с, 1H), 3,85 (c, 2H), 3,78 (c, 3H), 2,38 (c, 3H).
Пример 49
Синтез 4-(2-гидроксиэтил)-6-метил-2-феноксиникотинoнитрила
Получали 380 мг (90%) 4-(2-гидроксиэтил)-6-метил-2-феноксиникотинoнитрила в виде бесцветного масла, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 467 мг метилового эфира (3-циано-6-метил-2-феноксипиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 7,42-7,37 (м, 2H), 7,25-7,15 (м, 3H), 6,89 (c, 1Н), 3,98 (т, J=6,3 Гц, 2H), 3,06 (т, J=6,3 Гц, 2H), 2,37 (c, 3H).
Пример 50
Синтез 6-метил-8-фенокси-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 280 мг (86%) 6-метил-8-фенокси-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 326 мг 4-(2-гидроксиэтил)-6-метил-2-феноксиникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,38-7,33 (м, 2H), 7,20-7,14 (м, 3H), 6,74 (c, 1Н), 4,47 (т, J=6,0 Гц, 2H), 2,98 (т, J=6,0 Гц, 2H), 2,33 (c, 3H).
Пример 51
Синтез 8-бензиламино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 313 мг (51%) 8-бензиламино-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 32, за исключением того, что вместо пиперидина добавляли 460 мг 8-хлор-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она вместе с бензиламином.
1H ЯМР (300 МГц, CDCl3) δ 2,38 (c, 3H), 2,87 (т, 2H, J=6,0 Гц), 4,44 (т, 2H, J=6,0 Гц), 4,78 (д, 2H, J=5,7 Гц), 6,24 (с, 1H), 7,21-7,39 (м, 5H), 8,55 (шир.с, 1Н).
Пример 52
Синтез 8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4c]пиридин-1-она
Получали 2,97 г (98%) 8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 32, за исключением того, что вместо пиперидина добавляли 2,0 г 8-хлор-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она вместе с 4-метоксибензиламином.
1H ЯМР (300 МГц, CDCl3) δ 2,39 (c, 3H), 2,86 (т, 2H, J=6,0 Гц), 3,79 (c, 3H), 4,43 (т, 2H, J=6,0 Гц), 4,69 (д, 2H, J=5,7 Гц), 6,23 (с, 1Н), 6,83-6,88 (м, 2H), 7,28-7,33 (м, 2H), 8,48 (шир.с, 1Н).
Пример 53
Синтез 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
8-(4-Метоксибензиламино)-6-метил-3,4-дигидропирано[3,4c]пиридин-1-он (2,7 г, 9,05 ммоль) растворяли в 30 мл безводного метиленхлорида и затем по каплям добавляли анизол (1,97 мл, 18,10 ммоль) и трифторуксусную кислоту (30 мл), в данном порядке, и затем нагревали до кипения с обратным холодильником в течение около 15 часов в атмосфере азота. Смесь концентрировали при пониженном давлении, добавляли 50 мл дистиллированной воды и нейтрализовали прибавлением насыщенного раствора карбоната натрия, и затем экстрагировали дважды 150 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия и фильтровали. Полученный остаток очищали хроматографией на колонке с силикагелем (5% MeOH/MC) и получали 1,53 г (95%) 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,28 (c, 3H), 2,87 (т, 2H, J=6,0 Гц), 4,39 (т, 2H, J=6,0 Гц), 6,39 (c, 1H), 7,26 (шир.с, 2H).
Пример 54
Синтез N-(1-оксо-6-метил-3,4-дигидропирано[3,4-c]пиридин-8-ил)ацетамида
8-Амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (200 г, 1,122 ммоль) растворяли в 6 мл безводного ацетонитрила и затем по каплям добавляли триэтиламин (0,63 мл, 4,490 ммоль) и уксусный ангидрид (0,42 мл, 4,490 ммоль), в данном порядке, и затем нагревали до кипения с обратным холодильником в течение около 20 часов в атмосфере азота. Смесь концентрировали при пониженном давлении, добавляли 15 мл насыщенного раствора карбоната натрия и 15 мл дистиллированной воды и затем экстрагировали дважды 40 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия и фильтровали. Полученный остаток очищали хроматографией на колонке с силикагелем (5%MeOH/MC) и получали 219 мг (89%) N-(1-оксо-6-метил-3,4-дигидропирано[3,4-c]пиридин-8-ил)ацетамида в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,46 (с, 3H), 2,54 (c, 3H), 3,00 (т, 2H, J=6,0 Гц), 4,52 (т, 2H, J=6,0 Гц), 6,75 (c, 1H), 10,89 (шир.с, 1Н).
Пример 55
Синтез N-(1-оксо-6-метил-3,4-дигидропирано[3,4-c]пиридин-8-ил)бензамида
220 мг (69%) N-(1-оксо-6-метил-3,4-дигидропирано[3,4-c]пиридин-8-ил)бензамида получали в виде твердого продукта белого цвета, используя такой же способ, как в примере 54, за исключением того, что вместо уксусного ангидрида добавляли вместе с ангидридом бензойной кислоты 200 мг 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 2,65 (c, 3H), 3,05 (т, 2H, J=6,0 Гц), 4,57 (т, 2H, J=6,0 Гц), 6,82 (c, 1Н), 7,47-7,59 (м, 3H), 8,06-8,10 (м, 2H), 11,98 (шир.с, 1Н).
Пример 56
Синтез 5-иод-2-метокси-4,6-диметилникотинoнитрила
2-Метокси-4,6-диметилникотинoнитрил (1,0 г, 6,166 ммоль) растворяли в 30 мл безводного метиленхлорида и затем добавляли 6 мл трифторуксусной кислоты и N-иодсукцинимид (2,2 г, 9,248 ммоль), в данном порядке, при перемешивании при 0°C в атмосфере азота, и затем вновь перемешивали при комнатной температуре в течение около 4 часов. К смеси добавляли 60 мл насыщенного раствора карбоната натрия и 60 мл насыщенного раствора Na2S2O3 и затем экстрагировали дважды 80 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия и фильтровали. Полученный остаток очищали хроматографией на колонке с силикагелем (5% EtOAc/гексан) и получали 1,67 г (94%) 5-иод-2-метокси-4,6-диметилникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,64 (с, 3H), 2,75 (c, 3H), 4,01 (с, 3H).
Пример 57
Синтез 2-метокси-4,6-диметил-5-фенилникотинoнитрила
5-иод-2-метокси-4,6-диметилникотинoнитрил (1,6 г, 5,554 ммоль), Pd(PPh3)4 (642 мг, 0,555 ммоль), фенилборная кислота (1,05 г, 8,331 ммоль) и безводный карбонат калия (1,54 г, 11,11 ммоль) суспендировали в смешанном растворе из 60 мл безводного толуола и 3 мл безводного этанола и затем нагревали до кипения с обратным холодильником в течение около 72 часов в атмосфере азота. Смесь фильтровали, добавляли 100 мл насыщенного раствора хлорида аммония и затем экстрагировали дважды 100 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия и затем концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (5% EtOAc/гексан) и получали 1,04 г (78%) 2-метокси-4,6-диметил-5-фенилникотинoнитрила в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,18 (c, 3H), 2,22 (c, 3H), 4,06 (c, 3H), 7,08-7,12 (м, 2H), 7,37-7,49 (м, 3H).
Пример 58
Синтез метилового эфира (3-циано-2-метокси-6-метил-5-фенилпиридин-4-ил)уксусной кислоты
851 мг (86%) Метилового эфира (3-циано-2-метокси-6-метил-5-фенилпиридин-4-ил)уксусной кислоты получали в виде твердого вещества светло-желтого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 800 мг 2-метокси-4,6-диметилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 2,24 (c, 3H), 3,57 (c, 2H), 3,61 (c, 3H), 4,08 (c, 3H), 7,07-7,11 (м, 2H), 7,38-7,46 (м, 3H).
Пример 59
Синтез 4-(2-гидроксиэтил)-2-метокси-6-метил-5-фенилникотинoнитрила
Получали 429 мг (68%) 4-(2-гидроксиэтил)-2-метокси-6-метил-5-фенилникотинoнитрила в виде твердого продукта белого цвета, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 700 мг метилового эфира (3-циано-2-метокси-6-метил-5-фенилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 1,36 (шир.т, 1H, J=6,3 Гц), 2,20 (c, 3H), 2,83 (т, 2H, J=6,9 Гц), 3,68 (кв., 2H, J=6,9 Гц), 4,06 (c, 3H), 7,12-7,15 (м, 2H), 7,40-7,49 (м, 3H).
Пример 60
Синтез 8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 442 мг (94%) 8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 492 мг 4-(2-гидроксиэтил)-2-метокси-6-метил-5-фенилникотинoнитрила.
1H ЯМР (300 МГц, ДМСО-d6) δ 2,02 (c, 3H), 2,46 (т, 2H, J=6,0 Гц), 4,19 (т, 2H, J=6,0 Гц), 7,24-7,27 (м, 2H), 7,37-7,49 (м, 3H), 12,15 (шир.с, 1Н).
Пример 61
Синтез 8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 267 мг (89%) 8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 280 мг 8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1Н ЯМР (300 МГц, CDCl3) δ 2,37 (c, 3H), 2,71 (т, 2H, J=5,7 Гц), 4,36 (т, 2H, J=5,7 Гц), 7,13-7,17 (м,2H), 7,43-7,54 (м, 3H).
Пример 62
Синтез 6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
8-Хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он (120 мг, 0,438 ммоль), ацетат палладия (5,0 мг, 0,022 ммоль) и ацетат натрия (72 мг, 0,877 ммоль) суспендировали в 5 мл безводного метанола и затем перемешивали при комнатной температуре в течение около 2 часов в атмосфере водорода. Смесь фильтровали и затем концентрировали при пониженном давлении, добавляли 15 мл насыщенного раствора гидрокарбоната натрия и затем экстрагировали дважды 20 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (2% MeOH/MC) и получали 101 мг (96%) 6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,41 (c, 3H), 2,71 (т, 2H, J=6,0 Гц), 4,43 (т, 2H, J=6,0 Гц), 7,14-7,20 (м, 2H), 7,41-7,53 (м, 3H), 9,18 (c, 1H).
Пример 63
Синтез 2-гидрокси-4-метил-6-фенилникотинoнитрила
1-Бензоил-ацетон (5 г, 30,52 ммоль) и цианоацетамид (2,56 г, 30,52 ммоль) растворяли в 100 мл безводного этанола, добавляли пиперидин (2,598 г, 30,52 ммоль), и затем перемешивали в течение 2 дней при 80°C. Смесь упаривали при пониженном давлении для удаления растворителя. Полученный твердый продукт фильтровали и промывали метанолом и водой, и затем сушили с получением 4,75 г (73%) 2-гидрокси-4-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,81-7,77 (м, 2H), 7,54-7,51 (м, 3H), 6,73 (c, 1H), 2,41 (c, 3H).
Пример 64
Синтез 2-хлор-4-метил-6-фенилникотинoнитрила
Получали 2,17 г (92%) 2-хлор-4-метил-6-фенилникотинoнитрила в виде твердого продукта коричневого цвета, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 2 г 2-гидрокси-4-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,04-8,01 (м, 2H), 7,62 (c, 1H), 7,51-7,48 (м, 3H), 2,65 (с, 3H).
Пример 65
Синтез 4-метил-6-фенилникотинoнитрила
Получали 390 мг (92%) 4-метил-6-фенилникотинoнитрила, используя такой же способ, как в примере 62, за исключением того, что вместо 8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 500 мг 2-хлор-4-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,85 (c, 1Н), 8,04-8,01 (м, 2H), 7,69 (c, 1Н), 7,53-7,48 (м, 3H), 2,62 (c, 3H).
Пример 66
Синтез метилового эфира (5-циано-2-фенилпиридин-4-ил)уксусной кислоты
Получали 600 мг (92%) метилового эфира (5-циано-2-фенилпиридин-4-ил)уксусной кислоты в виде бесцветного масла, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 500 мг 4-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,92 (c, 1H), 8,06-8,03 (м, 2H), 7,82 (c, 1H), 7,52-7,50 (м, 3H), 3,94 (c, 2H), 3,79 (c, 3H).
Пример 67
Синтез 4-(2-гидроксиэтил)-6-фенилникотинoнитрила
Получали 400 мг (90%) 4-(2-гидроксиэтил)-6-фенилникотинoнитрила в виде твердого продукта белого цвета, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 500 мг метилового эфира (5-циано-2-фенилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 8,87 (c, 1Н), 8,05-8,02 (м, 2H), 7,77 (c, 1Н), 7,51-7,49 (м, 3H), 3,74 (т, J=6,3 Гц, 2H), 3,15 (т, J=6,3 Гц, 2H).
Пример 68
Синтез 6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 286 мг (95%) 6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 300 мг 4-(2-гидроксиэтил)-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 9,31 (c, 1Н), 8,07-8,04 (м, 2H), 7,63 (c, 1H), 7,52-7,49 (м, 3H), 4,60 (т, J=5,7 Гц, 2H), 3,13 (т, J=5,6 Гц, 2H).
Пример 69
Синтез 2-метокси-4-метил-6-фенилникотинoнитрила
2-Хлор-4-метил-6-фенилникотинoнитрил (455 мг, 1,99 ммоль) растворяли в 20 мл DME, добавляли 95%-ный метоксид натрия (1,13 г, 19,90 ммоль) и затем перемешивали при комнатной температуре в течение около 1 часа. Смесь выливали в холодную воду и устанавливали pH от около 6 до 7 с помощью 10%-ной HCl и затем экстрагировали этилацетатом. Полученный остаток очищали хроматографией на колонке с силикагелем (10% EtOAc/гексан) и получали 370 мг (83%) 2-метокси-4-метил-6-фенилникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 8,06-8,03 (м, 2H), 7,48-7,46 (м, 3H), 7,30 (c, 1H), 4,14 (c, 3H), 2,65 (с, 3H).
Пример 70
Синтез метилового эфира (3-циано-2-метокси-6-фенилпиридин-4-ил)уксусной кислоты
Получали 770 мг (90%) метилового эфира (3-циано-2-метокси-6-фенилпиридин-4-ил)уксусной кислоты в виде бесцветного масла, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 680 мг 2-метокси-4-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,06-8,03 (м, 2H), 7,49-7,40 (м, 3H), 7,40 (c, 1H), 4,16 (c, 3H), 3,89 (c, 2H), 3,76 (c, 3H).
Пример 71
Синтез 4-(2-гидроксиэтил)-2-метокси-6-фенилникотинонитрила
Получали 414 мг (95%) 4-(2-гидроксиэтил)-2-метокси-6-фенилникотинoнитрила в виде твердого продукта белого цвета, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 550 мг метиловый эфир (3-циано-2-метокси-6-фенилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 8,06-8,03 (м, 2H), 7,48-7,46 (м, 3H), 7,39 (c, 1H), 4,14 (c, 3H), 4,00 (т, J=6,0 Гц, 2H), 3,09 (т, J=6,0 Гц, 2H).
Пример 72
Синтез 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 360 мг (95%) 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 400 мг 4-(2-гидроксиэтил)-2-метокси-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,88-7,84 (м, 2H), 7,54-7,51 (м, 3H), 7,17 (c, 1H), 4,39 (т, J=6,0 Гц, 2H), 2,97 (т, J=6,0 Гц, 2H).
Пример 73
Синтез 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 230 мг (82%) 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 300 мг HCl соли 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 8,05-8,02 (м, 2H), 7,56 (c, 1H), 7,50-7,47 (м, 3H), 4,50 (т, J=6,0 Гц, 2H), 3,12 (т, J=6,0 Гц, 2H).
Пример 74
Синтез 2,4-диметил-6-фенилникотинoнитрила
Бромид меди (2,56 г, 17,49 ммоль) суспендировали в 20 мл безводного ТГФ, по каплям добавляли бромид магния (3,0M эфир, 11,66 мл, 34,99 ммоль) при -78°C и перемешивали в течение около 20 минут. К раствору, в котором был растворен 2-хлор-6-фенил-4-метилникотинoнитрил, по каплям добавляли 10 мл безводного ТГФ при вышеуказанной температуре и затем перемешивали в течение около 1 часа при комнатной температуре. К смеси добавляли насыщенный раствор гидроксида аммония и устанавливали pH раствора, равным 10, с помощью 1н. NaOH. Затем раствор экстрагировали этилацетатом, сушили безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (5% EtOAc/гексан) и получали 550 мг (55%) 2,4-диметил-6-фенилникотинoнитрила в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 8,03-8,00 (м, 2H), 7,50-7,47 (м, 3H), 2,82 (c, 3H), 2,59 (c, 3H).
Пример 75
Синтез метилового эфира (3-циано-2-метил-6-фенилпиридин-4-ил)уксусной кислоты
Используя такой же способ, как в примере 1, получали 610 мг (95%) метилового эфира (3-циано-2-метил-6-фенилпиридин-4-ил)уксусной кислоты в виде твердого продукта белого цвета, за исключением того, что вместо 4-метилникотинoнитрила использовали 500 мг 2,4-диметил-6-фенилникотинонитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,04-8,01 (м, 2H), 7,61 (c, 1Н), 7,50-7,47 (м, 3H), 3,91 (c, 2H), 3,77 (c, 3H), 2,85 (c, 3H).
Пример 76
Синтез 4-(2-гидроксиэтил)-2-метил-6-фенилникотинoнитрила
Используя такой же способ, как в примере 2, получали 465 мг (95%) 4-(2-гидроксиэтил)-2-метил-6-фенилникотинoнитрила в виде твердого продукта белого цвета, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 550 мг метилового эфира (3-циано-2-метил-6-фенилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 8,04-8,01 (м, 2H), 7,60 (с, 1H), 7,49-7,47 (м, 3H), 3,99 (т, J=6,0 Гц, 2H), 3,12 (т, J=6,0 Гц, 2H), 2,83 (c, 3H).
Пример 77
Синтез 8-метил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 440 мг (99%) 8-метил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 444 мг 4-(2-гидроксиэтил)-2-метил-6-фенилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 8,07-8,04 (м, 2H), 7,49-7,47 (м, 3H), 4,50 (т, J=5,7 Гц, 2H), 3,08 (т, J=5,7 Гц, 2H), 2,97 (c, 3H).
Пример 78
Синтез 1-оксо-6-фенил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил ацетилового эфира
Получали 255 мг (84%) 1-оксо-6-фенил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил ацетилового эфир в виде твердого продукта белого цвета, используя такой же способ, как в примере 21, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 300 мг 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 8,03-8,00 (м, 2H), 7,57 (c, 1H), 7,49-7,46 (м, 3H), 4,53 (т, J=6,0 Гц, 2H), 3,12 (т, J=6,0 Гц, 2H), 2,43 (c, 3H).
Пример 79
Синтез 8-метокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
HCl соль 8-гидрокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она (300 мг, 1,080 ммоль), иодметан (3,68 г, 25,92 ммоль), оксид серебра (936 мг, 4,04 ммоль) и сульфат кальция (239,7 мг, 1,76 ммоль) растворяли в 20 мл безводного опротонного растворителя и затем перемешивали в течение ночи при комнатной температуре. Смесь упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (30% EtOAc/гексан) и получали 193 мг (70%) 8-метокси-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 8,05-8,02 (м, 2H), 7,45-7,43 (м, 3H), 7,21 (c, 1H), 4,44 (т, J=6,0 Гц, 2H), 4,15 (c, 3H), 3,01 (т, J=6,0 Гц, 2H).
Пример 80
Синтез 8-метиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 101 мг (45%) 8-метиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 230 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с метиламином.
1H ЯМР (300 МГц, CDCl3) δ 8,17 (c, 1Н), 8,11-8,06 (м, 2H), 7,51-7,44 (м, 3H), 6,83 (c, 1Н), 4,50 (т, J=6,0 Гц, 2H), 3,18 (д, J=4,8 Гц, 3H), 2,98 (т, J=6,0 Гц, 2H).
Пример 81
Синтез 8-диметиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 140 мг (99%) 8-диметиламино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 137 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с диметиламином.
1H ЯМР (300 МГц, CDCl3) δ 8,07-8,05 (м, 2H), 7,46-7,44 (м, 3H), 6,95 (c, 1H), 4,47 (т, J=6,0 Гц, 2H), 3,18 (с, 6H), 3,01 (т, J=6,0 Гц, 2H).
Пример 82
Синтез 6-фенил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 127 мг (98%) 6-фенил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 110 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с пиперидином.
1H ЯМР (300 МГц, CDCl3) δ 8,05-8,01 (м, 2H), 7,45-7,42 (м, 3H), 6,93 (c, 1H), 4,45 (т, J=6,0 Гц, 2H), 3,58 (м, 4H), 2,98 (т, J=6,0 Гц, 2H), 1,70 (с, 6H).
Пример 83
Синтез 8-морфолин-4-ил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 128 мг (98%) 8-морфолин-4-ил-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 110 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он вместе с морфолином.
1H ЯМР (300 МГц, CDCl3) δ 8,03-8,00 (м, 2H), 7,46-7,43 (м, 3H), 7,02 (c, 1Н), 4,45 (т, J=6,0 Гц, 2H), 3,85 (т, J=5,1 Гц, 4H), 3,63 (т, J=5,1 Гц, 4H), 2,99 (т, J=6,0 Гц, 2H).
Пример 84
Синтез 6-фенил-8-пиролидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 120 мг (97%) 6-фенил-8-пиролидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 110 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с пиролидином.
1H ЯМР (300 МГц, CDCl3) δ 8,07-8,04 (м, 2H), 7,45-7,43 (м, 3H), 6,93 (c, 1H), 4,46 (т, J=6,0 Гц, 2H), 3,57 (c, 4H), 3,00 (т, J=6,0 Гц, 2H), 1,99-1,95 (м, 4H).
Пример 85
Синтез 8-(4-фторфениламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 134 мг (95%) 8-(4-фторфениламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта светло-желтого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 110 мг 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 10,42 (c, 1Н), 8,04-8,01 (м, 2H), 7,77-7,72 (м, 2H), 7,49-7,46 (м, 3H), 7,10-7,03 (м, 3H), 4,57 (т, J=6,0 Гц, 2H), 3,07 (т, J=6,0 Гц, 2H).
Пример 86
Синтез 8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 2,03 г (98%) 8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта светло-желтого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 1,5 г 8-хлор-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с 4-метоксибензиламином.
1H ЯМР (300 МГц, CDCl3) δ 2,98 (т, 2H, J=6,0 Гц), 3,79 (c, 3H), 4,49 (т, 2H, J=6,0 Гц), 4,82 (д, 2H, J=5,4 Гц), 6,84-6,89 (м, 3H), 7,32-7,37 (м, 2H), 7,42-7,47 (м, 3H), 8,02-8,05 (м, 2H), 8,57 (шир.с, 1H).
Пример 87
Синтез 8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 1,30 г (96%) 8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 53, за исключением того, что вместо 8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 2,03 г 8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 3,01 (т, 2H, J=6,0 Гц), 4,52 (т, 2H, J=6,0 Гц), 6,91 (c, 1H), 7,44-7,50 (м, 3H), 7,95-7,99 (м, 2H).
Пример 88
Синтез N-(1-оксо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-8-ил)ацетамида
Получали 212 мг (90%) N-(1-оксо-6-фенил-3,4-дигидропирано[3,4-с]пиридин-8-ил)ацетамида в виде твердого продукта белого цвета, используя такой же способ, как в примере 54, за исключением того, что вместо 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 200 мг 8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 2,60 (c, 3H), 3,12 (т, 2H, J=6,3 Гц), 4,57 (т, 2H, J=6,3 Гц), 7,33 (c, 1H), 7,47-7,52 (м, 3H), 8,05-8,10 (м, 2H), 10,99 (шир.с, 1H).
Пример 89
Синтез N-(1-оксо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-8-ил)бензамида
Получали 260 мг (83%) N-(1-оксо-6-фенил-3,4-дигидропирано[3,4-c]пиридин-8-ил)бензамида в виде твердого продукта белого цвета, используя такой же способ, как в примере 55, за исключением того, что вместо 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 220 мг 8-амино-6-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 3,16 (т, 2H, J=6,0 Гц), 4,62 (т, 2H, J=6,0 Гц), 7,41 (c, 1H), 7,47-7,61 (м, 6H), 8,08-8,12 (м, 2H), 8,21-8,25 (м,2H), 12,02 (шир.с, 1H).
Пример 90
Синтез 2,6-дихлор-4-метилникотинoнитрила
К 2,6-дигидрокси-4-метилникотинoнитрилу (6 г, 39,96 ммоль) и бензилтриэтиламмоний хлориду (18,20 г, 79,92 ммоль) добавляли оксихлорид фосфора (30,63 г, 199,8 ммоль) и перемешивали в течение ночи при 120°C. Смесь медленно выливали в холодную воду и полученный твердый продукт фильтровали с получением 6,64 г (89%) 2,6-дихлор-4-метилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,29 (c, 1H), 2,59 (c, 3H).
Пример 91
Синтез 2-хлор-6-метокси-4-метилникотинoнитрила
2,6-Дихлор-4-метилникотинoнитрил (3,70 г, 19,83 ммоль) растворяли в 30 мл метанола, добавляли 4,28 мл метанола, содержащего 25% метоксид натрия, и затем перемешивали в течение около 3 часов при комнатной температуре. Смесь выливали в холодную воду, устанавливали pH, от 6 до 7 с помощью 10% HCl и экстрагировали, используя метиленхлорид. Экстракт сушили с помощью безводного сульфата натрия, фильтровали и упаривали при пониженном давлении. Осуществляли хроматографию на колонке с силикагелем (10% EtOAc/гексан) и получали 1,8 г (50%) 2-хлор-6-метокси-4-метилникотинoнитрила в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 7,42 (c, 1H), 4,29 (c, 3H), 2,60 (c, 3H).
Пример 92
Синтез 6-метокси-2,4-диметилникотинoнитрила
Получали 266 мг (60%) 6-метокси-2,4-диметилникотинoнитрила в виде твердого продукта белого цвета, используя такой же способ, как в примере 74, за исключением того, что вместо 2-хлор-6-фенил-4-метилникотинoнитрила использовали 500 мг 2-хлор-6-метокси-4-метилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 6,47 (c, 1H), 3,94 (c, 3H), 2,64 (c, 3H), 2,43 (с, 3H).
Пример 93
Синтез метилового эфира (3-циано-6-метокси-2-метилпиридин-4-ил)уксусной кислоты
Получали 1,0 г (93%) метилового эфира (3-циано-6-метокси-2-метилпиридин-4-ил)уксусной кислоты в виде твердого продукта белого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 786 мг 6-метокси-2,4-диметилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 6,58 (c, 1H), 3,96 (c, 3H), 3,76 (c, 2H), 3,75 (c, 3H), 2,67 (c, 3H).
Пример 94
Синтез 4-(2-гидроксиэтил)-6-метокси-2-метилникотинонитрила
Получали 862 мг (98%) 4-(2-гидроксиэтил)-6-метокси-2-метилникотинонитрила в виде бесцветного масла, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 1 г метилового эфира (3-циано-6-метокси-2-метилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 6,58 (c, 1H), 3,94 (c, 3H), 3,97 (т, J=6,0 Гц, 2H), 3,09 (т, J=6,0 Гц, 2H), 2,64 (c, 3H).
Пример 95
Синтез HCl соли 6-гидрокси-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 1,17 г (100%) HCl соли 6-гидрокси-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинонитрила использовали 860 мг 4-(2-гидроксиэтил)-6-метокси-2-метилникотинонитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,14 (c, 1H), 4,50 (т, J=6,0 Гц, 2H), 3,00 (т, J=6,0 Гц, 2H), 2,87 (c, 3H).
Пример 96
Синтез 6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 196 мг (89%) 6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 200 мг 6-гидрокси-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,12 (c, 1Н), 4,46 (т, J=6,0 Гц, 2H), 3,01 (т, J=6,0 Гц, 2H), 2,86 (c, 3H).
Пример 97
Синтез 8-метил-6-(тиофен-2-ил)-3,4-дигидропирано[3,4-c]пиридин-1-она
2-(Трибутилстаннил)тиофен (940 мг, 2,52 ммоль) по каплям добавляли к толуольному раствору 6-хлор-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-она (250 мг, 1,26 ммоль) и Pd(PPh3)4 (146 мг, 0,13 ммоль) и затем перемешивали в течение ночи при 100°C. Раствор охлаждали до комнатной температуры, добавляли 15 мл 0,4M раствор KF и затем экстрагировали метиленхлоридом. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (33% EtOAC/гексан) и получали 298 мг (96%) 8-метил-6-(тиофен-2-ил)-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 7,68 (дд, J=1,1 Гц, 3,75 Гц, 1H), 7,49 (дд, J=1,1 Гц, 3,75, 1H), 7,36 (c, 1H), 7,14 (дд, J=3,9 Гц, 5,1 Гц, 1Н), 4,48 (т, J=6,0 Гц, 2H), 3,04 (т, J=5,9 Гц, 2H), 2,91 (c, 3H).
Пример 98
Синтез 6-(фуран-2-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 251 мг (87%) 6-(фуран-2-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта розового цвета, используя такой же способ, как в примере 97, за исключением того, что вместо 2-(трибутилстаннил)тиофена добавляли 6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,26 ммоль) вместе с 2-(трибутилстаннил)фураном.
1H ЯМР (300 МГц, CDCl3) δ 7,58 (д, J=0,9 Гц, 1Н), 7,42 (c, 1Н), 7,23 (д, J=3,3 Гц, 1Н), 6,57 (кв, J=1,8 Гц, 1Н), 4,48 (т, J=6,0 Гц, 2H), 3,05 (т, J=5,9 Гц, 2H), 2,92 (c, 1Н).
Пример 99
Синтез 6-(бензо[d][1,3]диоксол-6-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
К раствору оранжевого цвета 6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она (250 мг, 1,26 ммоль) и Fe(acac)3 (22 мг, 0,06 ммоль) в смеси ТГФ/NMP (6 мл/0,6 мл) медленно добавляли 3,4-(метилендеокси)фенилбромид магния (1M раствор в смеси толуол/ТГФ = 1/1, 2,5 мл, 2,5 ммоль) и затем перемешивали при комнатной температуре в течение 10 минут. В вышеуказанную смесь по каплям добавляли 50 мл раствор насыщенного хлорида аммония, добавляли 20 мл воды и затем экстрагировали 100 мл этилацетата. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (33% EtOAC/гексан) и получали 214 мг (59%) 6-(бензо[d][1,3]диоксол-6-ил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она, и его перекристаллизовывали из смеси MC/эфир с получением 116 мг того же продукта в виде порошка белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 7,61 (с,1H), 7,58 (д, J=1,8 Гц, 1H), 6,91 (д, J=8,7 Гц, 1H), 6,04 (c, 2H), 4,49 (т, J=5,7 Гц, 2H), 3,36 (т, J=5,7 Гц, 2H), 2,94 (c, 3H).
Пример 100: Синтез 6-(4-(диметиламино)фенил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-она
160 мг (45%) 6-(4-(диметиламино)фенил)-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он получали в виде твердого вещества светло-желтого цвета, используя такой же способ, как в примере 99, за исключением того, что вместо 3,4-(метилендеокси)фенилбромида магния добавляли 6-хлор-8-метил-3,4-дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,26 ммоль) вместе с 4-(N,N-диметил)анилин бромидом магния.
1H ЯМР (300 МГц, CDCl3) δ 8,00-8,03 (м, 2H), 7,34 (с, 1H), 6,76-6,79 (м, 2H), 4,47 (т, J=5,7 Гц, 2H), 3,01-3,05 (м, 8H), 2,93 (c, 3H).
Пример 101
Синтез 2-метокси-4-метил-6-пропилникотинoнитрила
В прозрачный раствор красного цвета 6-хлор-2-метокси-4-метилникотинoнитрила (2,00 г, 11,0 ммоль) и Fe(acac)3 (387 мг, 1,1 ммоль) в смеси ТГФ/NMP(50 мл/5 мл) медленно добавляли 11 мл н-пропилбромида магния (2M раствор в диэтиловом эфире) и затем перемешивали в течение около 20 минут. В смесь затем добавляли 10 мл 1M раствора HCl и разбавляли 300 мл этилацетата. Полученный органический слой промывали водой и насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем фильтровали. Осуществляли хроматографию на колонке с силикагелем (10% EtOAc/гексан) фильтрата, полученного при концентрировании вышеуказанного остатка при пониженном давлении, и получали 2,23 г (88%) 2-метокси-4-метил-6-пропилникотинoнитрила в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 6,77 (с, 1H), 4,01 (с,3H), 2,77 (т, J=7,5 Гц, 2H), 2,46 (c, 3H), 1,80-1,73 (м, 2H), 0,99 (т, J=7,5 Гц, 3H).
Пример 102
Синтез метилового эфира (3-циано-2-метокси-6-пропилпиридин-4-ил)уксусной кислоты
Получали 2,2 г (89%) метилового эфира (3-циано-2-метокси-6-пропилпиридин-4-ил)уксусной кислоты в виде бесцветного масла, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинонитрила использовали 1,9 г 2-метокси-4-метил-6-пропилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 6,79 (c, 1H), 4,03 (c, 3H), 3,79 (с, 2H), 3,74 (c, 3H), 2,69 (т, J=7,5 Гц, 2H), 1,77-1,72 (м, 2H), 0,96 (т, J=7,5 Гц, 3H).
Пример 103
Синтез 4-(2-гидроксиэтил)-2-метокси-6-пропилникотинoнитрила
Получали 1,8 г (94%) 4-(2-гидроксиэтил)-2-метокси-6-пропилникотинoнитрила в виде бесцветного масла, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (5-цианопиридин-4-ил)уксусной кислоты использовали 2,15 г метилового эфира (3-циано-2-метокси-6-пропилпиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 6,75 (c, 1Н), 4,02 (c, 3H), 3,95 (т, J=6,6 Гц, 2H), 3,00 (т, J=6,6 Гц, 2H), 2,68 (т, J=7,2 Гц, 2H), 1,78-1,71 (м, 2H), 0,96 (т, J=7,2 Гц, 2H).
Пример 104
Синтез HCl соли 8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она и HCl соли 6-гидрокси-8-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали HCl соль 8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она и HCl соль 6-гидрокси-8-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она, 1,8 г (90%) и 1,7 г (85%), соответственно, в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила, соответственно, использовали 1,8 г 4-(2-гидроксиэтил)-2-метокси-6-пропилникотинoнитрила и 4-(2-гидроксиэтил)-6-метокси-2-пропилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 7,01 (c, 1Н), 4,48 (т, J=6,0 Гц, 2H), 3,03 (т, J=6,0 Гц, 2H), 2,77 (т, J=7,2 Гц, 2H), 1,81-1,76 (м, 2H), 0,96 (т, J=7,2 Гц, 3H).
1H ЯМР (300 МГц, CDCl3) δ 7,08 (c, 1Н), 4,46 (т, J=6,0 Гц, 2H), 3,20-3,14 (м, 2H), 3,01 (т,J=6,0 ГцJ 2H), 1,77-1,69 (м, 2H), 0,99 (т, J=7,5 Гц, 3H).
Пример 105
Синтез 8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она и 8-пропил-6-хлор-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-он и 8-пропил-6-хлор-3,4-дигидропирано[3,4-c]пиридин-1-он, 450 мг (97%) и 400 мг (86%), соответственно, в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она, соответственно, использовали 500 мг HCl соли 8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она и HCl соли 6-гидрокси-8-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,00 (c, 1H), 4,48 (т, J=6,0 Гц, 2H), 3,04 (т, J=6, 2H), 2,77 (т, J=7,2 Гц, 2H), 1,80-1,73 (м, 2H), 0,98 (т, J=7,2 Гц, 3H).
1H ЯМР (300 МГц, CDCl3) δ 7,09 (с,1H), 4,44 (т, J=6,0 Гц, 2H), 3,17 (т, J=7,2 Гц, 2H), 3,00 (т, J=6,0 Гц, 2H), 1,77-1,72 (м, 2H), 0,99 (т, J=7,2 Гц, 3H).
Пример 106
Синтез 8-морфолин-4-ил-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 367 мг (90%) 8-морфолин-4-ил-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 35, за исключением того, что вместо 4-фторанилина добавляли 300 мг 8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с морфолином.
1H ЯМР (300 МГц, CDCl3) δ 7,02 (c, 1H), 4,49 (т, J=6,0 Гц, 2H), 3,88 (т, J=5,4 Гц, 4H), 3,64 (т, J=5,4 Гц, 4H), 3,05 (т, J=6,2 Гц, 2H), 2,77 (т, J=7,2 Гц, 2H), 1,80-1,73 (м, 2H), 0,98 (т, J=7,2 Гц, 3H).
Пример 107
Синтез эфира 1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
Получали 500 мг (87%) эфира 1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты в виде твердого продукта белого цвета, используя такой же способ, как в примере 21, за исключением того, что вместо 4-фторанилин-8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 564 мг HCl соли 8-гидрокси-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,02 (c, 1H), 4,51 (т, J=6,0 Гц, 2H), 3,05 (т, J=6,0 Гц, 2H), 2,77 (т, J=7,5 Гц, 2H), 2,74 (c, 3H), 1,80-1,73 (м, 2H), 0,98 (т, J=7,5 Гц, 3H).
Пример 108
Синтез 8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 450 мг 8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде бесцветного масла, используя такой же способ, как в примере 32, за исключением того, что вместо пиперидина добавляли 335 мг 8-хлор-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она вместе с 4-метоксибензиламином.
1H ЯМР (300 МГц, CDCl3) δ 8,50 (c, 1H), 7,33-7,28 (м, 2H), 6,88-6,83 (м, 2H), 7,01 (c, 1H), 4,69 (д, J=5,7 Гц, 2H), 4,50 (т, J=6,0 Гц, 2H), 3,05 (т, J=6,0 Гц, 2H), 2,77 (т, J=7,5 Гц, 2H), 1,80-1,73 (м, 2H), 0,98 (т, J=7,5 Гц, 3H).
Пример 109
Синтез 8-амино-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 200 мг (80%) 8-амино-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 53, за исключением того, что вместо 8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 400 мг 8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,02 (c, 1H), 4,52 (т, J=6,0 Гц, 2H), 3,05 (т, J=6,0 Гц, 2H), 2,77 (т, J=7,5 Гц, 2H), 1,80-1,73 (м, 2H), 0,97 (т, J=7,5 Гц, 3H).
Пример 110
Синтез N-(1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил)ацетамида
Получали 220 мг (92%) N-(1-оксо-6-пропил-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-ил)ацетамида в виде твердого продукта белого цвета, используя такой же способ, как в примере 54, за исключением того, что вместо 8-амино-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 200 мг 8-амино-6-пропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 10,9 (c, 1H), 7,00 (c, 1H), 4,50 (т, J=6,0 Гц, 2H), 3,04 (т, J=2 Гц, 2H), 2,77 (т, J=7,5 Гц, 2H), 2,60 (с, 3H), 1,81-1,74 (м, 2H), 0,99 (т, J=7,5 Гц, 3H).
Пример 111
Синтез 4-(2-метоксиэтил)хинолин-3-карбонитрила
4-Метилхинолин-3-карбонитрил (600 мг, 3,567 ммоль) растворяли в 10 мл безводного ТГФ, добавляли LHMDS (1M раствор в ТГФ, 3,9 мл, 3,924 ммоль) при -78°C в атмосфере азота и затем перемешивали в течение около 1 часа при той же температуре. К смеси по каплям добавляли хлорметилметиловый эфир (0,30 мл, 3,924 ммоль), и затем перемешивали в течение около 1 часа при -50°C, и затем в течение около 1 часа при 0°C. В вышеуказанную смесь при перемешивании при 0°C добавляли 5 мл насыщенного раствора хлорида аммония и 10 мл дистиллированной воды, и затем экстрагировали дважды 50 мл EtOAc. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили на безводном сульфате натрия и фильтровали. Осуществляли хроматографию на колонке с силикагелем (30% EtOAc/гексан) фильтрата, полученного при концентрировании вышеуказанного остатка при пониженном давлении, и получали 305 мг (40%) 4-(2-метоксиэтил)хинолин-3-карбонитрила в виде твердого продукта светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 3,34 (с, 3H), 3,62 (т, 2H, J=6,6 Гц), 3,78 (т, 2H, J=6,6 Гц), 7,67-7,73 (м, 1H), 7,84-7,89 (м, 1H), 8,15-8,19 (м, 2H), 8,98 (c, 1H).
Пример 112
Синтез 3,4-дигидро-2-окса-9-аза-фенантрен-1-она
4-(2-Метоксиэтил)хинолин-3-карбонитрил (250 мг, 1,178 ммоль) растворяли в 10 мл концентрированной HCl и нагревали до кипения с обратным холодильником в течение около 15 часов. Смесь концентрировали при пониженном давлении, растворяли в 10 мл дистиллированной воды, нейтрализовали насыщенным раствором гидрокарбоната натрия и экстрагировали дважды 50 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и концентрировали. Осуществляли хроматографию на колонке с силикагелем (3% MeOH/MC) фильтрата, полученного при концентрировании вышеуказанного остатка при пониженном давлении, и получали 216 мг (92%) 3,4-дигидро-2-окса-9-аза-фенантрен-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 3,49 (т, 2H, J=6,3 Гц), 4,73 (т, 2H, J=6,3 Гц), 7,68-7,74 (м, 1H), 7,86-7,92 (м, 1H), 8,03 (д, 1H, J=8,1 Гц), 8,21 (д, 1H, J=8,1 Гц), 9,48 (c, 1H).
Пример 113
Синтез 3,4-дигидропирано[3,4-c]пиридин-1-тиона
3,4-Дигидропирано[3,4-c]пиридин-1-он (250 мг, 1,676 ммоль) растворяли в безводном толуоле, добавляли реагент Лавессона (Lawesson) и перемешивали в течение ночи при комнатной температуре (420 мг, 1,005 ммоль). Смесь упаривали при пониженном давлении, и полученный остаток очищали хроматографией на колонке с силикагелем (70% EtOAc/гексан) и получали 200 мг (72%) 3,4-дигидропирано[3,4-c]пиридин-1-тиона в виде твердого продукта желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 9,50 (с, 1Н), 8,68 (д, J=4,8 Гц, 1Н), 7,15 (д, J=4,8 Гц, 1Н), 4,60 (т, J=6,3 Гц, 2Н), 3,08 (т, J=6,3 Гц, 2Н).
Пример 114
Синтез 4-(2-гидроксиэтил)-N-(4-метоксибензил)никотинамида
3,4-Дигидропирано[3,4-с]пиридин-1-он (1/5 г, 10,06 ммоль) растворяли в 40 мл безводного ТГФ, по каплям добавляли 4-метоксибензиламин (13 мл, 100,56 ммоль) и затем нагревали до кипения с обратным холодильником в течение около 45 часов в атмосфере азота. Смесь, при перемешивании при 0 С, нейтрализовали прибавлением 1н. HCl и экстрагировали три раза 100 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (7% МеОН/МС) и получали 2,24 г (78%) 4-(2-гидроксиэтил)-N-(4-метоксибензил) никотинамида в виде бесцветного масла.
1H ЯМР (300 МГц, ДМСО-d6) δ 2,87 (т, 2Н, J=6, 6 Гц), 3,62 (шир. т, 2Н, J=6,6 Гц), 3,74 (с, 3Н), 4,40 (д, 2Н, J=5,7 Гц), 4,84 (шир. с, 1Н), 6,88-6,92 (м, 2Н), 7,24-7,29 (м, 2Н), 7,34 (д, 1Н, J=5,l Гц), 8,50 (д, 1Н, J=5,l Гц), 8,51 (с, 1Н), 9,03 (шир. т, 1Н, J=5,7 Гц).
Пример 115
Синтез 2-(4-метоксибензил)-3,4-дигидро-2Н-[2,7]нафтиридин-1-она 4-(2-Гидроксиэтил)-N-(4-метоксибензил)никотинамид (2,2 г, 7,683 ммоль) и трифенилфосфин (4,03 г, 15,37 ммоль) растворяли в 50 мл безводного ТГФ. К смеси, при перемешивании при 0 С в атмосфере азота, по каплям добавляли диэтилазокарбоксилат (1,4 мл, 9,220 ммоль) и перемешивали в течение около 1 часа при комнатной температуре. Смесь затем концентрировали при пониженном давлении, и полученный остаток очищали хроматографией на колонке с силикагелем (3% МеОН/МС) и получали 1,88 г (91%) 2-(4-метоксибензил)-3,4-дигидро-2Н-[2,7]нафтиридин-1-она в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,92 (т, 2Н, J=6, 6 Гц), 3,49 (т, 2Н, J=6,6 Гц), 3,80 (с, 3Н), 4,72 (с, 2Н), 6,85-6,90 (м, 2Н), 7,10 (д, 1H, J=5,1 Гц), 7,24-7,29 (м, 2H), 8,61 (д, 1H, J=5,1 Гц), 9,27 (c, 1H).
Пример 116
Синтез 3,4-дигидро-2H-[2,7]нафтиридин-1-она
2-(4-Метоксибензил)-3,4-дигидро-2H-[2,7]нафтиридин-1-он (1,63 г, 6,075 ммоль) суспендировали в 30 мл безводного толуола, добавляли моногидрат п-толуолсульфоновой кислоты (4,62 г, 24,30 ммоль) и нагревали до кипения с обратным холодильником в течение около 6 часов в атмосфере азота. Смесь, при перемешивании при 0°C, нейтрализовали прибавлением насыщенного раствора карбоната натрия и экстрагировали семь раз 150 мл 15% MeOH/MC. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (7% MeOH/MC) и получали 550 мг (61%) 3,4-дигидро-2H-[2,7]нафтиридин-1-она в виде твердого вещества белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,93 (т, 2H, J=6,6 Гц), 3,38-3,43 (м, 2H), 7,35 (д, 1H, J=5,1 Гц), 8,08 (шир.с, 1H), 8,59 (д, 1H, J=5,1 Гц), 8,90 (c, 1H).
Пример 117
Синтез 2-бензил-3,4-дигидро-2H-[2,7]нафтиридин-1-она
193 мг (52%) 2-бензил-3,4-дигидро-2H-[2,7]нафтиридин-1-она получали в виде бесцветного масла, используя такой же способ, как в примере 2, за исключением того, что вместо 2H-[2,7]нафтиридин-1-она использовали 3,4-дигидро-2H-[2,7]нафтиридин-1-он (230 мг, 1,552 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 2,94 (т, 2H, J=6,6 Гц), 3,52 (т, 2H, J=6,6 Гц), 4,79 (c, 2H), 7,11 (д, 1Н, J=5,1 Гц), 7,27-7,36 (м, 5H), 8,62 (д, 1Н, J=5,1 Гц), 9,28 (c, 1Н).
Пример 118
Синтез 4-(2-гидрокси-2-фенилэтил)никотинoнитрила
4-Метилникотинoнитрил (2,0 г, 16,93 ммоль) растворяли в 20 мл безводного ТГФ (20 мл), добавляли LHMDS (1M раствор в ТГФ, 34 мл, 33,86 ммоль) при -78°C в атмосфере азота и затем перемешивали в течение около 1 часа при той же температуре. К смеси по каплям добавляли бензальдегид (2,1 мл, 20,32 ммоль) и перемешивали при -50°C в течение около 1 часа. К смеси, при перемешивании при 0°C, добавляли 30 мл насыщенного раствора хлорида аммония и 50 мл дистиллированной воды и затем экстрагировали дважды 100 мл EtOAc. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили с помощью безводного сульфата натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (2% MeOH/MC) и получали 3,46 г (91%) 4-(2-гидрокси-2-фенилэтил)никотинoнитрила в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, CDCl3) δ 2,16 (д, 1H, J=3,3 Гц), 3,22-3,24 (м, 2H), 5,03-5,08 (м, 1H), 7,29 (д, 1Н, J=5,4 Гц), 7,32-7,38 (м, 5H), 8,64 (д, 1Н, J=5,4 Гц), 8,80 (c, 1Н).
Пример 119
Синтез 4-стирилникотинамида
4-(2-Гидрокси-2-фенилэтил)никотинoнитрил (2,0 г, 8,92 ммоль) растворяли в KOH (1M раствор в MeOH, 36 мл, 35,67 ммоль) и затем перемешивали при комнатной температуре в течение около 4 часов в атмосфере азота. К смеси добавляли 100 мл дистиллированной воды и экстрагировали два раза 150 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (10% MeOH/MC) и получали 1,66 г (83%) 4-стирилникотинамида в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, ДМСО-d6) δ 7,33-7,60 (м, 7H), 7,68 (шир.с, 1Н), 7,82 (д, 1Н, J=5,4 Гц), 8,10 (шир.с, 1Н), 8,59 (д, 1Н, J=5,4 Гц), 8,62 (c, 1Н).
Пример 120
Синтез 3-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она (a) и 3-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она (b)
Стирилникотинамид (1,2 г, 5,35 ммоль) растворяли в 10 мл фосфорной кислоты и затем перемешивали при 120°C в течение около 8 часов. Смесь выливали в 200 мл дистиллированной воды, нейтрализовали прибавлением насыщенного раствора карбоната натрия, при перемешивании при 0°C, и затем экстрагировали дважды 200 мл метиленхлорида. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (5% MeOH/MC) и получали 408 мг (34%) 3-фенил-3,4-дигидропирано[3,4-c]пиридин-1-она (a) и 160 мг (13%) 3-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она (b), соответственно, в виде твердого продукта белого цвета.
3-фенил-3,4-дигидропирано[3,4-c]пиридин-1-он:
1H ЯМР (300 МГц, CDCl3) δ 3,13-3,40 (м, 2H), 5,57-5,62 (м, 1H), 7,25 (д, 1H, J=5,1 Гц), 7,37-7,49 (м, 5H), 8,76 (дJ 1H, J=5,1 Гц), 9,31 (c, 1H).
3-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он:
1H ЯМР (300 МГц, CDCl3) δ 3,10-3,26 (м, 2H), 4,86-4,92 (м, 1H), 6,06 (шир.с, 1H), 7,14 (д, 1H, J=5,1 Гц), 7,34-7,45 (м, 5H), 8,66 (д, 1H, J=5,1 Гц), 9,26 (c, 1H).
Пример 121
Синтез 2H-[2,7]нафтиридин-1-она
4-Метилникотинoнитрил (2,0 г, 16,93 ммоль) растворяли в 20 мл безводного ДМФ, по каплям добавляли N,N-диметилформамид диметилацеталь (4,5 мл, 33,86 ммоль) и затем перемешивали при 120°C в атмосфере азота в течение около 2 часов. Смесь концентрировали при пониженном давлении, добавляли дистиллированную воду и затем экстрагировали дважды 100 мл EtOAc. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили с помощью безводного сульфата натрия и затем концентрировали. Концентрированный остаток растворяли в смешанном растворе 10 мл уксусной кислоты и 10 мл серной кислоты и перемешивали при 110°C в течение около 1 часа. Смесь затем охлаждали до комнатной температуры, выливали в 200 мл дистиллированной воды и нейтрализовали, медленно добавляя карбонат калия при перемешивании при 0°C. Затем экстрагировали 6 раз 150 мл 20% MeOH/MC. Полученный органический слой сушили с помощью безводного сульфата натрия, фильтровали и концентрировали. Полученный остаток очищали хроматографией на колонке с силикагелем (10% MeOH/MC) и получали 1,49 г (60%) 2H-[2,7]нафтиридин-1-она в виде твердого вещества светло-желтого цвета.
1H ЯМР (300 МГц, ДМСО-d6) δ 6,55 (д, 1H, J=7,2 Гц), 7,43 (д, 1H, J=7,2 Гц), 7,57 (д, 1H, J=5,4 Гц), 8,69 (д, 1H, J=5,4 Гц), 9,30 (c, 1H), 11,59 (шир.с, 1H).
Пример 122
Синтез 2-бензил-2H-[2,7]нафтиридин-1-она
2H-[2,7]Нафтиридин-1-он (200 мг, 1,368 ммоль) суспендировали в 6 мл безводного ДМФ и добавляли NaH (60% дисперсия в минеральном масле, 82 мг, 2,053 ммоль) при перемешивании при 0°C в атмосфере азота. Смесь охлаждали до комнатной температуры в течение около 2 часов, по каплям добавляли бензилхлорид (0,19 мл, 1,642 ммоль) при 0°C и затем перемешивали при комнатной температуре в течение около 2 часов. К смеси добавляли 5 мл насыщенного раствора хлорида аммония и 5 мл дистиллированной воды, при перемешивании при 0°C, и экстрагировали два раза 30 мл EtOAc. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили с помощью безводного сульфата натрия, фильтровали и затем концентрировали. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем (5% MeOH/MC) и получали 288 мг (89%) 2-бензил-2H-[2,7]нафтиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, CDCl3) δ 5,22 (c, 2H), 6,42 (д, 1H, J=7,2 Гц), 7,26-7,39 (м, 7 H), 8,72 (д, 1H, J=5,1 Гц), 9,65 (c, 1H).
Пример 123
Синтез 8-метил-6-метил-2H-[2,7]нафтиридин-1-она
Получали 1,91 г (56%) 8-метил-6-фенил-2H-[2,7]нафтиридин-1-она в виде твердого вещества светло-желтого цвета, используя такой же способ, как в примере 121, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,4-диметил-6-фенилникотинoнитрил (3,01 г, 14,45 ммоль).
1H ЯМР (300 МГц, ДМСО-d6) δ 3,02 (c, 3H), 6,53 (д, 1H, J=6,9 Гц), 7,36 (д, 1H, J=6,9 Гц), 7,44-7,55 (м, 3H), 7,98 (c, 1H), 8,16-8,20 (м, 2H), 11,35 (шир.с, 1H).
Пример 124
Синтез 8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она
8-Метил-6-фенил-2H-[2,7]нафтиридин-1-он (500 мг, 2,116 ммоль) суспендировали в безводном этаноле, добавляли 5% Pd/C (400 мг) и затем перемешивали при комнатной температуре в атмосфере водорода в течение около 72 часов. Смесь фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (2% MeOH/MC) и получали 462 мг (92%) 8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она в виде твердого продукта белого цвета.
1H ЯМР (300 МГц, ДМСО-d6) δ 2,83 (с, 3H), 2,95 (т, 2H, J=6,3 Гц), 3,31-3,70 (м, 2H), 7,43-7,54 (м, 3H), 7,79 (c, 1H), 8,01 (шир.с, 1H), 8,11-8,14 (м, 2H).
Пример 125
Синтез 2,8-диметил-6-фенил-2H-[2,7]нафтиридин-1-она
Получали 320 мг (86%) 2,8-диметил-6-фенил-2H-[2,7]нафтиридин-1-он 320 мг (86%) в виде твердого вещества светло-желтого цвета, используя такой же способ, как в примере 122, за исключением того, что вместо 2H-[2,7]нафтиридин-1-она и бензилхлорида использовали 8-метил-6-фенил-2H-[2,7]нафтиридин-1-он (350 мг, 1,481 ммоль) и иодметан (0,11 мл, 1,777 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 3,20 (c, 3H), 3,58 (c, 3H), 6,42 (д, 1H, J=7,2 Гц), 7,24 (д, 1H, J=7,2 Гц), 7,41-7,52 (м, 3H), 7,57 (c, 1H), 8,08-8,12 (м, 2H).
Пример 126
Синтез 2,8-диметил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она
Получали 195 мг (87%) 2,8-диметил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 124, за исключением того, что вместо 8-метил-6-фенил-2H-[2,7]нафтиридин-1-она использовали 2,8-диметил-6-фенил-2H-[2,7]нафтиридин-1-он (220 мг, 0,879 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 3,00 (с, 3H), 3,01 (т, 2H, J=6,3 Гц), 3,18 (с, 3H), 3,57 (т, 2H, J=6,3 Гц), 7,38 (с,1H), 7,4 2-7,50 (м, 3H), 8,02-8,05 (м, 2H).
Пример 127
Синтез 2-бензил-8-метил-6-фенил-2H-[2,7]нафтиридин-1-она
Получали 265 мг (96%) 2-бензил-8-метил-6-фенил-2H-[2,7]нафтиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 122, за исключением того, что вместо 2H-[2,7]нафтиридин-1-она использовали 8-метил-6-фенил-2H-[2,7]нафтиридин-1-он(200 мг, 0,846 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 3,21 (с,3H), 5,19 (c, 2H), 6,41 (д, 1H, J=7,5 Гц), 7,24 (д, 1H, J=7,5 Гц), 7,27-7,39 (м, 5H), 7,40-7,52 (м, 3H), 7,56 (c, 1H), 8,08-8,12 (м, 2H).
Пример 128
Синтез 2-бензил-8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она
Получали 295 мг (82%) 2-бензил-8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 122, за исключением того, что вместо 2H-[2,7]нафтиридин-1-она использовали 8-метил-6-фенил-3,4-дигидро-2H-[2,7]нафтиридин-1-он (260 мг, 1,091 ммоль).
1H ЯМР (300 МГц, CDCl3) δ 2,92 (т, 2H, J=6,3 Гц), 3,03 (с, 3H), 3,49 (т, 2H, J=6,3 Гц), 4,80 (с,2H), 7,27-7,37 (м, 6H), 7,39-7,50 (м, 3H), 8,01-8,05 (м, 2H).
Пример 129
Синтез 6-циклогексил-2-метокси-4-метилникотинoнитрила
Получали 2,23 г (88%) 6-циклогексил-2-метокси-4-метилникотинoнитрила, используя такой же способ, как в примере 101, за исключением того, что вместо н-пропилмагний бромида добавляли 2,0 г 6-хлор-2-метокси-4-метилникотинoнитрила вместе с циклогексилмагнийхлоридом.
1H ЯМР (300 МГц, CDCl3) δ 6,68 (c, 1H), 4,04 (c, 3H), 2,55-2,64 (м, 1H), 2,48 (c, 3H), 1,71-1,94 (м, 5H), 1,26-1,57 (м, 5H).
Пример 130
Синтез метилового эфира (3-циано-6-циклогексил-2-метоксипиридин-4-ил)уксусной кислоты
Получали 2,43 г (87%) метилового эфира (3-циано-6-циклогексил-2-метоксипиридин-4-ил)уксусной кислоты в виде масла желтого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 2,23 г 6-циклогексил-2-метокси-4-метилникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 6,77 (c, 1H), 4,04 (c, 3H), 3,78 (д, J=3,0 Гц, 2H), 3,75 (c, 3H), 2,57-2,67 (м, 1H), 1,71-1,93 (м, 5H), 1,26-1,57 (м, 5H).
Пример 131
Синтез 6-циклогексил-4-(2-гидроксиэтил)-2-метоксиникотинoнитрила
Получали 2,11 г (96%) 6-циклогексил-4-(2-гидроксиэтил)-2-метоксиникотинoнитрила в виде бесцветного, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 2,43 г метилового эфира (3-циано-6-циклогексил-2-метоксипиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 6,75 (с,1H), 4,02 (c, 3H), 3,91-3,96 (м, 3H), 3,00 (т, J=6,5 Гц, 2H), 2,55-2,65 (м, 1Н), 1,69-1,92 (м, 5H), 1,26-1,57 (м, 5H).
Пример 132
Синтез 6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 1,80 г (90%) 6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта светло-желтого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 2,10 г 6-циклогексил-4-(2-гидроксиэтил)-2-метоксиникотинoнитрила.
1H ЯМР (300 МГц, ДМСО-d6) δ 1,85 (c, 1Н), 6,09 (c, 1Н), 4,29 (т, J=5,9 Гц, 2H), 2,83 (т, J=5,9 Гц, 2H), 2,42-2,51 (м, 1Н), 1,65-1,82 (м, 5H), 1,16-1,47 (м, 5H).
Пример 133
Синтез метилового эфира 6-циклогексил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
Получали 307 мг (88%) метилового эфира 6-циклогексил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты в виде твердого продукта белого цвета, используя такой же способ, как в примере 21, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 300 мг 6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,02 (c, 1Н), 4,51 (т, J=6,0 Гц, 2H), 3,05 (т, J=5,9 Гц, 2H), 2,66-2,76 (м, 1Н), 2,4 (c, 3H), 1,74-2,04 (м, 5H), 1,23-1,55 (м, 5H).
Пример 134
Синтез 8-хлор-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 814 мг (76%) 8-хлор-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она использовали 1,0 г 6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-c]пиридин-1-она.
1Н ЯМР (300 MГц, CDCl3) δ 7,01 (c, 1H), 4,48 (т, J=5,9 Гц, 2H), 3,05 (т, J=5,9 Гц, 2H), 2,68-2,78 (м, 1H), 1,75-1,94 (м, 5H), 1,24-1,63 (м, 5H).
Пример 135
Синтез 6-циклогексил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 173 мг (98%) 6-циклогексил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-с]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 32, за исключением того, что вместо 8-хлор-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-она использовали 150 мг 8-хлор-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 MГц, CDCl3) δ 6,31 (с, 1H), 4,39 (т, J=5,7 Гц, 2H), 3,51 (шир.с, 4H), 2,87 (т, J=5,9 Гц, 2H), 2,46-2,55 (м, 1H), 1,81-1,92 (м, 4H), 1,59-1,66 (м, 7H), 1,18-1,55 (м, 5H).
Пример 136
Синтез 6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 498 мг (90%) 6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 32, за исключением того, что вместо 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она и пиперидина использовали 400 мг 8-хлор-6-циклогексил-3,4-дигидропираноp[3,4-c]пиридин-1-он вместе с 4-метоксибензиламином.
1H ЯМР (300 МГц, CDCl3) δ 8,46 (шир.с, 1H), 7,3l (д, J=8,4 Гц, 2H), 6,82-6,87 (м, 2H), 6,22 (c, 1H), 4,71 (д, J=5,7 Гц, 2H), 3,79 (c, 3H), 2,87 (т, J=5,9 Гц, 2H), 2,48-2,55 (м, 1H), 1,72-1,90 (м,5H), 1,18-1,57 (м, 5H).
Пример 137
Синтез 8-амино-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 190 мг (92%) 8-амино-6-циклогексил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 53, за исключением того, что вместо 8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 307 мг 6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 6,32 (c, 1Н), 4,62 (т, J=6,0 Гц, 2H), 2,90 (т, J=5,9 Гц, 2H), 2,44-2,52 (м, 5H), 1,72-1,91 (м, 5H), 1,19-1,57 (м, 5H).
Пример 138
Синтез 6-изопропил-2-метокси-4-метилникотинонитрила
Получали 1,01 г (65%) 6-изопропил-2-метокси-4-метилникотинoнитрила в виде бесцветного масла, используя такой же способ, как в примере 101, за исключением того, что вместо н-пропилмагнийбромида добавляли 1,5 г 6-хлор-2-метокси-4-метилникотинoнитрил вместе с хлоридом магния.
1H ЯМР (300 МГц, CDCl3) δ 6,68 (c, 1Н), 4,02 (c, 3H), 2,93 (квинтет, J=6,8 Гц, 1Н), 2,46 (c, 3H), 1,26 (д, J=6,9 Гц, 6H).
Пример 139
Синтез метилового эфира (3-циано-6-изопропил-2-метоксипиридин-4-ил)уксусной кислоты
Получали 1,41 г (83%) метилового эфира (3-циано-6-изопропил-2-метоксипиридин-4-ил)уксусной кислоты в виде твердого продукта желтого цвета, используя такой же способ, как в примере 1, за исключением того, что вместо 4-метилникотинoнитрила использовали 1,29 г 6-изопропил-2-метоксиникотинoнитрила.
1H ЯМР (300 МГц, CDCl3) δ 6,78 (c, 1H), 4,05 (c, 3H), 3,79 (c, 2H), 3,75 (c, 3H), 2,97 (квинтет, J=6,8 Гц, 1H), 2,17 (c, 3H), 1,28 (д, J=6,9 Гц, 6H).
Пример 140
Синтез 4-(2-гидроксиэтил)-6-изопропил-2-метоксиникотинoнитрила
Получали 1,89 г (97%) 4-(2-гидроксиэтил)-6-изопропил-2-метоксиникотинoнитрила в виде масла светло-желтого цвета, используя такой же способ, как в примере 2, за исключением того, что вместо метилового эфира (3-цианопиридин-4-ил)уксусной кислоты использовали 2,20 г метилового эфира (3-циано-6-изопропил-2-метоксипиридин-4-ил)уксусной кислоты.
1H ЯМР (300 МГц, CDCl3) δ 6,77 (c, 1Н), 4,04 (c, 3H), 3,96 (т, J=5,3 Гц, 2H), 2,91-3,04 (м, 3H), 1,27 (д, J=6,6 Гц, 6H).
Пример 141
Синтез 8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 1,20 г (80%) 8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 3, за исключением того, что вместо 4-(2-гидроксиэтил)никотинoнитрила использовали 1,60 г (4-(2-гидроксиэтил)-6-изопропил-2-метоксиникотинoнитрила.
1H ЯМР (300 МГц, ДМСО-d6) δ 11,89 (шир.с, 1Н), 6,12 (c, 1Н), 4,29 (т, J=6,2 Гц, 2H),2,74-2,86 (м,3H), 1,19 (д, J=6,9 Гц, 6H).
Пример 142
Синтез метилового эфира 6-изопропил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-8-илуксусной кислоты
Получали 208 мг (87%) метилового эфира 6-изопропил-1-оксо-3,4-дигидро-1H-пирано[3,4-с]пиридин-8-илуксусной кислоты в виде твердого продукта белого цвета, используя такой же способ, как в примере 21, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она использовали 200 мг 8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,04 (с,1H), 4,51 (т, J=6,0 Гц, 2H), 3,02-3,11 (м, 3H), 2,41 (c, 3H), 1,31 (д, J=6,6 Гц, 6H).
Пример 143
Синтез 8-хлор-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 740 мг (85%) 8-хлор-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 20, за исключением того, что вместо 8-гидрокси-6-метил-3,4-дигидропирано [3,4-c]пиридин-1-она использовали 800 мг 8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она.
1H ЯМР (300 МГц, CDCl3) δ 7,03 (c, 1H), 4,49 (т, J=6,2 Гц, 2H), 3,03-3,12 (м, 3H), 1,32 (д, J=6,6 Гц, 6H).
Пример 144
Синтез 6-изопропил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-она
Получали 481 мг (95%) 6-изопропил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-c]пиридин-1-она в виде твердого продукта белого цвета, используя такой же способ, как в примере 32, за исключением того, что вместо 8-хлор-6-метил-3,4-дигидропирано[3,4-c]пиридин-1-она и пиперидина использовали 350 мг 8-хлор-6-изопропил-3,4-дигидропирано[3,4-c]пиридин-1-она и 4-метоксибензиламид.
1H ЯМР (300 МГц, CDCl3) δ 8,48 (шир.с, 1H), 7,29-7,33 (м, 2H), 6,83-6,87 (м, 2H), 6,23 (с, 1H), 4,71 (д, J=6,0 Гц, 2H), 4,44 (т, J=6,3 Гц, 2H), 3,79 (c, 3H), 2,84-2,86 (м, 3H), 1,24 (д, J=6,0 Гц, 6H).
Между тем, соединения, представленные вышеуказанной формулой 1, по настоящему изобретению, могут быть получены в различных формах в зависимости поставленных задач. Следующие представляют собой только немногие из иллюстративных способов получения лекарственных препаратов, содержащих соединения, представленные вышеуказанной формулой 1, в качестве активного компонента и поэтому не должны быть рассмотрены как ограничивающие объем настоящего изобретения.
Получение 1
Получение таблеток (прямая компрессия)
5,0 мг активного компонента просеивали и затем смешивали с 14,1 мг лактозы, 0,8 мг кросповидона USNF и 0,1 мг стеарата магния. Смесь прессовали и получали таблетки.
Получение 2
Получение таблеток (влажное гранулирование)
5,0 мг активного компонента просеивали и затем смешивали с 16,0 мг лактозы и 4,0 мг крахмала. В воде растворяли 0,3 мг полисольвата 80 и полученный раствор затем добавляли в вышеуказанную смесь для микроизмельчения. После сушки 2,7 мг коллоидного диоксида кремния смешивали с 2,0 мг стеарата магния. Микроизмельченную смесь прессовали и получали таблетки.
Получение 3
Получение порошков и капсул
5,0 мг активного компонента просеивали и затем смешивали с 14,8 мг лактозы, 10,0 мг поливинилпирролидона и 0,2 мг стеарата магния с получением смешенного порошка. Желатиновые капсулы No.5 наполняли порошком, используя подходящее оборудование.
Экспериментальный пример 1
Эксперимент по ингибиторной активности в отношении цитокинов
1) Ингибиторная активность в отношении цитокинов в цельной крови человека
У пяти здоровых добровольцев, мужчин или женщин, которые не принимали противовоспалительных препаратов за последние две недели, собирали 20 мл цельной венозной крови, соответственно, и добавляли гепарин. Отбирали по 1 мл каждого образца крови, соответственно, и переносили в экспериментальные пробирки, в которых кровь смешивали с исследуемым веществом. Вышеуказанную смесь предварительно культивировали при 37°C в течение около 1 часа. Затем в смесь добавляли 1 мкг/мл LPS (липополисахарида), оставляли взаимодействовать при той же температуре в течение от около 4 до около 12 часов и затем центрифугировали при 4°C на скорости 3000 об/мин в течение около 10 минут. Полученную таким образом плазму собирали, соответственно, и подсчитывали количество TNF-α в каждом образце плазмы, используя набор ELISA для человеческого TNF-α, на основании количества рекомбинантного TNF-α человека. Используемый планшет покрывали моноклональными антителами IgG против TNF-α человека. Аналогичным образом, в случае эксперимента с IL-1α, подсчитывали количество IL-1α в каждом образце плазмы, используя вышеуказанный образец плазмы и набор ELISA для человеческого IL-1α, на основании количества рекомбинантного IL-1α человека. Используемый планшет покрывали моноклональными антителами IgG против человеческого IL-1α. Затем, в эксперименте с PGE2, в каждом образце плазмы подсчитывали количество PGE2, используя вышеуказанный образец плазмы и набор ELISA для PGE2, на основании количества рекомбинантного PGE2 человека. Используемый планшет покрывали моноклональными антителами IgG против человеческого PGE2. В каждом из вышеуказанных тестов получали степень ингибирования экспрессии каждого цитокина и сравнивали их с данными для индометацина. Результаты показаны на приведенной ниже таблице 1.
(200 мкг/млL)
(200 мкг/мл)
(200 мкг/мл)
(100 нг/мл)
(100 нг/мл)
(300 мкг/мл)
(100 нг/мл)
(100 нг/мл)
(300 мкг/мл)
(100 нг/мл)
(100 нг/мл)
(300 мкг/мл)
Как показано выше в таблице 1, ингибирующая активность в отношении цитокина в цельной крови человека у производных пиридина, полученных по настоящему изобретению, выше чем у индометацина, коммерчески доступного противовоспалительного и анальгезирующего средства, в частности, в отношении продукции TNF-α и IL-1α ингибирующая активность выше приблизительно от двух до трех раз. Кроме того, соединение примера 9 обладает одинаковым уровнем ингибиторной активности с индометацином в отношении продукции PGE2.
2) Ингибиторная активность в отношении цитокина на модели животных
Крыс Sprague Dawley (SD) с массой тела от около 180 до около 200 г не кормили (свободный доступ к питью) и затем тестировали. Исследуемые соединения вводили перорально в количестве 40 мг/кг и затем вводили внутрибрюшинно вместе LPS 1 мкг/мл через 1 час. Через 2 часа крыс умерщвляли и кровь собирали из брюшиной вены, хранили при комнатной температуре в течение около 2 часов и затем центрифугировали при 12000 об/мин в течение около 2 минут. Полученную таким образом плазму соответственно собирали и в каждом образце плазмы подсчитывали количество TNF-α, используя набор ELISA для мышиного TNF-α, основываясь на количестве рекомбинантного TNF-α у крыс. Используемый планшет покрывали моноклональными антителами IgG против TNF-α крысы. Аналогичным образом, в случае эксперимента IL-1α, подсчитывали количество IL-1α в каждом образце плазмы, используя вышеуказанный образец плазмы и набор ELISA для мышиного IL-1α, на основании количества рекомбинантного IL-1α. Используемый планшет покрывали моноклональными антителами IgG против TNF-α крысы. Аналогичным образом, в случае эксперимента с IL-6, подсчитывали количество IL-6 в каждом образце плазмы, используя вышеуказанный образец плазмы и набор ELISA для мышиного IL-6, на основании количества рекомбинантного IL-6 мыши. Затем, в эксперименте с INF-γ, в каждом образце плазмы подсчитывали количество INF-γ, используя вышеуказанный образец плазмы и набор ELISA для INF-γ мыши, на основании количества рекомбинантного INF-γ у мыши. Используемый планшет покрывали моноклональными антителами IgG против мышиного INF-γ. В каждом из вышеуказанных тестов получали степень ингибирования экспрессии каждого цитокина и сравнивали их с данными для индометацина. Результаты показаны на приведенных ниже таблицах 2 и 3.
Как показано выше в таблицах 2 и 3, ингибирующая активность в отношении цитокина на модели крысы у производных пиридина, полученных по настоящему изобретению, выше чем у индометацина, в частности, в отношении продукции TNF-α, IL-α, IL-6 и INF-γ, ингибирующая активность выше приблизительно в два раза. Кроме того, ингибиторная активность соединений примеров 21, 30, 32, 33 и 79 в 1,5 или 2 раза выше ингибиторной активности индометацина в отношении продукции TNF-α.
3) Ингибиторная активность в отношении цитокинов в клетках
Основные используемые реагенты были приобретены у Sigma-Aldrich chem. Co. и ингибиторную активность в отношении цитокинов использовали следующим образом. Среды и реагенты, которые использовались в клеточных культурах, были приобретены у GIBCO BRL (USA), а набор ELISA для мышиных TNF-α был приобретен у R&D system (USA). Используемой аппаратурой был ридер ELISA (Spectra max-Plus 384, Molecular Device, USA).
Мышиная клеточная линия макрофагов RAW 264.7 была любезно предоставлена Korean Tissue Culture Center (KTCC). Клеточную линию культивировали в среде DMEM, содержащей 10% FBS, в устройстве для клеточной культуры в условиях 37°C, 5% CO2. Сначала мышиные RAW 264.7 культивировали в среде DMEM, содержащей 10% FBS в течение около 24 часов, и клетки высевали в количестве 200 мкл в каждую лунку 96-луночного планшета с концентрацией 5×105/мл и культивировали в течение около 24 часов. Затем исследуемые соединения обрабатывали при различных концентрациях и затем взаимодействовали при 37°C в течение около 1 часа, в течение которого в лунки добавляли 1 мкг/мл липополисахарида (LPS) и взаимодействие продолжали при 37°C в течение около 12 часов. Супернатант выделяли и подсчитывали количество мышиного TNF-α в среде, используя набор ELISA. В качестве положительного и отрицательного контроля, соответственно, использовали талидомид для сравнения активностей, результаты представлены в нижеследующих таблицах 4a-4c.
Как показано выше в таблицах 4a-4c, производные пиридина по настоящему изобретению демонстрируют высокую ингибирующую активность в отношении продукции INF-α в клеточной линии RAW 264.7. В частности, ингибиторная активность соединений примеров 30, 31, 53, 61, 62, 77, 78, 79 и 97 выше ингибиторной активности контрольных соединений.
Экспериментальный пример 2
Противовоспалительный и анальгезирующий эффект на животной модели
1) Эксперимент с отеком уха, индуцированным маслом кротона
Исследовали самцов мышей из ICR (Institute of Cancer Research) с массой тела от около 20 до 30 г, при этом в каждой группе было по 6 мышей. Через 1 час после перорального введения исследуемого соединения одно ухо смазывали маслом кротона (в растворе ацетона). Через 4 часа толщину опухшего уха в обработанной группе сравнивали с неопухшим ухом и получали среднее значение увеличенной толщины уха, подвергшегося обработки. Вышеуказанное увеличение сравнивали с плацебо группой, результаты показаны на приведенной ниже таблице 5.
2) Эксперимент с отеком уха, индуцированным арахидоновой кислотой
Исследовали самцов мышей из ICR (Institute of Cancer Research) с массой тела от около 20 до 30 г, при этом в каждой группе было по 6 мышей. Через 1 час после перорального введения исследуемого соединения одно ухо смазывали арахидоновой кислотой (в растворе ацетона). Через 1 час толщину опухшего уха в обработанной группе сравнивали с неопухшим ухом и получали среднее значение увеличенной толщины уха, подвергшегося обработки. Вышеуказанное увеличение сравнивали с плацебо группой, результаты показаны в приведенной ниже таблице 6.
3) Тест на обезболивание
Исследовали самцов мышей из ICR (Institute of Cancer Research) с массой тела от около 20 до 30 г, при этом в каждой группе было по 6 мышей. Через 1 час после перорального введения исследуемого соединения внутрибрюшинно вводили уксусную кислоту (в дистиллированной воде). В течение 10 минут отмечали число потягиваний у мышей и сравнивали с числом потягиваний у плацебо группы, результаты показаны в приведенной ниже таблице 7.
Как показано в вышеуказанных таблицах 5 и 6, на животных моделях противовоспалительный эффект производных пиридина по настоящему изобретению был сравним с эффектом коммерчески доступного Celecoxib (100 мг/кг) при концентрации 2 мг/кг и 10 мг/кг, соответственно. Однако противовоспалительные эффекты производных пиридина по настоящему изобретению были выше эффекта Celecoxib при концентрации 50 мг/кг. Кроме того, в эксперименте на обезболивание, вышеуказанная таблица 7, производные пиридина по настоящему изобретению демонстрировали немного меньший, но сравнимый уровень болеутоляющего эффекта по сравнению с эффектом Celecoxib (100 мг/кг), а соединение примера 9 демонстрировало такой же уровень болеутоляющего эффекта по сравнению с эффектом Celecoxib.
Промышленная применимость
Как указано выше, производные пиридина вышеуказанной формулы 1 по настоящему изобретению обладают прекрасным ингибиторным эффектом в отношении продукции цитокинов, которые вовлечены в воспалительные реакции, более конкретно, они обладают прекрасным ингибиторным эффектом на продукцию TNF-α, IL-1α, IL-6, INF-γ, PGE2. Кроме того, их противовоспалительный и анальгезирующий эффекты выше эффектов коммерчески доступного индометацина или Celecoxib. Следовательно, производные пиридина, представленные вышеуказанной формулой 1, по настоящему изобретению могут использоваться в качестве терапевтических средств для лечения заболеваний, связанных с воспалением, иммунным, хроническим воспалением, а также в качестве средства, обладающего противовоспалительным и болеутоляющим эффектом.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНДОЛА И ИНДАЗОЛА, ОБЛАДАЮЩИЕ КОНСЕРВИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К КЛЕТКАМ, ТКАНЯМ И ОРГАНАМ | 2009 |
|
RU2460525C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788147C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПУРИНИЛПИРИДИНИЛАМИНО-2,4-ДИФТОРФЕНИЛСУЛЬФОНАМИДА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ RAF-КИНАЗЫ, СОДЕРЖАЩАЯ ДАННОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2011 |
|
RU2550038C2 |
| Производные изохинолинона, способ их получения и фармацевтическая композиция для профилактики или лечения заболеваний, связанных с поли(АДФ-рибоза)полимеразой-1, содержащая их в качестве активного ингредиента | 2020 |
|
RU2815480C1 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788148C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСОИНДЕНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ АНТИВИРУСНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2012 |
|
RU2566761C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОПИРИДИНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ | 2017 |
|
RU2722594C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2012 |
|
RU2612958C2 |
| ПЕРОРАЛЬНО БИОДОСТУПНЫЕ ПРОЛЕКАРСТВА (+)-3- ГИДРОКСИМОРФИНАНА ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2008 |
|
RU2430089C2 |
Настоящее изобретение относится к новым производным пиридина или их фармацевтически приемлемым солям общей формулы 1:
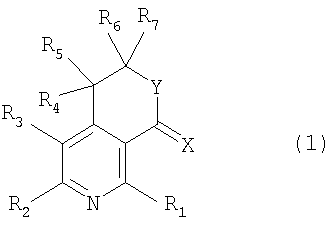
где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С3низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси; Х представляет собой атом кислорода или серы; Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода; вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы; вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными, причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано [3,4-с]пиридин-1-он, 5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он, 6-метил-8-фуран-2-ил-3,4-дигидропирано [3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
Эти соединения обладают ингибирующим действием в отношении образования цитокинов, которые включены в воспалительные реакции, таким образом могут быть использованы в качестве терапевтических средств для лечения заболеваний, относящихся к воспалениям, иммунным заболеваниям, хроническим воспалениям, а также средствам, обладающим противовоспалительным и болеутоляющим действием. Кроме того, настоящее изобретение относится к способам получения вышеуказанных веществ и фармацевтической композиции, содержащей вышеуказанные вещества. 9 н. и 12 з.п. ф-лы, 9 табл.
1. Соединение или фармацевтически приемлемая соль, представленная следующей формулой 1:

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, С1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
2. Соединение по п.1, где указанные Х и Y независимо представляют собой атом кислорода.
3. Соединение по п.1, где указанные R1, R2 и R3 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6алкиламино, ариламино, ациламино, насыщенную гетероциклическую группу, арил, гетероарил;
указанные R4, R5, R6 и R7 независимо выбраны из группы, содержащей атом водорода, C1-С6низший алкил и арильную группу;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R9 выбран из группы, включающей атом водорода;
указанная арильная группа представляет собой фенильную группу;
указанные гетероарильные и насыщенные гетероциклические группы выбраны из фурана, тиофена, пиридина, пиперидина, пиперазина, морфолина, пиролидина и бензодиоксола; и
указанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными.
4. Соединение по п.1, представленное формулой 1, выбрано из группы включающей:
3,4-дигидропирано[3,4-с]пиридин-1-он,
6,8-дихлор-3,4-дигидропирано[3,4-с]пиридин-1-он,
6,8-дигидрокси-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-гидрокси-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-хлор-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-иловый эфир уксусной кислоты,
8-метокси-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6,8-диметил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-тиофен-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-пиридин-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-фторфенил)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-хлорфенил)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-морфолин-4-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-(4-метилпиперазин-1-ил)-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-(4-пиримидин-2-илпиперазин-1-ил)-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-фторфениламино)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-хлорфениламино)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-трифторметилфениламино)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-п-толиламино-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-фениламино-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-фенетиламино-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-[(бензо[1,3]диоксол-5-илметил)амино]-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-8-фенокси-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-бензиламино-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-метоксибензиламино)-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-амино-6-метил-3,4-дигидропирано [3,4-с]пиридин-1-он,
8-ацетамидо-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-бензамидо-6-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-гидрокси-6-метил-5-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-хлор-6-метил-5-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-метил-5-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-гидрокси-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-хлор-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-метил-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
1-оксо-6-фенил-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-иловый эфир уксусной кислоты,
8-метокси-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-метиламино-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-диметиламино-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-фенил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-морфолин-4-ил-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-фенил-8-пиролидин-1-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-фторфениламино)-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-(4-метоксибензиламино)-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-амино-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-ацетамидо-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-бензамидо-6-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-гидрокси-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-хлор-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-метил-6-(тиофен-2-ил)-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-(фуран-2-ил)-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-(бензо[d][1,3]диоксол-6-ил)-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-(4-(диметиламино)фенил)-8-метил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-гидрокси-6-пропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-хлор-6-пропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-пропил-6-хлор-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-морфолин-4-ил-6-пропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
1-оксо-6-пропил-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-иловый эфир уксусной кислоты,
8-(4-метоксибензиламино)-6-пропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-амино-6-пропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
N-(1-оксо-6-пропил-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-ил)ацетамид,
3,4-дигидро-2-окса-аза-фенантрен-1-он,
3,4-дигидропирано[3,4-с]пиридин-1-тион,
2-(4-метоксибензил)-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2-бензил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
3-фенил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-фенил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-метил-6-фенил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2,8-диметил-6-фенил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2-бензил-8-метил-6-фенил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
6-циклогексил-8-гидрокси-3,4-дигидропирано[3,4-с]пиридин-1-он,
метиловый эфир 6-циклогексил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-илуксусной кислоты,
8-хлор-6-циклогексил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-циклогексил-8-пиперидин-1-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-циклогексил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-амино-6-циклогексил-3,4-дигидропирано[3,4-с]пиридин-1-он,
8-гидрокси-6-изопропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
метиловый эфир 6-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-илуксусной кислоты,
8-хлор-6-изопропил-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-изопропил-8-(4-метоксибензиламино)-3,4-дигидропирано[3,4-с]пиридин-1-он,
6-хлор-8-циклогексмил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
метиловый эфир 1-оксо-6-тиофен-2-ил-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-илуксусной кислоты,
6-этил-8-гидрокси-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
метиловый эфир 6-этил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-илуксусной кислоты,
8-хлоро-6-этил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-амино-6-этил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-этил-8-(4-метокси-бензиламино)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-этил-8-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-амино-6-изопропил-3,4-дигидро-пирано[3,4-с]-пиридин-1-он,
6-изопропил-8-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
2-этил-8-метил-6-фенил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-фуран-2-ил-6-фенил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-фенил-8-тиофен-2-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(4-фторфенил)-6-фенил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(4-фторфенил)-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-хлор-8-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-изопропил-6-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-изопропил-6-(4-метоксибензиламино)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-хлор-8-циклогексил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-циклогексил-6-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-циклогексил-6-морфолин-4-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-циклогексил-6-(4-метоксибензиламино)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-пропил-6-пирролидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-пиперидин-1-ил-8-пропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-морфолин-4-ил-8-пропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-амино-8-пропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-(4-метоксибензиламино)-8-пропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-гидрокси-8-пропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(4-фторфенил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-(4-фторфенил)-2,6-диметил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2-этил-8-(4-фторфенил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
6-амино-8-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-амино-8-циклогексил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
4-фтор-Н-(8-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-6-ил)-бензолсульфонамид,
4-хлор-N-(8-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-6-ил)-бензолсульфонамид,
N-(8-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-6-ил)-бензолсульфонамид,
N-(8-изопропил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-6-ил)-4-метокси-бензолсульфонамид,
N-(8-изопропил-1-оксо-3,4-дигидро-1H-пирано[3,4-c]пиридин-6-ил)-4-метокси-бензолсульфонамид,
8-[4-(2-гидроксиэтил)-пиперазин-1-ил]-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(4-бензилпиперазин-1-ил)-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-(4-фенилпиперазин-1-ил)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-[4-(2-этоксифенил)-пиперазин-1-ил]-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-[4-(2-хлорфенил)-пиперазин-1-ил]-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-(4-пиридин-2-ил-пиперазин-1-ил)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-(4-метил-пиперазин-1-ил)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-морфолин-4-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-пирролидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-изопропил-8-(метилфенетиламино)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-[1,4']бипепиридинил-1'-ил-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(4-бензилпиперидинил-1-ил)-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
1-(6-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-ил)-пиперидин-3-карбоксиламид,
этиловый эфир 1-(6-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-ил)-пиперидин-3-карбоновой кислоты,
этиловый эфир 1-(6-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-ил)-пиперидин-4-карбоновой кислоты,
5-(6-изопропил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-8-иламино)-пентановая кислота,
6-изопропил-8-тиоморфолин-4-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-трет-бутил-8-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-(1,1-диоксо-тиоморфолин-4-ил)-6-изопропил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-трет-бутил-8-хлор-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метокси-8-пиперидин-1-ил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-хлор-8-этил 1-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
8-этил-6-(4-метоксибензиламино)-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-амино-8-этил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
метиловый эфир 8-(4-фторфенил)-6-метил-1-оксо-3,4-дигидро-1Н-[2,7]нафтиридин-2-карбоновой кислоты,
2-(2-диметиламиноэтил)-8-(4-фторфенил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-(4-фторфенил)-6-метил-2-(2-пирролидин-1-ил-этил)-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-(4-фторфенил)-6-метил-2-(2-морфолин-4-ил-этил)-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
8-(4-фторфенил)-2-(2-гидроксиэтил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
этиловый эфир [8-(4-фторфенил)-6-метил-1-оксо-3,4-дигидро-1Н-[2,7]нафтиридин-2-ил]уксусной кислоты,
8-(4-фторфенил)-6-метил-2-пиридин-2-ил-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2-[1,3]диоксолан-2-ил-метил-8-(4-фторфенил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
2-(2-[1,3]диоксолан-2-ил-этил)-8-(4-фторфенил)-6-метил-3,4-дигидро-2Н-[2,7]нафтиридин-1-он,
[8-(4-фторфенил)-6-метил-1-оксо-3,4-дигидро-1Н-[2,7]нафтиридин-2-ил]-уксусная кислота,
Н-(8-этил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-6-ил)-4-фтор-бензолсульфонамид,
Н-(8-этил-1-оксо-3,4-дигидро-1Н-пирано[3,4-с]пиридин-6-ил)-3-фтор-бензолсульфонамид;
и их фармацевтически приемлемые соли.
5. Способ получения соединения, представленного следующей формулой 1, включающий:
(а) взаимодействие соединения, представленного следующей формулой 2, с соединением алкилового эфира, содержащего R6 в присутствии основания, с получением соединения, представленного следующей формулой 3;
(b) взаимодействие указанного соединения, представленного следующей формулой 3, с восстанавливающим агентом или металлическим реагентом, содержащим R7 при 0°С или комнатной температуре, с получением спиртового соединения, представленного следующей формулой 4; и
(c) проведение циклизации указанного спиртового соединения, представленного следующей формулой 4, с получением соединения, представленного следующей формулой 1
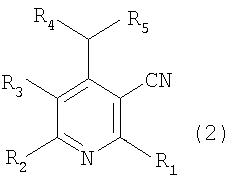
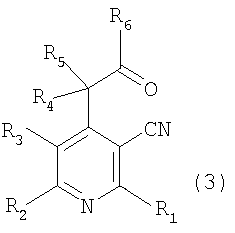
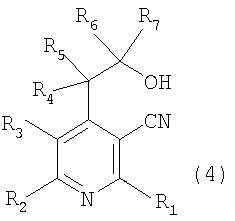
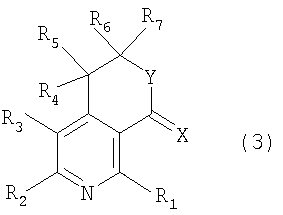
где R1, R2, R3, R4, R5, R6 и R7 являются такими, как определено в п.1, и Х и Y каждый в отдельности представляет собой атом кислорода.
6. Способ получения соединения, представленного следующей формулой 1, включающий:
(а) взаимодействие соединения, представленного следующей формулой 2, с соединением алкилкарбонила, представленным R6СОR7 в присутствии основания с получением соединения, представленного следующей формулой 4; и
(b) проведение циклизации указанного спиртового соединения, представленного следующей формулой 4, с получением соединения, представленного следующей формулой 1
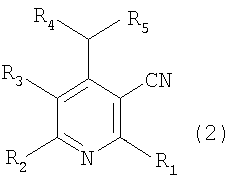
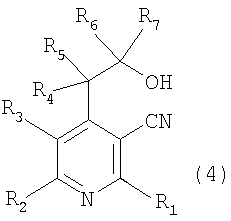

где R1, R2, R3, R4, R5, R6 и R7 являются такими, как определено по п.1, и Х и Y каждый в отдельности представляет собой атом кислорода.
7. Способ по п.5, где указанное соединение алкилового эфира, содержащее R6, представленное R6СООСН3.
8. Способ по п.5, где указанный металлический реагент, содержащий R7, представляющий собой реагент Гриньяра, представленный R7M, где М представляет собой щелочной металл, или R7MgX1, где Х представляет собой атом галогена.
9. Способ по п.5 или 6, где указанное основание, выбранно из группы, включающей бис(триметилсилил)амид лития, бис(триметилсилил)амид калия, диизопропиламид лития, гидрид натрия, гидрид калия и гидрид лития.
10. Способ по п.5 или 6, где указанную циклизацию выполняют с использованием сильной кислоты конц. HCl.
11. Способ получения соединения, представленного следующей формулой 1, включающий:
(a) взаимодействие соединения, представленного следующей формулой 1, где Х и Y каждый в отдельности представляет собой атом кислорода, с соединением амина, представленным R8NH2, с получением соединения, представленного следующей формулой 8; и
(b) проведение циклизации указанного соединения, представленного следующей формулой 8, с получением соединения, представленного следующей формулой 1, где Х представляет собой атом кислорода, и Y представляет собой N-R8

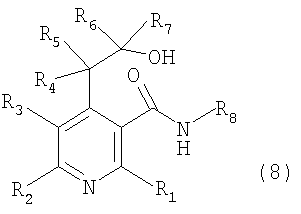
где R1, R2, R3, R4, R5, R6, R7, R8, X и Y являются такими, как определено в п.1.
12. Способ по п.11, где указанная циклизация выполняется с использованием диэтилазодикарбоксилата и трифенилфосфина.
13. Фармацевтическая композиция, обладающая ингибирующим действием в отношении образования цитокинов, где указанная композиция содержит соединение, представленное следующей формулой 1, или его фармацевтически приемлемую соль,

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
14. Фармацевтическая композиция по п.13, где указанный цитокин представляет собой TNF-α.
15. Терапевтическое средство, содержащее соединение, представленное следующей формулой 1, или ее фармацевтически приемлемую соль, эффективное в лечении воспалительных заболеваний,

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, С1-С6низший алкил, C1-С6низший алкокси, являются замещенньши,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
16. Терапевтическое средство по п.15, где указанные воспалительные заболевания, выбранные из группы, включающей ревматоидный артрит, рассеянный склероз, болезнь Крона, язвенный колит, реакцию "трансплантат против хозяина", системную красную волчанку, токсический шок, остеоартрит и инсулинозависимый сахарный диабет.
17. Терапевтическое средство, обладающее противовоспалительным и болеутоляющим действием, содержащее соединение, представленное следующей формулой 1, или ее фармацевтически приемлемую соль,

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
18. Терапевтическое средство для лечения иммунных заболеваний, содержащее соединение, представленное следующей формулой 1, или ее фармацевтически приемлемую соль,

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, С1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано [3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
19. Терапевтическое средство по п.18, где указанные иммунные заболевания выбранные из группы, включающей гломерулонефрит, дерматит, астму, инсульт, инфаркт миокарда, синдром острой дыхательной недостаточности, посттравматическую полиорганную недостаточность, гнойный менингит, некротический энтероколит, парагемодиализный синдром, септический шок и пост-климактерический остеопороз.
20. Терапевтическое средство для лечения хронических воспалительных заболеваний, содержащее соединение, представленное следующей формулой 1, или ее фармацевтически приемлемую соль,

где R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из группы, включающей атом водорода, галоген, амино, C1-С6низший алкил, С2-С6низший алкенил, C1-С6низший алкокси, C1-С10алкиламино, С4-С9циклоалкиламино, С4-С9гетероциклоалкиламино, C1-С10аралкиламино, ариламино, ациламино, насыщенный гетероциклил, ацилокси, арил, гетероарил, C1-С10аралкил, арилокси;
Х представляет собой атом кислорода или серы;
Y представляет собой атом кислорода или N-R8, где R8 выбран из группы, включающей атом водорода;
вышеуказанная арильная группа выбрана из фенила, нафтила и конденсированной фенильной группы;
вышеуказанные гетероарильные и насыщенные гетероциклические группы представляют собой гетероциклическое кольцо пентагональной или гексагональной формы, содержащее от 1 до 2 гетероатомов, выбранных из кислорода, азота и атома серы; или конденсированное гетероциклическое кольцо; и
вышеуказанные арильные и гетероарильные группы являются такими, что от 1 до 4 заместителей, выбранных из группы, включающей галоген, C1-С6низший алкил, C1-С6низший алкокси, являются замещенными,
причем упомянутые соединения или их фармацевтически приемлемая соль формулы 1 не являются следующими соединениями
6-метил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
5-винил-3,4-дигидро-пирано[3,4-с]пиридин-1-он,
6-метил-8-фуран-2-ил-3,4-дигидропирано[3,4-с]пиридин-1-он,
3-трет-бутил-5,6,7,8-тетрагидро-[2,7]нафтиридин-8-он и диметиловый эфир (3S)-6,8-диметил-1-оксо-1,2,3,4-тетрагидро-[2,7]нафтиридин-3,5-дикарбоновой кислоты.
21. Терапевтическое средство по п.20, где указанные хронические воспалительные заболевания представляют собой псориатический артрит, псориаз, алкилозирующий спондилоартрит, болезнь Стилла у взрослых, полимиозит, дерматомиозит или васкулит, такой как болезнь Бехчета и гранулематоз Вегенера.
| Dondoni A | |||
| et al, J | |||
| Org | |||
| Chem., 2003 (март), 68(16), p.6172-83 | |||
| El-Sedawy Al | |||
| et al, Planta Med | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Tata et al, J | |||
| of Heterocyclic Chemistry, 1989, 26(1), 45-48 | |||
| Popov et al, Journal of Products, 1988, 51 (4), p.765-768 | |||
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1998 |
|
RU2219178C2 |
Авторы
Даты
2009-09-10—Публикация
2004-12-30—Подача