ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым изолированным антителам человека против пептидов, являющихся производными аполипопротеина B, в особенности к антителам, используемым для иммунизационной терапии для лечения атеросклероза, к способу их получения и к способу пассивной иммунизации с использованием упомянутых антител.
В частности, настоящее изобретение включает в себя применение любого изолированного антитела против окисленной формы пептидов, перечисленных в таблице 1, в особенности MDA-модифицированных пептидов, преимущественно вместе с подходящим носителем и вспомогательным средством, в качестве иммунотерапии или «анти-атеросклеротической «вакцины» для профилактики и лечения ишемических сердечно-сосудистых заболеваний.
УРОВЕНЬ ТЕХНИКИ
Защитный эффект гуморального иммунитета, как известно, опосредован семейством структурно связанных гликопротеинов, именуемых антителами. Биологическая активность антител инициируется при связывании последних с антигенами. Антитело, связанное с антигеном, является в общем специфичным для одного антигена, и связывание, как правило, является высокоаффинным. Антитела вырабатываются B-лимфоцитами. Кровь содержит много различных антител, причем каждое происходит из клона B-клеток и каждое имеет различную структуру и специфичность в отношении антигена. Антитела находятся на поверхности B-лимфоцитов, в плазме, во внутритканевой жидкости и в секреторных жидкостях, таких как слюна и слизь на поверхности слизистых оболочек.
Все антитела являются сходными по своей общей структуре с учетом определенного сходства в физико-химических свойствах, таких как заряд и растворимость. Все антитела имеют общую структуру ядра, включающую две идентичные легкие цепи около 24 килодальтон каждая, и две идентичные тяжелые цепи, приблизительно 55-70 килодальтон каждая. К каждой из тяжелых цепей присоединена одна легкая цепь, причем две тяжелые цепи соединены друг с другом. Как легкие, так и тяжелые цепи содержат последовательность повторяющихся гомологических единиц, каждая длиной приблизительно в 110 аминокислотных остатков, которые свернуты непосредственно в обычный глобулярный фрагмент, именуемый иммуноглобулиновым (Ig) доменом. Область антитела, сформированная объединением двух тяжелых цепей, является гидрофобной. Как известно, антитела, в особенности моноклональные антитела, в случае когда они подвергаются неблагоприятным физическим или химическим условиям, расщепляются в области, в которой легкая цепь присоединяется к тяжелой цепи. Поскольку антитела содержат многочисленные остатки цистеина, в них имеется большое количество цистеин-цистеиновых дисульфидных связей. Все Ig домены содержат два слоя бета-складок с тремя или четырьмя нитями антипараллельных полипептидных цепей.
Вопреки сходству их общей структуры молекулы антител могут быть подразделены на небольшое количество различных классов и подклассов на основании физико-химических характеристик, таких как размер, заряд и растворимость, а также на основании их поведения в отношении связывания с антигенами. У человека классами молекул антител являются: IgA, IgD, IgE, IgG и IgM. О членах каждого класса говорят, что они принадлежат к одному и тому же изотипу. Изотипы IgA и IgG далее подразделяются на субтипы, называемые IgA1, IgA2, а также IgG1, IgG2, IgG3 и IgG4. Тяжелые цепи всех антител данного изотипа содержат обширные области с идентичными последовательностями аминокислот, но упомянутые области отличаются у антител, принадлежащих к другим изотипам и субтипам. Тяжелые цепи обозначаются буквами греческого алфавита в соответствии с общим изотипом антитела, т.е. IgA содержит альфа, IgD содержит дельта, IgE содержит эпсилон, IgG содержит гамма и IgM содержит мю тяжелые цепи. IgG, IgE и IgD существуют в виде мономеров, тогда как секретированные формы IgA и IgM являются соответственно димерами или пентамерами, стабилизированными J цепью. Некоторые молекулы IgA существуют в виде мономеров или тримеров.
У каждого индивидуума существует от 108 до 1010 структурно различных молекул антител, каждая с уникальной последовательностью аминокислот в области связывания с антигеном. Разнообразие последовательностей в антителах найдено преимущественно в трех коротких участках внутри аминоконцевых доменов тяжелых и легких цепей, причем такие участки называют вариабельными (V) областями, чтобы отличать их от более консервативных константных (C) областей.
Атеросклероз представляет собой хроническое заболевание, которое вызывает утолщение внутренних слоев (внутренней оболочки) больших и средних артерий. Атеросклероз снижает кровоток и может вызвать ишемию и разрушение тканей в органах, снабжаемых сосудами, которые подверглись заболеванию. Атеросклероз является основной причиной сердечно-сосудистых заболеваний, включая инфаркт миокарда, инсульт и болезни периферических артерий. Он является основной причиной смертности в западном мире и, как предсказывают, в течение двух десятилетий станет ведущей причиной смертности во всем мире.
Заболевание инициируется накоплением липопротеинов, в первую очередь липопротеинов низкой плотности (LDL), во внеклеточном матриксе сосудов. Эти частицы LDL агрегируются и подвергаются окислительной модификации. Окисленный LDL является токсичным и вызывает повреждение сосудов. Атеросклероз представляет собой во многих отношениях ответную реакцию на это повреждение, включающую воспаление и фиброзы.
В 1989 году Palinski и сотрудники идентифицировали у человека циркулирующие аутоантитела против окисленного LDL. Это наблюдение навело на мысль, что атеросклероз, возможно, является аутоиммунным заболеванием, вызванным иммунными реакциями против окисленных липопротеинов. В это время несколько лабораторий начали поиски взаимосвязей между титрами антител против окисленного LDL и сердечно-сосудистыми заболеваниями. Однако картина, которая возникла из этих исследований, была далека от ясности. Существовали антитела против большого количества различных эпитопов окисленного LDL, но структура этих эпитопов была неизвестна. Следовательно, термином «антитела окисленного LDL» именовали скорее неизвестную смесь различных антител, чем одно специфическое антитело. Независимые T-клеточные IgM-антитела встречались более часто, чем зависимые T-клеточные IgG-антитела.
Антитела против окисленного LDL имелись в наличии как у пациентов с сердечно-сосудистыми заболеваниями, так и у здоровых людей из контрольной группы. Хотя в некоторых ранних исследованиях сообщалось о взаимосвязи между титрами антител окисленного LDL и сердечно-сосудистыми заболеваниями, в других такой взаимосвязи не было обнаружено. Основной слабой стороной этих исследований являлось то, что с целью определения титров антител применяли тесты ELISA (Enzyme Linked Immunosorbent Assay- Твердофазный иммуноферментный анализ) с использованием частицы окисленного LDL в качестве лиганда. Состав LDL различен у различных индивидуумов, степень окислительной модификации трудно как регулировать, так и оценивать, и уровни антител против различных эпитопов в окисленных частицах LDL не могут быть определены. До некоторой степени из-за технических проблем было сложно оценить роль реакции антител против окисленного LDL, используя методики, доступные до сих пор, однако невозможно создать четко определенные и воспроизводимые компоненты вакцины, если будут использоваться целые частицы окисленного LDL.
Другой путь исследовать возможность того, что аутоиммунные реакции против окисленного LDL в стенках сосудов играют ключевую роль в развитии атеросклероза, состоит в том, чтобы иммунизировать животных против их собственного окисленного LDL. Идея, стоящая за этим подходом, заключается в том, что если аутоиммунные реакции против окисленного LDL усиливаются при использовании классического способа иммунизации, то это будет приводить к повышенному воспалению сосудов и прогрессированию атеросклероза. Для того чтобы проверить эту гипотезу, кроликов иммунизировали с помощью гомологов окисленного LDL и затем вызывали атеросклероз путем содержания животных на высокохолестериновом рационе в течение 3 месяцев.
Однако в противоположность исходной гипотезе иммунизация с помощью окисленной LDL имела защитный эффект уменьшения атеросклероза примерно в 50% случаев. Сходные результаты были также получены в последующих исследованиях, в которых высокохолестериновый рацион был объединен с повреждением сосудов шариками, чтобы вызвать более агрессивное образование бляшек. Параллельно с нашими исследованиями несколько других лабораторий сообщили об аналогичных наблюдениях. Доступные данные, взятые вместе, ясно демонстрируют, что существуют иммунные реакции, которые защищают от развития атеросклероза, причем они включают аутоиммунную реакцию против окисленного LDL.
Данные наблюдения приводят к мысли о возможности развития иммунной терапии или «вакцины» для лечения сердечно-сосудистых заболеваний человека, основанных на атеросклерозе. Один подход к этому мог бы заключаться в том, чтобы иммунизировать индивида его собственным LDL, после того как данный LDL был окислен под действием, например, меди. Однако данный подход осложняется тем фактом, что неизвестно, какая структура в окисленном LDL является ответственной за формирование защитного иммунитета и, если окисленный LDL также может содержать эпитопы, они могут давать прирост неблагоприятных иммунных реакций.
Идентификация эпитопов в окисленном LDL является важной с нескольких точек зрения.
Во-первых, один или несколько из этих эпитопов, вероятно, являются ответственными за активацию антиатерогенного иммунного отклика, наблюдаемого у животных, иммунизированных окисленным LDL. Пептиды, содержащие эти эпитопы, могут, следовательно, предоставлять возможность для развития иммунной терапии или «атеросклеротической вакцины» у человека. Дополнительно они могут быть использованы для терапевтического лечения атеросклероза, развившегося у человека.
Во-вторых, пептиды, содержащие идентифицированные эпитопы, могут быть использованы для того, чтобы развить способность ELISA определять антитела против определенных структур в окисленном LDL. Такой ELISA мог бы быть более точным и надежным, чем доступный в настоящее время, использующий частицы окисленного LDL в качестве антигена. Это сделало бы также возможным анализы иммунных ответов против различных эпитопов в окисленной LDL, связанных с сердечно-сосудистыми заболеваниями.
Патент Соединенных Штатов 5972890 относится к использованию пептидов для диагностики атеросклероза. Способ, представленный в вышеупомянутом патенте, в принципе является формой радиофизической диагностики. В пептидную последовательность вводят радиоактивную метку и вводят последовательность в кровоток. Если данная пептидная последовательность будет идентична последовательности, присутствующей в аполипопротеине B, то она свяжется с тканью, где имеются в наличии рецепторы, действительные для аполипопротеина B. Эта ткань имеется в наличии в сосудах над всеми атеросклеротическими бляшками. Концентрация радиоактивности на стенках сосудов может затем быть определена, например, с помощью гамма-камеры. Следовательно, способ представляет собой радиофизический способ диагностики, основанный на том, что пептидные последовательности, меченные радиоактивностью, будут связываться с соответствующими им рецепторами, имеющимися в наличии в атеросклеротических бляшках, и будут обнаруживаться при использовании анализа внешней радиоактивности. Описываемая техника является способом непосредственного анализа для идентифицикации атеросклеротических бляшек. Это требует того, чтобы пациенту давались радиоактивные соединения.
Опубликованные исследования (Palinski et al., 1995 и George et al., 1998) показали, что иммунизация против окисленного LDL ослабляет развитие атеросклероза. Это показывает, что иммунные реакции против окисленного LDL в целом обладают защитным влиянием. Однако результаты, приведенные здесь, неожиданно показали, что это не всегда так. Например, иммунизация с использованием пептидов # 10, 45, 154, 199 и 240 давала повышение ослабления развития атеросклероза. Иммунизация с использованием других пептидных последовательностей, например пептидных последовательностей #1 и 30-34, не обеспечивала общего влияния на развитие атеросклероза. Такие результаты являются неожиданными, поскольку они служат обоснованием того факта, что иммунные реакции против окисленного LDL в зависимости от того, на какую структуру в окисленном LDL они ориентированы, могут и защищать от развития атеросклероза, и вносить вклад в его развитие, и не иметь вообще никакого влияния. Данные открытия делают возможным развить способы иммунизации, которые выделяют активацию защитных иммунных реакций. Дополнительно они показывают, что иммунизация с использованием неповрежденного окисленного LDL могла бы иметь вредное влияние, если используемые частицы имеют высокое содержание структур, которые дают рост атерогенных иммунных реакций.
Методология настоящего изобретения основана на полностью отличных принципах и способах. В соответствии с п.1 формулы изобретения данное изобретение относится к антителам против окисленных фрагментов аполипопротеина B, причем данные антитела используют для иммунизации против сердечно-сосудистых заболеваний.
В качестве альтернативы активной иммунизации, использующей описанные выше идентифицированные пептиды, пассивная иммунизация предварительно сформированными антителами, направленными на те же пептиды, является привлекательной возможностью. Таким антителам могут быть приданы желаемые свойства, относящиеся, например, к специфичности и перекрестной реактивности, изотипу, аффинности и времени полужизни плазмы. Возможность разработать антитела с предварительно заданными свойствами стала ясной уже появлением технологии моноклонального антитела (Milstein and Kühler, 1975 Nature, 256:495-7). Эта технология использовала клетки мышиной гибридомы, производящие большие количества идентичных, но мышиных антител. Фактически было начато большое количество доклинических и также клинических испытаний с использованием мышиных моноклональных антител для лечения, например, раковых опухолей. Однако из-за того, что эти антитела были нечеловеческого происхождения, иммунная система пациентов распознавала их в качестве чужеродных и вырабатывала к ним антитела. Вследствие этого действенность и время полужизни плазмы мышиных антител оказывались сниженными, и часто посторонние эффекты аллергических реакций, вызванных чужеродными антителами, препятствовали успешному лечению.
Для решения этих проблем, чтобы понизить мышиную составляющую специфичных и потенциально терапевтических антител, было принято несколько подходов. Первый подход включал в себя технологию изготовления так называемых химерных антител, в которых мышиные вариабельные домены антител переносились на человеческие константные области, что приводило к образованию антител, которые были в основном человеческими (Neuberger et al., 1985, Nature 314:268-70). Дальнейшее усовершенствование этого подхода заключалось в разработке гуманизированных антител, в которых области мышиных антител, контактирующие с антигеном, так называемые области, определяющие комплементарность(CDR), переносились на каркас человеческого антитела. Такие антитела являются почти полностью человеческими и редко вызывают вредные иммунные ответы при введении пациентам. Несколько химерных или гуманизированных антител было зарегистрировано в качестве терапевтических лекарственных препаратов, и в настоящее время они широко используются при различных показаниях (Borrebaeck и Carlsson, 2001, Curr. Opin. Pharmacol. 1:404-408).
В настоящее время полностью человеческие антитела могут быть изготовлены с использованием рекомбинантных технологий. Как правило, используют большие библиотеки, включающие миллиарды различных антител. В противоположность предшествующим технологиям, использующим химеризацию и гуманизирование, например, мышиных антител, данная технология не основывается на иммунизации животных для того, чтобы произвести специфические антитела. Вместо того, чтобы рекомбинантные библиотеки включали огромное число вариантов предварительно полученных антител, более вероятно, что библиотека будет иметь по меньшей мере одно антитело, специфичное для любого антигена. Следовательно, при использовании такой библиотеки проблема заключается в том, чтобы найти определенную связку, уже существующую в библиотеке, а не генерировать ее с помощью иммунизации. Для того чтобы эффективным образом найти хорошую связку в библиотеке, были разработаны различные системы, в которых фенотипы, т.е. антитела или фрагменты антител, связаны с их генотипами, т.е. кодирующими генами. Наиболее распространенной из таких систем является так называемая система фагового дисплея, в которой фрагменты отображаемых антител экспрессируются в виде объединения с покровными белками фагов на поверхности нитевидных фаговых частиц при одновременном перенесении генетической информации, кодирующей отображаемую молекулу (McCafferty et al., 1990, Nature 348:552-554). Отображенные на фагах фрагменты антител, специфичные в отношении индивидуального антигена, могут быть отобраны путем связывания с антигеном, о котором идет речь. Изолированный фаг затем может быть амплифицирован, и ген, кодирующий выбранные вариабельные области антитела, может быть необязательно переведен в форматы другого антитела, как, например, полноразмерного иммуноглобулина, и выделен в большом количестве при использовании подходящих векторов и клеток-хозяев, хорошо известных в технике.
Формат специфичности антитела, отображенного на фаговых частицах, может различаться. Наиболее широко используемыми форматами являются Fab (Griffiths et al., 1994. EMBO J. 13:3245-3260) и одиночной цепи (scFv) (Hoogenboom et al., 1992, J Mol Biol. 227:381-388), причем оба содержат вариабельное антигенное связывание областей антител. Формат одиночной цепи состоит из вариабельного тяжелого домена (VH), связанного с вариабельным легким доменом (VL) через гибкий линкер (US 4946778). Перед использованием аналитических реагентов или терапевтических средств отображенную специфичность антитела переводят в растворимый формат, например Fab или scFv, и анализируют как таковую. На более поздних стадиях фрагмент антитела, идентифицированный на наличие желаемых характеристик, уже может быть переведен в другие форматы, такие как полноразмерные антитела.
В последнее время была представлена новая технология для генерирования вариабельности в библиотеках антител (WO98/32845, Soderlind et al., 2000, Nature BioTechnol.18:852-856). Все фрагменты антител, полученных из этой библиотеки, имеют одну и ту же каркасную область и различаются только в CDR. Поскольку каркасные области являются областями эмбриональной последовательности, иммуногенность антител, полученных из библиотеки или сходных библиотек, произведенных с использованием той же самой технологии, как ожидается, будет очень низкой (Soderlind et al., 2000, Nature BioTechnol. 18:852-856). Это свойство, как ожидают, будет очень ценным для терапевтических антител, снижающих для пациента риск формирования антител к введенным антителам, и, таким образом, снижающее риски аллергических реакций, появления блокирующих антител и допускающее длительное время полужизни плазмы антитела. Несколько антител, полученных из рекомбинантных библиотек, в настоящее время доступны в клиниках и, как ожидается, в недалеком будущем обеспечат терапевтические лекарственные препараты.
Таким образом, техника перешла от ранних технологий на основе гибридомы к использованию современной технологии рекомбинантных библиотек, столкнувшись с необходимостью разработки терапевтических антител для использования человеком (Soderlind et al., 2001, Comb.Chem. & High Throughput Screen.4:409-416). Было понято, что идентифицированные пептиды (PCT/SE02/00679), являющиеся составной частью настоящего изобретения, могут быть использованы в качестве антигенов для выработки полностью человеческих антител с предопределенными свойствами. В противоположность более ранней технике (US 6225070), антигенные структуры, т.е. пептиды, используемые в настоящем изобретении, были идентифицированы как особенно подходящие в качестве целевых последовательностей для терапевтических антител (PCT/SE02/00679). Кроме этого, в настоящем изобретении антитела получают из библиотеки антител, при этом исключается необходимость иммунизации липопротеин-дефицитной мыши для выращивания мышиных антител (US 6225070). Более того, итоговые антитела являются полностью человеческими, и не ожидается, что они вызовут любую нежелательную иммунологическую реакцию при введении пациенту.
Использованными и ранее идентифицированными (PCT/SE02/00679) являются следующие пептиды:
ТАБЛИЦА 1
A. Высокий IgG, различие MDA
P 11. FLDTVYGNCSTHFTVKTRKG
P 25. PQCSTHILQWLKRVHANPLL
P 74. VISIPRLQAEARSEILAHWS
B. Высокий IgM, нет различия MDA
P 40. KLVKEALKESQLPTVMDFRK
P 68. LKFVTQAEGAKQTEATMTFK
P 94. DGSLRHKFLDSNIKFSHVEK
P 99. KGTYGLSCQRDPNTGRLNGE
P 100. RLNGESNLRFNSSYLQGTNQ
P 102. SLTSTSDLQSGIIKNTASLK
P 103. TASLKYENYELTLKSDTNGK
P 105. DMTFSKQNALLRSEYQADYE
P 177. MKVKIIRTIDQMQNSELQWP
C. Высокий IgG, нет различия MDA
P 143. IALDDAKINFNEKLSQLQTY
P 210. KTTKQSFDLSVKAQYKKNKH
D. NHS/AHP, IgG-ak>2, различие MDA
P1. EEEMLENVSLVCPKDATRFK
P 129. GSTSHHLVSRKSISAALEHK
P 148. IENIDFNKSGSSTASWIQNV
P 162. IREVTQRLNGEIQALELPQK
P 252. EVDVLTKYSQPEDSLIPFFE
E. NHS/AHP, IgM-ak>2, различие MDA
P 301. HTFLIYITELLKKLQSTTVM
P 30. LLDIANYLMEQIQDDCTGDE
P 31. CTGDEDYTYKIKRVIGNMGQ
P 32. GNMGQTMEQLTPELKSSILK
P 33. SSILKCVQSTKPSLMIQKAA
P 34. IQKAAIQALRKMEPKDKDQE
P 100. RLNGESNLRFNSSYLQGTNQ
P 107. SLNSHGLELNADILGTDKIN
P 149. WIQNVDTKYQIRIQIQEKLQ
P 169. TYISDWWTLAAKNLTDFAEQ
P 236. EATLQRIYSLWEHSTKNHLQ
F. NHS/AHP, IgG-ak<0,5, нет различия MDA
P 10. ALLVPPETEEAKQVLFLDTV
P 45. IEIGLEGKGFEPTLEALFGK
P 111. SGASMKLTTNGRFREHNAKF
P 154. NLIGDFEVAEKINAFRAKVH
P 199. GHSVLTAKGMALFGEGKAEF
P 222. FKSSVITLNTNAELFNQSDI
P 240. FPDLGQEVALNANTKNQKIR
или активные области одного или более чем одного из указанных пептидов.
В приведенной выше таблице 1 пунктам A-F соответствует следующее:
(A) Фрагменты, которые вырабатывают высокие уровни антител IgG к MDA-модифицированным пептидам (n=3),
(B) Фрагменты, которые вырабатывают высокие уровни антител IgM, однако не существует различия между исходным и MDA-модифицированным пептидами (n=9),
(C) Фрагменты, которые вырабатывают высокие уровни антител IgG, однако не существует различия между исходными и MDA-модифицированными пептидами (n=2),
(D) Фрагменты, которые вырабатывают высокие уровни антител IgG к MDA-модифицированным пептидам и по меньшей мере вдвое больше антител NHP-пула по сравнению с AHP-пулом (n=5)
(E) Фрагменты, которые вырабатывают высокие уровни антител IgM к MDA-модифицированным пептидам и по меньшей мере вдвое больше антител NHP-пула по сравнению с AHP-пулом (n=11) и
(F) Фрагменты, которые вырабатывают высокий уровень антител IgG, однако не существует различия между исходным и MDA-модифицированным пептидами, но по меньшей мере вдвое больше антител AHP-пула по сравнению с NHP-пулом (n=7).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению по меньшей мере одного изолированного антитела или фрагмента антитела человека, которое направлено по меньшей мере на один окисленный фрагмент аполипопротеина B, в производстве фармацевтических композиций для терапевтического или профилактического лечения атеросклероза посредством пассивной иммунизации.
Далее настоящее изобретение относится к рекомбинантному получению таких антител, равно как и к способу пассивной иммунизации с использованием подобных антител, выращенных с использованием фрагмента окисленного аполипопротеина B в качестве антигена, в особенности фрагментов, идентифицированных выше.
В настоящем изобретении использована библиотека фрагментов изолированных антител для выработки специфических фрагментов антител человека против окисленных, в особенности MDA-модифицированных пептидов, полученных из апо-B100. Идентифицированные фрагменты антител с желаемыми характеристиками затем могут быть встроены в полноразмерный иммуноглобулин человека для использования в терапевтических целях.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее последует подробное описание изобретения, примером которого являются, не ограничивая его, антитела человека, полученные из библиотеки фрагментов изолированных антител и направленные на два MDA-модифицированных пептида из апо-B100.
Пример 1
Отбор scFv против MDA-модифицированных пептидов IEIGL EGKGF EPTLE ALFGK (P45 таблица 1) и KTTKQ SFDLS VKAQY KKNKH(P210, таблица 1).
Антигены-мишени подвергают химической модификации, чтобы остатки лизина и гистидина несли на себе малондиальдегидные (MDA) группы. Модифицированные пептиды обозначены IEI (P45) и KTT(P210).
Отборы выполняют с использованием библиотеки BioInvent n-CoDeRTMscFv, принципы построения и создания которой были описаны Soderlind et al. 2000, Nature BioTechnology. 18,852-856. Вкратце, CDR изолируют из генов иммуноглобулина человека и включают в стационарный каркас. Следовательно, вариабельность в вариабельных областях образовавшегося иммуноглобулина представляет собой последовательность рекомбинации всех шести CDR в стационарный каркас. Области каркаса полностью являются областями эмбриональной последовательности, и они идентичны во всех антителах. Следовательно, вариабельность ограничена CDR, который является полностью натуральным, причем человеческого происхождения. Библиотека содержит приблизительно 2·1010 независимых клонов, и 2000-кратный избыток клонов, которые используют в качестве исходных для каждого отбора. Отборы выполняют в три тура. В 1-ом туре отбора иммунологические пробирки (NUNC maxisorb 444202) покрывают 1,2 мл раствора 20 мкг/мл MDA-модифицированного пептида-мишени в PBS (137 мМ NaCl, 2,7 мМ KCl, 4,3 мМ Na2HPO4, 1,4 мМ KH2PO4) и энергично встряхивают при +4°C в течение ночи. Затем пробирки блокируют 5% TPBSB (5% BSA, 0,05% Tween 20, 0,02% азид натрия в PBS) в течение 30 минут и перед использованием дважды промывают 3% TPBSB (3% BSA, 0,05% Tween 20, 0,02% азид натрия в PBS). Затем каждую целевую пробирку инкубируют с приблизительно 2·1013 CFU фагами из библиотеки n-CodeRTM в 1,8 мл 3% TPBSB в течение 2 часов при комнатной температуре, используя энергичное встряхивание. Затем пробирки промывают 15×3 мл 3% TPBSB и 2×1 мл PBS, перед тем как связанные фаги элюируют с помощью 1 мл/пробирка 2 мг/мл трипсина (Roche, 109819) в течение 30 минут при комнатной температуре. Данная процедура использует преимущество специфической трипсиновой области в scFv-слитом белке для того, чтобы высвобождать фаг из мишени. Реакцию останавливают добавлением 100 мкл Aprotein (0,2 мг/мл, Roche, cat. 236624) и иммунологические пробирки промывают 300 мкл PBS, получая конечный объем 1,4 мл.
Для амплификации отобранного фага E.Coli HB101F' клетки экспоненциально выращивают в 10 мл среды LB (Merck, cat. 1.10285) до OD600 = 0,5 и инфицируют отобранными и элюированными фагами в основном, как описано (Soderlind et al., 2000, Nature BioTechnol. 18, 852-856). Итоговую кондиционированную среду фага затем осаждают добавлением 1/4 объема 20% PEG6000 в 2,5 M NaCl и инкубируют в течение 5 часов при +4°C. Затем фаги осаждают центрифугированием в течение 30 минут, 13 000g, повторно суспендируют в 500 мкл PBS и используют во втором туре отбора.
Амплифицированный штамм фагов используют во втором туре отбора в окончательном объеме 1,5 мл 5% BSA, 0,05% Tween 20, 0,02 % азида натрия в PBS. Также вводят не модифицированный MDA пептид (4·10-7 моль) для конкуренции против связывающих компонентов к немодифицированному целевому пептиду. Смесь инкубируют в иммунологических пробирках, приготовленных с антигеном, как описано выше, за исключением того, что пробирки блокируют 1% казеином вместо 3% TPBSB. Инкубирование и промывание иммунологических пробирок производят аналогично описанному выше для отбора 1. Связанные фаги затем элюируют в течение 30 минут, используя 600 мкл 100 мМ трис-глицинового буфера с pH 2,2. Пробирки дополнительно промывают 200 мкл глицинового буфера, элюаты объединяют и затем нейтрализуют 96 мкл 1М Tris-HCl с pH 8,0. Образцы ренатурируют в течение 1 часа при комнатной температуре и используют для 3 тура отбора.
Для третьего тура отбора BSA Tween 20 и азид натрия добавляют к ренатурированному фаговому пулу до итоговой концентрации 3%, 0,05% и 0,02% соответственно. Конкурирующие пептиды, т.е. MDA-модифицированные несвязанные пептиды и исходные пептиды-мишени без модификации, добавляют до концентрации 1·10-7 M. Смесь фагов (1100 мкл) добавляют в иммунологические пробирки, покрытые антигеном-мишенью, как описано в отборе 1, и инкубируют при 4°C в течение ночи при встряхивании. Затем пробирки промывают 3×3 мл 3% TPBSB, 5×3 мл PBS и в конечном счете связанные фаги элюируют, используя трипсин, как описано выше в туре отбора 1. Все элюаты инфицируют 10 мл логарифмически растущего HB101F' в LB, содержащем 100 мкг/мл ампициллина, 15 мкг/мл тетрациклина, 0,1% глюкозы, и выращивают в течение ночи при 30°C, 200 об/мин в вибрационном инкубаторе.
Инкубированные в течение ночи культуры используют для маломасштабного синтеза плазмидной ДНК, применяя Biorad mini prep Kit (Cat. 732 6100). Для того чтобы удалить часть фагового гена III из вектора экспрессии, 0,25 мкг плазмида ДНК разрезают в течение 2 часов при 37°C, используя 2,5 ед Eag-1 (New England Biolabs, cat. R050) в буфере, рекомендованном поставщиком. Затем образцы инактивируют в течение 20 минут при 65°C и лигируют в течение ночи при 16°C, используя 1 ед T4 ДНК лигазы в 30 мкл 1х буфера лигазы (Gibco/BRL). Эта процедура соединяет два Eag-1 участка, размещенных на противоположных сторонах фрагмента фагового гена III, создавая, таким образом, свободный scFv, отображающий концевую 6×his метку. После лигирования препараты обрабатывают в течение 2 часов при 37°C в растворе, содержащем 30 мкл лигирующей смеси, 3,6 мкл 10×REACT3 штамма, 0,4 мкл 1 M NaCl, 5 мкл H2O2, для того, чтобы разрушить клоны, в которых сегмент фагового гена III был религирован. Двадцать (20) нг конечного продукта трансформируют в химическую компоненту Top10F' и распределяют на 500 см2 Q-ячейки LA-планшетов (100 мкг/мл Amp, 1% глюкоза), чтобы сделать возможным сортировку отдельных колоний для дальнейшего скрининга.
Скрининг библиотеки n-CoDeRTMscFv для связывания фрагментов специфичных антител с MDA-модифицированными пептидами из аполипопротеина B-100.
Для того чтобы идентифицировать scFv, который мог бы осуществлять различие между MDA-модифицированным пептидом IEI (P45) и исходным IEI, а также между MDA-модифицированным пептидом KTT (P210) и исходным KTT соответственно, выполняют скрининги на бактериальных супернатантах из отобранных scFv экспрессирующих клонов.
Отбор колоний одиночных клонов, экспрессию scFv и скрининг номер 1 выполняют на автоматической системе BioInvent в соответствии со стандартными методиками. 1088 и 831 одиночные клоны, отобранные против MDA-модифицированных пептидов IEI и KTT соответственно, выбирают, культивируют и переносят в микротитровальные планшеты в среду 100 мкл LB, содержащую 100 мкг ампициллина/мл.
Для скрининга номер 1 белые аналитические планшеты (Greiner 655074) покрывают 54 пмоль пептида/лунку в покрывающем буфере (0,1 M карбонат натрия, pH 9,5), причем либо MDA-модифицированным пептидом, который служит в качестве положительной мишени, либо соответствующим немодифицированным пептидом, который служит в качестве нецелевого. Экспрессированный scFv определяют методом ELISA с помощью микологической метки, помещенной C-терминально по отношению к scFv, используя 1 мкг/мл моноклонального антитела против c-myc (9E10 Roche 1667 149) в промывочном буфере. В качестве вторичного антитела используют конъюгат козьего антитела против мышиной щелочной фосфатазы (Applied Biosystems Cat# AC32ML) при 25 000-кратном разбавлении. Для люминесцентного определения используют готовый к употреблению стандартный препарат CDP-Star с Emerald II Tropix (Applied Biosystems Cat#MS100RY) в соответствии с рекомендациями поставщика.
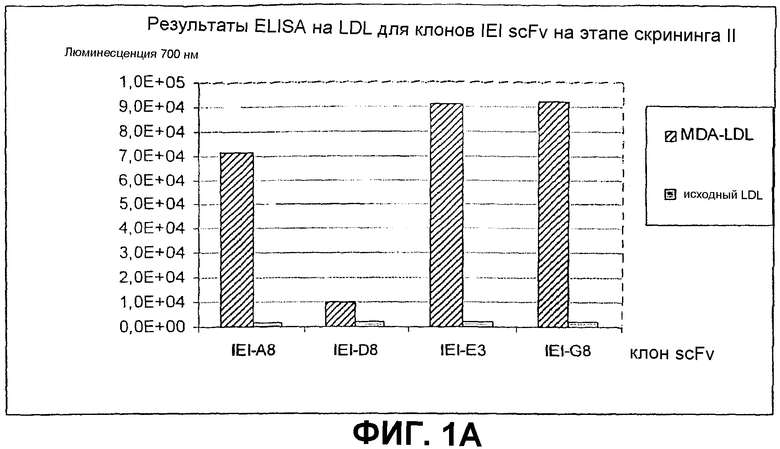
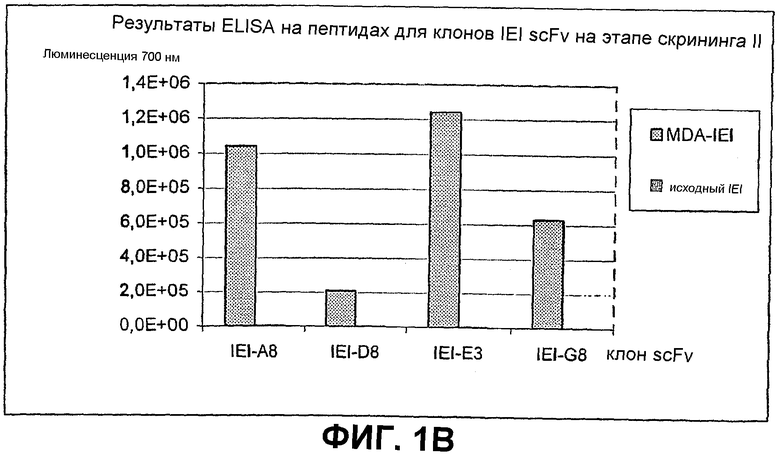
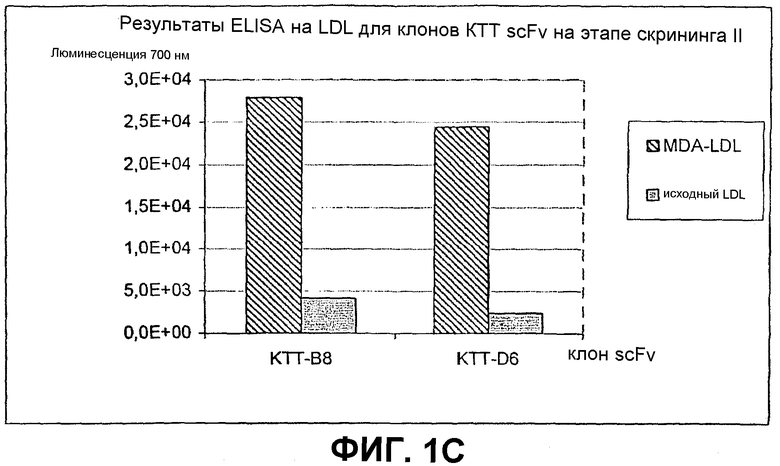
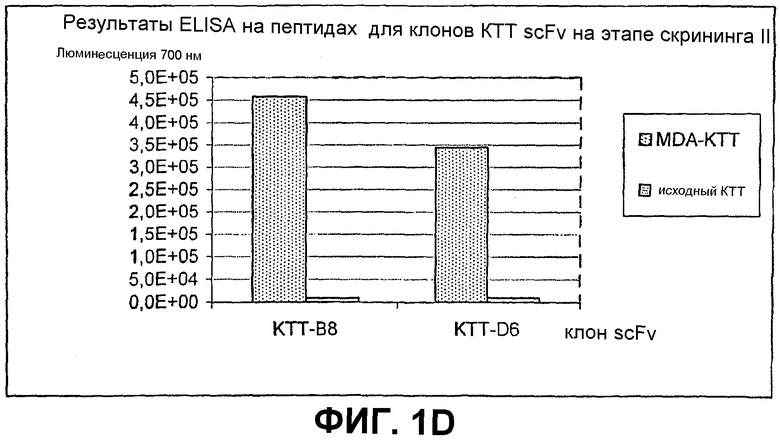
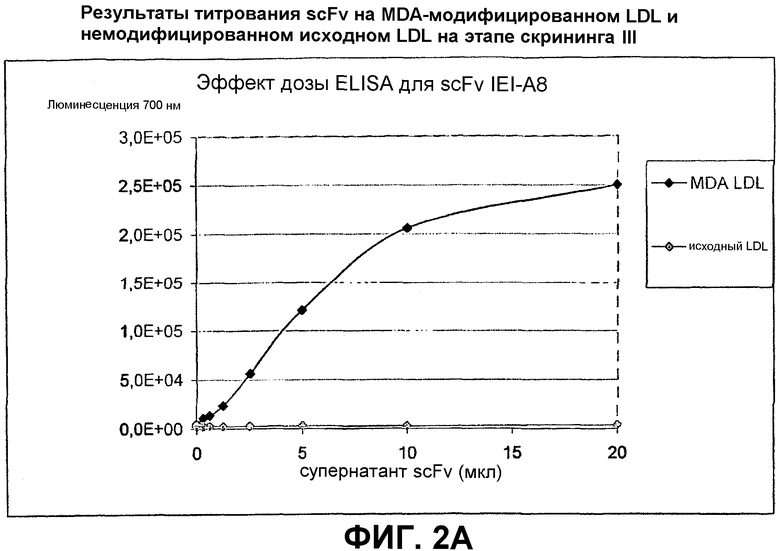
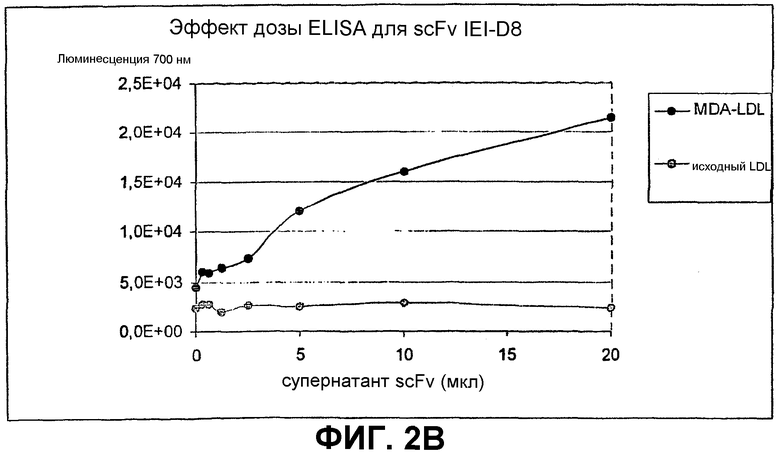
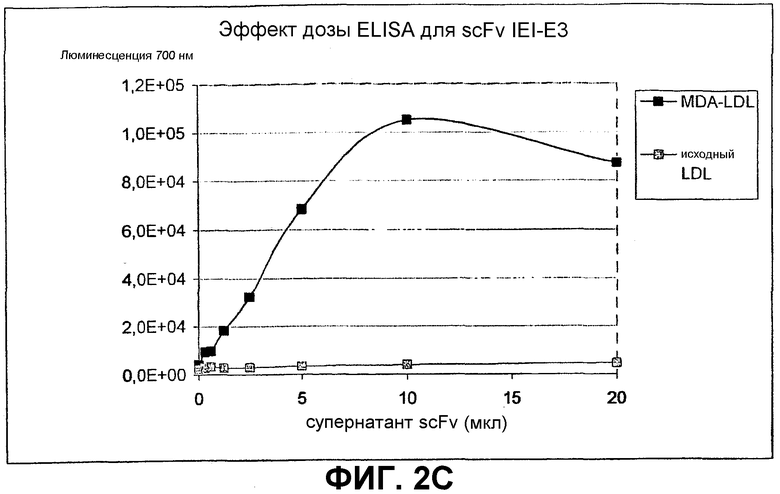
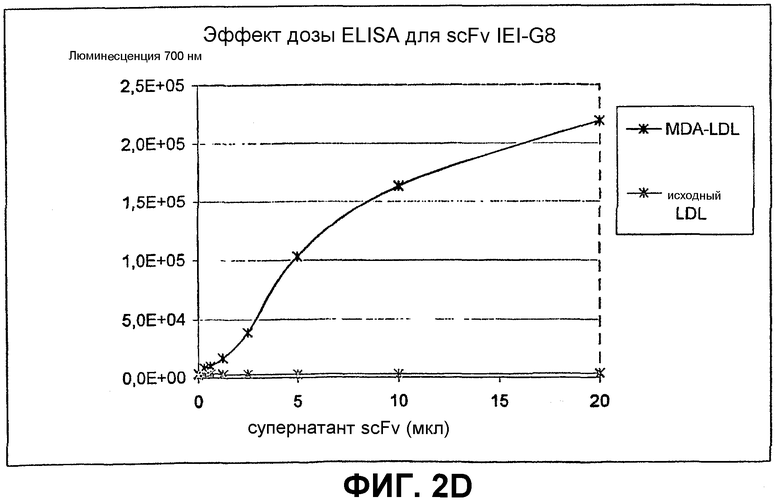
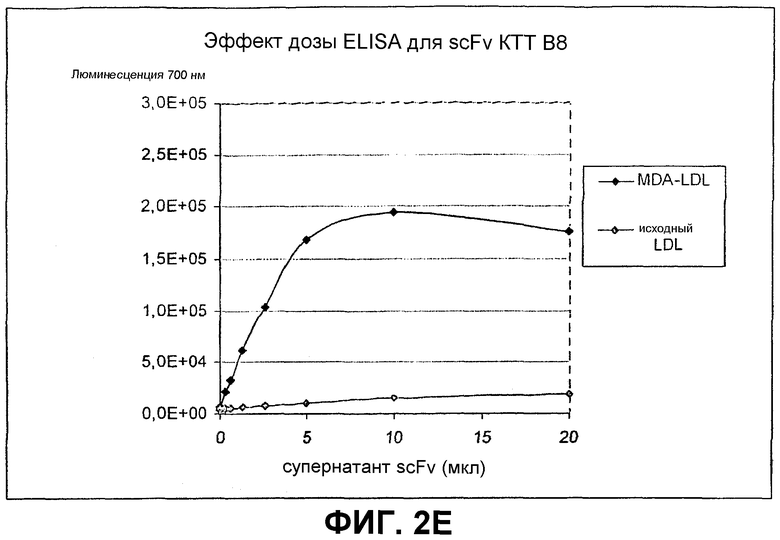
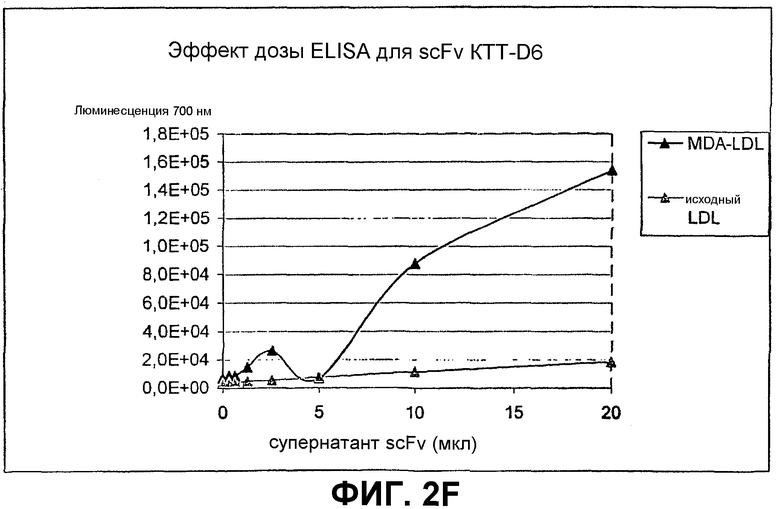
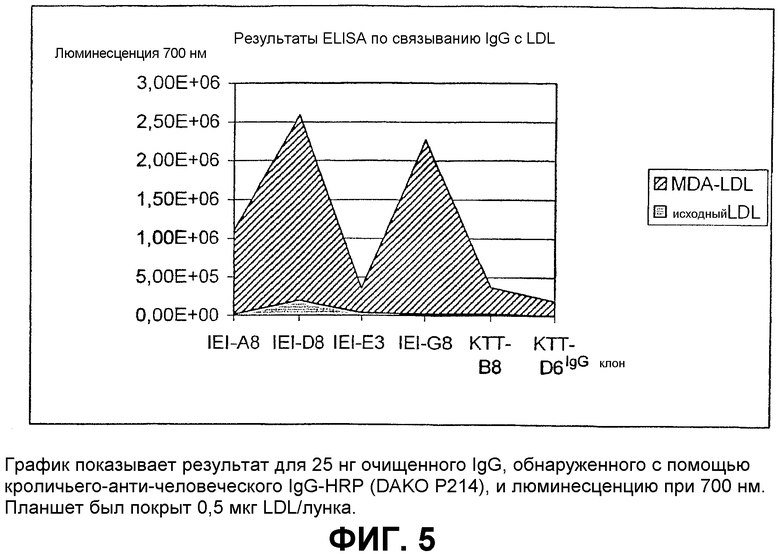
Клоны scFv, которые связывают MDA-модифицированный пептид, но не исходный пептид, реэкспрессируют, как описано выше, и подвергают скринингу еще раз в люминесцентном ELISA (Таблица 2 и фиг.1). Тесты выполняют как в отношении непосредственно покрытых пептидов (108 пмоль/лунку, покрытых PBS), так и в отношении более физиологической мишени, причем в качестве мишени используют частицы LDL (1 мкг/лунку, покрытые в PBS + 1 мМ EDTA), содержащие белок апо-B100 с MDA-модификацией или без нее. Положительными клонами являются те, которые связывают окисленный LDL и MDA-модифицированный пептид, но не исходные LDL или пептид. ELISA выполняют, как описано выше, за исключением того, что в качестве антитела детектирования используют anti-His антитела (MaB050 RαD). Как было найдено, двенадцать клонов IEI и 2 клона KTT дают более чем трехкратное увеличение люминесцентного сигнала при 700 нм для MDA-модифицированной формы по отношению к исходной форме как для пептида, так и для LDL.
Идентифицированные клоны в дальнейшем тестируют титрованием относительно фиксированного количества (1 мкг/лунка) MDA-модифицированного LDL и исходного LDL, с тем, чтобы оценить эффект дозы scFv (фиг.2).
Результаты скрининга. Количество клонов, протестированных на каждой стадии скрининга для каждой мишени. Отмеченные успешные результаты в процентах показаны в скобках.
Определяют последовательность выбранных клонов scFv, с тем чтобы найти уникальные клоны. Выполняют бактериальный PCR (Polymerase Chain Reaction - Тест с полимеразным усилением) с помощью Boeringer Mannheim Expand kit, используя праймеры (5'-CCC AGT CAC GAC GTT GTA AAA CG-3') и (5'-GAA ACA GCT ATG AAA TAC CTA TTG C-3') и GeneAmp PCR system 9700 (PE Applied system), а также используя циклическую температурную программу 94°C 5 мин, 30 циклов 94°C 30 с, 52°C в течение 30 с и 68°C в течение 2 мин и, наконец, 5 мин при 68°C. Реакцию секвенирования выполняют с бактериальным продуктом PCR (разбавленным в 5 раз) в качестве шаблона, используя смесь Big Dye Terminator mix из PE Applied Biosystems и GeneAmp PCR system 9700 (PE Applied system), а также циклическую температурную программу 25 циклов 10 с 96°C, 50°C в течение 5 с и 60°C в течение 4 минут. Продукты расширения очищают в соответствии с инструкцией производителя и выполняют разделение и определение продуктов расширения при использовании 3100 Genetic analyser (PE Applied Biosystems). Последовательности анализируют с помощью компьютерной программы собственной разработки. Из информации о последовательностях исключают гомологичные клоны и клоны с неподходящими сайтами рестрикции, оставляя 6 клонов для конверсии IgG. Последовательности ДНК тяжелых вариабельных (VH) и легких вариабельных (VL) доменов окончательно отобранных клонов показаны на фиг.3.
Пример 2
Перенос генов, кодирующих вариабельные части отобранных scFv, в полноразмерные IgG1 векторы человека.
Чтобы конвертировать бактерии, содержащие клоны scFv, в Ig-формат, их выращивают в течение ночи в среде LB с добавкой 100 мкг/мл ампициллина. Плазмидную ДНК получают из выдержанной в течение ночи культуры, используя мини-набор препарата плазмид Quantum Prep от Biorad(# 732-6100). Концентрацию ДНК измеряют с помощью измерения поглощения при 260 нм и ДНК разбавляют до концентрации 2 нг/мкл.
VH и VL из различных scFv-плазмидов амплифицируют PCR для того, чтобы снабдить эти сегменты сайтами рестрикции, совместимыми с векторами экспрессии (см. ниже). 5'-праймеры содержат BsmI, и 3'-праймеры содержат BsiWI сайт рестрикции расщепления энзимов (показанные курсивом). 3'-праймеры также содержат донорный сайт сплайсинга (показанный жирным шрифтом).
Праймеры для амплификации VH-сегментов:
5'VH: 5'-GGTGTGCATTCCGAGGTGCAGCTGTTGGAG (SEQ. ID. NO: 13)
3'VH: 5'-GACGTACGACTCACCTGAGCTCACGGTGACCAG (SEQ. ID. NO: 14)
Праймеры для амплификации VL-сегментов:
5'VL: 5'-GGTGTGCATTCCCAGTCTGTGCTGACTCAG (SEQ. ID. NO: 15)
3'VL: 5'-GACGTACGTTCTACTCACCTAGGACCGTCAGCTT (SEQ. ID. NO: 16)
PCR вводят в общий объем 50 мкл, содержащий 10 нг шаблона ДНК, 0,4 мкМ 5'-праймера, 0,4 мкМ 3'-праймера и 0,6 мкМ dNTP (дезоксинуклеозидтрифосфат) (Roche,#1 969 064). Использованная полимераза является Expand long template PCR system (Roche# 1 759 060), 3,5 ед на реакцию вместе с каждым из трех поставляемых буферов в 3 отдельных реакциях. Каждый цикл амплификации PCR состоит из стадии денатурирования при 94°C в течение 30 секунд, стадии ренатурирования при 55°C в течение 30 секнд, и стадии расширения при 68°C в течение 1,5 минут. Данный цикл амплификации повторяют 25 раз. Каждую реакцию начинают с одиночной стадии денатурирования при 94°C в течение 2 минут и заканчивают одиночной стадией расширения при 68°C в течение 10 минут. Наличие продукта PCR проверяют электрофорезом в агарозном геле и объединяют реакционные смеси, содержащие одинаковый амплифицированный материал (из числа реакций с различными буферами). Продукты амплификации PCR затем очищают с помощью хроматографии на вращающейся колонке, используя колонки S400-HR (Amersham-Pharmacia Biotech# 27-5240-01).
Четыре (4) мкл каждого пула продуктов PCR используют для TOPO TA клонирования (pCR 2.1 TOPO, InVitrogen#K4550-01) в соответствии с рекомендациями производителя. Колонии бактерий, содержащие плазмиды со вставками, выращивают в течение ночи в среде пополняемой LB со 100 мкг/мл ампициллина и 20 мкг/мл канамицина. Плазмидную ДНК приготовляют из культуры, выдержанной в течение ночи, используя мини-набор препарата плазмид Quantum Prep, от Biorad (# 732-6100). Препараты плазмиды очищают путем хроматографии на вращающейся колонке, используя колонку S400-HR (Amersham-Pharmacia Biotech#27-5240-01). Три плазмиды из каждого отдельного VH и VL клонирования подвергают секвенированию, используя BigDye Cycle Sequencing (Perkin Elmer Applied Biosystem,# 4303150). Цикл програм секвенирования состоит из стадии денатурирования при 96°C в течение 10 секунд, стадии ренатурирования при 50°C в течение 15 секунд и стадии расширения при 60°C в течение 4 минут. Цикл повторяют 25 раз. Каждую реакцию начинают с одиночной стадии денатурирования при 94°C в течение 1 минуты. Реакции выполняют в объеме 10 мкл, состоящем из 1 мкмоль праймера (5'-CAGGAAACAGCTATGAC), 3 мкл плазмидной ДНК и 4 мкл реакционной смеси Big Dye. Реакционные смеси осаждают в соответствии с рекомендациями производителя и образцы анализируют с помощью ABI PRISM 3100 Genetic Analyzer. Последовательности сравнивают с оригинальными последовательностями scFv, используя функцию выравнивания программы для анализа последовательностей OMIGA (Oxford Molecular Ltd).
Для плазмид, содержащих сегменты VH и VL без мутаций, осуществляют рестрикционное картирование. Для того чтобы разорвать вектор pCR 2.1 TOPO, плазмиды вначале расщепляют с помощью DraI (Roche# 1 417 983) при 37°C в течение 2 часов. Продукты расщепления инактивируют инактивируют нагреванием до 70°C в течение 20 минут и очищают методом хроматографии на вращающейся колонке, используя колонку S400-HR (Amersham-Pharmacia Biotech # 27-5240-01). Очищенные продукты DraI-расщепления в дальнейшем расщепляют BsmI (Roche# 1 292 307) и BsiWI (Roche# 1 388 959) при 55°C в течение ночи. Продукты расщепления очищают фенольной экстракцией и осаждением. Осажденную ДНК растворяют в 10 мкл H2О и используют для лигирования.
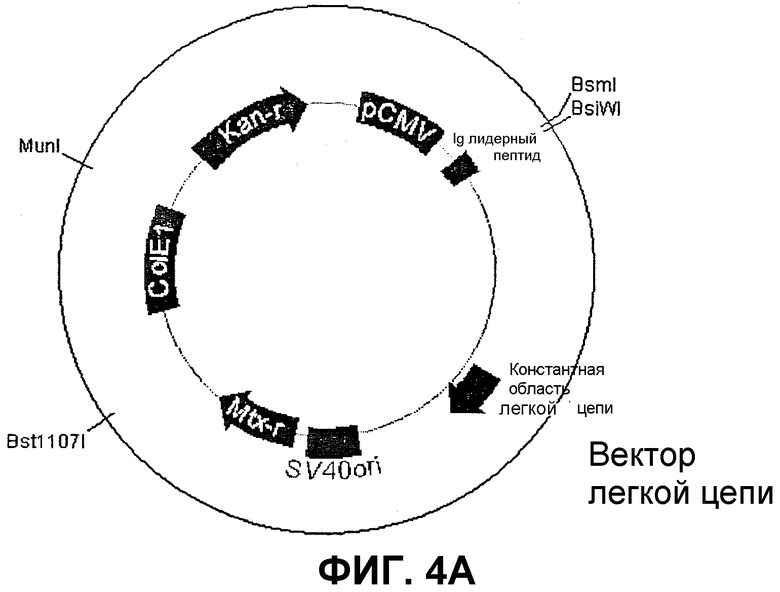
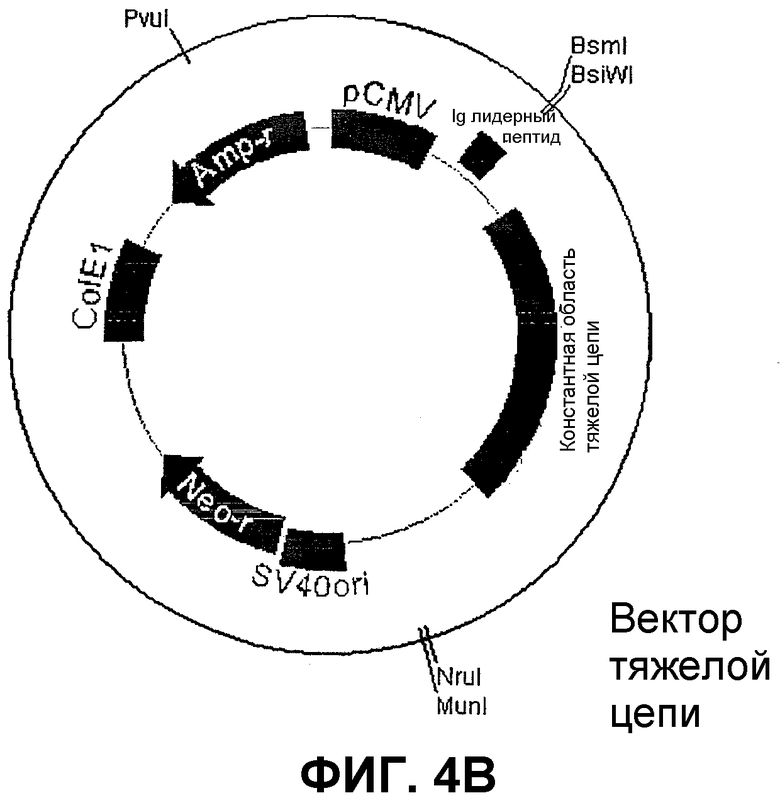
Векторы экспрессии были получены из Lars Norderhaug (J. Immunol. Meth. 204 (1997) 77-87). После некоторых модификаций векторы (фиг.4) содержат CMV-промотор, Ig-лидерный пептид, клонированный линкер, содержащий сайты рестрикции BsmI и BsiWI для клонирования VH/VL, геномные константные области IgG1 (вектор тяжелой цепи (HC)) или лямбда (вектор легкой цепи (LC)), неомицин- (вектор HC) или метотрексат- (вектор LC) резистантные гены для отбора в эукариотических клетках, сайты инициации репликации SV40 и ColEI и ампициллин- (вектор HC) и канамицин- (вектор LC) резистантные гены для отбора в бактериях.
Векторы HC и LC расщепляют с помощью BsmI и BsiWI, обрабатывают фосфатазой и очищают, используя фенольную экстракцию и осаждение. Лигирование выполняют при 16°C в течение ночи в объеме 10 мкл, содержащем 100 нг расщепленного вектора, 2 мкл расщепленного вектора VH/VL-pCR 2.1 TOPO (см. выше), 1 ед T4 ДНК-лигазы (Life Technologies,# 15224-025) и буфер поставщика. 2 мкл смеси для лигирования в дальнейшем преобразуют в 50 мкл хемокомпетентных бактерий top10F' и помещают на агаровые пластины для отбора (100 мкг/мл ампициллина или 20 мкг/мл канамицина).
Колонии, содержащие плазмиды HC/LC со вставками VH/VL, идентифицируют с помощью колонии PCR:
Прямой праймер: 5'-ATGGGTGACAATGACATC
Обратный праймер: 5'-AAGCTTGCTAGCGTACG
PCR вводят в общий объем 20 мкл, содержащий бактерии, 0,5 мкм прямого праймера, 0,5 мкМ обратного праймера и 0,5 мкМ dNTP (Roche#1 969 064). Используют полимеразу Expand long template PCR system (Roche# 1 759 060), 0,7 ед. на реакцию вместе с буфером поставщика #3. Каждый цикл амплификации PCR состоит из стадии денатурирования при 94°C в течение 30 секунд, стадии ренатурирования при 52°C в течение 30 секунд и стадии расширения при 68°C в течение 1,5 минут. Цикл амплификации повторяют в течение 30 раз. Каждую реакцию начинают с одиночной стадии денатурирования при 94°C в течение 2 минут и завершают одиночной стадией расширения при 68°C в течение 5 минут. Наличие продукта PCR проверяют электрофорезом в агарозном геле. Колонии, содержащие плазмиды HC/LC со вставками VH/VL, выращивают в течение ночи в среде LB с добавками 100 мкг/мл ампициллина или 20 мкг/мл канамицина. Плазмидную ДНК получают из выращенных в течение ночи культур, используя мини-набор препарата плазмид Quantum Prep, от Biorad (# 732-6100). Препараты плазмиды очищают путем хроматографии на вращающейся колонке, используя колонки S400-HR (Amersham Pharmacia Biotech# 27-5240-01). Для подтверждения целостности последовательности ДНК подвергают секвенированию по три плазмиды из каждого отдельного VH и VL, используя круговое секвенирование BigDye (Perkin Elmer Applied Biosystem,# 4303150). Цикл програм секвенирования состоит из стадии денатурирования при 96°C в течение 10 секунд, стадии ренатурирования при 50°C в течение 15 секунд и стадии расширения при 60°C в течение 4 минут. Цикл повторяют 25 раз. Каждую реакцию начинают с одиночной стадии денатурации при 94°C в течение 1 минуты. Реакции выполняют в объеме 10 мкл, состоящем из 1 мкМ праймера (5'-AGACCCAAGCTAGCTTGGTAC), 3 мкл плазмидной ДНК и 4 мкл реакционной смеси Big Dye. Реакционные смеси осаждают в соответствии с рекомендациями производителя, и образцы анализируют с помощью ABI PRISM 3100 Genetic Analyzer.
Последовательности анализируют, используя программное обеспечение для анализа последовательностей OMIGA (Oxford Molecular Ltd). Плазмидную ДНК используют для транзитной трансфекции клеток COS-7 (см. ниже) и расщепляют для получения объединенного вектора, содержащего гены с тяжелыми и легкими цепями в одной и той же плазмиде.
Векторы тяжелых и легких цепей, содержащие сегменты VH и VL, произошедшие от одного и того же scFv, расщепляют с помощью рестрикционных энзимов и лигируют: векторы HC- и LC- вначале расщепляют MunI (Roche# 1 441 337), после чего продукты расщепления инактивируют нагреванием при 70°C в течение 20 минут и очищают методом хроматографии на вращающейся колонке, используя колонки S200-HR (Amersham-Pharmacia Biotech # 27-5120-01). Продукты расщепления вектора HC- в дальнейшем расщепляют NruI (Roche# 776 769), и продукты расщепления вектора LC- расщепляют с помощью Bst1107I (Roche # 1 378 953). Затем продукты расщепления инактивируют нагреванием при 70°C в течение 20 минут и очищают методом хроматографии на вращающейся колонке, используя колонки S400-HR (Amersham-Pharmacia Biotech # 27-5240-01). 5 мкл каждого расщепленного плазмида лигируют при 16°C в течение ночи в общем объеме 20 мкл, содержащем 2 ед T4 DNA-лигазы (Life Technologies, # 15224-025) и буфер поставщика. 2 мкл смеси для лигирования в дальнейшем преобразовывают в 50 мкл хемокомпетентных бактерий top10F', и помещают на агаровые пластины для отбора (100 мкг/мл ампициллина или 20 мкг/мл канамицина).
Бактериальные колонии выращивают в течение ночи в среде LB с добавками 100 мкг/мл ампициллина и 20 мкг/мл канамицина. Плазмидную ДНК получают из выращенных в течение ночи культур, используя мини-набор препарата плазмид Quantum Prep, от Biorad (# 732-6100). Правильно соединенные векторы идентифицируют путем переваривания рестрикционными ферментами с последующим анализом размера фрагментов с помощью электрофореза в агарозном геле.
Препараты плазмиды очищают путем хроматографии на вращающейся колонке, используя колонки S400-HR (Amersham-Pharmacia Biotech# 27-5240-01), и используют для транзитной трансфекции клеток COS-7.
Клетки COS-7(ATCC# CRL-1651) выращивают при 37°C с 5% CO2 в среде Dulbeccos MEM (Dulbeco's Modified Eagle's Medium) с высоким содержанием глюкозы + GlutamaxI (Invitrogen# 31966021), с добавлением 0,1 мМ аминокислот, не являющихся незаменимыми (Invitrogen# 11140035), и 10% эмбриональной коровьей сыворотки (Invitrogen # 12476-024, batch# 1128016). За день до трансфекции клетки помещают в 12-луночный планшет (Nunc,# 150628), в количестве 1,5x105 клеток на лунку.
Перед трансфекцией плазмидную ДНК нагревают при 70°C в течение 15 минут. Клетки трансфицируют 1 мкг HC-плазмиды + 1 мкг LC-плазмиды, или 2 мкг объединенной плазмиды на лунку, используя Lipofectamine 2000 Reagent (Invitrogen,# 11668019), в соответствии с рекомендациями производителя. Через 24 часа после трансфекции среду клеточной культуры заменяют и дают расти клеткам на протяжении 5 дней. После этого среду собирают и анализируют выработку белка для использования ELISA.
Девяностошести(96)-луночный планшет (Costar# 9018, плоское дно, высокое связывание) покрывают в течение ночи при 4°C путем добавления 100 мкл/лунку лямбда легкой цепи анти-человеческого антитела кролика (DAKO,# A0193), разбавленного в 4000 раз в покрывающем буфере (0,1 M карбонат натрия, pH 9,5). Планшеты 4 раза промывают в PBS, который содержит 0,05% Tween 20, и после этого блокируют 100 мкл/лунку PBS + 3%BSA (Альбумин, фракция V, Roche# 735108) в течение 1 часа при комнатной температуре. Затем промывают, как описано выше, добавляют образец 100 мкл/лунку и инкубируют при комнатной температуре в течение 1 часа. В качестве стандарта для измерения концентрации используют очищенный человеческий IgG1 (Sigma,# I5029). Образцы и стандарты разводят в буфере для образцов (1×PBS содержащий 2% BSA и 0,5% сыворотки кролика (Sigma# R4505)). В дальнейшем планшеты промывают, как описано выше, добавляют 100 мкл/лунку анти-человеческого IgG (γ-цепь) HARP-сопряженного антитела кролика (DAKO,# P214), разбавленного в 8000 раз в буфере для образцов, и инкубируют при комнатной температуре в течение 1 часа. После 8-кратного промывания PBS, содержащего 0,05% Tween 20, добавляют 100 мкл/лунку раствора субстрата, содержащего одну таблетку OPD (10 мг, Sigma # P8287), растворенную в 15 мл буфера на основе лимонной кислоты и 4,5 мкл H2О2 (30%). После 10 минут реакцию прекращают добавлением 150 мкл/лунка 1M HCl. Измеряют поглощение при 490-650 нм и данные анализируют, используя программное обеспечение Softmax.
Бактерии, содержащие векторы HC- и LC-, соединенные надлежащим образом, выращивают в течение ночи в среде 500 мл LB с добавками ампициллина и канамицина. Плазмидную ДНК получают из выращенной в течение ночи культуры, используя мини-набор препарата плазмид Quantum Prep от Biorad (# 732-6130). Векторы линеаризуют, используя рестрикционный энзим PvuI (Roche# 650 129). Перед трансфекцией линеаризованную ДНК очищают путем хроматографии на вращающейся колонке, используя колонки S400-HR (Amersham-Pharmacia Biotech# 27-5240-01) и нагревают при 70°C в течение 15 минут.
Пример 3
Стабильная трансфекция клеток NS0, экспрессирующих антитела против MDA-модифицированных пептидных форм аполипопротеина B-100.
Клетки NS0 (ECACC no. 85110503) выращивают в DMEM (cat nr 31966-021, Invitrogen) с добавкой 10% эмбриональной коровьей сыворотки (cat no. 12476-024, lot: 1128016, Invitrogen) и 1X NEAA (аминокислоты, не являющиеся незаменимыми, cat no. 11140-053, Invitrogen). Культуры клеток сохраняют в увлаженной среде с 5% CO2 при 37°C.
Конструкциями ДНК, предназначенными для трансфицирования, являются четыре конструкции из числа IEI специфичных антител (IEI-A8, IEI-D8, IEI-E3, IEI-G8), две из числа KTT-специфичных антител (KTT-B8, KTT-D6) и одно контрольное антитело (JFPA12). За день до трансфекции клетки трипсинизируют и подсчитывают перед помещением их в колбу T-75, в количестве 12x106 клеток/колбу. В день трансфекции, когда клетки становятся слившимися на 85-90%, клетки помещают в 15 мл DMEM + 1X NEAA + 10% FBS (как описано выше). Для каждой колбы с клетками, подлежащими трансфекции, разбавляют 35-40 мкг ДНК в 1,9 мл OPTI-MEM I Reduced Serum Medium (Cat no. 51985-026, lot: 3062314, Invitrogen) без сыворотки. Для каждой колбы с клетками в другой пробирке разводят 114 мкл Lipofectamine 2000 Reagent (Cat nr. 11668-019, lot: 1116546, Invitrogen) в 1,9 мл OPTI-MEM I Reduced Serum Medium и инкубируют в течение 5 минут при комнатной температуре. Разбавленную ДНК объединяют с разбавленным Lipofectamine 2000 Reagent (в течение 30 мин) и инкубируют при комнатной температуре в течение 20 минут, чтобы дать образоваться комплексу ДНК-LF2000 Reagent.
Клетки один раз промывают средой и добавляют 11 мл DMEM + 1X NEAA + 10% FBS. Затем комплекс ДНК- LF2000 Reagent (3,8 мл) добавляют непосредственно в каждую колбу и осторожно перемешивают, покачивая колбу вперед и назад. Клетки инкубируют в инкубаторе при 37°C в среде 5% CO2 в течение 24 часов.
Затем клетки трипсинизируют, подсчитывают и в дальнейшем помещают в 96-луночный планшет в количестве 2x104 клеток/ячейка, используя пять 96-луночных планшетов/конструкцию. Клетки помещают в среду DMEM + 1X NEAA + 10% FBS (как описано выше) 100 мкл/лунку, содержащую G418-сульфат (cat nr. 10131-027, lot: 3066651, Invitrogen) в количестве 600 мкг/мл. Давление отбора поддерживают неизменным до сбора клеток.
Клетки выращивают в течение 12 дней и анализируют на выработку антител, используя ELISA. Для каждой конструкции клетки из 24 лунок, содержащих наибольшие количества IgG, переносят в 24-луночные планшеты и дают им достичь слияния. Затем с помощью ELISA анализируют выработку антител в клетках в данных лунках и отбирают для рескрининга 5-21 пул/конструкция (Таблица 3). В итоге отбирают клетки из 1-4 лучших лунок для каждой конструкции. Клетки последовательно разрастаются в колбах для культивирования клеток, и, наконец, их переносят в трехслойные колбы (500 см2) в 200 мл (DMEM +1xNEAA + 10% Ultra low IgG FBS (cat. no. 16250-078, lot. no. 113466, Invitrogen)+ G418(600 мкг/мл)) для выработки антител. Клетки инкубируют в течение 7-10 дней и анализируют супернатанты с помощью ELISA, собирают и фильтруют в стерильных условиях для очистки.
Пример 4
Выработка и очистка человеческого IgG1
Супернатанты из клеток NS0, трансфицированных различными антителами IgG1, фильтруют в стерильных условиях, используя 0,22 мкм фильтр, и очищают, используя аффинную среду MabSelectTM с рекомбинантным белком A, (Cat.No. 17519901 Amersham Biosciences).
Связанные IgG1 человека элюируют с помощью HCl-глицинового буфера pH 2,8. Элюаты собирают во фракции по 0,5 мл и используют OD280 для определения наличия белка. Фракции с наивысшим содержанием объединяют, и измеряют поглощение при 280 и 320 нм. Буфер заменяют значительным объемом PBS при помощи диализа. Очищенные препараты IgG-1 тестируют на наличие эндотоксинов, используя тест-LAL (QCL-1000R, cat.No. 50-647U Bio Whittaker). Образцы содержат эндотоксин в количестве от 1 до 12 ед/мл. С помощью PAGE-анализа (Polyacrilamide Gel Electrophoresis) устанавливают, что чистота препаратов достигает 98%.
Обобщенные результаты по выработке и очистке IgG1 человека
Очищенные препараты IgG1 тестируют в ELISA для определения реакционной способности к MDA-модифицированным и немодифицированным пептидам (фиг.5) и затем используют в функциональных исследованиях in vitro и in vivo.
Пример 5
Анализ возможного антиатерогенного влияния антител, выполненный в исследованиях на экспериментальных животных и клеточных культурах.
1. Влияние антител на атеросклероз у аполипопротеин E нокаутированных (апо E-) мышей.
апо E-мышей в возрасте 5 недель содержат на высокохолестериновом рационе в течение 15 недель. Такое кормление, как известно, приводит к образованию значительного количества атеросклеротических бляшек в аорте и сонных артериях. Затем мышам дают внутрибрюшную инъекцию, содержащую 500 мкг соответствующего антитела, идентифицированного выше. Контрольным мышам дают 500 мкг неподходящего контрольного антитела или PBS в чистом виде. Процедуры повторяют после 1 и 2 недель. Мышей умерщвляют через 4 недели после первоначальной инъекции антител. Степень тяжести атеросклероза в аорте определяют с помощью окрашивания плоских препаратов Масляным Красным О и с помощью определения размеров подклапанных атеросклеротических бляшек. Содержание коллагена, макрофага и Т-клеток в подклапанных атеросклеротических бляшках определяют с помощью окрашивания набором красителей Masson trichrome и клеточно-специфичной иммуноэнзимогистохимии. Количественное представление данных по окрашиванию Масляным Красным О, размеру подклапанных пятен, трехцветному окрашиванию и иммуногистохимическому окрашиванию выполняют, используя компьютерный анализ изображений.
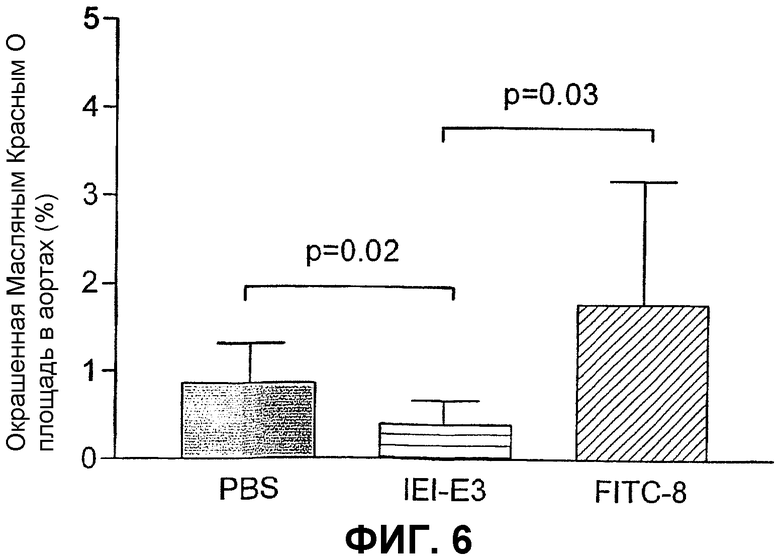
В первом эксперименте анализируют влияние антител на развитие атеросклероза у апо E-мышей, содержащихся на высокохолестериновом рационе. Мышам дают три внутрибрюшные инъекции антитела по 0,5 мг с недельными интервалами, начиная с возраста 21 недели и используя PBS в качестве контроля. Мышей умерщвляют через две недели после последней инъекции и оценивают степень атеросклероза при помощи окрашивания масляным Красным О плоского препарата нисходящей аорты. Четко выраженное влияние с более чем 50% снижением атеросклероза наблюдают у мышей, которым вводили антитело IEI-E3, по сравнению с группой PBS (P=0,02) и по сравнению с контрольной группой, получавшей антитело человека IgG1 (FITC8), направленное против нерелевантного антигена флуоресцеинизотиоцианата (FITC) (P=0,03) (фиг.6). Мыши хорошо переносят антитела человека, и отсутствие влияния на общее состояние здоровья мышей является очевидным.
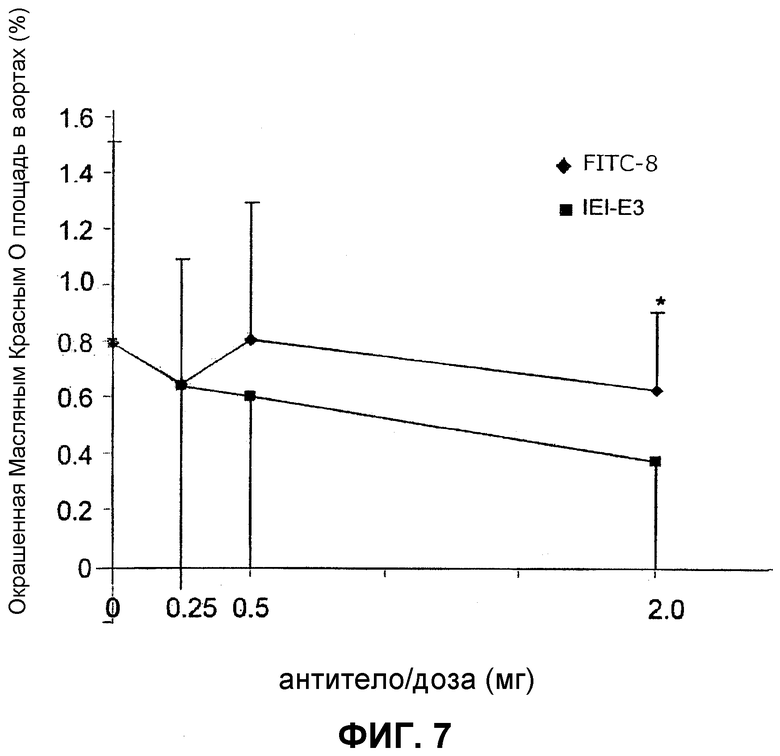
Затем для подтверждения ингибиторного влияния антитела IEI-E3 на развитие атеросклероза выполняют исследования эффекта дозы. Программа идентична той, которую используют на начальной стадии. У мышей, которым вводят антитела IEI-E3, атеросклероз понижается по сравнению с группами, которым вводят антитела FITC: на 2% в группе, которой вводили 0,25 мг (не отмечено), на 25% в группе, которой вводили 0,5 мг (не отмечено), и на 41% (P=0,02) в группе, которой вводили 2,0 мг (фиг.7).
2. Влияние антител на образование нео-интимы у апо E-мышей, которое следует за повреждением сонных артерий. Механическое повреждение артерий приводит к развитию фиброзно-мышечных нео-интимных бляшек в течение 3 недель. Бляшки имеют морфологическое сходство с фиброзно-мышечными атеросклеротическими бляшками, и их используют в качестве одной из моделей для исследований развития возникших повреждений. Помещение пластмассового воротничка вокруг сонной артерии вызывает механическое повреждение. Апо E-мышей в возрасте пяти недель содержат на рационе, богатом холестерином, в течение 14 недель. Затем мышам дают внутрибрюшную инъекцию, содержащую 500 мкг соответствующего антитела. Контрольные мыши получают 500 мкг нерелевантного контрольного антитела или чистого PBS. Процедуру повторяют через 7 дней и через 1 день выполняют размещение пластикового воротничка хирургическим путем. Последнюю инъекцию антитела или PBS дают через 6 дней после хирургического вмешательства, причем животных умерщвляют спустя 15 дней. Поврежденную сонную артерию фиксируют, заливают в парафин и делят на части. Размер нео-интимных бляшек измеряют, используя компьютерный анализ изображений.
3. Влияние антител на поглощение окисленного LDL в культивированных макрофагах человека.
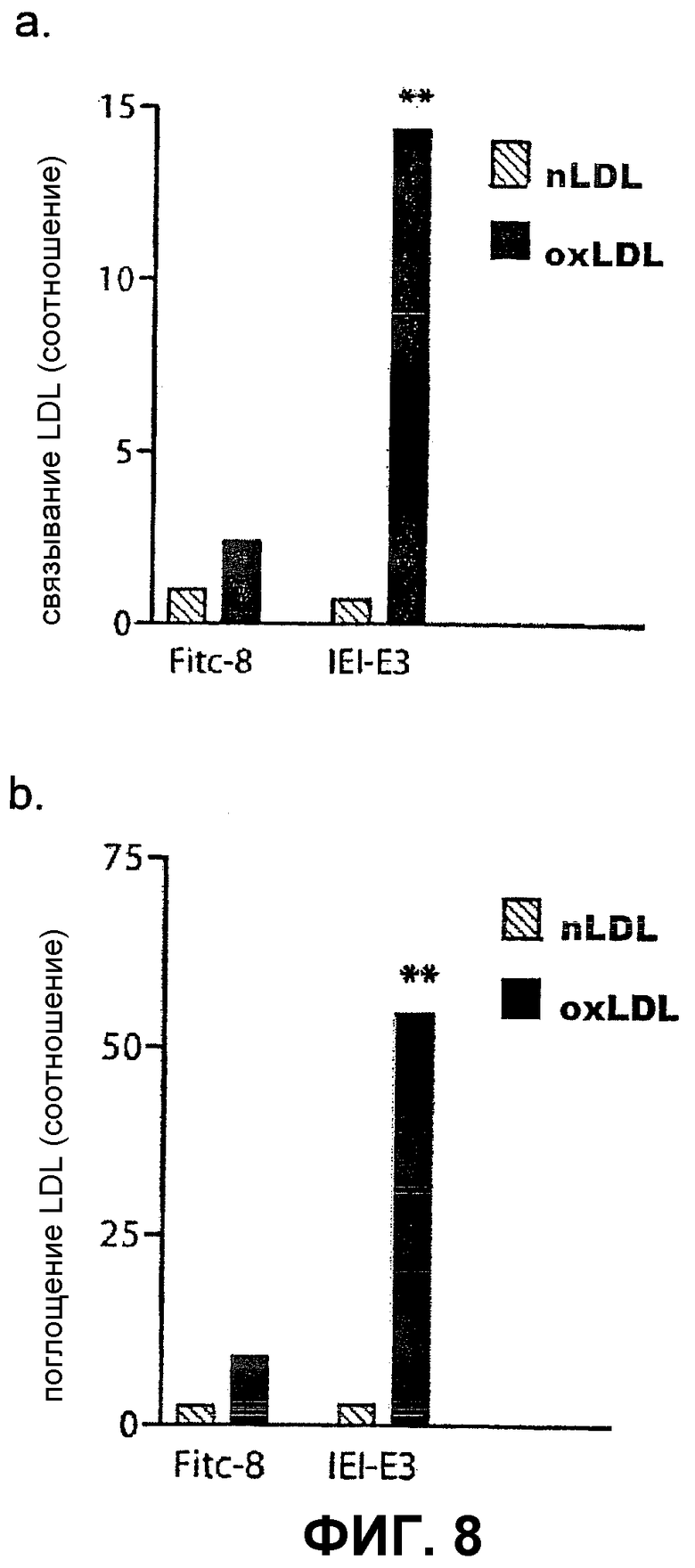
Поглощение окисленного LDL в артериальных макрофагах, ведущее к образованию заполненных холестерином пенистых клеток макрофага, является одной из наиболее характерных особенностей атеросклеротической бляшки. Предложено несколько серий доказательств того, что ингибирование поглощения окисленного LDL в артериальных макрофагах представляет собой возможную цель лечения атеросклероза. Для того чтобы изучить влияние антител на поглощение макрофагами окисленных клеток, клетки предварительно инкубируют с меченным 125I окисленным LDL человека в течение 2 часов. Макрофаги человека выделяют из лейкоцитарных пленок донорской крови с помощью центрифугирования в фиколл гипаке с последующим культивированием в присутствии 10% сыворотки в течение 6 дней. Затем клетки в течение 6 часов инкубируют в среде, содержащей комплексы антитело/окисленный LDL, промывают и определяют ассоциированную клетками радиоактивность на гамма-счетчике. Добавление антител IEI-E3 приводит к пятикратному уменьшению связывания (P=0,001) и поглощения (P=0,004) окисленного LDL в макрофагах, по сравнению с FITC-8, но не оказывает влияния на связывание или поглощение исходного LDL (фиг. 8a и 8b).
4. Влияние антител на цитотоксичность, обусловленную окисленным LDL. Окисленный LDL является высоко цитотоксичным. Полагают, что большая часть воспалительной активности в атеросклеротических бляшках объясняется повреждением клеток, вызванным окисленным LDL. Следовательно, ингибирование цитотоксичности окисленного LDL представляет собой другую возможную мишень для лечения атеросклероза. Для изучения влияния цитотоксичности окисленного LDL, культивированные гладкие мускульные клетки артерий человека подвергают действию 100 нг/мл окисленного LDL человека в течение 48 часов в присутствии увеличивающейся концентрации антител (0-200 нг/мл). Величину повреждения клеток определяют при помощи измерения выделения энзима LDH.
Показанные эксперименты выявляют эффект для отдельных антител, вырабатываемых против отдельных пептидов, но для специалистов в данной области техники очевидно, что все остальные антитела, вырабатываемые против обнаруженных пептидов будут вести себя таким же образом.
Антитела согласно изобретению используют в фармацевтических композициях для пассивной иммунизации, в силу чего фармацевтические композиции в первую очередь предназначены для инъекций, включая раствор, суспензию или эмульсию одиночного антитела или смеси антител по настоящему изобретению в такой дозировке, чтобы обеспечить терапевтически или профилактически активный уровень в организме подвергающегося лечению. Композиции могут быть снабжены обычно используемыми вспомогательными компонентами, чтобы увеличить абсорбцию антитела или смеси антител. Другим способом введения может быть назальный способ с помощью ингаляции антитела/смеси антител, в комбинации с ингалируемым наполнителем.
Такие фармацевтические композиции могут содержать активное антитело в количестве от 0,5 до 99,5% по весу, или от 5 до 90% по весу, или от 10 до 90% по весу, или от 25 до 80% по весу, или от 40 до 90% по весу.
Дневная доза антитела или его повторная доза обеспечивают терапевтически или профилактически активный уровень в организме подвергающегося лечению, с тем чтобы уменьшить или предотвратить признаки и симптомы атеросклероза путем пассивной иммунизации. Доза антитела согласно изобретению может составлять от 1 мкг до 1 мг на килограмм веса тела или более. Композиция, содержащая антитело, может быть дополнена другими лекарственными средствами для лечения или профилактики атеросклероза или сердечно-сосудистых заболеваний, такими как средства для понижения кровяного давления, например блокаторами бета-рецепторов, антагонистами кальция, диуретиками и другими противогипертоническими средствами.
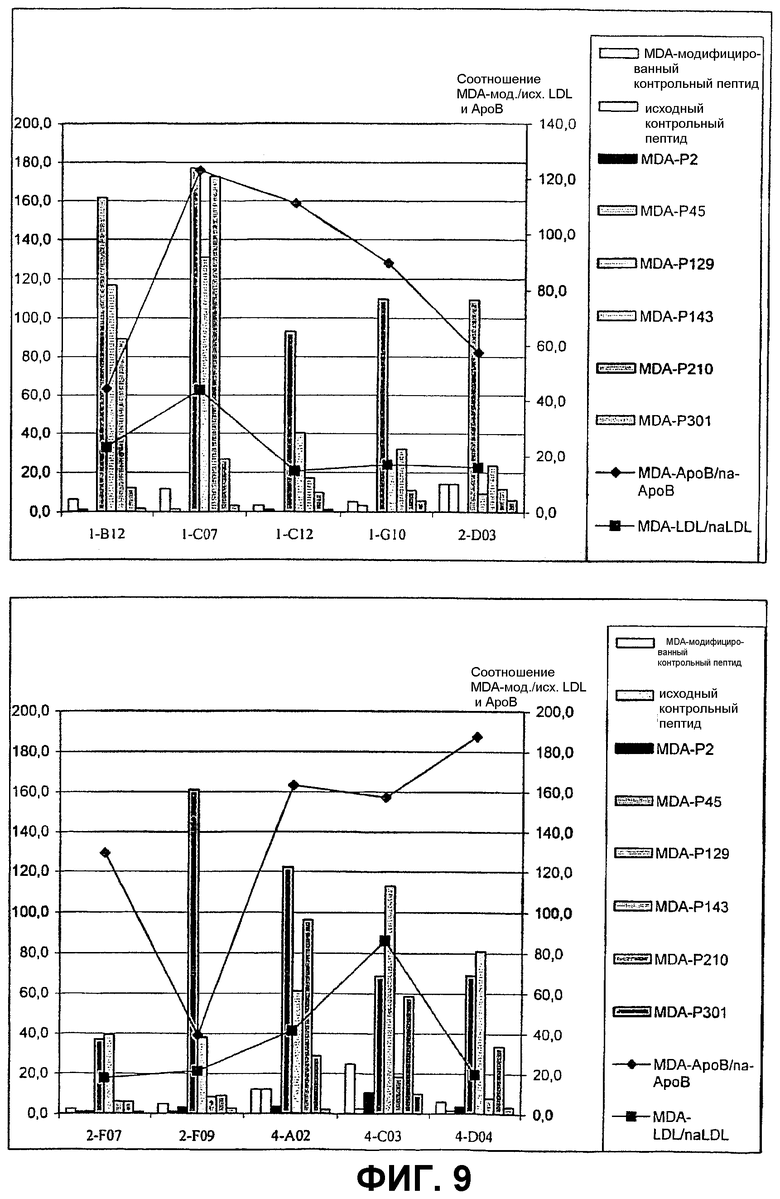
На фиг.9 показано связывание изолированного scFv с MDA-модифицированными пептидами, производными апо-B100, и с MDA-модифицированными контрольными пептидами с неподходящей последовательностью. Также изображены соотношения между связыванием scFv с MDA-модифицированным и исходным белком апо-B100 и LDL человека соответственно. Столбцы показаны в том порядке, в котором они определены сверху вниз в правой колонке соответствующего графика, входящего в фиг.9.
ССЫЛКИ
Dimayuga, P., В. Cercek, et al. (2002).
"Inhibitory effect on arterial injury-induced neointimal formation by adoptive B-cell transfer in Rag-1 knockout mice."
Arteriosclerosis, Thrombosis and Vascular Biology 22: 644-649.
Jovinge, S., M. Crisby, et al. (1997).
"DNA fragmentation and ultrastructural changes of degenerating cells in atherosclerotic lesions and smooth muscle cells exposed to oxidized LDL in vitro."
Arteriosclerosis, Thrombosis and Vascular Biology 17: 2225-2231.
Regnstrom, J., G. Walldius, et al. (1990).
"Effect of probucol treatment on suspectibility of low density lipoprotein isolated from hypercholesterolemic patients to become oxidativery modified in vitro."
Atherosclerosis 82: 43-51.
Steinberg, D., S. Parthasarathy, et al. (1989).
"Beyond cholesterol modifications of low-density lipoprotein that increase its atherogenicity."
New England Journal of Medicine 320(14): 915-924.
Zhou, X., G. Paulsson, et al. (1998).
"Hypercholesterolemia is associated with a T helper (Th) 1/Th2 switch of the autoimmune response in atherosclerotic apo E-knockout Mice."
Journal of Clinical Investigation 101: 1717-1725.








| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ | 2006 |
|
RU2454428C2 |
| АНТАГОНИСТЫ PCSK9 | 2009 |
|
RU2528735C2 |
| АНТАГОНИСТЫ PCSK9 | 2014 |
|
RU2618869C2 |
| Моноклональное антитело, способное нейтрализовать биологическую активность интерферона бета-1а человека | 2018 |
|
RU2729391C2 |
| СВЯЗЫВАЮЩИЕ БЕЛКИ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ LOX1, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2764993C2 |
| Антитело, связывающееся с карбоангидразой, и его применение | 2017 |
|
RU2727682C1 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2678127C2 |
| СПОСОБ ИНГИБИРОВАНИЯ GMCSFRa У ПАЦИЕНТА | 2012 |
|
RU2639546C2 |
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2725812C2 |
| АНТИТЕЛО ПРОТИВ ЛИПОАРАБИНОМАННАНА И ИММУНОЛОГИЧЕСКИЙ АНАЛИЗ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ КИСЛОТОУСТОЙЧИВЫМИ БАКТЕРИЯМИ, С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА | 2013 |
|
RU2588480C2 |








Изобретение относится к медицине, а именно к изолированным антителам человека против пептидов, являющихся производными аполипопротеина В. Настоящее изобретение включает применение изолированного антитела человека или фрагмента антитела, направленного, по меньшей мере, на один окисленный фрагмент аполипопротеина В, в производстве фармацевтической композиции для терапевтического или профилактического лечения атеросклероза посредством иммунизации. Преимущество настоящего изобретения заключается в том, что осуществляется пассивная иммунизация предварительно сформированными антителами, направленными на те же пептиды. При этом поскольку применяемые антитела являются полностью человеческими, то риск возникновения нежелательной иммунологической реакции при их введении пациенту снижен. 6 з. и 66 н.п. ф-лы, 9 ил., 3 табл.
IEIGLEGKGFEPTLEALFGK
KTTKQSFDLSVKAQYKKNKH
GSTSHHLVSRKSISAALEHK и
IALDDAKINFNEKLSQLQTY.
(SEQ. ID. NO. 1)
(SEQ. ID. NO. 3)
(SEQ. ID. NO. 5)
(SEQ. ID. NO. 7)
(SEQ. ID. NO. 9)
(SEQ. ID. NO. 11)
(SEQ. ID. NO. 19)
(SEQ. ID. NO. 11)
(SEQ. ID. NO. 23)
(SEQ. ID. NO. 25)
(SEQ. ID. NO. 27)
(SEQ. ID. NO. 29)
(SEQ. ID. NO. 31)
(SEQ. ID. NO. 33)
(SEQ. ID. NO. 35)
(SEQ. ID. NO. 37).
(SEQ. ID. NO. 2)
(SEQ. ID. NO. 4)
(SEQ. ID. NO. 6)
(SEQ. ID. NO. 8)
(SEQ. ID. NO. 10)
(SEQ. ID. NO. 12)
(SEQ. ID. NO. 20)
(SEQ. ID. NO. 22)
(SEQ. ID. NO. 24)
(SEQ. ID. NO. 26)
(SEQ. ID. NO. 28)
(SEQ. ID. NO. 30)
(SEQ. ID. NO. 32)
(SEQ. ID. NO. 34)
(SEQ. ID. NO. 36)
(SEQ. ID. NO. 38).
(SEQ. ID. NO. 1)
(SEQ. ID. NO. 3)
(SEQ. ID. NO. 5)
(SEQ. ID. NO. 7)
(SEQ. ID. NO. 9)
(SEQ. ID. NO. 11)
(SEQ. ID. NO. 19)
(SEQ. ID. NO. 21)
(SEQ. ID. NO. 23)
(SEQ. ID. NO. 25)
(SEQ. ID. NO. 27)
(SEQ. ID. NO. 29)
(SEQ. ID. NO. 31)
(SEQ. ID. NO. 33)
(SEQ. ID. NO. 35)
(SEQ. ID. NO. 37),
в сочетании по меньшей мере с одной легкой вариабельной областью (VL), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из
(SEQ. ID. NO. 2)
(SEQ. ID. NO. 4)
(SEQ. ID. NO. 6)
(SEQ. ID. NO. 8)
(SEQ. ID. NO. 10)
(SEQ. ID. NO. 12)
(SEQ. ID. NO. 20)
(SEQ. ID. NO. 22)
(SEQ. ID. NO. 24)
(SEQ. ID. NO. 26)
(SEQ. ID. NO. 28)
(SEQ. ID. NO. 30)
(SEQ. ID. NO. 32)
(SEQ. ID. NO. 34)
(SEQ. ID. NO. 36)
(SEQ. ID. NO. 38).
(SEQ. ID. NO. 1)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 2).
(SEQ. ID. NO. 3)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 4).
(SEQ. ID. NO. 5)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 6).
(SEQ. ID. NO. 7)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 8).
(SEQ. ID. NO. 9)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 10).
(SEQ. ID. NO. 11)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 12).
(SEQ. ID. NO. 19)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 20).
(SEQ. ID. NO. 21)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 22)
(SEQ. ID. NO. 23)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 24).
(SEQ. ID. NO. 25)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 26).
(SEQ. ID. NO. 27)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 28).
(SEQ. ID. NO. 29)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 30).
(SEQ. ID. N0.31)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 32).
(SEQ. ID. NO. 33)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 34).
(SEQ. ID. NO. 35)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 36).
(SEQ. ID. NO. 37)
и легкую вариабельную область (VL)
(SEQ. ID. NO. 38).
IEIGLEGKGFEPTLEALFGK
KTTKQSFDLSVKAQYKKNKH
GSTSHHLVSRKSISAALEHK и
IALDDAKINFNEKLSQLQTY,
содержащие тяжелую вариабельную область (VH), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из SEQ. ID. NO. 1, SEQ. ID. NO. 3, SEQ. ID. NO. 5, SEQ. ID. NO. 7, SEQ. ID. NO. 9, SEQ. ID. NO. 11, SEQ. ID. NO. 19, SEQ. ID. NO. 21, SEQ. ID. NO. 23, SEQ. ID. NO. 25, SEQ. ID. NO. 27, SEQ. ID. NO. 29, SEQ. ID. NO. 31, SEQ. ID. NO. 33, SEQ. ID. NO. 35, SEQ. ID. NO. 37.
IEIGLEGKGFEPTLEALFGK
KTTKQSFDLSVKAQYKKNKH
GSTSHHLVSRKSISAALEHK и
IALDDAKINFNEKLSQLQTY,
содержащие легкую вариабельную область (VL), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из SEQ. ID. NO. 2, SEQ. ID. NO. 4, SEQ. ID. NO. 6, SEQ. ID. NO. 8, SEQ. ID. NO. 10, SEQ. ID. NO. 12, SEQ. ID. NO. 20, SEQ. ID. NO. 22, SEQ. ID. NO. 24, SEQ. ID. NO. 26, SEQ. ID. NO. 28, SEQ. ID. NO. 30, SEQ. ID. NO. 32, SEQ. ID. NO. 34, SEQ. ID. NO. 36, SEQ. ID. NO. 38.
IEIGLEGKGFEPTLEALFGK
KTTKQSFDLSVKAQYKKNKH
GSTSHHLVSRKSISAALEHK и
IALDDAKINFNEKLSQLQTY,
содержащие тяжелую вариабельную область (VH), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из SEQ. ID. NO. 1, SEQ. ID. NO. 3, SEQ. ID. NO. 5, SEQ. ID. NO. 1, SEQ. ID. NO. 9, SEQ. ID. NO. 11, SEQ. ID. NO. 19, SEQ. ID. NO. 21, SEQ. ID. NO. 23, SEQ. ID. NO. 25, SEQ. ID. NO. 27, SEQ. ID. NO. 29, SEQ. ID. NO. 31, SEQ. ID. NO. 33, SEQ. ID. NO. 35, SEQ. ID. NO. 37 в сочетании с легкой вариабельной областью (VL), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из SEQ. ID. NO. 2, SEQ. ID. NO. 4, SEQ. ID. NO. 6, SEQ. ID. NO. 8, SEQ. ID. NO. 10, SEQ. ID. NO. 12, SEQ. ID. NO. 20, SEQ. ID. NO. 22, SEQ. ID. NO. 24, SEQ. ID. NO. 26, SEQ. ID. NO. 28, SEQ. ID. NO. 30, SEQ. ID. NO. 32, SEQ. ID. NO. 34, SEQ. ID. NO. 36, SEQ. ID. NO. 38.
и легкую вариабельную область (VL)
SEQ. ID. NO. 2.
SEQ. ID. NO. 3
и легкую вариабельную область (VL)
SEQ. ID. NO. 4.
SEQ. ID. NO. 5
и легкую вариабельную область (VL)
SEQ ID NO. 6.
SEQ. ID. NO. 7
и легкую вариабельную область (VL)
SEQ. ID. NO. 8.
SEQ. ID. NO. 9
и легкую вариабельную область (VL)
SEQ. ID. NO. 10.
SEQ. ID. NO. 11
и легкую вариабельную область (VL)
SEQ. ID. NO. 12.
SEQ. ID. NO. 19
и легкую вариабельную область (VL)
SEQ. ID. NO. 20.
SEQ. ID. NO. 21
и легкую вариабельную область (VL)
SEQ ID NO. 22.
SEQ. ID. NO. 23
и легкую вариабельную область (VL)
SEQ. ID. NO. 24.
SEQ. ID. NO. 25
и легкую вариабельную область (VL)
SEQ. ID. NO. 26.
SEQ. ID. NO. 27
и легкую вариабельную область (VL)
SEQ. ID. NO. 28.
SEQ. ID. NO. 29
и легкую вариабельную область (VL)
SEQ. ID. NO. 30.
SEQ. ID. NO. 31
и легкую вариабельную область (VL)
SEQ. ID NO. 32.
SEQ. ID. NO. 33
и легкую вариабельную область (VL)
SEQ. ID. NO. 34.
SEQ. ID. NO. 35
и легкую вариабельную область (VL)
SEQ. ID. NO. 36.
SEQ. ID. NO. 37
и легкую вариабельную область (VL)
SEQ. ID. NO. 38.
5'VH:S'-GGTGTGCATTCCGAGGTGCAGCTGTTGGAG (SEQ. ID. NO: 13)
3'VH:5'-GACGTACGACTCACCTGAGCTCACGGTGACCAG (SEQ. ID. NO: 14)
и праймеры для амплификации VL-сегментов:
5'VL:5'-GGTGTGCATTCCCAGTCTGTGCTGACTCAG (SEQ. ID. NO: 15)
3'VL:5'-GACGTACGTTCTACTCACCTAGGACCGTCAGCTT (SEQ. ID. NO: 16).
прямой праймер: 5'-ATGGGTGACAATGACATC (SEQ. ID. NO: 17)
обратный праймер: 5'-AAGCTTGCTAGCGTACG (SEQ. ID. NO: 18).
IEIGLEGKGFEPTLEALFGK
KTTKQSFDLSVKAQYKKNKH
GSTSHHLVSRKSISAALEHK и
IALDDAKINFNEKLSQLQTY.
в сочетании с легкой вариабельной областью (VL), которая выбрана из группы последовательностей нуклеиновых кислот, состоящей из SEQ. ID. NO. 2, SEQ. ID. NO. 4, SEQ. ID. NO. 6, SEQ. ID. NO. 8, SEQ. ID. NO. 10, SEQ. ID. NO. 12, SEQ. ID. NO. 22, SEQ. ID. NO. 24, SEQ. ID. NO. 26, SEQ. ID. NO. 28, SEQ. ID. NO. 30, SEQ. ID. NO. 32, SEQ. ID. NO. 34, SEQ. ID. NO. 36, SEQ. ID. NO. 38.
SEQ. ID. NO. 1,
и легкую вариабельную область (VL)
SEQ. ID. NO. 2.
SEQ. ID. NO. 3
и легкую вариабельную область (VL)
SEQ. ID. NO. 4.
SEQ. ID. NO. 5
и легкую вариабельную область (VL)
SEQ. ID. NO. 6.
SEQ. ID. NO. 7
и легкую вариабельную область (VL)
SEQ. ID. NO. 8.
SEQ. ID. NO. 9
и легкую вариабельную область (VL)
SEQ. ID. NO. 10.
SEQ. ID. NO. 11
и легкую вариабельную область (VL)
SEQ. ID. NO. 12.
SEQ. ID. NO. 19
и легкую вариабельную область (VL)
SEQ. ID. NO. 20.
SEQ. ID. NO. 21:
и легкую вариабельную область (VL)
SEQ. ID. NO. 22.
SEQ. ID. NO. 23
и легкую вариабельную область (VL)
SEQ. ID. NO. 24.
SEQ. ID. NO. 25
и легкую вариабельную область (VL)
SEQ. ID. NO. 26.
SEQ. ID. NO. 27
и легкую вариабельную область (VL)
SEQ. ID. NO. 28.
SEQ. ID. NO. 29
и легкую вариабельную область (VL)
SEQ. ID. NO. 30.
SEQ. ID. NO. 31
и легкую вариабельную область (VL)
SEQ. ID. NO. 32.
SEQ. ID. NO. 33
и легкую вариабельную область (VL)
SEQ. ID. NO. 34.
SEQ. ID. NO. 35
и легкую вариабельную область (VL)
SEQ. ID. NO. 36.
SEQ. ID. NO. 37
и легкую вариабельную область (VL)
SEQ. ID. NO. 38.
Приоритеты:
| WO 9908109 А2, 18.02.1999 | |||
| Гидравлический колонный пресс | 1960 |
|
SU132070A1 |
| ИНСТРУМЕНТ ДЛЯ БЕССТРУЖЕЧНОГО ФОРМООБРАЗОВАНИЯ | 1994 |
|
RU2080954C1 |
| WO 9842751, 01.10.1998 | |||
| ЕР 5972890, 19.06.1991 | |||
| US 5972890, 26.10.1999 | |||
| СИСТЕМА АВТОМАТИЧЕСКОГО РЕГУЛИРОВАНИЯ | 0 |
|
SU164008A1 |
| US 5494791 A, 27.02.1996 | |||
| US 5861276 A, 19.01.1999 | |||
| ДИМЕР МОЛЕКУЛЯРНОГО ВАРИАНТА АПО-ЛИПОПРОТЕИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1992 |
|
RU2134696C1 |
Авторы
Даты
2008-04-20—Публикация
2003-10-06—Подача