Изобретение относится к области микробиологии и может быть использовано при определении компонентного состава стрептотрицинового комплекса.
Антибиотики группы стрептотрицинов, продуцируемые различными штаммами микроорганизма Streptomyces, известны уже более 60 лет. Они обладают широким спектром биологической активности: подавляют рост грамположительных и грамотрицательных бактерий, микробактерий, некоторых грибов, вирусов и даже опухолей (Хохлов А.С. "Успехи в изучении стрептотрициновых антибиотиков. Антибиотики", 1983; 8: 613-622). Механизм действия стрептотрицинов обусловлен ингибированием рибосомального синтеза белков и индукцией ошибок в кодировании.
Хорошо известно применение стрептотрицинов в животноводстве и птицеводстве в виде кормовой добавки для увеличения веса животных, а в растениеводстве для защиты от фитопатогенных бактерий, а также в последнее время в молекулярной генетике микроорганизмов в качестве селекционного агента при выведении штаммов, резистентных к лекарственным средствам (Goldstein A.L., McCusker J.L. Three new drug resistance cassettes for gene disruption in Saccharomyces cerevisiae. Yeast. 1999; 15: 14: 1541-1653 или Sato M., Dhut S., Toda T. New drug-resistant cassettes for gene disruption and epitope tagging in Schizosaccharomyces pombe. Yeast. 2005; 22: 7: 583-591).
Молекулы всех стрептотрицинов состоят из неизменного общего ядра, включающего карбамоил-D-гулозамин, к которому присоединена гетероциклическая аминокислота стрептолидин, и варьируемого сегмента - полипептидной цепочки, связанной с аминосахаром и состоящей из 1-7 остатков β-лизина. Так стрептотрицин F имеет один остаток β-лизина, стрептотрицин Е - 2, стрептотрицин D - 3 и т.д. Как правило с возрастанием молекулярного веса увеличивается токсичность соединений.
Нурсеотрицин является продуктом метаболизма штамма Streptomyces noursei ZIMET 43716, в то время как антибиотик гризин (активное начало известного препарата кормогризин) синтезируется штаммами Streptomyces sp., близкими к Streptomyces griseus.
Для количественного определения стрептотрицинов в биологических образцах традиционно используется, в основном, микробиологический метод (Bocker H. Biological determination of nourseothricin. Arch. Exp. Vet. Med. 1986; 40:686-692), а в качестве дополнительных - химический (Romer W., Hesse W., Miosga N., Fricke H. Chemical determination of the streptothricin antibiotic nourseothricin. Arch. Exp. Vet. Med. 1986; 40:693-698), флуориметрический (Hesse W., Romer W., Miosga N. A new fluorimetric assay for streptothricins. Z. Allg. Mikrobiol. 1984; 24:10:709-711), и физико-химический (см., например, Попов А.И., Скворцова М.М. Физико-химический метод определения концентрации гризина в культуральной жидкости. Микробиологическая промышленность. 1974; 4:1-5). Однако все эти методы не дают информации о компонентном составе стрептотрицинового комплекса.
Наиболее близким к заявленному по технической сущности и достигаемому результату является способ ион-парной высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке с сорбентом С8 и с элюэнтом следующего состава, мас.%: ацетонитрил 33,5; натриевая соль октан-сульфоновой кислоты 0,02; трифторуксусная кислота 0,07; дистиллированная вода - остальное, рН 2,8, с последующей УФ-детекцией по поглощению при 210 нм. (Dornberger К., Krugel H., Peschel G., HPLC determination of the major factors of the nourseothricin complex, an antibiotic for nonmedical uses. J. Liq. Chrom. & Rel. Technol. 2001; 24:8:1153-1159).
Известный способ позволяет выполнять большое количество анализов один за другим; приемлемое время анализа (около 20 минут), однако широкие (с "хвостом") пики стрептотрицинов D и С не позволяют надежно измерить их площадь на хроматограмме, т.е. определить их точное количество. Кроме того, при анализе биологических проб пики примесей часто перекрываются с пиками стрептотрициновых составляющих, что неизбежно приводит к завышению результатов по определению содержания стрептотрицинов в биологических матрицах.
Техническим результатом изобретения является повышение эффективности количественного определения состава стрептотрицинового комплекса в биологических пробах с относительно низким содержанием антибиотика (т.е. с высоким содержанием примесей).
Технический результат достигается за счет того, что для количественного определения основных компонентов стрептотрицинового комплекса в биологических пробах, путем ион-парной высокоэффективной жидкостей хроматографии (ВЭЖХ), биологическую пробу пропускают через колонку с сорбентом, после чего осуществляют УФ-детекцию по поглощению при 210 нм. При этом в качестве сорбента используют сорбент с обращенной фазой С18 (сорбент на основе силикагеля с химически привитыми алкильными С18 радикалами, стабильный в водных растворах в интервале рН 2-8). Перед пропусканием через колонку биологическую пробу разбавляют элюентом следующего состава, мас.%: ацетонитрил 17,7-19,7, натриевая соль октан-сульфоновой кислоты 0,024-0,026, трифторуксусная кислота 0,13-0,16, дистиллированная вода - остальное.
При использовании элюэнта вышеуказанного состава удается избавиться от искажения формы пиков ("хвостов") стрептотрицинов D и С, добиться улучшения разделения всех компонентов, в результате чего примеси биологической матрицы не мешают анализу стрептотрицинов.
Тип сорбента и состав подвижной фазы (элюента) имеют решающее значение - малейшие отклонения приводят к резкому ухудшению разделения компонентов, пики сливаются, искажается их форма.
Пример осуществления способа
Предлагаемый метод был применен для анализа как очищенных стандартных образцов стрептотрициновых комплексов (нурсеотрицина и гризина), так и биологического препарата кормогризина, представляющего высушенный мицелий, содержащий антибиотик гризин.
Стандартный образец сульфата нурсеотрицина (содержание стрептотрицинов 85%) был приобретен у фирмы WERNER BioAgents (Йена, Германия). Стандартный образец сульфата гризина был поставлен ВГНКИ (Москва, Россия). Партии препарата кормогризин были закуплены у ОАО Восток (Киров, Россия).
Для приготовления подвижной фазы (элюента) использовались: бидистиллированная вода и ацетонитрил категории ОСЧ-1 (НПК Криохром, Санкт-Петербург, Россия). Ион-парный реагент натриевая соль октан-1-уксусной кислоты закуплен у фирмы Merck (Дармштадт, Германия). Трифторуксусная кислота категории HPLC (чистота 99%) поставлена фирмой Lancaster-Synthesis (Англия).
Стандарты стрептотрицинов (нурсеотрицин и гризин) растворяли в бидистиллированной воде. Стрептотрициновый комплекс (гризин) экстрагировали из препарата кормогризин следующим образом: 5 г препарата встяхивали на качалке с 50 мл водной 0,2 и HCl в течение 2,5 часов при комнатной температуре; затем полученный экстракт фильтровали через бумажный фильтр. Перед нанесением на колонку (пропусканием через колонку) экстракт кормогризина разбавляли элюэнтом в 30 раз. Все пробы перед нанесением на колонку фильтровали через фильтр для ВЭЖХ (0,45 мкм).
Использовали хроматограф с длиной волны УФ-детектора, установленной на 210 нм, аналитической колонкой с входным предохранительным картриджем С18 (частицы размером 5 мкм, длина 250 мм, внутренний диаметр 4,6 мм) и петлей инжектора 20 мкл. Скорость потока элюента 1,3 мл/мин. Элюент использовали следующего состава, мас.%: ацетонитрил 18,7, натриевая соль октан-сульфоновой кислоты 0,025, трифторуксусная кислота 0,15, дистиллированная вода - остальное, pH 2,4.
Примерные времена удерживания стрептотрициновых компонентов (мин): F - 4,0, Е - 6,4, D - 10,8, С - 18,9. Выход УФ-детектора через аналого-цифровой преобразователь был соединен с компьютером, соответствующая программа которого позволяет рассчитывать количественный состав стрептотрицинового комплекса.
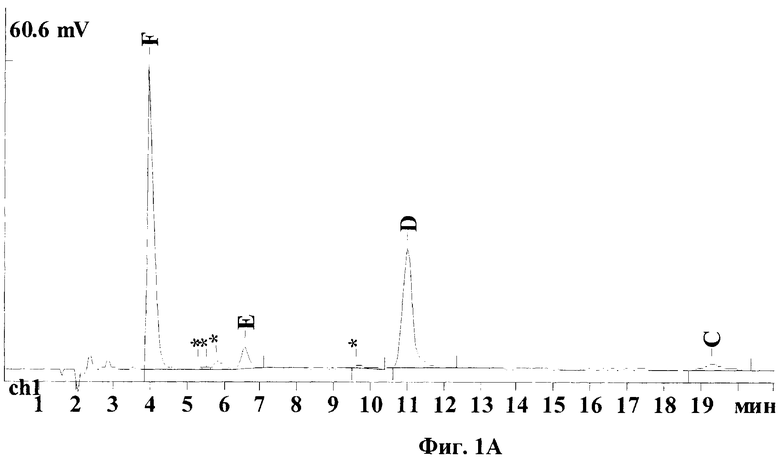
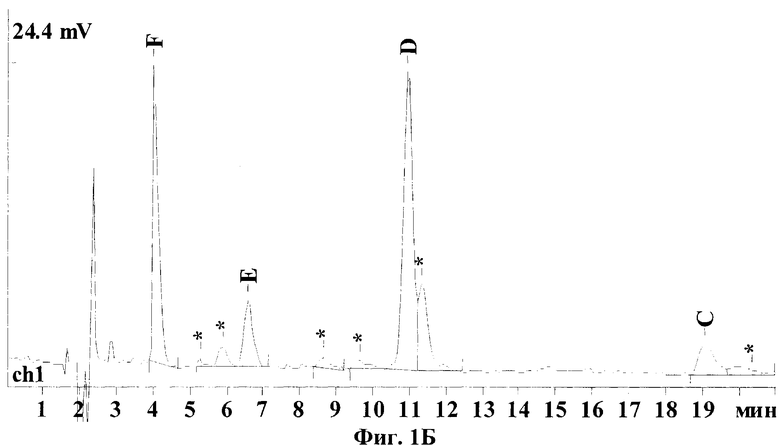
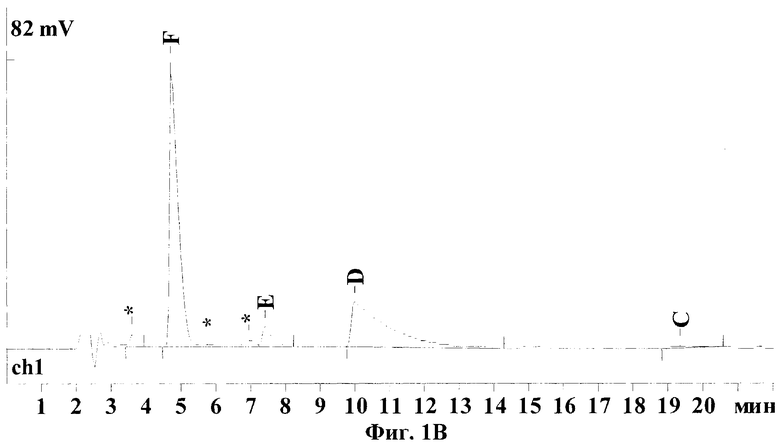
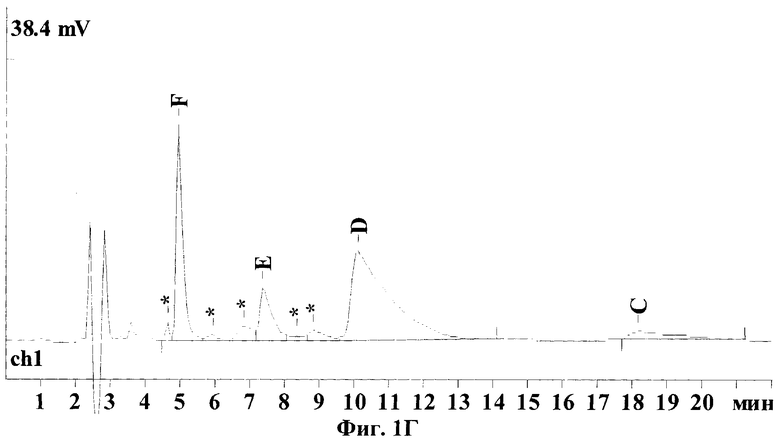
Хроматограммы, представленные на Фиг.1, иллюстрируют результаты, полученные по заявленному способу - (Фиг.1А и 1Б) и по ранее известному (Dornberger К., Krugel H., Peschel G., HPLC determination of the major factors of the nourseothricin complex, an antibiotic for nonmedical uses. J. Liq. Chrom. & Rel. Technol. 2001; 24:8:1153-1159) - (Фиг.1В и 1Г). Отнесения пиков стрептотрицинов на хроматограмме были сделаны по стандарту нурсеотрицина, как указано в известном способе и согласно данным, полученным дополнительно от производителя.
На Фиг.1А и 1Б видно, что все основные компоненты стрептотрицинового комплекса F, Е, D и С хорошо разделяются, форма пиков нормальная, без "хвостов". Хотя в обоих стандартах доминируют компоненты F и D, составляющие в сумме 80-90% от всего комплекса (см. таблицу), различия по составу между нурсеотрицином и гризином совершенно очевидны: в нурсеотрицине преобладает стрептотрицин F, а в гризине - D; также в гризине выше в несколько раз содержание стрептотрицинов Е и С. Кроме того, в стандарте гризина присутствует гораздо большее количество примесей по сравнению с нурсеотрицином (например, заметный пик вблизи компонента D). Рассчитанная по нурсеотрицину чистота стандартного образца гризина составила только 63,5%.
Для сравнения предлагаемого и известного методов эти же образцы нурсеотрицина и гризина были дополнительно проанализированы на колонке С8, согласно известному способу. В обоих случаях были получены широкие, "хвостящие" пики стрептотрицинов D и С и худшее отделение пиков примесей от компонента Е. Точное количественное определение площади пика компонента С становится практически невозможным. Кроме того, на хроматограмме гризина пик примеси, расположенный справа от пика стрептотрицина D, уже не отделяется. В результате чистота стандарта гризина, рассчитанная по нурсеотрицину, составила в этом случае уже 77%, а не 63,5%, т.е. ошибка превысила +20%.
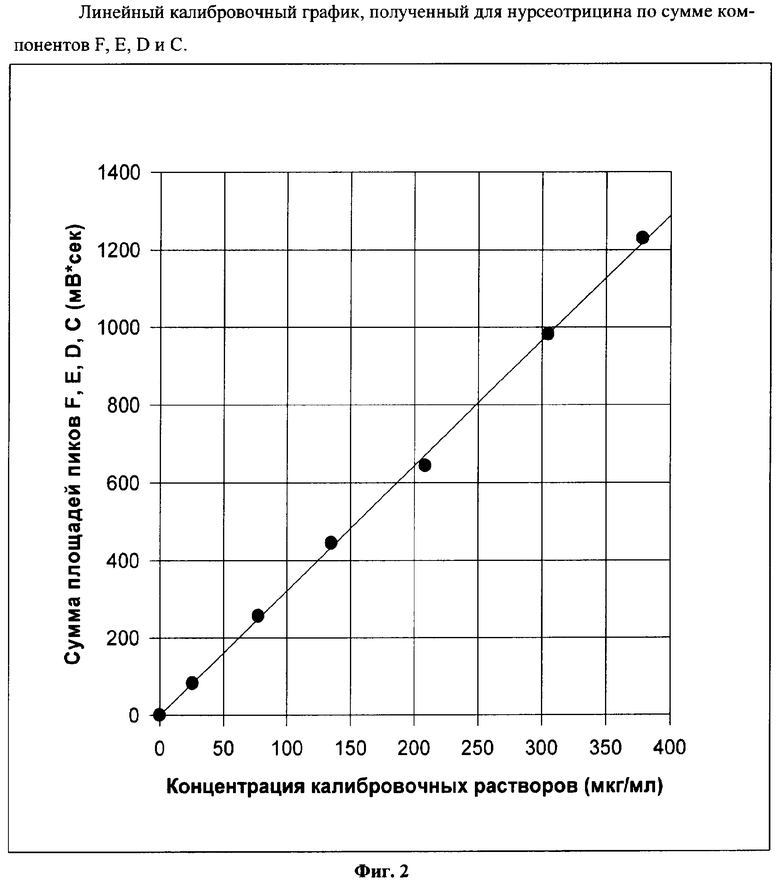
Для построения калибровочного графика, необходимого для количественного определения содержания стрептотрицинов по методике с внешним стандартом, использовали только стандартный образец нурсеотрицина, поскольку была известна его чистота 85% (чистота образца сульфата гризина, поставляемого ВГНКИ, не указывается). Всего использовали 6 рабочих калибровочных растворов стрептотрицинов с концентрациями от 25 до 379 мкг/мл. Из Фиг.2 видно, что полученный для нурсеотрицина (по сумме всех компонентов) калибровочный график линеен во всем изученном диапазоне концентраций антибиотика, что согласуется с данными метода Dornberger К. et al.
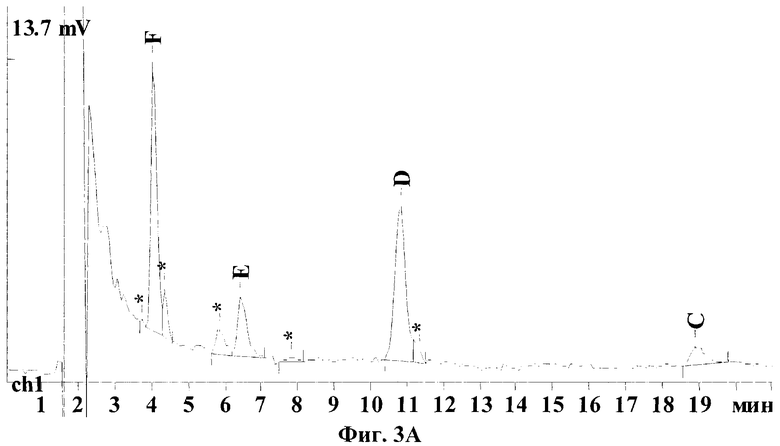
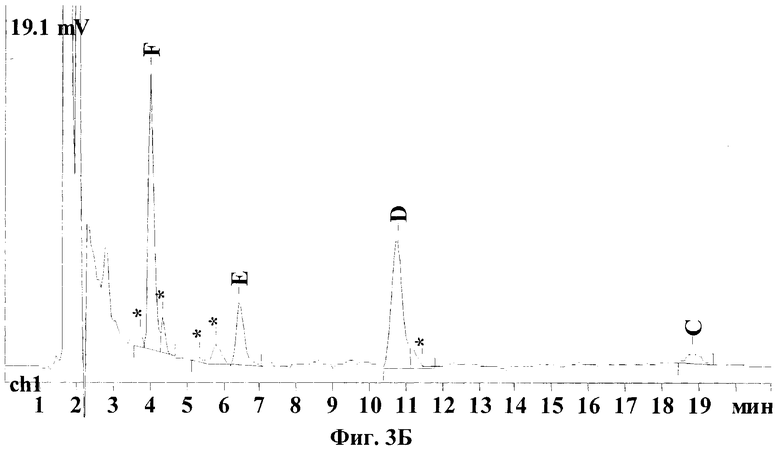
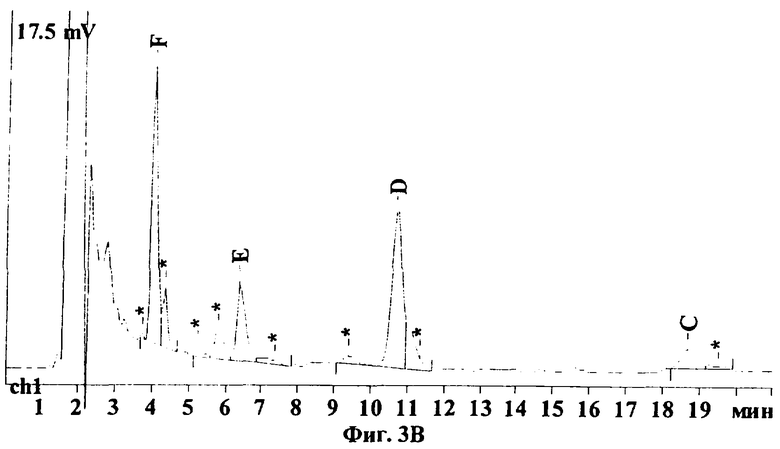
На Фиг.3А-3В показаны типичные хроматограммы водных экстрактов различных сортов коммерческого препарата кормогризин, а именно кормогризин-60, кормогризин-80 и кормогризин-100, из которых видно, что пики примесей не мешают определению основных компонентов стрептотрицинового комплекса. Были проанализированы 2-3 партии каждого сорта кормогризина. Анализ показывает, что компонентный состав различных партий одного и того же сорта кормогризина иногда варьируется в значительных пределах, например для компонента F 36-45%, для Е 12-18%, для D 36-45% и для С 3,5-8,5%. Однако в целом по сравнению со стандартом гризина есть заметные различия (см. таблицу). Так, содержание стрептотрицинов F и D в кормогризине приблизительно одинаково, а в стандарте гризина содержание D почти в 2 раза выше, чем F, концентрация Е в кормогризине выше на 50%, а концентрация стрептотрицина С, наоборот, существенно ниже, чем в стандарте гризина.
В таблице приведены также данные по биологической активности испытанных проб, измеренной на культуре Bacillus subtilis ATCC 6633 согласно ГОСТ СССР 27786-88. Интересно отметить, что в ГОСТе на кормогризин указано, что "1 условная единица активности гризина соответствует 1 мкг антибиотика в товарном препарате" (или 1 ЕД/мкг). На самом деле содержание ДВ (т.е. гризина или суммы стрептотрицинов) в препарате значительно ниже (см. таблицу). Пересчитанный коэффициент соответствия согласно данным таблицы для нурсеотрицина равен ˜ 2,35 ЕД/мкг, для стандарта гризина ˜ 2,10 ЕД/мкг, а для различных партий кормогризина варьируется в довольно широком диапазоне от 1,70 до 2,27, в среднем составляя примерно 2,04 ЕД/мкг. Возможно именно такое значение коэффициента, примерно равное 2, и следует учитывать при расчетах биологической активности препарата по измеренному содержанию стрептотрицинов.
Предлагаемый способ может быть использован для определения как суммарного содержания стрептотрицинов, так и их компонентного состава, в различных биологических пробах, без применения сложной пробоподготовки.
На Фиг.1(А-Г) показаны ВЭЖХ хроматограммы стандартов стрептотрициновых комплексов, полученные по предлагаемому методу (колонка С18) и по известному методу (колонка С8): (А) - сульфат нурсеотрицина (379 мкг/мл), колонка С18; (Б) - сульфат гризина (254 мкг/мл), колонка С18; (В) - сульфат нурсеотрицина (379 мкг/мл), колонка С8; (Г) - сульфат гризина (254 мкг/мл). Для получения хроматограмм (В) и (Г) была использована аналитическая колонка Altex Ultrasphere C8 (США) (частицы размером 5 мкм, длина 250 мм, внутренний диаметр 4,6 мм), петля инжектора 20 мкл, скорость потока 1 мл/мин, детекция при 210 нм. Состав элюента: вода (57%), ацетонитрил (43%), натриевая соль октан-сульфоновой кислоты (0,02%), трифторуксусная кислота (0,05%)).
Компонентный состав стрептотрициновых комплексов: стандарты нурсеотрицина и гризина и 5 экстрактов различных сортов коммерческого препарата кормогризин. Для кормогризина представлены усредненные данные по 2-3 различным партиям для каждого сорта. Сумма стрептотрицинов F, Е, D и С (или ДВ) принята за 100%. Биологическая активность, выраженная в условных единицах (ЕД/мкг), определялась на культуре Bacillus subtilis ATCC 6633 согласно методу по ГОСТ СССР 27786-88.
**Данные производителя/поставщика
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ БОРЬБЫ С БОЛЕЗНЯМИ РАСТЕНИЙ | 1998 |
|
RU2144292C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ АВЕРМЕКТИНОВ В ПРОДУКТАХ ЖИВОТНОГО И РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2207547C1 |
| Способ получения кормогризина | 1976 |
|
SU675070A1 |
| СРЕДСТВО ДЛЯ ЗАЩИТЫ РАСТЕНИЙ | 2006 |
|
RU2324351C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИМЕРНЫХ МОЛЕКУЛ ХИТОЗАНА В ПРЕПАРАТАХ ХИТОЗАНА | 2005 |
|
RU2295127C1 |
| СПОСОБ ВЫДЕЛЕНИЯ АВЕРМЕКТИНОВЫХ КОМПЛЕКСОВ | 2000 |
|
RU2182174C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДИГИДРОКВЕРЦЕТИНА | 2006 |
|
RU2319141C1 |
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ КОМПЛЕКСА АНТИБИОТИКОВ (ТЕТРАЦИКЛИНОВАЯ ГРУППА, ЛЕВОМИЦЕТИН, БАЦИТРАЦИН) В МЯСЕ И МЯСНЫХ ПРОДУКТАХ С ИСПОЛЬЗОВАНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2019 |
|
RU2729620C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИПРОФЛОКСАЦИНА МЕТОДОМ ОБРАЩЕННО-ФАЗНОЙ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2020 |
|
RU2751338C1 |
| Способ определения дабигатрана в сыворотке крови человека | 2018 |
|
RU2683032C1 |
Изобретение относится к биотехнологии и может быть использовано при определении компонентного состава стрептотрицинового комплекса. Способ предусматривает пропускание биологической пробы через колонку с сорбентом и последующую УФ-детекцию по поглощению при λ=210 нм. Перед пропусканием биологическую пробу разбавляют элюентом, при этом в качестве сорбента используют сорбент с обращенной фазой С18, а элюент используют следующего состава: ацетонитрил, натриевая соль октан-сульфоновой кислоты, трифторуксусная кислота, дистиллированная вода. Изобретение позволяет повысить эффективность количественного определения состава стрептотрицинового комплекса в биологических пробах с высоким содержанием примесей. 1 з.п. ф-лы, 8 ил., 1 табл.
| DORNBERGER К., KRUGEL H, PESCHEL G | |||
| "HPLC determination of the major factors of the nourseothricin complex, an antibiotic for nonmedical uses | |||
| J | |||
| Liq | |||
| Chrom | |||
| and Rel | |||
| Technol | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| РЕШЕТОВ П.Д | |||
| Получение и свойства стрептотрициновых антибиотиков | |||
| - М., 1964 (автореферат диссертации). | |||
Авторы
Даты
2008-04-20—Публикация
2006-05-10—Подача