Область изобретения
Изобретение относится к области генетической инженерии, биотехнологии и медицины, конкретно к генетической конструкции, кодирующей и обеспечивающей биосинтез человеческого эпидермального фактора роста и которая может быть использована для его препаративного получения в штаммах Е.coli, a также к процедуре получения человеческого эпидермального фактора роста на основе этой конструкции. Полученный белок может служить основой для создания противоожоговых и ранозаживляющих средств, диагностики злокачественных заболеваний, связанных с гиперпродукцией рецептора чЭФР, а также при создании новых методов адресной доставки тех или иных терапевтических средств в клетки-мишени, специфически экспрессирующие рецептор чЭФР.
Предпосылки изобретения
чЭФР - гормон пептидной природы, производимый разнообразными тканями и содержащийся практически во всех биологических жидкостях организма человека. чЭФР синтезируется в виде предшественника длиной 1217 аминокислот и подвергается дальнейшему протеолитическому процессингу с образованием зрелого белка с характерным размером 53 аминокислоты и тремя внутренними дисульфидными связями, имеющего молекулярную массу около 6000 Да [Scott J. et al, J.Cell Sci Suppl, 1985, 3:19-28]. ЭФР оказывает воздействие на значительное число физиологических процессов в организме, являясь, в частности, одним из наиболее мощных митогенов для эпителиальных и соединительно-тканных клеток in vitro и in vivo. Поскольку в большинстве случаев эпителиальные клетки являются быстро обновляющимися (кожа, желудочно-кишечный тракт), роль ЭФР чрезвычайно важна. В отличие от гормонов, он синтезируется клетками многих органов и оказывает свое действие не только эндокринным, но и паракринным путем, а также секретируется во многие биологические жидкости (мочу, слюну, молоко). В желудочно-кишечном тракте и мочевыводящих путях ЭФР оказывает цитопротективное и регенерирующее действие на клетки выстилающего их эпителия. В частности продемонстрировано противоязвенное действие ЭФР [Finney K.J. et al, 1987]. В течение беременности ЭФР регулирует развитие молочных желез и впоследствии поступает с молоком в организм новорожденного, восполняя недостаточную продукцию собственного ЭФР слюнными железами. Показано, что ЭФР является одним из факторов, необходимых для нормального сперматогенеза у мышей. Детальное изучение спектра действия чЭФР указывает на возможные пути его применения в качестве ранозаживляющего, цитопротективного и противоязвенного препарата [Schultz G. et al, Eye, 1994, 8(pt.2):184-187; Greenhalgh D.G., J. Trauma, 1996, 41(1):159-167; Schultz G. et al, J. Cell Biochem, 1991, 45(4):346-352].
Необходимым условием такого применения чЭФР является наличие эффективного источника получения высокоочищенных препаратов данного белка. Современная молекулярная биология позволяет получить такой источник с использованием технологии рекомбинантной ДНК. Основным элементом этой технологии является получение плазмиды - нехромосомной двунитевой ДНК, несущей ген нужного белка, а также информацию, необходимую для репродуцирования плазмиды (ориджин репликации) и одну или более фенотипических характеристик, таких как устойчивость к определенным антибиотикам, позволяющих осуществлять селекцию микроорганизмов, содержащих данную ДНК.
К настоящему времени известны рекомбинантные плазмидные ДНК, обеспечивающие продукцию чЭФР в клетках различных бактерий и дрожжей [Yamagata H. et al, Proc Natl Acad Sci USA, 1989, 86(10):3589-3593; Clare J.J. et al, Gene, 1991, 105(2):205-212]. Наиболее близкими по технической сущности являются рекомбинантная ДНК Yep40AB и содержащий ее штамм-продуцент Saccharomyces cerevisiae BKM CR-349D, способные обеспечить получение рекомбинантного чЭФР в секретируемой во внеклеточную среду форме [Эльдаров М.А. с соавт. Патент РФ 2150501, 2000].
Преимущество Е.coli как организма, обеспечивающего экспрессию гена целевого белка, находящегося в составе рекомбинантной плазмиды, состоит в простоте и дешевизне наращивания бактериальной культуры по сравнению с культурой эукариотических клеток, а также в отсутствии гликозилирования белка, которое в данном случае является нежелательным.
Внутриклеточная продукция чЭФР, в свою очередь, позволяет обеспечить высокий выход белка, добиться его накопления в форме «тел включения», которые легко отделяются от других твердых и растворимых компонентов клетки и содержат целевой белок с минимальным количеством примесей.
Предложенный способ экспрессии существенно облегчает процедуру очистки конечного продукта по сравнению с методом, использующим его экспрессию во внеклеточную среду, поскольку последняя сильно загрязнена как компонентами питательной среды, так и побочными продуктами жизнедеятельности микроорганизмов.
Сущность изобретения. Изобретательской задачей является обеспечение высокого выхода и упрощение процедуры получения биологически активного человеческого эпидермального фактора роста (чЭФР).
Для решения данной задачи предложена плазмидная ДНК pBSH2EGF, кодирующая синтез эпидермального фактора роста человека, характеризующаяся размером 3393 п.о. и несущая в себе следующие элементы: оперативно встроенный по сайтам рестрикции BamHI и Hind III ген человеческого эпидермального фактора роста (чЭФР), в который встроены старт- и стоп-кодонов, ген устойчивости к антибиотику канамицину, репликативный ориджин pUC on, ген, кодирующий lac-репрессор и последовательность, кодирующую участок связывания рибосом (RBS), необходимый для начала трансляции белка в клетках бактерии Е.Coli, при этом ген чЭФР находится под регуляцией Т7-промотора, связанного с участком посадки lac-репрессора.
Общая схема этой генетической конструкции представлена на фиг.1.
Кроме того, предложен способ получения человеческого эпидермального фактора роста путем экспрессии его гена в бактериях Escherichia. coli штамма BL21(DE3) или другого компетентного штамма данного вида, при этом синтетический ген, кодирующий чЭФР, находится в составе плазмидной ДНК pBSH2EGF. После трансформации бактериальных клеток данной плазмидой и их культивирования осуществляют выделение чЭФР из накапливающихся в клетках тел включения.
В качестве штамма заявителем используется BL21(DE3), который хорошо зарекомендовал себя в качестве организма-хозяина для рекомбинантных плазмидных ДНК подобной конструкции [Sambrook J., Fritsch E.F. and Maniatis T. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989], однако для трансформации пригодны и другие штаммы.
Разработанный нами вектор pBSH2EGF несет ген белка чЭФР под контролем Т7 промотора, который может быть транскрибирован только Т7 РНК-полимеразой. Ген Т7 полимеразы должен быть расположен в составе бактериального генома штамма под контролем lac-промотора, например как в штамме BL21(DE3). В этом случае транскрипция целевых генов, находящихся под контролем Т7 промотора, возможна только после индукции lac-промотора изопропил-бета-D-тиогалактозидом (ИПТГ). В состав вектора входит копия гена lac I, кодирующего lac-penpeccop. Lac оператор находится также между промотором Т7 и кодирующей частью гена чЭФР. Таким образом lac-репрессор подавляет базальную экспрессию белка в отсутствие индуктора. Связывание индуктора ИПТГ с репрессорной молекулой нарушает ее взаимодействие с операторным участком, делая возможным посадку на этот участок РНК-полимеразы с последующей транскрипцией. По предлагаемому способу осуществляют наращивание клеток, трансформированных плазмидной ДНК pBSH2EGF, в жидкой ростовой среде до ее мутности 0,4-0,6 OD, после чего в нее добавляют 0,1-0,3 мМ ИПТГ-индуктора lac-промотора и ведут экспрессию продукта под контролем индуцированного промотора плазмиды.
Непосредственно связанным с этим изобретением является описание методов и способов, которыми чЭФР, содержащийся как главный компонент во внутриклеточных тельцах клеток бактерий, может быть извлечен из них, очищен и с помощью рефолдинга возвращен к нативной структуре, благодаря которой реализуется его биологическая активность.
Очистку целевого продукта, полученного с помощью плазмидной ДНК pBSH2EGF, осуществляют после стадии ренатурации методом жидкостной хроматографии высокого давления на обращенной фазе.
Изобретение иллюстрируется следующими примерами:
Пример 1. Клонирование гена человеческого эпидермального фактора роста (ЭФР) человека.
В качестве источника гена чЭФР была использована библиотека генов человека.
Фрагмент гена пре-чЭФР, соответствующий последовательности, кодирующей чЭФР был выделен методом амплификации с помощью следующих праймеров:
Bam 5' TAACTTGGATCCATGAATAGTGACTCTGAAT
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI
EGF-Hind 5' TTATAAAGCTTATTAGCGCAGTTCCCACCACTT
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции HindIII
Ген чЭФР (EGF) со внесенными сайтами узнавания
рестрикционными ферментами BamHI и Hind III, а также старт- и стоп-кодонами.
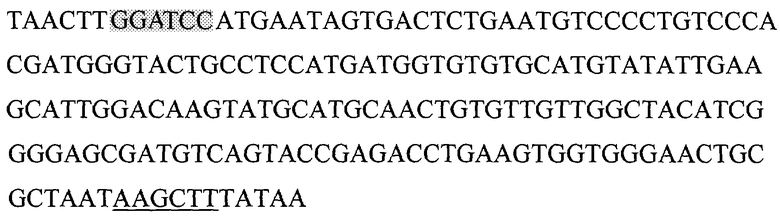
Выделенный фрагмент - сайт узнавания ферментом рестрикции BamHI, подчеркнутый - HindIII
Пример 2. Получение экспрессионного вектора
Для получения экспрессионного вектора последовательность EGF обработали ферментами рестрикции BamHI и Hind III и вставили по сайтам рестрикции BamHI и Hind III в вектор pBSH2. Полученный вектор назвали pBSH2EGF.
Для осуществления экспрессии белка данный вектор трансформировали в клетки бактерии Е.coli штамма BL21(DE3).
Индукция синтеза ЭФР оценивалась в 10 мл ИПТГ-индуцированных культур (выращивание до OD600 0-5, внесение ИПТГ до 0.2 мМ, затем 3 часа при 37°С на качалке). Продукция белка ожидаемого размера проверена по ДСН-электрофорезу в ПААГ.
Пример 3. Синтез чЭФР в штамме Е.coli BL21(DE3).
Уровень синтеза чЭФР определяли в штамме Е.coli, содержащем плазмиду pBSH2EGF. В качестве контроля использовали штамм Е.coli BL21(DE3) с плазмидой pBSH2, не несущей гена чЭФР. Клетки Е.coli штамма BL21(DE3) трансформировали плазмидой pBSH2EGF и выращивали в течение 12 ч при 37°С в среде LB с добавлением канамицина (100 мкг/мл) и глюкозы (0.2%). Затем разбавляли ночную культуру в 25 раз свежей средой LB с канамицином и подращивали 2-3 ч до плотности OD600=0,5, затем вносили ИПТГ до конечной концентрации 0.2 мМ для индукции синтеза чЭФР. Растили еще 3 часа, центрифугировали культуру при 5 тыс.об/мин в течение 10 мин, супернатант отбрасывали.
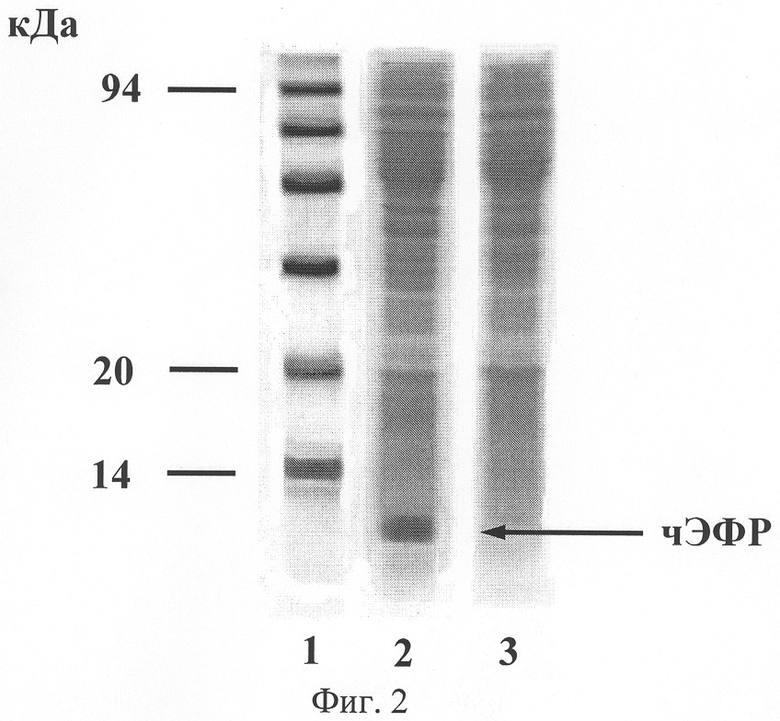
Как следует из данных, представленных на фиг.2, клетки E.coli, содержащие плазмиду pBSH2EGF, поддерживают экспрессию чЭФР. На фиг.2 представлены результаты электрофоретического разделения белков тотальных клеточных лизатов штаммов E.coli в ДСН-ПААГ, где
1 - маркеры молекулярной массы;
2 - штамм Е.coli BL21(DE3), несущий плазмиду pBSH2EGF;
3 - штамм Е.coli BL21(DE3), не несущий плазмиды pBSH2EGF;
Пример 4. Очистка рекомбинантного чЭФР из штамма-продуцента E.coli BL21(DE3), содержащего плазмидную ДНК pBSH2EGF.
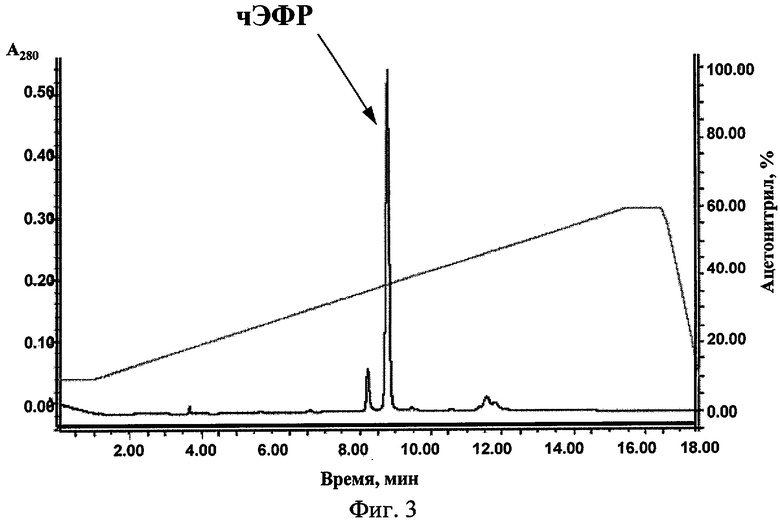
Осадок клеток, полученный из культуры E.coli, суспендировали в буфере для обработки ультразвуком (50 мМ трис-НС1, рН 8.0, 5 мМ ЭДТА), после чего добавляли лизоцим до конечной концентрации 50 мкг/мл и инкубировали в этом буфере при +4°С в течение 15 мин. Затем обработанные лизоцимом клетки подвергали воздействию ультразвука с помощью ультразвукового дезинтегратора в течение 2 мин при 0°С. Полученную суспензию центрифугировали в течение 15 мин при 10000 об/мин. Далее проводили процедуру отмывки телец включения. Для этого осадок ресуспендировали в буфере, содержащем 20 мМ трис-HCl, рН 8.0, 2 мМ ЭДТА, 0.1 М NaCl, 0.2% дезоксихолата натрия, и подвергали действию ультразвука, как описано выше, с последующим центрифугированием (10000 об/мин, 5 мин). Процедуру отмывки телец включения повторяли еще два раза. Полученный препарат был солюбилизирован в буфере, содержащем 50 мМ трис-HCl, 2 мМ ЭДТА, 1% натрия лаурилсаркозината. Ренатурацию белка проводили тремя последовательными диализами препарата против буфера, содержащего 25 мМ трис-HCl, 0.1 М NaCl. Далее препарат высушивали лиофилизацией и перерастворяли в минимальном объеме 10% водного раствора ацетонитрила. Белок подвергали очистке с помощью жидкостной хроматографии высокого давления на обращенной фазе, используя в качестве элюента непрерывный линейный градиент концентрации ацетонитрила от 10 до 60%. Фракции, содержащие целевой белок, объединяли и удаляли ацетонитрил лиофилизацией. После заключительной стадии очистки был получен белок высокой степени чистоты (см. фиг.3, 4). Выход белка составил ˜20 мг чЭФР из 1 л клеточной культуры.
Пример 5. Электрофоретический анализ конечного препарата чЭФР.
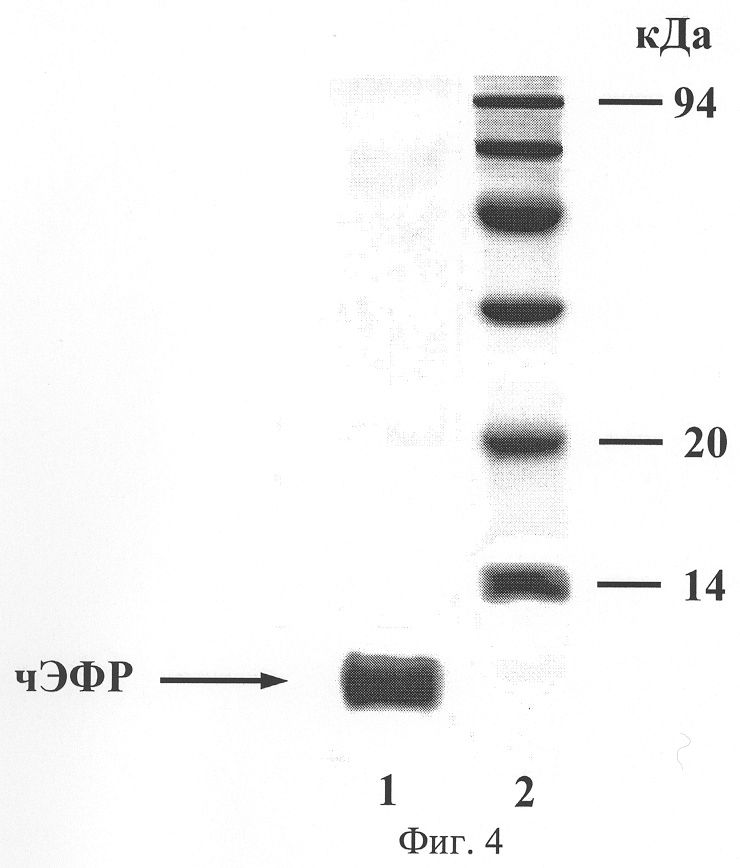
На фиг.4 представлены данные электрофоретического анализа рекомбинантного чЭФР в 15% полиакриламидном геле в присутствии 0.1% додецилсульфата натрия:
1 - препарат чЭФР из штамма с плазмидой pBSH2EGF после заключительной стадии очистки;
2 - маркеры молекулярных масс.
Из фиг.4 видно, что препарат представляет собой практически гомогенный белок (чистота более 98%) с молекулярной массой, соответствующей природному чЭФР.
Изобретение относится к области генной инженерии и биотехнологии и может быть использовано в медицине и фармацевтической промышленности. Синтезирована плазмидная ДНК pBSH2EGF, обеспечивающая экспрессию человеческого эпидермального фактора роста (чЭФР) в штаммах E.coli, содержащих ген полимеразы Т7, под контролем Т7-промотора, связанного с участком посадки lac-репрессора. Также предложен способ получения человеческого эпидермального фактора роста, предусматривающий индуцибельную экспрессию его в клетках штамма Escherichia. coli BL21(DE3), трансформированных плазмидной ДНК pBSH2EGF, с последующим выделением целевого продукта из телец включения. 2 н.п. ф-лы, 4 ил.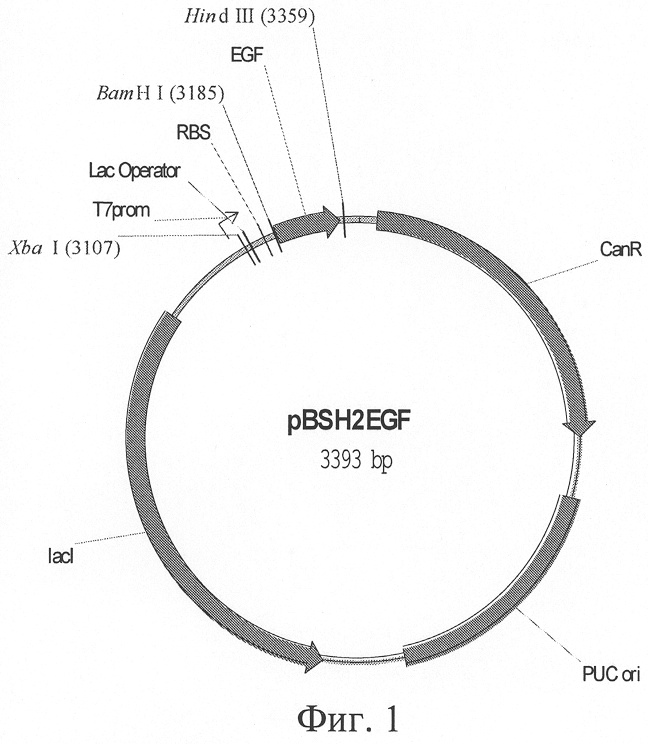
нуклеотидной последовательности, кодирующей чЭФР, которая получена из библиотеки кДНК человека с последующим дополнением старт- и стоп-кодонами и фланкирующими сайтами узнавания рестрикционными ферментами BamHI и Hind III (EGF);
Т7-промотора (T7prom), связанного с участком посадки lac-репрессора(Lac Operator);
гена, кодирующего lac-репрессор (lacl);
репликативного ориджина PUC (PUC ori);
участка связывания рибосом (RBS);
гена устойчивости к антибиотику канамицину (CanR),
которые расположены так, как это показано на фиг.1.
| ШТАММ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE-BKM CR-349D-ПРОДУЦЕНТ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА ЧЕЛОВЕКА | 1999 |
|
RU2150501C1 |
| Рентгенодифракционный способ исследования структурных нарушений в тонких приповерхностных слоях кристаллов | 1984 |
|
SU1257482A1 |
| LEE J.Y., YOON C.S., CHUNG I.Y., LEE Y.S., LEE E.K | |||
| Scale-up process for expression and renaturation of recombinant human epidermal growth factor from Escherichia coli inclusion bodies | |||
| Biotechnol | |||
| Appl | |||
| Biochem | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2006-12-20—Публикация
2004-12-21—Подача