Область техники, к которой относится настоящая заявка
Настоящее изобретение относится к новым производным 3,7-дигидро-[1,2,4]триазоло[1,5-а]пиримидин-5-карбоксамидов с активностью в отношении возбудителя туберкулеза, в том числе туберкулеза легких, и других бактерий, а также к фармацевтической композиции, содержащей указанные соединения.
Уровень техники
Туберкулез является социальной и медицинской проблемой во многих странах, в особенности в России. Несмотря на снижение заболеваемости туберкулезом, данное заболевание по-прежнему ежегодно уносит около 1.6 млн человеческих жизней. Особая опасность туберкулеза заключается в возникновении устойчивости (резистентности) возбудителя к используемым лекарственным средствам. По оценкам ВОЗ, в 2018 году во всем мире было выявлено полмиллиона новых случаев резистентности к рифампицину, из которых 78% - с множественной лекарственной устойчивостью микобактерий (МЛУ-ТБ). Высокий процент глобального бремени туберкулеза с МЛУ-ТБ приходится на Индию (27%), Китай (14%), Российскую Федерацию (9%), а также на страны бывшего СССР (>50% ранее леченных случаев туберкулеза). За последние годы в Российской Федерации, заболеваемость туберкулезом со множественной лекарственной устойчивостью возбудителя (МЛУ-ТБ) остается стабильной с 2015 года и существенно не изменилась к 2019 году (5,2 и 5,4 на 100 тыс. населения соответственно), несмотря на некоторое снижение распространенности (2015-25,5 против 2019-21,4). При этом в 56,5% случаев у больных сохраняется бактериовыделение, что связано с низкой эффективностью лечения. Применение новых противотуберкулезных препаратов привело к некоторому повышению эффективности лечения больных с МЛУ-ТБ с 2015 года (24,5%) и составила в 2019 году 35,7%, однако по данным ВОЗ необходимо достигнуть показателя 78%.
В настоящее время препаратами первой линии терапии туберкулеза являются изониазид и рифампицин; в случае развития резистентности к этим наиболее эффективным препаратам используют более токсичные и менее эффективные препараты второй линии: стрептомицин, канамицин, амикацин, этамбутол, пиразинамид, офлоксацин, ципрофлоксацин, этионамид, протионамид, капреомицин и циклосерин. В связи возникающей лекарственной резистентностью к препаратам первого ряд, а также с невысокой активностью препаратов второго ряда, разработка новых лекарственных средств с улучшенной активностью в отношении туберкулеза, является актуальной задачей.
Сущность изобретения
Соединения
В первом аспекте настоящее изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым солям:
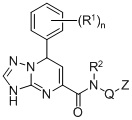
где в формуле (I)
R1 представляет собой галоген;
R2 представляет собой H или С1-6 алкил;
Q представляет собой связь или CHR3;
R3 представляет собой H или С1-6 алкил;
Z представляет собой фенил, необязательно замещенный галогеном, циклогексил или этинил; и
n представляет собой целое число от 0 до 2.
Более конкретно, в соединении формулы (I)
R1 представляет собой фтор или бром;
R2 представляет собой H или этил;
Q представляет собой связь или CHR3;
Z представляет собой фенил, необязательно замещенный хлором или фтором, циклогексил или этинил; и
n представляет собой целое число от 0 до 2.
Более конкретно, в соединении формулы (I)
один R1 представляет собой бром, и второй R1 представляет собой фтор;
R2 представляет собой H;
Q представляет собой CH2;
Z представляет собой фенил, необязательно замещенный фтором.
Еще более конкретно, в соединении формулы (I)
один R1 представляет собой 4-бром, и второй R1 представляет собой 2-фтор;
R2 представляет собой H;
Q представляет собой CH2;
Z представляет собой 4-фторфенил.
Более конкретно, в соединении формулы (I)
один R1 представляет собой бром, и второй R1 представляет собой фтор;
R2 представляет собой H;
Q представляет собой связь;
Z представляет собой фенил, необязательно замещенный хлором.
В частности, соединение формулы (I) может быть выбрано из следующих соединений: 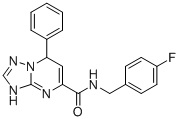 ,
,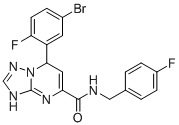 ,
,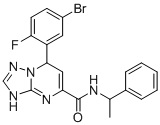 ,
,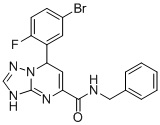 ,
,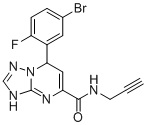 ,
,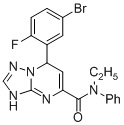 ,
,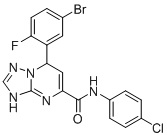 и
и 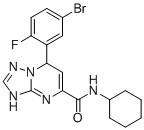 .
.
Соединения настоящего изобретения могут образовывать фармацевтически приемлемые соли с подходящими анионами или катионами. Примерами кислот, которые могут давать подходящий анион, могут быть хлороводородная, бромоводородная, йодоводородная, серная, фосфорная, метансульфоновая, толуолсульфоновая кислоты.
Примерами подходящий оснований являются гидроксид натрия, гидроксид калия, гидроксид аммония, триэтиламин.
Фармацевтическая композиция
Во втором аспекте настоящее изобретение относится к фармацевтической композиции для лечения заболевания, вызываемого микобактериями, содержащей эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, наполнитель или разбавитель.
В частности, изобретение относится к фармацевтической композиции для лечения заболевания, вызываемого Mycobacterium tuberculosis, Mycobacterium smegmatis или Mycobacterium fortuitum.
В частности, изобретение относится к фармацевтической композиции для лечения туберкулеза легких, туберкулеза суставов и костей, в частности, туберкулеза позвоночника.
Заявленная фармацевтическая композиция, помимо соединения формулы (I), носителя, наполнителя или разбавителя, может содержать дополнительный активный агент, выбранный из одного или нескольких из изониазида, рифампицина, стрептомицина, канамицина, амикацина, этамбутола, пиразинамида, офлоксацина, ципрофлоксацина, этионамида, протионамида, капреомицина и циклосерина.
Способы лечения
В еще одном аспекте настоящее изобретение относится к способу лечения заболевания, вызываемого микобактериями, который включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В частности, изобретение относится к способу лечения заболевания, вызываемого Mycobacterium tuberculosis, Mycobacterium smegmatis или Mycobacterium fortuitum, который включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В частности, изобретение относится к способу лечения туберкулеза легких, который включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В другом варианте осуществления, изобретение относится к способу лечения туберкулеза суставов и костей, в частности, туберкулеза позвоночника, который включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Заявленный способ может включать введение дополнительного одного или нескольких активных агентов, выбранных из изониазида, рифампицина, стрептомицина, канамицина, амикацина, этамбутола, пиразинамида, офлоксацина, ципрофлоксацина, этионамида, протионамида, капреомицина и циклосерина. Введение дополнительного агента может осуществляться вместе с заявленной композицией или в виде отдельной фармацевтической композиции.
Примеры
Все реагенты были приобретены из коммерческих источников и использовались без дополнительной очистки. Спектры ЯМР регистрировали на спектрометре Bruker Avance-400, 298 K, цифровое разрешение ± 0,01 м.д., с использованием остаточных сигналов растворителя в качестве внутреннего стандарта. Масс-спектрометрические исследования проводили на квадрупольном времяпролетном масс-спектрометре Agilent 6545 Q-TOF LC/MS (Agilent Technologies, США) с источником ионизации электрораспылением в режиме положительных (отрицательных) ионов. Для ввода образца использовалась хроматографическая система Agilent 1290 Infinity II.
Соединения формулы (I) были получены по следующей схеме
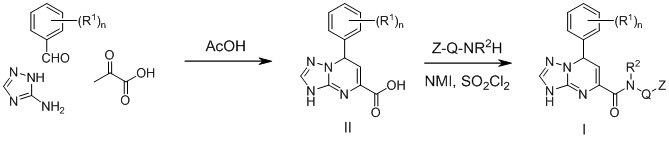
Группы R1, R2, Q и Z, а также переменная n являются такими, как описано выше.
Пример 1. Синтез исходных кислот формулы (II)
Раствор бензальдегида (5 ммоль, 1.0 эквив.), пировиноградной кислоты (5 ммоль, 1.0 эквив.) и 3-амино-1,2,4-триазола (5 ммоль, 1.0 эквив.) в уксусной кислоте (10 мл) нагревали при 90°C в течение 1 часа. Затем реакционную смесь охлаждали и добавляли 100 мл воды. Выпавший осадок отфильтровывали, промывали 100 мл воды и сушили.
7-Фенил-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоновая кислота
Выход 82%; белый порошок. Тпл. 175-177°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.93 (с, 1H, COOH), 7.62 (с, 1H, ArH), 7.34 (м, 3H, ArH), 6.26 (д, J = 4.0 Гц, 1H, NH), 5.79 (д, J = 4.0 Гц, 1H, CH). 13C ЯМР (100 МГц, ДМСО-d6): δ 163.3, 150.3, 149.4, 141.3, 129.2, 128.6, 128.1, 127.1, 106.6, 59.7. ЖХ-МС: 243.2 (M+H).
7-(5-Бром-2-фторфенил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоновая кислота
Выход 74%; светло-желтый порошок. Тпл. 210-215°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 13.61 (с, 1H, COOH), 10.09 (с, 1H, ArH), 7.77-7.63 (м, 2H, ArH), 7.18 (кв д, J = 8.2, 4.2 Гц, 1H, ArH), 6.79 (дд, J = 9.2, 3.1 Гц, 1H, ArH), 6.53 (д, J = 3.8 Гц, 1H, NH), 5.7 (д, J = 3.7 Гц, 1H, CH). 13C ЯМР (100 МГц, ДМСО-d6): δ 163.3, 163.1, 160.8, 150.8, 149.9, 141.3 (д, J = 6.4 Гц), 135.6 (д, J = 8.1 Гц), 129.3, 117.9 (д, J = 22.4 Гц), 116.7 (д, J = 23.7 Гц), 115.8 (д, J = 3.0 Гц), 102.4 (д, J = 179.8 Гц). ЖХ-МС: 340.1 (M+2H).
Пример 2. Синтез заявленных соединений
SO2Cl2 (2 ммоль, 2.0 эквив.) добавили к раствору N-метилимидазола (NMI, 2 ммоль, 2.0 эквив.) в дихлорметане (10 мл) и перемешивали 15 минут. Затем к реакционной смеси добавили карбоновую кислоту формулы (II) (1 ммоль, 1.0 эквив.) и амин Z-Q-NR2H (1.2 ммоль, 1.2 эквив.). Реакционную смесь перемешивали 2 часа при комнатной температуре и затем выливали в воду. Органический слой промывали насыщенным раствором NaHCO3 (10 мл) и насыщенным раствором NaCl (10 мл). Органический слой высушивали над Na2SO4 и концентрировали в вакууме. Полученный остаток промывали дихлорметаном с получением целевого продукта.
N-(4-Фторбензил)-7-фенил-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 1)
Выход 86%; белый порошок. Тпл. 152-155°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.87 (с, 1H, NHCH2), 8.95 (т, J = 6.0 Гц, 1H, ArH), 7.69 (м, 2H, ArH), 7.32 (дд, J = 8.4, 5.6 Гц 2H, ArH), 7.16 (м, 5H, ArH), 6.79 (д, J = 3.8 Гц, 1H, ArH), 6.52 (с, 1H, NH), 5.61 (д, J = 4.1 Гц, 1H, CH), 4.41 (т, J = 5.6 Гц, 2H, CH2). 13C ЯМР (100 МГц, ДМСО-d6): δ 162.4, 150.2, 149.1, 133.7, 130.5, 129.4, 128.7, 115.5, 114.5, 101.9, 59, 55.6, 42.4. ЖХ-МС: 350.1 (M+H).
7-(5-Бром-2-фторфенил)-N-(4-фторбензил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 2)
Выход 80%; белый порошок. Тпл. 176-178°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.92 (с, 1H, NHCH2), 8.97 (т, J = 5.9 Гц, 1H, ArH), 7.77-7.63 (м, 2H, ArH), 7.32 (дд, J = 8.4, 5.5 Гц, 2H, ArH), 7.23-7.08 (м, 3H, ArH), 6.86-6.74 (м, 1H, ArH), 6.53 (д, J = 3.6 Гц, 1H, ArH), 5.63 (д, J = 3.6 Гц, 1H, NH), 4.43-4.27 (т, J = 4.8 Гц, 2H, CH2). 13C ЯМР (100 МГц, ДМСО-d6): δ 163.3, 162.9, 161.6, 160.8, 160.5, 150.7, 149.9, 141.7, 135.5, 131.3, 129.9, 117.9, 116.6, 115.8, 115.4, 98.8, 59.7, 42.4. ЖХ-МС: 446.1 (M+H).
7-(5-Бром-2-фторфенил)-N-(1-фенилэтил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 3)
Выход 78%; белый порошок. Тпл. 172-174°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.93 (с, 1H, NHCH2), 8.74 (т, J = 7.1 Гц, 1H, ArH), 7.72 (м, 1H, ArH), 7.68 (д, J = 2.3 Гц, 2H, ArH), 7.32 (дд, J = 6.6, 4.4 Гц, 5H, ArH), 7.20 (м, 2H, ArH), 6.89-6.77 (м, 1H, ArH), 6.53 (д, J = 3.6 Гц, 1H, ArH),1.42 (дд, J = 7.0, 4.7 Гц, 3H, CH3). 13C ЯМР (100 МГц, ДМСО-d6): δ 163.3, 160.9, 160.7, 150.7, 149.8, 144.6, 141.8, 135.6, 131.3, 128.7, 127.2, 126.5, 117.9, 116.7, 115.9, 98.9, 49.1, 22.3. ЖХ-МС: 442.1 (M+H).
N-Бензил-7-(5-бром-2-фторфенил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 4)
Выход 83%; белый порошок. Тпл. 171-174°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.93 (с, 1H, NHCH2), 8.98 (т, J = 5.9 Гц, 1H, ArH), 7.74-7.61 (м, 2H, ArH), 7.34-7.12 (м, 6H, ArH), 6.79 (дд, J = 9.3, 3.1 Гц, 1H, ArH), 6.52 (д, J = 3.6 Гц, 1H, ArH), 5.64 (д, J = 3.6 Гц, 1H, NH), 4.43-4.27 (т, J = 4.8 Гц, 2H, CH2). 13C ЯМР (100 МГц, ДМСО-d6): δ 163.3, 161.5, 160.9, 150.8, 149.9, 141.8, 139.3, 135.6, 131.3, 129.1, 128.7, 127.9, 127.3, 118, 117.8, 116.8, 116.5, 115.8, 59.7, 43.1. ЖХ-МС: 428.1 (M+H).
7-(5-Бром-2-фторфенил)-N-(проп-2-ин-1-ил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 5)
Выход 75%; белый порошок. Тпл. 162-164°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 9.88 (с, 1H, NHCH2), 8.88 (т, J = 5.6 Гц, 1H, ArH), 7.73 (м, 1H, ArH), 7.68 (с, 1H, ArH), 7.21 (м, 1H, ArH), 6.79 (д, J = 4.3 Гц, 1H, CH), 6.51 (д, J = 3.8 Гц, 1H, NH), 5.61 (д, J = 4.3 Гц, 1H, CH), 3.94 (дд, J = 5.67, 2.5 Гц, 2H, CH2). 13C ЯМР (100 МГц, ДМСО-d6): δ 167.7, 159.6, 150.2, 149.1, 133.7, 129.7, 128.7, 114.5, 102.3, 58.9, 55.6. ЖХ-МС: 376.1 (M+H).
7-(5-Бром-2-фторфенил)-N-этил-N-фенил-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 6)
Выход 77%; белый порошок. Тпл. 177-181°C. 1H ЯМР (400 МГц, ДМСО-d6) δ 10.27 (с, 1H, NH), 7.67-7.52 (м, 2H, ArH), 7.28-7.18 (м, 4H, ArH), 7.18-7.1 (me, ZF), 6,2 (дд, J = 3.7, 1.3 Гц, 1H, ArH), 5.87 (с, 1H, CH), 4.61 (д, J = 3.5 Гц, 1H, CH), 3.86 (м, 1H, CH2CH3), 3.63 (м, 1H, CH2CH3), 1.05 (т, J = 7.1 Гц, 3H, CH3). 13C ЯМР (101 МГц, ДМСО-d6): δ 163.8, 150.7, 149.3, 142.2, 135.1, 132.4, 129.5, 127.6, 117.7, 98.1, 58.9, 44.4, 12.9. ЖХ-МС: 443.1 (M+2H).
7-(5-Бром-2-фторфенил)-N-(4-хлорфенил)-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 7)
Выход 74%; желтый порошок. Тпл. 144-147°C. 1H ЯМР (401 МГц, ДМСО-d6) δ 10.53 (дд, J = 8.1, 3.2 Гц, 1H,), 10.16 (с, 1H, NH), 7.83-7.67 (м, 4H, ArH), 7.44-7.36 (м, 2H, ArH), 7.22 (м, 1H, ArH), 6.91 (дд, J = 9.1, 3.1 Гц, 1H), 6.60 (д, J = 3.7 Гц, 1H), 5.90 (т, J = 3.5 Гц, 1H). 13C ЯМР (101 МГц, ДМСО-d6): δ 160.9, 160.4, 150.8, 149.8, 135.6, 131.6, 129.1, 128.2, 122.5, 100.5, 60.1. ЖХ-МС: 449.1 (M+2H).
7-(5-Бром-2-фторфенил)-N-циклогексил-3,7-дигидро-[1,2,4]триазоло[1,5-a]пиримидин-5-карбоксамид (Соединение 8)
Выход 78%; белый порошок. Тпл. 173-177°C. 1H ЯМР (400 МГц, ДМСО-d6) δ 9.80 (с, 1H, NH), 8.15 (д, J = 7.7 Гц, 1H, ArH), 7.73 (дд, J = 8.8, 53.2 Гц, 1H, ArH), 7.69 (с, 1H, ArH), 7.20 (м, 1H, ArH), 6.80 (дд, J = 9.4, 3.1 Гц, 1H, ArH), 6.52 (д, J = 3.7 Гц, 1H, ArH), 5.62 (д, J = 3.7 Гц, 1H, CH), 3.65 (м, 1H, CH2), 1.85-1.66 (м, 4H, CH2), 1.66-1.52 (м, 1H, CH), 1.34-1.17 (м, 4H, CH2), 1.47-1.01 (м, 1H, CH). 13C ЯМР (101 МГц, ДМСО-d6): δ 163.4, 160.5, 150.8, 149.9, 141.9, 135.6, 131.4, 117.9, 116.7, 115.9, 98.7, 59.7, 49, 32.9, 25.6, 25.3. ЖХ-МС: 421.1 (M+2H).
Пример 3. Определение противотуберкулезной активности
Антимикобактериальную активность целевых соединений in vitro определяли методом резазуринового анализа. Резазурин - это окислительно-восстановительный краситель, который имеет синий цвет в окисленном состоянии и становится розовым при восстановлении в результате роста жизнеспособных клеток. Изучаемые соединения, которые предотвращали изменение цвета красителя, считались ингибирующими в отношении тестируемых штаммов ТБ. Соединения исследовали в отношении M. tuberculosis H37Rv Американской коллекции типовых культур (ATCC) 27294 и нетуберкулезных видов микобактерий, таких как M. smegmatis (MS) ATCC 19420, M. fortuitum ATCC 19542 (MF) и штаммов МЛУ-ТБ. Значения MIC для каждого целевого соединения были определены в отношении тестируемых туберкулезных штаммов. В качестве стандартных препаратов использовали изониазид и рифампицин. Штаммы M. tuberculosis выращивали в бульоне Middlebrook 7H9 (Difco BBL, Sparks, MD, USA), дополненном 10% олеиновой каталазой альбумин-декстрозы (OADC, Becton Dickinson, Sparks, MD, USA). Используя ту же среду, культуру затем разводили до стандарта МакФарланда 2. Затем 50 мл культуры из этого стандартного раствора добавляли к 150 мл свежей среды в 96-луночные микротитровальные планшеты. Изучаемые соединения были приготовлены в виде исходных растворов (2 мг/мл) в N,N-диметилформамиде (ДМФА). Для предварительной оценки соединения тестировались в концентрациях 1, 10 и 100 мкг/мл. Значения MIC определяли в трех параллелях и выражали в виде среднего значения ± SD. Полученные результаты первого этапа приведены в табл. 1.
Таблица 1. Результаты предварительного скрининга соединений 1-8
a Mycobacterium tuberculosis H37Rv; b Mycobacterium smegmatis (ATCC 19420); c Mycobacterium fortuitum (ATCC 19542); d % ингибирования в отношении M. tuberculosis H37Rv.
Затем на втором этапе проводили тестирование в концентрациях 0,3125, 0,625, 1,25, 2,5 и 5 мкг/мл. Контрольные пробирки были заполнены такими же объемами ДМФА без субстрата. После инкубации исходного раствора при 37°C в течение 7 дней в каждую пробирку добавляли по 20 мл 0,01% резазурина в воде (Sigma, St. Louis, MO, USA). Каждый эксперимент проводился в трех параллелях. Значения MIC определяли в трех параллелях и выражали в виде среднего значения ± SD. Результаты второго этапа представлены в табл. 2.
Таблица 2. Результаты второго этапа испытания соединений 1-8
a Mycobacterium tuberculosis H37Rv; b Mycobacterium smegmatis (ATCC 19420); c Mycobacterium fortuitum (ATCC 19542).
Как видно из табл. 1 и 2, все заявленные соединения обладают активностью в отношении Mycobacterium tuberculosis соизмеримой с препаратами сравнения. При этом, соединения 2 и 7 обладают особенно высокой активностью, немного превосходя препарат сравнения изониазид. Особо следует отметить, что все заявленные соединения обладают активностью в отношении МЛУ-ТБ не хуже препаратов сравнения, а соединения 2 и 7 превосходят их по активности в 2-4 раза.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3,7-ДИЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-b][1,2,4,5]ТЕТРАЗИНЫ | 2022 |
|
RU2802300C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТЕТРАЗОЛА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА | 2018 |
|
RU2800930C2 |
| ПРОСТОЕ ЭФИРНОЕ ПРОИЗВОДНОЕ НИКОТИНИЛОВОГО СПИРТА, ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2735541C2 |
| ТРИАЗОЛОПИРИДИНОВОЕ СОЕДИНЕНИЕ И ЕГО ДЕЙСТВИЕ В КАЧЕСТВЕ ИНГИБИТОРА ПРОЛИЛГИДРОКСИЛАЗЫ И ИНДУКТОРА ВЫРАБОТКИ ЭРИТРОПОЭТИНА | 2010 |
|
RU2538963C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2802185C2 |
| СОЕДИНЕНИЯ | 2016 |
|
RU2734877C2 |
| ФЕНИЛАТНОЕ ПРОИЗВОДНОЕ, ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2744975C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2018 |
|
RU2783078C2 |
| МОЛЕКУЛЫ С ОПРЕДЕЛЕННОЙ ПЕСТИЦИДНОЙ АКТИВНОСТЬЮ И ОТНОСЯЩИЕСЯ К НИМ ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ, КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2650498C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2018 |
|
RU2767652C2 |
Изобретение относится к области химии и фармацевтики, а именно к соединению формулы (I), обладающему антимикотической активностью, и к фармацевтической композиции на его основе, для лечения заболевания, вызываемого микобактериями. В общей формуле (I) R1 представляет собой галоген; R2 представляет собой H или С1-6 алкил; Q представляет собой связь или CHR3; R3 представляет собой H или С1-6 алкил; Z представляет собой фенил, необязательно замещенный галогеном, циклогексил или этинил; и n представляет собой целое число от 0 до 2. Использование изобретения позволяет эффективно лечить заболевания, вызванные микобактериями, в том числе туберкулеза. 2 н. и 8 з.п. ф-лы, 2 табл., 3 пр. 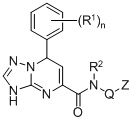 (I)
(I)
1. Соединение формулы (I)
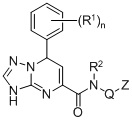
где в формуле (I)
R1 представляет собой галоген;
R2 представляет собой H или С1-6 алкил;
Q представляет собой связь или CHR3;
R3 представляет собой H или С1-6 алкил;
Z представляет собой фенил, необязательно замещенный галогеном, циклогексил или этинил; и
n представляет собой целое число от 0 до 2.
2. Соединение по п.1, отличающееся тем, что
R1 представляет собой фтор или бром;
R2 представляет собой H или этил;
Q представляет собой связь или CHR3;
Z представляет собой фенил, необязательно замещенный хлором или фтором, циклогексил или этинил; и
n представляет собой целое число от 0 до 2.
3. Соединение по п.1, отличающееся тем, что
один R1 представляет собой бром, и второй R1 представляет собой фтор;
R2 представляет собой H;
Q представляет собой CH2;
Z представляет собой фенил, необязательно замещенный фтором.
4. Соединение по п.1, отличающееся тем, что
один R1 представляет собой 4-бром, и второй R1 представляет собой 2-фтор;
R2 представляет собой H;
Q представляет собой CH2;
Z представляет собой 4-фторфенил.
5. Соединение по п.1, отличающееся тем, что
один R1 представляет собой бром, и второй R1 представляет собой фтор;
R2 представляет собой H;
Q представляет собой связь;
Z представляет собой фенил, необязательно замещенный хлором.
6. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:
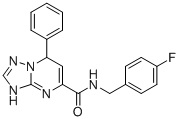
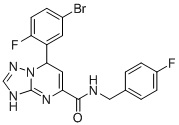
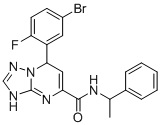
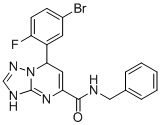
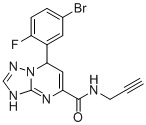
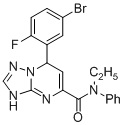
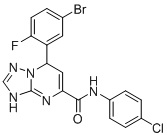
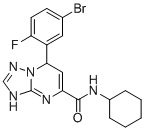
7. Соединение по любому из пп.1-6 для применения в лечении заболевания, вызываемого микобактериями.
8. Фармацевтическая композиция для лечения заболевания, вызываемого микобактериями, содержащая эффективное количество соединения по любому из пп.1-6 и фармацевтически приемлемый носитель, наполнитель или разбавитель.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что микобактерии представляют собой Mycobacterium tuberculosis, Mycobacterium smegmatis или Mycobacterium fortuitum.
10. Фармацевтическая композиция по п.8, отличающаяся тем, что заболевание, вызываемое микобактериями, представляет собой туберкулез легких.
Авторы
Даты
2025-03-18—Публикация
2024-07-04—Подача