ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Настоящее изобретение относится к новым соединениям, к способу их получения, их применению и фармацевтическим композициям, содержащим эти новые соединения. Новые соединения полезны в терапии, в частности, для лечения боли, тревоги и функциональных желудочно-кишечных расстройства
2. Обсуждение релевантной области техники
δ рецептор был идентифицирован как рецептор, играющий роль во многих функциях организма, таких как кровеносная и болевая системы. Поэтому лиганды δ рецептора могут иметь потенциальное применение в качестве анальгетиков и/или антигипертензивных агентов. Было также показано, что лиганды δ рецептора обладают иммуномодулирующей активностью.
В настоящее время точно идентифицированы по меньшей мере три разные популяции опиодных рецепторов (μ, δ и κ), и все три выявлены как в центральной, так и в периферической нервных системах многих видов, включая человека. При активации одного или более этих рецепторов аналгезия наблюдалась в различных животных моделях.
За некоторыми исключениями доступные в настоящее время избирательные опиодные δ лиганды по своей природе являются пептидами и не пригодны для введения системными путями. Одним из примеров непептидного δ-агониста является SNC80 (Bilsky E.J. et al., Journal of Pharmacology and Experimental Therapeutics, 273(1), pp.359-366 (1995)).
Большинство δ-агонистов, которые были идентифицированы в предшествующем уровне техники, имеют большие недостатки, которые заключаются в плохой фармакокинетике и в том, что при введении системными путями они не оказывают болеутоляющего действия. Кроме того, было документально подтверждено, что при системном введении большинство из этих δ-агонистов проявляют значительные судорожные эффекты.
В патенте США №6130222 (Roberts et al.) описаны некоторые δ-агонисты.
Однако потребность в улучшенных δ-агонистах все еще имеется.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если не оговорено особо, в этом описании в основном использована номенклатура в соответствии с примерами и правилами, изложенными в Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F and H, Pergamon Press, Oxford, 1979, которая включена в данное описание изобретения ссылками на названия иллюстративных химических структур и правила наименования химических структур.
Термин "Cm-n" или "Сm-n группа", используемый один или как префикс, относится к любой группе, имеющей от m до n атомов углерода.
Термин "углеводород", используемый один или как суффикс или префикс, относится к любой структуре, содержащей только атомы углерода и водорода, вплоть до 14 атомов углерода.
Термин "углеводородный радикал" или "гидрокарбил", используемый один или как суффикс или префикс, относится к любой структуре, образующейся в результате удаления из углеводорода одного или более атомов водорода.
Термин "алкил", используемый один или как суффикс или префикс, относится к одновалентным углеводородным радикалам с прямой или разветвленной цепью, содержащим от 1 до примерно 12 атомов углерода. "Алкил" возможно может содержать одну или более чем одну ненасыщенную связь углерод-углерод.
Термин "алкилен", используемый один или как суффикс или префикс, относится к двухвалентным углеводородным радикалам с прямой или разветвленной цепью, содержащим от 1 до примерно 12 атомов углерода, которые служат для связывания вместе двух структур.
Термин "алкенил", используемый один или как суффикс или префикс, относится к одновалентному углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну двойную связь углерод-углерод и содержащему от по меньшей мере от 2 до примерно 12 атомов углерода.
Термин "алкинил", используемый один или как суффикс или префикс, относится к одновалентному углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну тройную связь углерод-углерод и содержащему от по меньшей мере от 2 до примерно 12 атомов углерода.
Термин "циклоалкил", используемый один или как суффикс или префикс, относится к одновалентному циклическому углеводородному радикалу, содержащему от по меньшей мере 3 до примерно 12 атомов углерода.
Термин "циклоалкенил", используемый один или как суффикс или префикс, относится к одновалентному циклическому углеводородному радикалу, имеющему по меньшей мере одну двойную связь углерод-углерод и содержащему от по меньшей мере 3 до примерно 12 атомов углерода.
Термин "циклоалкинил", используемый один или как суффикс или префикс, относится к одновалентному циклическому углеводородному радикалу, имеющему по меньшей мере одну тройную связь углерод-углерод и содержащему от примерно 7 до примерно 12 атомов углерода.
Термин "арил", используемый один или как суффикс или префикс, относится к одновалентному углеводородному радикалу, имеющему одно или более чем одно полиненасыщенное углеродное кольцо, имеющее ароматический характер (например, 4n+2 делокализованных электронов) и содержащее от 5 до примерно 14 атомов углерода.
Термин "арилен", используемый один или как суффикс или префикс, относится к двухвалентному углеводородному радикалу, имеющему одно или более чем одно полиненасыщенное углеродное кольцо, имеющее ароматический характер (например, 4n+2 делокализованных электронов) и содержащее от 5 до примерно 14 атомов углерода, который служит для связывания вместе двух структур.
Термин "гетероцикл", используемый один или как суффикс или префикс, относится к кольцевой структуре или молекуле, имеющей один или более многовалентых гетероатомов, независимо выбранных из N, О, Р и S, как часть кольцевой структуры, и содержащей от по меньшей мере 3 и до примерно 20 атомов в кольце(ах). Гетероцикл может быть насыщенным или ненасыщенным, содержащим одну или более двойных связей, и гетероцикл может содержать более одного кольца. Когда гетероцикл содержит более одного кольца, эти кольца могут быть конденсированными или неконденсированными. Конденсированные кольца обычно относятся к по меньшей мере двум кольцам, имеющим два общих атома. Гетероцикл может иметь ароматический характер или может не иметь ароматического характера.
Термин "гетероароматический", используемый один или как суффикс или префикс, относится к кольцевой структуре или молекуле, имеющей один или более многовалентых гетероатомов, независимо выбранных из N, О, Р и S, как часть кольцевой структуры, и содержащей от по меньшей мере 3 и до примерно 20 атомов в кольце(ах), причем эта кольцевая структура или молекула имеет ароматический характер (например, 4n+2 делокализованных электронов).
Термин "гетероциклическая группа", "гетероциклическая группировка", "гетероциклический" или "гетероцикло", используемый один или как суффикс или префикс, относится к радикалу, образующемуся в результате удаления из гетероцикла одного или более атомов водорода.
Термин "гетероциклил", используемый один или как суффикс или префикс, относится к одновалентному радикалу, образующемуся в результате удаления из гетероцикла одного атома водорода.
Термин "гетероциклилен", используемый один или как суффикс или префикс, относится к двухвалентному радикалу, образующемуся в результате удаления из гетероцикла двух атомов водорода, который служит для связывания вместе двух структур.
Термин "гетероарил", используемый один или как суффикс или префикс, относится к гетероциклилу, имеющему ароматический характер.
Термин "гетерциклоалкил", используемый один или как суффикс или префикс, относится к гетероциклилу, который не имеет ароматического характера.
Термин "гетероарилен", используемый один или как суффикс или префикс, относится к гетероциклилену, имеющему ароматический характер.
Термин "гетерциклоалкилен", используемый один или как суффикс или префикс, относится к гетероциклилену, который не имеет ароматического характера.
Термин "шестичленный", используемый как префикс, относится к группе, имеющей кольцо, которое содержит шесть кольцевых атомов.
Термин "пятичленный", используемый как префикс, относится к группе, имеющей кольцо, которое содержит пять кольцевых атомов.
Гетероарил с пятичленным кольцом представляет собой гетероарил с кольцом, имеющим пять кольцевых атомов, где 1, 2 или 3 кольцевых атома независимо выбраны из N, О и S.
Примерами гетероарилов с пятичленными кольцами являются тиенил, фурил, пирролил, имидазолил, тиазолил, оксазолил, пиразолил, изотиазолил, изоксазолил, 1,2,3-триазолил, тетразолил, 1,2,3-тиадиазолил, 1,2,3-оксадиазолил, 1,2,4-триазолил, 1,2,4-тиадиазолил, 1,2,4-оксадиазолил, 1,3,4-триазолил, 1,3,4-тиадиазолил и 1,3,4-оксадиазолил.
Гетероарил с шестичленным кольцом представляет собой гетероарил с кольцом, имеющим шесть кольцевых атомов, где 1, 2 или 3 кольцевых атома независимо выбраны из N, О и S.
Примерами гетероарилов с шестичленными кольцами являются пиридил, пиразинил, пиримидинил, триазинил и пиридазинил.
Термин "замещенный", используемый как префикс, относится к структуре, молекуле или группе, в которой один или более атомов водорода замещены одной или более С1-6углеводородными группами или одной или более химическими группами, содержащими один или более гетероатомов, выбранных из N, О, S, F, Cl, Br, I и Р. Примерами химических групп, содержащих один или более гетероатомов, являются -NO2, -OR, -Cl, -Br, -I, -F, -CF3, -C(=O)R, -С(=O)ОН, -NH2, -SH, -NHR, -NR2, -SR, -SO3Н, -SO2R, -S(=O)R, -CN, -ОН, -C(=O)OR, -C(=O)NR2, -NRC(=O)R, оксо (=O), имино (=NR), тио (=S) и оксимино (=N-OR), где каждый "R" представляет собой С1-6гидрокарбил. Например, замещенный фенил может относиться к нитрофенилу, метоксифенилу, хлорфенилу, аминофенилу и т.д., причем группы нитро, метокси, хлоро и амино могут замещать любой подходящий водород на фенильном кольце.
Термин "замещенный", используемый как суффикс первой структуры, молекулы или группы с последующим одним или более чем одним названием химической группы, относится ко второй структуре, молекуле или группе, которая представляет собой результат замещения одного или более атомов водорода первой структуры, молекулы или группы одной или более чем одной названной химической группой. Например "фенил, замещенный нитро" относится к нитрофенилу.
Гетероцикл включает, например, моноциклические гетероциклы, такие как азиридин, оксиран, тииран, азетидин, оксетан, тиетан, пирролидин, пирролин, имидазолидин, пиразолидин, пиразолин, диоксолан, сульфолан, 2,3-дигидрофуран, 2,5-дигидрофуран, тетрагидрофуран, тиофан, пиперидин, 1,2,3,6-тетрагидропиридин, пиперазин, морфолин, тиоморфолин, пиран, тиопиран, 2,3-дигидропиран, тетрагидропиран, 1,4-дигидропиридин, 1,4-диоксан, 1,3-диоксан, диоксан, гомопиперидин, 2,3,4,7-тетрагидро-1H-азепин, гомопиперазин, 1,3-диоксепан, 4,7-дигидро-1,3-диоксепин и гексаметиленоксид.
Кроме того, гетероцикл включает ароматические гетероциклы, например пиридин, пиразин, пиримидин, пиридазин, тиофен, фуран, фуразан, пиррол, имидазол, тиазол, оксазол, пиразол, изотиазол, изоксазол, 1,2,3-триазол, тетразол, 1,2,3-тиадиазол, 1,2,3-оксадиазол, 1,2,4-триазол, 1,2,4-тиадиазол, 1,2,4-оксадиазол, 1,3,4-триазол, 1,3,4-тиадиазол и 1,3,4-оксадиазол.
Дополнительно, термин "гетероцикл" охватывает полициклические гетероциклы, например индол, индолин, изоиндолин, хинолин, тетрагидрохинолин, изохинолин, тетрагидроизохинолин, 1,4-бензодиоксан, кумарин, дигидрокумарин, бензофуран, 2,3-дигидробензофуран, изобензофуран, хромен, хроман, изохроман, ксантен, феноксантиин, тиантрен, индолизин, изоиндол, индазол, пурин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин, фенантридин, перимидин, фенантролин, феназин, фенотиазин, феноксазин, 1,2-бензизоксазол, бензотиофен, бензоксазол, бензтиазол, бензимидазол, бензтриазол, тиоксантин, карбазол, карболин, акридин, пиролизидин и хинолизидин.
В добавление к полициклическим гетероциклам, указанным выше, гетероцикл включает полициклические гетероциклы, в которых кольцевое конденсирование между двумя или более кольцами включает более одной связи, общей для обоих колец, и более двух атомов, общих для обоих колец. Примеры таких мостиковых гетероциклов включают хинуклидин, диазабицикло[2.2.1]гептан и 7-оксабицикло[2.2.1]гептан.
Гетероциклил включает, например, моноциклические гетероциклилы, такие как азиридинил, оксиранил, тииранил, азетидинил, оксетанил, тиетанил, пирролидинил, пирролинил, имидазолидинил, пиразолидинил, пиразолинил, диоксоланил, сульфоланил, 2,3-дигидрофуранил, 2,5-дигидрофуранил, тетрагидрофуранил, тиофанил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, морфолинил, тиоморфолинил, пиранил, тиопиранил, 2,3-дигидропиранил, тетрагидропиранил, 1,4-дигидропиридинил, 1,4-диоксанил, 1,3-диоксанил, диоксанил, гомопиперидинил, 2,3,4,7-тетрагидро-1Н-азепинил, гомопиперазинил, 1,3-диоксепанил, 4,7-дигидро-1,3-диоксепинил и гексаметиленоксидил.
Кроме того, гетероциклил включает ароматические гетероциклилы или гетероарилы, например пиридинил, пиразинил, пиримидинил, пиридазинил, тиенил, фурил, фуразанил, пирролил, имидазолил, тиазолил, оксазолил, пиразолил, изотиазолил, изоксазолил, 1,2,3-триазолил, тетразолил, 1,2,3-тиадиазолил, 1,2,3-оксадиазолил, 1,2,4-триазолил, 1,2,4-тиадиазолил, 1,2,4-оксадиазолил, 1,3,4-триазолил, 1,3,4-тиадиазолил и 1,3,4-оксадиазолил.
Дополнительно, термин "гетероциклил" охватывает полициклические гетероциклилы (в том числе как ароматические, так и неароматические), например индолил, индолинил, изоиндолинил, хинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, 1,4-бензодиоксанил, кумаринил, дигидрокумаринил, бензофуранил, 2,3-дигидробензофуранил, изобензофуранил, хроменил, хроманил, изохроманил, ксантенил, феноксантиинил, тиантренил, индолизинил, изоиндолил, индазолил, пуринил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, фенантридинил, перимидинил, фенантролинил, феназинил, фенотиазинил, феноксазинил, 1,2-бензизоксазолил, бензотиофенил, бензоксазолил, бензтиазолил, бензимидазолил, бензтриазолил, тиоксантинил, карбазолил, карболинил, акридинил, пиролизидинил и хинолизидинил.
В добавление к полициклическим гетероциклилам, указанным выше, гетероциклил включает полициклические гетероциклилы, в которых кольцевое конденсирование между двумя или более кольцами включает более одной связи, общей для обоих колец, и более двух атомов, общих для обоих колец. Примеры таких мостиковых гетероциклилов включают хинуклидинил, диазабицикло[2.2.1]гептил и 7-оксабицикло[2.2.1]гептил.
Термин "алкокси", используемый один или как суффикс или префикс, относится к радикалам общей формулы -O-R, где R выбран из углеводородных радикалов. Примерами алкокси являются метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, изобутокси, циклопропилметокси, аллилокси и пропаргилокси.
Термин "амин" или "амино", используемый один или как суффикс или префикс, относится к радикалам общей формулы -NRR', где R и R' независимо выбраны из водорода или углеводородного радикала.
Галоген включает фтор, хлор, бром и йод.
Термин "галогенированный", используемый один или как суффикс или префикс, означает, что один или более атомов водорода на этой группе замещены одним или более галогенами.
Термин "КТ" или "кт" означает комнатную температуру.
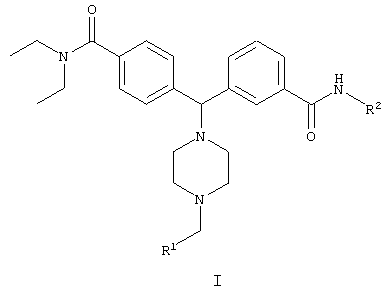
В одном аспекте изобретения предложено соединение формулы I, его энантиомеры, его диастереомеры и его фармацевтически приемлемые соли:
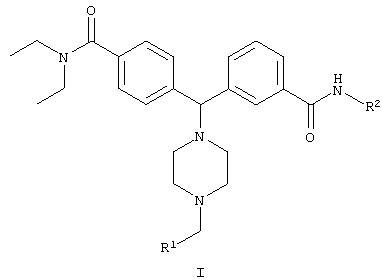
где
R1 представляет собой арил, гетероарил, замещенный арил или замещенный гетероарил; и
R2 представляет собой водород, возможно замещенный С1-12алкил, возможно замещенный С6-12 или возможно замещенный С2-12гетероциклил.
В одном воплощении настоящего изобретения предложено соединение формулы I, где
R1 выбран из фенила, пиридила, тиенила, фурила, имидазолила, триазолила, пирролила, тиазолила и N-оксидо-пиридила, возможно замещенных одной или более группами, выбранными из С1-6алкила, галогенированного С1-6алкила, -NO2, -CF3, С1-6алкокси, хлоро, фторо, бромо и йодо; и
R2 представляет собой водород или метил.
В другом воплощении настоящего изобретения предложено соединение формулы I, где
R1 выбран из фенила, пиридила, тиенила, фурила, имидазолила, пирролила и тиазолила, возможно замещенных одной или более группами, выбранными из С1-6алкила, галогенированного C1-6алкила, -NO2, -CF3, C1-6алкокси, хлоро, фторо, бромо и йодо; и
R2 представляет собой водород или метил.
В еще одном воплощении настоящего изобретения предложено соединение формулы I, где
R1 выбран из фенила, пиридила, тиенила, фурила, имидазолила, пирролила и тиазолила; и
R2 представляет собой водород или метил.
Понятно, что, когда соединения по настоящему изобретению содержат один или более хиральных центров, соединения по изобретению могут существовать в энантиомерной или диастереомерной формах или в виде рацемической смеси и могут быть выделены в таких формах. Настоящее изобретение включает любые возможные энантиомеры, диастереомеры, рацематы или их смеси соединения формулы I. Оптически активные формы соединения по изобретению могут быть получены, например, хиральным хроматографическим разделением рацемата, синтезом из оптически активных исходных веществ или асимметрическим синтезом по методикам, описанным ниже.
Ясно также, что некоторые соединения по настоящему изобретению могут существовать в виде геометрических изомеров, например Е и Z изомеров алкенов. Настоящее изобретение охватывает любой геометрический изомер соединения формулы I. Следует также иметь в виду, что настоящее изобретение охватывает таутомеры соединений формулы I.
Понятно также, что некоторые соединения по настоящему изобретению могут существовать в сольватированных, например гидратированных, формах, а также в несольватированных формах. Следует иметь в виду, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I.
В объем изобретения входят также соли соединений формулы I. Как правило, фармацевтически приемлемые соли соединений по настоящему изобретению могут быть получены с использованием стандартных методик, общеизвестных в данной области техники, например, путем взаимодействия достаточно основного соединения, например алкиламина, с подходящей кислотой, например HCl или уксусной кислотой, с получением физиологически приемлемого аниона. Также возможно получить соответствующую соль щелочного металла (например, натрия, калия или лития) или щелочно-земельного металла (например, кальция) путем обработки соединения по настоящему изобретению, имеющего соответствующий кислотный протон, такого как карбоновая кислота или фенол, одним эквивалентом гидроксида или алкоксида (например, этоксида или метоксида) щелочного металла или щелочно-земельного металла или соответствующим основным органическим амином (например, холином или меглумином) в водной среде с последующей очисткой стандартными методами.
В одном воплощении соединение формулы I, указанной выше, можно превратить в фармацевтически приемлемую соль или ее сольват, в частности соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или п-толуолсульфонат.
Новые соединения по настоящему изобретению полезны в терапии, в частности, для лечения различных болевых состояний, например хронической боли, невропатической боли, острой боли, раковой боли, боли, вызванной ревматоидным артритом, мигренью, висцеральной боли и т.д. Однако этот список не следует интерпретировать как исчерпывающий.
Соединения по изобретению полезны в качестве иммуномодуляторов, в частности, при аутоиммунных заболеваниях, таких как артрит, при пересадке кожи, трансплантации органов или подобных хирургических вмешательствах, при коллагеновых заболеваниях, различных аллергиях, для применения в качестве противоопухолевых агентов и противовирусных агентов.
Соединения по изобретению полезны при болезненных состояниях, при которых имеет место или в которые вовлечена дегенерация или дисфункция опиоидных рецепторов. Возможно также применение меченных изотопами вариантов соединений по изобретению в диагностических методах и методах визуализации, например в позитронной эмиссионной томографии (ПЭТ).
Соединения по изобретению полезны для лечения диареи, депрессии, тревоги и расстройств, связанных со стрессом, например расстройств, связанных с посттравматическим стрессом, панического расстройства, генерализованного тревожного расстройства, социофобии или обсессивно-компульсивного расстройства, недержания мочи, преждевременной эякуляции, различных психических заболеваний, кашля, отека легких, различных желудочно-кишечных расстройств, например запора, функциональных желудочно-кишечных расстройств, например синдрома раздраженного кишечника и функциональной диспепсии, болезни Паркинсона и других нарушений моторики, травматического повреждения мозга, инсульта, для кардиозащиты после инфаркта миокарда, для лечения повреждения спинного мозга и наркомании, включая лечение злоупотребления алкоголем, никотином, опиоидами и другими наркотическими веществами, и для лечения расстройств симпатической нервной системы, например гипертензии.
Соединения по изобретению полезны в качестве болеутоляющего агента для применения во время общего наркоза и контролируемой анестезии. Комбинации агентов с различными свойствами часто применяют для достижения баланса эффектов, необходимых для поддержания состояния анестезии (например, амнезия, аналгезия, мышечная релаксация и седация). В такую комбинацию включают ингаляционные анестетики, снотворные, анксиолитики, нейромышечные блокаторы и опиоиды.
В объем изобретения также входит применение любых соединений формулы I, указанной выше, для изготовления лекарства для лечения любых состояний, рассмотренных выше.
Еще одним аспектом изобретения является способ лечения субъекта, страдающего любым из состояний, рассмотренных выше, в соответствии с которым пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы I, указанной выше.
Таким образом, согласно изобретению предложено соединение формулы 1 или его фармацевтически приемлемая соль или сольват, как определено выше, для применения в терапии.
В еще одном аспекте настоящего изобретения предложено применение соединения формулы I или его фармацевтически приемлемой соли или сольвата, как определено выше, в изготовлении лекарства для применения в терапии.
В контексте настоящего описания изобретения термин "лечение" (или "терапия") также включает в себя "профилактику", если нет конкретных указаний обратного. Термины "терапевтический" и "терапевтически" следует понимать соответственно. Термин "лечение" в контексте настоящего изобретения также включает в себя введение эффективного количества соединения по настоящему изобретению для смягчения либо ранее существовавшего болезненного состояния, острого или хронического, либо рекуррентного состояния. Это определение также охватывает профилактическую терапию для предупреждения рекуррентных состояний и непрерывную терапию хронических расстройств.
Соединения по настоящему изобретению полезны в терапии, в частности, для лечения различных болевых состояний, включая хроническую боль, невропатическую боль, острую боль, боль в спине, раковую боль и висцеральную боль, но не ограничиваясь ими.
При применении для лечения теплокровного животного, например человека, соединение по изобретению можно вводить в форме стандартной фармацевтической композиции любым путем, в том числе перорально, внутримышечно, подкожно, местно, интраназально, интраперитонеально, интраторакально, внутривенно, эпидурально, инратекально, интрацеребровентрикулярно и инъекцией в суставы.
В одном воплощении изобретения путь введения может быть пероральным, внутривенным или внутримышечным.
Дозировка будет зависеть от пути введения, тяжести заболевания, возраста и массы пациента и других факторов, обычно учитываемых лечащим врачом при определении индивидуального режима и уровня дозировки, наиболее подходящих для конкретного пациента.
Для получения фармацевтических композиций из соединений по данному изобретению инертные, фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердой форме включают порошки, таблетки, дисперсные гранулы, капсулы, облатки и суппозитории.
Твердый носитель может быть одним веществом или веществами более одного, которые могут также служить разбавителями, корригентами, солюбилизаторами, смазывающими агентами, суспендирующими агентами, связующими или разрыхлителями для таблеток; он также может быть инкапсулирующим материалом.
В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, имеющим необходимые связующие свойства, в подходящих соотношениях и спрессован в желаемую форму желаемого размера.
Для приготовления суппозиторных композиций легкоплавкий воск, например смесь глицеридов жирных кислот или масла какао, сначала расплавляют и в нем диспергируют активный компонент, например, перемешиванием. Затем расплавленную гомогенную смесь выливают в формы нужного размера и оставляют стоять до охлаждения и затвердевания.
Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, легкоплавкий воск, масло какао и тому подобное.
Подразумевается также, что термин "композиция" включает в себя препарат из активного компонента с инкапсулирующим материалом в качестве носителя, обеспечивающий получение капсулы, в которой активный компонент (с другими носителями или без них) окружен носителем, который таким образом находится совместно с ним. Аналогичным образом охвачены облатки.
Таблетки, порошки, облатки и капсулы можно использовать в качестве твердых лекарственных форм, пригодных для перорального введения.
Композиции в жидкой форме включают растворы, суспензии и эмульсии. Например, стерильные водные и водно-пропиленгликолевые растворы активных соединений могут служить жидкими препаратами, пригодными для парентерального введения. Жидкие композиции также могут быть приготовлены в виде раствора в водно-полиэтиленгликолевом растворе.
Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления, если требуется, подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии для перорального применения могут быть изготовлены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как натуральные или синтетические камеди, смолы, метилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие известные в области приготовления фармацевтических препаратов суспендирующие агенты.
В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.% (массовый процент), более предпочтительно от 0,10 до 50 мас.% соединения по изобретению, причем все массовые процентные содержания рассчитаны по отношению к общей массе композиции.
Терапевтически эффективное количество для практики настоящего изобретения может быть определено с использованием известных критериев, включающих возраст, массу и ответную реакцию индивидуального пациента, и интерпретировано в контексте заболевания, которое лечат или которое предупреждают, специалистом в данной области.
В объем изобретения входит применение любого соединения формулы I, как определено выше, для изготовления лекарства.
В объем изобретения также входит применение любого соединения формулы I для изготовления лекарства для терапии боли.
Дополнительно предложено применение любого соединения формулы I для изготовления лекарства для терапии различных болевых состояний, включая хроническую боль, невропатическую боль, острую боль, боль в спине, раковую боль и висцеральную боль, но не ограничиваясь ими.
Еще одним аспектом изобретения является способ лечения субъекта, страдающего любым из состояний, рассмотренных выше, в соответствии с которым пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы I, указанной выше.
Дополнительно предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем.
В частности, предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем для терапии, в частности для терапии боли.
Предложена также фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем для применения при любом из состояний, рассмотренных выше.
В еще одном аспекте настоящего изобретения предложен способ получения соединения формулы I.
В одном воплощении изобретения предложен способ получения соединения формулы II
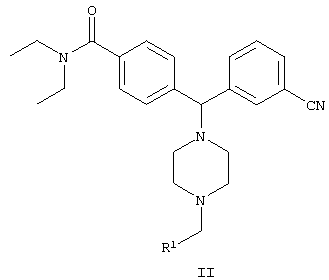
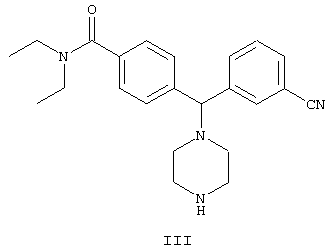
включающий стадию взаимодействия соединения формулы III
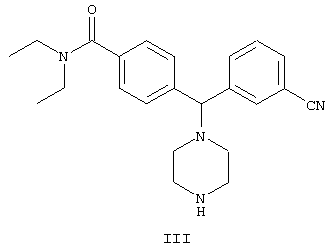
с R1-CHO с образованием соединения формулы II,
где
R1 представляет собой арил, гетероарил, замещенный арил или замещенный гетероарил.
В другом воплощении изобретения предложен способ получения соединения формулы IV
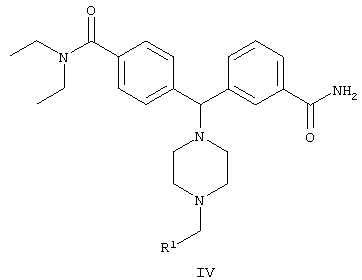
включающий стадию взаимодействия соединения формулы II

с гидроксидом щелочного металла в неводном растворителе с образованием соединения формулы IV:
где
R1 представляет собой арил, гетероарил, замещенный арил или замещенный гетероарил.
В частности, соединения по настоящему изобретению могут быть получены в соответствии с путями синтеза, представленными на Схемах 1 и 2.
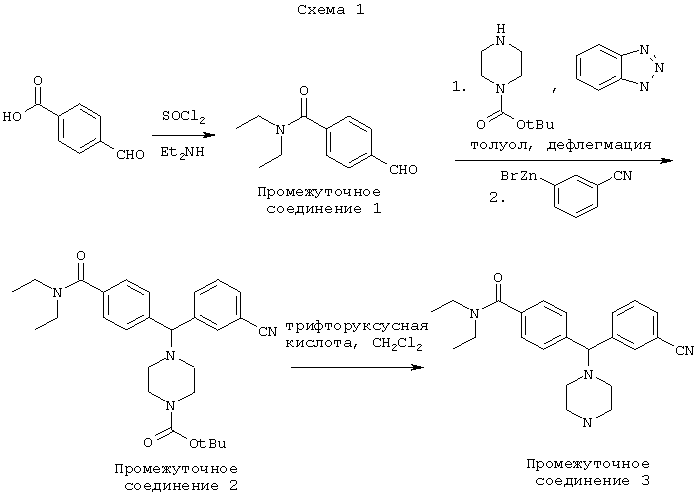
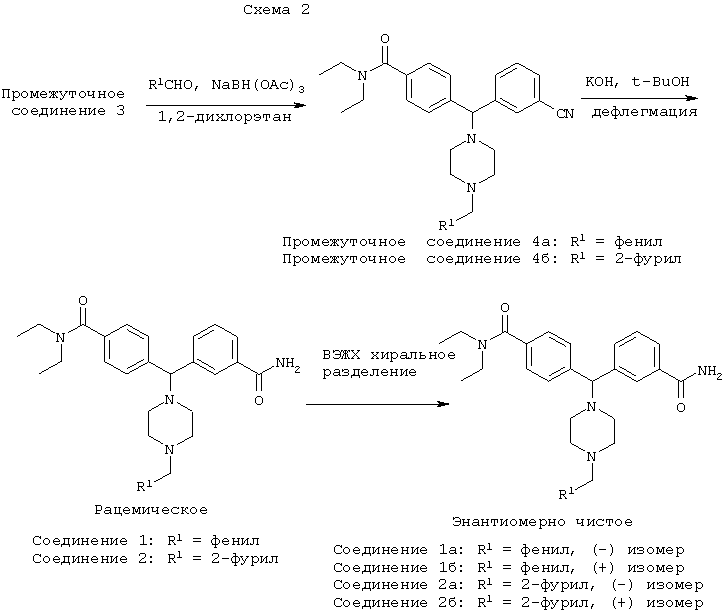
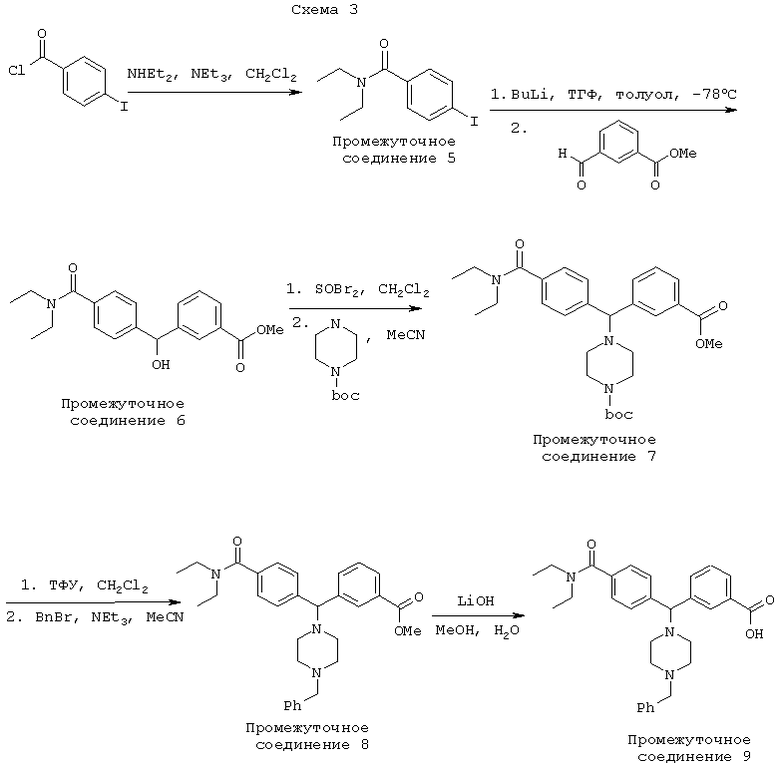
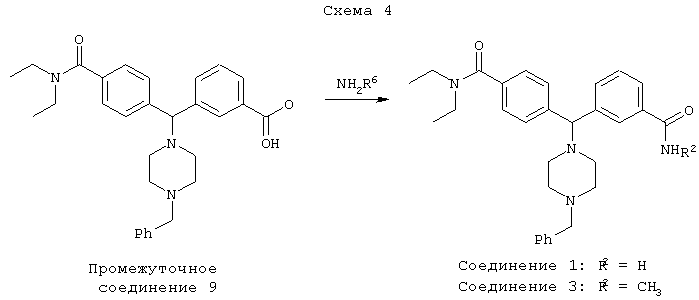
В другом воплощении соединения по настоящему изобретению могут быть получены в соответствии с путями синтеза, представленными на Схемах 3 и 4.
БИОЛОГИЧЕСКАЯ ОЦЕНКА
Установлено, что соединения по изобретению активны в отношении δ рецепторов у теплокровного животного, например человека. В частности, установлено, что соединения по изобретению являются эффективными лигандами δ рецепторов. Приведенные ниже in vitro анализы демонстрируют эти неожиданные действия, в частности активность и эффективность как агонистов, продемонстрированную в функциональном анализе на мозге крысы и/или функциональном анализе δ рецепторов человека (низкие). Эта особенность может быть связана с активностью in vivo и возможно не коррелирует в линейной зависимости с аффинностью связывания. В этих in vitro анализах соединение тестируют на их активность в отношении δ рецепторов и получают IC50 для определения селективной активности конкретного соединения по отношению к δ рецепторам. В настоящем контексте IC50 относится к концентрации соединения, при которой наблюдается 50% вытеснение стандартного радиоактивного лиганда δ рецептора.
Активности соединения в отношении κ и μ рецепторов также оценивают в аналогичном анализе.
Модель in vitro
Культура клеток
Клетки человека 293S, экспрессирующие клонированные κ, δ и μ рецепторы и обладающие устойчивостью к неомицину, культивируют в суспензии при 37°С и 5% CO2 во встряхиваемых колбах, содержащих DMEM (модифицированная по Дульбекко среда Игла) без кальция, 10% FBS (сыворотка плода коровы), 5% BCS (телячья сыворотка), 0,1% Pluronic F-68 и 600 мкг/мл генетицина.
Мозги крыс взвешивают и промывают в ледяном PBS (фосфатно-буферный раствор), содержащем 2,5 мМ EDTA (этилендиаминтетрауксусная кислота), рН 7,4). Мозги гомогенизируют с политроном в течение 30 с (крыса) в ледяном лизирующем буфере (50 мМ Tris (2-амино-2-(гидроксиметил)-1,3-пропандиоламинометан), рН 7,0, 2,5 мМ EDTA с добавлением фенилметилсульфонилфторида (PMSF) непосредственно перед использованием до 0,5 мМ из 0,5 М исходного раствора в смеси DMSO (диметилсульфоксид):этанол).
Получение мембран
Клетки осаждают центрифугированием и ресуспендируют в лизирующем буфере (50 мМ Tris, pH 7,0, 2,5 мМ EDTA с добавлением PMSF непосредственно перед использованием до 0,1 мМ из 0,1 М исходного раствора в этаноле), инкубируют на льду в течение 15 минут, затем гомогенизируют с политроном в течение 30 с. Суспензию центрифугируют при 1000 g (max) в течение 10 минут при 4°С. Супернатант оставляют на льду и осадки после центрифугирования ресуспендируют и центрифугируют как в предыдущий раз. Супернатанты от обоих центрифугирований объединяют и центрифугируют при 46000 g (max) в течение 30 минут. Осадки после центрифугирования ресуспендируют в холодном Tris буфере (50 мМ Tris/HCl, pH 7,0) и центрифугируют снова. Конечные осадки после центрифугирования ресуспендируют в буфере для мембран (50 мМ Tris, 0,32 М сахароза, pH 7,0). Аликвоты (1 мл) в полипропиленовых пробирках замораживают в сухом льду/этаноле и хранят при -70°С до использования. Концентрации белка определяют модифицированным анализом Лоури с додецилсульфатом натрия.
Анализы связывания
Мембраны размораживают при 37°С, охлаждают на льду, пропускают 3 раза через иглу номер 25 и разводят в буфере для связывания (50 мМ Tris, 3 мМ MgCl2, 1 мг/мл BSA (бычий сывороточный альбумин Sigma A-7888), pH 7,4, который хранят при 4°С после фильтрации через 0,22 m фильтр и к которому непосредственно перед использованием добавляют 5 мкг/мл апротинина, 10 мкМ бестатин, 10 мкМ дипротин А, без DTT (дитиотрейтол)). Аликвоты по 100 мкл добавляют в охлажденные льдом полипропиленовые пробирки 12×75 мм, содержащие по 100 мкл соответствующего радиоактивного лиганда и по 100 мкл тестируемого соединения в различных концентрациях. Общее связывание (ТВ) и неспецифическое (NS) связывание определяют в отсутствие и в присутствии 10 мкМ налоксона соответственно. Пробирки встряхивают на вортексе и инкубируют при 25°С в течение 60-75 минут, после чего содержимое быстро фильтруют под вакуумом и промывают примерно 12 мл/пробирка ледяного промывочного буфера (50 мМ Tris, pH 7,0, 3 мМ MgCl2) через фильтры GF/B (Whatman), предварительно вымоченные в течение по меньшей мере 2 часов в 0,1% полиэтиленимине. Радиоактивность (dpm (число распадов в минуту)), аккумулированную на фильтрах, измеряют бета-счетчиком после вымачивания фильтров по меньшей мере в течение 12 часов в мини-виалах, содержащих 6-7 мл сцинтилляционной жидкости. Если анализ выполняют в 96-луночных планшетах с глубокими лунками, фильтрация идет через единые фильтры для 96-луночных планшетов, которые промывают 3 раза 1 мл промывочного буфера и сушат в термостате при 55°С в течение 2 часов. Пластинки фильтров считывают в счетчике TopCount (Packard) после добавления 50 мкл на лунку сцинтилляционной жидкости MS-20.
Функциональные анализы
Активность соединений как агонистов измеряют путем определения степени, до которой комплекс рецептора с соединениями активирует связывание GTP (гуанидинтрифосфат) с G-белками, с которыми сопряжены рецепторы. В анализе связывания GTP GTP[γ]35S объединяют с тестируемыми соединениями и мембранами из HEK-293S клеток, экспрессирующих клонированные опиоидные рецепторы человека, или из гомогенизированного мозга крысы или мыши. Агонисты стимулируют связывание GTP[γ]35S с этими мембранами. Величины ЕС50 и Emax соединений определяют по кривым зависимости доза-ответ. Сдвиги вправо кривой зависимости доза-ответ дельта-антагонистом налтриндолом выполняли для проверки того, что агонистическая активность опосредована дельта рецепторами. Для функциональных анализов δ рецепторов человека ЕС50 (низкую) измеряют, когда δ рецепторы человека, используемые в анализе, экспрессировались при более низких уровнях по сравнению с δ рецепторами человека, используемыми в анализе EC50 (высокой). Величины Emax определяли по отношению к стандартному δ агонисту SNC80, т.е. Emax выше 100% - это соединение, которое имеет бульшую эффективность, чем SNC80.
Методика для GTP из мозга крысы
Мембраны мозга крысы размораживают при 37°С, пропускают 3 раза через тупоконечную иглу номер 25 и разводят в буфере для связывания GTPγS (50 мМ Hepes, 20 мМ NaOH, 100 мМ NaCl, 1 мМ EDTA, 5 мМ MgCl2, pH 7,4, добавить свежим: 1 мМ DTT, 0,1% BSA). 120 мкМ GDP (гуанидиндифосфат) в конце добавляют к разведениям мембран. EC50 и Emax соединений оценивают по кривым зависимости доза-ответ, построенным по 10 точкам с использованием соответствующего количества мембранного белка (20 мкг на лунку) и 100000-130000 dpm GTPγ35S на лунку (0,11-0,14 нМ). Исходное связывание и максимальное стимулированное связывание определяют в отсутствие и в присутствии 3 мкМ SNC-80.
Анализ данных
Специфическое связывание (SB) рассчитывали как TB-NS (общее связывание-неспецифическое связывание) и SB в присутствии различных тестируемых соединений выражали в виде процента от контрольного SB. Величины IC50 и коэффициент Хилла (nН) для лигандов в вытеснении специфически связанного радиоактивного лиганда рассчитывали из логит-графиков или с помощью программ построения кривых по точкам, например, Ligand, GraphPad Prism, Sigma Plot Receptor Fit. Величины Кi рассчитывали по уравнению Ченга-Пруссова. Приведены средние значения ± S.E.M. (среднеквадратическая ошибка) для IC50, Кi и nН для протестированных лигандов в по меньшей мере трех кривых вытеснения. Биологическая активность соединений и выбранных промежуточных соединений по настоящему изобретению указана в табл.1 и 2.
Эксперименты по насыщению рецептора
Значения Кδ для радиолиганда определяют путем выполнения анализов связывания на клеточных мембранах с соответствующими радиолигандами при концентрациях в 0,2-5 раз выше расчетной Kδ (вплоть до 10 раз, если количества требуемого радиолиганда допустимы). Специфическое связывание с радиолигандом выражают в пмоль/мг мембранного белка. Значения Кδ и Вmax из отдельных экспериментов получают по нелинейным подгонкам графиков зависимости специфически связанного (В) против нМ свободного (F) радиолиганда из отдельного эксперимента согласно односайтовой модели.
Определение механоаллодинии с использованием тестирования фон Фрея
Тестирование проводят между 08:00 и 16:00 ч, используя метод, описанный Chaplan et al. (1994). Крыс размещают в плексигласовых клетках на полу из проволочной сетки, которая дает доступ к лапе, и оставляют адаптироваться в течение 10-15 минут. Тестируемой областью является средняя подошвенная часть левой задней лапы, избегая менее чувствительных подушечек стопы. До лапы дотрагиваются поочередно 8 волосками фон Фрея с логарифмически возрастающей жесткостью (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51 и 15,14 грамма; Stoelting, III, США). Волосок фон Фрея прикладывают из-под сетчатого пола перпендикулярно поверхности подошвы с силой, достаточной, чтобы вызвать небольшой прогиб относительно лапы, и держат в течение примерно 6-8 секунд. Положительную ответную реакцию отмечают, если лапка резко отдергивается. Также рассматривают как положительную ответную реакцию вздрагивание сразу после удаления нити. Ходьбу рассматривают как неоднозначную реакцию и в таких случаях воздействие раздражителем повторяют.
Протокол тестирования
Животных тестируют в послеоперационный день 1 для группы, обработанной FCA (полный адьювант Фрейда). 50% порог отдергивания определяют, используя реверсивный метод Диксона (1980). Тестирование начинают с волоска 2,04 г. Раздражителями всегда воздействуют последовательно, либо по восходящей, либо по нисходящей. В отсутствие реакции отдергивания лапки на первоначально выбранную нить воздействуют более сильным раздражителем; в случае отдергивания лапки выбирают следующий более слабый раздражитель. Вычисление оптимального порога этим методом требует 6 ответных реакций в непосредственной близости от 50% порога, и подсчет этих 6 ответных реакций начинают, когда происходит первое изменение ответной реакции, например когда первый порог пройден. В случаях, когда пороги не попадают в диапазон раздражителей, присваивают соответственно значения 15,14 (нормальная чувствительность) или 0,41 (максимально аллодинная). Полученный паттерн положительных и отрицательных ответных реакций сводят в таблицу, используя условные обозначения: Х - отдергивания нет, О - отдергивание, и 50% порог отдергивания интерполируют, используя формулу
50% г порог =10(Xf+κδ)/10000
где Xf - значение при использовании последнего волоска фон Фрея (логарифмические единицы); κ - табличное значение (из Chaplan et al., (1994)) для паттерна положительных/отрицательных ответных реакций; и δ - средняя разница между раздражителями (логарифмические единицы). Здесь δ=0,224.
Пороги фон Фрея переводят в проценты от максимально возможного эффекта (% МРЕ) согласно Chaplan et al. 1994. Используют следующее уравнение для расчета % МРЕ:
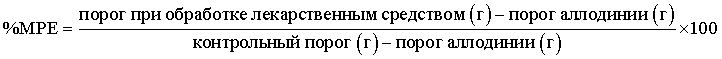
Введение тестируемого вещества
Перед тестированием по фон Фрею крысам инъецируют (подкожно, интраперитонеально, внутивенно или перорально) тестируемое вещество, при этом время между введением тестируемого соединения и тестированием по фон Фрею варьируют в зависимости от природы тестируемого соединения.
Тест на корчи
При интраперитонеальном введении мышам уксусная кислота приводит к абдоминальным сокращениям. Затем их тела вытягиваются характерным образом. При введении болеутоляющих лекарственных средств данное описанное движение наблюдается менее часто, и тогда лекарственное средство выбирают как потенциально хороший кандидат.
Рефлекс корчи рассматривают как полный и типичный только в том случае, когда имеет место следующее: животное не находится в движении; нижняя часть спины немного вдавлена; видны подошвы обеих лап. В этом анализе соединения по настоящему изобретению демонстрируют значительное ингибирование реакций-корч после перорального введения 1-100 мкмоль/кг.
(1) Приготовление растворов
Уксусная кислота (АсОН): 120 мкл уксусной кислоты добавляют к 19,88 мл дистиллированной воды с получением конечного объема 20 мл с конечной концентрацией 0,6% АсОН. Раствор затем перемешивают (на вортексе), после чего он готов для инъекции.
Соединение (лекарственное средство): каждое соединение получают и растворяют в наиболее подходящем носителе по стандартным методикам.
(2) Введение растворов
Соединение (лекарственное средство) вводят перорально, интраперитонеально (и.п.), подкожно (п.к.) или внутривенно (в.в.) из расчета 10 мл/кг (с учетом средней массы тела мышей) за 20, 30 или 40 минут (согласно классу соединения и его характеристикам) до тестирования. Когда доставку соединения осуществляют центрально: интравентрикулярно (и.в.к.) или интратекально (и.т.), вводят объем 5 мл.
АсОН вводят интраперитонеально (и.п.) в два места из расчета 10 мл/кг (с учетом средней массы тела мышей) непосредственно перед тестированием.
(3) Тестирование
Животное (мышь) наблюдают в течение периода времени 20 минут, и количество эпизодов (рефлекс корчи) отмечают и компилируют в конце эксперимента. Мышей держат в индивидуальных клетках типа "обувная коробка" с контактной подстилкой. Обычно одновременно наблюдают 4 мыши: одна контрольная и три получивших дозу лекарственного средства.
Эффективность в отношении тревожных или тревога-подобных состояний определяли у крыс в конфликтном тесте Геллера-Сейфтера.
Эффективность в отношении функциональных желудочно-кишечных расстройств определяли в анализе, описанном Coutinho SV et al. в American Journal of Physiology - Gastrointestinal & Liver Physiology. 282(2); G307 - 16, 2002 Feb, у крыс.
ДОПОЛНИТЕЛЬНЫЕ ПРОТОКОЛЫ IN VIVO ТЕСТИРОВАНИЯ
Субъекты и размещение
Не использовавшихся ранее в экспериментах самцов крыс Sprague Dawley (175-200 г) размещают группами по 5 в комнате с контролируемой температурой (22°С, влажность 40-70%, 12-часовой цикл свет/тьма). Эксперименты проводят во время светлой фазы цикла. Животные получают пищу и воду без ограничений, и их умерщвляют сразу после сбора данных.
Выборка
Для тестирования соединений (лекарственных средств) используют группы крыс, которым ничего не вводят, и другие группы крыс, которым вводят E.coli липополисахарид (LPS). Для эксперимента с введением LPS крысам четырех групп инъецируют LPS, затем крысам одной из этих четырех групп вводят растворитель, а крысам других трех групп инъецируют лекарственное средство и его носитель. Вторую серию экспериментов проводят на пяти группах крыс, ни одна из которых не получает LPS. Крысы групп, не подвергнутые какому-либо воздействию, не получают ни соединения (лекарственного средства), ни носителя; крысам остальных четырех групп вводят носитель с лекарственным средством или без него. Введения выполняют, чтобы определить анксиолитические или седативные эффекты лекарственных средств, которые могут внести вклад в понижение USV.
Введение LPS
Перед обработкой крысам дают возможность адаптироваться в экспериментальной лаборатории в течение 15-20 минут. Воспаление индуцируют введением LPS (эндотоксин грамотрицательного серотипа 0111:В4 бактерий E.coli, Sigma). LPS (2,4 мкг) инъецируют интрацеребровентрикулярно (и.ц.в.) в объеме 10 мкл, используя стандартные стереотаксические хирургические методики под изофлурановой анестезией. Кожу между ушами сдвигают рострально и делают продольный разрез 1 см, чтобы обнажить поверхность черепа. Место укола определяют по координатам: 0,8 мм назад от темени, 1,5 мм в сторону (влево) от места соединения ламбдовидного и стреловидного швов черепа (сагиттального шва) и на 5 мм ниже поверхности черепа (вертикально) в боковой желудочек. LPS инъецируют через стерильную иглу из нержавеющей стали (26-G 3/8) 5 мм длиной, присоединенную к шприцу Гамильтона на 100 мкл при помощи полиэтиленовой трубки (РЕ20; 10-15 см). Ограничитель размером 4 мм, сделанный из обрезанной иглы (20-G), надевают и закрепляют на игле 26-G силиконовым клеем, создавая желаемую 5 мм глубину.
После инъекции LPS иглу оставляют на месте в течение дополнительных 10 секунд, чтобы обеспечить диффузию соединения, а затем удаляют. Разрез закрывают, крысу возвращают в ее первоначальную клетку и оставляют отдыхать в течение минимум 3,5 ч перед тестированием.
Экспериментальная установка для раздражения воздушными "пшиками"
После инъекции LPS и введения соединения (лекарственного средства) крысы остаются в экспериментальной лаборатории. В момент тестирования всех крыс извлекают и размещают вне лаборатории. Одну крысу сразу запускают в лабораторию тестирования и помещают в чистую коробку (9×9×18 см), которую затем помещают в звукопоглощающую вентилируемую кабину размерами 62 (ширина) ×35 (длина) ×46 (высота) см (BRS/LVE, Div. Tech-Serv Inc.). Подачу воздушных "пшиков" через воздушное выходное сопло 0,32 см контролируют системой (AirStim, San Diego Instruments) с возможностью воздушных "пшиков" фиксированной продолжительности (0,2 с) и фиксированной интенсивности с частотой 1 "пшик" в 10 с. Делают максимум десять "пшиков" или пока не начнется издавание звуков. Первый воздушный "пшик" отмечается как начало записи.
Экспериментальная установка для записи ультразвука
Издавание звуков записывают в течение 10 минут, используя микрофоны (G.R.A.S. sound and vibrations, Vedbaek, Дания), помещенные внутри каждой кабины, и контролируют с помощью программы LMS (LMS CADA-X 3,5В, Data Acquisition Monitor, Troy, Michigan). Частоты между 0 и 32000 Гц записывают, сохраняют и анализируют при помощи такой же программы (LMS CADA-X 3,5В, Time Data Processing Monitor and UPA (User Programming and Analysis)).
Соединения (лекарственные средства)
рН всех соединений (лекарственных средств) доводят до 6,5-7,5 и их вводят в объеме из расчета 4 мл/кг. После введения соединения (лекарственного средства) животных возвращают в их первоначальные клетки, где они находятся до тех пор, пока не наступит время тестирования.
Анализ
Над записью выполняют серию статистических анализов и Фурье-анализов для фильтрации (20-24 кГц) и вычисления интересующих параметров. Данные выражают как среднее значение ±SEM. Статистическую значимость оценивают с использованием критерия Стьюдента для сравнения не подвергавшихся воздействию крыс и крыс, которым вводили LPS, и однофакторным ANOVA (дисперсионный анализ) с последующей проверкой множественного сравнения по Даннетту (post-hoc) в отношении эффективности лекарственного средства. Различие между группами считают значимым при минимальном значении p≤0,05. Эксперименты повторяют как минимум 2 раза.
ПРИМЕРЫ
Изобретение иллюстрируется примерами, в которых описаны способы, которыми соединения по настоящему изобретению могут быть получены, очищены и биологически протестированы и которые не должны рассматриваться как ограничивающие данное изобретение.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 1: N,N-диэтил-4-формилбензамид
К суспензии 4-карбоксибензальдегида (30 г, 0,2 моль) в 100 мл толуола SOCl2 добавляли (97 мл, 1,3 моль) при 60°С. Эту реакционную смесь нагревали до тех пор, пока не прекращалось газовыделение, после чего ее выпаривали до сухости с толуолом (3×50 мл). Получали остаток, который растворяли в CH2Cl2 (200 мл). К этому раствору, охлажденному в ледяной бане при перемешивании, добавляли диэтиламин (50 мл). Перемешивание продолжали в течение одного часа, а затем смесь нагревали с обратным холодильником в течение еще одного часа. После охлаждения смесь промывали последовательно Н2О, 2 н. HCl, H2O, затем 2 н. NaOH и в конце Н2О. Раствор сушили над MgSO4, фильтровали и концентрировали до сухости с получением 41 г масла. Перегонка при 140-150°С/1,5 торр (200 Па) дала 36,9 г, 90% ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 1.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 2: 1,1-диметилэтиловый эфир 4-[(3-цианфенил)[4-[(диэтиламино)карбонил]фенил]метил]-1-пиперазинкарбоновой кислоты
В сухую колбу, содержащую N,N-диэтил-4-формил-бензамид (ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 1) (1,60 г, 1 экв.), бензотриазол (929 мг, 1 экв.) и 1,1-диметиловый эфир 1-пиперазинкарбоновой кислоты (1,45 г, 1 экв.), добавляли сухой толуол (50 мл) и эту реакционную смесь нагревали с обратным холодильником с удалением воды. Через 3,5 часа реакционную смесь охлаждали и концентрировали до примерно 5 мл. Этот раствор разбавляли тетрагидрофураном (5 мл) и медленно добавляли в колбу, содержащую 3-цианофенилцинкйодид (0,37 М раствор в тетрагидрофуране, 42 мл, 2 экв.). Реакционную смесь нагревали при 50°С в течение 20 часов, затем охлаждали и гасили насыщенным водным хлоридом аммония (50 мл). Через 10 минут смесь экстрагировали дихлорметаном (2×100 мл) и объединенные органические экстракты затем сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией, элюируя 3% метанолом в дихлорметане, с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 2 в виде желтого масла (2,120 г).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 3: 4-[(3-цианфенил)-1-пиперазинилметил]-N,N-диэтилбензамид
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 2 (2,120 г) в дихлорметане (40 мл) добавляли трифторуксусную кислоту (6,5 мл, 15 экв.). После трех часов при комнатной температуре реакцию гасили водным раствором гидроксида натрия (1 н., 40 мл) и органический слой отделяли. Водный слой промывали дихлорметаном (2×50 мл) и объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией, элюируя от 10% до 20% метанолом в дихлорметане, с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 3 в виде бесцветной пены (1,113 г, 39% за 3 стадии).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 4а: 3-[(4-[(диэтиламино)карбонил]фенил)(4-бензил-пиперазин-1-ил)метил]бензонитрил
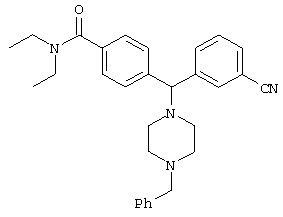
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 3 (606 мг) в 1,2-дихлорэтане (15 мл) добавляли бензальдегид (220 мкл, 1,3 экв.) и триацетоксиборгидрид натрия (480 мг, 1,4 экв.). Через 3 дня реакционную смесь разбавляли дихлорметаном (50 мл) и промывали насыщенным водным раствором бикарбоната натрия. Водный слой промывали дихлорметаном (2×25 мл) и объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией, элюируя 5% метанолом в дихлорметане, с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4а в виде бесцветной пены (428 мг, 57%).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 4б: 3-{(4-[(диэтиламино)карбонил]фенил)[4-(2-фурилметил)-пиперазин-1-ил]метил}бензонитрил
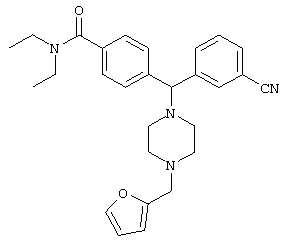
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 3 (567 мг) в 1,2-дихлорэтане (15 мл) добавляли 2-фуральдегид (160 мкл, 1,3 экв.) и триацетоксиборгидрид натрия (450 мг, 1,4 экв.). Через 3 дня реакционную смесь разбавляли дихлорметаном (50 мл) и промывали насыщенным водным раствором бикарбоната натрия. Водный слой промывали дихлорметаном (2×25 мл) и объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией, элюируя 5% метанолом в дихлорметане, с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б в виде бесцветной пены (367 мг, 53%).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 5: 4-йодо-N,N-диэтилбензамид
К смеси 4-йодо-бензоилхлорида (75 г) в 500 мл CH2Cl2 добавляли смесь Et3N (50 мл) и Et2NH (100 мл) при 0°С. После добавления полученную реакционную смесь подогревали до комнатной температуры за 1 час, а затем промывали насыщенным раствором хлорида аммония. Органический экстракт сушили (Na2SO4), фильтровали и концентрировали. Остаток перекристаллизовывали из горячих гексанов с получением 80 г ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 5.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 6: метиловый эфир 3-[[4-[(диэтиламино)карбонил]фенил]гидроксиметил]-бензойной кислоты
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 5 (2,8 г, 9,0 ммоль) растворяли в ТГФ (тетрагидрофуран) (100 мл) и охлаждали до -78°С в атмосфере азота. Затем н-BuLi (8,4 мл, 1,07 М раствор в гексане, 9,0 ммоль) добавляли по каплям в течение 10 минут при температуре от -65 до -78°С. Этот раствор прикапывали к 3-карбоксиметоксибензальдегиду (1,49 г, 9,1 ммоль) в смеси толуол/ТГФ (примерно 1:1, 50 мл) при -78°С. Через 30 минут добавляли NH4Cl (водный). После концентрирования в вакууме, экстракции смесью EtOAc/вода, сушки (MgSO4) и выпаривания органической фазы остаток очищали хроматографией на диоксиде кремния (0-75% EtOAc/гептан) с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 6 (1,5 г, 49%).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 7: 1,1-диметилэтиловый эфир 4-[[4-[(диэтиламино)карбонил]фенил][3-(метоксикарбонил)фенил]метил]-1-пиперазинкарбоновой кислоты
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 6 (1,5 г, 4,4 ммоль) в дихлорметане (25 мл) добавляли тионилбромид (0,36 мл, 4,6 ммоль). После 1 часа при комнатной температуре реакционную смесь промывали насыщенным водным раствором бикарбоната натрия (100 мл) и органический слой отделяли. Водный слой промывали дихлорметаном (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали.
Бензилбромид растворяли в ацетонитриле (35 мл) и N-Вос-пиперазине (0,9 г, 4,8 ммоль) и добавляли триэтиламин (0,67 мл, 4,8 ммоль). После нагревания этой реакционной смеси в течение одного часа при 65°С реакционную смесь охлаждали, промывали насыщенным хлоридом аммония/этилацетатом и отделяли органический слой. Водный слой экстрагировали этилацетатом (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 7 (2,04 г, 91%).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 8: метиловый эфир 3-[[4-[(диэтиламино)карбонил]фенил][4-(фенилметил)-1-пиперазинил]метил]-бензойной кислоты
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 7 (2,0 г, 3,9 ммоль) в дихлорметане (30 мл) добавляли трифторуксусную кислоту (15 мл). Через 10 минут реакционную смесь концентрировали, остаток растворяли в дихлорметане и промывали насыщенным водным раствором бикарбоната натрия. Органический экстракт сушили (MgSO4), фильтровали и концентрировали.
Остаток растворяли в ацетонитриле (25 мл) и добавляли бензилбромид (475 мкл, 4,0 ммоль) и триэтиламин (550 мкл, 4,0 ммоль). После одного часа при комнатной температуре реакционную смесь концентрировали, остаток растворяли в дихлорметане и промывали водой. Органический слой сушили (MgSO4), фильтровали и концентрировали с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 8 (1,66 г, 85%).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 9: 3-[[4-[(диэтиламино)карбонил]фенил][4-(фенилметил)-1-пиперазинил]метил]-бензойная кислота
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 8 (1,66 г, 3,3 ммоль) в метаноле (15 мл) и воде (5 мл) добавляли гидроксид лития (0,69 г, 16,5 ммоль). После 5 часов при комнатной температуре метанол удаляли и ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 9 осаждали из водного раствора добавлением 2М соляной кислоты.
СОЕДИНЕНИЕ 1, 1а и 1б: 3-[(4-[(диэтиламино)карбонил]фенил)(4-бензил-пиперазин-1-ил)метил]бензамид
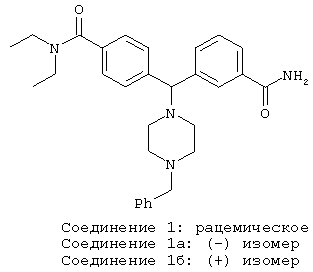
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4а (428 мг) в трет-бутаноле (10 мл) добавляли раздробленный гидроксид калия (129 мг, 2,5 экв.) и эту реакционную смесь нагревали с обратным холодильником. Через 90 минут реакционную смесь охлаждали и разбавляли дихлорметаном (40 мл). Реакционную смесь промывали водой (30 мл) и органический слой отделяли. Водный слой нейтрализовали 2 н. соляной кислотой и промывали дихлорметаном (2×25 мл). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией, элюируя 3% метанолом в дихлорметане, с получением СОЕДИНЕНИЯ 1 в виде бесцветной пены (374,5 г, 84%). 1Н ЯМР (CD3OD) δ 1.06 (t, J=6,9 Гц, 3Н), 1.20 (t, J=6,8 Гц, 3Н), 3.15-3.40 (m, 6H), 3.545-3.54 (m, 2H), 3.57-3.67 (m, 4Н), 4.44 (s, 2H), 5.39 (br s, 1H), 7.40 (d, J=8,4 Гц, 2H), 7.43-7.59 (m, 6H), 7.82 (d, J=7,8 Гц, 3Н), 7.93 (d, J=7,0 Гц, 1H), 8.22 (s, 1H).
СОЕДИНЕНИЕ 1 отделяли хиральной ВЭЖХ (высокоэффективная жидкостная хроматография) с получением СОЕДИНЕНИЙ 1а и 1б, используя хиральную AD (атмосферное давление) колонку со смесью 30% изопропанола/70% гексанов в качестве элюента, при этом время удерживания составляло 11,3 минут и 16,5 минут для СОЕДИНЕНИЙ 1а и 1б соответственно.
Для СОЕДИНЕНИЯ 1а: чистота (ВЭЖХ): >99%; оптическая чистота (хиральная ВЭЖХ): >99%; Найдено: С, 58,93; Н, 6,65; N, 8,82. С30Н36N4O2×3,2HCl×0,6Н2O имеет С, 58,87; Н, 6,65; N, 9,15%.
Для СОЕДИНЕНИЯ 1б: чистота (ВЭЖХ): >99%; оптическая чистота (хиральная ВЭЖХ): >99%; Найдено: С, 58,88; Н, 6,68; N, 8,94. С30Н36N4O2×3,1HCl×0,8Н2O имеет С, 58,87; Н, 6,70; N, 9,15%.
СОЕДИНЕНИЯ 2, 2а и 2б: 3-{(4-[(диэтиламино)карбонил]фенил)[4-(2-фурилметил)-пиперазин-1-ил]метил}бензамид
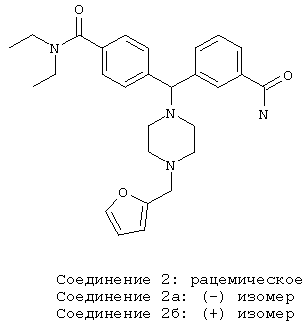
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б (365 мг) в трет-бутаноле (10 мл) добавляли раздробленный гидроксид калия (112 мг, 2,5 экв.) и эту реакционную смесь нагревали с обратным холодильником. Через 90 минут реакционную смесь охлаждали и разбавляли дихлорметаном (40 мл). Реакционную смесь промывали водой (30 мл) и органический слой отделяли. Водный слой нейтрализовали 2 н. соляной кислотой и промывали дихлорметаном (2×25 мл). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией с получением рацемического СОЕДИНЕНИЯ 2 в виде бесцветной пены. 1Н ЯМР (свободный амин) (400 МГц, CDCl3) δ 1.09 (br s, 3H), 1.20 (br s, 3H), 2.47 (m, 8H), 3.23 (br s, 2H), 3.52 (br s, 2H), 3.55 (s, 2H), 4.31 (s, 1Н), 5.63 (br s, 1H), 6.10 (br s, 1H), 6.19 (d, J=2,9 Гц, 1Н), 6.30 (m, 1H), 7.27 (d, J=8,2 Гц, 2H), 7.35 (m, 2H), 7.41 (d, J=8,2 Гц, 2H), 7.59 (m, 2H), 7.84 (s, 1H)
СОЕДИНЕНИЕ 2 отделяли хиральной ВЭЖХ с получением СОЕДИНЕНИЙ 2а и 2б, используя хиральную AD колонку со смесью 30% изопропанола/70% гексанов в качестве элюента, при этом время удерживания составляло 9,9 минут и 12,9 минут для СОЕДИНЕНИЙ 2а и 2б соответственно.
Для СОЕДИНЕНИЯ 2а: чистота (ВЭЖХ): >99%; оптическая чистота (хиральная ВЭЖХ): >99%; Найдено: С, 56,79; Н, 6,65; N, 9,60. С28Н34N4O3×2,6HCl×1,3Н2O имеет С, 56,73; Н, 6,67; N, 9,45%.
Для СОЕДИНЕНИЯ 2б: чистота (ВЭЖХ): >99%; оптическая чистота (хиральная ВЭЖХ): >99%; Найдено: С, 57,86; Н, 6,54; N, 9,56. С28Н34N4O3×0,7HCl×3,1Н2O имеет С, 57,86; Н, 6,76; N, 9,18%.
АЛЬТЕРНАТИВНЫЙ СИНТЕЗ СОЕДИНЕНИЯ 1
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 9 (100 мг, 0,21 ммоль) в дихлорметане (3 мл) при -20°С добавляли изобутилхлорформиат (41 мкл, 0,31 ммоль) и триэтиламин (43 мкл, 0,31 ммоль). Через 10 минут добавляли раствор аммиака в дихлорметане (1,5 М, 4,5 мл, 3 ммоль). Реакционную смесь нагревали до комнатной температуры и промывали рассолом. Органический слой сушили (MgSO4), фильтровали и концентрировали с получением СОЕДИНЕНИЯ 1.
СОЕДИНЕНИЕ 3, 3а и 3б: 3-[[4-[(диэтиламино)карбонил]фенил][4-(фенилметил)-1-пиперазинил]метил]-N-метил-бензамид
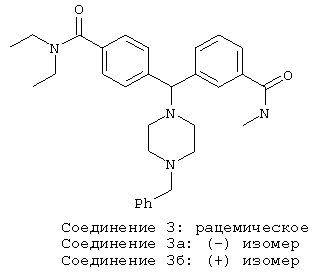
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 9 (0,120 мг, 0,25 ммоль) в ДМФ (диметилформамид) добавляли HATU (тетрафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония) (0,132 мг, 0,35 ммоль) и диизопропилэтиламин (173 мкл, 0,99 ммоль). Реакционную смесь перемешивали в течение 30 минут, после чего добавляли 2 н. HNCH3 в МеОН и перемешивание продолжали в течение ночи. Реакционную смесь концентрировали и распределяли между насыщенным раствором NaHCO3 и этилацетатом. Органический слой отделяли, а водный слой экстрагировали 5 раз этилацетатом. Органические слои сушили (MgSO4), фильтровали и концентрировали с получением СОЕДИНЕНИЯ 3. 1Н ЯМР (400 МГц, CD3OD) δ 1.07 (m, 3Н), 1.21 (m, 3Н), 2.32 (m, 2H), 2.90 (s, 3Н), 3.02 (m, 2H), 3.24 (m, 4H), 3.40 (m, 2H), 3.50 (m, 2H), 4.34 (s, 2H), 4.55 (s, 1H), 7.33 (d, J=8,2 Гц, 2H), 7.41 (m, 1Н), 7.48 (m, 5H), 7.56 (d, J=8,2 Гц, 2H), 7.63 (m, 2H), 7.93 (m, 1H).
СОЕДИНЕНИЕ 3 разделяли хиральной ВЭЖХ с получением СОЕДИНЕНИЙ 3а и 3б, используя хиральную AD колонку со смесью 35% изопропанола/65% гексанов в качестве элюента, при этом время удерживания составляло 7,1 минут и 17,3 минут для СОЕДИНЕНИЙ 3а и 3б соответственно.
Для СОЕДИНЕНИЯ 3а: чистота (ВЭЖХ): >99%; оптическая чистота (хиральная ВЭЖХ): >99%; Найдено: С, 59,20; Н, 5,94; N, 8,26. С31Н38N4O3×1,6С2HO2F3×0,7Н2O имеет С, 59,21; Н, 5,96; N, 8,08%.
Для СОЕДИНЕНИЯ 3б: чистота (ВЭЖХ): >97%; оптическая чистота (хиральная ВЭЖХ): >97%; Найдено: С, 59,73; Н, 5,91; N, 8,32. С31Н38N4O3×1,6HCl×0,4Н2O имеет С, 59,68; Н, 5,92; N, 8,14%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2004 |
|
RU2346938C2 |
| ДИАРИЛМЕТИЛПИПЕРАЗИНОВЫЕ ПРОИЗВОДНЫЕ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2005 |
|
RU2404172C2 |
| 4-ЗАМЕЩЕННЫЕ-2-ФЕНОКСИФЕНИЛАМИНОВЫЕ МОДУЛЯТОРЫ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2553453C2 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| АНТАГОНИСТЫ РЕЦЕПТОРА CGRP | 2004 |
|
RU2308458C2 |
| ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2543484C2 |
| ЗАМЕЩЕННЫЕ АРИЛАМИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT-РЕЦЕПТОРА | 2006 |
|
RU2440996C2 |
| ФЕНОКСИЗАМЕЩЕННЫЕ ПИРИМИДИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2554870C2 |
| ЗАМЕЩЕННЫЕ N-ФЕНИЛ-БИПИРРОЛИДИНМОЧЕВИНЫ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2008 |
|
RU2478094C2 |
| ПРОИЗВОДНЫЕ 4-(ФЕНИЛ-ПИПЕРАЗИНИЛ-МЕТИЛ)-БЕНЗАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2297412C2 |
Настоящее изобретение относится к производным 4-(фенил-пиперазинил-метил)бензамидам общей формулы I
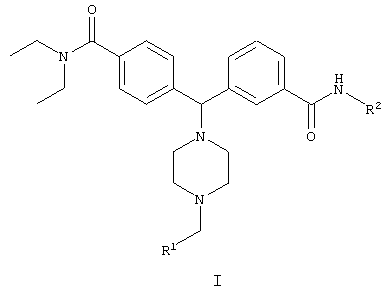
в которой R1 - арил, гетероарил, выбранный из группы, включающей фурил, пиридил и тиенил; R2 - водород или С1-12алкил. Соединения могут быть использованы для лечения боли или функциональных желудочно-кишечных расстройств. Описаны также способы получения соединений, фармацевтическая композиция на их основе и применение в изготовлении лекарственного средства. 5 н. и 3 з.п. ф-лы, 2 табл.
где R1 представляет собой арил, гетероарил, выбранный из группы, включающей фурил, пиридил и тиенил; и
R2 представляет собой водород или С1-12алкил.
R1 выбран из фенила, пиридила, тиенила и фурила; и
R2 представляет собой водород или метил.
3-[(4-[(диэтиламино)карбонил]фенил)(4-бензил-пиперазин-1-ил)метил]бензамида;
3-{(4-[(диэтиламино)карбонил]фенил)[4-(2-фурилметил)-пиперазин-1-ил]метил}бензамида;
3-[[4-[(диэтиламино)карбонил]фенил][4-(фенилметил)-1-пиперазинил]метил]-N-метил-бензамида;
их энантиомеров; и их фармацевтически приемлемых солей.
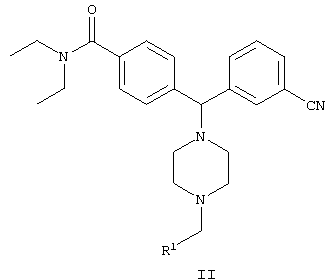
включающий стадию взаимодействия соединения формулы III:
с R1-СНО с образованием соединения формулы II, где
R1 представляет собой арил, гетероарил, выбранный из группы, включающей фурил, пиридил и тиенил.
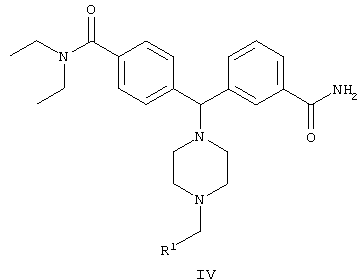
включающий взаимодействие соединения формулы II

с гидроксидом щелочного металла в неводном растворителе с образованием соединения формулы IV,
где R1 представляет собой арил, гетероарил, выбранный из группы, включающей фурил, пиридил и тиенил.
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2008-06-20—Публикация
2003-11-05—Подача