Настоящая заявка основана на предварительной заявке на патент США 60/602363, поданной 18 августа 2004 года, которая включена в данное описание путем ссылки, и заявлен приоритет в соответствии с 35 U.S.С. §119(a)-(d) согласно заявке на шведский патент 0401968-3, поданной 2 августа 2004 года.
Область изобретения
Настоящее изобретение относится к новым соединениям, способу их получения, их применению и фармацевтическим композициям, включающим новые соединения. Новые соединения полезны в терапии и, в частности, при лечении боли, тревоги и функциональных желудочно-кишечных расстройств.
Предшествующий уровень техники
Установлено, что дельта ("δ") рецептор играет роль во множестве функций организма, таких как кровеносная и болепроводящая системы. Таким образом, лиганды δ рецептора могут быть потенциально использованы в качестве анальгетиков и/или в качестве антигипертензивных агентов. Также показано, что лиганды δ рецептора обладают иммуномодулирующими активностями.
Идентификация по меньшей мере трех различных популяций опиоидных рецепторов (µ, δ и κ) в настоящее время хорошо доказана, и все три популяции обнаружены в центральной и периферической нервных системах множества видов, включающих человека. Аналгезию наблюдали в различных животных моделях, когда активирован один или более чем один из этих рецепторов.
За несколькими исключениями существующие в настоящее время избирательные лиганды δ-опиоидного рецептора по природе представляют собой пептиды и не подходят для системного введения. Один из примеров непептидного δ-агониста представляет собой SNC80 (Bilsky E.J. et al., Journal of Pharmacology and Experimental Therapeutics, 273 (1), pp.359-366 (1995)).
Множество соединений, представляющих собой δ-агонисты, идентифицированные в предшествующем уровне техники, обладают множеством недостатков, заключающихся в том, что они демонстрируют плохую фармакокинетику и не обладают обезболивающими свойствами при системном введении. Кроме того, отмечено, что множество этих соединений, представляющих собой δ-агонисты, проявляет значительные конвульсивные дейтвия при системном введении.
В публикации РСТ WO 02/094794 описаны некоторые δ-агонисты.
Тем не менее до сих пор существует необходимость в улучшенных δ-агонистах.
Описание изобретения
Авторы изобретения неожиданно обнаружили, что некоторые соединения демонстрируют одно или более чем одно улучшенное свойство, т.е. улучшенную δ-агонистическую активность, активность in vivo, фармакокинетику, биодоступность, стабильность in vitro, стабильность in vivo, проникновение в головной мозг, и/или низкую токсичность.
Если в этом описании не указано иначе, номенклатура, используемая в этом описании, как правило, соответствует примерам и правилам, установленным в Nomenclature of Organic Chemistry, Sections A, B, Q D, E, F, and H, Pergamon Press, Oxford, 1979, включенной здесь путем ссылки на примеры названий химических структур в ней и правила наименования химических структур. Возможно, название соединения может быть создано путем использования программы по образованию химических названий: ACD/ChemSketch, Version 5.09/September 2001, Advanced Chemistry Development, Inc., Toronto, Canada.
"Энантиомерно чистый" относится к соединению, содержащему по меньшей мере 75% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров. В конкретном воплощении "энантиомерно чистый" относится к соединению, содержащему по меньшей мере 90% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров. В более конкретном воплощении "энантиомерно чистый" относится к соединению, содержащему по меньшей мере 95% названного энантиомера от общего количества двух возможных содержащихся в нем энантиомеров.
"Теплокровное животное" включает человека.
В одном из аспектов в изобретении предложено соединение формулы I, его фармацевтически приемлемые соли, сольваты, пролекарства, диастереоизомеры, один или более чем один энантиомер и их смеси:
В одном из воплощений соединение по изобретению может быть выбрано из:
 ,
,  ,
,  ,
,
их фармацевтически приемлемых солей, одного или более чем одного выделенного энантиомера и их смесей.
В еще одном воплощении соединение по изобретению может быть выбрано из:
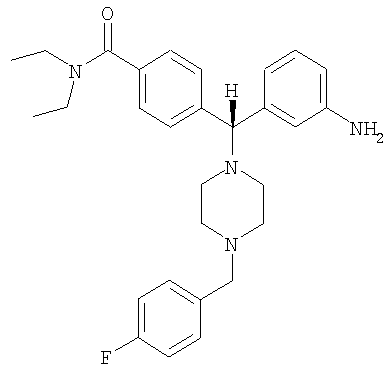 ,
,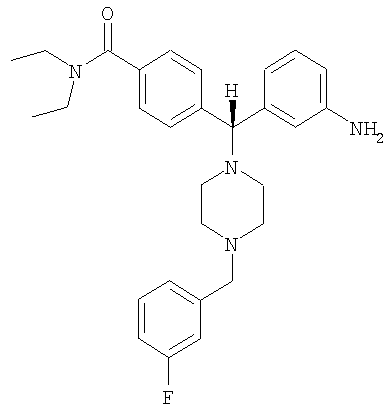 ,
, 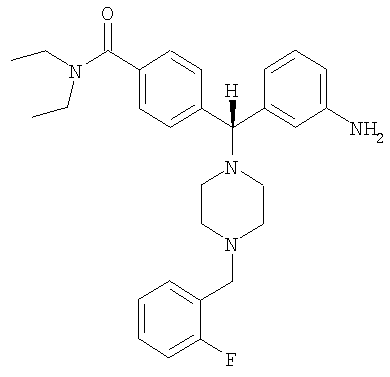 ,
,
и их фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
 и его фармацевтически приемлемых солей.
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
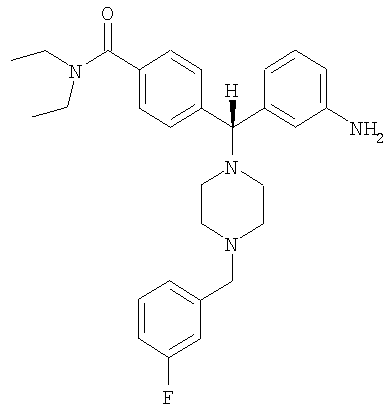 и его фармацевтически приемлемых солей.
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из
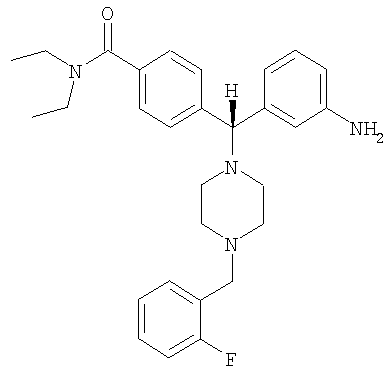 и его фармацевтически приемлемых солей.
и его фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из 4-{(S)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; 4-[(R)-(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида; 4-[(R)-(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида и их фармацевтически приемлемых солей.
В еще одном воплощении соединение по настоящему изобретению может быть выбрано из энантиомерно чистого 4-{(S)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; энантиомерно чистого 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамида; энантиомерно чистого 4-[(R)-(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида; энантиомерно чистого 4-[(R)-(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамида и их фармацевтически приемлемых солей.
Понятно, что соединения по настоящему изобретению содержат один или более чем один хиральный центр, соединения по изобретению могут существовать в виде энантиомерных или диастереоизомерных форм или в виде рацемической смеси, и могут быть выделены в виде энантиомерных или диастереоизомерных форм или в виде рацемической смеси. Настоящее изобретение включает любые возможные энантиомеры, диастереоизомеры, рацематы соединения формулы I или их смеси. Оптически активные формы соединения по изобретению могут быть получены, например, путем хирального хроматографического разделения рацемата, путем синтеза из оптически активных исходных веществ или путем асимметричного синтеза, основываясь на описанных далее способах.
Также понятно, что некоторые соединения по настоящему изобретению могут существовать в сольватированной, например гидратированной, а также несольватированной формах. Дополнительно понятно, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I.
В объеме изобретения также находятся соли соединений формулы I. Как правило, фармацевтически приемлемые соли соединений по настоящему изобретению могут быть получены с использованием стандартных способов, хорошо известных в области техники, например путем взаимодействия достаточно основного соединения, например алкиламина, с подходящей кислотой, например, HCl или уксусной кислотой, с получением физиологически приемлемого аниона. Также может быть возможно получение соответствующей соли щелочного (такого как натрий, калий или литий) или щелочно-земельного металла (такого как кальций) путем обработки соединения по настоящему изобретению, имеющего подходящий кислотный протон, такого как карбоновая кислота или фенол, одним эквивалентом гидроксида или алкоксида (такого как этоксид или метоксид) щелочного или щелочно-земельного металла, или подходящим основным органическим амином (таким как холин или меглумин) в водной среде с последующими обычными способами очистки.
В одном из воплощений соединение формулы I выше может быть превращено в его фармацевтически приемлемую соль или сольват, в частности соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или пара-толуолсульфонат.
Новые соединения по настоящему изобретению полезны в терапии, в особенности для лечения различных болевых состояний, таких как хроническая боль, невропатическая боль, острая боль, боль при раке, боль, вызванная ревматоидным артритом, мигрень, висцеральная боль и т.д. Тем не менее этот список не следует интерпретировать как исчерпывающий.
Соединения по изобретению полезны в лечении диареи, депрессии, тревоги и/или расстройств, вызванных стрессом, таких как посттравматические стрессовые расстройства, паническое расстройство, генерализированное тревожное расстройство, социофобия, и обсессивно-компульсивное расстройство, недержания мочи, преждевременной эякуляции, различных умственных расстройств, кашля, отека легкого, различных желудочно-кишечных расстройств, например запора, функциональных желудочно-кишечных расстройств, таких как синдром раздраженного кишечника и функциональная диспепсия, болезни Паркинсона и других моторных расстройств, травматического повреждения головного мозга, инсульта, для защиты сердца после инфаркта миокарда, в лечении повреждения спинного мозга и наркозависимости, включая лечение алкогольной, никотиновой, опиоидной и другой лекарственной зависимости, и расстройств симпатической нервной системы, например гипертензии.
Соединения по изобретению полезны в качестве иммуномодуляторов, в особенности при аутоиммунных заболеваниях, таких как артрит, при трансплантации кожи, трансплантации органов и похожих хирургических потребностях, при коллагеновых заболеваниях, различных аллергиях, для применения в качестве противоопухолевых агентов и противовирусных агентов.
Соединения по изобретению полезны при болезненных состояниях, при которых дегенерация или дисфункция опиоидных рецепторов присутствует или вовлечена в эту модель. Может быть включено применение меченных радиоактивными изотопами вариантов соединений по изобретению в диагностических способах и визуализирующих применениях, таких как позитронно-эмиссионная томография (ПЭТ).
Соединения по изобретению полезны в качестве анальгетического агента для применения при общей анестезии и контролируемой анестезии. Комбинации агентов, обладающих различными свойствами, часто используют для достижения баланса эффектов, необходимых для поддержания анестетического состояния (например амнезия, аналгезия, мышечное расслабление и седативное действие). В эту комбинацию включены ингалируемые анестетики, снотворные средства, анксиолитики, нейромышечные блокаторы и опиоиды.
В объеме изобретения находится применение любого из соединений формулы I в соответствии с определенным выше для изготовления лекарственного средства.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии боли, включая острую боль, хроническую боль, невропатическую боль, боль в спине, боль при раке и висцеральную боль, но не ограничиваясь ими.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии тревоги, включая социофобию, генерализированное тревожное расстройство, острое тревожное состояние, но не ограничиваясь ими.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии депрессии.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для терапии болезни Паркинсона.
Также в объеме изобретения находится применение любого из соединений по изобретению для изготовления лекарственного средства для лечения любого из обсуждавшихся выше состояний.
Еще один аспект изобретения представляет собой способ лечения субъекта, страдающего любым из обсуждавшихся выше состояний, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по настоящему изобретению.
Таким образом, в изобретении предложено соединение формулы I или его фармацевтически приемлемая соль или сольват в соответствии с определенным выше для применения в терапии.
В контексте настоящего описания, если специально не указано иного, термин "терапия" также включает "профилактику". Термины "терапевтический" и "терапевтически" должны быть интерпретированы соответственно. Термин "терапия" в контексте настоящего изобретения дополнительно включает введение эффективного количества соединения по настоящему изобретению для смягчения ранее существующего болезненного состояния, острого или хронического, или рецидивирующего состояния. Это определение также охватывает способы профилактической терапии для предотвращения рецидивирующих состояний и непрерывную терапию для хронических расстройств.
При применении для терапии у теплокровного животного, такого как человек, соединение по изобретению может быть введено в форме обычной фармацевтической композиции при помощи любого из путей, включающих пероральный, внутримышечный, подкожный, местный, интраназальный, внутрибрюшинный, внутригрудинный, внутривенный, эпидуральный, внутриоболочечный, интрацеребровентрикулярный путь и путем инъекции в с суставы.
В одном из воплощений изобретения путь введения может быть пероральным, внутривенным или внутримышечным.
Доза зависит от пути введения, тяжести заболевания, возраста и массы пациента и других факторов, обычно рассматриваемых лечащим врачом при определении наиболее подходящей для конкретного пациента индивидуальной схемы приема лекарственного средства и уровня дозы.
Дополнительно предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем.
В частности, предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, для терапии, более конкретно для терапии боли и тревоги.
Кроме того, предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению, его сольваты или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, для применения при любом из обсуждавшихся выше состояний.
Для приготовления фармацевтических композиций из соединений по изобретению инертные фармацевтически приемлемые носители могут быть твердыми и жидкими. Препараты в виде твердой формы включают порошки, таблетки, диспергируемые гранулы, капсулы, саше и суппозитории.
Твердый носитель может представлять собой одно или более чем одно вещество, которое также может действовать в качестве разбавителей, корригентов, солюбилизаторов, смазывающих веществ, суспендирующих агентов, связывающих веществ или разрыхлителей для таблеток; он также может представлять собой инкапсулирующее вещество.
В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным соединением по изобретению, или активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих пропорциях, и спрессован в желаемую форму и до желаемого размера.
Для приготовления композиций в виде суппозиториев легкоплавкий воск, такой как смесь глицеридов жирных кислот и масла какао, сначала плавят, и активный ингредиент диспергируют в нем, например путем перемешивания. Расплавленную гомогенную смесь затем выливают в формы с удобным размером и дают возможность охладиться и затвердеть.
Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, лактозу, сахар, пектин, декстрин, крахмал, трагакантовую камедь, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, легкоплавкий воск, масло какао и т.п.
Также предполагают, что термин "композиция" включает приготовление активного компонента с инкапсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент (с другими носителями или без них) окружен носителем, который, таким образом, ассоциирован с ним. Похожим образом, включены саше.
Таблетки, порошки, саше и капсулы могут быть использованы в качестве твердых лекарственных форм, подходящих для перорального введения.
Жидкие композиции включают растворы, суспензии и эмульсии. Например, стерильные водные или водные пропиленгликолевые растворы активных соединений могут представлять собой жидкие препараты, подходящие для парентерального введения. Жидкие композиции также могут быть приготовлены в виде раствора в водном растворе полиэтиленгликоля.
Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей. Водные суспензии для перорального применения могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как природные и синтетические камеди, смолы, метилцеллюлоза, натриевая карбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области фармацевтических препаратов.
В зависимости от способа введения фармацевтическая композиция предпочтительно включает от 0,05% до 99 мас.% (процент по массе), предпочтительней от 0,10 до 50 мас.% соединения по изобретению, все проценты по массе основаны на массе всей композиции.
Терапевтически эффективное количество для практического применения настоящего изобретения может быть определено путем применения известных критериев, включающих возраст, массу и реакцию конкретного пациента, и интерпретировано в контексте заболевания, которое лечит или предотвращает специалист в данной области техники.
В еще одном аспекте настоящего изобретения предложен способ получения соединений по настоящему изобретению.
В одном из воплощений в изобретении предложен способ получения соединения формулы I
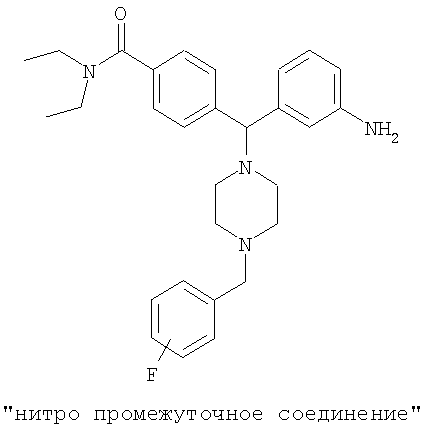
включающий взаимодействие N,N-диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамида с R-CH2X или R-CHO с получением нитро-промежуточного соединения;
восстановление указанного промежуточного соединения подходящим восстанавливающим агентом, где
R выбран из 2-фторфенила, 3-фторфенила и 4-фторфенила; и
Х выбран из Cl, I, Br, -OTs (тозил) и -OMs (мезилат).
В одном из воплощений указанный восстанавливающий агент может быть выбран из водорода, цинка и железа.
В еще одном воплощении указанный N,N-диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамид может быть выбран из N,N-диэтил-4-[(S)-(3-нитрофенил)(1-пиперазинил)метил]бензамида и N,N-диэтил-4-[(R)-(3-нитрофенил)(1-пиперазинил)метил]бензамида.
В еще одном воплощении R может представлять собой 2-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
В еще одном воплощении R может представлять собой 3-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
В еще одном воплощении R может представлять собой 4-фторфенил; и соединение формулы I может представлять собой 4-[(3-аминофенил)[4-[(4-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид.
Конкретней, соединения по настоящему изобретению и промежуточные соединения, используемые для их получения, могут быть получены в соответствии с путями синтеза в соответствии с приведенным на схемах 1 и 2.
Схема 1
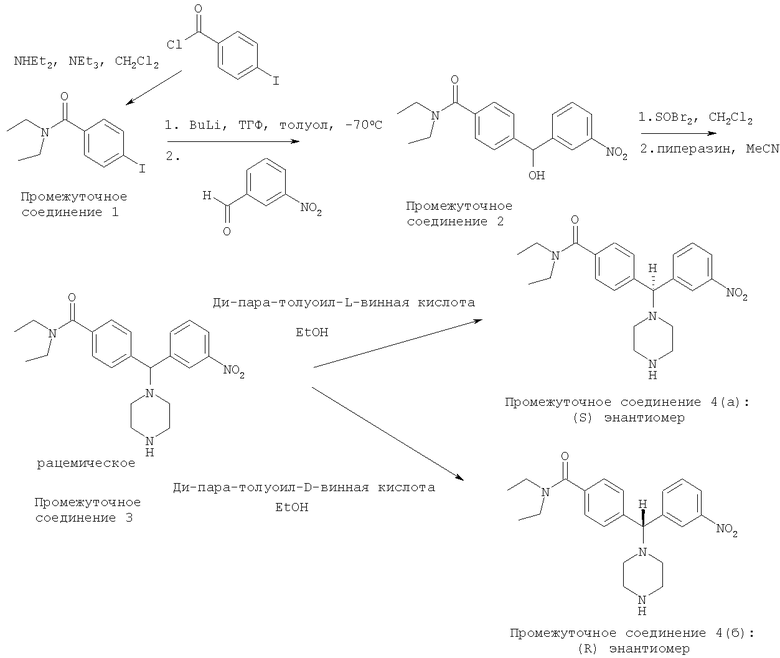
Схема 2
Биологическая оценка и свойства
Обнаружено, что соединения по изобретению активны в отношении δ рецепторов у теплокровного животного, например человека. В частности, обнаружено, что соединения по изобретению представляют собой эффективные лиганды δ рецептора. Анализы in vitro ниже продемонстрировали эти неожиданные активности, в особенности в отношении агонистической активности и эффективности, как продемонстрировано в функциональном анализе на головном мозге крысы и/или функциональном анализе человеческого δ рецептора (ниже). Это свойство может быть связано с активностью in vivo и может не коррелировать линейно с аффинностью связывания. В этих анализах in vitro тестируют активность соединения в отношении δ рецепторов и получают IC50 для определения избирательной активности для конкретного соединения в отношении δ рецепторов. В контексте настоящего изобретения IC50 в общем относится к концентрации соединения, при которой наблюдают 50%-ное замещение стандартного радиоактивного лиганда δ рецептора.
Активности соединения в отношении κ и µ рецепторов также измеряют в похожем анализе.
Модели in vitro
Культура клеток
Человеческие клетки 293S, экспрессирующие клонированные человеческие κ, δ и µ рецепторы, и резистентные к неомицину, выращивают в суспензии при 37°С и 5% CO2 в колбах шейкера, содержащих бескальциевую среду Игла, модифицированную Дульбекко (DMEM), 10% эмбриональной бычьей сыворотки (FBS), 5% сыворотки теленка (BCS), 0,1% Pluronic F-68 и 600 мкг/мл генетицина.
Образцы головного мозга крыс взвешивают и промывают охлажденным на льду физиологическим раствором, забуференным фосфатом (PBS) (содержащим 2,5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), рН 7,4). Образцы головного мозга гомогенизировают с использованием политрона в течение 30 с (для крыс) в охлажденном на льду лизирующем буфере (50 мМ Tris, рН 7,0, 2,5 мМ ЭДТА, с добавлением фенилметилсульфонилфторида непосредственно перед применением до концентрации 0,5 мМ из концентрированного 0,5 М раствора в смеси ДМСО (диметилсульфоксид):этанол).
Приготовление мембран
Клетки осаждают и ресуспендируют в лизирующем буфере (50 мМ Tris, рН 7,0, 2,5 мМ ЭДТА с добавлением фенилметилсульфонилфторида (ФМСФ) непосредственно перед применением до 0,1 мМ из 0,1 М концентрированного раствора в этаноле), инкубируют на льду в течение 15 мин, затем гомогенизируют с использованием политрона в течение 30 с. Суспензию центрифугируют при 1000 g (макс.) в течение 10 мин при 4°С. Супернатант хранят на льду, и осадки ресуспендируют и центрифугируют как ранее. Супернатанты после обоих центрифугирований объединяют и центрифугируют при 46000 g (макс.) в течение 30 мин. Осадки ресуспендируют в охлажденном буфере Tris (50 мМ Tris/Cl, рН 7,0) и вновь центрифугируют. Окончательно полученные осадки ресуспендируют в буфере для мембран (50 мМ Tris, 0,32 М сахароза, рН 7,0). Аликвоты (1 мл) в полипропиленовых пробирках замораживают в сухом льду/этаноле и хранят при -70°С до применения. Концентрации белка определяют путем модифицированного анализа Лоури с додецилсульфатом натрия.
Анализы связывания
Мембраны оттаивают при 37°С, охлаждают на льду (или хранят на льду, если не используют сразу), трижды пропускают через иглу 25-го калибра и разбавляют в буфере для связывания (50 мМ Tris, 3 мМ MgCl2, 1 мг/мл бычьего сывороточного альбумина (БСА) (Sigma A-7888), рН 7,4, который хранят при 4°С после фильтрования через фильтр 0,22 мм, и к которому сразу добавляют 5 мкг/мл апротинина, 10 мкМ бестатина, 10 мкМ дипротина А, если мембраны приготовлены из ткани (крысы, мыши, обезьяны, при отсутствии дитиотрейтола (ДТТ)). В охлажденные на льду полипропиленовые пробирки размером 12×75 мм, содержащие 100 мкл соответствующего радиолиганда и 100 мкл тестируемого соединения в различных концентрациях, добавляют аликвоты по 100 мкл. Общее связывание (ОС) и неспецифическое связывание (НС) определяют соответственно в отсутствие и в присутствии 10 мкМ налоксона. Пробирки вортексируют и инкубируют при 25°С в течение 60-75 мин, после чего содержимое подвергают быстрой вакуумной фильтрации и промывают приблизительно 12 мл/пробирку охлажденного на льду промывающего буфера (50 мМ Tris, рН 7,0, 3 мМ MgCl2) через фильтры GF/B (Whatman), предварительно промытые в течение по меньшей мере 2 ч в 0,1%-ном полиэтиленимине. Оставшуюся на фильтрах радиоактивность (распады в мин) измеряют при помощи бета-счетчика после выдержки фильтров в течение по меньшей мере 12 ч в минивиалах, содержащих 6-7 мл сцинтилляционной жидкости. Если анализ осуществляют в 96-луночных планшетах с глубокими лунками, фильтрацию осуществляют через монофильтры для 96-луночных планшетов, выдержанные в полиэтиленимине (ПЭИ), которые промывают 3×1 мл промывающего буфера и сушат в печи при 55°С в течение 2 ч. Фильтровальные планшеты подсчитывают в TopCount (Packard) после добавления 50 мкл сцинтилляционной жидкости MS-20/лунку. В случае анализов, проводимых в 96-луночных планшетах с глубокими лунками, IC50 соединений оценивают на основе 10-точечных кривых замещения в случае дельта, и 5-точечных кривых замещения в случае µ и κ. Анализ осуществляют в 300 мкл с соответствующим количеством мембранного белка (2 мкг, 35 мкг и 1 мкг в случае соответственно δ, µ и κ) и 50000-80000 распадов в мин/лунку соответствующего индикатора (125I-Deltorphin II, 125I-FK33824, и 125I-DPDYN соответственно для δ, µ и κ). Общее связывание и неспецифическое связывание определяют в присутствии и отсутствии 10 мкМ налоксона.
Функциональные анализы
Агонистическую активность соединений измеряют путем определения степени, в которой комплекс соединения и рецептора активирует связывание гуанозинтрифосфата (GTP) с G-белками, с которыми сопряжены рецепторы. В анализе связывания GTP комбинируют GTP[γ]35S с тестируемым соединением и мембранами клеток HEK-293S, экспрессирующих клонированные человеческие опиоидные рецепторы, или из гомогенизированных образцов головного мозга крысы или мыши. Агонисты стимулируют связывание GTP[γ]35S в этих мембранах. Значения ЕС50 и Emax соединений определяют из кривых доза-ответ. Сдвиг вправо кривой доза-ответ дельта-агонистом налтриндолом осуществляют для подтверждения того, что агонистическая активность опосредована дельта-рецепторами. Для функциональных анализов человеческих δ-рецепторов EC50 (низкая) измеряют, когда человеческие δ-рецепторы, используемые в анализе, экспрессируются с меньшими уровнями по сравнению с используемыми для определения EC50 (высокая). Значения Emax определяли относительно стандартного δ-агониста SNC80, т.е. величина, большая чем 100%, соответствует соединению, которое обладает лучшей эффективностью по сравнению с SNC80.
Процедура для GTP в головном мозге крысы
Мембраны головного мозга крыс оттаивают при 37°С, трижды пропускают через иглу 25-го калибра с тупым концом и разбавляют в буфере для связывания GTPγS (50 мМ HEPES, 20 мМ NaOH, 100 NaCl, 1 мМ ЭДТА, 5 мМ MgCl2, рН 7,4, добавляют свежеприготовленный: 1 мМ ДТТ, 0,1% БСА). В разведения мембран добавляют конечную концентрацию 120 мкМ гуанозиндифосфата (GDP). EC50 и Emax соединений оценивают по 10-точечным кривым доза-ответ в 300 мкл с соответствующим количеством мембранного белка (20 мкг/лунку) и 100000-130000 распадов в мин GTP[γ]35S на лунку (0,11-0,14 нМ). Базовое и максимальное стимулированное связывание определяют в отсутствие и в присутствии 3 мкМ SNC80. Анализ, осуществляемый на клетках НЕK 293S, стабильно экспрессирующих клонированные дельта рецепторы, проводят в слегка отличающемся буфере (50 мМ Hepes, 20 мМ NaOH, 200 мМ NaCl, 1 мМ ЭДТА, 5 мМ MgCl2, pH 7,4, добавляют свежеприготовленный: 0,5% БСА без ДТТ) и с конечной концентрацией 3 мкМ GDP.
Анализ данных
Специфическое связывание (СС) рассчитывали как ОС-НС, и СС в присутствии различных тестируемых соединений выражают в виде процента от контрольного СС. Значения IC50 и коэффициента Хилла (nH) для замещения лигандами специфически связавшегося радиолиганда рассчитывали по логарифмическим графикам или программам подгонки кривых, таких как Ligand, GraphPad Prism, SigmaPlot, или ReceptorFit. Значения константы ингибирования (Ki) рассчитывали в соответствии с уравнением Ченга-Прусоффа. Средние значения±стандартная ошибка среднего (СОС) для IC50, Ki, и nH приведены для лигандов, тестируемых по меньшей мере с использованием трех кривых замещения.
В Таблице 1 приведены некоторые биологические данные по нескольким соединениям по изобретению, измеренные с использованием вышеописанных анализов.
Н/O - не доступно
Эксперименты с насыщением рецептора
Значения Kδ для радиолиганда определяют путем осуществления анализов связывания на клеточных мембранах с соответствующими радиолигандами в концентрациях, находящихся в диапазоне 0,2-5 раз относительно установленного Кδ (до 10 раз, если требуемые количества радиолиганда являются допустимыми). Специфическое связывание радиолиганда выражают в виде пмоль/мг мембранного белка. Значения Кδ и Bmax для индивидуальных экспериментов получают по результатам нелинейных подгонок специфически связанного (В) относительно нМ свободного (F) радиолиганда для индивида в соответствии с одноцентровой моделью.
Определение механической аллодинии с использованием теста фон Фрея
Тестирование проводят в период с 08:00 до 16:00 ч с использованием способа, описанного в Chaplan et al. (1994). Крыс помещают в контейнеры из плексигласа на поверхности из проволочной сетки, дающей возможность для доступа к лапе, и оставляют для привыкания в течение 10-15 мин. Тестируемая область представляет собой середину подошвы левой задней лапы, избегая менее чувствительных подушечек лап. До лапы дотрагиваются серией из 8 волосков фон Фрея с логарифмически возрастающей жесткостью (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51 и 15,14 грамм; Stoelting, III, USA). Волосок фон Фрея применяют из-под сетчатого пола перпендикулярно поверхности подошвы с достаточной силой для того, чтобы вызвать слабый прогиб лапы и удерживают в течение приблизительно 6-8 секунд. Положительную реакцию регистрируют в том случае, если лапа резко отдергивается. Вздрагивание непосредственно при удалении волоска также рассматривают как положительную реакцию. Передвижение рассматривают как неопределенную реакцию и в таких случаях стимул повторяют.
Протокол теста
Животных в группе, обработанной полным адъювантом Фрейнда (FCA), тестируют на следующий день после операции. 50%-ный порог отдергивания определяют с использованием способа «вверх-вниз» Диксона (Dixon, 1980). Тестирование начинают с волосом 2,04 г в середине серии. Стимулы всегда представляют последовательно по восходящей или по нисходящей. В отсутствии реакции в виде отдергивания лапы на исходно выбранный волосок представляют более сильный стимул; в случае отдергивания лапы следующим выбирают более слабый стимул. Для оптимального расчета порогового уровня с использованием этого способа требуется 6 реакций в непосредственной близости от 50%-ного порогового уровня, и подсчет этих 6 реакций начинается, когда возникает первое изменение в реакции, например впервые пересекается пороговый уровень. В случаях, когда пороговые уровни оказываются за пределами стимулов, соответственно присваивают значения 15, 14 (нормальная чувствительность) или 0,41 (максимальная аллодиния). Получающуюся в результате картину положительных и отрицательных реакций табулируют с использованием правила Х = отсутствие отдергивания; O = отдергивание, и 50%-ный порог отдергивания интерполируют с использованием формулы
50%-ный г пороговый уровень = 10(Xf+κδ)/10000
где Xf = величина последнего используемого волоска фон Фрея (логарифмические единицы); κ = табличное значение (по Chaplan et al. (1994)) для картины положительных/отрицательных реакций; и δ = среднее различие между стимулами (логарифмические единицы). Здесь δ=0,224.
Пороговые величины фон Фрея превращают в процент от максимального возможного эффекта (% МВЭ) в соответствии с Chaplan et al. 1994. Для расчета % МВЭ используют следующее уравнение:

Введение тестируемого вещества
Крысам инъецируют (подкожно, внутрибрюшинно, внутривенно или перорально) тестируемое вещество перед тестом фон Фрея, время между введением тестируемого соединения и тестом фон Фрея варьирует в зависимости от природы тестируемого соединения.
Тест с корчами
Уксусная кислота вызывает абдоминальные сокращения при внутрибрюшинном введении крысам. Это затем приводит к типичному вытягиванию их тела. При введении обезболивающих средств это описанное движение наблюдают с меньшей частотой и лекарственное средство выбирают в качестве потенциального хорошего кандидата.
Полный и типичный рефлекс корчей рассматривают только тогда, когда присутствуют следующие элементы: животное не находится в движении; нижняя часть спины слегка ослаблена; наблюдают за подошвами обеих лап. В этом анализе соединения по настоящему изобретению демонстрируют значительное ингибирование реакций в виде корчей после перорального введения дозы 1-100 мкмоль/кг.
(1) Приготовление растворов
Уксусная кислота (АсОН): 120 мкл уксусной кислоты добавляют к 19,88 мл дистиллированной воды для получения конечного объема 20 мл с конечной концентрацией 0,6% АсОН. Раствор затем перемешивают (вортекс) и готовят для инъекции.
Соединение (лекарственное средство): Каждое соединение готовят и растворяют в наиболее подходящем разбавителе в соответствии со стандартными способами.
(2) Введение растворов
Соединение (лекарственное средство) вводят перорально, внутрибрюшинно (в.б.), подкожно (п.к.) или внутривенно (в.в.) в концентрации 10 мл/кг (из расчета средней массы тела мыши) за 20, 30 или 40 минут (в соответствии с классом соединения и его характеристиками) перед тестированием. Когда соединение вводят центрально: интравентрикулярно (и.в.к.) или внутриоболочечно (в.о.), вводят объем 5 мкл.
АсОН вводят внутрибрюшинно (в.б.) в две области в концентрации 10 мл/кг (из расчета средней массы тела мыши) непосредственно перед тестированием.
(3) Тестирование
За животными (мышами) наблюдают в течение 20 минут и количество событий (рефлекс корчей) фиксируют и накапливают в конце эксперимента. Мышей держат в индивидуальных клетках типа "коробка для обуви" с прикрепленной подстилкой. Обычно одновременно наблюдают за 4 мышами: один контроль и три дозы лекарственного средства.
Для тревоги и подобных тревоге показаний оценивают эффективность в конфликтном тесте Геллера-Зейфтера на крысах.
Для показаний функционального желудочно-кишечного расстройства эффективность может быть оценена на крысах в анализе, описанном Coutinho SV et al., в American Journal of Physiology - Gastrointestinal&Liver Physiology. 282 (2):G307-16, 2002 Feb.
Дополнительные протоколы тестирования in vivo
Объекты и содержание
Не подвергнутых обработке самцов крыс Sprague Dawley (175-200 г) содержат в группах по 5 штук в помещении с контролируемой температурой (22°С, влажность 40-70%, 12-часовой световой/темновой период). Эксперименты проводят во время светлой фазы цикла. Животные получают корм и воду без ограничений и их умерщвляют непосредственно после получения данных.
Образец
Тестируемые в отношении соединения (лекарственного средства) группы крыс включают группы, которые не подвергаются какой-либо обработке, и группы, которые обрабатывают липополисахаридом (ЛПС) Е.coli. Для эксперимента с обработкой ЛПС четырем группам инъецируют ЛПС, одну из четырех групп затем обрабатывают носителем, тогда как трем другим группам инъецируют лекарственное средство вместе с носителем. Во вторую проводимую серию экспериментов включают пять групп крыс, причем все они не подвергаются обработке ЛПС. Группе, не подвергшейся обработке, не вводят ни соединение (лекарственное средство), ни носитель; другие четыре группы обрабатывают носителем с лекарственным средством или без него. Эти эксперименты осуществляют для определения анксиолитического или седативного действия лекарственных средств, которые могут внести вклад в уменьшение USV.
Введение ЛПС
Крысам дают возможность освоиться в экспериментальной лаборатории в течение 15-20 мин перед обработкой. Воспаление вызывают путем введения ЛПС (эндотоксин грамотрицательной бактерии Е.coli, имеющей серотип 0111:В4, Sigma). ЛПС (2,4 мкг) интрацеребровентрикулярно (и.ц.в.) инъецируют в объеме 10 мкл с использованием стандартных стереотаксических оперативных способов с изофлурановой анестезией. Кожу между ушами клювовидно оттягивают и делают продольный разрез длиной приблизительно 1 см для обнажения поверхности черепа. Область пункции определяют по координатам: на 0,8 мм назад от брегмы, 1,5 мм латерально (левее) от ламбды (сагиттальный шов), и 5 мм ниже поверхности черепа (вертикально) в боковом желудочке. ЛПС инъецируют посредством стерильной иглы из нержавеющей стали (26-G 3/8) длиной 5 мм, присоединенной к шприцу Hamilton объемом 100-мкл через полиэтиленовую трубку (РЕ20; 10-15 см). Сверху размещают пробку диаметром 4 мм, изготовленную из обрезанной иглы (20-G), и прикрепляют ее к игле 26-G при помощи силиконового клея для получения желаемой глубины 5 мм.
После инъекции ЛПС иглу оставляют на месте в течение еще 10 с для того, чтобы дать возможность для диффузии соединения, а затем удаляют. Разрез закрывают и крысу возвращают в исходную клетку и оставляют минимум на 3,5 ч перед тестированием.
Постановка эксперимента для стимуляции путем вдувании воздуха
Крыс оставляют в экспериментальной лаборатории после инъекции ЛПС и введения соединения (лекарственного средства). В момент тестирования всех крыс извлекают и помещают вне лаборатории. Крыс по одной вносят в лабораторию для тестирования и помещают в прозрачный бокс (9×9×18 см), который затем помещают в шумопоглощающую вентилируемую кабинку размером 62 (ширина) × 35 (глубина) × 46 (высота) см (BRS/LVE, Div. Tech-Serv Inc). Вдувание воздуха через воздушную форсунку 0,32 см контролируют системой (AirStim, San Diego Intruments), способной вдувать воздух с фиксированной длительностью (0,2 с) и фиксированной интенсивностью с частотой 1 вдувание за 10 с. Осуществляют максимум 10 вдуваний или сколько получится до начала первой вокализации, смотря что наступит первым. Первое вдувание воздуха обозначает начало регистрации.
Постановка эксперимента для ультразвуковой регистрации
Вокализации регистрируют в течение 10 минут с использованием микрофонов (G.R.A.S. sound and vibrations, Vedbaek, Denmark), помещенных внутри каждой кабинки, и контролируют при помощи программного обеспечения лабораторной информационно-управляющей системы (LMS CADA-X 3.5В, Data Acquisition Monitor, Troy, Michigan). Регистрируют частоты от 0 до 32000 Гц, сохраняют и анализируют при помощи того же самого программного обеспечения (LMS CADA-X 3.5 В, Time Data Processing Monitor and UPA (программирование пользователем и анализ)).
Соединения (лекарственные средства)
рН для всех соединений (лекарственных средств) доводят до величины 6,5 до 7,5 и вводят их в объеме 4 мл/кг. После введения соединения (лекарственного средства) животных возвращают в исходные клетки до начала тестирования.
Анализ
Регистрацию осуществляют при помощи серии статистического анализа и анализа Фурье для фильтрации (20-24 кГц) и для расчета интересующих параметров. Данные выражают в виде среднего значения ± СОС. Статистическую значимость оценивают с использованием Т-теста для сравнения между крысами, не подвергшимися обработке, и крысами, обработанными ЛПС, и односторонним ANOVA (дисперсионный анализ) с последующим тестом множественного сравнения Дуннетта (post-hoc) для эффективности лекарственных средств. Различие между группами рассматривают как значимое при минимальном значении р не больше 0,05. Эксперименты повторяют минимум два раза.
Определение термической гипералгезии с использованием подошвенного теста Хагрейва (Hargreave)
Введение FCA или каррагинана
Полный адъювант Фрейнда (FCA): SIGMA кат. №F 5881, Mycobacterium tuberculosis (H37Ra, ATCC 25177), 1 мг/мл, инактированный теплом, высушенный, 0,85 мл парафина, 0,15 мл моноолеата маннида. Или каррагинан типа Лямбда IV (Cg): SIGMA кат. №С-3889, (желатин, растительный; ирландский мох), (1,0% раствор) в NaCl.
Инъекции осуществляют при помощи шприца Hamilton с размером стерильной иглы 26G5/8”. Крыс отбирают и помещают в камеру для анестезии изофлураном. При достижении желаемого действия крыс извлекают и помещают в лежачее положение на брюхе (грудинная позиция). Заднюю левую лапу зажимают и иглу вводят подкожно, вентрально, между подушечками пальцев #2 и #3 для нахождения середины лапы (плюсневая область). Наконец, объем 100 мкл раствора FCA или 100 мкл раствора каррагинана медленно инъецируют в лапу и небольшое давление прикладывают в течение 3-4 секунд после извлечения игл.
Если животные просыпаются во время процедуры, их возвращают в ингаляционную камеру до достижения желаемого действия.
После инъекции в подошву животным дают возможность проснуться под наблюдением в своей клетке.
При обработке FCA крыс оставляют на 48 часов для развития воспаления. При обработке каррагинаном крыс оставляют на 3 часа для развития воспаления. Утром в день тестирования крыс помещают в лабораторию (в свои клетки). Им дают возможность освоиться в помещении в течение 30 минут.
Тестируемая область
Тепловой стимул прикладывают к центру поверхности подошвы между подушечками. Тестируемая область должна быть в контакте со стеклом, причем между подошвой и стеклом не должно быть мочи или фекалий для обеспечения корректных теплопроводящих свойств от стекла к коже.
Аппарат для подошвенного теста состоит из бокса со стеклянным верхом/платформой, температуру стеклянной поверхности поддерживают на уровне 30°С по механизму обратной связи. Ниже этой стеклянной платформы располагается лампа накаливания, прикрепленная к подвижной стойке, зеркало располагается ниже для того, чтобы дать возможность направить свет на лапу крысы. При включении лампы она светит через отверстие диаметром приблизительно 2 мм. Экспериментатор включает свет, и автоматические датчики выключают свет, когда лапа отдергивается от поверхности; прерывание в момент 20,48 секунд обеспечивает гарантию того, что не произойдет повреждение тканей, если крыса не отдернет лапу. Экспериментатор также может выключить свет в любой момент. Таймер регистрирует период времени, в течение которого свет включен.
Флюксметр: измеряет величину поток/см2 при включении света. Она должна поддерживаться равной приблизительно 97-98; поток может быть модифицирован путем настройки аппарата для подошвенного теста, но никогда не должен меняться в середине эксперимента.
Период времени
Эксперимент может быть проведен через различные периоды времени после инициации воспаления. Гипералгезию измеряют через 48 ч после инъекции FCA или 3 ч после инъекции каррагинана.
Процедура теста
Крысы, не подвергнутые обработке: Для построения кривой доза-ответ в качестве контроля используют одну группу из 7 крыс; их подвергают анестезии вместе с остальными 28 крысами, но инъекцию не осуществляют. Тестирование не подвергшейся воздействию группы может быть осуществлено перед началом или непосредственно после эксперимента при минимальном возможном стрессе, крыс помещают в индивидуальные боксы из плексигласа (14×21×9 см) на поверхность аппарата для подошвенного теста; им дают возможность осваиваться в течение 30 минут. Когда животные готовы для тестирования, свет помещают непосредственно под тестируемую область и включают, и регистрируют продолжительность периода до отдергивания лапы. После периода времени 5-8 минут для того, чтобы дать температуре кожи возможность вернуться к нормальной, осуществляют вторую регистрацию, крыс затем извлекают и помещают в свои клетки.
Базовые значения: Оставшихся 28 крыс (разделенных на 4 группы), которым инъецировали FCA (или каррагинан), помещают в индивидуальные боксы на устройстве и дают возможность освоиться в течение 30 минут. Экспериментатор должен оценить степень воспаления лапы и проверить, не изменился ли ее цвет. Тепловой стимул помещают под тестируемую область и регистрируют продолжительность периода до отдергивания лапы; осуществляют две регистрации как ранее. Сравнивают эти базовые значения с базовыми значениями для животных, не подвергнутых обработке, что позволяет определить, присутствует ли гипералгезия.
Тестирование после введения лекарственного средства: Как только установлено наличие гипералгезии, крысам инъецируют интересующее соединение. Каждое соединение готовят и растворяют в наиболее подходящем носителе в соответствии со стандартными способами. Путь введения, дозы, объем и время тестирования после инъекции специфично для соединения (или класса соединений). Когда соединения тестируют через 20-30 минут после инъекции, такой как в.в. или п.к. инъекция, крыс помещают в аппарат для подошвенного теста и дают возможность привыкнуть к нему, пока лекарственное средство проявляет свое действие. Когда соединения тестируют через 60 минут или более после инъекции, крыс помещают назад в свои клетки со своими подстилками. Крыс всегда помещают назад в свои клетки со своими исходными подстилками для минимизации стресса восстановления социальной структуры внутри группы крыс. Через 30 мин крыс помещают в аппарат для подошвенного теста и дают возможность в течение 30 минут привыкнуть к аппарату для тестирования. Тестирование осуществляют в соответствии с описанным ранее. Осуществляют две регистрации.
Критерии тестирования
Животное должно быть спокойным и тихим, уже в состоянии готовности и в правильной позиции, при отсутствии мочи или фекалий между кожей лапы и стеклянной поверхностью аппарата. Животное не должно быть подвергнуто тестированию в том случае, если:
- животное находится в локомоции, включая обнюхивание, чистку и обследование;
- животное спит;
- животное демонстрирует очевидные признаки стресса (тоническая неподвижность, вокализации, прижатые уши), если только они не являются возможным результатом побочного действия соединения и их нельзя избежать;
- животное расположено таким образом, что лапа не находится в непосредственном контакте со стеклом (лапа лежит на поверхности хвоста);
- лапа животного приобретает голубой цвет в результате плохой инъекции. В этом случае животное полностью исключают из эксперимента (в начале).
Когда присутствуют моча или фекалии, животное извлекают, стеклянную поверхность вытирают дочиста, и затем животное помещают назад. Когда животное спит или демонстрирует токсическую неподвижность, экспериментатор может мягко подвинуть бокс или помахать руками перед боксом для того, чтобы вызвать кратковременное внимание. В процессе теста следует проводить детальное наблюдение за поведением животного.
Повторные тесты
В любой момент в процессе эксперимента, если экспериментатор не уверен, что отдергивание лапы не является реакцией на тепловой стимул, животное может быть тестировано повторно через 5-8 минут. Это может быть результатом неожиданного движения животного или мочеиспускания, или дефекации при прикладывании стимула.
Приемлемые реакции
Любую из следующих реакций рассматривают как реакцию на тепловой стимул:
- отдергивающее движение лапы от стекла (часто с последующим лизанием лапы);
- латеральное движение тела (контралатеральное по отношению к стимулированной лапе);
- пальцы отдергиваются от стекла;
- центропланарная часть (середина лапы) воспаленной лапы отдергивается от стекла.
Анализ
Данные выражают в виде среднего значения ± СОС. Статистическую значимость оценивают с использованием Т-теста для сравнения крыс, не подвергнутых воздействию, с крысами, имеющими воспаление, и односторонним ANOVA с последующим тестом множественного сравнения Дуннетта (post-hoc) для эффективности лекарственного средства. Различие между группами рассматривают как значимое при минимальном значении р не больше 0,05.
Метаболизм лекарственного средства и фармакокинетические свойства
Неожиданно было обнаружено, что одно или более чем одно метаболическое и фармакокинетическое свойство соединений улучшается благодаря фторо-замещению на нижнем бензиле бензилпиперазинильной группировки формулы I. В одном из воплощений обнаружено, что определенные реакционноспособные метаболиты уменьшены или элиминированы для соединений по настоящему изобретению. В еще одном воплощении некоторые соединения по настоящему изобретению обеспечивают улучшенную биологическую доступность, которая может являться результатом их слабой аффинности с 2D6 и 3А4 цитохромом Р450. Следующие анализы демонстрируют одно или более таких неожиданных свойств этих соединений.
Инкубации с микросомами
Соединение по настоящему изобретению (10 мкМ номинальная исходная концентрация) индивидуально инкубировали с микросомами печени крысы (0,5 мг/мл белка) в 0,1 М буфере KH2PO4 (рН 7,4) с 5 мМ MgCl2 и 5 мМ детектирующего реагента (глутатион (GSH), N-ацетилцистеин (NAC) или CH3ONH2) в течение 60 мин при 37°С. Реакции инициируют путем добавления восстановленного никотинамидадениндинуклеотидфосфата NADPH (1 мМ) и останавливают путем добавления к инкубационной смеси равного объема подкислителя (0,1%-ная муравьиная кислота в ацетонитриле).
Инкубации с гепатоцитами
Соединение по настоящему изобретению (номинальная исходная концентрация 10 мкМ) в течение 1 часа при рН 7,4 и 37°С индивидуально инкубировали со свежевыделенными гепатоцитами крыс (Sprague Dawley) и хранившимися при криогенной температуре гепатоцитами собак (бигль) (1×106 клеток/мл). Инкубационные смеси с гепатоцитами, содержащие среду Williams Е, дополненную 25 мМ HEPES, 1% ITS-G раствора (Life Technologies, кат. №41400-045), 10 мМ HEPES (pH 7,4) и 2 мМ L-глутамина. Инкубации останавливали путем добавления к инкубационной смеси равного объема подкисленного (0,1% муравьиная кислота) ацетонитрила.
Анализ путем жидкостной хроматографии/масс-спектрометрии (ЖХ-МС)
После осаждения белка супернатанты образцов анализировали в отношении метаболитов при помощи ЖХ-МС с полным сканированием. Информацию о молекулярной массе получали для каждого обнаруживаемого метаболита. Картины фрагментации в результате дополнительных экспериментов ЖХ-МС/МС анализировали для того, чтобы помочь определить структуры первичных метаболитов.
Результаты тестирования
Первичные пути биотрансформации, обнаруженные для соединений, представляли собой N-деэтилирование, N-деалкилирование и гидроксилирование. Для соединения по настоящему изобретению, имеющему фторзамещенную бензил-пиперазинильную группировку, в инкубатах гепатоцитов крыс не обнаружили глутатионовый аддукт на бензоле. Наоборот, некоторое количество глутатионового аддукта на кольце обнаружили в инкубатах гепатоцитов крыс для похожих соединений без фторзамещенного бензильного кольца.
Способы микродиализа in vivo
Способ
Крыс случайным образом распределяют в восемь групп для обработки:
носитель-спокойная, носитель-стресс, лекарственное средство-спокойная, лекарственное средство-стресс. Зонды для микродиализа (СМА/12, длина мембраны 4 мм для mPFC) имплантируют в головной мозг за 2 часа перед экспериментом и перфузируют искусственной спинномозговой жидкостью (СМЖ) (aCSF, CMA Microdialysis AB) со скоростью потока 1,1 мл/мин в течение 2 ч для стабилизации базовой величины. Три образца отбирают через 20 мин для определения базовой величины, животным в.б. инъецируют носитель или соединения и забор образцов проводят в течение следующих 5 ч. Программу процедуры стресса начинают через 20 мин после введения соединений. Образцы немедленно (интерактивно) инъецируют в систему высокоэффективной жидкостной хроматографии (ВЭЖХ) для анализа концентраций моноаминов. Концентрации нейротрансмиттеров в 3 образцах, отобранных перед введением соединений/носителя, усредняют и определяют в качестве базовой величины (100%). Концентрации нейротрансмиттеров в последующих микродиализатах затем выражают в виде процента от базовых уровней.
Процедура стресса
Для процедуры стресса используют стандартные боксы для пассивного избегания, оборудованные лампочками, звуковыми сигналами и шокерами (Med Associates, Inc). Боксы помещают в звукопоглощающие камеры. Модель стресса осуществляют в течение одного дня. Животных акклиматизируют в камерах в течение 2 часов, затем в течение 6 минут подвергают воздействию серий мигающего света с последующими электрическими ножными шоками (длительность 0,5 с, интенсивность 1,5 мА, в общей сложности 10 шоков). "Тихую" группу подвергают в камерах воздействию света, но без шока. Через 40 минут световую последовательность в отношении последних животных повторяли, но без шока.
Введение лекарственных средств
Все соединения растворяют в стерильной дистиллированной воде (носитель) и вводят внутрибрюшинно (в.б.) за 20 мин перед процедурой стресса.
ВЭЖХ и электрохимическое детектирование
Система ВЭЖХ состоит из насоса 5041, детектор модель 5200А Coulochem II, колонки MD-150 3×150 мм, амперометрическая ячейка модель 5041 (все от ESA Inc) и инжектора в режиме онлайн (от BAS Inc). Подвижная фаза представляет собой: 75 мМ Na2HPO4, 25 мМ ЭДТА, 1,7 мМ 1-октансульфоновая кислота, 100 мкл/л триэтиламин, 10% ацетонитрил, рН 3,0. Потенциал устанавливают на уровне +0,65 В, скорость потока поддерживают на уровне 0,3 мл/мин. Данные собирают с использованием системы получения информации/анализа на основе персонального компьютера (ПК) (компьютер 501 и программное обеспечение A/D Software, ESA, Inc), интегрируют и переносят в электронные таблицы/графическое программное обеспечение для дополнительного анализа.
Когда группы из 6-8 крыс, подготовленных с внутримозговыми зондами для микродиализа, размещенными в серединной предфронтальной коре головного мозга (где нейрохимический сигнал является самым сильным), подвергают воздействию описанной выше модели, у животных, обработанных разбавителем, обнаруживают увеличение концентрации норэпинефрина (НЭ) и дофамина. Некоторые соединения по изобретению блокируют длительное увеличение концентрации НЭ и дофамина.
Модель тревоги Геллера-Зейфтера (Geller-Siefter)
В конфликтном тесте голодных животных обучают нажимать на рычаг для поступления корма в стандартную оперантную камеру при двух условиях. При первом условии, названном "неподавленный компонент", корм доставляется в среднем после 17 нажатий на рычаг (также названном "схема VR17 усиления"). При втором условии, названном "подавленный компонент", о котором сгнализируют вспышки света внутри оперантной камеры, корм также поставляется в среднем после 17 нажатий на рычаг, но к полу клетки дополнительно подводится электрический шок в отдельной схеме VR17. Дневные сеансы состоят из 5 чередующихся презентаций каждого из компонентов: подавленных (длительность 3 мин) и неподавленных (длительность 3 мин). Количество нажатий на рычаг, вызванное в подавленном компоненте, очевидно ниже по сравнению с неподавленным компонентом. Противотревожные средства, такие как диазепам, увеличивают количество нажатий на педаль, которые животное производит в подавленном компоненте на протяжении некоторого диапазона доз, без изменения количества нажатий на рычаг, которые животное производит в неподавленном компоненте. Некоторые соединения по изобретению в этом способе проявляются как анксиолитические средства.
ПРИМЕРЫ
Изобретение дополнительно подробно описано при помощи следующих примеров, в которых описаны способы, посредством которых соединения по настоящему изобретению могут быть получены, очищены, проанализированы и подвергнуты биологическому тестированию, и которые не рассматривают как ограничивающие изобретение.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 1: 4-Йод-N,N-диэтилбензамид
К смеси 4-йодбензоилхлорида (75 г) в 500 мл CH2Cl2 при 0°С добавляли смесь Et3N (50 мл) и Et2NH (100 мл). После добавления получающуюся в результате реакционную смесь нагревали до комнатной температуры в течение 1 ч и затем промывали насыщенным хлоридом аммония. Органический экстракт сушили (Na2SO4), фильтровали и выпаривали. Остаток перекристаллизовывали из гексанов с получением 80 г ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 1.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 2: 4-[гидрокси(3-нитрофенил)метил]-N,N-диэтилбензамид
N,N-Диэтил-4-йодбензамид (5,0 г, 16 ммоль) растворяли в ТГФ (150 мл) и охлаждали до -78°С в атосфере азота. По каплям в течение 10 мин при температуре от -65°С до -78°С добавляли н-BuLi (15 мл, 1,07 М раствор в гексане, 16 ммоль). Раствор затем канюлировали в 3-нитробензальдегид (2,4 г, 16 ммоль) в смесь толуол/ТГФ (тетрагидрофуран) (приблизит. 1:1, 100 мл) при -78°С. Через 30 мин добавляли NH4Cl (водн). После выпаривания в вакууме, экстракции смесью EtOAc/вода, сушки (MgSO4) и упаривания органической фазы остаток очищали путем хроматографии на диоксиде кремния (0-75% EtOAc/гептан) с получением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 2 (2,6 г, 50%).
1H ЯМР (400 МГц, CDCl3) δн 1.0-1.3 (m, 6H), 3.2 (m, 2H), 3.5 (m, 2H), 5.90 (s, 1Н), 7.30-7.40 (m, 4Н), 7.50 (m, 1H), 7.70 (d, J=8 Гц, 1Н), 8.12 (m, 1H), 8.28 (m, 1Н).
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 3: N,N-диэтил-4-[(3-нитрофенил)(1-пиперазинил)метил]бензамид
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 2 в виде спирта (10,01 г, 30,5 ммоль) в дихлорметане (200 мл) добавляли тионилбромид (2,58 мл, 33,6 ммоль). Через один час при комнатной температуре реакционную смесь промывали насыщенным водным бикарбонатом натрия (100 мл) и органический слой отделяли. Водный слой промывали дихлорметаном (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали.
Неочищенный бензилбромид растворяли в ацетонитриле (350 мл) и добавляли пиперазин (10,5 г, 122 ммоль). После нагревания реакционной смеси в течение одного часа при 65°С реакционную смесь промывали смесью насыщенный хлорид аммония/этилацетат и органический слой отделяли. Водный слой экстрагировали этилацетатом (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали с получением рацемического ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 3.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 4б: N,N-диэтил-4-[(R)-(3-нитрофенил)(1-пиперазинил)метил]бензамид
Рацемическое ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 3 растворяли в зтаноле (150 мл) и добавляли ди-пара-толуоил-D-винную кислоту (11,79 г, 1 эквивалент). Продукт осаждали в течение 12 часов. Твердый продукт собирали путем фильтрования и перерастворяли в кипящем с обратным холодильником этаноле до растворения всего твердого вещества (приблизительно 1200 мл этанола). После охлаждения твердое вещество собирали путем фильтрования и перекристаллизацию повторяли. Твердое вещество собирали путем фильтрования и обрабатывали водным гидроксидом натрия (2 М) и экстрагировали этилацетатом. Органический экстракт затем сушили (Na2SO4), фильтровали и выпаривали с получением 1,986 г ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б.
1H ЯМР (400 МГц, CDCl3) δH 1.11 (шир. s, 3Н), 1.25 (шир. s, 3Н), 2.37 (шир. s, 4Н), 2.91 (t, J=5 Гц, 4Н), 3.23 (шир. s, 2H), 3.52 (шир. s, 2H), 4.38 (s, 1H), 7.31-7.33 (m, 2H), 7.41-7.43 (m, 2H), 7.47 (t, J=8 Гц, 1H), 7.75-7.79 (m, 1H), 8.06-8.09 (m, 1H), 8.30-8.32 (m, 1H).
Хиральную чистоту определяли путем ВЭЖХ с использованием следующих условий:
Колонка Chiralpack AD (Daicel Chemical Industries)
Низкая скорость 1 мл/минуту
Время анализа 30 минут при 25°С
Изократический 15% этанол (содержащий 0,1% об./об. диэтиламин) 85% гексаны (содержащие 0,1% об./об. диэтиламин)
Время удержания молекулы = 20 минут.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 4а: N,N-диэтил-4-[(S)-(3-нитрофенил)(1-пиперазинил)метил]бензамид
(S) Энантиомер ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4а может быть получен путем осуществления вышеописанной процедуры разделения с использованием ди-пара-толуоил-L-винной кислоты.
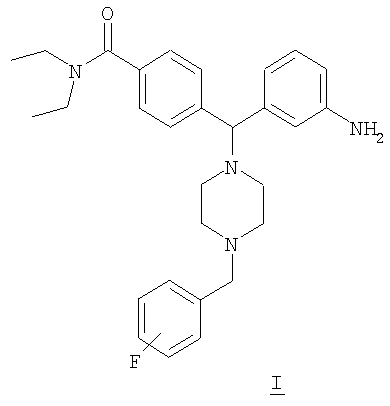
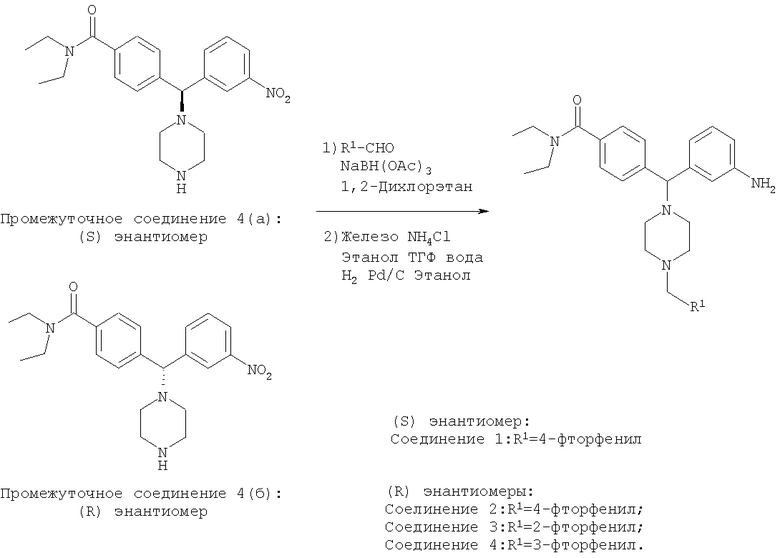
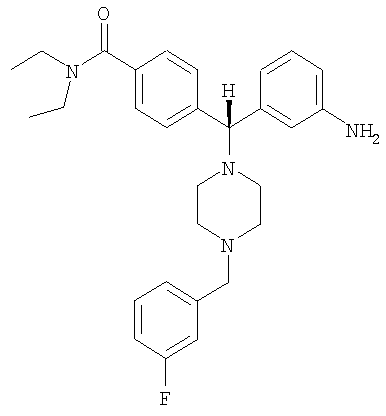
СОЕДИНЕНИЕ 1: 4{(S)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил-N,N-диэтилбензамид
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4а (467 мг) в 1,2-дихлорэтане (13 мл) добавляли 4-фторбензальдегид (252 мкл; 2 экв.) и триацетоксиборгидрид натрия (498 мг; 2 экв.). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов и выпаривали. Добавляли насыщенный бикарбонат натрия и водный раствор экстрагировали тремя порциями дихлорметана и объединенные органические вещества сушили над безводным сульфатом натрия, фильтровали и выпаривали. Соединение растворяли в смеси этанола, тетрагидрофурана, воды и насыщенного хлорида аммония (4 мл; отношение 4:2:1:1 об./об.). Добавляли наночастицы железа (3 раза на кончике шпателя) и раствор нагревали при 150°С в течение 10 минут под воздействием микроволн. Получающуюся в результате смесь охлаждали, фильтровали через целит и выпаривали. Остаток очищали путем флэш-хроматографии на силикагеле, элюируя градиентом от 1% до 5% МеОН в дихлорметане. Полученный продукт растворяли в дихлорметане, в который добавляли 1,2 мл 1 М HCl в диэтиловом эфире. Растворитель удаляли и продукт выделяли в виде соли гидрохлорид с получением СОЕДИНЕНИЯ 1 (164 мг, выход 30%) в виде бесцветного твердого вещества. Чистота (ВЭЖХ): больше 99%; оптическая чистота (хиральная ВЭЖХ): больше 99%;
1H ЯМР (400 МГц, CD3OD), 1.08 (t, J=6,5 Гц, 3Н), 1.21 (t, J=6,5 Гц, 3Н), 3.20-3.26 (m, 4Н), 3.51-3.54 (m, 6H), 4.43 (s, 2Н), 7.19-7.23 (m, 2H), 7.34 (d, J=8,0 Гц, 1Н), 7.40 (d, J=8,0 Гц, 2H), 7.54-7.63 (m, 3Н), 7.70-7.82 (m, 4H). Обнаружено: С, 54,63; Н, 6,49; N, 8,68. C29H36N4OF × 4,1 HCl × 0,8 H2O × 0,1 С4Н10О имеет С, 57,67; Н, 6,51; N, 8,67%.
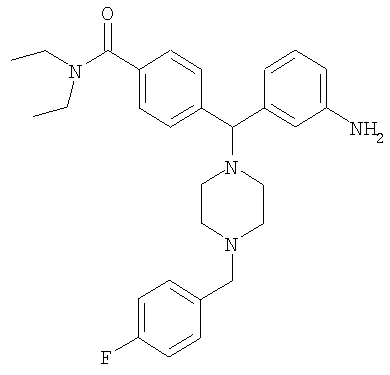
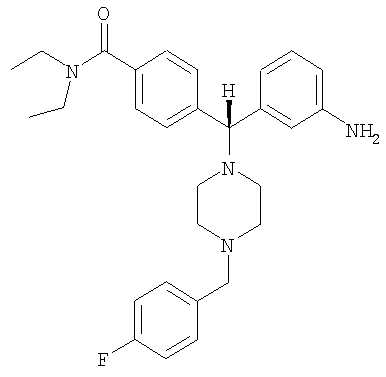
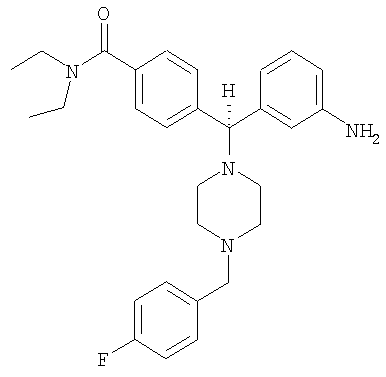
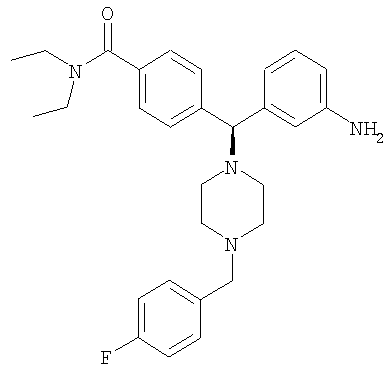
СОЕДИНЕНИЕ 2: 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамид
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б (5,790 г, 14,6 ммоль) в 1,2-дихлорэтане (60 мл) добавляли 4-фторбензальдегид (2,04 мл, 19,0 ммоль) и триацетоксиборгидрид натрия (4,02 г, 19,0 ммоль). Через 20 часов при комнатной температуре реакционную смесь гасили водным бикарбонатом натрия и органический слой отделяли. Водный слой экстрагировали дихлорметаном (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали. Остаток очищали путем флэш-хроматографии, элюируя 30-50% ацетоном в гексанах с получением бесцветной пены (5,285 г, 71%), представляющей собой нитро-промежуточное соединение. Нитро-промежуточное соединение (5,285 г, 10,4 ммоль) растворяли в смеси этанола, тетрагидрофурана, воды и водного насыщенного хлорида аммония (отношение 4:2:1:1 об./об.) (100 мл) и добавляли гранулы железа (0,63 мг, 11,5 ммоль). Реакционную смесь нагревали до температуры дефлегмации и периодически добавляли дополнительное количество гранул железа. Через 24 часа кипячения с обратным холодильником (90°С) реакционную смесь охлаждали до комнатной температуры и фильтровали через целит и выпаривали. К остатку добавляли водный бикарбонат натрия и дихлорметан. Органический слой отделяли и водный слой экстрагировали дихлорметаном (3×100 мл) и объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали. Остаток очищали на силикагеле, элюируя 1-5% метанолом в дихлорметане с получением СОЕДИНЕНИЯ 2 (3,505 г) в виде темно-желтой пены. Неочищенное вещество дополнительно получали путем вышеуказанной флэш-хроматографии и повторно очищали путем второй флэш-хроматографии, элюируя от 100% этилацетата до 5% метанола в этилацетате с получением еще 0,949 г СОЕДИНЕНИЯ 2. Полученное комбинированное вещество: 4,454 г (выход 90%). Чистота (ВЭЖХ): больше 99%; оптическая чистота (хиральная ВЭЖХ): больше 99%; 1H ЯМР (400 МГц, CD3OD) 1.08 (t, J=6,5 Гц, 3Н), 1.21 (t, J=6,5 Гц, 3Н), 3.20-3.26 (m, 4H), 3.51-3.54 (m, 6H), 4.43 (s, 2Н), 7.19-7.23 (m, 2Н), 7.34 (d, J=8,0 Гц, 1H), 7.40 (d, J=8,0 Гц, 2Н), 7.54-7.63 (m, 3Н), 7.70-7.82 (m, 4H). Обнаружено: С, 54,00; Н, 6,34; N, 8,47. C29H35FN4O × 4,7 HCl × 0,2 С4Н10О × 0,1 H2O имеет С, 54,02; Н, 6,37; N, 8,46%.
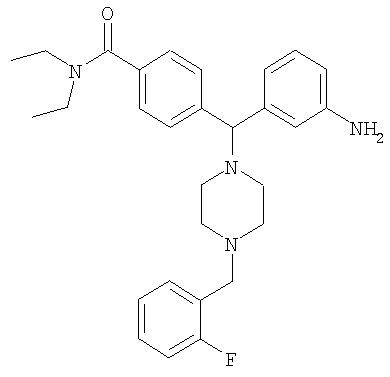
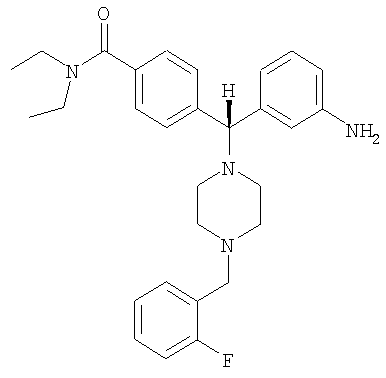
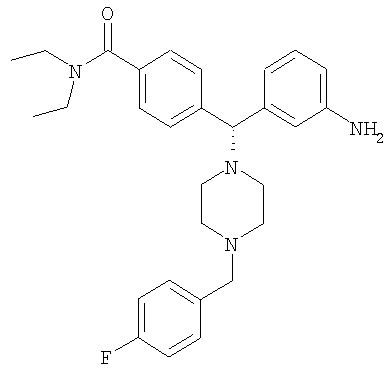
СОЕДИНЕНИЕ 3: 4-[(R)-(3-аминофенил)[4-[(2-фторфенил)метил]-1-пиперазинил]метил]N,N-диэтилбензамид
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б (298 мг, 0,752 ммоль) в 1,2-дихлорэтане (8,5 мл) добавляли 2-фторбензальдегид (160 мг, 1,503 ммоль, 2 экв.) и триацетоксиборгидрид натрия (319 мг, 1,503 ммоль, 2 экв.). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов и выпаривали. Добавляли насыщенный бикарбонат натрия и водный раствор экстрагировали тремя порциями дихлорметана и объединенные органические вещества сушили над безводным сульфатом натрия, фильтровали и выпаривали. Соединение растворяли в смеси этанола, тетрагидрофурана, воды и насыщенного хлорида аммония (3 мл; отношение 4:2:1:1 об./об.). Добавляли наночастицы железа (3 раза на кончике шпателя) и раствор нагревали при 150°С в течение 10 минут под воздействием микроволн. Получающуюся в результате смесь охлаждали, фильтровали через целит и выпаривали. Неочищенное вещество растворяли в CH2Cl2 и промывали водой. Органический слой отделяли и водный слой экстрагировали дихлорметаном. Объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали. Продукт очищали путем обращенно-фазовой ВЭЖХ (градиент 5-50% CH3CN в H2O, содержащей 0,1% ТФУ) с получением СОЕДИНЕНИЯ 3 (0,28 г, выход 46%) в виде соли ТФУ. Вещество лиофилизировали из CH3CN/H2O с получением темно-желтого порошка. 1H ЯМР (400 МГц, CD3OD) 1.08 (t, J=6,6 Гц, 3Н), 1.22 (t, J=6,6 Гц, 3Н), 2.39 (шир. s, 2H), 3.02 (шир. s, 2H), 3.18-3.38 (m, 4H), 3.43 (шир. s, 2H), 3.52 (q, J=6,8 Гц, 2H), 4.43 (s, 2H), 4.53 (s, 1H), 7.09 (dt, J=2,3, 6,8 Гц, 1H), 7.24-7.30 (m, 1H), 7.30-7.41 (m, 6H), 7.52-7.60 (m, 4H). Анал. рассчит. для C29H35FN4O × 2,8 ТФУ × 0,4 Н2О: С, 51,88; Н, 4,86; N, 6,99. Обнаружено: С, 51,89; Н, 4,89; N, 6,97%. МС (рассчит.): 475,3 (МН+), МС (обнаруж.): 475,2 (МН+). ВЭЖХ: k': 2,35; чистота: больше 99% (215 нм), больше 99% (254 нм), больше 99% (280 нм). Условия ВЭЖХ: Zorbax C-18, градиент 10-95% Б, поток: 1 мл/мин, 25°С, А: 0,1% ТФУ в H2O, Б: 0,1% ТФУ в МеСN.
Вращение: [α]16 D=-8,91 (c=1,179, МеОН).
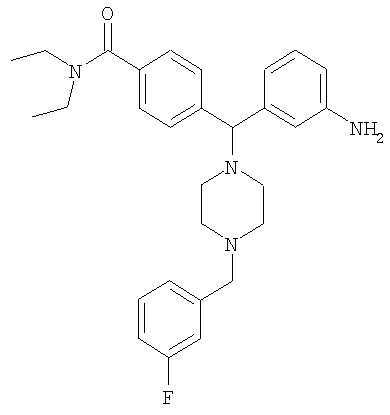
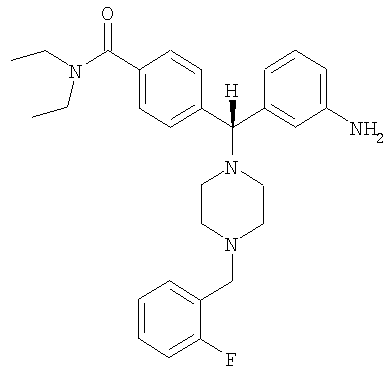
СОЕДИНЕНИЕ 4: 4-[(R)-(3-аминофенил)[4-[(3-фторфенил)метил]-1-пиперазинил]метил]-N,N-диэтилбензамид
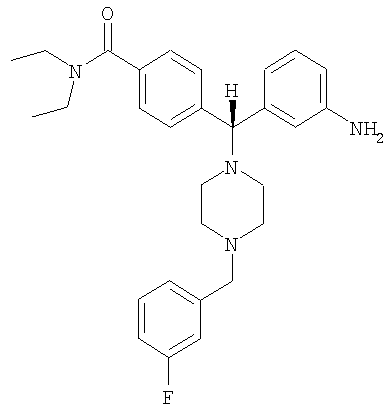
К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ 4б (281 мг, 0,709 ммоль) в 1,2-дихлорэтане (8 мл) добавляли 2-фторбензальдегид (180 мг, 1,417 ммоль, 2 экв.) и триацетоксиборгидрид натрия (300 мг, 1,417 ммоль, 2 экв.). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов и выпаривали. Добавляли насыщенный бикарбонат натрия и водный раствор экстрагировали тремя порциями дихлорметана и объединенные органические вещества сушили над безводным сульфатом натрия, фильтровали и выпаривали. Продукт растворяли в смеси этанола, тетрагидрофурана, воды и насыщенного хлорида аммония (3 мл; отношение 4:2:1:1 об./об.). Добавляли наночастицы железа (3 раза на кончике шпателя) и раствор нагревали при 150°С в течение 10 минут под воздействием микроволн. Получающуюся в результате смесь охлаждали, фильтровали через целит и выпаривали. Получающийся в результате продукт растворяли в CH2Cl2 и промывали водой. Органический слой отделяли и водный слой экстрагировали дихлорметаном. Объединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали. Продукт очищали путем обращенно-фазовой ВЭЖХ (градиент 5-50% CH3CN в H2O, содержащей 0,1% ТФУ) с получением СОЕДИНЕНИЯ 4 (0,375 г, выход 65%) в виде соли ТФУ. Это вещество лиофилизировали из CH3CN/Н2О с получением темно-желтого порошка. 1Н ЯМР (400 МГц, CD3OD) 1.08 (t, J=6,4 Гц, 3Н), 1.21 (t, J=6,8 Гц, 3Н), 2.38 (шир. s, 2Н), 3.00 (шир. s, 2Н), 3.16-3.28 (m, 4Н), 3.40 (шир. s, 2Н), 3.51 (q, J=6,8 Гц, 2Н), 4.37 (s, 2H), 4.56 (s, 1H), 7.18 (ddd, J=1,2, 2,3, 7,8 Гц, 1Н), 7.24 (ddd, J=1,0, 2,7, 8,8 Гц, 1H), 7.28-7.38 (m, 4H), 7.55 (d, J=8,2 Гц, 2H).
Анал. рассчит. для C29H35FN4O × 2,7 ТФУ × 1,1 H2O: С, 51,50; Н, 5,01; N, 6,98. Обнаружено: С, 51,52; Н, 5,01; N, 6,87%. МС (рассчит.): 475,3 (МН+), МС (обнаруж.): 475,2 (МН+). ВЭЖХ: k': 2,43; чистота: больше 99% (215 нм), больше 99% (254 нм), больше 99% (280 нм). Условия ВЭЖХ: Zorbax C-18, градиент 10-95% Б, поток: 1 мл/мин, 25°С, А: 0,1% ТФУ в H2O, Б: 0,1% ТФУ в MeCN. Вращение: [α]16 D=-8,94 (с=1,04, МеОН).
Описаны соединение формулы, его фармацевтически приемлемая соль или их смесь, энантиомерно чистый 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамид или его фармацевтически приемлемая соль. Соединения полезны в терапии, в частности для устранения боли, депрессии и тревоги. Описаны также способ терапии тревоги, способ терапии боли и способ терапии депрессии у животного. 5 н.п. ф-лы, 1 табл.

1. Дифенилметилпиперазиновое соединение формулы
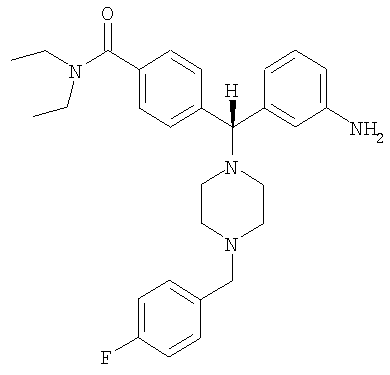
его фармацевтически приемлемая соль или их смесь.
2. Энантиомерно чистый 4-{(R)-(3-аминофенил)[4-(4-фторбензил)пиперазин-1-ил]метил}-N,N-диэтилбензамид или его фармацевтически приемлемая соль.
3. Способ терапии тревоги у теплокровного животного, включающий введение указанному животному, нуждающемуся в такой терапии, соединения по п.1 или 2 или его фармацевтически приемлемой соли в количестве, эффективном для такой терапии.
4. Способ терапии боли у теплокровного животного, включающий введение указанному животному, нуждающемуся в такой терапии, соединения по п.1 или 2 или его фармацевтически приемлемой соли в количестве, эффективном для такой терапии.
5. Способ терапии депрессии у теплокровного животного, включающий введение указанному животному, нуждающемуся в такой терапии, соединения по п.1 или 2 или его фармацевтически приемлемой соли в количестве, эффективном для такой терапии.
| ГАЗОАНАЛИЗАТОР | 1994 |
|
RU2094794C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРНОГО КОЭФФИЦИЕНТА ЛИНЕЙНОЙ ДЕФОРМАЦИИ | 1996 |
|
RU2094786C1 |
| WO 03094853 A2, 20.11.2003 | |||
| RU 2133744 C1, 27.09.1999. | |||
Авторы
Даты
2010-11-20—Публикация
2005-07-27—Подача