Данное изобретение относится к области медицинской диагностики, а именно к выявлению бактериальных инфекций
Острые кишечные инфекции (ОКИ) широко распространены среди всех возрастных групп, при этом занимают значительное место в структуре детской смертности. ОКИ - это группа заболеваний различной этиологии (дизентерия, сальмонеллезы, брюшной тиф, кишечная коли-инфекция и др.). В США ежегодно регистрируется 6,5 млн случаев пищевых инфекций и свыше 9000 летальных исходов. Среди бактериологически расшифрованных случаев на первом месте был сальмонеллез, далее шигеллез (Г.И.Осипова, 2002, Kilgore P.E., 1995). Эти заболевания бактериальной этиологии объединяют сходный патогенез (бактериемия/антигеемия, воздействие токсинов, нарушение обменных процессов) и похожие клинические проявления - кишечный синдром, эксикоз, токсикоз (Т.Е.Ивановская, Л.В.Леонова, 1989), что затрудняет их клиническую дифференциацию. Для подтверждения диагноза используют бактериологические методы исследования: посевы кала, крови, рвотных масс, а также серологические методы для выявления в динамике уровня специфических антител к бактериям (В.В. Иванова, 2002). Ввиду огромного эпидемиологического значения кишечных инфекций особую значимость приобретают ускоренные методы диагностики для назначения адекватной этиотропной и патогенетической терапии.
Известным способом выявления бактериальных инфекций является проведение реакции непрямой гемагглютинации РНГА.
1. В 10 лунок ряда вносят по 0,5 мл 9%-ного раствора хлорида натрия.
2. В 1-ю лунку ряда вносят 0,5 мл исследуемой сыворотки, разведенной 1:25, и делают серию двукратных разведений от 1:50 до 1:6400 путем переноса из лунки в лунку 0,5 мл и перемешивания их не менее 3-4 раз.
3. В каждую лунку добавляют по 0,2 мл 1%-ной рабочей взвеси диагностикума. Одновременно ставят контроли.
4. Пластины слегка встряхивают и инкубируют при температуре 37°С 1,5-2 ч.
5. Инкубация при комнатной температуре 14-18 ч.
6. Оценка результатов
Этот метод позволяет получить хорошие результаты. Однако существуют обстоятельства, снижающие его эффективность: он занимает много времени (24 часа), трудоемок и для получения результатов требуется дополнительное оборудование (микропланшеты и спектрофотометр), препараты невозможно длительно хранить и фотографировать. В ряде случаев определение серологических маркеров малоэффективно: у новорожденных вследствие несформировавшейся иммунной системы, при угнетении иммунной системы и в начальной стадии болезни, так как антитела образуются отсроченно.
Наиболее близким к предлагаемому нами способу является "Способ диагностики гемофильной инфекции в гистологических препаратах" патент на изобретение №21932004 от 20.11.02, Р.А.Насыров, А.С.Кветная, М.В.Маньков.
1. Гистологические парафиновые срезы тканей депарафинизируют в трех порциях ксилола, по 15 минут в каждой, при температуре 60°С.
2. Промывают в фосфатно-солевом буфере (рН 7.2-7.4) в течение 3-4 минут.
3. Обрабатывают 0,1% раствором трипсина в 0,1% CaCl2 в течение 20 минут.
4. Обрабатывают 0,03% перекисью водорода в течение 20 минут.
5. Промывают в двух порциях фосфатно-солевого буфера (рН 7.2), по 5 минут в каждой.
6. Инкубируют в 0,3% ТритонХ-100 при температуре 37°С в течение 15 минут.
7. Наносят поликлональные кроличьи антитела к рибозилрибитолфосфату. Инкубируют с поликлональными антителами при температуре 37°С в течение 45 минут.
8. Промывают в воде в течение 5 минут.
9. Промывают в двух порциях фосфатно-солевого буфера (рН 7.2), по 5 минут в каждой.
10. Наносят антивидовой конъюгат DAKO En Vision+System, HRP и инкубируют в течение 45 мин в темной камере при комнатной температуре.
11. Промывают в двух порциях фосфатно-солевого буфера (рН 7.2), по 5 минут в каждой.
12. Обрабатывают материал в водном растворе, содержащем 0,05% 3,3-диаминобензидин тетрахлорида (ДАБ) и 0,025% перекиси водорода, в течение 3 минут.
13. Слабо докрашивают гематоксилином.
14. Микроскопия.
Этот метод позволил авторам получить хорошие результаты. Однако недостатком данного метода является то, что он травматичен, так как материалом для исследования служат биоптаты. Проведение всех этапов способа достаточно длительно по времени. Взятие биоптата, его фиксация, заливка в парафин, приготовление гистологических срезов занимают не менее 6-7 часов и более 5 часов уходит на проведение иммунопероксидазной реакции. За счет высокого фонового окрашивания при работе с парафиновыми срезами снижается точность результата.
Устранению указанных недостатков может помочь предлагаемый авторами способ диагностики ОКИ, основанный на выявлении антигенов возбудителей.
Технический результат изобретения состоит в сокращении сроков и в повышении точности диагностики. Этот результат достигается тем, что антиген возбудителя ОКИ определяют непрямым иммунопероксидазным методом и согласно изобретению клетки крови (лимфоцитарную взвесь в объеме 0,05 мл), полученные путем центрифугирования, наносят на предметное стекло (мазок), высушивают при комнатной температуре, фиксируют в чистом ацетоне - 3-5 мин, затем обрабатывают в 3% Н2О2 20 минут, инкубируют с нормальной блокирующей сывороткой (10 минут), инкубируют с поли- или моноклональными антителами к искомым антигенам при температуре 37°С в течение 45 минут, инкубируют с полимерной системой детекции (Super Enhacer в течение 20 мин в темной камере при комнатной температуре, инкубируют с SS Label в течение 30 мин в темной камере при комнатной температуре), далее обрабатывают 3,3-диаминобензидин тетрахлоридом (ДАБ) и наличие коричневых гранул в лимфоцитах и моноцитах свидетельствует о выявлении искомого антигена возбудителя (диагностике инфекции) для своевременного назначения этиотропной и патогенетической терапии. Способ хорошо воспроизводим, что свидетельствует о его надежности.
Стандартная схема непрямого иммунопероксидазного метода описана Дж.Полак, С.Ван-Норден. Введение в иммуноцитохимию. М.: Мецицина, 1986 г.
1 - промывка срезов в буфере;
2 - обработка 0,03% раствором перекиси водорода;
3 - промывка в буфере;
4 - нанесение на срез первых специфических антител;
5 - промывка в буфере;
6 - нанесение вторых антител, связанных с пероксидазой;
7 - промывка в буфере;
8 - обработка 0,03% раствором диаминобензидина (ДАБ);
9 - докраска гематоксилином;
10 - заключение в бальзам. Микроскопия.
Но как показывают данные литературы и собственный опыт, приведенная схема лишь в общем виде отражает ход постановки методики. В зависимости от размеров, структуры и природы выявляемого антигена необходима детальная разработка всех этапов, начиная с фиксации и до нанесения диаминобензидина.
Предложенный авторами метод отличается тем, что для выявления антигенов возбудителей ОКИ в качестве объекта исследования была впервые использована лимфоцитарная взвесь.
Опытным путем было выявлено, что необходимо 0,05 мл лимфоцитарной взвеси как минимально достаточного количества для приготовления мазка, проведения иммуноцитогистохимической окраски и адекватной оценки результата.
В рамках предлагаемого способа впервые предложена обработка мазков более концентрированным (3%) раствором перекиси водорода, способствующая более полному и качественному блокированию эндогенной пероксидазы, что особенно важно при использовании лимфоцитарной взвеси.
Одна из сложных проблем - это возможное наличие в сыворотке неспецифических (фоновых) антител. Для устранения неспецифической реакции предложена обработка нормальной (блокирующей) сывороткой перед нанесением первых антител.
Использование в качестве системы детекции полимерного комплекса Super Sensitiv Polimer-HRP Detection System производства BioGenex, как более чувствительного, позволило использовать специфические антитела в малых концентрациях и свести до минимума фон неспецифического окрашивания, чего нельзя было достичь при применении обычных систем детекции. Кроме вышеуказанного, эта система детекции не содержит авидин и биотин, следовательно, неспецифическое окрашивание при взаимодействии авидина с эндогенным биотином исключается. Кровь является сложным и чувствительным объектом при проведении иммуногистоцитохимических исследований. В связи с этим предложенный новый способ диагностики ОКИ, основанный на выявлении антигенов возбудителей в клетках крови, требует выполнения комплекса разработанных методических приемов. Невыполнение последних не дает объективных результатов или искажает конечный результат исследований, не позволяет провести соответствующую интерпретацию полученных данных.
Предложенный способ осуществляется следующим образом.
1. Лимфоциты и моноциты, полученные путем центрифугирования периферической крови, наносят на предметное стекло (мазок).
2. Высушивают при комнатной температуре.
3. Фиксация в чистом ацетоне 3-5 мин.
4. Промывают в фосфатно-солевом буфере (рН 7.4) в течение 3-4 минут.
5. Обработка в 3% Н2О2 20 минут.
6. Промывка в двух порциях фосфатно-солевого буфера (рН 7.4), по 5 минут в каждой.
7. Инкубация в нормальной блокирующей сыворотке (Power Block) 10 минут.
8. Нанесение на мазки поли- или моноклональных антител к искомым антигенам. Инкубация с данными антителами при температуре 37°С в течение 45 минут.
9. Промывка в воде в течение 5 минут.
10. Промывка в двух порциях фосфатно-солевого буфера (рН 7.4), по 5 минут в каждой.
11. Нанесение на мазки Super Enhacer. Инкубация в течение 20 мин в темной камере при комнатной температуре.
12. Промывка в двух порциях фосфатно-солевого буфера (рН 7.4), по 5 минут в каждой.
13. Нанесение на мазки SS Label. Инкубация в течение 30 мин в темной камере при комнатной температуре.
14. Обработка материала в водном растворе, содержащем 0,05% 3,3-диаминобензидин тетрахлорида (ДАБ) и 0,025% перекиси водорода, в течение 3 минут.
15. Слабая докраска гематоксилином.
16. Микроскопия.
Микроскопию окрашенных препаратов проводят в обычном микроскопе. Продукт реакции при исследовании лимфоцитов и моноцитов, содержащих искомый антиген, выявляется в виде коричневых гранул внутриклеточно и на клеточной оболочке. При оценке данных микроскопического исследования важно учитывать возникновение артефициальных изменений, имитирующих положительную окраску. Чаще всего - это клеточные артефакты, выявляемые по краю мазка. В этом случае необходима оценка реакции на соседних участках.
Необходимые контроли для используемых антител
Для получения достоверных результатов и исключения возможности неспецифических реакций обязательным условием является проведение контролей на качество реактивов и специфичность антисыворотки.
1) Для проведения контроля специфичности антисыворотки в качестве первого слоя наносят неиммунную сыворотку или буфер (результаты должны быть отрицательными).
2) Неспецифичность сыворотки устраняют посредством максимального разведения высококонцентрированной сыворотки и укорочения времени инкубации. Описанный способ подкреплен примерами конкретного выполнения.
Было проведено исследование материала 20 больных острой кишечной инфекцией в первые 3-е суток от начала заболевания, у 8 из них была выявлена экспрессия комплексного антигена Salmonella, у 2-х Sh.Sonnei, у 5 Sh. Flexneri как моноинфекция, у 2-х определялись антигены Sh. Flexneri и Salmonella, у 2-х Sh. Sonnei и Salmonella и у одного Sh. Flexneri и Sh. Sonnei. Полученные результаты полностью совпадали с данными серологического исследования и клинических проявлений. Во всех случаях результаты исследования на выявление антигенов возбудителей ОКИ были получены через 4 часа от момента поступления материала
В качестве примера приводим микрофотографию мазка лимфоцитарной взвеси с четко определяемой экспрессией комплексного антигена Salmonella в лимфоцитах и моноцитах у больного Звягинцева, 4 лет, № истории болезни 5650, ФГУ НИИДИ Росздрава, г.Санкт Петербург от 12.10.2006 г., с выраженными проявлениями острой кишечной инфекции (фиг.1).
Микрофотографии мазка лимфоцитарной взвеси с четко определяемой экспрессией антигена Sh. Flexneri в лимфоцитах и моноцитах больного Пликайс Д., 2 лет, № истории болезни 3347, ДИБ № 3, г.Санкт Петербург от 03.11.2006 г., с клиникой острой кишечной инфекции (фиг.2).
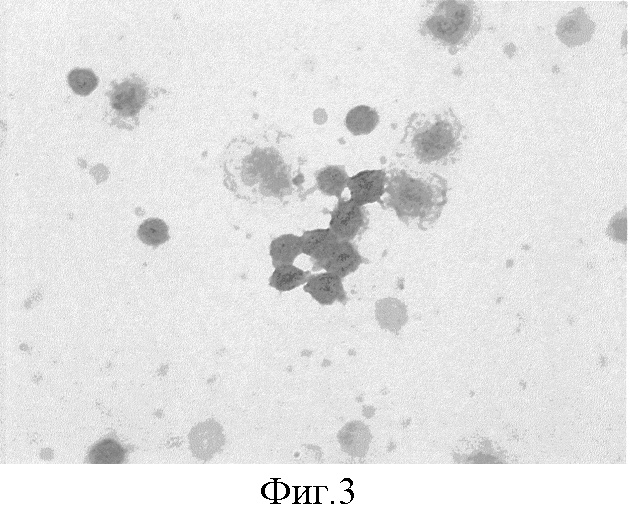
Микрофотографии мазка лимфоцитарной взвеси с выраженной экспрессией антигена Sh. Sonnei в лимфоцитах и моноцитах больного Ефремова А., 4 лет, № истории болезни 3210, ДИБ № 3, г.Санкт Петербург от 27.10.2006 г., с клиникой тяжелого течения острой кишечной инфекции (фиг.3).
В качестве контрольной группы была исследована лимфоцитарная взвесь двух больных с коклюшем и одного больного с герпетической нейроинфекцией. Во всех случаях антигены Salmonella, Sh. Flexneri, Sh. Sonnei не выявлялись.
Таким образом, предложенный способ позволяет с высокой степенью специфичности и достоверности выявлять экспрессию антигенов возбудителей ОКИ в мазках лимфоцитарной взвеси. Разработанный метод обладает и высокой надежностью.
Метод достаточно прост, возможно его широкое применение в практическом здравоохранении для экспресс-диагностики ОКИ и соответственно своевременного назначения этиотропной и патогенетической терапии.
Предлагаемый способ имеет экономическую значимость, т.к. при этом не требуется применения дополнительного лабораторного оборудования и может использоваться в качестве экспресс-диагностики, так как сокращает время получения результата до 3-4 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ЭПШТЕЙН- БАРР | 2002 |
|
RU2247390C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИТОКИНОВ | 2000 |
|
RU2180120C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ОСТРЫХ КИШЕЧНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2536243C1 |
| Способ дифференциальной диагностики бактериальных и вирусных кишечных инфекций у детей раннего возраста | 2017 |
|
RU2669404C1 |
| СПОСОБ ДИАГНОСТИКИ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ (HEMOPHILUS INFLUENZAE) | 2001 |
|
RU2193204C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КИШЕЧНЫХ ИНФЕКЦИЙ | 1992 |
|
RU2098824C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ СМЕШАННОЙ ГЕРПЕСВИРУСНОЙ И БАКТЕРИАЛЬНОЙ ИНФЕКЦИИ У ДЕТЕЙ | 2010 |
|
RU2456616C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ В КРОВИ ОПУХОЛЕВЫХ КЛЕТОК МЕТОДОМ МНОГОПАРАМЕТРОВОЙ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2024 |
|
RU2825188C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ДИФТЕРИЙНОГО ТОКСИНА | 1996 |
|
RU2127886C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. BPM VD-10 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА 5H/E К АНТИГЕНУ 200 KDA ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 2014 |
|
RU2570638C1 |


Изобретение относится к области медицины, а именно к медицинской диагностике. Для диагностики острых бактериальных кишечных инфекций определяют антиген возбудителя ОКИ в лимфоцитарной взвеси непрямым иммунопероксидазным способом. Клетки крови, полученные путем центрифугирования, наносят на предметное стекло (мазок), высушивают при комнатной температуре, фиксируют в чистом ацетоне, затем обрабатывают в 3% Н2О2 20 минут. Инкубируют в блокирующей нормальной сыворотке, инкубируют с поли- или моноклональными антителами к искомым антигенам при t 37°C. Затем обрабатывают реагентами полимерной системой детекции: Super Enhacer™ Reagent и далее с Poly-HRP Reagent. Обрабатывают 3,3-диаминобензидина-тетрахлоридом (ДАБ). Наличие коричневых гранул в лимфоцитах и моноцитах свидетельствует о выявлении искомого антигена, а именно диагностики инфекции. Использование способа позволяет повысить точность и сократить время диагностики острых бактериальных кишечных инфекций. 3 ил.
Способ экспресс-диагностики острых бактериальных кишечных инфекций путем проведения иммуногистоцитохимического окрашивания для выявления искомого антигена под световым микроскопом, отличающийся тем, что на предметное стекло тонким слоем наносят 0,05 мл лимфоцитарной взвеси крови больного, через 3-7 мин фиксируют в ацетоне, в течение 3-5 мин, обрабатывают 3% Н2О2 в течение 20 мин, промывают, обрабатывают блокирующей нормальной сывороткой в течение 10 мин, инкубируют с поли- или моноклональными антителами к искомому антигену в течение 45 мин при t 37°, затем обрабатывают реагентами полимерной системы детекции: инкубируют с Super Enhanced™ Reagent в течение 20 мин, промывают, инкубируют с Poly-HRP Reagent в течение 30 мин; промывают, обрабатывают 3,3-диаминобензидина тетрахлоридом 2-3 мин и при обнаружении искомого антигена в лимфоцитах, моноцитах (не менее чем в 5-8 клетках в поле зрения) в виде коричневых гранул, диагностируют этиологию острой кишечной инфекции.
| СПОСОБ ДИАГНОСТИКИ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ (HEMOPHILUS INFLUENZAE) | 2001 |
|
RU2193204C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ОСТРЫХ КИШЕЧНЫХ ИНФЕКЦИЙ У ДЕТЕЙ | 2004 |
|
RU2275634C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ИЕРСИНИОЗА | 1992 |
|
RU2087913C1 |
| Зерноочистительная машина | 1960 |
|
SU136975A1 |
| WAIN J et al | |||
| Quantitation of bacteria in blood of typhoid fever patients and relationship between counts and clinical features, transmissibility, and antibiotic resistance | |||
| J Clin Microbiol., 1998, Jun; 36 (6), p.1683-7, найдено в PubMed, | |||
Авторы
Даты
2008-07-20—Публикация
2007-01-09—Подача