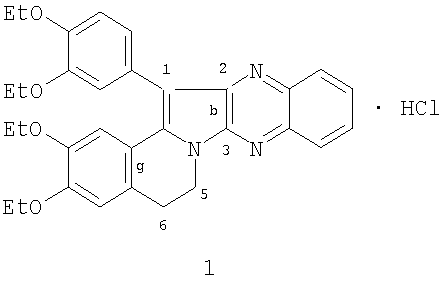
Изобретение относится к области органической химии, производным индолизина, а именно новому биологически активному 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлориду (1) формулы:
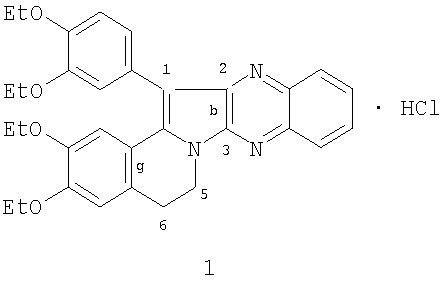
обладающего прямым антикоагулянтным действием, что позволяет предположить его использование в медицине в качестве антикоагулянта прямого действия.
Ближайшим структурным аналогом к заявляемому соединению является конденсированный индолизин 2 [Михайловский А.Г., Шкляев B.C. Реакция енаминов ряда изохинолина и фенантридина с оксалилхлоридом // Химия гетероцикл. соедин. - 1994. - №7. - С.946-949].
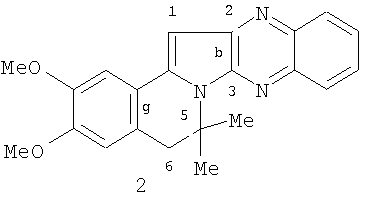
Данных об его антикоагулянтной активности в литературе не имеется. Среди производных азотсодержащих гетероциклов с прямым антикоагулянтным действием известен папаверина гидрохлорид [Кремлева В.Ф., Ивлева А.Я. Влияние папаверина на систему свертывания крови // Фармакология и токсикология. - 1974. - Т.37. - №2. - С.232-235], который взят нами в качестве эталона сравнения по структуре соединения 1.
Целью предлагаемого изобретения является поиск среди производных индолизина соединений, обладающих прямой антикоагулянтной активностью. Поставленная цель достигается получением 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорида 1, который синтезируют по реакции известного 2,3-диоксопирроло[2,1-а]изохинолина [Михайловский А.Г. Реакция 2,3-диоксопирроло[2,1-а]изохинолинов с боргидридом натрия и свойства ее продуктов // Химия гетероцикл. соедин. - 1996. - №5. - С.685-692] с о-фенилендиамином с последующей обработкой основания хлористым водородом:
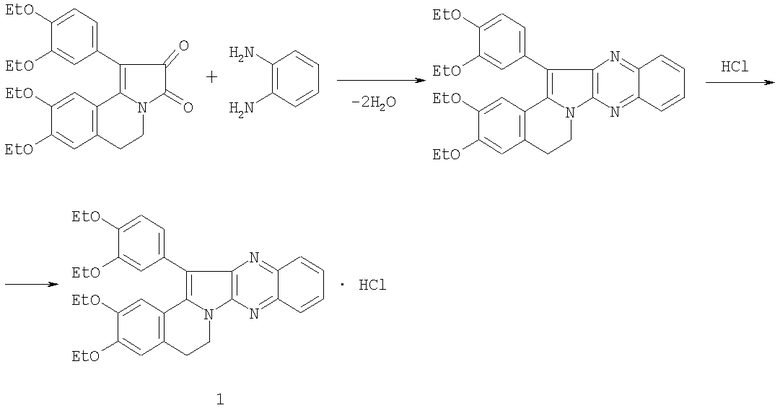
Для получения дикарбонильной составляющей используется основание дротаверина (но-шпы). Субстанция нош-шпы - относительно недорогой продукт промышленного производства, что делает данный метод перспективным. Все вспомогательные вещества также доступны и выпускаются промышленностью. Синтез основания соединения 1 описан [Полыгалова Н.Н., Михайловский А.Г., Вихарева Е.В., Сб. «Азотсодержащие гетероциклы». - М.: ICSPF-Press, 2006. T.2, с.417].
Методика получения 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорида 1.
К раствору 4,52 г (0,01 моль) 1-(3,4-диэтоксифенил)-2,3-диоксо-8,9-диэтокси-2,3,5,6-тетрагидропирроло[2,1-а]изохинолина в 15 мл ледяной уксусной кислоты добавляют 1,08 г (0,01 моль) о-фенилендиамина. Смесь кипятят 1 ч, охлаждают, разбавляют 100 мл 25% аммиака, выпавший осадок отфильтровывают, промывают водой, сушат, растворяют в 150 мл этилацетата и пропусканием сухого HCl получают гидрохлорид 1. При переходе вещества из основания в гидрохлорид желтая окраска переходит в ярко-красную. Полученное соединение перекристаллизовывают из изопропанола. Выход гидрохлорида 1 составляет 3,51 г (67%).
Заявляемое соединение представляет собой ярко-красное кристаллическое вещество, трудно растворимое в воде, растворимое в хлороформе, ДМСО, ДМФА. Тпл 160-161°С. Вычислено, %: С 68,6; Н 6,1; N 7,5; Cl 6,3. C32H33N3О4·HCl. Найдено, %: С 68,5; Н 6,0; N 7,6; Cl 6,2.
В спектре ЯМР 1Н (Varian Mercury 300, 300 МГц, внутренний стандарт - ГМДС) гидрохлорида 1, снятом в CDCl3, имеются сигналы: четыре триплета протонов четырех групп СН3CH2О (1,20-1,80 м.д., J=6,7 Гц); один квадруплет протонов группы ОСН2СН3 в области 3,8 м.д. (J=3,6 Гц) и три квадруплета протонов остальных трех групп ОСН2СН3 в области 4,10-4,33 м.д. (J=3,6 Гц); 3,2 м.д., м, (2Н, 4-СН2-С); 4,82 м.д., м, (2Н, СН2-N); ароматические мультиплеты в области 6,72 - 7,23 м.д. (5Н дротаверина) и 7,70-8,23 м.д. (4Н хиноксалина); 9,1 с (NH+).
Масс-спектр основания соединения 1 содержит пик молекулярного иона M=523 (100%) (прибор MAT-311, 70 эв, ЭУ).
Соединение 1 исследовали на наличие прямой антикоагулянтной активности. Исследования проведены с помощью коагулометра «Минилаб 701». Для исследования использовали нитратную (3,8%) кровь (9:1). Влияние соединения и эталона сравнения по структуре папаверина гидрохлорида на свертывание крови изучали в одинаковой концентрации 1 мг/мл. В качестве эталона прямой антикоагулянтной активности использовали гепарин, который испытывали в концентрации 1 ЕД/мл крови.
Как видно из таблицы, исследуемое соединение достоверно увеличивает время свертывания цитратной крови на 35,6%, папаверина гидрохлорид в той же концентрации - на 16,8%.
Острую токсичность определяли на нелинейных белых мышах массой 20-25 г. Исследуемое вещество вводили внутрибрюшинно в виде водного раствора из расчета 0,5 мл на 10 г массы животного в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при Р=0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. // Фармакология и токсикология. - 1978. - Т.41. - №4. - С.497-502].
Острая токсичность (ЛД50) заявляемого соединения составила 355,0 (310,0÷400,9) мг/кг, папаверина гидрохлорида - 96,0 (78,0÷119,0) мг/кг.
Таким образом, заявляемое соединение - 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорид - проявляет прямое антикоагулянтное действие, превосходящее по уровню активности аналог по структуре папаверина гидрохлорид при меньшей токсичности, поэтому может найти применение в медицине в качестве антикоагулянта прямого действия.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Михайловский А.Г., Шкляев B.C. Реакция енаминов ряда изохинолина и фенантридина с оксалилхлоридом // Химия гетероцикл. соедин. - 1994. - №7. - С.946-949.
2. Кремлева В.Ф., Ивлева А.Я. Влияние папаверина на систему свертывания крови // Фармакология и токсикология. - 1974. - Т.37. - №2. - С.232-235.
3. Михайловский А.Г. Реакция 2,3-диоксопирроло[2,1-а]изохинолинов с боргидридом натрия и свойства ее продуктов // Химия гетероцикл. соедин. - 1996. - №5. - С.685-692.
4. Полыгалова Н.Н., Михайловский А.Г., Вихарева Е.В. Сб. «Азотсодержащие гетероциклы». - М.: ICSPF-Press, 2006. Т.2, с.417.
5. Прозоровский В.В., Прозоровская М.П., Демченко В.М. // Фармакология и токсикология. - 1978. - Т.41. - №4. - С.497-502.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,2-ДИМЕТИЛ-4-(4,6-ДИМЕТИЛ-2-ПИРИДОН-3-ИЛ)-1,2-ДИГИДРО-БЕНЗО[f]ИЗОХИНОЛИНА ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ ПРЯМОЕ АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ | 2006 |
|
RU2320654C1 |
| 1,4,5,6-ТЕТРАГИДРО-6-ОКСО-5-(2-ПИПЕРАЗИНОЭТИЛ)-4-ФЕНИЛ-3-(4-ХЛОРФЕНИЛ)ПИРРОЛО[3, 4-С]ПИРАЗОЛА ДИГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ ГИПОТЕНЗИВНУЮ И АНТИКОАГУЛЯНТНУЮ АКТИВНОСТИ | 2006 |
|
RU2320661C2 |
| N-ИЗОПРОПИЛАМИДА 2-(6,7-ДИМЕТОКСИ-3-СПИРО-ЦИКЛОПЕНТИЛ-3,4-ДИГИДРОИЗОХИНОЛИЛ-1)-ЭТАНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ОБЛАДАЮЩИЙ ГИПЕРТЕНЗИВНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2491277C2 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ 2-(4'-ХЛОРФЕНОКСИ)-N, N-ДИЭТИЛЭТАНАМИНА ГИДРОХЛОРИД, ОБЛАДАЮЩЕЕ ПРЯМЫМ АНТИКОАГУЛЯНТНЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2348610C2 |
| 2-ГИДРОКСИ-4-ОКСО-4-(4-ХЛОРФЕНИЛ)-2-БУТЕНОАТ ТИАЗОЛИНАММОНИЯ, ОБЛАДАЮЩИЙ АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2461550C2 |
| АМИД 2-(3-МЕТИЛ-6-МЕТОКСИ-7-ЭТОКСИ-3,4-ДИГИДРОИЗОХИНОЛИЛ-1)-ЭТАНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АНТИГЕЛЬМИНТНОЕ ДЕЙСТВИЕ | 2013 |
|
RU2543374C2 |
| 2-ГИДРОКСИ-4-ОКСО-4-(4'-ХЛОРФЕНИЛ)-БУТ-2-ЕНОАТ 4-МЕТИЛ-2-ПИРИДИЛАММОНИЯ, ОБЛАДАЮЩИЙ ПРЯМЫМ АНТИКОАГУЛЯНТНЫМ ДЕЙСТВИЕМ | 2015 |
|
RU2649140C2 |
| N-БЕНЗИЛАМИД 2-(3-МЕТИЛ-6-МЕТОКСИ-7-ЭТОКСИ-3,4-ДИГИДРОИЗОХИНОЛИЛ-1)-ЭТАНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ ИНСЕКТИЦИДНОЕ ДЕЙСТВИЕ | 2012 |
|
RU2529504C2 |
| 4-АЦЕТИЛ-3-ГИДРОКСИ-1-(2-ГИДРОКСИЭТИЛАМИНОЭТИЛ)-5-ФЕНИЛ-3-ПИРРОЛИН-2-ОН, ПРОЯВЛЯЮЩИЙ АНТИКОАГУЛЯНТНУЮ АКТИВНОСТЬ | 2005 |
|
RU2312660C2 |
| 3-МЕТИЛ-2-ПИРИДИЛАМИД МАЛЕИНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ПРЯМОЕ АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ | 2005 |
|
RU2294199C2 |
Изобретение относится к новому 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлориду формулы:
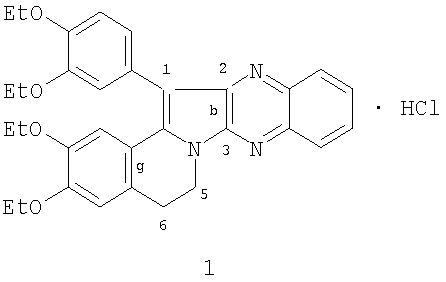
который проявляет прямое антикоагулянтное действие, достоверно увеличивая время свертывания нитратной крови и процент изменения свертываемости в концентрации 1 мг/мл на 36,5%. ЛД50 при внутрибрюшинном введении белым мышам составила 355,0 (310,0÷410,0) мг/кг. Тпл 160-161°С (изопропанол). 1 табл.
1-(3,4-Диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорид, проявляющий прямое антикоагулянтное действие
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Новая волна | |||
| С.Б.Дивов, 2001, т.1, с.396, 455 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
Авторы
Даты
2008-08-10—Публикация
2006-11-07—Подача