Область техники, к которой относится изобретение
Настоящее изобретение относится к активирующему глюкокиназу агенту, содержащему производное 2-пиридинкарбоксамида в качестве эффективного компонента. Кроме того, оно относится к новым производным 2-пиридинкарбоксамида и их солям.
Предпосылки создания изобретения
Глюкокиназа (GK) (АТР: D-гексозо-6-фосфотрансфераза, ЕС 2.7.1.1) является одним из 4 типов гексокиназы (гексокиназа IV) у млекопитающих. Гексоназа представляет собой активирующий фермент на первой стадии гликолитического пути, который катализирует реакцию от глюкозы до глюкозо-6-фосфата. Местонахождение глюкокиназы локализовано главным образом в печени и бета-клетках поджелудочной железы, в которых глюкокиназа контролирует определяющую скорость стадию метаболизма глюкозы, вследствие чего она играет важную роль в генерализованном метаболизме сахара. Глюкокиназа в печени и глюкокиназа в бета-клетках поджелудочной железы представляют собой одно и то же в отношении их ферментативных свойств, хотя N-терминальные последовательности из 15 аминокислот отличаются друг от друга в соответствии с различием сплайсинга. В 3 типах гексокиназы (I, II и III), других, чем глюкокиназа, ферментативные активности насыщены при концентрации глюкозы 1 ммоль или ниже, тогда как показатель Km глюкокиназы для глюкозы составляет 8 ммоль, значение которого является ближайшим к физиологическому уровню сахара в крови. Следовательно, внутриклеточный метаболизм глюкозы ускоряется за счет глюкокиназы в ответ на изменение уровня сахара в крови от нормального (5 ммоль) до возникающего после приема пищи повышения (10-15 ммоль).
Почти 10 лет тому назад была выдвинута гипотеза, что глюкокиназа действует как сенсор глюкозы в бета-клетках поджелудочной железы или в печени (Garfinkel D. и др., "Computer modeling identifies glucokinase as glukose sensor of panreatic beta-cells", American Journal Physilogy, 247, 3Pt2, 527-536 (1984)). Из недавно полученных результатов испытаний на мышах, которым глюкокиназу вводили методом генной инженерии, было установлено, что глюкокиназа в самом деле играет важную роль в генерализованном гомеостазе глюкозы. Хотя мыши, у которых ген глюкокиназы был уничтожен, погибают вскоре после рождения (Grupe A. и др., "Transgenic knockouts reveal a critical requirement for pancreatic beta cell glucokinase in maintaining glucose homeostasis", Cell, 83, 69-78 (1995)), уровень сахара в крови был снижен у нормальных и диабетических мышей, у которых глюкокиназа была генерирована в избытке (Ferre T. и др., "Correction of diabetic alterations by glucokinase", Proceedings of the National Academy of Sciences of the U.S.A., 93, 7225-7230 (1996)). С возрастанием концентрации глюкозы реакции панкреатических бета-клеток и гепатоцитов благоприятно вызывают снижение уровня сахара в крови, хотя степень снижения является, соответственно, различной. Панкреатические бета-клетки секретируют гораздо больше инсулина, а, с другой стороны, печень поглощает сахар, и он аккумулируется в ней в виде гликогена, результатом чего является уменьшение высвобождения сахара.
Таким образом, изменение ферментативной активности глюкокиназы играет важную роль в гомеостазе глюкозы у млекоптающих за счет печени и бета-клеток поджелудочной железы. В случае возникающего ювенильного диабета, который называют MODY2 (поздний сахарный диабет молодых), обнаружено, что происходит мутация в гене глюкокиназы и снижение активности глюкокиназы повышает уровень сахара в крови (Vionnet N. и др., "Nonsense mutation in the glucokinase gene causes early-onset non-insulin-dependent diabetes mellitus", Nature Genetics, 356, 721-722 (1992)). Следовательно, найдено, что существует тесная связь в том, что мутация повышает активность глюкокиназы и возникает гипогликемия (Glaser B. и др., "Familial hyperinsulinism caused by an activating glucokinase mutation", New England Journal Medicine, 338, 226-230 (1998)).
Это означает, что глюкокиназа действует как сенсор глюкозы у человека и играет важную роль в гомеостазе глюкозы. С другой стороны, принимают во внимание, что у большого числа пациентов с диабетом типа II можно регулировать уровень сахара в крови путем использования сенсорной глюкокиназной системы. Предполагают, что активирующие глюкокиназу вещества оказывают воздействие в отношении ускорения секреции инсулина в панкреатических бета-клетках и воздействие в отношении ускорения поглощения сахара и ингибирования высвобождения сахара в печени, и их обычно рассматривают в качестве терапевтических средств в случае пациентов с диабетом типа II.
В последние годы было выяснено, что местонахождение глюкокиназы типа таковой панкреатических бета-клеток локализовано в головном мозге крыс, особенно в ответственном за питание центре (вентромедиальный гипоталамус; VMH). Давно было установлено, что примерно 20% нейронов в VMH, называемых чувствительными к глюкозе нейронами, играют важную роль в регуляции массы тела. Потребность в пище крыс уменьшается, когда в головной мозг вводят глюкозу, тогда как ингибирование метаболизма глюкозы путем интрацеребрального введения аналога глюкозы, глюкозамина, вызывает гиперфагию. Из электрофизиологических экспериментов было установлено, что чувствительный к глюкозе нейрон активируется в ответ на физиологическое изменение концентрации глюкозы (5-20 ммоль), однако, его активность ингибируется за счет ингибирования метаболизма глюкозы с помощью глюкозамина. Такой же механизм через посредство глюкокиназы предполагается в случае сенсорной системы для концентрации глюкозы в VHM, как в случае секреции инсулина в панкреатических бета-клетках. Следовательно, вдобавок к действию в печени и панкреатических бета-клетках, предполагают, что активирующее глюкокиназу вещество в VMH улучшает положение в отношении не только уровня сахара в крови, но и также ожирения, которое является проблемой у большого числа пациентов с сахарным диабетом типа II.
Как следует из вышеприведенного описания, активирующие глюкокиназу соединения пригодны в качестве терапевтических средств и/или профилактических средств против сахарного диабета или против хронических диабетических осложнений, таких как ретинопатия, нефропатия, невроз, ишемическая болезнь сердца или артериосклероз, а также против ожирения.
Что касается соединения, обладающего пиридиновым скелетом и амидной связью, присоединенной к пиридиновому скелету, которые содержатся в соединениях формулы (I) согласно изобретению, было описано следующее соединение, представленное структурной формулой (IV) (см., например, открытую выкладку заявки на патент Японии 5-213382).
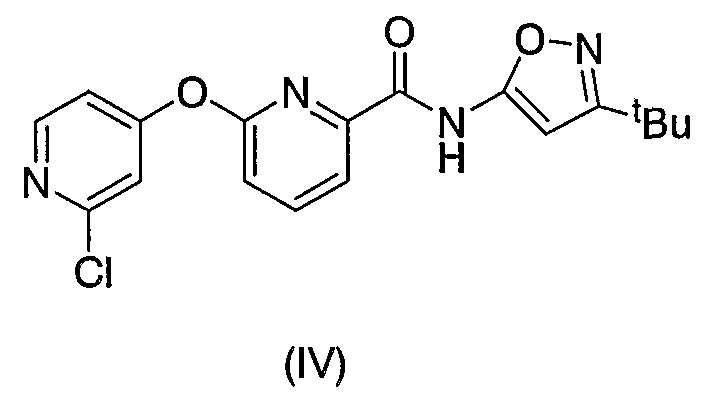
В соединении формулы (IV), описанном в открытой выкладке заявки на патент Японии 5-213382, однако, положение C=N и амидной связи в изоксазольной группе отличается от такового соединений согласно изобретению. Кроме того, также различным является то, что, тогда как полезность соединений согласно изобретению включает их использование против сахарного диабета, полезность, описанная в открытой выкладке заявки на патент Японии 5-213382, относится к гербициду.
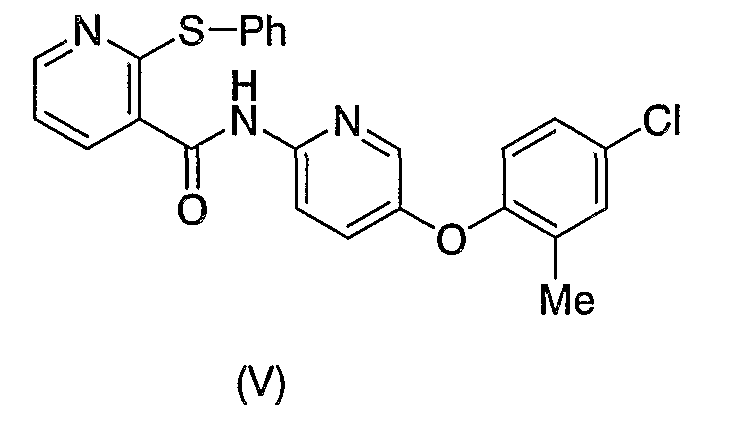
Что касается структурно аналогичных соединений, которые полезны против сахарного диабета, описаны следующие соединения, представленные формулой (V):
и формулой (VI):
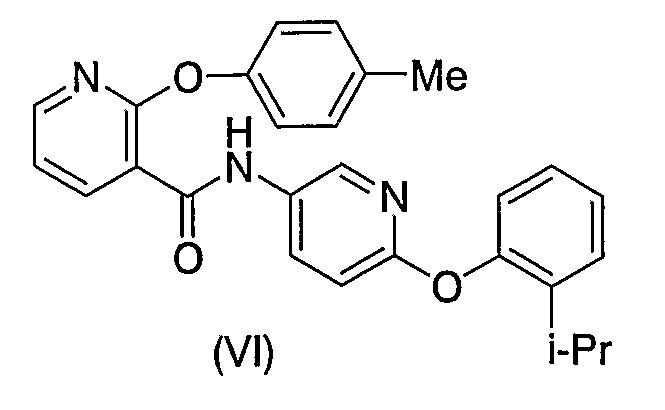
(см., например, опубликованный перевод с японского Международной публикации РСТ 2001-522834).
Одним из использований соединений, описанных в опубликованном переводе с японского Международной публикации РСТ 2001-522834, является применение против сахарного диабета, такое же, как и применение соединений формулы (I) согласно настоящему изобретению.
Соединение формулы (V) или (VI), описанное в опубликованном переводе с японского Международной публикации РСТ 2001-522834, и соединения формулы (I) согласно настоящему изобретению все имеют пиридиновый скелет в качестве основного скелета и амидную связь с пиридиновым циклом.
Отличием, однако, является то, что соединения формулы (I) согласно настоящему изобретению содержат заместитель в положении 6 пиридинового цикла, в то время как соединение формулы (V) или (VI) не имеет заместителя в положении 6 пиридинового цикла.
Кроме того, отличием является также то, что соединения формулы (I) согласно изобретению имеют амидную связь, соседнюю к атому азота, входящему в пиридиновый цикл, тогда как соединение формулы (VI), описанное в опубликованном переводе с японского Международной публикации РСТ 2001-522834, имеет амидную связь в положении, отделенном одним атомом углерода от атома азота, входящего в пиридиновый цикл. Кроме того, положение амидной связи, относящейся к структурному элементу C=N пиридинового цикла, соответствующему циклу В в соединениях формулы (I) согласно настоящему изобретению, отличается от такового в случае соединения формулы (VI) опубликованного перевода с японского Международной публикации РСТ 2001-522834.
Что касается соединения, имеющего такой же пиридин-2-карбоксамидный скелет, как и соединения формулы (I) согласно настоящему изобретению, описано соединение формулы (VII):
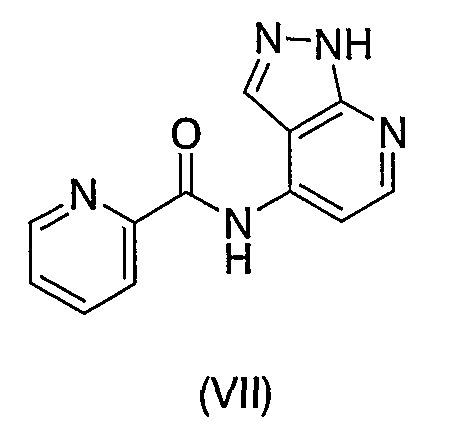
(см., например, Международную заявку на патент WO-01/81345). Однако положение амидной связи по отношению к атому азота 1Н-пиразол[3,4-b]пиридин-4-ила, который связан с атомом азота амидной связи в соединении формулы (VII), отличается от положения амидной связи по отношению к C=N в цикле В соединений формулы (I) согласно настоящему изобретению. Кроме того, различным является то, что, тогда как положения 3 и 6 пиридинового скелета в формуле (VII) заняты атомами водорода, таковые соединений формулы (I) заняты другими группами, чем атомы водорода. Таким образом, соединение формулы (VI) отличается от соединений формулы (I) согласно настоящему изобретению по всей структуре.
Следовательно, соединения формулы (I) согласно настоящему изобретению отличаются от соединения, описанного в Международной заявке на патент WO01/81345 с точки зрения заместителя, связанного с пиридиновым скелетом, хотя оба соединения включают пиридин-2-карбоксамид в качестве основной структуры. Таким образом, соединения формулы (I) полностью отличаются от соединения формулы (VII).
Целью изобретения является получение терапевтического средства и/или профилактического средства против сахарного диабета, которое может связываться с глюкокиназой для повышения активности глюкокиназы, а также в качестве средства против ожирения, которое активирует глюкокиназу для стимулирования центра насыщения.
Как указано выше, предпочтительным является то, что соединения согласно изобретению обладают лучшим лекарственным эффектом, чем существующие антидиабетические средства, и обеспечивают возможность достижения проявления новых лекарственных эффектов, которыми не обладают существующие антидиабетические средства.
Авторы настоящего изобретения поэтому стремились получить новое антидиабетическое средство, которое обладает лучшим новым лекарственным эффектом, чем существующие антидиабетические средства, базирующимся на механизме действия, отличном от такового существующих лекарственных средств. В результате они нашли, что соединения, отвечающие формуле (I), обладают активирующим глюкокиназу действием. Следовательно, поставленная в изобретении цель была достигнута.
Раскрытие изобретения
Таким образом, изобретение относится к следующему:
(1) Соединение формулы (I):
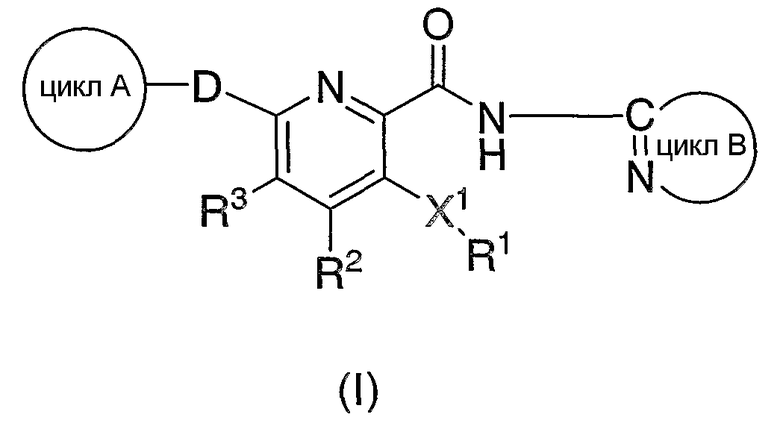
[где
Х1 означает N, S или О или двухвалентную насыщенную углеводородную группу с 1-6 атомами углерода (когда число атомов углерода двухвалентной насыщенной углеводородной группы составляет 2 или более, один из атомов углерода в ней может быть заменен атомом азота, атомом кислорода или атомом серы);
R1 означает 6-10-членную арильную группу, 5-10-членную гетероарильную группу, циклоалкильную группу с 3-7 атомами углерода или низшую алкильную группу (где R1 может быть замещен 1 или 2 группами, выбираемыми из группы, состоящей из аминогруппы, низшей алкильной группы (атом водорода низшей алкильной группы может быть замещен группой, включающей гидроксильную группу, низшую алкоксигруппу, атом галогена, карбамоильную группу, моно- или ди(низший алкил)карбамоильную группу, карбоксильную группу, алкоксикарбонильную группу, алканоильную группу, аминогруппу, моно- или диалкиламиногруппу), низшей алкоксигруппы (атом водорода метиленовой или метильной группы, входящей в низшую алкоксигруппу, может быть замещен гидроксильной группой, атомом галогена, карбамоильной группой, моно- или ди(низший алкил)карбамоильной группой, карбоксильной группой, алкоксикарбонильной группой, алканоильной группой, аминогруппой, моно- или ди(низший алкил)аминогруппой), карбамоильной группы, низшей алкилкарбамоильной группы, ди(низший алкил)карбамоильной группы, карбамоиламиногруппы, карбамоилоксигруппы, карбоксильной группы, цианогруппы, сульфамоильной группы, трифторметильной группы, атома галогена, гидроксильной группы, формильной группы, (С2-С6)-алканоильной группы, N-(С2-С6)-алканоиламиногруппы, (С1-С6)-алкилтиогруппы, N-(С1-С6)-алкилсульфамоильной группы, N,N-ди(С1-С6)-алкил)сульфамоильной группы, (С1-С6)-алкилсульфинильной группы, (С1-С6)-алкилсульфонильной группы, N-(С1-С6)-алкилсульфониламиногруппы, (С1-С6)-алкоксикарбонильной группы, N-(С1-С6)-алкиламиногруппы, N,N-ди((С1-С6)-алкил)аминогруппы, 6-10-членной арильной группы и 5-10-членной гетероарильной группы);
D означает О или S;
R2 и R3 являются одинаковыми или разными, причем каждый означает атом водорода, низшую алкильную группу, низшую алкоксигруппу или атом галогена;
формула (II):
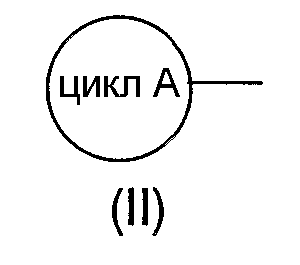
означает 5-7-членную гетероарильную группу или 6-10-членную арильную группу, которая может иметь в цикле 1 или 2 группы, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, гидроксильной группы, гидроксиалкильной группы (атом водорода гидрокси-части гидроксиалкильной группы, далее, может быть замещен низшей алкильной группой) и атома галогена;
формула (III):
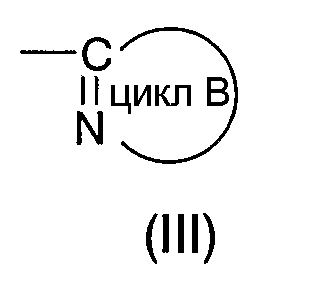
означает моноциклическую или бициклическую гетероарильную группу, в которой атом углерода, связанный с амидным атомом азота, входящим в формулу (I), образует C=N вместе с атомом азота цикла (где гетероарильная группа в случае цикла В может иметь 1 или 2 заместителя, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, атома галогена, трифторметильной группы, гидроксиалкильной группы (атом водорода гидрокси-части гидроксиалкильной группы, далее, может быть замещен низшей алкильной группой), аминоалкильной группы (аминогруппа в группе может быть замещена низшей алкильной группой), алканоильной группы, карбоксильной группы, алкоксикарбонильной группы и цианогруппы)]
или его фармацевтически приемлемая соль.
(2) Соединение по п. (1), где D означает S.
(3) Соединение по п. (1) или (2), где оба R2 и R3 означают атомы водорода.
(4) Соединение по любому из пп. (1)-(3), где цикл А означает фенильную группу, изотиазолильную группу, имидазолильную группу, оксазолильную группу, тиадиазолильную группу, тиенильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиримидинильную группу, фурильную группу, тиазолильную группу, изоксазолильную группу или пиразолильную группу, которые могут содержать в цикле 1 или 2 группы, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, гидроксигруппы, гидроксиалкильной группы (атом водорода гидрокси-части гидроксиалкильной группы, далее, может быть замещен низшей алкильной группой) и атома галогена.
(5) Соединение по любому из пп. (1)-(4), где Х1 означает группу, выбираемую из группы, состоящей из атома азота, атома серы, атома кислорода, -СН2-, -N-CH2-, -S-CH2-, -O-CH2-, -CH2-N-, -CH2-O- и -CH2-S-.
(6) Соединение по любому из пп. (1)-(5), где цикл В означает 5- или 6-членную гетероарильную группу, которая содержит по меньшей мере один атом азота в структурном элементе C=N, входящем в цикл, в качестве гетероатома, или 9- или 10-членную гетероарильную группу, которая образована путем конденсации предшествующей гетероарильной группы с фенильной или пиридильной группой.
(7) Соединение по любому из пп. (1)-(6), где R1 означает 6-10-членную арильную группу, 5-10-членную гетероарильную группу или циклоалкильную группу с 3-7 атомами углерода.
(8) Соединение по любому из пп. (1)-(6), где R1 означает 6-10-членную арильную группу или 5-10-членную гетероарильную группу.
(9) Соединение по любому из пп. (1)-(6), где R1 означает 6-10-членную арильную группу.
(10) Соединение по любому из пп. (1)-(6), где R1 означает 5-10-членную гетероарильную группу.
(11) Соединение по п. (9) или (10), где заместитель в цикле А означает атом водорода, низшую алкильную группу, низшую алкоксигруппу, гидроксильную группу или гидрокси(низший алкил)-группу (атом водорода гидрокси-части гидрокси(низший алкил)-группы, далее, может быть замещен низшей алкильной группой).
(12) Соединение по любому из пп. (9)-(11), где цикл В означает тиазолильную группу, имидазолильную группу, изотиазолильную группу, тиадиазолильную группу, триазолильную группу, оксазолильную группу, изоксазолильную группу, пиразинильную группу, пиридильную группу, пиридазинильную группу, пиразолильную группу, пиримидинильную группу, пиридотиазолильную группу или бензотиазолильную группу.
(13) Соединение по любому из пп. (1)-(10), где заместитель в цикле В означает атом водорода, низшую алкильную группу, атом галогена, гидроксиалкильную группу, аминоалкильную группу или алканоильную группу.
(14) Соединение по любому из пп. (9)-(12), где заместитель у R1 означает атом водорода, гидроксиалкильную группу, низшую алкильную группу, низшую алкоксигруппу, карбамоильную группу, алкилкарбамоильную группу, диалкилкарбамоильную группу, цианогруппу, трифторметильную группу, атом галогена, (С2-С6)-алканоильную группу, N-(C2-C6)-алканоиламиногруппу, (С1-С6)-алкилсульфонильную группу, (С1-С6)-алкиламиногруппу или аминоалкильную группу.
(15) Соединение по любому из пп. (1)-(14), где соединение, отвечающее формуле (I):

(где соответствующие символы имеют такие же значения, как указанные выше), представляет собой:
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(1-метилимидазол-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(1-метил-1Н-тетразол-5-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(циклогексилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(тиазол-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилсульфанил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилокси)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилметилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(3-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(2,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-цианофенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-ацетилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(тиофен-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-хлорфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(3Н-[1,2,4]триазол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилсульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метоксиметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-трифторметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-диметиламинометилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилсульфамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-гидроксициклогексилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридазин-3-ил)-2-пиридинкарбоксамид;
3-(пиразин-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(1-метил-1Н-тетразол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-фенокси-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-хлорфенилметиламино)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(пиридин-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(4-фторфенилсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(тиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(5-метил[1,3,4]тиадиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,3,4]тиадиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилкарбонилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиримидин-4-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-этоксикарбонилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилоксиметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилсульфанилметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилметил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилметил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламинометилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-4-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиэтилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксикарбонилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(пиримидин-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-метилпирролидин-3-илокси)фенилсульфанил]-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диэтиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-пирролидиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-диметиламиноэтилоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиразол-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-карбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(5-бром-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,5]тиадиазол-3-ил)-2-пиридинкарбоксамид;
3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метокси[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-циклопропил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2-фторпиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-метоксипиримидин-5-илсульфанил)-6-(2Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диэтилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-циклопропилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(пиразол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиносульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(5-фторпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]триазин-3-ил)-2-пиридинкарбоксамид;
3-(4-карбоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(имидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[4,5-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(5-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4,4-дифторметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиэтилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(2-метилимидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-гидроксиметил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтил)фенилсульфанил]-6-(4-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-метил-1Н-индазол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(3-метил[1,2,4]триазоло[4,3-a]пиридин-7-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(1Н-имидазол-1-ил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4,5-диметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4,5-диметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-метоксиэтил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-трифторметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-трифторметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(3-фтор-4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1,1-диметил-1-гидроксиметил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(3,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(3,5-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(1-метил-2-оксо-2,3-дигидро-1Н-индол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]триазолпиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-этоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-оксо-1,6-дигидропиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид.
(16) Соединение, которое представляет собой 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(17) Соединение, которое представляет собой 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(18) Соединение, которое представляет собой 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(19) Соединение, которое представляет собой 3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(20) Соединение, которое представляет собой 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(21) Соединение, которое представляет собой 3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(22) Соединение, которое представляет собой 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(23) Соединение, которое представляет собой 3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(24) Соединение, которое представляет собой 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(25) Соединение, которое представляет собой 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(26) Соединение, которое представляет собой 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(27) Соединение, которое представляет собой 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(28) Соединение, которое представляет собой 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(29) Соединение, которое представляет собой 3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(30) Соединение, которое представляет собой 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(31) Соединение, которое представляет собой 3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(32) Соединение, которое представляет собой 3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(33) Соединение, которое представляет собой 3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(34) Соединение, которое представляет собой 3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид или его фармацевтически приемлемую соль.
(35) Фармацевтическая композиция, используемая для лечения, профилактики и/или замедления появления сахарного диабета типа II, включающая следующие компоненты (1)-(3):
(1) соединение, отвечающее формуле (I);
(2) одно или более соединений, выбираемых из группы, состоящей из следующих составляющих (а)-(g):
(а) другой активатор глюкокиназы;
(b) бисгуанид;
(с) агонист PPAR;
(d) инсулин;
(е) соматостатин;
(f) ингибитор α-глюкозидазы и
(g) стимуляторы секреции инсулина;
и
(3) фармацевтически приемлемый носитель.
(36) Активирующий глюкокиназу агент, который включает в качестве эффективного компонента соединение по любому из пп. (1)-(34).
(37) Терапевтическое и/или профилактическое средство против сахарного диабета, которое включает в качестве эффективного компонента соединение по любому из пп. (1)-(34).
(38) Терапевтическое и/или профилактическое средство против ожирения, которое включает в качестве эффективного компонента соединение по любому из пп. (1)-(34).
Наилучший вариант осуществления изобретения
Ниже приводятся значения терминов, используемых в настоящем описании, для более подробного пояснения соединений согласно изобретению.
Термин "арильная группа" включает арильные группы циклических углеводородов с 6-14 атомами углерода, как, например, фенильная группа, нафтильная группа, бифенильная группа, антрильная группа и тому подобное.
Под термином "низшая алкильная группа" предпочтительно подразумевают линейную или разветвленную алкильную группу с 1-6 атомами углерода, включающую, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изоамильную группу, неопентильную группу, изопентильную группу, 1,1-диметил-пропильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 1,2-диметилпропильную группу, гексильную группу, изогексильную группу, 1-метилпентильную группу, 2-метилпентильную группу, 3-метилпентильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 2,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу, 3,3-диметилбутильную группу, 1-этилбутильную группу, 2-этилбутильную группу, 1,2,2-триметилпропильную группу, 1-этил-2-метилпропильную группу, и тому подобное.
Под термином "циклоалкильная группа" подразумевают моноцилическую насыщенную углеводородную группу с 3-7 атомами углерода, включающую, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу и тому подобное.
Под термином "низшая алкоксигруппа" подразумевают группу, где атом водорода гидроксигруппы замещен вышеуказанной низшей алкильной группой, включающую, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу, изопентилоксигруппу, гексилоксигруппу, изогексилоксигруппу и тому подобное.
Под термином "алкилсульфамоильная группа" подразумевают группу, где атом водорода сульфамоильной группы монозамещен вышеуказанной алкильной группой, предпочтительно включающую, например, метилсульфамоильную группу, этилсульфамоильную группу, изопропилсульфамоильную группу, и тому подобное.
Под термином "диалкилсульфамоильная группа" подразумевают группу, где атомы водорода группы NH2 алкилсульфамоильной группы дизамещены одинаковой или разной вышеуказанной алкильной группой, включающую, например, диметилсульфамоильную группу, диэтилсульфамоильную группу, метилэтилсульфамоильную группу и тому подобное.
Под термином "гетероарильная группа" подразумевают 4-7-членную моноциклическую гетероарильную группу, которая содержит 1-3 гетероатома, выбираемые из группы, состоящей из атома кислорода, атома серы и атома азота, в гетероарильной группе, или, альтернативно, бициклические гетероарильные группы, которые образуются путем конденсации моноциклической гетероарильной группы с бензольным или пиридиновым циклом, включающую, например, фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, пиразолильную группу, тиазолильную группу, тиадиазолильную группу, изотиазолильную группу, оксазолильную группу, изоксазолильную группу, пиридильную группу, пиримидильную группу, пиридазинильную группу, пиразолильную группу, пиразинильную группу, хинолильную группу, изохинолильную группу, хиназолинильную группу, хинолизинильную группу, хиноксалинильную группу, циннолинильную группу, бензимидазолильную группу, имидазопиридильную группу, бензофуранильную группу, нафтилидинильную группу, 1,2-бензизоксазолильную группу, бензоксазолильную группу, бензотиазолильную группу, оксазолпиридильную группу, пиридотиазолильную группу, изотиазолпиридильную группу, бензотиенильную группу и тому подобное.
Термин "атом галогена" включает, например, атом фтора, атом хлора, атом брома и атом иода.
Под термином "низшая алкилкарбамоильная группа" подразумевают карбамоильную группу, монозамещенную вышеуказанной низшей алкильной группой, включающую, например, метилкарбамоильную группу, этилкарбамоильную группу, пропилкарбамоильную группу, изопропилкарбамоильную группу, бутилкарбамоильную группу, втор-бутилкарбамоильную группу, трет-бутилкарбамоильную группу и тому подобное.
Под термином "ди(низший алкил)карбамоильная группа" подразумевают карбамоильную группу, дизамещенную одинаковой или разной вышеуказанной алкильной группой, включающую, например, диметилкарбамоильную группу, диэтилкарбамоильную группу, этилметилкарбамоильную группу, дипропилкарбамоильную группу, метилпропилкарбамоильную группу, диизопропилкарбамоильную группу и тому подобное.
Под термином "низшая алкиламиногруппа" подразумевают аминогруппу, монозамещенную вышеуказанной низшей алкильной группой, включающую, например, метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу, бутиламиногруппу, втор-бутиламиногруппу или трет-бутиламиногруппу.
Под термином "ди(низший алкил)аминогруппа" подразумевают аминогруппу, дизамещенную одинаковой или разной вышеуказанной низшей алкильной группой, включающую, например, диметиламиногруппу, диэтиламиногруппу, дипропиламиногруппу, метилпропиламиногруппу или диизопропиламиногруппу.
Под термином "алканоильная группа" подразумевают карбонильную группу, с которой связана вышеуказанная низшая алкильная группа, включающую, например, метилкарбонильную группу, этилкарбонильную группу, пропилкарбонильную группу, изопропилкарбонильную группу и тому подобное.
Под термином "алканоиламиногруппа" подразумевают группу, где вышеуказанная алканоильная группа связана с аминогруппой, включающую, например, метилкарбониламиногруппу, этилкарбонил-аминогруппу, изопропилкарбониламиногруппу и тому подобное.
Под термином "алкилтиогруппа" подразумевают группу, где вышеуказанная низшая алкильная группа связана с атомом серы, включающую, например, метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу и тому подобное.
Под термином "алкилсульфинильная группа" подразумевают группу, где вышеуказанная низшая алкильная группа связана с сульфинильной группой, включающую, например, метилсульфинильную группу, этилсульфинильную группу, изопропилсульфинильную группу и тому подобное.
Под термином "алкилсульфонильная группа" подразумевают группу, где вышеуказанная алкильная группа связана с сульфонильной группой, включающую, например, метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу и тому подобное.
Под термином "алкилсульфониламиногруппа" подразумевают группу, где атом водорода аминогруппы монозамещен вышеуказанной алкилсульфонильной группой, включающую, например, метилсульфониламиногруппу, этилсульфониламиногруппу, пропилсульфониламиногруппу или изопропилсульфониламиногруппу.
Под термином "алкоксикарбонильная группа" подразумевают группу, где атом водорода карбоксильной группы замещен вышеуказанной алкильной группой, включающую, например, метоксикарбонильную группу, этоксикарбонильную группу, пропилоксикарбонильную группу, изопропилоксикарбонильную группу и тому подобное.
Под понятием "двухвалентная насыщенная углеводородная группа с 1-6 атомами углерода" подразумевают линейную или разветвленную двухвалентную насыщенную углеводородную группу с 1-6 атомами углерода, в особенности включающую, например, метиленовую группу, этиленовую группу, пропиленовую группу, изопропиленовую группу, бутиленовую группу и тому подобное.
С целью дальнейшего пояснения конкретных примеров соединений формулы (I) согласно настоящему изобретению, соответствующие символы, используемые в формуле (I), могут быть пояснены следующими примерами.
Цикл А, представляемый формулой (II):

[где соответствующие символы имеют такие же значения, как указанные выше]
означает 5-7-членную гетероарильную группу или 6-10-членную арильную группу, которая может иметь в цикле А 1 или 2 группы, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, гидроксильной группы, гидроксиалкильной группы (атом водорода гидрокси-части гидроксиалкильной группы, далее, может быть замещен низшей алкильной группой) и атома галогена.
"5-7-Членная гетероарильная группа или 6-10-членная арильная группа", представляемая циклом А, представляет собой предпочтительно 5-6-членную гетероарильную группу, содержащую по меньшей мере один атом азота в цикле.
Цикл А конкретно включает, например, фенильную группу, изотиазолильную группу, имидазолильную группу, оксазолильную группу, тиадиазолильную группу, тиенильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиримидинильную группу, фурильную группу, тиазолильную группу, изоксазолильную группу или пиразолильную группу, причем предпочтительной является триазолильная группа, имидазолильная группа, тиазолильная группа и пиридильная группа, и, более предпочтительна, триазолильная группа.
Ниже поясняется заместитель, связанный с циклом А.
Цикл А в формуле (I) может иметь заместитель или заместители в цикле.
Заместитель в цикле А включает низший алкил, алкоксигруппу, атом галогена, гидроксигруппу и гидроксиалкильную группу (атом водорода гидроксигруппы, далее, может быть замещен алкильной группой). Среди этих заместителей предпочтительны низшая алкильная группа, низшая алкоксигруппа, гидроксигруппа и гидроксиалкильная группа и более предпочтительной является низшая алкильная группа.
Заместитель в цикле А, более конкретно, включает, например, метильную группу, этильную группу, изопропильную группу, метоксигруппу, этоксигруппу, гидроксигруппу, гидроксиметильную группу, гидроксиэтильную группу, метоксиметильную группу, атом фтора и атом хлора, причем предпочтительны метильная группа и этильная группа, и более предпочтительной является метильная группа.
Таким образом, в качестве предпочтительного цикла А, в целом, предпочтительны группы, представляемые следующими формулами (VIII):
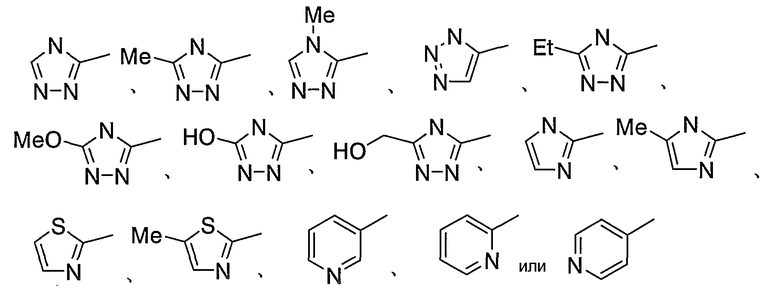
Группы, представляемые формулами (IX):
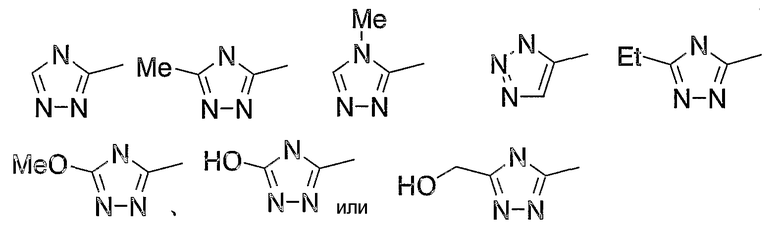
являются более предпочтительными.
D означает атом кислорода или атом серы, из которых предпочтительным является атом серы.
Цикл В может быть пояснен следующим образом.
Под циклом В, представляемым формулой (III):
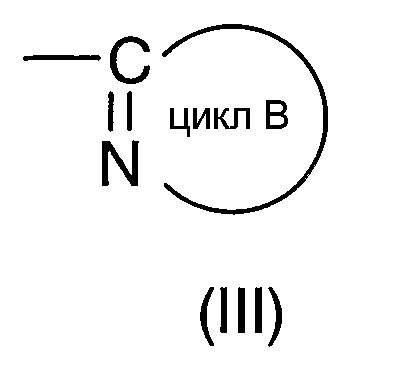
подразумевают моноциклическую или бициклическую гетероарильную группу, занимающую такое относительное положение, как представлено в нижеследующей формуле (Х):
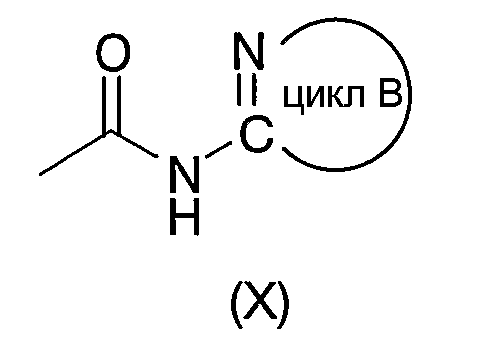
в которой структурный элемент C=N цикла связан с атомом азота амидной группы согласно вышеприведенной формуле (I).
"Моноциклическая или бициклическая гетероарильная группа", представляемая циклом В, имеет такие же значения, как и вышеуказанная "гетероарильная группа".
Цикл В включает, например, тиазолильную группу, имидазолильную группу, изотиазолильную группу, тиадиазолильную группу, триазолильную группу, оксазолильную группу, изоксазолильную группу, пиразинильную группу, пиридильную группу, пиридазинильную группу, пиразолильную группу, пиримидинильную группу, пиридотиазолильную группу и бензотиазолильную группу. Из этих групп предпочтительны тиазолильная группа, тиадиазолильная группа, изоксазолильная группа, пиразинильная группа, пиридотиазолильная группа и пиридильная группа, и более предпочтительными являются тиазолильная группа, пиридотиазолильная группа и изоксазолильная группа.
Цикл В может иметь в цикле 1 или 2 заместителя, предпочтительно 1 заместитель, выбираемый из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, атома галогена, трифторметильной группы, гидроксигруппы, гидроксиалкильной группы (атом водорода гидрокси-части гидроксиалкильной группы может быть замещен низшей алкильной группой), аминоалкильной группы, алканоильной группы, карбоксильной группы, алкоксикарбонильной группы и цианогруппы.
Из них, в качестве заместителя в цикле В, предпочтительны низшая алкильная группа, низшая алкоксигруппа, атом галогена, гидроксиалкильная группа (атом водорода гидроксильной части гидроксиалкильной группы может быть замещен низшей алкильной группой), аминоалкильная группа и алканоильная группа; и более предпочтительными являются низшая алкильная группа, гидроксиалкильная группа (атом водорода гидрокси-части гидроксиалкильной группы может быть замещен низшей алкильной группой) и алканоильная группа.
Заместитель в цикле В конкретно включает, например, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, атом хлора, атом фтора, атом брома, гидроксиметильную группу, гидроксиэтильную группу, метоксиметильную группу, этоксиэтильную группу, метоксиэтильную группу, метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, аминометильную группу, аминоэтильную группу, аминопропильную группу, метилкарбонильную группу, этилкарбонильную группу, пропилкарбонильную группу, и тому подобное. Из них предпочтительны метильная группа, этильная группа, атом хлора, атом фтора, гидроксиметильная группа, гидроксиэтильная группа, метоксиметильная группа, метоксиэтильная группа, метоксикарбонильная группа, этоксикарбонильная группа, аминометильная группа, аминоэтильная группа, метилкарбонильная группа и этилкарбонильная группа; и более предпочтительными являются метильная группа, гидроксиметильная группа, метоксиметильная группа и метилкарбонильная группа.
Следовательно, в качестве цикла В, в целом, предпочтительны, например, тиазол-2-ильная группа, 4-метилтиазол-2-ильная группа, 4-гидроксиметилтиазол-2-ильная группа, 4-метоксикарбонилтиазол-2-ильная группа, 4-метоксиметилтиазол-2-ильная группа, 4-аминометилтиазол-2-ильная группа, 4-цианотиазол-2-ильная группа, 4-фтортиазол-2-ильная группа, имидазол-2-ильная группа, 4-метилимидазол-2-ильная группа, 4-метоксикарбонилимидазол-2-ильная группа, изотиазол-3-ильная группа, 4-гидроксиметилизотиазол-3-ильная группа, [1,3,4]-тиадиазол-2-ильная группа, 5-метилкарбонил[1,3,4]тиадиазол-2-ильная группа, [1,2,4]тиадиазол-5-ильная группа, 3-метил[1,2,4]тиадиазол-5-ильная группа, [1,2,4]триазол-2-ильная группа, 5-гидроксиметил[1,2,4]триазол-3-ильная группа, пиразин-2-ильная группа, пиридин-2-ильная группа, 4-метилпиридин-2-ильная группа, 4-метоксиметилимидазол-2-ильная группа, 4-метилкарбонилимидазол-2-ильная группа, 5-гидроксиметилимидазол-2-ильная группа, 5-метил[1,3,4]тиадиазол-2-ильная группа, 5-фтор[1,3,4]тиадиазол-2-ильная группа, 5-метил[1,2,4]триазол-2-ильная группа, 5-метилкарбонил[1,2,4]триазол-3-ильная группа, изоксазол-3-ильная группа, 4-метоксиметилизоксазол-2-ильная группа, 5-метилизоксазол-3-ильная группа, 5-гидроксиметилизоксазол-3-ильная группа, 5-метоксиметилизоксазол-3-ильная группа, 5-метилкарбонилизоксазол-3-ильная группа, 5-хлоризоксазол-3-ильная группа, 5-аминометилизоксазол-3-ильная группа, 4-метил-1Н-пиразол-3-ильная группа, 1-метилпиразол-3-ильная группа, 6-метилпиридазин-3-ильная группа, тиазол-4-ильная группа, 2-метилтиазол-4-ильная группа, изоксазол-3-ильная группа, пиридотиазольная группа и тому подобное.
Х1 означает атом азота, атом серы или атом кислорода, или двухвалентную насыщенную углеводородную группу с 1-6 атомами углерода.
Под "двухвалентной насыщенной углеводородной группой с 1-6 атомами углерода" подразумевают алкиленовую группу с 1-6 атомами углерода, как указанная выше, включающую, например, метиленовую группу, пропиленовую группу, изопропиленовую группу, бутиленовую группу и тому подобное. Если число атомов углерода двухвалентной насыщенной углеводородной группы составляет 2-6, то, необязательно, атом углерода в двухвалентной насыщенной углеводородной группе может быть заменен атомом азота, атомом серы или атомом кислорода.
Х1 включает, более конкретно, например, атом азота, атом кислорода, атом серы, -СН2-, -N-CH2-, -S-CH2-, -O-CH2-, -CH2-N-, -CH2-S- и -CH2-O-, и тому подобное. Из них предпочтительны атом азота, атом серы, атом кислорода, -N-CH2- и -CH2-, причем более предпочтительным является атом серы.
R2 и R3 являются одинаковыми или разными, причем каждый означает атом водорода, низшую алкильную группу, алкоксигруппу или атом галогена.
"Низшие алкильные группы", обозначаемые радикалами R2 и R3, являются одинаковыми или разными, причем каждая предпочтительно означает метильную или этильную группу; более предпочтительно, оба радикала R2 и R3 означают метильную группу.
"Низшие алкоксигруппы", обозначаемые радикалами R2 и R3, являются одинаковыми или разными, причем каждая предпочтительно означает метокси- или этоксигруппу; более предпочтительно, оба радикала R2 и R3 означают метоксигруппу.
"Атомом галогена", обозначаемым радикалами R2 и R3, предпочтительно является атом фтора, атом хлора или атом брома, из которых более предпочтительным является атом фтора или атом хлора.
Что касается R2 и R3, оба R2 и R3 предпочтительно являются атомами водорода.
R1 означает 6-10-членную арильную группу, 5-10-членную гетероарильную группу, циклоалкильную группу с 3-7 атомами углерода или низшую алкильную группу.
"6-10-членная арильная группа", обозначаемая R1, означает арильную группу углеводородного цикла с 6-10 атомами углерода или 9- или 10-членную бициклическую арильную группу, которая образуется путем конденсации бензольного цикла с 5- или 6-членным алифатическим гетероциклом (алифатический гетероцикл может быть замещен оксигруппой), включающую в этом случае 1 или 2 гетероатома, выбираемые из группы, состоящей из атома азота, атома серы и атома кислорода.
6-10-Членная арильная группа углеводородного цикла, более конкретно, включает, например, фенильную группу, нафтильную группу, бифенильную группу и тому подобное, из которых предпочтительной является фенильная группа.
9- или 10-Членная бициклическая арильная группа, более конкретно, включает, например, этилендиоксифенильную группу, метилендиоксифенильную группу, тетрагидрохинолинильную группу, тетрагидроизохинолинильную группу, дигидроиндолильную группу, 2,3-дигидробензофуранильную группу, 1,3-дигидроизобензо-фуранильную группу, оксииндолильную группу или изоиндолильную группу и тому подобное, из которых предпочтительной является этилендиоксифенильная группа или тетрагидроизохинолинильная группа.
Под "5-10-членной гетероарильной группой", обозначаемой R1, подразумевают 5-7-членную моноциклическую гетероарильную группу или 9- или 10-членную бициклическую гетероарильную группу, которая в этом случае содержит 1-3 гетероатома, выбираемые из группы, состоящей из атома кислорода, атома азота и атома серы.
5-7-Членная моноциклическая гетероарильная группа, более конкретно, включает, например, изоксазолильную группу, изотиазолильную группу, имидазолильную группу, оксазолильную группу, тиазолильную группу, тиадиазолильную группу, тиенильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиразинильную группу, пиримидинильную группу, пиридазинильную группу, пиразолильную группу, пирролильную группу, пиранильную группу, фурильную группу, фуразанильную группу, имидазолидинильную группу и тому подобное.
9- или 10-членная бициклическая гетероарильная группа, более конкретно, включает, например, изохинолильную группу, изоиндолильную группу, индолильную группу, хинолильную группу, пиридотиазолильную группу, бензоимидазолильную группу, бензоксазолильную группу, бензотиазолильную группу, бензотриазолильную группу, бензофуранильную группу, имидазопиридинильную группу, триазопиридинильную группу и тому подобное.
Что касается 5-10-членной гетероарильной группы, предпочтительна 5-7-членная моноциклическая гетероарильная группа, более конкретно, предпочтительна пиридильная группа, имидазолильная группа, тиазолильная группа или тиенильная группа.
"Циклоалкильная группа с 3-7 атомами углерода", обозначаемая R1, включает те же самые группы, как указанные выше, и особенно предпочтительной является циклопентильная группа или циклогексильная группа.
"Низшая алкильная группа", обозначаемая R1, включает те же самые группы, как указанные выше; особенно предпочтительны пропильная группа и бутильная группа.
Что касается R1, предпочтительны 6-10-членная арильная группа, 5-10-членная гетероарильная группа, 3-7-членная циклоалкильная группа, и, более предпочтительны, 6-10-членная арильная группа, 5-10-членная гетероарильная группа.
Конкретные примеры включают фенильную группу, нафтильную группу, бифенильную группу, изоксазолильную группу, изотиазолильную группу, имидазолильную группу, оксазолильную группу, тиазолильную группу, тиадиазолильную группу, тиенильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиразинильную группу, пиримидинильную группу, пиридазинильную группу, пиразолильную группу, пирролильную группу, пиранильную группу, фурильную группу, фуразанильную группу, имидазолидинильную группу, изохинолильную группу, изоиндолильную группу, индолильную группу, этилендиоксифенильную группу, метилендиоксифенильную группу, хинолильную группу, пиридотиазолильную группу, дигидроиндолильную группу, тетрагидрохинолинильную группу, тетрагидроизохинолинильную группу, бензоимидазолильную группу, бензоксазолильную группу, бензотиазолильную группу, бензотриазолильную группу, бензофуранильную группу, циклопропильную группу, циклобутильную группу, циклофенильную группу, циклогексильную группу, циклогептильную группу, метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, пентильную группу, и тому подобное. Из них предпочтительны фенильная группа, нафтильная группа, пиридильная группа, имидазолильная группа, тиазолильная группа, тиенильная группа, циклопентильная группа и циклогексильная группа; и более предпочтительными являются фенильная группа, пиридильная группа, имидазолильная группа, тиазолильная группа и тиенильная группа, из которых особенно предпочтительна фенильная группа или пиридильная группа.
В нижеследующем контексте поясняется заместитель, содержащийся у радикала R1.
Заместитель, содержащийся у радикала R1, включает атом водорода, аминогруппу, гидроксильную группу, гидроксиалкильную группу (атом водорода гидроксильной группы может быть замещен низшей алкильной группой), низшую алкильную группу (атом водорода низшей алкильной группы может быть замещен гидроксильной группой, алкоксигруппой, аминогруппой, алкиламиногруппой, диалкиламиногруппой, атомом галогена, карбамоильной группой, моно- или диалкилкарбамоильной группой, карбоксильной группой, алкоксикарбонильной группой или алканоильной группой), низшую алкоксигруппу (атом водорода метиленовой группы или метильной группы, содержащейся в низшей алкоксигруппе, может быть замещен гидроксильной группой, атомом галогена, карбамоильной группой, моно- или ди(низший алкил)карбамоильной группой, карбоксильной группой, алкоксикарбонильной группой или алканоильной группой), карбамоильную группу, алкилкарбамоильную группу, диалкилкарбамоильную группу, карбамоилоксигруппу, карбамоиламиногруппу, цианогруппу, сульфамоильную группу, трифторметильную группу, атом галогена, формил, (С2-С6)-алканоильную группу, N-(С2-С6)-алканоиламиногруппу, (С1-С6)-алкилтиогруппу, N-(С1-С6)-алкилсульфамоильную группу, N,N-ди-(С1-С6)-алкилсульфамоильную группу, (С1-С6)-алкилсульфинильную группу, (С1-С6)-алкилсулфонильную группу, N-(С1-С6)-алкилсульфониламиногруппу, (С1-С6)-алкоксикарбонильную группу, (С1-С6)-алкиламиногруппу и N,N-(С1-С6)-диалкиламиногруппу.
R1 может содержать гидроксиалкильную группу в качестве заместителя. Предпочтительная гидроксиалкильная группа включает, например, гидроксиметильную группу, гидроксиэтильную группу, гидроксипропильную группу, гидроксиизопропильную группу, гидроксибутильную группу, гидроксипентильную группу, и тому подобное, причем более предпочтительными являются гидроксиметильная группа, гидроксиэтильная группа, гидроксипропильная группа или гидроксиизопропильная группа.
Атом водорода гидроксильной группы может быть замещен низшей алкильной группой с 1-6 атомами углерода. Замещенная гидроксиалкильная группа включает, например, метоксиметильную группу, 1-метоксиэтильную группу, этоксиметильную группу, метоксиэтильную группу, пропилоксиметильную группу и тому подобное. Из них предпочтительна метоксиметильная группа или метоксиэтильная группа, причем более предпочтительной является метоксиметильная группа.
R1 может содержать низшую алкильную группу в качестве заместителя. Указанная низшая алкильная группа включает такие же группы, как указанные выше; из них предпочтительны метильная группа, этильная группа, пропильная группа, бутильная группа, изопропильная группа и тому подобное, причем более предпочтительной является метильная группа или этильная группа.
Когда R1 содержит низшую алкильную группу в качестве заместителя, атом водорода низшей алкильной группы может быть замещен гидроксильной группой, низшей алкоксигруппой, аминогруппой, моноалкиламиногруппой или диалкиламиногруппой. Низшая алкильная группа включает, например, гидроксиметильную группу, гидроксиэтильную группу, метоксиметильную группу, этоксиметильную группу, метоксиэтильную группу, аминометильную группу, аминоэтильную группу, аминопропильную группу, метиламинометильную группу, этиламинометильную группу, диметиламинометильную группу, этилметиламинометильную группу, аминометильную группу, 2-аминоэтильную группу, 1-аминоэтильную группу, 3-аминопропильную группу, 2-амино-1-метилэтильную группу, 2-аминопропильную группу, 4-аминобутильную группу, 2-амино-1-метилпропильную группу, 2-аминобутильную группу, 5-аминопентильную группу, 3-амино-1,2-диметилпропильную группу, 6-аминогексильную группу и тому подобное. Из них предпочтительны аминометильная группа, 2-аминоэтильная группа, 1-аминоэтильная группа, 3-аминопропильная группа, 3-амино-1-метилэтильная группа и 2-аминопропильная группа, причем более предпочтительной является 2-аминоэтильная группа или 3-аминопропильная группа.
R1 может содержать низшую алкоксигруппу (где один из атомов водорода низшей алкоксигруппы может быть замещен гидроксигруппой или аминогруппой) в качестве заместителя.
Алкоксигруппа включает такие же группы, как указанные выше; из них предпочтительны метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа и тому подобное, причем более предпочтительной явлется метоксигруппа или этоксигруппа.
Когда атом водорода алкоксигруппы замещен гидроксильной группой, она включает, например, 2-гидрокси-этоксигруппу, 3-гидроксипропоксигруппу, 4-гидроксибутокси-группу, 2-гидрокси-1-метилэтоксигруппу, 2-гидроксипропоксигруппу, 3-гидрокси-2-метилпропоксигруппу, 3-гидроксибутоксигруппу, и тому подобное; из них предпочтительны 2-гидроксиэтоксигруппа, 3-гидроксипропоксигруппа и 2-гидрокси-1-метилэтоксигруппа, причем более предпочтительной является 2-гидроксиэтоксигруппа.
Когда атом водорода алкоксигруппы замещен аминогруппой, аминогруппа, далее, может быть замещена 1 или 2 низшими алкильными группами. Когда аминогруппа замещена 2 низшими алкильными группами, алкильные группы могут быть одинаковыми или разными; такая замещенная алкоксигруппа включает, предпочтительно, алкиламиноалкоксигруппу или диалкиламиноалкоксигруппу, и, более предпочтительно, диалкиламиноэтоксигруппу.
Более конкретно, например, можно назвать аминоэтоксигруппу, метиламиноэтоксигруппу, диметиламиноэтоксигруппу, диметиламинопропоксигруппу, и тому подобное. Из них предпочтительна метиламинометоксигруппа или диметиламиноэтоксигруппа, причем более предпочтительной является диметиламиноэтоксигруппа.
R1 может содержать низшую алкилкарбамоильную группу в качестве заместителя. Низшая алкилкарбамоильная группа включает такие же группы, как указанные выше, предпочтительно, низшие алкилкарбамоильные группы с 1-5 атомами углерода, более предпочтительно, низшие алкилкарбамоильные группы с 1-3 атомами углерода. Предпочтительная низшая алкилкарбамоильная группа, конкретно, включает метилкарбамоильную группу, этилкарбамоильную группу, пропилкарбамоильную группу и тому подобное, причем более предпочтительной является метилкарбамоильная группа.
R1 может содержать ди(низший алкил)карбамоильную группу в качестве заместителя. Низшая алкилкарбамоильная группа включает такие же группы, как указанные выше, и, например, диметилкарбамоильную группу, диэтилкарбамоильную группу, этилметилкарбамоильную группу и тому подобное, причем более предпочтительной является диметилкарбамоильная группа.
R1 может содержать атом галогена в качестве заместителя. Атом галогена включает такие же атомы галогена, как указанные выше, например, атом фтора, атом хлора, атом брома, и тому подобное, причем предпочтительным является атом фтора или атом хлора.
R1 может содержать (С2-С6)-алканоильную группу в качестве заместителя. (С2-С6)-Алканоильная группа включает те же самые группы, как указанные выше, более конкретно, например, метилкарбонильную группу, этилкарбонильную группу, пропилкарбонильную группу или изопропилкарбонильную группу, причем более предпочтительной является метилкарбонильная группа или этилкарбонильная группа.
R1 может содержать N-(C2-C6)-алканоиламиногруппу в качестве заместителя. Предпочтительная N-(C2-C6)-алканоиламиногруппа, конкретно, включает, предпочтительно, например, этилкарбониламиногруппу, пропилкарбониламиногруппу, изопропилкарбониламиногруппу, и тому подобное, причем более предпочтительной является метилкарбониламиногруппа или этилкарбониламиногруппа.
R1 может содержать (С1-С6)-алкилтиогруппу в качестве заместителя. Алкилтиогруппа включает те же самые группы, как указанные выше. Предпочтительная алкилтиогруппа, конкретно, включает, предпочтительно, например, метилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу, и тому подобное, причем более предпочтительной является метилтиогруппа или этилтиогруппа.
R1 может содержать алкилсульфамоильную группу в качестве заместителя. Алакилсульфамоильная группа включает те же самые группы, как указанные выше. Предпочтительная алкилсульфамоильная группа включает, предпочтительно, например, метилсульфамоильную группу, этилсульфамоильную группу, пропилсульфамоильную группу, и тому подобное, причем более предпочтительной является метилсульфамоильная группа или этилсульфамоильная группа.
R1 может содержать диалкилсульфамоильную группу в качестве заместителя. Диалкилсульфамоильная группа включает те же самые группы, как указанные выше. Предпочтительная диалкилсульфамоильная группа, конкретно, включает, например, диметилсульфамоильную группу, диэтилсульфамоильную группу, и тому подобное, причем более предпочтительной является диметилсульфамоильная группа.
R1 может содержать алкилсульфинильную группу в качестве заместителя. Алкилсульфинильная группа включает те же самые группы, как указанные выше. Предпочтительная алкилсульфинильная группа, конкретно, включает, например, метилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу, изопропилсульфинильную группу, и тому подобное, причем более предпочтительной является метилсульфинильная группа или этилсульфинильная группа.
R1 может содержать алкилсульфонильную группу в качестве заместителя. Алкилсульфонильная группа включает те же самые группы, как указанные выше. Предпочтительная алкилсульфонильная группа, конкретно, включает, например, метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу, и тому подобное, причем более предпочтительной является метилсульфонильная группа или этилсульфонильная группа.
R1 может содержать алкилсульфониламиногруппу в качестве заместителя. Алкилсульфониламиногруппа включает те же самые группы, как указанные выше. Предпочтительная алкилсульфониламиногруппа, конкретно, включает, например, метилсульфониламиногруппу, этилсульфониламиногруппу, пропилсульфониламиногруппу, изопропилсульфониламиногруппу, и тому подобное, причем более предпочтительной является метилсульфониламиногруппа или этилсульфониламиногруппа.
R1 может содержать алкоксикарбонильную группу в качестве заместителя. Алкоксикарбонильная группа включает те же самые группы, как указанные выше. Предпочтительная алкоксикарбонильная группа, конкретно, включает, например, метоксикарбонильную группу, этоксикарбонильную группу, изопропоксикарбонильную группу, пропоксикарбонильную группу, и тому подобное, причем более предпочтительной является метоксикарбонильная группа или этоксикарбонильная группа.
R1 может содержать алкиламиногруппу в качестве заместителя. Алкиламиногруппа включает те же самые группы, как указанные выше. Предпочтительная алкиламиногруппа, конкретно, включает, например, метиламиногруппу, этиламиногруппу, и тому подобное, причем более предпочтительной является метиламиногруппа.
R1 может содержать N,N-ди((С1-С6)-алкил)аминогруппу в качестве заместителя. Предпочтительная N,N-ди((С1-С6)-алкил)аминогруппа включает, например, диметиламиногруппу, диэтиламиногруппу, этилметиламиногруппу, и тому подобное, причем более предпочтительной является диметиламиногруппа.
R1 может содержать 5- или 6-членную циклическую аминогруппу в качестве заместителя. 5- или 6-членная циклическая аминогруппа включает те же самые группы, как указанные выше в качестве "циклической аминогруппы". Предпочтительный "заместитель, содержащийся у R1", включает, например, пирролидинильную группу, пиперазинильную группу, морфолинильную группу, и тому подобное, причем более предпочтительной является пиперидинильная группа или морфолинильная группа.
Относительно заместителей у R1, предпочтительным является атом водорода, низшая алкильная группа, низшая алкоксигруппа, карбамоильная группа, алкилкарбамоильная группа, цианогруппа, трифторметильная группа, атом галогена, (С2-С6)-алканоильная группа, N-(С2-С6)-алканоиламиногруппа, (С1-С6)-алкилсульфонильная группа, (С1-С6)-алкиламиногруппа или аминоалкильная группа, и из них более предпочтительной является низшая алкильная группа, низшая алкоксигруппа, алкилкарбамоильная группа, атом галогена, (С1-С6)-алкилсульфонильная группа или аминоалкильная группа.
Следовательно, относительно -Х1-R1, более конкретно, предпочтительными группами являются фенилсульфанильная группа, 4-гидроксиэтилфенилсульфанильная группа, 3-гидроксиметилфенилсульфанильная группа, 2-гидроксиметилфенилсульфанильная группа, 4-метилфенилсульфанильная группа, 3-метилфенилсульфанильная группа, 2-метилфенилсульфанильная группа, 4-изопропилфенилсульфанильная группа, 4-метоксифенилсульфанильная группа, 4-метоксиметилфенилсульфанильная группа, 3-метоксифенилсульфанильная группа, 2-этоксифенилсульфанильная группа, 4-этоксифенилсульфанильная группа, 4-гидроксиметилфенилсульфанильная группа, 4-гидроксиэтилоксифенилсульфанильная группа, 4-карбамоилфенилсульфанильная группа, 4-метилкарбамоилфенилсульфанильная группа, 4-диметилкарбамоилфенилсульфанильная группа, 4-изопропилкарбамоилфенилсульфанильная группа, 4-цианофенилсульфанильная группа, 4-трифторметилфенилсульфанильная группа, 4-фторфенилсульфанильная группа, 3-хлорфенилсульфанильная группа, 2-фторфенилсульфанильная группа, 4-метилкарбамоилфенилсульфанильная группа, 4-этилкарбамоилфенилсульфанильная группа, 3-метилкарбонилфенилсульфанильная группа, 3-этилкарбонилфенилсульфанильная группа, 4-метилкарбониламинофенилсульфанильная группа, 4-этилкарбонилфенилсульфанильная группа, 4-изопропилкарбонилфенилсульфанильная группа, 4-метилсульфонилфенилсульфанильная группа, 3-этилсульфонилфенилсульфанильная группа, 4-метилсульфонилфенилсульфанильная группа, 4-изопропилсульфонилфенилсульфанильная группа, 4-метиламинофенилсульфанильная группа, 3-этиламинофенилсульфанильная группа, 2-метиламинофенилсульфанильная группа, 4-аминометилфенилсульфанильная группа, 3-аминометилфенилсульфанильная группа, 4-аминоэтилфенилсульфанильная группа, 4-диметиламиноэтилоксифенилсульфанильная группа, тиазол-2-илсульфанильная группа, 4-гидроксиметилтиазол-2-ильная группа, 5-гидроксиметилтиазол-2-илсульфанильная группа, 4-гидроксиэтилтиазол-2-илсульфанильная группа, 4-метилтиазол-2-илсульфанильная группа, 5-метилтиазол-2-илсульфанильная группа, 4-этилтиазол-2-илсульфанильная группа, 4-метокситиазол-2-илсульфанильная группа, 4-этокситиазол-2-илсульфанильная группа, 4-карбамоилтиазол-2-илсульфанильная группа, 5-карбамоилтиазол-2-илсульфанильная группа, 4-метилкарбамоилтиазол-2-илсульфанильная группа, 4-этилкарбамоилтиазол-2-илсульфанильная группа, 4-изопропилтиазол-2-илсульфанильная группа, 4-цианотиазол-2-илсульфанильная группа, 4-хлортиазол-2-илсульфанильная группа, 4-фтортиазол-2-илсульфанильная группа, 4-метилкарбонилтиазол-2-илсульфанильная группа, 4-этилкарбонилтиазол-2-илсульфанильная группа, 4-этилкарбониламинотиазол-2-илсульфанильная группа, 4-метилкарбониламинотиазол-2-илсульфанильная группа, 4-метилсульфонилтиазол-2-илсульфанильная группа, 4-этилсульфонилтиазол-2-илсульфанильная группа, 3-метилсульфонилтиазол-2-илсульфанильная группа, 4-изопропилсульфонилтиазол-2-илсульфанильная группа, 4-метиламинотиазол-2-илсульфанильная группа, 3-метиламинотиазол-2-илсульфанильная группа, 4-этиламинотиазол-2-илсульфанильная группа, 4-аминометилтиазол-2-илсульфанильная группа, 4-аминоэтилтиазол-2-илсульфанильная группа, пиридин-2-илсульфанильная группа, пиридин-3-илсульфанильная группа, пиридин-4-илсульфанильная группа, 6-гидроксиметилпиридин-3-илсульфанильная группа, 4-гидроксиметилпиридин-5-илсульфанильная группа, 4-гидроксиметилпиридин-6-илсульфанильная группа, 3-гидроксиметилпиридин-6-илсульфанильная группа, 4-метилпиридин-5-илсульфанильная группа, 4-метилпиридин-6-илсульфанильная группа, 6-метилпиридин-3-илсульфанильная группа, 6-метоксипиридин-3-илсульфанильная группа, 6-этоксипиридин-3-илсульфанильная группа, 2-карбамоилпиридин-4-илсульфанильная группа, 6-карбамоилпиридин-3-илсульфанильная группа, 6-метилкарбамоилпиридин-3-илсульфанильная группа, 2-метилкарбамоилпиридин-4-илсульфанильная группа, 2-цианопиридин-4-илсульфанильная группа, 6-цианопиридин-3-илсульфанильная группа, 2-трифторметилпиридин-4-илсульфанильная группа, 6-трифторметилпиридин-3-илсульфанильная группа, 2-хлорпиридин-4-илсульфанильная группа, 6-хлорпиридин-3-илсульфанильная группа, 2-фторпиридин-4-илсульфанильная группа, 6-фторпиридин-3-илсульфанильная группа, 2-метилкарбонилпиридин-4-илсульфанильная группа, 6-метилкарбонилпиридин-3-илсульфанильная группа, 2-этилкарбонилпиридин-4-илсульфанильная группа, 6-этилкарбонилпиридин-3-илсульфанильная группа, 2-метилсульфонилпиридин-4-илсульфанильная группа, 6-метилсульфонилпиридин-3-илсульфанильная группа, 2-этилсульфонилпиридин-4-илсульфанильная группа, 6-изопропилсульфонилпиридин-3-илсульфанильная группа, 2-метилкарбониламинопиридин-4-илсульфанильная группа, 6-метилкарбониламинопиридин-3-илсульфанильная группа, 2-метиламинопиридин-4-илсульфанильная группа, 6-метиламинопиридин-3-илсульфанильная группа, 2-этиламинопиридин-4-илсульфанильная группа, 6-этиламинопиридин-3-илсульфанильная группа, 2-аминометилпиридин-4-илсульфанильная группа, 6-аминометилпиридин-3-илсульфанильная группа, 4-гидроксиэтилфениламиногруппа, 3-гидроксиметилфениламиногруппа, 2-гидроксиметилфениламиногруппа, 4-метилфениламиногруппа, 3-метилфениламиногруппа, 2-метилфениламиногруппа, 4-этилфениламиногруппа, 4-изопропилфениламиногруппа, 4-метоксифениламиногруппа, 3-метоксифениламиногруппа, 2-этоксифениламиногруппа, 4-этоксифениламиногруппа, 4-гидроксиметилфениламиногруппа, 4-карбамоилфениламиногруппа, 4-метилкарбамоилфениламиногруппа, 4-изопропилкарбамоилфениламиногруппа, 4-цианофениламиногруппа, 4-трифторметилфениламиногруппа, 4-фторфениламиногруппа, 3-хлорфениламиногруппа, 2-фторфениламиногруппа, 4-метилкарбонилфениламиногруппа, 4-этилкарбонилфениламиногруппа, 3-метилкарбонилфениламиногруппа, 3-этилкарбонилфениламиногруппа, 4-метилкарбониламинофениламиногруппа, 4-этилкарбониламинофениламиногруппа, 4-изопропилкарбониламинофениламиногруппа, 4-метилсульфонилфениламиногруппа, 3-этилсульфонилфениламиногруппа, 4-изопропилсульфонилфениламиногруппа, 4-метиламинофениламиногруппа, 3-этиламинофениламиногруппа, 4-аминометилфениламиногруппа, 3-аминометилфениламиногруппа, 4-аминоэтилфениламиногруппа, 3-аминоэтилфениламиногруппа, 4-метилтиазол-2-иламиногруппа, 5-метилтиазол-2-иламиногруппа, 4-этилтиазол-2-иламиногруппа, 5-этилтиазол-2-иламиногруппа, 4-этокситиазол-2-иламиногруппа, 5-метокситиазол-2-иламиногруппа, 4-карбамоилтиазол-2-иламиногруппа, 5-карбамоилтиазол-2-иламиногруппа, 4-метилкарбамоилтиазол-2-иламиногруппа, 4-этилкарбамоилтиазол-2-иламиногруппа, 4-метилтиазол-2-иламиногруппа, 4-цианотиазол-2-иламиногруппа, 4-хлортиазол-2-иламиногруппа, 4-фтортиазол-2-иламиногруппа, 4-этилкарбамоилтиазол-2-иламиногруппа, 4-изопропилтиазол-2-иламиногруппа, 4-метилкарбонилтиазол-2-иламиногруппа, 4-этилкарбонилтиазол-2-иламиногруппа, 4-этилкарбониламинотиазол-2-иламиногруппа, 4-метилкарбониламинотиазол-2-иламиногруппа, 4-метилсульфонилтиазол-2-иламиногруппа, 4-этилсульфонилтиазол-2-иламиногруппа, 3-метилсульфонилтиазол-2-иламиногруппа, 4-изопропилсульфонилтиазол-2-иламиногруппа, 4-метиламинотиазол-2-иламиногруппа, 3-метиламинотиазол-2-иламиногруппа, 4-этиламинотиазол-2-иламиногруппа, 4-аминометилтиазол-2-иламиногруппа, 4-аминоэтилтиазол-2-иламиногруппа, 3-аминометилтиазол-2-иламиногруппа, пиридин-4-иламиногруппа, 6-гидроксиметилпиридин-3-иламиногруппа, 3-гидроксиметилпиридин-4-иламиногруппа, 4-гидроксиметилпиридин-2-иламиногруппа, 5-гидроксиметилпиридин-2-иламиногруппа, 3-метилпиридин-4-илсульфанильная группа, 4-метилпиридин-2-иламиногруппа, 6-метилпиридин-3-иламиногруппа, 6-метоксипиридин-3-иламиногруппа, 2-карбамоилпиридин-4-иламиногруппа, 6-карбамоилпиридин-3-иламиногруппа, 6-метилкарбамоилпиридин-3-иламиногруппа, 2-метилкарбамоилпиридин-4-иламиногруппа, 2-цианопиридин-4-иламиногруппа, 6-цианопиридин-3-иламиногруппа, 2-трифторметилпиридин-4-иламиногруппа, 6-трифторметилпиридин-3-иламиногруппа, 2-хлорпиридин-4-иламиногруппа, 6-хлорпиридин-3-иламиногруппа, 2-фторпиридин-4-иламиногруппа, 6-фторпиридин-3-иламиногруппа, 2-метилкарбонилпиридин-4-иламиногруппа, 6-метилкарбонилпиридин-3-иламиногруппа, 2-этилкарбонилпиридин-4-иламиногруппа, 6-этилкарбонилпиридин-3-иламиногруппа, 2-метилсульфонилпиридин-4-иламиногруппа, 6-метилсульфонилпиридин-3-иламиногруппа, 2-этилсульфонилпиридин-4-иламиногруппа, 6-изопропилсульфонилпиридин-3-иламиногруппа, 2-метилкарбониламинопиридин-4-иламиногруппа, 6-метилкарбониламинопиридин-3-иламиногруппа, 2-метиламинопиридин-4-иламиногруппа, 6-метиламинопиридин-3-иламиногруппа, 2-этиламинопиридин-4-иламиногруппа, 6-этиламинопиридин-3-иламиногруппа, 2-аминометилпиридин-4-иламиногруппа, 6-аминометилпиридин-3-иламиногруппа, 4-гидроксиметилфеноксигруппа, 4-гидроксиэтилфеноксигруппа, 3-гидроксиметилфеноксигруппа, 3-гидроксиэтилфеноксигруппа, 4-метилфеноксигруппа, 3-этилфеноксигруппа, 4-метоксифеноксигруппа, 3-метоксифеноксигруппа, 4-этоксифеноксигруппа, 4-карбамоилфеноксигруппа, 3-карбамоилфеноксигруппа, 4-метилкарбамоилфеноксигруппа, 3-изопропилкарбамоилфеноксигруппа, 4-цианофеноксигруппа, 3-цианофеноксигруппа, 4-трифторметилфеноксигруппа, 3-трифторметилфеноксигруппа, 4-хлорфеноксигруппа, 3-хлорфеноксигруппа, 4-фторфеноксигруппа, 3-фторфеноксигруппа, 4-метилкарбонилфеноксигруппа, 3-метилкарбонилфеноксигруппа, 4-этилкарбонилфеноксигруппа, 4-метилкарбониламинофеноксигруппа, 3-метилкарбониламинофеноксигруппа, 4-метилсульфонилфеноксигруппа, 3-метилсульфонилфеноксигруппа, 4-этилсульфонилфеноксигруппа, 3-этилсульфонилфеноксигруппа, 4-метиламинофеноксигруппа, 3-метиламинофеноксигруппа, 4-этиламинофеноксигруппа, 3-этиламинофеноксигруппа, 4-аминометилфеноксигруппа, 3-аминометилфеноксигруппа, 4-аминоэтилфеноксигруппа, 3-аминоэтилфеноксигруппа, 4-гидроксиэтилфенилметиламиногруппа, 3-гидроксиметилфенилметиламиногруппа, 2-гидроксиметилфенилметиламиногруппа, 4-метилфенилметиламиногруппа, 3-метилфенилметиламиногруппа, 2-метилфенилметиламиногруппа, 4-этилфенилметиламиногруппа, 4-изопропилфенилметиламиногруппа, 4-метоксифенилметиламиногруппа, 3-метоксифенилметиламиногруппа, 2-этоксифенилметиламиногруппа, 4-этоксиметилфенилметиламиногруппа, 4-гидроксиметилфенилметиламиногруппа, 4-карбамоилфенилметиламиногруппа, 4-метилкарбамоилфенилметиламиногруппа, 4-изопропилкарбамоилфенилметиламиногруппа, 4-цианофенилметиламиногруппа, 4-трифторметилфенилметиламиногруппа, 4-фторфенилметиламиногруппа, 3-хлорфенилметиламиногруппа, 2-хлорфенилметиламиногруппа, 2-фторфенилметиламиногруппа, 4-метилкарбонилфенилметиламиногруппа, 4-этилкарбонилфенилметиламиногруппа, 3-метилкарбонилфенилметиламиногруппа, 3-этилкарбонилфенилметиламиногруппа, 4-метилкарбониламинофенилметиламиногруппа, 4-этилкарбониламинофенилметиламиногруппа, 4-изопропилкарбониламинофенилметиламиногруппа, 4-метилсульфонилфенилметиламиногруппа, 3-этилсульфонилфенилметиламиногруппа, 4-изопропилсульфонилфенилметиламиногруппа, 4-метиламинофенилметиламиногруппа, 3-этиламинофенилметиламиногруппа, 4-аминометилфенилметиламиногруппа, 3-аминометилфенилметиламиногруппа, 4-аминоэтилфенилметиламиногруппа, 3-аминоэтилфенилметиламиногруппа, 4-метилтиазол-2-илметиламиногруппа, 5-метилтиазол-2-илметиламиногруппа, 4-этилтиазол-2-илметиламиногруппа, 5-этилтиазол-2-илметиламиногруппа, 4-этокситиазол-2-илметиламиногруппа, 5-метокситиазол-2-илметиламиногруппа, 4-карбамоилтиазол-2-илметиламиногруппа, 5-карбамоилтиазол-2-илметиламиногруппа, 4-метилкарбамоилтиазол-2-илметиламиногруппа, 4-этилкарбамоилтиазол-2-илметиламиногруппа, 4-метилтиазол-2-илметиламиногруппа, 4-цианотиазол-2-илметиламиногруппа, 4-хлортиазол-2-илметиламиногруппа, 4-фтортиазол-2-илметиламиногруппа, 4-метилкарбамоилтиазол-2-илметиламиногруппа, 4-этилкарбамоилтиазол-2-илметиламиногруппа, 4-изопропилтиазол-2-илметиламиногруппа, 4-метилкарбонилтиазол-2-илметиламиногруппа, 4-этилкарбонилтиазол-2-илметиламиногруппа, 4-этилкарбониламинотиазол-2-илметиламиногруппа, 4-метилкарбониламинотиазол-2-илметиламиногруппа, 4-метилсульфонилтиазол-2-илметиламиногруппа, 4-этилсульфонилтиазол-2-илметиламиногруппа, 3-метилсульфонилтиазол-2-илметиламиногруппа, 4-изопропилсульфонилтиазол-2-илметиламиногруппа, 4-метиламинотиазол-2-илметиламиногруппа, 3-метиламинотиазол-2-илметиламиногруппа, 4-этиламинотиазол-2-илметиламиногруппа, 4-аминометилтиазол-2-илметиламиногруппа, 4-аминоэтилтиазол-2-илметиламиногруппа, 3-аминометилтиазол-2-илметиламиногруппа, пиридин-4-илметиламиногруппа, 6-гидроксиметилпиридин-3-илметиламиногруппа, 3-гидроксиметилпиридин-4-илметиламиногруппа, 4-гидроксиметилпиридин-2-илметиламиногруппа, 5-гидроксиметилпиридин-2-илметиламиногруппа, 3-метилпиридин-4-илсульфанильная группа, 4-метилпиридин-2-илметиламиногруппа, 6-метилпиридин-3-илметиламиногруппа, 6-метоксипиридин-3-илметиламиногруппа, 2-карбамоилпиридин-4-илметиламиногруппа, 6-карбамоилпиридин-3-илметиламиногруппа, 6-метилкарбамоилпиридин-3-илметиламиногруппа, 2-метилкарбамоилпиридин-4-илметиламиногруппа, 2-цианопиридин-4-илметиламиногруппа, 6-цианопиридин-3-илметиламиногруппа, 2-трифторметилпиридин-4-илметиламиногруппа, 6-трифторметилпиридин-3-илметиламиногруппа, 2-хлорпиридин-4-илметиламиногруппа, 6-хлорпиридин-3-илметиламиногруппа, 2-фторпиридин-4-илметиламиногруппа, 6-фторпиридин-3-илметиламиногруппа, 2-метилкарбонилпиридин-4-илметиламиногруппа, 6-метилкарбонилпиридин-3-илметиламиногруппа, 2-этилкарбонилпиридин-4-илметиламиногруппа, 6-этилкарбонилпиридин-3-илметиламиногруппа, 2-метилсульфонилпиридин-4-илметиламиногруппа, 6-метилсульфонилпиридин-3-илметиламиногруппа, 2-этилсульфонилпиридин-4-илметиламиногруппа, 6-изопропилсульфонилпиридин-3-илметиламиногруппа, 2-метилкарбониламинопиридин-4-илметиламиногруппа, 6-метилкарбониламинопиридин-3-илметиламиногруппа, 2-метиламинопиридин-4-илметиламиногруппа, 6-метиламинопиридин-3-иламиногруппа, 2-этиламинопиридин-4-иламиногруппа, 6-этиламинопиридин-3-иламиногруппа, 2-аминометилпиридин-4-иламиногруппа, 6-аминометилпиридин-3-илметиламиногруппа, 3-гидроксиметилфенилметильная группа, 2-гидроксиметилфенилметильная группа, 4-метилфенилметильная группа, 3-метилфенилметильная группа, 2-метилфенилметильная группа, 4-изопропилфенилметильная группа, 4-метоксифенилметильная группа, 3-метоксифенилметильная группа, 2-этоксифенилметильная группа, 4-этоксифенилметильная группа, 4-гидроксиметилфенилметильная группа, 4-карбамоилфенилметильная группа, 4-метилкарбамоилфенилметильная группа, 4-изопропилкарбамоилфенилметильная группа, 4-цианофенилметильная группа, 4-трифторметилфенилметильная группа, 4-фторфенилметильная группа, 3-хлорфенилметильная группа, 2-фторфенилметильная группа, 4-метилкарбонилфенилметильная группа, 4-этилкарбонилфенилметильная группа, 3-метилкарбонилфенилметильная группа, 3-этилкарбонилфенилметильная группа, 4-метилкарбониламинофенилметильная группа, 4-этилкарбонилфенилметильная группа, 4-изопропилкарбонилфенилметильная группа, 4-метилсульфонилфенилметильная группа, 3-этилсульфонилфенилметильная группа, 4-изопропилсульфонилфенилметильная группа, 4-метиламинофенилметильная группа, 3-этиламинофенилметильная группа, 2-метиламинофенилметильная группа, 4-аминометилфенилметильная группа, 3-аминометилфенилметильная группа, 4-аминоэтилфенилметильная группа, тиазол-2-илметильная группа, 4-гидроксиметилтиазол-2-ильная группа, 5-гидроксиметилтиазол-2-илметильная группа, 4-гидроксиэтилтиазол-2-илметильная группа, 4-метилтиазол-2-илметильная группа, 5-метилтиазол-2-илметильная группа, 4-этилтиазол-2-илметильная группа, 4-метокситиазол-2-илметильная группа, 4-этокситиазол-2-илметильная группа, 4-карбамоилтиазол-2-илметильная группа, 5-карбамоилтиазол-2-илметильная группа, 4-метилкарбамоилтиазол-2-илметильная группа, 4-этилкарбамоилтиазол-2-илметильная группа, 4-изопропилтиазол-2-илметильная группа, 4-цианотиазол-2-илметильная группа, 4-хлортиазол-2-илметильная группа, 4-фтортиазол-2-илметильная группа, 4-метилкарбонилтиазол-2-илметильная группа, 4-этилкарбонилтиазол-2-илметильная группа, 4-этилкарбониламинотиазол-2-илметильная группа, 4-метилкарбониламинотиазол-2-илметильная группа, 4-метилсульфонилтиазол-2-илметильная группа, 4-этилсульфонилтиазол-2-илметильная группа, 3-метилсульфонилтиазол-2-илметильная группа, 4-изопропилсульфонилтиазол-2-илметильная группа, 4-метиламинотиазол-2-илметильная группа, 3-метиламинотиазол-2-илметильная группа, 4-этиламинотиазол-2-илметильная группа, 4-аминометилтиазол-2-илметильная группа, 4-аминоэтилтиазол-2-илметильная группа, пиридин-4-илметильная группа, 6-гидроксиметилпиридин-3-илметильная группа, 3-гидроксиметилпиридин-4-илметильная группа, 4-гидроксиметилпиридин-2-илметильная группа, 3-метилпиридин-4-илсульфанильная группа, 4-метилпиридин-2-илметильная группа, 6-метилпиридин-3-илметильная группа, 6-метоксипиридин-3-илметильная группа, 2-карбамоилпиридин-4-илметильная группа, 6-карбамоилпиридин-3-илметильная группа, 6-метилкарбамоилпиридин-3-илметильная группа, 2-метилкарбамоилпиридин-4-илметильная группа, 2-цианопиридин-4-илметильная группа, 6-цианопиридин-3-илметильная группа, 2-трифторметилпиридин-4-илметильная группа, 6-трифторметилпиридин-3-илметильная группа, 2-хлорпиридин-4-илметильная группа, 6-хлорпиридин-3-илметильная группа, 2-фторпиридин-4-илметильная группа, 6-фторпиридин-3-илметильная группа, 2-метилкарбонилпиридин-4-илметильная группа, 6-метилкарбонилпиридин-3-илметильная группа, 2-этилкарбонилпиридин-4-илметильная группа, 6-этилкарбонилпиридин-3-илметильная группа, 2-метилсульфонилпиридин-4-илметильная группа, 6-метилсульфонилпиридин-3-илметильная группа, 2-этилсульфонилпиридин-4-илметильная группа, 6-изопропилсульфонилпиридин-3-илметильная группа, 2-метилкарбониламинопиридин-4-илметильная группа, 6-метилкарбониламинопиридин-3-илметильная группа, 2-метиламинопиридин-4-илметильная группа, 6-метиламинопиридин-3-иламиногруппа, 2-этиламинопиридин-4-иламиногруппа, 2-этиламинопиридин-5-иламиногруппа, 2-аминометилпиридин-4-иламиногруппа, 6-аминометилпиридин-3-илметильная группа. Из них предпочтительными группами являются фенилсульфанильная группа, 4-гидроксиэтилфенилсульфанильная группа, 4-метилфенилсульфанильная группа, 3-метилфенилсульфанильная группа, 4-метоксифенилсульфанильная группа, 3-метоксифенилсульфанильная группа, 4-этоксифенилсульфанильная группа, 4-гидроксиметилфенилсульфанильная группа, 4-гидроксиэтилоксисульфанильная группа, 4-карбамоилфенилсульфанильная группа, 4-метилкарбамоилфенилсульфанильная группа, 4-диметилкарбамоилфенилсульфанильная группа, 4-цианофенилсульфанильная группа, 4-трифторметилфенилсульфанильная группа, 4-фторфенилсульфанильная группа, 3-хлорфенилсульфанильная группа, 2-фторфенилсульфанильная группа, 4-метилкарбонилфенилсульфанильная группа, 4-этилкарбонилфенилсульфанильная группа, 4-метилкарбониламинофенилсульфанильная группа, 4-метилсульфонилфенилсульфанильная группа, 4-метиламинофенилсульфанильная группа, 4-аминометилфенилсульфанильная группа, 4-аминоэтилфенилсульфанильная группа, 4-диметиламиноэтилоксифенилсульфанильная группа, тиазол-2-илсульфанильная группа, 4-метилтиазол-2-илсульфанильная группа, 5-метилтиазол-2-илсульфанильная группа, пиридин-4-илсульфанильная группа, пиридин-3-илсульфанильная группа, пиридин-2-илсульфанильная группа, 6-гидроксиметилпиридин-3-илсульфанильная группа, 6-метилпиридин-3-илсульфанильная группа, 6-метоксипиридин-3-илсульфанильная группа, 6-карбамоилпиридин-3-илсульфанильная группа, 6-метилкарбамоилпиридин-3-илсульфанильная группа, 2-цианопиридин-4-илсульфанильная группа, 6-цианопиридин-3-илсульфанильная группа, 6-трифторметилпиридин-3-илсульфанильная группа, 2-хлорпиридин-4-илсульфанильная группа, 6-хлорпиридин-3-илсульфанильная группа, 2-фторпиридин-4-илсульфанильная группа, 6-фторпиридин-3-илсульфанильная группа, 6-метилкарбонилпиридин-3-илсульфанильная группа, 6-этилкарбонилпиридин-3-илсульфанильная группа, 6-метилсульфонилпиридин-3-илсульфанильная группа, 6-метилкарбониламинопиридин-3-илсульфанильная группа, 6-метиламинопиридин-3-илсульфанильная группа, 6-этиламинопиридин-3-илсульфанильная группа, 6-аминометилпиридин-3-илсульфанильная группа, 4-метилфениламиногруппа, 4-метоксифениламиногруппа, 4-фторфениламиногруппа, 4-метилтиазол-2-иламиногруппа, 5-метилтиазол-2-иламиногруппа, пиридин-4-иламиногруппа, 2-метилпиридин-5-иламиногруппа, 4-метилфеноксигруппа, 4-метоксифеноксигруппа, 4-фторфеноксигруппа, 4-метилфениламинометильная группа, 3-метилфениламинометильная группа, 2-метилфениламинометильная группа, 4-фторфениламинометильная группа, 2-хлорфенилметиламиногруппа, 2-фторфениламинометильная группа, 4-метилтиазол-2-иламинометильная группа, 5-метилтиазол-2-иламинометильная группа, пиридин-4-иламинометильная группа, 6-метилпиридин-3-иламинометильная группа, 2-метилпиридин-5-иламинометильная группа, 4-метилфенилметильная группа, 4-метилоксифенилметильная группа и 4-фторфенилметильная группа; более предпочтительными группами являются фенилсульфанильная группа, 4-гидроксиэтилфенилсульфанильная группа, 4-метилфенилсульфанильная группа, 3-метилфенилсульфанильная группа, 4-метоксифенилсульфанильная группа, 3-метоксифенилсульфанильная группа, 4-этоксифенилсульфанильная группа, 4-гидроксиметилфенилсульфанильная группа, гидроксиэтилоксифенилсульфанильная группа, 4-карбамоилфенилсульфанильная группа, 4-метилкарбамоилфенилсульфанильная группа, 4-диметилкарбамоилфенилсульфанильная группа, 4-цианофенилсульфанильная группа, 4-трифторметилфенилсульфанильная группа, 4-фторфенилсульфанильная группа, 3-хлорфенилсульфанильная группа, 2-фторфенилсульфанильная группа, 4-метилкарбонилфенилсульфанильная группа, 4-метилсульфонилфенилсульфанильная группа, 4-диметиламиноэтилоксифенилсульфанильная группа, пиридин-4-илсульфанильная группа, пиридин-3-илсульфанильная группа, 6-метоксипиридин-3-илсульфанильная группа, 6-метилпиридин-3-илсульфанильная группа и 6-трифторметилпиридин-3-илсульфанильная группа; и еще более предпочтительными группами являются фенилсульфанильная группа, 4-гидроксиэтилфенилсульфанильная группа, 4-метилфенилсульфанильная группа, 4-метоксифенилсульфанильная группа, 4-этоксифенилэтилсульфанильная группа, 4-метилкарбамоилфенилсульфанильная группа, 4-диметилкарбамоилфенилсульфанильная группа, 4-цианофенилсульфанильная группа, 4-трифторметилфенилсульфанильная группа, 4-фторфенилсульфанильная группа, 2-фторфенилсульфанильная группа, 4-метилкарбонилфенилсульфанильная группа, 4-метилсульфонилфенилсульфанильная группа, 4-диметиламиноэтилоксифенилсульфанильная группа, пиридин-4-илсульфанильная группа, пиридин-3-илсульфанильная группа, 6-метокси-4-илсульфанильная группа, 6-метоксипиридин-3-илсульфанильная группа и 6-метилпиридин-3-илсульфанильная группа.
Как указано выше, соединения согласно изобретению, отвечающие формуле (I):

(где соответствующие символы имеют такие же значения, как указанные выше)
более конкретно включают, например,
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(1-метилимидазол-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(1-метил-1Н-тетразол-5-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(циклогексилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(тиазол-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилсульфанил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилокси)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилметилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(3-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(2,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-цианофенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-ацетилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(тиофен-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-хлорфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(3Н-[1,2,4]триазол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилсульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метоксиметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-трифторметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-диметиламинометилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилсульфамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-гидроксициклогексилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридазин-3-ил)-2-пиридинкарбоксамид;
3-(пиразин-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(1-метил-1Н-тетразол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-фенокси-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-хлорфенилметиламино)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(пиридин-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(4-фторфенилсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(тиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3,6-бис(5-метил[1,3,4]тиадиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,3,4]тиадиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилкарбонилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиримидин-4-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-этоксикарбонилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилоксиметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилсульфанилметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-фенилметил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилметил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламинометилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-4-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиэтилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксикарбонилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(пиримидин-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-метилпирролидин-3-илокси)фенилсульфанил]-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диэтиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-пирролидиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-диметиламиноэтилоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиразол-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2 пиридинкарбоксамид;
3-(4-карбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(5-бром-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,5]тиадиазол-3-ил)-2-пиридинкарбоксамид;
3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метокси[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-циклопропил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2-фторпиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(2-метоксипиримидин-5-илсульфанил)-6-(2Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диэтилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-циклопропилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(пиразол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиносульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(5-фторпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]триазин-3-ил)-2-пиридинкарбоксамид;
3-(4-карбоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(имидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(2-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[4,5-b]пиридин-2-ил)-2-пиридинкарбоксамид;
3-(5-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4,4-дифторметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиэтилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(2-метилимидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-гидроксиметил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтил)фенилсульфанил]-6-(4-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-метил-1Н-индазол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(3-метил[1,2,4]триазоло[4,3-a]пиридин-7-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-[4-(1Н-имидазол-1-ил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4,5-диметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4,5-диметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1-метоксиэтил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-трифторметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-трифторметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(3-фтор-4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(1,1-диметил-1-гидроксиметил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(3,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(3,5-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(1-метил-2-оксо-2,3-дигидро-1Н-индол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]триазолпиридин-2-ил)-2-пиридинкарбоксамид;
3-(4-этоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-оксо-1,6-дигидропиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамид. Из них предпочтительными соединениями являются 3-(4-фторфенилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(пиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-хлорфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(3Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,3,4]тиадиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилсульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-N,N-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтил)фенилсульфанил]-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридин-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид; или 3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид. Более предпочтительные примеры включают: 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-N,N-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-2-ил)-2-пиридинкарбоксамид;
3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамид;
3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамид;
3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид; и
3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамид.
Производные 2-пиридинкарбоксамида согласно настоящему изобретению также могут находиться в виде фармацевтически приемлемых солей, включающих аддитивные соли кислот и аддитивные соли оснований.
В некоторых случаях соединения согласно настоящему изобретению находятся в виде стереоизомеров или таутомеров, таких как оптические изомеры, диастереомеры или геометрические изомеры, в зависимости от положения заместителей. Все эти изомеры, естественно, входят в рамки настоящего изобретения. Кроме того, в рамки настоящего изобретения также входят смеси этих изомеров в любом соотношении.
Соединения согласно настоящему изобретению обладают активностью в отношении активации глюкокиназы и поэтому они пригодны в качестве терапевтических и/или профилактических средств против сахарного диабета, а также против диабетического осложнения.
Под диабетическим осложнением подразумевают заболевания, провоцируемые развитием сахарного диабета, и включают, например, диабетическую нефропатию, диабетическую ретинопатию, диабетический невроз, диабетический артериосклероз и так далее.
Соединения согласно настоящему изобретению применимы как в случае инсулинзависимого сахарного диабета (IDDM), так и в случае инсулиннезависимого сахарного диабета (NIDDM).
Считают, что инсулинзависимый сахарный диабет (IDDM) развивается за счет повышения резистентности к инсулину, обусловленного ожирением, в дополнение к генетической предрасположенности в отношении уменьшения секреции инсулина и резистентности к инсулину, главным образом, в скелетных мышцах у взрослых. Инсулинзависимый сахарный диабет было предложено подразделять на тип I и тип II в зависимости от предрасположенности.
Полагают, что соединения согласно настоящему изобретению эффективны не только в случае инсулинзависимого диабета типа I, но и также при диабете типа II, в случае которого используемые до сих пор антидиабетические лекарственные средства неспособны в достаточной степени снижать уровень сахара в крови.
В случае сахарного диабета типа II, содержание сахара в крови после принятия пищи заметно сохраняется на высоком уровне в течение длительного периода времени по сравнению с таковым здоровых людей. Соединения согласно настоящему изобретению пригодны против такого диабета типа II.
Ниже поясняется способ получения соединений согласно настоящему изобретению.
Соединения формулы (I) согласно настоящему изобретению могут быть легко получены в соответствии с общеизвестным реакционным способом или само по себе могут быть известны. Соединения формулы (I) согласно изобретению могут быть получены по общепринятому способу, осуществляемому в жидкой фазе, или по недавно разработанному твердофазному способу, такому как комбинированный синтетический способ или параллельный способ синтеза. Предпочтительно, они могут быть получены, например, согласно следующим способам.
(где соответствующие символы имеют такие же значения, как указанные выше).
Стадия 1
На этой стадии, производное дихлорпиридинкарбоновой кислоты или ее реакционноспособное производное вводят в реакцию с аминосоединением (2), получая соединение (3). Реакция может быть осуществлена путем использования реакции, приводящей к образованию амида, описанным ранее способом (например, Basic Principle and Experiments in Peptide Syntheses, Nobuo Izumiya и др., Maruzen Co., Ltd., 1983; Comprehensive Organic Synthesis, 6, Pergamon Press, 1991), соответствующим ему способом или комбинацией их и стандартных способов. То есть, реакцию проводят в присутствии конденсирующего средства, известного специалисту в данной области, или по такому способу, как способ с активацией сложного эфира, способ с использованием смешанного ангидрида кислоты, способ с использованием хлорангидрида кислоты или способ с карбодиимидом, который может быть использован специалистом в данной области. Такой агент, приводящий к образованию амида, включает, например, тионилхлорид, оксалилхлорид, N,N-дициклогексилкарбодиимид, 1-метил-2-бром-пиридинийиодид, N,N'-карбонилдиимидазол, дифенилфосфорилхлорид, дифенилфосфорилазид, N,N'-дисукцинимидилкарбонат, N,N'-дисукцинимидилоксалат, 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид, этилхлорформиат, изобутилхлорформиат или бензотриазо-1-илокситрис(диметиламино)фосфонийгексафторфосфат. Из этих агентов предпочтительны, например, тионилхлорид, 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид, N,N-дициклогексилкарбодиимид или бензотриазо-1-илокситрис(диметиламино)фосфонийгексафторфосфат. В случае реакции, приводящей к образованию амида, основание и вспомогательный агент для конденсации могут быть использованы вместе с приводящим к образованию амида агентом.
Используемое основание включает, например, третичные алифатические амины, такие как триметиламин, триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, N-метилпирролидин, N-метилпиперидин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0]-ундец-7-ен (DBU) или 1,5-азобицикло[4,3,0]нон-5-ен (DBN); и ароматические амины, такие как пиридин, 4-диметиламинопиридин, пиколин, лутидин, хинолин или изохинолин. Из них предпочтительны третичные алифатические амины, особенно триэтиламин или N,N-диизопропилэтиламин.
Используемый вспомогательный агент для конденсации включает, например, N-гидроксибензотриазолгидрат, N-гидроксисукцин-имид, N-гидрокси-5-норборнен-2,3-дикарбоксамид или 3-гидрокси-3,4-дигидро-4-оксо-1,2,3-бензотриазол. Из них предпочтительны, например, N-гидроксибензотриазол и тому подобное.
Соединение (2) может быть использовано обычно в количестве 0,1-10 эквивалентов, предпочтительно, 0,5-3 эквивалента, на 1 эквивалент производного карбоновой кислоты (1) или ее реакционноспособного производного, однако, это количество зависит от типа соединения и растворителя и других условий реакции.
Приводящий к образованию амида агент может быть использован в количестве 1-10 эквивалентов, предпочтительно, 1-3 эквивалента, на 1 эквивалент производного карбоновой кислоты (1) или ее реакционноспособного производного, однако, это количество зависит от типа соединения и растворителя и других условий реакции.
Вспомогательный агент для конденсации может быть использован обычно в количестве 1-10 эквивалентов, предпочтительно, 1-3 эквивалента, на 1 эквивалент производного карбоновой кислоты (1) или ее реакционноспособного производного, однако, это количество зависит от типа соединения и растворителя и других условий реакции.
Основание может быть использовано обычно в количестве 1-10 эквивалентов, предпочтительно, 1-5 эквивалентов, однако, это количество зависит от типа соединения и растворителя и других условий реакции.
Нет особого ограничения в отношении растворителя для реакции, используемого на этой стадии, если он не оказывает неблагоприятного воздействия на реакцию; такой растворитель включает, например, инертные растворители, в особенности, дихлорметан, хлороформ, 1,2-дихлорэтан, N,N-диметилформамид, этилацетат, метилацетат, ацетонитрил, бензол, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, диметоксиэтан или их смесь. Принимая во внимание поддержание соответствующей температуры реакции, предпочтительным является дихлорметан, хлороформ, 1,2-дихлорэтан, ацетонитрил или N,N-диметилформамид.
Температура реакции на этой стадии обычно может представлять собой температуру от -78°С до температуры кипения с обратным холодильником растворителя, предпочтительно, от 0°С до 30°С.
Время реакции на этой стадии обычно может составлять от 0,5 часа до 96 часов, предпочтительно, от 3 часов до 24 часов.
Основание, приводящий к образованию амида агент и вспомогательный агент для конденсации, используемые на этой стадии, могут быть использованы индивидуально или в сочетании 2 или более видов.
Когда соединение (3), получаемое на этой стадии, содержит защитную группу в заместителе в цикле В, защитная группа, если необходимо, может быть удалена. Удаление защитной группы может быть осуществлено ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-е издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Таким образом полученное соединение (3) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, кристаллизации, экстракции растворителями, переосаждения, хроматографии, и так далее. Альтернативно, соединение (3) может быть использовано на последующей стадии без очистки.
Стадия 2
На этой стадии, полученное на стадии 1 соединение (3) вводят в реакцию с соединением (4), отвечающим формуле R1X1H (X1 означает атом кислорода, атом азота или атом серы; R1 имеет такие же значения, как указанные выше), или соединением формулы (II):
получая соединение (5), (6) или (I-1).
Соединение (4), используемое в этой реакции, представляет собой производное фенола, производное тиола или производное амина. Производное фенола включает таковое, в котором гидроксильная группа связана с арильной группой, а также таковое, в котором гидроксильная группа связана с 5-7-членной гетероарильной группой.
На этой стадии, когда используют соединение (4), может быть получено соединение (5).
По реакции с соединением, отвечающим формуле (5) (где соответствующие символы имеют такие же значения, как указанные выше), соединение формулы (II-1) является производным фенола или производным тиола, в котором группа -DH (где D означает атом кислорода или атом серы) связана с циклом А соединения формулы (II) (где производное фенола имеет то же самое значение, как указанное выше).
На этой стадии, когда используют соединение формулы (II), может быть получено соединение (6) или (I-1).
На этой стадии, соединение (4) или (II) может быть использовано обычно в количестве 0,2-10 эквивалентов, предпочтительно, 1-3 эквивалента, на 1 эквивалент соединения (3).
Соединение (I-1) входит в соединения формулы (I) согласно изобретению.
Основание, используемое на этой стадии, включает, например, третичные алифатические амины, такие как триметиламин, триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, N-метилпирролидин, N-метилпиперидин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0]-ундец-7-ен (DBU) или 1,5-азобицикло[4,3,0]нон-5-ен (DBN); ароматические амины, такие как пиридин, 4-диметиламинопиридин, пиколин, лутидин, хинолин или изохинолин; щелочные металлы, такие как калий, натрий или литий; гидриды щелочных металлов, такие как гидрид натрия или гидрид калия; металлорганические соединения, такие как бутиллитий; алкоголяты щелочных металлов, такие как трет-бутилат калия, этилат натрия или метилат натрия; гидроксиды щелочных металлов, такие как гидроксид калия или гидроксид натрия; или карбонаты щелочных металлов, такие как карбонат калия, карбонат натрия или карбонат цезия. Из них особенно предпочтительны третичные алифатические амины, гидриды щелочных металлов, карбонаты щелочных металлов или алкоголяты щелочных металлов, и особенно триэтиламин или N,N-диизопропилэтиламин, гидрид натрия или карбонат калия, или алкоголяты щелочных металлов, такие как трет-бутилат калия, этилат натрия или метилат натрия.
Основание, используемое на этой стадии, обычно может быть использовано в количестве 0,2-10 эквивалентов, предпочтительно, 1-5 эквивалентов, на 1 эквивалент соединения (3), однако, это количество зависит от типа соединения и используемого растворителя.
Нет особого ограничения в отношении используемого растворителя для реакции, если он не оказывает неблагоприятного воздействия на реакцию; такой растворитель включает, например, инертные органические растворители. Конкретно, он включает, например, дихлорметан, хлороформ, 1,2-дихлорэтан, трихлорэтан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, ацетон, этанол, изопропанол, трет-бутанол, трет-амиловый спирт, этилацетат, метилацетат, ацетонитрил, бензол, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, диметоксиэтан или их смесь. Из них предпочтительными являются N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, ацетонитрил, изопропанол и трет-амиловый спирт, и более предпочтительны N,N-диметилформамид, ацетонитрил или изопропанол.
Время реакции обычно составляет от 0,2 часа до 100 часов, предпочтительно, от 1 часа до 40 часов.
Температура реакции обычно составляет от -20°С до температуры кипения с обратным холодильником используемого растворителя, предпочтительно, от 0°С до температуры кипения с обратным холодильником растворителя.
На этой стадии, реакцию можно осуществлять ранее описанным способом (Organic Letters, 4, № 20, 3517-3520 (2002)), соответствующим ему способом или комбинацией их и стандартных способов. Если необходимо, в реакционную среду можно добавлять катализатор и добавку.
Что касается катализатора, используемого на этой стадии, то может быть использован любой тип катализатора, ускоряющего реакцию, включающий, например, хлорид меди, бромид меди, иодид меди, оксид меди, ацетат меди, и тому подобное, причем более предпочтительным является иодид меди.
Что касается добавки, используемой на этой стадии, то может быть использован любой тип добавки, ускоряющей реакцию, включающий, например, этиленгликоль, диметоксиэтан, и тому подобное, причем более предпочтительным является этиленгликоль.
Таким образом полученное соединение (5) или (6) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, переосаждения, экстракции растворителями, кристаллизации, хроматографии и так далее. Альтернативно, соединение (5) или (6) может быть использовано на последующей стадии без очистки.
Соединение (I-1) согласно настоящему изобретению может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, переосаждения, экстракции растворителями, кристаллизации, хроматографии и так далее.
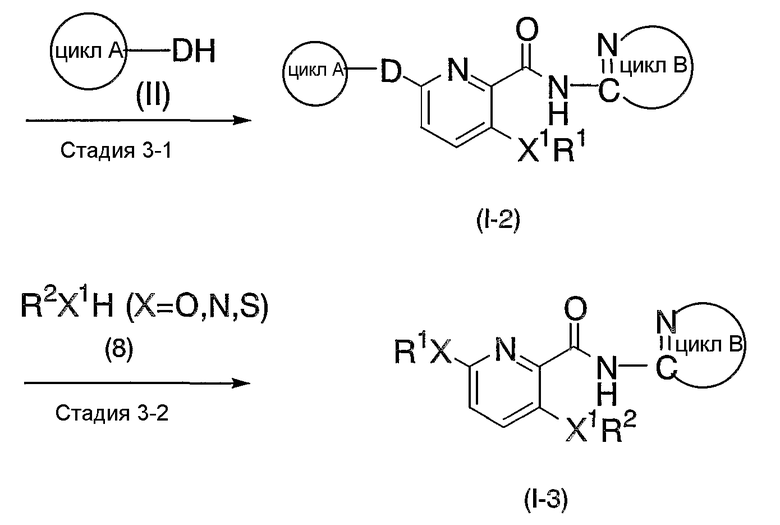
(где соответствующие символы имеют такие же значения, как указанные выше)
Стадия 3-1
На этой стадии, соединение (5), полученное на стадии 2, вводят в реакцию с производным фенола или тиазола, включающим цикл А формулы (II):
(где соответствующие символы имеют такие же значения, как указанные выше) в присутствии основания, получая соединения (I-2) согласно изобретению.
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 2, при условии использования такого же растворителя для реакции, времени реакции и температуры реакции и того же самого количества в эквивалентах исходных соединений.
Таким образом полученное соединение (I-2) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (I-2) может быть использовано на последующей стадии без очистки.
Стадия 3-2
На этой стадии, соединение (6), полученное на стадии 2, вводят в реакцию с соединением (4), отвечающим формуле R1X1H (где соответствующие символы имеют такие же значения, как указанные выше), получая соединение (I-3).
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 2, при условии использования такого же растворителя для реакции, времени реакции и температуры реакции и того же самого количества в эквивалентах исходных соединений и основания.
Таким образом полученное соединение (I-3) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, кристаллизации, экстракции растворителями, переосаждения, хроматографии, и так далее. Альтернативно, соединение (I-3) может быть использовано на последующей стадии без очистки.
Соединения (I-4) согласно изобретению также могут быть получены согласно следующему способу:
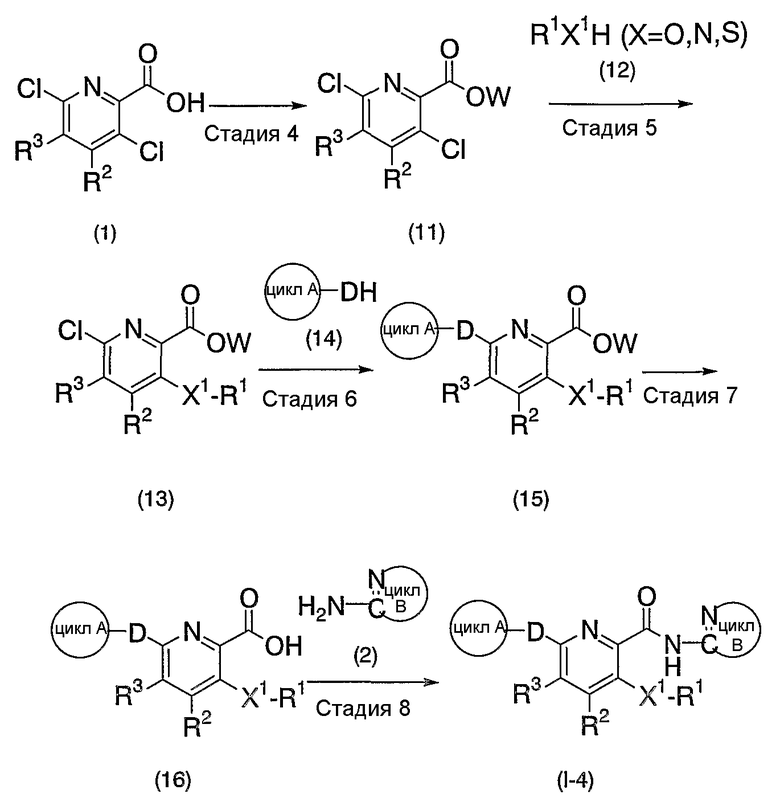
(где W означает защитную группу для карбоксила, а другие символы имеют такие же значения, как указанные выше).
Стадия 4
На этой стадии, в карбоксильную группу производного дихлорпиридин-2-карбоновой кислоты (1) вводят защитную группу, получая соединение (11). Соединение (11) может быть получено известным способом или соответствующим ему способом. Нет особого ограничения в отношении защитной группы W для карбоксильной группы в соединении (11), если она используется как защитная группа для карбоксильной группы на стадиях 5 и 6 и может быть легко удалена на стадии 7. Такая защитная группа включает, например, линейные или разветвленные низшие алкильные группы, такие как метильная группа, этильная группа и трет-бутильная группа; галогенированные низшие алкильные группы, такие как 2-иодэтил и 2,2,2-трихлорэтил; низшие алкенильные группы, такие как аллильная группа, 2-пропенильная группа и 2-метил-2-пропенильная группа; и аралкильные группы, такие как бензильная группа и РМВ-группа.
Введение и удаление защитной группы W в случае карбоксильной группы может быть осуществлено описанным ранее способом (Protective Groups in Organic Synthesis, T.W. Green, 2-е издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Таким образом полученное соединение (11) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, переосаждения, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (11) может быть использовано на последующей стадии без очистки.
Стадия 5
На этой стадии, соединение (11), полученное на стадии 4, вводят в реакцию с соединением (12), отвечающим формуле R1X1H (где соответствующие символы имеют такие же значения, как указанные выше), получая соединение (13).
На этой стадии реакция может быть осуществлена таким же путем, как в случае стадии 2, при условии использования такого же растворителя для реакции, времени реакции и температуры реакции и того же самого количества в эквивалентах исходных соединений и основания.
Таким образом полученное соединение (13) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (13) может быть использовано на последующей стадии без очистки.
Стадия 6
На этой стадии, соединение (13), полученное на стадии 5, вводят в реакцию с производным фенола или тиазола, отвечающим формуле (II):

(где соответствующие символы имеют такие же значения, как указанные выше), получая соединение (15).
Соединения (15) получают, вводя в реакцию производное фенола или производное тиола. В случае этой реакции производное фенола имеет те же самые значения, как указанные выше.
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 2, при условии использования такого же времени реакции, температуры реакции и растворителя для реакции и того же самого количества в эквивалентах исходных соединений и того же самого количества основания.
Таким образом полученное соединение (15) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, переосаждения, экстракции растворителями, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (15) может быть использовано на последующей стадии без очистки.
Стадия 7
На этой стадии, из соединения (15), полученного на стадии 6, удаляют защитную группу W для карбоксила, получая соединение (16).
Удаление защитной группы W в случае карбоксильной группы на этой стадии может быть осуществлено ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-e издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Таким образом полученное соединение (16) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (16) может быть использовано на последующей стадии без очистки.
Стадия 8
На этой стадии, производное карбоновой кислоты (16), полученное на стадии 7, вводят в реакцию с соединением (2), получая соединение (I-4) согласно изобретению.
Реакцией, используемой на этой стадии, является так называемая, приводящая к образованию амида реакция, которая может быть осуществлена таким же путем, как на стадии 1, при условии использования такой же температуры реакции и времени реакции, температуры реакции и такого же количества в эквивалентах исходных соединений и такого же количества конденсирующего агента и вспомогательного агента.
Таким образом полученное соединение (I-4) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (I-4) может быть использовано на последующей стадии без очистки.
Соединения (I-5) согласно настоящему изобретению также могут быть получены согласно следующему способу:
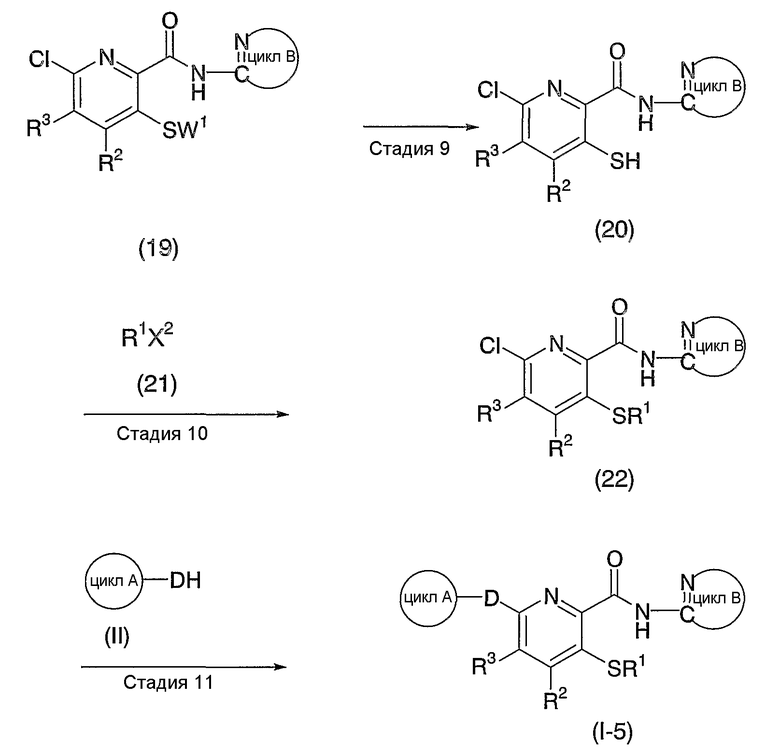
(где W1 означает защитную группу для тиола; Х2 означает удаляемую группу; а другие символы имеют такие же значения, как указанные выше).
Стадия 9
На этой стадии, из соединения (19) удаляют защитную группу для тиола, получая соединение (20).
Удаление защитной группы в случае тиольной группы на этой стадии может быть осуществлено ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-e издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Что касается защитной группы W1 для тиола, то может быть использован любой тип групп, если эта группа может быть легко удалена на этой стадии с получением группы SH. Такая, защитная для группа W1 тиола включает, например, ацильные группы, такие как ацетильная группа или бензоильная группа, или замещенные аралкильные группы, такие как тритильная группа или 4-метоксибезильная группа.
Таким образом полученное соединение (20) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (20) может быть использовано на последующей стадии без очистки.
Стадия 10
На этой стадии, соединение (20), полученное на стадии 9, вводят в реакцию с соединением (21) в присутствии основания, получая соединение (22).
Что касается соединения (21), используемого на этой стадии, может быть использован любой тип соединений, если Х2 в соединении (21) является удаляемой группой, приводящий к получению соединения (22). В качестве Х2 используют, например, атом галогена, такой как атом фтора, атом хлора, атом брома или атом иода, или сульфонат или фосфонат, причем предпочтительным является атом фтора, атом хлора, атом иода или трифторметансульфонат, и более предпочтительным является атом фтора, атом хлора или атом иода.
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 2, при условии использования такого же времени реакции, количества исходных соединений и основания.
Таким образом полученное соединение (22) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, кристаллизации, экстракции растворителями, переосаждения, хроматографии, и так далее. Альтернативно, соединение (22) может быть использовано на последующей стадии без очистки.
Стадия 11
На этой стадии, соединение (22), полученное на стадии 10, вводят в реакцию с соединением (8) в присутствии основания, получая соединение (I-5).
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 2, при условии использования такого же времени реакции, температуры реакции и растворителя для реакции и такого же количества исходных соединений и основания.
Таким образом полученное соединение (I-5) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, кристаллизации, экстракции растворителями, переосаждения, хроматографии, и так далее.
Из соединений согласно изобретению, когда -Х1-R1- в формуле (I) означает -СН2-О-R1 или -CH2-S-R1, соединения (I-6) согласно настоящему изобретению могут быть получены следующим способом.
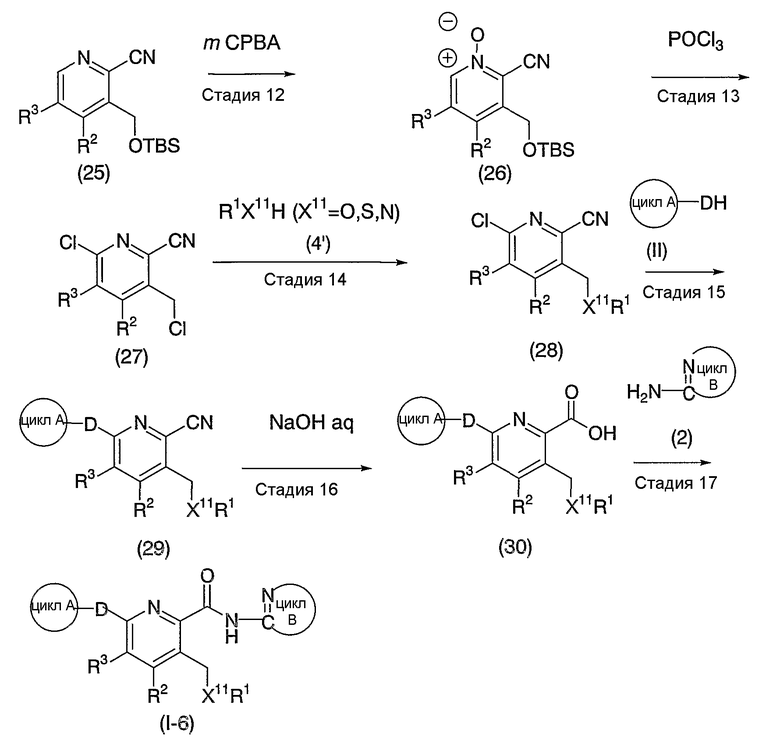
(где соответствующие символы имеют такие же значения, как указанные выше).
Стадия 12
На этой стадии, производное цианопиридина (25) вводят в реакцию с м-хлорпероксибензойной кислотой (mCPBA), получая соединение (26). Реакция окисления на этой стадии может быть осуществлена ранее описанным способом (Tetrahedron, 42, № 5, 1475-1485), соответствующим ему способом или комбинацией их и стандартных способов. mCPBA может быть использована обычно в количестве 0,5-1 эквивалент, предпочтительно, 1-3 эквивалента, на 1 эквивалент соединения (25).
Реакция может быть осуществлена в течение времени от 10 минут до 24 часов, предпочтительно, от 30 минут до 12 часов, при температуре от -20°С до температуры кипения растворителя, предпочтительно, от 0°С до температуры кипения растворителя.
Что касается растворителя, для реакции может быть использован любой тип растворителей, если он не оказывает неблагоприятного действия на протекание реакции, включающий, например, хлороформ, дихлорметан, 1,2-дихлорэтан, и тому подобное.
Таким образом полученное соединение (26) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (26) может быть использовано на последующей стадии без очистки.
Стадия 13
На этой стадии, соединение (26), полученное на стадии (12), вводят в реакцию с POCl3, получая соединение (27).
Используемый в этой реакции POCl3 может быть использован обычно в количестве 0,5-100 эквивалентов, предпочтительно, 1-20 эквивалентов, на 1 эквивалент соединения (26).
Реакция может быть осуществлена обычно при температуре от -20°С до температуры кипения растворителя, предпочтительно, от 20°С до температуры кипения растворителя. Время реакции обычно составляет от 0,5 часа до 50 часов, предпочтительно, от 1 часа до 24 часов.
В качестве растворителя для реакции может быть использован любой тип растворителей, если он не оказывает неблагоприятного действия на протекание реакции, включающий предпочтительно, например, дихлорметан, хлороформ, дихлорэтан, ацетонитрил, N,N-диметилформамид, и тому подобное. Таким образом полученное соединение (27) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, переосаждения, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (27) может быть использовано на последующей стадии без очистки.
Стадия 14
На этой стадии, соединение (27), полученное на стадии 13, вводят в реакцию с соединением (12), полученным на стадии 5, в присутствии основания, получая соединение (28).
На этой стадии реакция может быть осуществлена таким же путем, как на стадии 5, при условии использования такой же температуры реакции, времени реакции и такого же количества исходного соединения (12) и основания.
Таким образом полученное соединение (28) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (28) может быть использовано на последующей стадии без очистки.
Стадия 15
На этой стадии, соединение (28), полученное на стадии 14, вводят в реакцию с соединением (14), получая соединение (29).
Реакция на этой стадии может быть осуществлена таким же путем, как на стадии 2, при условии использования такой же температуры реакции, времени реакции и растворителя для реакции и такого же количества исходного соединения и основания.
Таким образом полученное соединение (29) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (29) может быть использовано на последующей стадии без очистки.
Стадия 16
На этой стадии, соединение (29), полученное на стадии 15, гидролизуют с получением карбоновой кислоты (30). Гидролиз на этой стадии проводят с помощью щелочи. Что касается щелочи, то может быть использован любой тип щелочей, с помощью которого цианогруппу соединения (29) превращают в карбоксильную группу; такая щелочь включает предпочтительно водный раствор гидроксида натрия, гидроксида калия, гидроксида бария, гидроксида лития, и тому подобное, причем более предпочтительным является водный раствор гидроксида натрия или гидроксида калия.
Щелочь может быть использована обычно в количестве 1-100 эквивалентов, предпочтительно, 1-30 эквивалентов, на 1 эквивалент соединения (29), однако, это количество зависит от типа соединений и используемого растворителя и других условий реакции.
Реакция может быть осуществлена обычно при температуре от 0°С до температуры кипения растворителя, предпочтительно, от 50°С до 100°С.
Время реакции составляет от 0,5 часа до 50 часов, предпочтительно, 1-24 часа.
Используемый на этой стадии растворитель включает, предпочтительно, метанол, этанол, изопропанол, диоксан, диметоксиэтан, этиленгликоль, и тому подобное, причем более предпочтительным является изопропанол или диоксан.
Таким образом полученное соединение (30) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (30) может быть использовано на последующей стадии без очистки.
Стадия 17
На этой стадии, карбоновую кислоту (30), полученную на стадии 16, вводят в реакцию с соединением (2), получая соединение (31). Реакция на этой стадии может быть осуществлена таким же путем, как на стадии 1, 8, или тому подобным образом, используя приводящую к образованию амидной связи реакцию ранее описанным способом (Basic Principle and Experiments in Peptide Syntheses, Nobuo Izumiya и др., Maruzen Co., Ltd., 1983; Comprehensive Organic Synthesis, 6, Pergamon Press, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Количество соединения (2), которое должно быть использовано, и условия, такие как растворитель для реакции и температура реакции, могут быть такими же, как в случае приводящей к образованию амидной связи реакции на стадии 1, 8, или тому подобным образом.
Таким образом полученное соединение (31) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее.
Соединение (I-7), то есть, соединения формулы (I), согласно настоящему изобретению, в которых -Х1-R1 означает -СН2-Cm-R1, может быть получено следующим способом (в данном случае Cm означает двухвалентную насыщенную углеводородную группу с 2-5 атомами углерода, где один из атомов углерода может быть заменен на атом азота, атом кислорода или атом серы; R1 имеет такие же значения, как указанные выше).
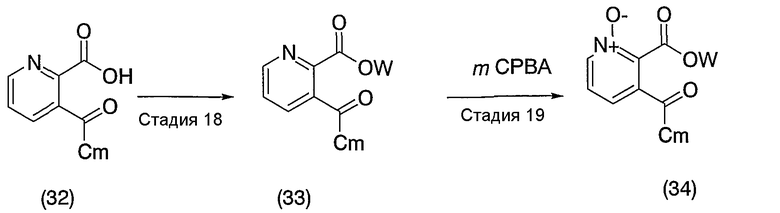
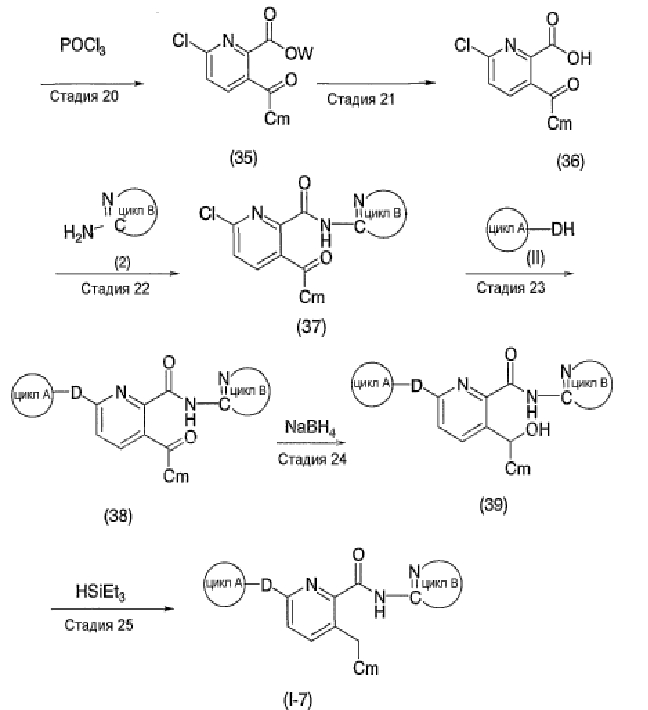
(где соответствующие символы имеют такие же значения, как указанные выше)
Стадия 18
На этой стадии вводят защитную группу для карбоксильной группы соединения (32), получая соединение (33).
Введение защитной группы для карбоксила может быть осуществлено, например, тем же самым путем, как описывается в случае стадии 4, ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-e издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Таким образом полученное соединение (33) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (33) может быть использовано на последующей стадии без очистки.
Стадия 19
На этой стадии, соединение (33), полученное на стадии 1, вводят в реакцию с м-хлорпероксибензойной кислотой (mCPBA), получая соединение (34). Количество mCPBA, которое должно быть использовано на этой стадии, и условия, такие как температура реакции и растворитель для реакции, могут быть теми же самыми, как описанные в случае стадии 12. Таким образом полученное соединение (34) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (34) может быть использовано на последующей стадии без очистки.
Стадия 20
На этой стадии, соединение (34), полученное на стадии (19), вводят в реакцию с POCl3, получая соединение (35).
Количество POCl3, которое должно быть использовано в расчете на 1 эквивалент соединения (34) на этой стадии, и условия, такие как температура реакции и время реакции, могут быть теми же самыми, как описанные в случае стадии 13. Таким образом полученное соединение (35) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, переосаждения, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (35) может быть использовано на последующей стадии без очистки.
Стадия 21
На этой стадии, из соединения (35), полученного на стадии 20, удаляют защитную группу для карбоксила, получая соединение (36).
Удаление защитной группы W в случае карбоксильной группы на этой стадии может быть осуществлено тем же самым путем, как описанный в случае стадии 7, в соответствии с ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-e издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов. Таким образом полученное соединение (36) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (36) может быть использовано на последующей стадии без очистки.
Стадия 22
На этой стадии, соединение (36), полученное на стадии 21, вводят в реакцию с соединением (2), получая соединение (37). Реакция на этой стадии может быть осуществлена тем же самым путем, как описанный в случае реакции, приводящей к образованию амидной связи, на стадии 1, 8, или тому подобным образом. Таким образом полученное соединение (37) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее. Альтернативно, соединение (37) может быть использовано на последующей стадии без очистки.
Стадия 23
На этой стадии, соединение (37), полученное на стадии 22, вводят в реакцию с соединением (14) в присутствии основания, получая соединение (38). Реакция на этой стадии может быть осуществлена тем же самым путем, как описанный в случае стадии 2. Таким образом полученное соединение (38) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, переосаждения, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (38) может быть использовано на последующей стадии без очистки.
Стадия 24
На этой стадии, соединение (38), полученное на стадии (23), вводят в реакцию с NaBH4, получая соединение (39). Реакция на этой стадии может быть осуществлена ранее описанным способом (Comprehensive Organic Synthesis), соответствующим ему способом или комбинацией их и стандартных способов. Количество NaBH4, которое должно быть использовано, составляет обычно 0,2-30 эквивалентов, предпочтителдьно, 1-10 эквивалентов, на 1 эквивалент соединения (38), однако, оно зависит от типа соединения (38) и используемого растворителя и других условий реакции.
Реакция может быть осуществлена обычно при температуре от -78°С до температуры кипения растворителя, предпочтительно, от -10°С до 40°С.
Время реакции составляет обычно 0,1-24 часа, предпочтительно, 0,2-5 часов.
Что касается используемого на этой стадии растворителя, то может быть использован любой тип растворителей, если он не оказывает неблагоприятного действия на протекание реакции, например, включающий предпочтительно метанол, этанол, изопропанол, тетрагидрофуран, и тому подобное, причем более предпочтительным является метанол или этанол. Таким образом полученное соединение (39) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, переосаждения, кристаллизации, хроматографии, и так далее. Альтернативно, соединение (39) может быть использовано на последующей стадии без очистки.
Стадия 25
На этой стадии, соединение (39), полученное на стадии (24), вводят в реакцию с HSi(C2H5)3, получая соединение (I-7). Проводимое на этой стадии восстановление может быть осуществлено ранее описанным способом (J.O.C., 53, № 22, 5301-5304 (1988)), соответствующим ему способом или комбинацией их и стандартных способов.
Количество HSi(C2H5)3, которое должно быть использовано, составляет обычно 0,5-100 эквивалентов, предпочтительно, 1-10 эквивалентов, на 1 эквивалент соединения (39), однако, оно зависит от типа соединения (39) и используемого растворителя и других условий реакции.
Реакция может быть осуществлена обычно в течение 0,2-30 часов, предпочтительно, 0,5-10 часов.
Температура реакции составляет от -10°С до температуры кипения растворителя, предпочтительно, от 0°С до температуры кипения растворителя.
Что касается используемого на этой стадии растворителя, то может быть использован любой тип растворителей, если он не оказывает неблагоприятного действия на протекание реакции, например, включающий, предпочтительно, трифторуксусную кислоту. Таким образом полученное соединение (I-7) может быть выделено и очищено обычным путем, например, путем концентрирования, вакуумной перегонки, экстракции растворителями, кристаллизации, переосаждения, хроматографии, и так далее.
На этой стадии, когда R2 или R3 означает низшую алкоксильную группу, атом водорода алкильной части алкоксигруппы может быть замещен гидроксильной группой или аминогруппой, и в таком случае, если необходимо, введение или удаление защитной для гидроксила группы или аминозащитной группы может быть осуществлено любым путем, описанным в случае стадий 1-25.
Введение или удаление защитной группы может быть осуществлено ранее описанным способом (Protective Groups in Organic Synthesis), соответствующим ему способом или комбинацией их и стандартных способов.
Кроме того, когда цикл А, R1 или цикл В содержит один или более заместителей, может оказаться возможным проведение реакции на каждой стадии путем введения или удаления защитной группы или групп, в соответствии с необходимостью, в случае каждого заместителя.
Реакция для введения или удаления защитной группы может быть осуществлена ранее описанным способом (Protective Groups in Organic Synthesis, T.W. Green, 2-e издание, John Wiley and Sons, 1991), соответствующим ему способом или комбинацией их и стандартных способов.
Производные пиридин-2-карбоксамида, получаемые согласно изобретению, иногда находятся в виде фармацевтически приемлемых солей, которые могут быть получены стандартным способом с использованием соединений формул (I-1), (I-2), (I-3), (I-4), (I-5), (I-6) и (I-7), относящихся к соединениям формулы (I) согласно настоящему изобретению.
В особенности, когда соединения формул (I-1), (I-2), (I-3), (I-4), (I-5), (I-6) и (I-7) содержат основную группу или группы, происходящие от аминогруппы или пиридильной группы, в молекуле, путем обработки кислотой они могут быть превращены в соответствующие фармацевтически приемлемые соли.
Аддитивные соли кислоты включают, например, соли галогеноводородных кислот, такие как гидрохлорид, гидрофторид, гидробромид и гидроиодид; соли неорганических кислот, такие как нитрат, перхлорат, сульфат, фосфат и карбонат; низшие алкилсульфонаты, такие как метансульфонат, трифторметансульфонат и этансульфонат; арилсульфонаты, такие как бензолсульфонат и п-толуолсульфонат; соли органических кислот, такие как фумарат, сукцинат, цитрат, тартрат, оксалат и малеат; и аддитивные соли аминокислот, такие как глутамат и аспартат. Когда соединения согласно настоящему изобретению содержат кислотную группу или кислотные группы в своих заместителях, например, карбоксильную группу, путем обработки основанием они могут быть превращены в соответствующие фармацевтически приемлемые соли. Аддитивные соли оснований включают, например, соли щелочных металлов, такие как соль натрия и соль калия; соли щелочноземельных металлов, такие как соли кальция или соли магния; и соли органических оснований, такие как соль аммония, гуанидина, триэтиламина и дициклогексиламина. Кроме того, соединения согласно настоящему изобретению могут находиться в необязательных формах гидратов или сольватов свободных соединений или солей.
Соединения формулы (I) могут быть использованы для получения лекарственного средства в целях предотвращения или профилактической или терапевтической обработки в случае сахарного диабета типа 2, или заболевания или состояния, ассоциированного с ним, путем объединения соединения формулы (I) с носителями.
Профилактическая или терапевтическая доза соединения формулы (I), конечно, может изменяться в зависимости от природы излечиваемого состояния, выбираемого конкретного соединения и пути его введения.
Она также может изменяться в соответствии с возрастом, массой и ответной реакцией отдельного пациента. Обычно, суточная доза колеблется в пределах от примерно 0,001 мг до примерно 100 мг на кг массы тела, предпочтительно, от примерно 0,01 мг до примерно 50 мг на кг и, более предпочтительно, от примерно 0,1 мг до 10 мг на кг, в виде разовой или разделенной доз. В некоторых случаях может оказаться необходимым использование доз вне этих пределов.
Примером подходящей пероральной дозы является доза приблизительно от 0,01 мг приблизительно до 2,0 г, вводимая перорально в виде одноразовой или разделенной доз, от двух до четырех раз в сутки. Предпочтительно, доза колеблется от примерно 1,0 мг до примерно 200 мг в сутки, вводимая один или два раза в сутки. Более предпочтительно, доза составляет примерно 10-100 мг, вводимая один раз в сутки.
Когда осуществляют внутривенное или пероральное введение, типичная доза колеблется в пределах от примерно 0,001 мг до примерно 100 мг (предпочтительно, от 0,01 мг до примерно 10 мг) соединения формулы (I) на кг массы тела в сутки, и, более предпочтительно, от примерно 0,1 мг до примерно 10 мг соединения формулы (I) на кг массы тела в сутки.
Как указано выше, фармацевтическая композиция включает соединение формулы (I) и фармацевтически приемлемый носитель. Термин "композиция" означает продукт, включающий активный ингредиент и инертный ингредиент (активные и инертные ингредиенты), фармацевтически приемлемые эксципиенты, которые составляют носитель, а также продукт, который получают, непосредственно или опосредованно, в результате комбинирования, коплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий между ингредиентами.
Предпочтительно, композиция включает соединение формулы (I) в количестве, которое является эффективным для лечения, профилактики или задержки появления сахарного диабета типа 2, в комбинации с фармацевтически приемлемым носителем.
Может быть использован любой подходящий путь введения для обеспечения млекопитающего, особенно человека, эффективной дозой соединения согласно настоящему изобретению. Может быть использован, например, пероральный, ректальный, местный, внутривенный, глазной, легочный, назальный путь введения, и тому подобное. Примеры лекарственных форм включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли, и тому подобное, причем предпочтительны пероральные таблетки.
При получении перорально вводимых композиций может быть использована любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и тому подобное в случае перорально вводимых жидкостей, примером которых могут служить суспензии, эликсиры и растворы; или носители могут включать крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, смазывающие вещества, связующие, дезинтегрирующие агенты и тому подобное; перорально вводимые твердые вещества могут включать порошки, капсулы и таблетки, причем предпочтительны перорально вводимые твердые препараты.
Из-за легкости их введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные разовые лекарственные формы. Если желательно, таблетки могут быть снабжены покрытием путем стандартных водных или неводных способов нанесения.
Вдобавок к общепринятым лекарственным формам, указанным выше, соединения формулы (I) также могут быть введены с помощью средств для контролируемого высвобождения и/или средств доставки лекарственных средств, таких как описанные в патентах США 3845770, 3916899, 3536809, 3598123, 3630200 и 4008719.
Фармацевтические композиции согласно настоящему изобретению, пригодные для перорального введения, могут быть, например, в виде капсул, крахмальных облаток или таблеток, причем каждая содержит заданное количество активного ингредиента, в виде порошка или гранул или суспензии в водной жидкости, неводной жидкости, эмульсии "масло-в-воде" или жидкой эмульсии "вода-в-масле". Такие композиции могут быть получены любым из способов, известных в фармации, однако, все способы включают стадию смешения активного ингредиента с носителем, включающим один или более необходимых ингредиентов.
Композиции обычно получают путем гомогенного и тщательного смешения активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или обоими типами носителей и затем, если необходимо, придания продукту соответствующей формы. Например, таблетка может быть получена путем прессования или формования, необязательно, вместе с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены путем прессования в подходящей машине, причем активный ингредиент в свободно-текучей форме, такой как порошок или гранулы, необязательно смешивают со связующим, смазывающим веществом, инертным разбавителем, поверхностно-активным веществом или диспергатором.
Формованные таблетки могут быть изготовлены путем формования в подходящей машине смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Желательно, каждая таблетка содержит от примерно 1 мг до примерно 1 г активного ингредиента и каждая облатка или капсула содержит от примерно 1 мг до 500 мг активного ингредиента.
Ниже приводятся примеры лекарственных форм для соединений формулы (I):
Суспензия для инъекции (внутримышечно)
Таблетка
Капсула
Аэрозоль
Соединения формулы (I) могут быть использованы в комбинации с другими лекарственными средствами, которые применяют при лечении/профилактике/замедлении появления сахарного диабета типа 2, а также при заболеваниях и состояниях, ассоциированных с сахарным диабетом типа 2. Другие лекарственные средства могут быть введены, путем и в количестве, которые обычно используют для них, одновременно или последовательно с соединением формулы (I).
Когда соединение формулы (I) используют одновременно с одним или более другими лекарственными средствами, предпочтительна композиция, содержащая другие лекарственные средства вдобавок к соединению формулы (I). Следовательно, фармацевтические композиции согласно настоящему изобретению включают композиции, которые также содержат один или более других активных ингредиентов вдобавок к соединению формулы (I). Примерами других активных ингредиентов, которые могут быть объединены с соединением формулы (I), вводимые либо отдельно, либо в одних и тех же фармацевтических композициях, являются, но не исчерпывающим образом:
(а) бисгуаниды (например, буформин, метформин, фенформин);
(b) агонисты PPAR (например, троглитазон, пиоглитазон, розиглитазон);
(с) инсулин;
(d) соматостатин;
(е) ингибиторы α-глюкозидазы (например, фоглибоза, миглитол, акарбоза); и
(f) стимуляторы секреции инсулина (например, ацетогексамид, карбутамид, хлорпропамид, глиборнурид, гликлазид, глимерпирид, глипизид, гликвидин, глизоксепид, глибурид, глигексамид, глипинамид, фенбутамид, толазамид, толбутамид, толцикламид, нетеглинид, репаглинид).
Массовое соотношение соединения формулы (I) ко второму активному ингредиенту может изменяться в широких пределах и зависит от эффективной дозы каждого ингредиента. Так, например, когда соединение формулы (I) комбинируют с агонистом PPAR, массовое соотношение соединения формулы (I) к агонисту PPAR обычно колеблется в пределах от примерно 1000:1 до примерно 1:1000, предпочтительно, от примерно 200:1 до примерно 1:200. Комбинации соединения формулы (I) с другими активными ингредиентами обычно также находятся в вышеуказанных пределах, однако, в каждом случае должна быть использована эффективная доза каждого активного ингредиента.
Ниже демонстрируется способность активировать глюкокиназу соединений формулы (I) согласно настоящему изобретению и способ ее определения.
Превосходная в отношении активирования глюкокиназы способность соединений формулы (I) может быть определена ранее описанным способом (Diabetes, 45, 1671-1677 (1996)) или соответствующим ему способом.
Глюкокиназная активность может быть установлена без непосредственного определения глюкозо-6-фосфата путем измерения количества тионикотинамид-аденин-динуклеотидфосфата (тио-NADH), генерируемого во время получения фосфоглюконолактона из глюкозо-6-фосфата с помощью репортерного фермента глюкозо-6-фосфатдегидрогеназы (G6PDH). Таким образом может быть определена степень глюкокиназной активности.
Используемую в этом анализе рекомбинантную GK (глюкокиназа) человеческой печени, экспрессируемую в виде слитого протеина FLAG в E.coli, очищали на ANTIFLAG M2 AFFINITY GEL (Sigma).
Анализ осуществляли при температуре 30°С на 96-луночном планшете. На планшете распределяли 69 мкл каждого буфера для анализа (25 мМ Гепес-буфер: рН=7,2; 2 мМ MgCl2, 1 мМ АТФ, 0,5 мМ TNAD, 1 мМ дитиотреитола), к которому добавляли 1 мкл раствора соединения в диметилсульфоксиде или диметилсульфоксид в качестве контроля. Затем там распределяли 20 мкл предварительно охлажденной льдом смеси ферментов (FLAG-GK, 20 Ед./мл G6PDH), к которой добавляли 10 мкл 25 мМ глюкозы в качестве субстрата для инициирования реакции (конечная концентрация глюкозы=2,5 мМ).
После начала реакции каждые 30 секунд в течение 10 минут определяли поглощение при 405 нм для оценки соединения, базирующейся на начальном повышении в течение 5 минут. FLAG-GK добавляли так, чтобы увеличение поглощения спустя 5 минут снижалось до величины от 0,05 до 0,1 в присутствии 1% диметилсульфоксида.
Оцениваемые величины оптической плотности (OD) соответствующих соединений определяли при соответствующих концентрациях, причем величину OD диметилсульфоксида, используемого в качестве контроля, принимали за 100%. Из значений OD при соответствующих концентрациях рассчитывали Emax (%) и ЕС50 (мкмоль) и использовали в качестве индикаторов способности соединений в отношении активирования глюкокиназы. Согласно вышеуказанному анализу определяли способность соединений согласно настоящему изобретению активировать глюкокиназу. Результаты представлены в таблице 5.
Как видно из таблицы 5, соединения согласно настоящему изобретению обладают достаточной для активирования глюкокиназы способностью, когда Emax и ЕС50 используют в качестве индикаторов.
Ниже настоящее изобретение поясняется более конкретно с помощью препаративных примеров и примеров получения, причем настоящее изобретение никоим образом не ограничивается ими в отношении объема его охраны.
Пример композиции 1
Соединение согласно примеру получения 1 (10 частей), 15 частей чистого оксида магния и 75 частей лактозы гомогенно смешивают для получения порошкообразной разбавленной композиции в виде порошка или мелкозернистого порошка с размером частиц не крупнее, чем 350 мкм. Разбавленную порошкообразную композицию вводят в капсулы-контейнеры для получения капсулированных препаратов.
Пример композиции 2
Соединение согласно примеру получения 1 (45 частей), 15 частей крахмала, 16 частей лактозы, 21 часть кристаллической целлюлозы, 3 части поливинилового спирта и 30 частей дистиллированной воды гомогенно смешивают, дезинтегрируют, гранулируют, высушивают и просеивают с получением гранулированного препарата с диаметром гранул от 1410 до 177 мкм.
Пример композиции 3
После получения гранулированного препарата способом, описанным в примере получения 2, к 96 частям гранулированнго препарата добавляют 3 части стеарата кальция, затем подвергают прямому прессованию, получая таблетки диаметром 10 мм.
Пример композиции 4
К 90 частям гранулированного препарата, полученного способом, описанным в примере получения 2, добавляют 10 частей кристаллической целлюлозы и 3 части стеарата кальция, после чего подвергают прямому прессованию с получением таблеток диаметром 8 мм. К ним добавляют смешанную суспензию желатинового сиропа и осажденного карбоната кальция, получая таблетки с покрытием из сахара.
В случае тонкослойной хроматографии согласно примерам, используют силикагель 60F245 (Merck) в виде пластинки и в случае способа определения используют УФ-детектор. В качестве силикагеля для колонки используют WakogelTM C-300 (Wako Pure Chemical), тогда как в качестве силикагеля для колонки с обращенной фазой используют LC-SorbTM SP-B-ODS (Chemco) или YMC-GelTM ODS-AQ 120-S50 (Yamamura Kagaku Kenkyusho).
Ниже приводятся значения аббревиатур в последующих примерах:
i-Bu: изобутильная группа
n-Bu: н-бутильная группа
t-Bu: трет-бутильная группа
Ме: метильная группа
Et: этильная группа
Ph: фенильная группа
i-Pr: изопропильная группа
n-Pr: н-пропильная группа
CDCl3: полностью дейтерированный хлороформ
CD3OD: полностью дейтерированный метанол
DMSO-d6: полностью дейтерированный диметилсульфоксид
Ниже приводятся значения аббревиатур для спектра ядерного магнитного резонанса:
s: синглет;
d: дублет;
dd: дублет дублетов;
t: триплет;
m: мультиплет;
br: уширенный;
q: квартет;
J: константа взаимодействия;
Hz: Герц.
Пример получения 1
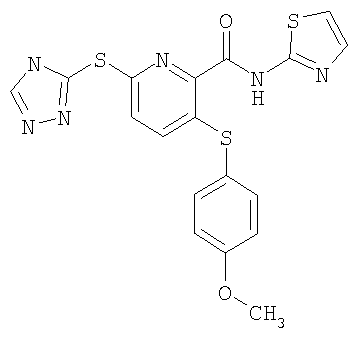
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
К раствору (400 мл) 14,1 г (73,0 ммоль) 3,б-дихлор-2-пиридинкарбоновой кислоты в хлороформе последовательно добавляют 9,00 г (89,9 ммоль) аминотиазола, 12,1 г (89,7 ммоль) N-гидроксибензотриазолгидрата и 19,0 г (99,2 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида с последующим перемешиванием при комнатной температуре в течение 24 часов. Затем реакционный раствор концентрируют, к остатку добавляют этилацетат, после чего промывают 0,2н. водным раствором хлороводорода, водой и водным насыщенным раствором гидрокарбоната натрия. После высушивания и концентрирования полученный остаток кристаллизуют из смешанного растворителя, состоящего из гексана и этилацетата (5:1), получая 12,8 г (выход: 64%) 3,6-дихлор-N-(тиазол-2-ил)-2-пиридинкарбоксамида в виде твердого вещества белого цвета.
К раствору (10 мл) 1,27 г (4,64 ммоль) полученного дихлорсоединения в N,N-диметилформамиде добавляют 1,25 г (9,04 ммоль) карбоната калия и 605 мкл (4,87 ммоль) 4-метокситиофенола, после чего перемешивают при комнатной температуре в течение 24 часов. К реакционному раствору добавляют воду, после чего экстрагируют этилацетатом и промывают водным насыщенным раствором хлорида натрия. После высушивания и концентрирования, полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=от 4:1 до 1:1), получая 1,70 г (выход: 97%) 6-хлор-3-(4-метоксифенилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида в виде твердого вещества белого цвета.
К раствору (10 мл) 705 мг (1,87 ммоль) полученного 6-хлорпроизводного в N,N-диметилформамиде добавляют 350 мг (2,53 ммоль) карбоната калия и 285 мг (2,82 ммоль) 3-меркапто-1,2,4-триазола, после чего кипятят с обратным холодильником в течение 35 часов. К реакционному раствору добавляют воду и после экстракции три раза хлороформом органический слой сушат и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=100:1) и кристаллизацией из смешанного растворителя, состоящего из гексана и этилацетата (1:1), получая 410 мг (выход: 50%) указанного в заголовке соединения в виде твердого вещества белого цвета.
1H-ЯМР (CDCl3) δ: 3,87 (3Н, с), 6,07-7,07 (4Н, м), 7,22 (1Н, д, J=8,7 Гц), 7,45 (1Н, д, J=3,6 Гц), 7,49 (2Н, д, J=9,0 Гц), 8,35 (1Н, с).
МС (ESI) (масс-спектрометрия с ионизацией электронным распылением) m/е: 443 [М+Н]+.
Соединения согласно примерам получения 2-51 получают способом, описанным в вышеприведенном примере получения 1. Аналитические данные для этих соединений представлены ниже.
Пример получения 2
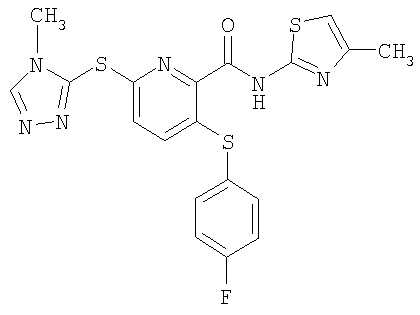
Получение 3-(4-фторфенилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 2 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, при применении общего способа, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 4-фтортиофенола и 3-меркапто-4-метил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,42 (3Н, с), 3,74 (3Н, с), 6,62 (1Н, с), 7,00 (1Н, д, J=9,0 Гц), 7,10 (1Н, д, J=9,0 Гц), 7,17 (2Н, м), 7,53 (2Н, м), 8,40 (1Н, с)
МС (ESI) m/е: 459 [М+Н]+.
Пример получения 3
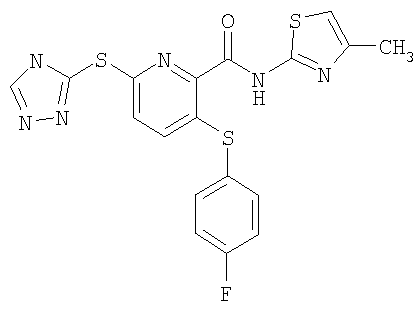
Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 3 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1N-ЯМР (CDCl3) δ: 2,40 (3Н, с), 6,61 (1Н, с), 7,01 (1Н, д, J=9,3 Гц), 7,17-7,25 (3Н, м), 7,58 (2Н, м), 8,35 (1Н, с)
МС (ESI) m/е: 445 [М+Н]+.
Пример получения 4
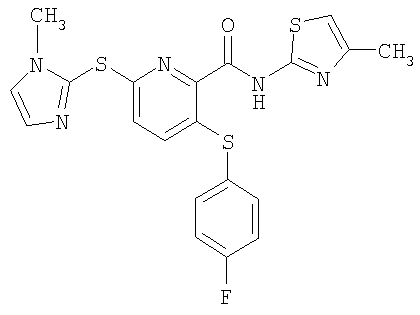
Получение 3-(4-фторфенилсульфанил)-6-(1-метилимидазол-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 4 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 4-фтортиофенола и 3-меркапто-4-метил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,41 (3Н, с), 3,73 (3Н, с), 6,60 (1Н, с), 6,77 (1Н, д, J=8,7 Гц), 6,92 (1Н, д, J=8,7 Гц), 7,10-7,22 (4Н, м), 7,52 (2Н, м)
МС (ESI) m/е: 458 [М+Н]+.
Пример получения 5
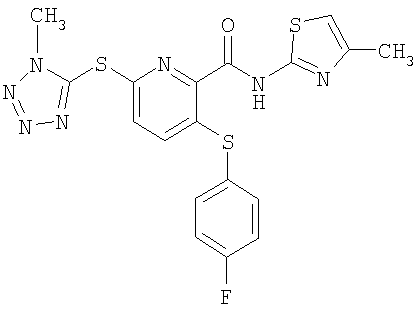
Получение 3-(4-фторфенилсульфанил)-6-(1-метил-1Н-тетразол-5-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 5 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 4-фтортиофенола и 5-меркапто-1-метилтриазола.
1H-ЯМР (CDCl3) δ: 2,43 (3Н, с), 4,12 (3Н, с), 6,65 (1Н, с), 7,12 (1Н, д, J=9,0 Гц), 7,21 (2Н, м), 7,45 (1Н, д, J=9,0 Гц), 7,58 (2Н, м)
МС (ESI) m/е: 460 [М+Н]+.
Пример получения 6
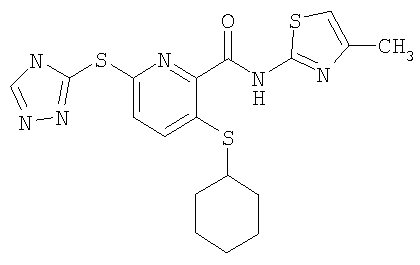
Получение 3-(циклогексилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 6 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, циклогексантиола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,20-1,75 (6Н, м), 1,84 (2Н, м), 2,06 (2Н, м), 2,36 (3Н, с), 3,25 (1Н, м), 6,56 (1Н, с), 7,43 (1Н, д, J=8,7 Гц), 7,64 (1Н, д, J=8,7 Гц), 8,33 (1Н, с)
МС (ESI) m/е: 433 [М+Н]+.
Пример получения 7
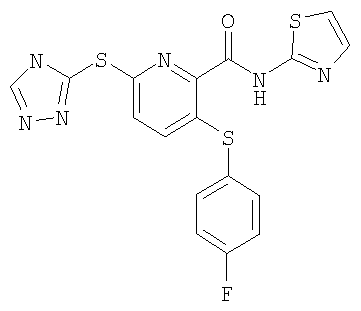
Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 7 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3, 6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 7,01 (1Н, д, J=8,7 Гц), 7,09 (1Н, д, J=3,6 Гц), 7,19 (2Н, м), 7,25 (1Н, д, J=8,7 Гц), 7,50 (1Н, д, J=3,6 Гц), 7,50 (2Н, м), 8,35 (1Н, с)
МС (ESI) m/е: 431 [М+Н]+.
Пример получения 8
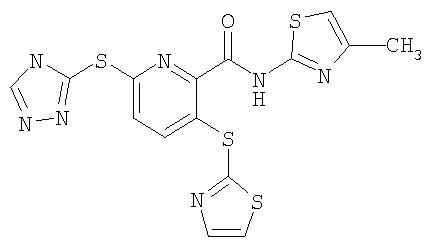
Получение 3-(тиазол-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-ил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 8 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 2-меркаптотиазола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) 5: 2,40 (3Н, с), 6,60 (1Н, м), 7,30-7,36 (2Н, м), 7,59 (1Н, д, J=3,6 Гц), 8,02 (1Н, д, J=3,6 Гц), 8,34 (1Н, с)
МС (ESI) m/е: 434 [М+Н]+.
Пример получения 9
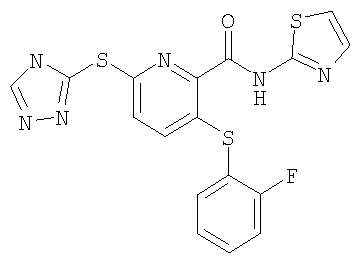
Получение 3-(2-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 9 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 2-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 7,01-7,04 (2H, м), 7,2-7,28 (3H, м), 7,46 (1H, д, J=3,6 Гц), 7,51-7,64 (2H, м), 8,36 (1H, с)
МС (ESI) m/e: 431 [M+H]+.
Пример получения 10
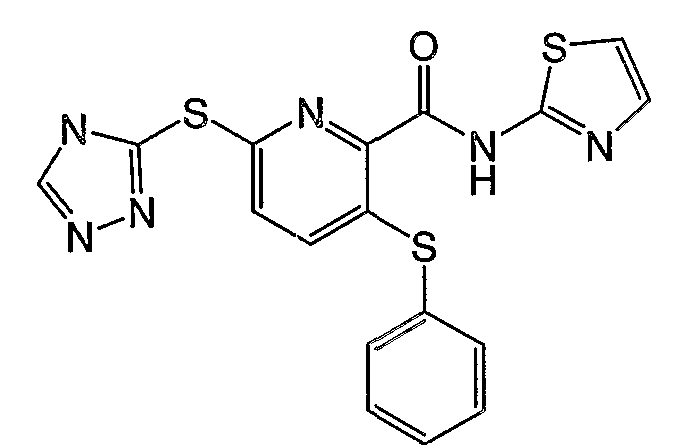
Получение 3-фенилсульфанил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 10 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 7,02-7,09 (2H, м), 7,24 (1H, д, J=8,7 Гц), 7,47-7,53 (4H, м), 7,57-7,63 (2H, м), 8,38 (1H, с)
МС (ESI) m/e: 413 [M+H]+.
Пример получения 11
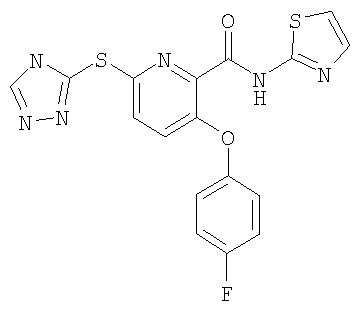
Получение 3-(4-фторфенилокси)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 11 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-фторфенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,04 (1Н, д, J=3,6 Гц), 7,05-7,13 (4Н, м), 7,24 (1Н, д, J=8,7 Гц), 7,46-7,51 (2Н, м), 8,32 (1Н, с)
МС (ESI) m/е: 415 [М+Н]+.
Пример получения 12
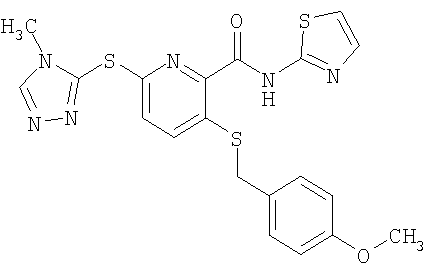
Получение 3-(4-метоксифенилметилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 12 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-метоксибензилмеркаптана и 3-меркапто-4-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,76 (3Н, с), 3,79 (3Н, с), 4,11 (2Н, с), 6,84 (2Н, д, J=8,8 Гц), 7,01 (1Н, д, J=3,2 Гц), 7,30 (1Н, д, J=8,8 Гц), 7,32 (2Н, д, J=8,8 Гц), 7, 51 (1Н, д, J=3,2 Гц), 7,65 (1Н, д, J=8,8 Гц), 8,44 (1Н, с)
МС (ESI) m/е: 471 [М+Н]+.
Пример получения 13
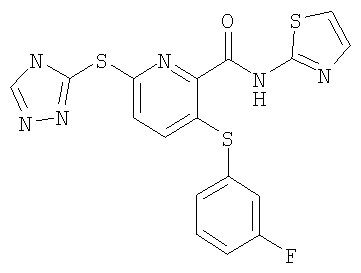
Получение 3-(3-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 13 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-фтортиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,02 (1Н, д, J=3,6 Гц), 7,05 (1Н, д, J=8,4 Гц), 7,18 (1Н, тд, J=8,4 Гц, 3,2 Гц), 7,24 (1Н, д, J=8,4 Гц), 7,29 (1Н, ддд, J=8,4 Гц, 2,8 Гц, 2,8 Гц), 7,36 (1Н, д, J=7,6 Гц), 7,42-7,48 (2Н, м), 8,35 (1Н, с)
MC (ESI) m/e: 431 [M+H]+.
Пример получения 14
Получение 3-(2,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 14 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 2,4-дифтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,98-7,05 (4Н, м), 7,28 (1Н, д, J=8,8 Гц), 7,46 (1Н, д, J=3,6 Гц), 7,58-7,64 (1Н, м), 8,36 (1Н, с)
MC (ESI) m/e: 449 [М+Н]+.
Пример получения 15
Получение 3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 15 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3, 6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-фтортиофенола и 3-меркапто-5-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,58 (3Н, с), 6,97 (1Н, д, J=8,4 Гц), 7,04 (1Н, д, J=3,6 Гц), 7,15-7,23 (3Н, м), 7,48 (1Н, д, J=3,6 Гц), 7,54-7,58 (2Н, м)
МС (ESI) m/е: 445 [М+Н]+.
Пример получения 16
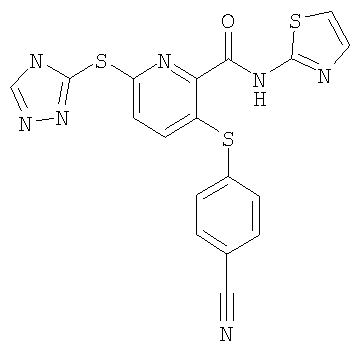
Получение 3-(4-цианофенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 16 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-цианотиофенола и 3-меркапто-1, 2, 4-триазола.
1Н-ЯМР (CDCl3) δ: 7,06 (1Н, д, J=3,6 Гц), 7,11 (1Н, д, J=8,8 Гц), 7,30 (1Н, д, J=8,8 Гц), 7,49 (1Н, д, J=3,6 Гц), 7,65 (2Н, д, J=8,8 Гц), 7,73 (2Н, д, J=8,8 Гц), 8,40 (1Н, с)
MC (ESI) m/e: 438 [M+H]+.
Пример получения 17
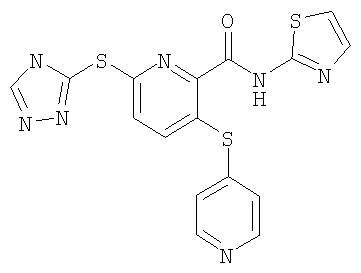
Получение 3-(пиридин-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 17 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,09 (1Н, д, J=3,6 Гц), 7,28-7,35 (2Н, м), 7,43 (2Н, д, J=6,0 Гц), 7,51 (1Н, д, J=3,6 Гц), 8,39 (1Н, с), 8,62 (2Н, д, J=6, 0 Гц)
MC (ESI) m/e: 414 [М+Н]+.
Пример получения 18
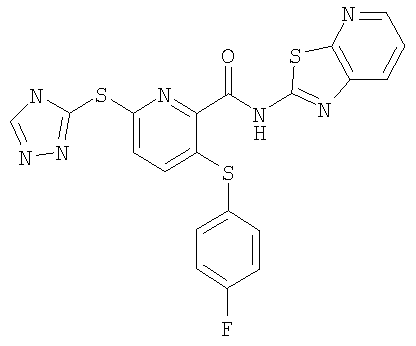
Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 18 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазоло[5,4-b]пиридина, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,00 (1Н, д, J=8,8 Гц), 7,16-7,20 (2Н, м), 7,25 (1Н, д, J=8,8 Гц), 7,37-7,41 (1Н, м), 7,55-7,58 (2Н, м), 8,02 (1Н, д, J=8,4 Гц), 8,42 (1Н, с), 8,51 (1Н, д, J=4,4 Гц)
МС (ESI) m/е: 482 [М+Н]+.
Пример получения 19
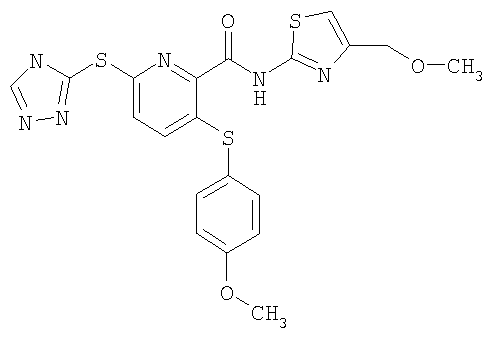
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 19 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,43 (3Н, с), 3,86 (3Н, с), 4,51 (2Н, с), 6,92 (1Н, с), 6, 96-7,02 (3Н, м), 7,22 (1Н, д, J=8,7 Гц), 7,49 (2Н, д, J=8,7 Гц), 8,35 (1Н, с)
MC (ESI) m/e: 487 [M+H]+.
Пример получения 20
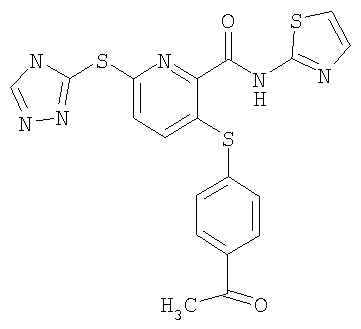
Получение 3-(4-ацетилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 20 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-ацетилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,65 (3Н, с), 7,05 (1Н, д, J=3,6 Гц), 7,10 (1Н, д, J=8,4 Гц), 7,25 (1Н, д, J=8,4 Гц), 7,47 (1Н, д, J=3,6 Гц), 7,65 (2Н, д, J=8,6 Гц), 8,01 (2Н, д, J=8,6 Гц), 8,36 (1Н, с)
MC (ESI) m/e: 455 [М+Н]+.
Пример получения 21
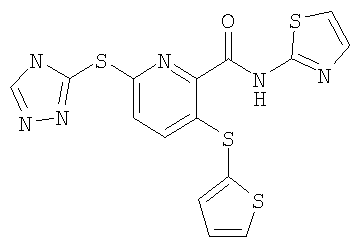
Получение 3-(тиофен-2-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 21 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 2-меркаптотиофена и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,01 (1Н, д, J=3,2 Гц), 7,06 (1Н, д, J=8,8 Гц), 7,16 (1Н, дд, J=3,6, 5,2 Гц), 7,26 (1Н, д, J=8,8 Гц), 7,35 (1Н, дд, J=1,2, 3,6 Гц), 7,43 (1Н, д, J=3,2 Гц), 7,60 (1Н, дд, J=1,2, 5,2 Гц), 8,35 (1Н, с)
МС (ESI) m/е: 419 [М+Н]+.
Пример получения 22
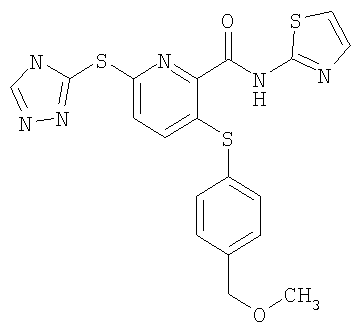
Получение 3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 22 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-метоксиметилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,46 (3Н, с), 4,50 (2Н, с), 7,00 (1Н, д, J=3,2 Гц), 7,02 (1Н, д, J=8,8 Гц), 7,17 (1Н, д, J=8,8 Гц), 7,42 (1Н, д, J=3,2 Гц), 7,43 (2Н, д, J=8,0 Гц), 7,54 (2Н, д, J=8,0 Гц), 8,33 (1Н, с)
MC (ESI) m/e: 457 [М+Н]+.
Пример получения 23
Получение 3-(4-фторфенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 23 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазоло[5,4-b]пиридина, 4-фтортиофенола и 3-меркапто-5-метил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,54 (3Н, с), 6,96 (1Н, д, J=8,8 Гц), 7,11-7,16 (2Н, м), 7,17 (1Н, д, J=8,8 Гц), 7,37 (1Н, дд, J=4,8, 8,0 Гц), 7,50-7,54 (2Н, м), 8,00 (1Н, д, J=8,0 Гц), 8,45 (1Н, д, J=4,8 Гц)
MC (ESI) m/e: 496 [М+Н]+.
Пример получения 24
Получение 3-(4-метилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 24 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 4-метилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,42 (3Н, с), 3,43 (3Н, с), 4,51 (2Н, с), 6,91 (1Н, с), 7,00 (1Н, д, J=8,8 Гц), 7,19 (1Н, д, J=8,8 Гц), 7,26 (2Н, д, J=8,4 Гц), 7,44 (2Н, д, J=8,4 Гц), 8,34 (1Н, с)
МС (ESI) m/е: 471 [М+Н]+.
Пример получения 25
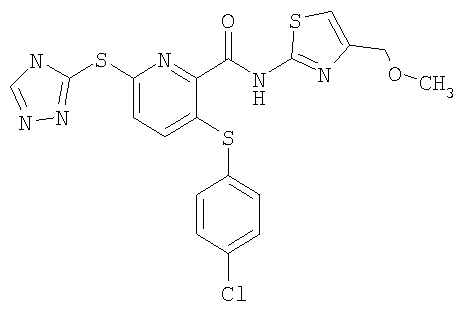
Получение 3-(4-хлорфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 25 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 4-хлортиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,43 (3Н, с), 4,50 (2Н, с), 6,91 (1Н, с), 6,97 (1Н, д, J=8,8 Гц), 7,20 (1Н, д, J=8,8 Гц), 7,42 (2Н, д, J=8,4 Гц), 7,49 (2Н, Д, J=8,4 Гц), 8,33 (1Н, с)
MC (ESI) m/e: 491 [М+Н]+.
Пример получения 26
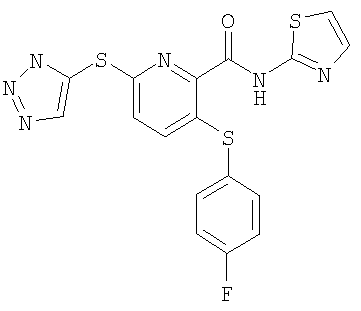
Получение 3-(4-фторфенилсульфанил)-6-(3Н-[1,2,4]триазол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 26 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 4-фтортиофенола и 4-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 6,66 (1Н, д, J=8,8 Гц), 6,72 (1Н, д, J=8,8 Гц), 6,86 (1Н, д, J=4,0 Гц), 6,89-6,94 (2Н, м), 7,25 (1Н, д, J=4,0 Гц), 7,27-7,30 (2Н, м), 7,72 (1Н, с)
MC (ESI) m/e: 431 [М+Н]+.
Пример получения 27
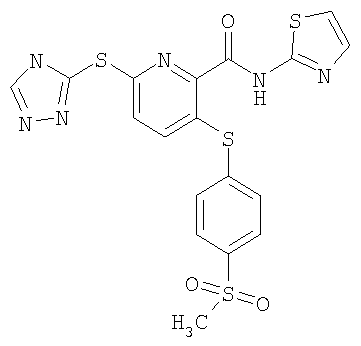
Получение 3-(4-метилсульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 27 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-метилсульфонилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,12 (3Н, с), 7,05 (1Н, д, J=3, 6 Гц), 7,11 (1Н, д, J=8,8 Гц), 7,28 (1Н, д, J=8,8 Гц), 7,48 (1Н, д, J=3,6 Гц), 7,74 (2Н, д, J=8,0 Гц), 8,00 (2Н, д, J=8,0 Гц) 8,39 (1Н, с)
МС (ESI) m/е: 491 [М+Н]+.
Пример получения 28

Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 28 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-гидроксиметилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,86 (3Н, с), 4,78 (2Н, с), 6,99 (2Н, д, J=8,8 Гц), 7,02 (1Н, д, J=8,8 Гц), 7,18 (1Н, д, J=8,8 Гц), 7,35 (1Н, с), 7,46 (2Н, д, J=8,8 Гц), 8,39 (1Н, с)
MC (ESI) m/e: 473 [М+Н]+.
Пример получения 29
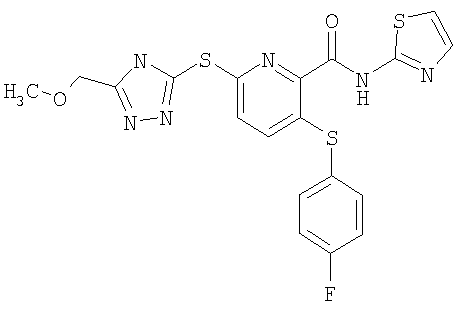
Получение 3-(4-фторфенилсульфанил)-6-(5-метоксиметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 29 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-фтортиофенола и 3-меркапто-5-метоксиметил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,50 (3Н, с), 4,76 (2Н, с), 6,98 (1Н, д, J=8,8 Гц), 7,03 (1Н, д, J=3,2 Гц), 7,14-7,22 (3Н, м), 7,48 (1Н, д, J=3,2 Гц), 7,54-7,57 (2Н, м)
МС (ESI) m/е: 475 [М+Н]+.
Пример получения 30
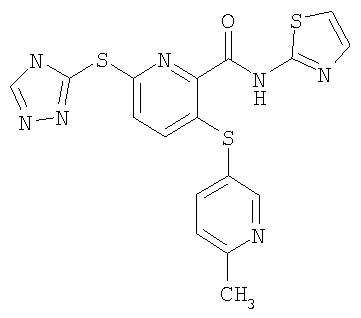
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 30 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (ДМСО-d6) δ: 2,51 (3Н, с), 7,17 (1Н, д, J=8,8 Гц), 7,21 (1Н, д, J=8,8 Гц), 7,35 (1Н, д, J=3,6 Гц), 7,36 (1Н, д, J=8,8 Гц), 7,57 (1Н, д, J=3,6 Гц), 7,83 (1Н, дд, J=2,4, 8,8 Гц), 8,53 (1Н, д, J=2,4 Гц), 8,72 (1Н, с)
МС (ESI) m/е: 428 [М+Н]+.
Пример получения 31
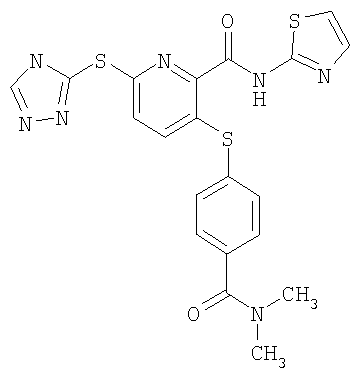
Получение 3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 31 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметилкарбамоилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,02 (3Н, с) 3,15 (3Н, с), 7,04 (1Н, д, J=3,6 Гц), 7,06 (1Н, д, J=8,8 Гц), 7,23 (1Н, д, J=8,8 Гц), 7,49 (1Н, д, J=3,6 Гц), 7,50 (2Н, д, J=8,4 Гц), 7,61 (2Н, д, J=8,4 Гц), 8,39 (1Н, с)
MC (ESI) m/e: 484 [М+Н]+.
Пример получения 32
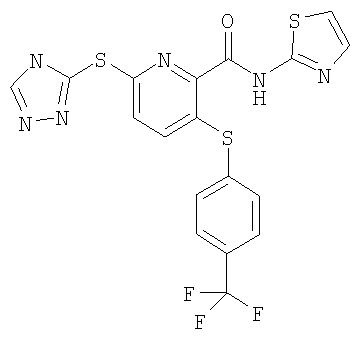
Получение 3-(4-трифторметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 32 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3, 6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-трифторметилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,04 (1Н, д, J=3,6 Гц), 7,06 (1Н, д, J=8,8 Гц), 7,26 (1Н, д, J=8,8 Гц), 7,47 (1Н, д, J=3,6 Гц), 7,66-7,74 (4Н, м), 8,38 (1Н, с)
МС (ESI) m/е: 481 [М+Н]+.
Пример получения 33
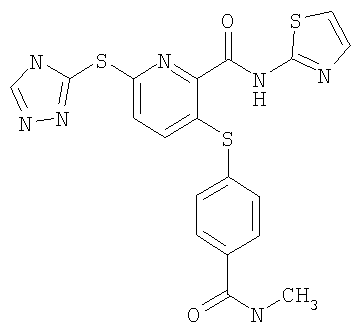
Получение 3-(4-метилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 33 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-метилкарбамоилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,00 (3Н, д, J=4,8 Гц), 7,02 (1Н, д, J=8,8 Гц), 7,05 (1Н, д, J=3,6 Гц), 7,20 (1Н, д, J=8,8 Гц), 7,47 (1Н, д, J=3,6 Гц), 7,59 (2Н, д, J=8,4 Гц), 7,81 (2Н, д, J=8,4 Гц), 8,32 (1Н, с)
MC (ESI) m/e: 470 [М+Н]+.
Пример получения 34
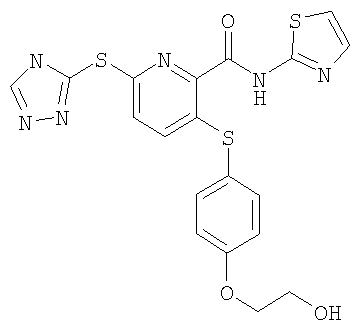
Получение 3-(гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 34 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-гидроксиэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,97 (2Н, м), 4,13 (2Н, м), 7,00-7,11 (4Н, м), 7,23 (1Н, д, J=9,0 Гц), 7, 46-7, 54 (3Н, м), 8,36 (1Н, с)
MC (ESI) m/e: 473 [М+Н]+.
Пример получения 35
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-диметиламинометилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 35 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-5-диметиламинометилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,32 (6Н, с), 3,70 (2Н, с), 3,85 (3Н, с), 6,97 (2Н, д, J=8,8 Гц), 7,00 (1Н, д, J=8,5 Гц), 7,19 (1Н, д, J=8,5 Гц), 7,26 (1Н, с), 7,46 (2Н, д, J=8,8 Гц), 8,31 (1Н, с)
МС (ESI) m/е: 500 [М+Н]+.
Пример получения 36
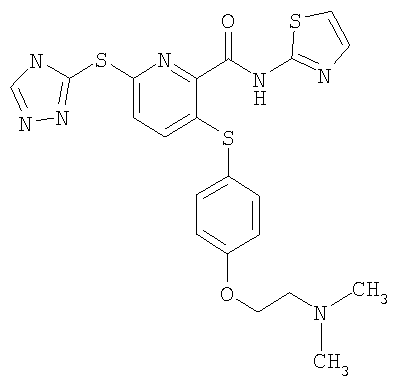
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 36 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметиламиноэтилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,40 (6Н, с), 2,82 (2Н, т, J=5,6 Гц), 4,13 (2Н, т, J=5,6 Гц), 6, 95-7,05 (4Н, м), 7,21 (1Н, д, J=8,7 Гц), 7,42-7,50 (ЗН, м), 8,36 (1Н, с) MC (ESI) m/e: 500 [М+Н]+.
Пример получения 37
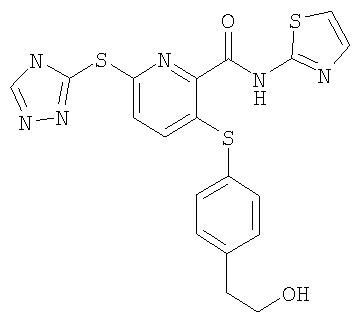
Получение 3-(4-гидроксиэтилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 37 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-гидроксиэтилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,93 (2Н, м), 3,90 (2Н, м), 7,04-7,10 (2Н, м), 7,23 (1Н, д, J=9,0 Гц), 7,36 (2Н, д, J=7, 8 Гц), 7,48-7,56(3Н, м), 8,34 (1Н, с)
МС (ESI) m/е: 457 [М+Н]+.
Пример получения 38
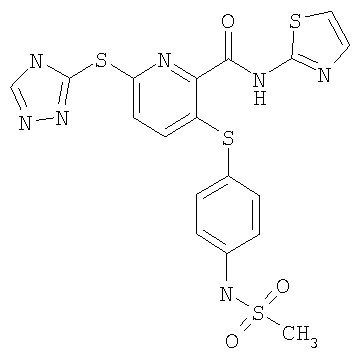
Получение 3-(4-метилсульфамоилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 38 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-метилсульфамоилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,97 (3Н, с), 6,98 (1Н, д, J=3,6 Гц), 7,21-7,25 (3Н, м), 7,30-7,50 (4Н, м), 8,28 (1Н, с)
МС (ESI) m/е: 505 [М+Н]+.
Пример получения 39
Получение 3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 39 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-аминооксазола, 4-диметилкарбамоилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,01 (3Н, с), 3,15 (3Н, с), 6,99 (1Н, д, J=8,8 Гц), 7,19 (1Н, д, J=8,8 Гц), 7,25 (1Н, д, J=l,6 Гц), 7,48 (2Н, д, J=8,1 Гц), 7,56 (2Н, д, J=8,1 Гц), 8,31 (1Н, д, J=1,6 Гц), 8,41 (1Н, с)
MC (ESI) m/e: 468 [М+Н]+.
Пример получения 40
Получение 3-(4-гидроксициклогексилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 40 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-меркаптоциклогексанола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,30-1,60 (4Н, м), 1,90-2,15 (4Н, м), 3,10-3,22 (1Н, м), 3,60-3,70 (1H, м), 6,99 (1H, д, J=3, 6 Гц), 7,40 (1H, д, J=8,8 Гц), 7,43 (1H, д, J=3,6 Гц), 7,61 (1H, д, J=8,8 Гц), 8,32 (1H, с)
МС (ESI) m/e: 435 [M+H]+.
Пример получения 41
Получение 3-(4-фторфенилсульфанил)-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридазин-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 41 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-аминопиридазина, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,96 (1Н, д, J=9,2 Гц), 7,12-7,16 (2Н, м), 7,19 (1Н, д, J=9,2 Гц), 7,50-7,55 (3Н, м), 8,41 (1Н, с), 8,65 (1Н, д, J=9,2 Гц), 8,85 (1Н, д, J=4,8 Гц)
МС (ESI) m/е: 426 [М+Н]+.
Пример получения 42
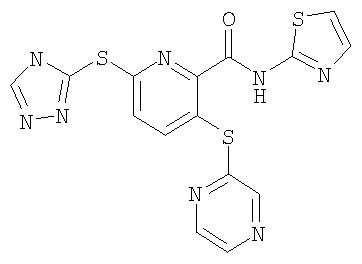
Получение 3-(пиридин-2-илфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 42 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 2-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 7,02 (1Н, д, J=3,6 Гц), 7,39 (1Н, д, J=8,8 Гц), 7,45 (1Н, д, J=3,6 Гц), 7,68 (1Н, д, J=8,8 Гц), 8,38 (1Н, с), 8,44-8,46 (2Н, м), 8,70 (1Н, д, J=1,6 Гц)
MC (ESI) m/e: 415 [М+Н]+.
Пример получения 43
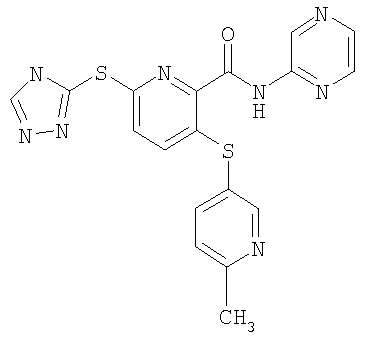
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4H-[1,2,4]-триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 43 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминопиразина, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,64 (3Н, с), 6,96 (1Н, д, J=8,8 Гц), 7,17 (1Н, д, J=8,8 Гц), 7,28 (1Н, д, J=8,l Гц), 7,77 (1Н, дд, J=8,1, 2,2 Гц), 8,29 (1Н, дд, J=2,6, 1,5 Гц), 8,35 (1Н, д, J=2,6 Гц), 8,41 (1Н, с), 8,61 (1Н, д, J=2,2 Гц), 9,68 (1Н, д, J=1,5 Гц)
МС (ESI) m/е: 423 [М+Н]+.
Пример получения 44
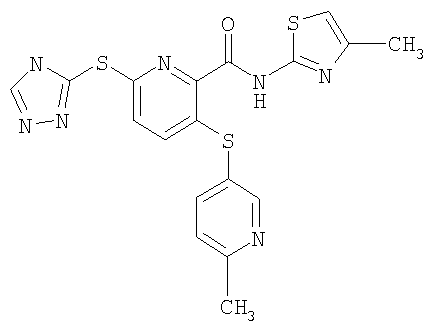
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 44 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,39 (3Н, с), 2,63 (3Н, с), 6,58 (1Н, с), 6,99 (1Н, д, J=8,8 Гц), 7,20-7,30 (2Н, м), 7,74 (1Н, д, J=8,0 Гц), 8,32 (1Н, с), 8,62 (1Н, с)
МС (ESI) m/е: 442 [М+Н]+.
Пример получения 45
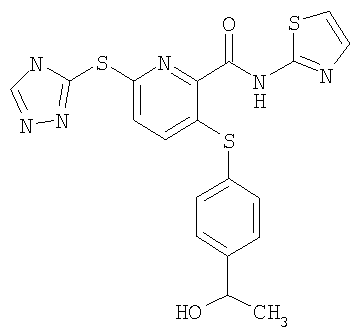
Получение 3-[4-(1-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 45 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-(1-гидроксиэтил)-тиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,52 (3Н, д, J=6,4 Гц), 4,97 (1Н, кв, J=6,4 Гц), 7,03 (1Н, д, J=8,4 Гц), 7,06 (1Н, д, J=3,6 Гц), 7,18 (1Н, д, J=8,4 Гц), 7,47 (2Н, д, J=8,0 Гц), 7,48 (1Н, д, J=3,6 Гц), 7,52 (2Н, д, J=8,0 Гц), 8,34 (1Н, с)
MC (ESI) m/e: 457 [М+Н]+.
Пример получения 46
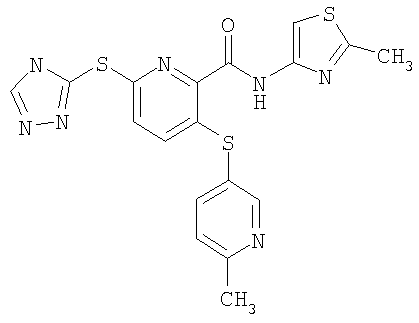
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 46 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,63 (3Н, с), 2,72 (3Н, с), 6,96 (1Н, д, J=8,4 Гц), 7,19 (1Н, д, J=8,1 Гц), 7,27 (1Н, д, J=8,4 Гц), 7,68 (1Н, с), 7,76 (1Н, дд, J=8,4, 2,2 Гц), 8,26 (1Н, с), 8,59 (1Н, д, J=2,2 Гц)
МС (ESI) m/е: 442 [М+Н]+.
Пример получения 47
Получение 3-(4-диметилкарбамоилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(2-метилтиазол-4-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 47 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метилтиазола, 4-диметилкарбамоилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,69 (3Н, с), 3,00 (3Н, с), 3,14 (3Н, с), 6,95 (1Н, д, J=8,8 Гц), 7,11 (1Н, д, J=8,8 Гц), 7,45 (2Н, д, J=8,1 Гц), 7,56 (2Н, д, J=8,1 Гц), 7,64 (1Н, с), 8,29 (1Н, с)
MC (ESI) m/e: 498 [М+Н]+.
Пример получения 48
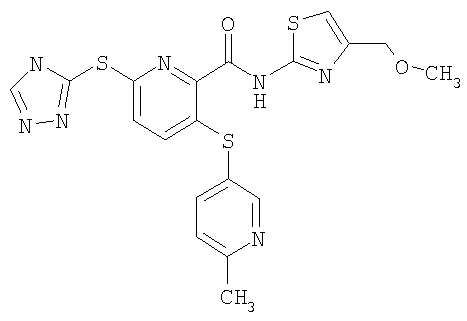
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 48 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,62 (3Н, с), 3,44 (3Н, с), 4,51 (2Н, с), 6,91 (1Н, с), 6,93 (1Н, д, J=8,4 Гц), 7,19 (1Н, д, J=8,4 Гц), 7,26 (1Н, д, J=8,0 Гц), 7,77 (1Н, дд, J=8,0 Гц, 2,4 Гц), 8,35 (1Н, с), 8,61 (1Н, д, J=2, 4 Гц)
MC (ESI) m/e: 472 [М+Н]+.
Пример получения 49
Получение 3-(1-метил-1Н-тетразол-5-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 49 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 5-меркапто-1-метил-1,2,4-триазола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,11 (3Н, с), 7,11 (1Н, д, J=3,2 Гц), 7,32 (1Н, д, J=8,8 Гц), 7,36 (1Н, д, J=8,8 Гц), 7,52 (1Н, д, J=3,2 Гц), 8,42 (1Н, с)
МС (ESI) m/е: 419 [М+Н]+.
Пример получения 50
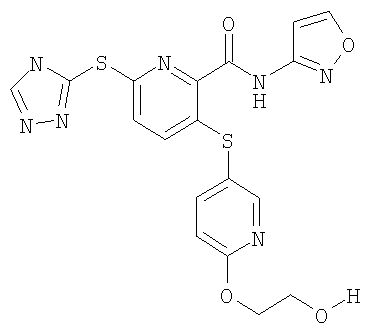
Получение 3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 50 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-аминооксазола, 4-гидроксиэтилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,91 (2Н, т, J=4,6 Гц), 4,05 (2Н, т, J=4,6 Гц), 6,91 (1Н, д, J=8,8 Гц), 6,92 (2Н, д, J=8,4 Гц), 7,11 (1Н, д, J=8,8 Гц), 7,22 (1Н, д, J=l,5 Гц), 7,39 (2Н, д, J=8,4 Гц), 8,25 (1Н, д, J=l,5 Гц), 8,29 (1Н, с)
MC (ESI) m/e: 457 [М+Н]+.
Пример получения 51
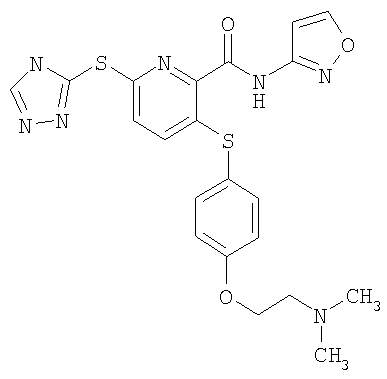
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 51 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-аминооксазола, 4-диметиламиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,43 (6Н, с), 2,85 (2Н, т, J=5,5 Гц), 4,12 (2Н, т, J=5,5 Гц), 6,90 (2Н, д, J=8,8 Гц), 6,93 (1Н, д, J=8,8 Гц), 7,15 (1Н, д, J=8,8 Гц), 7,24 (1Н, с), 7,38 (2Н, д, J=8,8 Гц), 8,30 (1Н, с), 8,38 (1Н, с)
МС (ESI) m/е: 484 [М+Н]+.
Пример получения 52
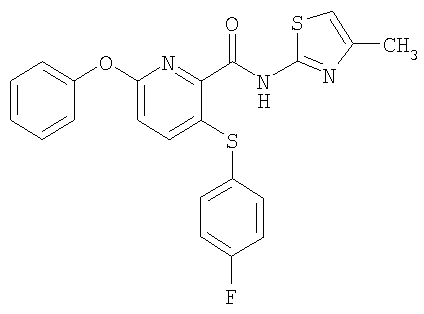
Получение 3-(4-фторфенилсульфанил)-6-фенокси-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
К раствору (3 мл) 84 мг (0,2 92 ммоль) 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида в N,N-диметилформамиде добавляют фенол (135 мг, 1,43 ммоль) и 540 мг (1,66 моль) карбоната цезия с последующим перемешиванием при температуре 120°С в течение 24 часов. К реакционному раствору добавляют 1н. водный раствор гидроксида натрия, после чего экстрагируют этилацетатом. Органический слой промывают водой и насыщенным водным солевым раствором, сушат и концентрируют в вакууме. Полученный остаток очищают тонкослойной хроматографией на силикагеле (гексан:этилацетат=4:1), получая 61 мг (выход: 61%) 3-хлор-6-фенокси-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида в виде твердого вещества белого цвета.
К раствору (2 мл) полученного 3-хлорпроизводного в N,N-диметилформамиде добавляют карбонат калия (80 мг, 0,579 ммоль) и 20 мкл (0,188 ммоль) 4-фтортиофенола с последующим перемешиванием при температуре 100°С в течение 16 часов. К реакционному раствору добавляют воду с последующей экстракцией этилацетатом и промывкой насыщенным водным солевым раствором. После высушивания и концентрирования полученный остаток очищают тонкослойной хроматографией на силикагеле (гексан:этилацетат=4:1), получая 11 мг (выход: 32%) указанного в заголовке соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 2,37 (3Н, с), 6,58 (1Н, с), 6,90 (1Н, д, J=9,0 Гц), 7,10-7,23 (6Н, м), 7,46 (1Н, д, J=7,8, 7,8 Гц), 7,62 (2Н, м)
MC (ESI) m/e: 438 [М+Н]+.
Соединение согласно примеру получения 53 получают способом примера получения 52. Аналитические данные для этого соединения приводятся ниже.
Пример получения 53
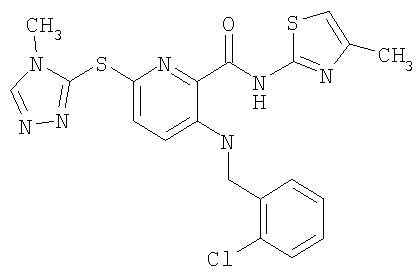
Получение 3-(2-хлорфенилметиламино)-6-амино-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 53 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида, 2-хлорбензиламина и 3-меркапто-4-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,41 (3Н, с), 3,73 (3Н, с), 4,55 (2Н, д, J=6,0 Гц), 6,58 (1Н, с), 6,92 (1Н, д, J=9,3 Гц), 7,20-7,45 (5Н, м), 8,32 (1Н, с), 8,72 (1Н, м)
МС (ESI) m/е: 472, 474 [М+Н]+.
Пример получения 54
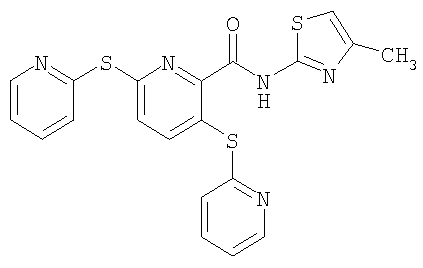
Получение 3,6-бис(пиридин-2-илсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
К раствору (2 мл) 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида, полученного способом, описанным в примере получения 1, в N,N-диметилформамиде, добавляют 2-меркаптопиридин (24 мг, 0,205 ммоль) и 68 г (0,492 ммоль) карбоната калия с последующим перемешиванием при температуре 100°С в течение 15 часов. К реакционному раствору добавляют воду, после чего экстрагируют этилацетатом и промывают насыщенным водным солевым раствором. После высушивания и концентрирования полученный остаток очищают тонкослойной хроматографией на силикагеле (хлороформ:метанол=20:1), получая 15 мг (выход: 23%) указанного в заголовке соединения в виде твердого вещества желтого цвета.
1H-HMP (CDCl3) δ: 2,39 (3Н, с), 6,58 (1Н, с), 7,20-7,30 (2Н, м), 7,40 (1Н, д, J=8,6 Гц), 7,46 (1Н, ушир.д, J=8,1 Гц), 7,52-7,75 (4Н, м), 8,55-8,65 (2Н, м)
МС (ESI) m/е: 438 [М+Н]+.
Соединения согласно примерам получения 55-57 могут быть получены способом примера получения 54. Аналитические данные для этих соединений приводятся ниже.
Пример получения 55

Получение 3,6-бис(4-фторфенилсульфанил)-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 55 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида и 4-фтортиофенола.
1H-ЯМР (CDCl3) δ: 2,41 (3Н, с), 6,59 (1Н, с), 6,77 (1Н, д, J=9,0 Гц), 6,88 (1Н, д, J=9,0 Гц), 7,09-7,20 (4Н, м), 7,49-7,60 (4Н, м)
MC (ESI) m/e: 472 [М+Н]+.
Пример получения 56
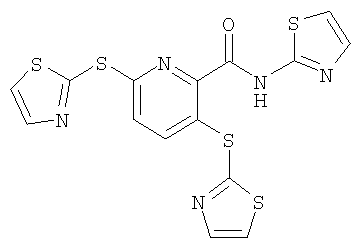
Получение 3,6-бис(тиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 56 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида и 2-меркаптотиазола.
1H-ЯМР (CDCl3) δ: 7,06 (1Н, д, J=3,6 Гц), 7,27 (1Н, д, J=8,8 Гц), 7,37 (1Н, д, J=8,8 Гц), 7,54 (1Н, д, J=3, 6 Гц), 7,59 (1Н, д, J=3,6 Гц), 7,61 (1Н, д, J=3,6 Гц), 7,98 (1Н, д, J=3,6 Гц), 8,02 (1Н, д, J=3,6 Гц)
МС (ESI) m/е: 436 [М+Н]+.
Пример получения 57
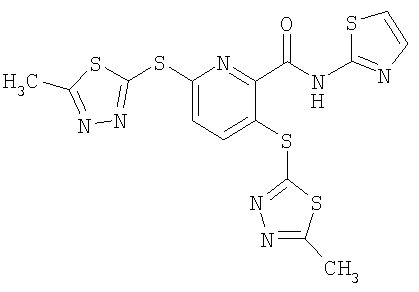
Получение 3,6-бис(5-метил[1,3,4]тиадиазол-2-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 57 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-N-(4-метилтиазол-2-ил)-2-пиридинкарбоксамида и 2-меркапто-5-метил-1,3,4-тиазола.
1H-ЯМР (CDCl3) δ: 2,86 (3Н, с), 2,91 (3Н, с), 7,07 (1Н, д, J=3,6 Гц), 7,44 (1Н, д, J=8,8 Гц), 7,52 (1Н, д, J=3,6 Гц), 7,64 (1Н, д, J=8,8 Гц)
МС (ESI) m/е: 466 [М+Н]+.
Пример получения 58
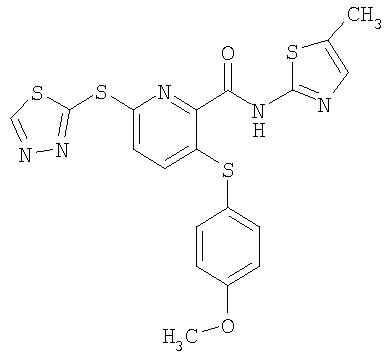
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-метилтиазол-2-ил)-2-пиридинкарбоксамида
Концентрированную серную кислоту (0,441 мл, 8,27 ммоль) добавляют по каплям к суспензии (35 мл) 3,86 г (32,2 ммоль) сульфата магния в дихлорметане и, после окончания прибавления, смесь перемешивают при комнатной температуре в течение 2 0 минут. После этого, при комнатной температуре, к реакционному раствору добавляют 750 мг (3,91 ммоль) 3,6-дихлор-2-пиридинкарбоновой кислоты и раствор (10 мл) 3,84 мл (40,2 ммоль) трет-бутилового спирта в дихлорметане, после чего интенсивно перемешивают при комнатной температуре в течение 15 часов. При охлаждения льдом, к реакционному раствору прибавляют по каплям водный раствор (40 мл) 3,0 г карбоната натрия, после чего перемешивают вплоть до образования гомогенного раствора. Реакционный раствор экстрагируют хлороформом и органический слой промывают насыщенным водным солевым раствором, сушат и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=97:3), получая 644 мг (выход: 66%) трет-бутил-3,6-дихлор-2-пиридинкарбоксилата в виде твердого вещества белого цвета.
К раствору (70 мл) 1,70 г (6,86 ммоль) полученного сложного эфира в N,N-диметилформамиде добавляют 4-метокситиофенол (0,927 мл, 7,55 ммоль) и 1,14 г (8,26 ммоль) карбоната калия при комнатной температуре с последующим перемешиванием в течение 1 часа. К реакционному раствору добавляют хлороформ, после чего промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором, сушат и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=9:1), получая 743 мг (выход: 31%) трет-бутил-6-хлор-3-(4-метоксифенилсульфанил)-2-пиридинкарбоксилата в виде бесцветного маслянистого вещества.
К раствору (30 мл) 451 мг (1,28 ммоль) полученного хлорсодержащего соединения в N,N-диметилформамиде при комнатной температуре добавляют 3-меркапто-1,2,4-триазол (258 мг, 2,55 ммоль) и 353 мг (2,56 ммоль) карбоната калия и реакционный раствор перемешивают при температуре 130°С в течение 10 часов. К реакционному раствору добавляют хлороформ, после чего промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором, сушат и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1), получая 264 мг (выход: 49%) трет-бутил-3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-2-пиридинкарбоксилата в виде бесцветного маслянистого вещества.
К раствору (5,0 мл) 264 мг (0,633 ммоль) полученного сложного эфира в дихлорметане при комнатной температуре добавляют трифторуксусную кислоту (2,0 мл) и реакционный раствор перемешивают при комнатной температуре в течение 1,5 часов. Реакционный раствор концентрируют в вакууме, получая 228 мг 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-2-пиридинкарбоновой кислоты в виде бледно-желтого твердого вещества.
К раствору (1,0 мл) 5,9 мг (16 мкмоль) полученной карбоновой кислоты в дихлорметане при комнатной температуре последовательно добавляют 5-метиламинотиазол (3,2 мг, 29 мкмоль), 3,8 мг (27 мкмоль) N-гидроксибензотриазолгидрата и 5,4 мг (28 мкмоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида и реакционный раствор перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия, затем экстрагируют хлороформом. Органический слой промывают насыщенным водным солевым раствором, сушат и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=95:5), получая 2,0 мг (выход: 15%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
1Н-ЯМР (CDCl3) δ: 2,43 (3H, c), 3,86 (3H, с), 6,98 (2H, д, J=8,4 Гц), 6,99 (1H, д, J=8,4 Гц), 7,09 (1H, с), 7,19 (1H, д, J=8,4 Гц), 7,47 (2H, д, J=8,4 Гц), 8,32 (1H, с)
МС (ESI) m/e: 457 [M+H]+.
Соединения согласно примерам получения 59-65 получают способом примера получения 58. Аналитические данные для этих соединений приводятся ниже.
Пример получения 59
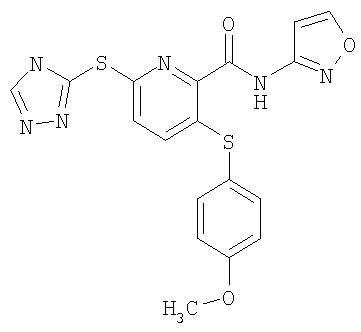
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(изоксазол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 59 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 3-аминоизоксазола.
1Н-ЯМР (CDCl3) δ: 3,86 (3Н, с), 6,98 (2Н, д, J=8,4 Гц), 6,99 (1Н, д, J=8,4 Гц), 7,19 (1Н, д, J=8,4 Гц), 7,30 (1Н, с), 7,47 (2Н, д, J=8,4 Гц), 8,31 (1Н, с), 8,41 (1Н, с)
МС (ESI) m/е: 427 [М+Н]+.
Пример получения 60
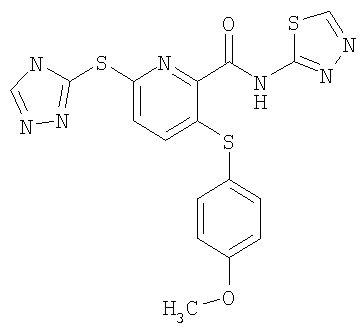
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,3,4]тиадиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 60 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 2-амино-1,3,4-тиадиазола.
1Н-ЯМР (CDCl3) δ: 3,86 (3Н, с), 6,99 (2Н, д, J=8,5 Гц), 7,03 (1Н, д, J=8,4 Гц), 7,23 (1Н, д, J=8,4 Гц), 7,47 (2Н, д, J=8,5 Гц), 8,45 (1Н, с), 8,85 (1Н, с)
MC (ESI) m/e: 444 [М+Н]+.
Пример получения 61
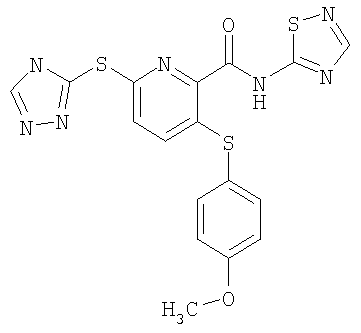
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 61 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 5-амино-1, 2,4-тиадиазола.
1Н-ЯМР (CDCl3) δ: 3,87 (3Н, с), 7,00 (2Н, д, J=8,4 Гц), 7,01 (1Н, д, J=8,4 Гц), 7,20 (1Н, д, J=8,4 Гц), 7,48 (2Н, д, J=8,5 Гц), 7,80 (1Н, с), 8,36 (1Н, с)
МС (ESI) m/e: 444 [M+H]+.
Пример получения 62
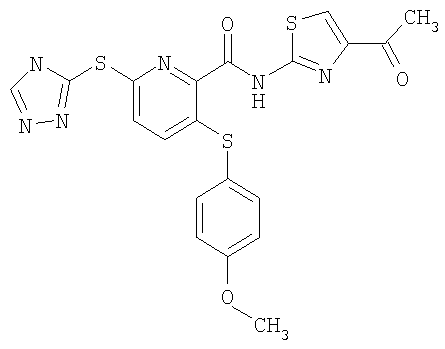
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метилкарбонилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 62 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 4-ацетил-2-аминотиазола.
1Н-ЯМР (CDCl3) δ: 2,63 (3Н, с), 3,86 (3Н, с), 6,98 (1Н, д, J=8,8 Гц), 7,01 (2Н, д, J=8,8 Гц), 7,22 (1Н, д, J=8,8 Гц), 7,46 (2Н, д, J=8,8 Гц), 7,86 (1Н, с), 8,33 (1Н, с)
МС (ESI) m/е: 485 [М+Н]+.
Пример получения 63
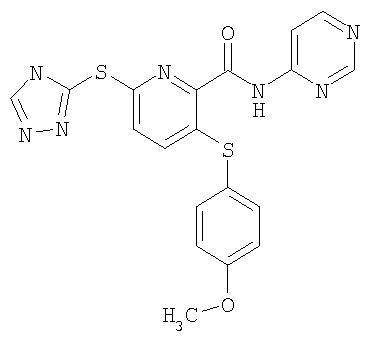
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиримидин-4-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 63 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 4-аминопиримидина.
1Н-ЯМР (CDCl3) δ: 3,86 (3Н, с), 6,98 (2Н, д, J=8,8 Гц), 7,02 (1Н, д, J=8,4 Гц), 7,22 (1Н, д, J=8,4 Гц), 7,46 (2Н, д, J=8,8 Гц), 8,38 (1Н, дд, J=5,9, 0,8 Гц), 8,41 (1Н, с), 8,65 (1Н, д, J=5,9 Гц), 8,93 (1Н, д, J=0,8 Гц)
MC (ESI) m/e: 438 [М+Н]+.
Пример получения 64
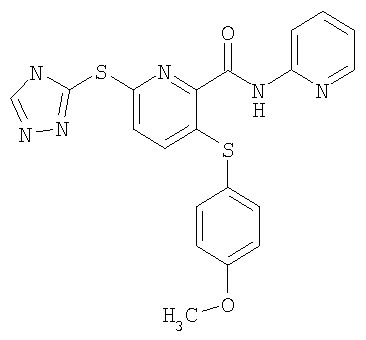
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 64 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 2-аминопиридина.
1Н-ЯМР (CDCl3) δ: 3,85 (3Н, с), 6,97 (2Н, д, J=8,8 Гц), 6,99 (1Н, д, J=8,8 Гц), 7,05 (1Н, дд, J=8,5, 4,5 Гц), 7,18 (1Н, д, J=8,8 Гц), 7,46 (2H, д, J=8,8 Гц), 7,73 (1Н, ддд, J=8,5, 8,5, 1,5 Гц), 8,29 (1Н, дд, J=4,5, 1,5 Гц), 8,31 (1Н, с), 8,41 (1Н, д, J=8,5 Гц)
МС (ESI) m/е: 437 [М+Н]+.
Пример получения 65
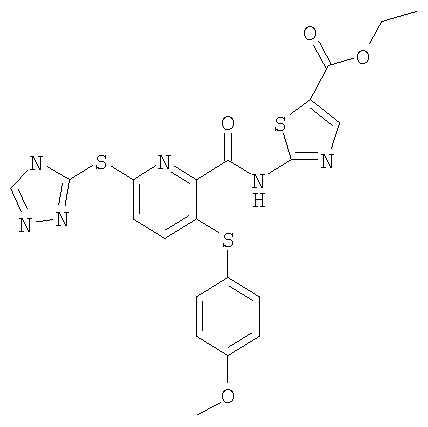
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-этоксикарбонилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 65 может быть получено способом, описанным в примере получения 58, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоксамида, 4-метокситиофенола, 3-меркапто-1,2,4-триазола и 2-амино-5-этоксикарбонилтиазола.
1H-ЯМР (CDCl3) 6: 1,37 (3Н, т, J=7,0 Гц), 3,86 (3Н, с), 4,34 (2Н, кв, J=7,0 Гц), 6,98 (2Н, д, J=8,8 Гц), 7,00 (1Н, д, J=8,5 Гц), 7,20 (1Н, д, J=8,5 Гц), 7,46 (2Н, д, J=8,8 Гц), 8,11 (1Н, с), 8,36 (1Н, с)
МС (ESI) m/е: 515 [М+Н]+.
Пример получения 66
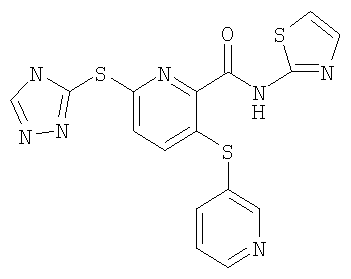
Получение 3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
К 152 мг (0,390 ммоль) 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида, полученного способом, описанным в примере получения 1, добавляют анизол (0,40 мл, 0,390 ммоль) и 5 мл трифторуксусной кислоты и реакционный раствор перемешивают при температуре 60°С в течение 5 часов и затем перемешивают в течение ночи при комнатной температуре. Реакционный раствор концентрируют в вакууме с получением 3-тиол-производного в виде окрашенного в оранжевый цвет маслянистого вещества.
К раствору (3 мл) полученного выше 3-тиол-производного в 2-пропаноле добавляют 62 мкл (1,10 ммоль) этиленгликоля, 141 мг (1,02 ммоль) карбоната калия, 114 мг (0,560 ммоль) 3-иодпиридина и 5,3 мг (0,030 ммоль) иодида меди и реакционный раствор перемешивают при температуре 80°С в течение ночи. Реакционный раствор фильтруют через целит и фильтрат распределяют между хлороформом и водой. Органический слой промывают водой, сушат и концентрируют в вакууме. Полученный остаток очищают тонкослойной хроматографией на силикагеле (гексан:этилацетат=1:1), получая 28 мг (выход: 21%) 6-хлорпроизводного в виде твердого вещества бледно-желтого цвета.
Затем к раствору (1 мл) 25 мг (0,22 ммоль) трет-бутилата калия в N,N-диметилформамиде добавляют 22 мг (0,22 ммоль) 3-меркапто-1,2,4-триазола, прибавляют по каплям раствор (3 мл) 28 мг (0,080 ммоль) полученного выше 6-хлорпроизводного в N,N-диметилформамиде и, после окончания прибавления, реакционный раствор перемешивают при температуре 120°С в течение 2 часов. К реакционному раствору добавляют воду, после чего экстрагируют хлороформом. Органический слой промывают водой, сушат и концентрируют в вакууме. Полученный остаток очищают тонкослойной хроматографией на силикагеле (хлороформ:метанол=9:1), получая 12 мг (выход: 37%) указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета.
1Н-ЯНР (CDCl3) δ: 6,96 (1Н, д, J=8,8 Гц), 7,05 (1Н, д, J=3,6 Гц), 7,22 (1Н, д, J=8,8 Гц), 7,40-7,43 (1Н, м), 7,47 (1Н, д, J=3,6 Гц), 7,87-7,90 (1Н, м), 8,32 (1Н, с), 8,64-8,66 (1Н, м), 8,70-8,71 (1Н, м)
МС (ESI) m/е: 414 [М+Н]+.
Соединения согласно примерам получения 67 и 68 получают способом примера получения 66. Аналитические данные для этих соединений приводятся ниже.
Пример получения 67
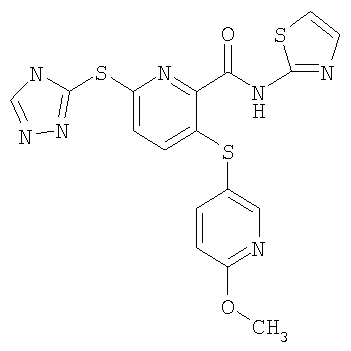
Получение 3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 67 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида, 6-метокси-3-иодпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 4,00 (3Н, с), 6,87 (1Н, д, J=8,7 Гц), 7,00-7,11 (2Н, м), 7,26 (1Н, д, J=8,4 Гц), 7,46 (1Н, д, J=3,3 Гц), 7,77 (1Н, дд, J=2,4, 8,7 Гц), 8,35 (1Н, д, J=2,4 Гц), 8,38 (1Н, с)
MC (ESI) m/e: 444 [М+Н]+.
Пример получения 68
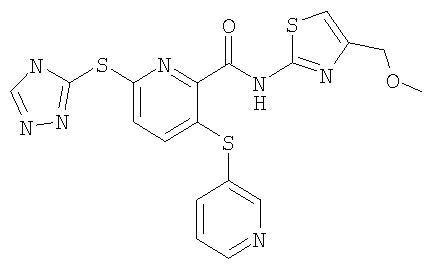
Получение 3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 68 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-N-(4-метоксифенилметилсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 3-иодпиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,49 (3Н, с), 4,56 (2Н, с), 6,94 (1Н, с), 6,97 (1Н, д, J=8,8 Гц), 7,27 (1Н, д, J=8,8 Гц), 7,43 (1Н, дд, J=7,6 Гц, 3,3 Гц), 7,93 (1Н, д, J=7,6 Гц), 8,38 (1Н, с), 8,71 (1Н, д, J=4,8 Гц), 8,77 (1Н, с)
МС (ESI) m/е: 458 [М+Н]+.
Пример получения 69
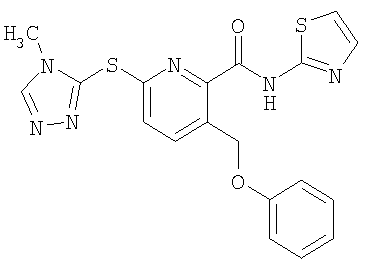
Получение 3-фенилоксиметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
К раствору (50 мл) 3,50 г (14,0 ммоль) 2-циано-3-трет-бутилдиметилсилилоксиметилпиридина в хлороформе добавляют 3-хлорнадбензойную кислоту (6,30 г, 21,0 ммоль) с последующим кипячением с обратным холодильником в течение ночи. К реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия, после чего экстрагируют хлороформом и органический слой промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором, затем сушат и концентрируют. Полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1), получая 1,50 г (выход: 41%) N-оксида в виде твердого вещества белого цвета.
Раствор (10 мл) 1,50 г (5,70 ммоль) полученного N-оксида в оксихлориде фосфора перемешивают при температуре 80°С в течение 1 часа. Реакционный раствор концентрируют в вакууме, к остатку добавляют насыщенный водный раствор гидрокарбоната натрия, после чего экстрагируют хлороформом и органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором. После сушки и концентрирования полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1), получая 625 мг (выход: 58%) 2-хлор-5-хлорметил-6-цианопиридина в виде твердого вещества белого цвета.
К раствору (5 мл) 50 мг (0,27 ммоль) 2-хлор-5-хлорметил-6-цианопиридина в ацетонитриле добавляют фенол (30 мг, 0,32 ммоль) и 44 мг (0,32 ммоль) гидрокарбоната натрия с последующим перемешиванием при комнатной температуре в течение 8 часов 30 минут. К реакционному раствору добавляют воду с последующей экстракцией этилацетатом. Органический слой промывают насыщенным водным солевым раствором, сушат и концентрируют в вакууме и полученный остаток очищают тонкослойной колоночной хроматографией (гексан:этилацетат=6:1), получая 61 мг (выход: 93%) 2-хлор-6-циано-5-феноксиметилпиридина в виде твердого вещества белого цвета.
К раствору (5 мл) 61 мг (0,249 ммоль) полученного 2-хлор-6-циано-5-феноксиметилпиридина в N,N-диметилформамиде добавляют 3-меркапто-4-метил-4Н-1,2,4-триазол (44 мг, 0,380 ммоль) и 52 мг (0,380 ммоль) карбоната калия с последующим перемешиванием при температуре 100°С в течение ночи. К реакционному раствору добавляют воду, после чего экстрагируют этилацетатом и органический слой промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором. После сушки и концентрирования полученный остаток очищают тонкослойной колоночной хроматографией (хлороформ:метанол=10:1), получая 4,4 мг (выход: 5%) тиотриазольного производного.
К этанольному раствору (5 мл) 4,4 мг (0,014 ммоль) полученного тиотриазольного производного добавляют 1н. водный раствор (0,5 мл) гидроксида натрия, затем кипятят с обратным холодильником в течение ночи. К реакционному раствору добавляют для подкисления 1н водный раствор хлороводорода, затем экстрагируют этилацетатом и органический слой промывают насыщенным водным солевым раствором. После сушки и концентрирования, к раствору (3 мл) полученного остатка в дихлорметане последовательно добавляют 3 мг (0,028 ммоль) 2-аминотиазола, 4 мг (0,030 ммоль) N-гидроксибензотриазолгидрата и 6 мг (0,030 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида с последующим перемешиванием при комнатной температуре в течение ночи. К реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия, после чего экстрагируют хлороформом и органический слой промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным солевым раствором. После сушки и концентрирования полученный остаток очищают тонкослойной хроматографией на силикагеле (хлороформ:метанол=10:1), получая 2,8 мг (выход: 47%) указанного в заголовке соединения в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3) δ: 3,79 (3Н, с), 5,71 (2Н, с), 6,97-7,02 (3Н, м), 7,05 (1Н, д, J=3,6 Гц), 7,30 (2Н, т, J=7,6 Гц), 7,40 (1Н, д, J=8,4 Гц), 7,54 (1Н, д, J=3, 6 Гц), 8,22 (1Н, д, J=8,4 Гц), 8,50 (1Н, с)
MC (ESI) m/e: 425 [М+Н]+.
Соединение согласно примеру получения 7 0 получают способом примера получения 69. Аналитические данные для соединения приводятся ниже.
Пример получения 70
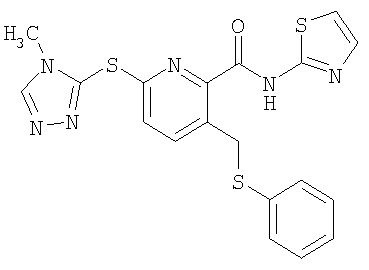
Получение 3-фенилсульфанилметил-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 70 может быть получено способом, описанным в примере получения 69, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 2-циано-3-трет-бутилдиметилсилилоксиметилпиридина, тиофенола, 3-меркапто-4-метил-4Н-1,2,4-триазола и 2-аминотиазола.
1Н-ЯМР (CDCl3) δ: 3,77 (3Н, с), 4,74 (2Н, с), 7,04 (1Н, д, J=3,2 Гц), 7,20 (1Н, д, J=8,4 Гц), 7, 24-7, 28 (5Н, м), 7,53 (1Н, д, J=3,2 Гц), 7,58 (1Н, д, J=8,4 Гц), 8,48 (1Н, с)
MC (ESI) m/e: 441 [М+Н]+.
Пример получения 71
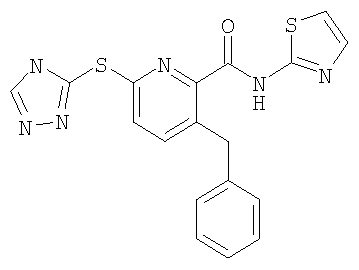
Получение 3-фенилметил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
3-бензоил-2-пиридинкарбоновую кислоту (2,0 г, 8,8 ммоль) растворяют в 10 мл метанола и при комнатной температуре прибавляют 10 капель концентрированной серной кислоты, после чего кипятят с обратным холодильником в течение всего дня и ночи. После охлаждения, метанол выпаривают, затем нейтрализуют с помощью насыщенного водного раствора гидрокарбоната натрия. Осуществляют экстракцию хлороформом, затем сушат над сульфатом натрия и концентрируют, получая 2,0 г метил-3-бензоил-2-пиридинкарбоксилата в виде неочищенного продукта.
Сложный эфир (2,0 г) растворяют в 10 мл хлороформа и добавляют 3,57 г (20,7 ммоль) м-хлорпероксибензойной кислоты (mCPBA), после чего кипятят с обратным холодильником в течение всего дня и ночи. После охлаждения к реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия для подщелачивания, после чего экстрагируют хлороформом. Сушат над сульфатом натрия и выпаривают в вакууме, получая N-оксид в виде неочищенного продукта. К полученному неочищенному продукту добавляют 10 мл оксихлорида фосфора, после чего перемешивают при температуре 80°С в течение 2 часов. После охлаждения нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. После сушки над сульфатом натрия и выпаривания в вакууме, осуществляют очистку колоночной хроматографией на силикагеле (этилацетат:гексан=1:2), получая 600 мг (выход: 26% (через три стадии очистки)) метил-3-бензоил-6-хлор-2-пиридинкарбоксилата.
Хлорпроизводное (300 мг, 1,10 ммоль) растворяют в 15 мл метанола и добавляют 5 мл 1н. раствора гидроксида натрия с последующим перемешиванием при комнатной температуре в течение 2 часов. После выпаривания метанола остаток нейтрализуют 1н. соляной кислотой и экстрагируют хлороформом. Хлороформный экстракт сушат над сульфатом натрия и выпаривают в вакууме, получая 285 мг (выход: 100%) 3-бензоил-6-хлор-2-пиридинкарбоновой кислоты в виде неочищенного продукта.
Полученную выше карбоновую кислоту (285 мг, 1,1 ммоль) растворяют в 10 мл хлороформа и добавляют 109 мг (1,1 ммоль) 2-аминотиазола, 221 мг (1,64 ммоль) N-гидроксибензотриазолгидрата и 229 мг (1,2 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида с последующим перемешиванием при комнатной температуре в течение всего дня и ночи. После добавления дистиллированной воды, экстрагируют хлороформом и сушат над сульфатом натрия. Полученный после выпаривания растворителя в вакууме остаток очищают колоночной хроматографией (этилацетат:гексан=1:2), получая 225 мг (выход: 60% (после двух стадий)) 3-бензоил-6-хлор-N-(тиазол-2-ил)-2-пиридинкарбоксамида.
Полученное выше хлорпроизводное (170 мг, 0,495 ммоль) растворяют в 3 мл диметилформамида и добавляют 55 мг (0,544 ммоль) 3-меркапто-1,2,4-триазола и 171 мг (1,24 ммоль) карбоната калия с последующим перемешиванием при температуре 100°С в течение целого дня и ночи. Реакционный раствор охлаждают, диметилформамид выпаривают из него и добавляют дистиллированную воду, после чего нейтрализуют с помощью 1н. соляной кислоты и экстрагируют хлороформом. После сушки над сульфатом натрия и выпаривания в вакууме остаток очищают колоночной хроматографией на силикагеле (метанол:хлороформ=1:10), получая 101 мг (выход: 50%) 3-бензоил-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида.
Полученный выше кетон (70 мг, 0,172 ммоль) суспендируют в 5 мл метанола, добавляют 12,7 мг (0,343 ммоль) боргидрида натрия, после чего перемешивают при комнатной температуре в течение 30 минут и растворитель выпаривают. К полученному остатку добавляют 99 мг (0,853 ммоль) триэтилсилана и 5 мл трифторуксусной кислоты с последующим перемешиванием при температуре 60°С в течение 1 часа. После концентрирования остаток распределяют между хлороформом и насыщенным водным раствором гидрокарбоната натрия и хлороформный слой сушат над сульфатом натрия. Остаток, полученный после выпаривания растворителя, очищают тонкослойной хроматографией на силикагеле два раза (метанол:хлороформ=1:8 и этилацетат:ацетон=2:1), получая 13,5 мг (выход: 20%) указанного в заголовке соединения.
1Н-ЯМР (CDCl3) δ: 4,63 (2H, с), 6,99 (1H, д, J=3,6 Гц), 7,18-7,29 (5H, м), 7,38 (1H, д, J=8,4 Гц), 7,41 (1H, дд, J=3,6 Гц), 7,45 (1H, д, J=8,4 Гц), 8,33 (1H, с)
MC (ESI) m/e: 395 [M+H]+.
Пример получения 72
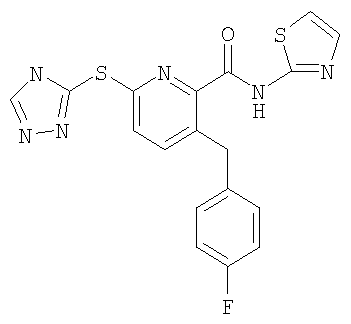
Получение 3-(4-фторфенилметил)-6-(4H-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 72 может быть получено способом, описанным в примере получения 71, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3-(4-фторбензоил)-2-пиридинкарбоновой кислоты, 2-аминотиазола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,60 (2Н, с), 6,94-6,98 (2Н, м), 7,01 (1Н, д, J=3,6 Гц), 7,14-7,17 (2Н, м), 7,40-7,46 (3Н, м), 8,35 (1Н, с)
MC (ESI) m/e: 413 [М+Н]+.
Пример получения 73
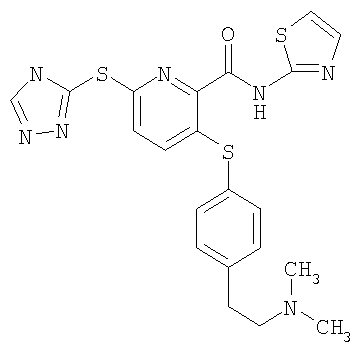
Получение 3-(4-диметиламиноэтилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 73 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметиламиноэтилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,39 (6H, c), 2,68 (2H, м), 2,84 (2H, м), 7,00-7,05 (2H, м), 7,18 (1H, д, J=8,7 Гц), 7,28 (2H, д, J=8,4 Гц), 7,41-7,58 (3H, м), 8,32 (1H, с)
МС (ESI) m/e: 484 [M+H]+.
Пример получения 74
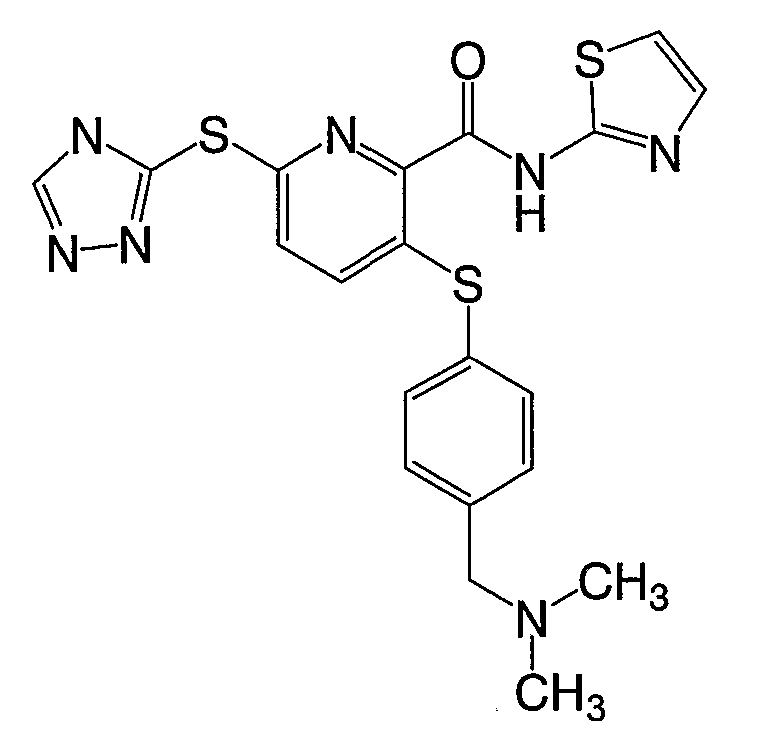
Получение 3-(4-диметиламинометилфенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 74 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметиламинометилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,23 (6H, c), 6,96 (1H, д, J=8,8 Гц), 7,00 (1H, д, J=3,6 Гц), 7,11 (1H, д, J=8,8 Гц), 7,34 (2H, д, J=8,0 Гц), 7,43 (1H, д, J=3,6 Гц), 7,46 (2H, д, J=8,0 Гц), 8,29 (1H, с)
МС (ESI) m/e: 470 [M+H]+.
Пример получения 75
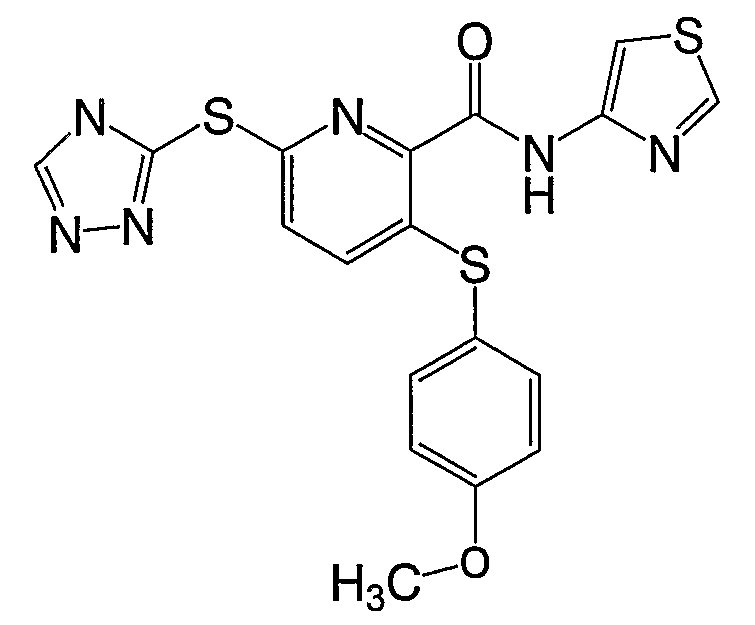
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-4-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 75 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 4-аминотиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,85 (3H, с), 6,96 (2H, д, J=8,8 Гц), 6,98 (1H, д, J=8,8 Гц), 7,15 (1H, д, J=8,8 Гц), 7,46 (2H, д, J=8,8 Гц), 7,90 (1H, д, J=2,4 Гц), 8,34 (1H, с), 8,61 (1H, д, J=2,4 Гц)
МС (ESI) m/e: 443 [M+H]+.
Пример получения 76
Получение 3-(4-диметилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 76 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметилкарбамоилметилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,99 (3H, с), 3,09 (3H, c), 4,73 (2H, c), 6,99 (2H, д, J=8,8 Гц), 7,01-7,03 (1H, м), 7,03 (1H, д, J=3,6 Гц), 7,19 (2H, д, J=8,4 Гц), 7,45 (2H, д, J=8,8 Гц), 7,46 (2H, д, J=3,6 Гц), 8,30 (1H, с)
МС (ESI) m/e: 514 [M+H]+.
Пример получения 77
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиэтилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 77 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-гидроксиэтилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,90 (2H, т, J=4,8 Гц), 3,83 (3H, с), 3,90 (2H, т, J=4,8 Гц), 6,65 (1H, с), 6,95 (2H, д, J=8,0 Гц), 6,97 (1H, д, J=8,8 Гц), 7,17 (1H, д, J=8,8 Гц), 7,43 (2H, д, J=8,0 Гц), 8,34 (1H, с)
МС (ESI) m/e: 487 [M+H]+.
Пример получения 78
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 78 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-гидрокситиофенола и 5-гидрокси-3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,65 (3H, c), 6,98-7,50 (5H, м), 7,82 (1H, м), 8,64 (1H, ушир.с)
МС (ESI) m/e: 444 [M+H]+.
Пример получения 79
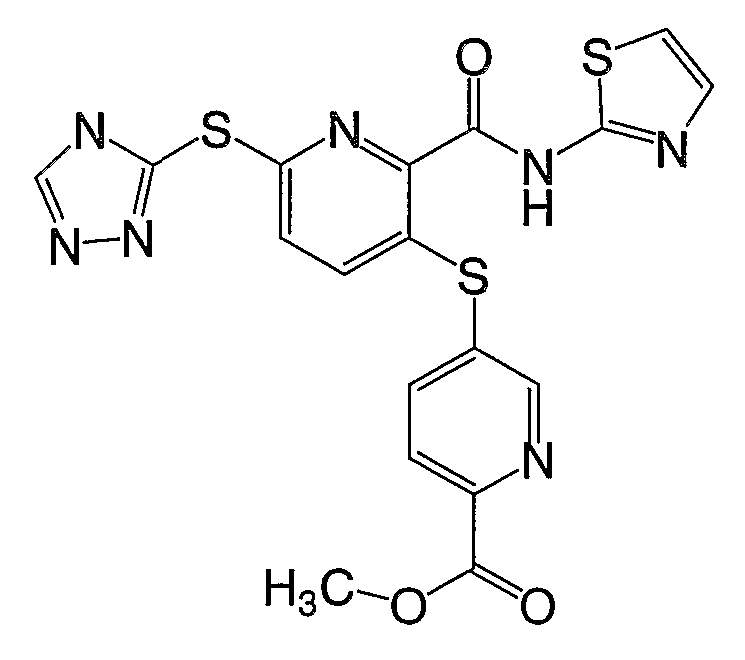
Получение 3-(6-метоксикарбонилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 79 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 5-иод-3-метоксикарбонилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,01 (3H, c), 7,03 (1H, д, J=7,6 Гц), 7,05 (1H, д, J=3,6 Гц), 7,24 (1H, д, J=7,6 Гц), 7,47 (1H, д, J=3,6 Гц), 8,00 (1H, м), 8,16 (1H, д, J=8,0 Гц), 8,33 (1H, c), 8,79 (1H, м)
МС (ESI) m/e: 472 [M+H]+.
Пример получения 80
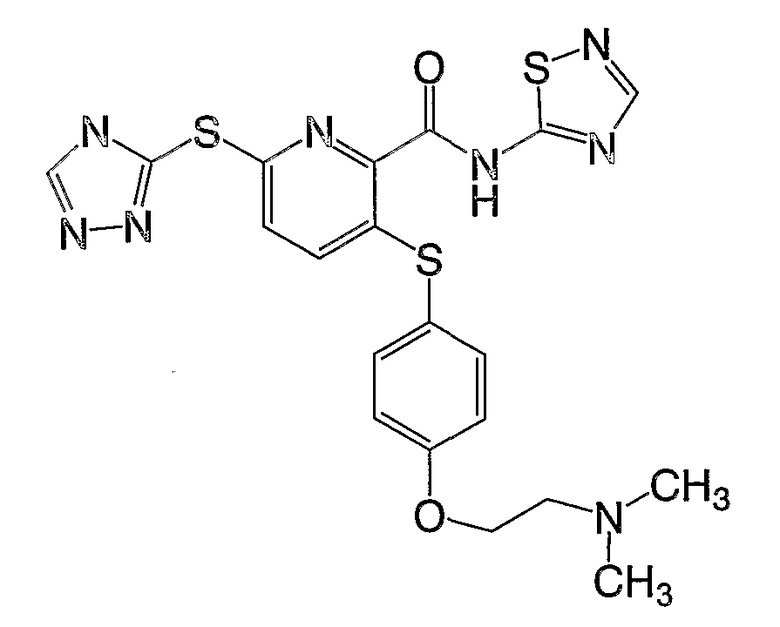
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 80 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-1,2,4-тиадиазола, 4-диметиламиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,42 (6H, с), 2,84 (2H, т, J=5,1 Гц), 4,13 (2H, т, J=5,1 Гц), 6,96 (2H, д, J=8,4 Гц), 7,00 (1H, д, J=8,8 Гц), 7,21 (1H, д, J=8,8 Гц), 7,43 (2H, д, J=8,4 Гц), 8,35 (1H, с)
МС (ESI) m/e: 501 [M+H]+.
Пример получения 81

Получение 3-(пиримидин-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 81 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 5-иодпиримидина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,95 (1H, д, J=8,4 Гц), 7,03 (1H, д, J=3,6 Гц), 7,22 (1H, д, J=8,4 Гц), 7,44 (1H, д, J=3,6 Гц), 8,33 (1H, c), 8,82 (2H, c), 9,20 (1H, c)
МС (ESI) m/e: 415 [M+H]+.
Пример получения 82
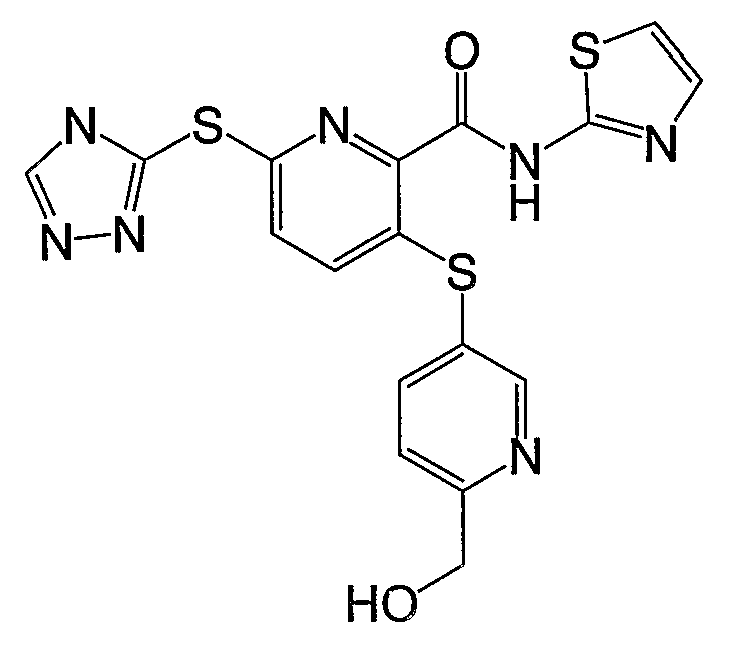
Получение 3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 82 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-гидроксиметилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,86 (2H, с), 7,01 (1H, д, J=9,2 Гц), 7,07 (1H, д, J=3,2 Гц), 7,28 (1H, д, J=9,2 Гц), 7,41 (1H, д, J=7,6 Гц), 7,52 (1H, д, J=3,2 Гц), 7,90 (1H, м), 8,42 (1H, c), 8,74 (1H, м)
МС (ESI) m/e: 444 [M+H]+.
Пример получения 83
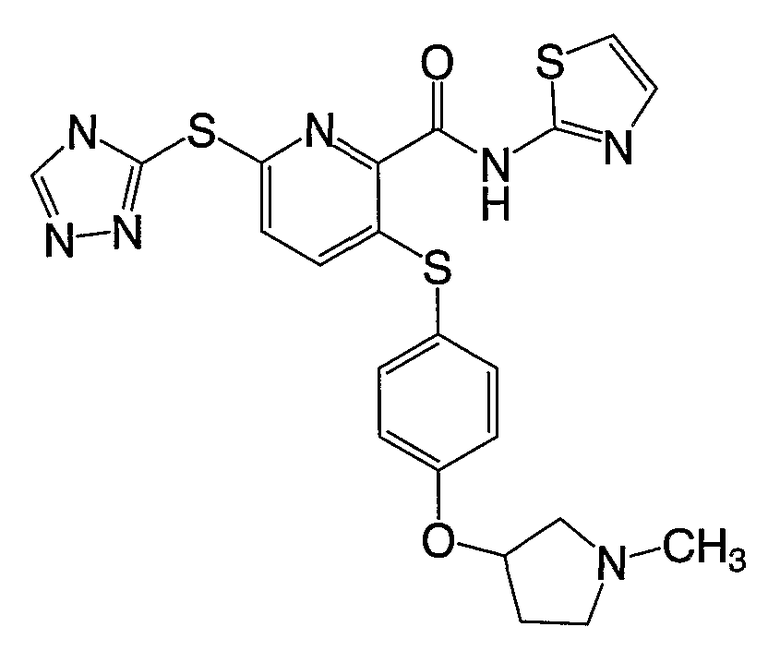
Получение 3-[4-(1-метилпирролидин-3-илокси)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 83 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-(1-метилпирролидин-3-ил)тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,90-1,98 (1H, м), 2,35 (3H, c), 2,25-2,35 (2H, м), 2,43-2,47 (1H, м), 2,80-2,83 (2H, м), 4,78-4,85 (1H, м), 6,85 (2H, д, J=8,4 Гц), 6,95 (1H, д, J=8,8 Гц), 7,00 (1H, д, J=3,6 Гц), 7,12 (1H, д, J=8,8 Гц), 7,38 (2H, д, J=8,4 Гц), 7,42 (1H, д, J=3,6 Гц), 8,29 (1H, с)
МС (ESI) m/e: 512 [M+H]+.
Пример получения 84
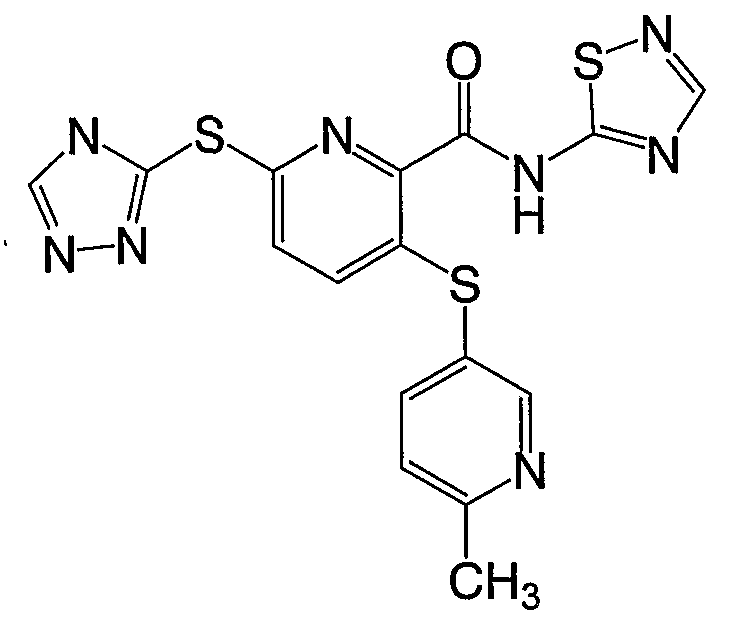
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 84 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,65 (3H, с), 7,01 (1H, д, J=8,6 Гц), 7,26 (1H, д, J=8,6 Гц), 7,30 (1H, д, J=8,0 Гц), 7,78 (1H, дд, J=8,0, 2,2 Гц), 8,35 (1H, с), 8,42 (1H, c), 8,64 (1H, д, J=2,2 Гц)
МС (ESI) m/e: 429 [M+H]+.
Пример получения 85
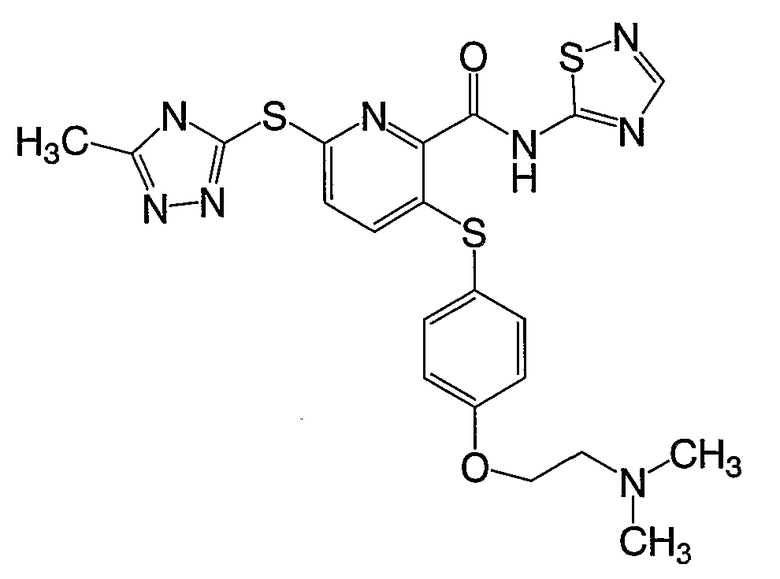
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 85 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-1,2,4-тиадиазола, 4-диметиламиноэтилокситиофенола и 3-меркапто-5-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,40 (6H, с), 2,62 (6H, с), 2,81 (2H, т, J=5,5 Гц), 4,12 (2H, т, J=5,1 Гц), 6,96 (2H, д, J=8,5 Гц), 6,98 (1H, д, J=8,5 Гц), 7,20 (1H, д, J=8,5 Гц), 7,42 (2H, д, J=8,5 Гц), 8,34 (1H, с)
МС (ESI) m/e: 515 [M+H]+.
Пример получения 86
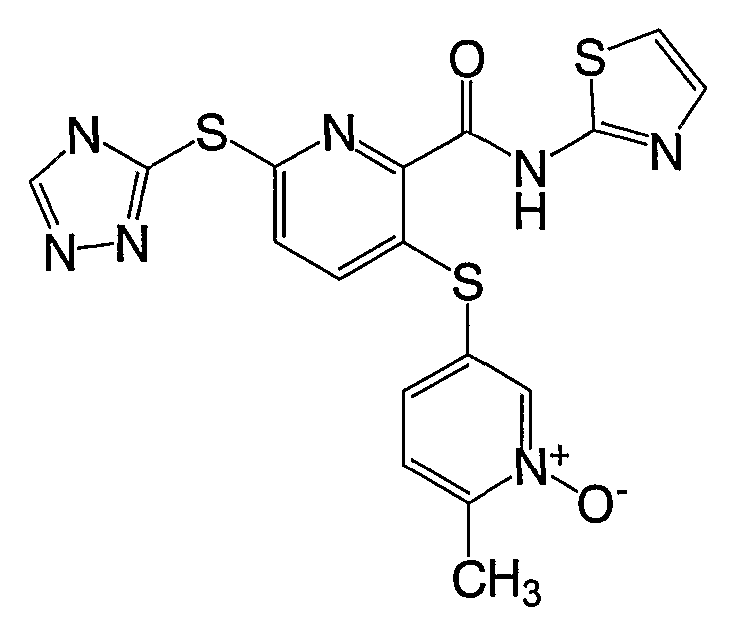
Получение 3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 86 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-меркапто-6-метил-1-оксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,60 (3H, c), 7,06 (1H, д, J=3,2 Гц), 7,12 (1H, д, J=8,4 Гц), 7,32 (1H, д, J=8,4 Гц), 7,39-7,39 (2H, м), 7,51 (1H, д, J=3,2 Гц), 8,44 (1H, с), 8,51 (1H, ушир.с)
МС (ESI) m/e: 446 [M+H]+.
Пример получения 87
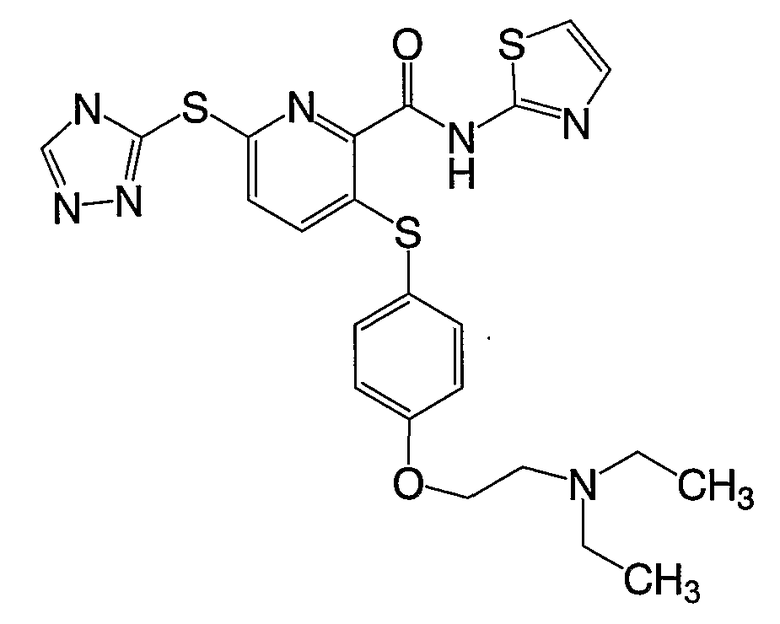
Получение 3-(4-диэтиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 87 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диэтиламиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,14 (6H, т, J=7,6 Гц), 2,73 (4H, кв, J=7,6 Гц), 2,99 (2H, т, J=6,0 Гц), 4,14 (2H, т, J=6,0 Гц), 6,99 (2H, д, J=8,8 Гц), 7,01 (1H, д, J=8,4 Гц), 7,07 (1H, д, J=4,0 Гц), 7,18 (1H, д, J=8,4 Гц), 7,46 (2H, д, J=8,8 Гц), 7,49 (1H, д, J=4,0 Гц), 8,36 (1H, c)
МС (ESI) m/e: 528 [M+H]+.
Пример получения 88
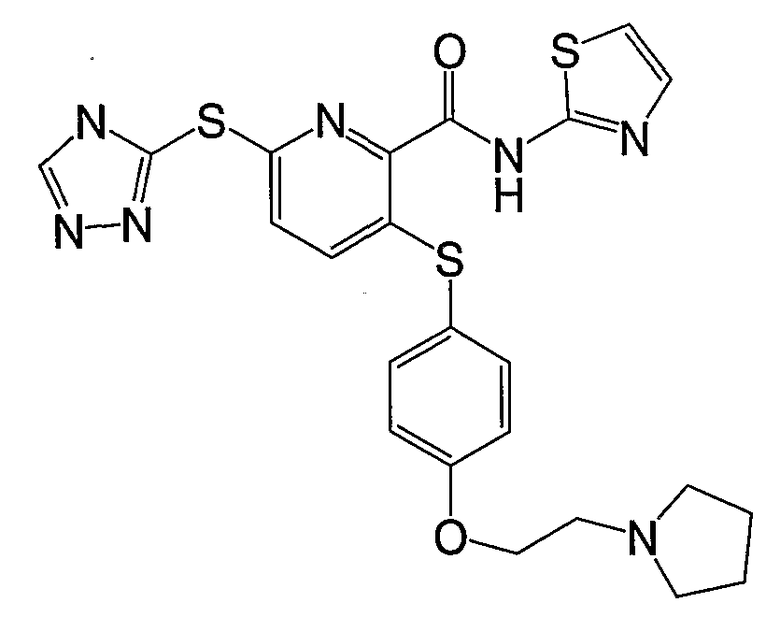
Получение 3-(4-пирролидиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 88 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-пирролидиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,80-1,90 (4H, м), 2,70-2,80 (4H, м), 3,02 (2H, т, J=5,2 Гц), 4,18 (2H, т, J=5,2 Гц), 6,95 (2H, д, J=8,8 Гц), 6,97 (1H, д, J=8,4 Гц), 7,02 (1H, д, J=3,6 Гц), 7,17 (1H, д, J=8,4 Гц), 7,42 (2H, д, J=8,8 Гц), 7,45 (1H, д, J=3,6 Гц), 8,29 (1H, c)
МС (ESI) m/e: 526 [M+H]+.
Пример получения 89
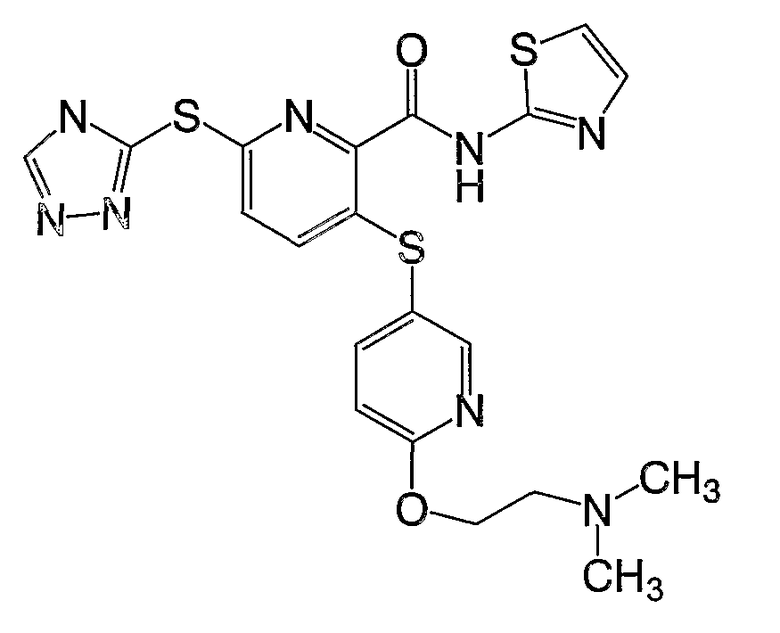
Получение 3-(6-диметиламиноэтилоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 89 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-меркапто-6-диметиламиноэтилоксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,41 (6H, с), 2,82 (2H, т, J=5,6 Гц), 4,48 (2H, т, J=5,6 Гц), 6,80 (1H, д, J=8,4 Гц), 6,98 (1H, д, J=8,4 Гц), 7,03 (1H, д, J=3,6 Гц), 7,23 (1H, д, J=8,4 Гц), 7,47 (1H, д, J=3,6 Гц), 7,63 (1H, дд, J=2,4, 8,4 Гц), 7,27 (1H, д, J=2,4 Гц), 8,36 (1H, c)
МС (ESI) m/e: 501 [M+H]+.
Пример получения 90

Получение 3-(пиразол-4-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 90 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 4-иодпиразола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 7,07 (1H, д, J=3,6 Гц), 7,18 (1H, д, J=8,4 Гц), 7,25 (1H, д, J=8,4 Гц), 7,49 (1H, д, J=3,6 Гц), 7,70 (2H, c), 8,35 (1H, c)
МС (ESI) m/e: 403 [M+H]+.
Пример получения 91
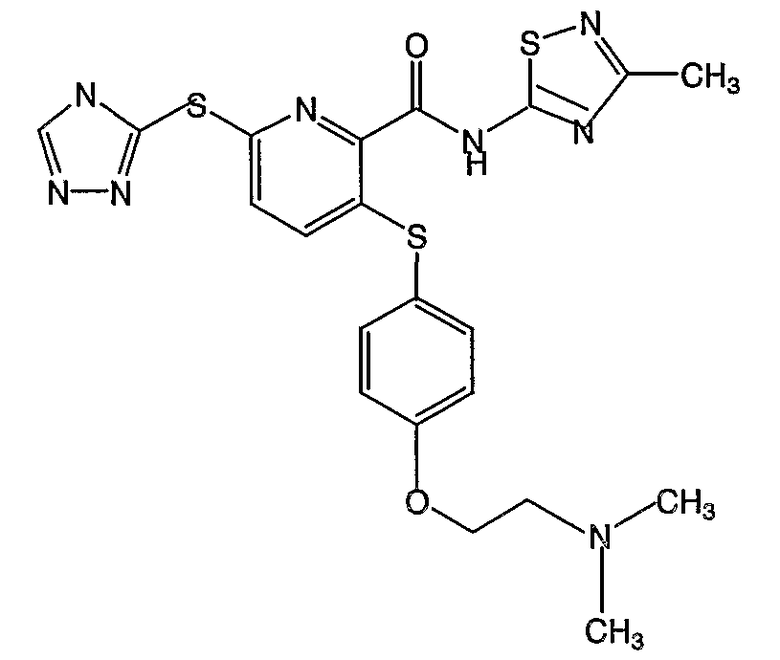
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 91 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-диметиламиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,37 (6H, c), 2,61 (3H, с), 2,80 (2H, т, J=5,6 Гц), 4,12 (2H, т, J=5,6 Гц), 7,00 (2H, д, J=8,4 Гц), 7,02 (1H, д, J=8,8 Гц), 7,22 (1H, д, J=8,8 Гц), 7,45 (2H, д, J=8,4 Гц), 8,34 (1H, с)
МС (ESI) m/e: 515 [M+H]+.
Пример получения 92
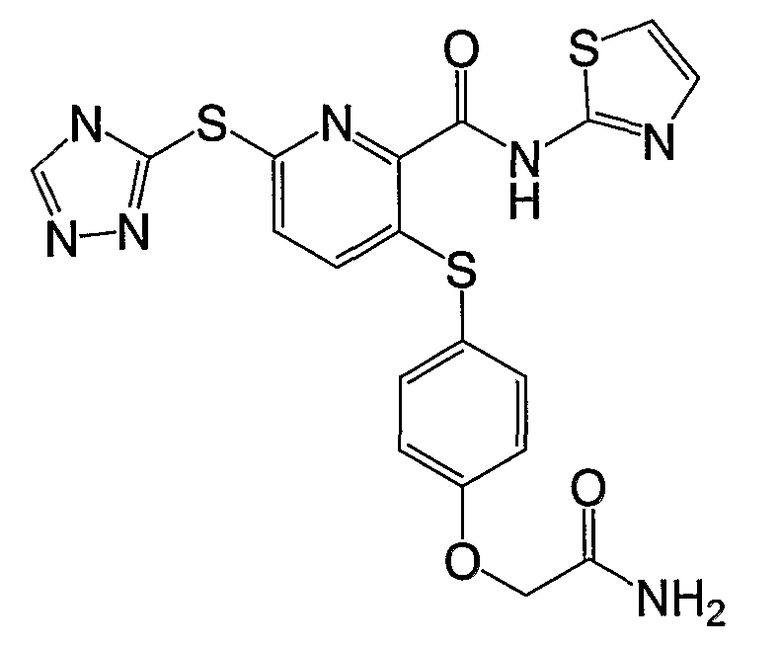
Получение 3-(4-карбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 92 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-карбамоилметилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,48 (2H, c), 6,95 (1H, д, J=8,4 Гц), 6,98 (2H, д, J=8,8 Гц), 7,02 (1H, д, J=3,6 Гц), 7,13 (1H, д, J=8,4 Гц), 7,44 (1H, д, J=3,6 Гц), 7,45 (2H, д, J=8,8 Гц), 8,33 (1H, с)
МС (ESI) m/e: 486 [M+H]+.
Пример получения 93
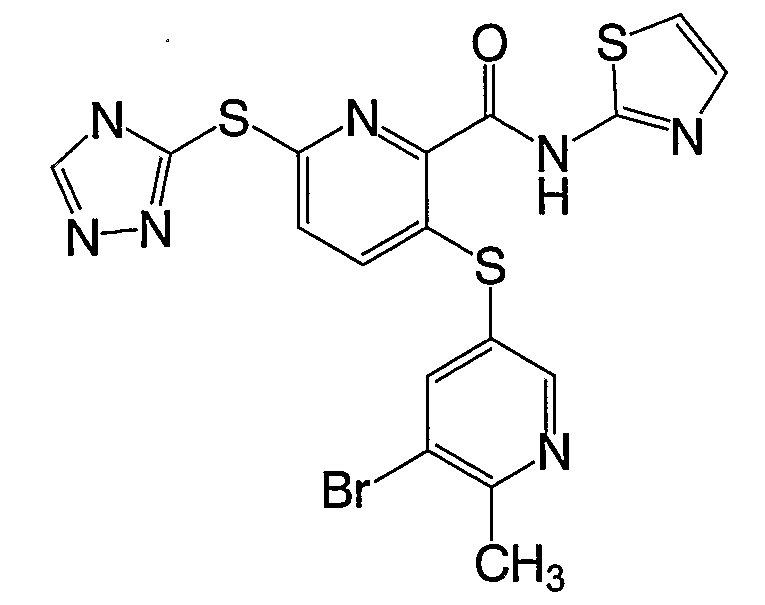
Получение 3-(5-бром-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 93 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 5-бром-3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,72 (3H, с), 7,00 (1H, д, J=8,4 Гц), 7,05 (1H, д, J=3,6 Гц), 7,22-7,24 (1H, м), 7,48 (1H, д, J=3,6 Гц), 8,01 (1H, д, J=2,0 Гц), 8,33 (1H, с), 8,52 (1H, д, J=2,0 Гц)
МС (ESI) m/e: 505, 507 [M+H]+.
Пример получения 94
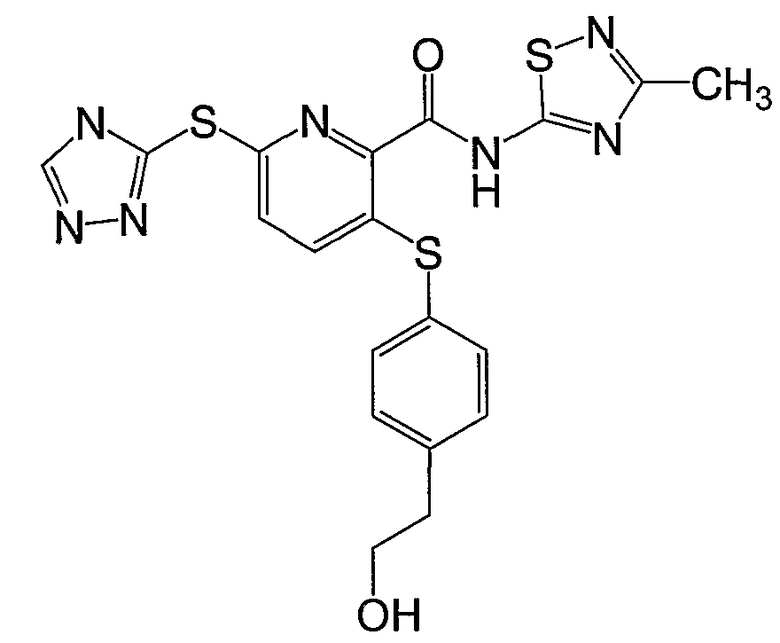
Получение 3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 94 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метилтиадиазола, 4-(2-гидроксиэтил)тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,61 (3H, c), 2,91 (2H, т, J=6,8 Гц), 3,84 (2H, т, J=6,8 Гц), 7,07 (1H, д, J=8,4 Гц), 7,21 (1H, д, J=8,4 Гц), 7,35 (2H, д, J=8,0 Гц), 7,48 (2H, д, J=8,0 Гц), 8,36 (1H, с)
МС (ESI) m/e: 472 [M+H]+.
Пример получения 95
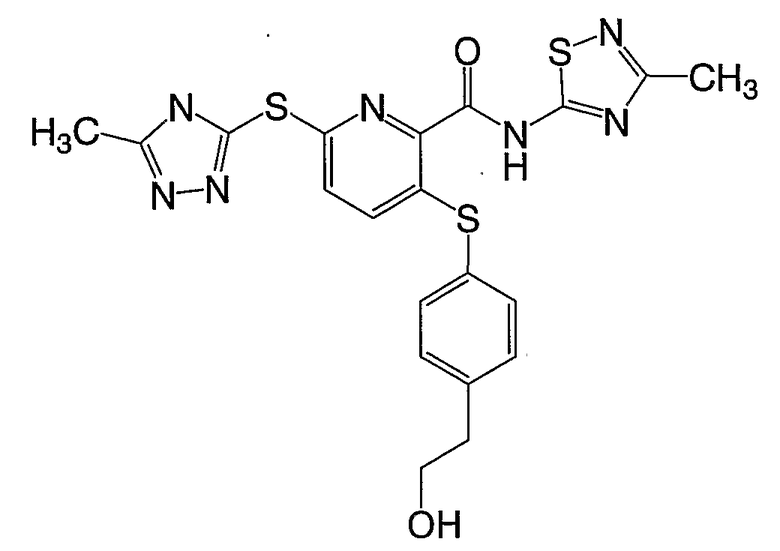
Получение 3-[4-(2-гидроксиэтилфенилсульфанил)]-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 95 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-(2-гидроксиэтил)тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,59 (3H, c), 2,59 (3H, с), 2,94 (2H, т, J=6,4 Гц), 3,94 (2H, т, J=6,4 Гц), 7,03 (1H, д, J=8,8 Гц), 7,21 (1H, д, J=8,8 Гц), 7,34 (2H, д, J=8,0 Гц), 7,49 (2H, д, J=8,0 Гц)
МС (ESI) m/e: 486 [M+H]+.
Пример получения 96
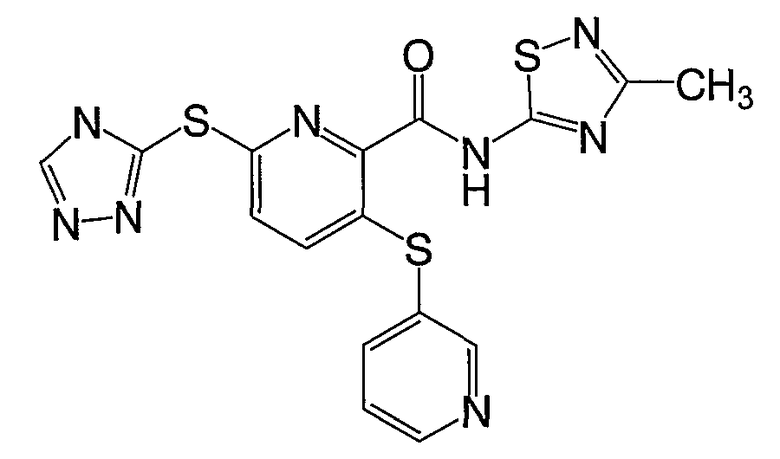
Получение 3-(пиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 96 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,61 (3H, c), 7,00 (1H, д, J=8,8 Гц), 7,29 (1H, д, J=8,8 Гц), 7,41-7,44 (1H, м), 7,88-7,91 (1H, м), 8,41 (1H, c), 8,71-8,73 (1H, м), 8,76-8,77 (1H, м)
МС (ESI) m/e: 429 [M+H]+.
Пример получения 97
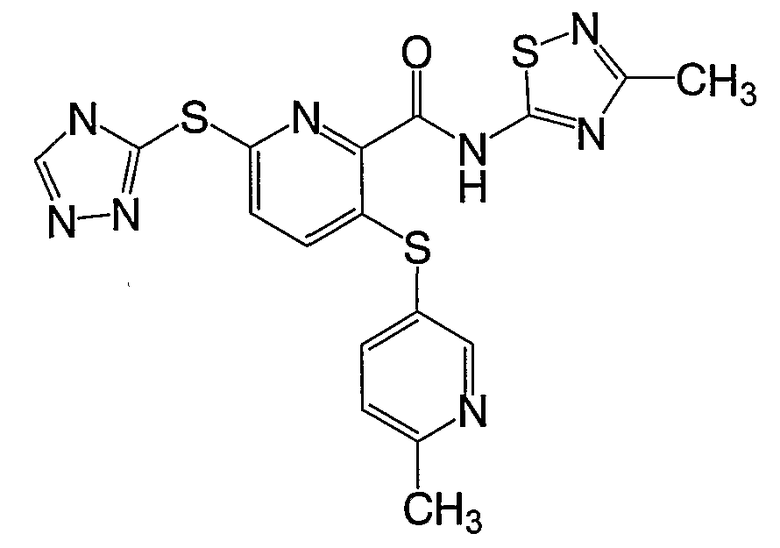
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 97 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,62 (3H, c), 2,64 (3H, с), 7,02 (1H, д, J=8,0 Гц), 7,25 (1H, д, J=8,0 Гц), 7,31 (1H, д, J=8,0 Гц), 7,78 (1H, дд, J=1,6 Гц, 8,0 Гц), 8,35 (1H, с), 8,60 (1H, д, J=1,6 Гц)
МС (ESI) m/e: 443 [M+H]+.
Пример получения 98
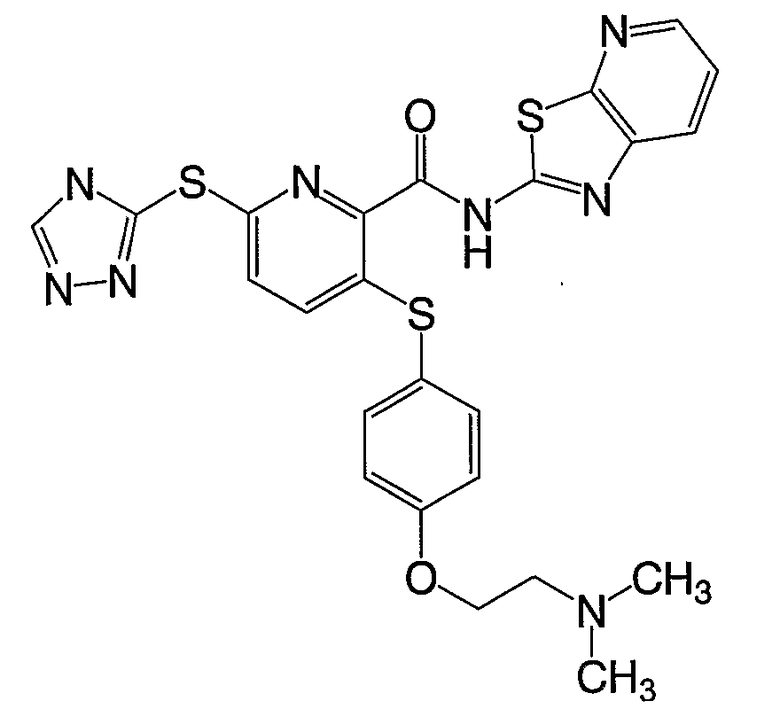
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[5,4-b]пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 98 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазоло[5,4-b]пиридина, 4-диметиламиноэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,43 (6H, c), 2,70-2,88 (2H, м), 4,08-4,14 (2H, м), 6,88 (2H, д, J=8,4 Гц), 6,89-6,93 (1H, м), 7,13 (1H, д, J=8,8 Гц), 7,31-7,35 (1H, м), 7,38 (2H, д, J=8,8 Гц), 7,96 (1H, д, J=8,4 Гц), 8,37 (1H, с), 8,44 (1H, д, J=4,0 Гц)
МС (ESI) m/e: 551 [M+H]+.
Пример получения 99
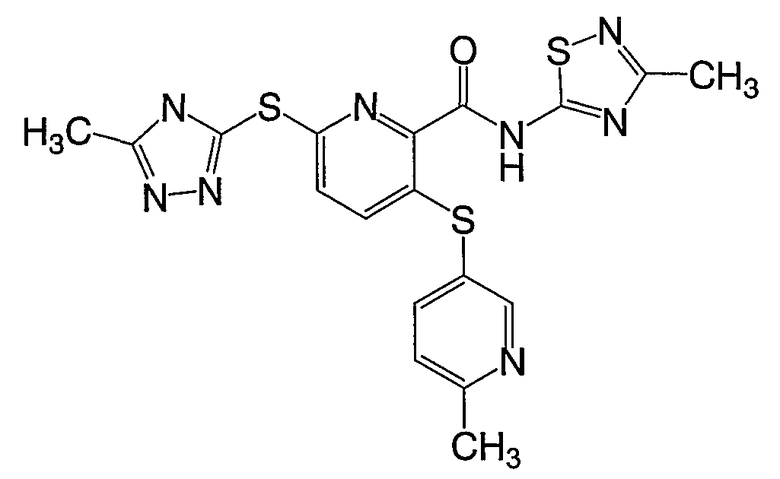
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 99 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,60 (3H, c), 2,61 (3H, c), 3,64 (3H, c), 7,00 (1H, д, J=8,8 Гц), 7,20-7,36 (1H, м), 7,29 (1H, д, J=8,0 Гц), 7,77 (1H, дд, J=2,4, 8,0 Гц), 8,63 (1H, д, J=2,4 Гц)
МС (ESI) m/e: 457 [M+H]+.
Пример получения 100
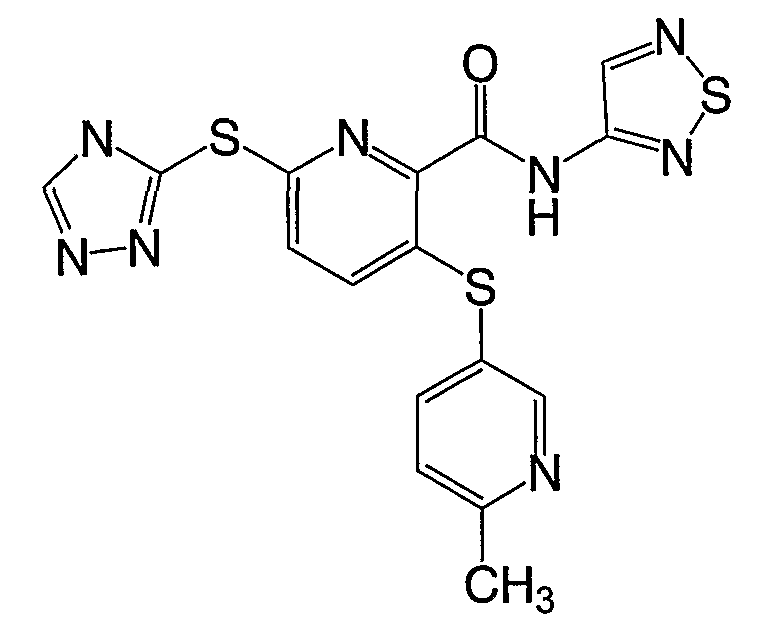
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,5]тиадиазол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 100 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1,2,5-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,63 (3H, с), 6,99 (1H, д, J=8,8 Гц), 7,21 (1H, д, J=8,8 Гц), 7,29 (1H, д, J=8,1 Гц), 7,78 (1H, дд, J=8,1, 2,2 Гц), 8,37 (1H, с), 8,60 (1H, д, J=2,2 Гц), 9,38 (1H, c)
МС (ESI) m/e: 429 [M+H]+.
Пример получения 101
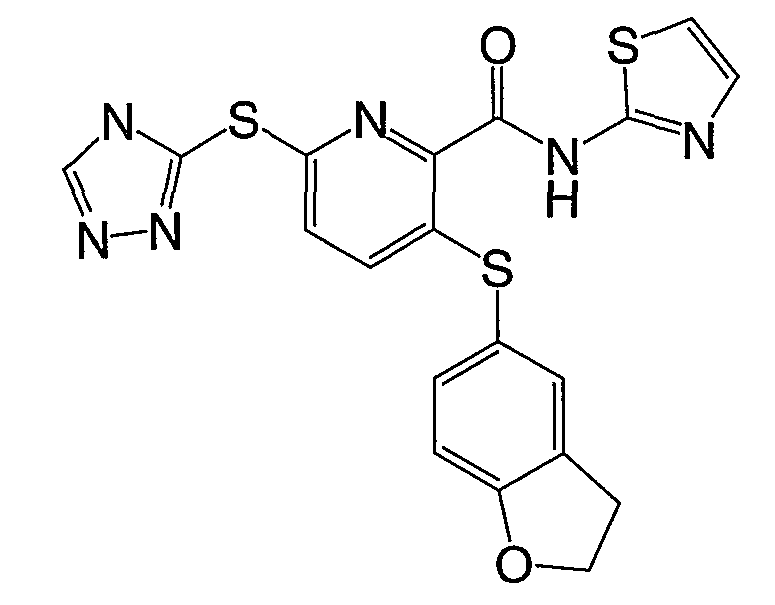
Получение 3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 5-иод-2,3-дигидробензофурана и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,26 (2H, т, J=8,8 Гц), 4,66 (2H, т, J=8,8 Гц), 6,86 (1H, д, J=8,0 Гц), 7,02 (1H, д, J=3,2 Гц), 7,06 (1H, д, J=8,8 Гц), 7,22 (1H, д, J=8,8 Гц), 7,31 (1H, д, J=8,0 Гц), 7,5 (1H, ушир.с), 7,45 (1H, д, J=3,2 Гц), 8,34 (1H, с)
МС (ESI) m/e: 455 [M+H]+.
Пример получения 102
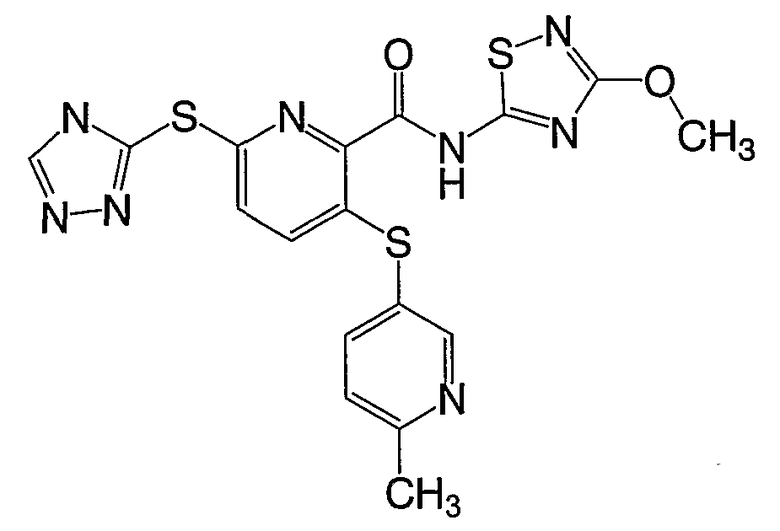
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метокси[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 102 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метокси-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,65 (3H, c), 4,08 (3H, c), 6,90-7,05 (1H, м), 7,10-7,30 (2H, м), 7,70-7,80 (1H, м), 8,39 (1H, c), 8,63 (1H, ушир.с)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 103
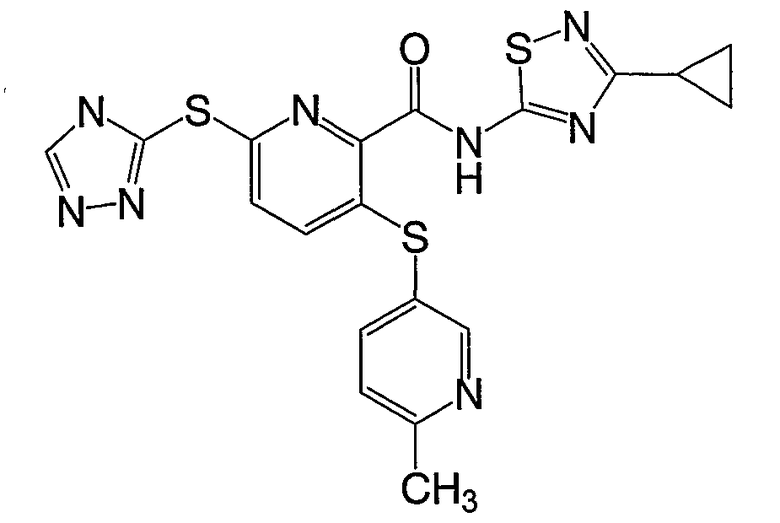
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-циклопропил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 103 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-циклопропил-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 0,90-1,20 (4H, м), 2,20-2,35 (1H, м), 2,64 (3H, с), 6,99 (1H, д, J=8,8 Гц), 7,20-7,30 (2H, м), 7,76 (1H, дд, J=2,4, 8,0 Гц), 8,38 (1H, с), 8,62 (1H, ушир.с)
МС (ESI) m/e: 469 [M+H]+.
Пример получения 104
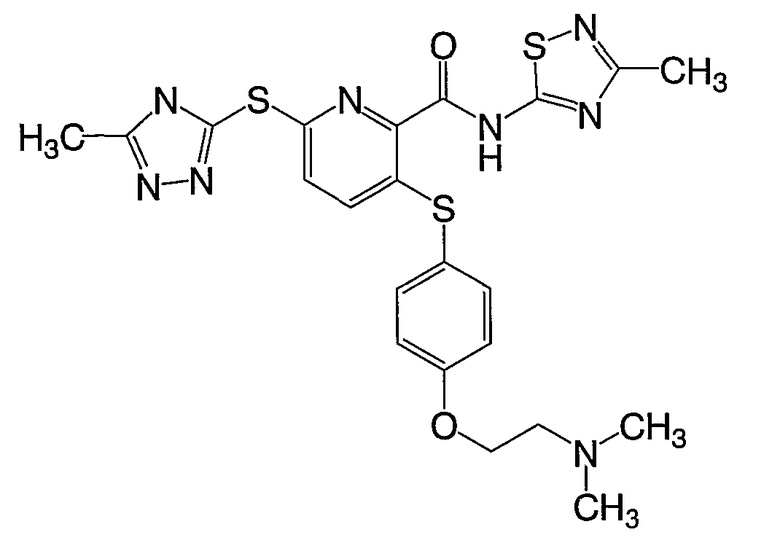
Получение 3-(4-диметиламиноэтилоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 104 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-диметиламиноэтилокситиофенола и 3-меркапто-5-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,41 (6H, c), 2,58 (3H, c), 2,59 (3H, c), 2,83 (2H, т, J=5,5 Гц), 4,12 (2H, т, J=5,5 Гц), 6,91 (2H, д, J=8,8 Гц), 6,94 (1H, д, J=8,6 Гц), 7,17 (1H, д, J=8,6 Гц), 7,40 (2H, д, J=8,8 Гц)
МС (ESI) m/e: 529 [M+H]+.
Пример получения 105
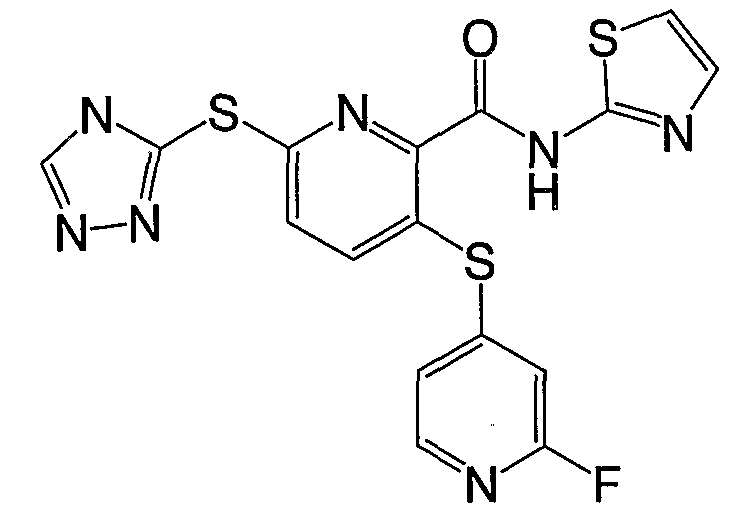
Получение 3-(2-фторпиридин-4-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 105 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 2-фтор-4-иодпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,95-7,10 (2H, м), 7,20-7,26 (2H, м), 7,30-7,42 (1H, м), 7,40-7,50 (1H, м), 8,10-8,26 (1H, м), 8,38-8,45 (1H, м)
МС (ESI) m/e: 432 [M+H]+.
Пример получения 106
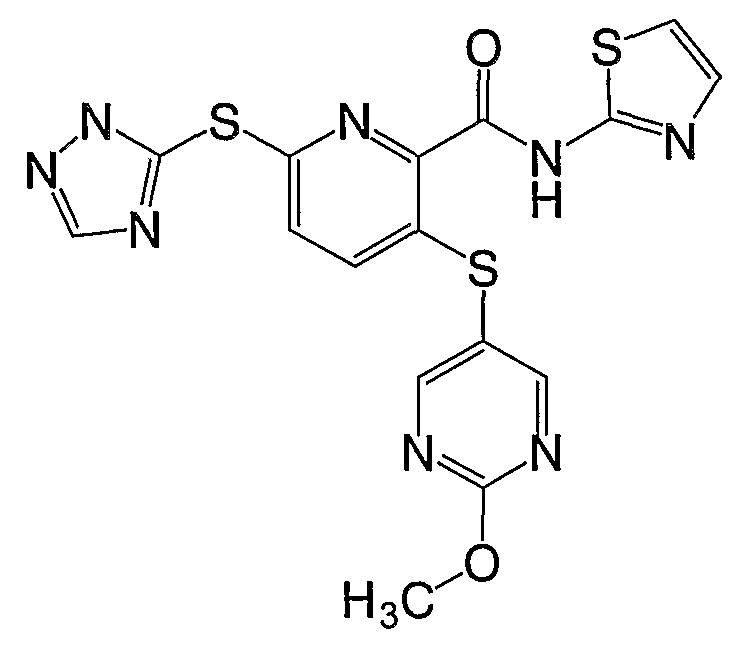
Получение 3-(2-метоксипиримидин-5-илсульфанил)-6-(2Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 106 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 5-иод-2-метоксипиримидина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,10 (3H, c), 7,02 (1H, д, J=8,4 Гц), 7,06 (1H, д, J=3,6 Гц), 7,32 (1H, д, J=8,4 Гц), 7,50 (1H, д, J=3,6 Гц), 8,39 (1H, с), 8,65 (2H, с)
МС (ESI) m/e: 445 [M+H]+.
Пример получения 107
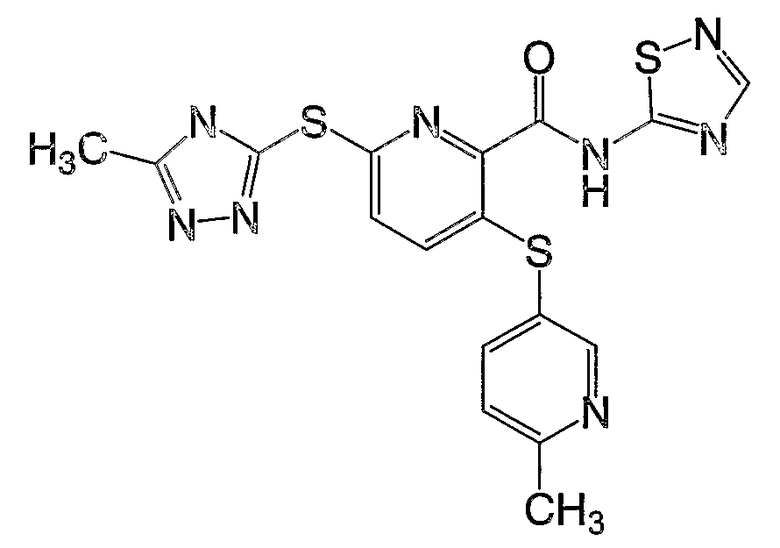
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 107 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-5-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,62 (3H, c), 2,64 (3H, с), 6,99 (1H, д, J=8,8 Гц), 7,20-7,35 (2H, м), 7,77 (1H, дд, J=2,0, 8,0 Гц), 8,35 (1H, c), 8,63 (1H, ушир.с)
МС (ESI) m/e: 443 [M+H]+.
Пример получения 108
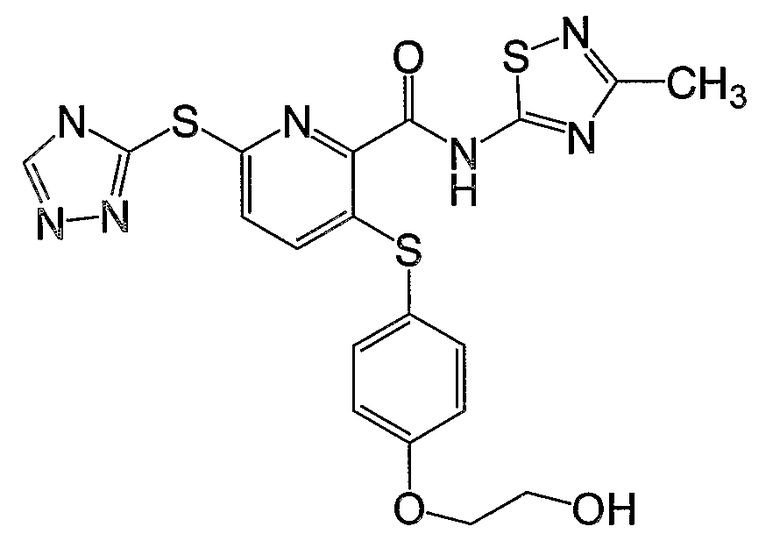
Получение 3-(4-гидроксиэтилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 108 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-гидроксиэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,63 (3H, c), 3,99 (2H, м), 4,13 (2H, м), 7,00-7,08 (3H, м), 7,25 (1H, д, J=8,4 Гц), 7,49 (2H, д, J=8,7 Гц), 8,36 (1H, c)
МС (ESI) m/e: 488 [M+H]+.
Пример получения 109
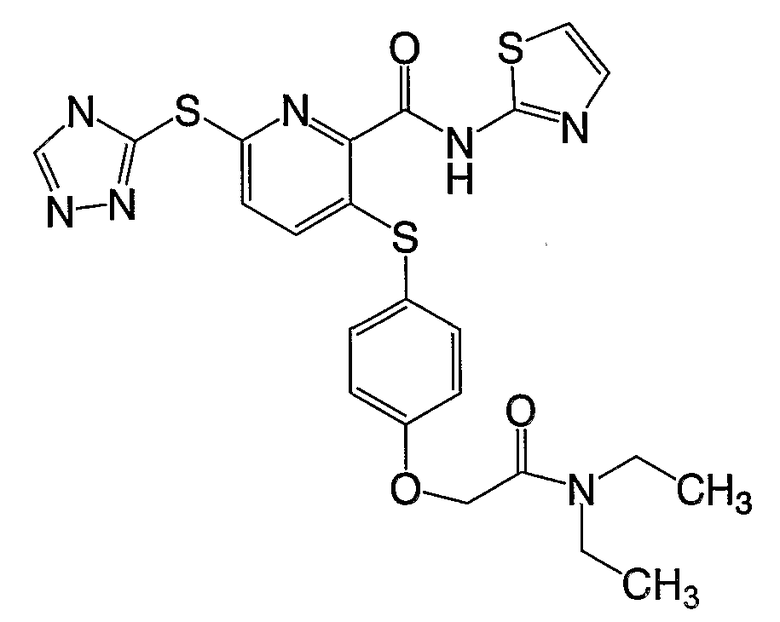
Получение 3-(4-диэтилкарбамоилметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 109 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диэтилкарбамоилметилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,72 (6H, с), 7,02 (1H, д, J=3,6 Гц), 7,03 (1H, д, J=8,0 Гц), 7,20 (1H, д, J=8,0 Гц), 7,44 (1H, д, J=3,6 Гц), 7,66 (2H, д, J=8,4 Гц), 7,78 (2H, д, J=8,4 Гц), 8,31 (1H, с)
МС (ESI) m/e: 542 [M+H]+.
Пример получения 110
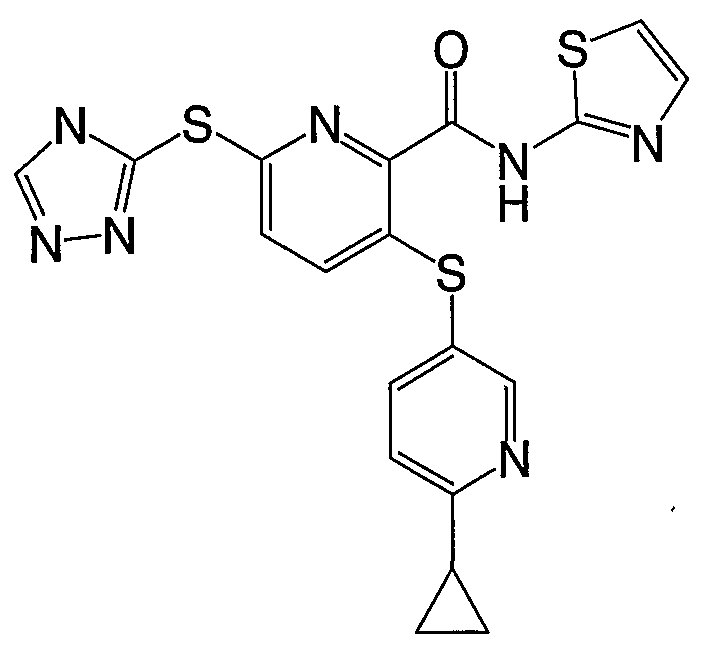
Получение 3-(6-циклопропилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 110 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 6-циклопропил-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 0,70-1,38 (4H, м), 1,98-2,18 (1H, м), 6,96-7,08 (2H, м), 7,46 (1H, д, J=3,2 Гц), 7,70 (1H, дд, J=2,0, 8,4 Гц), 8,36 (1H, с), 8,56 (1H, д, J=2,0 Гц)
МС (ESI) m/e: 453 [M+H]+.
Пример получения 111
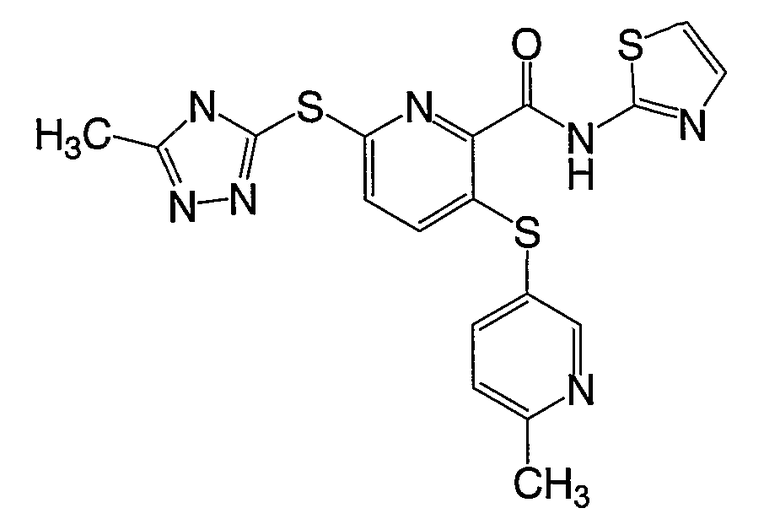
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(5-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 111 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-меркапто-6-метилпиридина и 3-меркапто-5-метил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,57 (3Н, с), 2,64 (3Н, с), 6,96 (1Н, д, J=8,8 Гц), 7,02 (1Н, д, J=3,6 Гц), 7,20 (1Н, д, J=8,8 Гц), 7,25-7,29 (1Н, м), 7,46 (1Н, д, J=3, 6 Гц), 7,76 (1Н, дд, J=2,4, 7,6 Гц), 8,63 (1Н, ушир.с)
МС (ESI) m/е: 442 [М+Н]+.
Пример получения 112
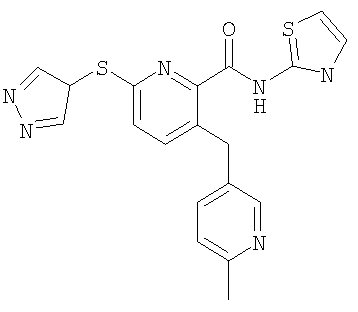
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(пиразол-4-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 112 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-меркапто-6-метилпиридина и 4-меркаптопиразола.
1Н-ЯМР (CDCl3) δ: 2,62 (3H, c), 6,88 (1H, м), 7,05 (1H, м), 7,24 (1H, д, J=8,9 Гц), 7,30-7,68 (3H, м), 7,72 (1H, дд, J=1,1, 8,9 Гц), 7,76-7,82 (1H, м), 8,60 (1H, д, J=1,1 Гц)
МС (ESI) m/e: 427 [M+H]+.
Пример получения 113
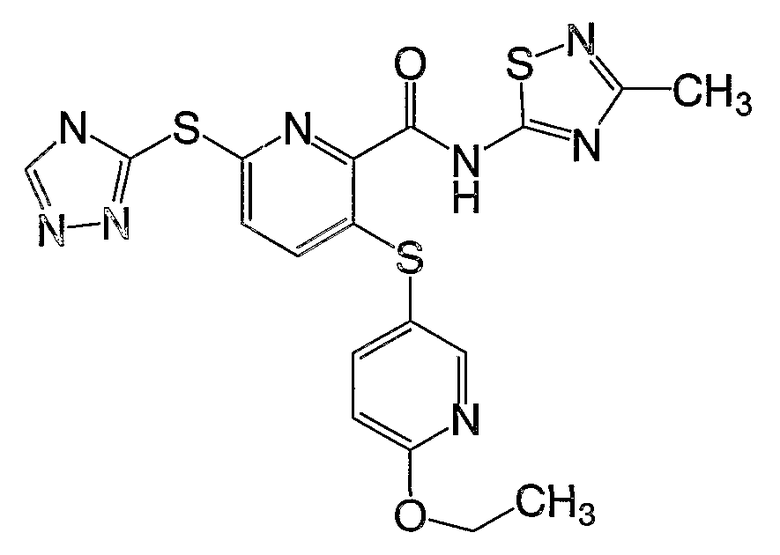
Получение 3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 113 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-гидрокси-1,2,4-тиадиазола, 6-этокси-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,43 (3H, т, J=6,9 Гц), 2,06 (3H, с), 4,42 (2H, кв, J=6,9 Гц), 6,85 (1H, д, J=9,0 Гц), 7,08 (1H, д, J=9,0 Гц), 7,29 (1H, д, J=9,0 Гц), 7,69 (1H, дд, J=9,0, 2,1 Гц), 8,31 (1H, д, J=2,1 Гц), 8,37 (1H, c)
МС (ESI) m/e: 473 [M+H]+.
Пример получения 114
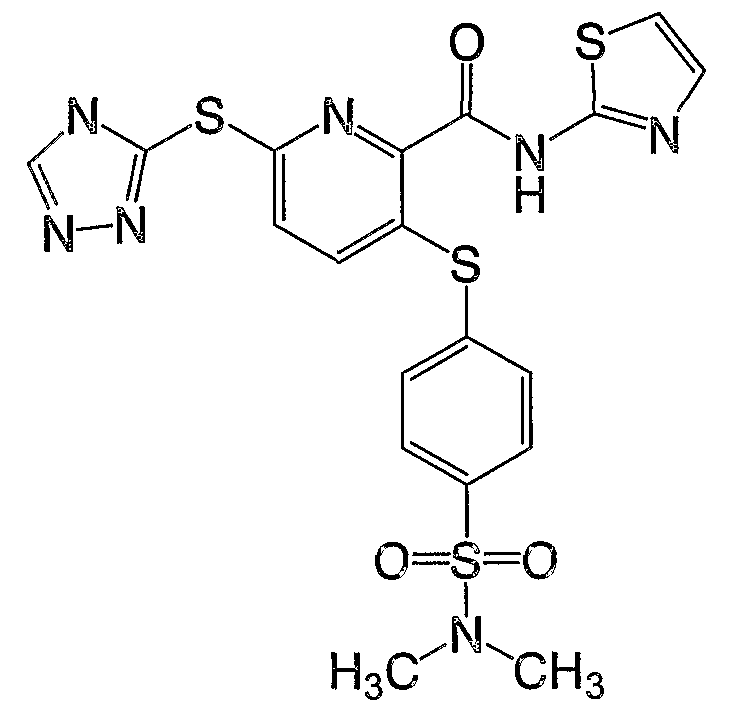
Получение 3-(4-диметиламиносульфонилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 114 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-диметиламиносульфонилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,72 (6H, с), 7,02 (1H, д, J=3,6 Гц), 7,03 (1H, д, J=8,0 Гц), 7,20 (1H, д, J=8,0 Гц), 7,44 (1H, д, J=3,6 Гц), 7,66 (2H, д, J=8,4 Гц), 7,78 (2H, д, J=8,4 Гц), 8,33 (1H, с)
МС (ESI) m/e: 520 [M+H]+.
Пример получения 115
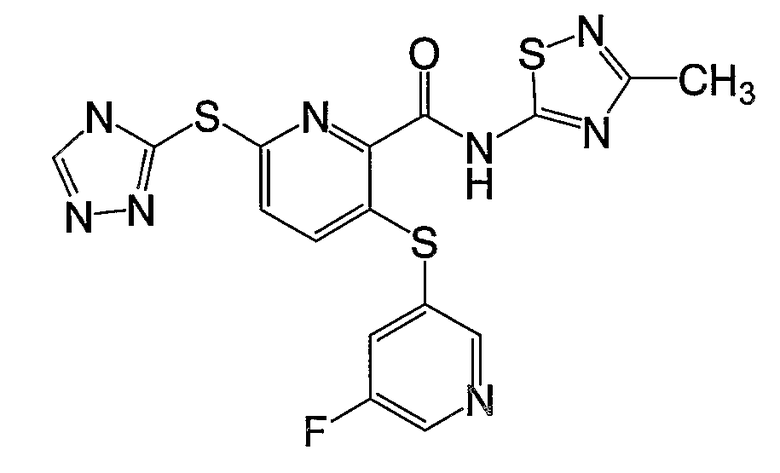
Получение 3-(5-фторпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 115 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 5-фтор-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,59 (3H, с), 7,02 (1H, д, J=8,8 Гц), 7,30 (1H, д, J=8,4 Гц), 7,60-7,75 (1H, м), 8,41 (1H, с), 8,50-8,65 (2H, м)
МС (ESI) m/e: 447 [M+H]+.
Пример получения 116

Получение 3-(2,3-дигидробензофуран-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 116 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(3-метил-1,2,4-тиадиазол-5-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 5-иод-2,3-дигидробензофурана и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,61 (3H, с), 3,25 (2H, т, J=8,4 Гц), 4,65 (2H, т, J=8,4 Гц), 6,85 (1H, д, J=8,4 Гц), 7,05 (1H, д, J=8,4 Гц), 7,06-7,33 (3H, м), 7,78 (1H, дд, J=2,4, 8,5 Гц), 8,31 (1H, c)
МС (ESI) m/e: 470 [M+H]+.
Пример получения 117
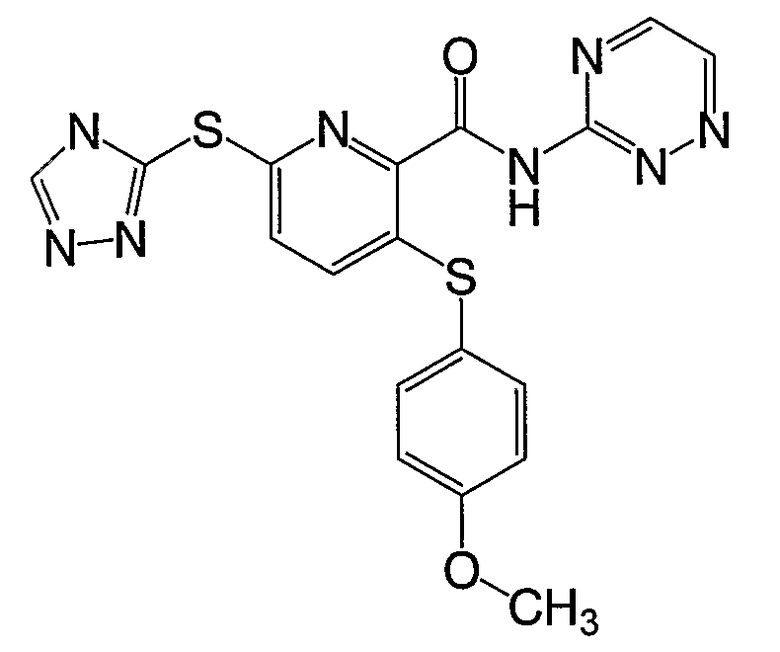
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-([1,2,4]триазин-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 117 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1,2,4-триазина, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,84 (3H, c), 6,95 (2H, д, J=8,8 Гц), 7,00 (1H, д, J=8,8 Гц), 7,17 (1H, д, J=8,8 Гц), 7,44 (2H, д, J=8,8 Гц), 8,40 (1H, с), 8,63 (1H, д, J=2,4 Гц), 8,96 (1H, д, J=2,4 Гц)
МС (ESI) m/e: 439 [M+H]+.
Пример получения 118
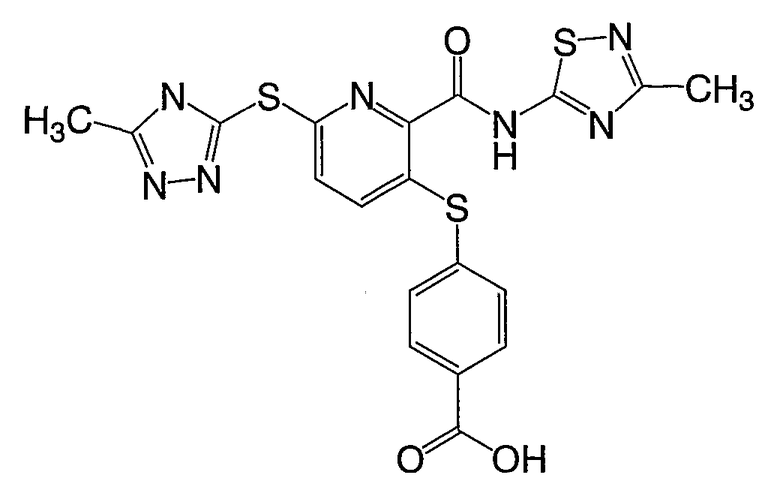
Получение 3-(4-карбоксифенилсульфанил)-6-(5-метил-4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 118 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-карбокситиофенола и 3-меркапто-5-метил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,46 (3Н, с), 2,52 (3Н, с), 7,00 (1Н, д, J=8,8 Гц), 7,13 (1Н, д, J=8,8 Гц), 7,52 (2Н, д, J=7,8 Гц), 8,01 (2Н, д, J=8,0 Гц)
MC (ESI) m/e: 486 [М+Н]+.
Пример получения 119
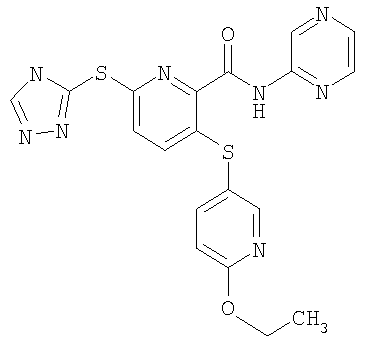
Получение 3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(пиразин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 119 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминопиразина, 6-этокси-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,43 (3Н, т, J=6,9 Гц), 4,41 (2Н, кв, J=6,9 Гц), 6,83 (1Н, д, J=8,7 Гц), 7,06 (1Н, д, J=8,7 Гц), 7,27 (1Н, д, J=8,7 Гц), 7,69 (1Н, м), 8,29-8, 35 (2Н, м), 8,40 (1Н, м), 8,42 (1Н, с), 9,75 (1Н, м)
MC (ESI) m/e: 453 [М+Н]+.
Пример получения 120
Получение 3-(имидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 120 может быть получено способом, описанным в примере получения 66, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 6-хлор-3-(4-метоксифенилметилсульфанил)-N-(3-метил-1,2,4-тиадиазол-5-ил)-2-пиридинкарбоксамида (который может быть получен способом, описанным в примере получения 1), 6-иодимидазо[1,2-a]пиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (ДМСО-d6) δ: 3,30 (3H, c), 7,10-7,40 (3H, м), 7,60-7,80 (2H, м), 7,97 (1H, с), 8,60-8,80 (1H, м), 8,93 (1H, с)
МС (ESI) m/e: 468 [M+H]+.
Пример получения 121
Получение 3-(2-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 121 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-2-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,59 (3H, c), 2,62 (3H, с), 6,84 (1H, д, J=8,8 Гц), 7,20-7,35 (2H, м), 7,80-7,92 (1H, м), 8,43 (1H, с), 8,60-8,68 (1H, м)
МС (ESI) m/e: 443 [M+H]+.
Пример получения 122
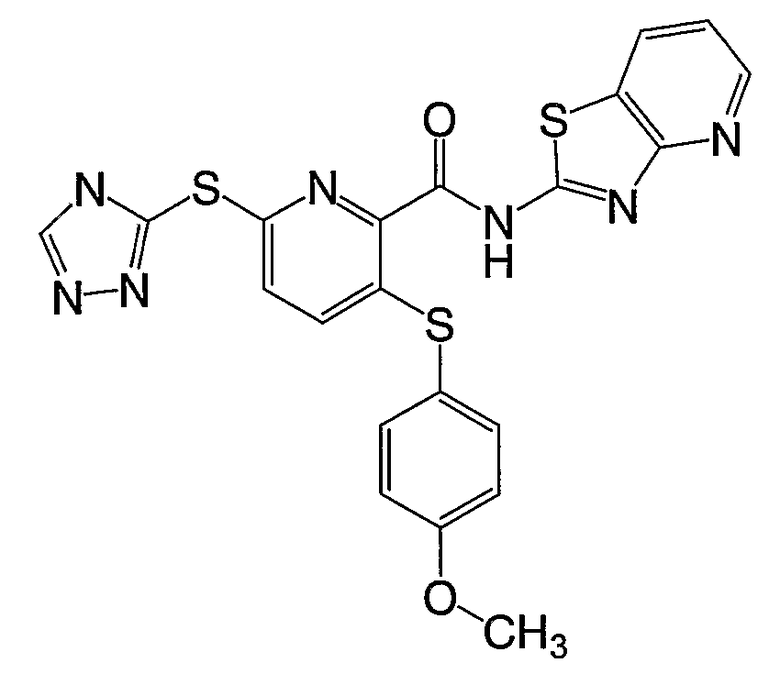
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазоло[4,5-b]пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 122 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазоло[4,5-b]пиридина, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,88 (3H, c), 7,01 (2H, д, J=8,8 Гц), 7,03 (1H, д, J=8,0 Гц), 7,02-7,26 (1H, м), 7,50 (2H, д, J=8,8 Гц), 8,23 (1H, д, J=8,0 Гц), 8,52 (1H, с), 8,59 (1H, c)
МС (ESI) m/e: 494 [M+H]+.
Пример получения 123
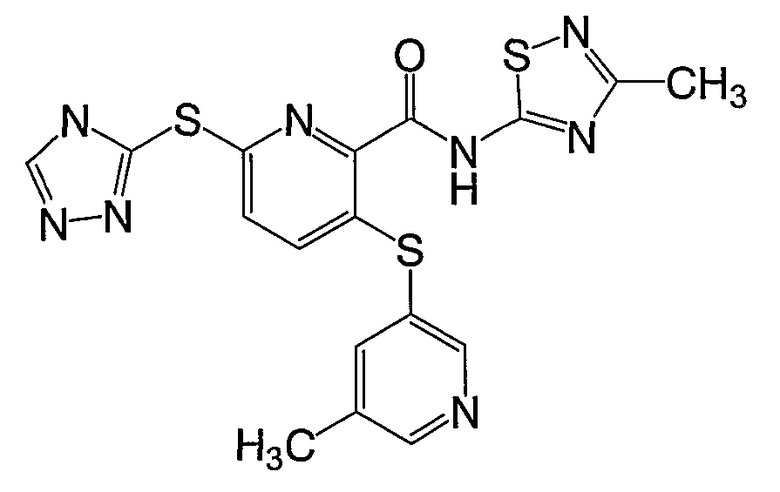
Получение 3-(5-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 123 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-5-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,40 (3H, c), 2,60 (3H, с), 6,99 (1H, д, J=8,4 Гц), 7,22-7,30 (1H, м), 7,71 (1H, c), 8,40 (1H, c), 8,55 (2H, м)
МС (ESI) m/e: 443 [M+H]+.
Пример получения 124
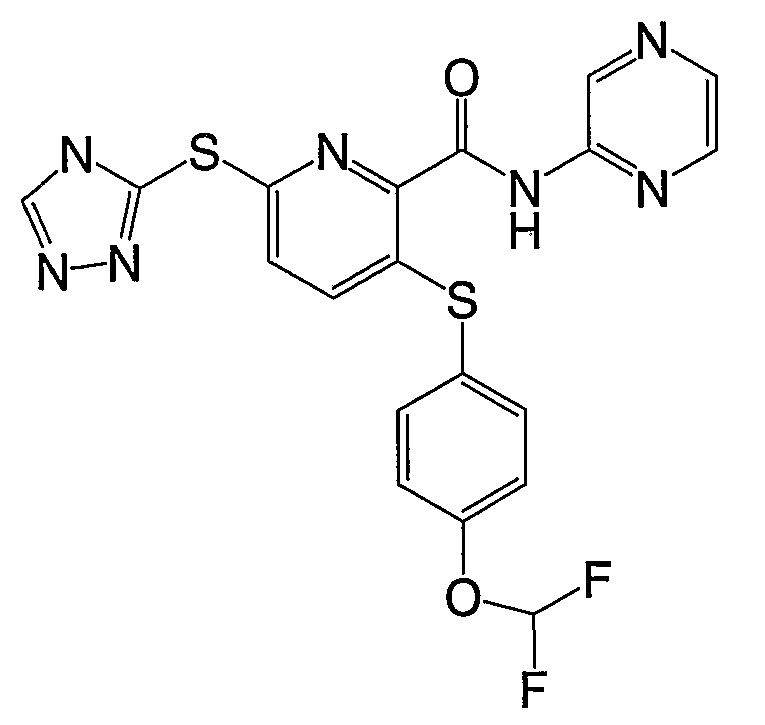
Получение 3-(4,4-дифторметилоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(пиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 124 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминопиридина, 4,4-дифторметилокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,62 (1H, т, J=73 Гц), 7,05 (1H, д, J=9,0 Гц), 7,20-7,30 (3H, м), 7,60 (2H, д, J=8,7 Гц), 8,30-8,43 (2H, м), 8,41 (1H, ушир.с), 9,78 (1H, ушир.с)
МС (ESI) m/e: 474 [M+H]+.
Пример получения 125
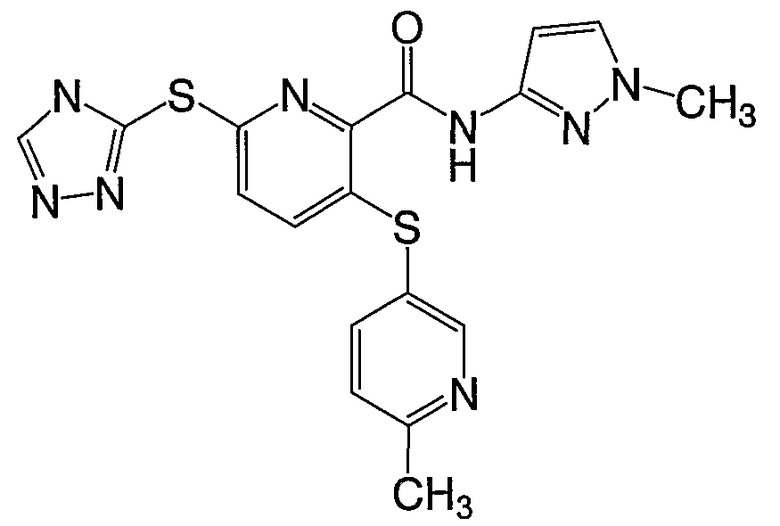
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 125 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,64 (3H, с), 3,89 (3H, c), 6,91 (1H, м), 6,97 (1H, д, J=8,4 Гц), 7,17-7,36 (3H, м), 7,79 (1H, м), 8,31 (1H, c), 8,63 (1H, м)
МС (ESI) m/e: 425 [M+H]+.
Пример получения 126
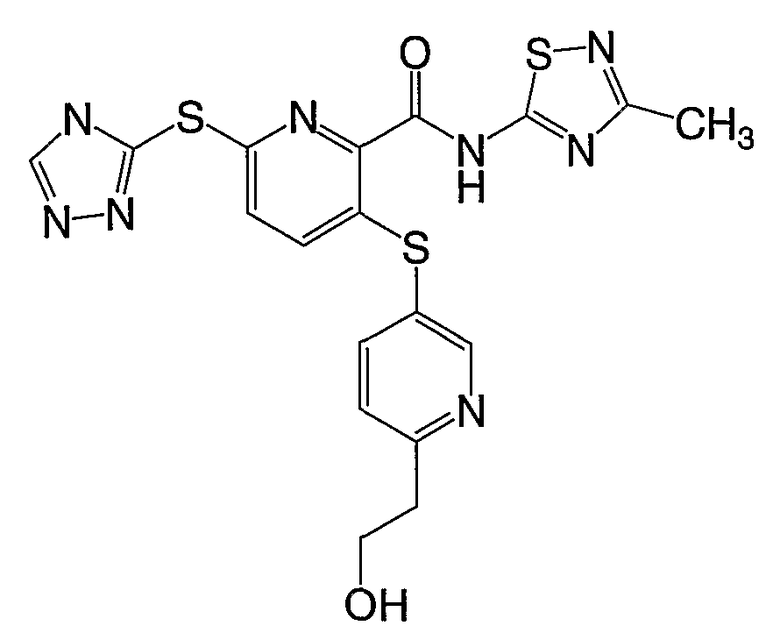
Получение 3-(6-гидроксиэтилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 126 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 6-гидроксиэтил-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,57 (3H, c), 3,04 (2H, т, J=6,0 Гц), 3,97 (2H, т, J=6,0 Гц), 6,98 (1H, д, J=8,8 Гц), 7,20 (1H, д, J=8,8 Гц), 7,30 (1H, д, J=8,0 Гц), 7,78 (1H, дд, J=2,4, 8,0 Гц), 8,32 (1H, с), 8,57 (1H, д, J=2,4 Гц)
МС (ESI) m/e: 473 [M+H]+.
Пример получения 127

Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 127 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-меркапто-1-метил-1Н-[1,2]пиразола, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,85 (3H, с), 6,89 (1H, ушир.с), 6,97 (1H, д, J=8,7 Гц), 7,11-7,21 (3H, м), 7,30 (1H, д, J=8,7 Гц), 7,57 (2H, м), 8,35 (1H, c)
МС (ESI) m/e: 428 [M+H]+.
Пример получения 128
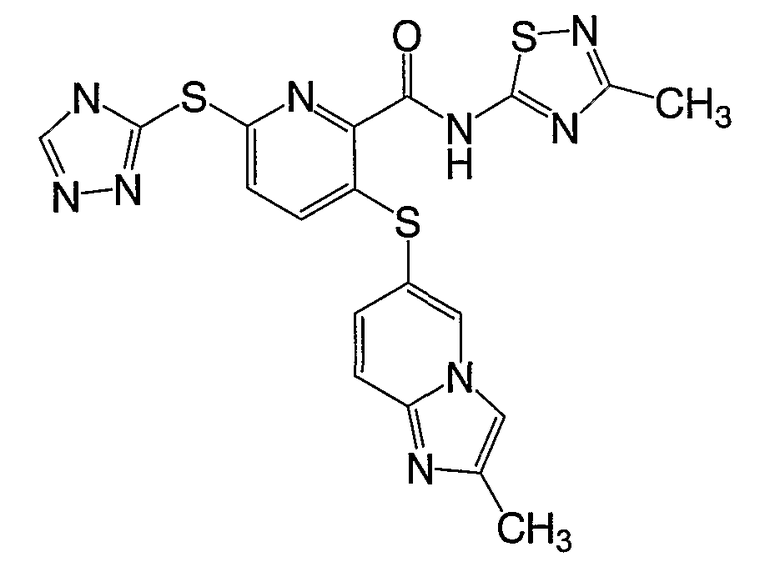
Получение 3-(2-метилимидазо[1,2-a]пиридин-6-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 128 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 6-меркапто-2-метилимидазо[1,2-a]пиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (ДМСО-d6) δ: 2,34 (3H, c), 2,50 (3H, с), 7,10-7,20 (2H, м), 7,28 (1H, д, J=8,4 Гц), 7,49 (1H, д, J=9,2 Гц), 7,70 (1H, c), 8,70 (1H, ушир.c), 8,83 (1H, с)
МС (ESI) m/e: 482 [M+H]+.
Пример получения 129
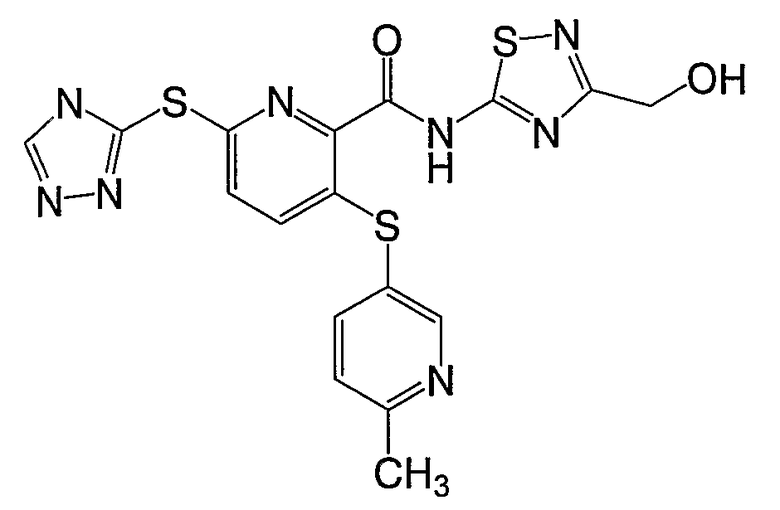
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-гидроксиметил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 129 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,59 (3H, c), 4,65 (2H, с), 6,97 (1H, д, J=8,4 Гц), 7,23 (1H, д, J=8,4 Гц), 7,26 (1H, д, J=7,6 Гц), 7,74 (1H, дд, J=2,0, 7,6 Гц), 8,34 (1H, с), 8,54 (1H, д, J=2,0 Гц)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 130
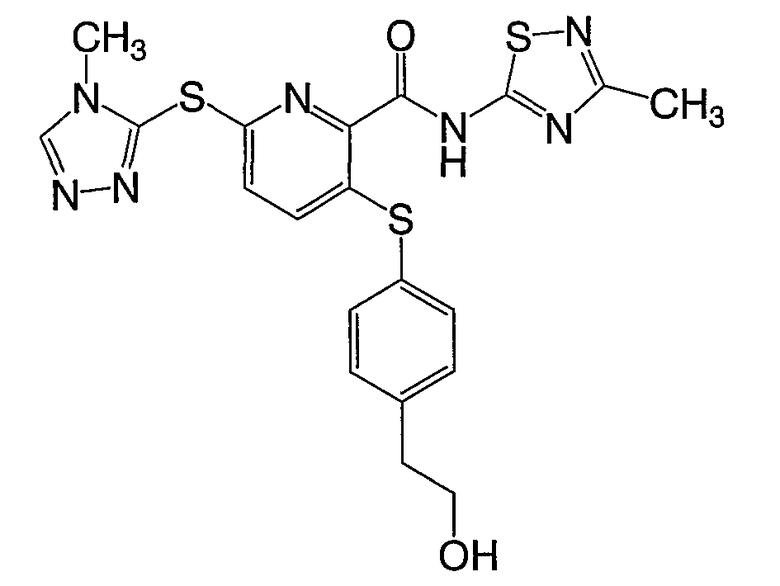
Получение 3-[4-(2-гидроксиэтил)фенилсульфанил]-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 130 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-гидроксиэтилтиофенола и 3-меркапто-4-метил-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,61 (3H, c), 2,93 (2H, т, J=6,4 Гц), 3,72 (3H, с), 3,92 (2H, т, J=6,4 Гц), 7,06 (1H, д, J=8,4 Гц), 7,11 (1H, д, J=8,4 Гц), 7,35 (2H, д, J=8,0 Гц), 7,47 (2H, д, J=8,0 Гц), 8,38 (1H, с)
МС (ESI) m/e: 486 [M+H]+.
Пример получения 131
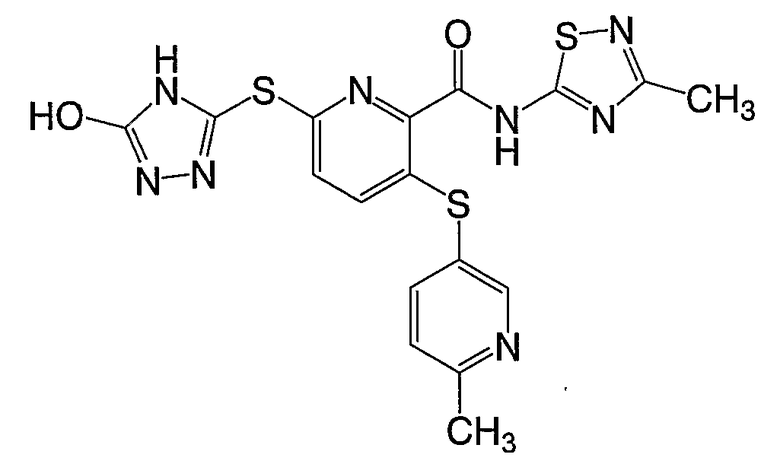
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(5-гидрокси-4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 131 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-6-метилпиридина и 5-гидрокси-3-меркапто-1,2,4-триазола.
1Н-ЯМР (ДМСО-d6) δ: 2,53 (3H, c), 2,65 (3H, с), 7,13-7,71 (3H, м), 7,84-7,98 (1H, м), 8,43-8,63 (1H, м)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 132
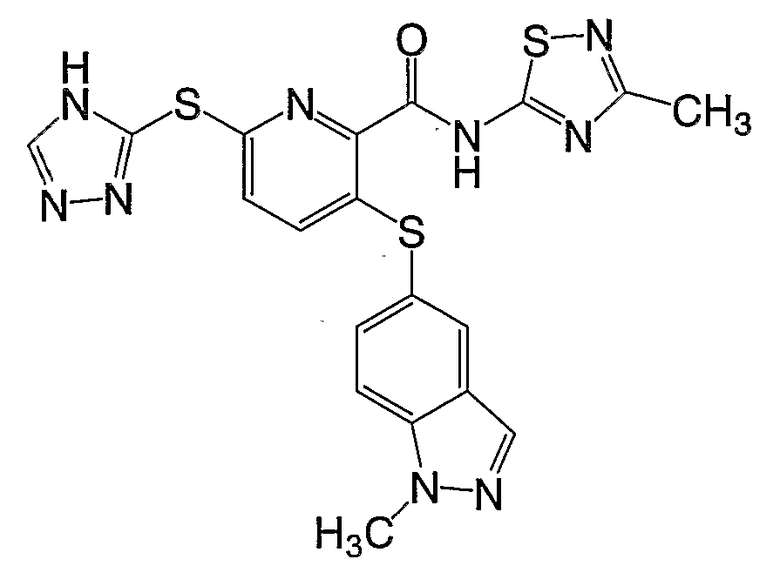
Получение 3-(1-метил-1Н-индазол-5-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 132 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 5-меркапто-1-метил-1Н-индазола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,53 (3H, с), 4,03 (3H, с), 6,87 (1H, д, J=8,8 Гц), 7,06 (1H, д, J=8,8 Гц), 7,39-7,45 (2H, м), 7,94 (2H, м), 8,27 (1H, c)
МС (ESI) m/e: 482 [M+H]+.
Пример получения 133
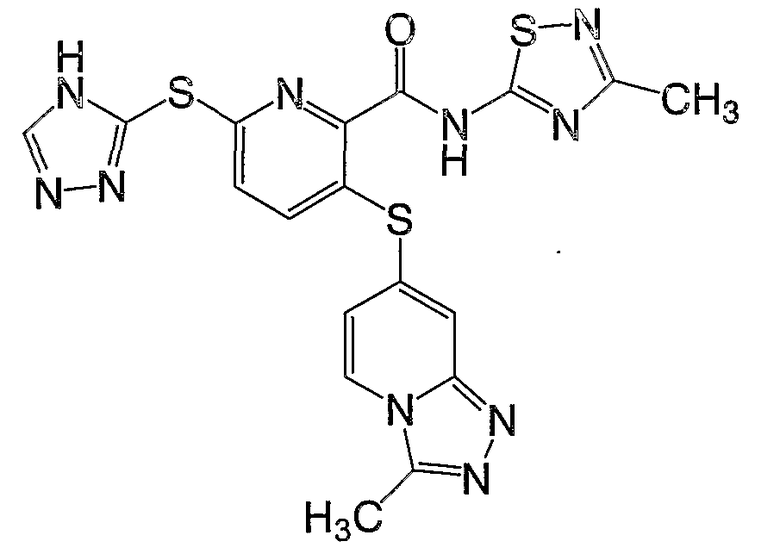
Получение 3-(3-метил[1,2,4]триазоло[4,3-a]пиридин-7-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 133 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-меркапто-1,2,4-тиадиазола, 7-меркапто-3-метил[1,2,4]триазоло[4,3-a]пиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (ДМСО-d6) δ: 2,49 (3H, с), 2,67 (3H, с), 6,82-6,87 (1H, м), 7,19 (1H, д, J=8,8 Гц), 7,57 (1H, д, J=8,8 Гц), 7,86 (1H, с), 8,35 (1H, д, J=7,2 Гц), 8,70-8,90 (1H, ушир.c)
МС (ESI) m/e: 483 [M+H]+.
Пример получения 134
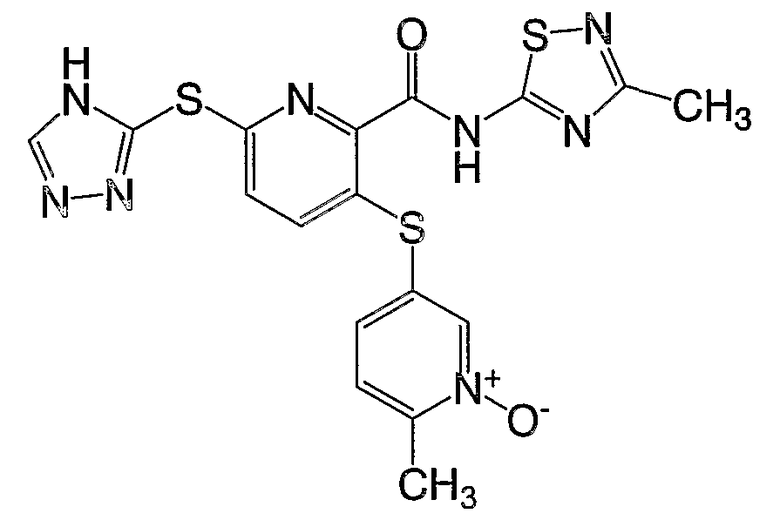
Получение 3-(1-окси-6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 134 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 3-меркапто-6-метил-1-оксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,58 (3H, c), 2,61 (3H, с), 7,16 (1H, д, J=8,4 Гц), 7,32 (1H, д, J=8,4 Гц), 7,40-7,45 (2H, м), 8,38 (1H, c), 8,43 (1H, ушир.с)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 135
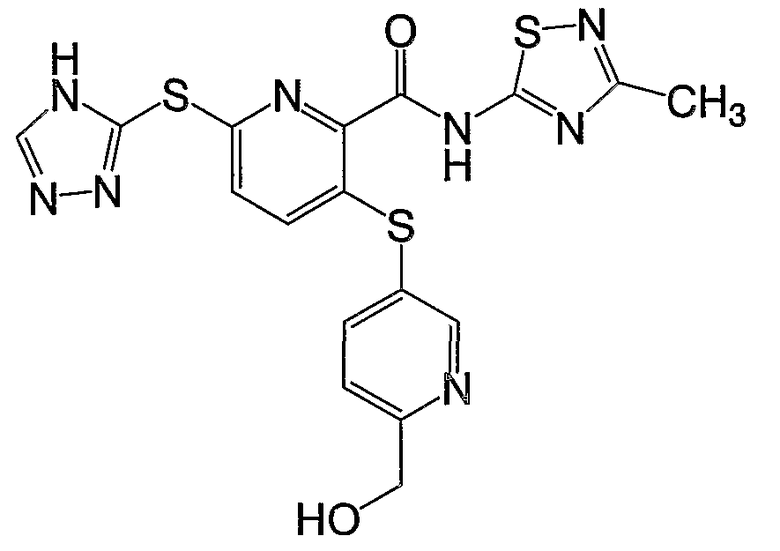
Получение 3-(6-гидроксиметилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 135 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 6-гидроксиметил-3-меркаптопиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,62 (3H, с), 4,80 (2H, с), 7,01 (1H, д, J=8,8 Гц), 7,26 (1H, д, J=8,8 Гц), 7,56 (1H, д, J=8,0 Гц), 7,91 (1H, дд, J=8,0 Гц; 1,2 Гц), 8,36 (1H, с), 8,65 (1H, д, J=1,2 Гц)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 136
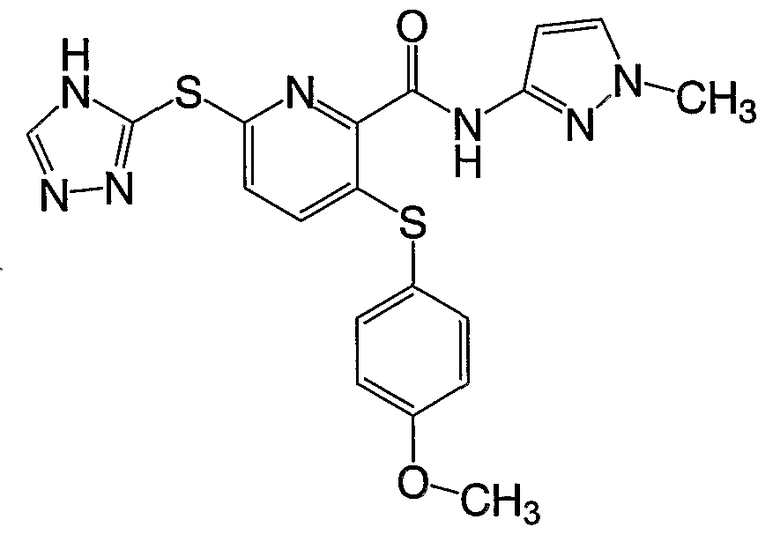
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 136 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,82 (3H, с), 3,83 (3H, с), 6,80 (1H, д, J=2,4 Гц), 6,93 (1H, д, J=8,4 Гц), 6,94 (2H, д, J=8,8 Гц), 7,08 (1H, д, J=8,4 Гц), 7,25 (1H, д, J=2,4 Гц), 7,43 (2H, д, J=8,8 Гц), 8,32 (1H, с)
МС (ESI) m/e: 440 [M+H]+.
Пример получения 137
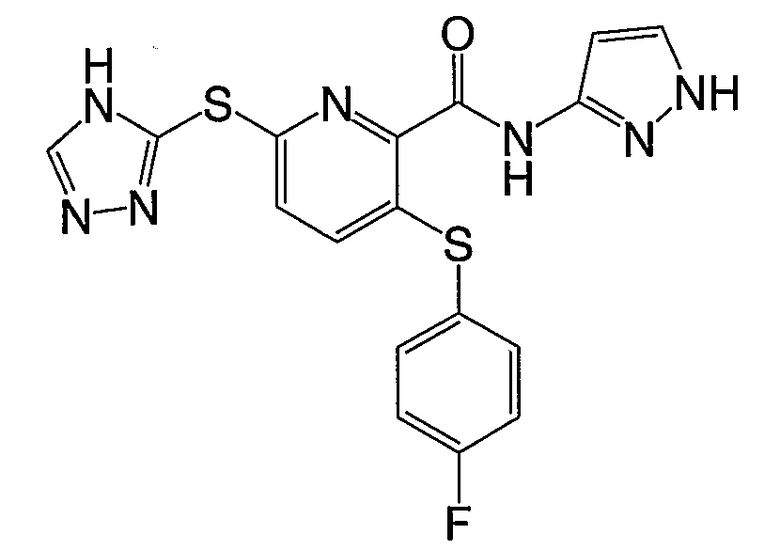
Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 137 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1Н-[1,2]пиразола, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,87 (1H, ушир.с), 6,94 (1H, д, J=8,4 Гц), 7,12-7,18 (3H, м), 7,45-7,53 (3H, м), 8,30 (1H, c)
МС (ESI) m/e: 414 [M+H]+.
Пример получения 138
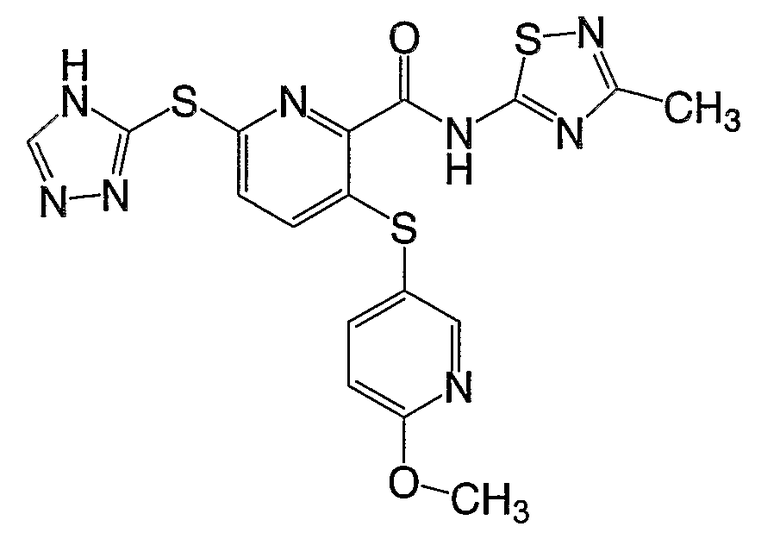
Получение 3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 138 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метилтиадиазола, 3-меркапто-6-метоксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,63 (3H, с), 4,00 (3H, с), 6,88 (1H, д, J=8,7 Гц), 7,07 (1H, д, J=8,7 Гц), 7,29 (1H, д, J=8,7 Гц), 7,70 (1H, дд, J=8,7, 2,1 Гц), 8,31-8,40 (2H, м)
МС (ESI) m/e: 459 [M+H]+.
Пример получения 139
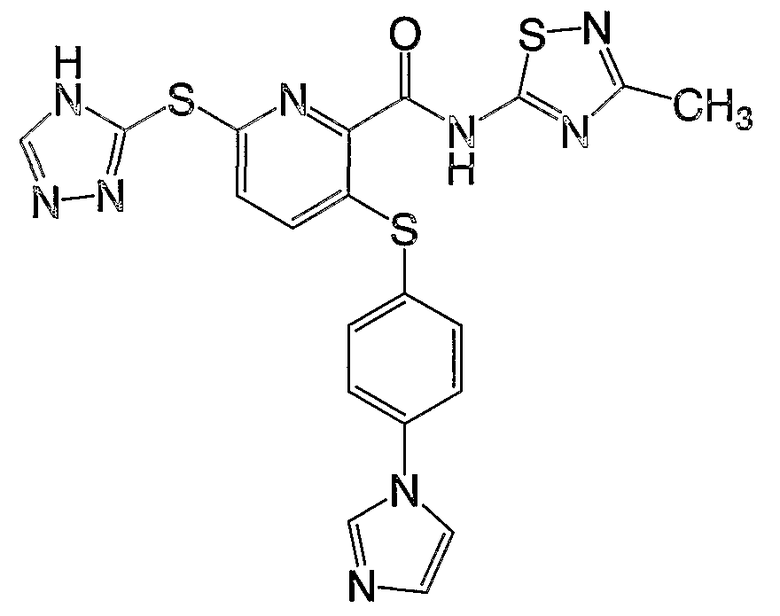
Получение 3-[4-(1Н-имидазол-1-ил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(3-метил[1,2,4]тиадиазол-5-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 139 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 5-амино-3-метил-1,2,4-тиадиазола, 4-(1Н-имидазол-1-ил)тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,57 (3H, с), 7,03 (1H, д, J=8,8 Гц), 7,16 (2H, ушир.с), 7,31 (1H, ушир.с), 7,48 (1H, д, J=8,4 Гц), 7,65 (2H, д, J=8,4 Гц), 7,92 (1H, с), 8,32 (1H, с)
МС (ESI) m/e: 494 [M+H]+.
Пример получения 140
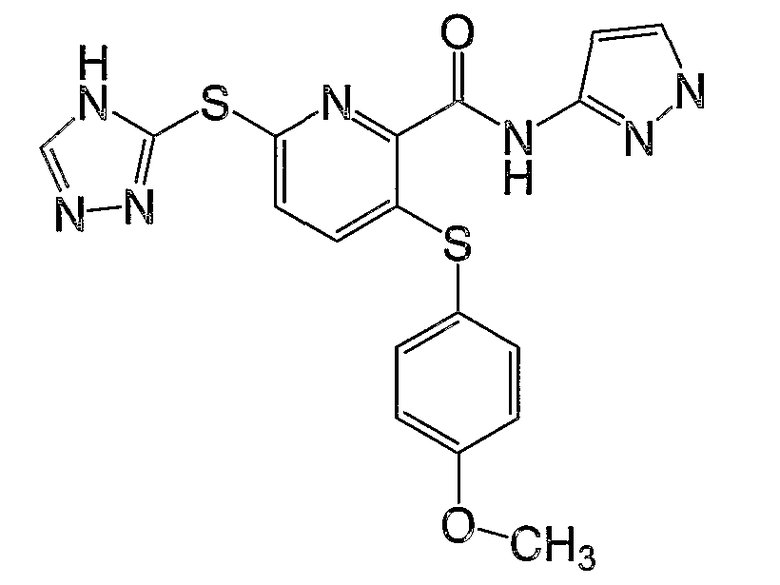
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 140 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1Н-[1,2]пиразола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 6,86 (1H, д, J=2,6 Гц), 6,98 (2H, д, J=8,8 Гц), 6,99 (1H, д, J=8,8 Гц), 7,17 (1H, д, J=8,8 Гц), 7,47 (2H, д, J=8,8 Гц), 7,50 (1H, д, J=2,6 Гц), 8,34 (1H, с)
МС (ESI) m/e: 426 [M+H]+.
Пример получения 141

Получение 3-(6-метоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 141 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-пиразола, 3-меркапто-6-метоксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,81 (3H, c), 3,95 (3H, с), 6,76 (1H, д, J=2,4 Гц), 6,80 (1H, д, J=8,4 Гц), 6,93 (1H, д, J=8,4 Гц), 7,10 (1H, д, J=8,4 Гц), 7,25 (1H, д, J=2,4 Гц), 7,65 (1H, дд, J=8,4 Гц, 2,0 Гц), 8,28 (1H, д, J=2,0 Гц), 8,36 (1H, с), 10,11 (1H, с)
МС (ESI) m/e: 441 [M+H]+.
Пример получения 142
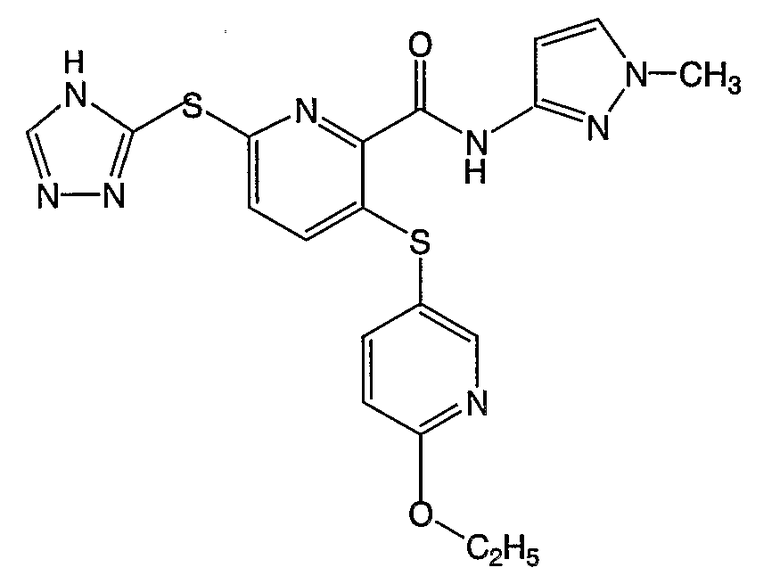
Получение 3-(6-этоксипиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 142 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-пиразола, 3-меркапто-6-этоксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,43 (3H, т, J=6,9 Гц), 3,87 (3H, с), 4,42 (2H, кв, J=6,9 Гц), 6,83 (1H, д, J=8,7 Гц), 6,93 (1H, д, J=2,1 Гц), 7,02 (1H, д, J=8,7 Гц), 7,22 (1H, д, J=8,7 Гц), 7,32 (1H, д, J=2,1 Гц), 7,69 (1H, дд, J=8,7, 2,4 Гц), 8,25-8,39 (2H, м)
МС (ESI) m/e: 455 [M+H]+.
Пример получения 143
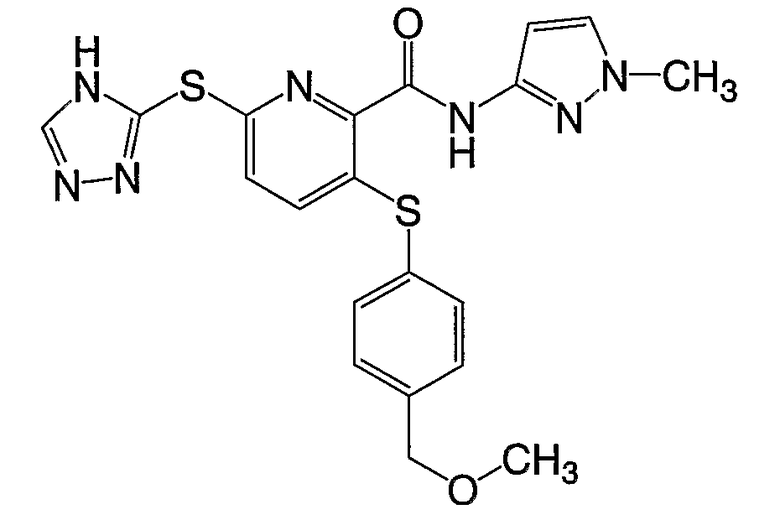
Получение 3-(4-метоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 143 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-пиразола, 4-метоксиметилтиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,45 (3H, с), 3,82 (3H, c), 4,49 (2H, c), 6,83 (1H, д, J=2,0 Гц), 6,96 (1H, д, J=8,8 Гц), 7,09 (2H, д, J=8,8 Гц), 7,25 (1H, д, J=2,0 Гц), 7,40 (2H, д, J=7,6 Гц), 7,51 (2H, д, J=7,6 Гц), 8,31 (1H, c), 10,14 (1H, c)
МС (ESI) m/e: 440 [M+H]+.
Пример получения 144

Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4,5-диметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 144 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4,5-диметилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,29 (3H, с), 2,33 (3H, c), 3,87 (3H, c), 6,98-7,03 (3H, м), 7,21 (1H, д, J=8,6 Гц), 7,48 (2H, д, J=8,6 Гц), 8,29 (1H, c)
МС (ESI) m/e: 471 [M+H]+.
Примеры получения 145
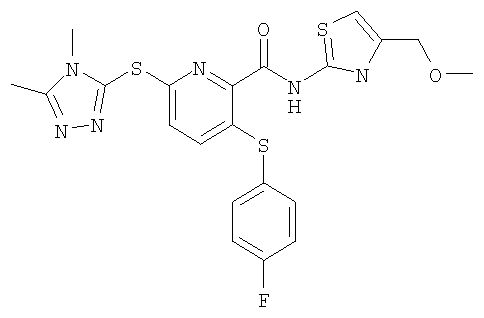
Получение 3-(4-фторфенилсульфанил)-6-(4,5-диметил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-метоксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 145 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-метоксиметилтиазола, 4-фтортиофенола и 3-меркапто-4,5-диметил-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 2,60 (3Н, с), 3,47 (3Н, с), 3,62 (3Н, с), 4,50 (2Н, с), 6,93 (1Н, с), 6,98 (1Н, д, J=8,8 Гц), 7,07 (1Н, д, J=8,8 Гц), 7,16 (2Н, дд, J=8,8, 8,8 Гц), 7,53 (2Н, дд, J=5,2, 8,8 Гц)
МС (ESI) m/е: 503 [М+Н]+.
Пример получения 146
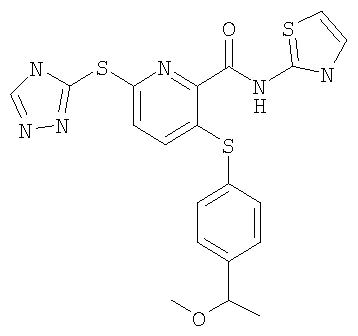
Получение 3-(4-(1-метоксиэтил)фенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 146 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-(1-метоксиэтил)тиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 1,27 (3Н, д, J=6,4 Гц), 3,30 (3Н, с), 4,36 (1Н, д, J=6,4 Гц), 7,03 (1Н, д, J=3,6 Гц), 7,05 (1Н, д, J=8,8 Гц), 7,23 (1Н, д, J=8,8 Гц), 7,41 (2Н, д, J=8,0 Гц), 7,47 (1Н, д, J=3,6 Гц), 7,54 (2Н, д, J=8,0 Гц), 8,35 (1Н, с)
MC (ESI) m/e: 471 [М+Н]+.
Пример получения 147
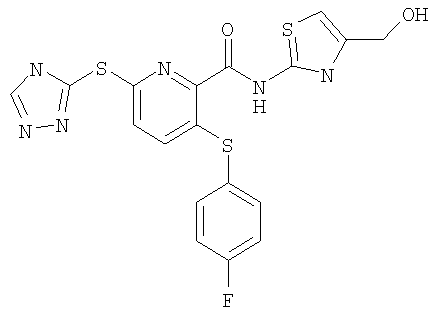
Получение 3-(4-фторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-гидроксиметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 147 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-гидроксиметилтиазола, 4-фтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,60 (2Н, с), 6,84 (1Н, с), 6,93 (1Н, д, J=8,8 Гц), 7,06-7,16 (3Н, м), 7,40-7,60 (2Н, м), 8,31 (1Н, с)
МС (ESI) m/е: 461 [М+Н]+.
Пример получения 148
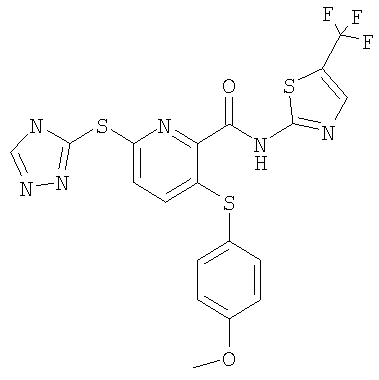
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(5-трифторметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 148 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-5-трифторметилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,86 (3Н, с), 6,97-7,05 (3Н, м), 7,22-7,27 (1Н, м), 7,47 (2Н, д, J=8,8 Гц), 7,80 (1Н, с), 8,39 (1Н, с)
МС (ESI) m/е: 509 [М+Н]+.
Пример получения 149
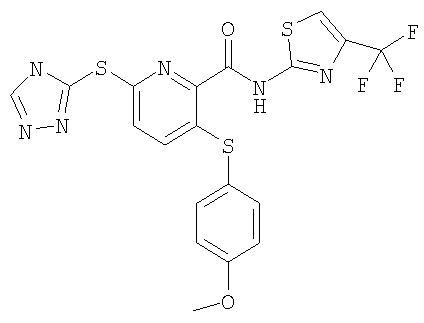
Получение 3-(4-метоксифенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(4-трифторметилтиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 149 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3, 6-дихлор-2-пиридинкарбоновой кислоты, 2-амино-4-трифторметилтиазола, 4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,85 (3Н, с), 6,96-7,00 (3Н, м), 7,17 (1Н, д, J=8,0 Гц), 7,44-7,47 (3Н, м), 8,37 (1Н, с)
MC (ESI) m/e: 511 [М+Н]+.
Пример получения 150
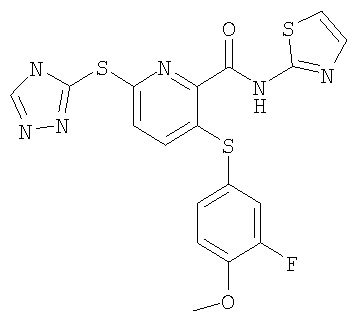
Получение 3-(3-фтор-4-метоксифенилсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 150 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 3-фтор-4-метокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,95 (3Н, с), 7,01-7,06 (3Н, м), 7,23-7,32 (3Н, м), 7,47 (1Н, д, J=4,0 Гц), 8,32 (1Н, с)
MC (ESI) m/e: 461 [М+Н]+.
Пример получения 151
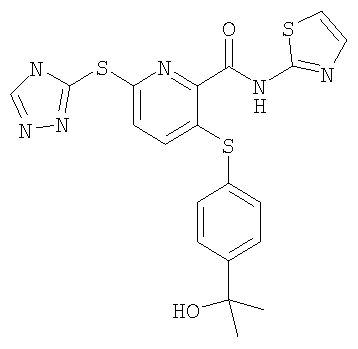
Получение 3-[4-(1,1-диметил-1-гидроксиметил)фенилсульфанил]-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(тиазол-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 151 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-аминотиазола, 4-(1,1-диметил-1-гидроксиметил)тиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,63 (6Н, с), 6,99-7,03 (2Н, м), 7,18 (1Н, д, J=8,4 Гц), 7,39 (1Н, д, J=3, 6 Гц), 7,51 (2Н, д, J=8,4 Гц), 7,58 (2Н, д, J=8,4 Гц), 8,30 (1Н, с)
МС (ESI) m/е: 471 [М+Н]+.
Пример получения 152
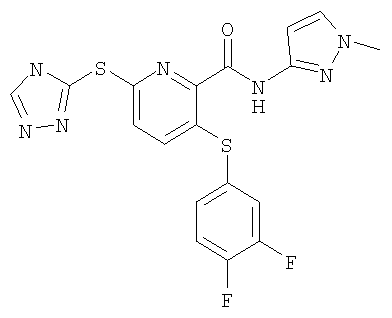
Получение 3-(3,4-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 152 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 3,4-дифтортиофенола и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) S: 3,84 (3Н, с), 6,82 (1Н, д, J=2,0 Гц), 6,94 (1Н, д, J=8,8 Гц), 7,15 (1Н, д, J=8,8 Гц), 7,20-7,41 (4Н, м), 8,33 (1Н, с)
MC (ESI) m/e: 446 [М+Н]+.
Пример получения 153
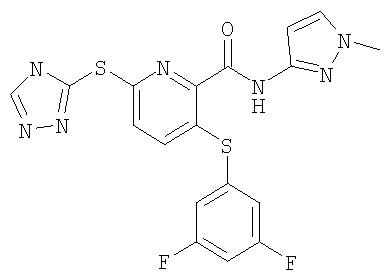
Получение 3-(3,5-дифторфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 153 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 3,4-дифтортиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,81 (3Н, с), 6,81 (1Н, д, J=2,8 Гц), 6,83-6,90 (1Н, м), 7,04-7,06 (2H, м), 7,16 (1Н, д, J=8,8 Гц), 7,27 (1Н, д, J=2,8 Гц), 8,27 (1Н, с)
МС (ESI) m/е: 446 [М+Н]+.
Пример получения 154
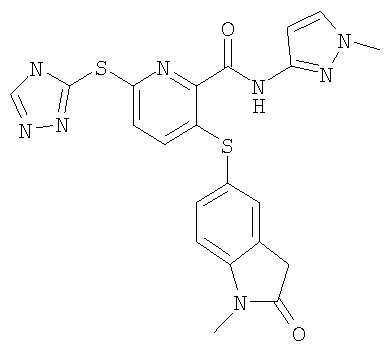
Получение 3-(1-метил-2-оксо-2,3-дигидро-1Н-индол-5-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 154 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 5-меркапто-1-метил-1,3-дигидроиндол-2-она и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 3,15 (3Н, с), 3,48 (2Н, с), 3,76 (3Н, с), 6,75 (1Н, д, J=2,4 Гц), 6,83 (1Н, д, J=8,0 Гц), 6,88 (1Н, д, J=8,8 Гц), 7,02 (1Н, д, J=8,8 Гц), 7,23 (1Н, д, J=2,4 Гц), 7,31 (1Н, д, J=1,6 Гц), 7,41 (1Н, дд, J=8,0, 1,6 Гц), 8,22 (1Н, с)
МС (ESI) m/е: 479 [М+Н]+.
Пример получения 155
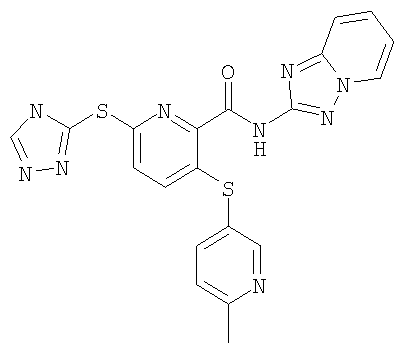
Получение 3-(6-метилпиридин-3-илсульфанил)-6-(4Н-[1,2,4]-триазол-3-илсульфанил)-N-([1,2,4]триазолопиридин-2-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 155 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 2-амино[1,2,4]триазолопиридина, 3-меркапто-6-метилпиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 2,58 (3Н, с), 6,93 (1Н, д, J=8,8 Гц), 7,01 (1Н, т, J=6,4 Гц), 7,16 (1Н, д, J=8,8 Гц), 7,24 (1Н, д, J=8,0 Гц), 7,51-7,60 (2Н, м), 7,73 (1Н, дд, J=8,0, 2,4 Гц), 8,32 (1Н, с), 8,53 (1Н, с), 8,60 (1Н, д, J=6,4 Гц)
MC (ESI) m/e: 462 [М+Н]+.
Пример получения 156
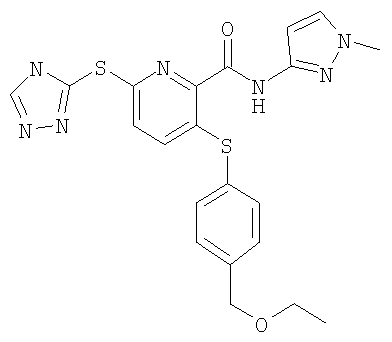
Получение 3-(4-этоксиметилфенилсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 156 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 4-этоксиметилтиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 1,28 (3Н, т, J=6,8 Гц), 3,60 (2Н, кв, J=6,8 Гц), 3,83 (3Н, с), 4,54 (2Н, с), 6,85 (1Н, д, J=2,0 Гц), 6,98 (1Н, д, J=8,8 Гц), 7,10 (1Н, д, J=8,8 Гц), 7,26 (1Н, д, J=2,0 Гц), 7,41 (2Н, д, J=8,0 Гц), 7,51 (2Н, д, J=8,0 Гц), 8,31 (1Н, с)
МС (ESI) m/е: 468 [М+Н]+.
Пример получения 157
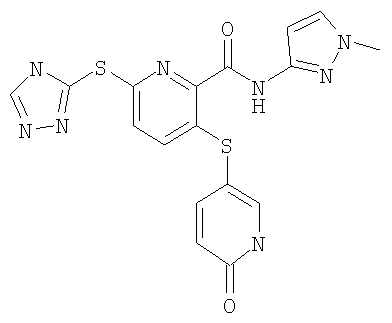
Получение 3-(6-оксо-1,6-дигидропиридин-3-илсульфанил)-6-(4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 157 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 3-меркапто-6-метоксипиридина и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,86 (3Н, с), 6,63 (1Н, д, J=9,3 Гц), 6,85 (1Н, д, J=2,1 Гц), 7,21 (1Н, д, J=9,0 Гц), 7,27 (1Н, д, J=9,0 Гц), 7,33 (1Н, м), 7,45 (1Н, ушир.д, J=9,3 Гц), 7,58 (1Н, д, J=2,1 Гц), 8,35 (1Н, с)
MC (ESI) m/e: 427 [М+Н]+.
Пример получения 158
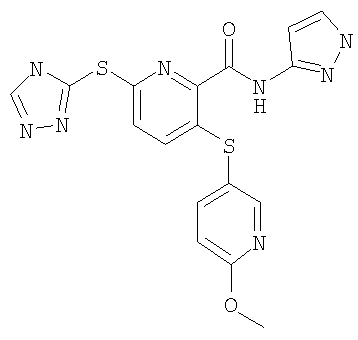
Получение 3-(6-метоксипиридин-3-илсульфанил)-6-(4H-[1,2,4]триазол-3-илсульфанил)-N-(1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 158 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 3-меркапто-6-метоксипиридина и 3-меркапто-1,2,4-триазола.
1Н-ЯМР (CDCl3) δ: 4,00 (3Н, с), 6,84-6,94 (2Н, м), 7,02 (1Н, д, J=9,0 Гц), 7,22 (1Н, д, J=9,0 Гц), 7,52 (1Н, м), 7,70 (1Н, м), 8,31-8,40 (2Н, м)
MC (ESI) m/e: 427 [М+Н]+.
Пример получения 159
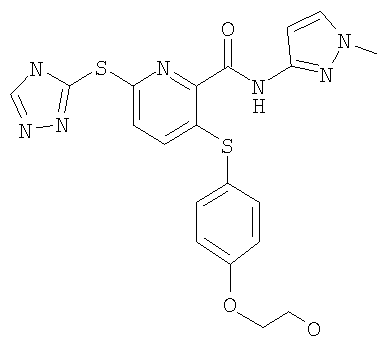
Получение 3-(4-гидроксиэтилоксифенилсульфанил)-6-(4-метил-4Н-[1,2,4]триазол-3-илсульфанил)-N-(1-метил-1Н-[1,2]пиразол-3-ил)-2-пиридинкарбоксамида
Соединение согласно примеру получения 159 может быть получено способом, описанным в примере получения 1, соответствующим ему способом или комбинацией их и стандартных способов, с использованием 3,6-дихлор-2-пиридинкарбоновой кислоты, 3-амино-1-метил-1Н-[1,2]пиразола, 4-гидроксиэтилокситиофенола и 3-меркапто-1,2,4-триазола.
1H-ЯМР (CDCl3) δ: 3,73 (3Н, с), 3,85 (3Н, с), 4,00 (2Н, м), 4,13 (2Н, м), 6,87 (1Н, д, J=2,l Гц), 6,95-7,06 (3Н, м), 7,24-7,31 (2Н, м), 7,46 (2Н, д, J=8,7 Гц), 8,41 (1Н, с)
МС (ESI) m/е: 484 [М+Н]+.
Ниже приводятся способы получения соединений, используемых для получения соединений согласно настоящему изобретению, в виде справочных примеров 1-6.
Справочный пример 1
Получение 5-метоксиметил-3-меркапто-1,2,4-триазола
Метоксиацетилхлорид (2,82 г; 0,023 моль) добавляют к раствору (15 мл) 2,09 г (0,0230 моль) тиосемикарбазида в пиридине с последующим перемешиванием в течение целого дня и ночи при комнатной температуре. Реакционный раствор концентрируют и к остатку добавляют 10 мл метанола и 8 мл 25 мас.%-ного метанольного раствора метилата натрия, после чего кипятят с обратным холодильником в течение целого дня и ночи. После охлаждения до комнатной температуры растворитель выпаривают и к остатку для подкисления добавляют концентрированную соляную кислоту. Выделившееся твердое вещество отфильтровывают, промывают дистиллированной водой и высушивают, получая 1,0 г (выход: 33%) указанного в заголовке соединения.
1H-ЯМР (ДМСО) δ: 3,24 (3Н, с), 4,29 (2Н, с)
MC (ESI) m/e: 146 [М+Н]+.
Справочный пример 2
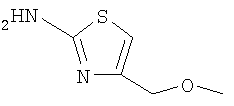
Получение 2-амино-4-метоксиметилтиазола
К раствору (120 мл) 13,4 г (106 ммоль) дихлорацетона добавляют 8,06 г (106 ммоль) тиомочевины, после чего перемешивают при температуре 55°С в течение 3 часов. Реакционный раствор концентрируют и к полученному твердому веществу белого цвета добавляют 200 мл метанола и 15,1 г (125 ммоль) сульфата магния, после чего кипятят с обратным холодильником в течение 3 дней. Реакционную смесь фильтруют через целит и фильтрат концентрируют и распределяют между хлороформом и насыщенным водным раствором гидрокарбоната натрия. Затем органический слой сушат и концентрируют, полученный остаток очищают колоночной хроматографией на силикагеле (этилацетат) и кристаллизацией из смешанного растворителя, состоящего из гексана и этилацетата (4:1), получая 6,59 г (выход: 43%) указанного в заголовке соединения в виде твердого вещества желтого цвета.
1H-HMP (CDCl3) δ: 3,44 (3Н, с), 4,34 (2Н, с), 6,45 (1Н, с)
МС (ESI) m/е: 145 [М+Н]+.
Справочный пример 3
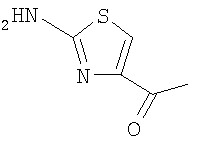
Получение 4-ацетил-2-аминотиазола К раствору (30 мл) 1,30 г (5,14 ммоль) 2-(трет-бутилоксикарбониламино)-4-карбокситиазола в N, N-диметилформамиде последовательно добавляют 660 мг (6,77 ммоль) N,O-диметилгидроксиламингидрохлорида, 1,40 мл (9,96 ммоль) триэтиламина, 1,10 г (8,14 ммоль) N-гидроксибензотриазолгидрата и 1,60 г (8,35 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида, после чего перемешивают при комнатной температуре в течение 5 дней. Реакционный раствор концентрируют, к остатку добавляют этилацетат и смесь промывают с помощью 1н. водного раствора хлороводорода, воды и насыщенного водного раствора хлорида натрия, сушат и концентрируют в вакууме, получая 1,35 г (выход: 91%) амидного соединения в виде маслянистого вещества. Раствор (40 мл) 920 г (3,20 ммоль) полученного амидного соединения в тетрагидрофуране охлаждают дотемпературы -78°С и к нему добавляют 18,0 мл (18,0 ммоль) раствора метиллития в диэтиловом эфире, после чего перемешивают в течение 7 дней. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония, после чего экстрагируют этилацетатом. Органический слой промывают водой, сушат и концентрируют, получая 666 мг (выход: 86%) ацетильного соединения в виде маслянистого вещества.
К раствору (10 мл) вышеполученного ацетильного соединения в хлороформе добавляют трифторуксусную кислоту (5 мл), затем перемешивают при комнатной температуре в течение полутора часов. Реакционный раствор концентрируют, нейтрализуют с помощью насыщенного водного раствора гидрокарбоната натрия и фильтруют, получая 149 мг (выход: 59%) указанного в заголовке соединения в виде твердого вещества белого цвета.
1H-ЯМР (CDCl3) δ: 2,48 (3Н, с), 7,35 (1Н, с)
MC (ESI) m/e: 143 [М+Н]+.
Справочный пример 4
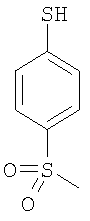
Получение 4-метилсульфонилбензолтиола
35%-ный Водный раствор пероксида водорода (18 мл) и 180 мг (0,72 ммоль) метилтриоксола добавляют к раствору (150 мл) 5,0 г (36 ммоль) 4-метилтиофенола в хлороформе, после чего перемешивают при комнатной температуре в течение 30 минут. К реакционному раствору при охлаждении льдом добавляют диоксид марганца, затем перемешивают при комнатной температуре в течение 4 часов и добавляют насыщенный водный раствор хлорида натрия, после чего экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат и концентрируют, получая 5,0 г (выход: 81%) 4-метилсульфонилфенола в виде твердого вещества белого цвета.
1,4-Диазабицикло[2,2,2]октан (6,5 г; 58 ммоль) и 5,4 г (44 ммоль) диметилтиокарбамоилхлорида добавляют к раствору (100 мл) 5,0 г (29 ммоль) полученного 4-метилсульфонилфенола в N,N-диметилформамиде, после чего перемешивают при температуре 75°С в течение 4 часов. К реакционному раствору добавляют воду, после чего экстрагируют этилацетатом. Органический слой промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Полученный после высушивания и концентрирования остаток перекристаллизовывают из смеси растворителей, состоящей из гексана и хлороформа, получая 4,8 г (выход: 63%) О-4-метилсульфонилфенилдиметилтиокарбамата в виде твердого вещества белого цвета.
Полученный О-4-метилсульфонилфенилдиметилтиокарбамат (4,8 г; 18 ммоль) перемешивают в течение 10 часов при температуре 180°С и, после возврата к комнатной температуре, добавляют 10 мл метанола. К реакционному раствору добавляют 10 мл 2н. водного раствора гидроксида натрия, после чего кипятят с обратным холодильником в течение 8 часов 30 минут. К реакционному раствору добавляют 1н. водный раствор хлороводорода, после чего экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат и концентрируют и полученный остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат=2:1; хлороформ:метанол=10:1), получая 3,6 г (выход: 100%) указанного в заголовке соединения в виде твердого вещества белого цвета.
1H-ЯМР (CDCl3) δ: 3,04 (3Н, с), 3,69 (1Н, с), 7,63 (2Н, д, J=7,6 Гц), 7,87 (2Н, д, J=7,6 Гц)
Справочный пример 5
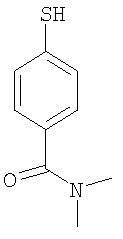
Получение 4-диметилкарбамоилбензолтиола
К раствору (50 мл) 1,30 г (5,14 ммоль) 4-метилтиобензойной кислоты в тетрагидрофуране последовательно добавляют 1,50 г (6,77 ммоль) карбонилдиимидазола и 4,70 мл (8,35 ммоль) раствора диметиламина в тетрагидрофуране, после чего перемешивают при комнатной температуре в течение двух с половиной часов. К реакционному раствору добавляют этилацетат, затем промывают 1н. водным раствором хлороводорода и насыщенным водным раствором хлорида натрия. Органический слой сушат и концентрируют, получая 960 мг неочищенного амидного соединения в виде маслянистого вещества.
К раствору (50 мл) вышеполученного амидного соединения в хлороформе медленно добавляют 980 мг (4,90 ммоль) 3-хлорнадбензойной кислоты, после чего перемешивают в течение 1 часа. К реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия, после чего перемешивают в течение 30 минут и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат и концентрируют, получая 910 мг неочищенного сульфоксидного соединения в виде маслянистого вещества.
К раствору (20 мл) вышеполученного сульфоксидного соединения последовательно добавляют 1,56 мл (13,4 ммоль) 2,6-лутидина и 1,80 мл (12,9 ммоль) ангидрида трифторуксусной кислоты, затем перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор концентрируют и к остатку добавляют 5 мл триэтиламина и 5 мл метанола, после чего перемешивают в течение 30 минут. Реакционный раствор концентрируют и к полученному остатку добавляют диэтиловый эфир, после чего промывают с помощью 1н. водного раствора хлороводорода и насыщенного водного раствора гидрокарбоната натрия. Органический слой сушат и концентрируют, получая 487 мг (выход: 62%) указанного в заголовке соединения в виде окрашенного в оранжевый цвет маслянистого соединения. Полученный сырой продукт используют в следующей реакции без очистки.
1Н-ЯМР (CDCl3) δ: 3,03 (3H, c), 3,14 (3H, c), 7,22-7,38 (3H, м), 7,46-7,52 (1H, м)
МС (ESI) m/e: 182 [M+H]+.
Справочный пример 6
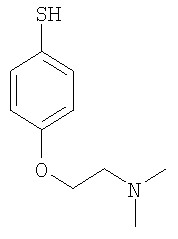
Получение 4-диметиламиноэтилоксибензолтиола
Гидрохлорид диметиламиноэтилхлорида (2,40 г; 17,1 ммоль) и 5,83 г (42,2 ммоль) карбоната калия последовательно добавляют к раствору (70 мл) 3,00 г (13,6 ммоль) 4-иодфенола в N,N-диметилформамиде, после чего перемешивают при температуре 70°С в течение 15 часов. Реакционный раствор разбавляют водой и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат и концентрируют.Полученный остаток очищают колоночной хроматографией на силикагеле (хлороформ:метанол=30:1), получая 840 мг (выход: 21%) иодпроизводного в виде маслянистого вещества.
Этиленгликоль (120 мкл; 2,15 ммоль), 305 мг (2,21 ммоль) карбоната калия, 150 мкл (1,08 ммоль) 4-метокситолуолтиола и 20 мг (0,105 ммоль) иодида меди добавляют к раствору (8 мл) 317 мг (1,08 ммоль) вышеполученного иодпроизводного в 2-пропаноле и реакционный раствор кипятят с обратным холодильником в течение 40 часов. Реакционный раствор фильтруют через целит и фильтрат распределяют между хлороформом и насыщенным водным раствором хлорида натрия. Органический слой сушат и концентрируют в вакууме, получая 298 мг маслянистого вещества. К маслянистому веществу последовательно добавляют 180 мкл анизола и 1,5 мл три-фторуксусной кислоты, после чего перемешивают при температуре 70°С в течение 2 часов. Реакционный раствор концентрируют и полученный неочищенный продукт используют для следующей реакции без очистки.
МС (ESI) m/e: 198 [M+H]+.
Промышленная применимость
Новое производное 2-пиридинкарбоксамида согласно настоящему изобретению, отвечающее формуле (I), проявляет превосходную активность в отношении глюкокиназы и, следовательно, оно пригодно в области медицины для лечения и/или предупреждения сахарного диабета, осложнений, вызываемых сахарным диабетом, или ожирения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛКАРБАМОИЛБЕНЗОЛА | 2004 |
|
RU2330030C2 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
| СОЕДИНЕНИЯ ДИГИДРОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ | 2013 |
|
RU2655914C9 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| ПРОИЗВОДНЫЕ АЗОЛОВ | 2012 |
|
RU2622639C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ТРИАЗОЛДИАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2274639C2 |
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОТИВОГРИБКОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2189982C2 |
| ЦЕФАЛОСПОРИНОВЫЕ АНТИБИОТИКИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИИ | 2001 |
|
RU2281948C2 |
| АЗАЗАМЕЩЕННЫЕ СПИРОПРОИЗВОДНЫЕ | 2006 |
|
RU2428423C2 |
Настоящее изобретение относится новым производным 2-пиридинкарбоксамида и их фармацевтически приемлемым солям, которые обладают свойствами активатора глюкокиназы и могут найти применение для лечения таких заболеваний, как сахарный диабет. В формуле (I):
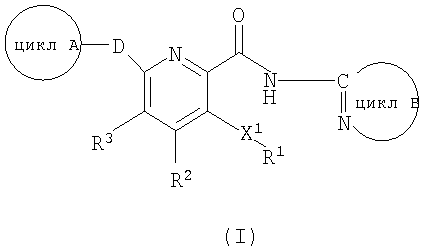
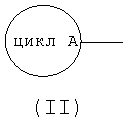
D означает О или S; R2 и R3 каждый означает атом водорода; формула (II) означает триазольную группу, имидазольную группу, тиазольную группу и пиридильную группу, которая может иметь в цикле 1 или 2 заместителя; формула (III) означает тиазолильную группу, тиадиазолильную группу, изоксазолильную группу, пиразинильную группу, пиридотиазолильную группу или пиридильную группу, цикл В может иметь 1 или 2 заместителя. Изобретение также относится к фармацевтической композиции на основе соединений изобретения. 2 н. и 17 з.п. ф-лы, 5 табл.
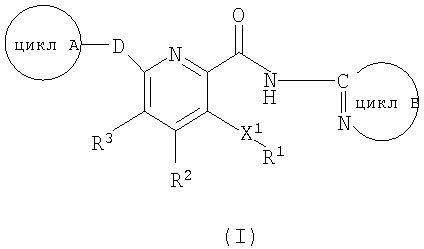
[где
-X1-R1 представляет фенилсульфанильную группу, 4-гидроксиэтилфенилсульфанильную группу, 4-метилфенилсульфанильную группу, 4-метоксифенилсульфанильную группу, 4-этоксифенилэтилсульфанильную группу, 4-метилкарбамоилфенилсульфанильную группу, 4-диметилкарбамоилфенилсульфанильную группу, 4-цианофенилсульфанильную группу, 4-трифторметилфенилсульфанильную группу, 4-фторфенилсульфанильную группу, 2-фторфенилсульфанильную группу, 4-метилкарбонилфенилсульфанильную группу, 4-метилсульфонилфенилсульфанильную группу, 4-диметиламиноэтилоксифенилсульфанильную группу, пиридин-4-илсульфанильную группу, пиридин-3-илсульфанильную группу, 6-метоксипиридин-4-илсульфанильную группу, 6-метоксипиридин-3-илсульфанильную группу и 6-метилпиридин-3-илсульфанильную группу;
D означает О или S;
R2 и R3 каждый означает атом водорода;
формула (II):
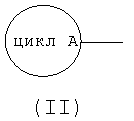
означает триазолильную группу, имидазолильную группу, тиазолильную группу и пиридильную группу, которая может иметь в цикле 1 или 2 группы, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, трифторметильной группы, гидроксигруппы, гидроксиалкильной группы (атом водорода гидроксичасти гидроксиалкильной группы, далее может быть замещен низшей алкильной группой) и атома галогена;
формула (III):
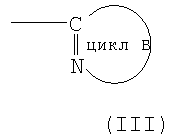
означает тиазолильную группу, тиадиазолильную группу, изоксазолильную группу, пиразинильную группу, пиридотиазолильную группу или пиридильную группу, цикл В может иметь 1 или 2 заместителя, выбираемые из группы, состоящей из низшей алкильной группы, низшей алкоксигруппы, атома галогена, трифторметильной группы, гидроксиалкильной группы (атом водорода гидроксичасти гидроксиалкильной группы, далее может быть замещен низшей алкильной группой), аминоалкильной группы (аминогруппа может быть замещена низшей алкильной группой), алканоильной группы, карбоксильной группы, алкоксикарбонильной группы и цианогруппы]
или его фармацевтически приемлемая соль.
 ,
, 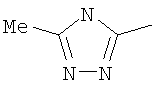 ,
, 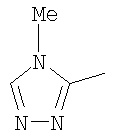 ,
, 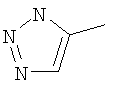 ,
, 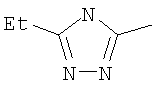 ,
,
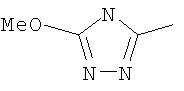 ,
, 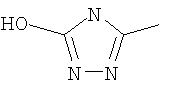 ,
, 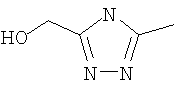 ,
, 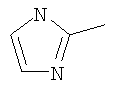 ,
, 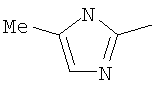 ,
,
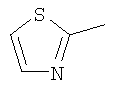 ,
, 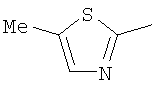 ,
,  ,
,  или
или 
| ПРОИЗВОДНЫЕ КАРБОКСАМИДА, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНЫМИ РАСТЕНИЯМИ | 1991 |
|
RU2037486C1 |
| ВЕКТОРНЫЙ ПОЛИПЕПТИД - АНАЛОГ ФРАГМЕНТА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА АЛЬФА (ТФРАЛЬФА), ЕГО ПРОТИВООПУХОЛЕВЫЙ КОНЪЮГАТ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОНЪЮГАТА | 2004 |
|
RU2277930C1 |
| JP 5812215 А, 19.07.1983. | |||
Авторы
Даты
2008-11-20—Публикация
2004-02-13—Подача