Изобретение относится к органическому синтезу, в частности к способу получения катализаторов водно-щелочного дегидрохлорирования.
Известно, что эффективными катализаторами водно-щелочного дегидрохлорирования являются четвертичные аммониевые соли (ЧАС) [Демлов Э. Межфазный катализ. М., Мир, 1987].
Из известных аналогов является способ получения высокоэффективного катализатора водно-щелочного дегидрохлорирования прибавлением к ЧАС спиртовой добавки при их мольном соотношении 1:1÷4 соответственно [Шаванов С.С., Шутенков Т.В., Рябов Н.А., Толстиков Г.А. Алкоксиды тетраалкил(бензил)аммония - новые высокоэффективные катализаторы жидкофазного дегидрохлорирования. Роль анионов в межфазном катализе. ДАН. Том 288, 1986, №6].
Недостатком этой каталитической системы является использование труднодоступных как бензилового спирта, так и бензилхлорида и триэтиламина для получения ЧАС.
Другим аналогом является катализатор для водно-щелочного дегидрохлорирования полихлоралканов, представляющий собой продукт взаимодействия при 40÷90°С в течение 1÷2 ч безводного или водного раствора третичного амина, галоидалкила, спирта и полихлоралкана, взятых в молярном соотношении 1:1:(2÷3):(2÷4), соответственно. В качестве третичного амина используют амин формулы R1R2R3N, где R1, R2, R3-алкил C1÷C5, алкил, γ-хлораллил, бензил, непредельные С4÷С5-углеводороды. Галоидалкил берут аллильного или бензильного типа. Спирт содержит непредельную или ароматическую группу в β-положении к атому кислорода [RU 2017521].
Недостатком этого катализатора водно-щелочного дегидрохлорирования полихлоралканов является использование труднодоступных бензилхлорида и триэтиламина, а также применение для получения ЧАС энергоемкого и технологически сложного хлораллила.
Следующим аналогом является способ получения катализаторов водно-щелочного дегидрохлорирования полихлоралканов, состоящих из четвертичных аммониевых солей и спиртовой добавки. Четвертичные аммониевые соли получают из осветленных отходов производства аллилхлорида с содержанием 30÷50 мас.% 1,3-дихлорпропенов, 30÷60 мас.% 1,2-дихлорпропана, 3÷5 мас.% 1,2,3-трихлорпропана первоначальной обработкой диметиламином, диэтиламином при температуре 50÷55°С или диэтаноламином при температуре 90÷100°С при мольном соотношении 1,3-дихлопропен:амин, равном 1:(1÷1,1), с дальнейшей обработкой реакционной массы стехиометрическим количеством к получаемым третичным аминам водным 25÷35% раствором NaOH, отделением органической фазы и прибавлением к ней стехиометрического количества к исходным 1,3-дихлорпропенам хлористого аллила, выдерживанием реакционной массы при перемешивании и температуре 45°С с последующим растворением образовавшейся четвертичной аммониевой соли минимальным количеством обессоленной воды, отделением органической фазы с получением 50÷60%-ного водного раствора четвертичной аммониевой соли и прибавлением к ней спиртовой добавки ROH, где R-алкил С3÷С4, ClCH=СН-СН2ОН и выделением из органической фазы 1,2-дихлорпропана [RU 2174441, МПК B01J 37/00, 1999].
Недостатками вышеуказанного катализатора является применение для их получения труднодоступного диэтаноламина, а также применение для получения ЧАС энергоемкого и технологически сложного аллилхлорида.
Наиболее близким к заявляемому по технической сущности и достигаемому эффекту является способ получения катализаторов водно-щелочного дегидрохлорирования взаимодействием водных вторичных аминов и осветленных отходов производства аллилхлорида, содержащих 30÷50 мас.% 1,3-дихлорпропенов, 30÷60 мас.% 1,2-дихлорпропана, 3÷5 мас.% 1,2,3-трихлорпропана и спиртовой добавки, где 30÷60%-ному водному раствору диметиламина при температуре 5÷10°С прибавляют осветленные отходы производства хлористого аллила в эквимолярном количестве к диметиламину 1,3-дихлорпропенов, содержащихся в отходах, выдерживанием смеси в течение 0,5÷1,0 ч, прибавлением к реакционной массе стехиометрического количества к диметиламину NaOH, взятого в виде 40÷44%-ного водного раствора, выдерживанием этой смеси при 20÷25°С в течение 0,5÷1,0 ч, прибавлением осветленных отходов производства хлористого аллила в эквимолярном количестве к диметиламину 1,3-дихлорпропенов, выдерживанием смеси при 60÷70°С при перемешивании в течение 2÷3 ч, отделением органической фазы и прибавлением к неорганической фазе спиртовой добавки ROH в мольном соотношении к четвертичному амину 1:1÷3, где R-C1÷C4 или бензил [RU 2247601, МПК B01J 37/04, 2003].
Недостатками этих каталитических систем является использование труднодоступного бензилового спирта, невысокая селективность образования конечного продукта.
Задачей заявляемого изобретения является получение высокоэффективного катализатора водно-щелочного дегидрохлорирования из доступного сырья - хлоролефиновой части хлорорганических отходов производства аллилхлорида путем их специфической утилизации.
Известно, что в производстве аллилхлорида высокотемпературным хлорированием пропена образуется до 280 кг хлорорганических отходов на одну тонну целевого продукта. Осветленная часть этих отходов, наряду с монохлорпропенами, состоит из 60÷65% мас. суммарных цис-,транс-1,3-дихлорпропенов, 20÷23% мас. из 1,2-дихлорпропана, из 3÷3,5% мас. 1,2,3-трихлорпропана [Технологический регламент производства аллилхлорида. Стерлитамак, ЗАО "Каустик", 1995]. Эти отходы долгие годы использовали в сельском хозяйстве для протравливания нематоцидов. Однако спрос на него уже более 3-х лет сильно ограничен в результате появления на потребительском рынке более качественных и относительно дешевых препаратов аналогичного действия.
Разделить эту отходы на индивидуальные компоненты не представляется возможным ввиду близких температур кипения 1,2-дихлорпропана и цис-,1,3-трансдихлорпропенов [Ошин Л.А. Промышленные хлорорганические продукты. М., Химия, 1978 г, с.200].
Эти отходы использовались также для получения перхлоруглеродов и, в основном, тетрахлорида углерода, однако согласно Монреальскому соглашению о защите озонового слоя атмосферы этот хлорпродукт запрещен к промышленному производству.
Практическую значимость представляет также 1,2,3-трихлорпропан, из которого водно-щелочным дегидрохлорированием почти количественно получают 2,3-дихлорпропен [Садыков Н.Б. Канд. диссертация «Разработка жидкофазных каталитических методов хлорирования хлорзамещенных пропана и пропилена». - Уфа, УНИ, 1985, 197 с.: ил.].
При практическом использовании заявляемого изобретения могут быть получены следующие технико-технологические и социальной направленности результаты:
- утилизация токсичных и особо опасных для окружающей среды хлорорганических отходов, которые в настоящее время не находят квалифицированного применения, либо используются как вторичное сырье для получения тетрахлорэтилена;
- получение относительно дешевого и более эффективного катализатора водно-щелочного дегидрохлорирования;
- исключение из технологии получения катализаторов водно-щелочного дегидрохлорирования труднодоступных бензилхлорида, бензилового спирта, диэтаноламина и энергоемкого и технологически сложного аллилхлорида;
- существенное упрощение технологии получения катализатора водно-щелочного дегидрохлорирования.
Указанные выше технические результаты при реализации изобретения достигаются тем, что осветленные отходы производства аллилхлорилда, содержащие 60,1÷65,1% мас. суммарных цис-,транс-1,3-дихлорпропенов, 20÷23% мас. 1,2-дихлорпропана, 3÷3,5% мас. 1,2,3-трихлорпропана, первоначально обрабатывают при температуре 5÷10°С диметиламином либо при температуре 50÷55°С диэтиламином при мольном соотношении 1,3-дихлорпропены:вторичный амин, равном 1,0:1,1, с дальнейшей обработкой реакционной массы стехиометрическим количеством к вторичным аминам водным 25÷35%-ным раствором NaOH, после выдерживания каждую из этих смесей при температуре 5÷10°С и 50÷55°С, соответственно, в течение 0,5÷1,0 часа охлаждают и отделяют органическую фазу, содержащую хлориды третичных аминов формул (СН3)2Н-СН2-СН=CHCl либо (C2H5)2N-CH2-СН=CHCl, далее к ней прибавляют стехиометрическое количество к исходному 1,3-дихлорпропену галоидного додекана (галоген - хлор, бром), выдерживают при перемешивании и температурах 20 и 70°С, соответственно, в течение 3,5÷4,0 часов с последующим охлаждением до комнатной температуры целевого продукта, представляющего собой сиропообразную консистенцию светло-желтоватого цвета формулы

где R - метил, этил; Hal - хлор, бром.
Основные физико-химические характеристики полученных катализаторов водно-щелочного дегидрохлорирования приведены в таблице.
 , г/л
, г/л
За ходом реакции следили по количеству непрореагировавшего вторичного амина, которое определяли титрованием 0,1 н. раствором соляной кислоты. Содержание четвертичной аммониевой соли в продукте устанавливали потенциометрическим титрованием 0,5 н. раствором азотнокислого серебра [Коростылев П.П. Приготовление раствора для химико-аналитических работ. Изд. 2 перераб. и доп. М.: Наука, 1964. - 399 с.].
Идентификацию полученных продуктов проводили по элементному составу ЯМР-спектров, которые приведены на чертеже.
Спектр ЯМР1Н записан на спектрометре «Bruker-AM-300» с рабочей частью 300 МГц, внутренний стандарт ТМС. Спектр снят в ДМСО-d6, химические сдвиги измерены в δ-шкале и даны в м.д., а КССВ - в Гц.
Спектр ЯМР1H: 0.81÷0.87 (м, 3Н, СН3); 0.85÷0.92 (м, 2Н, СН3); 1,15÷1,28 (т, 6Н,СН3, J=7.2); 1.22÷1.31 (м, 14Н, CH2); 3.05 (т, 2Н, СН2, J=7); 3.16÷3.25 (м, 4Н, СН2); 4.31 (д, 2Н, СН2, J=6.8); 6.75 (м, 1Н, СН); 6.85 (д, 1Н, CHl, J=13.9).
Полученные ЯМР-спектры подтверждают предложенную структуру синтезированных четвертичных аммонийных соединений.
Способ осуществляют следующим образом.
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, помещают расчетное количество осветленных отходов производства аллилхлорида, содержащих 60,1÷65,1% мас. суммарных цис-,транс-1,3-дихлорпропенов, 20÷23% мас. из 1,2-дихлорпропана, из 3÷3,5% мас. 1,2,3-трихлорпропана, прибавляют к ним расчетное количество диметиламина или диэтиламина, взятых в виде 30÷60%-ного водного раствора при перемешивании и температуре 5÷10 и 50÷55°С соответственно. Полученную смесь перемешивают в течение 0,5÷1,0 ч, после чего в реактор вводят расчетное количество NaOH в виде 25÷35%-ного водного раствора при температуре 5÷10 и 50÷55°С соответственно. Далее смесь выдерживают в течение 1,0÷1,5 ч, охлаждают и отделяют органическую фазу, содержащую хлорид третичного амина. Затем органическую фазу помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют расчетное количество (эквимолярное количество к 1,3-дихлорпропену) галоидного додекана (галоген - хлор, бром), выдерживают эту смесь при перемешивании в течение 3,0÷4,0 ч при температуре 20÷25 и 60÷70°С соответственно до получения четвертичной аммониевой соли.
Конверсия 1,3-дихлорпропенов приближается к количественной (98,0÷99,5%).
Способ подтверждается следующими примерами.
Пример 1
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, помещают 145 г осветленных отходов производства хлористого аллила, содержащих 60% мас. цис-,транс-1,3-дихлорпропенов, 20% мас. 1,2-дихлорпропана и 3% мас. 1,2,3-трихлорпропана, при перемешивании и температуре 5°С в реактор вводят 45 г диметиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 5°С и перемешивании в течение 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 25%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 204 г хлордодекана и перемешивают при температуре 60°С в течение 3,5 часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 320 г алкилдиметилхлорпропениламмонийхлорида формулы [(CH3)2N(CH2-CH=CHCl)(C12H25)]+·Cl- - ЧАС.
Пример 1′. Дегидрохлорирование 1,2-дихлорэтана
В четырехгорлую колбу, снабженную перемешивающим устройством, обратным холодильником, термометром и термостатирующим устройством, помещают 98 г 1,2 дихлорэтана и 1 мас.% к дихлорэтану полученного ЧАС (пример 1). При температуре 55°С при перемешивании через делительную воронку прибавляют 80 г NaOH в виде 50%-ного водного раствора. Выделяющийся винилхлорид через обратный холодильник улавливают охлаждаемой азотом ловушкой. Время реакции 30 минут, скорость образования винилхлорида 36,4 моль/л·с·104.
Пример 2
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством помещают 145 г осветленных отходов производства хлористого аллила, содержащих 65% мас. цис-,транс-1,3-дихлорпропенов, 23% мас. 1,2-дихлорпропана и 3÷3,5% мас. 1,2,3-трихлорпропана, при перемешивании и температуре 5°С в реактор вводят 45 г диметиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 5°С и перемешивании в течение 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 35%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 250 г бромдодекана и перемешивают при температуре 60°С в течение 3,5 часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 315 г алкилдиметилхлорпропениламмонийбромида формулы [(CH3)2N(CH2-CH=CHCl)(C12H25)]+·Br- - ЧАС.
В качестве катализатора дегидрохлорирования используют ЧАС, полученный по примеру 2. Дегидрохлорирование проводят в условиях примера 1′. Скорость образования винилхлорида составила 37,1 моль/л·с·104.
Пример 3
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, помещают 145 г осветленных отходов производства хлористого аллила, содержащих 62% мас. цис-,транс-1,3-дихлорпропенов, 22% мас. 1,2-дихлорпропана и 3,5% мас. 1,2,3-трихлорпропана, при перемешивании и температуре 10°С в реактор вводят 45 г диметиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 10°С и перемешивании в течение 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 30%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 204 г хлордодекана и перемешивают при температуре 70°С в течение 4-х часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 324 г алкилдиметилхлорпропениламмонийхлорида формулы [(CH3)2N(CH2-CH=CHCl)(C12H25)]+·Cl- - ЧАС.
Дегидрохлорирование проводят в условиях примера 1'. В качестве катализатора дегидрохлорирования используют ЧАС, полученный по примеру 3. Скорость образования винилхлорида составила 36,3 моль/л·с·104.
Пример 4
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством помещают 145 г осветленных отходов производства хлористого аллила, содержащих 65% мас. цис-,транс-1,3-дихлорпропенов, 23% мас. из 1,2-дихлорпропана, из 3% мас. 1,2,3-трихлорпропана при перемешивании и температуре 50°С в реактор вводят 68 г диэтиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 50°С и перемешивании в течении 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 30%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 250 г бромдодекана и перемешивают при температуре 80°С в течение 4-х часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 348 г алкилдиэтилхлорпропениламмонийбромида формулы [(C2H5)2N(CH2-CH=CHCl)(C12H25)]+·Br- - ЧАС.
Дегидрохлорирование проводят в условиях примера 1′. В качестве катализатора дегидрохлорирования используют ЧАС, полученный по примеру 4. Скорость образования винилхлорида составила 37,5 моль/л·с·104.
Пример 5
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, помещают 145 г осветленных отходов производства хлористого аллила, содержащих 65% мас. цис-,транс-1,3-дихлорпропенов, 20% мас. из 1,2-дихлорпропана, из 3,5% мас. 1,2,3-трихлорпропана при перемешивании и температуре 55°С в реактор вводят 68 г диэтиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 55°С и перемешивании в течение 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 35%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 204 г хлордодекана и перемешивают при температуре 80°С в течение 3,5 часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 350 г алкилдиэтилхлорпропениламмонийхлорида формулы [(C2H5)2N(CH2-CH=CHCl)(C12H25)]+·Cl- - ЧАС.
Дегидрохлорирование проводят в условиях примера 1′. В качестве катализатора дегидрохлорирования используют ЧАС, полученный по примеру 5. Скорость образования винилхлорида составила 37,0 моль/л·с·104.
Пример 6
В реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, помещают 145 г осветленных отходов производства хлористого аллила, содержащих 65% мас. цис-, транс-1,3-дихлорпропенов, 20% мас. из 1,2-дихлорпропана, из 3% мас. 1,2,3-трихлорпропана при перемешивании и температуре 50°С в реактор вводят 68 г диэтиламина, взятого в виде 50%-ного водного раствора. После выдерживания полученной смеси при температуре 50°С и перемешивании в течении 1 часа к полученной смеси прибавляют 39,1 г NaOH, взятой в виде 25%-го водного раствора. Далее реакционную массу охлаждают и переливают в делительную воронку. После расслоения органический слой отделяют.
Органический слой, содержащий хлорид третичного амина, помещают в реактор, снабженный мешалкой, термометром, обратным холодильником, делительной воронкой и термостатирующим устройством, добавляют 204 г хлордодекана и перемешивают при температуре 90°С в течение 3,5 часов. Полученный катализатор представляет собой светло-желтую сиропообразную четвертичную соль.
Получают 351 г алкилдиэтилхлорпропениламмонийхлорида формулы
[(C2H5)2N(CH2-CH=CHCl)(C12H25)]+·Cl- - ЧАС.
Дегидрохлорирование проводят в условиях примера 1′. В качестве катализатора дегидрохлорирования используют ЧАС, полученный по примеру 6. Скорость образования винилхлорида составила 36,8 моль/л·с·104.
Преимущества предлагаемого способа получения катализаторов водно-щелочного дегидрохлорирования перед известными заключается в том, что способ позволяет решить проблему утилизации отходов производства аллилхлорида более эффективным методом, который дает возможность получать из них одновременно и катализатор, и возвращать в технологический цикл 1,2-дихлорпропан для получения аллилхлорида.
Заявляемое изобретение позволяет также исключать использование труднодоступного сырья - бензилхлорида и бензилового спирта, диэтаноламина и энергоемкого и технологически сложного аллилхлорида. Следующим преимуществом данного изобретения является то, что получаемый катализатор относительно дешевле, так как сырьем служат отходы производства и упрощена технология его получения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ ВОДНО-ЩЕЛОЧНОГО ДЕГИДРОХЛОРИРОВАНИЯ ПОЛИХЛОРАЛКАНОВ | 1999 |
|
RU2174441C2 |
| АНТИСТАТИК ДЛЯ СТЕКЛОВОЛОКОН И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301223C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ ВОДНО-ЩЕЛОЧНОГО ДЕГИДРОХЛОРИРОВАНИЯ | 2003 |
|
RU2247601C2 |
| ДЕЗИНФИЦИРУЮЩЕЕ СРЕДСТВО | 2010 |
|
RU2449809C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА КОРРОЗИИ МЕТАЛЛА | 1999 |
|
RU2180931C2 |
| ДЕЗИНФИЦИРУЮЩЕЕ СРЕДСТВО | 2011 |
|
RU2475268C1 |
| СПОСОБ ОЧИСТКИ ОТХОДОВ ХЛОРОРГАНИЧЕСКИХ ПРОИЗВОДСТВ ОТ ПРОДУКТОВ ОСМОЛЕНИЯ | 2006 |
|
RU2313513C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВИНИЛХЛОРИДА | 2005 |
|
RU2292328C1 |
| СПОСОБ ПРЕВРАЩЕНИЯ ХЛОРИРОВАННОГО АЛКАНА В МЕНЕЕ ХЛОРИРОВАННЫЙ АЛКЕН | 1995 |
|
RU2141937C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВИНИЛИДЕНХЛОРИДА | 2005 |
|
RU2291850C1 |
Изобретение относится к органическому синтезу, в частности к способу получения катализаторов водно-щелочного дегидрохлорирования. Задачей заявляемого изобретения является получение высокоэффективного катализатора из доступного сырья - хлоролефиновой части хлорорганических отходов производства аллилхлорида путем их специфической утилизации. Технический результат при реализации изобретения достигается тем, что осветленные отходы производства аллилхлорида, содержащие 60,1÷65,1 мас.% суммарных цис-, транс-1,3-дихлорпропенов, 20-23 мас.% 1,2-дихлорпропана, 3÷3,5 мас.% 1,2,3-трихлорпропана первоначально обрабатывают при температуре 5÷10°С диметиламином либо при температуре 50÷55°С диэтиламином при мольном соотношении 1,3-дихлорпропены:вторичный амин равном 1,0:1,1 с дальнейшей обработкой реакционной массы стехиометрическим количеством к вторичным аминам водным 25÷35%-ным раствором NaOH. Далее смесь выдерживают в течение 0,5÷1,0 часа, охлаждают и отделяют органическую фазу, содержащую хлориды третичных аминов формул (CH3)2N-CH2-CH=CHCl либо (C2H5)2N-СН2-СН=CHCl. Затем к ней прибавляют стехиометрическое количество к исходному 1,3-дихлорпропену галоидного додекана, выдерживают при повышенной температуре в течение 3,5÷4,0 часов с последующим охлаждением до комнатной температуры и выделением целевого продукта, представляющего собой сиропообразную консистенцию светло-желтоватого цвета формулы
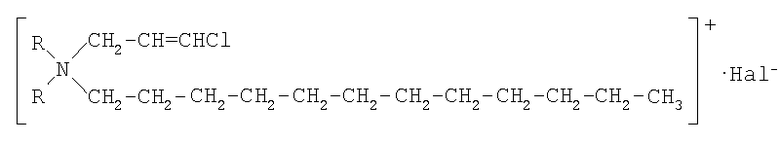
где R - метил, этил; Hal - хлор, бром. 2 з.п. ф-лы, 1 табл., 1 ил.
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ ВОДНО-ЩЕЛОЧНОГО ДЕГИДРОХЛОРИРОВАНИЯ | 2003 |
|
RU2247601C2 |
| Алкоксиды и ароксиды производных триалкиларалкил /алкил/ аммония в качестве катализатора для дегидрогалоидирования галоидуглеводородов | 1981 |
|
SU1038338A1 |
| СПОСОБ ПОЛУЧЕНИЯ β -ХЛОРОПРЕНА | 1991 |
|
RU2017710C1 |
| RU 2055065 C1, 27.02.1996 | |||
| СПОСОБ ПЕРЕРАБОТКИ ГАЛАЛИТОВЫХ ОТХОДОВ | 1940 |
|
SU60229A1 |
| US 5841004 A, 24.11.1998 | |||
| JP 10182515 A, 07.07.1998. | |||
Авторы
Даты
2008-12-20—Публикация
2006-08-22—Подача