Замещенные 6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-оны - антидоты гербицида гормонального действия 2,4-дихлор-феноксиуксусной кислоты и способ их получения
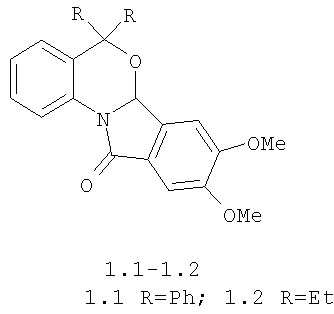
Изобретение относится к новым биологически активным соединениям - замещенным бензоксазиноизоиндолонам формулы 1: 8,9-диметокси-5,5-дифенил-6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-ону формулы 1.1; 8,9-диметокси-5,5-диэтил-6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-ону формулы 1.2, защищающим проростки подсолнечника от отрицательного действия гербицида 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) и способу их получения.
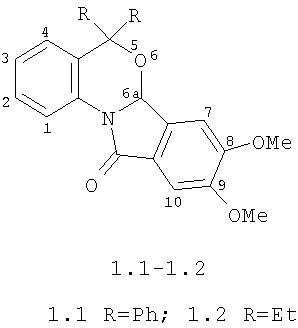
Перечисленные соединения, их химические и биологические свойства в литературе не описаны.
Известны вещества - антидоты, обладающие способностью ослаблять токсическое действие гербицидов на сельскохозяйственные культуры. Антидоты усиливают метаболическую детоксикацию гербицида в растении, в частности, за счет повышения активности глутатион-S-трансферазной системы. Они вносятся в почву отдельно и совместно с гербицидами, а в ряде случаев используются для предпосевной обработки семян [Стрелков В.Д. Поиск новых регуляторов роста растений и гербицидных антидотов. // Актуальные вопросы биологизации растений. Пущино, 2000. - С.152-155; Гилязетдинов Ш.Я., Узянбаев А.Х., Лукьянов С.А., Мухутдинов Ф.Г. Исследование рострегулирующей и протекторной активности иммуностимуляторов в смеси с гербицидами. // Создание высокопродуктивных агроэкосистем на основе новой парадигмы природопользования: Сб. докл. науч.-прак. конф. Уфа, 2001. С.372-378].
Антидотной активностью по отношению к 2,4-Д обладает 2-(н-аминобензолсульфамидо)-3-метоксипиразин, являющийся аналогом по свойствам [Патент №2043021 РФ. Антидот гормонального действия 2,4-дихлорфеноксиуксусной и 4-амино-3,5,6-трихлорпиколиновой кислот / В.Д.Стрелков, Л.И.Исакова, М.И.Калита, Л.Н.Литвинова, Т.И.Чубенко // БИ, 1995] и имеющий структурную формулу 2.
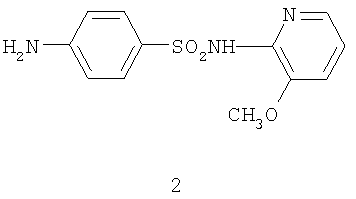
Аналогами по структуре и способу получения являются замещенные изоиндоло[2,1-α][3,1]бензоксазиноны 3.1-3.3 [Pigeon P., Sikoroiova J., Marehalin S., Decroix B. Intramolecular addition of a hydroxyl to a N-acyliminim system.
Application to the synthesis of isoindolo[2,1-α][3,1]benzoxazine and isoindolo[1,2-c][2,4]benzoxazepine derivatives. // Heterocycles, vol.56, 2002, pp.129-138].
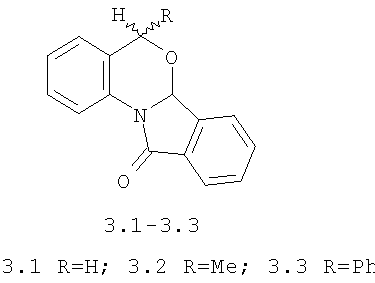
Среди аналогов по структуре не описана их антидотная активность. Способ получения 5-метил(фенил)изоиндоло[2,1-α][3,1]бензооксазин-11-онов 3.2, 3.3 с двумя хиральными атомами углерода С5 и С6a состоит из следующих стадий:
1-я стадия: конденсация 2-аминобензофенона 4 или 2-аминоацетофенона 5 с фталевым ангидридом, приводящая к фтальимидам 6.2, 6.3.
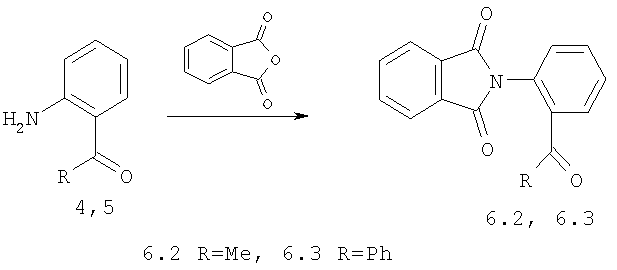
2-я стадия: восстановление соединений 6.2, 6.3 боргидридом натия до гидроксилактамов 7.2, 7.3. Для фтальимида 6.3 эта реакция сопровождается образование соединения 8 с раскрытием гетроцикла.
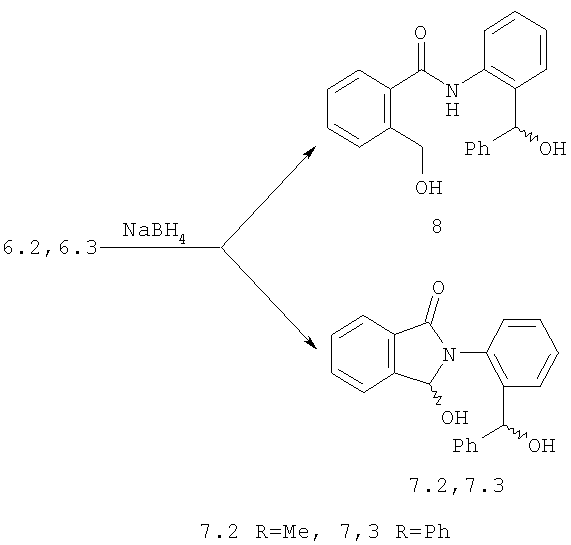
3-я стадия: гетероциклизация гидроксилактамов 7.2, 7.3 под действием n-ТСК до диастереоизомерной смеси (в соотношении 2:1) замещенных изоиндоло[2,1-α][3,1]бензооксазин-11-онов 3.2,3.3.
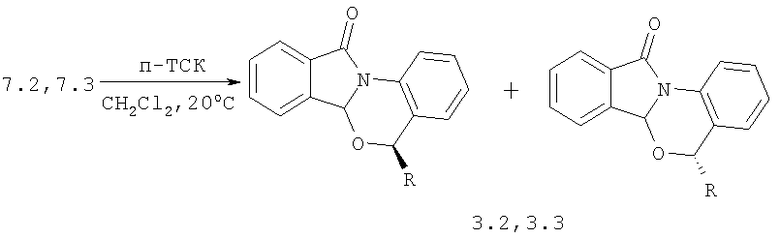
Соединения 3.2, 3.3 получаемые этим методом, являются аналогами по структуре заявляемых соединений, а способ их получения является способом-аналогом.
Техническим результатом изобретения является синтез новых соединений в ряду замещенных 6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-онов - антидотов гербицида гормонального действия 2,4-дихлорфеноксиуксусной кислоты с целью расширения ассортимента и упрощение способа их получения.
Технический результат достигается тем что, замещенные 6а,11-дигидро-5Н-бензо[4,5][1,3]оксазино[2,3-α] изоиндол-11-оны формулы 1, 8,9-диметокси-5,5-дифенил-6а,11-дигидро-5Н-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-он формулы 1.1, 8,9-диметокси-5,5-диэтил-6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-он формулы 1.2, обладают антидотными свойствами гербицидов гормонального действия 2,4-дихлор-феноксиуксусной кислоты для защиты проростков подсолнечника.
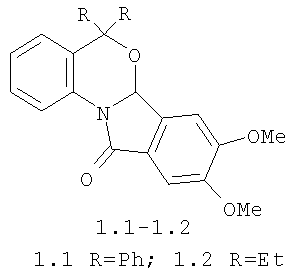
В способе получения 8,9-диметокси-5,5-дифенил-6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-она формулы 1.1, 8,9-диметокси-5,5-диэтил-6а,11-дигидро-5H-бензо[4,5][1,3]оксазино-[2,3-α]изоиндол-11-она формулы 1.2,
о-аминофенилдиэтил(дифенил)карбинолы 9, 10 подвергают взаимодействию 2-формил-4,5-диметоксибензойной кислотой 11 в соотношении 1:1 в уксусной кислоте.
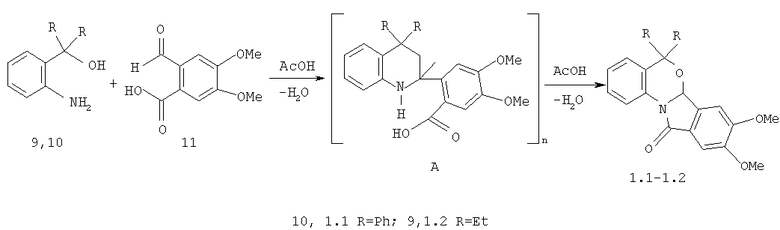
Уксусная кислота является одновременно и растворителем и кислотным катализатором для двух последовательных взаимодействий: как для конденсации исходных реагентов с промежуточно образующимися дигидробензоксазинами А [Е.В.Громачевская, В.Г.Кульневич, Т.П.Косулина, В.Г.Пустоваров // ХГС, 842, 1988], так и для их последующей внутримолекулярной дегидратации с образование целевых структур 1.1-1.2. Дигидробензоксазины А в ходе реакции не выделяются. За ходом реакции следили методом ТСХ (пластины Silufol UV-254, система бензол-ацетон (4:1), проявитель-пары иода).
Соединения 1.1-1.2 идентифицированы по совокупности данных элементного анализа, ИК- и ПМР-спектроскопии. ИК-спектры записаны в вазелиновом масле, спектры ГТМР - в растворах CDCl3.
Исходные аминокарбинолы 9, 10 для синтеза соединений 1.1-1.2 получают с выходом до 75% из производимого отечественной промышленностью метилантранилата, используя методику взаимодействия сложных эфиров с реактивом Гриньяра [Реакции карбонильных соединений - в кн.: Практикум по органической химии, Т. II / Под ред. Потапова В.П., Пономарева СВ. Пер. с немецкого. - М., с.195-199].
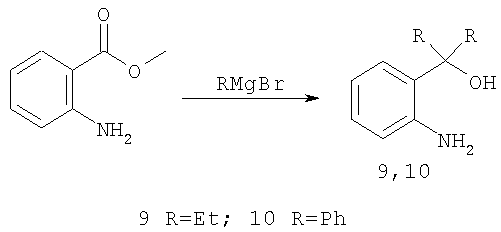
Физико-химические константы карбинолов 9 и 10 соответствуют литературным данным [Е.В. Громачевская, В.Г. Кульневич, Т.П. Косулина, В.Г. Пустоваров // ХГС, 842, 1988; Е.В. Громачевская, Т.П. Косулина, А.А. Бородавко // ХГС, 1230, 2006].
Изобретение иллюстрируется следующими примерами.
Пример 1. Изучение антидотной активности бензоксазиноизоиндолонов 1.1-1.2.
Испытания соединений 1.1-1.2 на антидотную активность к 2,4-Д на проростках подсолнечника сорта ВНИИМК 8883 в лабораторных условиях проводят следующим образом. Проросшие семена подсолнечника с длиной зародышевого корешка 2-4 мм помещали на 1 ч в раствор 2,4-дихлоруксусной кислоты в концентрации 10-3 % в расчете получения 40-60% ингибирования роста гипокотиля. После гербицидного воздействия проростки промывали водой и помещали в растворы испытываемых на антидотную активность веществ 1.1-1.2 в концентрациях 10-2, 10-3, 10-4, 10-5% (вариант гербицид+антидот). Спустя 1 час семена промывали водой и раскладывали на полосы фильтровальной бумаги (размер 10×75 см) по 20 шт., которые сворачивали в рулоны и помещали в стаканы с водой с 50 мл воды. Дальнейшее проращивание проводили в термостате в течение 3 суток при температуре 28°С. Одновременно проводят испытания аналога по свойтсвам - 2-(н-аминобензолсульфамидо)-3-метоксипиразина. Антидотный эффект определяют по увеличению длины гипокотиля и корня семян подсолнечника, полученного под действием антидота, относительно гербицидного варианта, который принимают за контроль.
Результаты испытаний представлены в табл.1, 2.
Соединение 1.1 при концентрациях 10-3 и 10-4 увеличивает длину гипокотиля на 14%, а при концентрации 10-5 - на 23%. При антидотных концентрациях 10-3 и 10-5 вещество увеличивает длину корня на 14 и 17%, соостветственно, а при концентрации 10-4 - на 28% по сравнению с контролем.
Аналог по свойствам увеличивает длину гипокотиля на 4-19%, но при этом возрастает токсическое воздействие 2,4-Д на корень растения - его длина уменьшается на 20-25%.
Соединение 1.2 при антидотных концентрациях 10-2 и 10-4 увеличивает длину гипокотиля на 16%, а при концентрациях 10-3 и 10-5 - на 11%. В диапазоне концентраций 10-2 - 10-4 вещество увеличивает длину корня на 11-33% по сравнению с контролем.
Как видно из таблиц 1 и 2, соединения 1.1-1.2 более эффективно активируют ростовые и синтетические процессы в проростках в условиях химического стресса, чем 2-(н-аминобензолсульфамидо)-3-метоксипиразин (2). Поскольку предлагаемые соединения 1.1-1.2 снижают токсичность гербицида 2,4-Д для подсолнечника, то это позволяет без вреда для урожайности культурных растений использовать максимальную дозу наземного гербицида в присутствии соответствующих антидотов, т.е. уйти от часто встречающегося в практике сознательного уменьшения применяемой дозы гербицидов. Как известно, оно способствует ускоренному появлению устойчивых к гербицидам форм сорных растений [Исаева Л.И. Повышение безопасности гербицидов для культурных растений (зарубежный опыт). // Агропромышленное производство: опыт, проблемы и тенденции развития. 1988. №1. С.35-44].
Пример 2. Синтез замещенных 6а,11-дигидро-5H-бензо [4,5][1,3] оксазино[2,3-α]изоиндол-11-онов (1.1-1.2, табл.3)
Получение 8,9-диметокси-5,5-дифенил-6а,11-дигидро-5H-бензо[4,5][1,3]-оксазино[2,3-α]изоиндол-11-она (1.1).
Вариант 1а. Смесь 1,38 г (0,005 моль) о-аминофенилдифинилкарбинола 10 и 1,05 (0,005 моль) 2-формил-4,5-диметокибензойной кислоты 11 в 10 мл ледяной уксусной кислоты в течение 20 мин перемешивают при комнатной температуре. Затем реакционную смесь нагревают на водяной бане до температуры 55-60°С и перемешивают еще 1 ч. По окончании реакции (контроль ТСХ), выделившийся осадок отфильтровывают, из фильтрата водно-спиртовой смесью (7:3) выделяют еще часть осадка. Осадки объединяют, перекристаллизовывают из смеси спирт-бензол (8:2). Выход продукта - 1,46 г (65%).
Температура плавления >230°С.
Найдено, %: С 77,38; Н 5,21; N 3,35; C29H23NO4;
Вычислено, %: С 77,51; Н 5,12; N 3,12.
ИК-спектр (ν, см-1): 1680 (С=O); 3030, 1590, 1570 (С=С Нар).
Спектр ПМР (δ, м.д., J, Гц): 3,96 и 3,98 (6Н, два с, (ОСН3)2);
5,78 (1Н, с, 6а-Н); 6,87 (1Н, д, 4-Н3J4,3=7,8); 6,96 (1Н, с, 7-Н); 7,03 (1Н, д.д, 3-Н); 7,35 (12Н, м, (С6Н5)2+2-Н+10-Н); 8,55 (1H, д, 11-Н, 3J2,1=8,0).
Получение 8,9-диметокси-5,5-диэтил-6а,11-дигидро-5H-бензо[4,5][1,3]-оксазино[2,3-α]изоиндол-11-она (1.2).
Вариант 1б. Смесь 0,89 г (0,005 моль) о-аминофенилдиэтилкарбинола 9 и 1,05 (0,005 моль) 2-формил-4,5-диметоксибензойной кислоты 11 в 10 мл ледяной уксусной кислоты в течение 30 мин перемешивают при комнатной температуре. Затем реакционную смесь нагревают на водяной бане до температуры 40-45°С и перемешивают еще 45 мин. По окончании реакции (контроль ТСХ) и охлаждения реакционной массы, продукт выделяют осаждением водно-спиртовой смесью (7:3). Выпавший осадок отфильтровывают, перекристаллизовывают из смеси спирт-бензол (8:2). Выход продукта - 1,32 г (75%).
Температура плавления 171-172°С.
Найдено, %: С 71,58; Н 6,41; N 4,08; C21H23NO4;
Вычислено, %: С 71,39; Н 6,52; N 3,97.
ИК-спектр (ν, см-1): 1690 (С=0); 3030, 3010, 1590,1575 (С=С Нар).
Спектр ПМР (δ, м. д., J, Гц): 0,55 и 1,18 (6Н, два т, (СН3)2); 1,75, 1,98, 2,09, и 2,30 (4Н, четыре кв, (СН2)2, 3JCH2CH3=7,2); 3,38 и 4,03 (6Н, два с, (ОСН3)2); 5,97 (1Н, с, 6a-Н); 7,08 (1Н, д, 7-Н); 7,22 (3Н, м, 2-Н+3-Н+4-Н); 7,38 (1H, с, 10-Н); 8,30 (1Н, д, 1-Н, 3J1,2=8,2).
Из экспериментального материала по синтезу продуктов 1.1, 1.2 видно, что оптимальными вариантами по их получению являются соответственно варианты 1а и 1б, (табл.3). Строение исходных соединений влияет на ход реакции и, следовательно, на условия ее проведения. Например, донорные (Et) заместители в составе аминокарбинола 9 способствуют внутримолекулярной дегидратации в соответствующих дигидробензоксазинах, вследствие чего выход изоиндолона 1.2 увеличивается на 10%. Применение избытка одного из реактивов (формилбензойной кислоты) во всех реакциях нецелесообразно, поскольку продукты получаются загрязненными. Для их очистки требуется несколько перекристаллизации, что ведет к снижению общего выхода.
Предлагаемый способ получения соединений 1.1-1.2 прост в исполнении, осуществляется в одной реакционной колбе. Преимуществом данного способа является одностадийность и не трудоемкость процесса. Это выгодно отличает его от способа аналога.
Антидотная активность 6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-онов 1.1-1.2 и аналога по свойствам к 2,4-Д на проростках подсолнечника (оценка по длине гипокотиля)
Антидотная активность 6а,11-дигидро-5H-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-онов 1.1-1.2 и аналога по свойствам к 2,4-Д на проростках подсолнечника (оценка по длине корня)
Условия проведения синтеза соединений 1.1-1.2
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ 3,1-БЕНЗОКСАЗИНО(1,2-С)(1,3)НАФТОКСАЗИНЫ - АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2006 |
|
RU2316209C1 |
| ЗАМЕЩЕННЫЕ 4,4-ДИФЕНИЛ-3,1-БЕНЗОКСАЗИНО(1,2-С)(1,3)БЕНЗОКСАЗИНЫ - АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2006 |
|
RU2316211C1 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-4Н-3,1-БЕНЗОКСАЗИНЫ-АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2006 |
|
RU2316210C1 |
| 2-АРИЛ-4,4-ДИФЕНИЛ-3,4-ДИГИДРОХИНАЗОЛИНЫ - АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2014 |
|
RU2574067C1 |
| N-алкилзамещенные бензо- и (пиридо[2,3-b]тиено)пирроло[1,2-a][1,4]диазепин-6-оны - антидоты гербицида гормонального действия 2,4-дихлорфеноксиуксусной кислоты на подсолнечнике | 2016 |
|
RU2607629C1 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2003 |
|
RU2242123C1 |
| 3-Бензил-2,5-бис(4-метоксифенил)-7-тиоксо-2,3,5,6,7,8-гексагидропиримидо[4,5-d]пиримидин-4(1H)-он в качестве антидота 2,4-Д на подсолнечнике | 2022 |
|
RU2783115C1 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИК | 2005 |
|
RU2284694C1 |
| N-Арил-3-(1,3-диоксоизоиндолин-2-ил)тиено[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике | 2023 |
|
RU2811272C1 |
| 5-(3-Амино-3-оксо-2-тиокарбамоил-1-(2-хлорфенил)пропил)-2,2-диметил-4-оксо-4H-1,3-диоксин-6-олат триэтиламмония в качестве антидота 2,4-Д на подсолнечнике | 2022 |
|
RU2798595C1 |
Изобретение относится к новым биологически активным соединениям -замещенным бензоксазиноизоиндолам формулы 1: 8,9-диметокси-5,5-дифенил-6а, 11-дигидро-5Н-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-ону формулы 1.1; 8,9-диметокси-5,5-диэтил-6а,11-дигидро-5Н-бензо[4,5][1,3]-оксазино[2,3-α]изоиндол-11-ону формулы 1.2, защищающим проростки подсолнечника от отрицательного действия гербицида 2,4-дихлорфеноксиуксусной кислоты и способу их получения. Способ получения 8,9-диметокси-5,5-дифенил-6а,11-дигидро-5Н-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-она формулы 1.1, 8,9-диметокси-5,5-диэтил-6а, 11-дигидро-5Н-бензо[4,5][1,3]оксазино[2,3-α]изоиндол-11-она формулы 1.2 предусматривает взаимодействие о-аминофенилдиэтил-(дифенил)карбинолов с замещенными 2-формил-4,5-диметоксибензойными кислотами в соотношении 1:1. Отличие предлагаемого способа от способа - аналога заключается в одностадийности процесса. 2 н.п ф-лы, 3 табл.

| Pigeon P., Sikoroiova J., Marehalin S., Decroix B | |||
| Intramolecular addition of a hydroxyl to a N-acyliminim systern | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Heterocycles, vol.56, 2002, pp.129-138 | |||
| ЗАМЕЩЕННЫЕ 3,1-БЕНЗОКСАЗИНО (1,2-С)(1,3) БЕНЗОКСАЗИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АКТИВАТОРОВ ПРОРАСТАНИЯ СЕМЯН ПШЕНИЦЫ | 2002 |
|
RU2206566C1 |
| ЗАМЕЩЕННЫЕ 4,4-ДИФЕНИЛ-1,2-ДИГИДРО-4Н-3,1-БЕНЗОКСАЗИНЫ, ПРОЯВЛЯЮЩИЕ РОСТОРЕГУЛИРУЮЩУЮ И АНТИСТРЕССОВУЮ АКТИВНОСТЬ | 2001 |
|
RU2195457C1 |
| ГИДРОХЛОРИД 2-МЕТИЛ-4,4-ДИ( β ФЕНИЛЭТИЛ)-1,2-ДИГИДРО-4Н-3,1-БЕНЗОКСАЗИНИЯ, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ АКТИВИРОВАТЬ ПРОРАСТАНИЕ СЕМЯН И ПОВЫШАТЬ УРОЖАЙНОСТЬ ЗЕРНОВЫХ КУЛЬТУР, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2084452C1 |
Авторы
Даты
2009-01-27—Публикация
2007-08-13—Подача