Настоящее изобретение относится к новым 1-азабициклоалкиловым производным, к способам их получения, их применению в качестве фармацевтических средств и к включающим их фармацевтическим композициям.
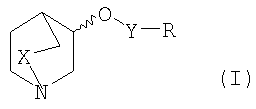
Более конкретно, настоящее изобретение в первом варианте осуществления относится к соединению формулы I
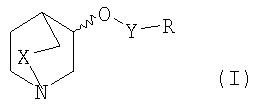
где
Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
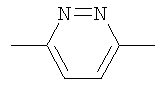 ,
, 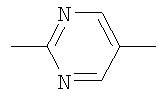 или
или 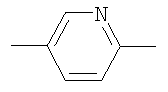 ;
;
R представляет собой замещенный или незамещенный С5-С10арил или замещенный или незамещенный гетеро-С5-С10арил, N(R1)(R4) или N(R2)(CHR3R4);
каждый из R1, R2 и R3 независимо представляет собой Н, С1-С4алкил или CF3;
R4 представляет собой замещенный или незамещенный С5-С10арил или замещенный или незамещенный гетеро-С5-С10арил;
в форме свободного основания или кислотной аддитивной соли.
С5-С10Арил и гетеро-С5-С10арил в том значении, в котором он здесь используется, обозначает особенно частично или полностью ненасыщенные, например ароматические, остатки, необязательно замещенные одним или несколькими заместителями, предпочтительно до трех заместителей, выбранными из галогена, например F, Cl, Br, I; CN; С1-С4алкила, такого как метил, этил или пропил, С2-C4алкенила, такого как винил, С2-С4алкинила, которые сами могут быть незамещенными или замещенными галогеном, например дифторметилом или трифторметилом; С1-С4алкокси, которые сами могут быть незамещенными или замещенными галогеном, например трифторметокси; формила, ацетила; C1-С3алкоксикарбонила; N,N-ди-(С1-С3алкил)карбамоила; фенила, фенокси; или заместители могут быть конденсированы, например, в бензо[1,3]диоксол или 2,3-дигидробензо[1,4]диоксин и/или в другое гетероциклическое кольцо. Гетеро-С5-С10арил представляет собой ароматическую гетероциклическую систему, включающую один, два или три гетероатома, выбранных из N, О, S, например 5- или 7-членный ароматический гетероциклический остаток, необязательно конденсированный, например, в 1 или 2 фенильных кольца и/или в другое гетероциклическое кольцо. Примеры указанных выше С5-С10арильных или
гетеро-С5-С10арильных остатков включают фенил, нафтил, тетрагидронафтил, такой как тетралинил, инданил, тиенил, бензотиенил, фуранил, бензофуранил и изобензофуранил.
Предпочтительно С5-С10арил и гетеро-С5-С10арил в том значении, в котором он здесь используется, обозначает частично или полностью ненасыщенные, например ароматические, остатки, необязательно замещенные одним или несколькими заместителями, предпочтительно до трех заместителей, выбранными из галогена, например F, Cl, Br, I; CN; С1-С4алкила, такого как метил, этил или пропил, которые сами могут быть незамещенными или замещенными галогеном, например дифторметилом или трифторметилом; С1-С4алкокси, которые сами могут быть незамещенными или замещенными галогеном, например, трифторметокси; или заместители могут быть конденсированы, например, в бензо[1,3]диоксол или 2,3-дигидробензо[1,4]диоксин и/или в другое гетероциклическое кольцо. Гетеро-С5-С10арил представляет собой ароматическую гетероциклическую систему, включающую один, два или три гетероатома, выбранных из N, О, S, например 5- или 7-членный ароматический гетероциклический остаток, необязательно конденсированный, например, в 1 или 2 фенильных кольца и/или в другое гетероциклическое кольцо. Примеры указанных выше С5-С10арильных или
гетеро-С5-С10арильных остатков включают фенил, нафтил, инданил, тетралинил, тиенил, бензотиенил, фуранил, бензофуранил и изобензофуранил.
Кислотными аддитивными солями предпочтительно являются фармацевтически приемлемые соли соединений формулы I. Для выделения или очистки также возможно применение фармацевтически неприемлемых солей, например пикратов или перхлоратов. Для терапевтического применения применяются только фармацевтически приемлемые соли или соединения в свободной форме (там, где это приемлемо - в форме фармацевтических составов), и, следовательно, они являются предпочтительными.
В отношении асимметричного атома(атомов) углерода, присутствующих в соединениях формулы I и их солях, соединения могут существовать в оптически активной форме или в форме смесей оптических изомеров, например в форме рацемических смесей. Все оптические изомеры и их смеси, включая рацемические смеси, составляют часть настоящего изобретения.
В формуле I предпочтительными являются следующие значения независимо друг от друга, вместе или в любой комбинации или субкомбинации, если возможно:
(а) Х представляет собой СН2;
(б) Y представляет собой 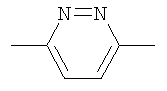 ;
;
(в) Y представляет собой 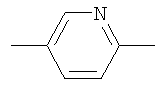 ,
,
(г) R представляет собой 1-изобензофуранил или замещенный или незамещенный фенил, например, монозамещенный хлором или фтором в положении 2, 3 или 4, CF3 в положении 2 или 3, метокси в положении 2; трифторметокси в положении 3; бензо[1,3]-диоксол; 2,3-дигидробензо[1,4]-диоксин; циано или дизамещенный, например, фтором в положении 2 и 5, 3 и 5 или хлором в положении 2 и фтором в положении 6.
Предпочтительными являются азабициклоалкильные производные формулы I, в которых
Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 ,
, 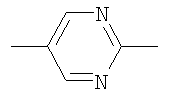 или
или  ;
;
R представляет собой фенил, нафтил, тетрагидронафтил, инданил, тиенил, бензотиенил, фуранил, бензофуранил и изобензофуранил, которые в каждом случае могут быть незамещенными или моно-, ди- или тризамещенными галогеном, циано, формилом, ацетилом, C1-С3алкоксикарбонилом, N,N-ди-(C1-С3алкил) карбамоилом, фенилом, фенокси, метилендиокси, этилендиокси; или
С1-С4алкил, С2-С4алкенил, С2-С4алкинил или С1-С4алкокси, которые сами могут быть незамещенными или моно-, ди- или тризамещенными галогеном.
Более предпочтительными являются азабициклоалкильные производные формулы I, в которых
Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 ,
,  или
или  ;
;
R представляет собой
(а) фенил, который является незамещенным или моно-, ди- или тризамещенным галогеном, циано, метилендиокси, С1-С4алкил, который является незамещенным или моно-, ди- или тризамещенным галогеном, или C1-С4алкокси, который является незамещенным или моно-, ди- или тризамещенным галогеном,
(б) нафтил, инданил, тетралинил или
(в) фуранил, бензофуранил, изобензофуранил, бензотиенил или тиенил,
в форме свободного основания или кислотной аддитивной соли.
Еще более предпочтительными являются азабициклоалкильные производные формулы I, в которых
Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 ,
,  или
или  ;
;
и
R представляет собой
(а) фенил, который является незамещенным или моно-, ди- или тризамещенным галогеном, циано, метилендиокси, С1-С4алкилом, который является незамещенным или моно-, ди- или тризамещенным галогеном, или C1-С4алкокси, который является незамещенным или моно-, ди- или тризамещенным галогеном,
(б) нафтил или
(в) фуранил, бензофуранил, изобензофуранил или тиенил,
в форме свободного основания или кислотной аддитивной соли.
В дополнение к вышеизложенному настоящее изобретение также относится к способу получения соединения формулы I, который включает стадию реакции соединения формулы II
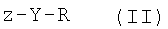 ;
;
где Y и R являются такими, как определено выше, и z представляет собой уходящую группу, например F, Cl, Br, I или OSO2CF3, с соединением формулы III
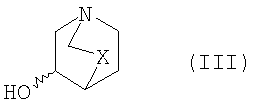
где Х является таким, как определено выше, с получением соединения формулы I,
и превращение полученного таким образом соединения формулы I в форму свободного основания или кислотную аддитивную соль.
Реакция может осуществляться в соответствии со стандартными процедурами, например, как показано в примерах.
Соединения формулы II являются известными или могут быть получены из соответствующих известных соединений, например, как описано в примерах, например, аналогично Coates WJ, McKillop A (1992) Synthesis 334-342. Соединения формулы III являются известными.
Альтернативно, соединения формулы I′
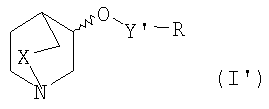
в которых
Х и R являются такими, как определено выше, и Y′ представляет собой
 или
или 
могут быть получены способом, включающим стадию
реакции соединения формулы IV
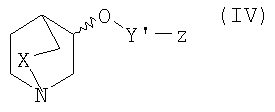 ;
;
где Y′, z и Х являются такими, как определено выше,
с соединением формулы V

где R является таким, как определено выше, с получением соединения формулы I,
и превращение полученного таким образом соединения формулы I в форму свободного основания или кислотную аддитивную соль.
Соединения формулы IV являются известными или могут быть получены из соответствующих известных соединений, например, как описано в примере 17, например, реакцией соединений формулы III с соединениями формулы II′;
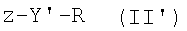
где Y′ представляет собой 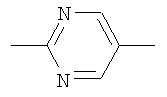 или
или 
и z является таким, как определено выше.
Соединения формулы V (например, незамещенные или замещенные фенилборные кислоты) являются известными или могут быть получены из соответствующих известных соединений. Например, соединение формулы VI,

в котором R имеет значение, которое указано для соединения формулы I, может реагировать с триалкилборатом в инертном растворителе, таком как бензол, толуол, тетрагидрофуран или их смесях, с добавлением бутиллития при температуре приблизительно между -78°С и -25°С, например приблизительно -40°С, в течение приблизительно от 1 часа до 6 часов, получая соединение формулы V.
Обработка реакционных смесей в соответствии с указанными выше способами и очистка полученных соединений могут осуществляться в соответствии с известными процедурами.
Кислотные аддитивные соли могут быть получены из свободных оснований известным способом и наоборот. Подходящие кислотные аддитивные соли для применения в соответствии с настоящим изобретением включают, например, гидрохлорид и формат.
Соединения формулы I в оптически чистой форме могут быть получены из соответствующих рацематов в соответствии с известными методиками, например ВЭЖХ с хиральным матриксом. Альтернативно, могут использоваться оптически чистые исходные реагенты.
Стереоизомерные смеси, например смеси диастереомеров, могут быть разделены на их соответствующие изомеры известными методиками подходящими способами разделения. Диастереомерные смеси, например, могут быть разделены на их индивидуальные диастереомеры с помощью фракционной кристаллизации, хроматографии, подборки растворителя и аналогичными процедурами. Это разделение может проводиться для исходного соединения или для самого соединения формулы I. Энантиомеры могут быть разделены с образованием диастереомерных солей, например с образованием соли с энантиомерно-чистой хиральной кислотой, или с помощью хроматографии, например, ВЭЖХ с помощью хроматографических субстратов с хиральными лигандами.
На дополнительных стадиях способа, проводимых при необходимости, функциональные группы исходных соединений, которые не должны участвовать в реакции, могут присутствовать в незащищенной форме или могут быть защищены, например, одним или несколькими защитными группами, указанными далее. Защитные группы затем полностью или частично удаляются описанными здесь способами.
Защитные группы уже могут присутствовать в предшественнике и должны защищать функциональные группы от нежелательных вторичных реакций. Характеристикой защитных групп является то, что они сами легко удаляются, т.е. без нежелательных вторичных реакций, обычно сольволизом, восстановлением, фотолизом или также активными ферментами, например, в условиях, аналогичных физиологическим условиям, и что они не присутствуют в конечных продуктах. Специалисту известно или можно легко установить, какие защитные группы подходят для указанных выше и далее реакций.
Защита таких функциональных групп защитными группами, сами защитные группы и реакции для их удаления описаны, например, в стандартных источниках, таких как J.F.W.McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London и New York 1973, в Т.W.Greene, "Protective Groups in Organic Synthesis", Wiley, New York 1981, в "The Peptides"; Volume 3 (editors: E.Gross и J.Meienhofer), Academic Press, London and New York 1981, в "Methoden der organischen Chemie" (Methods of organic chemistry), Houben Weyl, 4th edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974, в H.-D.Jakubke и H.Jescheit, "Aminosauren, Peptide, Proteine" (Amino acids, peptides, proteins), Verlag Chemie, Weinheim, Deerfield Beach, и Basel 1982 и в Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of carbohydrates: monosaccharides и Derivatives), Georg Thieme Verlag, Stuttgart 1974.
Все описанные здесь стадии способа могут осуществляться в известных реакционных условиях, предпочтительно в условиях, конкретно указанных, в отсутствие или обычно в присутствии растворителей или разбавителей, предпочтительно инертных к используемым реагентам и способным их растворять, в отсутствие или присутствии катализаторов, конденсирующих агентов или нейтрализующих агентов, например ионообменных смол, обычно катионообменных смол, например, в Н+ форме, в зависимости от вида реакции и/или реагентов при пониженной, нормальной или повышенной температуре, например в области от -100°С приблизительно до 190°С, предпочтительно приблизительно от -80°С приблизительно до 150°С, например при от -80 до -60°С, при комнатной температуре, при от -20 до 40°С или при температуре кипения используемого растворителя, при атмосферном давлении или в закрытом сосуде, при повышенном давлении и/или в инертной атмосфере, например, под аргоном или азотом.
Соединения по изобретению и их фармацевтически приемлемые кислотные аддитивные соли, далее описанные как агенты по изобретению, проявляют ценные фармакологические свойства при тестировании in vitro и на животных и, следовательно, являются полезными в качестве фармацевтических средств.
В частности, агенты по изобретению являются агонистами α7 никотинового ацетилхолинового рецептора (nAChR).
В функциональных анализах агенты по изобретению проявляют высокое сродство к α7 nAChR, что показано в следующих тестах:
а) Функциональный анализ на сродство с α7 nAChR проводили с клеточными линиями слизистых оболочек крыс, стабильно экспрессирующими α7 nAChR. При стимулировании рецептора использовали приток кальция. В этом анализе агенты по изобретению проявляют значения pEC50 приблизительно от 5 приблизительно до 8.
б) Для оценки активности агентов по изобретению на человеческих нервных nAChR α4β2 проводили аналогичный функциональный анализ, используя эпителиальную клеточную линию человека, стабильно экспрессирующую α4β2 подтип человека. В этом анализе агенты по изобретению проявляют селективность в отношении α7 nAChR подтипа.
в) Для оценки активности соединений по изобретению на "ганглиальный подтип" и мышечный тип никотинового рецептора проводили аналогичный функциональный анализ, как описано в а), используя эпителиальную клеточную линию человека, стабильно экспрессирующую ганглиальный подтип человека, или клеточную линию, эндогенно экспрессирующую мышечный тип никотиновых рецепторов человека. В этих анализах агенты по изобретению не проявляют или проявляют незначительную активность на ганглиальный и мышечный типы никотинового рецептора.
В модели мыши с сенсорным недостатком пропускания (DBA/2-мышь), описанной S.Leonard и др. в Schizophrenia Bulletin 22, 431-445 (1996), агенты по изобретению вызывают существенные сенсорные концентрации пропускания приблизительно от 10 приблизительно до 40 мкМ.
Агенты по изобретению, следовательно, полезны для предотвращения и лечения психических заболеваний, таких как шизофрения, мания, депрессия и беспокойство, и для предотвращения и лечения нейродегенеративных заболеваний, таких как старческое слабоумие, болезнь Альцгеймера и другие заболевания ухудшения интеллекта, такие как гиперактивные заболевания недостатка внимания (ADHD); болезнь Паркинсона, хорея Хантингтона, амиотрофный латеральный склероз, рассеянный склероз, эпилепсия, конвульсии, синдром Тоуретта, OCD (навязчивая зависимость), невропатия, послеоперационная и воспалительная боль, фантомная боль, познавательная способность, зависимость от курения, дефицит и нарушения памяти, дефицит обучения, панические заболевания, нарколепсия, заболевания болевых рецепторов, слабоумие при СПИДе, старческое слабоумие, аутизм, поздняя дискинезия, социальная фобия, псевдослабоумие. Пригодность агонистов α7 nAChR для нейродегенерации описана в уровне техники, например, в Wang и др., J.Biol. Chem. 275, 5626-5632 (2000).
Для указанных выше показаний подходящая дозировка агентов по изобретению, конечно, зависит, например, от пациента, способа введения и природы и серьезности излечиваемого заболевания, а также от относительной способности конкретного применяемого агента по изобретению. Например, требуемое количество активного агента может быть определено на основании известных методик in vitro и in vivo, определяя, насколько долго концентрация конкретного активного агента сохраняется в плазме крови на приемлемом для терапевтического эффекта уровне. Обычно удовлетворительные результаты на животных были получены в дневной дозировке приблизительно от 0,01 приблизительно до 20,0 мг/кг перорально. Для человека указанная дневная дозировка находится в области приблизительно от 0,7 приблизительно до 1400 мг/день перорально, например приблизительно от 50 до 200 мг (для 70 кг человека), обычно вводимая один раз, или в раздельных дозах до 4 раз в день, или в форме длительного высвобождения. Соответственно подходящие оральные дозированные формы включают приблизительно от 1,75 или 2,0 приблизительно до 700 или 1400 мг агента по изобретению в смеси с подходящим фармацевтически приемлемым разбавителем или носителем.
Примеры композиций, включающих агент по изобретению, включают, например, твердые дисперсии, водный раствор, например, содержащий солюбилизирующий агент, микроэмульсию и суспензию, например, гидрохлоридной соли соединения формулы I в области от 0,1 до 1%, например 0,5%. рН Композиции может быть доведен, например, до от 3,5 до 9,5, например рН 4,5, подходящим буферным агентом.
Агенты по изобретению также полезны в качестве химических веществ для исследования.
Для применения в соответствии с изобретением агент по изобретению можно вводить в виде отдельного активного агента или в комбинации с другими активными агентами, обычно применяемыми для лечения указанных здесь заболеваний, любым обычным способом, например орально, например, в форме таблеток или капсул, или парентерально, например, в форме инъекционных растворов или суспензий.
Фармацевтические композиции для отдельного комбинированного введения партнеров и для введения фиксированных комбинаций, т.е. отдельной галеновой композиции, включающей по крайней мере два партнера в комбинации, в соответствии с изобретением могут быть получены известным способом и подходят для энтерального, такого как орального или ректального, и парентерального введения млекопитающим, включая человека, включают терапевтически эффективное количество по крайней мере одного фармакологически активного партнера в комбинации отдельно или в комбинации с одним или несколькими фармацевтически приемлемыми носителями, особенно подходящими для энтерального или парентерального применения.
Фармацевтические композиции содержат, например, приблизительно от 0,1% приблизительно до 99,9%, предпочтительно приблизительно от 20% приблизительно до 60% активных ингредиентов. Фармацевтическими составами для комбинированной терапии для энтерального или парентерального введения являются, например, единичные дозированные формы, такие как покрытые сахаром таблетки, таблетки, капсулы или свечи и, кроме того, ампулы. Если не указано иное, их получают обычным способом, например обычными способами смешивания, гранулирования, покрывания сахаром, растворения или лиофилизации. Ясно, что единичное содержание партнера комбинации, содержащееся в индивидуальной дозе каждой дозированной формы, не должно само составлять эффективное количество, поскольку необходимое эффективное количество может достигаться введением нескольких дозированных единиц.
В частности, терапевтически эффективное количество каждого из партнеров комбинации может вводиться одновременно или последовательно и в любом порядке, и компоненты могут вводиться отдельно или в виде смешанной комбинации. Например, способ остановки прогрессии или лечения пролиферативного заболевания в соответствии с изобретением может включать (i) введение партнера комбинации (а) в свободной форме или в форме фармацевтически приемлемой соли и (ii) введение партнера комбинации (б) в свободной форме или в форме фармацевтически приемлемой соли, одновременно или последовательно в любом порядке, совместно в терапевтически эффективных количествах, предпочтительно в синергетически эффективных количествах, например в дневных дозировках, соответствующих описанным здесь количествам. Конкретные партнеры в комбинации могут вводиться отдельно в различное время во время лечения или вместе в отдельных или одной форме комбинации. Кроме того, термин введение также обозначает применение пролекарства партнера комбинации, который in vivo превращается в партнера комбинации. Настоящее изобретение, следовательно, должно пониматься как совмещение всех таких режимов одновременно или альтернативное лечение, и термин "введение" должен интерпретироваться соответственно.
Эффективная дозировка каждого из применяемых партнеров комбинации может изменяться в зависимости от конкретного соединения или применяемой фармацевтической композиции, способа введения, излечиваемого состояния, серьезности излечиваемого заболевания. Так, режим дозировки выбирают в соответствии с различными факторами, включая способ введения и функцию почек и печени пациента. Врач, доктор или ветеринар может легко определить и прописать эффективное количество отдельных активных ингредиентов, необходимых для предотвращения, противостояния или остановки прогрессирования заболевания. Оптимальное состояние в достижении концентрации активных ингредиентов в области, которая проявляет эффективность без токсичности, требует режим, основанный на кинетике доступности активных ингредиентов для сайта-мишени.
В соответствии с вышеизложенным настоящее изобретение также относится к:
(1) Агенту по изобретению для применения в качестве агониста альфа-7 рецептора, например, для применения в любых описанных выше конкретных показаниях.
(2) Фармацевтической композиции, включающей агент по изобретению в качестве активного ингредиента вместе с фармацевтически приемлемым разбавителем или носителем.
(2′) Фармацевтической композиции для лечения или предотвращения заболевания или состояния, в котором играет роль или присутствует активация альфа-7 рецептора, включающей агент по изобретению и носитель.
(3) Способу лечения любого указанного выше конкретного показания у субъекта, нуждающегося в этом, который включает введение эффективного количества агента по изобретению.
(3′) Способу лечения или предотвращения заболевания или состояния, в котором играет роль или присутствует активация альфа-7 рецептора, включающему введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества агента по изобретению.
(4) Применению агента по изобретению для получения лекарственного средства для лечения или предотвращения заболевания или состояния, в котором играет роль или присутствует активация альфа-7 рецептора.
(5) Способу, как определено выше, включающему также введение, например, одновременно или последовательно, терапевтически эффективного количества агониста альфа-7, например агента по изобретению и второго лекарственного средства, где указанное второе лекарственное средство предназначено, например, для применения в любом указанном выше конкретном показании.
(6) Комбинации, включающей терапевтически эффективное количество агониста альфа-7, например агента по изобретению и второе лекарственное средство, где указанное второе лекарственное средство предназначено, например, для применения в любом указанном выше конкретном показании.
Следующие примеры иллюстрируют настоящее изобретение.
Сокращения, используемые в примерах:
Пример 1: Получение (рац.)-3-[6-(4-фторфенил)-пиридазин-3-илокси]-1-азабицикло [2,2,2]октана
Раствор (рац.)-3-хинуклидинола (0,007 моль) в сухом ТГФ под азотом обрабатывали гидридом натрия (60% в минеральном масле; 1,1 эквив.). Через 1 час при комнатной температуре добавляли раствор 3-хлор-6-(4-фтор-фенил)пиридазина (1,0 эквив.) в ТГФ (30 мл) и реакционную смесь нагревали при кипении с обратным холодильником в течение 6 часов. После охлаждения до комнатной температуры ТГФ упаривали и остаток растворяли в этилацетате (100 мл) и затем промывали водой (3×20 мл), затем раствором хлорида натрия (20 мл). Этилацетат сушили над безводным сульфатом магния, отфильтровывали и упаривали досуха и полученное масло очищали колоночной хроматографией на силикагеле (элюент: этилацетат-метанол-триэтиламин (50:10:2) с получением (рац.)-3-[6-(4-фторфенил)-пиридазин-3-илокси]-1-азабицикло[2,2,2]октана в виде бесцветного твердого вещества. 1Н-ЯМР (400 МГц, CDCl3): δ=8,00 (т, 2Н), 7,75 (d, 1Н), 7,17 (m, 2Н), 7,1 (d, 1H), 5,35 (m, 1H), 3,5 (m, 1H), 2,99-2,83 (m, 5H), 2,32 (m, 1H), 1,98 (m, 1H), 1,76-1,68 (m, 2H), 1,46 (m, 1H).
Следующие соединения формулы I, в которых Y представляет собой 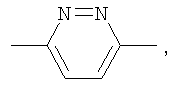 могут быть получены аналогично примеру 1:
могут быть получены аналогично примеру 1:
(соль)
(соль)
Пример 17: Получение (рац.)-3-(5-фенил-пиримидин-2-илокси)-1-азабицикло[2.2.2]октана
5-Бром-2-гидрокси-пиримидин (400 мг, 2,29 ммоль), (рац.)-3-хинуклидинол (432 мг, 3,36 ммоль) и трифенилфосфин (890 мг, 3,40 ммоль) растворяли в ТГФ (25 мл). После перемешивания в течение 10 мин при -10°С по каплям добавляли раствор DEAD (522 мкл, 3,36 ммоль) в ТГФ (20 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь упаривали с получением оранжевого полутвердого вещества (2,50 г), которое растирали с AcOEt и отфильтровывали с получением (рац.)-3-(5-бром-пиримидин-2-илокси)-1-азабицикло[2,2,2]-октана в виде белого твердого вещества. Фильтрат очищали FC (силикагель, элюенты: AcOEt/MeOH 9:1, затем AcOEt/MeOH/NEt3 70:27:3). (рац.)-3-(5-Бром-пиримидин-2-илокси)-1-азабицикло[2,2,2]октан (150 мг, 0,53 ммоль), фенилборную кислоту (66 мг, 0,54 ммоль) и тетракис(трифенил-фосфин)палладий растворяли в смеси толуол:EtOH 9:1 (15 мл). Na2СО3 (225 мг, 2,12 ммоль) растворяли в воде (1,5 мл) и добавляли к реакционной смеси, которую нагревали при 90°С в течение 20 ч. После охлаждения до комнатной температуры смесь отфильтровывали через целит; толуольный слой отделяли и промывали насыщенным раствором хлорида натрия. Водные слои повторно экстрагировали AcOEt, объединенные органические экстракты сушили над MgSO4, отфильтровывали и фильтрат упаривали с получением светло-желтой смолы (195 мг), которую очищали FC (силикагель, элюенты: AcOEt/MeOH 9:1, затем AcOEt/MeOH/NEt3 70:27:3) с получением белого твердого вещества, которое все еще содержало исходный реагент. Вторую очистку осуществляли RP-ВЭЖХ (Phenomenex RP18 колонка, градиент 0,08% водн. HCOOH/CH3CN 95:5→СН3CN в течение 20 мин) с получением (рац.)-3-(5-фенил-пиримидин-2-илокси)-1-азабицикло[2,2,2]октана в виде его соли формата; ВЭЖХ при комнатной температуре (мин): 5,4; tпл, °С: 108-114; М+Н+ 282,2.
Пример 18: Получение (R)-3-(5-Фенил-пиримидин-2-илокси)-1-азабицикло[2.2.2]октана
5-Бром-2-хлор-пиримидин (400 мг, 2,03 ммоль), фенилборную кислоту (253 мг, 2,07 ммоль) и тетракис(трифенилфосфин)палладий (118 мг, 0,102 ммоль) растворяли в смеси толуол/EtOH 9:1 (50 мл). Na2СО3 (861 мг, 8,12 ммоль) растворяли в воде (4 мл) и добавляли к реакционной смеси. Смесь перемешивали при 90°С в течение 19 ч, охлаждали до комнатной температуры и отфильтровывали через целит. Толуольный слой отделяли и промывали насыщенным раствором хлорида натрия. Водные слои повторно экстрагировали AcOEt; объединенные органические экстракты сушили над MgSO4 и отфильтровывали. Фильтрат упаривали с получением желтого твердого вещества (503 мг), которое очищали FC (силикагель, элюенты циклогексан и AcOEt/циклогексан 1:9) с получением 2-хлор-5-фенил-пиримидина.
(R)-3-хинуклидинол (478 мг, 3,76 ммоль) добавляли к суспензии NaH (164 мг 60% дисперсии в минеральном масле, 4,09 ммоль) в ДМФА (10 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли 2-хлор-5-фенил-пиримидин (177 мг, 0,93 ммоль) и смесь нагревали в течение 3,5 ч при 90°С. Реакционную смесь разбавляли толуолом и промывали 1М водн. раствором NaOH и насыщенным раствором хлорида натрия. Водные слои повторно экстрагировали толуолом (3х). Объединенные органические экстракты сушили над MgSO4 и отфильтровывали. Фильтрат упаривали с получением желтого твердого вещества (310 мг), которое очищали FC (силикагель, элюенты: AcOEt, затем AcOEt/MeOH/NEt3 80:18:2). Вторую очистку осуществляли RP-ВЭЖХ (Phenomenex RP18 колонка, градиент 0,08% водн. НСООН→0,08% водн. HCOOH/CH3CN 80:20 в течение 10 мин, → CH3CN в течение 15 мин) с получением (R)-3-(5-фенил-пиримидин-2-илокси)-1-азабицикло[2,2,2]-октана в виде его соли формата, ВЭЖХ при комнатной температуре (мин): 5,4; tпл, °C: 108-110; [α]D KT+8,6 (1,03, MeOH), M+H+ 282,2.
Следующие соединения формулы I, в которых -O-Y- представляет собой 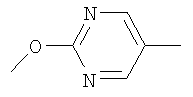 , могут быть получены аналогично примеру 17 или 18:
, могут быть получены аналогично примеру 17 или 18:
(0,95% МеОН)
(соль)
(соль)
(соль)
Пример 58: Получение (R)-3-(6-п-Толил-пиридин-3-илокси)-1-азабицикло[2,2.2]октана
К раствору 2-амино-5-хлорпиридина (15,0 г, 116,7 ммоль) в 47% водн. HBr (75,0 мл) при -10°С медленно добавляли бром (18,0 мл, 353,7 ммоль). Медленно добавляли водн. раствор NaNO2 (28,1 г, 407,3 ммоль). Смесь перемешивали в течение 1 ч при от -10 до -5°С, затем в течение 1 ч при 5°С. Смесь нейтрализовали 5М водн. раствором NaOH, поддерживая температуру ниже 25°С. Осадок отфильтровывали и перекристаллизовывали из пентана с получением 2-бром-5-хлорпиридина.
2-Бром-5-хлорпиридин (5,0 г, 26,0 ммоль), п-толилборную кислоту (4,0 г, 29,4 ммоль) и тетракис(трифенилфосфин)палладий (1,44 г, 1,2 ммоль) растворяли в смеси толуол:EtOH 9:1 (1375 мл). К реакционной смеси добавляли 2М водн. раствора Na2СО3 (62,5 мл). Смесь перемешивали при 90°С в течение 24 ч, охлаждали до комнатной температуры и отфильтровывали через целит. Толуольный слой отделяли и промывали насыщенным раствором хлорида натрия. Водные слои экстрагировали AcOEt. Объединенные органические экстракты сушили над MgSO4 и отфильтровывали. Фильтрат упаривали с получением коричневого твердого вещества, которое очищали FC (силикагель, толуол в качестве элюента) с получением 5-хлор-2-п-толил-пиридина.
(R)-3-Хинуклидинол (2,97 г, 23,4 ммоль) добавляли к суспензии NaH (0,96 г 60% дисперсии в минеральном масле, 22,8 ммоль) в ДМФА (90 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли 5-хлор-2-п-толил-пиридин (4,00 г, 19,6 ммоль) и смесь нагревали в течение 135 ч при 135°С. Реакционную смесь разбавляли толуолом и промывали 1М водн. раствором NaOH и насыщенным раствором хлорида натрия. Водные слои повторно экстрагировали толуолом (3х). Объединенные органические экстракты сушили над MgSO4 и отфильтровывали. Фильтрат упаривали с получением коричневого масла, которое очищали FC (силикагель, элюенты: AcOEt, затем AcOEt/MeOH/NEt3 87:10:3) и перекристаллизовывали из CH3CN с получением (R)-3-(6-п-толил-пиридин-3-илокси)-1-азабицикло[2,2,2]октана; tпл, °С: 110-112; [α]D KT=+21,2° (0,50% МеОН), M+H+ 295,2.
Следующие соединения формулы I, в которых -O-Y-R представляет собой 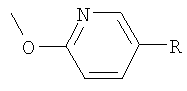 или
или 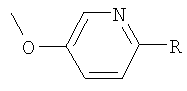 , могут быть получены аналогично примеру 58:
, могут быть получены аналогично примеру 58:
















Условия ВЭЖХ
Для примеров 1-21, 27-29, 32, 33, 35-38, 41-46, 48-53: колонка Phenomenex Luna или Kingsorb С 18, 30×4,6 мм, 3 мкМ. Градиент (А {Н2O+0,08% НСООН} В CH3CN): 0-5 мин: А:В от 100:0 до 80:20, 5-10 мин: от 80:20 до 0:100, поток 3,0 мл/мин.
Для примеров 22-26: колонка Waters Xterra MS С 18, 50×2,1 мм, 2,5 мкМ. Градиент (А: {Н2O+0,02%ТФУК}, В:{СН3CN+0,02%ТФУК}): 0-2 мин: А:В от 90:10 до 5:95; 2-4 мин: 5:95, 4-5,5 мин от 5:95 до 10:90, 5,5-6 мин: от 10:90 до 90:10, 6-7 мин: 90:10, поток 0,35 мл/мин.
Для примеров 30, 31, 34, 39, 40, 47, 54-74: колонка Waters Xterra MS С 18, 150×2,1 мм, 3,5 мкМ. Градиент (А:{Н2O+0,02%ТФУК}, В:{СН3CN+0,02%ТФУК}): 0-3 мин: А:В от 90:10 до 10:90; 3-8 мин: 10:90, 8-9 мин: от 10:90 до 90:10, 9-15 мин: 90:10, поток 0,35 мл/мин.
Пример 75: Получение R-3-(6-(2-фтор-4-метил-фенил)-пиридазин-3-илокси)-1-азабицикло[2.2.2]октана
К суспензии гидрида натрия (60% в минеральном масле, 0,234 г, 5,84 ммоль) в ДМФА (5 мл) медленно добавляли раствор (R)-(-)-3-хинуклидинола (0,742 г, 5,84 ммоль) в сухом ДМФА (5 мл) и перемешивали при 50°С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли раствор 3-хлор-6-(2-фтор-4-метил-фенил)-пиридазина (1,05 г, 4,49 ммоль) в ДМФА (10 мл). Полученную реакционную смесь перемешивали в течение 24 ч, гасили добавлением H2O и упаривали в высоком вакууме с получением оранжевого остатка. К остатку добавляли Н2О (100 мл) и экстрагировали EtOAc (3×50 мл). Органические экстракты объединяли, промывали Н2О (100 мл), сушили над MgSO4 (безводным) и упаривали при пониженном давлении с получением желтого твердого вещества, которое очищали хроматографией, получая указанный в заголовке продукт, ВЭЖХ при комнатной температуре (мин): 4,7; tпл, °С: 128-130; [α]D KT=+37° (0,1%, МеОН).
Стадия 75.1: Получение 2-фтор-4-метилбензолборной кислоты
К смеси толуола (160 мл) и ТГФ (40 мл) добавляли триизопропилборат (13,56 мл, 58,42 ммоль) и 3-фтор-4-бромтолуол (10,0 г, 48,69 ммоль). Смесь охлаждали до -40°С и медленно добавляли н-бутиллитий (2,5М в гексане) (23,4 мл, 58,42 ммоль) в течение 1 ч и смесь перемешивали в течение дополнительного часа, при этом температуру поддерживали при -40°С. Баню ацетон/сухой лед удаляли и реакционную смесь нагревали до -20°С перед добавлением 2,5М раствора HCl (20 мл). Когда смесь достигала комнатной температуры, водный слой экстрагировали EtOAc (3×50 мл), органические экстракты объединяли, сушили над MgSO4 (безводным) и упаривали при пониженном давлении с получением желтого твердого вещества, которое перекристаллизовывали из ацетонитрила с получением указанного в заголовке продукта.
Стадия 75.2: Получение 3-хлор-6-(2-фтор-4-метил-фенил)-пиридазина
К раствору 3,6-дихлорпиридазина (2,0 г, 13,42 ммоль) в 1,4-диоксане (20 мл) добавляли Pd2(dba)3 (0,21 г, 0,2 ммоль), P(tBu)3 (0,122 г, 0,6 ммоль) в 1,4-диоксане (1 мл), KF (2,57 г, 44,3 ммоль) и 2-фтор-4-метилбензолборную кислоту (стадия 31,1, 2,68 г, 17,45 ммоль). Полученную смесь нагревали при 120°С в течение 48 ч. Реакционную смесь отфильтровывали через целит и осадок промывали EtOAc. Фильтрат промывали Н2О, сушили над MgSO4 (безводным) и упаривали при пониженном давлении с получением коричневого твердого вещества, которое очищали хроматографией, с получением указанного в заголовке продукта.
Следующие соединения формулы I, в которых Y представляет собой  , могут быть получены аналогично примеру 75:
, могут быть получены аналогично примеру 75:
Пример 85:
Следующие соединения формулы I, в которых Y представляет собой  , могут быть получены аналогично примеру 75:
, могут быть получены аналогично примеру 75:
Пример 86: Мягкие капсулы
5000 Мягких желатиновых капсул, каждая из которых включает в качестве активного ингредиента 0,05 г одного из соединений формулы I, указанных ранее в примерах, получали следующим образом:
Композиция
Способ получения: Измельченный активный ингредиент суспендировали в Lauroglykol® (лаурат пропиленгликоля, Gattefossé S.A., Saint Priest, France) и помещали во влажный пульверизатор для получения частиц размером приблизительно от 1 до 3 мкм. Порции 0,419 г смеси затем вводили в мягкие желатиновые капсулы с помощью капсулонаполняющего устройства.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-(ГЕТЕРОАРИЛОКСИ)-2-АЛКИЛ-1-АЗАБИЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ, КАК ЛИГАНДЫ АЛЬФА-7-nAChR (НИКОТИНОВЫХ АЦЕТИЛХОЛИНОВЫХ РЕЦЕПТОРОВ), ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2005 |
|
RU2402551C2 |
| ПРОИЗВОДНЫЕ 1-АЗАБИЦИКЛО[3.3.1]НОНАНОВ | 2005 |
|
RU2445313C2 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| ПРОИЗВОДНЫЕ ХИНУКЛИДИНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, КОМБИНИРОВАННЫЙ ПРОДУКТ И СПОСОБ ИНГИБИРОВАНИЯ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2003 |
|
RU2314306C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ СОЕДИНЕНИЙ ПИРИМИДИНА И ПИРИДИНА С BTK ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2765154C2 |
| ПРОИЗВОДНЫЕ ДОЛАСТАТИНА 15 | 1998 |
|
RU2195462C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА С ИСПОЛЬЗОВАНИЕМ СОЕДИНЕНИЙ ПИРИМИДИНА И ПИРИДИНА С BTK ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2779287C2 |
| НОВЫЕ ХИНУКЛИДИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2323217C2 |
| ПРОИЗВОДНЫЕ 2-АЗА-БИЦИКЛО[3.3.0]ОКТАНА | 2008 |
|
RU2478099C2 |
Изобретение относится к производным 1-азабициклоалкила общей формулы I,
в которых Х представляет собой СН2 или простую связь; Y представляет собой группу формулы
 или
или 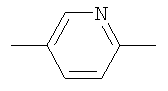
и где R имеет значения, указанные в описании, которые являются агонистами альфа 7 никотинового ацетилхолинового рецептора (nAChR); к способам их получения, их применению в качестве фармацевтических средств и к включающим их фармацевтическим композициям. 7 н. и 11 з.п. ф-лы.
1. Производное азабициклоалкила формулы I
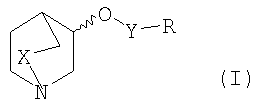
в котором Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 или
или 
R представляет собой замещенный или незамещенный С5-С10арил или замещенный или незамещенный гетеро-С5-С10арил;
где заместитель или заместители С5-С10арила или гетеро-С5-С10арила представляют собой один или более заместителей, выбранных из галогена, CN, незамещенного или галогензамещенного С1-С4алкила, незамещенного или галогензамещенного С2-С4алкенила, незамещенного или галогензамещенного С2-С4алкинила, незамещенного или галогензамещенного С2-С4алкокси, формила, ацетила, C1-С3алкоксикарбонила, N,N-ди-(C1-С3алкил)карбамоила, фенила и фенокси; или заместители могут быть конденсированы вместе с С5-С10арилом или гетеро-С5-С10арилом с образованием бензо[1,3]диоксола или 2,3-дигидробензо[1,4]диоксина и/или в другое гетероциклическое кольцо;
гетеро-С5-С10арил представляет собой ароматическую гетероциклическую систему, включающую один, два или три гетероатома, выбранных из N, О, S;
или производное азабициклоалкила выбрано из
(рац.)-3-[6-(4-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(3R,48)-3-[6-фенилпиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(3S,4R)-3-[6-фенилпиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(R)-3-[6-(4-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(рац.)-3-[6-(2-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-дихлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,5-дихлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(1-изобензофуранил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4,5-диметил-2-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-этилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-5-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-ОСН2Офенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-4-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-дифторметоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-изопропилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-диметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2,5-дифтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-5-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-трифторметоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(3R,4S)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(3S,4R)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(R)-3-[6-(2,5-дифторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-н-пропилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-хлор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(индан-5-ил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(6-тетралинил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-нафтил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-бензотиенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана, и
(R)-3-[6-(1-нафтил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана, в форме свободного основания или кислотной аддитивной соли.
2. 3-[6-фенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октан в форме свободного основания или кислотной аддитивной соли.
3. Производное азабициклоалкила формулы I

в котором Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 или
или  ;
;
R представляет собой замещенный или незамещенный С5-С10арил или замещенный или незамещенный гетеро-С5-С10арил;
где заместитель или заместители С5-С10арила или гетеро-С5-С10арила представляют собой один или более заместителей, выбранных из галогена, CN, незамещенного или галогензамещенного С1-С4алкила, незамещенного или галогензамещенного С2-С4алкенила, незамещенного или галогензамещенного С2-С4алкинила, незамещенного или галогензамещенного С1-С4алкокси, формила, ацетила, С1-С3алкоксикарбонила, N,N-ди-(C1-С3алкил)карбамоила, фенила и фенокси; или заместители могут быть конденсированы вместе с С5-С10арилом или гетеро-С5-С10арилом с образованием бензо[1,3]диоксола или 2,3-дигидробензо[1,4]диоксина и/или в другое гетероциклическое кольцо;
гетеро-С5-С10арил представляет собой ароматическую гетероциклическую систему, включающую один, два или три гетероатома, выбранных из N, О, S;
в форме свободного основания или кислотной аддитивной соли.
4. Производное азабициклоалкила формулы I по п.1, в котором Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 или
или  ;
;
и R представляет собой фенил, нафтил, тетрагидронафтил, инданил, тиенил, бензотиенил, фуранил, бензофуранил и изобензофуранил, которые в каждом случае могут быть незамещенными или моно-, ди- или тризамещенными галогеном, циано, формилом, ацетилом, С1-С3алкоксикарбонилом, N,N-ди-(С1-С3алкил)карбамоилом, фенилом, фенокси, метилендиокси, этилендиокси; или С1-С4алкилом, С2-С4алкенилом, C2-С4алкинилом или С1-С4алкокси, которые сами могут быть незамещенными или моно-, ди- или тризамещенными галогеном;
в форме свободного основания или кислотной аддитивной соли.
5. Производное азабициклоалкила формулы I по п.1, в котором
Х представляет собой СН2 или простую связь;
Y представляет собой группу формулы
 или
или  ;
;
и R представляет собой
(а) фенил, который является незамещенным или моно-, ди- или тризамещенным галогеном, циано, метилендиокси,
С1-С4алкил, который является незамещенным или моно-, ди- или тризамещенным галогеном, или
С1-С4алкокси, который является незамещенным или моно-, ди- или тризамещенным галогеном,
(б) нафтил, или
(в) фуранил, бензофуранил, изобензофуранил или тиенил, в форме свободного основания или кислотной аддитивной соли.
6. Производное азабициклоалкила формулы I по п.1, в котором Х представляет собой СН2;
Y представляет собой группу формулы

R представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным галогеном, циано, метилендиокси, С1-С4алкилом, который является незамещенным или моно-, ди- или тризамещенным галогеном, или С1-С4алкокси, который является незамещенным или моно-, ди- или тризамещенным галогеном,
в форме свободного основания или кислотной аддитивной соли.
7. Производное азабициклоалкила формулы I по п.1, выбранное из
(рац.)-3-(5-фенилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-фенилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(S)-3-(5-фенилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(2-фторфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3-хлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3,4-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(2,4-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3,5-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3-цианофенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3-трифторметилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-бензо[1,3]диоксол-5-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-фторфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(3,5-бистрифторметилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-хлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(3-хлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-тиофен-2-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-нафталин-1-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(4-хлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-бензофуран-2-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-тиофен-3-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-нафталин-2-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2,3-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2,3-фторфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-(2-метоксифенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2,6-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(3-фторфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-фуран-3-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-фуран-2-илпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2,5-дифторфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2,5-дихлорфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-трифторметилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-о-толилилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-м-толилилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-п-толилилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(5-фтор-2-метоксифенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-фтор-4-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-фтор-5-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(3,4-диметилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-хлор-4-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-фтор-4-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана, и
(R)-3-(5-(2-хлор-5-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
в форме свободного основания или кислотной аддитивной соли.
8. Производное азабициклоалкила формулы I по п.1, выбранное из
(R)-3-(5-фенилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-п-толилилпиримидин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-(2-фтор-4-метилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана, и
(R)-3-(5-(3,4-диметилфенил)пиримидин-2-илокси)-1-азабицикло[2,2,2]октана, в форме свободного основания или кислотной аддитивной соли.
9. Производное азабициклоалкила формулы I по п.1, в котором
Х представляет собой СН2;
Y представляет собой группу формулы

R представляет собой фенил, который является незамещенным или моно-, ди- или тризамещенным галогеном, циано, метилендиокси, С1-С4алкилом, который является незамещенным или моно-, ди- или тризамещенным галогеном, или С1-С4алкокси, который является незамещенным или моно-, ди- или тризамещенным галогеном,
в форме свободного основания или кислотной аддитивной соли.
10. Производное азабициклоалкила формулы I по п.1, выбранное из
(R)-3-(6-п-толилилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(рац.)-3-(5-фенилпиридин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(5-фенилпиридин-2-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-фенилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(3-трифторметилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(2-хлорфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(тиофен-2-ил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-о-толилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-м-толилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(2,3-диметилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(4-этилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(3,4-диметилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(2-хлор-4-метилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-п-толилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(1-нафтил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(2-нафтил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана, и
(R)-3-(6-(2-хлор-5-метилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
в форме свободного основания или кислотной аддитивной соли.
11. Производное азабициклоалкила формулы I по п.1, выбранное из
(R)-3-(6-п-толилилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-фенилпиридин-3-илокси)-1-азабицикло[2,2,2]октана,
(R)-3-(6-(4-этилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана, и
(R)-3-(6-(3,4-диметилфенил)пиридин-3-илокси)-1-азабицикло[2,2,2]октана,
в форме свободного основания или кислотной аддитивной соли.
12. Производное азабициклоалкила формулы I по п.1, выбранное из
(рац.)-3-[6-(4-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(3R,4S)-3-[6-фенилпиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(3S,4R)-3-[6-фенилпиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(R)-3-[6-(4-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(рац.)-3-[6-(2-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-хлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-дихлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]
октана,
(R)-3-[6-(3-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,5-дихлорфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(1-изобензофуранил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4,5-диметил-2-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-этилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-5-трифторметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-ОСН2Офенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-4-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-дифторметоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-метоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-изопропилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-диметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2,5-дифтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-фтор-5-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3-трифторметоксифенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(3R,4S)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(3S,4R)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,1]гептана,
(R)-3-[6-(2,5-дифторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-н-пропилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-хлор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(индан-5-ил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(6-тетралинил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-нафтил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(2-бензотиенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана, и
(R)-3-[6-(1-нафтил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
в форме свободного основания или кислотной аддитивной соли.
13. Производное азабициклоалкила формулы I по п.1, выбранное из
(R)-3-[6-(2-фтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4,5-диметил-2-фторфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(3,4-диметилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
(R)-3-[6-(4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана, и
(R)-3-[6-(2,5-дифтор-4-метилфенил)пиридазин-3-илокси]-1-азабицикло[2,2,2]октана,
в форме свободного основания или кислотной аддитивной соли.
14. Производное азабициклоалкила по любому из пп.1-13 в форме свободного основания или фармацевтически приемлемой кислотной аддитивной соли, обладающее агонистической активностью в отношении α7 nAChR.
15. Фармацевтическая композиция, обладающая агонистической активностью в отношении α7 nAChR, включающая производное азабициклоалкила по любому из пп.1-13 в форме свободного основания или фармацевтически приемлемой кислотной аддитивной соли в комбинации с фармацевтическим носителем или разбавителем.
16. Способ предотвращения и лечения заболеваний у субъекта, нуждающегося в таком лечении, который включает введение такому субъекту терапевтически эффективного количества производного азабициклоалкила по любому из пп.1-13 в форме свободного основания или фармацевтически приемлемой кислотной аддитивной соли, где указанное заболевание выбрано из психического заболевания, нейродегенеративного заболевания, заболевания ухудшения интеллекта и заболевания выбранного из группы, включающей эпилепсию, конвульсии, невропатическую боль, послеоперационную боль, воспалительную боль, фантомную боль, ноцицепцию, зависимость от курения и нарколепсию.
17. Способ предотвращения и лечения заболеваний у субъекта, нуждающегося в таком лечении, который включает введение такому субъекту терапевтически эффективного количества производного азабициклоалкила по любому из пп.1-13 в форме свободного основания или фармацевтически приемлемой кислотной аддитивной соли, где указанное заболевание выбрано из психического заболевания, нейродегенеративного заболевания, заболевания ухудшения интеллекта и заболевания выбранного из группы, включающей шизофрению, манию, депрессию, беспокойство, панические заболевания, социальную фобию, старческое слабоумие, болезнь Альцгеймера, болезнь Паркинсона, позднюю дискинезию, хорею Хантингтона, амиотрофный латеральный склероз, рассеянный склероз, слабоумие при СПИДе, гиперактивные заболевания недостатка внимания, синдром Тоуретта, навязчивую зависимость, познавательную способность, дефицит памяти, нарушения памяти, нарушения обучения, аутизм, псевдослабоумие, эпилепсию, конвульсии, невропатическую боль, послеоперационную боль, воспалительную боль, фантомную боль, ноцицепцию, зависимость от курения и нарколепсия.
18. Способ активации α7 nAChR, включающий введение терапевтически эффективного количества производного азабициклоалкила по любому из пп.1-13 в форме свободного основания или фармацевтически приемлемой кислотной аддитивной соли.
| 0 |
|
SU160821A1 | |
| Самопередвигающаяся машина для погрузки сыпучих материалов из штабелей на транспортные повозки | 1952 |
|
SU98248A1 |
Авторы
Даты
2009-04-20—Публикация
2003-09-03—Подача