Изобретение относится к новым производным 2-аза-бицикло[3.3.0]октана формулы (I) и их применению в качестве фармацевтических средств. Изобретение касается также родственных аспектов, включающих способы получения соединений, композиций, содержащих одно или более соединение формулы (I), и в частности, их применение в качестве антагонистов орексин рецептора.
Орексины (орексин А или ОХ-А и орексин В или ОХ-В) являются новыми нейропептидами, открытыми в 1998 г. двумя исследовательскими группами. Орексин А представляет собой пептид, состоящий из 33 аминокислот, а орексин В является пептидом, состоящим из 28 аминокислот (Sakurai Т. et al., Cell, 1998, 92, 573-585). Орексины продуцируются в раздельных нейронах латерального гипоталамуса и связаны с G-белок-сопряженными рецепторами (OX1 и OX2 рецепторы). Орексин-1 рецептор (OX1) является селективным в отношении ОХ-А, а орексин-2 рецептор (ОХ2) способен связываться с ОХ-А, а также с ОХ-В. Было установлено, что орексины стимулируют потребление пищи у крыс, что наводит на мысль о физиологической роли этих пептидов в качестве медиаторов в центральном механизме обратной связи, регулирующем пищевое поведение (Sakurai Т. et al., Cell, 1998, 92, 573-585). С другой стороны, было также отмечено, что орексины регулируют состояния сна и пробуждения, и это открывает потенциально новые терапевтические подходы к нарколепсии, а также к бессоннице и другим расстройствам сна (Chemelli R.M. et al., Cell, 1999, 98, 437-451).
Орексин рецепторы находятся в головном мозгу млекопитающих и, как известно из литературы, могут иметь причастность к многочисленным патологиям.
Настоящее изобретение предлагает производные 2-аза-бицикло[3.3.0]октана, которые являются непептидными антагонистами орексин рецепторов человека. Эти соединения, в частности, потенциально могут применяться при лечении расстройств, связанных с приемом пищи, питьем, нарушениями сна, или когнитивных нарушений при психиатрических и неврологических заболеваниях.
До сих пор известно несколько низкомолекулярных соединений, проявляющих потенциальный антагонизм либо специфически в отношении OX1 или OX2, либо в отношении обоих рецепторов одновременно. Пептидные производные, используемые в качестве антагонистов орексин рецептора, раскрыты в публикации WO 01/096302.
Настоящее изобретение впервые описывает производные 2-аза-бицикло[3.3.0]октана в качестве антагонистов орексин рецептора.
i) Первый аспект по настоящему изобретению относится к соединению формулы (I) со стереогенными центрами в (1S,3S,5S)-конфигурации
 ,
,
где
А представляет собой арил или гетероциклил, при этом арил или гетероциклил являются незамещенными или независимо друг от друга моно- или дизамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил, С2-6алкинил, C1-4алкоксигруппу, NR2R3, галоген и незамещенный или независимо друг от друга моно- или дизамещенный фенил, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, фтор и хлор;
В представляет собой арильную или гетероциклильную группу, где арил или гетероциклил являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил, NR2R3, NHC(O)СН3 и галоген;
R1 представляет собой арил или гетероциклил, где арил или гетероциклил являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, галоген, трифторметил и NR2R3; или R1 представляет собой 2,3-дигидробензофуранильную или 2,3дигидробензо[1,4]диоксинильную группу, которые являются незамещенными или независимо друг от друга моно- или дизамещенным С1-4алкилом, C1-4алкоксигруппой и галогеном;
R2 представляет собой водород или С1-4алкил;
R3 представляет собой водород или С1-4алкил.
Также изобретение включает соединения формулы (I) и их фармацевтически приемлемые соли.
Термин "галоген" означает фтор, хлор или бром, предпочтительно фтор или хлор.
Термин "С1-4алкил", один или в комбинации с другими группами, означает линейную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами С1-4алкильных групп являются метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Предпочтительными являются метил и этил. Наиболее предпочтительным является метил.
Термин "С2-6алкинил", один или в комбинации с другими группами, означает линейную или разветвленную алкинильную группу, содержащую от 2 до 6 атомов углерода. Примерами С1-4алкинильных групп являются этинил, 1-пропинил, 1-бутинил, 3-метил-1-бутинил, 1-пентинил, 3,3-диметил-1-бутинил, 3-метил-1-пентинил, 4-метил-1-пентинил или 1-гексинил.
Термин "С3-6циклоалкил", один или в комбинации с другими группами, означает циклоалкильную группу, содержащую от 3 до 6 атомов углерода. Примерами С3-6циклоалкильных групп являются циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительным является циклопропил.
Термин "С1-4алкоксигруппа", одна или в комбинации с другими группами, означает группу формулы С1-4алкил-O-, в которой термин "С1-4алкил" имеет приведенное ранее значение, такую, как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа или трет-бутоксигруппа. Предпочтительными являются метоксигруппа и этоксигруппа. Наиболее предпочтительной является метоксигруппа.
Термин "арил", один или в комбинации с другими группами, означает фенильную или нафтильную группу, предпочтительно фенильную группу. Арильная группа может быть незамещенной или независимо моно-, ди- или тризамещенной, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил, С2-6алкинил, C1-4алкоксигруппу, трифторметил, NR2R3, NHC(O)СН3, галоген и незамещенный или независимо друг от друга моно- или дизамещенный фенил, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, C1-4алкоксигруппу, фтор и хлор.
В случае, когда "А" представляет собой "арил", термин предпочтительно означает упомянутую выше группу, которая является незамещенной или независимо друг от друга моно- или дизамещенной, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил, С2-6алкинил, С1-4алкоксигруппу, NR2R3, галоген и незамещенный или независимо друг от друга моно- или дизамещенный фенил, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, C1-4алкоксигруппу, фтор и хлор. Предпочтительными примерами, где "А" представляет собой "арил", являются незамещенный или независимо друг от друга моно- или дизамещенный фенил (предпочтительно монозамещенный фенил), где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил, С1-4алкоксигруппу и NR2R3. Предпочтительным является фенил. В дополнение к упомянутым выше заместителям заместитель "А" также замещен заместителем "В".
В случае, когда "В" представляет собой "арил", термин предпочтительно означает упомянутую выше группу, которая является незамещенной или независимо друг от друга моно-, ди- или тризамещенной, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, C1-4алкоксигруппу, трифторметил, NR2R3, NHC(O)СН3 и галоген. Предпочтительные примеры, где "В" представляет собой "арил", включают незамещенный или независимо друг от друга моно-, ди- или тризамещенный фенил (предпочтительно моно- или дизамещенный фенил), при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил, NR2R3, NHC(O)СН3 и галоген (предпочтительными являются: С1-4алкил, NHC(O)СН3, трифторметил и галоген). Примеры арильных групп включают фенил, 3-метилфенил, 4-метилфенил, 3,5-диметилфенил, 2,4-диметилфенил, 3,4-диметилфенил, 3-фторфенил, 4-фторфенил, 3-хлорфенил, 4-бромфенил, 3,4-дифторфенил, 3,4-дихлорфенил, 3-бром-4-фторфенил, 3-ацетиламинофенил и 3-трифторметилфенил. В добавление к упомянутым выше заместителям заместитель "В" присоединен к заместителю "А".
В случае, когда "А" и "В" оба представляют собой "арил", комбинация "А-В" предпочтительно означает бифенильную группу, которая является незамещенной или независимо друг от друга моно- или дизамещенной для "А" и незамещенной или моно-, ди- или тризамещенной для "В", где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил, NR2R3, NHC(O)СН3 и галоген. Предпочтительными примерами, когда "А" и "В" оба представляют собой "арил", являются бифенильные группы, которые являются незамещенными или независимо друг от друга моно- или дизамещенными для "А" и незамещенными или моно-, ди- или тризамещенными (предпочтительно моно- или дизамещенными) для "В", при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил и галоген.
В случае, когда R1 представляет собой "арил", термин предпочтительно означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, галоген, трифторметил и NR2R3 (предпочтительно, С1-4алкил, С1-4алкоксигруппу, галоген и трифторметил).
Термин "гетероциклил", один или в комбинации с другими группами, означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один, два или три гетероатома, каждый из которых независимо выбирают из кислорода, азота и серы, которые могут быть одинаковыми или различными. Примерами таких гетероциклических групп являются фуранил, оксазолил, изооксазолил, оксадиазолил, тиенил, тиазолил, изотиазолил, тиадиазолил, пирролил, имидазолил, пиразолил, триазолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, индазолил, бензоимидазолил, бензоксазолил, бензотиазолил, бензоизотиазолил, бензотриазолил, бензоксадиазолил, бензотиадиазолил, хинолинил, изохинолинил, нафтиридинил, циннолинил, хиназолинил, хиноксалинил, фталазинил, пиразоло[1,5-а]пиридил, пиразоло[1,5-а]пиримидил, имидазо[1,2-а]пиридил или имидазо[2,1-b]тиазолил. Упомянутые выше гетероциклильные группы могут быть незамещенными или независимо друг от друга моно-, ди- или тризамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей C1-4алкил, С3-6циклоалкил, С2-6алкинил, С1-4алкоксигруппу, галоген, трифторметил, NR2R3, NHC(O)СН3 и незамещенный или независимо друг от друга моно- или дизамещенный фенил, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, фтор и хлор.
В случае, когда "А" представляет собой "гетероциклил", термин предпочтительно означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно- или дизамещенными (предпочтительно, незамещенными или монозамещенными), при этом заместители независимо друг от друга выбирают из группы, включающей C1-4алкил, С3-6циклоалкил, С2-6алкинил, С1-4алкоксигруппу, NR2R3, галоген и незамещенный или независимо друг от друга моно- или дизамещенный фенил, где заместители независимо друг от друга выбирают из группы, включающей C1-4алкил, С1-4алкоксигруппу, фтор и хлор.
В другом варианте осуществления настоящего изобретения в случае, когда "А" представляет собой "гетероциклил", термин означает упомянутые выше группы, которые являются незамещенными или монозамещенными, где заместитель выбирают из группы, включающей С1-4алкил, С3-6циклоалкил и NR2R3. Предпочтительными примерами, где "А" представляет собой "гетероциклил", являются незамещенные или монозамещенные тиазолил, оксазолил, пиримидил и пиразинил (предпочтительно тиазолил), при этом заместитель выбирают из С1-4алкила, С3-6циклоалкила или NR2R3. В дополнение к упомянутым выше заместителям заместитель "А" также замещен заместителем "В".
Примерами, где "А" представляет собой "гетероциклил" и один из заместителей представляет собой "В", являются следующие:
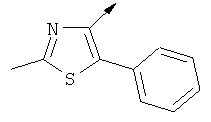
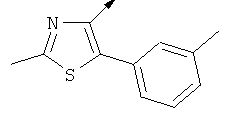


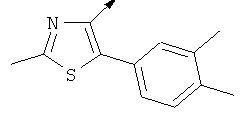
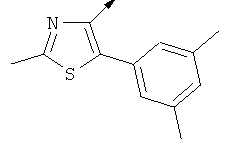


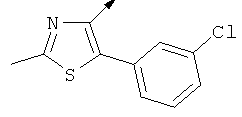
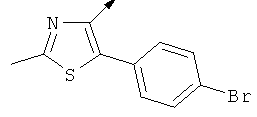

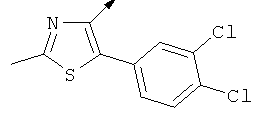
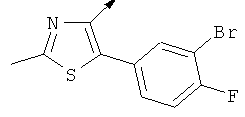
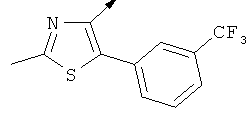
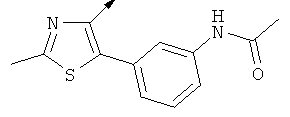
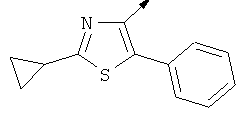

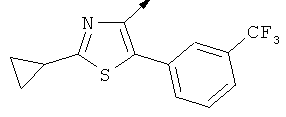

В случае, когда "В" представляет собой "гетероциклил", термин предпочтительно означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными (предпочтительно моно- или дизамещенными), при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил, NR2R3 и галоген (предпочтительно, С1-4алкил, трифторметил и галоген). В дополнение к упомянутым выше заместителям заместитель "В" присоединен к заместителю "А".
В случае, когда R1 представляет собой "гетероциклил", термин предпочтительно означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными (предпочтительно незамещенными или независимо друг от друга моно- или дизамещенными), при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, галоген, трифторметил и NR2R3. В другом предпочтительном варианте осуществления настоящего изобретения в случае, когда R1 представляет собой "гетероциклил", термин означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно-, ди- или тризамещенными, при этом заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, трифторметил и галоген. В другом предпочтительном варианте осуществления настоящего изобретения, в случае, когда R1 представляет собой "гетероциклил", термин означает упомянутые выше группы, которые являются незамещенными или независимо друг от друга моно- или дизамещенными, где заместителем является метил.
Предпочтительно примером, где R1 представляет собой "гетероциклил", является:

Следующим предпочтительным примером, где R1 представляет собой "гетероциклил", является:
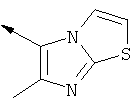
Термин "NR2R3" означает, например, NH2 и N(СН3)2.
Термин "фармацевтически приемлемые соли" относится к нетоксичным, аддитивным солям неорганических или органических кислот и/или оснований. Ссылка может быть сделана на: "Salt selection for basic drugs", Int. J. Pharm., (1986), 33, 201-217.
ii) Следующий предпочтительный вариант осуществления настоящего изобретения включает соединения формулы (I) согласно варианту i), где
А представляет собой гетероциклил, который является незамещенным или монозамещенным, при этом заместитель выбирают из группы, включающей С1-4алкил, С3-6циклоалкил или NR2R3.
iii) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-ii), где
В представляет собой арил, который является незамещенным или независимо друг от друга моно- или дизамещенным, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу, трифторметил, NHC(O)СН3 и галоген.
iv) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-iii), где
R1 представляет собой арил или гетероциклил, при этом арил или гетероциклил являются незамещенными или независимо друг от друга моно- или дизамещенными, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, С1-4алкоксигруппу и галоген; или R1 представляет собой 2,3-дигидробензофуранил- или 2,3-дигидробензо[1,4]диоксинил-группу.
v) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-iv), где
А представляет собой оксазолильную, тиазолильную или пиримидильную группу, при этом названные группы являются незамещенными или монозамещенными, где заместитель выбирают из группы, включающей C1-4алкил, С3-6циклоалкил или NH2.
vi) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-v), где
В представляет собой фенил, который является незамещенным или независимо друг от друга моно- или дизамещенным, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, трифторметил и галоген.
vii) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-vi), где
R1 представляет собой имидазо[2,1-b]тиазолильную или бензоизоксазолильную группу, которые являются незамещенными или монозамещенными, при этом заместитель выбирают из группы, включающей C1-4алкил, трифторметил и галоген; или R1 представляет собой 2,3-дигидробензофуранильную группу.
viii) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-vii), где
А представляет собой тиазолильную группу, которая является незамещенной или монозамещенной, где заместитель выбирают из группы, включающей С1-4алкил, С3-6циклоалкил или NH2.
ix) Следующий вариант осуществления настоящего изобретения включает соединения формулы (I) согласно одному из вариантов i)-viii), где
R2 и R3 оба представляют собой водород.
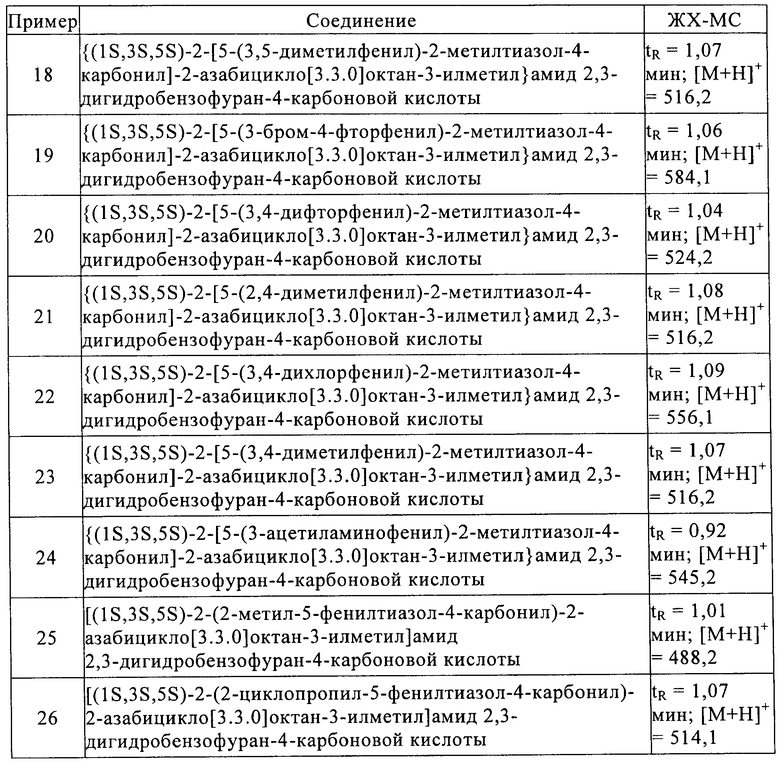
Примеры предпочтительных соединений выбирают из группы, включающей:
[(1S,3S,5S)-2-(2-метил-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
[(1S,3S,5S)-2-(2-амино-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[2-циклопропил-5-(4-фторфенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[2-циклопропил-5-(3-трифторметил-фенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид бензо[d]изоксазол-3-карбоновой кислоты;
[(1S,3S,5S)-2-(2-циклопропил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-м-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[2-метил-5-(3-трифторметилфенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-бромфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,5-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-бром-4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-дифторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(2,4-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-дихлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-ацетиламинофенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты и
[(1S,3S,5S)-2-(2-циклопропил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты.
Соединения согласно формуле (I) могут быть использованы для получения лекарственного соединения, являющегося подходящим для профилактики или лечения болезней, выбранных из группы, включающей: дистимические заболевания, включая главную депрессию и циклотимию, аффективный невроз, все типы маниакально-депрессивных заболеваний, делирий, психотические заболевания, шизофрению, кататоническую шизофрению, бредовую параною, регулируемые заболевания и все группы личностных расстройств; шизоаффективные заболевания; тревожные состояния, включая генерализованную тревогу, навязчивое компульсивное состояние, состояние посттравматического стресса, панические атаки, все типы фобической тревоги и отмены; сепаратную тревогу; все типы употребления, злоупотребления, психотропными средствами, влечение к ним и рецидивы; все типы психологических или физических аддикций, диссоциативные расстройства, включая многообразные личностные синдромы и психогенную амнезию; сексуальную и репродуктивную дисфункцию; психосексуальную дисфункцию и аддикцию; толерантность к наркотикам или синдром отмены; повышенный анестезический риск, отсутствие ответа на анестезию; гипоталамус-надпочечниковые дисфункции; распределенный биологический и циркадный ритмы; нарушения сна, связанные с такими болезнями, как неврологические расстройства, включая невропатическую боль и синдром «неспокойных ног»; остановку дыхания во сне (апноэ); нарколепсию; синдром хронической усталости; инсомнию, относящуюся к психиатрическим расстройствам; все виды идиопатической инсомнии и парасомнии; расстройства, связанные с нарушением режима сна, включая расстройство сна, связанное с перемещениями между часовыми поясами; все виды деменции и когнитивных дисфункций в здоровой популяции и при психиатрических и неврологических расстройствах; умственные возрастные дисфункции, все типы амнезии, некоторую задержку умственного развития; дискинезию и мышечные болезни; мускульную спастичность, тремор, болезни движения; спонтанную и вызываемую медикаментами дискинезию; нейродегеративные заболевания, включая болезни Хантингтона, Крейтцфельда-Якоба, Альцгеймера и синдром Туретта; амиотрофический боковой склероз; болезнь Паркинсона; синдром Кушинга; травматические повреждения; травму спинного мозга; травму головы; перинатальную гипоксию; потерю слуха; ощущение шума в ушах; демиелинизирующие болезни; спинальные и краниальные нервные болезни; повреждение зрения; ретинопатию; эпилепсию; припадки; приступы кратковременной потери сознания (абсенс), комплексные частичные и генерализованные припадки; синдром Леннокса; мигрень и головную боль; болевые расстройства; анестезию и аналгезию; усиленную или обостренную чувствительность к боли такую, как гипералгезия, каузалгия и аллодипия; острую боль; боль при ожоге; атипичную лицевую боль; нейропатическую боль; спинную боль; синдромы I и II комплексной региональной боли; боль при артрите; боль вследствие спортивных травм; зубную боль; боль, связанную с инфекциями, например, ВИЧ; боль после химиотерапии; боль после апоплексического удара; боль после операции; невралгию; остеоартрит; состояния, связанные с висцеральной болью такие, как синдром возбудимого кишечника; расстройства, связанные с принятием пищи; диабет; токсические и дисметаболические расстройства, включая церебральную аноксию, диабетические нейропатологии и алкоголизм; расстройства аппетита, вкуса, потребления пищи или жидкости; соматические расстройства, включая гипохондрию; рвоту/тошноту; рвоту; дискинезию желудочно-кишечного тракта; язву желудка; синдром Каллмана (аносмия); снижение толерантности к глюкозе; дискинезию моторики желудка; болезни гипоталамуса; болезни гипофиза; синдромы гипертермии такие, как лихорадка, лихорадочные приступы; идиопатический дефицит роста; карликовость; гигантизм; акромегалию; базофильную аденому; пролактиному; гиперпролактинемию; опухоли мозга, аденомы; доброкачественную гипертрофию простаты, рак простаты; рак эндометрия, грудной железы, толстой кишки; все типы тестикулярных дисфункций, фертильный контроль; патологии репродуктивных гормонов; приливы крови; гипоталамический гипогонадизм, функциональную или психогенную аменоррею; недержание мочи; астму; аллергию; все типы дерматита, угри и кисты, дисфункцию сальной железы; сердечно-сосудистые заболевания; болезни сердца и легких, острую и застойную сердечную недостаточность; гипотензию; гипертензию; дислипидемию, гиперлипидемию, инсулиновую резистенцию; задержку мочеиспускания; остеопороз; стенокардию; инфаркт миокарда; аритмию, сосудистые болезни, гипертрофию левого желудочка; ишемический или геморрагический удар; все типы цереброваскулярных заболеваний, включая субарахноидное кровоизлияние, ишемический или геморрагический удар и сосудистую деменцию; хроническую почечную недостаточность и другие болезни почек; подагру; рак почки; мочевое недержание; и другие болезни, относящиеся к общим дисфункциям орексиновой системы.
Соединения формулы (I) являются особенно подходящими для применения в лечении болезней или заболеваний, выбранных из группы, включающей все типы заболеваний, связанных с расстройством сна, обусловленные стрессами синдромы, применение и злоупотребление психотропными средствами, включая тягу и повторное возвращение к применению, когнитивные дисфункции в здоровой популяции и при психиатрических и неврологических расстройствах, заболевания, связанные с расстройством пищевого или питьевого поведения.
Расстройства пищевого поведения включают нарушение обмена веществ; разрегулированный контроль за аппетитом; компульсивное ожирение; рвотную булемию или нервно-психическую анерексию. Потребление патологически модифицированной пищи может быть следствием нарушенного аппетита (привлекательность или неприязнь пищи); измененный энергетический баланс (потребление против ограничения); нарушенное восприятие количества пищи (высоко жирная или высоко углеводная, особенно приятный вкус); нарушенная доступность пищи (неограниченное потребление или ограничение) или нарушенный водный баланс. Заболевания, связанные с потреблением жидкости, включают полидипсию при психиатрических расстройствах и все другие типы избыточного потребления жидкости. Расстройства сна включают все типы парасомнии, инсомнии, нарколепсии и других расстройств отсутствия сна, связанную со сном дистонию; синдром «беспокойных ног»; нарушение дыхания во время сна; синдром, связанный с перемещением между часовыми поясами; нарушение режима сна, синдром задержки или более раннего наступления сна или инсомнию, связанную с психиатрическими расстройствами. Инсомния включает в себя нарушения сна, связанные с возрастом; скачкообразным лечением хронической инсомнии; ситуационную кратковременную инсомнию (новая окружающая среда, шум) или краткосрочную инсомнию, обусловленную стрессом, горем, болью или заболеванием. Исомния включает также обусловленные стрессом синдромы такие, как пост-травматические расстройства, а также другие типы и подтипы тревожных состояний такие, как генерализованная тревога, обсессивно-компульсивное заболевание, панические атаки и все типы фобической тревоги и отмены; применение и злоупотребление психотропными средствами, стремление к применению, возвращение в исходное состояние, относящиеся ко всем типам психологической или физической наркомании и связанным с ней компонентам толерантности и зависимости. Когнитивные расстройства включают все типы дефицита внимания, обучения и функций памяти, кратковременно или хронически встречающиеся в нормальной, здоровой, молодой, зрелой или старческой популяции, и кратковременно или хронически встречающиеся при психиатрических, неврологических, сердечно-сосудистых и иммунных заболеваниях.
В следующем предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) являются особенно подходящими для применения при лечении болезней или заболеваний, выбранных из группы, включающей расстройства сна, которая включают все типы инсомнии, нарколепсию и другие расстройства, обусловленные бессоницей, связанную со сном дистонию, синдром, обусловленный перемещением между часовыми поясами; нарушение дыхания во время сна; синдром «беспокойных ног»; нарушение режима сна, синдром задержки или более раннего наступления сна или инсомнию, связанную с психиатрическими расстройствами.
В другом предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) являются особенно подходящими и/или могут быть применены при лечении болезней или заболеваний, выбранных из группы, включающей когнитивные расстройства, которые включают все типы дефицита внимания, обучения и функций памяти, кратковременно или хронически встречающиеся в нормальной, здоровой, молодой, зрелой или старческой популяции, и кратковременно или хронически встречающиеся при психиатрических, неврологических, сердечно-сосудистых и иммунных заболеваниях.
В другом предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) являются особенно подходящими для применения при лечении болезней или заболеваний, выбранных из группы, включающей расстройства, связанные с пищевым поведением, которые включают нарушение обмена веществ; разрегулированный контроль за аппетитом; компульсивное ожирение; рвотную булемию или нервно-психическую анерексию.
В другом предпочтительном варианте осуществления настоящего изобретения соединения формулы (I) являются особенно подходящими для применения при лечении болезней или заболеваний, выбранных из группы, включающей применение и злоупотребление психотропными средствами, которые включают все типы психологической или физической наркомании и связанные с ней компоненты толерантности и зависимости.
Получение фармацевтических композиций осуществляют с помощью методов, хорошо известных специалисту из области техники (см., например, Remington, The Science and Practice of Pharmacy, 21st Edition (2005), Part 5, "Pharmaceutical Manufacturing" [published by Lippincott Williams & Wilkins]), путем внесения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически подходящими субстанциями, в лекарственную форму для введения вместе с соответствующими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и, при необходимости, обычными фармацевтическими добавками.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть применены в качестве лекарственных средств, например, в виде фармацевтических композиций для энтерального или парентерального введения.
Следующий аспект изобретения касается способа получения соединений формулы (I). Соединения формулы (I) настоящего изобретения могут быть получены согласно общей последовательности реакций, представленных далее на схемах, где А, В и R1 имеют значения, приведенные в описании для формулы (I). Полученные соединения могут быть превращены в фармацевтически приемлемые соли общеизвестным методом.
В общем, все химические превращения могут быть проведены согласно хорошо известным стандартным методикам в соответствии с литературными данными или согласно описанным ниже методикам.
Получение соединений формулы (I):

Схема 1: Синтез соединений формулы (I), где А, В и R1 имеют значения, приведенные выше
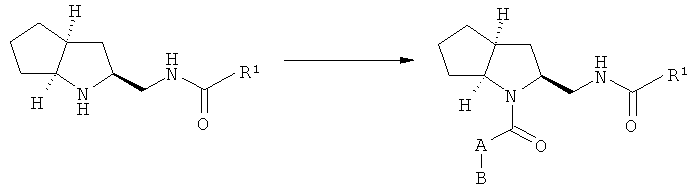
Первая стадия синтеза производных 2-аза-бицикло[3.3.0]октана формулы (I) заключается во введении защитной группы для атома азота в (1S,3S,5S)-2-азабицикло[3.3.0]октан-3-карбоксилате с использованием Бок2O и получением соединения (2), которое восстанавливают до спирта (3) путем обработки с помощью ДИБАЛ при низких температурах. Спирт (3) окисляют затем до соответствующего альдегида (4) с применением окислительного агента типа, например, перйодинана Десса-Мартина. После восстановительного аминирования соединения (4) бензиламином в присутствии восстанавливающего агента, подобного триацетоксиборгидриду натрия, бензильную группу промежуточного соединения (5) удаляют посредством гидрогенолиза с получением первичного амина (6). Ацилирование соединения (6) с помощью карбоновой кислоты R1COOH в присутствии конденсирующего агента, подобного ТБТУ, приводит к образованию амидов (7), которые после удаления Бок-группы превращаются в соединения формулы (I) путем амидной конденсации (например, В-А-СООН, ТБТУ).
Производные тиазол-4-карбоновой кислоты формулы В-А-СООН могут быть синтезированы, например, согласно схеме 2.
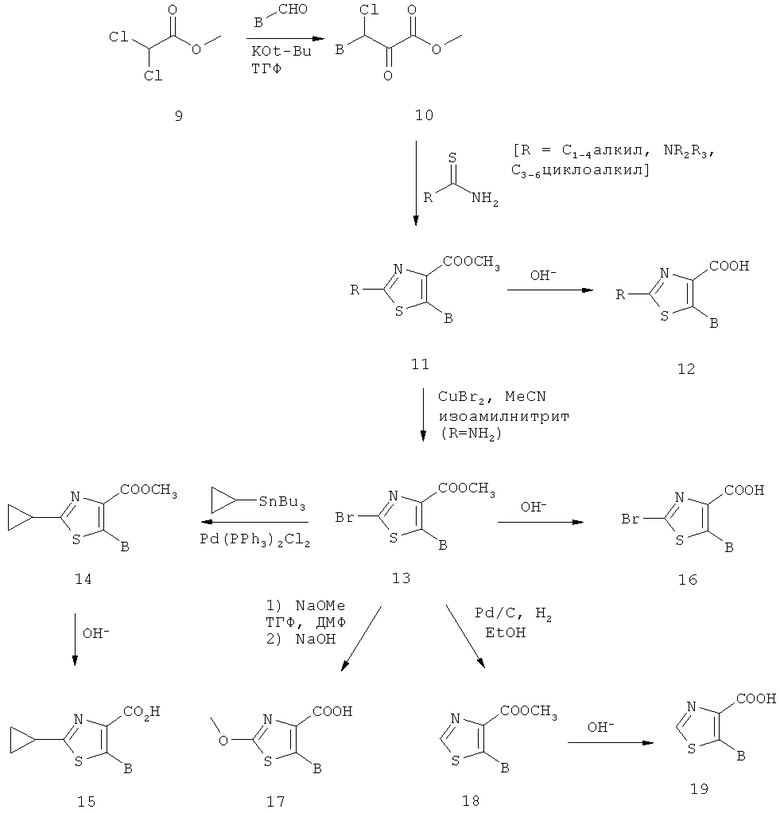
Схема 2: Синтез производных тиазол-4-карбоновой кислоты, где В имеет значение, обозначенное выше, и R обозначает C1-4алкил, С3-6циклоалкил или NR2R3, где R2 и R3 каждый представляют собой независимо друг от друга водород или C1-4алкил.
Реакцией метилдихлорацетата (9; коммерчески доступен) с альдегидом в присутствии основания, подобного трет-бутоксиду калия, получают α-оксоэфирные производные (10), которые превращают посредством реакции с тиоамидами (R обозначает C1-4алкил или С3-6циклоалкил) в 2-алкил- или 2-циклоалкилзамещенные производные тиазола (11), или посредством реакции с тиомочевиной (R обозначает NR2R3) в 2-аминозамещенные производные тиазола (11). Омыление сложно-эфирной функции с помощью, например, водного раствора гидроксида натрия в растворителе типа метанола, позволяет получить требуемые карбоновые кислоты (12, R обозначает C1-4алкил, С3-6циклоалкил или NR2R3). Производные 2-бромтиазола (13) получают, например, посредством реакции соответствующего производного 2-аминотиазола (11, R обозначает NH2) с изоамилонитрилом в присутствии бромида меди(II). Сложно-эфирные производные (13) превращают посредством катализируемой палладием реакции с производными циклопропилолова (коммерчески доступен) в соединения (14), которые после омыления превращают в карбоновые кислоты (15). Производное 2-бромтиазола (13) может быть дополнительно омылено до соответствующих карбоновых кислот (16), как описано выше, или превращено в 2-метоксизамещенный аналог (17) посредством реакции с метоксидом натрия и последующим омылением с помощью гидроксида натрия. Кроме того, соединения (19), которые не являются замещенными в 2-положении, могут быть синтезированы с помощью гидрирования соединения (13) водородом в присутствии палладия на угле и последующего омыления промежуточного сложного эфира (18). С3-6циклоалкилзамещенные тиоамиды (11), используемые в синтезе, являются коммерчески доступными, или могут быть получены посредством реакции карбоксамида с реагентом Лавессона (см. также экспериментальную часть А.1.6). Альдегиды В-СНО являются коммерчески доступными или могут быть синтезированы с помощью любой методики, известной из литературы, как, например, восстановлением соответствующей карбоновой кислоты или ее различных производных с помощью восстановительного агента, восстановлением соответствующего нитрила или окислением бензиловых спиртов и их гетероциклических аналогов при реакции с окислительными агентами (см., например: J.March, Advanced Organic Chemistry, 4th edition, John Wiley & Sons, p.447-449, 919-920 и 1167-1171).
Производные имидазо[2,1-b]тиазолкарбоновой кислоты формулы R1-СООН, если они не являются коммерчески доступными, могут быть синтезированы согласно одному из путей, представленных на схеме 3.
Путь А:

Путь Б:

Путь В:
Путь Г:
Путь Д:
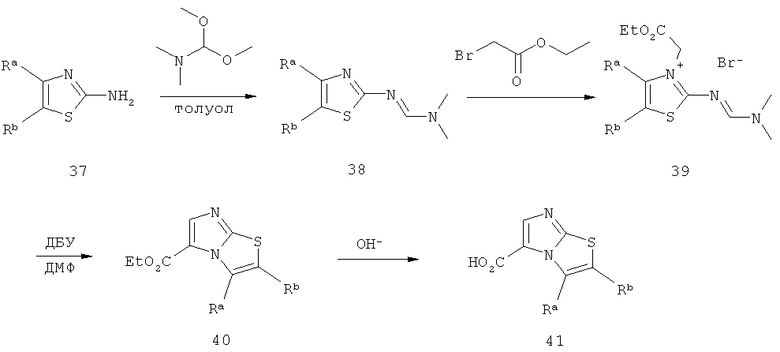
Путь Е:
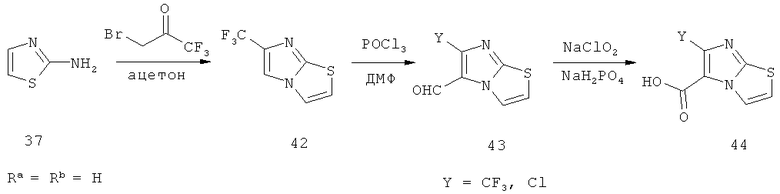
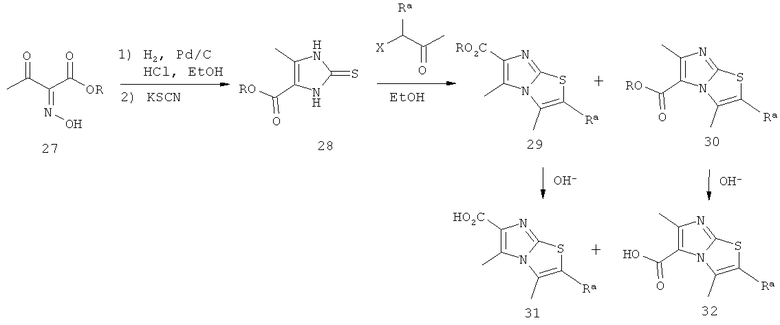
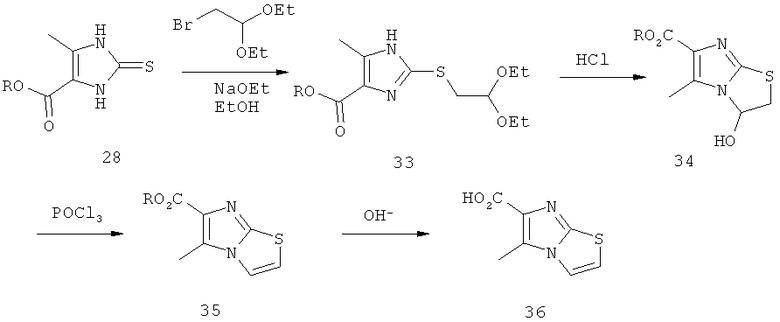
Схема 3: Синтез производных имидазо[2,1-b]тиазолкарбоновой кислоты, где R обозначает метил или этил, Ra обозначает водород или метил, Rb обозначает водород или метил, Х обозначает хлор или бром, и Y обозначает хлор или дифторметил.
Следуя путем А, производные имидазо[2,1-b]тиазолкарбоновой кислоты синтезируют исходя из метилового эфира 2-хлор-3-оксомасляной кислоты (20; коммерчески доступна) посредством реакции с тиомочевиной (коммерчески доступна) в растворителе, подобном этанолу, при повышенных температурах. Полученный аминотиазол (21) превращают в производное имидазо[2,1-b]тиазола (22) путем алкилирования и последующей циклизации с диэтилацеталем бромацетальдегида в присутствии кислоты типа концентрированной хлористоводородной кислоты. Омылением соединения (22), например, с помощью гидроксида натрия, в растворителях типа ТГФ и МеОН получают требуемые кислоты (23).
Альтернативный метод (путь Б) исходит из реакции эфира 2-бром-3-оксомасляной кислоты (24; коммерчески доступен) с 2-амино-5-метилтиазолом (коммерчески доступен) в растворителе типа ацетона с получением производного имидазо[2,1-b]тиазола (25), которое превращают в требуемую кислоту (26) посредством омыления, например, с помощью гидроксида натрия в растворителях типа ТГФ и МеОН.
Посредством гидрирования эфира 2-гидроксиимино-3-оксомасляной кислоты (27; коммерчески доступен) в присутствии палладия на угле в кислых условиях (например, HCl в EtOH) и последующей реакции с тиоцианатом калия получают производное имидазола (28), которое переводят в смесь двух возможных изомеров (29) и (30) посредством реакции с соответствующим α-галогенированным пропанолом (коммерчески доступен) или производным бутанона (путь В; коммерчески доступен). После разделения изомеров (29) и (30) с помощью хроматографии требуемые производные имидазо[2,1-b]тиазолкарбоновой кислоты (31) и (32) получают посредством омыления, например, гидроксидом натрия в растворителях, подобных ТГФ и МеОН.
Альтернативно (путь Г) имидазольное производное (28) может быть превращено в ацеталь (33) путем алкилирования с помощью диэтилацеталя бромацетальдегида (коммерчески доступен) в присутствии основания, подобного гидроксиду натрия. Циклизация в кислых условиях (например, водной хлористоводородной кислотой) и дегидратация промежуточного соединения (34), например, с помощью оксихлорида фосфора, приводят к сложному эфиру (35), который превращают в требуемую кислоту (36) посредством омыления, например, гидроксидом натрия, в растворителях, подобных ТГФ и МеОН.
В еще одном альтернативном методе (путь Д) соответствующий аминотиазол (37; коммерчески доступен) превращают в производное формамидина (38) путем нагревания соединения (37) с диметилацеталем N,N-диметилформамида (коммерчески доступен) в растворителе типа толуола. После алкилирования этилбромацетатом (коммерчески доступен) соответствующий бромид тиазолия (39) вводят в реакцию циклизации с ДБУ, получая сложный эфир (40), который омыляют в требуемую кислоту (41), например, гидроксидом натрия в растворителях, подобных ТГФ и МеОН.
Конечный путь Е начинают с алкилирования 2-аминотиазола (коммерчески доступен) 3-бром-1,1,1-трифторацетоном (коммерчески доступен) с получением дифторметилзамещенного производного имидазо[2,1-b]тиазола (42), которое формилируют до альдегида (43) посредством реакции с оксихлоридом фосфора в растворителе, подобном ДМФ. Посредством окисления альдегида (43) хлоритом натрия получают требуемую имидазо[2,1-b]тиазолкарбоновую кислоту (44, Y=CF3). Аналогично коммерчески доступный хлорированный альдегид (43, Y=Cl) окисляют до кислоты (44, Y=Cl).
Экспериментальная часть
Аббревиатуры, используемые в данном описании:
Ас - ацетил как в ОАс: ацетат, Бок - трет-бутоксикарбонил, БСА - бычий сывороточный альбумин, Bu - н-бутил, СНО - клетки яичника китайского хомячка, ДБУ - 1,8-диазабицикло[5.4.0]индец-7-ен, ДХМ - дихлорметан, ДИБАЛ - диизобутилалюминийгидрид, ДИПЭА - диизопропилэтиламин, ДМАП - 4-диметиламинопиридин, ДМФ - N,N-диметилформамид, экв. - эквивалент(ы), ЭС - электрораспылительная ионизация, Et - этил, эфир - диэтиловый эфир, EtOH - этанол, ФТС - фетальная телячья сыворотка, ФЛТПР - флюоресцентный томографический планшет-ридер, ч - час(ы), HBSS - сбалансированный солевой раствор Хенкса, HEPES - 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота, ВЭЖХ - высокоэффективная жидкостная хроматография, KOtBu - трет-бутоксид калия, ЖХ - жидкостная хроматография, Me - метил, MeCN - ацетонитрил, МеОН - метанол, мин - минута(ы), МС - масс-спектроскопия, Ph - фенил, преп.- препаративный, tR - время удерживания, ТБТУ - тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония, ТФК - трифторуксусная кислота, ТГФ - тетрагидрофуран.
I - Химия
Следующие примеры иллюстрируют получение фармакологически активных соединений по изобретению, не ограничивая, однако, его объема.
Все температуры представлены в °С.
Соединения охарактеризованы с помощью:
1Н-ЯМР: 300 МГц Varian Oxford или 400 МГц Bruker Avance; химические сдвиги даны в м. д. относительно используемых растворителей; мультиплетность: s = единичный, d = дублет, t = триплет, q = квартет, m = мультиплет, b = расширенный, константы сопряжения даны в Гц;
ЖХ-МС: Agilent 1100 серии с DAD, и МС детектирование (МС: Finnigan single quadrupole: колонки: (4,6×50 мм, 5 мкм): Zorbax SB-AQ, Zorbax Extend С 18 или Water XBridge С 18; условия:
основные: элюент А: MeCN, элюент Б: конц. NH3 в воде (1,0 мл/л), от 5% до 95% CH3CN;
кислотные: элюент А: MeCN, элюент Б: ТФК в воде (0,4 мл/л), от 5% до 95% CH3CN, время истечения 4,5 мл/мин; tR дано в мин.
Соединения очищают с помощью колоночной хроматографии на силикагеле или с помощью препаративной ВЭЖХ с использованием RP-C18 колонок с MeCN/вода градиентами и добавок в виде муравьиной кислоты или аммиака.
А. Получение исходных и промежуточных соединений:
A.1 Синтез производных тиазол-4-карбоновой кислоты
A.1.1 Синтез производных 3-хлор-2-оксопропионовых эфиров (общий метод)
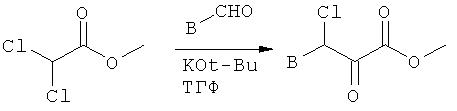
Раствор соответствующего альдегида (338 ммолей, 1,0 экв.) и метилдихлорацетата (338 ммолей, 1,0 экв.) в ТГФ (100 мл) добавляют по каплям к охлажденной до температуры -60°С суспензии KOtBu (335 ммолей, 1,0 экв.) в ТГФ (420 мл). Через 4 ч смесь оставляют самопроизвольно нагреваться до комнатной температуры, после чего перемешивают в течение ночи и концентрируют в вакууме. Затем добавляют ДХМ и охлажденную льдом воду, слои разделяют, и водный слой дважды экстрагируют ДХМ. Объединенные органические слои промывают охлажденной льдом водой и рассолом, высушивают над MgSO4 и концентрируют в вакууме, получая требуемый α-оксоэфир, который используют без дальнейшей очистки.
Метиловый эфир 3-хлор-2-оксо-3-п-толилпропионовой кислоты получают посредством реакции 4-метилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3-фторфенил)-2-оксопропионовой кислоты получают посредством реакции 3-фторбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(4-фторфенил)-2-оксопропионовой кислоты получают посредством реакции 4-фторбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3-хлорфенил)-2-оксопропионовой кислоты получают посредством реакции 3-хлорбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-2-оксо-3-м-толилпропионовой кислоты получают посредством реакции 3-метилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-2-оксо-3-(3-трифторметилфенил)пропионовой кислоты получают посредством реакции 3-трифторметилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-(4-бромфенил)-3-хлор-2-оксопропионовой кислоты получают посредством реакции 4-бромбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3,5-диметилфенил)-2-оксопропионовой кислоты получают посредством реакции 3,5-диметилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-(3-бром-4-фторфенил)-3-хлор-2-оксопропионовой кислоты получают посредством реакции 3-бром-4-фторбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3,4-дифторфенил)-2-оксопропионовой кислоты получают посредством реакции 3,4-дифторбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(2,4-диметилфенил)-2-оксопропионовой кислоты получают посредством реакции 2,4-диметилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3,4-дихлорфенил)-2-оксопропионовой кислоты получают посредством реакции 3,4-дихлорбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3,4-диметилфенил)-2-оксопропионовой кислоты получают посредством реакции 3,4-диметилбензальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-2-оксо-3-фенилпропионовой кислоты получают посредством реакции безнальдегида с метилдихлорацетатом.
Метиловый эфир 3-хлор-3-(3-нитрофенил)-2-оксопропионовой кислоты получают посредством реакции 3-нитробензальдегида с метилдихлорацетатом.
А.1.2 Синтез производных метилового эфира тиазол-4-карбоновой кислоты (общий метод)

Раствор тиоацетамида (132 ммолей, 1,0 экв.) в MeCN (250 мл) прибавляют к смеси соответствующего α-оксоэфира (132 ммолей, 1,0 экв.) и молекулярных сит (4Å, 12 г) в MeCN (60 мл). После перемешивания в течение 5 ч смесь охлаждают на бане со льдом и полученный осадок отфильтровывают. Остаток промывают холодным MeCN, высушивают, растворяют в МеОН (280 мл) и перемешивают при температуре 50°С в течение 6 ч. Затем растворители удаляют в вакууме, получая требуемое тиазольное производное в виде белого твердого вещества.
Метиловый эфир 2-метил-5-п-толилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-п-толилпропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,92 мин; [М+Н]+=248,2.
Метиловый эфир 5-(3-фторфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3-фторфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tr=0,91 мин; [М+H]+=252,1.
Метиловый эфир 5-(4-фторфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(4-фторфенил)-2-оксопропионовой кислоты с тиоацетамидом.
1Н-ЯМР (CDCl3): δ=2,75 (s, 3H); 3,84 (s, 3H); 7,10 (m, 2H); 7,47 (m, 2H).
Метиловый эфир 5-(3-хлорфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3-хлор-фенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,95 мин; [М+Н]+=268,0.
Метиловый эфир 2-метил-5-м-толилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-м-толилпропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,98 мин; [М+Н]+=248,5.
Метиловый эфир 2-метил-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-(3-трифторметилфенил)пропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,98 мин; [М+Н]+=302,2.
Метиловый эфир 5-(4-бромфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-(4-бромфенил)-3-хлор-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,95 мин; [М+Н]+=312,2.
Метиловый эфир 5-(3,5-диметилфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3,5-диметилфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,97 мин; [М+Н]+=262,3.
Метиловый эфир 5-(3-бром-4-фторфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-(3-бром-4-фторфенил)-3-хлор-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,95 мин; [М+Н]+=330,2.
Метиловый эфир 5-(3,4-дифторфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3,4-дифторфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,92 мин; [М+Н]+=270,3.
Метиловый эфир 5-(2,4-диметилфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(2,4-диметилфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,96 мин; [М+Н]+=262,3.
Метиловый эфир 5-(3,4-дихлорфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3,4-дихлорфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,99 мин; [М+Н]+=302,2.
Метиловый эфир 5-(3,4-диметилфенил)-2-метилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3,4-диметилфенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,96 мин; [М+Н]+=262,3.
Метиловый эфир 2-метил-5-фенилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-фенилпропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,89 мин; [M+H]+=234,0.
Метиловый эфир 2-метил-5-(3-нитрофенил)тиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(3-нитрофенил)-2-оксопропионовой кислоты с тиоацетамидом.
ЖХ-МС: tR=0,94 мин; [М+Н]+=279,3.
А.1.3 Синтез производных метилового эфира 2-аминотиазол-4-карбоновой кислоты (общий метод)

Раствор соответствующего α-оксоэфира (22,1 ммолей, 1,0 экв.) в ацетоне (25 мл) добавляют к суспензии тиомочевины (22,1 ммолей, 1,0 экв.) в ацетоне (45 мл). Смесь нагревают до температуры 57°С (температура бани), перемешивают в течение 24 ч и концентрируют до половины объема. Полученную суспензию фильтруют, и остаток промывают ацетоном. После высушивания получают требуемое производное аминотиазола в виде твердого вещества.
Метиловый эфир 2-амино-5-п-толилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-п-толилпропионовой кислоты с тиомочевиной.
ЖХ-МС: tR=0,77 мин; [М+Н]+=249,3.
Метиловый эфир 2-амино-5-(4-(фторфенил)тиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-3-(4-фторфенил)-2-оксопропионовой кислоты с тиомочевиной.
ЖХ-МС: tR=0,75 мин; [М+Н]+=253,2.
Метиловый эфир 2-амино-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты
получают посредством реакции метилового эфира 3-хлор-3-(3-трифторметилфенил)-2-оксопропионовой кислоты с тиомочевиной.
ЖХ-МС: tR=0,86 мин; [М+Н]+=303,3.
А.1.4 Синтез производных метилового эфира 2-бромтиазол-4-карбоновой кислоты (общий метод)
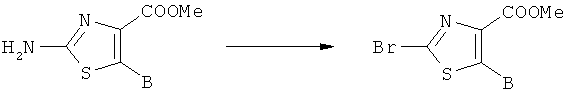
В инертной атмосфере бромид меди(II) (69,6 ммолей, 1,0 экв.) суспендируют в ацетонитриле (300 мл) и охлаждают до температуры 5-10°С, после чего добавляют 3-метилбутилнитрит (104 ммолей, 1,45 экв.) в течение 15 мин. Затем к этой реакционной смеси по частям добавляют производное 2-аминотиазола (70,0 ммолей, 1 экв., свободный амин) в течение 20 мин при температуре 5-10°С. Реакционную смесь затем осторожно нагревают до температуры 65°С, и перемешивание продолжают в течение 2 ч. Летучие фракции удаляют при пониженном давлении, а остаток очищают с помощью колоночной хроматографии (силикагель; гептан/EtOAc или ДХМ/метанол, в виде соответствующей смеси), получая требуемый продукт.
Метиловый эфир 2-бром-5-(4-фторфенил)тиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 2-амино-5-(4-фторфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,97 мин; [М+Н]+=316,1.
Метиловый эфир 2-бром-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты
получают посредством реакции метилового эфира 2-амино-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=1,04 мин; [М+Н]+=366,2.
А. 1.5 Синтез производных метиловых эфиров 2-циклопропилтиазол-4-карбоновой кислоты метил (общий метод I)

В инертной атмосфере раствор соответствующего производного 2-бромтиазола (9,0 ммолей, 1,0 экв.) и трибутилциклопропилстаннана (9,9 ммолей, 1,1 экв.) в 1,2-дихлорэтане (90 мл) перемешивают в течение 5 мин, а затем обрабатывают хлоридом бис(трифенилфосфин)палладия(II) (0,45 ммолей, 0,05 экв.). Смесь нагревают до температуры 80°С, перемешивают в течение 3 дней, после чего оставляют самопроизвольно нагреваться до комнатной температуры. Затем добавляют ДХМ и воду, слои разделяют, водный слой экстрагируют ДХМ. Объединенные органические слои высушивают над MgSO4 и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии (силикагель; гептан/EtOAc, в виде подходящей смеси), получая требуемый продукт.
Метиловый эфир 2-циклопропил-5-(4-фторфенил)тиазол-4-карбоновой кислоты
получают посредством циклопропанирования метилового эфира 2-бром-5-(4-фторфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,97 мин; [М+Н]+=278,3.
Метиловый эфир 2-циклопропил-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты получают посредством циклопропанирования метилового эфира 2-бром-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=1,03 мин; [М+Н]+=328,2.
А.1.6 Синтез производных метиловых эфиров 2-циклопропилтиазол-4-карбоновой кислоты (общий метод II)
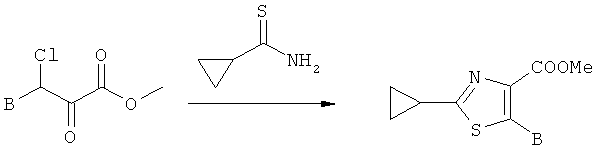
Синтез амида циклопропанкарботионовой кислоты
2,4-Бис-(4-метоксифенил)-[1,3,2,4]дитиадифосфетан-2,4-дисульфид (реагент Лавессона, 115 ммолей) прибавляют к смеси циклопропанкарбоксамида (115 ммолей) и карбоната натрия (115 ммолей) в ТГФ (500 мл). Смесь нагревают с обратным холодильником в течение 2 ч, затем растворители удаляют в вакууме, а остаток разбавляют эфиром (500 мл) и водой (500 мл). Слои разделяют, и водный слой экстрагируют эфиром (250 мл). Объединенные органические слои промывают рассолом (100 мл), высушивают над MgSO4 и концентрируют в вакууме, получая требуемый тиоамид, который используют без дальнейшей очистки.
ЖХ-МС: tR=0,39 мин; [M+H+CH3CN]+=143,2.
Синтез производных метиловых эфиров 2-циклопропилтиазол-4-карбоновой кислоты (общий метод II)
Раствор амида циклопропанкарботионовой кислоты (44,5 ммолей, 1,0 экв.) в MeCN (40 мл) добавляют к смеси соответствующего α-оксоэфира (44,5 ммолей, 1,0 экв.) и NaHCO3 (134 ммолей, 3,0 экв.) в MeCN (80 мл). После перемешивания в течение 16 ч смесь концентрируют в вакууме, и остаток разбавляют этилацетатом (200 мл) и водой (200 мл). Слои разделяют, и водный слой экстрагируют этилацетатом (100 мл). Объединенные органические слои промывают рассолом (100 мл), высушивают над MgSO4 и концентрируют в вакууме. Сырой продукт растворяют в МеОН (90 мл) и обрабатывают конц. H2SO4 (0,25 мл). Смесь затем нагревают при температуре 60°С в течение 16 ч и концентрируют в вакууме, получая соответствующее тиазольное производное.
Метиловый эфир 2-циклопропил-5-фенилтиазол-4-карбоновой кислоты получают посредством реакции метилового эфира 3-хлор-2-оксо-3-фенилпропионовой кислоты с амидом циклопропанкарботионовой кислоты.
ЖХ-МС: tR=0,99 мин; [М+Н]+=260,5.
А.1.7 Синтез метилового эфира 5-(3-ацетиламинофенил)-2-метилтиазол-4-карбоновой кислоты
А.1.7.1 Синтез метилового эфира 5-(3-аминофенил)-2-метилтиазол-4-карбоновой кислоты
Суспензию метилового эфира 2-метил-5-(3-нитрофенил)тиазол-4-карбоновой кислоты (44,1 ммолей) и хлорида аммония (220 ммолей) в смеси этанола (100 мл) и воды (50 мл) обрабатывают порошкообразным железом (53,0 ммолей) и нагревают до температуры 80°С. Через 4 ч прибавляют дополнительную порцию железного порошка (53,0 ммолей), смесь перемешивают при температуре 80°С в течение 3 ч, снова добавляют порошок железа (26,5 ммолей) и смесь опять перемешивают при температуре 80°С в течение 3,5 ч. Затем смесь оставляют самопроизвольно охлаждаться до комнатной температуры, разбавляют ДХМ и фильтруют через целит. Фильтрат концентрируют в вакууме и разбавляют ДХМ и насыщенным водным раствором NaHCO3. Слои разделяют, и органический слой промывают водой, высушивают над MgSO4 и концентрируют в вакууме, получая требуемое производное анилина.
ЖХ-МС: tR=0,67 мин; [М+Н]+=249,4.
А.1.7.2 Синтез метилового эфира 5-(3-ацетиламинофенил)-2-метилтиазол-4-карбоновой кислоты
Триэтиламин (14,2 ммолей) и ДМАП (4,00 ммолей) прибавляют к раствору метилового эфира 5-(3-аминофенил)-2-метилтиазол-4-карбоновой кислоты (4,00 ммолей) в ангидриде уксусной кислоты (25 мл). Через 30 мин добавляют EtOAc и воду, слои разделяют, и водный слой однократно экстрагируют EtOAc. Объединенные органические слои дважды промывают насыщенным водным раствором хлорида аммония, однократно водным раствором NaHCO3, однократно водой, после чего растворители удаляют в вакууме. Остаток разбавляют EtOAc и трижды экстрагируют насыщенным водным раствором NaHCO3. Органический слой высушивают над MgSO4 и концентрируют в вакууме, получая сырое твердое вещество, которое разбавляют эфиром. Полученную суспензию фильтруют, и остаток промывают эфиром, получая требуемый ацетамид.
ЖХ-МС: tR=0,81 мин; [М+Н]+=291,3.
А.1.8 Синтез производных тиазол-4-карбоновой кислоты (общий метод)

Раствор соответствующего сложного эфира (96,2 ммолей) в смеси ТГФ (150 мл) и МеОН (или изопропанола, 50 мл) обрабатывают водным раствором NaOH (1-молярный, 192 мл). После перемешивания в течение 3 ч образуется белая суспензия, после чего летучие органические фракции удаляют в вакууме. Оставшуюся смесь разбавляют водой (100 мл), охлаждают на бане со льдом и подкисляют (рН 3-4) добавлением водного раствора HCl (1-молярный). В случае выпадения в осадок суспензию фильтруют, и остаток промывают холодной водой и высушивают в вакууме, получая требуемую кислоту. В других случаях смесь дважды экстрагируют EtOAc, и органические слои объединяют, высушивают над MgSO4 и концентрируют в вакууме, получая соответствующую кислоту.
2-Метил-5-п-толилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-метил-5-п-толилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,83 мин; [М+Н]+=234,0.
5-(3-Фторфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3-фторфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,82 мин; [М+Н]+=238,1.
5-(4-Фторфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(4-фторфенил)-2-метилтиазол-4-карбоновой кислоты.
1Н-ЯМР (ДМСО-d6): δ=2,67 (s, 3Н); 7,27 (m, 2H); 7,53 (m, 2H); 12,89 (расширенный s, 1H).
5-(3-Хлорфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3-хлорфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,84 мин; [М+Н]+=254,0.
2-Метил-5-м-толилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-метил-5-м-толилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,87 мин; [М+Н]+=234,4.
2-Метил-5-(3-трифторметилфенил)тиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-метил-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,88 мин; [M+H]+=288,0.
5-(4-Бромфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(4-бромфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,85 мин; [М+Н]+=298,2.
5-(3,5-Диметилфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления 5-(3,5-диметилфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,86 мин; [M+H]+=248,3.
5-(3-Бром-4-фторфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3-бром-4-фторфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,86 мин; [М+H]+=316,2.
5-(3,4-Дифторфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3,4-дифторфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,82 мин; [М+Н]+=256,3.
5-(2,4-Диметилфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(2,4-диметилфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,85 мин; [М+Н]+=248,3.
5-(3,4-Дихлорфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3,4-дихлорфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,88 мин; [М+Н]+=288,2.
5-(3,4-Диметилфенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3,4-диметилфенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tr=0,86 мин; [М+Н]+=248,3.
2-Метил-5-фенилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-метил-5-фенилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,77 мин; [М+Н]+=220,0.
5-(3-Ацетиламинофенил)-2-метилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 5-(3-ацетиламинофенил)-2-метилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,73 мин; [М+Н]+=277,2.
2-Амино-5-п-толилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-амино-5-п-толилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,64 мин; [М+Н]+=235,2.
2-Циклопропил-5-(4-фторфенил)тиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-циклопропил-5-(4-фторфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,87 мин; [М+Н]+=264,2.
2-Циклопропил-5-(3-трифторметилфенил)тиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-циклопропил-5-(3-трифторметилфенил)тиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,94 мин; [M+H]+=314,2.
2-Циклопропил-5-фенилтиазол-4-карбоновую кислоту
получают посредством омыления метилового эфира 2-циклопропил-5-фенилтиазол-4-карбоновой кислоты.
ЖХ-МС: tR=0,91 мин; [М+Н]+=246,4.
А.2 Синтез 2,3-дигидробензофуран-4-карбоновой кислоты
Бензофуран-4-карбоновую кислоту (30,8 ммолей, М.А. Eissenstat et al. J. Med. Chem. 1995, 38, 3094-3105) прибавляют к суспензии Pd/C (10%-ная, 2,00 г) в EtOH (25 мл). Затем дополнительно добавляют EtOH (75 мл) и смесь перемешивают при комнатной температуре под давлением водорода (4 бар) в течение 16 ч. После фильтрования через целит и удаления растворителей получают требуемый продукт, который используют без дальнейшей очистки.
1Н-ЯМР (ДМСО-d6): δ=3,45 (t, J=8,79 Гц, 2Н); 4,55 (t, J=8,79 Гц, 2Н); 6,99 (d, J=7,78 Гц, 1Н); 7,21 (t, J=7.91 Гц, 1Н); 7,39 (d, J=7,78 Гц, 1Н); 12,9 (расширенный s, 1Н).
А.3 Синтез трет-бутилового эфира (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
А.3.1 Синтез бензилового эфира (1S,3S,5S)-(2-трет-бутоксикарбонил)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты
К суспензии гидрохлорида бензил-(1S,3S,5S)-2-азабицикло[3.3.0]октан-3-карбоксилата (17,3 ммолей, 1,0 экв.) в ДХМ (50 мл) добавляют ДИПЭА (22,5 ммолей, 1,3 экв.), ди-трет-бутилдикарбонат (17,3 ммолей, 1,0 экв.) и дополнительное количество ДХМ (5 мл). Смесь затем перемешивают в течение 1 ч и концентрируют в вакууме, после чего добавляют EtOAc и водный раствор лимонной кислоты (10%-ный), слои разделяют, и водный слой однократно экстрагируют этилацетатом. Объединенные органические слои промывают, концентрируют, высушивают над MgSO4 и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии (гептан/EtOAc в соотношении 3:1), получая требуемый продукт.
ЖХ-МС: tR=1,08 мин; [М+Н]+=346,3.
А.3.2 Синтез трет-бутилового эфира (1S,3S,5S)-3-гидроксиметил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
Охлажденный до температуры -78°С раствор ДИБАЛ в толуоле (1,7-молярный, 22,5 ммолей) добавляют по каплям к раствору бензилового эфира (1S,3S,5S)-(2-трет-бутоксикарбонил)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты (9,0 ммолей) в ТГФ (50 мл). Через 40 мин смесь оставляют самопроизвольно нагреваться до комнатной температуры, дополнительно перемешивают в течение 45 мин и переносят в смесь водного раствора NaOH (1-молярный, 250 мл) и льда. Затем добавляют EtOAc, слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические слои промывают водным раствором NaOH (1-молярный) и рассолом, высушивают над MgSO4 и концентрируют в вакууме, получая требуемый спирт, который очищают с помощью колоночной хроматографии (гептан/EtOAc в соотношении 3:1).
ЖХ-МС: tR=0,91 мин; [М+Н]+=242,4.
А.3.3 Синтез трет-бутилового эфира (1S,3S,5S)-3-формил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
Раствор перйодинана Десса-Мартина (4,14 ммолей, 2,2 экв.) в ДХМ (10 мл) обрабатывают раствором трет-бутилового эфира (1S,3S,5S)-3-гидроксиметил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты (1,85 ммолей, 1,0 экв.) в ДХМ (4 мл) и нескольких каплях воды. Через 5 ч прибавляют водный раствор NaOH (1-молярный) и слои разделяют. Органический слой промывают водным раствором лимонной кислоты (10%-ный) и рассолом, затем высушивают над MgSO4 и концентрируют в вакууме, получая требуемый альдегид, который используют без дальнейшей очистки.
А.3.4 Синтез трет-бутилового эфира (1S,3S,5S)-3-(бензиламинометил)-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
Бензиламин (2,76 ммолей, 2,3 экв.) прибавляют к раствору трет-бутилового эфира (1S,3S,5S)-3-формил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты (1,2 ммолей, 1,0 экв.) в хлороформе (10 мл). Смесь затем перемешивают в течение 5 мин, обрабатывают триацетоксиборгидридом натрия (4,8 ммолей, 4,0 экв.) и уксусной кислотой (0,05 мл), перемешивают дополнительно в течение 14 ч и переносят в насыщенный раствор NaHCO3, после чего добавляют ДХМ, слои разделяют и водный слой экстрагируют ДХМ. Объединенные органические слои промывают водой (100 мл) и концентрируют в вакууме. Остаток растворяют в эфире и трижды экстрагируют хлористоводородной кислотой (0,1-молярный раствор). Объединенные водные слои однократно экстрагируют эфиром, подщелачивают (рН 9-10) путем добавления раствора NaOH (1,0-молярного) и трижды экстрагируют эфиром. Объединенные органические слои высушивают над MgSO4 и концентрируют в вакууме, получая требуемый бензиламин, который используют без дальнейшей очистки.
ЖХ-МС: tR=0,89 мин; [М+H]+=331,5.
А.3.5 Синтез трет-бутилового эфира (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
Раствор трет-бутилового эфира (1S,3S,5S)-3-(бензиламинометил)-2-азабицикло[3.3.0]октан-2-карбоновой кислоты (9,0 ммолей) в этаноле (10 мл) прибавляют к суспензии Pd/C (1,9 г, 10%-ная) в этаноле (40 мл) и перемешивают под давлением водорода (1 бар) в течение 16 ч. После фильтрования через целит смесь промывают этанолом и удаляют растворители, получая требуемый амин, который используют без дальнейшей очистки.
ЖХ-МС: tR=0,73 мин; [М+Н]+=241,4.
А.4 Синтез производных (1S,3S,5S)-(2-азабицикло[3.3.0]октан-3-илметил)амида
А.4.1 Синтез трет-бутилового эфира (1S,3S,5S)-3-(ароиламинометил)-2-азабицикло[3.3.0]октан-2-карбоновой кислоты (общий метод)

ТБТУ (5,0 ммолей, 1,2 экв.) добавляют к раствору соответствующей карбоновой кислоты (4,6 ммолей, 1,1 экв.) в ДМФ (15 мл). Через 30 мин добавляют ДИПЭА (12,5 ммолей, 3,0 экв.) и раствор трет-бутилового эфира (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты (4,2 ммолей, 1,0 экв.) в ДМФ (10 мл), после чего смесь перемешивают в течение 60 мин. Затем прибавляют воду и EtOAc, слои разделяют, и органический слой однократно промывают водой. Объединенные водные слои однократно экстрагируют этилацетатом и объединенные органические слои высушивают над MgSO4. Растворители удаляют в вакууме, а остаток очищают с помощью колоночной хроматографии (ДХМ), получая соответствующий амид.
трет-Бутиловый эфир (1S,3S,5S)-3-{[(6-метилимидазо[2,1-b]тиазол-5-карбонил)амино]метил}-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
получают посредством реакции 6-метилимидазо [2,1-b]тиазол-5-карбоновой кислоты (A.Andreani et al. Eur. J. Med. Chem 1982, 17, 271-274) с трет-бутиловым эфиром (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=0,91 мин; [М+Н]+=405,2.
трет-Бутиловый эфир (1S,3S,5S)-3-{[(бензо[d]изоксазол-3-карбонил)амино]метил}-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
получают посредством реакции трет-бутилового эфира бензо[d]изоксазол-3-карбоновой кислоты с трет-бутиловым эфиром (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=1,11 мин; [М+Н]+=386,6.
трет-Бутиловый эфир (1S,3S,5S)-3-{[(2,3-дигидробензофуран-4-карбонил)амино]метил}-2-азабицикло[3.3.0]октан-2-карбоновой кислоты
получают посредством реакции 2,3-дигидробензофуран-4-карбоновой кислоты с трет-бутиловым эфиром (1S,3S,5S)-3-аминометил-2-азабицикло[3.3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=1,00 мин; [М+Н]+=387,1.
А.4.2 Синтез производных (1S,3S,5S)-(2-азабицикло[3.3.0]октан-3-илметил)амида (общий метод)

Раствор HCl в диоксане (4,0-молярный, 20 мл) прибавляют к раствору соответствующего Бок-защищенного производного 2-азабицикло[3.3.0]октана (3,6 ммолей) в диоксане (20 мл). После проведения анализа с помощью ЖХ-МС, указывающего на завершение реакции (от 1 до 3 ч), смесь концентрируют в вакууме, получая соответствующий освобожденный от защитной группы продукт, который используют без дальнешей очистки.
[(1S,3S,5S)-(2-Азабицикло[3.3.0]октан-3-ил)метил]амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты
получают посредством удаления защитной группы с трет-бутилового эфира (1S,3S,5S)-3-{[(6-метилимидазо[2,1-b]тиазол-5-карбонил)амино]метил}-2-азабицикло[3,3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=0,56 мин; [М+Н]+=305,3.
[(1S,3S,5S)-(2-Азабицикло[3.3.0]октан-3-ил)метил]амид бензо[d]изоксазол-3-карбоновой кислоты
получают посредством удаления защитной группы с трет-бутилового эфира (1S,3S,5S)-3-{[(бензо[d]изоксазол-3-карбонил)амино]метил}-2-азабицикло[3.3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=0,71 мин; [М+Н]+=286,3.
[(1S,3S,5S)-(2-Азабицикло[3.3.0]октан-3-ил)метил]амид 2,3-дигидробензофуран-4-карбоновой кислоты
получают посредством удаления защитной группы с трет-бутилового эфира (1S,3S,5S)-3-{[(2,3-дигидробензофуран-4-карбонил)амино]метил}-2-азабицикло[3.3.0]октан-2-карбоновой кислоты.
ЖХ-МС: tR=0,70 мин; [М+Н]+=287,4.
Б. Получение соединений формулы (I):
Б.1 Синтез карбоксиламидных производных (общий метод)
К смеси соответствующей карбоновой кислоты (0,44 ммолей, 1,1 экв.) в ацетонитриле (1,0 мл) прибавляют ТБТУ (0,48 ммолей, 1,2 экв.), а затем, через 30 мин, ДИРЭА (1,2 ммолей, 3,0 экв.). Через 15 мин добавляют раствор соответствующего производного 2-азабицикло[3.3.0]октана (0,40 ммолей, 1,0 экв.) в ДХМ (1,0 мл). Смесь перемешивают в течение ночи, а затем очищают с помощью препаративной ВЭЖХ, получая соответствующее амидное производное.

II. Биологические анализы
Активность соединений формулы (I) в качестве антагонистов орексин рецептора определяли в соответствии со следующим экспериментальным методом.
Измерение внутриклеточного кальция:
Клетки яичников китайского хомячка (СНО), экспрессирующие человеческий орексин-1-рецептор и орексин-2-рецептор, соответственно, выращивают в культуральной среде (Ham F-12 с L-глутамином), содержащей 300 мкг/мл G418, 100 U/мл пенициллина, 100 мкг/мл стрептомицина и 10%-ную инактивированную плодную телячью сыворотку (FCS). Клетки высеивают с плотностью 20'000 клеток/на ячейку в стерильном 384-ячеистом планшете с затемненным дном (фирмы Greiner). Все реагенты получены от фирмы Gibco BRL. Засеянные планшеты инкубируют в течение ночи при температуре 37°С в 5%-ной атмосфере CO2.
Человеческий орексин-А в качестве агониста готовят в виде 1 мМ исходного раствора для разведения в смеси МеОН/вода (в соотношении 1:1), разбавляют в HBSS, содержащем 0,1% бычьего сывороточного альбумина (БСА), NaHCO3 0,375 г/л и 20 мМ HEPES, для использования в анализе при конечной концентрации, равной 0,3 нМ.
Антагонисты получают в виде 10 мМ исходного раствора для разведения в ДМСО, затем разбавляют в 384-ячеистом планшете, используя ДМСО, с последующим переходом на разбавление в HBSS, содержащем 0,1% бычьего сывороточного альбумина (БСА), NaHCO3: 0,375 г/л и 20 мМ HEPES. На следующий день проведения анализа в каждую ячейку добавляют 50 мкл буфера для окрашивания (HBSS, содержащий 1% ФТС, 20 мМ HEPES, NaHCO3: 0,375 г/л, 5 мМ пробного индикатора (Sigma) и 3 мкМ флюоресцентного индикатора кальция fluo-4 AM (1 мМ исходного раствора в ДМСО, содержащего 10% плюроновой кислоты). Затем 384-ячеистый клеточный планшет инкубируют в течение 50 мин при температуре 37°С в 5% СО2 с последующим уравновешиванием при комнатной температуре в течение 30-120 мин перед измерением.
Внутрь флюоресцентного томографического планшета-ридера (FLIPR2 или FLIPR Tetra, фирма Molecular Devices) антагонисты добавляют в объеме 10 мкл/ячейку, инкубируют в течение 10 мин и в конце добавляют 10 мкл/ячейку агониста. Флюоресценцию измеряют для каждой ячейки с 1-секундными интервалами, и высоту каждого флюоресцентного пика сравнивают с высотой флюоресцентного пика, индуцированного 3 нМ орексина-А с буфером вместо антагониста. Для каждого антагониста определяют величину IC50 (концентрация соединения, необходимого для ингибирования 50% агонистического ответа). Вычисленные IC50 величины соединений могут колебаться в зависимости от суточного проведения клеточного анализа. Колебания такого рода известны специалистам в области техники.
IC50 величины 26 исследуемых соединений лежат в интервале от 4 до 2438 нМ в отношении OX1 рецептора. IC50 величины всех исследуемых соединений лежат в интервале от 11 до 1669 нМ в отношении ОХ2 рецептора. Антагонистические активности некоторых соединений представлены в таблице.
Величины, приведенные в таблице, измерены с помощью FLIPR2 или с помощью 1) FLIPR Tetra.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2-АЗА-БИЦИКЛО[3.1.0.]ГЕКСАНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ОРЕКСИНА | 2007 |
|
RU2460732C2 |
| СОЕДИНЕНИЯ 3-АЗА-БИЦИКЛО[3.3.0]ОКТАНА | 2008 |
|
RU2471796C2 |
| ВТОРИЧНЫЕ АМИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕНИНА | 2007 |
|
RU2425032C2 |
| ЛИГАНДЫ НИКОТИНОВОГО РЕЦЕПТОРА АЛЬФА-7, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2005 |
|
RU2418797C2 |
| КОНДЕНСИРОВАННОЕ ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИНОПИРРОЛИДИНА | 2007 |
|
RU2443698C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2019 |
|
RU2821941C2 |
| ПРОИЗВОДНЫЕ 1-[М-КАРБОКСАМИДО(ГЕТЕРО)АРИЛ-МЕТИЛ]-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДА | 2013 |
|
RU2644761C2 |
| СОЕДИНЕНИЯ АЗЕТИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ОРЕКСИНА | 2007 |
|
RU2447070C2 |
| АМИДЫ δ-АМИНО-γ-ГИДРОКСИ-ω-АРИЛАЛКАНОВОЙ КИСЛОТЫ | 2004 |
|
RU2413716C2 |
| ПРОИЗВОДНЫЕ С-АРИЛГЛЮКОЗИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2606501C2 |
Изобретение относится к производному 2-аза-бицикло[3.3.0]октана формулы (I), со стереогенными центрами в (1S,3S,5S)-конфигурации, где А представляет собой тиазолил, который является незамещенным или монозамещенным, где заместитель независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил и NH2; В представляет собой фенил, который является незамещенным или моно- или дизамещенным, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, трифторметил, NHC(O)СН3 и галоген; и R1 представляет собой группу имидазо[2,1-b]тиазолила или бензоизоксазолила, где названные группы являются независимо друг от друга незамещенными или монозамещенными, где заместители независимо друг от друга выбирают из группы, включающей C1-4алкил; или R1 представляет собой группу 2,3-дигидробензофуранила; или его фармацевтически приемлемая соль. Производное 2-аза-бицикло[3.3.0]октана формулы (I) используют в качестве лекарственного средства, обладающего активностью антагонистов орексин рецептора. Технический результат - новые производные 2-аза-бицикло[3.3.0]октана в качестве антагонистов орексин рецептора. 3 н. и 5 з.п. ф-лы, 1 табл., 26 пр.

1. Соединение формулы (I) со стереогенными центрами в (1S,3S,5S)-конфигурации

где А представляет собой тиазолил, который является незамещенным или монозамещенным, где заместитель независимо друг от друга выбирают из группы, включающей С1-4алкил, С3-6циклоалкил и NH2;
В представляет собой фенил, который является незамещенным или моно- или дизамещенным, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, трифторметил, NHC(O)СН3 и галоген;
R1 представляет собой группу имидазо[2,1-b]тиазолила или бензоизоксазолила, где названные группы являются независимо друг от друга незамещенными или монозамещенными, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил; или R1 представляет собой группу 2,3-дигидробензофуранила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
В представляет собой фенил, который является незамещенным или независимо друг от друга моно- или дизамещенным, где заместители независимо друг от друга выбирают из группы, включающей С1-4алкил, трифторметил и галоген;
или его фармацевтически приемлемая соль.
3. Соединение по п.1, где
R1 представляет собой
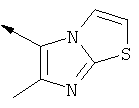
или его фармацевтически приемлемая соль.
4. Соединение по п.1, выбранное из группы, включающей:
[(1S,3S,5S)-2-(2-метил-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
[(1S,3S,5S)-2-(2-амино-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[2-циклопропил-5-(4-фторфенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
{(1S,3S,5S)-2-[2-циклопропил-5-(3-трифторметилфенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 6-метилимидазо[2,1-b]тиазол-5-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-п-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид бензо[d]изоксазол-3-карбоновой кислоты;
[(1S,3S,5S)-2-(2-циклопропил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид бензо[d]изоксазол-3-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-хлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-м-толилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[2-метил-5-(3-трифторметилфенил)тиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(4-бромфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,5-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-бром-4-фторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-дифторфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(2,4-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-дихлорфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3,4-диметилфенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
{(1S,3S,5S)-2-[5-(3-ацетиламинофенил)-2-метилтиазол-4-карбонил]-2-азабицикло[3.3.0]октан-3-илметил}амид 2,3-дигидробензофуран-4-карбоновой кислоты;
[(1S,3S,5S)-2-(2-метил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты и
[(1S,3S,5S)-2-(2-циклопропил-5-фенилтиазол-4-карбонил)-2-азабицикло[3.3.0]октан-3-илметил]амид 2,3-дигидробензофуран-4-карбоновой кислоты;
или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, обладающая активностью антагонистов орексин рецептора, содержащая в качестве активной составляющей соединение формулы (I) по п.1 или 4 или его фармацевтически приемлемую соль и по крайней мере одно терапевтически инертное вспомогательное вещество.
6. Соединение по п.1 или 4 или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, обладающего активностью антагонистов орексин рецептора.
7. Применение соединения по п.1 или 4 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения расстройств сна.
8. Соединение по п.1 или 4 или его фармацевтически приемлемая соль для лечения расстройств сна.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 2135503 C1, 27.08.1999 | |||
| Способ получения производных бензимидазола в виде смеси изомеров или индивидуальных изомеров в свободном виде или в виде их физиологически приемлемых солей | 1988 |
|
SU1676451A3 |
Авторы
Даты
2013-03-27—Публикация
2008-07-25—Подача