Предпосылки настоящего изобретения
1.Область применения настоящего изобретения
Настоящее изобретение касается полученного методом генной инженерии циклического одноцепочечного триспецифичного антитела, кодирующих его последовательностей ДНК, векторов экспрессии, содержащих указанные последовательности, а также клеток-хозяина, содержащих указанные векторы экспрессии.
2. Описание родственных технологий
Стратегия конструирования циклического одноцепочечного триспецифичного антитела основана на введении в одну и ту же молекулу трех различных антигенсвязывающих сайтов. Поскольку гены антитела, отобранные для конструирования антитела, разные, то циклическое одноцепочечное триспецифичное антитело имеет различные биологические функции. Известные триспецифичные антитела конструировали в основном способом химического сцепления, по методике межвидовой гибридомы или генетической экспрессией при слиянии, и антитела содержали три Fab-фрагмента или только одно одноцепочечное антитело (scFv) из трех антител (Fay Т N et al., 1988; Tutt A et al., 1991; Jung G et al., 1991; Schott M E et al., 1993; French R R, 1998; Somasundaram С et al., 1999; Schoonjans R et al., 2000a; Schoonjans R et al., 2000b; Wong W M et al., 2000).
Упоминаемое в настоящем изобретении циклическое одноцепочечное триспецифичное антитело представляет собой новый вид антитела, полученного генной инженерией, оно сконструировано на основе модели двухсигнальной активации Т-клеток, которые в иммунотерапии раковых заболеваний играют роль ключевого фактора. В иммунотерапии опухолей клеточный иммунитет, опосредованный Т-клетками, играет важную роль. Для полной активации Т-клеток необходимы два сигнала: первичный сигнал создается комплексом TCR/CD3, связанным со специфичностью антигена; второй сигнал, называемый также со-стимулирующим сигналом, создается со-стимулирующими молекулами на поверхности АРС. CD3 человека содержит 5 различных полипептидных цепей. CD3 и TCR образуют CD3/TCR комплекс с нековалентными связями. Если Т-клетки получают только первичный сигнал (TCR-связывание), то со-стимулирующий сигнал является антиген-неспецифичным и не имеет ограничения с точки зрения главного комплекса гистосовместимости, однако он вовлечен в индицирование секреции цитокинов, пролиферацию и оказывает влияние на работу Т-клеток. CD28 представляет собой наиболее важный рецептор со-стимулирующего сигнала на поверхности Т-клеток. Из различных рецепторов со-стимулирующего сигнала на Т-клетках (типа CD2, CD4, CD8 и т.д.) только CD28 способен предотвратить индукцию иммунологической толерантности Т-клеток (Slavik et al., 1999). На основании этих принципов возможна активация Т-клеток с помощью анти-CD3 антитела и анти-CD8 антитела в качестве лигандов этих молекул соответственно.
Разработки генной технологии, в частности применение генной технологии для модификации антител, способствует перестройке антитела в соответствии с требованиями конкретного приложения. В последние годы были получены некоторые биспецифичные антитела и биспецифичные одноцепочечные антитела, имеющие различные свойства клетки-мишени, способные распознавать раковые клетки и стимулировать иммунные клетки-эффекторы.
Большинство сообщений относительно использования антител, полученных методом генной инженерии, в иммунотерапии опухолей касалось биспецифичных антител (BsAb) или моноклональных антител, специфичных к опухолеспецифическому антигену (ТАА) и CD3 или CD28. В ранних клинических экспериментах по иммунотерапии опухолей BsAb продуцировали сцеплением двух антител в отношении триггерной молекулы TCR-CD3 и ТАА. Однако эффект терапии не оправдал надежд, поскольку она могла привести к иммунологической толерантности клона, активированной Т-клетки, а также к апоптозу. Указанную проблему можно обойти с помощью ex vivo активации Т-клеток за счет использования в качестве со-стимулирующей молекулы IL-2 или лектина. При более глубоком изучении молекулы CD28 и разработке теории двойного стимулирующего сигнала было обнаружено, что моноклональное анти-СВ28 антитело, в качестве В7-семейства, способно подавать со-стимулирующий сигнал и объединяться с анти-CD3/ТАА, запуская в действие оптимальное активирование Т-клеток.
В работе Demanet et al (1996) показано, что в модели на мышах (Balb/C) лимфома, нагруженная клетками 10.sup.5 BCL1, исчезала в результате неоднократных инъекций BsAb анти-CD3/анти-Id вместе с моноклональным анти-CD28 антителом. По сравнению с однократным применением BsAb, лечебный эффект был выше в 20 раз, в то время как доза BsAb составляла только 10% от однократной дозы BsAb. Используя в модели на мышах (SCID) хроническую В лимфоцитную лейкемию человека Bohlen et al (1997) показали, что комбинированная инъекция анти-CD3/анти-CD19 BsAb и анти-CD28 McAb может опосредовать аутологические Т-клетки к подавлению роста опухолевых клеток и предотвращению рецидива опухолевого процесса. В дальнейших исследованиях анти-CD3/анти-ТАА BsAb и анти-CD28/анти-ТАА BsAb использовали вместе для того, чтобы уточнить специфичность к опухолевым клеткам. Например, в работе Renner et al (1994) сообщалось, что объединенная инъекция анти-CD3/анти-CD30 BsAb и анти-CD28/анти-CD30 BsAb, сделанная мышам SCID, больным болезнью Ходгкина, оказала летальное действие. Mazzoni et al (1996) применял одновременно анти-CD3/анти-FBP (карцинома яичника ТАА) и анти-CD28/анти-FBP BsAb при анализе цитолиза in vitro, полученные результаты показали, что двойные сигналы способны эффективно активировать CD8.sup.+Т-клетки, уничтожая клетки карциномы яичника с помощью антигена FBP. Сравнивая результаты, полученные при использовании только анти-CD3/анти-CD19 BsAb, Manzke et al (1999) получил многообещающий эффект в результате одновременного применения анти-CD3/анти-CD19 BsAb и бивалентного анти-СВ28 антитела для лечения опосредованного В-клетками лимфоцитов рака. Получен также существенный эффект от лечения солидных опухолей с помощью BsAb. На модели мыши с трансплантированной меланомой В16 и раком легкого в работе Grosse-Hovest et al (1999) показано, что анти-CD3/антираковое BsAb обладает значительным лечебным воздействием, однако это воздействие по скорости уничтожения раковых клеток можно существенно усилить путем синхронной инъекции анти-С028 BsAb и анти-CD3/антиракового BsAb. Кроме того, при повторной атаке раковых клеток количество уцелевших на продолжительное время особей было значительно выше у мышей, получавших внутривенную инъекцию BsAb, что доказывает тот факт, что BsAb способен индуцировать длительный защитный иммунитет.
Таким образом, антитело, получившееся в результате совместного сцепления генов анти-ТАА антитела, анти-CD3 антитела и анти-CD28 антитела, и их экспрессии по технологии генной инженерии, должно активировать клетки эффектора и более эффективно излечивать опухоль. Одновременно вся методика продуцирования должна стать более простой и эффективной, а также менее дорогостоящей. Однако если три указанные антитела будут сцеплены только одно за другим, образуя линейную молекулу, то такое антитело будет нестойким и его будет трудно транспортировать in vivo. В целях решения этой задачи в настоящем изобретении разработан способ конструирования циклического одноцепочечного триспецифичного антитела (TsAb) путем циклизации линейной молекулы антитела с фрагментами антитела шарнирной области.
Помимо этого, существует множество задач, касающихся использования mAb мышей в клинической терапии, и эти задачи требуют решения. Одной из главных задач является НАМА (human anti-mouse antibody) - ответ антител человека на антиген мыши, возникший у пациента за счет иммуногенности mAb мыши. Этот ответ создает быстрый клиренс антител мыши из крови, нейтрализует и блокирует деятельность антител, является причиной аллергической реакции пациента. Поскольку создать моноклональное антитело человека по технологии гибридомы очень трудно, то для полного приложения моноклонального антитела грызунов с помощью методики ослабления антител посредством технологии генной и белковой инженерии необходим селективный способ.
Стратегии ослабления антител основаны на сведениях о распознаваемости структуры и четком домене антител. Форма антитела напоминает заглавную букву «Y» и содержит две идентичные «тяжелые» цепи и две идентичные «легкие» цепи. Каждая цепь имеет один вариабельный домен, а также один или более консервативных доменов. Вариабельные домены в основном отвечают за связывание с антигеном, в то время как консервативные домены отвечают за связывание с молекулами эффектора. Вариабельные домены содержат три области гибких петель, последовательности которых и кристаллическая структура гипервариабельны, эти области непосредственно сцеплены с антигенами и названы гипервариабельными участками молекулы антитела (CDRs). Остальные области вариабельных доменов обладают меньшей вариабельностью, они состоят из антипараллельных β-пластин и называются каркасными участками (FRs). Последовательность CDRs и FRs расположены друг за другом, образуя структуру сэндвича. Эта структура сцеплена дисульфидной связью, находящейся между тяжелыми и легкими цепями или между двумя тяжелыми цепями. Консервативность структуры антитела делает возможным ее изменения методами генной и белковой инженерии при сохранении антигенсвязывающей специфики и функции эффектора; одновременно при этом снижается, максимально возможно, его иммуногенность для применения в клинической терапии.
Первое поколение ослабленных антител представляет собой гибридное антитело человека-мыши, содержащее вариабельные участки грызуна и константные участки человека. Было показано, что гибридное антитело способно существенно повысить фармакодинамический коэффициент и снизить иммуногенность; некоторые гибридные антитела были использованы в клинических экспериментах. Однако результат этих экспериментов показал, что более чем у половины пациентов, лечившихся гибридными антителами, ответ НАМА вырабатывался только после повторной инъекции. Второе поколение ослабленных антител назвали антителом, привитым на гипервариабельном участке («CDR-grafted» antibody), в этом случае гипервариабельные участки антитела грызуна были трансплантированы в скелетные участки антитела человека. По сравнению с гибридным антителом такое антитело еще более ослаблено, это сделано для того, чтобы указанное антитело было в большей степени идентично человеческому, но при этом сохраняло бы антигенсвязывающую специфичность антитела грызуна. В принципе в одни и те же каркасные участки антитела человека можно трансплантировать различные гипервариабельные участки антитела грызунов, получая при этом различные трансформированные антитела, которые содержат различные последовательности. Однако такой сверхпростой трансплантат обычно продуцирует антитела, обладающие слабой активностью (или не обладающие активностью), поскольку дополнительные переходы отдельных аминокислотных остатков в пределах одного каркаса могут оказывать влияние на конформацию антигенсвязывающего сайта. Поэтому существует постоянная необходимость учитывать возможные взаимодействия аминокислотных остатков FRs и CDRs. Необходимо сохранить присущие грызунам аминокислотные остатки, которые служат для удерживания CDRs в соответствующих пространственных антигенсвязывающих конструкциях. Например, если в антитело человека, направленное к каркасу антигенной молекулы, проводят трансплантацию только CDRs антитела грызуна в отношении поверхностного антигена лимфоцитов человека, то полученное в результате трансформированное антитело обладает неприемлемым сродством. При применении компьютерной модели к VH-области CDRs и FRs было обнаружено, что в антителе грызуна Phe27 на FR1 непосредственно контактирует с CDR1, но с Ser27 антитела человека. Когда указанный остаток серина в положении 27 был замещен на фенилаланин, то трансформированное таким образом антитело сохраняло исходную связывающую активность антитела грызуна. В действительности, после мутаций нескольких отдельных FR остатков сродство некоторых трансформированных антител можно повысить более чем в 3 раза. Первое трансформированное антитело САМРАТН-1Н было успешно использовано в клинической терапии лимфомы (не представляющей собой лимфому Ходгкина) и ревматоидного артрита. Аналогичные результаты были также получены от HuRSV-19 и D1.3VHFNS/VK.
Общая стратегия замещения аминокислотных остатков включает: выбор в качестве акцептора наиболее гомологичной последовательности человека FRs, опираясь на известную кристаллическую структуру вариабельных участков и на последовательности аминокислот соответствующих семейств; построение молекулярной модели с помощью компьютера; и последующее определение того, какой из аминокислотных остатков нуждается в замещении. Однако следует отметить, что подбор главных остатков FR может увеличить гетерогенность антитела, так же как и его сродство. В связи с этим при конструировании пригодного в терапевтическом отношении антитела необходимо неоднократно оптимизировать баланс между сродством и иммуногенностью. В настоящем изобретении мы сконструировали циклическое триспецифичное антитело с трансформированным анти-CD3 scFv и трансформированным однодоменным анти-CD28 антителом; они были сконструированы в нашей собственной библиотеке. Для дальнейшего использования в клинической терапии было бы полезно снизить иммуногенность всей молекулы в целом.
При конструировании циклического триспецифичного антитела очень важен выбор интерлинкера, т.к. именно он должен определять, будет ли определенная конструкция настолько удачной, насколько этого хотелось. В нашем изобретении в качестве интерлинкеров мы выбрали часть Fc фрагмента IgG человека, часть сывороточного альбумина человека и шарнирную область иммуноглобулина IgG3' CL. Между указанными интерлинкерами и фрагментами антител был использован гибкий короткий лептид (Gly4Ser), который предназначен для того, чтобы содействовать точному удерживанию различных фрагментов антитела.
Интерлинкер Fc: Неспособность активировать каскад эффектора из-за отсутствия Fc является главным недостатком небольших молекул антител. Было доказано, что из четырех подклассов IgG человека наиболее эффективно опосредовать ADCC CDC способен IgGl. Некоторые С-терминальные остатки IgGl CH2 могут соединяться с Clq, запуская классический хромосомный путь обмена. Из этих остатков остатки Glu318, Lys320 и Lys322 являются пространственно замкнутыми и они расположены на поверхности Fc для того, чтобы быть непосредственно соединены с Clq. Некоторыми исследованиями было показано также, что гликозилирование Fc у Asn297 очень существенно для ADCC и CDC, при этом не наблюдалось никакого влияния на антигенсвязывающую активность антител. Поэтому при конструировании триспецифичного антитела по настоящему изобретению в качестве интерлинкера был выбран фрагмент IgGl CH2 человека, содержащий 26 аминокислотных фрагментов начиная с Asn 297 до Lys322 (включая сайт гликозилирования и сайт Clq связывания).
Интерлинкер HSA: Другой проблемой применения небольших молекул антител в клинической практике является их короткий полупериод и быстрое выведение из крови, что составляет существенный дефект для иммунотерапии, но представляет собой преимущество для иммунодиагностики и нейтрализации токсинов. Сывороточный альбумин человека является самым главным белком и он широко распространен в организме человека. Не обладая ферментативной активностью, иммунной активностью и побочными эффектами, HSA выводится из печени медленно и находится в состоянии in vivo в течение нескольких недель. Было показано, что стабильность белка, сцепленного с HSA, может увеличиться в 20-40 раз, а слитый белок, в целях очищения, в основном поглощался печенью, что существенно снижало токсичность в отношении почек. Молекула HSA содержит 3 домена, которые включают в себя 585 аминокислотных остатков и 17 дисульфидных связей. Было. подтверждено, что домен III может выполнять функцию интактного HSA белка. Поэтому в качестве интерлинкера по настоящему изобретению был выбран фрагмент из 25 аминокислотных остатков (с 403 по 425) из домена III.
Шарнирная область иммуноглобулина человека IgG3' CL: Цистеин шарнирной области способен образовывать дисульфидные связи, что облегчает соединение двух тяжелых цепей при формировании антитела с естественной пространственной структурой. Шарнирная область иммуноглобулина человека IgG3' состоит из 17 аминокислотных остатков, включая два цистеиновых, и это делает ее пригодной в функции интерлинкера. В настоящем изобретении фрагмент из 17 аминокислотных остатков шарнирной области иммуноглобулина человека IgG3' CL используется для циклизации триспецифичного антитела.
Литература: [0018] [Reterences: I. Huang H L. Gene engineering antibody. Monoclonal Antibody Communication, 1991, 7(3): 1-4; 2. Liu X F, Huang HL. Progress in gene engineering antibody. Progress Biotechnol, 1994, 14(1): 54; 3) Huang H L. Humanized antibody: small molecule antibody and tumor therapy. Monoclonal Antibody Communication, 1993, 9(3): 19; 4. Slavik, J M., Hutchcroft, J E. & Bierer, B. E.(1999): CD28/CTLA-4 and CD80/CD86 families, signaling and function. Immunologic Research. 19/1:1-24; 5. Demanet С, Brissinck J, Leo O et al.: Bispecific antiboddy-mediated immunotherapy of the BCL1 lymphoma: increasd efficacy with multiple injections and CD28-induced costimulation. Blood 1996; 87: 4390-4398; 6. Bohlen H, Manzke O, Titzer S et al.: Prevention of Epstein-Barr virus-induced human B-cell lymphoma in severe combined immunodeficient mice treated with CD3.times.CD19 bispecific antibodies, CD28 monospecific antibodies, and autologous Т cells. Cancer Res. 1997; 57: 1704-1709; 7. Reimer С, Jang W, Sahin U et al. Science 1994; 264: 833-835; 8. Mazzoni A, Mezzanzanica D, Jung G et al.: CD3-CD28 costimulation as a means to avoiding Т cell preactivation in bispecific monoclonal antibody-based treatment of ovarian carcinoma. Cancer Res. 1996; 56: 5443-5449; 9. Manzke, O., Berthold, F, Huebe, К et al. (1999): CD3.times.Cd19 bispecific antibodies and CD28 bivalent antibodies enhance T-cell reactivity against autologous leukemic cells in pediatric B-A11 bone marrow. Int. J. Cancer, 80: 715-722; 10. Grosse-Hovest L, Brandl M, Dohlsten M et al.: Int. J. Cancer 1999; 80: 138-144; 11. Bouliannc, G L., Hozumi, N. & Shulman, M J (1984): Production of functional chimeric mouse/human antibody. Nature. 312, 643-646; 12. Neubcrger, M S., Williams, G Т & Fox, R.О. (1984): Recombinant antibodies possessing novel effector functions. Nature 312,604-608; 13. Jones, P T, Dear, P H., Foote, J et al. (1986): Replacing the complementarity-determining regions in a human antibody with those from a mouse. Nature, 321,522-525; 14. Riechmann, L., dark, M, Waldmann, H. et al. (1988): Reshaping human antibodies for therapy. Nature, 332,323-327; 15. Fay T N, Jacobs I, Teisner B. ct al.(1988): Two fetal antigens (FA-1 and FA-2) and endometrial proteins (PP 12 and PP 14) isolated from amniotic fluid; preliminary observations in fetal and maternal tissues. Eur J Obstet Gynecol Reprod Biol, 29(1):73-85; 16. Tutt A, Stevenson G T, Glennie M J(1991): Trispecific F(ab)3 derivatives that use cooperative signaling via the TCR/CD3 complex and CD2 to activate and redirect resting cytotoxic T cells. J Immunol 147(1):60-9; 17. Jung G, Frcimann U, Von Marschall Z. et al.(1991): Target cell-induced T cell activation with bi- and trispecific antibody fragments. Eur J Immunol 21(10):2431-5: 18. French R R, (1998): Production of bispecific and trispecific F(ab)2 and F(ab)3 antibody derivatives. Methods Mol Biol, 80: 121-134; 19. Somasundaram С, Sundarapandiyan К, Keler Т. et al., (1999): Development of a trispecific antibody conjugate that directs two distinct tumor-associated antigens to CD64 on myeloid effector cells. Hum Antibodies, 9(1):47-54; 20. Schoonjans R, Willems A, Schoonooghe S, et al.(2000a): Fab chains As an efficient heterodimerization scaffold for the production of recombinant bispecific and trispeciiic antibody derivatives. J Immunol, 165(12):7050-7; 21. Schoonjans R, Willems A, Grooten J, ct al., (2000b): Efficient heterodimerization of recombinant bi- and trispecific antibodies. Bioseparation, 9(3): 179-83; 22. Wong W M, Vakis S A, Ayre К R, et al., (2000): Rheumatoid arthritis T cells produce Thi cytokines in response to stimulation with a novel trispecific antibody directed against CD2, CD3, and CD28. Scand J Rheumatol, 29(5):282-7; 23. Schott M E, Frazier К A, Pollock D K, et al., (1993): Preparation, characterization, and in vivo biodistribution properties of synthetically cross-linked multivalent antitumor antibody fragments. Bioconjug Chem, 4(2): 153-65].
Карцинома яичника занимает второе место среди злокачественных опухолей в гинекологии. Наиболее серьезной трудностью этого заболевания является отсутствие симптомов на ранней стадии, склонность к рецидивам и довольно низкая выживаемость (30%). Для улучшения ситуации после курса лечения этого заболевания было бы важным разработать чувствительный метод ранней диагностики, а также эффективный подход к устранению очагов, оставшихся после хирургической операции. В этом случае при проведении иммунотерапии карциномы яичника должно быть полезным циклическое одноцепочечное триспецифичное антитело.
Краткое содержание настоящего изобретения
Целью настоящего изобретения является обеспечение специально разработанного методом генной инженерии циклического одноцепочечного триспецифичного антитела, которое обладает низкой токсичностью и высокой эффективностью; а также упрощение способа его продуцирования.
В предпочтительном варианте настоящее изобретение обеспечивает вектор экспрессии, который может быть использован при конструировании универсального циклического одноцепочечного триспецифичного антитела.
В другом аспекте настоящее изобретение обеспечивает вектор клетки-хозяина, содержащий вектор экспрессии, используемый при конструировании циклического одноцепочечного триспецифичного антитела.
В еще одном аспекте настоящее изобретение обеспечивает последовательность нуклеотидов, кодирующую указанное циклическое одноцепочечное триспецифичное антитело.
Молекула антитела содержит две идентичные пары тяжелых цепей и легких цепей. Каждая цепь состоит из одной вариабельной области (V) и одной или более константных областей (С). Вариабельные области V ответственны за связывание с антигеном, а константные области С - за связывание с молекулой эффектора. В пределах каждой вариабельной области имеется три коротких гибких петлеобразных сегмента, которые называют гипервариабельными участками (CDRs), они абберантны по последовательному расположению и по кристаллической структуре. Другие промежуточные участки, называемые каркасными (FRs), относительно стабильны и состоят из β-пластин. Указанные участки CDRs и FRs расположены с промежутками, образуя структуру «сэндвича». Ниже приведены термины, используемые в настоящем изобретении.
«Fab антитело» представляет собой фрагмент антитела, содержащий Fd фрагмент
(Vн тяжелой цепи + CH1), а также целиком всю легкую цепь. Посредством дисульфидной связи они образуют гетеродимер. Его размер составляет приблизительно 1/3 размера всей молекулы антитела и имеет только один антигенсвязывающий сайт.
«Одноцспочечное антитело (scFv)» представляет собой рекомбинантный белок, полученный методом генной инженерии. Он состоит из VH и VL, соединенных пептидным линкером. Его размер составляет приблизительно 1/6 размера всей молекулы антитела.
«Однодоменное антитело» - это вариабельный участок тяжелой или легкой цепи. Этот тип фрагмента антитела, полученного методом генной инженерии, имеет единственный домен, а его размер составляет приблизительно 1/12 размера всей молекулы антитела.
«Минимально распознаваемой единицей» (MRU) является любой одиночный гипервариабельный участок CDR из вариабельных участков тяжелой или легкой цепи. Его размер составляет от приблизительно 1/70 до приблизительно 1/80 размера всей молекулы антитела.
В «трансформированном антителе» (называемым также CDR-привитым антителом) замена CDRs грызуна на CDRs человека проводят искусственным синтезом или сайт-направленным мутагенезом, поэтому антигенсвязывающая активность исходного моноклонального антитела грызуна сохраняется. Некоторые аминокислотные остатки FRs человека могут препятствовать конформации антигенсвязывающего сайта, поэтому их необходимо изменить для того, чтобы получить ослабленное антитело, обладающее наивысшим сродством.
Настоящее изобретение обеспечивает циклическое одноцепочечное триспецифичное противоопухолевое антитело. Оно содержит три части: противоопухолевое Fab, однодоменное антитело или scFv, трансформированное Fab, однодоменное антитело или scFv в отношении CD3 человека, а также трансформированное Fab, трансформированное однодоменное антитело или scFv в отношении CD28 человека; эти части сшиты пептидными интерлинкерами, образуя циклическую одноцепочечную молекулу.
Противоопухолевым антителом, имеющим циклическиую одноцепочечную триспецифичную структуру, упомянутую в настоящем изобретении, может быть Fab-фрагмент, однодоменное антитело или одноцепочечное антитело в отношении рака яичника человека.
Лучше всего, если указанное циклическое одноцепочечное триспецифичное антитело состоит из одноцепочечного антитела в отношении карциномы, трансформированного одноцепочечного антитела в отношении CD3 человека и трансформированного одноцепочечного антитела в отношении CD28 человека, которые сшиты пептидными интерлинкерами с образованием циклической одноцепочечной молекулы.
Лучше, если указанное циклическое одноцепочечное триспецифичное антитело, упомянутое в настоящем изобретении, представляет собой VН антитела в отношении CD28, имеющее одну из приведенных ниже последовательностей аминокислот:

Лучше, если в циклическом одноцепочечном триспецифичном антителе, упомянутом в настоящем изобретении, присутствует несколько пептидных интерлинкеров, находящихся между указанным противоопухолевым антителом (Fab, однодоменное антитело или scFv), трансформированным CD3 антителом (Fab, однодоменное антитело или scFv) и трансформированным CD28 антителом (Fab, однодоменное антитело или scFv). Указанные пептидные интерлинкеры могут иметь одну из следующих аминокислотных последовательностей:

Было бы лучше, чтобы указанное триспецифичное антитело было сшито с образованием циклической молекулы при использовании следующих пептидных интерлинкеров:
3 (1) HINGE (reverse): HUMAN-IgG3'CL PCRPCTHTTDGLPTKLE (2) HINGE (forward): HUMAN-IgG3'CL ELKTPLGDTTHTCPRCP
Настоящее изобретение обеспечивает последовательность нуклеотидов, кодирующих циклическое одноцепочечное триспецифичное антитело, упомянутое в изобретении.
В других аспектах настоящее изобретение обеспечивает вектор экспрессии, содержащий упомянутые выше последовательности нуклеотидов. Вектором экспрессии может быть pTRI.
В других аспектах настоящее изобретение обеспечивает клетку-хозяина, содержащую упомянутый выше вектор экспрессии. Указанной клеткой-хозяином может быть Escherichia coli.
Проектирование и построение упомянутого в настоящем изобретении циклического одноцепочечного триспецифичного антитела основаны на следующей теории. Для активирования Т-лимфоцитов необходим со-стимулирующий сигнал. Ген, кодирующий антитело в отношении карциномы человека, сливают с последовательностями двух трансформированных антител в отношении двух основных молекул, стимулирующих сигнал. Настоящее триспецифичное антитело отличается от других триспецифичных антител следующими характеристиками:
1. Триспецифичное циклическое антитело представляет собой белковую молекулу. Шарнирный участок антитела человека вводят во фланкирующие области молекулы линейного триспецифичного антитела, и с помощью последовательности шарнирного участка это антитело замыкается в круг по дисульфидным связям. Образование циклической молекулы снижает помехи от различных антигенсвязывающих сайтов в одной и той же молекуле, делает ее более стабильной и упрощает ее транспортировку in vivo.
2. Все три антитела триспецифичного антитела (в особенности однодоменное антитело в отношении CD28 человека) являются антитела, молекулы которых имеют небольшие размеры. Молекулярная масса триспецифичного антитела довольно низка (84 kDa), что делает его пригодной в иммунотерапии рака.
3. Антитела в отношении CD28 и CD3,ответственные за активацию Т-клеток, представляют собой ослабленные трансформированные антитела, обладающие значительно более низкой иммуногенностью.
4. Между каждыми из двух антител находится специально сконструированный интерлинкер, который обеспечивает удерживание антитела в нужной конформации, а также вводит много других биологических функций.
5. Все три молекулы антител сцеплены со всей молекулой и наделяют ее тремя различными функциями.
6. Противоопухолевое антитело триспецифичного антитела можно легко заменить другим опухолево-специфичным или цинокин-специфичным антителом; это должно расширить границы его применения.
7. Настоящее антитело спроектировано таким образом, что его может продуцировать E.coli, а полученные продукты не требуют дальнейшей трансформации in vitro. Поэтому указанное антитело легко получить при низкой стоимости.
Краткое описание чертежей
Фиг.1 представляет собой схему построения и экспрессии циклического одноцепочечного триспецифичного антитела;
Фиг.2 иллюстрирует сшивание различных антител (противоопухолевое scFv x анти-CD3 x анти-CD28) и интерлинкеров;
Фиг.3 (а, в) представляет две последовательности ДНК, а также предполагаемые аминокислотные последовательности трансформированного одноцепочечного антитела (VH) в отношении CD28;
Фиг.4 (а, в) представляет ДНК и аминокислотные последовательности интерлинкеров;
Фиг.5 представляет продукты цепной реакции полимеразы (ПЦР);
Фиг.6 представляет генетическую карту универсального вектора экспрессии pTRI, используемого для циклического одноцепочечного триспецифичного антитела;
Фиг.7 представляет результаты денатурирующего электрофореза в полиакриламидном геле циклического триспецифичного антитела в отношении карциномы яичника, подвергнутого экспрессии в pTRI;
Фиг.8 представляет собой результаты анализа циклического триспецифичного антитела в отношении карциномы яичника, подвергнутого экспрессии в Е.coli, сделанного методом вестерн-блоттинга; на левой проекции представлен Lane 1, супернатант вектора pTMF, и Lane 2, супернатант TsAb; на правой проекции представлены Lane 1, супернатант TsAb (400 мкг/мл); Lane 2, супернатант TsAb (40 мкг/мл); Lane 3, супернатант TsAb (4 мкг/мл);
Фиг.9 представляет результаты взаимодействия циклического одноцепочечного триспецифичного антитела в отношении карциномы яичника с антигеном CD28; результаты получены методом твердофазного иммуноферментного анализа (ELISA), контролем служил супернатант вектора pTMF; TRI был супернатаном TsAb;
Фиг.10 представляет результаты взаимодействия циклического одноцепочечного триспецифичного антитела в отношении карциномы яичника с антигеном клеток мембраны карциномы яичника или с антигеном CD3; результаты получены методом твердофазного иммуноферментного анализа (ELISA); причем PTMFSKOV - взаимодействие супернатанта вектора pTMF с антигеном клеток мембраны карциномы яичника; TRISKOV - взаимодействие TsAb с антигеном клеток мембраны карциномы яичника; PTMFJUR - взаимодействие супернатанта вектора pTMF с антигеном клеток мембраны Juekat; TRIJUR - взаимодействие TsAb с антигеном клеток мембраны Jurkat;
Фиг.11 иллюстрирует цитотоксичность in vitro циклического одноцепочечного триспецифичного антитела в отношении карциномы яичника к клеткам карциномы яичника (OCCD3CD28: anti-ovary carcinoma scFv+anti-CD3 antibody+anti-CD28 antibody; OCCD3: anti-ovary carcinoma scFv+anti-CD3 antibody; TRI: циклическое одноцепочечное триспецифичное антитело; Контроль: антитела отсутствуют; Vector CK: супернатант вектора);
Фиг.12 представляет анализ циклического одноцепочечного триспецифичного антитела с использованием реакции розеткообразования.
Подробное описание настоящего изобретения
Последовательность интерлинкера была синтезирована искусственно с использованием цепной реакции полимеразы. Путем внедрения этой последовательности в pUC19 была получена новая плазмида, названная pUHM1. Фрагмент ДНК биспецифичного антитела в отношении карциномы яичника CD3 получили расщеплением плазмиды pALM-Fc с помощью XhoI и BamHI и последующем внедрении в pUHMl. Плазмиду, содержащую эту последовательность, назвали pUHM2. Другую - экспрессионную плазмиду pTCH1 получили, внедряя трансформированное однодоменное антитело в отношении CD28 и интерлинкер в pTMF. Фрагмент биспецифичного антитела (anti-ovarian carcinoma x anti-CD3) и интерлинкер расщепляли из pUHM2, а затем внедряли в pTCH1. Полученный в результате этого вектор экспрессии, названный pTRI, использовали для изменения компетентных клеток BL21. После того, как было подтверждено, что полученные клоны являются pTRI-положительными, провели инокуляцию в среду LB, содержащую 50 мкг/мл канамицина. Культивирование проводили при 37°С и энергичном встряхивании до оптической плотности, составляющей от приблизительно 0,4 до приблизительно 0,5. Культуру обрабатывали IPTG в течение 4 ч до конечной концентрации 0, 8 ммол/л, а затем собрали центрифугированием. Полученные клетки подвергли лизису с помощью ультразвука, а лизат центрифугировали в течение 10 мин при скорости 12000 об/мин. Супернатант и плотные сгустки разделили денатурирующим электрофорезом в 8% и 12% полиакриламидном геле. Образцы подвергли стандартному анализу, включая иммуноблоттинг, анализ иммунологической активности и цитологический анализ (см. фиг.1-фиг.6).
Ниже приведен подробный протокол клонирования вектора.
1. Конструкция клонирующего вектора pUMH1
Указанный клонирующий вектор был получен из pUC19. Последовательность линкера (5'-HmdIII-pelB-human IgG3'CL hinge(complementary)-Gly4Ser-HSA-Gly4Ser-NdeI-EcoRI-3') была внедрена в pUC19, линеаризированную HindIII и EcoRI. 6 олигонуклеотидных фрагментов, названных P1-P3 и RE1-RE3, использовали в качестве матрицы/праймера для получения полных 285 пар оснований фрагмента линкера:
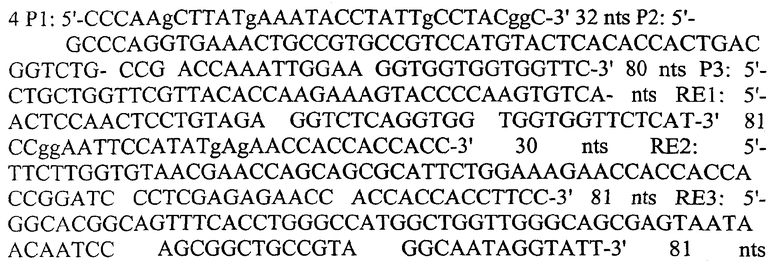
1.1 Использование перекрывающихся продуктов ПЦР при конструировании линкерной последовательности
Процесс проводили в две стадии, как это показано на фиг.5. Первая стадия: два продукта M1 и М2, имеющие двойные спирали, соединили с Р1, P2, RE2 и RE3, P3 и RE1, соответственно. Вторая стадия: целиком линкер был получен при использовании перекрывающихся продуктов ПЦР с эквимолярным количеством M1 и М2 (в качестве матриц).
Получение M1: в 30 мкл реакции при добавлении 4 мкл (приблизительно 10 пмол/л) P1, Р2, RE2 и RE3, соответственно, 3 мкл 10 × pfu буфера ДНК полимеразы, 4 мкл dNTPs (2 мкмол/л каждый), 1 мкл pfu ДНК полимеразы, введением деионизированной Н2O до полного объема, составляющего 30 мкл, и наложением сверху 100 мкл парафинового масла. Проведение 30 ПЦР по термическому датчику циклов. Термический цикл составлял: 94°С в течение 1 мин, 55°С в течение 30 с и 72°С в течение 40 с. Фрагменты амплифицированной ДНК анализировали в 2,5% агарозном геле. Целевая полоса была вырезана и восстановлена с помощью набора для очистки ДНК (Gel DNA purification kit; Watson Inc. Shanghai, China).
Получение М2: в 30 мкл реакции при добавлении 10 мкл Р3, RE1 (приблизительно 10 пмол каждый) соответственно, 3 мкл 10 × буфера ПЦР, 4 мкл dNTPs (2 мкмол/л каждый), 1 мкл 10 pfu буфера ДНК полимеразы, введением деионизированной Н2O до полного объема, составляющего 30 мкл, и наложением сверху 100 мкл парафинового масла. Проведение 30 ПЦР по термическому датчику циклов. Термический цикл составлял: 94°С в течение 1 мин, 60°С в течение 30 с и 72°С в течение 40 с. Фрагменты амплифицированной ДНК анализировали в 2,5% агарозном геле. Целевая полоса была вырезана и восстановлена с помощью набора для очистки ДНК (Gel DNA purification kit; Watson Inc. Shanghai, China).
Получение полной длины линкера: в 30 мкл реакции при добавлении 5 мкл восстановленных M1 и М2 в качестве матриц, 2 мкл Р1 и RE1 в качестве праймеров, 3 мкл 10 × pfu буфера, 4 мкл dNTPs (по 2 мМ каждый), 1 мкл ДНК полимеразы, введением деионизированной Н2О до полного объема, составляющего 30 мкл, и наложением сверху 100 мкл парафинового масла. Проведение 30 ПЦР по термическому датчику циклов. Термический цикл составлял: 94°С в течение 1 мин, 55°С в течение 30 с и 72°С в течение 40 с. Фрагменты амплифицированной ДНК анализировали в 2,5% агарозном геле. Целевая полоса была вырезана и восстановлена с помощью набора для очистки ДНК (Gel DNA purification kit; Watson Inc. Shanghai, China).
1.2 Расщепление рестрикционной эндонуклеазы и очистка продуктов ПЦР
Продукт ПЦР по всей своей длине расщепляли в течение 4 ч с помощью HindIII и EcoRI при 37°С. Расщепленные фрагменты ДНК отделяли на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
1.3 Мини-препарирование pUC19
Одноколониевую DH5α, содержащую плазмиду pUC19, инокулировали в 5 мл среды LB, содержащей 100 мкг/мл ампициллина. Культуру инкубировали в течение ночи при энергичном встряхивании при 37°С. 1,5 мл культуры вылили в пробирку и в течение 1 мин проводили центрифугирование при скорости 12000 об/мин. Среду удалили и провели повторное суспендирование бактериального осадка в 100 мкл раствора 1 (50 ммол/л глюкозы, 10 ммол/л ЭТДК, 25 ммол/л Tris-C18.0) при энергичном вихревом встряхивании. К полученной суспензии бактерий добавили 200 мкл свежеприготовленного раствора II (0,2 мол/л NaOH, 1% додецилсульфат натрия), пробирку плотно закрыли, содержимое перемешали, несколько раз переворачивая пробирку. Пробирку держали 3 мин на льду и потом в нее добавили 150 мкл охлажденного льдом раствора III (3 мол/л КАс, рН 4.8). Пробирку закрыли и осторожно несколько раз переворачивали. Пробирку держали на льду 5 мин. Лизат бактерий центрифугировали при скорости 12000 об/мин в течение 10 мин, супернатант перенесли в пробирку. Добавили двойной объем охлажденного на льду этанола и из полученного супернатанта осадили ДНК. Раствор перемешали при вихревом встряхивании и отставили на 10 мин при комнатной температуре. Провели центрифугирование при скорости 12000 об/мин в течение 20 мин, для однократного промывания осадка ДНК добавили 75% этанол и открытую пробирку оставили для высушивания при комнатной температуре. Осадок растворили в 100 мкл Н2O. содержащих 50 мкг/мл РНК, свободной от ДНК. Пробирку выдерживали в течение 30 мин, добавили равные объемы фенола и хлороформа (1:1). При встряхивании смешали органическую и водную фазы и провели центрифугирование при скорости 12000 об/мин в течение 2 мин при комнатной температуре. Верхний водный слой перенесли в чистую пробирку и добавили равный объем хлороформа: изопентанола (24:1; объем/объем). Добавили 1/10 объема NaAc (3 мол/л, рН 5.2) и 2 объема охлажденного на льду этанола. Полученный раствор перемешали при вихревом встряхивании и отставили на 10 мин при комнатной температуре. Провели центрифугирование при скорости 12000 об/мин в течение 60 мин. Для однократного промывания осадка ДНК добавили 75% этанол и открытую пробирку оставили для высушивания при комнатной температуре. Полученный осадок растворили в 25 мкл H2O.
1.4 Расщепление рестрикционной эндонуклеазы и очистки плазмиды pUC19
1 мкг pUC19 ДНК расщепляли с помощью HindIII и EcoRI, процесс проводили в 40 мкл системе (4 мкл × 10 буфера, 30 единиц HindIII и 30 единиц EcoRI) при 37°С в течение 4 ч. Реакционную смесь анализировали на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit;Watson Inc. Shanghai, China).
1.5 Сшивание линеаризированой pUC19 с фрагментом линкера
В 20 мкл реакторе для сшивания использовали приблизительно 40 нг восстановленного фрагмента дважды расщепленной pUC19 и приблизительно 20 нг дважды расщепленных продуктов ПЦР (2 мкл × 10 буфер Т4 ДНК лигазы, буфер Т4 ДНК лигазы). Инкубирование проводили в течение ночи при 1,6°С.
1.6 Получение компетентной клетки Е.coli с помощью хлорида кальция
С пластины собрали одну колонию Тор 10. Эту колонию переместили в 3 мл среды LB, не содержащей антибиотика. Культуру инкубировали при встряхивании в течение ночи при 37°С. 300 мкл полученной культуры перенесли в 30 мл среды LB. Инкубирование проводили при 37°С в условиях энергичного встряхивания до оптической плотности OD550, приблизительно составляющей от 0,3 до приблизительно 0,4; процесс занял приблизительно 3 ч. Культуру сохраняли на льду в течение 10 мин для ее охлаждения, а потом провели центрифугирование со скоростью 4000 об/мин при 4°С. Супернатант удалили. Для повторного суспендирования добавили 20 мл охлажденного на льду 0,1 мол/л CaCl2, создавая при этом легкое завихрение и мягкое встряхивание. Культуру охладили, оставив пробирку на 30 мин на льду. Провели центрифугирование в течение 10 мин со скоростью 4000 об/мин при 4°С. Супернатант удалили, а для повторного суспендирования осадка добавили 2 мл охлажденного на льду 0,1 мол/л CaCl2, содержащего 12% глицерина. В пробирку добавили по 200 мкл компетентных клеток и их сохраняли при -70°С.
1.7 Трансформация Е.coli, скриннинг положительных колоний бактерий и идентификация секвенированием
Осторожно смешали 10 мкл продукта сшивания с 200 мкл DH5 α химически компетентных клеток, 30 мин сохраняли на льду, а затем инкубировали при 42°С на водяной бане в течение ровно 90 с. Потом в течение 5 мин охлаждали на льду и все 200 мкл трансформированных компетентных клеток перенесли на агаровую среду LB, содержащую 100 мкг/мл ампициллина. После поглощения жидкости пластину перевернули и проводили инкубирование в течение ночи при 37°С. Собрали одну колонию для того, чтобы методом щелочного лизиса осуществить мини-препарирование плазмиды ДНК. Провели идентификацию плазмиды при ее расщеплении с помощью Hind и EcoR, а затем осуществили амплифицирование, используя Р1 и RE1 в качестве праймеров. Затем положительная плазмида была идентифицирована секвенированием и построена как pUMH1.
2. Конструирование клонирующего вектора pUMH2
Клонирующий вектор pUMH2 получали исходя из плазмиды pUMH1 при внедрении в нее фрагмента биспецифичного антитела (5'-XhoI-anti-ovarian carcinoma scFv-Fc linker-anti-CD3 scFv-BamHI-3') между XhoI и BamHI. Полученный фрагмент (anti-ovarian x anti-CD3) биспецифичного одноцепочечного антитела расщеплили из pALM-Fc, построенного в нашей лаборатории.
2.1 Получение и очистка фрагмента биспецифичного антитела
Плазмиду ДНК экстрагировали из pALM-Fc методом щелочного лизиса. Провели расщепление 1 мкг pALM-Fc с помощью XhoI и BamHI, процесс осуществляли в 40 мкл реакции, содержащей 30 единиц XhoI и BamHI (TaKaRa, Dalian, China), 4 мкл × буфера, инкубирование проводили при 37°С в течение 4 ч. Полученный продукт отделили на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
2.2 Расщепление и очистка плазмиды pUMH1
Провели расщепление 1 мкл pUMH1 ДНК с помощью XhoI и BamHI, процесс осуществляли в 40 мкл объеме так, как это описано выше; инкубирование проводили при 37°С в течение 4 ч. Расщепленный фрагмент экстрагировали с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
2.3 Сшивание, трансформирование и скриннинг положительной колонии
Реакция сшивания проводилась при следующих условиях:
Инкубирование проводили в течение ночи при 16°С. 10 мкл сшиваемой смеси осторожно смешали с 200 мкл DH5 α компетентных клеток. Поместили на 30 мин на лед, затем инкубировали при 42°С на водяной бане в течение ровно 90 с. После этого охладили на льду в течение 5 мин и все 200 мкл трансформированных компетентных клеток перенесли на агаровую LB среду, содержащую 100 мкг/мл ампициллина. После поглощения жидкости пластину перевернули и проводили инкубирование в течение ночи при 37°С. Собрали одну колонию для того, чтобы осуществить мини-препарирование плазмиды ДНК. Провели идентификацию внедренного фрагмента с помощью XhoI, BamHI, HindIII и EcoR. Идентифицированная положительная плазмида представляла собой pUMH2.
3. Построение и экспрессия циклического одноцепочечного триспецифичного антитела
Построение циклического одноцепочечного триспецифичного антитела основано на экспрессии вектора рТСН1 и биспецифичного фрагмента pUMH2. рТСН1 был получен из вектора pTMF, который содержал - NdeI-(VH of anti-CD28 scFv)-(c-myc)-Gly4Ser-Human IgG3'CL(17aa, Forward)-BamHI.
3.1 Построение экспрессионной плазмиды pTCH1
Провели экстракцию рекомбинантной плазмиды pUC19, содержащей фрагмент - NdeI-(anti-CD28 VH)-(c-myc)-Gly4Ser-Human IgG3'CL (17AA, Forward)-BamHI-, используя для этого методику щелочного лизиса. Затем осуществили расщепление 1 мкг плазмиды ДНК с помощью NdeI и BamHI, проводимое в 40 мкл системе (4 мкл 10 × буфер, по 30 единиц NdeI, BamHI). Инкубировали на водяной бане при 37°С в течение 4 ч. Одновременно проводили расщепление вектора pTMF. Полученный продукт отделили на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
Реакция сшивания проводилась при следующих условиях:
Инкубировали в течение ночи при 16°С.
10 мкл сшиваемой смеси осторожно смешали с 200 мкл BL21 компетентных клеток. Поместили на лед на 30 мин, затем инкубировали при 42°С на водяной бане в течение ровно 90 с. После этого охладили на льду в течение 5 мин и все 200 мкл трансформированных компетентных клеток BL21 перенесли на агаровую LB среду, содержащую 50 мкг/мл канамицина. После поглощения жидкости пластину перевернули и проводили инкубирование в течение ночи при 37°С. Собрали одну колонию для того, чтобы осуществить мини-препарирование плазмиды ДНК. Провели идентификацию внедренного фрагмента с помощью NdeI и HindIII. Полученную положительную плазмиду назвали pTCH1.
3.2 Расщепление рестрикционной эндонуклеазы и очистка вектора pTCH1
1 мкг ДНК pTCH1 расщепляли с помощью NdeI и HindIII, процесс проводили в 40 мкл системе (4 мкл × 10 буфера, 30 единиц NdeI и HindIII) при 37°С в течение 4 ч. Продукт отделили на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
3.3 Получение и очистка интерлинкера, содержащего биспецифичное антитело
С помощью метода щелочного лизиса провели мини-препарирование pUMH2. 1 мкг ДНК pUMH2 расщепили с помощью NdeI и HindIII, процесс проводили в 40 мкл системе (4 мкл 10 × буфер, 30 единиц NdeI и HindIII). Инкубировали при 37°С в течение 4 ч. Продукт отделили на 1% агарозном геле. Целевую полосу восстановили с помощью набора для очистки ДНК (Gel DNA purification Kit; Watson Inc. Shanghai, China).
3.3 Сшивание, трансформирование и скриннинг положительной колонии
Реакция сшивания проводилась при следующих условиях:
Инкубирование проводили в течение ночи при 16°С. 10 мкл сшиваемой смеси осторожно смешали с 200 мкл BL21 компетентных клеток. Поместили на лед на 30 мин, затем инкубировали при 42°С на водяной бане в течение ровно 90 с.После этого охладили на льду в течение 5 мин и все 200 мкл трансформированных компетентных клеток перенесли на агаровую LB среду, содержащую 50 мкг/мл канамицина. После поглощения жидкости пластину перевернули и проводили инкубирование в течение ночи при 37°С. Собрали одну колонию для того, чтобы осуществить мини-препарирование плазмиды ДНК. Провели идентификацию внедренного фрагмента с помощью NdeI и HindIII. Положительную плазмиду назвали pTR1.
3.5 Экспрессия циклического одноцепочечного триспецифичного антитела
Собрали одну свежеприготовленную положительную колонию pTR1, перенесли в среду LB, содержащую 50 мкг/мл канамицина, и инкубировали в течение ночи при 37°С. Полученную ночную культуру разбавили в соотношении 1:100 в 50 мл свежеприготовленной среды LB, процесс проводили в 250-мл колбе. Культуру инкубировали при 37°С для ее роста вплоть до достижения середины своего логарифмического роста (OD600 0,4-0,5). Затем в культуру дополнительно внесли IPTG до конечной концентрации, составляющей 0,8 мМ, и продолжили инкубирование в течение дополнительных 4 ч. Полученные микроорганизмы собрали и обработали ультразвуком на льду, потом провели центрифугирование в течение 10 мин при скорости 12000 об/мин. Полученный супернатант и осадок анализировали методом денатурирующего электрофореза в 8%, 12% полиакриламидном геле.
Формование геля додецилсульфат натрия-полиакриламид (НДС-ПАА) (табл.1).
Таблица 1
2,1
4,9
6,9
0,93
Приготовление образца: образец белка смешивают с равным объемом буфера (100 мМ Tris-HCl рН 6.8, 200 мМ DTT, 4% додецилсульфата натрия 20% глицерина, 0,2% бромфенол синий), нагревают в течение 5 мин при 100°С. Затем каждый образец загружают в полиакриламидный гель для денатурирующего электрофореза. Его проводят при 60V в концентрирующем геле, затем при 120V в разделяющем геле в специальном буфере (25 мМ Tris, 0,1% додецилсульфата натрия, 250 мМ глицин (рН8.3)). Белки окрашивались в течение 1-2 ч в красящем растворе кумасси бриллиантового голубого R-250 (0,25% (вес/объем) красителя R 250, 50% метанол, 10% уксусная кислота). Затем проводят обесцвечивание с помощью 10% уксусной кислоты (50% метанол, 10% уксусная кислота), раствор меняют каждые 30 мин до тех пор, пока подложка не станет прозрачной (3-5 раз). Делают фотоснимки и проводят анализ гелей (показано на фиг.7).
Вестерн-блоттинг: используя электрофорез, образцы белка переносят с полиакриламидного геля на поливинилиденфторидную мембрану. Электрофорез проводят в соответствии с протоколом, предоставленным производителем. В течение 2 ч в блокирующем растворе (5% снятое молоко) осуществляют быстрое инкубирование мембраны, затем трижды (по 5 мин каждое промывание) промывают с использованием TBST. Мембрану перенесли в TBST, содержащий иммуноглобулин мыши (anti-c-myc IgG) в разведении 1:1000, и проводили инкубирование в течение 1 ч при комнатной температуре. Затем мембрану промывают трижды в TBST (по 5 мин каждое промывание) и переносят ее в TBST, содержащий конъюгат антитела козла и мыши (goat anti-mouse IgG HRP). В завершение проводят инкубирование мембраны в растворе субстрата (6 мг/мл DAB, 1% H2О2), которое осуществляют до тех пор, пока интенсивность целевых полос не станет достаточной. Реакцию прекращают путем неоднократного промывания указанной мембраны в деионизированной воде. Молекулярная масса scTsAb составила 84 kDa (показано на фиг.8).
4. Химическая характеристика циклического одноцепочсчного триспецифичного антитела in vitro
4.1 Антигенсвязывающие активности циклического одноцепочечного триспецифичного антитела
Антигенсвязывающие активности sTRI по отношению к антигену rhCD28/Fc и антигену клеточной мембраны клетки Jurkat и клетки SKOV-3 исследовали методом твердофазного иммуноферментного анализа (ELISA). Антиген клеточной мембраны получали путем ультразвукового разрушения опухолевых клеток. ELISA проводили на антигене, иммобилизованном на 96-ячейковой пластине. В качестве первичного антитела использовали антитело мыши (mouse anti-c-myc antibody, (9E10)), а в качестве вторичного антитела - HRP-конъюгат антитела козла и иммуноглобулинов мыши (HRP-conjugated goat anti-mouse IgG). В заключение результаты визуализировали, используя в качестве субстрата оптическую разность хода (OPD); поглощение измеряли при 490 нм. Как показано на фиг.9 и фиг.10, циклическое одноцепочечное триспецифичное антитело способно образовывать специфичные химические связи с тремя типами антигенов.
4.2 Оценка цитотоксичности in vitro
Лимфоциты периферической крови человека (PBL) были получены от здоровых доноров путем градиентного разделения Ficoll; фракцию моноциты/макрофаги инактивировали методом сцепления со стеклом (37°С, 2 ч). Для приготовления монослоя клеток на 96-ячейковую плоскодонную пластину поместили клетки SKOV-3. Одновременно к этому монослою опухолевых клеток добавили свежевыделенные клетки эффектора (PBL); при различных разведениях супернатанта, содержащего sTRI, использовались соответствующие соотношения. Инкубирование проводилось в течение 3 суток при 37°С в инкубаторах с 5% содержанием CO2. Для удаления клеток эффектора пластину дважды промывали средой RPMI 1640. Добавили 200 мкл среды RPMI 1640 и 20 мкл раствора МТТ (0,5 мг/мл, sigma) и проводили инкубирование в течение 4 ч при 37°С. Супернатант МТТ отбросили, добавили 100 мкл ДМСО и показания прибора считывали при OD570. Добавив только одну среду, приготовили холостой опыт, в качестве контроля добавили целевые клетки и клетки эффектора. Для каждого образца сделали три повтора. Процент цитотоксичности вычислялся по следующей формуле: % цитотоксичности = (поглощение контрольных ячеек - поглощение исследуемых ячеек/поглощение контрольных ячеек - поглощение холостых ячеек) × 100. Как показано на фиг.11, добавление циклического одноцепочечного триспецифичного антитела привело к эффекту уничтожения опухолевых клеток. Процент цитотоксичности для группы циклического одноцепочечного триспецифичного антитела существенно выше, чем в двух других экспериментальных группах (oc-scFv+CD3scFv и oc-scFv+CD3 scFv+CD28 scFv).
4.3 Анализ розеткообразования
Обработанные трипсином клетки SKOV-3 центрифугировали в течение 5 мин при скорости 1000 об/мин, супернатант отбросили и провели повторное суспендирование клеток в полной среде (10% бычья сыворотка, RPMI 1640). В каждую ячейку добавили 2×102 клеток SKOV-3 и провели инкубирование в течение ночи при 37°С в инкубаторе с 5% СО2. Лимфоциты периферической крови были выделены так, как это описано выше, одновременно провели их активирование, добавив 100 IU IL-2, процесс осуществляли при 37°С в течение ночи. Для удаления оставшегося IL-2, PBLs трижды промывали RPMI 1640, а затем их ввели на пластину SKOV-3, соотношение Е/Т на которой составляло 20:1 (Е: клетки эффектора, PBLs; Т: клетки-мишени, клетки SKOV-3). Тем временем добавили супернатант циклического одноцепочечного триспецифичного антитела, провели инкубирование полученной смеси при 37°С в инкубаторе с 5% СО2. Через интервалы, составляющие 2 ч, были сделаны фотоснимки под обращенным микроскопом. Как показано на фиг.12 и в таблице 2, спустя 2 ч клетки эффектора начали слипаться с клетами-мишени. Спустя 4 ч началось разрушение большинства клеток-мишеней, а спустя 10 ч большинство клеток-мишеней распалось на фрагменты.


| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОЦЕПОЧЕЧНОЕ ТРИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО РЕКОМБИНАНТ АНТИ-СЕА/CD3/CD28, ПОЛУЧЕННЫЙ ПУТЕМ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ | 2005 |
|
RU2361878C2 |
| ОПУХОЛЕСПЕЦИФИЧНОЕ АНТИТЕЛО ПРОТИВ EGFR И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2730605C2 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2678127C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| МОЛЧАЩИЕ АНТИ-CD28-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2261723C2 |
| АНТИТЕЛО ПРОТИВ PDL-1, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2017 |
|
RU2693661C2 |
| АНТИТЕЛО, НАЦЕЛИВАЮЩЕЕСЯ НА CD3, БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2808138C1 |
| PSCAXCD3, CD19XCD3, C-METXCD3, ЭНДОСИАЛИНXCD3, EPCAMXCD3, IGF-1RXCD3 ИЛИ FAP-АЛЬФАXCD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2547600C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УСТОЙЧИВОСТЬЮ К РАСТВОРИМОМУ СЕА | 2006 |
|
RU2426743C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2535992C2 |
Настоящее изобретение относится к области биотехнологии и иммунологии. Предложен полинуклеотид, кодирующий циклическое одноцепочечное триспецифическое антитело. Антитело направлено против карциномы яичника человека in vitro, имеет массу около 84 кДа и состоит из трех компонентов: антитела против клетки карциномы яичника человека, анти-CD3 антитела и анти-CD28 антитела, которые связаны между собой пептидными интерлинкерами таким образом, что образуют циклическое антитело. Раскрыт экспрессирующий вектор, содержащий кодирующий полинуклеотид и варианты клетки-хозяина Е.coli на основе полинуклеотида и экспрессирующего вектора. Использование изобретения обеспечивает устойчивую молекулу антитела, оптимальную для активирования Т-клеток, что может найти применение для лечения карциномы яичника человека. 4 н. и 4 з.п. ф-лы, 12 ил., 2 табл.
1. Полинуклеотид, кодирующий цикличное одноцепочечное триспецифическое антитело против карциномы яичника человека in vitro, которое имеет молекулярную массу около 84 кДа, включает расположенные в приведенном порядке от аминоконца до карбоксиконца следующие составляющие:
интерлинкер, выбранный из обратного шарнирного интерлинкера из IgG3 человека, включающий аминокислотную последовательность PCRPCTHTTDGLPTKLE, или из шарнирного интерлинкера из IgG3 человека, включающий аминокислотную последовательность ELKTPLGDTTHTCPRCP;
пептид с аминокислотной последовательностью SEQ ID NO: 4 или SEQ ID NO: 5;
(i) антитело, иммуноспецифически связывающее клетку карциномы яичника человека, где указанное антитело представляет собой Fab фрагмент, однодоменное или гуманизированное одноцепочечное (scFv) антитело;
интерлинкер, состоящий из аминокислотной последовательности с Asn297 по Lys 322 из СН2 IgG1;
(ii) анти-CD3 антитело, где указанное антитело представляет собой Fab фрагмент, однодоменное или гуманизированное одноцепочечное (scFv) антитело;
пептид с аминокислотной последовательностью SEQ ID NO: 4 или SEQ ID NO: 5;
интерлинкер, состоящий из аминокислотной последовательности с 403 по 425 аминокислотный остаток домена III сывороточного альбумина человека;
пептид с аминокислотной последовательностью SEQ ID NO: 4 или SEQ ID NO: 5;
(iii) анти-CD28 антитело, где указанное антитело представляет собой Fab фрагмент, однодоменное или гуманизированное одноцепочечное (scFy) антитело;
пептид с аминокислотной последовательностью SEQ ID NO: 4 или SEQ ID NO: 5;
интерлинкер, выбранный из шарнирного интерлинкера из IgG3 человека с аминокислотной последовательностью ELKTPLGDTTHTCPRCP из обратного шарнирного интерлинкера из IgG3 человека с аминокислотной последовательностью PCRPCTHTTDGLPTKLE,
при этом первый интерлинкер и последний интерлинкер триспецифического антитела выбирают таким образом, чтобы они образовывали дисульфидную связь.
2. Полинуклеотид по п.1, где указанный анти-CD28 сегмент указанного триспецифического антитела включает аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2.
3. Полинуклеотид по п.1 или 2, отличающийся тем, что в антителе, которое кодируется указанным полинуклеотидом, обратный шарнирный интерлинкер имеет аминокислотную последовательность SEQ ID NO: 9; интерлинкер, состоящий из аминокислотной последовательности с Asn297 по Lys 322 из СН2 LgG1, имеет аминокислотную последовательность SEQ ID NO: 6; интерлинкер, состоящий из аминокислотной последовательности с 403 по 425 аминокислотный остаток домена III сывороточного альбумина человека, имеет аминокислотную последовательность SEQ ID NO: 7; а шарнирный интерлинкер имеет аминокислотную последовательность SEQ ID NO: 10.
4. Полинуклеотид по п.3, отличающийся тем, что в антителе, которое кодируется указанным полинуклеотидом, шарнирный интерлинкер дополнительно включает сегмент с-myc, включающий аминокислотную последовательность SEQ ID NO: 8; а обратный шарнирный интерлинкер дополнительно включает аминокислотную последовательность SEQ ID NO: 3.
5. Экспрессирующий вектор, включающий полинуклеотид по п.1 или 2.
6. Экспрессирующий вектор по п.5, отличающийся тем, что он является pTRI.
7. Клетка-хозяин Е.coli, включающая полинуклеотид по п.1 или 2.
8. Клетка-хозяин Е.coli, содержащая экспрессирующий вектор по п.5.
| WO 9103493 А, 21.03.1991 | |||
| Jung G “Target cell-induced T cell activation with bi- and trispecific antibody fragments”, Eur J | |||
| Immunol | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| ИММУНОСТИМУЛЯТОРНЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА | 1995 |
|
RU2155190C2 |
Авторы
Даты
2009-05-20—Публикация
2002-04-10—Подача