ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области иммунологии, и, в частности, настоящее изобретение относится к опухолеспецифичным антителам против EGFR и их применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
EGFR подвержен сверхэкспрессии или мутации во многих опухолях, и, несомненно, избирательное распознавание таких сверхэкспрессируемых или мутированных EGFR представляет собой важный научный вопрос. До настоящего времени, антитела против эпитопа EGFR287-302 предполагались для распознавания EGFR, EGFRvIII и de4 EGFR, сверхэкспрессируемых на поверхности опухолей, вместо EGFR в нормальных клетках. К сожалению, антитела против этого эпитопа по-прежнему имеют побочные эффекты, такие как высыпания, в клинических испытаниях (http://meetinglibrary.asco.org/content/115945-132), из чего можно сделать вывод, что при нацеливании на этот эпитоп может происходить идентификация EGFR в нормальных клетках (таких как кератиноциты).
Таким образом, очень важно проверять антитела против EGFR на более высокую опухолеспецифичность. Высоко опухолеспецифичные антитела имеют очень большое потенциальное значение или для диагностики иммуносцинтиграфии опухолей, индивидуальной диагностики или противоопухолевой терапии.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение опухолеспецифичных антител против EGFR и их применение.
Первым аспектом настоящего изобретения обеспечено антитело, специфически распознающее экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR , где антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи,
CDR1 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41, SEQ ID NO: 47, SEQ ID NO: 55;
CDR2 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 42, SEQ ID NO: 53;
CDR3 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 43, SEQ ID NO: 48, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 57;
CDR1 вариабельной области тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 44;
CDR2 вариабельной области тяжелой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 52;
CDR3 вариабельной области тяжелой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 50.
В предпочтительном варианте осуществления антитело включает:
антитело (а), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 46,
антитело (b), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 47, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 48, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 49, CDR3 с последовательностью SEQ ID NO: 50,
антитело (с), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 48, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (d), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (e), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 50,
антитело (f), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 53, CDR3 с последовательностью SEQ ID NO: 54, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (g), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 54, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (h), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 55, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 56, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 50,
антитело (i), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 53, CDR3 с последовательностью SEQ ID NO: 56, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (j), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 56, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (k), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 57, или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50; или
антитело (l), которое распознает ту же антигенную детерминанту, которую распознает любое из антител (а) - (k).
В другом предпочтительном варианте осуществления антитело, специфически распознающее экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR, может представлять собой: одноцепочечное антитело (scFV), моноклональное антитело, однодоменное антитело, Fab-фрагмент, Fd-фрагмент, Fv-фрагмент, F(ab')2-фрагмент и его производное или другие формы антител; предпочтительно одноцепочечное антитело.
В другом предпочтительном варианте осуществления антитело, специфически распознающее экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR, гуманизировано, полностью гуманизировано, представляет собой химерное или мышиное.
В другом предпочтительном варианте осуществления аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 13; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 13;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 59; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 59;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 61; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 61;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 63; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 63;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 65; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 65;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 67; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 67;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 69; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 69;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 71; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 71;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 73; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 73;
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 75; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 75; или
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 77; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 77.
В другом предпочтительном варианте осуществления антитело представляет собой антитело (а); более предпочтительно, аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 13; или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 13.
В другом аспекте изобретения обеспечена нуклеиновая кислота, кодирующая антитело, как описано выше.
В другом аспекте настоящего изобретения обеспечен вектор экспрессии, содержащий нуклеиновую кислоту. В другом предпочтительном варианте осуществления вектор экспрессии представляет собой вектор PH/DHFR.
В другом аспекте настоящего изобретения обеспечена клетка-хозяин, содержащая вектор экспрессии или в геном которой интегрирована нуклеиновая кислота. В другом предпочтительном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку-хозяина или прокариотическую клетку-хозяина; предпочтительно эукариотическую клетку-хозяина, более предпочтительно клетку яичника китайского хомячка (СНО).
Другим аспектом изобретения обеспечено применение любого из вышеописанных антител для получения направленно действующего лекарственного средства, конъюгата антитела с лекарственным средством или многофункционального антитела, специфически направленного на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR; или средства для диагностики опухолей, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR; или применение для получения иммунной клетки, модифицированной химерным антигенным рецептором; предпочтительно, иммунная клетка включает: Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
В другом аспекте настоящего изобретения обеспечен многофункциональный иммуноконъюгат, включающий: любое из вышеописанных антител, и связанную с ним функциональную молекулу (включая ковалентно связанные, конъюгированные, присоединенные, адсорбированные); при этом функциональная молекула выбрана из группы, состоящей из молекулы, которая нацелена на маркер поверхности опухоли, молекулы, подавляющей опухоль, молекулы, которая нацелена на маркер поверхности иммунной клетки, или детектируемой метки.
В предпочтительном варианте осуществления молекула, которая нацелена на маркер поверхности опухоли, представляет собой антитело или лиганд, который связывается с маркером поверхности опухоли; или молекула, подавляющая опухоль представляет собой противоопухолевый цитокин или противоопухолевый токсин; предпочтительно цитокины включают, но не ограничиваются ими: IL-12, IL-15, IFN-бета, TNF-альфа.
В другом предпочтительном варианте осуществления в многофункциональном иммуноконъюгате детектируемая метка включает флуоресцентную метку и хромогенную метку.
В другом предпочтительном варианте осуществления в многофункциональном иммуноконъюгате молекула, нацеленная на маркер поверхности иммунной клетки, представляет собой антитело или лиганд, который связывается с маркером поверхности иммунной клетки; предпочтительно маркеры поверхности иммунной клетки включают, но не ограничиваются следующими: CD3, CD16, CD28.
В другом предпочтительном варианте осуществления в многофункциональном иммуноконъюгате молекула, которая нацелена на маркер поверхности иммунной клетки, представляет собой антитело, которое связывается с маркером поверхности Т-клеток, которое может образовывать с любым из вышеописанных антител способное связываться с Т-клеткой бифункциональное антитело (привлекающий T-клетки биспецифический активатор, BiTE).
В другом предпочтительном варианте осуществления в многофункциональном иммуноконъюгате антитело, которое связывается с маркером поверхности иммунной клетки, представляет собой антитело против CD3. В другом предпочтительном варианте осуществления антитело против CD3 представляет собой одноцепочечное антитело (scFV), моноклональное антитело, Fab-фрагмент, Fd-фрагмент, Fv-фрагмент, F(ab')2-фрагмент и их производное; предпочтительно одноцепочечное антитело. В другом предпочтительном варианте осуществления антитело против CD3 является гуманизированным, полностью человеческим, химерным или мышиным.
В другом предпочтительном варианте осуществления многофункциональный иммуноконъюгат представляет собой слитый полипептид и дополнительно содержит линкерный пептид (линкер) между любым из вышеописанных антител, и связанной с ним функциональной молекулой.
В другом предпочтительном варианте осуществления линкерный пептид имеет последовательность (GlyGlyGlyGlySer)n, где n представляет собой целое число от 1 до 5; более предпочтительно n равно 3.
В другом предпочтительном варианте осуществления многофункциональный иммуноконъюгат вводят в виде полипептида или способом введения гена.
В другом аспекте изобретения обеспечена нуклеиновая кислота, кодирующая многофункциональный иммуноконъюгат.
В другом аспекте изобретения обеспечено применение любого из вышеописанных многофункциональных иммуноконъюгатов для получения противоопухолевого средства или средства для диагностики опухолей, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR; или для получения иммунных клеток, модифицированных химерным антигенным рецептором. Предпочтительно иммунные клетки включают Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
В другом аспекте настоящего изобретения обеспечен химерный антигенный рецептор, включающий любое из вышеописанных антител, и химерный антигенный рецептор экспрессируется на поверхности иммунной клетки и содержит последовательно связанные любое из вышеописанных антител, трансмембранную область и внутриклеточную сигнальную область; при этом внутриклеточная сигнальная область выбрана из группы, состоящей из последовательностей внутриклеточных сигнальных областей CD3ζ, FcεRIγ, CD27, CD28, CD137 и CD134 или их комбинации.
В предпочтительном варианте осуществления трансмембранная область содержит трансмембранную область CD8 или CD28.
В другом предпочтительном варианте осуществления иммунные клетки включают Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
В другом предпочтительном варианте осуществления химерный антигенный рецептор содержит следующие последовательно связанные антитело, трансмембранную область и внутриклеточную сигнальную область:
любое из вышеописанных антител, CD8 и CD3ζ;
любое из вышеописанных антител, CD8, CD137 и CD3ζ;
любое из вышеописанных антител, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28 и CD3ζ; или
любое из вышеописанных антител, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28, CD137 и CD3ζ.
В другом предпочтительном варианте осуществления антитело представляет собой одноцепочечное антитело или однодоменное антитело.
В другом предпочтительном варианте осуществления химерный антигенный рецептор содержит:
SEQ ID NO: 36 или аминокислотную последовательность, представленную в положениях с 285 по 601; или
SEQ ID NO: 37 или аминокислотную последовательность, представленную в положениях с 285 по 702; или
SEQ ID NO: 38 или аминокислотную последовательность, представленную в положениях с 285 по 744; или
SEQ ID NO: 39 или аминокислотную последовательность, представленную в положениях с 285 по 749; или
SEQ ID NO: 40 или аминокислотную последовательность, представленную в положениях с 285 по 791.
В другом аспекте изобретения обеспечена нуклеиновая кислота, кодирующая любой из вышеописанных химерных антигенных рецепторов. В другом предпочтительном варианте осуществления нуклеиновая кислота, кодирующая химерный антигенный рецептор, содержит:
SEQ ID NO: 31 или нуклеотидную последовательность, представленную в положениях с 966 по 1916; или
SEQ ID NO: 32 или нуклеотидную последовательность, представленную в положениях с 966 по 2219; или
SEQ ID NO: 33 или нуклеотидную последовательность, представленную в положениях с 966 по 2345; или
SEQ ID NO: 34 или нуклеотидную последовательность, представленную в положениях с 966 по 2360; или
SEQ ID NO: 35 или нуклеотидную последовательность, представленную в положениях с 966 по 2486.
В другом аспекте настоящего изобретения обеспечен вектор экспрессии, содержащий вышеописанную нуклеиновую кислоту.
В другом предпочтительном варианте осуществления вектор экспрессии получают из лентивирусной плазмиды pWPT (или pWPT-eGFP).
В другом аспекте настоящего изобретения обеспечен вирус, содержащий вышеописанный вектор.
Обеспечено применение любого из описанных выше химерных антигенных рецепторов или кодирующей его нуклеиновой кислоты, или вектора экспрессии или вируса, содержащего нуклеиновую кислоту, для получения генетически модифицированных иммунных клеток, которые нацелены на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR.
В другом аспекте настоящего изобретения обеспечена генетически модифицированная иммунная клетка, которая трансдуцирована нуклеиновой кислотой или вектором экспрессии, или вирусом; или экспрессирует химерный антигенный рецептор на ее поверхности.
В предпочтительном варианте осуществления иммунная клетка дополнительно содержит экзогенную кодирующую последовательность для цитокина; предпочтительно цитокин включает: IL-12, IL-15 или IL-21.
В другом предпочтительном варианте иммунная клетка дополнительно экспрессирует другой химерный антигенный рецептор, который не содержит CD3ζ, но содержит внутриклеточный сигнальный домен CD28, внутриклеточный сигнальный домен CD137 или их комбинацию.
В другом предпочтительном варианте иммунная клетка дополнительно экспрессирует хемокиновый рецептор; предпочтительно хемокиновый рецептор включает CCR2.
В другом предпочтительном варианте иммунная клетка дополнительно экспрессирует миРНК, которая может снижать экспрессию PD-1, или белок, который может блокировать PD-L1.
В другом предпочтительном варианте осуществления иммунная клетка дополнительно экспрессирует предохранитель; предпочтительно, предохранитель включает индуцируемую каспазу-9, процессированный EGFR или RQR8.
В другом аспекте изобретения обеспечено применение указанных генетически модифицированных иммунных клеток для получения лекарственного средства, ингибирующего опухоль, и указанная опухоль представляет собой опухоль, которая экспрессирует EGFRvIII или сверхэкспрессирует EGFR.
В другом аспекте изобретения обеспечена фармацевтическая композиция (включая лекарственное средство или средство для диагностики опухолей), включающая:
любое из вышеописанных антител или нуклеиновую кислоту, кодирующую антитело; или
любой из вышеописанных иммуноконъюгатов или нуклеиновую кислоту, кодирующую конъюгат; или
любой из вышеописанных химерных антигенных рецепторов или нуклеиновую кислоту, кодирующую химерный антигенный рецептор; или
любую из вышеописанных генетически модифицированных иммунных клеток.
Другие аспекты изобретения будут очевидны для специалиста в данной области техники в контексте представленного раскрытия.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Антитела 7B3 и Y022 могут специфически связываться с антигенами EGFRvIII и N1N2-806 (анализ в фаговом формате ELISA).
Фиг. 2. Кривая связывания антитела 7B3 с антигеном EGFRvIII.
Фиг. 3. Кривая связывания антитела Y022 с антигеном EGFRvIII.
Фиг. 4. Электрофорограмма очистки трех слитых антител scFv-Fc.
Фиг. 5. Обнаружение одноцепочечных антител scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc по их способности связываться с EGFR поверхности клеток способом сортировки клеток с возбуждением флуоресценции (FACS).
Фиг. 6. Структурная схема вектора экспрессии pH-Y022/CD3.
Фиг. 7. Обнаружение одноцепочечных бифункциональных антител Y022/CD3, 806/CD3 и C225/CD3 с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ).
Фиг. 8. Обнаружение одноцепочечного бифункционального антитела Y022/CD3 по его антигенсвязывающей специфичности способом FACS.
Фиг. 9. Графики цитотоксичности одноцепочечных бифункциональных антител.
Фиг. 10. Схематическая иллюстрация последовательности лигирования различных частей химерного антигенного рецептора.
Способы осуществления изобретения
После интенсивных исследований и проверок, авторами настоящего изобретения было получено антитело, которое специфически распознает EGFRvIII или сверхэкспрессируемый EGFR в опухолевых клетках и практически не распознает EGFR в нормальных клетках. Антитело по настоящему изобретению можно применять для получения различных противоопухолевых лекарственных средств и лекарственных средств для диагностики опухолей.
Антитело против EGFR
Авторами настоящего изобретения дополнительно проведены скрининговые и аминокислотные мутации на основе гуманизированных антител, полученных на предыдущей стадии, и обнаружено антитело против EGFR, способное к нацеливанию на EGFR опухолевых клеток с более высокой специфичностью, которое избирательно связывается со сверхэкспрессирующимися опухолью EGFR или EGFRvIII, и в то же время не связывается с EGFR на нормальных клетках.
Антитела по изобретению могут быть интактными молекулами иммуноглобулина или антигенсвязывающими фрагментами, включая, но не ограничиваясь следующими: Fab-фрагменты, Fd-фрагменты, Fv-фрагменты, F(ab')2 фрагменты, фрагменты области, определяющей комплементарность (CDR), одноцепочечное антитело (scFv), однодоменное антитело, двухвалентное одноцепочечное антитело, одноцепочечное фаговое антитело, биспецифическое диатело, антитело с тремя цепями, антитело с четырьмя цепями.
Антигенсвязывающие свойства антитела могут быть описаны тремя специфическими областями, расположенными в вариабельных областях тяжелой и легкой цепей, называемыми областями, определяющими комплементарность (CDR), которые разделяют вариабельные области на четыре каркасные области (FR), а аминокислотные последовательности четырех FR являются относительно консервативными, и непосредственно не вовлечены в реакции связывания. Эти CDR образуют петлевую структуру, в которой β-складки, образованные FR, расположены близко друг к другу в пространстве, а антигенсвязывающий сайт антитела состоит из CDR на тяжелой цепи и CDR на соответствующей легкой цепи. Можно определить, какие аминокислоты составляют области FR или CDR, сравнивая аминокислотные последовательности того же типа антител. Области CDR представляют собой последовательности иммунологически интересных белков, а CDR области антител по изобретению являются совершенно новыми. Антитело может содержать два, три, четыре, пять или все шесть областей CDR, описанных в данном документе.
Другой аспект изобретения включает функциональные варианты антител, описанных в данном документе. Если вариант способен конкурировать с исходным антителом за специфическое связывание с SEQ ID NO: 1, и его способность распознавать EGFRvIII или сверхэкспрессируемый EGFR в опухолевых клетках близка к таковой для специфических антител, представленных в примерах настоящего изобретения. Функциональные варианты могут иметь модификации консервативных последовательностей, включая нуклеотидные и аминокислотные замены, добавления и делеции. Эти модификации могут быть введены стандартными способами, известными в данной области техники, такими как направленный мутагенез и случайный ПЦР-опосредованный мутагенез, и могут включать как природные, так и неприродные нуклеотиды и аминокислоты. Предпочтительно модификация последовательности происходит вне области CDR антитела.
Иммуноконъюгат
В настоящем изобретении также обеспечен многофункциональный иммуноконъюгат, содержащий антитела, описанные в настоящем документе, и дополнительно содержащий по меньшей мере одну функциональную молекулу другого типа. Функциональная молекула выбрана из, но не ограничивается следующими: молекулы, которая нацелена на маркер поверхности опухоли, молекулы, подавляющей опухоль, молекулы, которая нацелена на маркер поверхности иммунной клетки или детектируемой метки. Антитело и функциональная молекула могут образовывать конъюгат путем ковалентного связывания, спаривания, связывания, сшивания и т.п.
В качестве предпочтительного способа иммуноконъюгат может содержать антитело по изобретению и по меньшей мере одну молекулу, которая нацелена на маркер поверхности опухоли, или молекулу, подавляющую опухоль. Молекула, подавляющая опухоль, может представлять собой противоопухолевые цитокины или противоопухолевые токсины. Предпочтительно цитокины включают, но не ограничиваются следующими: IL-12, IL-15, IFN-бета, TNF-альфа. Молекулы, которые нацелены на маркеры поверхности опухоли, например, могут действовать синергетически с антителами по изобретению для того, чтобы более точно нацеливаться на опухолевые клетки.
В качестве предпочтительного способа иммуноконъюгат может содержать антитело по настоящему изобретению и детектируемую метку. Такие детектируемые метки включают, но не ограничиваются следующими: флуоресцентные метки, хромогенные метки, такие как ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, радиоактивные материалы, позитрон-излучающие металлы и нерадиоактивный парамагнитный ион металла. Также можно включить более одного маркера. Метка, применяемая для маркировки антитела с целью обнаружения и/или анализа и/или диагностики, зависит от применяемого конкретного способа обнаружения/анализа/диагностики техники и/или способа, например, иммуногистохимического окрашивания образцов (ткани), проточной цитометрии и т.п. Специалистам в данной области техники хорошо известны подходящие метки для способов обнаружения/анализа/диагностики и/или способов, известных в данной области техники.
В качестве предпочтительного способа иммуноконъюгат может содержать антитело по изобретению, а также молекулу, которая нацелена на маркер поверхности иммунной клетки. Молекула, которая нацелена на маркеры поверхности иммунных клеток, может распознавать иммунные клетки и переносить антитела по изобретению к иммунным клеткам, так что антитела по изобретению могут нацеливать иммунные клетки на опухолевые клетки и тем самым запускать иммуноциты для специфического уничтожения опухоли.
В качестве средства химического получения иммуноконъюгата путем конъюгации, прямо или косвенно (например, линкером), иммуноконъюгат может быть получен в виде слитого белка, содержащего антитело по изобретению и другие подходящие белки. Слитый белок может быть получен способом, известным в данной области техники, например, получен рекомбинантно путем конструирования и последующей экспрессии молекулы нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую антитело в рамке с нуклеотидной последовательностью, кодирующей подходящую метку.
В другом аспекте изобретения обеспечена молекула нуклеиновой кислоты, кодирующая по меньшей мере одно антитело по изобретению, функциональный вариант или его иммуноконъюгат. После получения соответствующей последовательности, способ рекомбинации может быть применен для получения соответствующей последовательности в больших количествах. Обычно это делается путем клонирования ее в вектор, трансфекции его в клетку и последующего выделения соответствующей последовательности из пролиферирующих клеток-хозяев обычными способами.
Настоящее изобретение также относится к векторам, содержащим соответствующие последовательности ДНК, описанные выше, а также подходящие промоторы или контрольные последовательности. Эти векторы могут быть применены для трансформации соответствующей клетки-хозяина, для обеспечения экспрессии белка. Клетка-хозяин может представлять собой прокариотическую клетку, такую как бактериальная клетка; или низшую эукариотическую клетку, такую как дрожжевая клетка; или высшую эукариотическую клетку, такую как клетка млекопитающего.
Химерный антигенный рецептор
и генетически модифицированная иммунная клетка
В настоящем изобретении обеспечен химерный антигенный рецептор, экспрессируемый на поверхности иммунной эффекторной клетки (иммунной клетки), где химерный антигенный рецептор содержит последовательно связанные внеклеточную область связывания, трансмембранную область и внутриклеточную сигнальную область, при этом внеклеточная область связывания содержит антитело по изобретению. Путем экспрессии химерного антигенного рецептора на поверхности иммунных эффекторных клеток, иммунные эффекторные клетки могут оказывать высокоспецифическое цитотоксическое действие на опухолевые клетки, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR.
Используемый здесь термин "иммунные клетки" и "иммунные эффекторные клетки" используются взаимозаменяемо и включают: Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит и т.п.
В качестве предпочтительного варианта осуществления настоящего изобретения антитело, содержащееся в химерном антигенном рецепторе, представляет собой одноцепочечное антитело, которое связано с CD8 или трансмембранной областью CD28 через шарнирную область CD8, и за трансмембранной областью сразу же следует внутриклеточная сигнальная область.
Изобретение также включает нуклеиновые кислоты, кодирующие химерные антигенные рецепторы. Настоящее изобретение также относится к вариантам вышеописанных полинуклеотидов, которые кодируют полипептид или фрагмент, аналог и производное полипептида, имеющего ту же аминокислотную последовательность, что и по настоящему изобретению.
Трансмембранная область химерного антигенного рецептора может быть выбрана из трансмембранной области белка, такого как CD8 или CD28. Белок CD8 человека представляет собой гетеродимер, состоящий из двух цепей, αβ или γδ. В одном варианте осуществления изобретения трансмембранная область выбрана из трансмембранной области CD8α или CD28. Кроме того, шарнирная область CD8α является гибкой областью, так что CD8 или CD28 и трансмембранная область, а также шарнирная область используются для связывания целевого домена распознавания scFv химерного антигенного рецептора (CAR) с внутриклеточной сигнальной областью.
Внутриклеточная сигнальная область может быть выбрана из группы, состоящей из внутриклеточной сигнальной области белка CD3ζ, FcεRIγ, CD28, CD137, CD134 и их комбинаций. Молекула CD3 состоит из пяти субъединиц, в которых субъединица CD3ζ (также известная как CD3 zeta, сокращенно Z) содержит 3 мотива ITAM, которые являются важными областями сигнальной трансдукции в комплексе TCR-CD3. CD3δZ представляет собой укороченную последовательность CD3ζ без мотива ITAM и, в общем, сконструирована в настоящем изобретении в качестве отрицательного контроля. FcsRIγ в основном распределен на поверхности тучных клеток и базофилов, содержит мотив ITAM, похож на CD3ζ по структуре, распределению и функции. Кроме того, как упоминалось выше, CD28, CD137 и CD134 являются ко-стимулирующими сигнальными молекулами. Ко-стимулирующий эффект их внутриклеточных сигнальных сегментов при связывании с соответствующими лигандами приводит к продолжительной пролиферации иммунных эффекторных клеток, прежде всего Т-лимфоцитов, и увеличению уровня цитокинов, таких как IL-2 и IFN-γ, секретируемых иммунными эффекторными клетками, а также увеличению периода выживания и противоопухолевого действия химерного антигенного рецептора иммунных эффекторных клеток in vivo.
Химерный антигенный рецептор по настоящему изобретению может быть последовательно соединен следующим образом:
антитело по изобретению, CD8 и CD3ζ;
антитело по изобретению, CD8, CD137 и CD3ζ;
антитело по изобретению, трансмембранная область молекулы CD28, внутриклеточная сигнальная область молекулы CD28 и CD3ζ; или
антитело по изобретению, трансмембранная область молекулы CD28, внутриклеточная сигнальная область молекулы CD28, CD137 и CD3ζ.
И их комбинации, где CD28a в соответствующем белке химерного антигенного рецептора представляет собой трансмембранную область молекулы CD28, а CD28b представляет собой внутриклеточную сигнальную область молекулы CD28. Различные описанные выше химерные антигенные рецепторы в совокупности называются scFv (EGFR)-CAR.
Настоящее изобретение также обеспечивает вектор, содержащий вышеописанную нуклеиновую кислоту, кодирующую белок химерного антигенного рецептора, экспрессируемого на поверхности иммунной эффекторной клетки. В конкретном варианте осуществления вектор, применяемый в настоящем изобретении, представляет собой лентивирусный плазмидный вектор pWPT-eGFP. Эта плазмида относится к третьему поколению самоинактивирующейся лентивирусной векторной системы. Система имеет три плазмиды, упаковочная плазмида psPAX2, кодирующая белок Gag/Pol, кодирующая белок Rev; плазмида оболочки PMD2.G, кодирующая белок VSV-G (гликопротеин вируса везикулярного стоматита); и пустой вектор pWPT-eGFP, который может быть применен для рекомбинантного введения, представляющей интерес последовательности нуклеиновой кислоты, то есть нуклеиновой кислоты, кодирующей химерный антигенный рецептор. В пустом векторе pWPT-eGFP экспрессия усиленного зеленого флуоресцентного белка (eGFP) регулируется промотором фактора элонгации-1α (EF-1α). В то время как в рекомбинантном векторе экспрессии pWPT-eGFP-F2A-CAR, содержащем последовательность нуклеиновой кислоты, кодирующей CAR, совместная экспрессия eGFP и CAR достигается с помощью последовательности 2A (сокращенно F2A) вируса ящура (FMDV), вызывающей пропуск рибосомы.
Изобретение также включает вирусы, содержащие векторы, описанные выше. Вирусы по изобретению включают упакованные инфекционные вирусы, а также вирусы, подлежащие упаковке, которые содержат необходимые компоненты для упаковки в инфекционные вирусы. Другие вирусы, известные в данной области техники, которые могут быть применены для трансдукции экзогенных генов в иммунные эффекторные клетки и их соответствующие плазмидные векторы, также применимы в настоящем изобретении.
Настоящее изобретение дополнительно включает генетически модифицированный Т-лимфоцит, который трансдуцируют нуклеиновой кислотой по настоящему изобретению или трансдуцируют вышеописанной рекомбинантной плазмидой, содержащей нуклеиновую кислоту по настоящему изобретению, или вирусной системой, содержащей плазмиду. В настоящем изобретении могут быть применены обычные в данной области техники способы трансдукции нуклеиновой кислоты, включая способы невирусной и вирусной трансдукции. Способы невирусной трансдукции включают способы электропорации и транспозона. В последнее время, с помощью нуклеофектора, аппарата для ядерной трансфекции, разработанного Amaxa, можно непосредственно вводить чужеродные гены в ядро для достижения высокоэффективной трансдукции генов-мишеней. Кроме того, по сравнению с обычной электропорацией, была значительно улучшена эффективность трансдукции системы транспозонов на основе системы Sleeping Beauty или транспозона PiggyBac. Сообщалось о комбинации нуклеофектора для трансфекции и системы транспозона SB Sleeping Beauty (Davies JK., et al. Combining CD19 redirection and alloanergization to generate tumor-specific human T cells for allogeneic cell therapy of B-cell malignancies. Cancer Res, 2010, 70(10): OF1-10.), и благодаря этому способу может быть достигнута высокая эффективность трансдукции и сайт-направленной интеграции генов-мишеней. В одном варианте осуществления изобретения способ трансдукции Т-лимфоцитов, модифицированных геном химерного антигенного рецептора, представляет собой способ трансдукции на основе вируса, такого как ретровирус или лентивирус. Способ имеет преимущества высокой эффективности трансдукции и стабильной экспрессии экзогенного гена, при этом время культивирования in vitro Т-лимфоцитов до клинического уровня может быть сокращено. Трансдуцированная нуклеиновая кислота экспрессируется, проходя этапы транскрипции и трансляции, на поверхности трансгенных Т-лимфоцитов. Анализ цитотоксичности in vitro, проведенный на различных культивируемых опухолевых клетках, показал, что иммунные эффекторные клетки по настоящему изобретению обладают высокоспецифическими эффектами уничтожения опухолевых клеток (также известными как цитотоксичность). Таким образом, нуклеиновая кислота, кодирующая белок химерного антигенного рецептора по настоящему изобретению, плазмида, содержащая нуклеиновую кислоту, вирус, содержащий плазмиду, и трансгенные иммунные эффекторные клетки, трансфицированные нуклеиновой кислотой, плазмидой или вирусом, описанными выше, могут эффективно применяться в иммунотерапии опухоли.
Иммунные клетки по настоящему изобретению также могут нести экзогенные кодирующие последовательности для цитокинов, включая, но не ограничиваясь следующими: IL-12, IL-15 или IL-21. Эти цитокины обладают иммуномодулирующей или противоопухолевой активностью, усиливают функцию эффекторных Т-клеток и активированных естественных клеток-киллеров, или непосредственно оказывают противоопухолевое действие. Таким образом, специалистам в данной области техники будет понятно, что применение этих цитокинов поможет иммунным клеткам функционировать лучше.
В дополнение к химерному антигенному рецептору, описанному выше, иммунные клетки по настоящему изобретению могут также экспрессировать другой химерный антигенный рецептор, который не содержит CD3ζ, но содержит внутриклеточный сигнальный домен CD28 и внутриклеточный сигнальный домен CD137 или их комбинацию.
Иммунные клетки по настоящему изобретению могут также экспрессировать хемокиновые рецепторы; хемокиновые рецепторы включают, но не ограничиваются следующим: CCR2. Опытному специалисту будет понятно, что хемокиновый рецептор CCR2 может конкурентно связывать CCR2 в организме и применим для блокирования метастазирования опухоли.
Иммунные клетки по настоящему изобретению могут также экспрессировать миРНК, которая может уменьшить экспрессию PD-1 или блокирующий PD-L1 белок. Опытному специалисту будет понятно, что конкурентная блокировка взаимодействий между PD-L1 и его рецептором PD-1 будет способствовать восстановлению противоопухолевых Т-клеточных ответов, тем самым ингибируя рост опухоли.
Иммунные клетки по настоящему изобретению могут также экспрессировать предохранитель; предпочтительно, предохранитель включает индуцируемую каспазу-9, процессированный EGFR или RQR8.
Фармацевтическая композиция
Антитела, иммуноконъюгаты, содержащие антитела, и генетически модифицированные иммунные клетки по настоящему изобретению могут быть применены для получения фармацевтической композиции или средства для диагностики опухолей. В дополнение к эффективному количеству антитела, иммунологического конъюгата или иммунной клетки, композиция может дополнительно содержать фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый" означает, что, когда молекулярные субстанции и композиции правильно вводят животным или людям, они не вызывают неблагоприятных, аллергических или других нежелательных реакций.
Конкретными примерами некоторых веществ, которые могут быть применены в качестве фармацевтически приемлемых носителей или их компонентов, являются сахара, такие как лактоза, декстроза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и метилцеллюлоза; трагант; солод; желатин; тальк; твердые смазывающие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как Tween®; смачивающие агенты, такие как лаурилсульфат натрия; красители; ароматизаторы; таблетки, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотонические солевые растворы; и фосфатные буферы и т.п.
Композиция по настоящему изобретению может быть получена в различных лекарственных формах по мере необходимости, и дозировка, которую нужно вводить пациенту, может быть определена врачом в соответствии с факторами, такими как тип, возраст, масса тела и общее медицинское состояние пациента, способ введения и тому подобное. Например, можно применять инъекцию или другое лечение.
Далее настоящее изобретение описано конкретными вариантами осуществления. Следует понимать, что эти примеры предназначены только для иллюстрации настоящего изобретения и не предназначены для ограничения объема настоящего изобретения. В нижеследующих примерах, экспериментальные процедуры, там, где не указаны конкретные условия, обычно выполняются в соответствии с условиями, описанными в обычных условиях, такими как составленные J. Sambrook et al., Molecular Cloning Experiments Guide, Third Edition, Science Press, 2002, или согласно предлагаемым изготовителем условиям.
Пример 1. Конструирование библиотеки одноцепочечного антитела 7B3 с созревшей аффинностью
Одноцепочечное антитело 7B3 представляет собой гуманизированный фрагмент антитела, который специфически распознает криптический эпитоп (287CGADSYEMEEDGVRKC302 (SEQ ID NO: 1)), образованный из аминокислотной последовательности положений 287-302 EGFR, представленного в опухолевых клетках. Нуклеотидные последовательности генов VL и VH были получены из последовательностей SEQ ID NO: 14 и SEQ ID NO: 13, как показано в патентной заявке 201210094008.x, и связаны в порядке VL7B3-линкер-VH7B3.
Нуклеотидная последовательность (717 пар оснований, SEQ ID NO: 2) одноцепочечного антитела 7B3:
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACAGCAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCGTTCAGTACGCCCAGTTCCCATATACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCAGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела 7B3 (239 аминокислот, SEQ ID NO: 3, подчеркнутая область представляла собой 7B3 VL CDR1, CDR2, CDR3, 7B3 VH CDR1, CDR2, CDR3, соответственно):
DIQMTQSPSSLSASVGDRVTITCHASQDINSNIGWLQQKPGKAFKGLIYHGKNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQYAQFPYTFGQGTKVEIKRGGGGSGGGGSGGGGSDVQLVESGGGLVQPGGSLRLSCAVSGYSITSDYAWNWIRQAPGKGLEWLGYISYRGRTSYNPSLKSRISITRDNSKNTFFLQLNSLRAEDTAVYYCARLGRGFRYWGQGTLVTVSS
Для повышения способности одноцепочечного антитела 7B3 связываться с EGFR, некоторые аминокислоты в CDR3 легкой цепи и CDR3 тяжелой цепи были случайным образом мутированы и были сконструированы соответствующие библиотеки с созревшей аффиностью.
1. Конструирование библиотеки 7B3 с созревшей аффинностью легкой цепи CDR3
После выравнивания последовательностей и анализа одноцепочечного антитела 7B3 была выбрана часть аминокислот в третьей области CDR легкой цепи 7B3, и случайные мутации были введены праймерами для создания библиотеки с созревшей аффинностью легкой цепи.
Для получения фрагмента ДНК, кодирующего библиотеку мутантного 7B3, два ДНК-фрагмента были соответственно получены с помощью ПЦР с применением плазмиды pCantab 5E-7B3 (вставка 7B3 в сайт sfiI/NotI pCantab 5E-7B3) в качестве матрицы с последующим сплайсированием способом обходного ПЦР. В частности, применяли следующую процедуру: для синтеза генов, реакции ПЦР выполняли в объеме по 50 мкл каждая с применением плазмиды pCantab 5E-7B3 в качестве матрицы с конечной концентрацией 0,2 мкМ для каждого праймера и добавляли 5 мкл 10 × KOD Plus буфера, 4 мкл dNTP (dATP, dCTP, dGTP и dTTP, 2 мМ каждый), 2 мкл 25 мМ MgSO4 и 1 ед. KOD Plus (Takara) и процедуру ПЦР запускали в термоциклере после доведения объема водой. Реакцию сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 25 циклов при 94 °С в течение 30 с, 56 °С в течение 30 с и 68 °С в течение 30 с, и, наконец, при 68 °С в течение 10 минут. Первый фрагмент амплифицировали с применением праймеров pC7B3fw (SEQ ID NO: 4, ATAACAGGCCCAGCCGGCCATGGATATTCAGATGACCCAGAG) и LR3re (SEQ ID NO: 5, CACTTTGGTGCCCTGGCCAAATGTMNNTGGGNNMNNMNNMNNCTGMNNGCAATA ATAGGTCGCAAAATC), а второй фрагмент амплифицировали с применением праймеров LR3f2fw (SEQ ID NO: 6, ACATTTGGCCAGGGCACCAAAG) и pC7B3re (SEQ ID NO: 7, ATAAATGCGGCC GCGCTGCTCACGGTCAC).
Предполагаемые продукты ПЦР идентифицировали аналитическим электрофорезом в агарозном геле и очищали от образцов с помощью Wizard SV Gel и набора PCR Clean-Up (доступно от Promega). Оба фрагмента добавляли в эквимолярном отношении во второй цикл мостиковой ПЦР в качестве матрицы, и реакционная система все еще использовала указанную выше систему KOD Plus. Реакционную смесь сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 10 циклов, причем каждый цикл включал следующие условия 94 °С в течение 30 с, 60 °С в течение 30 с, и 68 °С в течение 30 с, и, наконец, 68 °С в течение 10 минут. Затем праймеры pC7B3fw и pC7B3re непосредственно добавляли в реакционную систему при конечной концентрации 0,2 мкМ, и запускали программу ПЦР. Реакцию сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 25 циклов при 94 °С в течение 30 с, 56 °С в течение 30 с, и 68 °С в течение 30 с, и, наконец, при 68 °С в течение 10 минут. Предполагаемые продукты ПЦР разделяли препаративным электрофорезом в агарозном геле и очищали наборами Wizard SV Gel и PCR Clean-up в соответствии с инструкциями производителя.
В библиотеке полные фрагменты ДНК, содержащие сайты распознавания рестриктазы sfiI и Notl на каждом конце, расщепляли с помощью рестрикционной эндонуклеазы sfiI/NotI (приобретено у New England Biolabs) для рестрикционного расщепления и вставляли в фагмидный вектор pCANTAB 5E, расщепляемый теми же двумя ферментами. Продукты лигирования выделяли и обессоливали с применением Wizard SV Gel и набора PCR Clean-Up для электротрансформации. Для электротрансформации применяли компетентный E. coli ER2738 собственного получения (доступный от New England Biolabs) с кюветой для электропорации и прибором для электропорации Gene Pulser II (от Bio-Rad). Наконец, была подтверждена библиотека, содержащая 1,9 × 109 мутантов.
2. Конструирование библиотеки с созревшей аффинностью тяжелой цепи CDR3 7B3
После выравнивания последовательностей и анализа одноцепочечного антитела 7B3 была выбрана часть аминокислот в третьей области CDR тяжелой цепи 7B3, и случайные мутации были введены праймерами для конструирования библиотеки с созревшей аффинностью тяжелой цепи.
Для получения фрагмента ДНК, кодирующего библиотеку мутантного 7B3, два ДНК-фрагмента были соответственно получены с помощью ПЦР с применением плазмиды pCantab 5E-7B3 в качестве матрицы с последующим сплайсированием способом обходного ПЦР. В частности, применяли следующую процедуру: для синтеза генов, реакции ПЦР выполняли в объеме по 50 мкл каждая с применением плазмиды pCantab 5E-7B3 в качестве матрицы с конечной концентрацией 0,2 мкМ для каждого праймера и добавляли 5 мкл 10 × KOD Plus буфера, 4 мкл dNTP (dATP, dCTP, dGTP и dTTP, 2 мМ каждый), 2 мкл 25 мМ MgSO4 и 1 ед. KOD Plus и процедуру ПЦР запускали в термоциклере после доведения объема водой. Реакцию сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 25 циклов при 94 °С в течение 30 с, 56 °С в течение 30 с и 68 °С в течение 30 с, и, наконец, при 68 °С в течение 10 минут. Первый фрагмент амплифицировали с применением праймеров HR3f1fw (SEQ ID NO: 8, TCGCAATTCCTTTAGTTGTTCC) и HR3f1re (SEQ ID NO: 9, CAGGGTGCCCTGGCCCCAGTAANNMNNMNNMNNMNNMNNGCGCGCGCAATAATACAC), а второй фрагмент амплифицировали с применением праймеров HR3f2fw (SEQ ID NO: 10, TACTGGGGCCAGGGCACCCTG) и HR3f2re (SEQ ID NO: 11, GGAATAGGTGTATCACCGTACTCAG).
Предполагаемые продукты ПЦР идентифицировали аналитическим электрофорезом в агарозном геле и очищали от образцов с помощью Wizard SV Gel и набора PCR Clean-Up. Оба фрагмента добавляли в эквимолярном отношении во второй цикл мостиковой ПЦР в качестве матрицы, и реакционная система все еще использовала указанную выше систему KOD Plus. Реакционную смесь сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 10 циклов, причем каждый цикл включал следующие условия 94 °С в течение 30 с, 60 °С в течение 30 с, и 68 °С в течение 30 с, и, наконец, 68 °С в течение 10 минут. Затем праймеры HR3f1fw и HR3f2re непосредственно добавляли в реакционную систему при конечной концентрации 0,2 мкМ, и запускали программу ПЦР. Реакцию сначала нагревали до 94 °С в течение 5 минут, а затем инкубировали в течение 25 циклов при 94 °С в течение 30 с, 56 °С в течение 30 с, 68 °С в течение 30 с, и, наконец, при 68 °С в течение 10 минут. Предполагаемые продукты ПЦР разделяли препаративным электрофорезом в агарозном геле и очищали наборами Wizard SV Gel и PCR Clean-up в соответствии с инструкциями производителя.
В библиотеке полные фрагменты ДНК, содержащие сайты распознавания рестриктазы sfiI и Notl на каждом конце, расщепляли с помощью рестрикционной эндонуклеазы sfiI/NotI для рестрикционного расщепления и вставляли в фагмидный вектор pCANTAB 5E, расщепляемый теми же двумя ферментами. Продукты лигирования выделяли и обессоливали с применением Wizard SV Gel и набора PCR Clean-Up для электротрансформации. Для электротрансформации применяли компетентный E. coli ER2738 собственного получения с кюветой для электропорации и прибором для электропорации Gene Pulser II. Наконец, была подтверждена библиотека, содержащая 6,0 × 109 мутантов.
Пример 2. Скрининг EGFRvIII с применением библиотеки 7B3 с созревшей аффинностью
Для получения мутантов 7B3 с более высокой аффинностью были проведены четыре цикла скрининга с применением библиотек мутантов легкой цепи и тяжелой цепи, соответственно, следующим образом: из вышеуказанной библиотеки получали соответствующую фаговую библиотеку путем заражения вспомогательного фага M13KO7. Фаговую библиотеку инкубировали с биотин-меченым антигеном EGFRvIII (приобретен у Shanghai raygene biotechnology Co., LTD) в течение 2 часов при комнатной температуре, а затем инкубировали с 2 мас./об.% магнитными частицами, блокированными БСА (бычий сывороточный альбумин, приобретен у Shanghai Bioengineering), покрытыми стрептавидином MyOne Cl (от Invitrogen) при комнатной температуре в течение 30 минут. Затем частицы промывали буфером ФСБТ (фосфатно-солевой буфер, содержащий 0,1 % Tween-20) для удаления фага, не связанного специфически или с более слабой связывающей способностью. Фаги с высокой связывающей способностью отделяли от магнитных частиц глицином-HCl (рН 2,2), нейтрализовали нейтрализующим раствором Триса (pH 9,1) и затем применяли для инфицирования E. coli ER2738 в средней логарифмической фазе роста для следующего цикла скрининга.
В вышеописанных четырех циклах скрининга количество магнитных частиц составляло 50 мкл, 25 мкл, 10 мкл и 10 мкл, концентрации биотин-меченого антигена EGFRvIII составляли 10 нМ, 1 нМ, 0,5 нМ и 0,1 нМ, соответственно, и ФСБT применяли для промывки в течение 10, 10, 15 и 20 раз. Из второго цикла скрининга, 50-, 500- и 1000-кратный избыток немеченого антигена EGFRvIII, соответственно, добавляли в качестве конкурента перед элюированием для удаления мутантов с более слабой связывающей способностью.
Для получения фага, представляющего на поверхности мутантов одноцепочечных антител 7B3, штамм в глицерине, полученный в примере 1, инокулировали в 400 мл среды 2YT/ампициллина, чтобы плотность клеток составляла OD600 = 0,1, и при 37 °C и 200 об/мин культивировали при встряхивании до достижения плотности клеток OD600 = 0,5. Для инфицирования применяли 1012 БОЕ вспомогательного фага M13KO7 и инкубировали при 30 °C и 50 об/мин в течение 30 минут. После добавления 50 мг/л канамицина и встряхивания при 37 °C и 200 об/мин в течение 30 минут гранулы отделяли центрифугированием (15 минут, 1600 × г, 4 °C) и ресуспендировали в 400 мл среды 2YT/ампициллин/канамицин и культивировали в течение 16 часов при 37 °С со встряхиванием при 200 об/мин. Наконец, гранулы отделяли центрифугированием (5000 об/мин, 4 °С в течение 20 минут) и отбрасывали. Супернатант фильтровали через фильтр 0,45 мкм и добавляли 1/4 объема 20 мас./об.% ПЭГ 8000, добавляли 2,5 М раствор NaCl и инкубировали на ледяной бане в течение 1 часа для осаждения фаговых гранул. Затем гранулы центрифугировали (20 мин, 8000 × g, 4 °С) и супернатант отбрасывали. Фаг ресуспендировали в 25 мл предварительно очищенного ФСБ (137 мМ NaCl, 2,7 мМ KCl, 8 мМ Na2HPO4, 2 мМ KH2PO4) и центрифугировали (5 минут, 20000 × g, 4 °C). К супернатанту добавляли 1/4 объема 20 мас./об.% ПЭГ 8000, 2,5 М раствор NaCl и инкубировали на ледяной бане в течение 30 минут для повторного осаждения фаговых частиц. Гранулы получали центрифугированием (30 мин при 20000 × g при 4 °С), повторно суспендировали в 2 мл предварительно охлажденный ФСБ, выдерживали на льду в течение 30 мин и центрифугировали (30 мин, 17000 × g, 4 °С). Супернатант смешивали с 4 мас./об.% БСА в ФСБ при соотношении 1:1, помещали в роторный смеситель и инкубировали на 30 минут при комнатной температуре, а затем применяли непосредственно для скрининга.
Пример 3. Идентификация мутантов 7B3, специфически связывающихся с EGFRvIII
После четырех циклов скрининга в отношении антигена EGFRvIII, случайным образом выбрали 96 клонов из клонов, полученных в четвертом цикле скрининга, и проанализировали их на комбинацию с антигенами EGFRvIII и N1N2-806 (приобретено у Shanghai raygene biotechnology Co., LTD) с применением ELISA (ферментный иммуносорбентный анализ) с единичным фагом, где N1N2-806 представляет собой слитый белок домена N1N2 белка M13 фага PIII и аминокислот EGFR в положениях от 287 до 302. Для этой цели каждую отдельную колонию инокулировали в 300 мкл среды 2YT/ампициллин (содержащей 2 % глюкозы) на 96-луночном планшете с глубокими лунками и культивировали при встряхивании при 37 °C и 250 об/мин в течение 16 часов. 20 мкл культуры вносили в 500 мкл среды 2YT/ампициллина (содержащей 0,1 % глюкозы) и встряхивали при 37 °C и 250 об/мин в течение 1,5 часов. Для получения раствора вспомогательного фага брали 75 мкл M13KO7 (титр 3 × 1012 БОЕ/мл) и смешивали с 15 мл среды 2YT и добавляли в планшет по 50 мкл/лунку. Инкубацию проводили при 37 °С и 150 об/мин в течение 30 минут, а затем добавляли 50 мкл/лунку готового раствора канамицина (180 мкл 50 мг/мл канамицина и добавляли в 15 мл среды 2YT) и культивировали при 37 °C и 250 об/мин в течение 16 часов при встряхивании. Наконец, клетки осаждали путем центрифугирования (30 минут при 5000 × g, 4 °C) и супернатант переносили в новый 96-луночный планшет с глубокими лунками.
Для проведения ELISA с единичным фагом в 96-луночный планшет MediSorp ELISA (приобретен у Nunc) размещали 100 нг/лунку антигена EGFRvIII, N1N2-806 и белки отрицательного контроля БСА и N1N2 (приобретены у Shanghai raygene biotechnology Co., LTD) по 50 мкл/лунку и покрывали, оставляя в течение ночи при 4 °С. Каждую лунку блокировали ФСБT, содержащим 2 % БСА (мас./об.). Затем лунки промывали ФСБT три раза. Затем каждый раствор фага, полученный выше, добавляли в каждую лунку планшета по 100 мкл/лунку. После инкубации в течение 2 часов при 37 °С его промывали три раза ФСБT. Для обнаружения связанного фага, конъюгат супероксиддисмутазы и антитела против M13 (приобретен у GE Healthcare) разводили в соотношении 1:5000 в ФСБT и в каждую лунку добавляли по 100 мкл. После инкубации при 37 °С в течение 1 часа, лунки промывали три раза ФСБT и затем три раза промывали ФСБ. Наконец, 50 мкл субстрата TMB добавляли в лунки и проводили визуализацию в течение 10 минут при комнатной температуре с последующим добавлением 50 мкл 2М H2SO4 на лунку для остановки реакции окрашивания. Значения экстинкции измеряли при 450 нм с помощью иммуносорбента с иммобилизованными ферментами (Bio-Rad).
При проведении анализа ELISA, клоны с более сильным сигналом связывания антигена вместо БСА, были отобраны и использованы в последующем анализе оценки и секвенирования. Затем антитела, полученные из библиотеки с созревшей аффинностью легкой цепи, дополнительно объединяли с антителами, полученными из примера 2, в библиотеке с созревшей аффинностью тяжелой цепи в последовательности вариабельной области легкой цепи и последовательности вариабельной области тяжелой цепи, и полученные антитела также способны специфически связываться с антигенами EGFRvIII и N1N2-806 вместо контрольных белков БСА и N1N2.
По кристаллической структуре антитела и антигенной детерминанты в отношении структуры анализировали связывание комбинированных антител, полученных от мутаций легкой и тяжелой цепей 7B3 и EGFR287-302, и, наконец, некоторые аминокислотные положения были выбраны для дальнейшей мутации для достижения более высокой аффинности и стабильности. Все измененные положения аминокислот включают S31 в области CDR1 легкой цепи, V89, A92, Q93, F94 и Y96 в области CDR3 легкой цепи, S182 в области CDR2 тяжелой цепи, L222, R224, G225, F226 и R227 в области CDR3 тяжелой цепи. На основании последовательностей комбинированных антител после мутагенеза легкой и тяжелой цепей, дополнительно вводили сайты мутации для получения антитела Y022. По сравнению с исходным антителом 7B3, Y022 содержит 12 сайтов мутаций аминокислот (S31V, V89N, A92E, Q93N, F94I, Y96L, S182Q, L222M, R224K, G225N, F226W и R227D). Как показано на фиг.1, при анализе ELISA с единичным фагом, Y022 способен специфически связываться с антигенами EGFRvIII и N1N2-806 без связывания с контрольными белками БСА и N1N2.
Нуклеотидная последовательность одноцепочечного антитела Y022 (717 оснований, SEQ ID NO: 12):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATATCCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCAGTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCATGGGTAAGAATTGGGATTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела Y022 (239 аминокислот, SEQ ID NO: 13):
DIQMTQSPSSLSASVGDRVTITCHASQDINVNIGWLQQKPGKAFKGLIYHGKNLEDGVPS
RFSGSGSGTDFTLTISSLQPEDFATYYCNQYENIPLTFGQGTKVEIKRGGGGSGGGGSGG
GGSDVQLVESGGGLVQPGGSLRLSCAVSGYSITSDYAWNWIRQAPGKGLEWLGYISYRGR
TQYNPSLKSRISITRDNSKNTFFLQLNSLRAEDTAVYYCARMGKNWDYWGQGTLVTVSS
При этом легкая цепь находится в положениях с 1 по 108 и последовательность CDR1 легкой цепи: HASQDINVNIG (SEQ ID NO: 41), последовательность CDR2: HGKNLED (SEQ ID NO: 42), последовательность CDR3: NQYENIPLT (SEQ ID NO: 43).
При этом тяжелая цепь находится в положениях с 124 по 239 и последовательность CDR1 тяжелой цепи: GYSITSDYAWN (SEQ ID NO: 44), последовательность CDR2: YISYRGRTQYNPSLKS (SEQ ID NO: 45), последовательность CDR3: MGKNWDY (SEQ ID NO: 46).
Поскольку его подвергали скринингу в библиотеке мутантов, сконструированной ранее и подвергнуто сайт-направленному мутагенезу, нуклеотидная последовательность Y022 содержалась в pCantab 5E, названной плазмидой pCantab 5E-Y022.
Авторы изобретения также получили 10 дополнительных клонов антител со значительно улучшенными аффинностью и стабильностью, а именно M14, M15, M25, M26, S7, S8, S17, S22, S23 и S29, применяя тот же способ, что и для получения антитела Y022. По сравнению с исходным антителом 7B3 все одноцепочечные антитела содержали сайты мутаций аминокислот, как показано в таблице 1.
Таблица 1
Нуклеотидная последовательность одноцепочечного антитела М14 (717 оснований; SEQ ID NO: 58):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACAGCAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCAATTACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCAACTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела М14 (239 аминокислот; SEQ ID NO: 59):

Аминокислотные последовательности легкой цепи CDR1 M14 (HASQDINSNIG), CDR2 (HGKNLED), CDR3 (NQYENNPIT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTNYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 47, 42, 48, 44, 49, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела М15 (717 оснований; SEQ ID NO: 60):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCAATTACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCAGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела М15 (239 аминокислот; SEQ ID NO: 61):

Аминокислотные последовательности легкой цепи CDR1 M15 (HASQDINVNIG), CDR2 (HGKNLED), CDR3 (NQYENNPIT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTSYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 48, 44, 51, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела М25 (717 оснований; SEQ ID NO: 62):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATATCCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела М25 (239 аминокислот; SEQ ID NO: 63):

Аминокислотные последовательности легкой цепи CDR1 M25 (HASQDINVNIG), CDR2 (HGKNLED), CDR3 (NQYENIPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTRYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 43, 44, 52, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела М26 (717 оснований; SEQ ID NO: 64):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATATCCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCAGTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела М26 (239 аминокислот; SEQ ID NO: 65):

Аминокислотные последовательности легкой цепи CDR1 M26 (HASQDINVNIG), CDR2 (HGKNLED), CDR3 (NQYENIPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTQYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 43, 44, 45, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S7 (717 оснований; SEQ ID NO: 66):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCACCAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCAATTACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCAGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S7 (239 аминокислот; SEQ ID NO: 67):

Аминокислотные последовательности легкой цепи CDR1 S7 (HASQDINVNIG), CDR2 (HGTNLED), CDR3 (NQYENNPIT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTSYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 53, 54, 44, 51, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S8 (717 оснований; SEQ ID NO: 68):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAAGCTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCAATTACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCAGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S8 (239 аминокислот; SEQ ID NO: 69):

Аминокислотные последовательности легкой цепи CDR1 S8 (HASQDINVNIG), CDR2 (HGKNLED), CDR3 (NQYENNPIT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTSYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 54, 44, 51, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S17 (717 оснований; SEQ ID NO: 70):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACACCAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCAGTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S17 (239 аминокислот; SEQ ID NO: 71):

Аминокислотные последовательности легкой цепи CDR1 S17 (HASQDINTNIG), CDR2 (HGKNLED), CDR3 (NQYENNPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTQYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 55, 42, 56, 44, 45, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S22 (717 оснований; SEQ ID NO: 72):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCACCAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S22 (239 аминокислот; SEQ ID NO: 73):

Аминокислотные последовательности легкой цепи CDR1 S22 (HASQDINVNIG), CDR2 (HGTNLED), CDR3 (NQYENNPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTRYNPSLKS), CDR3(LGRGFRY) представляют собой SEQ ID NO: 41, 53, 56, 44, 52, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S23 (717 оснований; SEQ ID NO: 74):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAAGCTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATAACCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S23 (239 аминокислот; SEQ ID NO: 75):

Аминокислотные последовательности легкой цепи CDR1 S23 (HASQDINVNIG), CDR2 (HGKNLEDG), CDR3 (NQYENNPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTRYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 56, 44, 52, 50, соответственно.
Нуклеотидная последовательность одноцепочечного антитела S29 (717 оснований; SEQ ID NO: 76):
GATATTCAGATGACCCAGAGCCCGAGCAGCCTGAGCGCGAGCGTGGGCGACCGTGTGACC
ATTACCTGCCATGCGAGCCAGGATATTAACGTGAACATTGGCTGGCTGCAGCAGAAACCG
GGCAAAGCGTTTAAAGGCCTGATTTATCATGGCAAAAACCTGGAAGATGGCGTGCCGAGC
CGTTTTAGCGGCAGCGGCAGCGGCACCGATTTTACCCTGACCATTAGCAGCCTGCAGCCG
GAAGATTTTGCGACCTATTATTGCAATCAGTATGAAAATTTCCCACTGACATTTGGCCAG
GGCACCAAAGTGGAAATTAAACGTGGTGGAGGCGGTTCAGGCGGAGGTGGCTCTGGCGGT
GGCGGATCGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCTGGTGCAGCCGGGCGGCAGC
CTGCGTCTGAGCTGCGCGGTGAGCGGCTATAGCATTACCAGCGATTATGCGTGGAACTGG
ATTCGTCAGGCGCCGGGCAAAGGCCTGGAATGGCTGGGCTATATTAGCTATCGTGGCCGC
ACCCGCTATAACCCGAGCCTGAAAAGCCGTATTAGCATTACCCGTGATAACAGCAAAAAC
ACCTTTTTCCTGCAGCTGAACAGCCTGCGTGCGGAAGATACCGCGGTGTATTATTGCGCG
CGCCTGGGACGCGGCTTCCGCTACTGGGGCCAGGGCACCCTGGTGACCGTGAGCAGC
Аминокислотная последовательность одноцепочечного антитела S29 (239 аминокислот; SEQ ID NO: 77):

Аминокислотные последовательности легкой цепи CDR1 S23 (HASQDINVNIG), CDR2 (HGKNLED), CDR3 (NQYENFPLT) и тяжелой цепи CDR1 (GYSITSDYAWN), CDR2 (YISYRGRTRYNPSLKS), CDR3 (LGRGFRY) представляют собой SEQ ID NO: 41, 42, 57, 44, 52, 50, соответственно.
Пример 4. Экспрессия и очистка антитела
Гены каждого антитела вставляли в сайт NdeI/XhoI вектора экспрессии pET22B(+), белки антител рекомбинантно продуцировали в E. coli BL21 (DE3) и очищали колонкой для никель-хелатной хроматографии с применением полипептидов, содержащих карбокситерминальный слитый 6 × гистидин. В частности, для получения белка антитела каждую отдельную колонию инокулировали в 5 мл среды 2×YT/ампициллин и культивировали при встряхивании при 37 °С и 220 об/мин в течение 16 часов. 1 мл этой предварительной культуры применяли для инокуляции 100 мл среды 2×YT/ампициллина и культивировали при встряхивании при 37 °C и 220 об/мин до достижения плотности клеток OD600 равной 0,5. После индукции экспрессии чужеродного гена 1 мМ α-D-изопропилтиогалактозидом (IPTG), культуру встряхивали в течение 6 часов при 30 °С и 220 об/мин. Затем клетки осаждали центрифугированием (15 минут при 3500 × г, 4 °C) и ресуспендировали в 35 мл разрушающего буфера (50 мМ PB, 300 мМ NaCl, 2 М мочевины, 0,5 % Triton X-100, pH 8,0). После обработки ультразвуком, образец встряхивали при комнатной температуре в течение 30 минут, чтобы полностью лизировать клеточный дебрис. Затем осадок с включениями собирали путем центрифугирования (15 минут, 10000 × g, 4 °C) и добавляли 20 мл денатурирующего буфера (50 мМ PB, 300 мМ NaCl, 8 М мочевина, 10 мМ имидазола, рН 8,0) и встряхивали в течение 1 часа при комнатной температуре. Осадок удаляли центрифугированием (15 мин, 10000 × g, 4 °С), лизат собирали и белок очищали 5 мл HisTrap HP колонкой очистки (коммерчески доступной от GE Healthcare). Чистоту очищенного белка антитела анализировали электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия, а концентрацию белка определяли количественным биуретовым анализом содержания белков (BCA).
Пример 5. Анализ активности связывания антитела
Активность связывания антитела к антигену EGFRvIII определяли с помощью анализа ELISA с градиентом концентрации. С этой целью антиген EGFRvIII разбавляли 0,1 М раствором для нанесения жидкой фазы NaHCO3 (pH 9,6) и каждую лунку покрывали 200 нг по 50 мкл/лунку в течение ночи при 4 °С и блокировали с помощью ФСБТ, содержащим 2 мас./об.% БСА в течение 2 часов при комнатной температуре. Затем планшет трижды промывали ФСБТ. Затем в каждую лунку добавляли 100 мкл каждого раствора белка антитела в ФСБТ, содержащего ряд концентраций (начальная концентрация 50 нг/лунку, 18 нМ, разбавленная до 1:81), и каждый образец анализировали параллельно в трех лунках. После инкубации в течение 2 часов при 37 °С, планшет трижды промывали ФСБТ с последующим добавлением 100 мкл/лунку мышиного антитела анти-His-tag (доступно от Santa Cruz) с разведением 1:2000 в течение 1 часа при 37 °С. Для тестирования связанного антитела, козьи антимышиные антитела, меченые HRP (приобретено у Santa Cruz), разводили в ФСБТ в разведении 1:15000 и добавляли 100 мкл на лунку и инкубировали при 37 °C в течение 1 часа. Для обнаружения лунки трижды промывали ФСБТ и затем трижды промывали ФСБ и, наконец, добавляли TMB для визуализации в течение 15 минут. Реакцию окрашивания останавливали 50 мкл 2М H2SO4 на лунку и значения экстинкции измеряли при 450 нм с помощью иммуноферментного анализа (Bio-Rad). Полученные значения оптической плотности оценивали с применением программного обеспечения Sigma Plot и рассчитывали силу связывания антитела. С этой целью значение экстинкции, измеренное в каждом случае, было нанесено в зависимости от соответствующей концентрации антитела, и полученная кривая была построена с применением следующей нелинейной регрессии.
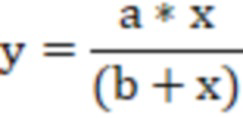
Где равновесие связывания/диссоциации, идентифицированное между иммобилизованным антигеном и белком антитела, представляет собой:
x представляет собой концентрацию белка антитела;
y представляет собой концентрацию комплекса антиген/антитело (косвенно измеряется оптической плотностью после цветной реакции);
a представляет собой общую концентрацию иммобилизованного антигена;
b представляет собой константу диссоциации (KD).
Кривая связывания, полученная для антитела 7B3 в анализе ELISA с градиентом концентрации, показана на Фиг. 2, где KD составляет приблизительно 22,4 нМ; кривая связывания антитела Y022 с EGFRvIII показана на Фиг. 3, где видимая KD составляет приблизительно 2,7 нМ.
Пример 6. Анализ на активность связывания Y022 с EGFR клеточной поверхности
1. Экспрессия и очистка scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc слитого антитела
Согласно стандартной схеме, фрагмент scFv-Y022 амплифицировали из полученных клонов с применением пары праймеров V5-Y022-F (SEQ ID NO: 14, ACAGTGCTAGCAGATATTCAGATGACCCAG) и V5-Y022-R (SEQ ID NO: 15, AAGAATGCGGCCGCGCTGCTCACGGTCACCAG); scFv-806 амплифицировали с применением пары праймеров V5-806-F (SEQ ID NO: 16, ACAGTGCTAGCAGACATCCTGATGACCCAAT) и V5-806-R (SEQ ID NO: 17, AAGAATGCGGCCGCTGCAGAGACAGTGACCAG) и pH-806/CD3 (см. 201210094008.X) в качестве матрицы; фрагмент scFv-C225 клонировали с применением пары праймеров V5-C225-F (SEQ ID NO: 18, ACAGTGCTAGCAGACATCTTGCTGACTCAG) и V5-C225-R (SEQ ID NO: 19, AAGAATGCGGCCGCTGCAGAGACAGTGACCAG) и фрагмента ДНК C225 (VL-линкер-VH) (его последовательность определена в соответствии с SEQ ID NO: 10 и SEQ ID NO: 12 в US 20090099339A1 и получена в Shanghai raygene biootechnology Co., LTD, путем синтеза цельного генома) в качестве матрицы; и амплифицированный продукт расщепляли NheI/NotI (приобретено у NEB), соединяли с векторной плазмидой pCMV-V5-Fc, расщепленной NheI/NotI (в векторе Fc-фрагмент человеческого IgG1 гибридизировали с сайтом множественного клонирования, сокращенно V5-Fc, приобретено у Shanghai raygene biotechnology Co., LTD), с помощью ДНК-лигазы T4 (приобретено у NEB) и трансформировали в штамм-хозяин TOP10. Клоны отбирали и положительные клоны идентифицировали с помощью ПЦР и подтверждали секвенированием, с получением V5-scFv-Y022-Fc, V5-scFv-806-Fc и V5-scFv-C225-Fc эукариотических экспрессионных плазмид, соответственно.
Вышеуказанные экспрессионные плазмиды соответственно трансфицировали в хорошо растущие клетки HEK-293F, культивировали при 37 °С, 5 % СО2, встряхивании при 125 об/мин в течение 7 дней и центрифугировали при 4000 об/мин в течение 10 мин. Осадок удаляли, супернатант собирали и фильтровали с помощью 0,45 мкм мембраны. Образец аффинно очищали с помощью колонки с иммобилизованным белком А (от GE), для получения окончательно очищенных слитых с Fc-антителом белков scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc. Результаты показаны на Фиг. 4.
2. Определение связывающей способности одноцепочечных scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc с EGFR клеточной поверхности способом FACS
Связывающие способности каждого из одноцепочечных антител scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc к следующим линиям клеток анализировали способом сортировки клеток с возбуждением флуоресценции (FACS) (BD, FACS Calibur).
Конкретные способы заключаются в следующем:
1. Клетки опухоли в логарифмической фазе роста, как указано в таблице 2, инокулировали в чашке размером 6 см с плотностью посева приблизительно 90 % и инкубировали при 37 °С в инкубаторе в течение ночи.
2. Клетки расщепляли 10 мМ ЭДТА и клетки собирали центрифугированием при 200 г в течение 5 мин. Клетки ресуспендировали в 1 % фосфатно-солевом буфере (NBS ФСБ), содержащем телячью сыворотку в концентрации от 1 × 106 до 1 × 107 /мл, и добавляли в проточную пробирку в количестве 100 мкл/пробирку.
3. Клетки центрифугировали при 200 г × 5 мин и супернатант отбрасывали.
4. Соответственно добавляли антитела scFv-Y022-Fc, scFv-806-Fc и scFv-C225-Fc, подлежащие тестированию. ФСБ применяли в качестве отрицательного контроля. Конечная концентрация антитела составляла 20 мкг/мл, к каждой пробирке добавляли 100 мкл и помещали на ледяную баню на 45 минут.
5. В каждую пробирку добавляли 2 мл 1 % NBS ФСБ и центрифугировали при 200 г × 5 мин дважды.
6. Супернатант отбрасывали и добавляли меченые флуоресцином FITC козьи античеловеческие антитела (от компании Shanghai Kangcheng Bio-engineering Company) в разведении 1:50, и 100 мл добавляли к каждой пробирке и помещали на ледяную баню на 45 минут.
7. В каждую пробирку добавляли 2 мл 1 % NBS ФСБ и центрифугировали при 200 г × 5 мин дважды.
8. Супернатант отбрасывали, ресуспендировали в 300 мкл 1 % NBS ФСБ и детектировали с помощью проточной цитометрии.
9. Данные анализировали с применением программного обеспечения для анализа данных проточной цитометрии WinMDI 2.9.
Таблица 2
Результаты показаны на Фиг. 5, одноцепочечное антитело Y022 по настоящему изобретению может в разной степени связываться с U87-EGFR, экзогенно сверхэкспрессирующей EGFR (способ конструирования можно найти в Wang H., et al., Identification of an Exon 4-Deletion Variant of Epidermal Growth Factor Receptor with Increased Metastasis-Promoting Capacity. Neoplasia, 2011, 13, 461-471) и U87-EGFRvIII, сверхэкспрессирующей EGFRvIII (способ конструирования можно найти в WO/2011/035465), A431, CAL27, MDA-MB-468, эндогенно сверхэкспрессирующей EGFR и особенно сильно связывается с клетками U87-EGFRvIII и A431, но его связывающая способность не такая высокая, как у одноцепочечного антитела 806. Связывающая способность одноцепочечного антитела C225 к этим клеткам очень сильна. Эти одноцепочечные антитела имеют низкую связывающую способность с клетками U87.
Кроме того, одноцепочечные антитела как Y022, так и 806 почти не связывались с клетками линии клеток глиомы U87. В частности, одноцепочечное антитело Y022 также не связывается с нормальными эпителиальными клетками предстательной железы RWPE-1 и первичными кератиноцитами человека K2, тогда как одноцепочечное антитело 806 связывается с обеими этими нормальными клетками в разной степени.
Эти результаты показывают, что одноцепочечное антитело Y022 специфически связывается с опухолевыми клетками, сверхэкспрессирующими EGFR, а также EGFRvIII, и имеют низкую связывающую способность с клетками с нормальной экспрессией EGFR.
Пример 7. Конструирование вектора экспрессии, содержащего нуклеотидную последовательность, кодирующую одноцепочечные бифункциональные антитела Y022/CD3
ПЦР-амплификацию проводили с применением плазмиды pCantab 5E-Y022, полученной в примере 3, в качестве матрицы и пары праймеров, прямого праймера pH7B3f2_fw (SEQ ID NO: 20, GATATTCAGATGACCCAGAGCCCGAGCAG) и обратного праймера pH7B3f2_re (SEQ ID NO: 21, AATAGGATCCACCACCTCCGCTGCTCACGGTCAC) для получения фрагмента ДНК scFv Y022. Другой фрагмент ДНК, содержащий сигнальную пептидную последовательность рН-вектора, получали ПЦР с применением плазмиды pH-7B3/CD3 (см. 201210094008.X Пример 3 и Фиг. 2) в качестве матрицы, и прямого праймера pH7B3f1_fw (SEQ ID NO: 22, CCATTGACGCAAATGGGCGGTAGG) и обратного праймера pH7B3f1_re (SEQ ID NO: 23, CTGCTCGGGCTCTGGGTCATCTGAATATC). Оба фрагмента смешивали в эквимолярном отношении для сплайсинга фрагментов и ПЦР. Условия сплайсинга: денатурация: 94 °С в течение 4 мин; денатурация: 94 °С в течение 40 с; отжиг: 60 °С в течение 40 с; элонгация: 68 °С в течение 140 с, в течение 5 циклов, а затем общая элонгация при 68 °С, 10 мин. Затем добавляли ДНК-полимеразу и прямой праймер pH7B3f1_fw и обратный праймер pH7B3f2_re, выполняли 30 циклов амплификации, и условия амплификации: 94 °C, 4 мин; денатурация: 94 °С, 40 с; отжиг: 60 °C, 40 с; 68 °С в течение 140 с, в течение 30 циклов, а затем общая элонгация при 68 °С в течение 10 мин.
Амплифицированную последовательность расщепляли рестрикционной эндонуклеазой NheI/BamHI и дважды расщепляли в соответствии с условиями реакции, рекомендованными поставщиком ферментов (New England Biolabs, NEB). Вектор экспрессии pH (см. 201210094008.X Пример 3 и Фиг. 2) также аналогичным образом расщепляли рестрикционным ферментом NheI/BamHI. Дважды расщепленный фрагмент scFv Y022 и фрагмент вектора рН затем лигировали с помощью ДНК-лигазы T4 в соответствии с условиями реакции, рекомендованными поставщиком ферментов (NEB). Нуклеотидную последовательность, кодирующую полученный таким образом полипептид одноцепочечного антитела Y022, клонировали в вектор и транскрибировали вместе с нуклеотидной последовательностью, уже содержащейся в векторе, кодирующей полипептид одноцепочечного антитела CD3, в мРНК, которую, в конечном счете, транслировали в полипептид одноцепочечного бифункционального антитела Y022/CD3. Новая плазмида была названа pH-Y022/CD3, а подробная структура представлена на Фиг. 6.
Пример 8. Экспрессия и очистка одноцепочечных бифункциональных антител Y022/CD3, pH-806/CD3 и pH-C225/CD3
Векторы экспрессии pH-Y022/CD3, pH-806/CD3 и pH-C225/CD3 (см. 201210094008.X) трансфицировали в клетки яичника китайского хомячка (CHO) в соответствии с процедурой трансфекционного реагента FreeStyle MAX Reagent (от Invitrogen). Затем стабильные клоны подвергали скринингу в соответствии с набором экспрессии белка OptiCHO™ (от Invitrogen). Стабильные клоны клеток СНО, трансфицированные каждым из вышеуказанных векторов экспрессии, культивировали во встряхиваемых колбах при 37 °С в течение 7 дней при 130 об/мин, с применением среды CD OptiCHO (от Gibco). Супернатант культуры получали центрифугированием и затем хранили при -20 °С.
Очистку белка проводили с применением колонки для аффинной хроматографии с гистидином (колонка His Trap HP, доступная у GE Healthcare) в соответствии со стадиями способа изготовителя. В частности, колонку уравновешивали буфером А (20 мМ фосфата натрия, рН 7,4, 0,4 М NaCl), а затем к колонке (1 мл) добавляли супернатант клеточной культуры (500 мл супернатанта) со скоростью потока 3 мл/мин после диализа против ФСБ. Затем колонку промывали 5 объемами буфера А и 10 объемами буфера А, содержащего 50 мМ имидазола, для удаления примесей белка. Связанный белок, представляющий интерес, элюировали тем же буфером А, дополненным 250 мМ имидазола. Все этапы очистки проводили при 4 °С.
Очищенные одноцепочечные бифункциональные антитела детектировали ДСН-ПААГ в восстанавливающих условиях. Как показано на Фиг. 7, молекулярные массы этих молекул антител составляли около 60 кДа, что соответствовало молекулярной массе одноцепочечного бифункционального антитела, вычисленного из аминокислотных последовательностей.
Пример 9. Анализ антигенсвязывающей специфичности одноцепочечного бифункционального антитела, такого как Y022/CD3
Связывающие способности одноцепочечных бифункциональных антител Y022/CD3 к EGFR анализировали способом сортировки клеток с возбуждением флуоресценции (FACS) (BD, FACS Calibur).
Конкретные способы заключаются в следующем:
1. Клетки опухоли в фазе логарифмического роста, перечисленные в таблице 2, инокулировали в чашке размером 6 см с плотностью посева приблизительно 90 % и инкубировали при 37 °С в течение ночи.
2. Клетки расщепляли 10 мМ ЭДТА и клетки собирали центрифугированием при 200 г в течение 5 мин. Клетки ресуспендировали в 1 % фосфатно-солевом буфере (NBS ФСБ), содержащем телячью сыворотку в концентрации от 1 × 106 до 1 × 107 / мл, и добавляли в проточную пробирку в количестве 100 мкл/пробирку.
3. Клетки центрифугировали при 200 г × 5 мин и супернатант отбрасывали.
4. Добавляли антитело Y022/CD3, подлежащее тестированию. И нерелевантное антитело NGR/CD3 применяли в качестве отрицательного контроля. Конечная концентрация антитела составляла 5 мкг/мл, 100 мкл добавляли в каждую пробирку и помещали на ледяную баню на 45 минут.
5. В каждую пробирку добавляли 2 мл 1 % NBS ФСБ и центрифугировали при 200 г × 5 мин дважды.
6. Супернатант отбрасывали и добавляли мышиные антитела анти-His-tag (от Shanghai Genomics Technology Co., Ltd.) в разведении 1:50 и добавляли 100 мл к каждой пробирке и помещали на ледяную баню на 45 минут.
7. В каждую пробирку добавляли 2 мл 1 % NBS ФСБ и центрифугировали при 200 г × 5 мин дважды.
8. Супернатант отбрасывали и добавляли меченые флуоресцином FITC козьи антимышиные антитела (от Shanghai Kangcheng Bio-engineering Company) в разведении 1:50 и добавляли 100 мл к каждой пробирке и помещали на ледяную баню на 45 минут.
9. В каждую пробирку добавляли 2 мл 1 % NBS ФСБ и центрифугировали при 200 г × 5 мин дважды.
10. Супернатант отбрасывали, ресуспендировали в 300 мкл 1 % NBS ФСБ и детектировали способом проточной цитометрии.
11. Данные анализировали с применением программного обеспечения для анализа данных проточной цитометрии WinMDI 2.9.
Результаты показаны на Фиг. 8, бифункциональное антитело Y022/CD3 по настоящему изобретению может связываться с клетками U87-EGFR, U87-EGFRvIII и A431, при этом незначительно связывается с клетками U87 и кератиновыми эпителиальными клетками человека. Эти результаты показывают, что Y022/CD3 может специфически связываться с опухолевыми клетками, экспрессирующими мутантный EGFR человека и сверхэкспрессирующими EGFR, но не связывается с тканями, имеющими нормальную экспрессию EGFR.
Кроме того, Y022/CD3 также может связываться с мононуклеарными клетками периферической крови человека (МКПК) или клетками Юркат (Т-клетки лейкемии периферической крови человека, CD3-положительные), как показано на фигуре, что указывает на то, что бифункциональное антитело по настоящему изобретению может специфически связываться с CD3-антигеном на поверхности Т-клеток.
Экспрессионные плазмиды конструировали в соответствии со способами, указанными в примерах 7 и 8 соответственно (Y022 в примерах 7 и 8 были заменены другими мутантными формами антител) и M14/CD3, M15/CD3, M25/CD3, M26/CD3, S7/CD3, S8/CD3, S17/CD3, S22/CD3, S23/CD3, S29/CD3 были экспрессированы и очищены. В соответствии со способом данного примера были соответственно определены связывающие способности этих антител к клеткам U87-EGFRvIII, сверхэкспрессирующим EGFRvIII, и к клеткам CAL27, эндогенно сверхэкспрессирующим EGFR. Вышеуказанные антитела способны связывать оба типа этих клеток, а значения их средней интенсивности флуоресценции (MFI) показаны в табл. 13.
Таблица 13
Пример 10. Анализ биологической активности одноцепочечного бифункционального антитела, такого как Y022/CD3 - цитотоксичность для различных опухолевых клеток
Мононуклеарные клетки периферической крови (МКПК) выделяли из крови здоровых людей по стандартным методикам с применением центрифугирования в градиенте плотности Ficoll (от Biochrom). После центрифугирования клетки промывали фосфатно-солевым буфером (ФСБ) в концентрации 0,1 М и затем ресуспендировали в полной среде RPMI 1640 (Gibco) и концентрацию клеток доводили до 5 × 105/мл. МКПК служили эффекторными клетками в экспериментах по цитотоксичности. В качестве клеток-мишеней действовали различные опухолевые клетки. Концентрацию клеток-мишеней доводили до 5 × 104/мл полной средой RPMI 1640. Тот же объем клеток-мишеней и эффекторных клеток смешивали таким образом, что соотношение эффекторная клетка:клетка-мишень (Э:М) составляло 10:1.
Смешанную клеточную суспензию разносили в 96-луночный планшет в объеме 75 мкл/лунку. Затем в каждую лунку добавляли 25 мкл следующего реагента, последовательно разведенного в десять раз от 1000 нг/мл до 0,1 нг/мл:
(1) Одноцепочечное бифункциональное антитело Y022/CD3 (BiTe);
(2) Полная среда RPMI 1640 (фон);
(3) Одноцепочечное бифункциональное антитело NGR/CD3 (отрицательный контроль, NGR представляет собой неоваскулярный направленно действующий пептид, который не имеет сайта перекрестного связывания с EGFR и получен в соответствии с обычным способом).
После инкубации в течение 40 часов в инкубаторе при температуре 37 °C, 5 % CO2, цитотоксичность антитела тестировали с применением набора для анализа нерадиоактивной цитотоксичности CytoTox 96® (от Promega) в соответствии с инструкциями производителя.
Анализ нерадиоактивной цитотоксичности CytoTox 96® представляет собой колориметрический анализ, который может заменить тест на высвобождение 51Cr. С помощью анализа CytoTox 96® определяли количественный выход лактатдегидрогеназы (ЛДГ). ЛДГ является стабильным цитозольным ферментом, который высвобождается при лизисе клеток и высвобождается так же, как выделяется радиоактивный 51Cr. Супернатант с высвобожденной средой ЛДГ может быть обнаружен 30-минутной связанной ферментативной реакцией, в которой ЛДГ превращает соль тетразолия (INT) в красный формазан. Количество полученного красного продукта пропорционально количеству лизированных клеток.
Пять связанных с EGFR типов опухолевых клеток, перечисленных в таблице 3 ниже, применяли для анализа способности T-клеток к уничтожению опухоли, опосредованной бифункциональным антителом Y022/CD3 по настоящему изобретению, и одноцепочечным бифункциональным антителом NGR/CD3, которое не связано с EGFR в качестве контроля, соответственно.
Скорость уничтожения опухолевых клеток (то есть, % цитотоксичности) рассчитывали на основе следующей формулы, приведенной в руководстве по анализу нерадиоактивной цитотоксичности CytoTox 96® G1780:
% цитотоксичности = [(эксперимент - эффекторная клетка после спонтанного выхода - клетка-мишень после спонтанного выхода) / (клетка-мишень после максимального выхода - клетка-мишень после спонтанного выхода)] × 100
где:
"эксперимент" относится к выходу ЛДГ, полученному в экспериментальных лунках, в которые были добавлены клетки-мишени/антитело/эффектор,
"эффекторная клетка после спонтанного выхода " относится к выходу ЛДГ, полученному эффекторными клетками спонтанно,
"клетка-мишень после спонтанного выхода" относится к выходу ЛДГ, полученному клетками, которые не подвергали обработке другими факторами,
"клетка-мишень после максимального выхода" относится к выходу ЛДГ в результате полного лизиса клеток-мишеней после обработки 0,8 % Triton X-100,
"клетка-мишень после максимального выхода - клетка-мишень после спонтанного выхода" относится к выходу ЛДГ в результате полного лизиса клеток после внешней обработки.
Таблица 3
% цитотоксичности Y022/CD3
% цитотоксичности NGR/CD3
Результаты, представленные в табл. 3 показывают, что все опухолевые клетки, экспрессирующие мутантный EGFR и/или сверхэкспрессирующие EGFR, такие как U87-EGFRvIII, U87-EGFR и A431, будут специфически уничтожены Т-клетками, направленными бифункциональным антителом Y022/CD3.
В частности, в вышеуказанной группе опухолевых клеток, обработанной Y022/CD3, минимальная специфическая цитотоксичность составляла 32,1 %, а максимальная 66,2 %. Хотя цитотоксичность Y022/CD3 для клеток, экспрессирующих низкие уровни EGFR, U87 и первичных кератиноцитов человека, была очень низкой 3,4 % и 4,5 % соответственно, что было значительно ниже, чем цитотоксичность для вышеуказанных мутантных клеток, экспрессирующих EGFR и/или сверхэкспрессирующих EGFR.
Более конкретно, % цитотоксичности Y022/CD3 и контрольного антитела NGR/CD3 в различных концентрациях к каждой опухоли, показан в таблицах 4-8 ниже.
Таблица 4
Таблица 5
Таблица 6
Таблица 7
Таблица 8
Кроме того, анализ токсичности in vitro проводили тем же способом на следующих экспрессированных и очищенных BiTe: M14/CD3, M15/CD3, M25/CD3, M26/CD3, S7/CD3, S8/CD3, S17/CD3, S22/S29/CD3, и результаты показаны на Фиг. 9.
Как можно видеть на Фиг. 9, опухолевые клетки, экспрессирующие мутированный EGFR и/или сверхэкспрессирующие EGFR, такие как U87-EGFRvIII, U87-EGFR и CAL27, могут быть уничтожены Т-клетками, направленными бифункциональными специфическими антителами M14/CD3, M15/CD3, M25/M26/CD3, S7/CD3, S8/CD3, S17/CD3, S22/CD3, S23/CD3, S29/CD3 в разной степени. В то время как для U87, клеток, которые экспрессируют низкие уровни EGFR, эффект уничтожения достаточно низок.
Пример 11. Конструирование лентивирусной плазмиды, экспрессирующей белок химерного антигенного рецептора, кодируемый нуклеиновой кислотой по настоящему изобретению, и упаковка вируса
Конструирование химерного антигенного рецептора и порядок соединения химерного антигенного рецептора, приведенного в качестве примера в настоящем изобретении, показаны в таблице 9 и на Фиг. 10.
Таблица 9
Примечание: CD28a представляет собой трансмембранную область молекулы CD28, а CD28b представляет собой внутриклеточную сигнальную область молекулы CD28.
1. Амплификация фрагментов нуклеиновых кислот
(1) Амплификация последовательностей scFv
scFv Y022 получали с помощью ПЦР с применением плазмиды pCantab 5E-Y022 в качестве матрицы с прямым праймером (SEQ ID NO: 24, содержащим часть последовательности сигнального пептида CD8) и обратным праймером (SEQ ID NO: 25, включающим часть последовательности шарнирной области CD8).
SEQ ID NO: 24 (TGCTCCACGCCGCCAGGCCGGATATTCAGATGACCCAG)
SEQ ID NO: 25 (CGCGGCGCTGGCGTCGTGGTGCTGCTCACGGTCAC)
(2) Последовательности нуклеиновой кислоты других частей химерного антигенного рецептора
Последовательности нуклеиновых кислот других частей белка химерного антигенного рецептора против EGFRvIII, за исключением scFv Y022, соответственно получали с помощью ПЦР с применением последовательностей SEQ ID NO: 26, 27, 28, 29 и 30, раскрытых в патентной заявке № 201310164725.X в качестве матрицы. Конкретно, последовательность eGFP-F2A-CD8sp получали с помощью ПЦР-амплификации с применением плазмиды SEQ ID NO: 27, раскрытой в патентной заявке № 201310164725.X в качестве матрицы и пар праймеров (SEQ ID NO: 26 и 27). CD8-CD3δ zeta (δZ) получали путем ПЦР-амплификации с применением плазмиды SEQ ID NO: 26, раскрытой в патентной заявке CN201310164725.X в качестве матрицы и пар праймеров (SEQ ID NO: 28 и 29). CD8-CD3 zeta (Z), CD8-CD137-CD3 zeta (BBZ), CD28a-CD28b-CD3 (28Z) и CD28a-CD28b-CD137-CD3 zeta (28BBZ) получали с помощью ПЦР-амплификации, соответственно с применением SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, раскрытых в патентной заявке CN201310164725.X в качестве матрицы и пар праймеров (SEQ ID NO: 28, 30).
SEQ ID NO: 26 (TGCAGTAGTCGCCGTGAAC)
SEQ ID NO: 27 (CGGCCTGGCGGCGTGGAGCA)
SEQ ID NO: 28 (ACCACGACGCCAGCGCCGCGACCAC)
SEQ ID NO: 29
(GAGGTCGACCTACGCGGGGGCGTCTGCGCTCCTGCTGAACTTCACTCT)
SEQ ID NO: 30 (GAGGTCGACCTAGCGAGGGGGCAGGGCCTGCATGTGAAG)
2. Сплайсинг фрагментов нуклеиновых кислот
Фрагмент нуклеиновой кислоты eGFP-F2A-CD8sp, полученный, как описано выше, и эквимолярный фрагмент нуклеиновой кислоты scFv Y022 и эквимолярные фрагменты нуклеиновой кислоты CD8-CD3δ zeta (δZ) или CD8-CD3 zeta (Z) или CD8-CD137-CD3 zeta (BBZ) или CD28a-CD28b-CD3 zeta (28Z) или CD28a-CD28b-CD137-CD3 zeta (28BBZ) подвергали сплайсингу трех сегментов и ПЦР, как показано на Фиг. 9, при следующих условиях: предварительная денатурация: 94 °С в течение 4 мин; денатурация: 94 °С в течение 40 с; отжиг: 60 °С в течение 40 с; элонгация: 68 °C в течение 140 с в течение 5 циклов, а затем общая элонгация 68 °C в течение 10 минут. ДНК-полимеразу и прямой праймер (SEQ ID NO: 24) и обратный праймер (обратный праймер, соответствующий zeta CD8-CD3δ, представлял собой SEQ ID NO: 29, а другой представлял собой SEQ ID NO: 30), а затем ПЦР проводили в течение 30 циклов с условиями амплификации: предварительная денатурация: 94 °C в течение 4 мин; денатурация: 94 °С в течение 40 с; отжиг: 60 °С в течение 40 с; элонгация: 68 °C в течение 140 с, в течение 30 циклов, а затем общая элонгация 68 °C в течение 10 минут. Амплифицированным фрагментам дали следующие названия (табл. 2):
eGFP-F2A-Y022 scFv-δZ (SEQ ID NO: 31),
eGFP-F2A-Y022 scFv-Z (SEQ ID NO: 32),
eGFP-F2A-Y022 scFv-BBZ (SEQ ID NO: 33),
eGFP-F2A-Y022 scFv-28Z (SEQ ID NO: 34),
eGFP-F2A-Y022 scFv-28BBZ (SEQ ID NO: 35).
3. Конструирование лентивирусного плазмидного вектора
В качестве примера, векторная система, применяемая для лентивирусных плазмидных векторов, построенная ниже, принадлежит к самоинактивирующей лентивирусной векторной системе третьего поколения, которая имеет три плазмиды, а именно: упаковочная плазмида psPAX2, кодирующая белок Gag/Pol, кодирующая белок Rev (от Addgene); плазмида оболочки PMD2.G, кодирующая белок VSV-G (от Addgene); и рекомбинантный вектор экспрессии, кодирующий ген интереса CAR на основе пустого вектора pWPT-eGFP (от Addgene).
В пустом векторе pWPT-eGFP экспрессия усиленного зеленого флуоресцентного белка (eGFP) регулируется промотором фактора элонгации-1α (EF-1α). После вставки в пустой вектор конструкций, сконструированных так, как описано в этом примере, был сформирован рекомбинантный вектор экспрессии, кодирующий CAR гена-мишени, при этом совместная экспрессия eGFP и гена-мишени CAR достигается с помощью последовательности вируса ящура (FMDV, F2A), вызывающей пропуск рибосомы. F2A представляет собой коровую последовательность 2A (или "саморасщепляющийся полипептид 2A") вируса ящура, обладающую функцией "самосдвигания" 2A, которая обеспечивает совместную экспрессию гена, лежащего выше по цепи, и гена, лежащего ниже по цепи. 2A обеспечивает эффективную и жизнеспособную стратегию для конструирования полицистронных векторов для генной терапии благодаря высокой эффективности сдвига, высокому балансу экспрессии генов, лежащих выше по цепи и лежащих ниже по цепи и короткой последовательности. В частности, в иммунотерапии, основанной на Т-лимфоцитах, модифицированных геном химерного антигенного рецептора, эта последовательность часто используется для достижения совместной экспрессии гена-мишени с GFP или eGFP. Экспрессия CAR может быть косвенно обнаружена путем обнаружения GFP или eGFP.
В этом примере сконструировали лентивирусный вектор экспрессии, совместно экспрессирующий eGFP и специфический CAR, связанный F2A, который в совокупности называется pWPT-eGFP-F2A-CAR. Ген-мишень eGFP-F2A-CAR (см. пункт 2 в примере 7, компонент после F2A сокращенно обозначен как CAR), полученный на вышеуказанной стадии 2, был дважды расщеплен рестрикционными ферментами MluI и SalI и лигирован в дважды расщепленный таким же образом вектор pWPT для того, чтобы сконструировать лентивирусный вектор, экспрессирующий каждый химерный антигенный рецептор. Сконструированный вектор идентифицировали с помощью расщепления MluI и SalI и секвенировали по корректным последовательностям, чтобы он был готов к лентивирусной упаковке. Как упоминалось выше, eGFP-F2A-CAR был транскрибирован в одной мРНК, но в конечном итоге транслировался на двух пептидных цепях химерных антигенных рецепторов eGFP и анти-EGFRvIII, где химерный антигенный рецептор против EGFRvIII будет локализован под контролем сигнального пептида CD8α на клеточной мембране.
Векторы, содержащие требуемые CAR, представляют собой следующие (компоненты, следующие за F2A, могут быть сокращены как CAR):
pWPT-eGFP-F2A-Y022 scFv-δZ;
pWPT-eGFP-F2A-Y022 scFv-Z;
pWPT-eGFP-F2A-Y022 scFv-BBZ;
pWPT-eGFP-F2A-Y022 scFv-28Z;
pWPT-eGFP-F2A-Y022 scFv-28BBZ.
5 полипептидных последовательностей eGFP-F2A-CAR были соответственно получены с помощью вышеописанной конструкции, и носят названия:
eGFP-F2A-Y022 scFv-δZ (SEQ ID NO: 36);
eGFP-F2A-Y022 scFv-Z (SEQ ID NO: 37);
eGFP-F2A-Y022 scFv-BBZ (SEQ ID NO: 38);
eGFP-F2A-Y022 scFv-28Z (SEQ ID NO: 39);
eGFP-F2A-Y022 scFv-28BBZ (SEQ ID NO: 40).
4. Трансфицированные плазмидой клетки 293T для упаковки лентивируса
Клетки HEK-293T (ATCC: CRL-11268), культивированные от пассажа 6 к пассажу 10, высевали с плотностью 6 × 106 в чашках по 10 см и культивировали в течение ночи при 37 °С в 5 % CO2 для трансфекции. В качестве среды использовали минимальную эссенциальную среду Игла, модифицированную по способу Дульбекко (DMEM) (доступную от PAA), содержащую 10 % фетальной бычьей сыворотки (приобретаемой у PAA).
Стадии трансфекции заключаются в следующем:
4.1. Получение жидкости А: растворяли 10 мкг ложного контроля или 10 мкг каждой из требуемых генных плазмид pWPT-eGFP-F2A-CAR с 7,5 мкг упаковочной плазмиды PAX2 и 3 мкг плазмиды оболочки pMD2.G в 800 мкл свободной от сыворотки среды DMEM и хорошо перемешивали.
4.2. Получение жидкости B: растворяли 60 мкг PEI (полиэтиленимин, приобретенный у Polysciences) в 800 мкл свободной от сыворотки среды DMEM, осторожно перемешивали и инкубировали при комнатной температуре в течение 5 мин.
4.3. Формирование комплекса трансфекции: добавляли жидкость А в жидкость В и осторожно перемешивали, интенсивно или осторожно перемешивали сразу после добавления, инкубировали при комнатной температуре в течение 20 мин.
4.4. По каплям добавляли 1,6 мл трансфекционного комплекса в клетки HEK-293T, и через 4-5 ч, меняли среду на DMEM с 2 % фетальной бычьей сывороткой для трансфицированных 293T клеток.
На следующий день после трансфекции наблюдали эффективность трансфекции (т.е. доля зеленых флуоресцентных клеток): приблизительно 80 % положительной эффективности трансфекции представляет собой успешные эксперименты по трансфекции. Через 72 ч трансфекции вирус собирали фильтрованием с использованием фильтра 0,45 мкм (доступного от Millipore Corporation) и центрифугировали при 28000 об/мин с применением ультрацентрифуги Beckman Optima L-100XP в течение 2 часов при 4 °C. Супернатант отбрасывали и полученный осадок центрифугировали от 1/10 до 1/50 стокового раствора AIM-V (приобретаемого у Invitrogen) и ресуспендировали по 100 мкл/пробирку при -80 °C для титрования вируса или инфицирования Т-лимфоцитов.
5. Определение лентивирусных титров, упакованных ложной плазмидой или eGFP-F2A-CAR
В первый день клетки 293T инокулировали по 1 × 105 мл в 96-луночные планшеты для культивирования, 100 мкл/лунку и культивировали при 37 °С, 5 % СО2, в культуральной среде DMEM, содержащей 10 % фетальной бычьей сыворотки. На следующий день отбирали 50 мкл/лунку культурального супернатанта, добавляли 50 мкл/лунку свежей среды и добавляли полибрен в конечной концентрации 6 мкг/мл. Культуру инкубировали в течение 30 мин при 37 °С в 5 % СО2. Добавляли 10 мкл/лунку стока вируса или 1 мкл/лунку концентрата вируса (3-кратное разбавление, 6 градиентов, две лунки репликации) и инкубировали при 37 °С в 5 % СО2. Через 48 ч после инфицирования, eGFP детектировали проточной цитометрией, клетки с положительной частотой от 5 до 20 % подходят для расчета титра (ед./мл) = положительная частота × разведения × 100 × 104. Титры вируса, содержащего вышеуказанный пустой вектор в качестве ложного контроля, и каждый eGFP-F2A-CAR, упакованный способом трансфекции PEI, составляли приблизительно от 0,5 до 1 × 107 ед./мл, а обнаруженный титр вируса после концентрации составлял приблизительно от 0,5 до 1 × 108 ед./мл.
Пример 12. Т-клетки, инфицированные рекомбинантным лентивирусом
Мононуклеарные клетки периферической крови человека получали из периферической крови здорового человека путем центрифугирования в градиенте плотности (от Shanghai Blood Center) и добавляли в лимфоцитарную среду AIM-V (приобретаемую у Invitrogen) при плотности приблизительно 2 × 106/мл. Магнитные гранулы, покрытые антителами против CD3 и CD28 (Invitrogen), добавляли в соотношении клеток к магнитным гранулам 1:1 и рекомбинантный IL-2 человека (от Shanghai Huaxin Biotechnology Co., Ltd.) при конечной концентрации 300 ед./мл добавляли для стимуляции и культивирования в течение 48 часов. И затем Т-клетки инфицировали вышеуказанным рекомбинантным лентивирусом (MOI приблизительно равно 15). Инфицированные Т-клетки детектировали проточной цитометрией на 8-й день культивирования по экспрессии различных химерных антигенных рецепторов. Поскольку eGFP совместно экспрессировался с CAR, обнаруженные eGFP-позитивные клетки были положительными клетками, экспрессирующими химерные антигенные рецепторы. При использовании неинфицированных Т-лимфоцитов в качестве отрицательного контроля положительные частоты инфицированных вирусом Т-клеток, экспрессирующих различные химерные антигенные рецепторы, показаны в таблице 10. Результаты положительной частоты показывают, что при использовании лентивирусной инфекции может быть получена определенная положительная частота Т-клеток с CAR.
Таблица 10
Т-клетки инфицировали вирусами с разными химерными антигенными рецепторами, и затем субкультивировали с плотностью клеток 5 × 105/мл через день, подсчитывали и дополняли IL-2 (конечная концентрация 300 ед./мл). На 11-й день культивирования было получено приблизительно от 100 до 1000 циклов амплификации, что указывает на то, что Т-клетки, экспрессирующие различные химерные антигенные рецепторы, могут быть размножены в определенном количестве in vitro, что обеспечивает проведение последующих тестов на токсичность in vitro и проведение экспериментов in vivo.
Пример 13. Противоопухолевая активность CAR-Y022 in vitro
В экспериментах по токсичности in vitro применяли следующие материалы:
Клетками-мишенями являлись U87, U87-EGFR, U87-EGFRvIII, A431, CAL 27, MDA-MB-468, RWPE-1 и первичные кератиноциты человека K2, как показано в таблице 5, соответственно. Эффекторными клетками являлись Т-лимфоциты (Т-клетки с CAR), культивируемые в течение 12 дней in vitro, и несущие химерные антигенные рецепторы, что подтверждено способом FACS.
Эффективные целевые соотношения составляли 3:1, 1:1 и 1:3 соответственно. Количество клеток-мишеней составляло 10000/лунку, и каждая группа имела 5 лунок репликации. Время обнаружения составляло 18 часов.
Каждая экспериментальная группа и каждая контрольная группа представлены в следующем порядке:
Каждая экспериментальная группа: каждая клетка-мишень + T-лимфоциты с CAR, экспрессирующие различные химерные антигенные рецепторы;
Контрольная группа 1: клетки-мишени с максимальным выходом ЛДГ;
Контрольная группа 2: клетки-мишени со спонтанным выходом ЛДГ;
Контрольная группа 3: эффекторные клетки со спонтанным выходом ЛДГ.
Способ детектирования: применяли CytoTox 96® для анализа нерадиоактивной цитотоксичности (Promega), который представляет собой колориметрический анализ, который может заменить тест на высвобождение 51Cr. С помощью анализа CytoTox 96® определяли количественный выход лактатдегидрогеназы (ЛДГ). ЛДГ является стабильным цитозольным ферментом, который высвобождается при лизисе клеток и высвобождается так же, как выделяется радиоактивный 51Cr. Супернатант с высвобожденной средой ЛДГ может быть обнаружен 30-минутной связанной ферментативной реакцией, в течение которой ЛДГ превращает соль тетразолия (INT) в красный формазан. Количество полученного красного продукта пропорционально количеству лизированных клеток. Подробности можно найти в инструкциях набора для обнаружения нерадиоактивной цитотоксичности CytoTox 96.
Цитотоксичность рассчитывается следующим образом:
% цитотоксичности = [(экспериментальная группа - контрольная группа 2 - контрольная группа 3)/(контрольная группа 1 - контрольная группа 2)] × 100
В частности, как показано в таблице 11 и таблице 12, сравнения 806-CAR T, Y022-28Z CAR T и Y022-28BBZ CAR T, экспрессирующих химерные антигенные рецепторы по настоящему изобретению, при различных соотношениях эффектор-мишень, показали значительный эффект уничтожения на клетки с высокой экспрессией EGFR и EGFRvIII, и градиентную зависимость соотношения эффектор-мишень, то есть чем выше соотношение эффектор-мишень, тем сильнее цитотоксические эффекты. Данные зависимости соотношения эффектор-мишень также демонстрируют специфические цитотоксические эффекты Т-клеток с CAR, экспрессирующих химерные антигенные рецепторы по изобретению, на клетках с высокой экспрессией EGFR и его вариантов.
Следует отметить, что Y022-CAR T практически не оказывает эффекта уничтожения на клетки RWPE-1, которые имеют нормальную экспрессию EGFR, и на первичные кератиноциты человека K2. При соотношении эффектор-мишень 3:1, цитотоксичность T-лимфоцитов с CAR химерным антигенным рецептором Y022-28BBZ к клеткам RWPE-1 и первичным кератиноцитам человека K2 составляла 12 % и 2 %, соответственно. Цитотоксичность T-лимфоцитов с CAR Y022-28Z к клеткам RWPE-1 и первичным кератиноцитам человека K2 составляла 8 % и 3 %. Напротив, 806-CAR T имели различную степень цитотоксичности в обоих типах этих клеток. Цитотоксичность Т-лимфоцитов с CAR 806-28BBZ к клеткам RWPE-1 и первичным кератиноцитам человека K2 составляла 25 % и 22 %, соответственно, а цитотоксичность T-лимфоцитов с CAR 806-28Z к клеткам RWPE-1 и первичным кератиноцитам человека K2 составляла 15 % и 13 %, соответственно.
Кроме того, CAR T, как отрицательный контроль, трансфицированный вирусом, содержащим ложную плазмиду (несущий scFv-Y022-δZ), показал очень низкие цитотоксические эффекты на вышеуказанные клеточные линии.
Вышеприведенные результаты показывают, что химерный антигенный рецептор Y022-CAR T, который сконструирован из одноцепочечного антитела против EGFR и его вариантов, может избирательно уничтожать опухолевые клетки, сверхэкспрессирующие EGFR и его вариант (EGFRvIII), и при этом оказывает незначительный цитотоксический эффект на клетки с нормальной экспрессией EGFR. Кроме того, из данных по цитотоксичности, CAR T третьего поколения (Y022-28BBZ) был более цитотоксичным по отношению к клеткам-мишеням, по сравнению со вторым поколением CAR T (Y022-28Z).
Таблица 11
цитотоксичности
Различные соотношения эффектор-мишень
Различные соотношения эффектор-мишень
Различные соотношения эффектор-мишень
Таблица 12
Различные соотношения эффектор-мишень
Различные соотношения эффектор-мишень
Различные соотношения эффектор-мишень
Все ссылки, указанные в настоящей заявке, включены сюда посредством ссылки, как если бы каждая ссылка была включена посредством ссылки. Кроме того, следует понимать, что после прочтения вышеуказанных положений настоящего изобретения специалисты в данной области техники смогут вносить различные модификации или изменения в настоящее изобретение, и такие эквивалентные формы также входят в объем прилагаемой формулы настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| АНТИТЕЛО ПРОТИВ ГЛИПИКАНА-3 И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2744245C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| САЙТЫ АНТИТЕЛ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕ EGFRvIII | 2014 |
|
RU2696892C2 |
| ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К МЕЗОТЕЛИНУ И ИММУННЫЕ ЭФФЕКТОРНЫЕ КЛЕТКИ, НАЦЕЛЕННЫЕ НА МЕЗОТЕЛИН | 2016 |
|
RU2748281C2 |
| АНТИТЕЛЬНЫЕ АГЕНТЫ, СПЕЦИФИЧНЫЕ К CD19 ЧЕЛОВЕКА, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2773317C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ НЕКТИНА-2 ЧЕЛОВЕКА | 2020 |
|
RU2820275C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
| ИНДУЦИРУЮЩЕЕ ПОВРЕЖДЕНИЕ КЛЕТОК ТЕРАПЕВТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ ПРОТИВОРАКОВОЙ ТЕРАПИИ | 2017 |
|
RU2746754C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2812875C1 |


























































































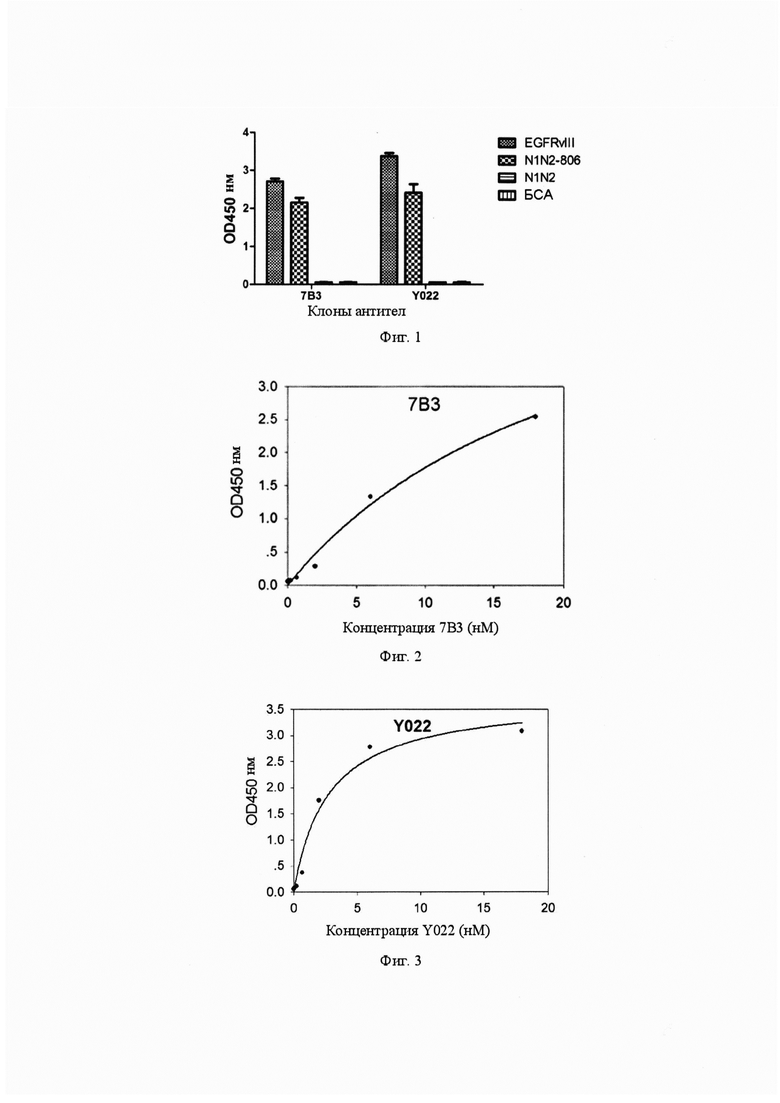

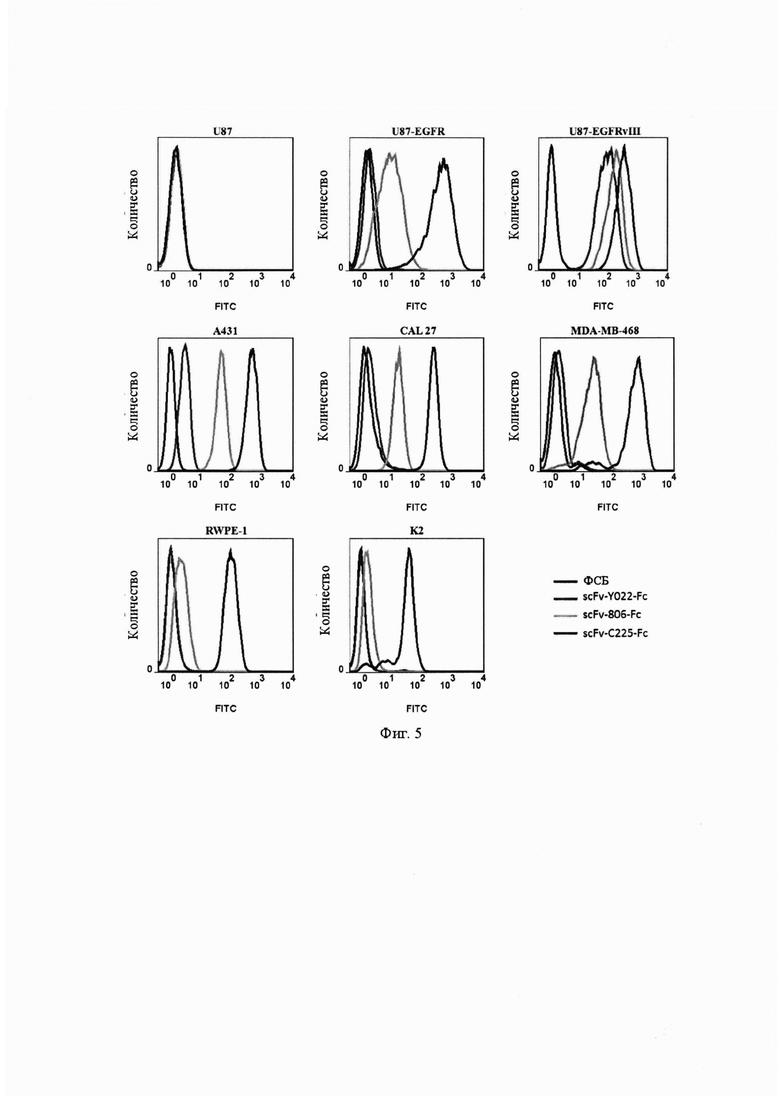
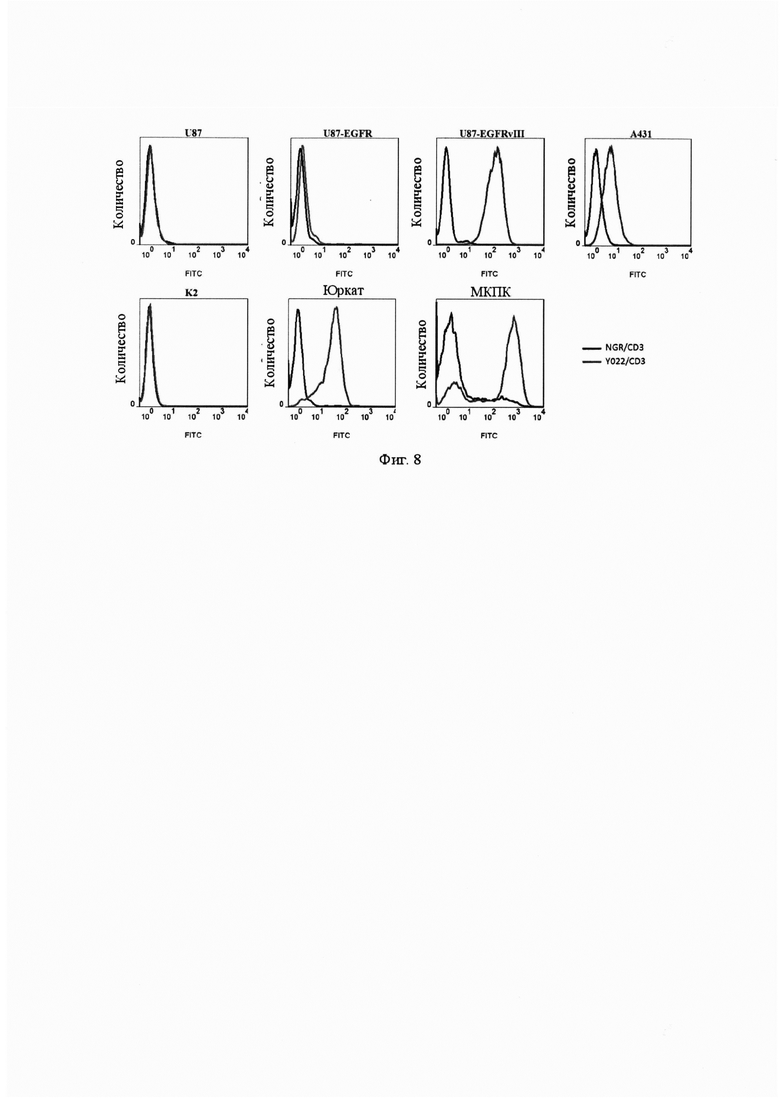
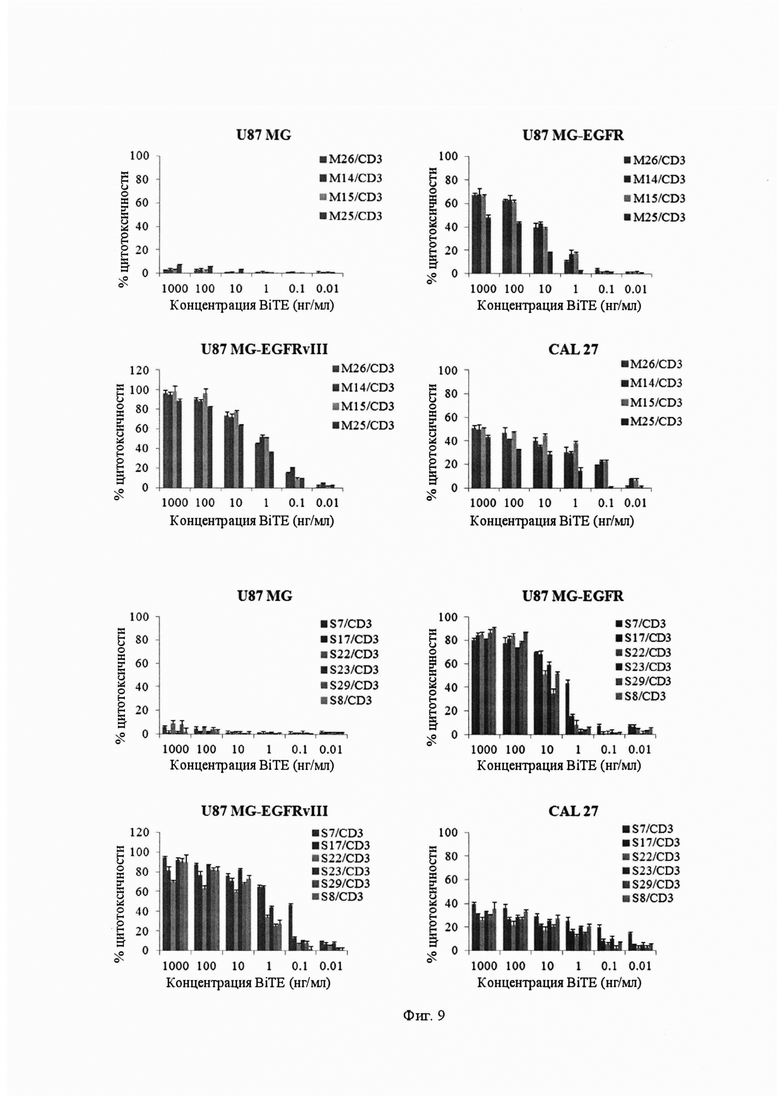
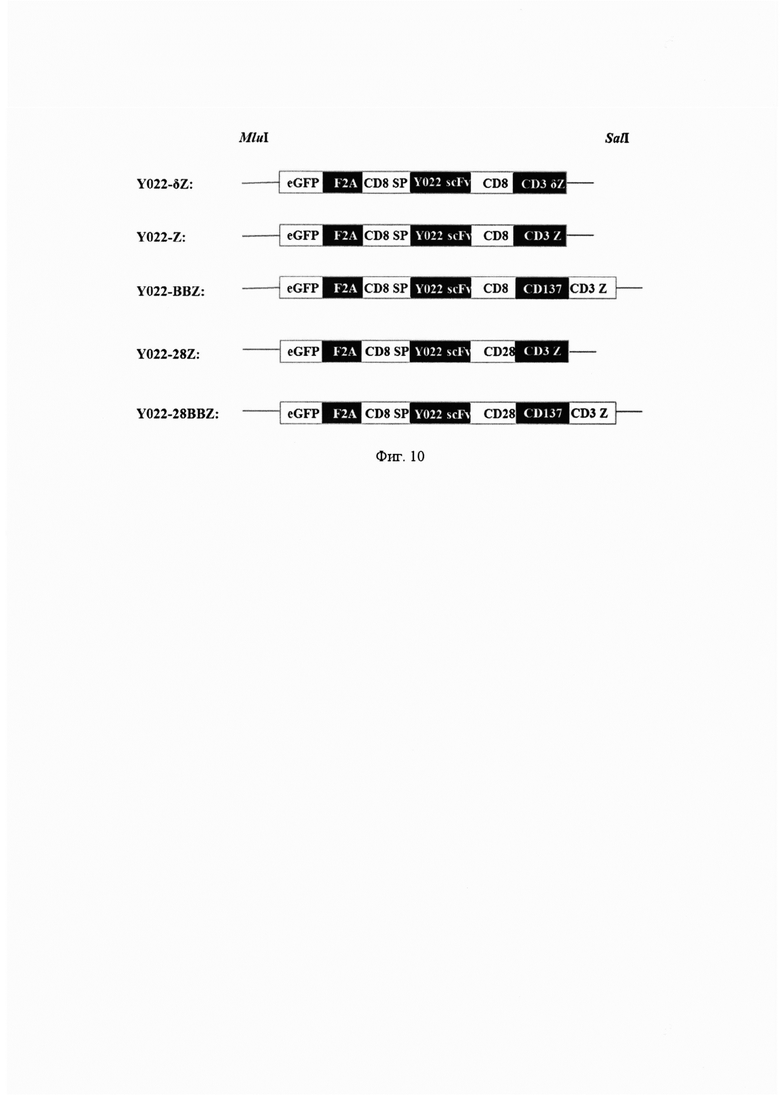
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая антитело, специфически распознающее экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR, нуклеиновую кислоту, кодирующую вышеуказанное антитело, вектор экспрессии, клетку-хозяин, применение антитела для получения направленно действующего лекарственного средства, специфически направленного на опухолевые клетки, применение антитела для получения конъюгата антитела с лекарственным средством, специфически направленного на опухолевые клетки, применение антитела для получения многофункционального антитела, специфически направленного на опухолевые клетки, применение антитела для получения средства для диагностики опухолей, применение антитела для получения иммунной клетки, модифицированной химерным антигенным рецептором, иммуноконъюгат (варианты), применение иммуноконъюгата для получения средства против опухолей, применение иммуноконъюгата для получения средства для диагностики опухолей, применение иммуноконъюгата для получения иммунных клеток, модифицированных химерным антигенным рецептором, химерный антигенный рецептор, нуклеиновую кислоту, кодирующую химерный антигенный рецептор, вектор экспрессии, вирус для получения генетически модифицированной иммунной клетки, применение химерного антигенного рецептора, или нуклеиновой кислоты, или вектора экспрессии, или вируса для получения генетически модифицированных иммунных клеток, генетически модифицированную иммунную клетку, нацеленную на опухолевые клетки (варианты), применение генетически модифицированных иммунных клеток для получения лекарственного средства, ингибирующего опухоль и фармацевтическую композицию для ингибирования опухоли. Изобретение расширяет арсенал средств, специфически распознающих экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR. 25 н. и 20 з.п. ф-лы, 10 ил., 13 табл., 13 пр.
1. Антитело, специфически распознающее экспрессируемый опухолевыми клетками EGFRvIII или сверхэкспрессируемый EGFR, где антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, и
CDR1 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41, SEQ ID NO: 47, SEQ ID NO: 55,
CDR2 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 42, SEQ ID NO: 53,
CDR3 вариабельной области легкой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 43, SEQ ID NO: 48, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 57,
CDR1 вариабельной области тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 44,
CDR2 вариабельной области тяжелой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 45, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 52,
CDR3 вариабельной области тяжелой цепи имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 46, SEQ ID NO: 50.
2. Антитело по п. 1, включающее:
антитело (а), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 46,
антитело (b), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 47, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 48 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 49, CDR3 с последовательностью SEQ ID NO: 50,
антитело (с), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 48 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (d), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (e), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 43 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 50,
антитело (f), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 53, CDR3 с последовательностью SEQ ID NO: 54 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (g), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 54 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 51, CDR3 с последовательностью SEQ ID NO: 50,
антитело (h), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 55, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 56 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 45, CDR3 с последовательностью SEQ ID NO: 50,
антитело (i), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 53, CDR3 с последовательностью SEQ ID NO: 56 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (j), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 56 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50,
антитело (k), вариабельная область легкой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 41, CDR2 с последовательностью SEQ ID NO: 42, CDR3 с последовательностью SEQ ID NO: 57 или вариабельная область тяжелой цепи которого имеет CDR1 с последовательностью SEQ ID NO: 44, CDR2 с последовательностью SEQ ID NO: 52, CDR3 с последовательностью SEQ ID NO: 50, или
антитело (l), которое распознает ту же антигенную детерминанту, которую распознает любое из антител (а) - (k).
3. Антитело по п. 2, где аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 13 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 13,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 59 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 59,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 61 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 61,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 63 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 63,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 65 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 65,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 67 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 67,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 69 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 69,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 71 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 71,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 73 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 73,
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 75 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 75 или
аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 77 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 77.
4. Антитело по п. 2, представляющее собой антитело (а), более предпочтительно аминокислотная последовательность вариабельной области тяжелой цепи антитела представлена в положениях с 124 по 239 последовательности SEQ ID NO: 13 или аминокислотная последовательность вариабельной области легкой цепи антитела представлена в положениях с 1 по 108 последовательности SEQ ID NO: 13.
5. Нуклеиновая кислота, кодирующая антитело по любому из пп. 1-4.
6. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 5.
7. Клетка-хозяин для экспрессии антитела по любому из пп. 1-4, которая содержит вектор экспрессии по п. 6 или в геном которой интегрирована нуклеиновая кислота по п. 5.
8. Применение антитела по любому из пп. 1-4 для получения направленно действующего лекарственного средства, специфически направленного на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR.
9. Применение антитела по любому из пп. 1-4 для получения конъюгата антитела с лекарственным средством, специфически направленного на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR.
10. Применение антитела по любому из пп. 1-4 для получения многофункционального антитела, специфически направленного на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR.
11. Применение антитела по любому из пп. 1-4 для получения средства для диагностики опухолей, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR.
12. Применение антитела по любому из пп. 1-4 для получения иммунной клетки, модифицированной химерным антигенным рецептором, предпочтительно иммунная клетка включает Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
13. Иммуноконъюгат для детекции опухоли, содержащий:
антитело по любому из пп. 1-4 и
связанную с ним функциональную молекулу, представляющую собой молекулу, которая нацелена на маркер поверхности опухоли.
14. Иммуноконъюгат для подавления опухоли, содержащий:
антитело по любому из пп. 1-4 и
связанную с ним функциональную молекулу, представляющую собой молекулу, подавляющую опухоль.
15. Иммуноконъюгат для детекции иммунной клетки, содержащий:
антитело по любому из пп. 1-4 и
связанную с ним функциональную молекулу, представляющую собой молекулу, которая нацелена на маркер поверхности иммунной клетки.
16. Иммуноконъюгат для детекции опухоли, содержащий:
антитело по любому из пп. 1-4 и
связанную с ним функциональную молекулу, представляющую собой детектируемую метку.
17. Иммуноконъюгат по любому из пп. 13-16, где молекула, которая нацелена на маркер поверхности опухоли, представляет собой антитело или лиганд, который связывается с маркером поверхности опухоли, или
молекула, подавляющая опухоль, представляет собой противоопухолевый цитокин или противоопухолевый токсин, предпочтительно цитокины включают, но не ограничиваются следующими: IL-12, IL-15, IFN-бета, TNF-альфа.
18. Иммуноконъюгат по любому из пп. 13-16, где детектируемая метка включает флуоресцентную метку и хромогенную метку.
19. Иммуноконъюгат по любому из пп. 13-16, где молекула, нацеленная на маркер поверхности иммунной клетки, представляет собой антитело или лиганд, который связывается с маркером поверхности иммунной клетки, предпочтительно маркеры поверхности иммунной клетки включают: CD3, CD16, CD28.
20. Иммуноконъюгат по п. 19, где молекула, которая нацелена на маркер поверхности иммунной клетки, представляет собой антитело, связывающееся с маркером поверхности Т-клеток, которое образует способное связываться с Т-клеткой бифункциональное антитело с антителом по любому из пп. 1-4.
21. Иммуноконъюгат по п. 20, где антитело, которое связывается с маркером поверхности иммунной клетки, представляет собой антитело против CD3.
22. Иммуноконъюгат по любому из пп. 13-16, представляющий собой слитый полипептид, состоящий из антитела по любому из пп. 1-4 и связанной с ним функциональной молекулы, и линкерного пептида между антителом и функциональной молекулой.
23. Применение иммуноконъюгата по любому из пп. 13-22 для получения средства против опухолей, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR.
24. Применение иммуноконъюгата по любому из пп. 13-22 для получения средства для диагностики опухолей, которые экспрессируют EGFRvIII или сверхэкспрессируют EGFR.
25. Применение иммуноконъюгата по любому из пп. 13-22 для получения иммунных клеток, модифицированных химерным антигенным рецептором, предпочтительно иммунные клетки включают Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
26. Химерный антигенный рецептор, специфически распознающий EGFRvIII, экспрессируемый опухолевыми клетками, или EGFR, сверхэкспрессируемый опухолевыми клетками, и который экспрессируется на поверхности иммунной клетки, содержащий антитело по любому из пп. 1-4, где химерный антигенный рецептор содержит последовательно связанные антитело по любому из пп. 1-4, трансмембранную область и внутриклеточную сигнальную область.
27. Химерный антигенный рецептор по п. 26, где внутриклеточная сигнальная область выбрана из группы, состоящей из последовательностей внутриклеточных сигнальных областей CD3ζ, FcεRIγ, CD27, CD28, CD137 и CD134 или их комбинации.
28. Химерный антигенный рецептор по п. 27, где трансмембранная область содержит трансмембранную область CD8 или CD28.
29. Химерный антигенный рецептор по п. 27, где иммунные клетки включают Т-лимфоцит, естественную клетку-киллер или естественный киллерный Т-лимфоцит.
30. Химерный антигенный рецептор по п. 27, содержащий последовательно связанные следующие антитело, трансмембранную область и внутриклеточную сигнальную область:
антитело по любому из пп. 1-4, CD8 и CD3ζ,
антитело по любому из пп. 1-4, CD8, CD137 и CD3ζ,
антитело по любому из пп. 1-4, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28 и CD3ζ или
антитело по любому из пп. 1-4, трансмембранную область молекулы CD28, внутриклеточную сигнальную область молекулы CD28, CD137 и CD3ζ.
31. Химерный антигенный рецептор по п. 27, где антитело представляет собой одноцепочечное антитело или однодоменное антитело антитела по любому из пп. 1-4.
32. Химерный антигенный рецептор по п. 27, содержащий:
аминокислотную последовательность, представленную в положениях с 285 по 601 SEQ ID NO: 36, или
аминокислотную последовательность, представленную в положениях с 285 по 702 SEQ ID NO: 37, или
аминокислотную последовательность, представленную в положениях с 285 по 744 SEQ ID NO: 38, или
аминокислотную последовательность, представленную в положениях с 285 по 749 SEQ ID NO: 39, или
аминокислотную последовательность, представленную в положениях с 285 по 791 SEQ ID NO: 40.
33. Нуклеиновая кислота, кодирующая химерный антигенный рецептор по любому из пп. 26-32.
34. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 33.
35. Вирус для получения генетически модифицированной иммунной клетки, которая нацелена на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR, содержащий вектор по п. 34.
36. Применение химерного антигенного рецептора по любому из пп. 26-32, или нуклеиновой кислоты по п. 33, или вектора экспрессии по п. 34, или вируса по п. 35 для получения генетически модифицированных иммунных клеток, которые нацелены на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR.
37. Генетически модифицированная иммунная клетка, нацеленная на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR, трансдуцированная нуклеиновой кислотой по п. 33, или вектором экспрессии по п. 34, или вирусом по п. 35.
38. Генетически модифицированная иммунная клетка, нацеленная на опухолевые клетки, экспрессирующие EGFRvIII или сверхэкспрессирующие EGFR, экспрессирующая химерный антигенный рецептор по любому из пп. 26-32 на своей поверхности.
39. Иммунная клетка по п. 37, содержащая экзогенную кодирующую последовательность для цитокина, предпочтительно включающего: IL-12, IL-15 или IL-21.
40. Иммунная клетка по п. 37, экспрессирующая другой химерный антигенный рецептор, который не содержит CD3ζ, но содержит внутриклеточный сигнальный домен CD28, внутриклеточный сигнальный домен CD137 или их комбинацию.
41. Иммунная клетка по п. 37, экспрессирующая хемокиновый рецептор, предпочтительно включающий CCR2.
42. Иммунная клетка по п. 37, экспрессирующая миРНК, которая может снижать экспрессию PD-1, или белок, который может блокировать PD-L1.
43. Иммунная клетка по п. 37, экспрессирующая предохранитель, предпочтительно включающий индуцируемую каспазу-9, процессированный EGFR или RQR8.
44. Применение генетически модифицированных иммунных клеток по любому из пп. 37-43 для получения лекарственного средства, ингибирующего опухоль, где указанная опухоль представляет собой опухоль, которая экспрессирует EGFRvIII или сверхэкспрессирует EGFR.
45. Фармацевтическая композиция для ингибирования опухоли, которая экспрессирует EGFRvIII или сверхэкспрессирует EGFR, содержащая:
эффективное количество антитела по любому из пп. 1-4 или нуклеиновой кислоты, кодирующей антитело, или
эффективное количество иммуноконъюгата по любому из пп. 13-22 или нуклеиновой кислоты, кодирующей конъюгат, или
эффективное количество химерного антигенного рецептора по любому из пп. 26-32 или нуклеиновой кислоты, кодирующей химерный антигенный рецептор, или
эффективное количество генетически модифицированной иммунной клетки по любому из пп. 37-43 и
фармацевтически приемлемый носитель.
| БЕЛКИ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2549678C2 |
| US 8580263 B2, 12.11.2013 | |||
| WO 2008140493 A2, 20.11.2008 | |||
| Hui K | |||
| Gan, Anna N | |||
| Cvrljevic, Terrance G | |||
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОГО ГЛИНОЗЕМА И ЕГО СОЛЕЙ ИЗ СИЛИКАТОВ ГЛИНОЗЕМА, ПРОСТЫХ ГЛИН И. Т.П. | 1915 |
|
SU280A1 |
Авторы
Даты
2020-08-24—Публикация
2016-07-21—Подача