Изобретение относится к медицинской и ветеринарной микробиологии и может быть использовано для изучения свойств эритроцитов фиксировать на своей поверхности различные микроорганизмы, в том числе и возбудителей инфекций бактериальной природы человека и сельскохозяйственных животных, что может способствовать изучению особенностей патогенеза ряда бактериальных заболеваний.
Большое внимание при изучении патогенеза инфекционных болезней придается исследованию адгезивных свойств микробов в отношении клеток макроорганизма [1, 3]. Существуют различные способы определения фиксирующих свойств микробов к эритроцитам. Однако они имеют некоторые недостатки, такие как трудоемкость исследований, ограниченное число изучаемых штаммов микроорганизмов, недостаточная информативность, а порой и необходимость использования сложной и дорогостоящей аппаратуры [3].
Известен способ одномоментного определения адгезивности микробных колоний первичного посева в отношении эритроцитов [2], который заключается в том, что на изолированные колонии первичного посева, выросшие на плотной питательной среде, наносят 3-5%-ную взвесь эритроцитов и затем спустя 2-5 мин подсчитывают количество колоний, вокруг которых образуется ореол прикрепленных к их краям эритроцитов. Такие колонии считают адгезивно-активными.
Способ дает возможность проводить изучение адгезивности лишь отдельных изолированных колоний, выбранных исследователем, что в значительной степени обесценивает полученные результаты. Кроме того, используя данный способ, можно наблюдать лишь передвижение эритроцитов к колониям и их фиксирование по их краям, а говорить о непосредственной фиксации микробов к эритроцитам достаточно затруднительно.
Существует способ определения адгезивных свойств микробных клеток [1], заключающийся в том, что в пробирку вносят по 0,5 мл взвесей микробов и эритроцитов в концентрациях 109 кл/мл и 100 млн/мл соответственно. Смеси инкубируют при 37°С на встряхивателе в течение 30 мин, после чего на предметном стекле готовят мазок, его высушивают, окрашивают и рассматривают под микроскопом. Адгезивные свойства оценивают по 3 показателям: среднему показателю адгезии (СПА), коэффициенту адгезии (КА), индексу адгезии микроорганизма (ИАМ). При этом СПА - среднее количество микробов, прикрепившееся к 1 эритроциту, при подсчете не менее 25 эритроцитов. КА - это процент эритроцитов, имеющих на своей поверхности фиксированные микробы. А ИАМ - среднее число микробных клеток на одном участвующем в адгезивном процессе эритроците.
К недостаткам этого способа следует отнести трудоемкость и относительную субъективность при подсчете эритроцитов и микробов на их поверхности, а также ограниченное количество исследуемых эритроцитов. Кроме того, при микроскопии мазков достаточно сложно разделять фиксацию микробов на эритроцитах и их спонтанное расположение около них.
Сущность предлагаемого способа заключается в том, что для определения фиксирующей активности эритроцитов в отношении микробов сначала проводится инкубирование смеси взвесей микробов и эритроцитов в пробирке при 37-39°С на встряхивателе в течение 30 мин, а затем, в отличие от прототипа, смесь центрифугируют до осаждения эритроцитов, после чего с помощью фотоэлектроколориметра определяют оптическую плотность (ОП) надосадочной жидкости в пробирке.
Для контроля определяют ОП надосадочной жидкости в пробирке, содержащей микробную взвесь и физраствор хлорида натрия вместо взвеси эритроцитов и находящейся в тех же условиях.
В случае фиксации определенного количества микробов на эритроцитах ОП надосадочной жидкости в опытной системе в сравнении с контрольной после центрифугирования снижается.
Бактериофиксирующую активность эритроцитов предложили рассчитывать по формуле
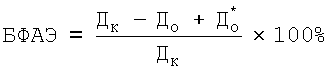 ,
,
где БФАЭ % - бактериофиксирующая активность эритроцитов, Дк - ОП надосадочной жидкости в контрольной системе, До - ОП надосадочной жидкости в опытной системе,  - ОП надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси, и находящейся в тех же условиях.
- ОП надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси, и находящейся в тех же условиях.
Величину  ввели в формулу для более точного рассчета БФАЭ, чтобы устранить влияние частичного гемолиза эритроцитов при манипуляциях с ними на результаты измерения ОП.
ввели в формулу для более точного рассчета БФАЭ, чтобы устранить влияние частичного гемолиза эритроцитов при манипуляциях с ними на результаты измерения ОП.
Для проведения эксперимента использовали вакцинный штамм EV чумного микроба и культуру Staph.epidermidis музейного штамма, которые выращивали в течение 24 часов в чашках Петри на мясопептонном агаре (МПА). С помощью физиологического раствора хлорида натрия делали смывы выросших культур с поверхности сред. От содержащихся в полученных взвесях крупных взвешенных частиц освобождались путем центрифугирования при 1000 об/мин в течение 1 мин для их осаждения. Затем оптическую плотность (ОП) микробных взвесей доводили 1,0 ед. экстинкции (для стандартизации опыта). Для измерения ОП использовали прибор КФК-2, зеленый светофильтр, кюветы с рабочим расстоянием между гранями 5 мм, а в качестве растворителя для взвесей - физиологический раствор хлорида натрия.
В опытную систему в силиконизированные пробирки вносили по 1 мл взвеси эритроцитов человека, трижды отмытых физиологическим раствором, в концентрации 0,6-0,7 млрд/мл и по 2,5 мл взвеси микробной культуры с ОП 1 ед. Пробирки выдерживали в течение 30 мин во встряхивателе при температуре 37-39°С. Применяли лабораторный встряхиватель типа 358 S с максимальной амплитудой (25 мм) и минимальной частотой колебаний (50 циклов/мин). Затем пробирки центрифугировали при 1000 об/мин для осаждения эритроцитов и измеряли оптическую плотность надосадочной жидкости. Контролем служили пробы с 1 мл физраствора и 2,5 мл взвеси микробов, находящиеся в аналогичных условиях.
Учет результатов фиксации бактерий к эритроцитам осуществляли по разнице измерения оптической плотности (ОП) надосадочной жидкости в пробирках опытной и контрольной систем (таблица 1).
Результаты измерения ОП надосадочной жидкости в опытной и контрольной системах, ед. экстинкции, (n=6)
Из данной таблицы видно, что в опытной системе, содержащей взвесь вакцинного штамма чумного микроба, происходило уменьшение ОП надосадочной жидкости после центрифугирования по сравнению с контрольной системой, что свидетельствовало о фиксации микробов на эритроцитах. В пробирках со стафилококком уменьшения ОП в опытной системе по сравнению с контрольной не было, т.е. фиксации не наблюдалось.
Установили, что в опытной системе в ходе эксперимента возникает незначительный гемолиз эритроцитов, что влияет на результат измерения ОП надосадочной жидкости. При проведении исследований в 1-2 пробирки вносили по 1 мл взвеси эритроцитов и 2,5 мл физраствора. Измеряли ОП надосадочной жидкости в них после культивирования во встряхивателе и центрифугирования и установили, что она отличается от ОП физраствора на 0,05-0,13 ед. экстинкции. Данную величину ( ) предложили учитывать при расчете БФАЭ.
) предложили учитывать при расчете БФАЭ.
В следующей серии опытов провели сравнительную оценку БФАЭ человека в отношении вакцинного штамма EV и нескольких музейных штаммов сапрофитных микробов. В качестве питательных сред применяли МПА, при выращивании чумного микроба вакцинного штамма - МПА с добавлением генцианвиолета. Пользуясь полученными данными, по предложенной формуле определяли БФАЭ человека в отношении указанных микробов (таблица 2).
Определение БФАЭ в отношении различных микроорганизмов, (n=5)
Для более объективной характеристики БФАЭ в отношении различных микробов ввели шкалу оценки, в соответствие с которой БФАЭ менее 10% считается слабой, 11-20% - средней, 21-40% - высокой, 41% и более - очень высокой.
БФАЭ в отношении штамма EV определили как очень высокую, в отношении Ps.aeruginosa - среднюю, E.coli - слабую. В отношении двух музейных штаммов двух видов микробов - Pr.vulgaris и Staph.epidermidis БФАЭ не проявилась.
Обнаружили, что БФАЭ в отношении одних и тех же микробов, многократно пассированных через питательные среды, резко уменьшается, кроме того, значительное влияние на проявление у микроба адгезивных свойств в отношении эритроцитов оказывает состав плотной питательной среды для выращивания микроба. Для этого проводили эксперимент, в котором использовали свежие культуры вакцинного штамма EV чумного микроба, взятые из новых флаконов с вакциной и выращиваемые в течение 24 часов на МПА и переваре Хоттингера, и культуры этого же микроба, пассированные трехкратно через плотные питательные среды (МПА). В состав сред для подавления посторонней микрофлоры добавляли генцианвиолет. Результаты определения БФАЭ в эксперименте представлены в таблице 3.
Влияние состава питательной среды и количества пассажей на БФАЭ в отношении вакцинного штамма чумного микроба, (n=6).
Из таблицы видно, что более оптимальной средой выращивания для проявления у вакцинного штамма чумного микроба адгезивных свойств в отношении эритроцитов человека является перевар Хоттингера. При культивировании этого микроба на МПА данная способность проявляется в меньшей степени, а при многократном пассировании через плотную питательную среду значительно снижается.
Таким образом, предложенный способ определения БФАЭ позволяет изучать фиксирующие свойства эритроцитов по отношению к различным микроорганизмам в том числе и к возбудителям бактериальных инфекций, оценивать степень их выраженности, выявлять условия, влияющие на фиксацию микробов на эритроцитах. Это дает возможность получить новые, дополнительные сведения о характере взаимодействия микробных клеток с эритроцитами человека. Предлагаемый способ определения БФАЭ не требует применения сложного и дорогостоящего оборудования, достаточно чувствителен, а также прост в исполнении. Он позволяет, в отличие от прототипа, одновременно устанавливать взаимодействие миллионов эритроцитов с десятками миллионов бактерий. С его помощью можно изучать адгезивные свойства широкого спектра микробов и выявлять даже незначительные их изменения.
Литература
1. Брилис В.И. Методика изучения адгезивного процесса микроорганизмов. / В.И.Брилис, Т.А.Брилене, Х.П.Ленцнер, А.А.Ленцнер // Лабораторное дело. - 1986. - №4. - С.210-212. - прототип.
2. Гизатулина С.С. Способ оценки состояния микрофлоры кишечника человека по количеству адгезивно-активных колоний и типу адгезинов. / С.С.Гизатулина, М.О.Биргер, Л.И.Кулинич и др. // Журнал микробиологии, эпидемиологии и иммунологии. - 1991. - №4а. - С.21-23.
3. Куликовский А.В. Изменение адгезивной способности микроорганизмов. / А.В.Куликовский, И.Б.Павлова // Ветеринария. - 1993. - №7. - С.22.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения дозы вакцины | 1982 |
|
SU1175438A1 |
| Штамм бактерий Lactobacillus paracasei 1, используемый для приготовления пробиотического препарата | 2015 |
|
RU2608871C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КУЛЬТИВИРОВАНИЯ И СБОРА БИОМАССЫ ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА Y.pestis EV | 2018 |
|
RU2702174C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАГНОИММУНОСОРБЕНТА ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ (ВАРИАНТЫ) | 2003 |
|
RU2271540C2 |
| СРЕДА ВЫСУШИВАНИЯ ЖИДКАЯ ДЛЯ СТАБИЛИЗАЦИИ БИОМАССЫ ВТОРИЧНОГО СБОРА ЧУМНОГО МИКРОБА ВАКЦИННОГО ШТАММА EV | 2013 |
|
RU2528069C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ YERSINIA PESTIS EV | 2018 |
|
RU2708029C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КОНТРОЛЯ КОЛИЧЕСТВА ЖИВЫХ МИКРОБНЫХ КЛЕТОК ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА Y. PESTIS EV | 2020 |
|
RU2748492C1 |
| Питательная среда плотная для культивирования и сбора биомассы чумного микроба вакцинного штамма Y.pestis EV | 2016 |
|
RU2626568C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА НА ОСНОВЕ ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА | 2012 |
|
RU2510825C2 |
| СПОСОБ ПОВЫШЕНИЯ АДГЕЗИВНОЙ АКТИВНОСТИ ЛАКТОБАЦИЛЛ, ИСПОЛЬЗУЕМЫХ В ПРОИЗВОДСТВЕ ПРОБИОТИКОВ И КИСЛОМОЛОЧНЫХ ПРОДУКТОВ | 2016 |
|
RU2633067C1 |
Изобретение относится к медицинской и ветеринарной микробиологии. Сущность разработки заключается в том, что смесь взвесей микробов и эритроцитов инкубируют при 37-39°С на встряхивателе в течение 30 мин, центрифугируют до осаждения эритроцитов, а затем с помощью фотоэлектроколориметра определяют оптическую плотность надосадочной жидкости смеси. Бактериофиксирующую активность эритроцитов - БФАЭ (%) - рассчитывают по разности между Дк (оптическая плотность надосадочной жидкости в контрольной системе) и суммой До (оптическая плотность надосадочной жидкости в опытной системе) и 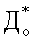 (оптическая плотность надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси и находящейся в тех же условиях), деленной на Дк и умноженной на 100%. Использование способа позволяет определять способность эритроцитов фиксировать на своей поверхности различные микроорганизмы, в том числе возбудителей бактериальных инфекций и дает возможность изучения адгезивных свойств микробов. 3 табл.
(оптическая плотность надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси и находящейся в тех же условиях), деленной на Дк и умноженной на 100%. Использование способа позволяет определять способность эритроцитов фиксировать на своей поверхности различные микроорганизмы, в том числе возбудителей бактериальных инфекций и дает возможность изучения адгезивных свойств микробов. 3 табл.
Способ определения бактериофиксирующей активности эритроцитов (БФАЭ), включающий инкубирование смеси взвесей микробов и эритроцитов при 37-39°С на встряхивателе в течение 30 мин, отличающийся тем, что в последующем смесь центрифугируют до осаждения эритроцитов, а затем с помощью фотоэлектроколориметра определяют оптическую плотность надосадочной жидкости смеси по формуле 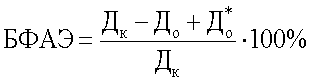 ,
,
где БФАЭ (%) - бактериофиксирующая активность эритроцитов;
Дк - оптическая плотность надосадочной жидкости в контрольной системе;
До - оптическая плотность надосадочной жидкости в опытной системе;
 - оптическая плотность надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси и находящейся в тех же условиях.
- оптическая плотность надосадочной жидкости системы, содержащей взвесь эритроцитов и физраствор хлорида натрия вместо микробной взвеси и находящейся в тех же условиях.
| БРИЛИС В.И | |||
| с соавт | |||
| Методика изучения адгезивного процесса микроорганизмов | |||
| Лабораторное дело, N4, 1986, с.210-212 | |||
| RU 95112691 А, 27.11.1997 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ АДГЕЗИВНЫХ СВОЙСТВ ЛЕЙКОЦИТОВ КРОВИ | 2003 |
|
RU2246728C2 |
| Способ определения адгезивности тромбоцитов | 1989 |
|
SU1734020A1 |
| Способ определения адгезии лейкоцитов | 1989 |
|
SU1697008A1 |
Авторы
Даты
2009-07-10—Публикация
2007-11-06—Подача