Изобретение относится к применению 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамида, называемого ниже «соединением I», или его фармацевтически приемлемой соли для получения фармацевтических композиций для лечения диабета, например диабета I типа или диабета II типа, к применению соединения I или его фармацевтически приемлемой соли для лечения диабета, например диабета I типа или диабета II типа, к способу лечения теплокровных животных, включая млекопитающих, особенно людей, страдающих от диабета, например диабета I типа или диабета II типа, заключающемуся во введении указанному животному, нуждающемуся в таком лечении, эффективной в отношении указанной болезни дозы соединения I или его фармацевтически приемлемой соли.
Подписи к чертежам
Фиг.1. На цитокин-индуцируемое продуцирование NO не влияет 10 мкмоль соединения I, например соли I, в bTC-6-клетках и изолированных островковых клетках крыс. Показаны средние результаты ± SEM для трех независимых наблюдений.
Фиг.2. Соединение I, например соль I, частично защищает островковые клетки человека от оксида азота. Результаты являются средними ± SEM для трех отдельных доноров.
Фиг.3. Степень апоптоза в bTC-6-клетках, обработанных зацепляющей siPHK или с-Abl-специфичной siPHK. Обработка цитокином (IL-1-β+IFN-γ+TNF-α) инициируется за 24 ч до анализа клеток. Апоптоз определяется количественно проточной цитометрией. Результаты являются средними ± SEM для 3-4 наблюдений.
Более одного миллиона американцев болеют диабетом I типа, также называемым инсулин-зависимым сахарным диабетом, сокращенно ИЗСД, или ювенильным диабетом. При диабете I типа поджелудочная железа пациентов вырабатывает мало или совсем не вырабатывает инсулин - гормон, необходимый для поддержания жизни. Хотя проявления данного заболевания полностью не изучены, диабет I типа является многофакторным аутоиммунным заболеванием, возникающим в результате специфического и прогрессирующего разрушения продуцирующих инсулин бета-клеток в поджелудочной железе. Он является одним из тех хронических детских заболеваний, которые требуют наибольших материальных затрат и никогда не излечиваются. Хотя инсулин позволяет пациенту выживать, он лечит диабет, но не предотвращает его возможные разрушительные эффекты: почечную недостаточность, слепоту, нервное повреждение, ампутации, сердечный приступ и инсульт. Для выживания пациенты с диабетом I типа должны ежедневно получать инсулин путем многократных инъекций или непрерывного вливания с помощью насоса, а также проводить анализ сахара в крови, взятой из пальца шесть или более раз в сутки. Пытаясь соотносить инъекции инсулина с количеством потребленной пищи, пациенты с диабетом I типа должны постоянно быть готовыми к возможности возникновения гипогликемии, т.е. низкому уровню сахара в крови, и гипергликемии, т.е. высокому уровню сахара в крови, состояниям, которые могут угрожать жизни. Несмотря на строгое внимание к поддержанию здоровой диеты, режиму упражнений и постоянные инъекции подходящего количества инсулина, многие другие факторы могут неблагоприятно влиять на контроль сахара в крови пациентов, включая стресс, гормональные изменения, периоды роста, физическую активность, лекарственные средства, болезни/инфекции и усталость. Несмотря на применение инсулина, диабет I типа обычно приводит к резкому снижению качества жизни и в среднем укорачивает продолжительность жизни на 15 лет. Каждый год приблизительно у 30000 американцев диагностируют диабет I типа, из них свыше 13000 являются детьми. Это составляет 35 детей каждый день.
Диабет II типа, также называемый неинсулин-зависимым сахарным диабетом (ИНЗСД) или диабетом взрослых, обычно связан с ожирением, инсулиновой резистентностью или относительным недостатком инсулина. Хотя эта форма диабета в большинстве случаев не нуждается в инсулине, имеются выраженные совпадения между ним и диабетом I типа. Например, в настоящее время общепризнано, что имеется безусловный недостаток инсулин-продуцирующих бета-клеток также при диабете II типа и что этот дефицит бета-клеток является возможным результатом увеличения скорости гибели бета-клеток. Таким образом, фармакологическое лечение, которое приводит к защите бета-клеток от гибели, может быть успешным для лечения и диабета I типа, и диабета II типа.
Неожиданно было обнаружено, что ингибитор с-Abl-, PDGF-R-, c-kit- или ARG-тирозинкиназы или его фармацевтически приемлемая соль, например соединение I или его фармацевтически приемлемая соль, например соль I, особенно полезен для лечения диабета, например диабета I типа или диабета II типа. Неожиданно было обнаружено, что ингибитор с-Abl-, PDGF-R-, c-kit-ARG-тирозинкиназы или его фармацевтически приемлемая соль, например соединение I или его фармацевтически приемлемая соль, например соль I, может применяться для лечения или профилактики диабета, например диабета I типа или диабета II типа.
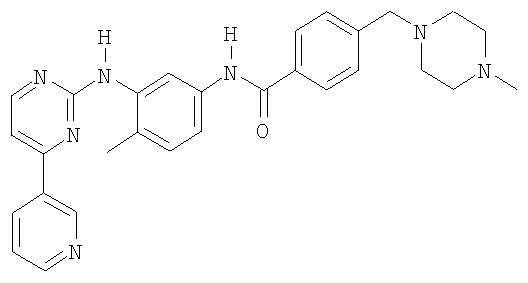
Соединением I является 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид формулы
Соединение I в виде свободного основания, его приемлемые соли и его приготовление заявлены в Европейском патенте 0564409. Соединение I в виде свободного основания соответствует активной части молекулы.
Соль монометансульфоновой кислоты соединения I, называемая в настоящем изобретении «солью I», предпочтительно в кристаллической форме, например в форме бета-кристаллов, описана в РСТ-заявке на патент WO 99/03854, опубликованной 28 января 1999.
Изобретение относится к применению ингибитора с-Abl-, PDGF-R-, c-kit- или ARG-тирозинкиназы или его фармацевтически приемлемой соли в качестве лекарственного средства против диабета, например диабета I типа или диабета II типа. Наиболее предпочтительно изобретение относится к применению соединения I или его фармацевтически приемлемой соли, например соли I, в качестве препарата против диабета, например диабета I типа или диабета II типа.
Ингибиторы с-Abl-, PDGF-R-, c-kit- или ARG-тирозинкиназы, применяемые в соответствии с настоящим изобретением, выбраны из группы, включающей следующие соединения: 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид, называемый в настоящем изобретении соединением I, ингибитор изоформ PDGF-рецептора, Bcr-Abl и с-Kit, который характеризуется высокой активностью и пероральной биодоступностью; бис(1H-2-индолил)-1-метаноны другого класса ингибиторов тирозинкиназы, которые охарактеризованы в качестве PDGF-R ТК-ингибиторов (Mahboobi S. и др., J. Med. Chem. 45, 2002, сс.1002-1018) и включены в настоящий патент в виде ссылки; блокатор киназы PDGF-рецептора AG 1295, имеющий CAS-номер 71897-07-9; AG 1295/96, описанный в работах Kovalenko М. и др. в Cancer Res. 54, 1994, сс.6106-6114, и Ludewig D. и др. в Cell Tissue Res. 299, 2000, cc.97-103, которые включены в настоящий патент в виде ссылок; СТ 52923 (4-(6,7-диметокси-4-хиназолинил)-N-(3,4-метилендиоксибензил)-1-пиперазинтиокарбоксамид); RP-1776; GFB-111; пиррол[3,4-с]-бета-карболиндионы, SU 102 (созданный фирмой Sugen); AG 1296, имеющий CAS-номер 146535-11-7; RPR 101511 A, разработанный фирмой Aventis Pharma; CDP 860 и Zvegf3, разработанные фирмой ZymoGenetics; CP 673451 и PD 170262 фирмы Pfizer; KI 6783, имеющий CAS-номер 190726-45-5, ингибитор PDGF-R, разработанный фирмой Kirin Brewery, Япония; KN 1022, разработанный фирмой Kyowa Hakko в Японии и фирмой Millenium Pharmaceuticals в США; AG 13736, разработанный фирмой Pfizer; CHIR 258, разработанный фирмой Chiron Corporation; MLN 518 от фирмы Millenium Pharmaceuticals и SU 11248 от фирмы SUGEN-Pfizer, лефлуномид, или их фармацевтически приемлемые соли.
СТ 52923 описан Matsuno К. и др. в кн.: «18th Symposium on Medicinal Chemistry; 1998, Kyoto, Japan, the Pharmaceutical Society of Japan, Division of Medicinal Chemistry», Токио, Япония, сс.2-P-05.
Циклический пептид RP-1776 выделен из культурального бульона Streptomyces sp. KY 11784. Он описан, например, Toki S. и др. в J.Antibiot., 54, 2001, сс.405-414.
GFB-111 описан Blaskovich М.А. и др. в Nat. Biotechnol. 18, 2000, сс.1065-1070, и Delarue F. и др. в кн.: «91st Annual meeting of American Association for Cancer research», 41, 2000, c.458.
Пирроло[3,4-с]-бета-карболиндионы, описанные, например, Teller S., Eur. J. Med. Chem. 35, 2000, сс.413-427. CDP 860 является фрагментом пегелированного антитела, производного от антитела ростового фактора бета-рецептора из антитромбоцитов человека.
СЗ 673451 нацелен на PDGF-рецептор.
PD 170262 или 2-[4-(2-диэтиламиноэтокси)фениламино]-8-метил-6-(3-тиенил)пиридо[2,3-d]пиримидин-7(8Н)-он является сильным ингибитором тирозинкиназы и избирателен по отношению к тирозинкиназе тромбоцитарного фактора роста. Синтез и ингибиторная активность в отношении тирозинкиназы соединений серии 2-амино-8Н-пиридо[2,3-d]пиримидинов описаны, например, Klutchko S. и др. в кн.: «213th American Chemical Society National meeting: abst. MEDI» 1997, с.201, США.
KI 6783 или 4-(3,4-диметоксифенокси)-6,7-диметоксихинолин описан, например, Kubo К. и др., Bioorganic and Medicinal Chemistry Letters 7, 1997, сс.2935-2940, и Yagi М. и др., Exp. Cell Research 234, 1997, сс.285-292.
KN 1022 или 6,7-диметокси-4-[4-(4-нитрофенил)аминокарбонилпиперазин-1-ил]хиназолин, который ингибирует PDGFR-фосфорилирование, описан, например, в кн.: «217th American Chemical Society National meeting abstr. MEDI» 1999, часть 1, с.061, Япония.
AG 013736 или N-метил-2-[3-[2-(2-пиридил)винил]-1Н-индазол-6-илсульфанил]бензамид описан, например, Heller и др. в кн.: «93rd Annual meeting of American association for Cancer research» 43, 2002, с.1082, США.
CHIR 258 является перорально активным аминобензимидазолхинолиновым ингибитором киназы фактора роста, который проявляет спектр ингибиторной активности в отношении рецептора тирозинкиназы, например, из PDGFR-семейства. CHIR 258 описан, например, Steigerwalt R. и др. а также Lee S.H. и др. в кн.: «94th Annual meeting of American association for Cancer research» 2003, США, с.3783 и с.R4702 соответственно.
SU 11248 или (2-диэтиламиноэтил)амин 5-[3-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты является направленным на многие мишени ингибитором киназы, селективным, например, по отношению к PDGFR. SU 11248 описан, например, Xin L. и др. в кн.: «93rd Annual meeting of American Association for Cancer Research» 43, 2002, с.1081, США.
MLN 518 является пиперазинильным производным хиназолина формулы 4-[4-(N-пара-изопропоксифенилкарбамоил)-1-пиперазинил]-6-метокси-7-(пиперидинопропилокси)хиназолин, который ингибирует, например, PDGF R-фосфорилирование в анализах связывания (Stone R.M. и др., Blood 102, 2003, сс.65-66; Kelly L.M. и др., Cancer Cell 1, 2002, сс.421-423).
Лефлуномид (SU 101) или 4-изоксазолкарбоксамид, 5-метил-N-[4-(трифторметил)фенил] является ингибитором тирозинкиназы.
SU 11654 ингибирует активность тирозинкиназы рецептора c-kit.
Структура активных агентов, идентифицируемых кодовыми номерами, генерическими или торговыми названиями, может быть взята из текущего издания стандартного краткого руководства «The Merck Index» или из базы данных, например, Patents International (IMS World Publications). Соответствующее содержание приводится в настоящем изобретении в виде ссылок.
Настоящее изобретение относится также к применению 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамида, бис(1H-2-индолил)-1-метанонов, AG 1295, СТ 52923, RP-1776, GFB-111, пирроло[3,4-с]-бета-карболиндионов, SU 102, AG 1296, RPR 101511А, CDP 860, Zvegf3, CP 673451, PD 170262, KI 6783, KN 1022, AG 13736, CHIR 258, MLN 518, SU 11248, лефлуномида или их фармацевтически приемлемых солей для получения лекарственного средства, предназначенного для лечения диабета, например диабета I типа или диабета II типа, предпочтительно применяется соединение I или его фармацевтически приемлемая соль.
Настоящее изобретение относится также к применению ингибиторов с-Abl-,
PDGF-R-, c-kit- или ARG-тирозинкиназы или их фармацевтически приемлемых солей для получения лекарственного средства для лечения диабета, например диабета I типа или диабета II типа. Предпочтительно ингибитор с-Abl-, PDGF-R-, c-kit- или ARG-тирозинкиназы выбраны из группы, включающей 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид, бис(1H-2-индолил)-1-метаноны, AG 1295, СТ 52923, RP-1776, GFB-111, пиррол[3,4-с]-бета-карболиндионы, SU 102, AG 1296, RPR 101511 А, CDP 860, Zvegf3, CP 673451, PD 170262, KI 6783, KN 1022, AG 13736, CHIR 258, MLN 518, SU 11248, лефлуномид или их фармацевтически приемлемые соли, предпочтительно 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид.
В настоящем описании термин «лечение» обозначает либо профилактическую, или превентивную обработку, либо подавляющее болезнь лечение, включая лечение пациентов с риском развития диабета и больных диабетом. Этот термин также включает лечение с целью замедления развития болезни.
Понятие «подавление и/или реверсирование диабета» означает, что состояние диабета больше не наблюдается у пациента или что заболевание пребывает в не столь тяжелой форме, чем до лечения или при отсутствии лечения.
Применяемый термин «лечение» в контексте настоящего изобретения означает, что обработка приводит к ремиссии диабета или постоянных приступов диабета.
Термин «профилактический» или «превентивный» обозначает профилактику начала заболевания или рецидива диабета.
В контексте настоящего изобретения понятие «замедление прогрессирования» обозначает, что введение активного соединения пациенту на предварительном этапе или на ранней стадии диабета предотвращает заболевание от дальнейшего развития или ослабляет развитие болезни по сравнению с развитием болезни без введения активного соединения.
Фармацевтические композиции согласно настоящему изобретению могут быть получены способом, известным per se, и подходят для энтерального, например перорального или ректального, и парентерального введения теплокровным животным, включая человека, они содержат терапевтически эффективное количество, по меньшей мере, одного фармакологически активного ингредиента, одного или в комбинации с одним или несколькими фармацевтически приемлемыми носителями, особенно приемлемыми для энтерального или парентерального применения. Предпочтительным способом введения дозовых форм настоящего изобретения является пероральный способ.
Таким образом, изобретение также относится к способу лечения теплокровных животных с диабетом, например диабетом I типа или диабетом II типа, предусматривающему введение указанному животному, нуждающимся в таком лечении, соединения I или его фармацевтически приемлемой соли в терапевтически эффективном количестве.
Изобретение относится к способу введения человеку, болеющему диабетом, например диабетом I типа или диабетом II типа, предпочтительно диабетом I типа, кислотной соли соединения I, предпочтительно соли I, монометансульфонатной соли 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамида.
Квалифицированный специалист в данной области может легко выбрать нужные тестовые модели, чтобы подтвердить проявление полезных эффектов, упомянутых в настоящем изобретении, в отношении диабета, например диабета I типа или диабета II типа. Фармакологическую активность указанного соединения можно, например, продемонстрировать с помощью примеров, описанных ниже, с помощью тестов in vitro и in vivo или приемлемыми клиническими исследованиями. Подходящими клиническими исследованиями являются, например, открытые меченые нерандомизированные исследования с повышением дозы на пациентах с диабетом, например диабетом I типа или диабетом II типа. В этих исследованиях определяется эффективность лечения, например, путем оценки заболевания каждые 4 недели и сопоставлением с контролем, в котором применяли плацебо.
Эффективная доза соединения I может изменяться в зависимости от применяемого соединения или фармацевтической композиции, способа введения, типа диабета, например диабета I типа или диабета II типа, подвергаемого лечению, или от тяжести заболевания. Дозовый режим выбирается в соответствии с множеством других факторов, включая функционирование почек и печени у пациента. Врачи, клиницисты или ветеринары обычной квалификации могут легко определить и прописать эффективное количество соединений, требуемых для профилактики, сдерживания или прекращения развития заболевания.
В зависимости от возраста, индивидуального состояния, способа введения и клинической картины эффективные дозы, например суточные дозы соединения I или его фармацевтически приемлемой соли, соответствующие 100-1000 мг свободного основания в качестве активного начала, особенно 800 мг, вводятся теплокровным животным массой тела около 70 кг. Предпочтительно теплокровным животным является человек. Для пациентов с недостаточной реакцией на суточные дозы может безопасно рассматриваться вопрос о повышении доз, пациентов могут подвергать лечению на протяжении длительного времени до тех пор, пока будет наблюдаться польза от лечения при отсутствии сдерживающей токсичности.
Изобретение также относится к способу введения пациенту, болеющему диабетом, например диабетом I типа или диабетом II типа, соединения I или его фармацевтически приемлемой соли, предусматривающему введение фармацевтически эффективного количества соединения I или его фармацевтически приемлемой соли пациенту один раз в сутки на протяжении периода времени, превышающего 3 месяца. Особенно изобретение относится к такому способу, при котором суточная доза соединения I, составляющая 400-800 мг, предпочтительно 800 мг, вводится взрослому пациенту.
Изобретение также предлагает упаковку лекарственного средства, включающую ингибитор с-Abl-, PDGF-R-, c-kit- или ARG-тирозинкиназы или их фармацевтически приемлемую соль, например соединение I или его фармацевтически приемлемые соли, например соль I, вместе с отпечатанными инструкциями по введению для пациентов с диабетом, например диабетом I типа или диабетом II типа.
Пример 1. Защищает ли соединение I, например соль I, от диабета и от гибели бета-клетки?
В приводимых ниже примерах β-ТС6-клетки обозначаются как бета-ТС6-клетки.
Инсулин-зависимый (I типа) сахарный диабет (ИЗСД) является многофакторным аутоиммунным заболеванием, которое возникает в результате специфического и прогрессирующего разрушения инсулин-продуцирующих β-клеток. Дисфункция и повреждение β-клеток, как полагают, происходит при непосредственном контакте с островковыми инфильтрующими клетками (макрофагами, CD4+ или CD8+ (NK) Т-клетками) и/или в результате воздействия цитотоксических медиаторов, продуцируемых этими клетками, например провоспалительными цитокинами (IL-1, TNF-α, IFN-γ), свободными радикалами, Fas-лигандом, TPAIL и перфорином. Аутоиммунность, направленная против бета-клеток, может быть инициирована факторами окружающей среды, например токсинами бета-клеток, пищевыми компонентами, стрессом, метаболической перегрузкой, вирусами и т.д. Возможно, что бета-клетка при конвертировании наружного сигнала гибели во внутренние апоптозные события активно участвует в собственном разрушении при диабете I типа. Провоспалительные цитокины, а именно комбинация IL-1 и IFN-γ, индуцируют апоптоз и некроз бета-клетки. Таким образом, указанные цитокины, возможно, не только модулируют активность островковых инфильтрующих иммунных клеток, но также воздействуют на прямые вредные эффекты на бета-клетку в патогенезе диабета I типа. Вероятно, что стимуляция бета-клеток с помощью IL-1 приводит к множественным сигнальным событиям, включая активацию протеинкиназ (РКС, р38, JNK, ERK, MSK1), липаз (PLC, PLD, сфингомиелиназы), циклооксигеназы и факторов транскрипции (NF-кВ, ATF-2, c-jun, Elk-1, CREB, cEBP-β, IRF-1, STAT-1). Указанные события сопровождаются индукцией индуцируемой синтазы оксида азота (iNOS) и белков стресса, например, hsp70, гемоксигеназы, Mn-SOD, ICE и других. К сожалению, остается неясным, какие происходят изменения в генной экспрессии, которые имеют большое значение для гибели бета-клеток при диабете I типа. Преимущественно апоптоз происходит в линии бета-клеток в ответ на УФ-излучение или ингибирование репарации ДНК. Этому предшествует индукция р53 опухолевого супрессорного белкового индуктора, генерирование реактивного кислорода, PARP-ингибирование, прекращение S- и G2-клеточного цикла и понижение митохондриального мембранного потенциала. Цитокины, которые в основном стимулируют некроз и только в меньшей степени апоптоз, существенно активируют такие сигнальные этапы, как ингибирование репарации ДНК и УФ-излучение. Из этих экспериментов in vitro ясно, что модель гибели бета-клеток может изменяться в зависимости от сигнала гибели, а также, что аналогичные сигнальные пути метаболизма могут применяться для достижения различных форм гибели бета-клеток.
С-Abl является повсеместно экспрессируемой протеинтирозинкиназой с приблизительной молекулярной массой 145 кДа. Было показано, что в физиологических условиях с-Abl участвует в контроле функций цитоскелета, например миграции и структуре клеток, а также в развитии клеточного цикла. Тем не менее, когда клетки подвергаются различным формам стресса, с-Abl становится высоко активированной, что приводит к остановке клеточного цикла и апоптозу.
В итоге интенсивные исследования клеток, не являющихся бета-клетками, показали, что с-Abl стимулирует апоптоз в ответ на различные типы стресса. Предполагаемая роль с-Abl в инсулин-продуцирующих клетках не выяснена. Таким образом, не ясно, играет ли указанный белок какую-то роль в гибели бета-клеток и выборе между апоптозом и некрозом.
Значение для диабета I типа. Хотя патогенез диабета I типа представляется очень сложным процессом, возможно, что внутриклеточные метаболические пути, приводящие к гибели бета-клеток, сходятся в некоторой определенной точке. Гипотетически это открывает возможность за счет применения только одного подхода блокировать большое число сигналов гибели, в результате чего достигалось бы выживание бета-клеток.
Тирозинкиназа с-Abl может быть важным медиатором гибели бета-клеток. Тирозинкиназа с-Abl экспрессируется в bTC-6-клетках и выделенных островковых клетках крыс, и ингибирование с-Abl-активности либо с применением фармакологического агента СОЕДИНИНИЯ I, либо нокаутом с- Abl-экспрессии с помощью РНКи-методики, приводит к защите от гибели бета-клеток, индуцируемой провоспалительными цитокинами или донорами оксида азота. С-Abl не действует при стимулировании образования оксида азота, так как ингибирование с-Abl не противодействует цитокин-индуцированному образованию оксида азота.
В свете указанных данных с-Abl действует как сенсор стресса и внешних сигналов гибели, и с-Abl-активация может привести к фосфорилированию и активации JNK- и р38 МАР-киназ, инактивации NF-кВ и PI3K, митохондриальному высвобождению про-апоптозных факторов и, в итоге, к гибели бета-клеток. Соединение I способно блокировать различные сигналы гибели, в результате чего достигается выживание бета-клеток и защита от диабета.
Результаты Для того чтобы установить, мешает ли соединение I, например соль I, или участвует ли с-Abl в сигнальном каскаде, который приводит к гибели бета-клеток, выделенные островковые клетки крыс обрабатывают постепенно высвобождающим оксид азота донором DETA/NO (0,5 ммоль) или комбинацией IL-1-β (25 ЕД/мл) + IFN-γ (1000 ЕД/мл) + TNF-α (1000 ЕД/мл) в течение 24 ч. В обоих случаях островковые клетки культивируют, с добавлением или без него, 10 мкМ соединения I, например соли I, в течение инкубационного периода. После инкубационного периода островковые клетки витально окрашивают иодидом пропидиума + бисбензимидом и фотографируют флуоресцентным микроскопом. Апоптозные (белые конденсированные или фрагментированные ядра) и некротические (красные или розовые нефрагментированные ядра) подсчитывают и выражают в виде процента от общего количества клеток. Соль I, например соединение I, сама по себе не влияет на жизнеспособность островковых клеток. DETA/NO индуцирует некроз в 10% островковых клеток, и комбинация цитокинов - приблизительно 40% некроза. Интересно, что гибели клеток, индуцируемой NO-донором, четко противодействует соединение I, например соль I, (табл.1). Также с-Abl-ингибитор частично уменьшает цитокин-индуцированный некроз островковых клеток. Частота апоптозных клеток составляет менее 10% во всех группах (результаты не представлены).
Таблица 1. Соединение I, например соль I, защищает островковые клетки от NO- и цитокин-индуцированной гибели. Результаты являются средними ± SEM (средняя ошибка) для трех независимых наблюдений.
Определяют уровень нитрита из клеток, инкубированных с комбинацией цитокинов в течение более 24 ч, вместе или без 1 или 10 мкмолей соединения I, например соли I. Соединение I, например соль I, не ингибирует цитокин-индуцируемое образование оксида азота (фиг.1). И, напротив, уровень образования оксида азота в присутствии соли I выше, возможно, из-за более высокой жизнеспособности обработанных солью I клеток, более 35% нитрита высвобождается из клеток, обработанных цитокином в сочетании с соединением I, по сравнению только с одним цитокином.
Проводят исследование с целью установить, защищает ли соединение I от диабетогенного препарата стрептозотоцина in vitro. При концентрации стрептозотоцина 0,4 ммолей защита высокая, существенная, в то время как при концентрации стрептозотоцина 0,75 ммолей соединение I защищает слабо (табл.2). При концентрации стрептозотоцина 0,6 ммолей защитный эффект соединения I выражается средним значением.
Таблица 2. Соединение I, например соль I, защищает от стрептозотоцин-индуцированной гибели островковых клеток. Соединение I (10 ммоль) добавляют за 24 ч до внесения стрептозотоцина. Островковые клетки собирают и фотографируют через шесть часов после добавления стрептозотоцина. Некротические (красные или розовые нефрагментированные ядра) подсчитывают и выражают в виде процента от общего числа клеток. Результаты показывают процент некротических клеток, выраженный средними значениями ± SEM трех независимых наблюдений. ***, ** и * обозначают р<0,001, 0,01 и 0,05 с применением парного t-критерия Стьюдента.
Для исследования, регулирует ли соединение I, например соль I, также клеточную гибель применительно к островковым клеткам человека, последние инкубировали в течение 24 ч с добавлением или без добавления соединения I, например соли I, (10 мкмолей), DETA/NO (2 ммоля) и брефелдина А (10 ммолей). Аналогично наблюдавшемуся ранее для островковых клеток крысы островковые клетки человека также частично защищены от токсичных уровней NO (фиг.2). Таким образом, соль I частично противодействует брефелдин В-индуцированной гибели островковых клеток (ER-стрессу).
Для того чтобы исследовать, регулирует ли с-Abl и/или защищает ли соединение I, например соль I, от стрептозотоцин-индуцированного диабета in vivo, применяют следующую методику: мужские особи мышей NMRI с массой примерно 25 г приобретают на фирме Taconic M&B, Sollentuna, Швеция. Животные имеют свободный доступ к водопроводной воде и гранулированному корму в течение времени исследования. Подстилку меняют еженедельно. Массу и уровень глюкозы в крови определяют с применением прибора Pen Sensor (фирма MediSense, Уолтем, Массачусетс, США) перед экспериментом. Животным принудительно скармливают 200 мкл соединения I, например соли I, растворенной в 0,9% NaCl в количестве 200 мг/кг массы тела в течение трех суток подряд (сутки -1, 0 и 1). В сутки 0 мышам вводят в хвостовую вену 120 или 160 мг/кг массы тела стрептозотоцина (фирма Sigma-Aldrich Co, Сент-Луис, МО, США). Стрептозотоцин растворяют в 0,9% NaCl непосредственно перед инъекцией. Массу и уровень глюкозы в крови определяют на 0, 1, 2, 3, 5, 7, 9 сутки по образцам крови, собранным из хвоста. На 9 сутки животных забивают цервикальным смещением. Местный Комитет по этическому отношению к животным (Тиерп, Швеция) санкционирует все эксперименты с животными.
Лечение соединением I полностью защищает от инъекции 120 мг/кг стрептозотоцина (табл.4). Кроме того, соединение I, например соль I, частично защищает от более высоких доз стрептозотоцина (160 мг/кг) (табл.3).
Таблица 3. Эффект соединения I, например соли I, на диабет у мышей, индуцированный стрептозотоцином в количестве 160 мг/кг. Мышам NMRI принудительно скармливают соединение I в количестве 200 мг/кг раз в сутки (сутки -1, 0 и 1). В сутки 0 мышам вводят 160 мг/кг стрептозотоцина внутривенно и уровень глюкозы в крови определяют на сутки, показанные на фиг.*, ** и *** обозначают р<0,05, 0,01 и 0,001 относительно STZ с применением парного t-критерия Стьюдента. Число наблюдений составляет 5 (физиологический раствор и соединение I) и 10 (STZ и STZ + соединение I).
Таблица 4. Влияние соединения I на диабет у мышей, индуцируемый стрептозотоцином в количестве 120 мг/кг. Мышам NMRI принудительно скармливают соединение I в количестве 200 мг/кг раз в сутки (сутки -1, 0 и 1). В сутки 0 мышам вводят 120 мг/кг стрептозотоцина внутривенно и уровень глюкозы в крови определяют на сутки, показанные на чертежах. * и *** обозначают р<0,05 и 0,001 соответственно при сопоставлении относительно STZ-группы (t-критерий Стьюдента). Число наблюдений составляет 10.
План исследований и методы
1. Установить дополнительные сигналы гибели и факторы стресса, которые стимулируют гибель бета-клеток человека посредством ингибируемых соединением I путей метаболизма. Островковые клетки человека обрабатывают 10 мкмолями соли I, например, соединения I, и гибель островковых клеток определяют в ответ на следующие цитотоксические агенты: пероксид водорода (150 мкмолей; окислительный стресс), стауроспорин (200 нмолей, РКС- ингибирование), FCCP (5 мкмолей; разобщение и изменение митохондриальной мембранной проницаемости), брефелдин А (10 мкмолей, ER-стресс), тапсигаргин (200 нмолей, ER-стресс и повышенное содержание Са2+) и доксорубицин (2 мкмоля, повреждение ДНК). Гибель клеток визуализируют витальным окрашиванием с пропидиум иодидом и бисбензимидом с последующей флуоресцентной микроскопией. Используют островковые клетки в двойных группах по 10. Эта процедура позволяет количественно оценивать и апоптоз, и некроз в интактных островковых клетках. Комбинируют методику витального окрашивания с ХТТ-анализом (упрощенная версия МТТ-анализа), что в результате дает простой и быстрый способ скрининга жизнеспособности островковых клеток.
2. Изучить, влияет ли соединение I на развитие диабета I типа на моделях животных. Согласно описанному выше, соединение I, например соль I, защищает от однодозовой инъекции стрептозотоцина. Для поддержания этого наблюдения оценивают роль с-Abl в развитии диабета при многократном введении стрептозотоцина на моделях мышей линии c57KSJ/черные. Ежедневное лечение соединением I (200 мг/кг соединения I в 200 мкл 0,9% NaCl) начинают за сутки до первого введения стрептозотоцина (ежедневные инъекции низкой дозы 40 мг/кг в течение 5 суток) и продолжается в течение десяти суток или двух недель, когда обнаруживается диабет. Лечение оценивается ежедневными измерениями уровня глюкозы в крови. После десяти суток или двух недель мышей забивают, поджелудочные железы удаляют и фиксируют для проведения иммуногистохимического и морфометрического анализа. Оценивают воспаление островковых клеток и массу бета-клеток.
Исследуют роль с-Abl в возникновении рецидива заболевания у мышей, заболевание диабетом у которых не связано с ожирением (линия мышей NOD). Применяют протокол, аналогичный приведенному выше протоколу. Однако в этом случае лечение соединением I проводят на самках больных диабетом NOD-мышей. Спустя сутки после первого введения соединения I путем принудительного кормления 300 островковых клеток, выделенных из молодых NOD-мышей, трансплантируют под почечную капсулу. Спустя семь суток определяют уровень глюкозы и мышей забивают. В этой временной точке активированные иммунные клетки разрушают большинство трансплантированных бета-клеток; определяют любой выраженный эффект соединения I на выживание бета-клеток. Трансплантаты извлекают и фиксируют для анализа.
В-третьих, воздействие соединения I изучают на природном курсе диабета у NOD-мышей. Самкам NOD-мышей в возрасте 4-5 недель, когда они еще не болеют диабетом или имеют очень слабо выраженный диабет, вставляют подкожно миниосмотические насосы Alzet, которые высвобождают по 0,25 мкл/ч в течение четырех недель концентрированное соединение I или только один наполнитель. После четырех недель мышей забивают, извлекают поджелудочные железы и фиксируют для иммуногистохимического и морфометрического анализа. Оценивают степень инсулита и массу бета-клеток.
Учитывая, что возможность фармакологического ингибирования с-Abl может быть неясной, пробуют применить генетический подход. С этой целью островковые клетки выделяют из мышей линии c57ASJ/черные и из NOD-мышей и диспергируют островковые клетки обработкой трипсином. Островковые клетки трансдуцируют рекомбинантным аденовирусным вектором при множественности заражения 5 MOI, который направляет транскрипцию с-Abl-специфичной молекулы si-PHK. В качестве контроля используют аденовирусный вектор, который кодирует зацепляющую последовательность si-PHK. Затем клетки реагрегируют в течение 5 суток in vitro перед импланатацией под почечную капсулу сингенной мыши. Мышей лечат и анализируют согласно указанному выше методу.
Возможно, что аденовирусный вектор не подходит для исследований in vivo ввиду присущей ему токсичности и иммунногенности. Конструируют AAV вектор, который экспрессирует ту же анти-с-Abl-si-РНК-конструкцию. Примерно 30% островковых бета-клеток трансдуцируют вектором AAV при диспергировании in vitro (результаты не представлены). Это существенно ниже, чем эффективность трансдукции, полученной с аденовирусным вектором, но достаточно высоко, чтобы позволить оценить роль с-Abl в деструкции бета-клеток in vivo.
Материалы и методы
Островковые клетки человека. Островковые клетки человека культивируют путем свободной флотации в стандартных условиях культивирования (5,6 ммолей глюкозы в RPMI 1640 + 10% ФТС).
Проточная цитометрия и сортировка клеток. Эффективность легко оценивают с применением проточного цитометра (прибор FACSCalibur, фирма Becton-Dickinson), способного сортировать клетки с применением дестабилизированной формы зеленого флуоресцентного белка в качестве репортера и одновременной сортировкой трансфектированных клеток для последующего эксперимента или трансплантации. Таким образом, отпадает необходимость убеждаться в генерации выборочных клонов клеток инсулиномы, которые стабильно экспрессируют трансген (проблемы с вариацией клонов). Можно применять временно трансфектированные клетки, отделенные от нетрансфектированных клеток. Кроме того, проточный цитометр также оценивает жизнеспособность клеток (окрашивание пропидиум иодидом) и апоптоз (антиактивированное каспаза-3-антитело). Проточный цитометр также применяют для сортировки бета-клеток грызунов, анализа клеточного цикла, митохондриального мембранного потенциала, образования свободных радикалов кислорода и иммунофлуоресцентных исследований (инсулин, глюкагон, Вс1-2).
Пример 2. Капсулы с метансульфонатом 4-[(4-метил-1-пиперазин-1-илметил)-N-[4-метил-3-[4-(3-пиридинил)-2-пиримидинил]амино]фенил]бензамида, бета-кристаллическая форма
Капсулы, содержащие 119,5 мг соли I, что соответствует 100 мг соединения I (свободному основанию) в качестве активного начала, получают в следующей композиции:
Капсулы приготавливают смешиванием компонентов и наполнением смесью твердых желатиновых капсул, размер 1.
Пример 3. Исследования механизмов, лежащих в основе индуцируемой соединением I защиты от гибели бета-клеток и диабета in vivo
Предпосылки создания изобретения. Известно, что соединение I ингибирует с-Abl повсеместно экспрессируемую белковую тирозинкиназу с примерной молекулярной массой 145 кДа. Показано, что в физиологических условиях с-Abl участвует в регуляции цитоскелетных функций, например, миграции и в клеточной структуре, а также в развитии клеточного цикла. Однако, когда клетки подвергают различным формам стресса, с-Abl сильно активируется, что приводит к остановке клеточного цикла и апоптозу.
Ранее полученные результаты С-Abl экспрессируется в bTC-6-клетках и изолированных островковых клетках крыс, и ингибирование активности с-Abl под воздействием фармакологического агента соединения I приводит к защите от гибели бета-клеток, индуцированной стрептозотоцином, провоспалительными цитокинами или донорами оксида азота. Соединение I, например, соль I, является селективным ингибитором, используемым в клинике для лечения CML. Известно, что кроме с-Abl соединение I ингибирует ABL-онкогены, c-KIT, PDFG-бета-рецептор и с-Abl-гомолог ARG. Таким образом, необходимо показать, что эффекты соли I специфически опосредуются через ингибирование с-АbA. Для этого клетки bTC-6 обрабатывают либо зацепляющей siPHK, либо siPHK, специфичной для с-Abl. siPHK вводят в клетки с применением реагента липофектамина. Затем клетки выдерживают в течение 1 или 3 суток, после чего выделяют тотальную РНК. к-ДНК синтезируют из РНК и применяют для ПЦР-амплификации с использованием праймеров, специфичных для с-Abl (35 циклов) и b-актина, например, бета-актина (20 циклов). ПЦР-продукты отделяют на агарозном геле и визуализируют окрашиванием этидиум бромидом. Спустя 24 ч после обработки siPHK в клетках не наблюдают зону с-Abl (не представлено). Однако аосле 72 ч появляется зона с-Abl. Эти результаты показывают, что siPHK, направленная против A-Abl, опосредует нокаут посредника через РНКи-механизм, и что эффект в быстрой пролиферации b-TC-6-клеток является только временным (данные не представлены). Установив, что с-Abl-мРНК-уровни могут быть уменьшены с помощью РНКи-методики, далее исследуют, дефицитны ли b-ТС-6-клетки в отношении с-АbA-м-РНК, отвечающей на комбинацию IL-1β, IFN-γ и TFN-α с повышенной гибелью клеток. В отличие от ситуации, наблюдаемой в первичных островковых клетках, bTC-6-клетки погибают в ответ на цитокины, преимущественно в результате апоптоза. Более того, цитокин-индуцированная гибель bTC-6-клеток сильно нейтрализуется с-Abl-специфичной siPHK после двух или трех суток лечения (фиг.3). Это показывает, что предположительно медленный обмен с-Аbl-белка приводит к задержке эффекта от лечения с помощью siPHK. Но более важно то, что согласно полученным данным защита, индуцируемая солью I, против NO-донора и комбинации цитокинов опосредуется ингибированием с-Abl.
Связь между с-Abl и различными МАР-киназами. Исследовали связь между с-Abl и различными МАР-киназами р38, JNK и ERK, которые могут действовать в качестве эффекторов с-Abl, расположенных ниже по цепи. С этой целью островковые клетки крыс предварительно инкубируют в течение 24 ч с 10 мкмолями соединения I и затем обрабатывают DETA/NO (2 ммолями) и комбинацией IL-1β, IFN-γ и TNF-α в течение 20 мин. Затем островковые клетки анализируют для определения фосфорилирования р38, JNK и ERK 1/2 с применением фосфоспецифичных антител и иммуноблоттинга. Обработка соединением I, например солью I, частично (25-45%) нейтрализует DETA/NO-индуцированную активацию р38, JNK и ERK и увеличивает цитокин-индуцируемую МАРК-активацию (табл.5 и 6).
Таблица 5. Эффекты соединения I, например соли I, на активацию DETA/NO- и цитокин-индуцируемых р38-, JNK и ERK. Выделенные островковые клетки крыс предварительно инкубируют в течение 24 ч с 10 мкмолями соединения I и затем обрабатывают в течение 20 минут DETA/NO или цитокинами IL-1β (50 ЕД/мл) и IFN-γ (1000 ЕД/мл). ERK, JNK и р38-фосфорилирование определяют иммуноблоттингом и выражают относительно общих количеств ERK, JNK и р38. Результаты выражают в виде процента от контроля для 4 независимых наблюдений.
** и * обозначают р<0,01 и р<0,05 соответственно при сравнении с соответствующей группой без применения соединения I с использованием 2-стороннего вариационного анализа ANOVA и t-критерия Стьюдента.
Таблица 6. Результаты, представленные в табл.5, пересчитаны таким образом, что эффекты соединения I выражены в процентах относительно соответствующих групп, в которых не было добавления соединения I.
Эти результаты подтверждают, что цитокин-индуцируемое образование оксида азота активирует JNK и р38, по меньшей мере, частично, через пути метаболизма с-Abl, и что это приводит к гибели бета-клеток. С другой стороны, раннее повышение активности JNK и р38, которое имеет место в ответ на цитокины, вероятно, подавляется с-Abl. Тем не менее в этой ситуации возможно, что первый пик в цитокин-индуцируемой активности JNK и р38 представляет физиологический ответ, который приводит к измененной генной экспрессии и повышенной пролиферации, а не к апоптозу per se. Например, предполагают, что цитокин-активация JNK и р38 участвует в последующей экспрессии iNOS-гена. В этом контексте наблюдаемое с-Abl-опосредованное подавление JNK и р38 хорошо объясняет повышенное образование оксида азота, наблюдаемое в островковых клетках, обработанных цитокинами и соединением I.
Из этих данных следует, что с-Abl выступает в роли сенсора стресса и внешних сигналов гибели, и с-Abl-активация может приводить к фосфорилированию и активации JNK и р38 МАР-киназ и, в конце концов, к гибели бета-клеток.
Дополнительные эксперименты
1. Изучить экспрессию с-Abl в бета-клетках. Экспрессия с-Abl мРНК может быть оценена по реальному времени-ПЦР. Уровни с-Abl мРНК островковых клеток сравнивают с их уровнем в других тканях. Флуоресцентные зонды, специфичные для с-Abl, приобретают на фирме TIBMOLBIOL Syntheselabor (Берлин, Германия), флуоресцентные сигналы оценивают количественно в отношении с-Abl-сДНК- стандартной кривой с применением прибора Lightcycler. Количество молекул с-Abl-мРНК стандартизируют по отношению к молекулам b-актин-мРНК. Содержание с-Abl-мРНК в островковых клетках человека сравнивают с их содержанием в печени, мышцах, почках, селезенке, мозге и легких. Параллельно количественно определяют экспрессию с-Abl-аналогичной тирозинкиназы ARG, которая может действовать аналогичным образом на с-Abl. В этом контексте определяют, влияют ли на уровень с-Abl-мРНК цитокины, окислительный стресс и ER-стресс. Островковые клетки человека обрабатывают IL-1β (25 ЕД/мл) + IFN-γ (1000 ЕД/мл) + TNF-α (1000 ЕД/мл), 100 ммолями пероксида водорода или брефелдином (10 ммолями) в течение трех часов и затем анализируют на предмет с-Abl-мРНК-экспрессии методом ПЦР реального времени.
2. Изучить, фосфорилируется ли с-Abl в ответ на стресс бета-клеток. Стабильные линии bTC-6-клеток, которые избыточно экспрессируют A-Abl дикого типа, генерируют путем липофекции клеток плазмидой pCDNA3/ с-Abl (полученной из Ludwig Institute, Университет Упсалы) с последующим отбором по устойчивости к генетицину. Клетки bTC-6 с повышенной экспрессией с-Abl затем обрабатывают IL-1, брефелдином А и DETA/NO в течение 20, 60, 360 мин для выяснения, фосфорилируется ли с-Abl в ответ на цитокины, ER-стресс и оксид азота. Затем клетки гомогенизируют в присутствии фосфатазных ингибиторов и с-Abl подвергают иммунопрецепитации с применением К-12 анти-с-Abl-антитела (фирма Santa Cruz). После PAGE и переноса на нейлоновый фильтр с-Abl-зоны анализируют для определения тирозин-фосфорилирования при аминокислоте 245 и полного тирозин-фосфорилирования с двумя фосфоспецифичными с-Abl-антителами (Туr 245 и Thr 735), которые можно приобрести на фирме Cell Signaling Technology, и фосфотирозиновым антителом 4G10. Активность с-Abl повышается, когда аминокислотные остатки Туr 245 и Thr 735 гиперфосфорилированы.
3. Изучить, влияет ли стресс бета-клеток на субклеточную локализацию с-Abl. Клетки ВТС-6, повышенно экспрессирующие с-Abl, выращивают на покровном стекле и затем обрабатывают цитокинами, брефелдином А и донором окида азота в течение 6 ч. После фиксации, блокирования и повышения проницаемости клетки анализируют конфокальной микроскопией с применением красителя Mitotracker green (фирма Molecular Probes), который окрашивает митохондрии в зеленый цвет, и К-12 с-Abl-антитела (фирма Santa Cruz), которое с родамин-конъюгированным вторичным антителом является красителем с-Abl красным. Если происходит изменение локализации с-Abl из ER в митохондрии, окрашенный образец изменяет окраску от раздельно красной и зеленой исключительно на желтую.
4. Идентифицировать мишени с-Abl, расположенные ниже по цепи. С этой целью получают CbTC-6-клетки, которые временно повышенно экспрессируют дикий тип или конститутивно активную форму с-Abl. Клетки ВТС-6 липофицируют (липофектамин + липофектамин плюс) с рсДНК3/с-Abl-вектором и GFP-вектором экспрессии. Это приводит к 20% GFP-положительных клеток, которые обогащены более чем на 75% FACS. Отсортированные клетки высевают в чашки и культивируют в течение 24 ч и затем анализируют для определения фосфорилирования целевых мишеней ERK, JNK, p38, Ikb, p53 и АКТ (эффектор PI3K, находящийся ниже по цепи). За 20 и 120 мин перед анализом клетки стимулируют доксорубицином (ядерная активация с-Abl) или DETA/NO (цитоплазменная активация с-Abl) с добавлением или без добавления соли I, например соединения I. Фосфорилирование (ser/thr) предполагаемых белков-мишеней анализируют иммуноблоттингом с применением коммерческих фосфо-специфичных антител (фирма Cell Signal Technology). Это показывает, фосфорилировались ли и активировались ли целевые эффекторы в ответ на с-Abl-активацию. Анализируют уровни Bcl-2, Bcl-XL и Aph2 с применением традиционной методики вестерн-блоттинга. В некоторых случаях иммунопреципитация целевых белков бывает необходима для повышения чувствительности иммуноблоттинга. Для тирозин-специфичного фосфорилирования целевые эффекторы подвергают иммунопреципитации и анализируют иммуноблоттингом с применением РY20-антифосфотирозин-антитела.
5. Изучить взаимодействие между с-Abl и Shb. Эксперименты проводят с целью понять предполагаемое взаимодействие между с-Abl и адапторным белком Shb. Shb является SH2-доменом, содержащим белок с обогащенными пролином мотивами на N-конце, центральный РТВ (фосфотирозин-связывающий)-домен, несколько потенциальных сайтов тирозин-фосфорилирования и С-концевой SH2-домен; известно, что он играет роль в образовании сигнального комплекса в ответ на активацию тирозинкиназы. Интересно, что склонность к апоптозу у Shb-сверхэкспрессируемых бета-клеток повышенная. В самом деле, экспрессируемый SHB трансгенных мышей под контролем промотора инсулина крыс проявляет повышенную степень апоптоза, когда островковые клетки культивируют без сыворотки или в присутствии цитотоксичных цитокинов. Принимая во внимание предыдущее сообщение, показывающее, что Shd, член семейства Shb, связывается и взаимодействует с с-Abl, возможно, что с-Abl действует через взаимодействия с Shb в бета-клетках. Для этого исследования клетки временно трансфектируют для сверхэкспрессии с-Abl, Shb или Shb-мутанта, обрабатывают перванадатом и затем иммунопреципитируют с помощью анти-Shb-антител а. Затем проводят иммуноблоттинг на иммунопреципитатах для анализа уровня с-Abl и Shb и тирозин-фосфорилирования с-Abl, совместно преципитированного с Shb. Предварительные результаты показали, что с-Abl совместно преципитируется с Shb и, напротив, что сверхэкспрессия с-Abl приводит к повышенному Shb-фосфорилированию (данные не представлены). Эти результаты подтверждают мнение, что Shb является субстратом для с-Abl-киназы.
Для дальнейшего понимания взаимодействия между с-Abl и Shb проводят эксперименты с гибридными белками. GST, GST-ShbSH2 и GST-ShbPTB/обогащенный пролином домен гибридные белки позволяют взаимодействовать с COS-клеточными гомогенатами, содержащими высокий уровень с-Abl. Реакции проводят со стимуляцией перванадатом или без нее, т.е. с целью установить значение с-Abl-фосфорилирования тирозина и добавления фосфотирозина, т.е. установить важность взаимодействия SH2-домена с фосфотирозиновым остатком. Полученные продукты анализируют для определения с-Abl и фосфо-с-Abl методом иммуноблоттинга. Эти эксперименты показывают, какие домены Shb необходимы для связывания с нефосфорилированной или фосфорилированной с-Abl. Соответствующие эксперименты с применением гибридного белка с-Abl (c-Abl-SH2 и c-Abl-SH3) проводят для выяснения, какой домен является ответственным за связывания с Shb.
Для выяснения опосредует ли Shb-c-Abl-взаимодействие повышенную склонность Shb-сверхэкспрессируемых островковых клеток к преодолению апоптоза в ответ на различные вредные стимулы, выделяют островковые клетки из Shb-трансгенных мышей и обрабатывают цитокинами, DETA/NO и стрептозотоцином с проведением предварительной обработки соединением I или без обработки. Апоптоз и некроз оценивают количественно и данные, полученные в опытах с трансгенными мышами, сравнивают с данными, полученными параллельно на мышах в контроле. Если повышенные уровни апоптоза и некроза в Shb-островковых клетках нормализует соединение I, например соль I, возможно, что Shb-c-Abl-взаимодействие может быть важным путем метаболизма, регулирующим апоптоз.
Материалы: РНКи. Исследования инициируют, ориентируясь на выключение генной экспрессии в бета-клетках с применением РНКи-методики. Короткие интерферирующие молекулы РНК (siPHK) закупают на фирме Dharmacon Research по цене 300-600 $ за пару РНК-олигонуклеотидов. При применении FITC-меченных siPHK оказалось, что siPHK эффективно вводится в инсулин-продуцирующие клетки при применении липофектамина и липофектамина 2000 (результаты не представлены). К сожалению, эффект липосомной доставки siPHK является только временным. Для получения рекомбинантных аденоассоциированных (AAV) векторов применяют AAV-систему без хелпера (фирма Stratagene). Этот набор содержит плазмиды для получения экспрессирующих бета-галактозидазу AAV-векторов, которые применяют для предварительной оценки эффективности трансфекции. Работа с вирусными векторами была санкционирована Агентством Шведского Правительства Arbetarskyddstyrelsen.
Метод полимеразной цепной реакции в реальном времени (ПЦР-РВ). Инструмент светоциклер (фирма Roche) является циклером ПЦР реального времени. Этот аппарат позволяет быстро и точно количественно определять молекулы мРНК и поэтому подходит для исследований генной экспрессии.
Применяют методики конфокальной микроскопии и электронной микроскопии.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2447891C2 |
| КОМБИНАЦИИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2449788C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ИНГИБИТОРЫ Bcr-Abl/c-Kit/PDGF-R TK, ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2452492C2 |
| ЛЕЧЕНИЕ ТУБЕРОЗНОГО СКЛЕРОЗА | 2007 |
|
RU2473343C2 |
| ЛЕЧЕНИЕ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ | 2006 |
|
RU2487711C2 |
| ИНГИБИТОРЫ КИНАЗ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2442777C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2383545C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2006 |
|
RU2411242C2 |
| НОВОЕ ПРИМЕНЕНИЕ АГОНИСТОВ ПЕЧЕНОЧНОГО РЕЦЕПТОРА Х | 2006 |
|
RU2417078C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ АНТИАНГИОГЕННЫЕ СРЕДСТВА И TNF-α | 2002 |
|
RU2316337C2 |
Изобретение относится к применению ингибитора с-Ab1-, PDGF-R- или с-kit-тирозинкиназы 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-
бензамида или его фармацевтически приемлемых солей для получения лекарственного средства для предупреждения или для лечения диабета (варианты), например диабета I типа, диабета II типа, и к упаковке данного вещества для введения пациентам, болеющим диабетом. Показано новое свойство соединения предотвращать гибель вырабатывающих инсулин бета-клеток поджелудочной железы in vitro и in vivo. 4 н. и 4 з.п. ф-лы, 3 ил., 6 табл.
1. Применение 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамида или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предупреждения диабета.
2. Применение 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамида или его фармацевтически приемлемой соли для получения лекарственного средства для лечения диабета.
3. Применение 4-(4-метилпиперазин-1-илметил)-N-
[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамида или его фармацевтически приемлемой соли для получения лекарственного средства для предупреждения диабета.
4. Применение по одному из пп.1-3, в котором диабетом является диабет I типа.
5. Применение по одному из пп.1-3, в котором диабетом является диабет II типа.
6. Применение по п.4, в котором 4-
(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамид находится в форме монометансульфонатной соли.
7. Применение по п.5, в котором 4-(4-метилпиперазин-1-илметил)-N-
[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамид находится в форме монометансульфонатной соли.
8. Упаковка лекарственного средства, содержащая 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]-бензамид или его фармацевтически приемлемую соль, вместе с инструкциями, для введения пациентам, болеющим диабетом, например диабетом I типа, диабетом II типа.
Приоритет по пп.4, 6 от 27.05.2003, по пп.1-3, 5, 7 от 06.02.2004, по п.8 - от 26.05.2004.
Приоритет по пунктам:
27.05.2003 - пп.4, 6;
06.02.2004 - пп.1-3, 5, 7;
26.05.2004 - п.8.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Гидроабразивный перфоратор | 1975 |
|
SU564409A1 |
| АЖГИХИН И.С | |||
| Технология лекарств | |||
| Сплав для отливки колец для сальниковых набивок | 1922 |
|
SU1975A1 |
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия | |||
| - М.: Высшая школа, 1993, ч.1, с.363 | |||
| RU 96108256 А, 10.07.1998 | |||
| Малая медицинская энциклопедия | |||
| - М.: Большая российская энциклопедия, 1992, т.3, с.101-103. | |||
Авторы
Даты
2009-08-27—Публикация
2004-05-26—Подача