Изобретение относится к области медицины, конкретно к гематологии, и может быть использовано для фармакологической коррекции нарушений в системе крови, развивающихся при цитостатическом воздействии.
Практически все цитостатические препараты при клиническом применении небезопасны для организма и оказывают выраженное миелодепрессивное действие, которое характеризуется подавлением отдельных либо всех ростков кроветворения на разных уровнях дифференцировки. Все это в значительной мере ограничивает применение противоопухолевых препаратов в онкологической практике [1].
Известен способ коррекции нарушений гранулоцитопоэза после цитостатического воздействия под влиянием препарата рекомбинантного гранулоцитарного колониестимулирующего фактора (Г-КСФ) [2].
Недостатком способа являются малая эффективность препарата гранулоцитарного КСФ при краткосрочном применении и осложнения при его длительном введении, что во многом ограничивает применение препаратов на основе гранулоцитарного КСФ в клинике [3].
Перспективным для лечения цитостатической миелосупрессии является комплексное влияние на кроветворную ткань - восстановление структурно-функциональной целостности костного мозга и воздействие на пул предшественников гранулоцитопоэза, что, предположительно, будет препятствовать развитию депрессии гранулоцитарного ростка кроветворения и усиливать эффект препарата гранулоцитарного КСФ.
Задачей, решаемой данным изобретением, является повышение эффективности способа и уменьшение побочного действия гранулоцитарного колониестимулирующего фактора.
Поставленная задача решается тем, что резерпин в дозе 2 мг/кг вводят за 30 мин до введения цитостатика, а на следующие сут после цитостатического воздействия вводят препарат рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор в дозе 100 мкг/кг ежедневно однократно в течение 5 дней.
Совместное применение резерпина и Г-КСФ стало возможным благодаря выявленному авторами новому свойству резерпина потенцировать действие Г-КСФ и предотвращать развитие депрессии гранулоцитарного ростка кроветворения, развивающейся при цитостатических миелосупрессиях.
Новым в предлагаемом способе является последовательное использование резерпина в дозе 2 мг/кг, цитостатического препарата и гранулоцитарного колониестимулирующего фактора.
Алкилирующий цитостатический препарат циклофосфан (Р №000459/01-2001) обладает широким противоопухолевым спектром действия и оказывает более мягкое действие, чем другие аналогичные препараты. Имеются данные о применении алкилирующего агента при гломерулонефритах, красной волчанке, ревматоидном артрите [3]. Известно, что циклофосфан токсичен преимущественно в отношении гранулоцито- и эритропоэза [4]. Механизм угнетения гемопоэза циклофосфаном заключается, прежде всего, в поражении пролиферирующих клеток костного мозга и истощении пула кроветворных прекурсоров [4].
Основным фармакологическим свойством резерпина является его симпатолитическое действие, обусловленное ускоренным выделением катехоламинов из гранулярных депо пресинаптических нервных окончаний. Высвобожденные катехоламины инактивируются моноаминоксидазой, что ведет к уменьшению выхода катехоламинов в синаптическую щель [3]. Действие резерпина распространяется и на ЦНС. Первоначально до появления современных нейролептиков препарат применяли для лечения психических заболеваний. В связи с созданием новых эффективных и безопасных препаратов резерпин в настоящее время используют в качестве антигипертензивного средства в ранних стадиях артериальных гипертензий, он также входит в состав ряда комбинированных лекарственных средств и применяется в качестве фармакологического агента при экспериментальных исследованиях [3]. В эксперименте показана эффективная коррекция резерпином нарушений в системе кроветворения при экспериментальных неврозах [5].
Основные показания для назначения гранулоцитарного КСФ: профилактика и лечение разных видов нейтропений (и предупреждение связанного с ними снижения устойчивости к инфекционным осложнениям), профилактика и лечение осложнений у онкологических больных, подвергающихся миелосупрессивной химиотерапии [3]. Однако применение гранулоцитарного КСФ в клинике ограничено вследствие наличия у него спектра побочных эффектов (болезненность мышц, суставов, лихорадка, повышение давления, усталость, потеря аппетита), кроме того, данный гемопоэтин относится к разряду раннедействующих и соответственно не отличается особенной избирательностью действия [3, 6]. В последнее время стали появляться новые сведения о побочных эффектах и осложнениях после курсов Г-КСФ: у здоровых доноров в периферической крови обнаруживались тетраплоидные клетки миелоидного ряда, описан случай тяжелой тромбоцитопении, зафиксирован случай острого миелолейкоза, в эксперименте у мыши возникло миелопролиферативное заболевание [7]. Гемостимулирующий эффект препарата Г-КСФ обусловлен непосредственной активацией пролиферации гранулоцитарных предшественников и гранулоцитарно-макрофагальных прекурсоров и созревания нейтрофильных гранулоцитов [2].
Отличительные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста. Идентичной совокупности признаков не обнаружено в проанализированной патентной и научно-медицинской литературе.
Способ может быть использован для повышения эффективности лекарственной химиотерапии. Исходя из вышеизложенного заявляемое изобретение соответствует критериям патентоспособности изобретения «Новизна», «Изобретательский уровень» и «Промышленная применимость».
Предлагаемый способ изучен в экспериментах на мышах-самцах линии CBA/CaLac в количестве 380 штук, массой 20-22 г. Животные первой категории, конвенциональные линейные мыши, получены из питомника отдела экспериментального биомедицинского моделирования ГУ НИИ фармакологии ТНЦ СО РАМН (сертификат имеется).
Способ осуществляют следующим образом.
У лабораторного животного (мыши) цитостатическую миелодепрессию моделировали однократным внутрибрюшинным введением в 1/3 МПД алкилирующего агента циклофосфана (83 мг/кг). За 30 мин до цитостатического воздействия животным опытных групп однократно внутрибрюшинно вводили симпатолитик резерпин ("Polfa", Польша) в дозе 2 мг/кг. В проведенных ранее экспериментах указанная доза была определена как максимально эффективная. Непосредственно перед использованием препарат растворяли в стерильном физиологическом растворе. Контрольным животным во всех сериях экспериментов в аналогичных условиях вводили эквивалентный объем физиологического раствора (0,2 мл).
На следующий день после введения цитостатика мыши опытных групп получали подкожные инъекции препарата рекомбинантного человеческого гранулоцитарного КСФ нейтростима (ФГУН ГНЦ ВБ «Вектор»), произведенного на основе негликозилированного белка, который вырабатывается оригинальным лабораторным штаммом бактерии E.coli, содержащим плазмиду с полноразмерным геном Г-КСФ человека. Нейтростим растворяли в стерильном фосфатном буфере (рН 7,2) и вводили в дозе 100 мкг/кг ежедневно в течение 5-ти дней. Выбор эффективной дозы Г-КСФ был осуществлен на основании литературных данных об его специфической активности у мышей [8] и подтвержден в отдельной предварительной серии экспериментов. В качестве фона использовали интактных животных.
На 1-7-е сут после цитостатического воздействия у животных определяли показатели периферической крови и костномозгового кроветворения стандартными гематологическими методами, структурно-функциональную организацию костного мозга изучали путем ферментативного выделения гемопоэтических островков и последующей оценки их количественного и качественного состава [9].
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента.
Пример.
В ходе исследований установлено, что циклофосфан значительно снижает число незрелых (1-3 сут) и зрелых (1-5 сут) нейтрофильных гранулоцитов в костном мозге мышей и палочкоядерных (1-3 сут) и сегментоядерных (1-5 сут) нейтрофилов в периферической крови (табл.1, 4). В основе изменений гранулоцитарного ростка кроветворения лежат выраженные нарушения структурно-функциональной организации костного мозга (табл.7). В частности, на 1-5-е сут наблюдается снижение клеточных ассоциаций, содержащих в своем составе стромальную клетку (макрофагнегативные гемопоэтические островки). Изучение цитологических препаратов позволило выявить статистически достоверное снижение числа островков гранулоцитарного типа (1-3, 5-7 сут).
Введение рекомбинантного препарата Г-КСФ приводит к ускорению процессов восстановления миелопоэза, подавленного цитостатиком. Так, препарат увеличивает содержание незрелых (на 2-4 сут) и зрелых (3-5 сут) нейтрофильных гранулоцитов в кроветворной ткани (табл.1, 2). В периферической крови стимулирующий эффект препарата Г-КСФ наблюдается только в отношении сегментоядерных нейтрофилов, их количество увеличивается на 2, 4, 5 сут опыта (табл.4, 5), тогда как количество палочкоядерных нейтрофильных гранулоцитов изменяется либо также как в группе животных, получавших циклофосфан, либо снижается на 5-е сут эксперимента, что связывается нами с ускорением созревания гранулоцитов. Применение препарата Г-КСФ препятствует угнетению под влиянием циклофосфана макрофагнегативных и гранулоцитарных гемопоэтических островков на 2, 3-й сут опыта (табл.7, 8). Однако на 6-и сут их число достоверно снижается по сравнению с контрольной группой (без препарата).
Последовательное совместное использование резерпина и препарата Г-КСФ увеличивает содержание незрелых (на 1-3, 6-7 сут) и зрелых (на 2-7-е сут) нейтрофильных гранулоцитов в костном мозге животных после цитостатического воздействия (табл.1, 3). При этом на 4, 5, 7-е сут опыта наблюдается достоверное увеличение сегментоядерных нейтрофильных гранулоцитов в периферической крови (табл.4-6). Примечательно, что активация гранулоцитарного ростка кроветворения при применении препарата Г-КСФ уступает таковой при совместном использовании резерпина и Г-КСФ (табл.1-6).
Показана способность резерпина совместно с нейтростимом восстанавливать структурно-функциональную целостность кроветворной ткани у мышей, получавших циклофосфан (табл.7-9). Так, при применении препаратов наблюдается продолжительное увеличение содержания макрофагнегативных (1-3, 7 сут) и гранулоцитарных (1-3, 5-7 сут) гемопоэтических островков (табл.9). Следует отметить, что в этой группе стимуляция образования дополнительных очагов гранулоцитарного кроветворения более выражена и по своей продолжительности существенно превосходит таковую в группе животных, получавших препарат Г-КСФ (табл.8-9).
Таким образом, введение резерпина до моделирования цитостатической миелосупрессии с последующим введением препарата рекомбинантного гранулоцитарного колониестимулирующего фактора (нейтростима) препятствует разрушению структурно-функциональной целостности кроветворного ткани и развитию депрессии гранулоцитарного ростка кроветворения, а также способствует нормализации содержания нейтрофильных гранулоцитов в периферической крови. По всем показателям положительный эффект совместного применения резерпина и гранулоцитарного КСФ превосходит эффект коррекции нарушений гранулоцитопоэза препаратом гранулоцитарным КСФ.
Литература
1. Птушкин В.В. Совершенствование методов поддерживающей терапии при проведении цитостатического лечения // Современная онкология. - 2002. - Т.4, №2.
2. Гольдберг Е.Д., Дыгай A.M., Жданов В.В. и др. Механизмы действия гранулоцитарного колониестимулирующего фактора на гемопоэз // Бюл. эксперим. биол. и медицины. - 2005. - Приложение №1. - С.5-13.
3. Машковский М.Д. Лекарственные средства. - 15-е изд., перераб., испр. и доп.- М.: «Новая волна», 2006. - С.453-455, 716-717, 969.
4. Гольдберг Е.Д., Дыгай A.M., Жданов В.В. Роль гемопоэзиндуцирующего микроокружения при цитостатических миелосупрессиях. - Томск, 1999. - С.43-44; 55-57.
5. Гольдберг Е.Д., Дыгай A.M., Провалова Н.В., Скурихин Е.Г., Суслов Н.И. Роль нервной системы в регуляции кроветворения. - Томск: Изд-во Том. ун-та, 2004. - С.87-90.
6. Vial Т., Descotes J. Clinical toxicity of cytokines used as haemopoietic growth factors // Drug Saf. - 1995. - Vol.13. - №6. - P. 371-406.
7. Бигильдеев А.Е., Сац Н.В., Грищук А.Л. и др. Характеристика перевиваемого миелопролиферативного заболевания, развившегося после многократных введений гранулоцитарного колониестимулирующего фактора //Бюл. эксперим. биол. и медицины. - 2008. - Т.145, №2. - С.234-240.
8. Lord B.I., Bronchud M.N., Owens S. The kinetics of human granylopoiesis following treatment with G-CSF in vivo // Proceedings of the National Academy of Sciences of the USA. - 1989. - V. 86. - P. 9499-9503.
9. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. - Томск, 1992. - С.172-173, 208.
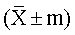
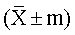
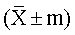
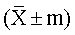
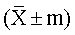
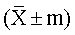
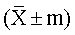
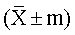
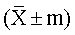
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОСТИ ГЕМОСТИМУЛЯТОРОВ ПРИ ЦИТОСТАТИЧЕСКОЙ МИЕЛОСУПРЕССИИ | 2009 |
|
RU2421720C2 |
| СПОСОБ СТИМУЛЯЦИИ МИЕЛОПОЭЗА | 2008 |
|
RU2366452C1 |
| СПОСОБ ОЦЕНКИ ГРАНУЛОЦИТОПОЭЗСТИМУЛИРУЮЩЕЙ АКТИВНОСТИ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ | 2006 |
|
RU2332667C1 |
| СРЕДСТВО, ПРЕПЯТСТВУЮЩЕЕ РАЗВИТИЮ ДЕПРЕССИИ ЭРИТРОИДНОГО РОСТКА КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКИХ МИЕЛОДЕПРЕССИЯХ | 2007 |
|
RU2351333C1 |
| СПОСОБ СТИМУЛЯЦИИ МИЕЛОПОЭЗА | 2007 |
|
RU2336899C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭРИТРОИДНЫЙ РОСТОК КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКИХ МИЕЛОДЕПРЕССИЯХ | 1992 |
|
RU2061475C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭРИТРОИДНЫЙ И ГРАНУЛОЦИТАРНЫЙ РОСТКИ КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКИХ МИЕЛОДЕПРЕССИЯХ | 1993 |
|
RU2083201C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ГРАНУЛОЦИТАРНЫЙ РОСТОК КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКОЙ МИЕЛОДЕПРЕССИИ | 1999 |
|
RU2157688C1 |
| СРЕДСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2421239C1 |
| СРЕДСТВО, ИЗБИРАТЕЛЬНО СТИМУЛИРУЮЩЕЕ ГРАНУЛОМОНОЦИТОПОЭЗ ПРИ ГИПОПЛАЗИИ КОСТНОМОЗГОВОГО КРОВЕТВОРЕНИЯ, ВЫЗВАННОГО ЦИТОСТАТИКОМ | 1988 |
|
RU2020936C1 |
Изобретение относится к медицине, а именно к гематологии, и касается коррекции депрессии гранулоцитопоэза при цитостатическом воздействии. Для этого через сутки после введения цитостатика вводят рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор (Г-КСФ) в дозе 100 мкг/кг ежедневно однократно в течение 5 дней, причем за 30 минут до введения цитостатика вводят резерпин в дозе 2 мг/кг. Способ обеспечивает эффективную коррекцию гранулоцитопоэза и снижение побочных эффектов от длительного введения Г-КСФ за счет способности резерпина, вводимого в разработанной дозе и режиме, потенцировать эффект Г-КСФ. 9 табл.
Способ коррекции депрессии гранулоцитопоэза при цитостатическом воздействии, заключающийся во введении через сутки после цитостатика препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора в дозе 100 мкг/кг ежедневно однократно в течение 5 дней, отличающийся тем, что предварительно за 30 мин до введения цитостатического препарата вводят резерпин в дозе 2 мг/кг.
| ГОЛЬДБЕРГ Е.Д | |||
| и др | |||
| Механизмы действия гранулоцитарного | |||
| колониестимулирующего фактора на гемопоэз | |||
| Бюл | |||
| эксперим | |||
| биол | |||
| и медицины | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ ЭРИТРОПОЭЗА ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ ЭНЦЕФАЛОПАТИИ | 2005 |
|
RU2302664C2 |
| JP 1085098 A, 30.03.1989 | |||
| УСТАНОВКА ДЛЯ ГИДРОАБРАЗИВНОЙ ОБРАБОТКИ ЗАГОТОВОК | 2015 |
|
RU2605402C1 |
| У ДУТ Е.В | |||
| Коррекция анемического синдрома при миелоингибирующих воздействиях | |||
| Автореф | |||
| дис | |||
| д.м.н | |||
| - | |||
Авторы
Даты
2009-09-10—Публикация
2008-05-19—Подача