Изобретение относится к области нанотехнологии и конкретно касается способа получения наноразмерных частиц халькогенидных материалов, например материалов состава AIIBVI, где АII - металл подгруппы цинка (Zn, Cd или Hg), BIV - халькоген (S, Se, Те).
Соединения типа АIIBVI уже более полувека занимают важное место в полупроводниковой электронике [1]. Их используют для создания приемников излучения, солнечных элементов, полупроводниковых источников света, модуляторов, волноводов, лазерных окон, магниторезисторов, видиконов и других функциональных элементов электронных устройств и приборов [1, 2]. Исследования последних 10-15 лет показали, что при характеристических размерах полупроводниковых частиц меньше 10 нм многие их физико-химические свойства существенно отличаются от аналогичных свойств макроскопических объектов [3]. Поэтому миниатюризация функциональных элементов микросхем до наноуровня требует применения новых технологий, прежде всего в полупроводниковом материаловедении. Существующие подходы в этом направлении проанализированы в обзорах [3, 4].
Наиболее часто для получения наночастиц полупроводниковых материалов используют химический синтез, прежде всего с применением процессов конденсации из растворов. Однако универсальных подходов для всех типов соединений АIIBVI при этом методе не существует. Так, для получения сульфидов ZnS и CdS часто используют сероводород [5]. Применение для таких целей H2Se и тем более Н2Те в силу их труднодоступности, токсичности и неустойчивости весьма проблематично. Использование водных растворов Na2S (Na2Se или Na2Te) сталкивается с трудностями регулирования размеров наночастиц [6]. С этой целью в реакционную систему добавляют тиолы (н-октантиол, тиофенол, бензилмеркаптан и др.) [4, 7]. Однако тиолы легко окисляются в присутствии воздуха до дисульфидов [8], а селенолы (RSeH) и еще в большей степени теллуролы (RTeH) относятся к крайне труднодоступным и чрезвычайно неустойчивым соединениям [9], поэтому их использование для стабилизации наночастиц селенидов и теллуридов практически не возможно и, по-видимому, до сих пор не применялось.
Для получения халькогенидных наноразмерных полупроводниковых материалов перспективным является использование в качестве сырья халькогенов в элементном состоянии. В этом состоянии все три халькогена доступны, устойчивы при хранении, практически не токсичны, не обладают запахом, легко получаются в достаточно чистом виде.
Однако прямая реакция S, Se или Те, например, с хлоридом кадмия осуществляется только в жестких условиях (нагревание в автоклаве в течение 24 час в присутствии этилендиамина в качестве активатора халькогена) [10].
Наиболее близким к заявляемому способу является метод синтеза наночастиц ZnS и CdS (а также PbS и MnS), основанный на использовании элементной серы и комплексов солей металлов с олеиламином. Соответствующие комплексы смешивают с серой и нагревают, что приводит к образованию наночастиц. Олеиламин в данном случае выступает в качестве активатора серы и лиганда-стабилизатора [11] (прототип).
К недостаткам прототипа относятся следующие:
1. Олеиламин является труднодоступным и достаточно дорогим реагентом.
2. С использованием этого метода, скорее всего, можно получить только сульфидные наночастицы, т.к. элементный селен и особенно теллур практически не активируются органическими аминами, даже при небольшом нагревании.
3. При нагревании элементная сера способна реагировать с азотсодержащими непредельными соединениями, к которым относится олеиламин, как по двойной связи, так и по аминогруппе [12], что может приводить к неконтролируемому загрязнению получаемых частиц.
Предлагается способ получения наночастиц халькогенидных полупроводниковых материалов, основанный на взаимодействии соли металла с элементным халькогеном (S, Se, Те) и одновременно с органическим дихаль-когенидом (R2Y2, Y-S, Se, Те; R=C6H5, С6Н5СН2, С2Н5, С4Н9, (НОСН2)2СН, НОСН2СН2, СН2=СНСН2, C8H17), который является источником лигандов-стабилизаторов. Синтез наночастиц осуществляют в водно-гидразиновой среде при температуре 40-60°С с предварительной активацией халькогена и органического дихалькогенида щелочью в гидразин-гидрате.
Химическая сущность способа описывается следующими уравнениями:
1). Активация халькогена
2Y+4МОH+Na2H4·H2O→2M2Y+N2+5H2O,
где M=Na, K; Y=S, Se, Те.
2). Активация дихалькогенида
2R2Y2+4MOH+N2H4·H2O→4RYM+N2+5H2О,
где M=Na, K; Y=S, Se, Те; R=C6H5, С6Н5СН2, C2H5, С4Н9, (НОСН2)2СН, НОСН2СН2, СН2=СНСН2, C8H17.
3). Синтез наночастиц
nМеХ2+mM2Y+2(n-m)RYM→(MenYm)(YR)2(n-m)+2nMX,
где Me=Zn, Cd, Hg; X-Cl, Br, 0,5SO4, NО3, СН3СОО; n=10-30, m=8-24; M, Y и R - см. уравнения 1 и 2.
В отдельных реакционных сосудах осуществляют активацию халькогена (реакция 1) и соответствующего органического дихалькогенида (реакция 2). Активацию проводят в условиях, описанных ранее [13], воздействием щелочи в гидразин-гидрате при температуре 70-80°С. Полученные растворы объединяют и смесь прикапывают при интенсивном перемешивании к водному раствору соли МеХ2 при температуре 40-60°С.
Образующиеся наночастицы (MenYm)(YR)2(n-m) отделяют дробной кристаллизацией, и по аналогии с работой [14] им может быть приписано следующее строение:
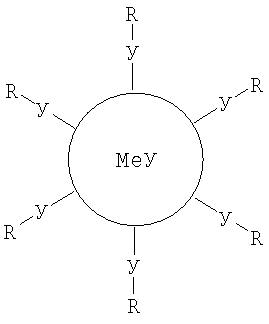
Доказательством образования наночастиц могут служить данные элементного анализа на углерод и водород, а также растворимость полученных продуктов в некоторых органических растворителях, например, диметилсульфоксиде, диметилформамиде, ацетонитриле, а для некоторых производных даже в воде. Хорошо известно, что халькогениды цинка, кадмия и ртути и многие известные их халькогеноляты обладают очень низкой растворимостью даже в воде. ИК-спектры и спектры ПМР полученных продуктов содержат уширенные сигналы, проявляющиеся в областях, характерных для присутствия группировок R.
Предлагаемый способ получения наночастиц халькогенидных материалов обладает следующими преимуществами:
1. Способ базируется на доступном сырье: простые соли металлов, элементные халькогены, доступные и устойчивые (особенно для серы и селена) дихалькогениды, многотоннажный продукт неорганической химии - гидразин-гидрат, едкое кали или каустическая сода.
2. Метод является универсальным как по отношению к получаемым халькогенидам (сульфиды, селениды или теллуриды), так и по отношению к используемому металлу (Zn, Cd, Hg).
3. Способ позволяет получать наночастицы, стабилизированные лигандами самого разнообразного строения, для которых при необходимости легко может быть отрегулирован гидрофильно-гидрофобный баланс, который может определять растворимость частиц в различных растворителях.
4. Варьированием соотношения между количеством соли металла, халькогена и лиганда-стабилизатора можно изменять размеры получаемых наночастиц и устойчивость соответствующих дисперсных систем.
5. В качестве источника лиганда-стабилизатора наночастиц предлагаются органические дихалькогениды, использование которых более удобно с препаративной точки зрения по сравнению с тиолами, фосфинами и другими лигандами. Органические дихалькогениды легко могут быть получены из элементных халькогенов и органилгалогенидов в системе гидразин-гидрат-основание [13].
6. Наночастицы образуются с выходами, близкими к количественным (в расчете на используемый металл).
Существенными отличительными признаками предлагаемого способа являются следующие:
1. Синтез наночастиц осуществляют с применением элементных халькогенов, которые предварительно активируют щелочью в гидразин-гидрате.
2. Синтез осуществляют в присутствии лигандов-стабилизаторов, которые получают предварительной активацией органических дихалькогенидов R2Y2 щелочью в гидразин-гидрате.
3. Процесс получения наночастиц осуществляют в водногидразиновой среде при температуре 40-60°С.
Активация халькогенов и органических дихалькогенидов щелочью в гидразин-гидрате известна и широко используется в синтезе халькогенорганических соединений (например, [13]). Однако в предлагаемом способе она используется в другом качестве - во-первых, халькогены и органические дихалькогениды используются одновременно, во-вторых, они активированы для синтеза наночастиц на основе солей металлов (цинк, кадмий, ртуть). Только совокупность воздействия халькогена и дихалькогенида в активированных формах позволяет получить желаемый результат. Использование только халькогенов (без органических дихалькогенидов) приводит к быстрому образованию осадков MeY, имеющих окраску, соответствующую литературным данным, которые не растворимы в доступных органических растворителях. По-видимому, частицы осадка в данном случае уже не отвечают наноразмерам.
Проведение реакции синтеза наночастиц при температуре ниже 40°С замедляет скорость реакции и усложняет выделение наночастиц. Повышение температуры выше 60°С приводит к неконтролируемому образованию осадка более крупных частиц халькогенида.
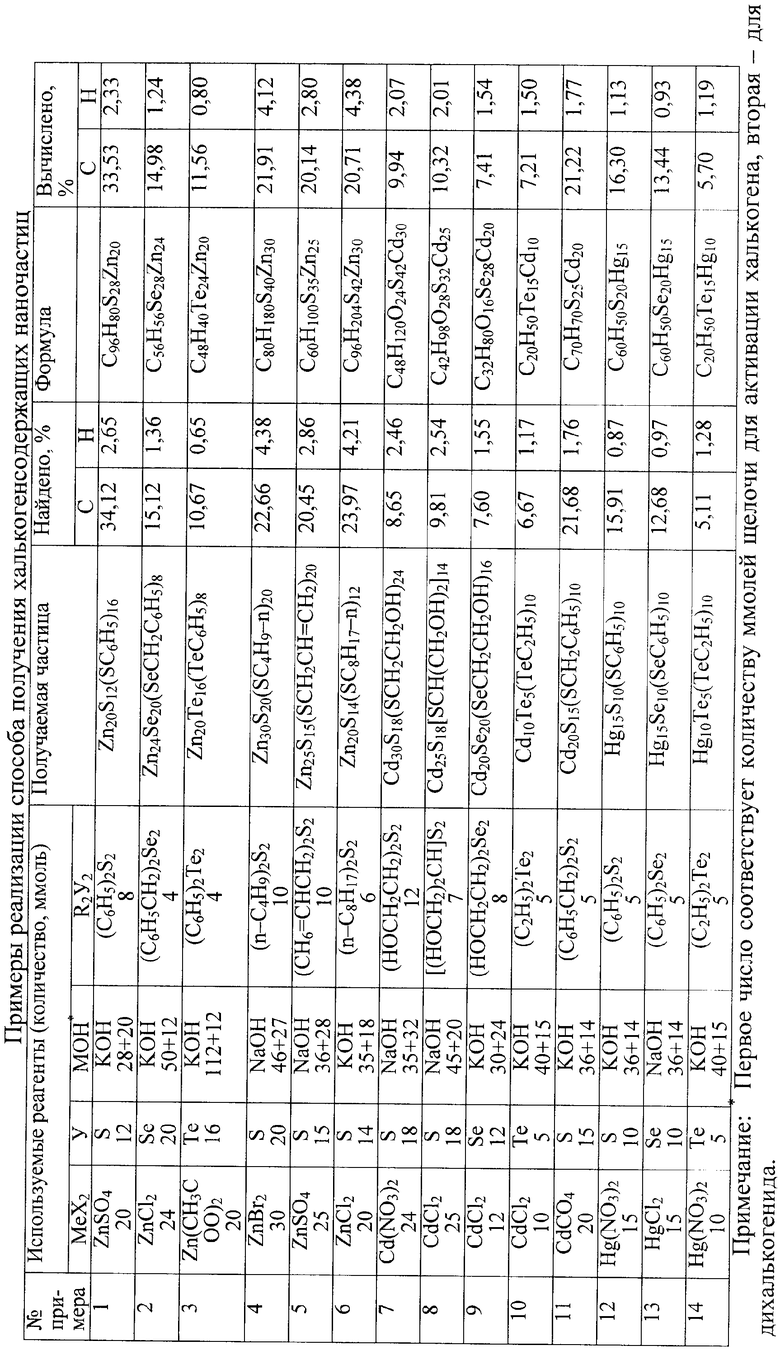
Предлагаемый способ иллюстрируется примерами, представленными в таблице.
В реакционную колбу для активации халькогена помещают необходимое для активации количество щелочи (соотношение щелочь:халькоген = 2,3-2,5:1 для серы и селена и 6,0-8,0:1 для теллура обеспечивает преимущественную активацию до анионов Y2-) и добавляют гидразин-гидрат. В полученный раствор при интенсивном перемешивании и температуре 70-80°С порциями добавляют необходимое количество растертой в порошок серы (селена или теллура), после окончания присыпания халькогена смесь перемешивают при температуре 70-80°С в течение 1-2 час. Понижение температуры растворения халькогена ниже 70°С способствует частичному образованию дихалькогенид (или даже полихалькогенид анионов Yn 2-), что приводит к конечному продукту (халькогениду металла) неоднородного состава. Повышение температуры растворения халькогена выше 80°С нецелесообразно, в частности, из-за дополнительных энергозатрат.
В другую реакционную колбу помещают щелочь в количестве, необходимом для активации дихалькогенида R2Y2 (соотношение щелочь:дихалькогенид = 2,5-3,0:1), и добавляют гидразингидрат. К полученному раствору порциями добавляют дихалькогенид R2Y2 при температуре 70-80°С и перемешивают реакционную смесь при этой температуре 1-2 час. Применение температуры ниже 70°С нецелесообразно из-за увеличения времени активации и неполной конверсии дихалькогенида. Увеличение температуры выше 80°С не дает существенного положительного эффекта, но требует дополнительных энергозатрат.
Полученные растворы халькогенида щелочного металла (M2Y) и халькогенолята (RYM) объединяют и при перемешивании и температуре 40-60°С прикалывают к водному раствору соответствующей соли цинка, кадмия или ртути.
В примерах 1-3, 10-14 (таблица) продукт отделяется в виде мелкодисперсного порошка, который растворим в высокополярных органических растворителях. Из полученных растворов продукт может быть переосажден действием других растворителей (этанол, вода и др.). В примерах 4-6 целевой продукт отделяется в виде эмульсии, из которой мелкодисперсный порошок выпадает при действии этанола. В остальных примерах продукт растворим в водно-гидразиновом растворе и выделяется в виде порошка при действии этанола.
Полученные продукты не имеют характерных температур плавления и изменяют окраску (темнеют) при температурах выше 150-200°С.
Таким образом, предлагаемый способ позволяет получить халькогенидные полупроводниковые наночастицы простым в препаративном отношении методом.
Источники информации
1. Физика и химия соединений АIIBVI ./ Под ред. С.А.Медведева. - М.: Мир. 1970.
2. Берченко Н.Н. и др. Полупроводниковые твердые растворы и их применение.- М.: Воениздат. 1982. 208 с.
3. Хайрутдинов Р.Ф. Химия полупроводниковых наночастиц. // Успехи химии. 1998. Т.67. №2. С.125.
4. Губин С.П., Катаева Н.А., Хомутов Г.Б. Перспективные направления нанонауки: химия наночастиц полупроводниковых материалов. // Известия академии наук. Серия химическая. 2005. №4. С.811.
5. Li Y., Liao H. и др. // Inorg. Chem. 1999, V.38. P.1382.
6. Gautan U.K., Ghosh М., C.N.Rao // Chem. Phys. Lett. 2003. V.381. P.1.
7. Vossmeyer Т. и др. Double-Layer Superlattice Structure Built Up of Cd32S14(SCH2CH(OH)CH3)364H2O Clusters. // J. Am. Chem. Soc. 1995. V.117. №51. P.12881.
8. Коваль И.В. Тиолы как синтоны. // Успехи химии. 1993. Т.62. №8. С.813.
9. Общая органическая химия. / Под ред. Д.Бартона и У.Д.Оллиса. Т.6.-М.: Химия. 1984. 544 с.
10. Deng Z.X. и др. // Inorg. Chem. 2003. V.42. Р.2331.
11. Joo J. и др. // J. Chem. Soc. 2003. V.125. P.11100 (прототип).
12. Реакции серы с органическими соединениями. / Под ред. М.Г.Воронкова. - Новосибирск: Наука (Сибирское отделение). 1979. 367 с.
13. Дерягина Э.Н., Руссавская Н.В. и др. Синтез халькогенорганических соединений в основно-восстановительных системах. // Изв. АН. Сер. хим. 2005. №11. С.2395.
14. Patolsky F. и др. // J. Am. Chem. Soc. 2003. V.125. P.13918.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ ХАЛЬКОГЕНИДОВ МЕТАЛЛОВ | 2010 |
|
RU2417863C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛУПРОВОДНИКОВЫХ ХАЛЬКОГЕНИДНЫХ НАНОЧАСТИЦ | 2010 |
|
RU2459311C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОСОБО ЧИСТЫХ ХАЛЬКОГЕНИДНЫХ СТЕКОЛ, СОДЕРЖАЩИХ ГАЛЛИЙ | 2021 |
|
RU2770494C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛУПРОВОДНИКОВЫХ НАНОЧАСТИЦ | 2012 |
|
RU2517781C2 |
| СПОСОБ ПОЛУЧЕНИЯ СВЕТОПОГЛОЩАЮЩЕГО СЛОЯ ТОНКОПЛЕНОЧНЫХ СОЛНЕЧНЫХ ЭЛЕМЕНТОВ ИЗ МЕДИ-ИНДИЯ-ГАЛЛИЯ-СЕРЫ-СЕЛЕНА | 2008 |
|
RU2446510C1 |
| Способ получения халькобромидов благородных металлов | 1987 |
|
SU1611862A1 |
| СПОСОБ КОЛЛОИДНОГО СИНТЕЗА КВАНТОВЫХ ТОЧЕК СТРУКТУРЫ ЯДРО/МНОГОСЛОЙНАЯ ОБОЛОЧКА | 2018 |
|
RU2692929C1 |
| Способ получения тонких пленок вида Pb-Ch-Ch и устройство для его реализации | 2023 |
|
RU2816689C1 |
| Способ получения коллоидных квантовых точек для применения в медицинской диагностике | 2022 |
|
RU2809097C1 |
| СВЕТОЧУВСТВИТЕЛЬНЫЙ МАТЕРИАЛ | 1990 |
|
RU2021624C1 |
Изобретение относится к нанотехнологии, а именно к получению наноразмерных частиц халькогенидных материалов, используемых в приемниках излучения, солнечных элементах, волноводах, лазерных окнах, видиконах и в других функциональных элементах электронных устройств и приборов. Предварительно осуществляют активацию халькогена и дихалькогенида в щелочи, содержащей гидразин-гидрат, при температуре 70-80°С при соотношении щелочь:халькоген, равном 2,3-2,5:1 для серы и селена и 6-8:1 для теллура, и при соотношении щелочь:дихальгонид, равном 2,5-3,0:1. В качестве щелочи используют гидроксид калия или натрия, а в качестве органического дихалькогенида используют соединения R2Y2, где R - С6Н5, С6Н5СН2, С2Н5, С4Н9, HOCH2CH2, (HOCH2)2CH, CH2=CHCH2, C8H17.
Наночастицы получают при взаимодействии соли металлов с элементным халькогеном и одновременно с органическим дихалькогенидом, который является источником лигандов-стабилизаторов наночастиц при температуре 40-60°С. При этом получают халькогенидные полупроводниковые наночастицы MenYm(YR)2(n-m), где Me - Zn, Cd, Hg, Y - S, Se, Те, n=10-30, m=8-24, R - органический радикал. Обеспечивается простота получения частиц и высокий выход продукта. 1 з.п. ф-лы, 1 табл.
1. Способ получения наночастиц халькогенидных полупроводниковых материалов состава MenYm(YR)2(n-m), где Me - Zn, Cd, Hg, Y - S, Se, Те, n=10-30, m=8-24, R - органический радикал, включающий предварительную активацию органического дихалькогенида, являющегося источником лигандов - стабилизаторов наночастиц, и элементного халькогена в щелочи, содержащей гидразин-гидрат и их взаимодействие с солью металла при температуре 40-60°С.
2. Способ по п.1, отличающийся тем, что активацию халькогена и дихалькогенида осуществляют при температуре 70-80°С при соотношении щелочь:халькоген, равном 2,3-2,5:1 для серы и селена и 6-8:1 для теллура, и при соотношении щелочь:дихалькогенид, равном 2,5-3,0:1, при этом в качестве щелочи используют гидроксид калия или натрия, а в качестве органического дихалькогенида используют соединения R2Y2, где R - С6Н5, С6Н5СН2, С2Н5, С4Н9, HOCH2CH2, (НОСН2)2СН, СН2=СНСН2, C8H17.
| АНДРИЕВСКИЙ Р.А | |||
| и др | |||
| Наноструктурные материалы | |||
| - М.: издательский центр «Академия», 2005, с.135-139 | |||
| ПОТАПОВ В.А | |||
| и др | |||
| Новые способы получения селен- и теллурсодержащих соединений из элементных халькогенов | |||
| Журнал органической химии | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ДЕРЯГИНА Э.Н | |||
| и др | |||
| Синтез халькогенорганических соединений в | |||
Авторы
Даты
2009-09-10—Публикация
2007-10-15—Подача