Изобретение относится к нефтегазовой промышленности и может быть использовано при строительстве, эксплуатации и ликвидации скважин, для разрушения участка металлических обсадных труб.
Известен способ разрушения участка металлической трубы в скважине, включающий подачу на стенку разрушаемой трубы электролита и по кабелю к устройству электрического тока для создания процесса электрохимического анодного растворения участка трубы, в котором подачу электролита осуществляют его постоянной прокачкой с поверхности на колонне насосно-компрессорных труб через кольцевое пространство между корпусом и трубчатым кожухом и далее в электрохимическую ячейку - активную зону, при этом параметры процесса поддерживают в следующих пределах: температуру электролита от 0 до +200°С, давление электролита от 0,1 до 40 МПа, при этом используют импульсный электрический ток при напряжении от 0,1 до 1000 В, а прокачку электролита прекращают при фиксировании прекращения протекания электрического тока, которое прекращается автоматически после полного разрушения участка трубы (см. описание изобретения к патенту РФ №2227201, МПК Е21В 29/02, публикация 20.04.2004 г.).
Недостатками данного способа являются:
- сложность реализации из-за неопределенности параметров используемого импульсного электрического тока;
- недостаточная эффективность электролиза, приводящего к большим энергетическим затратам, в связи с недоучетом зависимости процессов анодного растворения от состава и величины кислотности электролита;
- повышенная вероятность загрязнения окружающей среды активными солями растворяемого металла, из-за отсутствия возможности замыкания цикла окислительно-восстановительной реакции.
Задачей предлагаемого изобретения является повышение эффективности способа.
Сущность изобретения заключается в следующем.
По первому варианту
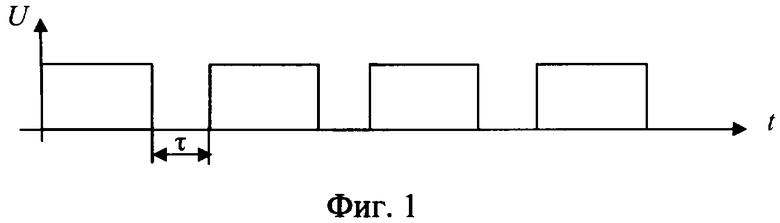
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный электрический ток, а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим прерыванием подаваемого напряжения (фиг.1); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, прерывание тока осуществляют на время τ не менее 1 миллисекунды, так как при меньших значениях τ прерывание электрохимического процесса не происходит из-за малых скоростей диффузии ионов.
По второму варианту
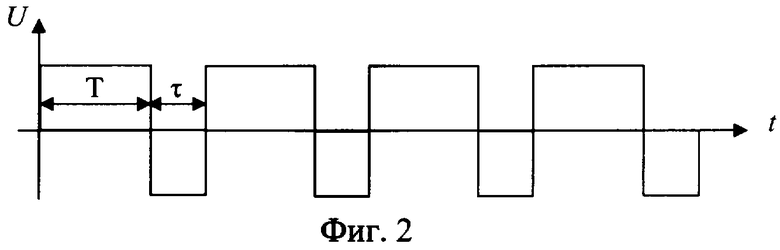
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный электрический ток, а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим изменением полярности подаваемого напряжения (фиг.2); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, периодически меняют полярность напряжения при соотношении длительности положительного Т к длительности отрицательного τ напряжений, равном от 1,1 до 1000, при длительности отрицательного τ не менее 1 миллисекунды.
По третьему варианту
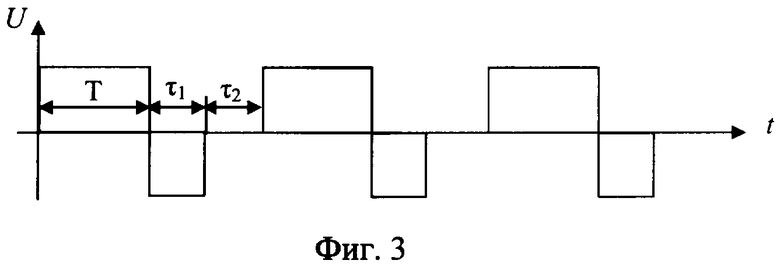
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают по крайней мере одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный электрический ток, а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим изменением полярности подаваемого напряжения и последующим прерыванием тока (фиг.3); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, периодически меняют полярность напряжения при соотношении длительности положительного Т к длительности отрицательного τ1 напряжений, равном от 1,1 до 1000, при длительности отрицательного τ1 не менее 1 миллисекунды с последующим прерыванием тока на время τ2 не менее 1 миллисекунды.
По четвертому варианту
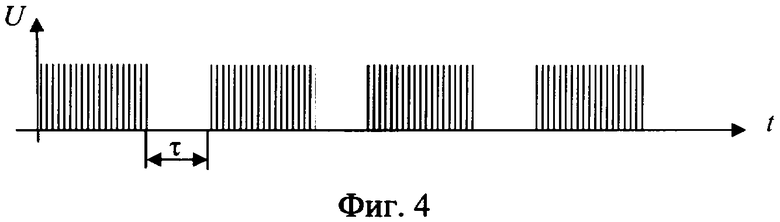
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный импульсный электрический ток частотой 3÷150 кГц (такой диапазон рабочих частот обусловлен тем, что при частотах менее 3-х кГц снижается эффективность анодного растворения металла, а при частотах более 150 кГц возрастает реактивное сопротивление обмоток схемы, что снижает КПД всего процесса), а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим прерыванием подаваемого напряжения (фиг.4); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, прерывание тока осуществляют на время τ не менее 1 миллисекунды, так как при меньших значениях τ прерывание электрохимического процесса не происходит из-за малых скоростей диффузии ионов.
По пятому варианту
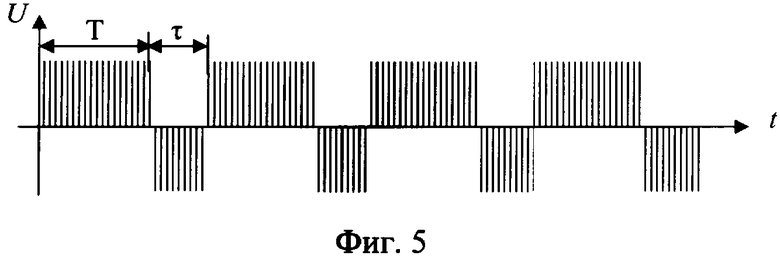
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный импульсный электрический ток частотой 3÷150 кГц (такой диапазон рабочих частот обусловлен тем, что при частотах менее 3-х кГц снижается эффективность анодного растворения металла, а при частотах более 150 кГц возрастает реактивное сопротивление обмоток схемы, что снижает КПД всего процесса), а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим изменением полярности подаваемого напряжения (фиг.5); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, периодически меняют полярность напряжения при соотношении длительности положительного Т к длительности отрицательного τ напряжений, равном от 1,1 до 1000, при длительности отрицательного τ не менее 1 миллисекунды.
По шестому варианту
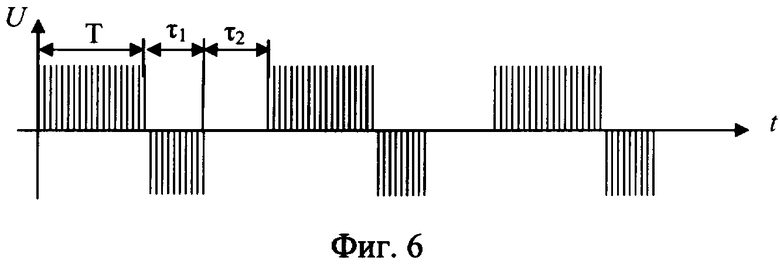
Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях (при pH<1,5 происходит смещение процессов в электрохимической ячейке в сторону выделения водорода на катоде и хлора на аноде; при pH>6,0 процесс растворения железа на аноде резко уменьшается и идет процесс разложения воды), кроме того, в состав электролита включают, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, на электроды электрохимической ячейки подают постоянный импульсный электрический ток частотой 3÷150 кГц (такой диапазон рабочих частот обусловлен тем, что при частотах менее 3-х кГц снижается эффективность анодного растворения металла, а при частотах более 150 кГц возрастает реактивное сопротивление обмоток схемы, что снижает КПД всего процесса), а так как зависимость скорости электрохимического процесса окисления железа δ от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); II - зона пассивации, связанная с образованием снижающей скорость основного процесса оксидной пленки на границе металл-раствор; III - зона транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды), то из этого следует, что, подавая на электроды напряжение в пределах 1,0÷4,0 В, можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса; кроме того, с целью снятия концентрационных затруднений при растворении металла на аноде процесс осуществляют с периодическим изменением полярности подаваемого напряжения и последующим прерыванием тока (фиг.6); окислительно-восстановительные реакции на электродах электрохимической ячейки проводят до полного разрушения участка трубы.
Кроме того, периодически меняют полярность напряжения при соотношении длительности положительного Т к длительности отрицательного τ1 напряжений, равном от 1,1 до 1000, при длительности отрицательного не менее 1 миллисекунды с последующим прерыванием тока на время τ2 не менее 1 миллисекунды.
Сущность изобретения поясняется чертежами, где
на фиг.1÷6 приведены формы электрических импульсов соответственно по вариантам 1÷6;
на фиг.7 показана зависимость скорости электрохимического процесса окисления железа δ от напряжения U на электродах.
Способ осуществляется следующим образом.
По варианту 1 в скважину, на глубину расположения разрушаемого участка металлической трубы, спускают устройство, образующее со стенкой разрушаемой трубы электрохимическую ячейку, и в кольцевой зазор между разрушаемым участком металлической трубы, являющимся анодом, и устройством, на котором расположен катод, подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов (например, водный раствор NaCl) с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий от 0,01 до 0,70 мас.%, по крайней мере, одну добавку-комплексообразователь, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный электрический ток напряжением 1,0÷4,0 В с периодическим прерыванием передаваемого напряжения, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
При использовании постоянного тока в электрохимических процессах устанавливается постоянное значение величины, ограничивающей скорость электрохимической реакции. Главным ограничивающим фактором является скорость отвода продуктов реакции окисления (для анодных процессов). При этом константа диффузии, являющаяся одним из факторов, определяющих скорость процесса, остается постоянной. Поэтому увеличение плотности тока приводит к торможению основного процесса и увеличению скорости побочного - например, выделению хлора при анодном растворении железа в растворах солей хлористоводородной кислоты - возникновению поляризации электрода, смещающей потенциал в сторону положительных значений. В результате эффективность способа недостаточно высокая. Замена постоянного тока на различные формы импульсного тока в электрохимических процессах позволяет, при одних и тех же средних значениях плотностей тока, равных по значению постоянному, повысить эффективность использования электрической энергии в основном процессе (растворении металла). Это связано с тем, что в импульсном режиме между импульсами тока имеется временной бестоковый промежуток. В этот момент происходит выравнивание концентраций в области электрохимической реакции, в результате чего резко уменьшается поляризация электрода, потенциал остается в зоне значений, обеспечивающих протекание основной реакции (окисления металла), что позволяет увеличить плотность тока основного электрохимического процесса. Введение вместо паузы импульса обратной полярности приводит к дополнительному ускорению устранения концентрационных ограничений по основному рабочему процессу, что дополнительно увеличивает производительность данного процесса. Величина напряжения, подаваемого на электрохимическую ячейку, выбирается следующим образом. Проведенные исследования показывают, что зависимость скорости электрохимического процесса δ окисления железа от напряжения на электродах имеют три зоны (фиг.7): I - активного растворения металла (в пределах двух - трех вольт); затем зона пассивации - II, связанная с образованием оксидной пленки на границе металл-раствор, снижающей скорость основного процесса; при дальнейшем повышении потенциала электрода появляется зона III - транспассивации, где наряду с окислением металла интенсифицируется параллельно протекающая реакция электрохимического разложения растворителя (воды). Из этого следует, что если на электроды подавать напряжение в пределах 1,0÷4,0 В, то можно более эффективно использовать электрическую энергию на проведение основного процесса - окисление железа и таким образом повысить эффективность процесса.
Для повышения скорости (растворения) разрушения участка металлической трубы периодически проводится прерывание электрического тока электрохимической ячейки (фиг.1) на время τ, необходимое для разрушения двойного электрического слоя, но не менее одной миллисекунды, так как при меньших значениях τ прерывание электрохимического процесса не происходит из-за малых скоростей диффузии ионов, или для достижения той же цели периодически меняют полярность напряжения электрического тока (фиг.2) при соотношении длительности положительного Т к длительности отрицательного τ, равном от 1,1 до 1000, при длительности отрицательного не менее 1 миллисекунды. Возможно использование обоих методов (фиг.3). Это позволяет снять концентрационные затруднения растворения металла на аноде и восстановления его на катоде.
Электролит, как правило, представляет собой водный раствор хлоридов, бромидов, йодидов щелочных (Li, Na, К и т.д.) или щелочноземельных (Be, Mg и т.д.) металлов как наиболее простых и легко растворимых соединений. Чаще всего используют один из водных растворов хлоридных солей щелочных или щелочноземельных металлов как наиболее дешевых соединений с их насыщенностью, составляющей при термобарических условиях рабочей зоны (интервала удаления участка обсадной трубы) 20÷80% от предельной растворимости.
Использование электролитов концентрации менее 20% повышает затраты электроэнергии на процесс растворения метала, при концентрации более 80% от растворимости при термобарических забойных условиях, в верхней части ствола и на устье скважины, будет происходить его высаливание из-за снижения температуры.
В результате протекания окислительной реакции на аноде электрохимической ячейки происходит насыщение зоны реакции продуктами анодного окисления:
Ме0-n·е-→Men+,
где Ме0 - разрушаемый металл;
Men+ - положительный ион разрушаемого металла, а также выделения в газообразном виде атомарного хлора, активно взаимодействующего с ионами металлов и гидрокатионов, накапливающихся в катодном пространстве:
Mem++Cl-+ОН→Men-1СlОН.
В присутствии воды происходит частичный гидролиз этого соединения с образованием осадка гидроокисных соединений окисляемого металла:
Men-1ОН·Cl→Ме(ОН)n+Cl2,
другая же часть растворенного металла в ионном виде переносится в катодное пространство и восстанавливается до металла:
Mem+-m·е-→Ме0.
В результате, замыкая цикл окислительно-восстановительной реакции, то есть используя восстановительную реакцию на катоде электрохимической ячейки, можно уменьшить степень загрязнения окружающей среды солями растворяемого металла.
Для интенсификации процесса растворения в электролит вводят вещества, связывающие образующиеся ионы железа (Fe+2) в комплексные растворимые соединения, т.к., в случае отсутствия комплексообразователей, весьма вероятен процесс химического доокисления ионов двухвалентного железа до трехвалентного состояния с последующим образованием тригидрооксида железа, выпадающего в нерастворимую форму, и, тем самым, затрудняющим процесс электрохимического окисления за счет образования фазовой пленки на поверхности растворяемого металла. Использование добавок-комплексообразователей позволяет частично связывать и ионы железа в одновалентной форме, что, согласно закону Фарадея, позволяет увеличить массу растворяемого металла, приходящегося на единицу количества электричества.
Вместе с этим комплексные ионы железа под действием электрического поля имеют возможность переносится на отрицательно заряженный электрод - катод и восстанавливаться до металла. Таким образом, в данной системе с электролитом, содержащим добавки - комплексообразователи, в ходе протекания процесса анодного растворения железа возможен катодный процесс, в результате чего электрохимический цикл замыкается. Ионы комплексообразователя, высвобождаемые в катодной части процесса, опять связывают образующиеся в анодной реакции ионы железа. Происходит перенос вещества с анода на катод.
Экспериментальные данные по введению добавок щавелевой кислоты (табл.1) и сульфаминовой кислоты (табл.2) в раствор хлорида натрия показывают увеличение скорости растворения в сравнении с электролитом без добавок, на 11÷23% соответственно при увеличении концентрации добавок от 0,05 до 0,25 мас.%.
Влияние добавок сульфаминовой (амидсульфокислоты) на процесс электрохимического растворения нержавеющей стали в растворе хлорида натрия (d=1,116 г/мл), плотность тока 50 А/дм2, напряжение 3 В, отношение длительности положительного импульса к длительности отрицательного - 5 (Табл.1).
Влияние добавок щавелевой кислоты на процесс электрохимического растворения нержавеющей стали в растворе хлорида натрия (d=1,116 г/мл), плотность тока 50 А/дм2, напряжение 3 В, отношение длительности положительного импульса к длительности отрицательного - 5 (Табл.2).
Для поддержания (эффективности) скорости процесса кислотность электролита pH поддерживают в пределах от 1,5 до 6, а напряжение в электрохимической ячейке в пределах от 1 до 4 В. При полном разрушении участка трубы, соответствующего длине катода, автоматически прекращается протекание электрического тока, что фиксируется устьевым прибором, после чего прекращают подачу электролита в скважину.
Скорость разрушения участка металлической трубы в лабораторных условиях [кг/час] в зависимости от конкретных параметров при применении заявляемого способа приведена в таблицах:
- при постоянных величинах: давления - 10 МПа; скорости прокачки электролита - 0,5 л/с; температуре окружающей среды 50°С; при периодической смене полярности подаваемого постоянного напряжения на электроды электрохимической ячейки и соотношении длительности положительного импульса к длительности отрицательного - 100, при общей длительности - 1c; плотности тока - 50 А/дм2 в зависимости от напряжения на электродах электрохимической ячейки - таблица 3;
- при постоянных величинах: давления - 10 МПа; температуре окружающей среды 50°С; скорости прокачки электролита - 0,5 л/с; при периодической смене полярности подаваемого постоянного напряжения - 3 В на электроды электрохимической ячейки; плотности постоянного тока - 50 А/дм2 в зависимости от соотношения длительности положительного импульса к длительности отрицательного, при общей длительности - 1 с - таблица 4.
Пример. В зону разрушаемого участка металлической трубы диаметром 175 мм, находящегося в скважине на глубине 4000 м, спускают состоящее из десяти блоков цилиндрическое устройство, представляющее собой катод длиной 2 м и образующее со стенкой разрушаемой трубы электрохимическую ячейку, в кольцевой зазор между разрушаемым участком металлической трубы, являющимся анодом, и устройством, на котором расположен катод, подают электролит: водный раствор NaCl плотностью 1,116 г/мл с добавкой щавелевой кислоты 0,015 мас.%, кислотность электролита pH составляет 1,5. К цилиндрическому устройству с поверхности подается постоянный ток напряжением 300 В, мощность источника 35 кВт. Подаваемое напряжение преобразуется в модулированное импульсное напряжение 3 В, частотой 40 кГц, прямая последовательность импульсов 1 с, обратная последовательность импульсов 0,15 с и подается на анод и катод. Возникающий в электрохимической ячейке ток (около 5500 А) позволяет растворить двухметровый участок трубы за 23 часа.
По вариантам 2÷6 способ осуществляют аналогично первому варианту.
Использование предлагаемого способа дает следующие преимущества:
- позволяет избежать процессов пассивации и транспассивации в электрохимической ячейке, что резко сокращает энергетические затраты на разрушение участка металлической трубы;
- возможность расширить технические возможности способа и область его применения;
- позволяет повысить эффективность способа.
Ориентировочный экономический эффект при создании 10-ти метрового технологического окна на глубине 3500-4000 метров в скважине, обсаженной двумя 7" и 9" колоннами (группа прочности NT-80, NT-90SS, HS-90÷95), по сравнению с известными механическими способами разрушения, составит от 500 до 1000 тыс.руб.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРФОРАЦИИ УЧАСТКА ТРУБЫ В СКВАЖИНЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2009 |
|
RU2414588C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ИЗВЛЕЧЕНИЯ СЕРЕБРА ИЗ СЕРЕБРОСОДЕРЖАЩИХ ТОКОПРОВОДЯЩИХ ОТХОДОВ | 2011 |
|
RU2467082C1 |
| СПОСОБ РАЗРУШЕНИЯ УЧАСТКА МЕТАЛЛИЧЕСКОЙ ТРУБЫ В СКВАЖИНЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2536067C2 |
| Электролит для получения осмиевых покрытий | 1981 |
|
SU1014996A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИДОВ И/ИЛИ ГИДРОКСООКСИДОВ МЕТАЛЛОВ ПУТЕМ ДИАФРАГМЕННОГО АНАЛИЗА | 1995 |
|
RU2153538C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАНИЛИНА ЭЛЕКТРОХИМИЧЕСКИМ ОКИСЛЕНИЕМ ВОДНЫХ РАСТВОРОВ ИЛИ СУСПЕНЗИЙ ЛИГНИНА | 2012 |
|
RU2600322C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО РАЗЛОЖЕНИЯ ОРГАНИЧЕСКИХ КОМПЛЕКСООБРАЗУЮЩИХ РЕАГЕНТОВ В ВОДНЫХ РАСТВОРАХ | 2001 |
|
RU2201401C1 |
| ЭЛЕКТРОХИМИЧЕСКОЕ УСТРОЙСТВО ДЛЯ АККУМУЛИРОВАНИЯ И/ИЛИ ПОДАЧИ ЭНЕРГИИ С КОНТРОЛЕМ ВЕЛИЧИНЫ РН | 1993 |
|
RU2110118C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРОДА | 2014 |
|
RU2551425C1 |
| ЭЛЕКТРОЛИТ СЕРЕБРЕНИЯ | 2006 |
|
RU2323276C2 |
Группа изобретений относится к нефтегазовой промышленности и может быть использована для разрушения участка трубы при ремонте скважин. Способ включает создание электрохимической ячейки, анодом которой является металлическая труба. К участку металлической трубы подают электролит с кислотностью pH от 1,5 до 6,0, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, на электроды электрохимической ячейки подают постоянный электрический ток напряжением 1,0-4,0 В, проводят окислительно-восстановительные реакции на электродах до полного разрушения участка трубы. Повышается эффективность процесса разрушения. Предложено шесть вариантов осуществления способа. 6 н. и 6 з.п. ф-лы, 7 ил., 4 табл.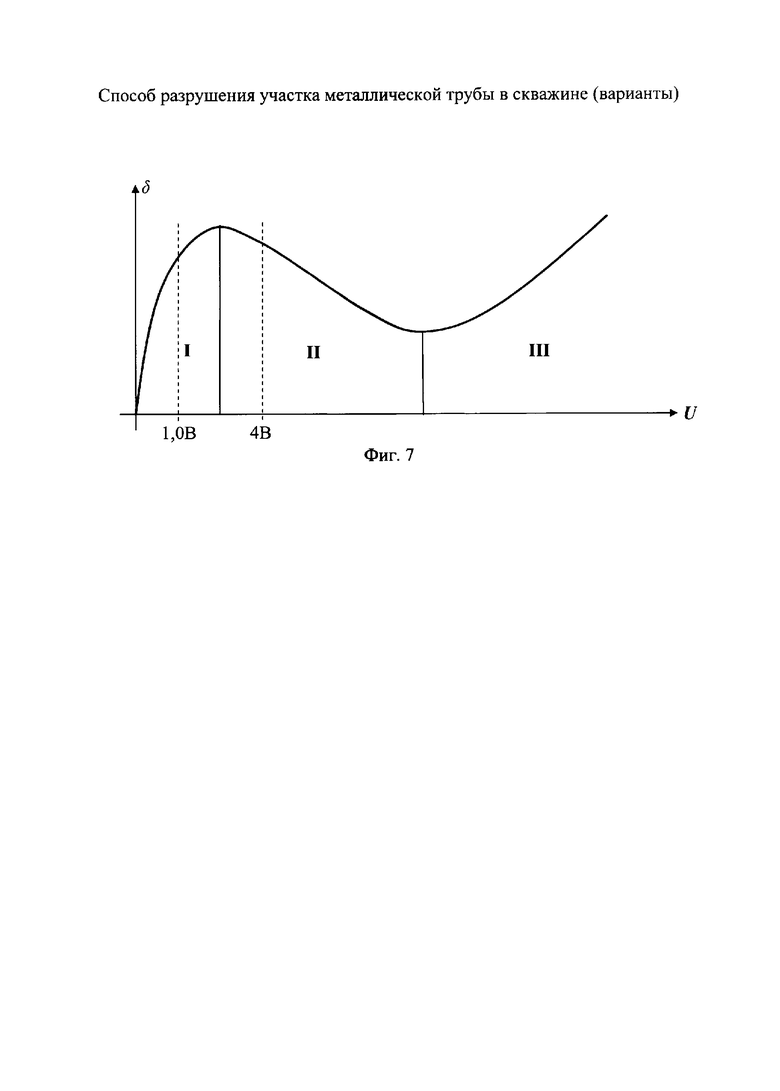
1. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный электрический ток напряжением 1,0÷4,0 В с периодическим прерыванием подаваемого напряжения, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
2. Способ по п.1, отличающийся тем, что прерывание тока осуществляют на время не менее 1 мс.
3. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный электрический ток напряжением 1,0÷4,0 В с периодическим изменением полярности подаваемого напряжения, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
4. Способ по п.3, отличающийся тем, что периодически меняют полярность напряжения при соотношении длительности положительного к длительности отрицательного напряжений, равном от 1,1 до 1000, при длительности отрицательного не менее 1 мс.
5. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный электрический ток напряжением 1,0÷4,0 В с периодическим изменением полярности подаваемого напряжения и последующим прерыванием тока, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
6. Способ по п.5, отличающийся тем, что периодически меняют полярность напряжения при соотношении длительности положительного к длительности отрицательного напряжений, равном от 1,1 до 1000, при длительности отрицательного не менее 1 мс с последующим прерыванием тока на время не менее 1 мс.
7. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный импульсный электрический ток напряжением 1,0÷4,0 В, частотой 3÷150 кГц, с периодическим прерыванием подаваемого напряжения, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
8. Способ по п.7, отличающийся тем, что прерывание тока осуществляют на время не менее 1 мс.
9. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный импульсный электрический ток напряжением 1,0÷4,0 В, частотой 3÷150 кГц, с периодическим изменением полярности подаваемого напряжения, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
10. Способ по п.9, отличающийся тем, что периодически меняют полярность напряжения при соотношении длительности положительного к длительности отрицательного напряжений, равном от 1,1 до 1000, при длительности отрицательного не менее 1 мс.
11. Способ разрушения металлического участка трубы в скважине путем создания электрохимической ячейки, анодом которой является металлическая труба, при этом к участку разрушаемой трубы подают электролит с кислотностью pH от 1,5 до 6,0, преимущественно водный раствор хлоридных солей щелочных и/или щелочно-земельных металлов с их растворимостью, составляющей 20÷80% от предельной растворимости при термобарических забойных условиях, включающий, по крайней мере, одну добавку-комплексообразователь от 0,01 до 0,70 мас.%, преимущественно щавелевую или сульфаминовую кислоту, а на электроды электрохимической ячейки подают постоянный импульсный электрический ток напряжением 1,0÷4,0 В, частотой 3÷150 кГц с периодическим изменением полярности подаваемого напряжения и последующим прерыванием тока, проводят окислительно-восстановительные реакции на электродах электрохимической ячейки до полного разрушения участка трубы.
12. Способ по п.11, отличающийся тем, что периодически меняют полярность напряжения при соотношении длительности положительного к длительности отрицательного напряжений, равном от 1,1 до 1000, при длительности отрицательного не менее 1 с с последующим прерыванием тока на время не менее 1 мс.
| СПОСОБ РАЗРУШЕНИЯ УЧАСТКА ТРУБЫ В СКВАЖИНЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2002 |
|
RU2227201C2 |
| Устройство для разрушения металли-чЕСКиХ пРЕдМЕТОВ | 1979 |
|
SU853088A1 |
| Устройство для электрохимической резки труб в скважине | 1972 |
|
SU456891A1 |
| Линия для электрохимической обработки внутренней поверхности труб и трубных изделий | 1988 |
|
SU1587079A1 |
| US 3076507 A, 05.02.1963. | |||
Авторы
Даты
2009-10-20—Публикация
2008-01-29—Подача