ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к белку, способному метаболизировать гербицидное соединение (метаболизирующему гербицид белку), его гену и их применению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Гербициды при их применении наносят в необходимом количестве разбавленного раствора. Имеются ситуации, в которых остаются избыточные количества. Имеются также ситуации, в которых нанесенный гербицид после его нанесения в течение некоторого времени остается в почве или в остатке растения. Первоначально, при условии, что безопасность таких гербицидов проверялась, такие небольшие количества остаточных растворов или остатков оказывали небольшое влияние на окружающую среду или на культивируемые после этого сельскохозяйственные культуры. Однако если существует способ, в котором содержащееся гербицидное соединение превращается в соединение более низкой гербицидной активности, то, например, могут проводиться обработки для инактивации остаточных растворов или остатков, описанных выше, по мере необходимости.
Кроме того, в случае применения гербицида имеются ситуации, в которых трудно отличить культивируемые растения от сорняков тех видов, которые имеют общие с ними черты, для селективного уничтожения только сорняков. Поэтому желательной является разработка нового способа для придания гербицид-резистентности растению-мишени.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В этих обстоятельствах авторы данного изобретения провели интенсивное исследование и в результате нашли, что ингибирующее протопорфириногеноксидазу (далее называемую иногда “PPO”) гербицидное соединение может быть превращено реакцией с определенным белком в соединение более низкой гербицидной активности, что и привело к завершению данного изобретения.
Таким образом, в данное изобретение включены:
1. ДНК, кодирующая метаболизирующий гербицид белок, где указанный белок выбран из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II):
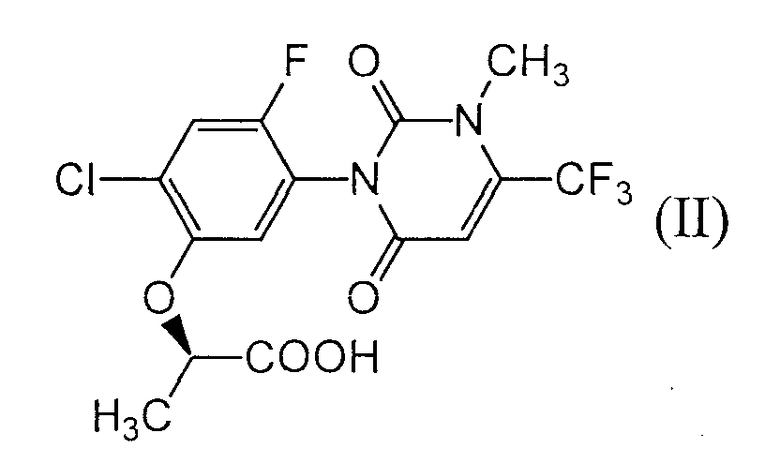
в соединение формулы (III):

и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi;
2. ДНК, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из:
(а1) нуклеотидной последовательности, показанной в SEQ ID NO:6;
(а2) нуклеотидной последовательности, показанной в SEQ ID NO:7;
(а3) нуклеотидной последовательности, показанной в SEQ ID NO:8;
(а4) нуклеотидной последовательности, показанной в SEQ ID NO:109;
(а5) нуклеотидной последовательности, показанной в SEQ ID NO:139;
(а6) нуклеотидной последовательности, показанной в SEQ ID NO:140;
(а7) нуклеотидной последовательности, показанной в SEQ ID NO:141;
(а8) нуклеотидной последовательности, показанной в SEQ ID NO:142;
(а9) нуклеотидной последовательности, показанной в SEQ ID NO:143;
(а10) нуклеотидной последовательности, показанной в SEQ ID NO:225;
(а11) нуклеотидной последовательности, показанной в SEQ ID NO:226;
(а12) нуклеотидной последовательности, показанной в SEQ ID NO:227;
(а13) нуклеотидной последовательности, показанной в SEQ ID NO:228;
(а14) нуклеотидной последовательности, показанной в SEQ ID NO:229;
(а15) нуклеотидной последовательности, показанной в SEQ ID NO:230;
(а16) нуклеотидной последовательности, показанной в SEQ ID NO:231;
(а17) нуклеотидной последовательности, показанной в SEQ ID NO:232;
(а18) нуклеотидной последовательности, показанной в SEQ ID NO:233;
(а19) нуклеотидной последовательности, показанной в SEQ ID NO:234;
(а20) нуклеотидной последовательности, кодирующей аминокислотную последовательность белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), причем указанная нуклеотидная последовательность имеет, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8 или SEQ ID NO:109; и
(а21) нуклеотидной последовательности, кодирующей аминокислотную последовательность белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), причем указанная нуклеотидная последовательность имеет, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:139, SEQ ID NO:140, SEQ ID NO:141, SEQ ID NO:142, SEQ ID NO:143, SEQ ID NO:225, SEQ ID NO:226, SEQ ID NO:227, SEQ ID NO:228, SEQ ID NO:229, SEQ ID NO:230, SEQ ID NO:231, SEQ ID NO:232, SEQ ID NO:233 или SEQ ID NO:234;
3. ДНК по п.1, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность указанного белка, где использование кодонов в указанной нуклеотидной последовательности находится в диапазоне плюс или минус 4% использования кодонов в генах из вида клетки-хозяина, в которую вводят эту ДНК, и GC-содержание указанной нуклеотидной последовательности составляет, по меньшей мере, 40% и максимально 60%;
4. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:214;
5. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:368;
6. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:393;
7. ДНК, в которой ДНК, имеющая нуклеотидную последовательность, кодирующую транзитную сигнальную последовательность внутриклеточной органеллы, присоединена «слева» от ДНК по п.1 в рамке считывания;
8. ДНК, в которой ДНК по п.1 и промотор, функциональный в клетке-хозяине, функционально связаны;
9. Вектор, содержащий ДНК по п.1;
10. Способ получения вектора, предусматривающий стадию встраивания ДНК по п.1 в вектор, реплицируемый в клетке-хозяине;
11. Трансформант, в котором ДНК по п.1 введена в клетку-хозяина;
12. Трансформант по п.11, где клеткой-хозяином является клетка микроорганизма или клетка растения;
13. Способ получения трансформанта, предусматривающий стадию введения в клетку-хозяина ДНК по п.1;
14. Способ получения белка, способного превращать соединение формулы (II) в соединение формулы (III), причем указанный способ предусматривает стадии культивирования трансформанта по п.11 и извлечения продуцированного указанного белка;
15. Применение ДНК по п.1 для получения белка, способного превращать соединение формулы (II) в соединение формулы (III);
16. Способ придания растению резистентности к гербициду, предусматривающий стадию введения в клетку растения и экспрессии в клетке растения ДНК по п.1;
17. Полинуклеотид, имеющий частичную нуклеотидную последовательность ДНК по п.1 или нуклеотидную последовательность, комплементарную указанной частичной нуклеотидной последовательности;
18. Способ обнаружения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), предусматривающий стадию обнаружения ДНК, с которой гибридизуется зонд при гибридизации с использованием в качестве зонда ДНК по п.1 или полинуклеотида по п.17;
19. Способ обнаружения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), предусматривающий стадию обнаружения ДНК, амплифицированной в полимеразной цепной реакции с полинуклеотидом по п.17 в качестве праймера;
20. Способ по п.19, где, по меньшей мере, один из праймеров выбран из группы, состоящей из полинуклеотида, содержащего нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и полинуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129;
21. Способ получения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), предусматривающий стадию извлечения ДНК, детектированной по способу по п.18 или 19;
22. Способ скрининга клетки, имеющей ДНК, кодирующую белок, способный превращать соединение формулы (II) в соединение формулы (III), предусматривающий стадию детектирования указанной ДНК из тест-клетки по способу по п.18 или 19;
23. Метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi;
24. Антитело, узнающее метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi;
25. Способ обнаружения метаболизирующего гербицид белка, предусматривающий:
(1) стадию контактирования тест-соединения с антителом, узнающим указанный белок, и
(2) стадию детектирования комплекса указанного белка и указанного антитела, возникающего в результате указанного контакта,
где указанный белок выбран из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi;
26. Набор для анализа или детектирования, содержащий антитело по п.24;
27. ДНК, кодирующая ферредоксин, выбранный из группы, состоящей из:
(В1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:12;
(В2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:13;
(В3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:14;
(В4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:111;
(В5) ферредоксина, содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В6) ферредоксина, содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В7) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:149;
(В8) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:150;
(В9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:151;
(В10) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:152;
(В11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:153;
(В12) ферредоксина, содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251 или SEQ ID NO:253, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:150, SEQ ID NO:252 или SEQ ID NO:254;
(В13) ферредоксина, содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251, SEQ ID NO:252, SEQ ID NO:253 или SEQ ID NO:254;
(В14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:245;
(В15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:247;
(В16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:248;
(В17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:249;
(В18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:250;
(В19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:251;
(В20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:252;
(В21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:253; и
(В22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:254;
28. ДНК, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из:
(b1) нуклеотидной последовательности, показанной в SEQ ID NO:15;
(b2) нуклеотидной последовательности, показанной в SEQ ID NO:16;
(b3) нуклеотидной последовательности, показанной в SEQ ID NO:17;
(b4) нуклеотидной последовательности, показанной в SEQ ID NO:112;
(b5) нуклеотидной последовательности, показанной в SEQ ID NO:154;
(b6) нуклеотидной последовательности, показанной в SEQ ID NO:155;
(b7) нуклеотидной последовательности, показанной в SEQ ID NO:156;
(b8) нуклеотидной последовательности, показанной в SEQ ID NO:157;
(b9) нуклеотидной последовательности, показанной в SEQ ID NO:158;
(b10) нуклеотидной последовательности, показанной в SEQ ID NO:255;
(b11) нуклеотидной последовательности, показанной в SEQ ID NO:257;
(b12) нуклеотидной последовательности, показанной в SEQ ID NO:258;
(b13) нуклеотидной последовательности, показанной в SEQ ID NO:259;
(b14) нуклеотидной последовательности, показанной в SEQ ID NO:260;
(b15) нуклеотидной последовательности, показанной в SEQ ID NO:261;
(b16) нуклеотидной последовательности, показанной в SEQ ID NO:262;
(b17) нуклеотидной последовательности, показанной в SEQ ID NO:263;
(b18) нуклеотидной последовательности, показанной в SEQ ID NO:264; и
(b19) нуклеотидной последовательности, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:112, SEQ ID NO:154, SEQ ID NO:155, SEQ ID NO:156, SEQ ID NO:157, SEQ ID NO:158, SEQ ID NO:255, SEQ ID NO:257, SEQ ID NO:258, SEQ ID NO:259, SEQ ID NO:260, SEQ ID NO:261, SEQ ID NO:262, SEQ ID NO:263 или SEQ ID NO:264;
29. Вектор, содержащий ДНК по п.28;
30. Трансформант, в котором ДНК по п.28 введена в клетку-хозяина;
31. Ферредоксин, выбранный из группы, состоящей из:
(В1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:12;
(В2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:13;
(В3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:14;
(В4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:111;
(В5) ферредоксина, содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В6) ферредоксина, содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В7) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:149;
(В8) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:150;
(В9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:151;
(В10) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:152;
(В11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:153;
(В12) ферредоксина, содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251 или SEQ ID NO:253, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:150, SEQ ID NO:252 или SEQ ID NO:254;
(В13) ферредоксина, содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251, SEQ ID NO:252, SEQ ID NO:253 или SEQ ID NO:254;
(В14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:245;
(В15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:247;
(В16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:248;
(В17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:249;
(В18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:250;
(В19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:251;
(В20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:252;
(В21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:253; и
(В22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:254;
32. ДНК, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из:
(ab1) нуклеотидной последовательности, показанной в SEQ ID NO:9;
(ab2) нуклеотидной последовательности, показанной в SEQ ID NO:10;
(ab3) нуклеотидной последовательности, показанной в SEQ ID NO:11;
(ab4) нуклеотидной последовательности, показанной в SEQ ID NO:110;
(ab5) нуклеотидной последовательности, показанной в SEQ ID NO:144;
(ab6) нуклеотидной последовательности, показанной в SEQ ID NO:145;
(ab7) нуклеотидной последовательности, показанной в SEQ ID NO:146;
(ab8) нуклеотидной последовательности, показанной в SEQ ID NO:147;
(ab9) нуклеотидной последовательности, показанной в SEQ ID NO:148;
(ab10) нуклеотидной последовательности, показанной в SEQ ID NO:235;
(ab11) нуклеотидной последовательности, показанной в SEQ ID NO:236;
(ab12) нуклеотидной последовательности, показанной в SEQ ID NO:237;
(ab13) нуклеотидной последовательности, показанной в SEQ ID NO:238;
(ab14) нуклеотидной последовательности, показанной в SEQ ID NO:239;
(ab15) нуклеотидной последовательности, показанной в SEQ ID NO:240;
(ab16) нуклеотидной последовательности, показанной в SEQ ID NO:241;
(ab17) нуклеотидной последовательности, показанной в SEQ ID NO:242;
(ab18) нуклеотидной последовательности, показанной в SEQ ID NO:243; и
(ab19) нуклеотидной последовательности, показанной в SEQ ID NO:244;
33. Вектор, содержащий ДНК по п.32;
34. Трансформант, в котором ДНК по п.32 введена в клетку-хозяина;
35. Трансформант по п.34, где клеткой-хозяином является клетка микроорганизма или клетка растения;
36. Способ получения трансформанта, предусматривающий стадию введения в клетку-хозяина ДНК по п.32;
37. Способ получения белка, способного превращать соединение формулы (II) в соединение формулы (III), предусматривающий стадию культивирования трансформанта по п.34 и извлечения продуцированного указанного белка;
38. Способ уничтожения сорняков, предусматривающий стадию нанесения соединения на зону культивирования растения, экспрессирующего, по меньшей мере, один метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224;
где указанное соединение является соединением формулы (I):

где в формуле (I) G представляет группу, показанную в любой из следующих формул G-1 - G-9:
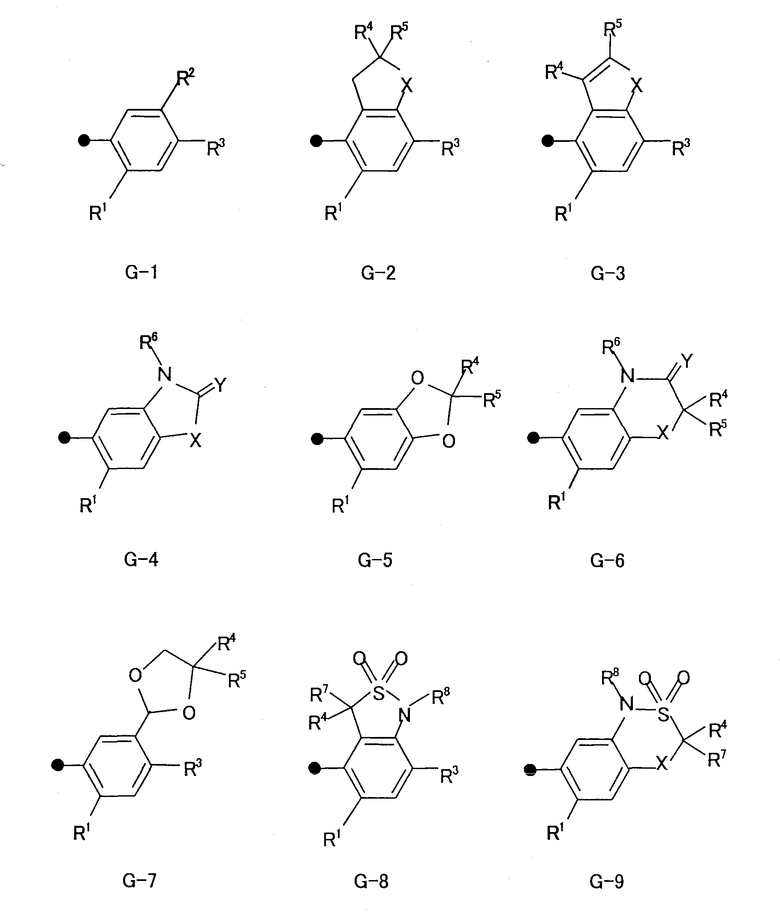
где в G-1 - G-9
Х представляет атом кислорода или атом серы;
Y представляет атом кислорода или атом серы;
R1 представляет атом водорода или атом галогена;
R2 представляет атом водорода, С1-С8алкильную группу, С1-С8галогеналкильную группу, атом галогена, гидроксильную группу, группу -OR9, группу -SH, группу -S(O)pR9, группу -COR9, группу -СО2R9, группу -С(О)SR9, группу -С(О)NR11R12, группу -CONH2, группу -СНО, группу -CR9=NOR18, группу -СН=СR19СО2R9, группу -СН2СНR19СО2R9, группу -CO2N=CR13R14, нитрогруппу, цианогруппу, группу -NHSO2R15, группу -NHSO2NHR15, группу -NR9R20, группу -NH2 или фенильную группу, которая может быть замещена одной или несколькими С1-С4алкильными группами, которые могут быть одинаковыми или различными;
р равно 0, 1 или 2;
R3 представляет С1-С2алкильную группу, С1-С2галогеналкильную группу, группу -ОСН3, группу -SCH3, группу -OCHF2, атом галогена, цианогруппу, нитрогруппу или
С1-С3алкоксигруппу, замещенную фенильной группой, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы, С1-С3галогеналкильной группы, группы OR28, группы
NR11R28, группы SR28, цианогруппы, группы СО2R28 и нитрогруппы;
R4 представляет атом водорода, С1-С3алкильную группу или С1-С3галогеналкильную группу;
R5 представляет атом водорода, С1-С3алкильную группу, С1-С3галогеналкильную группу, циклопропильную группу, винильную группу, С2алкинильную группу, цианогруппу, группу -С(О)R20, группу -СО2R20, группу -С(О)NR20R21, группу
-СНR16R17CN, группу -СR16R17С(О)R20, группу -С16R17CО2R20, группу -СR16R17C(O)NR20R21, группу -CHR16OH, группу -CHR16OC(O)R20 или группу -OCHR16OC(O)NR20R21, или, когда G представляет G-2 или G-6, R4 и R5 могут представлять группу С=О вместе с атомом углерода, к которому они присоединены;
R6 представляет С1-С6алкильную группу, С1-С6галогеналкильную группу, С2-С6алкоксиалкильную группу, С3-С6алкенильную группу или С3-С6алкинильную группу;
R7 представляет атом водорода, С1-С6алкильную группу, С1-С6галогеналкильную группу, атом галогена, группу -S(O)2(С1-С6алкил) или группу -С(=О)R22;
R8 представляет атом водорода, С1-С8алкильную группу, С3-С8циклоалкильную группу, С3-С8алкенильную группу, С3-С8алкинильную группу, С1-С8галогеналкильную группу, С2-С8алкоксиалкильную группу, С3-С8алкоксиалкоксиалкильную группу, С3-С8галогеналкинильную группу, С3-С8галогеналкенильную группу, С1-С8алкилсульфонильную группу, С1-С8галогеналкилсульфонильную группу, С3-С8алкоксикарбонилалкильную группу, группу -S(O)2NH(С1-С8алкил), группу -С(О)R23 или бензильную группу, которая может быть замещена R24 на фенильном кольце;
R9 представляет С1-С8алкильную группу, С3-С8циклоалкильную группу, С3-С8алкенильную группу, С3-С8алкинильную группу, С1-С8галогеналкильную группу, С2-С8алкоксиалкильную группу, С2-С8алкилтиоалкильную группу, С2-С8алкилсульфинилалкильную группу, С2-С8алкилсульфонилалкильную группу,
С4-С8алкоксиалкоксиалкильную группу, С4-С8циклоалкилалкильную группу, С4-С8циклоалкоксиалкильную группу,
С4-С8алкенилоксиалкильную группу, С4-С8алкинилоксиалкильную группу, С3-С8галогеналкоксиалкильную группу,
С4-С8галогеналкенилоксиалкильную группу,
С4-С8галогеналкинилоксиалкильную группу,
С4-С8циклоалкилтиоалкильную группу, С4-С8алкенилтиоалкильную группу, С4-С8алкинилтиоалкильную группу, С1-С4алкильную группу, замещенную феноксигруппой, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы и С1-С3галогеналкильной группы, С1-С4алкильную группу, замещенную бензилоксигруппой, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы и С1-С3галогеналкильной группы, С4-С8триалкилсирилалкильную группу, С2-С8цианоалкильную группу, С3-С8галогенциклоалкильную группу, С3-С8галогеналкенильную группу, С5-С8алкоксиалкенильную группу, С5-С8галогеналкоксиалкенильную группу, С5-С8алкилтиоалкенильную группу, С3-С8галогеналкинильную группу, С5-С8алкоксиалкинильную группу, С5-С8галогеналкоксиалкинильную группу, С5-С8алкилтиоалкинильную группу, С2-С8алкилкарбонильную группу, бензильную группу, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы, С1-С3галогеналкильной группы, группы -OR28, группы -NR11R28, группы -SR28, цианогруппы, группы -СО2R28 и нитрогруппы, группу
-СR16R17СОR10, группу СR16R17CО2R20, группу -СR16R17Р(O)(OR10)2, группу
-СR16R17Р(S)(OR10)2, группу -СR16R17С(O)NR11R12, группу -СR16R17С(O)NH2, группу
-С(=СR26R27)COR10, группу -C(=CR26R27)CO2R20, группу -C(=CR26R27)Р(О)(OR10)2, группу -C(=CR26R27)Р(S)(OR10)2, группу -C(=CR26R27)С(О)NR11R12, группу -C(=CR26R27)С(О)NH2 или любое из колец, показанных в Q-1 - Q-7:
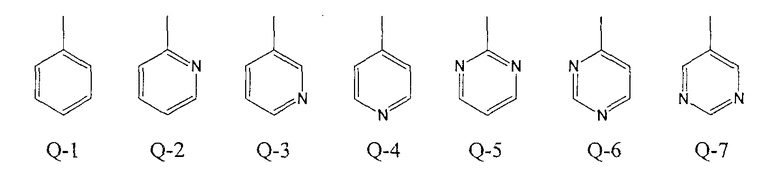
которые могут быть замещены на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С6алкильной группы, С1-С6галогеналкильной группы, С2-С6алкенильной группы, С2-С6галогеналкенильной группы, С2-С6алкинильной группы, С3-С6галогеналкинильной группы, С2-С8алкоксиалкильной группы, группы -OR28, группы -SR28, группы -NR11R28, С3-С8алкоксикарбонилалкильной группы, С2-С4карбоксиалкильной группы, группы -СО2R28 и цианогруппы;
R10 представляет С1-С6алкильную группу, С2-С6алкенильную группу, С3-С6алкинильную группу или тетрагидрофуранильную группу;
R11 и R13 независимо представляют атом водорода или С1-С4алкильную группу;
R12 представляет С1-С6алкильную группу, С3-С6циклоалкильную группу, С3-С6алкенильную группу, С3-С6алкинильную группу, С2-С6алкоксиалкильную группу, С1-С6галогеналкильную группу, С3-С6галогеналкенильную группу, С3-С6галогеналкинильную группу, фенильную группу, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С4алкильной группы и С1-С4алкоксигруппы, или группу -СR16R17CО2R25; или
R11 и R12 вместе могут представлять -(СН2)5-, -(СН2)4- или -СН2СН2ОСН2СН2- или в этом случае полученное кольцо может быть замещено заместителем, выбранным из С1-С3алкильной группы, фенильной группы и бензильной группы;
R14 представляет С1-С4алкильную группу или фенильную группу, которая может быть замещена на кольце заместителем, выбранным из атома галогена, С1-С3алкильной группы и С1-С3галогеналкильной группы; или
R13 и R14 могут представлять С3-С8циклоалкильную группу вместе с атомом углерода, к которому они присоединены;
R15 представляет С1-С4алкильную группу, С1-С4галогеналкильную группу или
С3-С6алкенильную группу;
R16 и R17 независимо представляют атом водорода или С1-С4алкильную группу, С1-С4галогеналкильную группу, С2-С4алкенильную группу, С2-С4галогеналкенильную группу, С2-С4алкинильную группу, С3-С4галогеналкинильную группу; или
R16 и R17 могут представлять С3-С6циклоалкильную группу с атомом углерода, к которому они присоединены, или образованное таким образом кольцо может быть замещено, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы и С1-С3галогеналкильной группы;
R18 представляет атом галогена, С1-С6алкильную группу, С3-С6алкенильную группу или С3-С6алкинильную группу;
R19 представляет атом водорода, С1-С4алкильную группу или атом галогена,
R20 представляет атом водорода, С1-С6алкильную группу, С3-С6циклоалкильную группу, С3-С6алкенильную группу, С3-С6алкинильную группу, С2-С6алкоксиалкильную группу, С1-С6галогеналкильную группу, С3-С6галогеналкенильную группу, С3-С6галогеналкинильную группу, фенильную группу, которая может быть замещена на кольце, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С4алкильной группы и группы -OR28, или группу -СR16R17CО2R25;
R21 представляет атом водорода, С1-С2алкильную группу или группу -СО2(С1-С4алкил);
R22 представляет атом водорода, С1-С6алкильную группу, С1-С6алкоксигруппу или группу NH(С1-С6алкил);
R23 представляет С1-С6алкильную группу, С1-С6галогеналкильную группу, С1-С6алкоксигруппу, группу NH(С1-С6алкил), бензильную группу, С2-С8диалкиламиногруппу или фенильную группу, которая может быть замещена R24;
R24 представляет С1-С6алкильную группу, 1-2 атома галогена, С1-С6алкоксигруппу или группу CF3;
R25 представляет С1-С6алкильную группу, С1-С6галогеналкильную группу, С3-С6алкенильную группу, С3-С6галогеналкенильную группу, С3-С6алкинильную группу или С3-С6галогеналкинильную группу;
R26 и R27 представляют, каждый независимо, атом водорода, С1-С4алкильную группу, С1-С4галогеналкильную группу, С2-С4алкенильную группу, С2-С4галогеналкенильную группу, С2-С4алкинильную группу, С3-С4галогеналкинильную группу, группу -OR28, группу -NHR28 или группу -SR28; или
R26 и R27 могут представлять С3-С8циклоалкильную группу с атомом углерода, к которому они присоединены, или каждое из образованных таким образом колец может быть замещено, по меньшей мере, одним заместителем, выбранным из атома галогена, С1-С3алкильной группы и С1-С3галогеналкильной группы; и
R28 представляет атом водорода, С1-С6алкильную группу, С1-С6галогеналкильную группу, С3-С6алкенильную группу, С3-С6галогеналкенильную группу, С3-С6алкинильную группу, С3-С6галогеналкинильную группу, С2-С4карбоксиалкильную группу, С3-С8алкоксикарбонилалкильную группу,
С3-С8галогеналкоксикарбонилалкильную группу,
С5-С9алкенилоксикарбонилалкильную группу,
С5-С9галогеналкенилоксикарбонилалкильную группу,
С5-С9алкинилоксикарбонилалкильную группу,
С5-С9галогеналкинилоксикарбонилалкильную группу,
С5-С9циклоалкоксикарбонилалкильную группу или
С5-С9галогенциклоалкоксикарбонилалкильную группу;
39. Способ уничтожения сорняков, предусматривающий стадию нанесения соединения в зону культивирования растения, экспрессирующего, по меньшей мере, один белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi;
40. Способ оценки резистентности клетки к соединению формулы (I), предусматривающий:
(1) стадию контактирования указанного соединения с клеткой, экспрессирующей, по меньшей мере, один метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(2) стадию оценки степени повреждения клетки, которая контактировала с соединением на указанной стадии (1);
41. Способ по п.40, где эта клетка является клеткой микроорганизма или клеткой растения;
42. Способ отбора клетки, устойчивой к соединению формулы (I), предусматривающий стадию отбора клетки на основе устойчивости, оцениваемой в способе по п.40;
43. Клетка, устойчивая к гербициду, отобранная с использованием способа по п.42, или ее культура;
44. Способ оценки устойчивости растения к соединению формулы (I), предусматривающий:
(1) стадию контактирования указанного соединения с растением, экспрессирующим, по меньшей мере, один метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(2) стадию оценки степени повреждения растения, которое контактировало с соединением, описанным в стадии (1);
45. Способ отбора растения, устойчивого к соединению формулы (I), предусматривающий стадию отбора растения на основе устойчивости, оцениваемой в способе по п.44.
46. Устойчивое к гербициду растение, выбранное на основе способа по п.45, или его потомство.
47. Способ обработки соединения формулы (I), предусматривающий реакцию указанного соединения в присутствии системы транспорта электронов, содержащей донор электрона с, по меньшей мере, одним метаболизирующим гербицид белком, выбранным из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224;
48. Способ по п.47, где реакция соединения с метаболизирующим гербицид белком происходит посредством контакта соединения с трансформантом, в котором ДНК, кодирующую метаболизирующий гербицид белок, вводят в клетку-хозяина в положении, позволяющем ее экспрессию в указанной клетке;
49. Применение для обработки соединения формулы (I) метаболизирующего гербицид белка, выбранного из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
50. Применение для обработки соединения формулы (I) полинуклеотида, кодирующего метаболизирующий гербицид белок, выбранный из группы, состоящей из:
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает сайт отжига ПЦР-праймеров, используемых для получения ДНК данного изобретения (А1) и ДНК данного изобретения (В1). Каждая из цифр относится к идентификационному номеру последовательности, SEQ ID-номеру, показывающему нуклеотидную последовательность этих праймеров. Стрелки показывают сайты отжига олигонуклеотидных праймеров, имеющих нуклеотидную последовательность, показанную ее SEQ ID-номером, и направление удлинения ДНК-полимеразной реакции от этих праймеров. Пунктирные линии представляют ДНК, амплифицированную при помощи ПЦР с использованием этих праймеров. Толстая линия представляет район, смежный с сайтом встраивания ДНК вектора, используемого для получения библиотеки хромосомной ДНК.
Фиг. 2 показывает сайт отжига ПЦР-праймеров, используемых для получения ДНК данного изобретения (А2) и ДНК данного изобретения (В2). Каждая из цифр относится к идентификационному номеру последовательности, SEQ ID-номеру, показывающему нуклеотидную последовательность этих праймеров. Стрелки показывают сайты отжига олигонуклеотидных праймеров, имеющих нуклеотидную последовательность, показанную ее SEQ ID-номером, и направление удлинения ДНК-полимеразной реакции от этих праймеров. Пунктирные линии представляют ДНК, амплифицированную при помощи ПЦР с использованием этих праймеров. Толстая линия представляет район, смежный с сайтом встраивания ДНК вектора, используемого для получения библиотеки хромосомной ДНК.
Фиг. 3 показывает сайт отжига ПЦР-праймеров, используемых для получения ДНК данного изобретения (А4) и ДНК данного изобретения (В4). Каждая из цифр относится к идентификационному номеру последовательности, SEQ ID-номеру, показывающему нуклеотидную последовательность этих праймеров. Стрелки показывают сайты отжига олигонуклеотидных праймеров, имеющих нуклеотидную последовательность, показанную ее SEQ ID-номером, и направление удлинения ДНК-полимеразной реакции от этих праймеров. Пунктирные линии представляют ДНК, амплифицированную при помощи ПЦР с использованием этих праймеров. Толстая линия представляет район, смежный с сайтом встраивания ДНК вектора, для получения библиотеки хромосомной ДНК. Однако олигонуклеотидный праймер, представленный номером 57, является праймером, который отжигается с районом, смежным с сайтом встраивания ДНК вектора, используемого для получения библиотеки хромосомной ДНК, и не способен отжигаться с ДНК данного изобретения (А4).
Фиг. 4 показывает рестрикционную карту плазмиды pKSN2.
Фиг. 5 показывает рестрикционную карту плазмиды pCRrSt12.
Фиг. 6 показывает рестрикционную карту плазмиды pCR657ET.
Фиг. 7 показывает рестрикционную карту плазмиды pCR657FET.
Фиг. 8 показывает рестрикционную карту плазмиды pCR657Bs.
Фиг. 9 показывает рестрикционную карту плазмиды pCR657FBs.
Фиг. 10 показывает рестрикционную карту плазмиды pUCrSt12.
Фиг. 11 показывает рестрикционную карту плазмиды pUCrSt657.
Фиг. 12 показывает рестрикционную карту плазмиды pUCrSt657F.
Фиг. 13 показывает рестрикционную карту плазмиды pUCCR16G6-p/t.
Фиг. 14 показывает структуру линкера NotI-EcoRI, полученного отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:89, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:90.
Фиг. 15 показывает рестрикционную карту плазмиды pUCCR16G6-p/tΔ.
Фиг. 16 показывает структуру линкера HindI-NotI, полученного отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:91, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:92.
Фиг. 17 показывает рестрикционную карту плазмиды pNdC6-ΔТ.
Фиг. 18 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt657.
Фиг. 19 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt657F.
Фиг. 20 показывает рестрикционную карту плазмиды pKFrSt12.
Фиг. 21 показывает рестрикционную карту плазмиды
pKFrSt12-657.
Фиг. 22 показывает рестрикционную карту плазмиды
pKFrSt12-657F.
Фиг. 23 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-657.
Фиг. 24 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-657F.
Фиг. 25 показывает структуру линкера HindI-NotI-EcoRI, полученного отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:98, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:99.
Фиг. 26 показывает рестрикционную карту плазмиды pBI121S.
Фиг. 27 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-657.
Фиг. 28 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-657F.
Фиг. 29 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-657.
Фиг. 30 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-657F.
Фиг. 31 показывает рестрикционную карту плазмиды pCR923Sp.
Фиг. 32 показывает рестрикционную карту плазмиды
pNdG6-rSt12.
Фиг. 33 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt-923.
Фиг. 34 показывает рестрикционную карту плазмиды
pKFrSt12-923.
Фиг. 35 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-923.
Фиг. 36 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-923.
Фиг. 37 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-923.
Фиг. 38 показывает рестрикционную карту плазмиды pCR671ET.
Фиг. 39 показывает рестрикционную карту плазмиды pCR671Bs.
Фиг. 40 показывает рестрикционную карту плазмиды pUCrSt671.
Фиг. 41 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt-671.
Фиг. 42 показывает рестрикционную карту плазмиды
pKFrSt12-671.
Фиг. 43 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-671.
Фиг. 44 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-671.
Фиг. 45 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-671.
Фиг. 46 показывает результаты, полученные детектированием с использованием электрофореза в агарозном геле ДНК, амплифицированной при помощи ПЦР с применением в качестве праймера олигонуклеотида, имеющего частичную нуклеотидную последовательность ДНК (А) данного изобретения. Дорожки 1, 7, 8, 12, 19, 26, 27, 32, 37, 42 и 47 представляют электрофорез ДНК-маркера (продукта расщепления ϕ 174/HaeIII). Другие дорожки представляют электрофорез проб, показанных в таблицах 20 и 21.
Фиг. 47 показывает структуру линкера, полученного отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:134, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:135.
Фиг. 48 показывает рестрикционную карту плазмиды pUCrSt657soy.
Фиг. 49 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt-657soy.
Фиг. 50 показывает рестрикционную карту плазмиды
pKFrSt12-657soy.
Фиг. 51 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-657soy.
Фиг. 52 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-657soy.
Фиг. 53 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-657soy.
Фиг. 54 показывает рестрикционную карту плазмиды pUCrSt1584soy.
Фиг. 55 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt-1584soy.
Фиг. 56 показывает рестрикционную карту плазмиды
pKFrSt12-1584soy.
Фиг. 57 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-1584soy.
Фиг. 58 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-1584soy.
Фиг. 59 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-1584soy.
Фиг. 60 показывает рестрикционную карту плазмиды pUCrSt1609soy.
Фиг. 61 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt-1609soy.
Фиг. 62 показывает структуру линкера ЕсоТ22I-12аа-ЕсоТ22I, полученного отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:402, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:403.
Фиг. 63 показывает рестрикционную карту плазмиды
pUCrSt12-1609soy.
Фиг. 64 показывает рестрикционную карту плазмиды
pSUM-NdG6-rSt12-1609soy.
Фиг. 65 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt-1609soy.
Фиг. 66 показывает рестрикционную карту плазмиды
pBI-NdG6-rSt12-1609soy.
Аббревиатуры, используемые в приведенных выше фигурах, объясняются ниже.
ДНК А1: ДНК (А1) данного изобретения
ДНК А2: ДНК (А2) данного изобретения
ДНК А3: ДНК (А3) данного изобретения
ДНК А4: ДНК (А4) данного изобретения
ДНК В1: ДНК (В1) данного изобретения
ДНК В2: ДНК (В2) данного изобретения
ДНК В4: ДНК (В4) данного изобретения
ДНК A1S: ДНК (А1)S данного изобретения
ДНК А23S: ДНК (А23)S данного изобретения
ДНК А25S: ДНК (А25)S данного изобретения
tac p: промотор tac
rrnB t: терминатор rrnB
ColE1 ori: сайт инициации репликации плазмиды ColE1
Ampr: ген устойчивости к ампициллину
RuBPCssCTP: нуклеотидная последовательность, кодирующая хлоропластный транзитный пептид малой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы сои (сорта Jack)
12аа: нуклеотидная последовательность, кодирующая 12 аминокислот зрелого белка, находящихся после хлоропластного транзитного пептида малой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы сои (сорта Jack).
Kmr: ген устойчивости к канамицину
F1 ori: сайт инициации репликации плазмиды F1
СR16G6p: промотор CRl6G6
CR16t: терминатор CR16
CR16tΔ: ДНК, в которой нуклеотидная последовательность «справа» от сайта рестрикции рестриктазы ScaI удалена из терминатора CR16
CR16G6pΔ: ДНК, в которой нуклеотидная последовательность «слева» от сайта рестрикции рестриктазы NdeI удалена из терминатора CR16G6
NOSp: промотор гена нопалинсинтазы
NPTII: ген устойчивости к канамицину
NOSt: терминатор гена нопалинсинтазы
GUS: ген β-глюкуронидазы
RB: правая граничная последовательность Т-ДНК
LB: левая граничная последовательность Т-ДНК
NdeI, HindIII, BspHI, EcoRI, BamHI, ЕсоТ221, SphI, KpnI, SacI, BglII, NotI, ScaI: сайты рестрикции соответствующих рестрикционных ферментов (рестриктаз).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже данное изобретение объясняется подробно.
Метаболизирующий гербицид белок, выбранный из следующей группы белков (далее называемый иногда «белком (А) данного изобретения»), способен превращать соединение формулы (II) (далее иногда называемое «соединением (II)») в соединение формулы (III) (далее называемое иногда «соединением (III)»):
<группы белков>
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224;
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224; и
(А28) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, и с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis, Streptomyces steffisburgensis или Saccharopolyspora taberi.
В качестве характерных примеров белка (А) данного изобретения упоминаются:
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:1 (далее иногда называемый “белком (А1) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:2 (далее иногда называемый “белком (А2) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:3 (далее иногда называемый “белком (А3) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:108 (далее иногда называемый “белком (А4) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:159 (далее иногда называемый “белком (А11) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:160 (далее иногда называемый “белком (А12) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:136 (далее иногда называемый “белком (А13) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:137 (далее иногда называемый “белком (А14) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:138 (далее иногда называемый “белком (А15) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:215 (далее иногда называемый “белком (А16) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:216 (далее иногда называемый “белком (А17) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:217 (далее иногда называемый “белком (А18) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:218 (далее иногда называемый “белком (А19) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:219 (далее иногда называемый “белком (А20) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:220 (далее иногда называемый “белком (А21) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:221 (далее иногда называемый “белком (А22) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:222 (далее иногда называемый “белком (А23) данного изобретения”);
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:223 (далее иногда называемый “белком (А24) данного изобретения”); и
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:224 (далее иногда называемый “белком (А25) данного изобретения”).
Например, реакция гербицидного соединения формулы (I) РРО-ингибиторного типа (далее называемого иногда «соединением (I)) с белком (А) данного изобретения способна превращать указанное соединение в соединение с более низкой гербицидной активностью.
Далее, в обработке для превращения соединения (I) в соединение более низкой гербицидной активности может быть также использован метаболизирующий гербицид белок, выбранный из следующей группы (далее называемый иногда «данным белком (А)»):
<группы белков>
(А1) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:1;
(А2) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:2;
(А3) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:3;
(А4) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:108;
(А5) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А6) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А7) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, которая гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108;
(А8) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую ДНК, амплифицируемой полимеразной цепной реакцией с праймером, содержащим нуклеотидную последовательность, показанную в SEQ ID NO:129, праймером, содержащим нуклеотидную последовательность, показанную в любой из SEQ ID NO:124 - SEQ ID NO:128, и с использованием в качестве матрицы хромосомы микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora;
(А9) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:4;
(А11) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность, показанную в SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из последовательностей SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(А27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из последовательностей SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224.
В качестве примеров данного белка (А) может быть упомянут белок А данного изобретения, описанный выше. Кроме того, в качестве других примеров могут быть упомянуты
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4, (далее называемый иногда «данным белком (А9)») и
белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:5, (далее называемый иногда «данным белком (А10)»).
В аминокислотной последовательности белка, показанного в (А5), (А6), (А7), (А8), (А26), (А27) или (А28) в приведенных выше группах белков, различия, которые могут наблюдаться из аминокислотных последовательностей, показанных в SEQ ID NO:1, 2, 3, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223, или 224, являются такими, как делеция, замена и добавление определенных аминокислот. Такие различия включают, например, делецию в результате процессинга, которую указанный выше белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:1, 2, 3, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223 или 224, получает в клетке. Далее, они включают полиморфную вариацию, которая имеет место в природе, происходящую из различия, определяемого видом, индивидуумом или т.п., организма, из которого получают данный белок; аминокислотные делеции, замены и добавления, возникающие в результате генетических мутаций, вводимых искусственным путем, например способом сайт-направленного мутагенеза, способом случайного мутагенеза, обработкой мутагенами и т.п.
Число аминокислот, подвергающихся таким делециям, заменам и добавлениям, может находиться в диапазоне, в котором данный белок (А) может развивать способность превращать соединение (II) в соединение (III). Кроме того, в качестве замены аминокислоты могут быть упомянуты, например, замены на аминокислоту, которая является сходной по гидрофобности, заряду, рК, стереоструктурному признаку или т.п. В качестве таких замен особо упоминаются, например, замены внутри групп: (1) глицин и аланин; (2) валин, изолейцин и лейцин; (3) аспарагиновая кислота, глутаминовая кислота, аспарагин и глутамин; (4) серин и треонин; (5) лизин и аргинин; (6) фенилаланин и тирозин; и т.п.
Далее, в данном белке (А) предпочтительно, чтобы цистеин, присутствующий в положении, совпадающем при сопоставлении с цистеином с аминокислотным номером 357 в аминокислотной последовательности, показанной в SEQ ID NO:1, был сохранен (не подвергался делеции или замене): примеры такого цистеина включают цистеин с аминокислотным номером 350 в аминокислотной последовательности, показанной в SEQ ID NO:2, цистеин с аминокислотным номером 344 в аминокислотной последовательности, показанной в SEQ ID NO:3, цистеин с аминокислотным номером 360 в аминокислотной последовательности, показанной в SEQ ID NO:108; цистеин с аминокислотным номером 359 в аминокислотной последовательности, показанной в SEQ ID NO:4, цистеин с аминокислотным номером 355 в аминокислотной последовательности, показанной в SEQ ID NO:5, цистеин с аминокислотным номером 358 в аминокислотной последовательности, показанной в SEQ ID NO:159, цистеин с аминокислотным номером 374 в аминокислотной последовательности, показанной в SEQ ID NO:160, цистеин с аминокислотным номером 351 в аминокислотной последовательности, показанной в SEQ ID NO:136, цистеин с аминокислотным номером 358 в аминокислотной последовательности, показанной в SEQ ID NO:137, цистеин с аминокислотным номером 358 в аминокислотной последовательности, показанной в SEQ ID NO:138, цистеин с аминокислотным номером 347 в аминокислотной последовательности, показанной в SEQ ID NO:222, цистеин с аминокислотным номером 347 в аминокислотной последовательности, показанной в SEQ ID NO:224 и т.п.
В качестве способов, искусственно вызывающих такие делеции, добавления или замены аминокислот (далее называемые в общем виде “модификацией аминокислот”), упоминается, например, способ, предусматривающий стадии проведения сайт-направленного мутагенеза на ДНК, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:1, 2, 3, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223, или 224, с последующей экспрессией таких ДНК с использованием общепринятого способа. В качестве способа сайт-направленного мутагенеза можно, например, упомянуть способ, который использует амбер-мутации (Gapped Duplex method, Nucleic Acids Res., 12, 9441-9456 (1984)), способ ПЦР, использующий праймеры для введения мутации, и т.п. Кроме того, в качестве искусственной модификации аминокислот упоминается, например, способ, предусматривающий стадии проведения случайного мутагенеза на ДНК, кодирующей любую из аминокислотных последовательностей, показанных в SEQ ID NO:1, 2, 3, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223 или 224, с последующей экспрессией таких ДНК с использованием общепринятого способа. В качестве способа случайного мутагенеза может быть упомянут, например, способ проведения ПЦР с использованием ДНК, кодирующей любую из приведенных выше аминокислотных последовательностей, в качестве матрицы и с использованием пары праймеров, которые могут амплифицировать полную длину каждой из этих ДНК, в условиях, в которых концентрация каждого из dATP, dTTP, dGTP и dCTP, используемых в качестве субстрата, отличается от обычной, или в условиях, в которых концентрация Mg2+, которая стимулирует полимеразную реакцию, увеличена до более высокой концентрации, чем используемая обычно концентрация. В качестве таких способов ПЦР упоминается, например, способ, описанный в Method in Molecular Biology, (31), 1994, 97-112. Кроме того, может быть упомянут способ, описанный в Патентной публикации РСТ WO 00/09682.
В данном изобретении «идентичность последовательности» обозначает гомологию и идентичность между двумя нуклеотидными последовательностями или двумя аминокислотными последовательностями. Такая «идентичность последовательности» может быть определена сравнением двух последовательностей, каждая из которых выравнивается в оптимальном состоянии, на протяжении всего района этих тест-последовательностей. Таким образом, при оптимальном выравнивании тестируемых последовательностей нуклеиновых кислот или аминокислотных последовательностей могут быть использованы добавления или делеции (например, гэпы, т.е. пробелы) как таковые. Такая идентичность последовательности может быть рассчитана посредством стадии получения выравнивания, проводимого анализом гомологии с использованием программы, такой как FASTA (Pearson and Lipman, Proc. Natl. Acad. Sci. USA, 4, 2444-2448 (1988)), BLAST (Altschul et al., Journal of Molecular Biology, 215, 403-410 (1990)), CLUSTAL W (Thompson, Higgins and Gibson, Nucleic Acid Research, 22, 4673-4680 (1994a)) и т.п. Такие программы могут быть, например, обычно использованы на веб-странице (http://www.ddbj.nig.ac.jp) Банка данных ДНК Японии (международного банка данных, работающего в центре информации по биологии, и банка данных по ДНК Японии). Кроме того, идентичность последовательности может быть определена с использованием коммерчески доступного программного обеспечения для анализа последовательности. Например, конкретно, она может быть рассчитана получением выравнивания, проводимого анализом гомологии по способу Lipman-Pearson (Lipman, D.J. and Pearson, W.R., Science, 227, 1435-1441, (1985)) с использованием GENETYX-WIN Ver.5 (Software Development Company, Ltd.).
В качестве «жестких условий», описанных в (А7), могут быть упомянуты, например, условия, в которых гибрид образуется при 45°С в растворе, содержащем 6хSSC (с допущением 10хSSC раствора, содержащего 1,5 М NaCl и 0,15 М тринатрийцитрат), и затем этот гибрид отмывают при 50°С 2хSSC (Molecular Biology, John Wiley and Sons, N.Y. (1989), 6.3.1-6.3.6) при гибридизации, проводимой в соответствии с общепринятым способом, описанным, например, в Sambrook, J., Fritsch, E.F. and Maniatis, T. Molecular Cloning, 2nd Edition, Cold Spring Harbor Press. Концентрация соли в стадии отмывки может быть выбрана, например, из диапазона от условий 2 х SSC (условий низкой жесткости) до условий 0,2 х SSC (условий высокой жесткости). Температура в стадии отмывки может быть выбрана, например, в диапазоне от комнатной температуры (условие низкой жесткости) до 65°С (условие высокой жесткости). Альтернативно, как концентрация соли, так и температура могут быть изменены.
В качестве ДНК, которая «гибридизуется в жестких условиях с ДНК, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 или SEQ ID NO:108», конкретно, например, может быть упомянута ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в любой из SEQ ID NO:1, 2, 3, 4, 5, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223, или 224, ДНК, содержащая нуклеотидную последовательность, показанную в любой из SEQ ID NO:6, 7, 8, 78, 84, 109, 139, 140, 141, 142, 143, 225, 226, 227, 228, 229, 230, 231, 232, 233 или 234, и т.п. Может быть также упомянута ДНК, содержащая нуклеотидную последовательность, имеющую, по меньшей мере, приблизительно 60% идентичность с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:6, 7, 8, 78, 84, 109, 139, 140, 141, 142, 143, 225, 226, 227, 228, 229, 230, 231, 232, 233 или 234.
Молекулярная масса данного белка (А) равна приблизительно 30000-60000 и обычно равна приблизительно 40000-50000 (по сравнению, например, с белком, состоящим из аминокислотной последовательности, показанной в любой из SEQ ID NO:1, 2, 3, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223, или 224), при идентификации этой молекулярной массы электрофорезом в содержащем додецилсульфат натрия полиакриламидном геле (далее называемом «электрофорезом в ДСН-ПААГ»). Кроме того, данный белок (А), пока его способность превращать соединение (I) в соединение (III) не элиминирована, может быть использован в качестве белка, к которому добавлена аминокислотная последовательность «слева» от его амино-конца или «справа» от его карбокси-конца.
В качестве маркера способности данного белка (А) метаболизировать гербицидное соединение РРО-ингибиторного типа формулы (I) может быть упомянута способность превращения соединения (II) в соединение (III). Такая способность может быть, например, подтверждена реакцией соединения (II) с данным белком (А) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, и детектированием получаемого соединения (III).
Термин «система транспорта электронов, содержащая донор электрона», относится к системе, в которой происходит окислительно-восстановительная реакция и электрон переносится от донора электрона к данному белку (А). В качестве донора электрона могут быть, например, упомянуты коферменты НАДФН, НАДН и т.п. Например, в качестве белков, которые могут составлять систему транспорта электронов от НАДФН к данному белку (А), могут быть упомянуты ферредоксин и ферредоксин-НАДФ+-редуктаза, НАДФН-цитохром Р-450-редуктаза и т.п.
Например, для подтверждения способности превращать соединение (II) в соединение (III) реакционный раствор приблизительно рН 7, содержащий данный белок (А), β-НАДФН, ферредоксин, ферредоксин-НАДФ+-редуктазу и соединение (II), меченное радиоактивным изотопом, инкубируют при приблизительно 30°С в течение приблизительно 10 минут - 1 часа. Затем после доведения рН реакционного раствора до кислого рН хлористоводородной кислотой его экстрагируют этилацетатом. После подвергания извлеченного этилацетатного слоя тонкослойной хроматографии (далее называемой “ТСХ”) проводят авторадиографию, и способность превращать соединение (II) в соединение (III) может быть подтверждена детектированием меченого соединения (III).
Для получения данного белка (А), например, сначала получают ДНК, кодирующую данный белок (А) (далее называемую иногда совокупно «данной ДНК (А)»), в соответствии с общепринятыми способами генной инженерии (например, способы, описанные в Sambrook, J., Fritsch, E.F. and Maniatis, T. Molecular Cloning, 2nd Edition, Cold Spring Harbor Press).
В качестве примеров данной ДНК (А) может быть упомянута ДНК, кодирующая белок (А) данного изобретения (далее иногда называемая «ДНК (А) данного изобретения»). В качестве характерных примеров ДНК (А) данного изобретения могут быть упомянуты:
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:1 (далее называемая иногда «ДНК (А1) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:2 (далее называемая иногда «ДНК (А2) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:3 (далее называемая иногда «ДНК (А3) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:108 (далее называемая иногда «ДНК (А4) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:159 (далее называемая иногда «ДНК (А11) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:160 (далее называемая иногда «ДНК (А12) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:136 (далее называемая иногда «ДНК (А13) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:137 (далее называемая иногда «ДНК (А14) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:138 (далее называемая иногда «ДНК (А15) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:215 (далее называемая иногда «ДНК (А16) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:216 (далее называемая иногда «ДНК (А17) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:217 (далее называемая иногда «ДНК (А18) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:218 (далее называемая иногда «ДНК (А19) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:219 (далее называемая иногда «ДНК (А20) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:220 (далее называемая иногда «ДНК (А21) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:221 (далее называемая иногда «ДНК (А22) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:222 (далее называемая иногда «ДНК (А23) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:223 (далее называемая иногда «ДНК (А24) данного изобретения»);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:224 (далее называемая иногда «ДНК (А25) данного изобретения»); и т.п.
Далее, в качестве более характерных примеров ДНК (А) данного изобретения могут быть упомянуты:
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:6;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:9;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:7;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:10;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:8;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:11;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:109;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:110;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:139;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:144;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:140;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:145;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:141;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:146;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:142;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:147;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:143;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:148;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:225;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:235;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:226;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:236;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:227;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:237;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:228;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:238;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:229;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:239;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:230;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:240;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:231;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:241;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:232;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:242;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:233;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:243;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:234;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:244;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:214;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:368;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:393;
ДНК, кодирующая белок, способный превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), и имеющая, по меньшей мере, 80% идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:6, 7, 8 или 109;
ДНК, кодирующая белок, способный превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), и имеющая, по меньшей мере, 90% идентичность последовательности с нуклеотидными последовательностями, показанными в любой из SEQ ID NO:139, 140, 141, 142, 143, 225, 226, 227, 228, 229, 230, 231, 232, 233 или 234; и т.п.
Далее, в качестве примеров данной ДНК (А), кроме ДНК (А) данного изобретения, приведенной выше, упоминаются:
ДНК, содержащая нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4 (далее называемая иногда «данной ДНК (А9)»);
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:78;
ДНК, содержащая нуклеотидную последовательность, кодирующую белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:5 (далее называемая иногда «данной ДНК (А10)»);
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:84;
ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:85; и т.д.
Данная ДНК (А) может быть, например, ДНК, клонированной из природного источника, и может быть ДНК, полученной введением делеции, замены или добавления нуклеотида (нуклеотидов) в ДНК, клонированную из природного источника, например, способом сайт-направленного мутагенеза, способом случайного мутагенеза, и может быть искусственно синтезированной ДНК. Затем данный белок (А) может быть продуцирован или получен экспрессией полученной данной ДНК (А) в соответствии с общепринятыми способами генной инженерии. Такими путями может быть получен данный белок (А).
Данная ДНК (А) может быть получена, например, следующими способами. Сначала получают хромосомную ДНК общепринятыми способами генной инженерии, такими как описанные в Molecular Cloning: A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press; и Current Protocols in Molecular Biology (1987), John Wiley and Sons, Incorporated, из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces carbophilus, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces carbophilus SANK62585, Streptomyces griseofuscus IFO 12870t, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t, и т.п. Затем, после частичного расщепления хромосомной ДНК рестриктазой, такой как Sau3AI, извлекают ДНК размером приблизительно 2 т.п.н. Полученную ДНК клонируют в вектор в соответствии с общепринятыми способами генной инженерии, описанными в Molecular Cloning: A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press; и Current Protocols in Molecular Biology (1987), John Wiley and Sons, Incorporated. В качестве вектора, например, может быть использован плазмидный вектор pUC 119 (TaKaRa Shuzo Company), pTVA 118N (Takara Shuzo Compani), pBlueScript II (Toyobo Company), pCR2.1-TOPO (Invitrogen), pTrc99A (Amersham Pharmacia Biotech Company), pKK331-1A (Amersham Pharmacia Biotech Company) и т.п. Библиотека хромосомной ДНК может быть получена экстракцией плазмиды из полученного клона.
Данная ДНК (А) может быть получена гибридизацией зонда с полученной библиотекой хромосомной ДНК в условиях, описанных ниже, и детектированием и извлечением ДНК, которая связана специфически с этим зондом. Зондом может быть ДНК, состоящая из приблизительно, по меньшей мере, 20 нуклеотидов, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в одной из SEQ ID NO:1, 2, 3 или 108. В качестве характерных примеров ДНК, которые могут быть использованы в качестве зондов, упоминаются ДНК, содержащая нуклеиновую кислоту, показанную в любой из SEQ ID NO:6, 7, 8 или 109; ДНК, содержащая частичную нуклеотидную последовательность последовательности нуклеиновой кислоты, показанной в любой из SEQ ID NO:6, 7, 8 или 109; ДНК, содержащая нуклеотидную последовательность, комплементарную указанной частичной нуклеотидной последовательности; и т.п.
ДНК, используемую в качестве зонда, метят радиоактивным изотопом, флуоресцентным окрашиванием или т.п. Для мечения ДНК радиоактивным изотопом, может быть, например, использован набор для случайного мечения Boehringer или Takara Shuzo Company. Кроме того, ДНК, меченная 32Р, может быть получена проведением ПЦР. ДНК, подлежащую зондированию, используют в качестве матрицы. dCTP, обычно используемый в реакционном растворе ПЦР, заменяют (α-32Р)dCTP. Кроме того, при мечении ДНК флуоресцентным окрашиванием, например, может быть использован набор для мечения и детектирования DIG-High Prime DNA Labelling and Detection Starter Kit II (Roche Company).
Далее объясняется характерный пример получения зонда. Например, ДНК, меченная дигоксигенином, содержащая полноразмерную нуклеотидную последовательность, показанную в SEQ ID NO:6, может быть получена с использованием хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO 12898, как описано выше, или библиотеки хромосомной ДНК в качестве матрицы, с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:93, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:94, и проведением ПЦР, как описано в примерах, приведенных ниже, например, с набором для синтеза зондов PCR DIG Probe Synthesis Kit (Roche Diagnostics GmbH) в соответствии с прилагаемым руководством. Подобным образом, ДНК, меченная дигоксигенином, содержащая нуклеотидную последовательность от нуклеотида 57 до нуклеотида 730 SEQ ID NO:6, может быть получена с использованием хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO 12898, описанной выше, или библиотеки хромосомной ДНК в качестве матрицы. Что касается праймеров, эту ПЦР проводят с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:130, и олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:131. Кроме того, ДНК, меченная дигоксигенином, содержащая полноразмерную нуклеотидную последовательность, показанную в SEQ ID NO:7, может быть получена с использованием хромосомной ДНК, полученной из Saccharopolyspora taberi JCM 9383t, описанной выше, или библиотеки хромосомной ДНК в качестве матрицы. Что касается праймеров, эту ПЦР проводят с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:61, и олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:62. Кроме того, ДНК, меченная дигоксигенином, содержащая полноразмерную нуклеотидную последовательность, показанную в SEQ ID NO:8, может быть получена с использованием хромосомной ДНК, полученной из Streptomyces testaceus ATCC21469, описанной выше, или библиотеки хромосомной ДНК в качестве матрицы. Что касается праймеров, эту ПЦР проводят с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:70, и олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:71. Кроме того, ДНК, меченная дигоксигенином, содержащая нуклеотидную последовательность от нуклеотида 21 до нуклеотида 691 SEQ ID NO:8, может быть получена с использованием хромосомной ДНК, полученной из Streptomyces testaceus ATCC21469, описанной выше, или библиотеки хромосомной ДНК в качестве матрицы. Что касается праймеров, эту ПЦР проводят с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:132, и олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:133.
Способы, при помощи которых зонду дают возможность гибридизоваться с библиотекой хромосомной ДНК, могут включать гибридизацию колоний и гибридизацию бляшек, и может быть выбран подходящий способ, который является совместимым с типом вектора, используемого для приготовления данной библиотеки. При конструировании используемой библиотеки с использованием плазмидных векторов проводят гибридизацию колоний. Конкретно, сначала получают трансформанты введением ДНК этой библиотеки в микроорганизм, в котором плазмидный вектор, использованный для конструирования этой библиотеки, является реплицируемым. Полученные трансформанты разводят и распределяют на чашку с агаром и культивируют до появления колоний. При использовании фагового вектора для конструирования библиотеки проводят гибридизацию бляшек. Конкретно, сначала микроорганизм, в котором используемый для получения библиотеки фаговый вектор является реплицируемым, смешивают с фагом этой библиотеки в условиях, в которых является возможным инфицирование. Затем эту смесь смешивают с мягким агаром. Затем смесь распределяют на чашку с агаром. После этого смесь культивируют до появления бляшек.
Затем, в случае любой из описанных выше гибридизаций помещают мембрану на поверхность чашки с агаром, в которой проводили культивирование, и колонии трансформантов или частицы фага в бляшках переносят на эту мембрану. После щелочной обработки мембраны проводят нейтрализующую обработку. Затем ДНК, элюированную из трансформантов или фаговых частиц, фиксируют на данной мембране. Более конкретно, например, в событии гибридизации бляшек, фаговые частицы абсорбируют на мембране помещением нитроцеллюлозной мембраны или найлоновой мембраны, в частности, например, Hybond-N+ ((Amersham Pharmacia Biotech Company), на чашку с агаром и выжидают в течение 1 минуты. Мембрану погружают в раствор щелочи (1,5 М NaCl и 0,5 н. NaOH) на приблизительно 3 минуты для растворения фаговых частиц и элюции фаговой ДНК на мембрану. Затем мембрану пропитывают в нейтрализующем растворе (1,5 М NaCl и 0,5М Трис-HCl-буфер рН 7,5) в течение приблизительно 5 минут. После отмывания этой мембраны в отмывочном растворе (0,3 М NaCl, 30 мМ цитрат натрия, 0,2 М Трис-HCl-буфер рН 7,5) в течение, например, приблизительно 5 минут ДНК фага фиксируют на мембране инкубированием при приблизительно 80°С в течение приблизительно 90 минут.
С использованием приготовленной таким образом мембраны проводят гибридизацию с описанной выше ДНК в качестве зонда. Гибридизацию можно проводить, например, в соответствии с описанием в Molecular Cloning, A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press, и т.п.
Хотя для проведения гибридизации пригодны различные температурные условия и реагенты, мембрану, полученную, как описано выше, пропитывают и выдерживают в течение 1 - 4 часов при 42-65°С в предгибридизационном растворе, который готовят при соотношении 50 мкл - 200 мкл на 1 см2 мембраны. Например, предгибридизационный раствор может содержать 450 - 900 мМ NaCl и 45 - 90 мМ цитрат натрия, может содержать додецилсульфат натрия (далее называемый “ДСН”) в концентрации 0,1-1,0% и может содержать денатурированную неспецифическую ДНК в концентрации от 0 до 200 мкг/мл и может иногда содержать альбумин, фикол и поливинилпирролидон, каждый в концентрации 0-0,2%. Затем мембрану, например, пропитывают и выдерживают в течение 12 - 20 часов при 42-65°С в гибридизационном растворе, который готовят при соотношении от 50 до 200 мкл на 1 см2 мембраны. Гибридизационный раствор является, например, смесью предгибридизационного раствора, который может содержать 450 - 900 мМ NaCl и 45 - 90 мМ цитрат натрия, может содержать ДСН в концентрации 0,1-1,0% и может содержать денатурированную неспецифическую ДНК в концентрации от 0 до 200 мкг/мл и может иногда содержать альбумин, фикол и поливинилпирролидон, каждый в концентрации 0-0,2%, с зондом, полученным по способу получения, описанному выше (в относительном количестве 1,0х104 имп/мин - 2,0х106 имп/мин на 1 см2 мембраны). Затем мембрану удаляют и отмывают в течение 5 - 15 минут приблизительно 2-4 раза с использованием отмывочного раствора 42-65°С, который содержит 15 - 300 мМ NaCl, 1,5 - 30 мМ цитрат натрия и 0,1-1,0% ДСН. Затем, после легкого споласкивания 2хSSC-раствором (300 мМ NaCl и 30 мМ цитрат натрия) мембрану сушат. Посредством детектирования положения зонда на мембране подверганием мембраны авторадиографии идентифицируют положение ДНК, гибридизующейся с используемым зондом на мембране. Альтернативно, предгибридизацию и гибридизацию можно проводить с использованием коммерчески доступного набора для гибридизации, например с использованием гибридизационного раствора, содержащегося в наборе DIG-High Prime DNA Labelling and Detection Starter Kit II (Roche). После гибридизации мембрану отмывают, например, дважды в течение 5 минут при комнатной температуре в 2хSSC, содержащем 0,1% ДСН, с последующим отмыванием дважды в течение 15 минут при 65°С в 0,5хSSC, содержащем 0,1% ДСН. Положения ДНК на мембране, гибридизующихся с используемым зондом, детектируют поочередно обработкой отмытой мембраны раствором для детектирования, содержащимся в указанном наборе, и детектированием положения зонда на мембране.
Клоны, соответствующие положениям детектированных ДНК на мембране, идентифицируют на исходной агаровой среде, и они могут быть извлечены выскребанием для выделения клонов, несущих эти ДНК.
Данная ДНК (А), полученная, как описано выше, может быть клонирована в вектор в соответствии с общепринятыми способами генной инженерии, описанными в Molecular Cloning: A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press; и Current Protocols in Molecular Biology (1987), John Wiley and Sons, Incorporated и т.п. В качестве вектора, например, может быть использован, конкретно, плазмидный вектор pUCА119 (Takara Shuzo Company), pTVA118N (Takara Shuzo Compani), pBlueScript II (Toyobo Company), pCR2.1-TOPO (Invitrogen Company), pTrc99A (Pharmacia Company), pKK331-1A (Pharmacia Company) и т.п.
Далее, нуклеотидная последовательность данной ДНК (А), полученная в соответствии с приведенным выше описанием, может быть подвергнута анализу при помощи способа, использующего дидезокситерминацию, описанного в F. Sanger, S. Nicklen, A.R. Coulson, Proc. Natl. Acad. Sci. USA (1977) 74:5463-5467. Для приготовления пробы для анализа нуклеотидной последовательности может быть использован коммерчески доступный реагент, такой как ABI PRISM Dye Terminator Cycle Sequencing Ready Reaction Kit (Perkin Elmer Company).
Данная ДНК (А) может быть также получена следующим образом. Данная ДНК (А) может быть амплифицирована проведением ПЦР. ПЦР может использовать в качестве матрицы хромосомную ДНК или библиотеку хромосомной ДНК, полученную, как описано выше, из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces carbophilus, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces carbophilus SANK62585, Streptomyces griseofuscus IFO 12870t, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t и т.п. ПЦР может также использовать олигонуклеотид, содержащий, по меньшей мере, приблизительно 20 нуклеотидов 5'-конца нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO: 1, 2, 3, 4, 5, 108, 159, 160, 136, 137, 138, 215, 216, 217, 218, 219, 220, 221, 222, 223 или 224, с олигонуклеотидом, содержащим нуклеотидную последовательность, комплементарную, по меньшей мере, приблизительно 20 нуклеотидам, смежным с 3'-концом или «справа» от 3'-конца нуклеотидной последовательности, кодирующей любую из аминокислотных последовательностей, приведенных выше. ПЦР может проводиться при условиях, описанных ниже. На 5'-концевой стороне праймера, используемого для ПЦР, как описано выше, может быть добавлена последовательность узнавания рестриктазой.
Более конкретно, например, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:1, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:6, или т.п. может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO 12898, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:51, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:52. Альтернативно, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:9 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:1), может быть амплифицирована проведением ПЦР с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:51, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:53.
Например, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:2, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:7, или т.п. может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Saccharopolyspora taberi JCM 9383t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:61, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:62. Альтернативно, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:10 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:2), может быть амплифицирована проведением ПЦР с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:61, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:63.
Например, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:108, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:109, или т.п. может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces achromogenes IFO 12735, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:119, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:120. Альтернативно, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:110 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:108), может быть амплифицирована проведением ПЦР с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:119, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:121.
Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:144 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:159), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces nogalater IFO 13445, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:165, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:166.
Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:145 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:160), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces tsusimaensis IFO 13782, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:171, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:172.
Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:146 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:136), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces thermocoerulescens IFO 14273t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:177, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:178.
Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:147 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:137), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces glomerochromogenes IFO 13673t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:183, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:184.
Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:148 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:138), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces olivochromogenes IFO 12444, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:184, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:185.
При применении в качестве матрицы библиотеки ДНК, в которой хромосомная ДНК введена, например, в вектор, данная ДНК (А) может быть также амплифицирована проведением ПЦР с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, выбранную из нуклеотидной последовательности, кодирующей любую из аминокислотных последовательностей, показанных в SEQ ID NO:1, 2, 3, 4, 5, 108, 159, 160, 136, 137 или 138 (например, олигонуклеотида, содержащего нуклеотидную последовательность из, по меньшей мере, приблизительно 20 нуклеотидов 5'-концевой стороны нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:1), и олигонуклеотида из, по меньшей мере, приблизительно 20 нуклеотидов, содержащего нуклеотидную последовательность, комплементарную нуклеотидной последовательности, смежной с сайтом ДНК-встраивания вектора, используемого для конструирования библиотеки. На стороне 5'-конца праймера, используемого для ПЦР, как описано выше, может быть добавлена последовательность узнавания рестриктазой.
В качестве условий для описанной выше ПЦР, может быть упомянуто условие поддержания 97°С в течение 2 минут, затем повторение 10 циклов, где каждый цикл включает поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд и затем 72°С в течение 2 минут; затем проведение 15 циклов, где каждый цикл включает поддержание 97°С в течение 15 секунд, затем 68°С в течение 30 секунд и затем 72°С в течение 2 минут (с добавлением 20 секунд к каждому циклу поочередно); и затем поддержание 72°С в течение 7 минут. Эта ПЦР может использовать реакционный раствор 50 мкл, содержащий 50 нг хромосомной ДНК, содержащий 300 нМ каждого из 2 праймеров в таких парах, как описанные выше, содержащий 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из четырех типов dNTP), содержащий 5,0 мкл 10хExpand HF-буфера (содержащего MgCl2, Roche Molecular Biochemicals Company) и содержащий 0,75 мкл смеси ферментов Expand HiFi (Roche Molecular Biochemicals Company).
Альтернативно, может быть упомянуто условие поддержания 97°С в течение 2 минут, затем повторение 30 циклов, где каждый цикл включает поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 90 секунд; и затем поддержание реакционного раствора при 72°С в течение 4 минут. Эта ПЦР может использовать реакционный раствор 50 мкл, содержащий 250 нг хромосомной ДНК, содержащий 200 нМ каждого из 2 праймеров в таких парах, как описанные выше, содержащий 5,0 мкл dNTP-смеси (смеси 2,5 мМ каждого из 4 типов dNTP), 5 мкл 10хExTaq-буфера (содержащего MgCl2, Takara Shuzo Company) и содержащий 0,5 мкл ExTaq-полимеразы (Takara Shuzo Company).
Альтернативно, например, олигонуклеотиды могут быть сконструированы и приготовлены для применения в качестве праймеров на основе нуклеотидной последовательности района, в отношении которого идентичность последовательности является особенно высокой, в нуклеотидной последовательности, показанной в SEQ ID NO:6, 7, 8 или 109. Данная ДНК (А) может быть также получена проведением ПЦР с использованием полученных олигонуклеотидов в качестве праймеров и хромосомной ДНК или библиотеки хромосомной ДНК. Хромосомная ДНК или библиотека хромосомной ДНК могут быть получены, как описано выше, из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces carbophilus, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces carbophilus SANK62585, Streptomyces griseofuscus IFO 12870t, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t и т.п. В качестве «района, в отношении которого идентичность последовательности является особенно высокой, в нуклеотидной последовательности, показанной в SEQ ID NO:6, 7, 8 или 109», упоминается, например, район, соответствующий району, состоящему из нуклеотидов 290-315, 458-485, 496-525 или 1046-1073 в нуклеотидной последовательности, показанной в SEQ ID NO:6. В качестве праймеров, сконструированных на основе таких районов этой нуклеотидной последовательности, может быть упомянут, например, праймер, содержащий нуклеотидную последовательность, показанную в любой из SEQ ID NO:124-129.
SEQ ID NO:124 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 290-315;
SEQ ID NO:125 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 458-485;
SEQ ID NO:126 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 458-485;
SEQ ID NO:127 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 496-525;
SEQ ID NO:128 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 496-525; и
SEQ ID NO:129 основана на нуклеотидной последовательности района, соответствующего району, состоящему из упомянутых выше нуклеотидов 1046-1073.
Например, ДНК из приблизительно 800 п.н. амплифицируют с использованием в качестве праймеров пары из олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК из приблизительно 600 п.н. амплифицируют с использованием в качестве праймеров пары из олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:125, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК из приблизительно 600 п.н. амплифицируют с использованием в качестве праймеров пары из олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:126, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК из приблизительно 580 п.н. амплифицируют с использованием в качестве праймеров пары из олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:127, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. Кроме того, ДНК из приблизительно 580 п.н. амплифицируют с использованием в качестве праймеров пары из олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:128, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129.
В качестве условий для ПЦР, в частности, например, может быть упомянуто условие поддержания 95°С в течение 1 минуты; повторение в течение 30 циклов, где цикл включает поддержание 94°С в течение 15 секунд, затем 65°С в течение 30 секунд и затем 72°С в течение 1 минуты; и затем поддержание 72°С в течение 5 минут. Может быть использован реакционный раствор 25 мкл, содержащий 10 нг хромосомной ДНК, содержащий 200 нМ каждого из 2 праймеров, содержащий 0,5 мкл смеси dNTP (смеси 10 мМ каждого из 4 типов dNTP), содержащий 5 мкл 5х реакционного буфера для GC-геномной ПЦР, содержащий 5 мкл 5М GC-расплава и содержащий 0,5 мкл смеси геномной полимеразы Advantage-GC genomic polymerase mix (Clontech Company).
Посредством извлечения ДНК, амплифицированной, как описано выше, может быть получена ДНК, содержащая частичную нуклеотидную последовательность данной ДНК (А). Затем, на основе нуклеотидной последовательности, которую имеет полученная «ДНК, содержащая частичную нуклеотидную последовательность данной ДНК (А)», конструируют и получают олигонуклеотид, содержащий частичную нуклеотидную последовательность из, по меньшей мере, приблизительно 20 нуклеотидов указанной нуклеотидной последовательности, или олигонуклеотид, содержащий нуклеотидную последовательность, комплементарную частичной нуклеотидной последовательности из, по меньшей мере, приблизительно 20 нуклеотидов указанной нуклеотидной последовательности. ДНК, содержащая частичную нуклеотидную последовательность данной ДНК (А), удлиненная «справа» от 3'-конца или «слева» от 5'-конца «ДНК, содержащей частичную нуклеотидную последовательность данной ДНК (А)», полученная, как описано выше, может быть получена проведением ПЦР. Эта ПЦР может использовать в качестве праймеров пару из олигонуклеотида, полученного, как описано выше на основе нуклеотидной последовательности «ДНК, содержащей частичную нуклеотидную последовательность данной ДНК (А)», и олигонуклеотида из, по меньшей мере, приблизительно 20 нуклеотидов, содержащего нуклеотидную последовательность района, смежного с сайтом ДНК-встраивания вектора, используемого для конструирования вышеуказанной библиотеки, или олигонуклеотида из, по меньшей мере, приблизительно 20 п.н., содержащего нуклеотидную последовательность, комплементарную такой нуклеотидной последовательности этого района. Эта ПЦР может, например, использовать в качестве матрицы библиотеку хромосомной ДНК, полученную из микроорганизмов, которые способны превращать соединение (II) в соединение (III), как описано выше. Соединением такой ДНК, содержащей частичную нуклеотидную последовательность данной ДНК (А), можно получить данную ДНК (А). В таком способе получения может быть использован коммерчески доступный набор, такой как Universal Genome Walker (Clontech Company). Альтернативно, данная ДНК (А) может быть получена проведением ПЦР посредством получения праймеров на основе полноразмерной нуклеотидной последовательности данной ДНК (А), полученной соединением частичных нуклеотидных последовательностей данной ДНК (А), как описано выше, с использованием таких праймеров и с использованием в качестве матрицы библиотеки хромосомной ДНК, как описано выше.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 316-1048 SEQ ID NO:139 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:159), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces nogalater IFO 13445, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:144 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:159, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:149), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 364-1096 SEQ ID NO:140 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:160), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces tsusimaensis IFO 13782, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:145 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:150, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:160), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 295-1027 SEQ ID NO:141 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:136), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces thermocoerulensis IFO 14273t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:146 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:136, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:151), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 316-1048 SEQ ID NO:142 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:137), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces glomerochromogenes IFO 13673t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:147 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:137, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:152), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 316-1048 SEQ ID NO:143 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:138), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces olivochromogenes IFO 12444, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:148 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:138, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:153), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 289-1015 SEQ ID NO:232 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:222), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces roseorubens IFO 13682t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:242 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:232, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:252), может быть получена соединением полученных ДНК.
Например, ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 289-1015 SEQ ID NO:234 (частичной нуклеотидной последовательности нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:224), может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces steffisburgensis IFO 13446t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:124, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129. ДНК, содержащую нуклеотидную последовательность, удлиненную справа от ее 3'-конца или слева от ее 5'-конца, получают в соответствии с приведенным выше описанием на основе нуклеотидной последовательности полученной ДНК. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:244 (содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:234, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:254), может быть получена соединением полученных ДНК.
Данная ДНК (А), полученная с использованием ПЦР, как описано выше, может быть клонирована в вектор в соответствии с общепринятыми способами генной инженерии, описанными в Molecular Cloning: A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press; и Current Protocols in Molecular Biology (1987), John Wiley and Sons, Incorporated и т.п. Например, конкретно, клонирование может проводиться с использованием плазмидных векторов, таких как pBlueScript II Stratagene Company, или плазмидного вектора, содержащегося в наборе для клонирования ТА Invitrogen Company.
Далее, данная ДНК (А) может быть получена, например, как описано ниже. Сначала конструируют нуклеотидную последовательность. Эта нуклеотидная последовательность кодирует аминокислотную последовательность белка, кодируемого данной ДНК (А). Эта нуклеотидная последовательность имеет содержание GC максимально 60% и минимально 40%, предпочтительно максимально 55% и минимально 45%. Использование кодонов в нуклеотидной последовательности, кодирующей аминокислотную последовательность указанного выше белка, находится в диапазоне плюс или минус 4% использования кодонов в генах из вида клетки-хозяина, в которую вводят данную ДНК (А). Посредством получения ДНК, имеющей сконструированную нуклеотидную последовательность, в соответствии с общепринятыми способами генной инженерии может быть получена данная ДНК (А).
Например, может быть сконструирована описанным ниже способом нуклеотидная последовательность, кодирующая аминокислотную последовательность (SEQ ID NO:1) белка данного изобретения (А1) и имеющая содержание GC максимально 55% и минимально 45%, где использование кодонов в этой нуклеотидной последовательности, кодирующей аминокислотную последовательность указанного выше белка, находится в диапазоне плюс или минус 4% использования кодонов в генах из сои. Сначала, например, сравнивают использование кодонов (таблица 22 и таблица 23) в нуклеотидной последовательности (SEQ ID NO:6), кодирующей аминокислотную последовательность белка (А1) данного изобретения, которая может быть получена из Streptomyces phaeochromogenes IFO12898, и использование кодонов в сое (таблица 24 и таблица 25). На основании результата этого сравнения добавляют нуклеотидные замены в нуклеотидную последовательность, показанную в SEQ ID NO:6, так что содержание GC составляет максимально 55% и минимально 45% и использование кодонов находится в диапазоне плюс или минус 4% использования кодонов сои. В качестве такой нуклеотидной замены выбирают нуклеотидную замену, которая не приводит к замене аминокислоты. Например, использование кодона CTG, кодирующего лейцин, составляет 1,22% в генах сои и 7,09% в нуклеотидной последовательности, показанной в SEQ ID NO:6. В результате, например, каждый из кодонов CTG, начинающийся от нуклеотидов 106, 163, 181, 226, 289, 292, 544, 1111 и 1210 нуклеотидной последовательности, показанной в SEQ ID NO:6, заменяют на кодоны СТТ; каждый из кодонов CTG, начинающийся от нуклеотидов 211, 547 и 1084, заменяют на кодоны СТА; кодон CTG, начинающийся от нуклеотида 334, заменяют на кодон ТТА; каждый из кодонов CTG, начинающихся от нуклеотидов 664, 718, 733, 772, 835, 1120 и 1141, заменяют на кодон TTG; и кодон CTG, начинающийся от нуклеотида 787, заменяют кодоном ТТА. В SEQ ID NO:214 показана одна нуклеотидная последовательность, сконструированная таким образом, использование кодонов в которой показано в таблице 26 и таблице 27. В нуклеотидной последовательности, показанной в SEQ ID NO:214, например, использование кодона CTG, кодирующего лейцин, составляет 1,71% и находится в диапазоне плюс или минус 4% использования кодонов (1,22%) сои. ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:214, может быть получена введением нуклеотидных замен в ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:6, в соответствии со способами сайт-направленного мутагенеза, описанными, например, в Sambrook, J., Fritsch, E.F. and Maniatis, T.; Molecular Cloning, 2nd Edition, Cold Spring Harbor Press. Альтернативно, ДНК, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:214, может быть получена способом синтеза ДНК, использующим ПЦР, описанным в примере 46 ниже.
Подобным образом, нуклеотидная последовательность, показанная в SEQ ID NO:368, является примером конструирования нуклеотидной последовательности, кодирующей аминокислотную последовательность (SEQ ID NO:222) белка (А23) данного изобретения и имеющей содержание GC максимально 55% и минимально 45%, где использование кодонов в нуклеотидной последовательности, кодирующей аминокислотную последовательность указанного выше белка, находится в диапазоне плюс или минус 4% использования кодонов для генов из сои. Далее, нуклеотидная последовательность, показанная в SEQ ID NO:393, является примером конструирования нуклеотидной последовательности, кодирующей аминокислотную последовательность (SEQ ID NO:224) белка (А25) данного изобретения и имеющей содержание GC максимально 55% и минимально 45%, где использование кодонов в нуклеотидной последовательности, кодирующей аминокислотную последовательность указанного выше белка, находится в диапазоне плюс или минус 4% использования кодонов для генов из сои.
Данная ДНК (А), полученная таким путем, может быть клонирована в вектор в соответствии с общепринятыми способами генной инженерии, описанными в Sambrook, J., Fritsch, E.F. and Maniatis, T.; “Molecular Cloning, 2nd Edition” (1989) Cold Spring Harbor Press; и “Current Protocols in Molecular Biology” (1987), John Wiley and Sons, Incorporated и т.п. В качестве вектора, например, могут быть использованы, конкретно, плазмидный вектор pUC 119 (Takara Shuzo Company), pTVA 118N (Takara Shuzo Compani), pBlueScript II (Toyobo Company), pCR2.1-TOPO (Invitrogen Company), pTrc99A (Pharmacia Company), pKK331-1A (Pharmacia Company) и т.п.
Далее, нуклеотидная последовательность данной ДНК (А), полученная таким путем, может быть подвергнута анализу при помощи способа, использующего дидезокситерминацию, описанного в F. Sanger, S. Nicklen, A.R. Coulson, Proceedings of National Academy of Science USA (1977) 74:5463-5467.
Способность метаболизировать гербицидное соединение РРО-ингибиторного типа формулы (I) данного белка (А), который кодируется данной ДНК (А), полученной способом, описанным выше, может быть подтверждена способностью превращения соединения (II) в соединение (III) в качестве маркера способом, описанным ниже. Сначала, как описано ниже, указанную ДНК встраивают в вектор, так что она присоединяется справа от промотора, который может функционировать в данной клетке-хозяине, и этот вектор вводят в клетку-хозяина для получения трансформанта. Затем культуру трансформанта или экстракт, полученный в результате разрушения этой культуры, подвергают взаимодействию с соединением (II) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН. Образующиеся в результате продукты реакции анализируют для детектирования соединения (III). Таким путем может быть детектирован трансформант, способный метаболизировать соединение (II) и продуцировать соединение (III), и может быть определено, что такой трансформант несет данную ДНК (А), кодирующую белок, имеющий такую способность. Более конкретно, например, готовят 30 мкл реакционного раствора, состоящего из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего культуру или экстракт вышеуказанного трансформанта, донор электрона, такой как β-НАДФН, в конечной концентрации приблизительно 2 мМ, ферредоксин, полученный из шпината, в конечной концентрации приблизительно 2 мг/мл, ферредоксинредуктазу в конечной концентрации приблизительно 0,1 Е/мл и 3 м.д. соединения (II), меченного радиоактивным изотопом. Этот реакционный раствор инкубируют при приблизительно 30 - 40°С в течение 10 минут - 1 часа. После такой инкубации добавляют 3 мкл 2 н. HCl и 90 мкл этилацетата, перемешивают и центрифугируют при 8000 g для получения супернатанта. После сушки этого супернатанта в вакууме остаток растворяют в этилацетате и полученный раствор проявляют на ТСХ-пластинке силикагеля. ТСХ-пластинку анализируют с использованием авторадиографии. Посредством идентификации пятен, соответствующих соединению (III), меченному радиоактивным изотопом, может быть подтверждена способность превращать соединение (II) в соединение (III).
Поиск ДНК, кодирующей белок, способный превращать соединение (II) в соединение (III), или микроорганизма, имеющего такую ДНК, может быть дополнительно проведен гибридизацией или ПЦР, как описано выше, с использованием ДНК (А) данного изобретения или полинуклеотида, содержащего частичную нуклеотидную последовательность указанной ДНК, или нуклеотидную последовательность, комплементарную этой частичной нуклеотидной последовательности.
В частности, проводят, например, гибридизацию, как описано выше, и идентифицируют ДНК, с которой гибридизуется зонд. Гибридизацию проводят с использованием ДНК (А) данного изобретения или полинуклеотида, содержащего частичную нуклеотидную последовательность ДНК (А) данного изобретения, или нуклеотидную последовательность, комплементарную этой частичной нуклеотидной последовательности, в качестве зонда и геномной ДНК, полученной из природного микроорганизма, например микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces carbophilus, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens и Streptomyces rutgersensis и Streptomyces steffisburgensis; микроорганизмов, принадлежащих к Saccharopolyspora, например Saccharopolyspora taberi; и т.п. В качестве характерных примеров ДНК, которые могут быть использованы в качестве зонда, могут быть упомянуты ДНК, содержащая полноразмерную нуклеотидную последовательность, показанную в любой из SEQ ID NO:6, 7, 8, 109, 139, 140, 141, 142, 143, 225, 226, 227, 228, 229, 230, 231, 232, 233 или 234; ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 57-730 нуклеотидной последовательности, показанной в SEQ ID NO:6; ДНК, содержащая нуклеотидную последовательность, состоящую из нуклеотидов 21-691 нуклеотидной последовательности, показанной в SEQ ID NO:8; и т.п.
Альтернативно, может проводиться ПЦР, как описано выше, и может детектироваться амплифицированная ДНК. ПЦР использует полинуклеотид, содержащий частичную нуклеотидную последовательность ДНК (А) данного изобретения, или нуклеотидную последовательность, комплементарную этой частичной нуклеотидной последовательности. ПЦР использует в качестве матрицы геномную ДНК, полученную из природного микроорганизма, например из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces carbophilus, Streptomyces griseofuscus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis; микроорганизмов, принадлежащих к Saccharopolyspora, например Saccharopolyspora taberi; и т.п. В качестве праймеров могут быть упомянуты праймеры, которые были сконструированы на основе нуклеотидной последовательности «района, идентичность последовательности в отношении которого является особенно высокой в нуклеотидной последовательности, показанной в SEQ ID NO:6, 7, 8 или 109», как описано выше. В качестве более конкретных примеров этих праймеров упоминаются пары из праймера, содержащего нуклеотидную последовательность, показанную в любой из SEQ ID NO:124-128, и праймера, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:129.
Детектированную таким образом ДНК выделяют. Когда выделенная ДНК не содержит полноразмерную нуклеотидную последовательность данной ДНК (А), такую ДНК используют и превращают в ДНК, соответствующую полноразмерной нуклеотидной последовательности, способом, описанным выше. Полученную ДНК вводят в клетку-хозяина для получения трансформанта. Способность превращать соединение (II) в соединение (III) белка, кодируемого ДНК, введенной в трансформант, может оцениваться с использованием культур полученного трансформанта и измерением способности превращения соединения (II) в соединение (III) способом, описанным выше.
Для экспрессии данной ДНК (А) в клетке-хозяине данную ДНК (А) вводят в клетку-хозяина в положении, позволяющем ее экспрессию в указанной клетке. Под введением данной ДНК (А) в «положение, позволяющее ее экспрессию» имеют в виду, что данную ДНК (А) вводят в клетку-хозяина таким образом, что она помещается в положение, соседнее с нуклеотидной последовательностью, управляющей транскрипцией и трансляцией из этой нуклеотидной последовательности (т.е., например, нуклеотидной последовательностью, контролирующей продуцирование данного белка (А) и РНК, кодирующей данный белок (А)).
Для введения данной ДНК (А) в клетку-хозяина таким образом, что она помещается в положение, позволяющее ее экспрессию, например, ДНК, в которой данная ДНК (А) и промотор, функциональный в данной клетке-хозяине, являются функционально связанными, вводят в клетку-хозяина. Термин “функционально связанные” означает здесь то состояние, в котором данная ДНК (А) связана с промотором таким образом, что она экспрессируется под контролем этого промотора при введении этой ДНК в клетку-хозяина.
Когда клетка-хозяин является клеткой микроорганизма, в качестве функционального промотора могут быть, например, упомянуты промотор оперона лактозы E. coli, промотор оперона триптофана E. coli, промотор фага Т7 или искусственные промоторы, функциональные в E. coli, такие как промотор tac или промотор trc и т.п. Далее, может быть использован промотор, исходно присутствующий слева от данной ДНК (А) в хромосоме микроорганизма, принадлежащего к Streptomyces или Saccharopolyspora.
Когда клетка-хозяин является клеткой растения, в качестве функционального промотора могут быть упомянуты, например, полученные из Т-ДНК конститутивные промоторы, такие как промотор гена нопалинсинтазы и промотор гена октопинсинтазы; полученные из вирусов растений промоторы, такие как промоторы 19S и 35S вируса мозаики цветной капусты; индуцируемые промоторы, такие как промотор гена фенилаланинаммиаклиазы, промотор гена халконсинтазы и промотор гена связанного с патогенезом белка; промотор растения, описанный в Японской публикации еще не прошедшей экспертизу заявки на патент с номером 2000-166577. Далее, терминатор, функциональный в клетке растения, может быть связан с ДНК, в которой функционально связаны промотор, функциональный в клетке растения, и данная ДНК (А). В этом случае обычно является предпочтительным, чтобы терминатор был связан «справа» от данной ДНК (А). В качестве функционального терминатора упоминаются, например, полученные из Т-ДНК конститутивные терминаторы, такие как терминатор гена нопалинсинтазы (NOS); полученные из вирусов растений терминаторы, такие как терминаторы вируса лука (Allium) GV1 или GV2; терминатор растения, описанный в Японской публикации еще не прошедшей экспертизу заявки на патент с номером 2000-166577, и т.п.
При введении данной ДНК (А) таким образом, что эта ДНК помещается в положение, разрешающее ее экспрессию, например, может быть использована ДНК, имеющая нуклеотидную последовательность, кодирующую сигнал (переноса) транзита во внутриклеточную органеллу, присоединенная «слева» от данной ДНК (А) таким образом, что рамки считывания находятся в одной рамке считывания. Под термином присоединенная “таким образом, что рамки считывания находятся в одной рамке считывания”, имеется в виду, что рамка считывания последовательности сигнала (переноса) транзита во внутриклеточную органеллу и рамка считывания данной ДНК (А) являются соединенными с образованием одной непрерывной рамки считывания. В качестве транзитной сигнальной последовательности, обеспечивающей транзицию и локализацию белка во внутриклеточной органелле в клетке растения, могут быть упомянуты, например, транзитная сигнальная последовательность, происходящая из цитоплазматического предшественника белка, локализующегося в хлоропласте растения, как описано в Патенте США с номером 5717084, химерные последовательности, образованные из различных транзитных сигнальных последовательностей, описанные в Патенте США с номером RE36449. Более конкретно, упоминается хлоропластный транзитный пептид, полученный из малой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы сои, который может быть получен в соответствии со способом, описанным в примере 15 ниже.
Обычно, данная ДНК (А), данная ДНК (А), к которой присоединена ДНК, имеющая нуклеотидную последовательность, кодирующую сигнал (переноса) транзита во внутриклеточную органеллу, как описано выше, или ДНК, в которой такая ДНК функционально связана с промотором, функциональным в клетке-хозяине, может быть встроена в вектор, применимый в клетке-хозяине, и этот вектор вводят в клетку-хозяина. При применении вектора, уже обладающего промотором, функциональным в данной клетке-хозяине, данная ДНК (А) может быть встроена справа от промотора, присутствующего в векторе, так что указанный промотор и данная ДНК (А) могут быть функционально связаны.
В качестве вектора, в частности, при применении E. coli в качестве клетки-хозяина, могут быть, например, упомянуты pUC 119 (Takara Shuzo Company), pTVA 118N (Takara Shuzo Company), pBlueScript II (Stratagene Company), pCR2.1-TOPO (Invitrogen), pTrc99A (Amersham Pharmacia Biotech Company), pKK331-1A (Amersham Pharmacia Biotech Company), рЕТ11d (Novagen) и т.п. С использованием вектора, содержащего селективный маркер (например, гены, придающие устойчивость к антибиотику, такие как ген устойчивости к канамицину, ген устойчивости к неомицину и т.п.), преимущество заключается в том, что трансформант, в который введена данная ДНК, может быть отобран по фенотипу селективного маркера в качестве индикатора.
В качестве способа введения данной ДНК (А) или вектора, содержащего данную ДНК (А), в клетку-хозяина может быть упомянут способ, описанный в Shin Seikagaku Zikken Kouza (Nippon-Seikagaku-Kai eds., Tokyo Kagaku Dozin), Vol. 17, Biseibutu-Zikken-Hou, когда клеткой-хозяином является микроорганизм, например, E. coli, Bacillus subtilis, Bacillus brevis, Pseudomonas sp., Zymomonas sp., молочнокислые бактерии, уксуснокислые бактерии, Staphylococcus sp., Streptomyces sp., Saccharopolyspora sp. или дрожжи, такие как Saccharomyces cerevisiae, Schizosaccharomyces ponmbe, гриб, такой как Aspergillus, и т.п. Альтернативно, например, может быть использован кальций-хлоридный способ, описанный в Sambrook, J., Fritsch, E.F. and Maniatis, T.; “Molecular Cloning, 2nd Edition”, Cold Spring Harbor Press (Molecular Biology, John Wiley and Sons, N.Y. (1989); или “Current Protocols in Molecular Biology” (1987), John Wiley and Sons, Incorporated, или способ электропорации, описанный в “Methods in Electroporation: Gene Pulser/E. coli Pulser System”, Bio-Rad Laboratories (1993).
Трансформант, в который была введена данная ДНК (А) или вектор, содержащий данную ДНК (А), может быть, например, отобран на фенотип селективного маркера, содержащегося в векторе, в который данная ДНК (А) была встроена, как описано выше, в качестве индикатора. Далее, содержание в трансформанте данной ДНК (А) или вектора, содержащего данную ДНК (А), может быть подтверждено получением ДНК из этого трансформанта и затем проведением с полученной ДНК способов анализа генной инженерии, описанных, например, в “Molecular Cloning, 2nd Edition”, Cold Spring Harbor Press (Molecular Biology, John Wiley and Sons, N.Y. (1989) (таких как подтверждение сайтов рестриктаз, секвенирование ДНК, гибридизации по Саузерну, ПЦР и т.п.).
Когда клеткой-хозяином является клетка растения, могут быть упомянуты, например, двудольные, такие как табак, хлопчатник, рапс, сахарная свекла, Arabidopsis, канола, лен, подсолнечник, картофель, люцерна, салат, банан, соя, горох, растение из семейства бобовых, сосна, тополь, яблоня, виноград, апельсин, лимон, другие цитрусовые плоды, миндаль, лесной орех, другие орехи; однодольные, такие как кукуруза, рис, пшеница, ячмень, рожь, овес, сорго, сахарный тростник и газонные травы; и т.п. В качестве клетки, в которую вводят данную ДНК (А), могут быть упомянуты ткань растения, целое растение, культивируемые клетки, семена и т.п.
В качестве способов введения данной ДНК (А) или вектора, содержащего данную ДНК (А), в клетку-хозяина упоминаются такие способы, как инфицирование Agrobacterium (публикация прошедшей экспертизу заявки на патент Японии № 2-58917 и публикация еще не прошедшей экспертизу заявки на патент Японии № 60-70080), электропорация в протопласты (публикация еще не прошедшей экспертизу заявки на патент Японии № 60-251887 и публикация еще не прошедшей экспертизу заявки на патент Японии № 5-68575) или способ дробовика (или ружья) для частиц (публикация еще не прошедшей экспертизу заявки на патент Японии № 5-508316 и публикация еще не прошедшей зкспертизу заявки на патент Японии № 63-258525).
В таких случаях, например, трансформант, в который была введена данная ДНК, может быть отобран по фенотипу селектируемого маркера в качестве индикатора введением в клетку растения одновременно с вектором, содержащим данную ДНК (А), селективного маркера, выбранного из гена гигромицинфосфотрансферазы, гена неомицинфосфотрансферазы и гена хлорамфениколацетилтрансферазы. Ген селективного маркера и данная ДНК (А) могут быть встроены в один и тот же вектор и введены в клетку-хозяина. Вектор, содержащий ген селективного маркера, и вектор, содержащий данную ДНК (А), могут также вводиться одновременно. Трансформант, в который была введена данная ДНК (А), может быть также отобран культивированием в среде, содержащей гербицидное соединение РРО-ингибиторного типа формулы (I), и выделением клона, способного размножаться в этой среде. Содержит ли этот трансформант данную ДНК (А), может быть подтверждено получением ДНК из трансформанта и затем проведением с полученной ДНК способов анализа генной инженерии, описанных, например, в “Molecular Cloning, 2nd Edition”, Cold Spring Harbor Press (Molecular Biology, John Wiley and Sons, N.Y. (1989) (таких как подтверждение сайтов рестриктаз, секвенирование ДНК, гибридизации по Саузерну, ПЦР и т.п.). Данная ДНК (А), введенная в клетку-хозяина, может сохраняться в местоположениях в этой клетке, других, чем ДНК, содержащаяся в ядре, будучи инсертированной в ДНК, содержащуюся во внутриклеточных органеллах, таких как хлоропласт.
Из трансформированной клетки растения, полученной таким путем, может быть получено трансгенное растение, в которое была введена данная ДНК (А), регенерацией целого растения по способу культивирования клеток растений, описанного в Shokubutu-Idenshi-Sosa-Manual: Transgenic-Shokubutu-No-Tukurikata (Uchimiya, Kodansha-Scientific, 1990), pp. 27-55. Кроме того, требуемый тип растения, в который введена данная ДНК (А), может быть получен скрещиванием требуемого типа растения с трансгенным растением, в который введена данная ДНК (А), так что данная ДНК (А) вводится в хромосому требуемого типа растения.
В частности, например, рис или Arabidopsis, имеющие введенную в них данную ДНК (А) и экспрессирующие данный белок (А), могут быть получены по способу, описанному в Model-Shokubutu-No-Jikken-Protocol: Ine, Shiroinunazuna-Hen (Supervisors: Koh SHIMAMOTO and Kiyotaka OKADA, Shujun-sha, 1996), Fourth chapter. Кроме того, может быть получена соя, имеющая введенную в нее данную ДНК (А) и экспрессирующая данный белок (А), введением в соматический зародыш сои с использованием ружья для частиц в соответствии со способом, описанным в публикации еще не прошедшей зкспертизу заявки на патент Японии № 3-291501. Подобным образом, кукуруза, имеющая введенную в нее данную ДНК (А) и экспрессирующая данный белок (А), может быть получена введением в соматический зародыш кукурузы с использованием ружья для частиц в соответствии со способом, описанным Fromm, M.E., et al., Bio/Technology, 8; p 838 (1990). Пшеница, имеющая введенную в нее данную ДНК (А) и экспрессирующая данный белок (А), может быть получена введением этого гена в стерильно культивируемый незрелый скутеллум пшеницы с использованием ружья для частиц в соответствии с общепринятым способом, описанным Takumi et al., Journal of Breeding Society (1995), 44; Extra Vol. 1, p 57. Подобным образом, ячмень, имеющий введенную в него данную ДНК (А) и экспрессирующий данный белок (А), может быть получен введением в стерильно культивируемый незрелый скутеллум ячменя с использованием ружья для частиц в соответствии с общепринятым способом, описанным Hagio, et al., Journal of Breeding Society (1995), 44; Extra Vol. 1, p 67.
Трансформант, имеющий введенную в него данную ДНК (А) и экспрессирующий данный белок (А), может уменьшать повреждение растения соединением (I) посредством превращения указанного гербицидного соединения в соединение меньшей гербицидной активности в его клетках. В частности, например, распределением микроорганизма, экспрессирующего данный белок (А), на зону культивирования желаемого культивируемого растения перед высевом семян данного растения гербицидное соединение, оставшееся в почве, может быть метаболизировано и повреждение желаемого растения может быть уменьшено. Кроме того, в результате получения желаемой разновидности растения, экспрессирующего данный белок (А), способность метаболизировать гербицидное соединение РРО-ингибиторного типа формулы (I) до соединения более низкой активности передается указанному растению. В результате, повреждение растения этим гербицидным соединением в данном растении уменьшается и придается устойчивость к указанному соединению.
Данный белок (А) может быть получен, например, культивированием клетки, содержащей данную ДНК (А). В качестве такой клетки может быть упомянут микроорганизм, экспрессирующий данную ДНК (А) и имеющий способность продуцировать данный белок (А), такой как штамм микроорганизма, выделенный из природного источника, содержащий данную ДНК (А), мутантные штаммы, полученные из этого природного штамма обработкой агентами или ультрафиолетовыми лучами или т.п. Более конкретно, например, могут быть упомянуты микроорганизмы, принадлежащие к Streptomyces, такие как Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces carbophilus SANK62585, Streptomyces griseofuscus IFO 12870t, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или микроорганизмы, принадлежащие к Saccharopolyspora, такие как Saccharopolyspora taberi JCM 9383t и т.п. Далее, может быть упомянут трансформант, в который была введена данная ДНК (А) или вектор, содержащий данную ДНК (А). Конкретно, например, упоминается трансформант, в котором данная ДНК (А), функционально связанная с промотором tac, промотором trc, промотором lac или промотором фага T7, введена в E. coli. В качестве более конкретных примеров упомянуты E.coli JM109/pKSN657, E.coli JM109/pKSN657F, E.coli JM109/pKSN923, E.coli JM109/pKSN923F, E.coli JM109/pKSN11796, E.coli JM109/pKSN11796F, E.coli JM109/pKSN671, E.coli JM109/pKSN671F, E.coli JM109/pKSNSCA, E.coli JM109/pKSN646, E.coli JM109/pKSN646F, E.coli JM109/pKSN849AF, E.coli JM109/pKSN1618F, E.coli JM109/pKSN474F, E.coli JM109/pKSN1491AF, E.coli JMl09/pKSN1555AF, E.coli JM109/pKSN1584F, E.coli JM109/pKSN1609F и т.п., описанные в приведенных ниже примерах.
В качестве среды для культивирования вышеуказанных микроорганизмов, содержащих данную ДНК (А), может быть использована любая из сред, обычно применяемых для культивирования микроорганизма, которая содержит источники углерода и источники азота, органические и неорганические соли по мере необходимости. Может быть добавлено соединение, которое является предшественником гема, такое как аминолевулиновая кислота.
В качестве источника углерода упоминаются, например, сахариды, такие как глюкоза, фруктоза, сахароза и декстрин; сахароспирты, такие как глицерин и сорбит; и органические кислоты, такие как фумаровая кислота, лимонная кислота и пировиноградная кислота; и т.п. Количество источников углерода, перечисленных выше, которое должно быть добавлено в среду, обычно равно приблизительно 0,1% (мас./об.) - 10% (мас./об.) в расчете на общее количество данной среды.
В качестве источника азота упоминаются, например, соли аммония неорганических кислот, такие как хлорид аммония, сульфат аммония и фосфат аммония; соли аммония органических кислот, такие как фумарат аммония и цитрат аммония; органические источники азота, такие как мясной экстракт, дрожжевой экстракт, экстракт солода, порошок сои, замочная вода кукурузы, порошок семян хлопчатника, высушенные дрожжи, гидролизат казеина; а также аминокислоты. Среди перечисленных выше источников азота наиболее часто применимыми могут быть соли аммония органических кислот, органические источники азота и аминокислоты, так же как и источники углерода. Количество источников азота, которое должно быть добавлено в среду, обычно равно приблизительно 0,1% (мас./об.) - 10% (мас./об.) в расчете на общее количество данной среды.
В качестве неорганической соли упоминаются, например, фосфаты, такие как фосфат калия, дикалий-фосфат, фосфат натрия, динатрий-фосфат; хлориды, такие как хлорид калия, хлорид натрия, гексагидрат хлорида кобальта; сульфаты, такие как сульфат магния, гептагидрат сульфата трехвалентного железа, гептагидрат сульфата цинка, тригидрат сульфата марганца и т.п. Количество, которое должно быть добавлено, обычно равно приблизительно 0,0001% (мас./об.) - 1% (мас./об.) в расчете на общее количество данной среды.
В случае культивирования трансформанта, удерживающего данную ДНК (А), присоединенную «справа» от промотора фага Т7, и ДНК, в которой нуклеотидная последовательность, кодирующая РНК-полимеразу Т7 (лизоген λ DE3), присоединена «справа» от промотора lac UV5, обычно может быть добавлено небольшое количество, например, изопропил-β-D-тиогалактозида (далее называемого «IPTG») в качестве индуктора для индукции продуцирования данного белка (А). IPTG может быть также добавлен к среде в случае культивирования трансформанта, имеющего введенную в него ДНК, в которой данная ДНК (А) функционально связана с типом промотора, который индуцируется лактозой, такого как промотор tac, промотор trc и промотор lac.
Микроорганизм, содержащий данную ДНК (А), может культивироваться в соответствии со способом, используемым обычно для культивирования микроорганизма, в том числе жидкофазным культивированием, таким как культивирование с ротационным встряхиванием, культивирование с вибрационным возвратно-поступательным встряхиванием, ферментация в контейнерах (культивирование с использованием ферментеров-контейнеров) и культивирование в танках (чанах); или твердофазным культивированием. При применении ферментера-контейнера обычно в этот ферментер должен вводиться асептический воздух при скорости аэрации приблизительно 0,1 - приблизительно 2 объема культуральной жидкости в минуту. Температура, при которой выполняют культивирование, может варьироваться в диапазоне, позволяющем микроорганизму расти, и обычно находится в диапазоне от приблизительно 15°С до приблизительно 40°С, и рН среды находится обычно в диапазоне от приблизительно 6 до приблизительно 8. Время культивирования может варьироваться в зависимости от условий культивирования и обычно равно приблизительно 1 дню - приблизительно 10 дням.
Данный белок (А), продуцируемый микроорганизмом, содержащим данную ДНК (А), может быть использован, например, в различных формах при обработке гербицидного соединения РРО-ингибиторного типа формулы (I), таких как культура микроорганизма, продуцирующего данный белок (А), клетка микроорганизма, продуцирующая данный белок (А), материал, полученный обработкой такой клетки, бесклеточный экстракт микроорганизма, грубо очищенный белок, очищенный белок и т.п. Материал, полученный обработкой клетки, описанный выше, включает, например, лиофилизированную клетку, высушенную ацетоном клетку, растертую клетку, автолизат клетки, обработанную ультразвуком клетку, обработанную щелочью клетку, обработанную органическим растворителем клетку и т.п. Альтернативно, данный белок (А) в любой из различных форм, описанных выше, может быть иммобилизован в соответствии с известными способами, такими как способ связывания с носителем, использующий адсорбцию на неорганическом носителе, таком как силикагель или керамический материал, производное полисахарида, такое как ДЭАЭ-целлюлоза, синтезированный полимер, такой как Амберит IRA-935 (товарное название, изготовляемый Rohm and Haas) и т.п., и способ включения, использующий включение в пространственный полимерный матрикс, такой как полиакриламид, серусодержащий полисахаридный гель (например, каррагенановый гель), гель альгиновой кислоты, агаровый гель и т.п., и затем использован при обработке описанного выше гербицидного соединения.
В качестве способов очистки данного белка (А) из культуры микроорганизма, содержащего данную ДНК (А), могут быть использованы общепринятые способы, используемые в очистке белка. Например, может быть упомянут следующий способ.
Сначала клетки собирают из культуры микроорганизма центрифугированием или подобным способом и затем разрушают физически обработкой ультразвуком, обработкой DYNOMILL, обработкой FRENCH-прессом и т.п. или разрушают химически с использованием поверхностно-активного вещества или лизирующего клетки фермента, такого как лизоцим. Из полученного таким образом лизата нерастворимые вещества удаляют центрифугированием, фильтрованием через мембрану или т.п. с получением бесклеточного экстракта, который затем фракционируют любыми подходящими средствами для разделения и очистки, такими как катионообменная хроматография, анионообменная хроматография, гидрофобная хроматография, гель-фильтрационная хроматография и т.п., с получением таким образом очищенного данного белка (А). Поддерживающие материалы, используемые в такой хроматографии, включают, например, смолу-носитель, такую как целлюлоза, декстран и агароза, соединенные с карбоксиметильной (КМ) группой, диэтиламиноэтильной (ДЭАЭ) группой, фенильной группой или бутильной группой. Может быть использована также коммерчески доступная колонка, уже упакованная любым носителем, таким как Q-Sepharose FF, Phenyl-Sepharose HP, PD-10 и HiLoad 26/10 Q-Sepharose HP (товарное название, из Amersham Pharmacia Biotech), TSK-gel G3000SW (товарное название, TOSOH CORPORATION).
Приводится один пример очистки данного белка (А).
Клетки микроорганизма, продуцирующие данный белок (А), собирают центрифугированием и затем суспендируют в буфере, таком как 0,1 М фосфат калия (рН 7,0). Эту суспензию обрабатывают ультразвуком для разрушения клеток и полученный таким образом лизат центрифугируют при приблизительно 40000 g в течение приблизительно 30 минут с получением супернатанта, который затем центрифугируют при 150000 g в течение приблизительно 1 часа для извлечения супернатанта (бесклеточного экстракта). Полученный бесклеточный экстракт подвергают фракционированию сульфатом аммония с получением фракции, которая является растворимой в присутствии 45%-насыщенного сульфата аммония и осаждается при 55%-насыщенном сульфате аммония. После замены растворителя этой фракции буфером, не содержащим сульфата аммония, например, 1 М фосфатом калия, с использованием колонки PD10 (Amersham Pharmacia Biotech Company), полученную фракцию наносят, например, на колонку HiLoad 26/10 Q-Sepharose HP (Amersham Pharmacia Biotech Company). Колонку элюируют 20 мМ бистриспропаном с линейным градиентом NaCl для получения серии фракций элюата. Фракции, обнаруживающие активность в превращении соединения (II) в соединение (III) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, извлекают. Затем, после замены буфера в этих фракциях с использованием, например, колонки PD10 (Amersham Pharmacia Biotech Company), полученные фракции наносят на колонку Bio-Scale Ceramic, например гидроксиапатитную колонку СНТ10-I типа I (Bio-Rad Compamy). После промывания этой колонки буфером А (2 мМ калий-фосфатный буфер, содержащий 1,5 мМ CaCl2; рН 7,0), колонку элюируют буфером А с линейным градиентом буфера В (100 мМ калий-фосфатный буфер, содержащий 0,03 мМ CaCl2) с получением серии фракций элюата. Фракции, обнаруживающие активность в превращении соединения (II) в соединение (III) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, извлекают. Затем, после замены буфера в этих фракциях с использованием, например, колонки PD10 (Amersham Pharmacia Biotech Company), полученные фракции концентрируют, например, с использованием ультрафильтрации (microcon filter unit mickrocon-30; Millipore Company). Полученную фракцию вводят, например, в колонку 75 пг HiLoad 16/60 Superdex (Amersham Pharmacia Biotech Company) и элюируют 0,05 М калий-фосфатным буфером, содержащим 0,15 М NaCl (рН 7,0), с получением серии фракций элюата. Фракции, обнаруживающие активность в превращении соединения (II) в соединение (III) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, извлекают. Данный белок (А) может быть очищен разделением электрофорезом в ДСН-ПААГ, если требуется.
Очисткой белка (А) данного изобретения описанным выше способом, с последующим использованием полученного белка (А) данного изобретения в качестве иммунного антигена, может быть получено антитело, узнающее белок (А) данного изобретения (далее иногда называемое «антителом (А) данного изобретения»)).
Конкретно, например, животное иммунизируют данным белком (А), очищенным, как описано выше, в качестве антигена. Например, для иммунизации животного, такого как мышь, хомячок, морская свинка, курица, крыса, кролик, собака или т.п., антиген вводят, по меньшей мере, один раз с использованием общепринятого способа иммунизации, описанного, например, в W.H. Newsome, J. Assoc. Off. Anal. Chem. 70(6) 1025-1027 (1987). В качестве схемы введения упоминается, например, введение 2 или 3 раза при 7-30-дневных интервалах, предпочтительно при 12-16-дневных интервалах. Доза его введения равна, например, от приблизительно 0,05 мг до 2 мг антигена на каждое введение. Способ введения может быть выбран из подкожного введения, внутрикожного введения, внутрибрюшинного введения, внутривенного введения и внутримышечного введения, причем инъекция, предоставляемая внутривенно, интраабдоминально или подкожно, является типичной формой введения. Этот антиген используют обычно после растворения в подходящем буфере, например натрий-фосфатном буфере, или физиологическом солевом растворе, содержащем, по меньшей мере, один тип обычно используемого адъюванта, такого как полный адъювант Фрейнда (смесь Aracel A, Bayol F и мертвых туберкулезных бацилл), системы адъювантов RAS [MPL (монофосфориллипид А) + TDM (синтетический дикориномиколат трегалозы) + CWS (скелет клеточной стенки)] или гидроксид алюминия. Однако в зависимости от способа или условий введения описанные адъюванты могут не использоваться. Термин «адъювант» обозначает вещество, которое при введении с антигеном усиливает иммунную реакцию неспецифически против этого антигена. После содержания животного, которому вводят антиген, в течение 0,5-4 месяцев берут небольшое количество крови, например, из ушной вены животного и измеряют титр антител. Когда титр антител увеличивается, антиген вводят дополнительно в течение подходящего количества введений, в зависимости от конкретных случаев. Например, антиген может вводиться еще один раз в дозе приблизительно 100 - 1000 мкг. Спустя один или два месяца после последнего введения кровь собирают обычным способом из иммунизированного животного. Фракционированием этой крови общепринятыми способами, такими как осаждение центрифугированием или сульфатом аммония или полиэтиленгликолем, хроматографией, такой как гель-фильтрационная хроматография, ионообменная хроматография и аффинная хроматография и т.п., антитело (А) данного изобретения может быть получено в виде поликлональной антисыворотки. Далее, эта антисыворотка может быть инкубирована, например, при 56°С в течение 30 минут для инактивации системы комплемента.
Альтернативно, полипептид, содержащий частичную аминокислотную последовательность белка (А) данного изобретения, синтезируют химически и вводят в качестве иммунного антигена животному с получением таким образом антитела (А) данного изобретения. В качестве аминокислотной последовательности полипептида, используемого в качестве иммунного антигена, выбирают аминокислотную последовательность, которая имеет по возможности наиболее низкую гомологию с аминокислотными последовательностями других белков, из аминокислотных последовательностей белка (А) данного изобретения. Полипептид, имеющий длину 10 - 15 аминокислот, состоящий из выбранной аминокислотной последовательности, синтезируют химически общепринятым способом и сшивают, например, с белком-носителем, таким как гемоцианин Limulus plyhemus, с использованием MBS и т.п., и затем используют для иммунизации животного, такого как кролик, как описано выше.
Затем полученное антитело (А) данного изобретения приводят в контакт с тест-пробой, и затем комплекс этого белка в тест-пробе с антителом, описанным выше, детектируют общепринятым иммунологическим способом, с детектированием таким образом белка (А) данного изобретения или полипептида, содержащего его частичную аминокислотную последовательность, в тест-пробе. Конкретно, например, можно оценивать присутствие белка (А) данного изобретения или определять количество белка (А) данного изобретения в испытуемой тест-пробе при помощи Вестерн-блот-анализа с использованием антитела (А) данного изобретения, как показано в примерах 45 или 73 ниже.
Далее, например, клетка, экспрессирующая данный белок (А), может быть детектирована контактированием антитела (А) данного изобретения с тест-клеткой или тест-пробой, полученной из этой тест-клетки, с последующим детектированием комплекса описанного выше антитела и белка в тест-клетке или тест-пробе, полученной из этой тест-клетки, в соответствии с общепринятыми иммунологическими способами. Детектированием клетки, экспрессирующей белок (А) данного изобретения, таким образом можно также отобрать из множества клеток клетку, экспрессирующую белок (А) данного изобретения. Можно также клонировать или отобрать клон, содержащий белок (А) данного изобретения, с использованием антитела (А) данного изобретения. Например, может быть получена геномная библиотека экстракцией геномной ДНК из клетки, которая экспрессирует белок (А) данного изобретения, с последующим встраиванием этой геномной ДНК в экспрессирующий вектор. Эту геномную библиотеку вводят в клетку. Из полученной группы клеток отбирают клетку, экспрессирующую белок (А) данного изобретения, с использованием антитела (А) данного изобретения, как описано выше.
Набор, содержащий антитело (А) данного изобретения, может быть использован для детектирования белка (А) данного изобретения, как описано выше, или для анализа, детектирования или поиска клетки, экспрессирующей белок (А) данного изобретения. Этот набор данного изобретения может содержать реагенты, необходимые для описанных выше способов анализа, другие, чем антитело (А) данного изобретения, и может иметь такой реагент, используемый вместе с антителом (А) данного изобретения.
Посредством реакции гербицидного соединения РРО-ингибитора типа формулы (I) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, с данным белком (А) указанное выше соединение метаболизируется и превращается в соединение более низкой гербицидной активности. Конкретно, например, посредством реакции соединения (II) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, с данным белком (А), соединение (II) превращается в соединение (III), которое по существу не обнаруживает гербицидной активности. Примером белка (А) в таких случаях является белок (А) данного изобретения. Может быть использована одна вариация данного белка (А) и могут быть использованы вместе множественные вариации.
Соединение формулы (I) является соединением, имеющим структуру урацила. В качестве характерных примеров могут быть упомянуты соединение (II) или соединение любой из формул (IV) - (IX) (далее называемые, соответственно, соединением (IV) - соединением (IX)). Соединение (II) и соединение (IX) можно синтезировать в соответствии со способом, описанным в публикации еще не прошедшей зкспертизу заявки на патент Японии с номером 2000-319264, соединение (IV) и соединение (V) - в соответствии со способом, описанным в Патенте США № 5183492, соединение (VI) - в соответствии со способом, описанным в патенте США № 5674810, соединение (VII) - в соответствии со способом, описанным в публикации еще не прошедшей зкспертизу заявки на патент Японии с номером 3-204865, и соединение (VIII) - в соответствии со способом, описанным в публикации еще не прошедшей зкспертизу заявки на патент Японии с номером 6-321941.

Далее, в качестве характерных примеров соединения формулы (I) может быть упомянуто соединение любой из формул (Х) - (XVII) (далее соответственно называемых соединение (Х) - соединение (XVII)).
Соединения, которые могут быть субстратом метаболизирующей реакции, осуществляемой данным белком (А), могут быть отобраны с использованием соединения, присутствующего в реакции, в которой соединение (II), меченное радиоактивным изотопом, взаимодействует с данным белком (А) в присутствии системы транспорта электронов, содержащей донор электрона, такой как кофермент НАДФН, и детектированием в качестве маркера конкурентного ингибирования реакции превращения данным белком (А) меченого соединения (II) в меченое соединение (III). При анализе на присутствие конкурентного ингибирования, осуществляемого тест-соединением, это тест-соединение обычно добавляют в количестве до 1-100-кратной молярной концентрации меченого соединения (II).
Реакция, в которой соединение (I) реагирует с данным белком (А), может проводиться, например, в водном буфере, содержащем соли неорганических кислот, такие как, например, фосфат щелочного металла, такой как фосфат натрия и фосфат калия; или соли органических кислот, такие как ацетат щелочного металла, такой как ацетат натрия и ацетат калия; или т.п. Концентрация соединения формулы (I) в растворе метаболизирующей реакции обычно равна максимально приблизительно 30% (масса/объем) и предпочтительно приблизительно 0,001% (масса/объем) - 20% (масса/объем). Количество системы транспорта электронов, содержащей донор электрона, такой как НАДФН, или данного белка (А) может варьироваться, например, в зависимости от периода времени реакции. Температуру реакции выбирают обычно из диапазона от приблизительно 10 до 70°С, и она обычно равна приблизительно 20-50°С. рН реакции выбирают из диапазона обычно от приблизительно 4 до 12 и предпочтительно от приблизительно 5 до 10. Период времени реакции может варьироваться и обычно составляет от приблизительно 1 часа до 10 дней.
Далее, реакцию, в которой соединение (I) взаимодействует с данным белком (А), можно проводить в клетке, содержащей данную ДНК (А). В качестве клеток, содержащих данную ДНК (А), можно, например, упомянуть микроорганизм, способный экспрессировать данную ДНК (А) и продуцировать данный белок (А), такой как штамм микроорганизмов, выделенных из природного источника, содержащих данную ДНК (А), мутантный штамм, полученный из этого штамма микроорганизма обработкой химикалиями или ультрафиолетовым излучением, трансформированная клетка микроорганизма, в которой данная ДНК (А) или вектор, содержащий данную ДНК (А), введены в клетку-хозяина. Далее, может быть упомянута трансформированная клетка растения, в которую введена данная ДНК (А), или клетка трансформированного растения, в которое введена данная ДНК (А). В таких случаях соединение формулы (I) может непосредственно применяться к клетке, содержащей данную ДНК (А), или может быть добавлено в культуральную среду этой клетки или в почву, контактирующую с клеткой, так, чтобы оно могло войти в эту клетку. Системой транспорта электронов, содержащей донор электрона, такой как НАДФН, может быть система, исходно присутствующая в этой клетке, или она может быть добавлена извне в эту клетку.
Метаболизм соединения (I) данным белком (А) может быть подтвержден, например, детектированием соединения, продуцируемого метаболизмом соединения (I). Конкретно, например, соединение (III), продуцируемое в результате метаболизма соединения (II), может детектироваться ВЭЖХ-анализом или ТСХ-анализом, как описано выше.
Далее, метаболизм соединения (I) данным белком (А) может быть подтвержден на основе того, что гербицидная активность в реакционном растворе после реакции соединения (I) с данным белком (А) является сравнительно более низкой, чем в случае, когда соединение (I) не взаимодействует с данным белком (А). В качестве способа испытания гербицидной активности упоминается, например, способ, в котором описанные выше реакционные растворы наносят на сорняки, такие как петушье просо (Echinochloa crus-galli), лисохвост мышехвостниковый (Alopercurus myosuroides), вьюнок плющевидный (Ipomoea hederacea) и канатник Теофраста (Abutilon theophrasti), и испытывают гербицидные эффекты; или способ, в котором эти сорняки культивируют на пробах почвы, к которым добавляют описанные выше реакционные растворы, и испытывают гербицидные эффекты; и т.п. Далее, можно упомянуть способ, в котором указанные выше реакционные растворы могут быть нанесены в виде пятна на листовой диск, взятый из растения, и после этого исследуют присутствие повреждения растения (отбеливание), вызываемое этим реакционным раствором.
Кроме того, метаболизм соединения (I) данным белком (А) может быть подтвержден детектированием в качестве маркера РРО-ингибиторной активности в реакционном растворе, после взаимодействия соединения (I) с данным белком (А), которая является сравнительно более низкой, чем активность в реакционном растворе, в котором соединение (I) не взаимодействует с данным белком (А). РРО является ферментом, катализирующим превращение протопорфириногена IX в протопорфирин IX (далее называемый “PPIX”). Например, после добавления описанных выше реакционных растворов к реакционной системе РРО, добавляют протопорфириноген IX, который является субстратом РРО, и инкубируют в течение приблизительно 1-2 часов при 30°С в темноте. Затем измеряют количество PPIX в каждом из проинкубированных растворов с использованием ВЭЖХ или подобных способов. Когда количество PPIX в системе, к которой добавляют реакционный раствор после взаимодействия соединения (I) с данным белком (А), является большим, чем количество PPIX в системе, к которой добавляют реакционный раствор, в котором соединение (I) не взаимодействует с данным белком (А), это определяет, что соединение (I) было метаболизировано данным белком (А). В качестве РРО может быть использован белок, очищенный из растений и т.п., или может быть использована фракция хлоропластов, экстрагированная из растения. При использовании фракций хлоропластов в реакционной системе РРО вместо протопорфириногена IX может быть использована аминолевулиновая кислота. Аминолевулиновая кислота является предшественником протопорфириногена IX в пути биосинтеза хлорофилла-гема. Более конкретный пример приводится в примере 42 ниже.
Посредством реакции данного белка (А) таким образом может быть проведена обработка гербицидного соединения РРО-ингибиторного типа формулы (I), которая приводит к метаболизации и превращению этого соединения в соединение более низкой гербицидной активности. Повреждение растения указанным соединением может уменьшаться обработкой, в которой указанное соединение, которое было разбрызгано на зону культивирования растения, в частности, например, соединение, которое было разбрызгано на зону культивирования растения и остается в остатке растения или в почве или т.п., взаимодействует с данным белком (А).
В качестве «системы транспорта электронов, содержащей донор электрона», которая может использоваться для реакции соединения (I) с данным белком (А), может быть, например, упомянута система, содержащая НАДФН, ферредоксин и ферредоксин-НАДФ+-редуктазу.
В качестве способа предоставления «системы транспорта электронов, содержащей донор электрона», в систему для реакции соединения (I) с данным белком (А), может быть, например, упомянут способ добавления к указанной выше системе реакции НАДФН, ферредоксина, полученного из растения, такого как шпинат, и ферредоксин-НАДФ+-редуктазы, полученной из растения, такого как шпинат. Далее, к указанной реакционной системе может быть добавлена фракция, содержащая компонент, функциональный для системы транспорта электронов в реакционной системе данного белка (А), которая может быть получена из микроорганизма, такого как E. coli. Для получения такой фракции, например, после того как клетки собирают из культуры микроорганизма центрифугированием или т.п., эти клетки разрушают физически обработкой ультразвуком, обработкой DYNOMILL, FRENCH PRESS-обработкой и т.п., или разрушают химически с использованием поверхностно-активного вещества или лизирующего клетки фермента, такого как лизоцим. Из полученного таким образом лизата нерастворимые вещества удаляют центрифугированием, фильтрованием через мембрану или т.п. с получением бесклеточного экстракта. Этот бесклеточный экстракт может быть использован вместо ферредоксина в виде фракции, содержащей компонент, функциональный для системы транспорта электронов в реакционной системе данного белка (А). Кроме того, когда система, которая может транспортировать электрон от донора электрона к данному белку (А), присутствует в такой клетке, как это имеет место, когда реакцию данного белка (А) с соединением (I) проводят в клетке, такой как клетка микроорганизма или клетка растения, система транспорта электронов может не добавляться извне.
В качестве ферредоксина может использоваться, например, ферредоксин, полученный из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t и т.п. (далее иногда называемый совокупно «данным белком (В)»). Конкретно, например, может быть упомянут ферредоксин, выбранный из группы белков, приведенной ниже (далее иногда называемый «белком (В) данного изобретения»).
<группа белков>
(В1) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:12 (далее иногда называемый «белком (В1) данного изобретения»);
(В2) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:13 (далее иногда называемый «белком (В2) данного изобретения»);
(В3) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:14 (далее иногда называемый «белком (В3) данного изобретения»);
(В4) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:111 (далее иногда называемый «белком (В4) данного изобретения»);
(В5) ферредоксин, содержащий аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В6) ферредоксин, содержащий аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
(В7) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:149 (далее иногда называемый «белком (В7) данного изобретения»);
(В8) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:150 (далее иногда называемый «белком (В8) данного изобретения»);
(В9) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:151 (далее иногда называемый «белком (В9) данного изобретения»);
(В10) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:152 (далее иногда называемый «белком (В10) данного изобретения»);
(В11) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:153 (далее иногда называемый «белком (В11) данного изобретения»);
(В12) ферредоксин, содержащий аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из аминокислотных последовательностей, показанных в SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251 или SEQ ID NO:253, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с любой из аминокислотных последовательностей, показанных в SEQ ID NO:150, SEQ ID NO:252 или SEQ ID NO:254;
(В13) ферредоксин, содержащий аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с любой из нуклеотидных последовательностей, кодирующих аминокислотную последовательность, показанную в SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251, SEQ ID NO:252, SEQ ID NO:253 или SEQ ID NO:254;
(В14) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:245;
(В15) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:247;
(В16) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:248;
(В17) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:249;
(В18) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:250;
(В19) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:251;
(В20) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:252;
(В21) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:253; и
(В22) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:254.
ДНК, кодирующая данный белок (В) (далее называемая иногда “данной ДНК (В)”), может быть получена в соответствии с общепринятыми способами генной инженерии, описанными в Molecular Cloning: A Laboratory Manual 2nd Edition (1989), Cold Spring Harbor Laboratory Press; Current Protocols in Molecular Biology (1987), John Wiley and Sons, Incorporated и т.п., на основе нуклеотидных последовательностей, кодирующих аминокислотные последовательности белка (В) данного изобретения, показанных в SEQ ID NO:12, 13, 14, 111, 149, 150, 151, 152, 153, 245, 247, 248, 249, 250, 251, 252, 253 или 254.
В качестве ДНК, кодирующей белок (В) данного изобретения (называемой иногда совокупно “ДНК (В) данного изобретения”), могут быть упомянуты
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:12 (далее иногда называемая “ДНК (В1) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:13 (далее иногда называемая “ДНК (В2) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:14 (далее иногда называемая “ДНК (В3) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:111 (далее иногда называемая “ДНК (В4) данного изобретения”);
ДНК, кодирующая ферредоксин, содержащий аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
ДНК, кодирующая ферредоксин, содержащий аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14 или SEQ ID NO:111;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:149 (далее иногда называемая “ДНК (В7) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:150 (далее иногда называемая “ДНК (В8) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:151 (далее иногда называемая “ДНК (В9) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:152 (далее иногда называемая “ДНК (В10) данного изобретения);
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:153 (далее иногда называемая “ДНК (В11) данного изобретения);
ДНК, кодирующая ферредоксин, содержащий аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251 или SEQ ID NO:253, или аминокислотную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с аминокислотной последовательностью, показанной в любой из SEQ ID NO:150, SEQ ID NO:252 или SEQ ID NO:254;
ДНК, кодирующая ферредоксин, содержащий аминокислотную последовательность, кодируемую нуклеотидной последовательностью, имеющей, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, показанную в любой из SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:245, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250, SEQ ID NO:251, SEQ ID NO:252, SEQ ID NO:253 или SEQ ID NO:254;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:245;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:247;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:248;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:249;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:250;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:251;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:252;
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:253, и
ДНК, кодирующая белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:254.
В качестве более конкретных примеров ДНК (В) данного изобретения могут быть упомянуты ДНК, содержащая нуклеотидную последовательность, показанную в любой из SEQ ID NO:15, 16, 17, 112, 154, 155, 156, 157, 158, 255, 257, 258, 259, 260, 261, 262, 263 или 264, или ДНК, содержащая нуклеотидную последовательность, имеющую, по меньшей мере, 90% идентичность последовательности с нуклеотидной последовательностью, показанной в любой из SEQ ID NO:15, 16, 17, 112, 154, 155, 156, 157, 158, 255, 257, 258, 259, 260, 261, 262, 263 или 264.
Такая ДНК может быть получена проведением способов, в которых ПЦР проводят с использованием ДНК, содержащей частичную нуклеотидную последовательность этих нуклеотидных последовательностей, в качестве праймеров, или способов гибридизации, в которых такую ДНК используют в качестве зондов, в соответствии с условиями, описанными выше в способах получения данной ДНК (А).
Например, конкретно, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:12, или ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:15, может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO 12898, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:105, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:53.
Далее, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:13, или ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:16, может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Saccharopolyspora taberi JCM 9383t, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:106, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:63.
Далее, ДНК, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность, показанную в SEQ ID NO:14, или ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:17, может быть получена проведением ПЦР с использованием в качестве матрицы хромосомной ДНК или библиотеки хромосомной ДНК, полученной из Streptomyces testaceus ATCC21469, и с использованием в качестве праймеров олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:107, и олигонуклеотида, содержащего нуклеотидную последовательность, показанную в SEQ ID NO:72.
Далее, например, ДНК (В) данного изобретения может быть получена гибридизацией с библиотекой хромосомной ДНК, ДНК, состоящей, по меньшей мере, из приблизительно 20 нуклеотидов, содержащей нуклеотидную последовательность, кодирующую аминокислотные последовательности, показанные в любой из SEQ ID NO:12, 13, 14, 111, 149, 150, 151, 152 или 153, в качестве зонда в условиях, описанных выше, с последующим детектированием и извлечением ДНК, специфически связанной с указанным зондом. Библиотека хромосомной ДНК может быть получена, как описано выше, из микроорганизмов, принадлежащих к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T, и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t и т.п. В качестве конкретных примеров ДНК, которая может быть использована в качестве таких зондов, может быть упомянута ДНК, содержащая нуклеотидную последовательность, показанную в любой из SEQ ID NO:15, 16, 17, 112, 154, 155, 156, 157, 158, 255, 257, 258, 259, 260, 261, 262, 263 или 264; ДНК, содержащая частичную нуклеотидную последовательность таких нуклеотидных последовательностей; или ДНК, содержащая нуклеотидную последовательность, комплементарную указанным частичным нуклеотидным последовательностям.
Для экспрессии данной ДНК (В) клеткой-хозяином, например ДНК, в которой данная ДНК (В) и промотор, функциональный в клетке-хозяине, функционально связаны, получают в соответствии с общепринятыми способами генной инженерии, описанными в “Molecular Cloning: A Laboratory Manual 2nd Edition (1989)”, Cold Spring Harbor Laboratory Press; “Current Protocols in Molecular Biology (1987)”, John Wiley and Sons, Incorporated и т.п., и вводят в клетку-хозяина. Содержит ли полученный трансформант данную ДНК (В), может быть проверено получением ДНК из трансформанта и затем проведением с полученной ДНК способов анализа генной инженерии, описанных, например, в “Molecular Cloning 2nd Edition”, Cold Spring Harbor Laboratory Press (Molecular Biology, John Wiley and Sons, N.Y. (1989) (таких как подтверждение сайтов рестриктаз, секвенирование ДНК, гибридизация по Саузерну, ПЦР и т.п.).
Данная ДНК (В) и данная ДНК (А) могут экспрессироваться в одной и той же клетке введением в клетку, содержащую данную ДНК (А), ДНК, в которой данная ДНК (В) и промотор, функциональный в клетке-хозяине, являются функционально связанными.
Данный белок (В) может быть получен, например, культивированием клетки, содержащей данную ДНК (В). В качестве такой клетки может быть упомянут микроорганизм, экспрессирующий данную ДНК (В) и способный продуцировать данный белок (В), такой как штамм микроорганизма, выделенный из природного источника, содержащий данную ДНК (В), мутантные штаммы, полученные из указанного природного штамма обработкой агентами или ультрафиолетовыми лучами, или т.п. Например, могут быть упомянуты микроорганизмы, принадлежащие к Streptomyces, например Streptomyces phaeochromogenes, Streptomyces testaceus, Streptomyces achromogenes, Streptomyces griseolus, Streptomyces thermocoerulescens, Streptomyces nogalater, Streptomyces tsusimaensis, Streptomyces glomerochromogenes, Streptomyces olivochromogenes, Streptomyces ornatus, Streptomyces griseus, Streptomyces lanatus, Streptomyces misawanensis, Streptomyces pallidus, Streptomyces roseorubens, Streptomyces rutgersensis и Streptomyces steffisburgensis, и более конкретно Streptomyces phaeochromogenes IFO12898, Streptomyces testaceus ATCC21469, Streptomyces achromogenes IFO 12735, Streptomyces griseolus ATCC11796, Streptomyces thermocoerulescens IFO 14273t, Streptomyces nogalater IFO 13445, Streptomyces tsusimaensis IFO 13782, Streptomyces glomerochromogenes IFO 13673t, Streptomyces olivochromogenes IFO 12444, Streptomyces ornatus IFO 13069t, Streptomyces griseus ATCC 10137, Streptomyces griseus IFO 13849T, Streptomyces lanatus IFO 12787T, Streptomyces misawanensis IFO 13855T, Streptomyces pallidus IFO 13434T, Streptomyces roseorubens IFO 13682T, Streptomyces rutgersensis IFO 15875T и Streptomyces steffisburgensis IFO 13446T и т.п., или из микроорганизмов, принадлежащих к Saccharopolyspora, таких как Saccharopolyspora taberi, более конкретно Saccharopolyspora taberi JCM 9383t и т.п. Далее, может быть упомянут трансформант, в который была введена данная ДНК (В). Например, конкретно, может быть упомянут трансформант, в котором данная ДНК (В), функционально связанная с промотором tac, промотором trc, промотором lac или промотором фага Т7, была введена в E. coli. В качестве более конкретных примеров могут быть упомянуты E. coli JM109/pKSN657FD, E. coli JM109/pKSN923FD, E. coli JM109/pKSN671FD и т.п., описанные в приведенных ниже примерах.
Микроорганизм, содержащий данную ДНК (В), может культивироваться в соответствии со способом, используемым обычно для культивирования микроорганизма и, более конкретно, проводимым в соответствии с условиями, описанными выше в способах культивирования микроорганизма, содержащего данную ДНК (А).
Данный белок (В), продуцируемый микроорганизмом, содержащим данную ДНК (В), может быть использован, например, в различных формах в реакционной системе данного белка (А), таких как культура микроорганизма, продуцирующего данный белок (В), клетка микроорганизма, продуцирующая данный белок (В), материал, полученный обработкой такой клетки, бесклеточный экстракт микроорганизма, грубо очищенный белок, очищенный белок и т.п. Материал, полученный обработкой клетки, описанной выше, включает, например, лиофилизированную клетку, высушенную ацетоном клетку, растертую клетку, автолизат клетки, обработанную ультразвуком клетку, обработанную щелочью клетку, обработанную органическим растворителем клетку и т.п. Альтернативно, данный белок (В) в любой из различных форм, описанных выше, может быть иммобилизован в соответствии с известными способами, такими как способ связывания с носителем, использующий адсорбцию на синтезированный полимер и т.п., и способ включения, использующий включение в пространственный полимерный матрикс, и затем использован в реакционной системе данного белка (А).
В качестве способов очистки данного белка (В) из культуры микроорганизма, содержащего данную ДНК (В), могут быть использованы общепринятые способы, используемые в очистке белка. Например, может быть упомянут следующий способ.
Сначала клетки собирают из культуры микроорганизма центрифугированием или подобным способом и затем разрушают физически обработкой ультразвуком и т.п. или разрушают химически с использованием поверхностно-активного вещества или лизирующего клетки фермента, такого как лизоцим. Из полученного таким образом лизата нерастворимые вещества удаляют центрифугированием, фильтрованием через мембрану или т.п. с получением бесклеточного экстракта, который затем фракционируют любыми подходящими средствами для разделения и очистки, такими как катионообменная хроматография, анионообменная хроматография, гидрофобная хроматография, гель-фильтрационная хроматография и т.п., с получением таким образом очищенного данного белка (В). Посредством разделения полученной таким образом фракции электрофорезом в ДСН-ПААГ данный белок (В) может быть дополнительноо очищен.
Функция данного белка (В) в качестве ферредоксина может быть подтверждена как функция переносчика электрона от ферредоксин-НАДФ+-редуктазы к данному белку (А) в реакционной системе, в которой соединение (I) взаимодействует с данным белком (А). Например, конкретно, подтверждение может быть выполнено добавлением данного белка (В) с НАДФН, ферредоксин-НАДФ+-редуктазой и данным белком (А) к реакционной системе, в которой соединение (I) взаимодействует с данным белком (А), с последующим детектированием превращения соединения (II) в соединение (III).
В способе уничтожения сорняков данного изобретения соединение (I) наносят на зону культивирования растения, экспрессирующего данный белок (А). Такое растение может экспрессировать одну вариацию данного белка (А) или может экспрессировать множественные вариации данного белка (А). В качестве данного белка (А) может быть, например, упомянут белок (А) данного изобретения. Растения, экспрессирующие данный белок (А), могут быть получены в виде трансгенного растения, в которое была введена данная ДНК (А). Такое введение включает введение данной ДНК (А) в клетку растения, как описано выше, таким образом, что эта ДНК помещается в положение, разрешающее ее экспрессию, с последующей регенерацией растения из полученной трансформированной клетки. Данная ДНК (А), вводимая в растение, может иметь связанную «слева» от нее нуклеотидную последовательность, кодирующую сигнал переноса во внутриклеточную органеллу так, что рамки считывания этих последовательностей находятся в одной рамке считывания.
Растение, имеющее введенную в него данную ДНК (А) и экспрессирующее данный белок (А), метаболизирует соединение (I), в его клетках, в соединение более низкой гербицидной активности. В результате повреждение растения от гербицидного соединения в растении уменьшается и придается устойчивость к указанному соединению. Вследствие этого данное растение, имеющее введенную в него данную ДНК (А) и экспрессирующее данный белок (А), может расти хорошо даже в том случае, когда соединение (I) наносят на зону его культивирования. Сорняки, другие, чем растение, имеющее введенную в него данную ДНК (А) и экспрессирующее данный белок (А), могут эффективно удаляться культивированием указанного растения и нанесением указанной гербицидной композиции на зону культивирования. Возможно улучшение урожая указанного выше растения, улучшение качества, уменьшение количества используемого гербицида и экономия затрат труда.
Оценка устойчивости клетки, экспрессирующей данный белок (А), к соединению формулы (I) или гербицидной композиции, содержащей указанное соединение, может проводиться контактированием клетки, экспрессирующей ген, кодирующий данный белок (А), с указанным соединением или указанной гербицидной композицией и оценкой степени повреждения этой клетки.
Конкретно, для оценки устойчивости клетки микроорганизма, экспрессирующей данный белок (А), к соединению формулы (I) или гербицидной композиции, содержащей соединение (I), может быть получена трансформированная E. coli, экспрессирующая РРО растения и данный белок (А). Такое получение включает дополнительно введение данной ДНК (А), например, в трансформированную E. coli, которая может быть использована для оценки ингибирования активности РРО и была описана в заявке на патент Японии № 11-102534, более конкретно трансформированную E. coli, в которой ген РРО растения, описанный в патенте США с номером 5939602 или т.п., функционально вводят в штамм E. coli ВТ3 и получают экспрессию этого гена РРО. Штамм E. coli ВТ3 имеет дефект по гену РРО и не способен к пролиферации, как описано F. Yamamoto, H. Inokuti, H. Ozaki, (1988) Japanese Journal of Genetics, Vol. 63, pg. 237-249. Устойчивость к соединению или гербицидной композиции может оцениваться культивированием полученной трансформированной E. coli при встряхивании в течение приблизительно 18-24 часов при 37°С в жидкой культуральной среде, содержащей соединение (I) или гербицидную композицию, содержащую указанное соединение, в количестве 0-1,0 м.д., и измерением пролиферации указанной трансформированной E. coli по оптической плотности при 600 нм. В качестве данного белка (А) может быть, например, упомянут белок (А) данного изобретения.
В качестве способа оценки степени устойчивости растения, экспрессирующего данный белок (А), к соединению формулы (I) или гербицидной композиции, содержащей указанное соединение, может быть упомянут способ нанесения этой гербицидной композиции на растение и измерение степени роста этого растения. Для более количественной проверки, например, сначала кусочки листьев этого растения погружают в водные растворы, содержащие соединение (I) при различных концентрациях, или водные растворы соединения (I) разбрызгивают на кусочки листьев этого растения, затем дают им находиться на агаровой среде на свету при комнатной температуре. Спустя несколько дней хлорофилл экстрагируют из этих листьев растения в соответствии со способом, описанным Mackenney, G., J. Biol. Chem., 140; p 315 (1941), для определения содержания хлорофилла. Например, конкретно, берут листья растения и разрезают их на равные 2 части вдоль главной жилки. Гербицидную композицию распределяют на всю поверхность одной из половин листа. Другую половину листа оставляют необработанной. Эти куски листа помещают на среду MS, содержащую 0,8% агар, и выдерживают на свету при комнатной температуре в течение 7 дней. Затем каждый кусок листа растирают пестиком в ступке в 5 мл 80% водного раствора ацетона для экстрагирования хлорофилла. Жидкость экстракта разбавляют в 10 раз 80% водным раствором ацетона и оптическую плотность измеряют при 750 нм, 663 нм и 645 нм для расчета общего содержания хлорофилла по способу, описанному Mackenney, G., J. Biol. Chem. (1941) 140; p 315. Степень устойчивости к соединению (I) может быть оценена сравнительно выражением в процентилях содержания общего хлорофилла обработанного куска листа от общего содержания хлорофилла необработанного куска листа. В качестве данного белка (А) может быть, например, упомянут белок (А) данного изобретения.
На основании описанного выше способа оценки степени устойчивости к соединению (I) или гербицидной композиции, содержащей соединение (I), могут быть отобраны растение или клетка растения, обнаруживающие устойчивость к соединению (I) или гербицидной композиции, содержащей соединение (I). Например, отбирают растение, где нет повреждения от разбрызгивания соединения (I) или гербицидной композиции, содержащей это соединение, на зону культивирования этого растения, или отбирают клетку растения, которая непрерывно растет на протяжении культивирования в присутствии соединения (I). Например, конкретно, почву набивают в пластиковый сосуд, имеющий, например, диаметр 10 см и глубину 10 см. Семена растения высевают и культивируют в оранжерее. Готовят эмульсию смешиванием 5 частей гербицидной композиции, содержащей соединение (I), 6 частей sorpol3005X (Toho chemicals) и 89 частей ксилола. Определенное количество этой эмульсии разбавляют водой, содержащей 0,1% (об./об.) обеспечивающего прилипание агента, в пропорции 1000 л на 1 гектар, и распределяют однородно пистолетом для опрыскивания на все стороны листвы сверху от растения, культивируемого в описанном выше сосуде. После культивирования этих растений в течение 16 дней в оранжерее исследуют повреждение этих растений. Растения, в которых не наблюдается повреждение, или растения, в которых повреждение является уменьшенным, могут быть отобраны. Далее, может быть получено потомство растений скрещиванием таких отобранных растений.
ПРИМЕРЫ
Ниже данное изобретение объясняется более подробно примерами, но не ограничивается этими примерами.
ВЭЖХ для анализа содержания в примерах 1, 41 и 42 и очистку фракций данного соединения проводили в условиях, показанных ниже.
(Условие 1 ВЭЖХ-анализа)
Колонка: SUMIPAX ODS211 (Sumika Chemical Analysis Service)
Температура колонки: 35°С
Скорость тока: 1 мл/мин
Длина волны детектирования: УФ254 нм
Элюент А: 0,01% водный раствор ТФУ
Элюент В: ацетонитрил
Условия элюции: Пробу вводят в колонку,
уравновешенную смесью растворителей 90% элюента А и 10% элюента В. Затем смесь растворителей 90% элюента А и 10% элюента В протекают в течение 5 минут. За этим следует протекание смеси растворителей элюента А и элюента В в течение 20 минут при увеличении доли элюента В с 10% до 90%. Затем смесь растворителей 10% элюента А и 90% элюента В протекает в течение 8 минут.
Пример 1. Преобразование соединения (II) микроорганизмом
(1) Метаболизация соединения (II)
Различные микроорганизмы, показанные в таблицах 1 и 2, выращивали в среде с агаром ISP2 (1,0% (мас./об.) экстракт солода, 0,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глюкоза, 2,0% (мас./об.) агар, рН 7,3). «Полную петлю» каждого из микроорганизмов добавляли к среде TGY (0,5% (мас./об.) триптон, 0,5% (мас./об.) дрожжевой экстракт, 0,1% (мас./об.) глюкоза, 0,01% (мас./об.) КН2РО4, рН 7,0) и инкубировали при встряхивании при 30°С в течение 2-4 дней. Одну десятую миллилитра (0,1 мл) полученной культуры инкубировали при встряхивании в 3 мл среды для спорообразования (0,1% (мас./об.) мясной экстракт, 0,2% (мас./об.) триптоза, 1% (мас./об.) глюкоза, рН 7,1), содержащей соединение (II) при 100 м.д., в течение 7-8 дней при 30°С. Пятьдесят микролитров (50 мкл) 2 н. HCl добавляли к полученной культуре и экстрагировали 3 мл этилацетата. Полученный этилацетатный слой анализировали с помощью ВЭЖХ. Концентрация соединения (II) уменьшалась (время удерживания колонки 23,9 минут) и новые пики детектировались для соединений при временах удерживания 21,6 минут и 22,2 минут (каждый из них называют метаболитом (I) и метаболитом (II)). Результаты показаны в таблицах 1 и 2.
(2) Определение структуры метаболита (I) и метаболита (II)
Замороженный исходный материал Streptomyces griseus ATCC11429 добавляли к 3 мл культуральной среды для микроорганизма (0,7% (мас./об.) полипептон, 0,5% (мас./об.) дрожжевой экстракт, 1,0% (мас./об.) глюкоза, 0,5% (мас./об.) К2НРО4, рН 7,2) и инкубировали при встряхивании в тест-пробирке в течение ночи для получения предварительной культуры. Такую предварительную культуру добавляли к 300 мл среды для микроорганизма, содержащей соединение (II) при концентрации 100 м.д. Этот объем распределяли в 100 небольших тест-пробирок по 3 мл в каждую и инкубировали при встряхивании при 30°С в течение 6 дней. После доведения 250 мл такой культуры до рН 2 добавлением HCl ее экстрагировали 250 мл этилацетата. Растворители удаляли из этилацетатного слоя. Остаток растворяли в 3 мл ацетона и пробу наносили на пластинку ТСХ с силикагелем (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 5:7:1 (об./об./об.) толуол:муравьиная кислота:этилформиат. Брали величину Rf около 0,58 силикагеля. Такие содержания ТСХ-пластинок экстрагировали ацетоном. Из слоя экстракции удаляли ацетон. Остаток растворяли в 10 мл ацетонитрила и фракционировали с использованием ВЭЖХ. Фракции, содержащие только метаболит (I) и метаболит (II), извлекали с получением 3,7 мг метаболитов (далее называемых «метаболит А)»).
Проводили масс-спектрометрию метаболита А. Метаболит А имел массу, которая была на 14 меньше, чем масса соединения (II). Далее, из Н-ЯМР-анализа определили, что метаболит (А) был соединением, имеющим структуру, показанную в формуле (III).
(3) Тестирование гербицидной активности соединения (III)
Почву набивали в круглый пластиковый сосуд, имеющий диаметр 10 см и глубину 10 см. Петушье просо, лисохвост мышехвостниковый и вьюнок плющевидный высевали и культивировали в оранжерее в течение 10 дней. Пять (5) частей тест-соединения, 6 частей sorpol3005X (Toho Chemical Company) и 89 частей ксилола хорошо смешивали с получением эмульсии. Определенное количество этой эмульсии разбавляли водой, содержащей 0,1% (об./об.) обеспечивающего прилипание агента, в пропорции 1000 л на 1 гектар, и распределяли однородно пистолетом для опрыскивания на все стороны листвы сверху от растения, культивируемого в описанном выше сосуде. После культивирования этих растений в течение 16 дней в оранжерее исследовали гербицидную активность тест-соединения. Результаты показаны в таблице 3.
Почву набивали в круглый пластиковый сосуд, имеющий диаметр 10 см и глубину 10 см. Петушье просо, лисохвост мышехвостниковый и вьюнок плющевидный высевали. Пять (5) частей тест-соединения, 6 частей sorpol3005X (Toho Chemical Company) и 89 частей ксилола хорошо смешивали с получением эмульсии. Определенное количество этой эмульсии разбавляли водой, содержащей 0,1% (об./об.) обеспечивающего прилипание агента, в пропорции 1000 л на 1 гектар, и распределяли однородно пистолетом для опрыскивания на поверхность почвы. После культивирования этих растений в течение 19 дней в оранжерее исследовали гербицидную активность тест-соединения. Результаты показаны в таблице 4.
В приведенных выше таблицах 3 и 4 сила гербицидной активности показана ступенчатым образом как 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10. Число «0» представляет ситуации, в которых состояние прорастания или вегетации во время испытания растения, используемого для данного испытания, было сравнимым и вообще не имело или по существу не имело различия с состоянием необработанного контроля. Число «10» представляет ситуации, в которых растение полностью завядало или прорастание или вегетация были полностью подавленными.
Пример 2. Получение белка (А1) данного изобретения
(1) Получение неочищенного экстракта клеток
Замороженный исходный материал Streptomyces phaeochromogenes IFO 12898 добавляли к 100 мл среды А (0,1% (мас./об.) глюкоза, 0,5% (мас./об.) триптон, 0,5% (мас./об.) дрожжевой экстракт, 0,1 (мас./об.) дикалий-гидрофосфат, рН 7,0) в трехгранной колбе на 500 мл и инкубировали с ротационным качанием при 30°С в течение 1 дня для получения предварительной культуры. Восемь миллилитров (8 мл) предварительной культуры добавляли к 200 мл среды А и инкубировали с ротационным качанием в колбе с перегородкой на 500 мл при 30°С в течение 2 дней. Осадки клеток получали центрифугированием (3000 g, 5 мин) полученной культуры. Эти осадки клеток суспендировали в 100 мл среды В (1% (мас./об.) глюкоза, 0,1% мясной экстракт, 0,2% (мас./об.) триптоза), содержащей соединение (II) при 100 м.д., и инкубировали с возвратно-поступательным качанием в колбе Сакагучи на 500 мл в течение 16 часов при 30°С. Осадки клеток получали центрифугированием (3000 g, 5 мин) 10 л полученной культуры. Полученные осадки клеток промывали дважды 1 л 0,1 М калий-фосфатного буфера (рН 7,0) с получением 162 г осадков клеток.
Эти осадки клеток суспендировали в 0,1 М калий-фосфатном буфере (рН 7,0) при 2 мл на 1 г осадков клеток и добавляли 1 мМ ФМСФ, 5 мМ бензамидин·HCl, 1 мМ ЭДТА и 1 мМ дитиотрейтол. Раствор клеточного лизата получали разрушением дважды этой суспензии с использованием Френч-пресса (1000 кг/см2) (Ohtake Seisakusho). После центрифугирования раствора клеточного лизата (40000 g, 30 мин) супернатант извлекали и центрифугировали в течение 1 часа при 150000 g для извлечения супернатанта (называемого далее «неочищенным клеточным экстрактом»).
(2) Определение способности превращать соединения (II) в соединение (III)
Готовили 30 мкл реакционного раствора 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2,4 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,5 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл неочищенного клеточного экстракта, полученного в примере 2(1). Реакционный раствор выдерживали при 30°С в течение часа. Кроме того, готовили и выдерживали таким же образом реакционный раствор без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 5.
(3) Фракционирование неочищенного клеточного экстракта
К неочищенному клеточному экстракту, полученному в примере 2(1), добавляли сульфат аммония до 45% насыщения. После перемешивания в охлаждаемых льдом условиях получали супернатант центрифугированием в течение 10 минут при 12000 g. После добавления сульфата аммония к полученному супернатанту до 55% насыщения и перемешивания в охлаждаемых льдом условиях осадок получали центрифугированием в течение 10 минут при 12000 g. Этот осадок растворяли в 27,5 мл 20 мМ бистриспропанового буфера (рН 7,0). Этот раствор подвергали хроматографии на колонке PD10 (Amersham Pharmacia Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) с получением 38,5 мл фракций, содержащих белки (далее называемых «фракцией 45-55% сульфата аммония»).
(4) Выделение белка (А1) данного изобретения
Фракцию 45-55% сульфата аммония, полученную в примере 2(3), вводили в колонку HiLoad 26/10 Q-Sepharose HP (Amersham Pharmacia Company). Затем после протекания 106 мл 20 мМ бистриспропанового буфера (рН 7,0) через колонку, 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,001415 М/мин, диапазон концентрации NaCl был от 0 М до 0,375 М, скорость тока была 3 мл/мин) для фракционного извлечения фракций по 25 мл, элюирующихся при концентрации NaCl от 0,21 до 0,22 М. Затем извлеченные фракции подвергали хроматографии на колонке PD10 (Amersham Pharmacia Biotech Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) для получения фракций, содержащих белок.
Извлеченные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) с элюцией буфером А (2 мМ калий-фосфатный буфер, содержащий 1,5 мМ NaCl, рН 7,0) для получения фракций, содержащих белок. Затем эти фракции вводили в колонку СНТ10-I Bio-Scale Ceramic Hydroxyapatite Type I (Bio-Rad Company). Тридцать миллилитров (30 мл) буфера А пропускали через колонку. Затем буфер А протекал с линейным градиентом буфера В (100 мМ калий-фосфатный буфер, содержащий 0,03 М NaCl; линейный градиент начинался при 100% буфера А с увеличением до 50% буфера В на протяжении периода 100 минут, скорость тока была 2 мл/мин) для фракционного извлечения фракций, элюирующихся при концентрации буфера В от 17 до 20%. Далее, полученные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) и элюировали 0,05 М калий-фосфатным буфером (рН 7,0) с получением фракций, содержащих белок.
Полученные фракции концентрировали в 20 раз с использованием ультрафильтрационной мембраны (Microcon YM-30, Millipore Company) и вводили в колонку 75 пг HiLoad 16/60 Superdex (Amersham Pharmacia Biotech Company). 50 мМ калий-фосфатный буфер, содержащий 0,15 М NaCl (рН 7,0), протекал (скорость тока 1 мл/мин) через колонку. Элюат фракционировали по 2 мл в каждой пробирке. Фракции, элюирующиеся при объемах элюции 56 - 66 мл, фракционно извлекали по отдельности. Белок, содержащийся в каждой из этих фракций, анализировали электрофорезом в 10-20% ДСН-ПААГ.
Вместо неочищенного клеточного экстракта в реакционном растворе, описанном в примере 2(2), полученные фракции добавляли и выдерживали в присутствии компонента А, компонента В, компонента С и соединения (II), меченного 14С, подобно примеру 2(2). Реакционные растворы после этого выдерживания анализировали при помощи ТСХ для исследования интенсивности пятен, соответствующих соединению (III), меченному 14С. Наблюдали, что белок, перемещающийся к положению 47 кДа при описанном выше электрофорезе в ДСН-ПААГ, имел флуктуации в концентрациях полос этих фракций, добавляемых по очереди, которые были параллельными с флуктуациями интенсивности пятен, соответствующих соединению (III). Указанный белок извлекали из геля ДСН-ПААГ и подвергали аминокислотному анализу с использованием секвенатора белков (Applied Biosystems Company, Procise 494HT, импульсный жидкостной способ). В результате была получена аминокислотная последовательность, показанная в SEQ ID NO:18. Затем, после расщепления этого белка трипсином, полученный расщепленный материал анализировали на масс-спектрометре (ThermoQuest Company, Ion Trap Mass Spectrometer LCQ, колонка: LC Packings Company PepMap C18 75 мкм х 150 мм, растворитель А: 0,1% HOAc-H2O, растворитель В: 0,1% НОАс-метанол, градиент: линейный градиент, начинающийся при элюции смесью 95% растворителя А и 5% растворителя В и увеличивающийся до концентрации 100% растворителя В на протяжении 30 минут, скорость тока: 0,2 мкл/мин). В результате была получена последовательность, показанная в SEQ ID NO:19.
Пример 3. Получение ДНК (А1) данного изобретения
(1) Получение хромосомной ДНК Streptomyces phaeochromogenes IFO12898
Streptomyces phaeochromogenes IFO12898 инкубировали при встряхивании при 30°С в течение 1 - 3 дней в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2 .6Н2О). Клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток инкубировали при встряхивании при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55°С в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
(2) Получение библиотеки хромосомной ДНК Streptomyces phaeochromogenes IFO12898
943 нг хромосомной ДНК, полученной в примере 3(1), расщепляли 1 единицей рестриктазы Sau3AI при 37°С в течение 60 минут. Полученный расщепленный раствор разделяли электрофорезом в 0,7% агарозном геле. ДНК размером приблизительно 2,0 т.п.н. извлекали из геля. Эту ДНК очищали с использованием набора для очистки ДНК Prep-A-GeneR (Bio-Rad Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с получением 10 мкл раствора, содержащего желаемую ДНК. Микролитр (1 мкл) этого раствора ДНК, 98 нг плазмидного вектора pUC118, расщепленного рестриктазой BamHI и обработанного дефосфорилированием, и 11 мкл раствора I из набора для лигирования Ver. 2 (Takara Shuzo Company) смешивали и инкубировали в течение ночи при 16°С. E. coli DH5α трансформировали с использованием 5 мкл раствора для лигирования. E. coli культивировали при встряхивании в течение ночи при 30°С. Из полученной культуральной среды извлекали E. coli. Плазмиду экстрагировали с получением библиотеки хромосомной ДНК.
(3) Выделение ДНК (А1) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 3(1) (фиг. 1). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:35, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:36 (далее называемую «парой 1 праймеров»). Нуклеотидную последовательность, показанную в SEQ ID NO:35, конструировали на основе нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:18. Далее, нуклеотидную последовательность, показанную в SEQ ID NO:36, конструировали на основе нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей аминокислотную последовательность, показанную в SEQ ID NO:19. Реакционный раствор для ПЦР доводили до 25 мкл добавлением каждого из этих 2 праймеров, доведенных до 200 нМ, 250 нг вышеуказанной хромосомной ДНК, 0,5 мкл смеси dNTP (смеси 10 мМ каждого из 4 типов dNTP; Clontech Company), 5 мкл 5хGC-геномного реакционного буфера для ПЦР (Clontech Company), 1,1 мкл 25мМ Mg(OAc)2, 5 мкл 5 М GC-расплава (Clontech Company) и 0,5 мкл смеси геномной полимеразы Advantage-GC (Clontech Company) и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 95°С в течение 1 минут, повторение 30 циклов, где каждый цикл включал поддержание 94°С в течение 15 секунд, затем 60°С в течение 30 секунд, затем 72°С в течение 1 минуты, и затем поддержание при 72°С в течение 5 минут. После этого поддержания реакционный раствор наносили на 4% агарозный гель для электрофореза. Зоны геля, содержащие ДНК размером приблизительно 159 п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором ТА pCR2.1 (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company). В этой реакции секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате получили нуклеотидную последовательность, состоящую из нуклеотидов 36-132 нуклеотидной последовательности, показанной в SEQ ID NO:9. Указанная нуклеотидная последовательность кодировала аминокислотную последовательность, состоящую из аминокислот 12-23 аминокислотной последовательности, показанной в SEQ ID NO:18. В этой связи ожидалось, что указанная ДНК кодирует часть белка (А1) данного изобретения.
Затем проводили ПЦР, подобно описанному выше, со смесью геномной полимеразы Advantage-GC (Clontech Company) и с использованием хромосомной ДНК, полученной в примере 3(2), в качестве матрицы. В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:37, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:38 (далее называемую «парой 2 праймеров») или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:39, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:40 (далее называемую «парой 3 праймеров»).
Затем амплифицировали при помощи ПЦР ДНК, имеющую нуклеотидную последовательность, в которой 3'-конец простирается после нуклеотида, показанного как нуклеотид 132 нуклеотидной последовательности, показанной в SEQ ID NO:9. ПЦР проводили с использованием в качестве матрицы реакционного раствора, полученного с использованием пары 2 праймеров, и с использованием в качестве праймеров пары из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:41, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:38 (далее называемую «парой 4 праймеров»). Подобным образом, амплифицировали при помощи ПЦР ДНК, имеющую нуклеотидную последовательность, в которой 5'-конец простирается после нуклеотида, показанного как нуклеотид 36 нуклеотидной последовательности, показанной в SEQ ID NO:9. ПЦР проводили с использованием в качестве матрицы реакционного раствора, полученного с использованием пары 3 праймеров, и с использованием в качестве праймеров пары из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:42, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:40 (далее называемую «парой 5 праймеров»). ДНК размером 2 т.п.н., амплифицированную с использованием пары 4 праймеров, и ДНК размером 150 п.н., амплифицированную с использованием пары 5 праймеров, клонировали в клонирующий вектор ТА pCR2.1 аналогично описанному выше. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company) и олигонуклеотидов, показанных в SEQ ID NO:43-50. В этой реакции секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате секвенирования нуклеотидной последовательности ДНК размером 2 т.п.н., амплифицированной с использованием пары 4 праймеров, получили нуклеотидную последовательность, состоящую из нуклеотидов 133-1439 нуклеотидной последовательности, показанной в SEQ ID NO:9. Далее, в результате секвенирования нуклеотидной последовательности ДНК размером 150 п.н., амплифицированной с использованием пары 5 праймеров, получили нуклеотидную последовательность, состоящую из нуклеотидов 1-35 нуклеотидной последовательности, показанной в SEQ ID NO:9. В результате соединения полученных нуклеотидных последовательностей получили нуклеотидную последовательность, показанную в SEQ ID NO:9. В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания. Таким образом, в ней содержалась нуклеотидная последовательность (SEQ ID NO:6), состоящая из 1227 нуклеотидов (включая стоп-кодон) и кодирующая 408 аминокислотных остатков, а также нуклеотидная последовательность (SEQ ID NO:15), состоящая из 201 нуклеотида (включая стоп-кодон) и кодирующая 66 аминокислотных остатков. Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:1), кодируемого нуклеотидной последовательностью, показанной в SEQ ID NO:6, равна 45213 Да. Далее, аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, содержала аминокислотную последовательность (SEQ ID NO:18), определенную из секвенирования аминокислот из N-конца белка (А1) данного изобретения, и аминокислотную последовательность (SEQ ID NO:19), определенную из секвенирования аминокислот расщепленных трипсином фрагментов при помощи масс-спектрометрического анализа. Было рассчитано, что молекулярная масса данного белка, состоящего из аминокислотной последовательности (SEQ ID NO:12), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:15, равна 6818 Да.
Пример 4. Экспрессия белка (А1) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей белок (А1) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO12898 в примере 3(1), и с использованием ПЦР-системы Expand High Fidelity (Roche Molecular Biochemicals Company). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:51, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:52 (далее называемую «парой 19 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:51, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:53 (далее называемую «парой 20 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих двух праймеров, доведенных до 300 нМ, 50 нг вышеуказанной хромосомной ДНК, 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP), 5 мкл 10х буфера Expand HF (содержащего MgCl2) и 0,75 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд, затем 72°С в течение 2 минут, затем проводили 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 сек, затем 68°С в течение 30 сек и затем 72°С в течение 2 минут (где добавляли 20 секунд для поддержания при 72°С для каждого цикла); затем поддержание 72°С в течение 7 минут. После этого поддержания реакционный раствор наносили на 1% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 19 праймеров. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 20 праймеров. ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором ТА pCR2.1 (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company), олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:43, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:46. В этой реакции секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:6, была названа pCR657, а плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:9, была названа pCR657F.
Кроме того, олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:134, и олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:135, отжигали вместе с получением линкера (фиг. 47). Плазмиду pKSN24R2 (Akiyoshi-ShibaTa M. et al., Eur. J. Biochem. 224: P335 (1994)) расщепляли HindIII и XmnI. Этот линкер встраивали в полученную ДНК размером приблизительно 3 т.п.н. Полученная плазмида была названа pKSN2 (фиг. 4).
Затем каждую из плазмид pCR657 и pCR657F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR657. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR657F. Эти ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Каждую из полученных ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуру анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:6, в которой ДНК размером приблизительно 1,2 т.п.н., кодирующая белок (А1) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN657. Далее, плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:9, в которой ДНК размером приблизительно 1,5 т.п.н., кодирующая белок (А1) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN657F. Каждую из вышеуказанных плазмид pKSN657 и pKSN657F вводили в E. coli JM109. Полученные трансформанты E. coli были названы соответственно JM109/pKSN657 и JM109/pKSN657F. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (А1) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN657, JM109/pKSN657F и JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. После достижения OD660 приблизительно 0,5 добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 17 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатанта (далее фракцию супернатанта, полученную из E. coli JM109/pKSN657, называют “экстрактом E. coli pKSN657”, фракцию супернатанта, полученную из E. coli JM109/pKSN657F, называют “экстрактом E. coli pKSN657F», а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15-25% ДСН-ПААГ и окрашивали Кумасси синим (далее называемым “СВВ”). В результате явно более интенсивные полосы были обнаружены в экстракте E. coli pKSN657 и в экстракте E. coli pKSN657F, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 47 кДа. В экстракте E. coli pKSN657F обнаружили более интенсивную полосу, чем в экстракте E. coli pKSN657. Было показано, что E. coli JM109/pKSN657F экспрессировала белок (А1) данного изобретения в более высокой степени, чем E. coli JM109/pKSN657.
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 1 часа при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 4(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 6.
E. coli
Пример 5. Получение белка (А2) данного изобретения
(1) Получение неочищенного экстракта клеток
Замороженный исходный материал Saccharopolyspora taberi JCM 9383t добавляли к 10 мл среды А (0,1% (мас./об.) глюкоза, 0,5% (мас./об.) триптон, 0,5% (мас./об.) дрожжевой экстракт, 0,1% (мас./об.) дикалий-гидрофосфат, рН 7,0) в тест-пробирке на 10 мл и инкубировали при встряхивании при 30°С в течение 1 дня для получения предварительной культуры. Восемь миллилитров (8 мл) предварительной культуры добавляли к 200 мл среды А и инкубировали при вращении в колбе с перегородкой на 500 мл при 30°С в течение 2 дней. Осадки клеток получали центрифугированием (3000 g, 10 мин) 10 л полученной культуры. Эти осадки клеток суспендировали в 100 мл среды В (1% (мас./об.) глюкоза, 0,1% мясной экстракт, 0,2% (мас./об.) триптоза), содержащей соединение (II) при 100 м.д., и инкубировали с возвратно-поступательным качанием в колбе Сакагучи на 500 мл в течение 20 часов при 30°С. Осадки клеток получали центрифугированием (3000 g, 10 мин) 10 л полученной смеси. Полученные осадки клеток промывали дважды 1 л 0,1 М калий-фосфатного буфера (рН 7,0) с получением 119 г осадков клеток.
Эти осадки клеток суспендировали в 0,1 М калий-фосфатном буфере (рН 7,0) при 2 мл на 1 г осадков клеток. Добавляли 1 мМ ФМСФ, 5 мМ бензамидин·HCl, 1 мМ ЭДТА, 3 мкг/мл лейпептина, 3 мкг/мл пепстатина и 1 мМ дитиотрейтола. Раствор клеточного лизата получали разрушением дважды этой суспензии с использованием Френч-пресса (1000 кг/см2) (Ohtake Seisakusho). После центрифугирования раствора клеточного лизата (40000 g, 30 мин) супернатант извлекали и центрифугировали в течение 1 часа при 150000 g для извлечения супернатанта (называемого далее «неочищенным клеточным экстрактом»).
(2) Определение способности превращать соединение (II) в соединение (III)
Готовили 30 мкл реакционного раствора 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2,4 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,5 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл неочищенного клеточного экстракта, полученного в примере 5(1). Реакционный раствор выдерживали при 30°С в течение часа. Кроме того, готовили и выдерживали таким же образом реакционный раствор без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 7.
(3) Фракционирование неочищенного клеточного экстракта
К неочищенному клеточному экстракту, полученному в примере 5(1), добавляли сульфат аммония до 45% насыщения. После перемешивания в охлаждаемых льдом условиях получали супернатант центрифугированием в течение 10 минут при 12000 g. После добавления сульфата аммония к полученному супернатанту до 55% насыщения и перемешивания в охлаждаемых льдом условиях осадок получали центрифугированием в течение 10 минут при 12000 g. Этот осадок растворяли в 32,5 мл 20 мМ бистриспропанового буфера (рН 7,0). Этот раствор подвергали хроматографии на колонке PD10 (Amersham Pharmacia Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) с получением 45,5 мл фракций, содержащих белки (далее называемых «фракцией 45-55% сульфата аммония»).
(4) Выделение белка (А2) данного изобретения
Фракцию 45-55% сульфата аммония, полученную в примере 5(3), вводили в колонку HiLoad 26/10 Q-Sepharose HP (Amersham Pharmacia Company). Затем после протекания 100 мл 20 мМ бистриспропанового буфера (рН 7,0) через колонку, 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,004 М/мин, диапазон концентрации NaCl был от 0 М до 0,5 М, скорость тока была 8 мл/мин) для фракционного извлечения 30 мл фракций, элюирующихся при концентрации NaCl от 0,25 до 0,26 М. Затем извлеченные фракции подвергали хроматографии на колонке PD10 (Amersham Pharmacia Biotech Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) для получения фракций, содержащих белок.
Извлеченные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) с элюцией буфером А (2 мМ калий-фосфатный буфер, содержащий 1,5 мМ NaCl, рН 7,0) для получения фракций, содержащих белок. Затем эти фракции вводили в колонку СНТ10-I Bio-Scale Ceramic Hydroxyapatite Type I (Bio-Rad Company). Двадцать миллилитров (20 мл) буфера А пропускали через колонку. Затем буфер А протекал с линейным градиентом буфера В (100 мМ калий-фосфатный буфер, содержащий 0,03 мМ NaCl; линейный градиент начинался при 100% буфера А с увеличением до 50% буфера В на протяжении периода 100 минут, скорость тока была 2 мл/мин) для фракционного извлечения 10 мл фракций, элюирующихся при концентрации буфера В от 23 до 25%. Далее, полученные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) и элюировали 0,05 М калий-фосфатным буфером (рН 7,0) с получением фракций, содержащих белок.
Полученные фракции концентрировали до приблизительно 770 мкл с использованием ультрафильтрационной мембраны (Microcon YM-30, Millipore Company) и вводили в колонку 75 пг HiLoad 16/60 Superdex (Amersham Pharmacia Biotech Company). 50 мМ калий-фосфатный буфер, содержащий 0,15 М NaCl (рН 7,0), протекал (скорость тока 1 мл/мин) через колонку. Элюат фракционировали по 2 мл в каждой пробирке. Фракции, элюирующиеся при объемах элюции более или менее 61 мл, фракционно извлекали по отдельности. Белок, содержащийся в каждой из этих фракций, анализировали электрофорезом в 10-20% ДСН-ПААГ.
Вместо неочищенного клеточного экстракта в реакционном растворе, описанном в примере 5(2), полученные фракции добавляли и выдерживали в присутствии компонента А, компонента В, компонента С и соединения (II), меченного 14С, подобно примеру 5(2). Реакционные растворы после этого выдерживания анализировали при помощи ТСХ для исследования интенсивности пятен, соответствующих соединению (III), меченному 14С. Наблюдали, что белок, перемещающийся к положению 47 кДа при описанном выше электрофорезе в ДСН-ПААГ, имел флуктуации в концентрациях полос этих фракций, добавляемых по очереди, которые были параллельными с флуктуациями интенсивности пятен, соответствующих соединению (III). Указанный белок извлекали из геля ДСН-ПААГ и подвергали аминокислотному анализу с использованием секвенатора белков (Applied Biosystems Company, Procise 494HT, импульсный жидкостной способ) для секвенирования N-конца аминокислотной последовательности. В результате была получена аминокислотная последовательность, показанная в SEQ ID NO:20. Затем, после расщепления этого белка трипсином, полученный расщепленный материал анализировали на масс-спектрометре (ThermoQuest Company, Ion Trap Mass Spectrometer LCQ, колонка: LC Packings Company PepMap C18 75 мкм х 150 мм, растворитель А: 0,1% HOAc-H2O, растворитель В: 0,1% НОАс-метанол, градиент: линейный градиент, начинающийся при элюции смесью 95% растворителя А и 5% растворителя В и увеличивающийся до концентрации 100% растворителя В на протяжении 30 минут, скорость тока: 0,2 мкл/мин). В результате была получена последовательность, показанная в SEQ ID NO:21.
Пример 6. Получение ДНК (А2) данного изобретения
(1) Получение хромосомной ДНК Saccharopolyspora taberi JCM 9383t
Saccharopolyspora taberi JCM 9383t культивировали при встряхивании при 30°С в течение 1 - 3 дней в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2.6Н2О). Клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток встряхивали при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55°С в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
(2) Получение библиотеки хромосомной ДНК Saccharopolyspora taberi JCM 9383t
Девятнадцать микрограммов (19 мкг) хромосомной ДНК, полученной в примере 5(1), расщепляли 0,78 единицами рестриктазы Sau3AI при 37°С в течение 60 минут. Полученный расщепленный раствор разделяли электрофорезом в 1% агарозном геле. ДНК размером приблизительно 2,0 т.п.н. извлекали из геля. Эту ДНК очищали с использованием набора для экстракции из гелей QIAquick Gel Extraction (Qiagen Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и концентрировали осаждением этанолом с получением 10 мкл раствора, содержащего желаемую ДНК. 8 микролитров (8 мкл) этого раствора ДНК, 100 нг плазмидного вектора pUC118, расщепленного рестриктазой BamHI и обработанного дефосфорилированием, и 12 мкл раствора I из набора для лигирования Ver. 2 (Takara Shuzo Company) смешивали и инкубировали в течение 3 часов при 16°С. E. coli DH5α трансформировали с использованием раствора для лигирования. Трансформанты E. coli культивировали в течение ночи при 37°С в среде с LB-агаром, содержащей 50 мг/л ампициллина. Полученные колонии извлекали из агаровой среды. Плазмиды экстрагировали и их называли библиотекой хромосомной ДНК.
(3) Выделение ДНК (А2) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 6(1) с ПЦР-системой Expand HiFi (Boehringer Manheim Company) (фиг. 2). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:54, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:55 (далее называемую «парой 6 праймеров»). Нуклеотидную последовательность, показанную в SEQ ID NO:54, конструировали на основе нуклеотидной последовательности, кодирующей N-концевую аминокислотную последовательность, показанную в SEQ ID NO:20. Далее, нуклеотидную последовательность, показанную в SEQ ID NO:55, конструировали на основе нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей внутреннюю аминокислотную последовательность, показанную в SEQ ID NO:21. Реакционный раствор для ПЦР доводили до 25 мкл добавлением 300 нг вышеуказанной хромосомной ДНК, каждого из этих 2 праймеров, доведенных до 7,5 пмоль, 0,2 мкл смеси dNTP (смеси 2 мМ каждого из 4 типов dNTP), 2,5 мкл 10х буфера (содержащего MgCl2), 0,19 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд и затем 72°С в течение 1 минуты; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 секунд добавляли к выдерживанию при 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. После этого выдерживания реакционный раствор наносили на 2% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 800 п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей Qiagenquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором ТА pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company). Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате получили нуклеотидную последовательность, состоящую из нуклеотидов 36-819 нуклеотидной последовательности, показанной в SEQ ID NO:10. Нуклеотиды 37-60 нуклеотидной последовательности, показанной в SEQ ID NO:10, кодировали часть аминокислотной последовательности, показанной в SEQ ID NO:20. В этой связи, ожидалось, что указанная ДНК кодирует часть белка (А2) данного изобретения.
Затем проводили ПЦР с использованием хромосомной ДНК, полученной в примере 6(2), в качестве матрицы, подобно описанному выше с ПЦР-системой Expand HiFi. В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:56, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:57 (далее называемую «парой 7 праймеров»). Посредством проведения ПЦР с такими праймерами амплифицировали ДНК, имеющую нуклеотидную последовательность, в которой 5'-конец удлиняется после нуклеотида, показанного как нуклеотид 36 нуклеотидной последовательности, показанной в SEQ ID NO:10. Далее, в качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:58, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:59 (далее называемую «парой 8 праймеров»). Посредством проведения ПЦР с такими праймерами амплифицировали ДНК, имеющую нуклеотидную последовательность, в которой 3'-конец удлиняется после нуклеотида, показанного как нуклеотид 819 нуклеотидной последовательности, показанной в SEQ ID NO:10. Каждую из ДНК размером 1,3 т.п.н., амплифицированной с использованием пары 7 праймеров, и ДНК размером 0,4 т.п.н., амплифицированной с использованием пары 8 праймеров, клонировали в клонирующий вектор ТА pCRII-TOPO. Из полученного трансформанта E. coli получали плазмидную ДНК с использованием Qiagen Tip20 (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company) и олигонуклеотида, показанного в SEQ ID NO:60. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате секвенирования нуклеотидной последовательности ДНК размером 1,3 т.п.н., амплифицированной с использованием пары 7 праймеров, получили нуклеотидную последовательность, состоящую из нуклеотидов 1-35 нуклеотидной последовательности, показанной в SEQ ID NO:10. Далее, в результате секвенирования нуклеотидной последовательности ДНК размером 0,4 т.п.н., амплифицированной с использованием пары 8 праймеров, получили нуклеотидную последовательность, состоящую из нуклеотидов 819-1415 нуклеотидной последовательности, показанной в SEQ ID NO:10. В результате соединения полученных последовательностей получили нуклеотидную последовательность, показанную в SEQ ID NO:10. В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, в ней содержалась нуклеотидная последовательность (SEQ ID NO:7), состоящая из 1206 нуклеотидов (включая стоп-кодон) и кодирующая 401 аминокислотный остаток, а также нуклеотидная последовательность (SEQ ID NO:16), состоящая из 198 нуклеотидов (включая стоп-кодон) и кодирующая 65 аминокислотных остатков. Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:2), кодируемого нуклеотидной последовательностью, показанной в SEQ ID NO:7, равна 43983 Да. Далее, аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, содержала аминокислотную последовательность (SEQ ID NO:20), определенную из секвенирования аминокислот из N-конца белка (А2) данного изобретения, и аминокислотную последовательность (SEQ ID NO:21), определенную из секвенирования аминокислот расщепленных трипсином фрагментов при помощи масс-спектрометрического анализа. Было рассчитано, что молекулярная масса данного белка, состоящего из аминокислотной последовательности SEQ ID NO:13, кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:16, равна 6707 Да.
Пример 7. Экспрессия белка (А2) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей белок (А1) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Saccharopolyspora taberi JCM 9383t в примере 6(1), и с использованием ПЦР-системы Expand HiFi (Boehringer Manheim Company). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:61, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:62 (далее называемую «парой 21 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:61, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:63 (далее называемую «парой 22 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих двух праймеров, доведенных до 300 нМ, 50 нг вышеуказанной хромосомной ДНК, 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP), 5 мкл 10х буфера Expand HF (содержащего MgCl2) и 0,75 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд, затем 72°С в течение 1 минуты; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 секунд добавляли для поддержания 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. После этого выдерживания реакционный раствор наносили на 1% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 21 праймеров. Зону геля, содержащую ДНК размером приблизительно 1,4 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 22 праймеров. ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми в указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Затем реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company), олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:56, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:64. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:7, была названа pCR923, а плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:10, была названа pCR923F.
Затем каждую из плазмид pCR923 и pCR923F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR923. Зону геля, содержащую ДНК размером приблизительно 1,4 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR923F. Эти ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Каждую из полученных ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:7, в которой ДНК размером приблизительно 1,2 т.п.н., кодирующая белок (А2) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN923. Далее, плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:10, в которой ДНК размером приблизительно 1,4 т.п.н., кодирующая белок (А2) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN923F. Каждую из вышеуказанных плазмид pKSN923 и pKSN923F вводили в E. coli JM109. Полученные трансформанты E. coli были названы соответственно JM109/pKSN923 и JM109/pKSN923F. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (А2) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN923 и JM109/pKSN923F и JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. После достижения OD660 приблизительно 0,5 добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 17 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200хg, 5 минут) супернатанты извлекали и центрифугировали (150000хg, 70 минут) для получения фракций супернатанта (далее фракцию супернатанта, полученную из E. coli JM109/pKSN923, называют “экстрактом E. coli pKSN923”, фракцию супернатанта, полученную из E. coli JM109/pKSN923F, называют “экстрактом E. coli pKSN923F», а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15%-25% ДСН-ПААГ и окрашивали СВВ. В результате явно более интенсивные полосы были обнаружены в экстракте E. coli pKSN923 и в экстракте E. coli pKSN923F, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 47 кДа. Было подтверждено, что E. coli JM109/pKSN923 и E. coli JM109/pKSN923F экспрессировали белок (А2) данного изобретения.
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 7(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 8.
E. coli
Пример 8. Получение белка (А10) данного изобретения
(1) Получение неочищенного экстракта клеток
Замороженный исходный материал Streptomyces griseolus ATCC 11796 добавляли к 250 мл среды В (0,1% (мас./об.) глюкоза, 0,1% (мас./об.) мясной экстракт, 0,2% (мас./об.) триптоза) в колбе с перегородкой на 500 мл и инкубировали с ротационным качанием при 30°С в течение 3 дней для получения предварительной культуры. Сорок миллилитров (40 мл) предварительной культуры добавляли к 400 мл среды В и инкубировали с ротационным качанием в трехгранной колбе на 1 л при 30°С в течение 24 часов. После прекращения культивирования культуре давали осесть. Удаляли только 220 мл супернатанта. Подобным образом готовили 220 мл свежей среды и добавляли к остальным 220 мл культуральной среды до объема 440 мл. Соединение (II) добавляли к этому объему до количества 100 м.д. Клетки инкубировали при ротационном встряхивании в трехгранной колбе на 1 л при 30°С в течение 40 часов. Осадки клеток получали центрифугированием (3000 g, 5 мин) 2,6 л полученной культуры. Полученные осадки клеток промывали 1 л 0,1 М PIPES-NaOH-буфера (рН 6,8) с получением 26 г осадков клеток.
Эти осадки клеток суспендировали в 0,1 М PIPES-NaOH-буфере (рН 6,8) при 3 мл на 1 г клеточных осадков и добавляли 1 мМ ФМСФ, 5 мМ бензамидин.HCl, 1 мМ ЭДТА, 3 мкг/мл лейпептина, 3 мкг/мл пепстатина А и 1 мМ дитиотрейтол. Раствор клеточного лизата получали разрушением дважды этой суспензии с использованием Френч-пресса (1000 кг/см2) (Ohtake Seisakusho). После центрифугирования раствора клеточного лизата (40000 g, 30 мин) супернатант извлекали и центрифугировали в течение 1 часа при 150000 g для извлечения супернатанта (называемого далее «неочищенным клеточным экстрактом»).
(2) Определение способности превращать соединение (II) в соединение (III)
Готовили 30 мкл реакционного раствора 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2,4 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,5 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл неочищенного клеточного экстракта, полученного в примере 8(1). Реакционный раствор выдерживали при 30°С в течение часа. Кроме того, готовили и выдерживали таким же образом реакционный раствор без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 9.
(3) Фракционирование неочищенного клеточного экстракта
К неочищенному клеточному экстракту, полученному в примере 8(1), добавляли сульфат аммония до 45% насыщения. После перемешивания в охлаждаемых льдом условиях получали супернатант центрифугированием в течение 10 минут при 12000 g. После добавления сульфата аммония к полученному супернатанту до 55% насыщения и перемешивания в охлаждаемых льдом условиях осадок получали центрифугированием в течение 10 минут при 12000 g. Этот осадок растворяли в 20 мМ бистриспропановом буфере (рН 7,0) до количества 10 мл. Этот раствор подвергали хроматографии на колонке PD10 (Amersham Pharmacia Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) с получением 14 мл фракций, содержащих белки (далее называемых «фракцией 45-55% сульфата аммония»).
(4) Выделение белка (А10) данного изобретения
Фракцию 45-55% сульфата аммония, полученную в примере 8(3), вводили в колонку MonoQ HR 10/10 (Amersham Pharmacia Company). Затем после протекания 16 мл 20 мМ бистриспропанового буфера (рН 7,0) через колонку, 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,00625 М/мин, диапазон концентрации NaCl был от 0 М до 0,5 М, скорость тока была 4 мл/мин) для фракционного извлечения 15 мл фракций, элюирующихся при концентрации NaCl от 0,28 до 0,31 М. Затем извлеченные фракции подвергали хроматографии на колонке PD10 (Amersham Pharmacia Biotech Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) для получения фракций, содержащих белок.
Извлеченные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) с элюцией буфером А (2 мМ калий-фосфатный буфер, содержащий 1,5 мМ NaCl, рН 7,0) для получения фракций, содержащих белок. Затем эти фракции вводили в колонку СНТ10-I Bio-Scale Ceramic Hydroxyapatite Type I (BioRad Company). Пятьдесят миллилитров (50 мл) буфера А пропускали через колонку. Затем буфер А протекал с линейным градиентом буфера В (100 мМ калий-фосфатный буфер, содержащий 0,03 мМ NaCl; линейный градиент начинался при 100% буфера А с увеличением до 50% буфера В на протяжении периода 40 минут, скорость тока была 5 мл/мин) для фракционного извлечения фракций, элюирующихся при концентрации буфера В от 16 до 31%. Далее, полученные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) и элюировали 0,05 М калий-фосфатным буфером (рН 7,0) с получением фракций, содержащих белок. Белок, содержащийся в каждой из этих фракций, анализировали электрофорезом в 10-20% ДСН-ПААГ.
Вместо неочищенного клеточного экстракта в реакционном растворе, описанном в примере 8(2), полученные фракции добавляли и выдерживали в присутствии компонента А, компонента В, компонента С и соединения (II), меченного 14С, подобно примеру 8(2). Реакционные растворы после этого выдерживания анализировали при помощи ТСХ для исследования интенсивности пятен, соответствующих соединению (III), меченному 14С. Наблюдали, что белок, перемещающийся к положению 47 кДа при описанном выше электрофорезе в ДСН-ПААГ, имел флуктуации в концентрациях полос этих фракций, добавляемых по очереди, которые были параллельными с флуктуациями интенсивности пятен, соответствующих соединению (III). Указанный белок извлекали из геля ДСН-ПААГ и подвергали расщеплению трипсином. Полученный расщепленный материал анализировали на масс-спектрометре (ThermoQuest Company, Ion Trap Mass Spectrometer LCQ, колонка: LC Packings Company PepMap C18 75 мкм х 150 мм, растворитель А: 0,1% HOAc-H2O, растворитель В: 0,1% НОАс-метанол, градиент: линейный градиент, начинающийся при элюции смесью 95% растворителя А и 5% растворителя В и увеличивающийся до концентрации 100% растворителя В на протяжении 30 минут, скорость тока: 0,2 мкл/мин). В результате были получены последовательности, показанные в SEQ ID NO:22-34.
Пример 9. Получение хромосомной ДНК Streptomyces griseolus ATCC 11796
Streptomyces griseolus ATCC 11796 инкубировали при встряхивании при 30°С в течение 1 - 3 дней в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2 ·6Н2О). Клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток встряхивали при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55єС в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
Пример 10. Получение ДНК, кодирующей данный белок (А10), и экспрессия в E. coli
(1) Получение трансформированной E. coli, имеющей данную ДНК
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces griseolus ATCC 11796 в примере 9, и с использованием ПЦР-системы Expand High Fidelity (Roche Molecular Biochemicals Company). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:79, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:80 (далее называемую «парой 23 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:79, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:81 (далее называемую «парой 24 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением этих 2 праймеров, доведенных до 300 нМ, 50 нг вышеуказанной хромосомной ДНК, 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP), 5 мкл 10х буфера Expand HF (содержащего MgCl2) и 0,75 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд, затем 72°С в течение 2 минут; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 68°С в течение 30 секунд, затем 72°С в течение 2 минут; (где добавляли 20 секунд для поддержания 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. После этого выдерживания каждый из реакционных растворов наносили на 1% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 23 праймеров. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 24 праймеров. ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором pCR2.1-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора Qiaprep Spin Miniprep Kit (Qiagen Company). Затем реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров праймера -21М13 (Applied Biosystems Japan Company) и праймера М13Rev (Applied Biosystems Japan Company), олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:82, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:83. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:84, была названа pCR11796, а плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:85, была названа pCR11796F. Две открытые рамки считывания (ORF) присутствовали в нуклеотидной последовательности, показанной в SEQ ID NO:85. Таким образом, в ней содержалась нуклеотидная последовательность (SEQ ID NO:84), состоящая из 1221 нуклеотидов (включая стоп-кодон) и кодирующая 406 аминокислотных остатков (аминокислотную последовательность, показанную в SEQ ID NO:5), и нуклеотидная последовательность, состоящая из 210 нуклеотидов (включая стоп-кодон) и кодирующая 69 аминокислотных остатков.
Затем каждую из плазмид pCR11796 и pCR11796F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR11796. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR11796F. Эти ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей Qiagen quick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Каждую из полученных ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:84, в которой ДНК размером приблизительно 1,2 т.п.н., кодирующая белок (А10) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN11796. Далее, плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:85, в которой ДНК размером приблизительно 1,5 т.п.н., кодирующая белок (А10) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN11796F. Каждую из вышеуказанных плазмид pKSN11796 и pKSN11796F вводили в E. coli JM109. Полученные трансформанты E. coli были названы соответственно JM109/pKSN11796 и JM109/pKSN11796F. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия данного белка (А10) в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN11796, JM109/pKSN11796F и JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. После достижения OD660 приблизительно 0,5, добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 17 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатанта (далее фракцию супернатанта, полученную из E. coli JM109/pKSN11796, называют “экстрактом E. coli pKSN11796”, фракцию супернатанта, полученную из E. coli JM109/pKSN11796F, называют “экстрактом E. coli pKSN11796F», а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15-25% ДСН-ПААГ и окрашивали Кумасси синим (далее называемым “СВВ”). В результате явно более интенсивные полосы были обнаружены в экстракте E. coli pKSN11796 и в экстракте E. coli /pKSN11796F, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 45 кДа. В экстракте E. coli pKSN11796F обнаружили более интенсивную полосу, чем в экстракте E. coli pKSN11796. Было показано, что E. coli JM109/pKSN11796F экспрессировала данный белок (А10) в более высокой степени, чем E. coli JM109/pKSN11796.
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 1 часа при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 10(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 10.
E. coli
Пример 11. Получение ДНК (А3) данного изобретения
(1) Получение хромосомной ДНК Streptomyces testaceus ATCC21469
Streptomyces testaceus ATCC21469 инкубировали при встряхивании при 30°С в течение 1 - 3 дней в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2·6Н2О). Клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток встряхивали при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55°С в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
(2) Выделение ДНК (А3) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 11(1). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:65, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:66 (далее называемую «парой 9 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением 250 нг вышеуказанной хромосомной ДНК, каждого из этих 2 праймеров, доведенных до 200 нМ, 4 мкл смеси dNTP (смеси 2,5 мМ каждого из 4 типов dNTP), 5 мкл 10х ExTaq буфера, 0,5 мкл полимеразы ExTaq (Takara Shuzo Company) и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 30 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд, затем 72°С в течение 90 секунд, и затем поддержание 72°С в течение 4 минут. После этого выдерживания реакционный раствор наносили на 0,8% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 1,4 т.п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором ТА pCR2.1 (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:67, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:68. В реакциях секвенирования использовали полученную плазмиду в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате получили нуклеотидную последовательность, показанную в SEQ ID NO:69. Две открытые рамки считывания (ORF) присутствовали в указанной нуклеотидной последовательности. Таким образом, в ней содержалась нуклеотидная последовательность, состоящая из 1188 нуклеотидов (включая стоп-кодон) и кодирующая 395 аминокислотных остатков, и нуклеотидная последовательность (SEQ ID NO:17), состоящая из 195 нуклеотидов (включая стоп-кодон) и кодирующая 64 аминокислотных остатка. Было рассчитано, что молекулярная масса аминокислотной последовательности, кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:17, равна 6666 Да.
Пример 12. Экспрессия белка (А3) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А3) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 11(1), и с использованием полимеразы ExTaq (Takara Shuzo Company) в условиях, сходных с условиями, описанными выше. В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:70, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:71 (далее называемую «парой 10 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:70, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:72 (далее называемую «парой 11 праймеров»). ДНК размером 1,2 т.п.н., амплифицированную с использованием пары 10 праймеров, и ДНК размером 1,5 т.п.н., амплифицированную с использованием пары 11 праймеров, клонировали в клонирующий вектор ТА pCR2.1 в соответствии с описанными выше способами. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:67, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:68. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате было показано, что плазмида, клонированная с ДНК, амплифицированной парой 10 праймеров, имеет нуклеотидную последовательность, показанную в SEQ ID NO:8. Было показано, что плазмида, клонированная с ДНК, амплифицированной парой 11 праймеров, имеет нуклеотидную последовательность, показанную в SEQ ID NO:11. Две открытые рамки считывания (ORF) присутствовали в указанной нуклеотидной последовательности, показанной в SEQ ID NO:11. Таким образом, в ней содержалась нуклеотидная последовательность (SEQ ID NO:8), состоящая из 1188 нуклеотидов (включая стоп-кодон) и кодирующая 395 аминокислотных остатков, и нуклеотидная последовательность, состоящая из 195 нуклеотидов (включая стоп-кодон) и кодирующая 64 аминокислотных остатка. Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности, кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:8, равна 43752 Да. Что касается полученных плазмид, плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:8, была названа pCR671, а плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:11, была названа pCR671F.
Затем каждую из плазмид pCR671 и pCR671F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,2 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR671. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR671F. Эти ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей Qiagen quick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Каждую из полученных ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:8, в которой ДНК размером приблизительно 1200 п.н., кодирующая белок (А3) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN671. Далее, плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:11, в которой ДНК размером приблизительно 1400 п.н., кодирующая белок (А3) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN671F. Каждую из вышеуказанных плазмид pKSN671 и pKSN671F вводили в E. coli JM109. Полученные трансформанты E. coli были названы соответственно JM109/pKSN671 и JM109/pKSN671F. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (А3) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN671, JM109/pKSN671F и JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. После достижения OD660 приблизительно 0,5 добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 17 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатанта (далее фракцию супернатанта, полученную из E. coli JM109/pKSN671, называют “экстрактом E. coli pKSN671”, фракцию супернатанта, полученную из E. coli JM109/pKSN671F, называют “экстрактом E. coli pKSN671F», а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 1 часа при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 12(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 11.
E. coli
Пример 13. Получение данной ДНК (А9)
(1) Получение хромосомной ДНК Streptomyces carbophilus SANK62585
Streptomyces carbophilus SANK62585 (FERM BP-1145) инкубировали при встряхивании при 30°С в течение 1 дня в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2.6Н2О). Затем клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток встряхивали при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55°С в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
(2) Выделение ДНК (А9) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 13(1). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:74, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:75 (далее называемую «парой 12 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:76, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:77 (далее называемую «парой 13 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих 2 праймеров, доведенных до 200 нМ, 250 нг вышеуказанной хромосомной ДНК, 4 мкл смеси dNTP (смеси 2,5 мМ каждого из 4 типов dNTP), 5 мкл 10х ExTaq буфера, 0,5 мкл полимеразы ExTaq (Takara Shuzo Company) и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 95°С в течение 2 минут, повторение 30 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд, затем 72°С в течение 90 секунд, и затем поддержание при 72°С в течение 4 минут. После этого выдерживания реакционный раствор наносили на 0,8% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 500 п.н., извлекали из геля, на который наносили реакционный раствор для ПЦР, использующий пару 12 праймеров. Зону геля, содержащую ДНК размером приблизительно 800 п.н., извлекали из геля, на который наносили реакционный раствор для ПЦР, использующий пару 13 праймеров. ДНК очищали из каждого извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученные ДНК лигировали с клонирующим вектором ТА pCR2.1 (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидные ДНК получали из полученных трансформантов E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакцию секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:67, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:68. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матриц. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). В результате нуклеотидную последовательность, состоящую из нуклеотидов 1-498 нуклеотидной последовательности, показанной в SEQ ID NO:78, получили с использованием ДНК, полученной ПЦР, использующей пару 12 праймеров. Нуклеотидную последовательность, состоящую из нуклеотидов 469-1233 нуклеотидной последовательности, показанной в SEQ ID NO:78, получили с использованием ДНК, полученной ПЦР, использующей пару 13 праймеров. Плазмида, имеющая нуклеотидную последовательность нуклеотидов 1-498, показанную в SEQ ID NO:78, была названа pCRSCA1. Плазмида, имеющая нуклеотидную последовательность нуклеотидов 469-1233, показанную в SEQ ID NO:78, была названа pCRSCA2.
Пример 14. Экспрессия данного белка (А9) в E. coli
(1) Получение трансформированной E. coli, имеющей данную ДНК (А9)
После получения плазмид в примере 13(2) указанную выше плазмиду pCRSCA1 расщепляли NdeI и NcoI и pCRSCA2 расщепляли NdeI и NcoI. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 500 п.н., вырезали из геля, на который наносили продукты расщепления pCRSCA1. Зону геля, содержащую ДНК размером приблизительно 800 п.н., вырезали из геля, на который наносили продукты расщепления pCRSCA2. ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Два типа полученной ДНК лигировали вместе с плазмидой pKSN2, расщепленной NdeI и HindIII, с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:78, в которой ДНК, кодирующая белок (А9) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSNSCA.
(2) Экспрессия данного белка (А9) в E. coli и выделение указанного белка
E. coli JM109/pKSNSCA культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Полученную культуральную среду переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, так что OD660 была 0,2, и культивировали при 26°С. После достижения OD660 приблизительно 2,0 добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 200 мМ и дополнительно культивировали в течение 5 часов.
Клетки извлекали из каждой из культуральных сред, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатанта (далее фракцию супернатанта, полученную из E. coli JM109/pKSNSCA, называют “экстрактом E. coli pKSNSCA”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 14(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 12.
E. coli
Пример 15. Выделение гена RuBPC сои
После посева сои (сорта Jack) сою культивировали при 27°С в течение 30 дней и собирали листья. Две десятых грамма (0,2 г) - 0,3 г собранных листьев замораживали жидким азотом и растирали пестиком в ступке. Затем из растертого продукта экстрагировали тотальную РНК в соответствии с руководством, прилагаемым к растворителю для экстракции РНК ISOGEN (Nippon Gene Company). Далее, синтезировали кДНК с использованием системы синтеза первой цепи Superscript для ОТ-ПЦР (Invitrogen Company), проведением процедур в соответствии с прилагаемым руководством. Конкретно, первую цепь кДНК синтезировали с использованием праймера Oligo(dT)12-18, обеспечиваемого этим набором, в качестве праймера и тотальной РНК сои в качестве матрицы и добавлением к ним обратной транскриптазы, обеспечиваемой этим набором. Затем при помощи ПЦР амплифицировали ДНК, кодирующую хлоропластный транзитный пептид малой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы (далее рибулозо-1,5-бисфосфаткарбоксилазу называют «RuBPC») сои (сорта Jack) с последующими 12 аминокислотами зрелого белка (далее хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), называют иногда “rSt”; а ДНК, кодирующую хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) с последующими 12 аминокислотами зрелого белка, называют «данной ДНК rSt12»). В этой ПЦР использовали полученную кДНК в качестве матрицы, а в качестве праймеров-олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:86, и олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:87. В ПЦР использовали полимеразу Taq LA ((Takara Shuzo Company). ПЦР проводили поддержанием один раз 94°С в течение 3 минут; проведением 30 циклов, где каждый цикл включал поддержание 98°С в течение 25 секунд и затем 68°С в течение 1 минуты; и поддержание один раз 72°С в течение 10 минут. Плазмиду pCRrSt12 (фиг. 5) получали встраиванием амплифицированной ДНК в сайт клонирования ПЦР-продукта плазмиды pCR2.1 (Invitrogen Company). Затем плазмиду вводили в компетентные клетки штамма E. coli JM109 и отбирали устойчивые к ампициллину штаммы. Затем нуклеотидную последовательность плазмиды, содержащейся в отобранных устойчивых к ампициллину штаммах, определяли с использованием набора Dye terminator cycle sequencing FS ready (PE Applied Biosystems Company) и секвенатора ДНК 373S (РЕ Applied Biosystems Company). В результате получали нуклеотидную последовательность, показанную в SEQ ID NO:88. Было подтверждено, что плазмида pCRrSt12 содержала данную ДНК rSt12.
Пример 16. Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А1) данного изобретения, для прямого введения
(1) Выделение ДНК (А1) данного изобретения
ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:6, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы геномной ДНК Streptomyces phaeochromogenes IFO12898 и с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:93, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:94. Далее, ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:9, амплифицировали при помощи ПЦР. Эту ПЦР проводили с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:93, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:95. В указанной ПЦР использовали ПЦР-систему Expand High Fidelity (Boehringer Company). После поддержания один раз 97°С в течение 2 минут проводили 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты; затем проводили 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 секунд добавляли к поддержанию 72°С для каждого цикла); и затем проводили поддержание 72°С в течение 7 минут. Плазмиды pCR657ET (фиг. 6) и pCR657FET (фиг. 7) получали встраиванием амплифицированной ДНК в район клонирования продукта ПЦР pCR2.1 (Invitrogen Company). Кроме того, другую, чем при использовании олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:96, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:94, плазмиду pCR657Bs (фиг. 8) получали с использованием процедур, сходных с описанным выше способом. Кроме того, другую, чем при использовании олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:96, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:97, плазмиду pCR657FBs (фиг. 9) получали с использованием процедур, сходных с описанным выше способом. Затем эти плазмиды вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали устойчивые к ампициллину клетки. Далее, нуклеотидные последовательности этих плазмид, содержащиеся в устойчивых к ампициллину штаммах, определяли с использованием набора BigDye terminator cycle sequencing Ready Reaction kit v.2.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (РЕ Applied Biosystems Company). В результате было подтверждено, что плазмиды pCR657ET и pCR657Bs имеют нуклеотидную последовательность, показанную в SEQ ID NO:6. Было подтверждено, что плазмиды pCR657FET и pCR657FBs имеют нуклеотидную последовательность, показанную в SEQ ID NO:9.
(2) Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А1) данного изобретения, для прямого введения - часть (1)
Плазмиду, содержащую химерную ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) (далее иногда называемой «последовательностью, кодирующей хлоропластный транзитный пептид»), без изменения рамок считывания в кодонах, конструировали в качестве плазмиды для введения ДНК (А1) данного изобретения в растение с использованием способа с ружьем для частиц.
Сначала, pCRrSt12 расщепляли рестриктазами HindIII и KpnI. Выделяли ДНК, содержащую данную ДНК rSt12 изобретения. Затем получали ДНК размером приблизительно 2640 п.н. удалением приблизительно ДНК размером 40 п.н. из плазмидного вектора pUC19 (Takara Shuzo Company) расщеплением рестриктазами HindIII и KpnI. Затем, 5'-конец этой ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). ДНК, содержащую данную ДНК rSt12, полученную из pCRrSt12, встраивали в нее с получением pUCrSt12 (фиг. 10). Затем ДНК, содержащую ДНК (А1) данного изобретения, выделяли расщеплением каждой из плазмид pCR657ET и pCR657FET рестриктазами ЕсоТ22I и SacI. Каждую из полученных ДНК встраивали между сайтом рестрикции ЕсоТ22I и сайтом рестрикции SacI pUCrSt12 с получением плазмид pUCrSt657 (фиг. 11) и pUCrSt657F (фиг. 12), содержащих химерную ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
pBICR16G6PT (описанную в еще не прошедшей экспертизу заявке на патент 2000-166577 Японии) расщепляли рестриктазой EcoRI для выделения ДНК размером приблизительно 3 т.п.н. (Далее промотор, содержащийся в ДНК, описанной в указанной выше еще не прошедшей экспертизу заявке на патент Японии, называют также “промотором CR16G6”. Кроме того, терминатор, содержащийся в ДНК, описанной в указанной выше еще не прошедшей экспертизу заявке на патент Японии, называют также “терминатором CR16”). После расщепления плазмидного вектора pUC19 (Takara Shuzo Company) рестриктазой EcoRI, 5'-конец указанной ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). ДНК размером 3 т.п.н., полученную из pBICR16G6PT, встраивали в нее с получением плазмиды pUCCR16G6-p/t (фиг. 13). pUCCR16G6-p/t расщепляли рестриктазами HindIII и ScaI для выделения ДНК, содержащей промотор CR16G6. Затем расщеплением плазмидного вектора pUC19 (Takara Shuzo Company) рестриктазами HindIII и EcoRI ДНК размером 51 п.н. удаляли и получали оставшуюся ДНК, состоящую из 2635 п.н. Затем 5'-конец указанной ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). Указанную выше ДНК, содержащую промотор CR16G6, полученную из pUCCR16G6-p/t, и линкер NotI-EcoRI (фиг. 14), полученный из отжига олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:89, с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:90, встраивали в нее с получением pUCCR12G6-p/tΔ (фиг. 15). pUCCR12G6-p/tΔ расщепляли рестриктазами NdeI и EcoRI для выделения ДНК, имеющей частичную нуклеотидную последовательность терминатора CR16t. Далее, плазмидный вектор pUC19 (Takara Shuzo Company) расщепляли рестриктазами HindIII и EcoRI с получением ДНК размером 2635 п.н. 5'-конец указанной ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). Указанную выше ДНК, имеющую частичную нуклеотидную последовательность терминатора CR16t, полученную из pUCCR12G6-p/tΔ, и линкер HindIII-NotI (фиг. 16), полученный отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:91, с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:92, встраивали в нее с получением pNdG6-ΔТ (фиг. 17).
Затем посредством расщепления каждой из плазмид pUCrSt657 и pUCrSt657F рестриктазами BamHI и SacI выделяли ДНК, содержащую химерную ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах. Эту ДНК встраивали между сайтом рестриктазы BglII и сайтом рестриктазы SacI плазмиды pNdG6-ΔТ с получением плазмиды pSUM-NdG6-rSt-657 (фиг. 18) и плазмиды pSUM-NdG6-rSt-657F (фиг. 19).
(3) Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А1) данного изобретения, для прямого введения - часть (2)
Плазмиду, содержащую химерную ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах, конструировали в качестве плазмиды для введения ДНК (А1) данного изобретения в растение с использованием способа с ружьем для частиц. Сначала, после расщепления плазмидного вектора pKF19 (Takara Shuzo Company) рестриктазой BspHI, концы ДНК затупляли добавлением нуклеотидов к двухцепочечному гэпу с использованием ДНК-полимеразы KOD (Toyobo Corporation). Плазмиду pKF19ΔBs получали самоциклизацией полученной ДНК ДНК-лигазой Т4. pUCrSt12, полученную в примере 1, расщепляли рестриктазами HindIII и KpnI. ДНК, содержащую данную ДНК rSt12, выделяли. Плазмиду pKF19ΔBs расщепляли рестриктазами HindIII и KpnI с получением ДНК размером приблизительно 2160 п.н. 5'-концы указанной ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). ДНК, содержащую данную ДНК rSt12, полученную из pUCrSt12, встраивали в нее с получением pKFrSt12 (фиг. 20). Затем плазмиды pCR657Bs и pCR657FBs, полученные в примере 16(1), расщепляли, каждую, рестриктазами BspHI и SacI с выделением ДНК, содержащей ДНК (А1) данного изобретения. Каждую из этих ДНК встраивали между сайтом рестрикции BspHI и сайтом рестрикции SacI плазмиды pKFrSt12 с получением плазмиды pKFrSt12-657 (фиг. 21) и плазмиды pKFrSt12-657F (фиг. 22), которые содержали химерную ДНК, в которой ДНК (А1) данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах.
Затем каждую из плазмид pKFrSt12-657 и pKFrSt12-657F расщепляли рестриктазами BamHI и SacI с получением ДНК, содержащей ДНК (А1) данного изобретения. Каждую из этих ДНК встраивали между сайтом рестрикции BglII и сайтом рестрикции SacI плазмиды pNdG6-ΔТ, полученных в примере 16(2), с получением плазмид pSUM-NdG6-rSt12-657 (фиг. 23) и pSUM-NdG6-rSt12-657F (фиг. 24), где химерную ДНК, в которой ДНК (А1) данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах, присоединяли «справа» от промотора CR16G6.
Пример 17. Введение ДНК (А1) данного изобретения в сою
(1) Получение пролиферативных соматических зародышей
После погружения стручков сои (сортов: Fayette и Jack) в 1% раствор гипохлорита натрия для стерилизации извлекали незрелые семена. Оболочку семян отшелушивали и вынимали незрелый зародыш, имеющий диаметр 2-5 мм. Зародышевую ось полученного незрелого зародыша вырезали скальпелем с получением незрелого котиледона. Этот незрелый котиледон делили на 2 части котиледона (семядоли). Каждую часть котиледона (каждую семядолю) помещали в среду для развития соматических зародышей, соответственно. Средой для развития соматических зародышей была отверждаемая среда, где 0,2% (мас./об.) Гельрит добавляли к среде Мурашиге-Скуга (описанной в Murashige T. and Skoog F., Physiol. Plant (1962) 15, p473; далее называемой «средой МС»), в которой устанавливали рН 7,0 и которая имела добавленные к ней 180 мкМ 2,4-Д и 30 г/л сахарозы. Спустя 1 месяц после этого помещения на среду образованный глобулярный зародыш пересаживали в среду для выращивания соматических зародышей. Средой для выращивания соматических зародышей была отверждаемая среда, где 0,2% (мас./об.) Гельрит добавляли к среде МС, которую доводили до рН 5,8 и которая имела 90 мкМ 2,4 Д и 30 г/л сахарозы, добавленные к ней. После этого глобулярные зародыши пересаживали в свежую среду для выращивания соматических зародышей 5-8 раз с интервалами 2-3-недели. Каждое из условий культивирования, использующих указанную выше среду для развития соматических зародышей и среду для выращивания соматических зародышей, проводили при 23 часах света с 1 часом темноты и при 23-25°С в течение суток.
(2) Введение гена пролиферативным соматическим зародышам
После пересадки глобулярного зародыша, полученного в примере 17(1), на свежую среду для выращивания соматических зародышей и культивирования в течение 2-3 дней глобулярный зародыш использовали для введения гена. Плазмиды pSUM-NdG6-rSt657, pSUM-NdG6-rSt657F, pSUM-NdG6-rSt12657 и pSUM-NdG6-rSt12657F наносили в виде покрытия на частицы золота с диаметром 1,0 мкм для проведения введения гена с использованием способа ружья для частиц. Количество плазмид было 1,66 мкг для 1 мг частиц золота. После введения гена зародыш культивировали дополнительно в течение 2-3 дней. Каждое из условий культивирования проводили при 23 часах света с 1 часом темноты и при 23-25°С в течение суток.
(3) Отбор соматических зародышей с гигромицином
Глобулярные зародыши после введения гена, полученные в примере 17(2), пересаживали на селективную среду для соматических зародышей. Селективная среда для соматических зародышей была отверждаемой средой, где 0,2% (мас./об.) Гельрит и 15 мг/л гигромицина добавляли к среде МС, которую доводили до рН 5,8 и которая имела добавленные к ней 2,4-Д и 30 г/л сахарозы. Выжившие глобулярные зародыши пересаживали после этого на свежую селективную среду для соматических зародышей 5-8 раз с интервалами 2-3 недели. В это время селективной средой для соматических зародышей была отверждаемая среда, где 0,2% (мас./об.) Гельрита и 30 мг/л гигромицина добавляли к среде МС, которая была доведена до рН 5,8 и которая имела добавленные к ней 90 мкМ 2,4-Д и 30 г/л сахарозы. Каждое из условий культивирования при использовании указанной выше селективной среды для соматических зародышей проводили при 23 часах света с 1 часом темноты и при 23-25°С в течение суток.
(4) Отбор соматических зародышей с соединением (II)
Глобулярные зародыши после введения гена, полученные в примере 17(2), пересаживали на селективную среду для соматических зародышей. Селективная среда для соматических зародышей была отверждаемой средой, где 0,2% (мас./об.) Гельрит и 0,1 мг/л соединения (II) добавляли к среде МС, которую доводили до рН 5,8 и которая имела добавленные к ней 90 мкм 2,4-Д и 30 г/л сахарозы. Выжившие глобулярные зародыши пересаживали после этого на свежую селективную среду для соматических зародышей 5-8 раз с интервалами 2-3 недели. В это время селективной средой для соматических зародышей была отверждаемая среда, где 0,2% (мас./об.) Гельрита и 0,3-1 мг/л соединения (II) добавляли к среде МС, которая была доведена до рН 5,8 и которая имела добавленные к ней 90 мкМ 2,4-Д и 30 г/л сахарозы. Каждое из условий культивирования при использовании указанной выше селективной среды для соматических зародышей проводили при 23 часах света с 1 часом темноты и при 23-25°С в течение суток.
(5) Регенерация растения из соматического зародыша
Глобулярные зародыши, отобранные в примере 17(3) или 17(4), пересаживают в среду для развития и культивируют в течение 4 недель при 23 часах света и 1 часе темноты и при 23-25°С в течение суток. Средой для развития является отверждаемая среда, где 0,8% (мас./об.) агара (Wako Pure Chemical Industries, Lts., применение для культур тканей растений) добавляют к среде МС, которая доведена до рН 5,8 и которая имеет добавленные к ней 60 г/л мальтозы. Спустя 6-8 недель после этого получают зародыши типа семядолей от белого до желтого цвета. Эти зародыши типа семядолей пересаживают в среду для прорастания и культивируют в течение 2 недель. Средой для прорастания является отверждаемая среда, где 0,2% (мас./об.) Гельрит добавлен к среде МС, которая доведена до рН 5,8 и имеет добавленную к ней в концентрации 30 г/л сахарозу. В результате может быть получена соя, которая развивает листья и имеет корни.
(6) Акклимация и культивирование регенерированного растения
Сою, полученную в примере 17(5), пересаживают в садовую почву и акклимируют в инкубационной камере при 23 часах света и 1 часе темноты и 23-25°С в течение суток. Спустя 2 недели после этого укорененное растение переносят в сосуд, имеющий диаметр 9 см, и культивируют при комнатной температуре. Условия культивирования при комнатной температуре используют естественное освещение при 23-25°С в течение суток. Спустя два-четыре месяца после этого собирают семена сои.
(7) Оценка устойчивости к гербицидному соединению (II)
Листья регенерированного растения собирают и делят равным образом на 2 куска листа вдоль главной жилки. Соединение (II) разбрызгивают на всю поверхность одного из кусков листа. Другой кусок листа оставляют необработанным. Эти куски листьв помещают на среду МС, содержащую 0,8% агар, и оставляют стоять при комнатной температуре в течение 7 дней в светлом месте. Затем каждый кусок листа растирают пестиком в ступке в 5 мл 80% водного раствора ацетона для экстракции хлорофилла. Жидкость экстракта разбавляют в 10 раз 80% водным раствором ацетона и измеряют оптическую плотность при 750 нм, 663 нм и 645 нм для расчета общего содержания хлорофилла согласно способу Mackenney G., J. Biol. Chem. (1941) 140, p 315. Степень устойчивости к соединению (II) может сравнительно оцениваться выражением в процентилях общего содержания хлорофилла обработанного куска листа от общего содержания хлорофилла необработанного куска листа.
Далее, почву набивают в пластиковый сосуд, имеющий диаметр 10 см и глубину 10 см. Семена вышеуказанного растения высевают и культивируют в оранжерее. Готовят эмульсию смешиванием 5 частей соединения (II), 6 частей sorpol3005X (Toho chemicals) и 89 частей ксилола. Определенное количество этой эмульсии разбавляют водой, содержащей 0,1% (об./об.) обеспечивающего прилипание агента, в пропорции 1000 л на 1 гектар, и распределяют однородно пистолетом для опрыскивания на все стороны листвы сверху от растения, культивируемого в описанном выше сосуде. После культивирования этих растений в течение 16 дней в оранжерее исследуют повреждение этих растений и оценивают устойчивость к соединению (II).
Пример 18. Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А1) данного изобретения, для введения с использованием Agrobacterium
Конструировали плазмиду для введения ДНК (А1) данного изобретения в растение при помощи способа с использованием Agrobacterium. Сначала после расщепления бинарного плазмидного вектора pBI121 (Clontech Company) рестриктазой NotI концы ДНК затупляли добавлением нуклеотидов к двухцепочечнному гэпу с использованием ДНК-полимеразы I (Takara Shuzo Company). Для самоциклизации использовали ДНК-лигазу Т4. После расщепления полученной плазмиды рестриктазой EcoRI концы ДНК затупляли добавлением нуклеотидов к двухцепочечному гэпу с использованием ДНК-полимеразы I (Takara Shuzo Company). Для самоциклизации использовали ДНК-лигазу Т4 с получением плазмиды pBI121Δ NotIEcoRI. После расщепления этой плазмиды HindIII 5'-конец полученной ДНК дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo Company). Линкер HindIII-NotI-EcoRI (фиг. 25), полученный отжигом олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:98, с олигонуклеотидом, состоящим из нуклеотидной последовательности, показанной в SEQ ID NO:99, встраивали в нее. Бинарный плазмидный вектор pBI121S (фиг. 26) получали самоциклизацией. Указанная плазмида имеет структуру, в которой линкер HindIII-NotI-EcoRI был встроен в направлении, в котором сайт рестрикции HindIII, сайт рестрикции NotI и сайт рестрикции EcoRI выстраиваются по порядку от местоположения, смежного с геном β-глюкуронидазы.
Затем каждую из плазмид pSUM-NdG6-rSt-657 и pSUM-NdG6-rSt-657F расщепляли рестриктазами HindIII и EcoRI с получением из каждой из них химерной ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах. Эти ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI вышеуказанного бинарного плазмидного вектора pBI121S с получением плазмид pBI-NdG6-rSt-657 (фиг. 27) и pBI-NdG6-rSt-657F (фиг. 28). Далее, каждую из вышеуказанных плазмид pSUM-NdG6-rSt12-657 и pSUM-NdG6-rSt12-657F расщепляли рестриктазами HindIII и EcoRI с получением из каждой из них химерной ДНК, в которой ДНК (А1) данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Эти ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI вышеуказанного бинарного плазмидного вектора pBI121S с получением плазмид pBI-NdG6-rSt12-657 (фиг. 29) и pBI-NdG6-rSt12-657F (фиг. 30).
Пример 19. Введение ДНК (А1) данного изобретения в табак
ДНК (А1) данного изобретения вводили в табак при помощи способа с применением Agrobacterium, с использованием плазмиды pBI-NdG6-rSt-657, плазмиды pBI-NdG6-rSt-657F, плазмиды pBI-NdG6-rSt12-657 и плазмиды pBI-NdG6-rSt12-657F, полученных в примере 18.
Сначала плазмиды pBI-NdG6-rSt-657, pBI-NdG6-rSt-657F, pBI-NdG6-rSt12-657 и pBI-NdG6-rSt12-657F вводили в Agrobacterium tumefaciens LBA4404 (Clontech Company) соответственно. Трансформированные штаммы Agrobacterium, несущие pBI-NdG6-rSt-657, pBI-NdG6-rSt-657F, pBI-NdG6-rSt12-657 или pBI-NdG6-rSt12-657F, выделяли культивированием полученных трансформантов в среде с LB-агаром (0,5% дрожжевой экстракт, 1,0% бактотриптон, 0,5% NaCl), содержащей 300 мг/л стрептомицина, 100 мг/л рифампицина и 25 мг/л канамицина, и отбором устойчивых колоний.
Затем в соответствии со способом, описанным в Manual for Gene Manipulation of Plant (Hirofumi UCHIMIYA, Kodan-sha Scientific, 1992), этот ген вводили в табак. Штаммы Agrobacterium, несущие указанные выше плазмиды, культивировали, каждый, при 28°С в течение ночи в LB-среде, содержащей 300 мг/л стрептомицина, 100 мг/л рифампицина и 25 мг/л канамицина, и затем кусочки листьев табака (штамма Nicotiana tabacum SR1), культивируемые стерильно, погружали в жидкую культуральную среду. Кусочки листьев высаживали и культивировали при комнатной температуре в течение 2 дней на свету в агаровой среде МС (неорганические соли МС, витамины МС, 3% сахароза и 0,8% агар; описана в Murashige T. and Skoog F., Physiol. Plant. (1962) 15, p 473), содержащей 0,1 мг/л нафтилуксусной кислоты и 1,0 мг/л бензиламинопурина. Затем кусочки листьев промывали стерилизованной водой и культивировали в течение 7 дней на среде МС с агаром, содержащей 0,1 мг/л нафтилуксусной кислоты, 1,0 мг/л бензиламинопурина и 500 мг/л цефотаксима. Затем эти кусочки листьев пересаживали и культивировали на среде МС с агаром, содержащей 0,1 мг/л нафтилуксусной кислоты, 1,0 мг/л бензиламинопурина, 500 мг/л цефотаксима и 100 мг/л канамицина. Культивирование проводили непрерывно в течение 4 месяцев при пересадке кусочков листьев на свежую среду того же состава с интервалами 4 недели. В это время неприкрепленные почки, развивающиеся из этих кусочков листьев, пересаживали и укореняли на среде МС с агаром, содержащей 300 мг/л цефотаксима и 50 мг/л канамицина, для получения регенерированных растеньиц. Регенерированные растеньица пересаживали и культивировали в среде с агаром МС, содержащей 50 мг/г канамицина, с получением трансгенного табака, в который был введен район Т-ДНК pBI-NdG6-rSt-657, pBI-NdG6-rSt-657F, pBI-NdG6-rSt12-657 или pBI-NdG6-rSt12-657F соответственно.
Далее, плазмиду PBI121S, полученную в примере 18, вводили в табак по способу с применением Agrobacterium. Трансформированный штамм Agrobacterium, несущий pBI121S, выделяли аналогично описанному выше, за исключением того, что использовали плазмиду pBI121S вместо pBI-NdG6-rSt-657, pBI-NdG6-rSt-657F, pBI-NdG6-rSt12-657 и pBI-NdG6-rSt12-657F. Затем трансгенный табак, в который был введен район Т-ДНК плазмиды pBI121S, получали, подобно описанному выше, с использованием указанной трансформированной Agrobacterium.
Три листа брали из трансгенного табака. Каждый лист делили на 4 кусочка, причем каждый кусочек имел ширину 5-7 мм. Каждый кусочек листа высаживали на среду с агаром МС, содержащую 0,1 мг/л соединения (II), и культивировали на свету при комнатной температуре. На 7-й день культивирования наблюдали гербицидное повреждение каждого из этих кусочков листа. Кусочки листьев, полученные из табака, в который вводили контрольную ДНК (район Т-ДНК плазмиды pBI121S), становились белыми и завядали. В противоположность этому кусочки листьев, полученные из табака, в который вводили ДНК (А1) данного изобретения (район Т-ДНК плазмиды pBI-NdG6-rSt-657, плазмиды pBI-NdG6-rSt12-657, плазмиды pBI-NdG6-rSt-657F или плазмиды pBI-NdG6-rSt12-657F), росли непрерывно.
Пример 20. Введение ДНК данного изобретения в растение
Конструировали плазмиды для введения ДНК (А2) данного изобретения в растение с применением ружья для частиц и при помощи способа с использованием Agrobacterium. Сначала ДНК (А2) данного изобретения, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:7, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы геномной ДНК Saccharopolyspora taberi JCM9383t и с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:100, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:101. В указанной ПЦР использовали ПЦР-систему Expand High Fidelity (Boehringer Company). После поддержания один раз 97°С в течение 2 минут проводили повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 60 секунд; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 сек добавляли к поддержанию 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. Плазмиду pCR923Sp (фиг. 31) получали встраиванием амплифицированной ДНК в район клонирования продукта ПЦР pCR2.1-TOPO (Invitrogen Company). Затем эту плазмиду вводили в компетентные клетки E. coli JM109 (Takara Shuzo Company) и отбирали устойчивые к ампициллину клетки. Далее, нуклеотидные последовательности плазмид, содержащиеся в устойчивых к ампициллину штаммах, определяли с использованием набора BigDye terminator cycle sequencing Ready Reaction kit v.2.0 (PE Applied Biosystems Company) и секвенатора ДНК 373S (РЕ Applied Biosystems Company). В результате было подтверждено, что плазмида pCR923Sp имеет нуклеотидную последовательность, показанную в SEQ ID NO:7.
Плазмиду pKFrSt12, сконструированную в примере 16(3), расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей данную ДНК rSt12. Указанную ДНК встраивали между сайтом рестрикции BglII и сайтом рестрикции SacI pNdG6-ΔТ, полученной в примере 16(2), с получением плазмиды pNdG6-rSt12 (фиг. 32). Плазмиду pCR923Sp расщепляли рестриктазами SphI и KpnI с получением ДНК, содержащей ДНК (А2) данного изобретения. Плазмиду pNdG6-rSt12 расщепляли рестриктазами SphI и KpnI для удаления ДНК, кодирующей 12 аминокислот зрелого белка малой субъединицы RuBPC сои (сорта Jack). На их место встраивали вышеуказанную ДНК, содержащую ДНК (А2) данного изобретения, полученную из плазмиды pCR923Sp, с получением pSUM-NdG6-rSt-923 (фиг. 33), где промотор CR16G6 был присоединен «справа» от химерной ДНК, в которой указанная ДНК была присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамки считывания в кодонах.
Затем плазмиду pCR923Sp расщепляли рестриктазой SphI. После затупления концов полученной ДНК ДНК-полимеразой KOD указанную ДНК дополнительно расщепляли рестриктазой KpnI для выделения ДНК, содержащей ДНК (А2) данного изобретения. Плазмиду pKFrSt12, полученную в примере 16(3), расщепляли рестриктазой BspHI. После затупления концов полученной ДНК ДНК-полимеразой KOD указанную ДНК дополнительно расщепляли рестриктазой KpnI для удаления ДНК размером приблизительно 20 п.н. На ее место встраивали вышеуказанную ДНК, содержащую ДНК (А2) данного изобретения, полученную из плазмиды pCR923Sp, с получением плазмиды pKFrSt12-923 (фиг. 34), содержащей химерную ДНК, в которой ДНК (А2) данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. pKFrSt12-923 расщепляли рестриктазами SphI и KpnI с получением химерной ДНК, в которой соединены ДНК (А2) данного изобретения и ДНК, кодирующая первые 12 аминокислот зрелого белка малой субъединицы RuBPC сои (сорта Jack). Плазмиду pNdG6-rSt12 расщепляли рестриктазами SphI и KpnI для удаления ДНК, кодирующей 12 аминокислот зрелого белка малой субъединицы RuBPC сои (Jack). На ее место встраивали вышеуказанную химерную ДНК, полученную из плазмиды pKFrSt12-923, с получением плазмиды pSUM-NdG6-rSt12-923 (фиг. 35), в которой промотор CR16G6 присоединен «справа» от химерной ДНК, в которой вышеуказанная ДНК, содержащая ДНК (А2) данного изобретения, присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамки считывания в кодонах.
ДНК (А2) данного изобретения вводили в сою способом, использующим ружье для частиц, процедурами, идентичными процедурам способа, описанного в примере 17, с использованием полученных плазмид pSUM-NdG6-rSt-923 и pSUM-NdG6-rSt12-923.
Вышеуказанную плазмиду pSUM-NdG6-rSt-923 расщепляли рестриктазами HindIII и EcoRI для выделения ДНК, содержащей химерную ДНК, в которой указанная ДНК, содержащая ДНК (А2) данного изобретения, присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамки считывания в кодонах. Как и при получении pBI-NdG6-rSt657 в примере 18, вышеназванную ДНК, содержащую химерную ДНК, полученную из плазмиды pSUM-NdG6-rSt-923, встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI бинарного вектора pBI121S с получением pBI-NdG6-rSt-923 (фиг. 36). Далее, вышеуказанную плазмиду pSUM-NdG6-rSt12-923 расщепляли рестриктазами HindIII и EcoRI для выделения ДНК, содержащей химерную ДНК, в которой указанная ДНК, содержащая ДНК (А2) данного изобретения, присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Эту химерную ДНК, полученную из pSUM-NdG6-rSt12-923, встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI бинарного вектора pBI121S с получением pBI-NdG6-rSt12-923 (фиг. 37).
Каждую из плазмид pBI-NdG6-rSt-923 и pBI-NdG6-rSt12-923 вводили в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивировали в LB-среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина. Трансформанты отбирали для выделения штаммов Agrobacterium, несущих pBI-NdG6-rSt-923 или pBI-NdG6-rSt12-923.
Кусочки листьев стерильно культивируемого табака инъецировали каждым из штамма Agrobacterium, несущего pBI-NdG6-rSt-923, и штамма Agrobacterium, несущего pBI-NdG6-rSt12-923. Табак, в который была введена ДНК (А2) данного изобретения, получали процедурами, сходными со способами, описанными в примере 19.
Три (3) листа брали из полученного трансгенного табака. Каждый лист делили на 4 кусочка, причем каждый кусочек имел ширину 5-7 мм. Каждый кусочек листа высаживали на среду с агаром МС, содержащую 0,1 мг/л соединения (II), и культивировали на свету при комнатной температуре. На 7-й день культивирования наблюдали гербицидное повреждение каждого из этих кусочков листа. Кусочки листьев, полученные из табака, в который вводили контрольную ДНК (район Т-ДНК плазмиды pBI121S), становились белыми и завядали. В противоположность этому кусочки листьев, полученные из табака, в который вводили ДНК (А2) данного изобретения (район Т-ДНК плазмиды pBI-NdG6-rSt-923 или плазмиды pBI-NdG6-rSt12-923), росли непрерывно.
Пример 21. Введение ДНК (А3) данного изобретения в табак
Конструировали плазмиды для введения ДНК (А3) данного изобретения в растение с применением ружья для частиц и при помощи способа с использованием Agrobacterium.
Сначала ДНК (А3) данного изобретения, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:8, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы геномной ДНК Streptomyces testaceus ATCC21469 и с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:102, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:103. В указанной ПЦР использовали ПЦР-систему Expand High Fidelity (Boehringer Company). После поддержания один раз 97°С в течение 2 минут проводили повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 сек добавляли к поддержанию 72°С для каждого цикла); и затем проводили поддержание один раз 72°С в течение 7 минут. Плазмиду pCR671ЕТ (фиг. 38) получали встраиванием амплифицированной ДНК в район клонирования продукта ПЦР pCR2.1 (Invitrogen Company). Затем плазмиду pCR671Bs (фиг. 39) получали процедурами, сходными со способом, описанным выше, за исключением того, что использовали в качестве праймеров для ПЦР олигонуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO:104, и олигонуклеотид, состоящий из нуклеотидной последовательности, показанной в SEQ ID NO:103. Затем эти плазмиды вводили в компетентные клетки E. coli JM109 (Takara Shuzo Company) и отбирали устойчивые к ампициллину клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в устойчивых к ампициллину штаммах, определяли с использованием набора BigDye terminator cycle sequencing Ready Reaction kit v.2.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (РЕ Applied Biosystems Company). В результате было подтверждено, что плазмиды pCR671ЕТ и pCR671Bs имеют нуклеотидную последовательность, показанную в SEQ ID NO:8.
Плазмиду pCR671ET расщепляли рестриктазами EcoT221 и KpnI для выделения ДНК, содержащей ДНК (А3) данного изобретения. Указанную ДНК встраивали между сайтом рестрикции EcoT22I и сайтом рестрикции KpnI с получением плазмиды pUCrSt671 (фиг. 40), содержащей химерную ДНК, в которой ДНК (А3) данного изобретения присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамки считывания в кодонах. Плазмиду pUCrSt671 расщепляли рестриктазами NheI и KpnI для выделения ДНК, содержащей ДНК (А3) данного изобретения. Плазмиду pNdG6-rSt12, полученную в примере 16(2), расщепляли рестриктазами NheI и KpnI для удаления ДНК размером приблизительно 80 п.н. На ее место встраивали вышеуказанную ДНК, содержащую ДНК (А3) данного изобретения, полученную из плазмиды pUCrSt671, с получением pSUM-NdG6-rSt-671 (фиг. 41), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой ДНК (А3) данного изобретения присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамки считывания в кодонах.
Плазмиду pCR671Bs расщепляли рестриктазами BspHI и KpnI для выделения ДНК, содержащей ДНК (А3) данного изобретения. Указанную ДНК встраивали между сайтом рестрикции BspHI и сайтом рестрикции KpnI pKFrSt12, полученной в примере 16(3), с получением плазмиды pKFrSt12-671 (фиг. 42), содержащей химерную ДНК, в которой ДНК (А3) данного изобретения присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамки считывания в кодонах. Плазмиду pNdG6-rSt12, полученную в примере 20, расщепляли рестриктазами NheI и KpnI для удаления ДНК размером приблизительно 80 п.н. На ее место встраивали вышеуказанную ДНК, содержащую ДНК (А3) данного изобретения, полученную из плазмиды pKFrSt12-671, с получением pSUM-NdG6-rSt12-671 (фиг. 43), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой ДНК (А3) данного изобретения присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамки считывания в кодонах.
ДНК (А3) данного изобретения вводили в сою способом, использующим ружье для частиц, процедурами, идентичными процедурам способа, описанного в примере 17, с использованием полученных плазмид pSUM-NdG6-rSt-671 и pSUM-NdG6-rSt12-671.
Вышеуказанную плазмиду pSUM-NdG6-rSt-671 расщепляли рестриктазами HindIII и EcoRI для выделения химерной ДНК, в которой указанная ДНК (А3) данного изобретения присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамки считывания в кодонах. Вышеуказанную ДНК, содержащую химерную ДНК, полученную из плазмиды pSUM-NdG6-rSt-671, встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI вышеуказанного бинарного плазмидного вектора pBI121S, полученного в примере 18, с получением pBI-NdG6-rSt-671 (фиг. 44). Далее, вышеуказанную плазмиду pSUM-NdG6-rSt12-671 расщепляли рестриктазами HindIII и EcoRI для выделения ДНК, содержащей химерную ДНК, в которой указанная ДНК, содержащая ДНК (А3) данного изобретения, присоединена непосредственно после последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Химерную ДНК, полученную из pSUM-NdG6-rSt12-671, встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI бинарного плазмидного вектора pBI121S с получением pBI-NdG6-rSt12-671 (фиг. 45).
Каждую из плазмид pBI-NdG6-rSt-671 и pBI-NdG6-rSt12-671 вводили в Agrobacterium tumefaciens LBA4404. Полученные трансформанты культивировали в LB-среде, содержащей 300 мкг/мл стрептомицина, 100 мкг/мл рифампицина и 25 мкг/мл канамицина. Трансформанты отбирали для выделения штаммов Agrobacterium, несущих pBI-NdG6-rSt-671 и pBI-NdG6-rSt12-671.
Кусочки листьев стерильно культивируемого табака инъецировали каждым из штамма Agrobacterium, несущего pBI-NdG6-rSt-671, и штамма Agrobacterium, несущего pBI-NdG6-rSt12-671. Табак, в который была введена ДНК (А3) данного изобретения, получали процедурами, сходными со способами, описанными в примере 19.
Три (3) листа брали из трансгенного табака. Каждый лист делили на 4 кусочка,причем каждый кусочек имел ширину 5-7 мм. Каждый кусочек листа высаживали на среду с агаром МС, содержащую 0,1 мг/л соединения (II), и культивировали на свету при комнатной температуре. На 7-й день культивирования наблюдали гербицидное повреждение каждого из этих кусочков листа.
Пример 22. Экспрессия белка (В1) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (В1) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces phaeochromogenes IFO 12898 в примере 3(1). Реакционный раствор для ПЦР доводили до 50 мкл добавлением 300 нг вышеуказанной хромосомной ДНК, 4 мкл смеси dNTP (смеси 2,5 мМ каждого из 4 типов dNTP), 5 мкл 10х буфера ExTaq, 0,5 мкл полимеразы ExTaq (Takara Shuzo Company), дистиллированной воды и 200 нМ каждого из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:105, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:53. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 25 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 90 секунд; и затем поддержание 72°С в течение 4 минут. После этого выдерживания реакционный раствор и вектор pCR2.1-TOPO (Invitrogen Company) лигировали в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:67, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:68. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:15, была названа pCR657FD.
Затем pCR657FD расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 200 п.н., вырезали из геля. Эту ДНК очищали из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:15, в которой ДНК размером приблизительно 200 п.н., кодирующая белок (В1) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN657FD. Плазмиду pKSN657FD вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN657FD. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (В1) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN657FD и E. coli JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. Спустя 30 минут после достижения OD660 приблизительно 0,5, добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 20 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN657FD, называют “экстрактом E. coli pKSN657FD”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15-25% ДСН-ПААГ и окрашивали СВВ. В результате явно более интенсивные полосы были обнаружены в экстракте E. coli pKSN657FD, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 7 кДа. Было показано, что E. coli JM109/pKSN657FD экспрессировала белок (В1) данного изобретения.
(3) Применение белка (В1) данного изобретения для реакционной системы превращения соединения (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 9 мкл экстракта E. coli pKSN657FD, полученного в примере 22(2), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 15 мкл экстракта E. coli pKSN657F, полученного в примере 4(2) (далее называемого «компонентом D»). Далее, готовили реакционные растворы, в которые добавляли 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company) вместо экстракта E. coli pKSN657FD, и реакционный раствор, в который ничего не добавляли вместо экстракта E. coli pKSN657FD. Такие реакционные растворы выдерживали аналогичным образом. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 13.
E. coli
меченное 14С
Пример 23. Экспрессия белка (В2) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (В2) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Saccharopolyspora taberi JCM9383t в примере 6(1). Реакционный раствор для ПЦР доводили до 50 мкл добавлением 300 нг вышеуказанной хромосомной ДНК, 4 мкл смеси dNTP (смеси 2,5 мМ каждого из 4 типов dNTP), 5 мкл 10х буфера ExTaq, 0,5 мкл полимеразы ExTaq (Takara Shuzo Company), дистиллированной воды и 200 нМ каждого из олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:106, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:63. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 25 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 90 секунд; и затем поддержание 72°С в течение 4 минут. После этого выдерживания реакционный раствор и вектор pCR2.1-TOPO (Invitrogen Company) лигировали в соответствии с инструкциями, прилагаемыми в указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора QIAprep Spin Miniprep Kit (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:67, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:68. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 373А (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:16, была названа pCR923FD.
Затем плазмиду pCR923FD расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 200 п.н., вырезали из геля. Эту ДНК очищали из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:16, в которой ДНК размером приблизительно 200 п.н., кодирующая белок (В2) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN923FD. Плазмиду pKSN923FD вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN923FD. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (В2) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN923FD и E. coli JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. Спустя 30 минут после достижения OD660 приблизительно 0,5 добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 20 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200 g, 5 минут) супернатанты извлекали и центрифугировали (150000 g, 70 минут) для получения фракций супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN923FD, называют “экстрактом E. coli pKSN923FD”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15-25% ДСН-ПААГ и окрашивали СВВ. В результате, детектированием явно более интенсивных полос в экстракте E. coli pKSN923FD, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 7 кДа, можно подтвердить экспрессию белка (В2) данного изобретения в E. coli.
(3) Применение белка (В2) данного изобретения для реакционной системы превращения соединения (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 9 мкл экстракта E. coli pKSN923FD, полученного в примере 23(2), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 15 мкл экстракта E. coli pKSN657F, полученного в примере 4(2) (далее называемого «компонентом D»). Далее, готовили реакционные растворы, в которые добавляли 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company) вместо экстракта E. coli pKSN923FD, и реакционный раствор, в который ничего не добавляли вместо экстракта E. coli pKSN923FD. Такие реакционные растворы выдерживали аналогичным образом. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Посредством подтверждения, что соединение (III) образуется в реакции, содержащей компонент А, экстракт E. coli pKSN923FD, компонент С и компонент D, может быть доказано, что белок (В2) данного изобретения может быть использован вместо ферредоксина, полученного из шпината, в реакционной системе превращения соединения (II) в соединение (III).
Пример 24. Экспрессия белка (В3) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (В3) данного изобретения
ПЦР проводили аналогично способам, описанным в примере 23(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces testaceus ATCC 21469 в примере 11(1), и использования в качестве праймеров олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:107, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:72. Плазмиду pCR671FD, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:17, получали аналогично способу, описанному в примере 23(1), с использованием полученного реакционного раствора.
Затем с использованием указанной плазмиды, плазмиду pKSN671FD, в которой ДНК (В3) данного изобретения встроена между сайтом NdeI и сайтом HindIII pKSN2, получают аналогично способу, описанному в примере 23(1). Введением этой плазмиды в E. coli JM109 может быть получена E. coli JM109/pKSN671FD, имеющая ДНК (В3) данного изобретения.
(2) Экспрессия белка (В3) данного изобретения в E. coli и выделение указанного белка
С использованием E. coli JM109/pKSN671FD фракции супернатанта (далее называемые “экстрактом E. coli pKSN671FD”) извлекают аналогично способу, описанному в примере 23(2). Один микролитр (1 мкл) указанных выше фракций супернатантов анализируют электрофорезом в 15-25% ДСН-ПААГ и окрашивают СВВ. В результате детектированием явно более интенсивных полос в экстракте E. coli pKSN671FD, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 7 кДа, можно подтвердить экспрессию белка (В3) данного изобретения в E. coli.
(3) Применение белка (В3) данного изобретения для реакционной системы превращения соединения (II) в соединение (III)
За исключением использования экстракта E. coli pKSN671FD, полученного в примере 24(2), пятно, соответствующее соединению (III), меченному 14С (величины Rf 0,24 и 0,29), подтверждается аналогично способу, описанному в примере 23(3). Подтверждением того, что соединение (III) образуется в реакции, включающей компонент А, экстракт E. coli pKSN671FD, компонент С и компонент D, может быть доказано, что белок (В3) данного изобретения может быть использован вместо ферредоксина, полученного из шпината, в реакционной системе превращения соединения (II) в соединение (III).
Пример 25. Получение белка (А4) данного изобретения
(1) Получение неочищенного экстракта клеток
Замороженный исходный материал Streptomyces achromogenes IFO12735 добавляли к 10 мл среды А (0,1% (мас./об.) глюкоза, 0,5% (мас./об.) триптон, 0,5% (мас./об.) дрожжевой экстракт, 0,1% (мас./об.) дикалий-гидрофосфат, рН 7,0) в большой тест-пробирке и инкубировали при встряхивании при 30°С в течение 1 дня для получения предварительной культуры. Восемь миллилитров (8 мл) предварительной культуры добавляли к 200 мл среды А и инкубировали ротационным встряхиванием в колбе с перегородкой на 500 мл при 30°С в течение 2 дней. Осадки клеток получали центрифугированием (3000 g, 10 мин) полученной культуры. Эти осадки клеток суспендировали в 100 мл среды В (1% (мас./об.) глюкоза, 0,1% мясной экстракт, 0,2% (мас./об.) триптоза), содержащей соединение (II) при 100 м.д., и инкубировали с возвратно-поступательным качанием в колбе Сакагучи на 500 мл в течение 20 часов при 30°С. Осадки клеток получали центрифугированием (3000 g, 10 мин) 2 л полученной культуры. Полученные осадки клеток промывали дважды 1 л 0,1 М калий-фосфатного буфера (рН 7,0) с получением 136 г осадков клеток.
Эти осадки клеток суспендировали в 0,1 М калий-фосфатном буфере (рН 7,0) при 1 - 2 мл на 1 г осадков клеток. К клеточной суспензии добавляли 1 мМ ФМСФ, 5 мМ бензамидин·HCl, 1 мМ ЭДТА, 3 мкг/мл лейпептина, 3 мкг/мл пепстатина и 1 мМ дитиотрейт(ол). Раствор клеточного лизата получали разрушением дважды этой суспензии с использованием Френч-пресса (1000 кг/см2) (Ohtake Seisakusho). После центрифугирования раствора клеточного лизата (40000 g, 30 мин) супернатант извлекали и центрифугировали в течение 1 часа при 150000 g для извлечения супернатанта (называемого далее «неочищенным клеточным экстрактом»).
(2) Определение способности превращать соединения (II) в соединение (III)
Готовили 30 мкл реакционного раствора 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2,4 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 0,5 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 15 мкл неочищенного клеточного экстракта, полученного в примере 25(1). Реакционный раствор выдерживали при 30°С в течение 1 часа. Кроме того, готовили и выдерживали таким же образом реакционный раствор без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Эти результаты показаны в таблице 14.
(3) Фракционирование неочищенного клеточного экстракта
К неочищенному клеточному экстракту, полученному в примере 25(1), добавляли сульфат аммония до 45% насыщения. После перемешивания в охлаждаемых льдом условиях получали супернатант центрифугированием в течение 30 минут при 12000 g. После добавления сульфата аммония к полученному супернатанту до 55% насыщения и перемешивания в охлаждаемых льдом условиях осадок получали центрифугированием в течение 10 минут при 12000 g. Этот осадок растворяли в 12,5 мл 20 мМ бистриспропанового буфера (рН 7,0). Этот раствор подвергали хроматографии на колонке PD10 (Amersham Pharmacia Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) с получением 17,5 мл фракций, содержащих белки (далее называемых «фракцией 45-55% сульфата аммония»).
(4) Выделение белка (А4) данного изобретения
Фракцию 45-55% сульфата аммония, полученную в примере 25(3), вводили в колонку HiLoad 26/10 Q-Sepharose HP (Amersham Pharmacia Company). Затем после протекания 100 мл 20 мМ бистриспропанового буфера (рН 7,0) через колонку, 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,004 М/мин, диапазон концентрации NaCl был от 0 М до 1 М, скорость тока была 4 мл/мин) для фракционного извлечения 30 мл фракций, элюирующихся при концентрации NaCl от 0,12 М до 0,165 М. Затем извлеченные фракции подвергали хроматографии на колонке PD10 (Amersham Pharmacia Biotech Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) для получения фракций, содержащих белок.
Извлеченные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) с элюцией буфером А (2 мМ калий-фосфатный буфер, содержащий 1,5 мМ NaCl, рН 7,0) для получения фракций, содержащих белок. Затем эти фракции вводили в колонку СНТ10-I Bio-Scale Ceramic Hydroxyapatite Type I (Bio-Rad Company). Двадцать миллилитров (20 мл) буфера А пропускали через колонку. Затем буфер А протекал с линейным градиентом буфера В (100 мМ калий-фосфатный буфер, содержащий 0,03 мМ NaCl; линейный градиент начинался при 100% буфера А с увеличением до 50% буфера В на протяжении периода 100 минут, скорость тока была 2 мл/мин) для фракционного извлечения фракций, элюирующихся при концентрации буфера В от 4 до 6%. Далее, полученные фракции наносили на колонку PD10 (Amersham Pharmacia Biotech Company) и элюировали 0,05 М калий-фосфатным буфером (рН 7,0) с получением фракций, содержащих белок.
Сходное количество 0,05 М калий-фосфатного буфера (рН 7,0), содержащего 2,0 М сульфат аммония, добавляли в извлеченные фракции и перемешивали. Затем извлеченые фракции инъецировали в колонку 1 мл RESOURSE PHE (Amersham Pharmacia Biotech Company). После протекания 5 мл 0,05 М калий-фосфатного буфера (рН 7,0), содержащего 1,0 М сульфат аммония, пропускали 0,05 М калий-фосфатный буфер (рН 7,0) с линейным градиентом сульфата аммония (градиент концентрации сульфата аммония был 1 - 0 М, скорость тока была 2 мл/мин) для фракционного извлечения фракций, элюирующихся при концентрации сульфата аммония от приблизительно 0,4 М до 0,5 М. Белок, содержащийся в этих фракциях, анализировали электрофорезом в 10-20% ДСН-ПААГ.
Вместо неочищенного экстракта клеток в реакционных растворах, описанных в примере 25(2), добавляли извлеченные фракции и выдерживали в присутствии компонента А, компонента В, компонента С и соединения (II), меченного 14С, аналогично примеру 25(2). Реакционные растворы после выдерживания анализировали ТСХ для исследования интенсивности пятен, соответствующих соединению (III), меченному 14С. Указанный белок, перемещающийся в положение приблизительно 45 кДа при указанном электрофорезе в ДСН-ПААГ, извлекали из геля и подвергали анализу аминокислотной последовательности с использованием секвенатора белков (Applied Biosystems Company, Procise 494НТ, импульсный жидкостной способ) для секвенирования N-концевой аминокислотной последовательности. В результате получали аминокислотную последовательность, показанную в SEQ ID NO:113.
Пример 26. Получение ДНК (А4) данного изобретения
(1) Получение хромосомной ДНК Streptomyces achromogenes IFO 12735
Streptomyces achromogenes IFO 12735 культивировали при встряхивании при 30°С в течение 1 - 3 дней в 50 мл среды YEME (0,3% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) бактопептон, 0,3% (мас./об.) экстракт солода, 1,0% (мас./об.) глюкоза, 34% (мас./об.) сахароза и 0,2% (об./об.) 2,5 М MgCl2·6Н2О). Клетки собирали. Полученные клетки суспендировали в среде YEME, содержащей 1,4% (мас./об.) глицин и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки извлекали из культуральной среды. После промывания один раз дистиллированной водой их ресуспендировали в буфере (100 мМ Трис-HCl (рН 8,0), 100 мМ ЭДТА, 10 мМ NaCl) при 1 мл на 200 мг клеток. Добавляли двести микрограммов на миллилитр (200 мкг/мл) лизоцима яичного белка. Эту суспензию клеток встряхивали при 30°С в течение часа. Затем добавляли 0,5% ДСН и 1 мг/мл протеиназы К. Суспензию клеток инкубировали при 55°С в течение 3 часов. Суспензию клеток экстрагировали дважды смесью фенола, хлороформа и изоамилового спирта для извлечения каждого из водных слоев. Затем проводили одну экстракцию смесью хлороформа и изоамилового спирта для извлечения водного слоя. Хромосомную ДНК получали осаждением этанолом из данного водного слоя.
(2) Получение библиотеки хромосомной ДНК Streptomyces achromogenes IFO 12735
Тридцать восемь микрограммов (38 мкг) хромосомной ДНК, полученной в примере 26(1), расщепляли 3,2 единицами рестриктазы Sau3AI при 37°С в течение 60 минут. Полученный расщепленный раствор разделяли электрофорезом в 1% агарозном геле. ДНК размером приблизительно 2,0 т.п.н. извлекали из геля. Эту ДНК очищали с использованием набора для экстракции из гелей QIAquick Gel Extraction (Qiagen Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и концентрировали осаждением этанолом с получением 20 мкл раствора, содержащего желаемую ДНК. 8 микролитров (8 мкл) этого раствора ДНК, 100 нг плазмидного вектора pUC118, расщепленного рестриктазой BamHI и обработанного дефосфорилированием, и 16 мкл раствора I из набора для лигирования Ver. 2 (Takara Shuzo Company) смешивали и инкубировали в течение 3 часов при 16°С. E. coli DH5α трансформировали с использованием раствора для лигирования и распределяли на среде с LB-агаром, содержащим 50 мг/л ампициллина, для культивирования в течение ночи при 37°С. Полученные колонии извлекали из агаровой среды. Плазмиду экстрагировали. Полученные плазмиды были названы библиотекой хромосомной ДНК.
(3) Выделение ДНК (А4) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 26(2). В качестве праймеров использовали пару из олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:114, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:57. Нуклеотидную последовательность, показанную в SEQ ID NO:114, конструировали на основе аминокислотной последовательности, показанной в SEQ ID NO:113. Для приготовления реакционного раствора использовали ПЦР-систему Expand HiFi (Boehringer Manheim Company). Реакционный раствор для ПЦР доводили до 25 мкл добавлением 2,5 мкл вышеуказанной библиотеки хромосомной ДНК, каждого из этих 2 праймеров, доведенных до 7,5 пмоль, 0,2 мкл смеси dNTP (смеси 2 мМ каждого из 4 типов dNTP), 2,5 мкл 10х буфера (содержащего MgCl2), 0,38 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд, затем 72°С в течение 1 минуты; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 65°С в течение 30 секунд, затем 72°С в течение 1 минуты (где 20 секунд добавляли для выдерживания при 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. После этого выдерживания 2,5 мкл реакционного раствора использовали в качестве раствора матрицы для проведения ПЦР второй раз. В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:115, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:57. Нуклеотидную последовательность, показанную в SEQ ID NO:115, конструировали на основе аминокислотной последовательности, показанной в SEQ ID NO:113. Подобно описанному выше способу, для проведения ПЦР использовали ПЦР-систему Expand HiFi (Boehringer Manheim Company). Реакционный раствор после выдерживания наносили на 2% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 800 п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором ТА pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Реакцию секвенирования проводили с набором Big Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:67, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:68. Полученную плазмиду использовали в качестве матрицы в реакции секвенирования. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). В результате получили нуклеотидную последовательность, состоящую из нуклеотидов 57-832 нуклеотидной последовательности, показанной в SEQ ID NO:110. В полученной нуклеотидной последовательности нуклеотиды 58-60 нуклеотидной последовательности, показанной в SEQ ID NO:110, кодировали аминокислоту 20 в аминокислотной последовательности, показанной в SEQ ID NO:113.
Затем проводили ПЦР с ПЦР-системой Expand HiFi (Boehringer Manheim Company) при описанных выше условиях, с использованием библиотеки хромосомной ДНК, полученной в примере 26(2), в качестве матрицы. В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:116, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:59. Амплифицированную ДНК размером приблизительно 1,4 т.п.н. клонировали в клонирующий вектор pCRII-TOPO. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием Qiagen Tip20 (Qiagen Company). Реакцию секвенирования проводили с использованием набора Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:67, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:68. Полученную плазмиду использовали в качестве матрицы в реакции секвенирования. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 1-58 нуклеотидной последовательности, показанной в SEQ ID NO:110.
Проводили клонирование ДНК, простирающейся «справа» от 3'-конца нуклеотида, показанного в качестве нуклеотида 832 нуклеотидной последовательности, показанной в SEQ ID NO:110. Конкретно, 13 мкг хромосомной ДНК Streptomyces achromogenes IFO 12735, полученной в примере 26(1), расщепляли в течение ночи 200 Е рестрикатазы HincII при 37°С. После экстракции фенолом ДНК очищали осаждением этанолом. Полученную ДНК использовали для получения 20 мкл водного раствора. Четыре микролитра (4 мкл) этого раствора, 1,9 мкл 15 мкМ адаптора Walker Adaptor (Genome прогулки по геному), 1,6 мкл 10х буфера для лигирования и 0,5 мкл 6Е/мкл лигазы Т4 смешивали и выдерживали в течение ночи при 16°С. После этого выдерживали при 70°С в течение 5 минут и добавляли 72 мкл дистиллированной воды для обеспечения библиотеки Genome Walker. ПЦР проводили с использованием указанной библиотеки в качестве матрицы. Реакционный раствор для ПЦР, доведенный до 50 мкл, обеспечивали добавлением 1 мкл библиотеки Genome Walker и праймера API (обеспечиваемого универсальным набором Genome Walker) и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:117, каждого до количества 200 нМ, добавлением 1 мкл смеси dNTP (смеси 10 мМ каждого из 4 типов dNTP), 10 мкл 5х буфера для GC-геномной ПЦР, 2,2 мкл 25 мМ Mg(OAc)2, 10 мкл 5 М GC-расплава и 1 мкл смеси геномной полимеразы Advantage-GC и добавлением дистиллированной воды. Условия реакции ПЦР после выдерживания при 95°С в течение 1 минуты были следующими: проведение 7 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 72°С в течение 3 минут; 36 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 68°С в течение 3 минут; и поддержание 68°С в течение 7 минут. Реакционный раствор после этого выдерживания разбавляли в 50 раз дистиллированной водой. Эти продукты ПЦР называли продуктами первой ПЦР и использовали в качестве матрицы для проведения второй ПЦР. ПЦР, доведенную до 50 мкл, обеспечивали добавлением 1 мкл продуктов первой ПЦР и праймера АР2 (обеспечиваемого универсальным набором Genome Walker) и олигонуклеотида, показанного в SEQ ID NO:118, каждого до количества 200 нМ, добавлением 1 мкл смеси dNTP (смеси 10 мМ каждого из 4 типов dNTP), 10 мкл 5х буфера для GC-геномной ПЦР, 2,2 мкл 25 мМ Mg(OAc)2, 10 мкл 5 М GC-расплава и 1 мкл смеси геномной полимеразы Advantage-GC и добавлением дистиллированной воды. Условия реакции ПЦР после поддержания 95°С в течение 1 минуты были следующими: проведение 5 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 72°С в течение 3 минут; 20 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 68°С в течение 3 минут; и поддержание 68°С в течение 7 минут. Реакционный раствор после этого выдерживания подвергали электрофорезу в 1% агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1300 п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми в указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Реакцию секвенирования проводили с набором Big Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотида, показанного в SEQ ID NO:67, и олигонуклеотида, показанного в SEQ ID NO:68. Полученную плазмиду использовали в качестве матрицы в реакции секвенирования. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). В результате получили нуклеотидную последовательность, состоящую из нуклеотидов 644-1454 нуклеотидной последовательности, показанной в SEQ ID NO:110. В результате соединения всех анализируемых нуклеотидных последовательностей получили нуклеотидную последовательность, показанную в SEQ ID NO:110. Две открытые рамки считывания (ORF) присутствовали в указанной нуклеотидной последовательности. Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:109), состоящую из 1236 нуклеотидов (включая стоп-кодон) и кодирующую 411 аминокислотных остатков (SEQ ID NO:108), и нуклеотидную последовательность (SEQ ID NO:112), состоящую из 192 нуклеотидов (включая стоп-кодон) и кодирующую 63 аминокислотных остатков (SEQ ID NO:111). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:108), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:109, равна 45465 Да. Далее, аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, содержала аминокислотную последовательность (SEQ ID NO:113), определенную из секвенирования аминокислот от N-конца белка (А4) данного изобретения. Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:111), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:112, равна 6871 Да.
Пример 27. Экспрессия белка (А4) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А4) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces achromogenes IFO 12735 в примере 26(1), и с использованием ПЦР-системы Expand HiFi (Boehringer Manheim Company). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:119, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:120 (далее называемую «парой 25 праймеров»), или пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:119, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:121 (далее называемую «парой 26 праймеров»). Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих 2 праймеров, доведенных до 300 нМ, 50 нг вышеуказанной хромосомной ДНК, 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP), 5,0 мкл 10х буфера Expand HF (содержащего MgCl2) и 0,75 мкл смеси ферментов Expand HiFi и дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал выдерживание при 97°С в течение 15 секунд, затем 60°С в течение 30 секунд, затем 72°С в течение 1 минуты; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты (где 20 секунд добавляли для поддержания 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. После этого выдерживания реакционный раствор наносили на 1% агарозный гель для электрофореза. Зону геля, содержащую ДНК размером приблизительно 1,3 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 25 праймеров. Зону геля, содержащую ДНК размером приблизительно 1,6 т.п.н., извлекали из геля, на который наносили реакционный раствор, использующий пару 26 праймеров. ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми в указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Затем реакции секвенирования проводили с набором Big Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотидов, показанных в SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:122 и SEQ ID NO:123. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:109, была названа pCR646, а плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:110, была названа pCR646F.
Затем каждую из плазмид pCR646 и pCR646F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,3 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR646. Зону геля, содержащую ДНК размером приблизительно 1,6 т.п.н., вырезали из геля, на который наносили продукты расщепления pCR646F. Эти ДНК очищали из каждого из извлеченных гелей с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Каждую из полученных ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 1 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:109, в которой ДНК размером приблизительно 1,3 т.п.н., кодирующая белок (А4) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN646. Далее, плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:110, в которой ДНК размером приблизительно 1,6 т.п.н., кодирующая белок (А4) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN646F. Каждую из вышеуказанных плазмид pKSN646 и pKSN646F вводили в E. coli JM109. Полученные трансформанты E. coli были названы соответственно JM109/pKSN646 и JM109/pKSN646F. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (А4) данного изобретения в E. coli и выделение указанного белка
Каждую из E. coli JM109/pKSN646, JM109/pKSN646F и JM109/pKSN2 культивировали в течение ночи при 37°С в 10 мл среды ТВ (1,2% (мас./об.) триптон, 2,4% (мас./об.) дрожжевой экстракт, 0,4% (мас./об.) глицерин, 17 мМ дигидрофосфат калия, 72 мМ дикалий-гидрофосфат), содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. После достижения OD660 приблизительно 0,5, добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 17 часов.
Клетки извлекали из каждой культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл указанного выше буфера, содержащего 1 мМ ФМСФ. Полученные клеточные суспензии подвергали 6 раз обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 3 минут каждый раз в условиях излучаемой мощности 3, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (1200хg, 5 минут) супернатанты извлекали и центрифугировали (150000хg, 70 минут) для получения фракций супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN646, называют “экстрактом E. coli pKSN646”, фракцию супернатанта, полученную из E. coli JM109/pKSN646F, называют “экстрактом E. coli pKSN646F», а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”). Один микролитр (1 мкл) указанных выше фракций супернатантов анализировали электрофорезом в 15-25% ДСН-ПААГ и окрашивали СВВ. В результате посредством детектирования явно более интенсивных полос как в экстракте E. coli pKSN646 и в экстракте E. coli pKSN646F, чем в экстракте E. coli pKSN2, в положениях электрофореза, соответствующих молекулярной массе 45кДа, можно подтвердить, что белок (А4) данного изобретения экспрессируется в E. coli.
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Готовили реакционные растворы по 30 мкл и выдерживали их в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 18 мкл фракции супернатанта, полученной в примере 27(2). Затем готовили и выдерживали подобным образом реакционные растворы без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В и компонента С. Добавляли три микролитра (3 мкл) 2 н. HCl и 90 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 75 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 6,0 мкл этилацетата. Пять микролитров (5,0 мкл) этого раствора наносили на ТСХ-пластинку (силикагель ТСХ-пластинки 60F254, 20 см х 20 см, толщина 0,25 мм, Merck Company). ТСХ-пластинку проявляли смесью 6:1:2 хлороформа, уксусной кислоты и этилацетата в течение приблизительно 1 часа. Затем растворителям давали испариться. ТСХ-пластинку экспонировали в течение ночи на визуализирующей пластинке (Fuji Film Company). Затем визуализирующую пластинку анализировали на Анализаторе изображения BAS2000 (Fuji Film Company). Присутствие пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Может быть подтверждено образование соединения (III) в реакционных растворах, содержащих компонент А, компонент В, компонент С и экстракт E. coli pKSN646, или в реакционных растворах, содержащих компонент А, компонент В, компонент С и экстракт E. coli pKSN646F.
Пример 28. Идентичность последовательности относительно белка данного изобретения
Идентичности последовательности относительно белков данного изобретения и ДНК данного изобретения анализировали с использованием программы GENETIX-WIN Ver. 5 (Software Development Company). Сопоставления выстраиванием получали проведением анализа гомологии способом Липмана-Пирсона (Lipman, D.J. and Pearson, W.R., Science, 227, 1435-1441 (1989)).
В отношении аминокислотных последовательностей белков (А1)-(А4) данного изобретения определяли идентичности последовательностей относительно друг друга и относительно известных белков с наивысшей гомологией. Эти результаты показаны в таблице 15.
AAC25766
CAB46536
AAC25766
CAB46536
В отношении нуклеотидных последовательностей ДНК (А1) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:6, ДНК (А2) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:7, ДНК (А3) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:8, и ДНК (А4) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:109, были определены идентичности последовательностей относительно друг друга и относительно известных генов с наивысшей гомологией. Эти результаты показаны в таблице 16.
[ДНК (А2) данного изобретения]
[ДНК (А3) данного изобретения]
[ДНК (А4) данного изобретения]
AF072709
Y18574
AF072709
[ДНК (А4) данного изобретения]
Y18574
В отношении аминокислотных последовательностей белков (В1)-(В4) данного изобретения определяли идентичности последовательностей относительно друг друга и относительно известных белков с наивысшей гомологией. Эти результаты показаны в таблице 17.
AAC25765
AAF71770
AAC25765
AAA26824
В отношении нуклеотидных последовательностей ДНК (В1) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:15, ДНК (В2) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:16, ДНК (В3) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:17, и ДНК (В4) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:112, были определены идентичности последовательностей относительно друг друга и относительно известных генов с наивысшей гомологией. Эти результаты показаны в таблице 18.
[ДНК (В2) данного изобретения]
[ДНК (В3) данного изобретения]
[ДНК (В4) данного изобретения]
AF072709
M32238
AF072709
[ДНК (В4) данного изобретения]
M32239
Пример 29. ПЦР, использующая олигонуклеотид, имеющий частичную нуклеотидную последовательность ДНК (А) данного изобретения, в качестве праймера
ПЦР проводили с использованием в качестве матрицы каждой из: хромосомной ДНК Streptomyces phaeochromogenes IFO 12898, полученной в примере 2; хромосомной ДНК Saccharopolyspora taberi JCM 9383t, полученной в примере 5; хромосомной ДНК Streptomyces griseolus ATCC 11796, полученной в примере 9; хромосомной ДНК Streptomyces testaceus ATCC 21469, полученной в примере 11; хромосомной ДНК Streptomyces achromogenes IFO 12735, полученной в примере 26; и каждой из хромосомной ДНК Streptomyces griseofuscus IFO 12870t, Streptomyces thermocoerulescens IFO 14273t и Streptomyces nogalater IFO 13445, полученных аналогично способу, описанному в примере 2. В качестве праймеров использовали 5 пар праймеров, показанных в таблице 19. Предсказанный размер ДНК, амплифицированной при помощи ПЦР, использующей каждую из пар праймеров, основанных на нуклеотидной последовательности, показанной в SEQ ID NO:6, приведен а таблице 19.
Реакционный раствор для ПЦР доводили до 25 мкл добавлением 200 нМ каждого из 2 праймеров пары, показанной в таблице 19, добавлением 10 нг хромосомной ДНК, 0,5 мкл смеси dNTP (смеси 10 мМ каждого из 4 типов dNTP), 5 мкл 5х буфера для GC-геномной ПЦР, 1,1 мкл 25 мМ Mg(OAc)2, 5 мкл 5 М GC-расплава и 0,5 мкл смеси геномной полимеразы Advantage-GC и добавлением воды. Условия реакции ПЦР после поддержания 95°С в течение 1 минуты были следующими: повторение 30 циклов, где каждый цикл включал поддержание 94°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 1 минуты; и поддержание 72°С в течение 5 минут. Каждый из этих реакционных растворов после указанного выдерживания анализировали электрофорезом в 3% агарозном геле. Результаты показаны на фиг. 46 и в таблице 20 и таблице 21. Амплификацию предсказанного размера ДНК наблюдали в каждом случае или во всех случаях с парами праймеров 14, 15, 16, 17 и 18, а также в случаях с использованием хромосомной ДНК из любого из этих штаммов в качестве матрицы.
JCM 9393t
ATCC 11796
ATCC 21469
JCM 9393t
ATCC 11796
ATCC 21469
JCM 9393t
ATCC 11796
ATCC 21469
JCM 9393t
ATCC 11796
IFO 12870t
IFO 12735
IFO 13445
IFO 12735
IFO 13445
IFO 12870t
IFO 12735
IFO 13445
IFO 12870t
IFO 13445
IFO 12870t
IFO 12735
IFO 13445
Пример 30. Гибридизация, использующая в качестве зонда ДНК, состоящую из частичной нуклеотидной последовательности данной ДНК (А) и ДНК (А) данного изобретения
(1) Получение зонда
ДНК, состоящую из частичной нуклеотидной последовательности ДНК (А1) данного изобретения, или частичную нуклеотидную последовательность ДНК (А1) данного изобретения, получали в виде зонда, меченного дигоксигенином (DIG-меченного зонда). ПЦР проводили с набором для синтеза DIG-зонда для ПЦР (Roche Diagnostics GmbH Company) в соответствии с прилагаемым руководством с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes IFO 12898, полученной в примере 3, и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:93, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:94. Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из 2 праймеров, доведенных до 200 нМ, добавлением 50 нг хромосомной ДНК, 2,5 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP), 2,5 мкл DIG-смеси для ПЦР (смеси 2,0 мМ каждого из 4 типов dNTP, меченных DIG), 5 мкл 10х ПЦР-буфера и 0,75 мкл смеси ферментов Expand HiFi и добавлением дистиллированной воды. Условия реакции ПЦР были следующими: после выдерживания при 95°С в течение 2 минут, повторение 10 циклов, где каждый цикл включал поддержание 95°С в течение 10 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 2 минут; затем проведение 15 циклов, где каждый цикл включал поддержание 95°С в течение 10 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 2 минут (где 20 секунд добавляли для поддержания 72°С для каждого цикла); и затем поддержание 72°С в течение 7 минут. Реакционный раствор подвергали после этого электрофорезу в 1% агарозном геле. В результате была подтверждена амплификация ДНК размером приблизительно 1,3 т.п.н. Эту амплифицированную ДНК извлекали с получением ДНК, меченной дигоксигенином и имеющей нуклеотидную последовательность, показанную в SEQ ID NO:6. С использованием аналогичного способа ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces phaeochromogenes IFO 12898 и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:130, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:131. ДНК, амплифицированную указанной ПЦР, извлекали с получением ДНК, меченной дигоксигенином и имеющей нуклеотидную последовательность, состоящую из нуклеотидов 57-730 нуклеотидной последовательности, показанной в SEQ ID NO:6.
В аналогичном способе ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Saccharopolyspora taberi JCM 9383t, полученной в примере 6, и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:61, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:62. ДНК, амплифицированную указанной ПЦР, извлекали с получением ДНК, меченной дигоксигенином и имеющей нуклеотидную последовательность, показанную в SEQ ID NO:7.
Далее, с использованием аналогичного способа ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces testaceus ATCC 21469, полученной в примере 11, и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:70, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:71. ДНК, амплифицированную указанной ПЦР, извлекали с получением ДНК, меченной дигоксигенином и имеющей нуклеотидную последовательность, показанную в SEQ ID NO:8. Далее ПЦР проводили с использованием вышеуказанной хромосомной ДНК в качестве матрицы и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:132, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:133. ДНК, амплифицированную указанной ПЦР, извлекали с получением ДНК, меченной дигоксигенином и имеющей нуклеотидную последовательность, состоящую из нуклеотидов 21-691 нуклеотидной последовательности, показанной в SEQ ID NO:8.
(2) Дот-блот-гибридизация
Каждую из ДНК pKSN657, полученной в примере 4 (ДНК, содержащей ДНК (А1) данного изобретения), ДНК pKSN923, полученной в примере 7 (ДНК, содержащей ДНК (А2) данного изобретения), ДНК pKSN671, полученной в примере 12 (ДНК, содержащей ДНК (А3) данного изобретения), ДНК pKSNSCA, полученной в примере 14 (ДНК, содержащей данную ДНК (А9), и ДНК pKSN11796, полученной в примере 10 (ДНК, содержащей данную ДНК (А10), наносили блоттингом на найлоновую мембрану Hybond N+ (Amersham Pharmacia Company) до количества 100 нг и 10 нг. Ультрафиолетовый свет был направлен на полученные мембраны с использованием трансиллюминатора в течение 5 минут.
Набор DIG-High Prime DNA Labeling и Detector Starter Kit II (Roche Diagnostics GmbH Company) использовали для гибридизации и детектирования в соответствии с прилагаемым руководством. В качестве зондов использовали каждую из ДНК, меченных дигоксигенином и полученных в примере 30(1), которые выдерживали при 100°С в течение 5 минут и затем быстро охлаждали во льду (далее называемые “DIG-меченным зондом”). Вышеописанную мембрану с нанесенными пятнышками (дотами) выдерживали при 42°С в течение 30 минут в 2,0 мл DIGEasyHyb, обеспечиваемом указанным набором. Затем 2,0 мл DIG Easy Hyb, 5,0 мкл DIG-меченных зондов и эту мембрану заключали в пластиковый мешочек для гибридизации и выдерживали при 42°С в течение 18 часов. Мембрану вынимали, отмывали дважды в 2хSSC, содержащем 0,1% ДСН, в течение 5 минут при комнатной температуре и затем отмывали дважды в 0,5хSSC, содержащем 0,1% ДСН, при 65°С в течение 15 минут. Затем мембрану отмывали в 50 мл отмывного буфера в течение 2 минут, затем выдерживали в 50 мл блокирующего раствора при комнатной температуре в течение 30 минут, затем выдерживали в 2,0 мл раствора антител в течение 30 минут и затем отмывали дважды в 50 мл отмывного буфера в течение 15 минут. Затем, после выдерживания в 50 мл детектирующего буфера в течение 5 минут, эту мембрану заключали в мешочек для гибридизации с 2,0 мл раствора цветного субстрата и выдерживали при комнатной температуре в течение 18 часов. Сигнал детектировали в каждом из случаев проведения гибридизации с каждым из реагентов 10 нг и 100 нг каждой из pKSN657, pKSN923, pKSN671, pKSNSCA и pKSN11796.
Пример 31. Получение ДНК (А11) данного изобретения
(1) Получение хромосомной ДНК Streptomyces nogalator IFO13445
Streptomyces nogalator IFO13445 культивировали при встряхивании при 30°С в течение 3 дней в 50 мл среды YGY (0,5% (мас./об.) дрожжевой экстракт, 0,5% (мас./об.) триптон, 0,1% (мас./об.) глюкоза и 0,1% (мас./об.) K2HPO4, рН 7,0). Клетки собирали. Полученные клетки суспендировали в среде YGY, содержащей 1,4% (мас./об.) глицина и 60 мМ ЭДТА, и дополнительно инкубировали при встряхивании в течение одного дня. Клетки собирали из культуральной среды. После промывки один раз дистиллированной водой их суспендировали в 3,5 мл буфера В1 (50 мМ Трис-HCl (рН 8,0), 50 мМ ЭДТА, 0,5% Твин-20 и 0,5% Тритон Х-100). Восемьдесят микролитров (80 мкл) раствора лизоцима 100 мкг/мл и 100 мкл протеазы Qiagen (600 мАЕ/мл, Qiagen Company) добавляли к этой суспензии и выдерживали при 37°С в течение часа. Затем добавляли 1,2 мл буфера В2 (3 М гуанидин·HCl и 20% Твин-20), смешивали и выдерживали при 50°С в течение 30 минут. Полученный раствор клеточного лизата добавляли к геномному чипу Qiagen 100G (Qiagen Company), уравновешенному в буфере QBT (750 мМ NaCl, 50 мМ MOPS (рН 7,0), 15% изопропанол и 0,15% Тритон Х-100). Затем, после промывания этого чипа дважды 7,5 мл буфера QC (50 мМ MOPS (рН 7,0) и 15% изопропанол), ДНК элюировали пропусканием 5 мл буфера QF (1,25 М NaCl, 50 мМ ТРис-HCl (рН 8,5), 15% изопропанол). 3,5 мл изопропанола смешивали с полученным раствором ДНК для осаждения и извлечения хромосомной ДНК. После промывания 70% этанолом извлеченную хромосомную ДНК растворяли в 1 мл буфера ТВ.
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А11) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной в примере 31(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Амплифицированную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и затем вводили в E. coli TOP10F'. Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:57, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:59. В реакции секвенирования использовали полученную плазмиду в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). В результате получали нуклеотидную последовательность, состоящую из нуклеотидов 316-1048 нуклеотидной последовательности, показанной в SEQ ID NO:139.
Далее, хромосомную ДНК, полученную в примере 31(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:161, и праймера API (универсального набора Genome Walker (Clontech Company)). Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:162, и праймера AP2 (универсального набора Genome Walker (Clontech Company)). Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-330 нуклеотидной последовательности, показанной в SEQ ID NO:144.
Далее, хромосомную ДНК, полученную в примере (31(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:163, и праймера API (универсального набора Genome Walker (Clontech Company)). Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:164, и праймера AP2 (универсального набора Genome Walker (Clontech Company)). Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 983-1449 нуклеотидной последовательности, показанной в SEQ ID NO:144.
(3) Анализ последовательности ДНК (А11) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:144, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 31(2). Присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:139), состоящую из 1230 нуклеотидов (включая стоп-кодон) и кодирующую 409 аминокислотных остатков (SEQ ID NO:159), и нуклеотидную последовательность (SEQ ID NO:154), состоящую из 207 нуклеотидов (включая стоп-кодон) и кодирующую 68 аминокислотных остатков (SEQ ID NO:149). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:159), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:139, равна 45177 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:149), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:154, равна 7147 Да.
Пример 32. Экспрессия белка (А11) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А11) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces nogalator IFO 13445 в примере 31(1), и с использованием ПЦР-системы Expand HiFi (Boehringer Manheim Company). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:165, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:166. Состав реакционного раствора и выдерживание были сходными с условиями, описанными в примере 27(1). После этого выдерживания реакционный раствор подвергали электрофорезу в 1% агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., извлекали. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company) в соответствии с инструкциями, прилагаемыми к указанному вектору, и вводили в E. coli ТОР10F'. Плазмидную ДНК получали из полученных трансформантов E. coli с использованием набора Qiagen Tip20 (Qiagen Company). Реакции секвенирования проводили с набором Dye terminator cycle sequencing FS ready (Applied Biosystems Japan Company) в соответствии с инструкциями, прилагаемыми к указанному набору, с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные в SEQ ID NO:57, 59 и 186. В реакциях секвенирования использовали полученную плазмидную ДНК в качестве матрицы. Продукты реакции анализировали с использованием секвенатора ДНК 3100 (Applied Biosystems Japan Company). На основании этих результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:144, была названа pCR849AF.
Затем pCR849F расщепляли рестриктазами NdeI и HindIII. Продукты расщепления подвергали электрофорезу в агарозном геле. Зону геля, содержащую ДНК размером приблизительно 1,5 т.п.н., вырезали из геля. ДНК очищали из извлеченного геля с использованием набора для экстракции из гелей QIAquick (Qiagen Company) в соответствии с прилагаемыми инструкциями. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с использованием набора для лигирования Ver. 2 (Takara Shuzo Company) в соответствии с инструкциями, прилагаемыми к указанному набору, и вводили в E. coli JM109. Из полученных трансформантов E. coli получали плазмидные ДНК. Их структуры анализировали. Плазмида, содержащая нуклеотидную последовательность, показанную в SEQ ID NO:144, в которой ДНК размером приблизительно 1,5 т.п.н., кодирующая белок (А4) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2, была названа pKSN849AF. Плазмиду pKSN849АF вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN849АF. Далее, плазмиду pKSN2 вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN2.
(2) Экспрессия белка (А11) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN849AF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN849AF, называют “экстрактом E. coli pKSN849AF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Эти реакционные растворы состояли из 0,1 М калий-фосфатного буфера (рН 7,0), содержащего 3 м.д. соединения (II), меченного 14С, 2 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 2 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,1 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 23 мкл фракции супернатанта, полученной в примере 32(2). Подобно примеру 4(3), эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN849АF. В противоположность этому, такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 33. Получение ДНК (А12) данного изобретения
(1) Получение хромосомной ДНК Streptomyces tsusimaensis IFO 13782
Хромосомную ДНК Streptomyces tsusimaensis IFO 13782 получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А12) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces tsusimaensis IFO 13782, полученной в примере 33(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 364-1096 нуклеотидной последовательности, показанной в SEQ ID NO:140.
Далее, хромосомную ДНК, полученную в примере 33(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:167, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:168, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-392 нуклеотидной последовательности, показанной в SEQ ID NO:145.
Далее, хромосомную ДНК, полученную в примере 33(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:169, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:170, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1048-1480 нуклеотидной последовательности, показанной в SEQ ID NO:145.
(3) Анализ последовательности ДНК (А12) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:145, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 33(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:140), состоящую из 1278 нуклеотидов (включая стоп-кодон) и кодирующую 425 аминокислотных остатков (SEQ ID NO:160), и нуклеотидную последовательность (SEQ ID NO:155), состоящую из 198 нуклеотидов (включая стоп-кодон) и кодирующую 65 аминокислотных остатков (SEQ ID NO:150). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:160), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:140, равна 46549 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:150), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:155, равна 6510 Да.
Пример 34. Экспрессия ДНК (А12) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А12) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces tsusimaensis IFO 13782 в примере 33(1) и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:171, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:172. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59, 171, 172 и 187. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:145, была названа pCR1618F. Подобно примеру 32(1), pCR1618F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:145, в которой ДНК, кодирующая белок (А12) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1618F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1618F.
(2) Экспрессия белка (А12) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1618F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1618F, называют “экстрактом E. coli pKSN1618F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. За исключением использования фракций супернатантов, полученных в примере 34(2) (экстракта E. coli pKSN1618F или экстракта E. coli pKSN2), реакционные растворы готовили подобно примеру 32(3). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1618F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 35. Получение ДНК (А13) данного изобретения
(1) Получение хромосомной ДНК Streptomyces thermocoerulesces IFO 14273t
Хромосомную ДНК Streptomyces thermocoerulesces IFO 14273t получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А13) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces thermocoerulesces IFO 14273t, полученной в примере 35(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 295-1027 нуклеотидной последовательности, показанной в SEQ ID NO:141.
Далее, хромосомную ДНК, полученную в примере 35(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:173, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:174, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-370 нуклеотидной последовательности, показанной в SEQ ID NO:146.
Далее, хромосомную ДНК, полученную в примере 35(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:175, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:176, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 960-1473 нуклеотидной последовательности, показанной в SEQ ID NO:146.
(3) Анализ последовательности ДНК (А13) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:146, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 35(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:141), состоящую из 1209 нуклеотидов (включая стоп-кодон) и кодирующую 402 аминокислотных остатка (SEQ ID NO:136), и нуклеотидную последовательность (SEQ ID NO:156), состоящую из 252 нуклеотидов (включая стоп-кодон) и кодирующую 83 аминокислотных остатков (SEQ ID NO:151). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:136), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:141, равна 44629 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:151), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:156, равна 8635 Да.
Пример 36. Экспрессия ДНК (А13) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А13) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces thermocoerulesces IFO 14273t в примере 35(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:177, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:178. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием олигонуклеотидов, имеющих нуклеотидные последовательности, показанные соответственно в SEQ ID NO:57, 59, 173, 175 и 188. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:146, была названа pCR474F. Подобно примеру 32(1), pCR474F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:146, в которой ДНК, кодирующая белок (А13) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN474F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN474F.
(2) Экспрессия белка (А13) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN474F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN474F, называют “экстрактом E. coli pKSN474F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. За исключением использования фракций супернатантов, полученных в примере 36(2) (экстракта E. coli pKSN474F или экстракта E. coli pKSN2), реакционные растворы готовили подобно примеру 32(3). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN474F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 37. Получение ДНК (А14) данного изобретения
(1) Получение хромосомной ДНК Streptomyces glomerochromogenes IFO 13673t
Хромосомную ДНК Streptomyces glomerochromogenes IFO 13673t получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А14) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces glomerochromogenes IFO 13673t, полученной в примере 37(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 316-1048 нуклеотидной последовательности, показанной в SEQ ID NO:142.
Далее, хромосомную ДНК, полученную в примере 37(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:179, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:180, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-330 нуклеотидной последовательности, показанной в SEQ ID NO:147.
Далее, хромосомную ДНК, полученную в примере 37(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:181, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:182, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 982-1449 нуклеотидной последовательности, показанной в SEQ ID NO:147.
(3) Анализ последовательности ДНК (А14) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:147, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 37(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:142), состоящую из 1230 нуклеотидов (включая стоп-кодон) и кодирующую 409 аминокислотных остатка (SEQ ID NO:137), и нуклеотидную последовательность (SEQ ID NO:157), состоящую из 207 нуклеотидов (включая стоп-кодон) и кодирующую 68 аминокислотных остатков (SEQ ID NO:152). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:137), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:142, равна 45089 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:152), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:157, равна 7174 Да.
Пример 38. Экспрессия ДНК (А14) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А14) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces glomerochromogenes IFO 13673t в примере 37(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:183, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:184. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59 и 189. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:147, была названа pCR1491F. Подобно примеру 32(1), pCR1491F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:147, в которой ДНК, кодирующая белок (А14) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1491АF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1491АF.
(2) Экспрессия белка (А14) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1491АF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1491АF, называют “экстрактом E. coli pKSN1491АF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. За исключением использования фракций супернатантов, полученных в примере 38(2) (экстракта E. coli pKSN1491АF или экстракта E. coli pKSN2), реакционные растворы готовили подобно примеру 32(3). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1491АF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 39. Получение ДНК (А15) данного изобретения
(1) Получение хромосомной ДНК Streptomyces olivochromogenes IFO 12444
Хромосомную ДНК Streptomyces olivochromogenes IFO 12444 получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А15) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces olivochromogenes IFO 12444, полученной в примере 39(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК лигировали с клонирующим вектором pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 316-1048 нуклеотидной последовательности, показанной в SEQ ID NO:143.
Далее, хромосомную ДНК, полученную в примере 37(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной ДНК в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:179, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:180, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-330 нуклеотидной последовательности, показанной в SEQ ID NO:148.
Далее, хромосомную ДНК, полученную в примере 39(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:181, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:182, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 982-1449 нуклеотидной последовательности, показанной в SEQ ID NO:148.
(3) Анализ последовательности ДНК (А15) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:148, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 39(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:143), состоящую из 1230 нуклеотидов (включая стоп-кодон) и кодирующую 409 аминокислотных остатков (SEQ ID NO:138), и нуклеотидную последовательность (SEQ ID NO:158), состоящую из 207 нуклеотидов (включая стоп-кодон) и кодирующую 68 аминокислотных остатков (SEQ ID NO:153). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:138), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:143, равна 45116 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:153), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:158, равна 7179 Да.
Пример 40. Экспрессия ДНК (А15) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А15) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces olivochromogenes IFO 12444 в примере 39(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:184, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:185. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59 и 189. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:148, была названа pCR1555АF. Подобно примеру 32(1), pCR1555AF расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:148, в которой ДНК, кодирующая белок (А15) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1555АF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1555АF.
(2) Экспрессия белка (А15) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1555АF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1555АF, называют “экстрактом E. coli pKSN1555АF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. За исключением использования фракций супернатантов, полученных в примере 40(2) (экстракта E. coli pKSN1555АF или экстракта E. coli pKSN2), реакционные растворы готовили подобно примеру 32(3). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1555АF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 41. Преобразование соединений белком (А1) данного изобретения
(1) Получение фракций пластид
Сто граммов (100 г) семян редьки полевой (семян Takii) высевали в увлажненное бумажное лабораторное полотенце в лотке, культивировали при 25°С в течение 6 дней в темноте и затем культивировали в течение 4 часов под флуоресцентной лампой. Тридцать граммов (30 г) позеленевших семядолей растирали с использованием гомогенизатора Nissei AM-8 (Nihonseiki Seisakusho; 18000-20000 об/мин, 4°С, 5 секунд) в буфере для разрушения (1 мМ хлорид магния, 20 мМ N-трис(гидроксиметил)метил-2-аминоэтансульфонат, 10 мМ N-2-гидроксиэтилпиперидин-N'-2-этансульфонат, 0,5 мМ ЭДТА, 5 мМ цистеин, 0,5 М сахароза; рН 7,7). Полученный раствор клеточного лизата пропускали через 4 слоя найлоновой марли. Полученный раствор центрифугировали (13170 g, 4°С, 1 минута). Полученные фракции остатков суспендировали в 60 мл буфера для разрушения и центрифугировали (2640 g, 4°С, 2 минуты). Фракции остатка ресуспендировали в 10 мл буфера для разрушения, наслаивали на буфер высокой плотности (1 мМ хлорид магния, 20 мМ N-трис(гидроксиметил)метил-2-аминоэтансульфонат, 30 мМ N-2-гидроксиэтилпиперидин-N'-2-этансульфонат, 0,5 мМ ЭДТА, 5 мМ цистеин, 0,6 М сахароза; рН 7,7) в центрифужной пробирке и центрифугировали (675 g, 4°С, 15 минут). Остатки суспендировали в 3 мл буфера для суспендирования (1 мМ хлорид магния, 20 мМ N-трис(гидроксиметил)метил-2-аминоэтансульфонат, 30 мМ N-2-гидроксиэтилпиперидин-N'-2-этансульфонат, 0,5 мМ ЭДТА; рН 7,7), и эти суспензии называли фракцией пластид.
(2) Преобразование соединения (XII) белком (А1) данного изобретения
Получали 100 мкл реакционного раствора из 50 мМ калий-фосфатного буфера (рН 7,0), содержащего 5 м.д. соединения (XII), 3 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 1 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,15 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и фракцию супернатанта, полученную в примере 4(2). Реакционный раствор выдерживали при 30°С в течение 10 минут. Кроме того, готовили и выдерживали таким же образом 100 мкл реакционного раствора из 50 мМ калий-фосфатного буфера (рН 7,0) без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В, компонента С и фракции супернатанта, полученной в примере 4(2). Добавляли десять микролитров (10 мкл) 2 н. HCl и 500 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Полученные реакционные растворы центрифугировали при 8000 g для извлечения 490 мкл этилацетатного слоя. После сушки этилацетатных слоев при пониженном давлении остаток растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Сорок микролитров (40 мкл) растворов фракций (далее раствор фракции, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 4(2), называют «раствором для (XII)-преобразования (А1)»; далее раствор фракции, полученный из реакционного раствора, не содержащего компонента А, компонента В, компонента С и фракции супернатанта, полученной в примере 4(2), называют «раствором (XII)-контроля (А1)») анализировали с помощью ВЭЖХ. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А1), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А1), была более низкой. Далее, из раствора для (XII)-преобразования (А1) был детектирован пик, который не детектировался из раствора (XII)-контроля (А1). Проводили масс-спектрометрию для соединения, содержащегося в этом пике. Масса соединения, содержащегося в таком пике, была на 14 меньше, чем масса соединения (XII).
Двадцать микролитров (20 мкл) 32-кратного разведения вышеуказанного раствора для (XII)-преобразования (А1) и 60 мкл фракции пластид, полученной в примере 41(1), смешивали. В затемненных условиях добавляли 20 мкл раствора субстрата (10 мМ аденозинтрифосфат, 5 мМ аминолевулиновая кислота, 4 мМ глутатионредуктаза и 0,6 мМ НАД+; рН 6,5; далее такой раствор субстрата называют «раствором субстрата РРО») и выдерживали при 30°С в течение 1,5 часов. Далее, вместо указанных 20 мкл 32-кратного разведения вышеуказанного раствора для (XII)-преобразования (А1) готовили реакционный раствор, к которому добавляли 20 мкг 32-кратного разведения раствора (XII)-контроля (А1) и добавляли раствор субстрата РРО и выдерживали таким же образом. После выдерживания в каждый реакционный раствор добавляли триста микролитров (300 мкл) смеси диметилсульфоксид-метанол (диметилсульфоксид:метанол = 7:3) и центрифугировали (8000 g, 4°С, 10 минут). Супернатанты извлекали и подвергали их анализу обращенно-фазовой ВЭЖХ в условиях анализа, приведенных ниже, для измерения количества PPIX. Количество PPIX в реакционном растворе, к которому добавляли раствор для (XII)-преобразования (А1), было большим, чем количество PPIX в реакционном растворе, к которому добавляли раствор (XII)-контроля (А1).
(Условие 2 анализа ВЭЖХ)
колонка: SUMIPAX ODS212 (Sumika Chemical Analysis Service)
скорость тока: 2 мл/мин
длина волны детектирования: возбуждение флуоресценции: 410 нм, испускание: 630 нм
элюент: смесь 95:5 метанола и 1 М ацетата аммония (рН 5,7).
(3) Преобразование соединения (XIII) белком (А1) данного изобретения
За исключением использования 5 м.д. соединения (XIII) вместо 5 м.д. соединения (XII), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 4(2), называют «раствором для (XIII)-преобразования (А1)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 4(2), называют «раствором (XIII)-контроля (А1)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А1), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1), была более низкой. Далее, из раствора для (XIII)-преобразования (А1) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А1). Проводили масс-спектрометрию на соединение, содержащееся в этом пике. Масса соединения, содержащегося в таком пике, была на 14 меньше, чем масса соединения (XIII).
Двадцать микролитров (20 мкл) 128-кратного разведения вышеуказанного раствора для (XIII)-преобразования (А1) и 60 мкл фракции пластид смешивали. В затемненных условиях добавляли 20 мкл раствора субстрата РРО и выдерживали при 30°С в течение 1,5 часов. Далее, вместо указанных 20 мкл 128-кратного разведения вышеуказанного раствора для (XIII)-преобразования (А1), готовили реакционный раствор, к которому добавляли 20 мкл 128-кратного разведения раствора (XIII)-контроля (А1), и добавляли раствор субстрата РРО и выдерживали таким же образом. Аналогично примеру 41(2), после выдерживания готовили каждый из реакционных растворов и подвергали их анализу обращенно-фазовой ВЭЖХ в условиях анализа 2, приведенных выше, для измерения количества PPIX. Количество PPIX в реакционном растворе, к которому добавляли раствор для (XIII)-преобразования (А1), было большим, чем количество PPIX в реакционном растворе, к которому добавляли раствор (XIII)-контроля (А1).
(4) Преобразование соединения (XVI) белком (А1) данного изобретения
За исключением использования 12,5 м.д. соединения (XVI) вместо 5 м.д. соединения (XII), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 200 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 4(2), называют «раствором для (XVII)-преобразования (А1)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 4(2), называют «раствором (XVI)-контроля (А1)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XVI), детектируемого из раствора (XVI)-контроля (А1), концентрация соединения (XVI), детектируемого из раствора для (XVI)-преобразования (А1), была более низкой. Далее, из раствора для (XVI)-преобразования (А1) был детектирован пик, который не детектировался из раствора (XVI)-контроля (А1).
Двадцать микролитров (20 мкл) 8-кратного разведения вышеуказанного раствора для (XVI)-преобразования (А1) и 60 мкл фракции пластид смешивали. В затемненных условиях добавляли 20 мкл раствора субстрата РРО и выдерживали при 30°С в течение 1,5 часов. Далее, вместо указанных 20 мкл 8-кратного разведения раствора для (XVI)-преобразования (А1) готовили реакционный раствор, к которому добавляли 20 мкл 8-кратного разведения раствора (XVI)-контроля (А1), и добавляли раствор субстрата РРО и выдерживали таким же образом. Аналогично примеру 41(2), после выдерживания готовили каждый из реакционных растворов и подвергали их анализу обращенно-фазовой ВЭЖХ в условиях анализа 2, приведенных выше, для измерения количества PPIX. Количество PPIX в реакционном растворе, к которому добавляли раствор для (XVI)-преобразования (А1), было большим, чем количество PPIX в реакционном растворе, к которому добавляли раствор (XVI)-контроля (А1).
(5) Преобразование соединения (XVII) белком (А1) данного изобретения
За исключением использования 12,5 м.д. соединения (XVII) вместо 5 м.д. соединения (XII), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 200 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 4(2), называют «раствором для (XVII)-преобразования (А1)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 4(2), называют «раствором (XVII)-контроля (А1)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XVII), детектируемого из раствора (XVII)-контроля (А1), концентрация соединения (XVII), детектируемого из раствора для (XVII)-преобразования (А1), была более низкой. Далее, из раствора для (XVII)-преобразования (А1) был детектирован пик, который не детектировался из раствора (XVII)-контроля (А1).
Двадцать микролитров (20 мкл) 32-кратного разведения вышеуказанного раствора для (XVII)-преобразования (А1) и 60 мкл фракции пластид смешивали. В затемненных условиях добавляли 20 мкл раствора субстрата РРО и выдерживали при 30°С в течение 1,5 часов. Далее, вместо указанных 20 мкл 32-кратного разведения раствора для (XVII)-преобразования (А1) готовили реакционный раствор, к которому добавляли 20 мкл 32-кратного разведения раствора (XVII)-контроля (А1) и добавляли раствор субстрата РРО и выдерживали таким же образом. Аналогично примеру 41(2), после выдерживания готовили каждый из реакционных растворов и подвергали их анализу обращенно-фазовой ВЭЖХ в условиях анализа 2, приведенных выше, для измерения количества PPIX. Количество PPIX в реакционном растворе, к которому добавляли раствор для (XVII)-преобразования (А1), было большим, чем количество PPIX в реакционном растворе, к которому добавляли раствор (XVII)-контроля (А1).
(6) Преобразование соединения (VI) белком (А1) данного изобретения
E. coli JM109/pKSN657F культивировали в течение ночи при 37°С в 3 мл среды ТВ, содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. Когда OD660 достигала 0,5, добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 20 часов.
Клетки извлекали из культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл 0,1 М Трис-HCl-буфера, содержащего 1% глюкозу. Соединение (VI) добавляли к полученной клеточной суспензии до конечной концентрации 100 м.д. и инкубировали при встряхивании при 30°С. В 0 часов и на следующий день после начала встряхивания 2 мл этой клеточной суспензии фракционировали. Пятьдесят микролитров (50 мкл) 2 н. HCl добавляли к каждой фракции и их экстрагировали 2 мл этилацетата. Полученные этилацетатные слои анализировали с помощью ВЭЖХ при условии реакции 1. По сравнению с концентрацией соединения (VI), детектируемого из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, концентрация соединения (VI), детектируемого из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания, была более низкой. Кроме того, пик, который не детектировался из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, детектировали из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания. Проводили масс-спектрометрию соединения, содержащегося в указанном пике. Масса соединения, содержащегося в указанном пике, была на 14 меньше, чем масса соединения (VI).
(7) Преобразование соединения (VIII) данным белком (А1)
За исключением использования соединения (VIII) вместо соединения (VI), проводили в соответствии со способом, описанным в примере 41(6), культивирование E. coli JM109/pKSN657F, приготовление раствора клеточной суспензии, инкубирование при встряхивании раствора клеточной суспензии, к которой добавляли соединение (VIII), приготовление реагентов из раствора клеточной суспензии и ВЭЖХ-анализ этих реагентов. По сравнению с концентрацией соединения (VIII), детектируемого из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, концентрация соединения (VIII), детектируемого из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания, была более низкой. Кроме того, 2 пика, которые не детектировались из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, детектировали из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания. Проводили масс-спектрометрию соединений, содержащихся в указанных пиках. Масса соединения, содержащегося в одном из указанных пиков, была на 14 меньше, а масса соединения, содержащегося в другом пике, была на 28 меньше, чем масса соединения (VIII).
(8) Преобразование соединения (Х) белком (А1) данного изобретения
За исключением использования соединения (Х) вместо соединения (VI), проводили в соответствии со способом, описанным в примере 41(6), культивирование E. coli JM109/pKSN657F, приготовление раствора клеточной суспензии, инкубирование при встряхивании раствора клеточной суспензии, к которому добавляли соединение (Х), приготовление реагентов из раствора клеточной суспензии и ВЭЖХ-анализ этих реагентов. По сравнению с концентрацией соединения (Х), детектируемого из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, концентрация соединения (Х), детектируемого из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания, была более низкой. Кроме того, 2 пика, которые не детектировались из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, детектировали из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания. Проводили масс-спектрометрию соединений, содержащихся в указанных пиках. Масса соединения, содержащегося в одном из указанных пиков, была на 40 меньше, а масса соединения, содержащегося в другом пике, была на 54 меньше, чем масса соединения (Х).
(9) Преобразование соединения (XI) белком (А1) данного изобретения
За исключением использования соединения (XI) вместо соединения (VI), проводили в соответствии со способом, описанным в примере 41(6), культивирование E. coli JM109/pKSN657F, приготовление раствора клеточной суспензии, инкубирование при встряхивании раствора клеточной суспензии, к которой добавляли соединение (XI), приготовление реагентов из раствора клеточной суспензии и ВЭЖХ-анализ этих реагентов. По сравнению с концентрацией соединения (XI), детектируемого из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, концентрация соединения (XI), детектируемого из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания, была более низкой. Кроме того, 2 пика, которые не детектировались из этилацетатного слоя, полученного из клеточной суспензии в 0 часов после начала встряхивания, детектировали из этилацетатного слоя, полученного из клеточной суспензии на следующий день после начала встряхивания. Проводили масс-спектрометрию соединений, содержащихся в указанных пиках. Масса соединения, содержащегося в одном из указанных пиков, была на 14 меньше, а масса соединения, содержащегося в другом пике, была на 16 меньше, чем масса соединения (XI).
Пример 42. Преобразование соединений белком (А11) данного изобретения
(1) Преобразование соединения (Х) белком (А11) данного изобретения
E. coli JM109/pKSN849АF и E. coli JM109/pKSN2 культивировали в течение ночи при 37°С в 3 мл среды ТВ, содержащей 50 мкг/мл ампициллина. Миллилитр (1 мл) полученной культуральной среды переносили в 100 мл среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26°С. Когда OD660 достигала 0,5, добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и культивирование продолжали. Спустя 30 минут после этого добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали в течение 18 часов.
Клетки извлекали из культуральной среды, промывали 0,1 М Трис-HCl-буфером (рН 7,5) и суспендировали в 10 мл 0,1 М Трис-HCl-буфера, содержащего 1% глюкозу. Соединение (Х) добавляли к полученной клеточной суспензии до конечной концентрации 25 м.д. и инкубировали при встряхивании при 30°С. В 0 часов и через 4 дня после начала встряхивания 2 мл этой клеточной суспензии фракционировали. Пятьдесят микролитров (50 мкл) 2 н. HCl добавляли к каждой фракции и их экстрагировали 2 мл этилацетата. Полученные этилацетатные слои анализировали с помощью ВЭЖХ при условии реакции 1. По сравнению с концентрацией соединения (Х), детектируемого из этилацетатного слоя, полученного из клеточной суспензии JM109/pKSN2, концентрация соединения (Х), детектируемого из этилацетатного слоя, полученного из клеточной суспензии JM109/pKSN849AF, была более низкой. Кроме того, 3 пика, которые не детектировались из этилацетатного слоя, полученного из клеточной суспензии JM109/pKSN2, детектировали из этилацетатного слоя, полученного из клеточной суспензии JM109/pKSN849AF. Из этих трех пиков, время элюции в ВЭЖХ 1 из пиков совпадало со временем элюции пика соединения, которое имеет массу, на 40 меньшую, чем соединение (Х), детектированного в примере 41(8). Далее, время элюции в ВЭЖХ другого пика совпадало со временем элюции пика соединения, которое имеет массу, на 54 меньшую, чем соединение (Х), детектированного в примере 41(8).
После сушки, соответственно, 1 мл этилацетатного слоя, полученного из вышеупомянутой клеточной суспензии JM109/pKSN2, и 1 мл этилацетатного слоя, полученного из вышеупомянутой клеточной суспензии JM109/pKSN849AF, остатки растворяли в 1 мл диметилсульфоксида (далее, раствор, полученный из этилацетатного слоя, полученного из JM109/pKSN849AF, называют «раствором для (Х)-преобразования (А11)»; далее, раствор, полученный из этилацетатного слоя, полученного из суспензии клеток JM109/pKSN2, называют «раствором (Х)-контроля (А11)»).
Смешивали 20 мкл 128-кратного разведения вышеупомянутого раствора для (X)-преобразования (А11) и 60 мкл фракции пластид. В затемненных условиях добавляли 20 мкл раствора субстрата РРО и выдерживали при 30°С в течение 1,5 часов. Далее, вместо указанных 20 мкл 128-кратного разведения раствора для (X)-преобразования (А11) готовили реакционный раствор, к которому добавляли 20 мкл 128-кратного разведения раствора (X)-контроля (А11), и добавляли раствор субстрата РРО и выдерживали таким же образом. Аналогично примеру 41(2), после выдерживания готовили каждый из реакционных растворов и подвергали их анализу обращенно-фазовой ВЭЖХ в условиях анализа 2, приведенных выше, для измерения количества PPIX. Количество PPIX в реакционном растворе, к которому добавляли раствор для (X)-преобразования (А11), было большим, чем количество PPIX в реакционном растворе, к которому добавляли раствор (X)-контроля (А11).
(2) Преобразование соединения (XII) белком (А11) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 32(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 32(2), называют «раствором для (XII)-преобразования (А11)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 32(2), называют «раствором (XII)-контроля (А11)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А11), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А11), была более низкой. Далее, из раствора для (XII)-преобразования (А11) был детектирован пик, который не детектировался из раствора (XII)-контроля (А11). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором эта масса на 14 меньше, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1), в примере 41(2).
(3) Преобразование соединения (XIII) белком данного изобретения (А11)
За исключением использования 20 мкл фракции супернатанта, полученной в примере 32(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 32(2), называют «раствором для (XIII)-преобразования (А11)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 32(2), называют «раствором (XIII)-контроля (А11)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А11), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А11), была более низкой. Далее, из раствора для (XIII)-преобразования (А11) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А11). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором эта масса на 14 меньше, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А11), в примере 41(3).
(4) Преобразование соединения (XVI) белком (А11) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 32(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(4). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 200 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 32(2), называют «раствором для (XVI)-преобразования (А11)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 32(2), называют «раствором (XVI)-контроля (А11)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XVI), детектируемого из раствора (XVI)-контроля (А11), концентрация соединения (XVI), детектируемого из раствора для (XVI)-преобразования (А11), была более низкой. Далее, из раствора для (XVI)-преобразования (А11) был детектирован пик, который не детектировался из раствора (XVI)-контроля (А11). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика в примере 41(4), который детектировался из раствора для (XVI)-преобразования (А11) и не детектировался в растворе (XVI)-контроля (А11).
(5) Преобразование соединения (XVII) белком (А11) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 32(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(5). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 200 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 32(2), называют «раствором для (XVII)-преобразования (А11)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 32(2), называют «раствором (XVII)-контроля (А11)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XVII), детектируемого из раствора (XVII)-контроля (А11), концентрация соединения (XVII), детектируемого из раствора для (XVII)-преобразования (А11), была более низкой. Далее, из раствора для (XVII)-преобразования (А11) был детектирован пик, который не детектировался из раствора (XVII)-контроля (А11). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика в примере 41(5), который детектировался из раствора для (XVII)-преобразования (А1) и не детектировался в растворе (XVII)-контроля (А1).
Пример 43. Преобразование соединений белками (А2), (А3), (А12), (А13), (А14) или (А15) данного изобретения или белком (А10) данного изобретения
(1) Преобразование соединения (XII) белком (А2) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 7(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 7(2), называют «раствором для (XII)-преобразования (А2)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 7(2), называют «раствором (XII)-контроля (А2)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А2), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А2), была более низкой. Далее, из раствора для (XII)-преобразования (А2) был детектирован пик, который не детектировался из раствора (XII)-контроля (А2). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(2) Преобразование соединения (XII) белком (А3) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 12(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 12(2), называют «раствором для (XII)-преобразования (А3)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 7(2), называют «раствором (XII)-контроля (А3)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А3), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А3), была более низкой. Далее, из раствора для (XII)-преобразования (А3) был детектирован пик, который не детектировался из раствора (XII)-контроля (А3). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(3) Преобразование соединения (XII) данным белком (А10)
За исключением использования 20 мкл фракции супернатанта, полученной в примере 10(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 10(2), называют «раствором для (XII)-преобразования (А10)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 12(3), называют «раствором (XII)-контроля (А10)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А10), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А10), была более низкой. Далее, из раствора для (XII)-преобразования (А10) был детектирован пик, который не детектировался из раствора (XII)-контроля (А10). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(4) Преобразование соединения (XII) белком (А12) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 34(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 34(2), называют «раствором для (XII)-преобразования (А12)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 34(2), называют «раствором (XII)-контроля (А12)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А12), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А12), была более низкой. Далее, из раствора для (XII)-преобразования (А12) был детектирован пик, который не детектировался из раствора (XII)-контроля (А12). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(5) Преобразование соединения (XII) белком (А13) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 36(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 7(2), называют «раствором для (XII)-преобразования (А13)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 36(2), называют «раствором (XII)-контроля (А13)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А13), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А13), была более низкой. Далее, из раствора для (XII)-преобразования (А13) был детектирован пик, который не детектировался из раствора (XII)-контроля (А13). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(6) Преобразование соединения (XII) белком (А14) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 38(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 38(2), называют «раствором для (XII)-преобразования (А14)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 38(2), называют «раствором (XII)-контроля (А14)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А14), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А14), была более низкой. Далее, из раствора для (XII)-преобразования (А14) был детектирован пик, который не детектировался из раствора (XII)-контроля (А14). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(7) Преобразование соединения (XII) белком (А15) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 40(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(2). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл 50 мМ калий-фосфатного буфера (рН 7,0). Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 40(2), называют «раствором для (XII)-преобразования (А15)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 40(2), называют «раствором (XII)-контроля (А15)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А15), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А15), была более низкой. Далее, из раствора для (XII)-преобразования (А15) был детектирован пик, который не детектировался из раствора (XII)-контроля (А15). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектируемого из раствора для (XII)-преобразования (А1) в примере 41(2).
(8) Метаболизм соединения (XIII) белком (А2) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 7(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 7(2), называют «раствором для (XIII)-преобразования (А2)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 7(2), называют «раствором (XIII)-контроля (А2)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А2), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А2), была более низкой. Далее, из раствора для (XIII)-преобразования (А2) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А2). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(9) Преобразование соединения (XIII) белком (А3) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 12(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 12(2), называют «раствором для (XIII)-преобразования (А3)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 12(2), называют «раствором (XIII)-контроля (А3)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А3), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А3), была более низкой. Далее, из раствора для (XIII)-преобразования (А3) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А3). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(10) Преобразование соединения (XIII) данным белком (А10)
За исключением использования 20 мкл фракции супернатанта, полученной в примере 10(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 10(2), называют «раствором для (XIII)-преобразования (А10)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 10(2), называют «раствором (XIII)-контроля (А10)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А10), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А10), была более низкой. Далее, из раствора для (XIII)-преобразования (А10) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А10). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(11) Преобразование соединения (XIII) белком (А12) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 34(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 34(2), называют «раствором для (XIII)-преобразования (А12)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 34(2), называют «раствором (XIII)-контроля (А12)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А12), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А12), была более низкой. Далее, из раствора для (XIII)-преобразования (А12) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А12). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(12) Преобразование соединения (XIII) белком (А13) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 36(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 36(2), называют «раствором для (XIII)-преобразования (А13)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 36(2), называют «раствором (XIII)-контроля (А13)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А13), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А13), была более низкой. Далее, из раствора для (XIII)-преобразования (А13) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А13). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(13) Преобразование соединения (XIII) белком (А14) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 38(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 38(2), называют «раствором для (XIII)-преобразования (А14)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 38(2), называют «раствором (XIII)-контроля (А14)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А14), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А14), была более низкой. Далее, из раствора для (XIII)-преобразования (А14) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А14). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
(14) Преобразование соединения (XIII) белком (А15) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 40(2), вместо 20 мкл фракции супернатанта, полученной в примере 4(2), реакционные растворы получали и выдерживали подобно способу, описанному в примере 41(3). Подобно примеру 41(2), каждый из этих реакционных растворов после выдерживания экстрагировали этилацетатом и полученные остатки растворяли в 100 мкл диметилсульфоксида. Полученные растворы (далее раствор, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 40(2), называют «раствором для (XIII)-преобразования (А15)»; далее раствор, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 40(2), называют «раствором (XIII)-контроля (А15)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А15), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А15), была более низкой. Далее, из раствора для (XIII)-преобразования (А15) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А15). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А1) в примере 41(3).
Пример 44. Получение антитела (А) данного изобретения, узнающего белок (А1) данного изобретения (далее называемого антителом (А1) данного изобретения»)
(1) Получение экстракта E. coli, экспрессирующей белок (А1) данного изобретения
В соответствии со способом, описанным в примере 4(2), E. coli JM109/pKSN657F, которая экспрессирует белок (А1) данного изобретения, предварительно культивировали в течение ночи и затем культивировали в 1 л среды ТВ, содержащей 50 мкг/мл ампициллина. После извлечения и разрушения клеток получали фракции супернатантов (экстракт E. coli pKSN657F) из полученного раствора клеточного лизата.
(2) Очистка белка (А1) данного изобретения
Белок (А1) данного изобретения очищали в соответствии со способом, описанным в примере 2(4) подверганием фракции супернатанта, полученной в примере 44(1) (экстракта E. coli pKSN657F), поочередно хроматографии на колонке Hiload HiLoad26/10 Q Sepharose HP и затем на колонке СНТ10-1 типа I Bio-Scale Ceramic Hydroxyapatite. Очищенные фракции анализировали электрофорезом на 10-20% ДСН-ПААГ для подтверждения того, что эти фракции были фракциями только белка (А1) данного изобретения.
(3) Получение антитела (А1) данного изобретения
Белок (А1) данного изобретения, полученный в примере 44(2), растворяли в 0,05 М калий-фосфатном буфере (рН 7,0) таким образом, что его концентрация была равна 1 мг/мл. Добавляли 40 мкл адъювантной системы RAS (MPL (монофосфориллипид А) + TDM (синтетический дикориномиколат трегалозы) + CWS (скелет клеточной стенки) (Sigma Company)), уже проинкубированной при 42-43°С, и хорошо перемешивали с 2 мл полученного раствора. Полученную смесь вводили, соответственно, Ново-Зеландским белым кроликам (самкам, 14-недельного возраста, со средним весом 2,4 кг) в дозе 1 мл на одного кролика. Таким образом, инъецировали 100 мкл подкожно в 10 местоположениях на спинке. Приблизительно Ѕ количества первого введения вводили после 3 недель и после 5 недель. Во время этого времени титр антител измеряли взятием проб крови из ушной вены кролика. Поскольку титр антител увеличивался после третьего введения, кровь извлекали из шеи иммунизированного кролика через 2 недели после третьего введения. Полученную кровь добавляли в пробирку Separapit (Sekisui Chemical Company), инкубировали при 37°С в течение 2 часов и затем центрифугировали (3000 об/мин, 20 минут, при комнатной температуре). Антисыворотку (содержащую антитело (А1) данного изобретения)) получали извлечением супернатанта.
Пример 45. Детектирование данного белка антителом (А1) данного изобретения и детектирование экспрессии клетками данного белка
Иммуноблот-анализ проводили с использованием антитела (А1) данного изобретения, полученного в примере 44, с каждым из экстрактов E. coli. Проводили электрофорез в ДСН-полиакриламиде (40 мА, 1 час): экстракта E. coli pKSN657F, полученного в примере 4(2) (содержащего приблизительно 0,5 пмоль белка (А1) данного изобретения, содержащего приблизительно 0,78 мг белка); экстракта E. coli pKSN2, полученного в примере 4(2) (содержащего приблизительно 0,78 мг белка); экстракта E. coli pKSN923F, полученного в примере 7(2) (содержащего приблизительно 2 пмоль белка (А2) данного изобретения); экстракта E. coli pKSN671F, полученного в примере 12(2) (содержащего приблизительно 2 пмоль белка (А3) данного изобретения); экстракта E. coli pKSN646F, полученного в примере 27(2) (содержащего приблизительно 2 пмоль белка (А4) данного изобретения); экстракта E. coli pKSN11796F, полученного в примере 10(2) (содержащего приблизительно 2 пмоль белка (А10) данного изобретения); экстракта E. coli pKSNSCA, полученного в примере 14(2) (содержащего приблизительно 2 пмоль белка (А9) данного изобретения); экстракта E. coli pKSN849АF, полученного в примере 32(2) (содержащего приблизительно 2 пмоль белка (А11) данного изобретения); экстракта E. coli pKSN1618F, полученного в примере 34(2) (содержащего приблизительно 2 пмоль белка (А12) данного изобретения); экстракта E. coli pKSN474F, полученного в примере 36(2) (содержащего приблизительно 2 пмоль белка (А13) данного изобретения); экстракта E. coli pKSN1491АF, полученного в примере 38(2) (содержащего приблизительно 2 пмоль белка (А14) данного изобретения) и экстракта E. coli pKSN1555АF, полученного в примере 40(2) (содержащего приблизительно 2 пмоль белка (А15) данного изобретения). PVDF-мембрану помещали на этот гель. Белки в геле переносились на PVDF-мембрану с помощью блоттинг-устройства BioRad при 4°С, 30 В в течение 2 часов в условиях пропитки буфером для переноса (25 мМ Трис, 192 мМ глицин, 10% метанол). После промывания раствором TBS + Твин 20 (50 мМ Трис-HCl (рН 7,5), 200 мМ NaCl, 0,05% Твин 20) полученную PVDF-мембрану инкубировали в течение 30 минут в растворе TBS + Твин 20, содержащем 3% БСА, и затем использовали для реакции с вышеописанной антисывороткой, разведенной в 30000 раз, в течение 30 минут в растворе TBS + Твин 20, содержащем 3% БСА. После этой реакции PVDF-мембрану промывали дважды раствором TBS + Твин 20. Затем PVDF-мембрану использовали для реакции в растворе TBS + Твин 20, содержащем 3% БСА, в течение 30 минут с 3000-кратным разведением козьей антисыворотки против кроличьего IgG, меченной щелочной фосфатазой (Santa Cruz Biotechnology Company). После реакции PVDF-мембрану промывали дважды раствором TBS + Твин 20 и пропитывали в растворе NBT-BCIP (Sigma Company). Детектировали окрашивание полосы, соответствующей каждому из белков данного изобретения (А1), (А2), (А3), (А4), (А11), (А12), (А13), (А14) и (А15), а также белков (А9) и (А10) данного изобретения. Не детектировали окрашивание полосы с реагентом экстракта E. coli pKSN2 (содержащим приблизительно 0,78 мг белка), полученным в примере 4(2).
Пример 46. Получение и экспрессия ДНК (А1) данного изобретения, в которой использование кодонов было приспособлено для экспрессии в сое (далее называемой “ДНК (А1)S данного изобретения»))
(1) Получение ДНК (А1)S данного изобретения
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:192, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:213. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:191, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:212. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:190, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:211. Полученный реакционный раствор был назван реакционным раствором 1.
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:195, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:210. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:194, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:209. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:193, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:208. Полученный реакционный раствор был назван реакционным раствором 2.
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:198, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:207. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:197, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:206. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:196, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:205. Полученный реакционный раствор был назван реакционным раствором 3.
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:201, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:204. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:200, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:203. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:199, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:202. Полученный реакционный раствор был назван реакционным раствором 4.
Реакционные растворы 1-4, полученные таким образом, смешивали. ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве матрицы аликвоты этой смеси и с использованием праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:190, и праймера, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:202. Нуклеотидную последовательность амплифицированной ДНК подтверждали. Получали ДНК, имеющую последовательность, в которой нуклеотидная последовательность 5'-cat-3' присоединена «слева» от 5'-конца, а нуклеотидная последовательность 5'-aagctt-3' присоединена «справа» от 3'-конца нуклеотидной последовательности, показанной в SEQ ID NO:214.
Использование кодонов ДНК (А1) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:6 (GC-содержание 70,58%), показано в таблице 22 и таблице 23. Использование кодонов сои (GC-содержание 46,12%, база данных использования кодонов, опубликованная Kazusa DNA Research Institute (http//:www.kazusa.or.jp/codon)) показано в таблице 24 и таблице 25. Использование кодонов ДНК (А1) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:214 (GC-содержание 51,59%), показано в таблице 26 и таблице 27.
(2) Получение трансформированной E. coli, имеющей белок (А1)S данного изобретения
ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:214, полученную в примере 46(1), расщепляли рестриктазами NdeI и HindIII. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, в которой ДНК, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:214, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой «pKSN657soy»). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN657soy.
(3) Экспрессия белка (А1) данного изобретения в E. coli и выделение указанного белка
Аналогично примеру 4(2), культивировали каждую из E. coli JM109/pKSN657soy, полученной в примере 46(2), и E. coli JM109/pKSN657, полученной в примере 4(1). Клетки извлекали. Получали растворы клеточных лизатов. По способу, описанному в примере 4(2), получали фракции супернатантов из этих растворов клеточных лизатов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN657soy, называют “экстрактом E. coli pKSN657soy”, а фракцию супернатанта, полученную из E. coli JM109/pKSN657, называют “экстрактом E. coli pKSN657”). Количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN657soy, сравнивали с количеством Р450 на количество белка, содержащимся в экстракте E. coli pKSN657, и оно было более высоким, чем количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN657.
Пример 47. Введение ДНК (А1)S данного изобретения в растение
(1) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А1)S данного изобретения, для прямого введения - часть 1
Плазмиду, содержащую химерную ДНК, в которой ДНК (А1)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах, конструировали в качестве плазмиды для введения ДНК (А1)S данного изобретения в растение способом с использованием ружья для частиц.
Сначала ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:214, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы pKSN657soy, полученной в примере 46(2), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:394, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:395. В ПЦР использовали KOD-plus (Toyobo Company). ПЦР проводили после поддержания 94°С в течение 2 минут следующим образом: 30 циклов, где каждый цикл включал поддержание 94°С в течение 30 секунд, затем 50°С в течение 30 секунд и затем 68°С в течение 60 секунд; и конечное поддержание 68°С в течение 30 секунд. Амплифицированную ДНК выделяли и очищали с использованием MagExtractor-PCR & Gel-Clean up (Toyobo Company) проведением процедур в соответствии с прилагаемым руководством. После расщепления очищенной ДНК рестриктазами EcoТ22I и SacI, ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:214, выделяли. После расщепления плазмиды pUCrSt657, полученной в примере 16(2), рестриктазами EcoТ22I и SacI, выделяли ДНК размером приблизительно 2,9 т.п.н., имеющую нуклеотидную последовательность, происходящую из pUC19, и последовательность, кодирующую хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack). Полученную ДНК и вышеупомянутую ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:214, лигировали с получением pUCrSt657soy (фиг. 48), содержащей химерную ДНК, в которой ДНК (А1)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Полученную плазмиду pUCrSt657soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:214. Указанную ДНК встраивали между сайтом рестриктазы BglII и сайтом рестриктазы SacI плазмиды pNdG6-ΔТ, полученной в примере 16(2), с получением плазмиды pSUM-NdG6-rSt-657soy (фиг. 49), где промотор CR16G6 присоединен после химерной ДНК, в которой ДНК (А1)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в отобранных ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt-657soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:214.
(2) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А1)S данного изобретения, для прямого введения - часть 2
Конструировали плазмиду для введения ДНК (А1)S данного изобретения в растение способом с использованием ружья для частиц. Эта плазмида содержала химерную ДНК, в которой ДНК (А1)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Сначала ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:214, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы pKSN657soy, полученной в примере 46(2), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:395, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:396. В ПЦР использовали KOD-plus (Toyobo Company). ПЦР проводили после поддержания 94°С в течение 2 минут следующим образом: 25 циклов, где каждый цикл включал поддержание 94°С в течение 30 секунд, затем 46°С в течение 30 секунд и затем 68°С в течение 60 секунд; и конечное поддержание 68°С в течение 3 минут. Амплифицированную ДНК выделяли и очищали с использованием MagExtractor-PCR & Gel-Clean up (Toyobo Company) проведением процедур в соответствии с прилагаемым руководством. После расщепления очищенной ДНК рестриктазой SacI, ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:214, выделяли.
Плазмиду pKFrSt12-657, полученную в примере (16(3), расщепляли рестриктазой BspHI. Затем эту ДНК затупляли и 5'-конец дефосфорилировали с использованием набора TaKaRa BKL Kit (Takara Shuzo Company) в соответствии с прилагаемым руководством. Затем, после расщепления ДНК рестриктазой SacI ДНК, полученную из плазмиды pKFrSt12, выделяли. Указанную ДНК лигировали с ДНК, которую расщепляли SacI и которая содержит нуклеотидную последовательность, показанную в SEQ ID NO:214, с получением плазмиды pKFrSt12-657soy (фиг. 50), содержащей химерную ДНК, в которой ДНК (А1)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах.
Полученную плазмиду pKFrSt12-657soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:214. Указанную ДНК встраивали между сайтом рестриктазы BglII и сайтом рестриктазы SacI плазмиды pNdG6-ΔТ с получением плазмиды pSUM-NdG6-rSt12-657soy (фиг. 51), где промотор CR16G6 присоединен после химерной ДНК, в которой указанная ДНК присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt12-657soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:214.
(3) Введение ДНК (А)S данного изобретения в сою
Глобулярные зародыши сои (сорта: Fayette и Jack) получали в соответствии со способом, описанным в примере 17(1), за исключением замены источника витаминов среды MS источником витаминов среды В5 (O.L. Gamborg et al., Exp. Cell Res. (1986) 50 p 151).
Полученный глобулярный зародыш пересаживали в свежую среду для выращивания соматических зародышей и культивировали в течение 2-3 дней. В соответствии со способом, описанным в примере 17(2), плазмиду pSUM-NdG6-rSt-657soy, сконструированную в примере 47(1), или плазмиду pSUM-NdG6-rSt12-657soy, сконструированную в примере 47(2), вводили в указанные глобулярные зародыши.
(4) Отбор соматического зародыша с гигромицином
Отбор с использованием гигромицина глобулярного зародыша после введения гена, полученного в примере 47(3), проводили в соответствии со способом, описанным в примере 17(3), за исключением замены источника витаминов среды MS источником витаминов среды В5. Однако после второй пересадки использовали среду, к которой был добавлен 0,2 (мас./об.)% Гельрит, или жидкую среду, к которой не добавляли Гельрит, в качестве среды для отбора соматического зародыша. В случае жидкой среды, культивирование проводили при 90 осторожных оборотов в минуту.
(5) Отбор соматического зародыша с соединением (II)
Отбор с использованием соединения (II) глобулярного зародыша после введения гена, полученного в примере 47(3), проводили в соответствии со способом, описанным в примере 17(4), за исключением замены источника витаминов среды MS источником витаминов среды В5.
(6) Регенерация растения из соматического зародыша, акклимация и культивирование растения
В соответствии со способом, описанным в примере 17(5), регенерацию растения проводили из глобулярных зародышей, отобранных в примере 47(4) или 47(5). Однако концентрацию агара в среде для развития доводили до 0,8 (мас./об.)% или 1,0 (мас./об.)%. Далее, источник витаминов среды MS заменяли источником витаминов среды В5.
Растение с корнями и развитыми листьями подвергают акклимации и культивированию в соответствии со способом, описанным в примере 17(6), и собирают массу растения.
(7) Оценка устойчивости к гербицидному соединению (II)
Степень устойчивости против соединения (II) регенерированного растения, полученного в примере 47(6), оценивали в соответствии со способом, описанным в примере 17(4).
(8) Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А1)S данного изобретения, для введения с использованием Agrobacterium
Конструировали плазмиду для введения ДНК (А1)S данного изобретения в растение способом с использованием Agrobacterium. Плазмиду pSUM-NdG6-rSt-657soy расщепляли рестриктазой NotI с получением химерной ДНК, в которой ДНК (А1)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах. Указанную ДНК встраивали в сайт рестриктазы NotI указанного выше бинарного плазмидного вектора pBI121S, полученного в примере 18, с получением плазмиды pBI-NdG6-rSt-657soy (фиг. 52). Далее, плазмиду pSUM-NdG6-rSt12-657soy расщепляли рестриктазой NotI с выделением химерной ДНК, в которой ДНК (А1)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Эту ДНК встраивали в сайт рестриктазы NotI указанного выше бинарного плазмидного вектора pBI121S с получением плазмиды pBI-NdG6-rSt12-657soy (фиг. 53).
(9) Введение ДНК (А1)S данного изобретения в табак
ДНК (А1)S данного изобретения вводили в табак способом с применением Agrobacterium, с использованием pBI-NdG6-rSt-657soy и pBI-NdG6-rSt12-657soy, полученных в примере 47(8).
Сначала, в соответствии со способом, описанным в примере 19, каждую из плазмид pBI-NdG6-rSt-657soy и pBI-NdG6-rSt12-657soy вводили в Agrobacterium tumefaciens LBA4404 (Clontech Company). Выделяли трансгенную агробактерию, несущую pBI-NdG6-rSt-657soy или pBI-NdG6-rSt12-657soy.
Затем, за исключением культивирования в течение ночи трансгенных агробактерий, несущих указанную выше плазмиду, при 30°С в жидкой среде LB, содержащей 25 мг/л канамицин, указанные агробактерии использовали для введения генов в табак в соответствии со способом, описанным в примере 19. Получали, соответственно, трансгенные растения табака, которые включали район Т-ДНК pBI-NdG6-rSt-657soy или pBI-NdG6-rSt12-657soy.
(10) Оценка устойчивости с использованием кусочка листа трансгенного табака, имеющего ДНК (А1)S данного изобретения
Листья собирали из 35 трансгенных растений табака, полученных в примере 47(9). Каждый лист делили на кусочки, причем каждый кусочек имел ширину 5-7 мм. Кусочки листа высаживали на среду с агаром МС, содержащую 0, 0,05, 0,1 или 0,2 мг/л соединения (II), и культивировали на свету при комнатной температуре. На 11-й день культивирования наблюдали гербицидное повреждение каждого из этих кусочков листа. Затем кусочки листа высаживали на среды с агаром МС, содержащие 0, 0,01, 0,02, 0,05 или 0,1 мг/л соединения (XII), и культивировали на свету при комнатной температуре. На 7-й день культивирования наблюдали гербицидное повреждение каждого из кусочков листа. В качестве контроля 20 кусочков листа табака, с которым не проводили генетического введения (далее называемого «табаком дикого типа»), использовали при каждой концентрации. Среднюю оценку (балл) для каждой группы определяли с принятием оценки 1 балл для кусочка листа, который непрерывно рос, оценки 0,5 балла для наполовину завядшего кусочка листа, в котором наблюдали химическое повреждение, и оценки 0 баллов для кусочка листа, который становился белым и завядал. Кусочки листьев табака, в которые была введена ДНК (А1)S данного изобретения (район Т-ДНК плазмиды pBI-NdG6-rSt-657soy или pBI-NdG6-rSt12-657soy), давали более высокий балл, чем табак дикого типа с каждым из соединений (II) и (XII).
Пример 48. Получение ДНК (А16) данного изобретения
(1) Получение хромосомной ДНК Streptomyces ornatus IFO 13069t
Хромосомную ДНК Streptomyces ornatus IFO 13069t получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А16) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces ornatus IFO 13069t, полученной в примере 48(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 343-1069 нуклеотидной последовательности, показанной в SEQ ID NO:225.
Далее, хромосомную ДНК, полученную в примере 48(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:265, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:266, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-501 нуклеотидной последовательности, показанной в SEQ ID NO:235.
Далее, хромосомную ДНК, полученную в примере 48(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:267, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:268, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1044-1454 нуклеотидной последовательности, показанной в SEQ ID NO:235.
(3) Анализ последовательности ДНК (А16) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:235, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 48(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:225), состоящую из 1251 нуклеотидов (включая стоп-кодон) и кодирующую 416 аминокислотных остатка (SEQ ID NO:215), и нуклеотидную последовательность (SEQ ID NO:225), состоящую из 198 нуклеотидов (включая стоп-кодон) и кодирующую 65 аминокислотных остатков (SEQ ID NO:245). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:215), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:225, равна 46013 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:245), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:255, равна 6768 Да.
Пример 49. Экспрессия ДНК (А16) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А16) данного изобретения
ПЦР проводили с использованием ПЦР-системы GeneAmp High Fidelity (Applied Biosystems Japan Company) и с использованием в качестве матрицы хромосомной ДНК, полученной из Streptomyces ornatus IFO 13069t в примере 48(1). В качестве праймеров использовали пару из олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:269, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:286. Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих 2 праймеров, доведенных до 200 нМ, 50 нг вышеуказанной хромосомной ДНК, 5,0 мкл смеси dNTP (смеси 2,0 мМ каждого из 4 типов dNTP; Clontech Company), 5,0 мкл 10х буфера (содержащего MgCl2) и 0,5 мкл смеси ферментов GeneAmp HF и добавлением дистиллированной воды. Условия реакции ПЦР были следующими: после поддержания 97°С в течение 1 минуты, повторение 10 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 90 секунд; затем проведение 15 циклов, где каждый цикл включал поддержание 97°С в течение 15 секунд, затем 60°С в течение 30 секунд и затем 72°С в течение 90 секунд (где 20 секунд добавляли для поддержания 72°С для каждого цикла); и затем поддержание при 72°С в течение 7 минут. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59, 267, 286 и 288. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:235, была названа pCR452F. Подобно примеру 32(1), pCR452F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:235, в которой ДНК, кодирующая белок (А16) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN452F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN452F.
(2) Экспрессия белка (А16) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN452F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN452F, называют “экстрактом E. coli pKSN452F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 49(2) (экстракт E. coli pKSN452F или экстракт E. coli pKSN2). Реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN452F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 50. Получение ДНК (А17) данного изобретения
(1) Получение хромосомной ДНК Streptomyces griseus ATCC 10137
Хромосомную ДНК Streptomyces griseus ATCC 10137 получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А17) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces griseus ATCC 10137, полученной в примере 50(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 343-1069 нуклеотидной последовательности, показанной в SEQ ID NO:226.
Далее, хромосомную ДНК, полученную в примере 50(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:270, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:271, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-361 нуклеотидной последовательности, показанной в SEQ ID NO:236.
Далее, хромосомную ДНК, полученную в примере 50(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:272, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:273, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1035-1454 нуклеотидной последовательности, показанной в SEQ ID NO:236.
(3) Анализ последовательности ДНК (А17) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:236, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 50(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:226), состоящую из 1251 нуклеотидов (включая стоп-кодон) и кодирующую 416 аминокислотных остатка (SEQ ID NO:216), и нуклеотидную последовательность (SEQ ID NO:226), состоящую из 198 нуклеотидов (включая стоп-кодон) и кодирующую 65 аминокислотных остатков (SEQ ID NO:246). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:216), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:226, равна 46082 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:246), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:256, равна 6768 Да. Нуклеотидная последовательность, показанная в SEQ ID NO:256, является на 100% идентичной нуклеотидной последовательности, показанной в SEQ ID NO:255. Аминокислотная последовательность, показанная в SEQ ID NO:246, является на 100% идентичной аминокислотной последовательности, показанной в SEQ ID NO:245.
Пример 51. Экспрессия ДНК (А17) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А17) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces griseus ATCC 10137 в примере 50(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:274, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:275. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59, 274, 276 и 277. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:236, была названа pCR608F. Подобно примеру 32(1), pCR608F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:236, в которой ДНК, кодирующая белок (А17) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN608F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN608F.
(2) Экспрессия белка (А17) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN608F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN608F, называют “экстрактом E. coli pKSN608F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 51(2) (экстракт E. coli pKSN608F или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN608F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 52. Получение ДНК (А18) данного изобретения
(1) Получение хромосомной ДНК Streptomyces achromogenes IFO 12735
Хромосомную ДНК Streptomyces achromogenes IFO 12735 получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А18) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces achromogenes IFO 12735, полученной в примере 52(1), и с использованием пары 17 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 526-1048 нуклеотидной последовательности, показанной в SEQ ID NO:227.
Далее, хромосомную ДНК, полученную в примере 52(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:278, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:279, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-361 нуклеотидной последовательности, показанной в SEQ ID NO:237.
Далее, хромосомную ДНК, полученную в примере 52(1), расщепляли рестриктазой BalI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:163, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:164, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 983-1449 нуклеотидной последовательности, показанной в SEQ ID NO:237.
(3) Анализ последовательности ДНК (А18) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:237, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 52(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:227), состоящую из 1230 нуклеотидов (включая стоп-кодон) и кодирующую 409 аминокислотных остатков (SEQ ID NO:217), и нуклеотидную последовательность (SEQ ID NO:257), состоящую из 207 нуклеотидов (включая стоп-кодон) и кодирующую 68 аминокислотных остатков (SEQ ID NO:247). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:217), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:227, равна 45099 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:247), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:257, равна 7193 Да.
Пример 53. Экспрессия ДНК (А18) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А18) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces achromogenes IFO 12735 в примере 52(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:183, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:280. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68, 163, 279 и 281. На основании полученных результатов, плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:237, была названа pCR646ВF. Подобно примеру 32(1), pCR646ВF расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:237, в которой ДНК, кодирующая белок (А18) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN646ВF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN646ВF.
(2) Экспрессия белка (А18) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2), культивировали каждую из E. coli JM109/pKSN646ВF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN646ВF, называют “экстрактом E. coli pKSN646ВF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 53(2) (экстракт E. coli pKSN646ВF или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN646ВF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 54. Получение ДНК (А19) данного изобретения
(1) Получение хромосомной ДНК Streptomyces griseus IFO 13849T
Хромосомную ДНК Streptomyces griseus IFO 13849T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А19) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces griseus IFO 13849T, полученной в примере 54(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 343-1069 нуклеотидной последовательности, показанной в SEQ ID NO:228.
Далее, хромосомную ДНК, полученную в примере 54(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:282, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:283, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-358 нуклеотидной последовательности, показанной в SEQ ID NO:238.
Далее, хромосомную ДНК, полученную в примере 54(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:284, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:285, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1005-1454 нуклеотидной последовательности, показанной в SEQ ID NO:238.
(3) Анализ последовательности ДНК (А19) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:238, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 54(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:228), состоящую из 1251 нуклеотидов (включая стоп-кодон) и кодирующую 416 аминокислотных остатков (SEQ ID NO:218), и нуклеотидную последовательность (SEQ ID NO:258), состоящую из 156 нуклеотидов (включая стоп-кодон) и кодирующую 51 аминокислотный остаток (SEQ ID NO:248). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:218), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:228, равна 45903 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:248), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:258, равна 5175 Да.
Пример 55. Экспрессия ДНК (А19) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А19) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces griseus IFO 13849T в примере 54(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:286, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:287. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59, 284, 286 и 288. На основании полученных результатов, плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:238, была названа pCR1502F. Подобно примеру 32(1), pCR1502F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:238, в которой ДНК, кодирующая белок (А19) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1502F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1502F.
(2) Экспрессия белка (А19) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1502F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1502F, называют “экстрактом E. coli pKSN1502F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 55(2) (экстракт E. coli pKSN1502F или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1502F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 56. Получение ДНК (А20) данного изобретения
(1) Получение хромосомной ДНК Streptomyces lanatus IFO 12787T
Хромосомную ДНК Streptomyces lanatus IFO 12787T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А20) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces lanatus IFO 12787T, полученной в примере 56(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 304-1036 нуклеотидной последовательности, показанной в SEQ ID NO:229.
Далее, хромосомную ДНК, полученную в примере 56(1), расщепляли рестриктазой PmacI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:278, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:289, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-318 нуклеотидной последовательности, показанной в SEQ ID NO:239.
Далее, хромосомную ДНК, полученную в примере 56(1), расщепляли рестриктазой StuI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:290, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:291, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 969-1461 нуклеотидной последовательности, показанной в SEQ ID NO:239.
(3) Анализ последовательности ДНК (А20) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:239, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 56(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:229), состоящую из 1218 нуклеотидов (включая стоп-кодон) и кодирующую 405 аминокислотных остатков (SEQ ID NO:219), и нуклеотидную последовательность (SEQ ID NO:259), состоящую из 231 нуклеотида (включая стоп-кодон) и кодирующую 76 аминокислотных остатков (SEQ ID NO:249). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:219), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:229, равна 45071 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:249), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:259, равна 7816 Да.
Пример 57. Экспрессия ДНК (А20) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А20) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces lanatus IFO 12787T в примере 56(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:292, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:293. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68, 188, 278 и 290. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:239, была названа pCR1525F. Подобно примеру 32(1), pCR1525F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:239, в которой ДНК, кодирующая белок (А20) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1525F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1525F.
(2) Экспрессия белка (А20) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1525F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1525F, называют “экстрактом E. coli pKSN1525F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 57(2) (экстракт E. coli pKSN1525F или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1525F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 58. Получение ДНК (А21) данного изобретения
(1) Получение хромосомной ДНК Streptomyces misawanensis IFO 13855T
Хромосомную ДНК Streptomyces misawanensis IFO 13855T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А21) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces misawanensis IFO 13855T, полученной в примере 58(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 328-1063 нуклеотидной последовательности, показанной в SEQ ID NO:230.
Далее, хромосомную ДНК, полученную в примере 58(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:294, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:295, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-341 нуклеотидной последовательности, показанной в SEQ ID NO:240.
Далее, хромосомную ДНК, полученную в примере 58(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:296, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:297, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1017-1458 нуклеотидной последовательности, показанной в SEQ ID NO:240.
(3) Анализ последовательности ДНК (А21) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:240, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 58(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:230), состоящую из 1245 нуклеотидов (включая стоп-кодон) и кодирующую 414 аминокислотных остатков (SEQ ID NO:220), и нуклеотидную последовательность (SEQ ID NO:260), состоящую из 201 нуклеотида (включая стоп-кодон) и кодирующую 66 аминокислотных остатков (SEQ ID NO:250). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:220), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:230, равна 45806 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:250), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:260, равна 6712 Да.
Пример 59. Экспрессия ДНК (А21) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А21) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces misawanensis IFO 13855T в примере 58(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:298, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:299. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:57, 59, 296, 298 и 300. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:240, была названа pCR1543ВF. Подобно примеру 32(1), pCR1543ВF расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:240, в которой ДНК, кодирующая белок (А21) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1543ВF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1543ВF.
(2) Экспрессия белка (А21) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1543ВF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1543ВF, называют “экстрактом E. coli pKSN1543ВF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 59(2) (экстракт E. coli pKSN1543ВF или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1543ВF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 60. Получение ДНК (А22) данного изобретения
(1) Получение хромосомной ДНК Streptomyces pallidus IFO 13434T
Хромосомную ДНК Streptomyces pallidus IFO 13434T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А22) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces pallidus IFO 13434T, полученной в примере 60(1), и с использованием пары 15 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 483-1048 нуклеотидной последовательности, показанной в SEQ ID NO:231.
Далее, хромосомную ДНК, полученную в примере 60(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:301, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:302, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 68-516 нуклеотидной последовательности, показанной в SEQ ID NO:241.
Далее, хромосомную ДНК, полученную в примере 60(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:302, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:303, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-270 нуклеотидной последовательности, показанной в SEQ ID NO:241.
Далее, хромосомную ДНК, полученную в примере 60(1), расщепляли рестриктазой HincII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:304, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:305, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 982-1448 нуклеотидной последовательности, показанной в SEQ ID NO:241.
(3) Анализ последовательности ДНК (А22) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:241, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 60(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:231), состоящую из 1230 нуклеотидов (включая стоп-кодон) и кодирующую 409 аминокислотных остатков (SEQ ID NO:221), и нуклеотидную последовательность (SEQ ID NO:261), состоящую из 195 нуклеотидов (включая стоп-кодон) и кодирующую 64 аминокислотных остатка (SEQ ID NO:251). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:221), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:231, равна 45050 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:251), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:261, равна 6914 Да.
Пример 61. Экспрессия ДНК (А22) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А22) данного изобретения
ПЦР проводили подобно примеру 32(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces pallidus IFO 13434T в примере 60(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:306, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:307. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68 и 308. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:241, была названа pCR1558ВF. Подобно примеру 32(1), pCR1558ВF расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:241, в которой ДНК, кодирующая белок (А22) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1558ВF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1558ВF.
(2) Экспрессия белка (А22) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1558ВF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1558ВF, называют “экстрактом E. coli pKSN1558ВF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 61(2) (экстракт E. coli pKSN1558ВF или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1558ВF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 62. Получение ДНК (А23) данного изобретения
(1) Получение хромосомной ДНК Streptomyces roseorubens IFO 13682T
Хромосомную ДНК Streptomyces roseorubens IFO 13682T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А23) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces roseorubens IFO 13682T, полученной в примере 62(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 289-1015 нуклеотидной последовательности, показанной в SEQ ID NO:232.
Далее, хромосомную ДНК, полученную в примере 62(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:309, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:310, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-354 нуклеотидной последовательности, показанной в SEQ ID NO:242.
Далее, хромосомную ДНК, полученную в примере 62(1), расщепляли рестриктазой PvuII. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:311, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:312, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 966-1411 нуклеотидной последовательности, показанной в SEQ ID NO:242.
(3) Анализ последовательности ДНК (А23) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:242, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 62(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:232), состоящую из 1197 нуклеотидов (включая стоп-кодон) и кодирующую 398 аминокислотных остатков (SEQ ID NO:222), и нуклеотидную последовательность (SEQ ID NO:262), состоящую из 201 нуклеотида (включая стоп-кодон) и кодирующую 66 аминокислотных остатков (SEQ ID NO:252). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:222), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:232, равна 43624 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:252), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:262, равна 6797 Да.
Пример 63. Экспрессия ДНК (А23) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А23) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces roseorubens IFO 13682T в примере 62(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:313, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:314. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК анализировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68, 309, 311 и 315. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:242, была названа pCR1584F. Подобно примеру 32(1), pCR1584F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:242, в которой ДНК, кодирующая белок (А23) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1584F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1584F.
(2) Экспрессия белка (А23) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1584F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1584F, называют “экстрактом E. coli pKSN1584F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 63(2) (экстракт E. coli pKSN1584F или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1584F. В противоположность этому, такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 64. Получение ДНК (А24) данного изобретения
(1) Получение хромосомной ДНК Streptomyces rutgersensis IFO 15875T
Хромосомную ДНК Streptomyces rutgersensis IFO 15875T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А24) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces rutgersensis IFO 15875T, полученной в примере 64(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 322-1057 нуклеотидной последовательности, показанной в SEQ ID NO:233.
Далее, хромосомную ДНК, полученную в примере 64(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:316, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:317, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-384 нуклеотидной последовательности, показанной в SEQ ID NO:243.
Далее, хромосомную ДНК, полученную в примере 64(1), расщепляли рестриктазой NaeI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:318, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:319, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 992-1466 нуклеотидной последовательности, показанной в SEQ ID NO:243.
(3) Анализ последовательности ДНК (А24) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:243, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 64(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:233), состоящую из 1245 нуклеотидов (включая стоп-кодон) и кодирующую 414 аминокислотных остатков (SEQ ID NO:223), и нуклеотидную последовательность (SEQ ID NO:263), состоящую из 198 нуклеотидов (включая стоп-кодон) и кодирующую 65 аминокислотных остатков (SEQ ID NO:253). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:223), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:233, равна 45830 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:253), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:263, равна 7034 Да.
Пример 65. Экспрессия ДНК (А24) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А24) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces rutgersensis IFO 15875T в примере 64(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:320, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:321. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК секвенировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68 и 322. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:243, была названа pCR1589ВF. Подобно примеру 32(1), pCR1589ВF расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:243, в которой ДНК, кодирующая белок (А24) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1589ВF”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1589ВF.
(2) Экспрессия белка (А24) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1589ВF и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1589ВF, называют “экстрактом E. coli pKSN1589ВF”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 65(2) (экстракт E. coli pKSN1589ВF или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1589ВF. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 66. Получение ДНК (А25) данного изобретения
(1) Получение хромосомной ДНК Streptomyces steffisburgensis IFO 13446T
Хромосомную ДНК Streptomyces steffisburgensis IFO 13446T получали по способу, описанному в примере 31(1).
(2) Выделение ДНК, имеющей частичную нуклеотидную последовательность ДНК (А25) данного изобретения
ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces steffisburgensis IFO 13446T, полученной в примере 66(1), и с использованием пары 14 праймеров в соответствии со способом, описанным в примере 29. Подобно примеру 31(2), амплифицированную ДНК клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Ее нуклеотидную последовательность анализировали. В результате была получена нуклеотидная последовательность, состоящая из нуклеотидов 289-1015 нуклеотидной последовательности, показанной в SEQ ID NO:234.
Далее, хромосомную ДНК, полученную в примере 66(1), расщепляли рестриктазой SmaI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:323, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:324, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 1-303 нуклеотидной последовательности, показанной в SEQ ID NO:244.
Далее, хромосомную ДНК, полученную в примере 66(1), расщепляли рестриктазой PmacI. Библиотеку genome walker получали с использованием полученной ДНК в соответствии со способом, описанным в примере 26(3). ПЦР проводили в условиях, описанных в примере 26(3), с получением продуктов первой ПЦР, с использованием полученной библиотеки в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:311, и праймера АР1. Затем ПЦР проводили в условиях, описанных в примере 26(3), с использованием продуктов первой ПЦР в качестве матрицы и с использованием олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:325, и праймера АР2. Нуклеотидную последовательность полученной ДНК анализировали. Получали нуклеотидную последовательность, состоящую из нуклеотидов 966-1411 нуклеотидной последовательности, показанной в SEQ ID NO:244.
(3) Анализ последовательности ДНК (А25) данного изобретения
Нуклеотидную последовательность, показанную в SEQ ID NO:244, получали соединением нуклеотидных последовательностей, обеспеченных ДНК, полученной в примере 66(2). В указанной нуклеотидной последовательности присутствовали две открытые рамки считывания (ORF). Таким образом, она содержала нуклеотидную последовательность (SEQ ID NO:234), состоящую из 1197 нуклеотидов (включая стоп-кодон) и кодирующую 398 аминокислотных остатков (SEQ ID NO:224), и нуклеотидную последовательность (SEQ ID NO:264), состоящую из 201 нуклеотида (включая стоп-кодон) и кодирующую 66 аминокислотных остатков (SEQ ID NO:254). Было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:224), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:234, равна 44175 Да. Далее, было рассчитано, что молекулярная масса белка, состоящего из аминокислотной последовательности (SEQ ID NO:254), кодируемой нуклеотидной последовательностью, показанной в SEQ ID NO:264, равна 6685 Да.
Пример 67. Экспрессия ДНК (А25) данного изобретения в E. coli
(1) Получение трансформированной E. coli, имеющей ДНК (А25) данного изобретения
ПЦР проводили подобно примеру 49(1), за исключением использования в качестве матрицы хромосомной ДНК, полученной из Streptomyces steffisburgensis IFO 13446T в примере 66(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:326, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:327. Подобно примеру 32(1), ДНК очищали из реакционного раствора для ПЦР и клонировали в клонирующий вектор pCRII-TOPO (Invitrogen Company). Нуклеотидную последовательность полученной плазмидной ДНК секвенировали с использованием в качестве праймеров олигонуклеотидов, имеющих нуклеотидные последовательности, показанные, соответственно, в SEQ ID NO:67, 68, 311, 315 и 323. На основании полученных результатов плазмида, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:244, была названа pCR1609F. Подобно примеру 32(1), pCR1609F расщепляли рестриктазами NdeI и HindIII. Из продуктов расщепления очищали ДНК размером приблизительно 1,5 т.п.н. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:244, в которой ДНК, кодирующая белок (А25) данного изобретения, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой “pKSN1609F”). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1609F.
(2) Экспрессия белка (А25) данного изобретения в E. coli и выделение указанного белка
Подобно примеру 4(2) культивировали каждую из E. coli JM109/pKSN1609F и JM109/pKSN2. Клетки извлекали. Готовили растворы клеточных лизатов. По способу, описанному в примере 4(2), из этих растворов клеточных лизатов получали фракции супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN16093F, называют “экстрактом E. coli pKSN1609F”, а фракцию супернатанта, полученную из E. coli JM109/pKSN2, называют “экстрактом E. coli pKSN2”).
(3) Обнаружение способности превращать соединение (II) в соединение (III)
Подобно примеру 32(3), реакционные растворы по 30 мкл готовили и выдерживали в течение 10 минут при 30°С. Однако в качестве фракции супернатанта использовали фракцию супернатанта, полученную в примере 67(2) (экстракт E. coli pKSN1609F или экстракт E. coli pKSN2). Эти реакционные растворы после выдерживания экстрагировали этилацетатом и экстрагированные слои анализировали при помощи ТСХ. После проявления пластинки ТСХ присутствие на ней пятна, соответствующего соединению (III), меченному 14С, исследовали (величина Rf 0,24 и 0,29). Пятно, соответствующее соединению (III), детектировали из реакционного раствора, содержащего экстракт E. coli pKSN1609F. В противоположность этому такое пятно не детектировалось из реакционного раствора, содержащего экстракт E. coli pKSN2.
Пример 68. Преобразование соединений белком (А16), (А17), (А18), (А19), (А20), (А21), (А22), (А23), (А24) или (А25) данного изобретения
(1) Преобразование соединения (XII) белком (А16) данного изобретения
Получали 100 мкл реакционного раствора из 50 мМ калий-фосфатного буфера (рН 7,0), содержащего 12,5 м.д. соединения (XII), 3 мМ β-НАДФН (далее называемого “компонентом А”) (Oriental Yeast Company), 1 мг/мл ферредоксина, полученного из шпината (далее называемого «компонентом В») (Sigma Company), 0,15 Е/мл ферредоксинредуктазы (далее называемой «компонентом С») (Sigma Company) и 20 мкл фракции супернатанта, полученной в примере 49(2). Реакционный раствор выдерживали при 30°С в течение 10 минут. Кроме того, готовили и выдерживали таким же образом 100 мкл реакционного раствора из 50 мМ калий-фосфатного буфера (рН 7,0) без добавления, по меньшей мере, одного компонента, используемого в составе вышеописанного реакционного раствора, выбранного из компонента А, компонента В, компонента С и фракции супернатанта, полученной в примере 49(2). Добавляли пять микролитров (5 мкл) 2 н. HCl и 100 мкл этилацетата в каждый из этих реакционных растворов после указанного выдерживания и перемешивали. Супернатант, центрифугированный при 8000 g, фильтровали с использованием фильтрующего устройства UltraFree MC 0,22 мкм (Millipore Company). Сорок микролитров (40 мкл) жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 49(2), называют «раствором для (XII)-преобразования (А16)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 49(2), называют «раствором (XII)-контроля (А16)») анализировали с помощью ВЭЖХ при условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А16), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А16), была более низкой. Далее, из раствора для (XII)-преобразования (А16) был детектирован пик, который не детектировался из раствора (XII)-контроля (А16). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(2) Преобразование соединения (XII) белком (А17) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 51(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционный раствор после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 51(2), называют «раствором для (XII)-преобразования (А17)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 51(2), называют «раствором (XII)-контроля (А17)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А17), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А17), была более низкой. Далее, из раствора для (XII)-преобразования (А17) был детектирован пик, который не детектировался из раствора (XII)-контроля (А17). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(3) Преобразование соединения (XII) белком (А18) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 53(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 53(2), называют «раствором для (XII)-преобразования (А18)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 53(2), называют «раствором (XII)-контроля (А18)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А18), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А18), была более низкой. Далее, из раствора для (XII)-преобразования (А18) был детектирован пик, который не детектировался из раствора (XII)-контроля (А18). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(4) Преобразование соединения (XII) белком (А19) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 55(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 55(2), называют «раствором для (XII)-преобразования (А19)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 55(2), называют «раствором (XII)-контроля (А19)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А19), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А19), была более низкой. Далее, из раствора для (XII)-преобразования (А19) был детектирован пик, который не детектировался из раствора (XII)-контроля (А19). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(5) Преобразование соединения (XII) белком (А20) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 57(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 57(2), называют «раствором для (XII)-преобразования (А20)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 57(2), называют «раствором (XII)-контроля (А20)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А20), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А20), была более низкой. Далее, из раствора для (XII)-преобразования (А20) был детектирован пик, который не детектировался из раствора (XII)-контроля (А20). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(6) Преобразование соединения (XII) белком (А21) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 59(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 59(2), называют «раствором для (XII)-преобразования (А21)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 59(2), называют «раствором (XII)-контроля (А21)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А21), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А21), была более низкой. Далее, из раствора для (XII)-преобразования (А21) был детектирован пик, который не детектировался из раствора (XII)-контроля (А21). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(7) Преобразование соединения (XII) белком (А22) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 61(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 61(2), называют «раствором для (XII)-преобразования (А22)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 61(2), называют «раствором (XII)-контроля (А22)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А22), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А22), была более низкой. Далее, из раствора для (XII)-преобразования (А22) был детектирован пик, который не детектировался из раствора (XII)-контроля (А22). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(8) Преобразование соединения (XII) белком (А23) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 63(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 63(2), называют «раствором для (XII)-преобразования (А23)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 63(2), называют «раствором (XII)-контроля (А23)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А23), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А23), была более низкой. Далее, из раствора для (XII)-преобразования (А23) был детектирован пик, который не детектировался из раствора (XII)-контроля (А23). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(9) Преобразование соединения (XII) белком (А24) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 65(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 65(2), называют «раствором для (XII)-преобразования (А24)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 65(2), называют «раствором (XII)-контроля (А24)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А24), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А24), была более низкой. Далее, из раствора для (XII)-преобразования (А24) был детектирован пик, который не детектировался из раствора (XII)-контроля (А24). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(10) Преобразование соединения (XII) белком (А25) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 67(2), вместо 20 мкл фракции супернатанта, полученной в примере 49(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(1). Подобно примеру 68(1), готовили реакционные растворы после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 67(2), называют «раствором для (XII)-преобразования (А25)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 67(2), называют «раствором (XII)-контроля (А25)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XII), детектируемого из раствора (XII)-контроля (А25), концентрация соединения (XII), детектируемого из раствора для (XII)-преобразования (А25), была более низкой. Далее, из раствора для (XII)-преобразования (А25) был детектирован пик, который не детектировался из раствора (XII)-контроля (А25). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XII), детектированного из раствора для (XII)-преобразования (А1) в примере 41(2).
(11) Преобразование соединения (XIII) белком (А17) данного изобретения
За исключением использования 12,5 м.д. соединения (XIII) вместо 12,5 м.д. соединения (XII), реакционный раствор готовили и выдерживали в соответствии со способом, описанным в примере 68(2). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 51(2), называют «раствором для (XIII)-преобразования (А17)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 51(2), называют «раствором (XIII)-контроля (А17)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А17), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А17), была более низкой. Далее, из раствора для (XIII)-преобразования (А17) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А17). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(12) Преобразование соединения (XIII) белком (А18) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 53(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 53(2), называют «раствором для (XIII)-преобразования (А18)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 53(2), называют «раствором (XIII)-контроля (А18)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А18), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А18), была более низкой. Далее, из раствора для (XIII)-преобразования (А18) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А18). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(13) Преобразование соединения (XIII) белком (А19) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 55(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 55(2), называют «раствором для (XIII)-преобразования (А19)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 55(2), называют «раствором (XIII)-контроля (А19)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А19), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А19), была более низкой. Далее, из раствора для (XIII)-преобразования (А19) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А19). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(14) Преобразование соединения (XIII) белком (А20) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 57(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 57(2), называют «раствором для (XIII)-преобразования (А20)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 57(2), называют «раствором (XIII)-контроля (А20)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А20), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А20), была более низкой. Далее, из раствора для (XIII)-преобразования (А20) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А20). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(15) Преобразование соединения (XIII) белком (А21) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 59(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 59(2), называют «раствором для (XIII)-преобразования (А21)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 59(2), называют «раствором (XIII)-контроля (А21)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А21), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А21), была более низкой. Далее, из раствора для (XIII)-преобразования (А21) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А21). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(16) Преобразование соединения (XIII) белком (А23) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 63(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 63(2), называют «раствором для (XIII)-преобразования (А23)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 63(2), называют «раствором (XIII)-контроля (А23)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А23), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А23), была более низкой. Далее, из раствора для (XIII)-преобразования (А23) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А23). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
(17) Преобразование соединения (XIII) белком (А25) данного изобретения
За исключением использования 20 мкл фракции супернатанта, полученной в примере 67(2), вместо 20 мкл фракции супернатанта, полученной в примере 51(2), реакционный раствор получали и выдерживали подобно способу, описанному в примере 68(11). Подобно примеру 68(1), готовили каждый из реакционных растворов после выдерживания. Сорок микролитров (40 мкл) полученного жидкого фильтрата (далее жидкий фильтрат, полученный из реакционного раствора, содержащего компонент А, компонент В, компонент С и 20 мкл фракции супернатанта, полученной в примере 67(2), называют «раствором для (XIII)-преобразования (А25)»; далее жидкий фильтрат, полученный из реакционного раствора, не содержащего компонент А, компонент В, компонент С и фракцию супернатанта, полученную в примере 67(2), называют «раствором (XIII)-контроля (А25)») анализировали с помощью ВЭЖХ при указанном выше условии анализа 1. По сравнению с концентрацией соединения (XIII), детектируемого из раствора (XIII)-контроля (А25), концентрация соединения (XIII), детектируемого из раствора для (XIII)-преобразования (А25), была более низкой. Далее, из раствора для (XIII)-преобразования (А25) был детектирован пик, который не детектировался из раствора (XIII)-контроля (А25). Время элюции указанного пика на ВЭЖХ совпадало со временем элюции пика соединения, в котором масса является на 14 меньшей, чем масса указанного соединения (XIII), детектированного из раствора для (XIII)-преобразования (А1) в примере 41(3).
Пример 69. Гибридизация, в которой ДНК (А1), (А2), (А3) или (А4) данного изобретения была зондом
(1) Получение зонда
ПЦР проводили в соответствии со способом, описанным в примере 30(1). Однако в качестве матрицы использовали 10 нг хромосомной ДНК Streptomyces achromogenes IFO 12735, полученной в примере 26(1), вместо указанных 50 нг хромосомной ДНК Streptomyces phaeochromogenes IFO 12898, полученной в примере 3(1). В качестве праймеров использовали олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:328, и олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:329. ДНК, амплифицированную с помощью указанной ПЦР, извлекали с получением зонда, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:109, меченного дигоксигенином (далее называемого «DIG-меченным зондом (А4)»).
(2) Получение раствора плазмиды
ПЦР проводили с использованием смеси геномной полимеразы Advantage-GC (Clontech Company) и с использованием в качестве матрицы хромосомной ДНК Streptomyces nogalator IFO 13445, полученной в примере 31(1). В качестве праймеров использовали олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:330, и олигонуклеотид, имеющий нуклеотидную последовательность, показанную в SEQ ID NO:331. Реакционный раствор для ПЦР доводили до 50 мкл добавлением каждого из этих 2 праймеров, доведенных до 200 нМ, 10 нг хромосомной ДНК, 4,0 мкл смеси dNTP (смеси 2,5 мМ каждого из 4 типов dNTP; Clontech Company), 10,0 мкл 5хGC-буфера, 2,2 мкл 25мМ Mg(OAc)2, 10,0 мкл 5 М GC-расплава и 1,0 мкл смеси геномной полимеразы Advantage-GC (Clontech Company) и дистиллированной воды. Условия ПЦР были следующими: после поддержания 94°С в течение 1 минуты, повторение 7 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 72°С в течение 3 минут; повторение 36 циклов, где каждый цикл включал поддержание 94°С в течение 10 секунд и затем 67°С в течение 3 минут; и затем поддержание 67°С в течение 7 минут. ДНК очищали из реакционного раствора для ПЦР с использованием набора для очистки ПЦР QIAquick (Qiagen Company) в соответствии с прилагаемыми к этому набору инстукциями. Полученную ДНК лигировали с клонирующим вектором ТА pCR2.1 (Invitrogen Company) в соответствии с прилагаемым руководством и вводили в E. coli TOP10F' (Invitrogen Company). Плазмидную ДНК получали из полученного трансформанта E. coli с использованием набора QIAprep Spin Miniprep (Qiagen Company) с получением раствора плазмиды, содержащей ДНК (А11) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces tsusimaensis IFO 13782, полученной в примере 33(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:332, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:333. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А12) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces thermocoerulesces IFO 14273t, полученной в примере 35(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:334. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А13) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces glomerulochromogenes IFO 13673t, полученной в примере 37(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:330, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А14) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces olivochromogenes IFO 12444, полученной в примере 39(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:330, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А15) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces ornatus IFO 13069t, полученной в примере 48(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:335, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:336. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А16) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces griseus ATCC 10137, полученной в примере 50(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:335, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:336. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А17) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces achromogenes IFO 12735, полученной в примере 52(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:330, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А18) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces griseus IFO 13849T, полученной в примере 54(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:333, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:335. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А19) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces lanatus IFO 12787T, полученной в примере 56(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:337. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А20) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces misawanensis IFO 13855Т, полученной в примере 58(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:338. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А21) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces roseorubens IFO 13682T, полученной в примере 62(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:339. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А23) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces steffisburgensis IFO 13446T, полученной в примере 66(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:331, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:339. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А25) данного изобретения.
Далее, подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces pallidus IFO 13434T, полученной в примере 60(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:340, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:341. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А22) данного изобретения.
Подобным образом, ПЦР проводили с использованием в качестве матрицы хромосомной ДНК Streptomyces rutgersensis IFO 15875T, полученной в примере 64(1), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:342, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:343. ДНК, полученную при помощи этой ПЦР, лигировали с вектором, аналогично описанному выше. Затем трансформировали E. coli. Из полученного трансформанта E. coli получали плазмиду для получения раствора плазмиды, содержащей ДНК (А24) данного изобретения.
(2) Дот-блот-гибридизация
Приблизительно 100 нг и 10 нг каждой из плазмид, полученных в примере 69(2), наносили блоттингом на найлоновую мембрану Hybond N+ (Amersham Biosciences Company). Этими плазмидами были: плазмидная ДНК, содержащая ДНК (А11) данного изобретения, плазмидная ДНК, содержащая ДНК (А12) данного изобретения, плазмидная ДНК, содержащая ДНК (А13) данного изобретения, плазмидная ДНК, содержащая ДНК (А14) данного изобретения, плазмидная ДНК, содержащая ДНК (А15) данного изобретения, плазмидная ДНК, содержащая ДНК (А16) данного изобретения, плазмидная ДНК, содержащая ДНК (А17) данного изобретения, плазмидная ДНК, содержащая ДНК (А18) данного изобретения, плазмидная ДНК, содержащая ДНК (А19) данного изобретения, плазмидная ДНК, содержащая ДНК (А20) данного изобретения, плазмидная ДНК, содержащая ДНК (А21) данного изобретения, плазмидная ДНК, содержащая ДНК (А23) данного изобретения, плазмидная ДНК, содержащая ДНК (А25) данного изобретения. Ультрафиолетовый свет был направлен на полученные мембраны с использованием трансиллюминатора в течение 5 минут.
Гибридизацию и детектирование проводили в соответствии со способом, описанным в примере 30(2). Зонды, полученные в примере 30(1), выдерживали при 100°С в течение 5 минут и затем охлаждали на льду. В качестве зондов использовали ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:6, меченную дигоксигенином (далее называемую “DIG-меченным зондом (А1)”), ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:7, меченную дигоксигенином (далее называемую “DIG-меченным зондом (А2)”), ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:8, меченную дигоксигенином (далее называемую “DIG-меченным зондом (А3)”), или DIG-меченный зонд (А4), полученный в примере 69(1). В случаях использования любого из DIG-меченных зондов (А1), (А2), (А3) или (А4) для гибридизации сигнал детектировали для каждого из этих реагентов при 10 нг и 100 нг каждой из вышеуказанных плазмидных ДНК.
Далее, подобным образом, приблизительно 10 нг и 100 нг каждой из плазмидной ДНК, содержащей ДНК (А22) данного изобретения, полученной в примере 69(2), и плазмидной ДНК, содержащей ДНК (А24) данного изобретения, наносили блоттингом на найлоновую мембрану Hybond N+ (Amersham Biosciences Company). Гибридизацию и детектирование проводили в соответствии с примером 30(2).
Пример 70. Получение ДНК (А23) данного изобретения, в которой использование кодонов было приспособлено для экспрессии в сое (далее называемой “ДНК (А23)S данного изобретения»))
(1) Получение ДНК (А23)S данного изобретения
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:346, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:367. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:345, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:366. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:344, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:365. Полученный реакционный раствор был назван реакционным раствором 1.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:349, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:364. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:348, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:363. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:347, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:362. Полученный реакционный раствор был назван реакционным раствором 2.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:352, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:361. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:351, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:360. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:350, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:359. Полученный реакционный раствор был назван реакционным раствором 3.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:355, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:358. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:354, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:357. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:353, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:356. Полученный реакционный раствор был назван реакционным раствором 4.
Реакционные растворы 1-4, полученные таким образом, смешивали. ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве матрицы аликвоты этой смеси и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:344, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:356. Нуклеотидную последовательность этой амплифицированной ДНК подтверждали. Была получена ДНК, имеющая последовательность, в которой нуклеотидная последовательность 5'-cat-3' присоединена слева от 5'-конца и нуклеотидная последовательность 5'-aagctt-3' присоединена справа от 3'-конца нуклеотидной последовательности, показанной в SEQ ID NO:368.
Использование кодонов ДНК (А23) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:232 (GC-содержание 73,10%), показано в таблице 28 и таблице 29. Использование кодонов сои (GC-содержание 46,12%) показано в таблице 24 и таблице 25. Использование кодонов ДНК (А23)S данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:368 (GC-содержание 52,38%), показано в таблице 30 и таблице 31.
(2) Получение трансформированной E. coli, имеющей белок (А23)S данного изобретения
ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:368, полученную в примере 70(1), расщепляли рестриктазами NdeI и HindIII. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, в которой ДНК, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:368, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой «pKSN1584soy»). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1584soy.
(3) Экспрессия белка (А23) данного изобретения в E. coli и выделение указанного белка
Аналогично примеру 4(2), культивировали каждую из E. coli JM109/pKSN1584soy, полученной в примере 70(2), и E. coli JM109/pKSN1584F, полученной в примере 63(1). Клетки извлекали. Получали растворы клеточных лизатов. По способу, описанному в примере 4(2), получали фракции супернатантов из этих растворов клеточных лизатов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1584soy, называют “экстрактом E. coli pKSN1584soy”, а фракцию супернатанта, полученную из E. coli JM109/pKSN1584F, называют “экстрактом E. coli pKSN1584F”). Количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN1584soy, сравнивали с количеством Р450 на количество белка, содержащимся в экстракте E. coli pKSN1584F, и оно было более высоким, чем количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN1584F.
Пример 71. Получение и экспрессия ДНК (А25) данного изобретения, в которой использование кодонов было приспособлено для экспрессии в сое (далее называемой “ДНК (А25)S данного изобретения»)
(1) Получение ДНК (А25)S данного изобретения
ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:371, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:392. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:370, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:391. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:369, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:390. Полученный реакционный раствор был назван реакционным раствором 1.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:374, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:389. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:373, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:383. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:372, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:387. Полученный реакционный раствор был назван реакционным раствором 2.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:377, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:386. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:376, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:385. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:375, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:384. Полученный реакционный раствор был назван реакционным раствором 3.
Далее, ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:380, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:383. Аликвоту полученного продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:379, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:382. Далее, аликвоту этого продукта ПЦР использовали в качестве матрицы для ПЦР, проводимой таким же образом с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:378, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:381. Полученный реакционный раствор был назван реакционным раствором 4.
Реакционные растворы 1-4, полученные таким образом, смешивали. ПЦР проводили с ДНК-полимеразой Pyrobest (Takara Shuzo Company) в соответствии с прилагаемым руководством, с использованием в качестве матрицы аликвоты этой смеси и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:369, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:381. Нуклеотидную последовательность этой амплифицированной ДНК подтверждали. Была получена ДНК, имеющая последовательность, в которой нуклеотидная последовательность 5'-cat-3' присоединена слева от 5'-конца и нуклеотидная последовательность 5'-aagctt-3' присоединена справа от 3'-конца нуклеотидной последовательности, показанной в SEQ ID NO:393.
Использование кодонов ДНК (А25) данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:234 (GC-содержание 71,93%), показано в таблице 32 и таблице 33. Использование кодонов сои (GC-содержание 46,12%) показано в таблице 24 и таблице 25. Использование кодонов ДНК (А25)S данного изобретения, имеющей нуклеотидную последовательность, показанную в SEQ ID NO:393 (GC-содержание 52,05%), показано в таблице 34 и таблице 35.
(2) Получение трансформированной E. coli, имеющей белок (А25)S данного изобретения
ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO:393, полученную в примере 71(1), расщепляли рестриктазами NdeI и HindIII. Полученную ДНК и плазмиду pKSN2, расщепленную NdeI и HindIII, лигировали с получением плазмиды, в которой ДНК, имеющая нуклеотидную последовательность, показанную в SEQ ID NO:393, встроена между сайтом NdeI и сайтом HindIII pKSN2 (далее называемой «pKSN1609soy»). Указанную плазмиду вводили в E. coli JM109. Полученный трансформант E. coli был назван JM109/pKSN1609soy.
(3) Экспрессия белка (А25) данного изобретения в E. coli и выделение указанного белка
Аналогично примеру 4(2), культивировали каждую из E. coli JM109/pKSN1609soy, полученной в примере 71(2), и E. coli JM109/pKSN1609F, полученной в примере 67(1). Клетки извлекали. Получали растворы клеточных лизатов. По способу, описанному в примере 4(2), получали фракции супернатантов из этих растворов клеточных лизатов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1609soy, называют “экстрактом E. coli pKSN1609soy”, а фракцию супернатанта, полученную из E. coli JM109/pKSN1609F, называют “экстрактом E. coli pKSN1609F”). Количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN1609soy, сравнивали с количеством Р450 на количество белка, содержащимся в экстракте E. coli pKSN1609F, и оно было более высоким, чем количество Р450 на количество белка, содержащееся в экстракте E. coli pKSN1609F.
Пример 72. Получение антитела (А) данного изобретения, узнающего белок (А25) данного изобретения (далее называемого антителом (А25) данного изобретения»)
(1) Получение экстракта E. coli, экспрессирующей белок (А25) данного изобретения
В соответствии со способом, описанным в примере 4(2), E. coli JM109/pKSN1609soy, полученную в примере 71(2), предварительно культивировали в течение ночи. Полученную культуральную среду инокулировали в 1 л среды ТВ, содержащей 50 мкг/мл ампициллина, и культивировали при 26оС. Затем добавляли 5-аминолевулиновую кислоту до конечной концентрации 500 мкМ и добавляли IPTG до конечной концентрации 1 мМ и дополнительно культивировали. Клетки извлекали из культуральной среды, промывали 0,05 М Трис-HCl-буфером (рН 7,5) и затем суспендировали в 100 мл указанного буфера, содержащего 1 мМ ФМСФ. Полученную культуральную среду клеток подвергали 3 раза обработке на ультразвуковом дезинтеграторе (Sonifier (Branson Sonic Power Company)) в течение 10 минут каждый раз в условиях излучаемой мощности 5, нагрузки цикла 30%, для получения растворов клеточных лизатов. После центрифугирования растворов клеточных лизатов (9000 g, 10 минут) супернатанты извлекали и центрифугировали (200000 g, 70 минут) для получения фракций супернатантов (далее фракцию супернатанта, полученную из E. coli JM109/pKSN1609soy, называют “экстрактом E. coli pKSN1609soy”).
(2) Очистка белка (А25) данного изобретения
Фракцию супернатанта, полученную в примере 72(1) (экстракт E. coli pKSN1609soy) вводили в колонку Hiload HiLoad16/10 Q Sepharose HP (Amersham Bioscience Company). Затем, после протекания 40 мл 20 мМ бистриспропанового буфера (рН 7,0) через эту колонку, 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,00125 М/мин, диапазон концентраций NaCl был от 0 М до 0,375 М, скорость тока была 3 мл/мин) для фракционного извлечения 10 мл фракций, элюирующихся при концентрации NaCl 0,088-0,100 М.
Извлеченные фракции подвергали очистке на колонке PD-10 (Amersham Bioscience Company) и элюировали 20 мМ бистриспропановым буфером (рН 7,0) для извлечения фракций, содержащих белок. Затем указанные фракции вводили в MonoQ HR 10/10 (Amersham Bioscience Company). Шестнадцать миллилитров (16 мл) 20 мМ бистриспропанового буфера пропускали через колонку. Затем 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,001042 М/мин, диапазон концентрации NaCl был от 0 до 0,25 М, скорость тока была 4 мл/мин) для фракционного извлечения 8 мл фракций, элюирующихся при концентрации NaCl от 0,060 до 0,069 М.
Извлеченные фракции разбавляли в 2,5 раза 20 мМ бистриспропановым буфером (рН 7,0) и вводили в колонку MonoQ HR 5/5 (Amersham Bioscience Company). Затем после протекания 2 мл 20 мМ бистриспропанового буфера (рН 7,0) через колонку 20 мМ бистриспропановый буфер протекал с линейным градиентом NaCl (градиент NaCl был 0,008333 М/мин, диапазон концентраций NaCl был от 0 М до 0,25 М, скорость тока была 1 мл/мин) для фракционного извлечения 0,5 мл фракций, элюирующихся при концентрации NaCl 0,073-0,077 М.
Фракции, очищенные таким образом, анализировали электрофорезом в ДСН-ПААГ с использованием “PAG mini Daiichi 10/20” (Daiichi Pure Chemicals Co., Ltd.) для подтверждения, что эти фракции были фракциями, которые в основном содержат белок (А25) данного изобретения.
(3) Получения антитела (А25) данного изобретения
Получение антитела данного изобретения проводили в соответствии со способом, описанным в примере 44(3). Однако вместо использования белка (А1) данного изобретения использовали белок (А25) данного изобретения, полученный в примере 72(2), с получением антисыворотки, содержащей антитело (А25) данного изобретения.
Пример 73. Детектирование белка данного изобретения антителом (А25) данного изобретения
Иммуноблот-анализ проводили с использованием антитела (А25) данного изобретения, полученного в примере 72(3), с каждым из экстрактов E. coli. Проводили электрофорез в ДСН-полиакриламиде (40 мА, 1 час): экстракта E. coli pKSN452F, полученного в примере 49(2) (содержащего приблизительно 2 пмоль белка (А16) данного изобретения); экстракта E. coli pKSN608F, полученного в примере 51(2) (содержащего приблизительно 2 пмоль белка (А17) данного изобретения); экстракта E. coli pKSN646ВF, полученного в примере 53(2) (содержащего приблизительно 2 пмоль белка (А18) данного изобретения); экстракта E. coli pKSN1502F, полученного в примере 55(2) (содержащего приблизительно 2 пмоль белка (А19) данного изобретения); экстракта E. coli pKSN1525F, полученного в примере 57(2) (содержащего приблизительно 2 пмоль белка (А20) данного изобретения); экстракта E. coli pKSN1543BF, полученного в примере 59(2) (содержащего приблизительно 2 пмоль белка (А21) данного изобретения); экстракта E. coli pKSN1558ВF, полученного в примере 61(2) (содержащего приблизительно 2 пмоль белка (А22) данного изобретения); экстракта E. coli pKSN1584F, полученного в примере 63(2) (содержащего приблизительно 2 пмоль белка (А23) данного изобретения); экстракта E. coli pKSN1589ВF, полученного в примере 65(2) (содержащего приблизительно 2 пмоль белка (А24) данного изобретения); экстракта E. coli pKSN1609F, полученного в примере 67(2) (содержащего приблизительно 0,5 пмоль белка (А25) данного изобретения), экстракта E. coli pKSN1584soy, полученного в примере 70(3) (содержащего приблизительно 2 пмоль белка (А23) данного изобретения), экстракта E. coli pKSN1609soy, полученного в примере 71(3) (содержащего приблизительно 0,5 пмоль белка (А25) данного изобретения) и экстракта E. coli pKSN2, полученного в примере 67(2) (содержащего приблизительно 0,8 мг белка). Белки в указанном геле переносили на PVDF-мембрану в соответствии со способом, описанным в примере 45. Мембрану PDVF, полученную в примере 45 (далее называемая «PDVF-мембраной (А)»), и мембрану PDVF, полученную вышеуказанным способом (далее называемая «PDVF-мембраной (В)»), подвергали реагированию с антисывороткой, полученной в примере 72(3), в соответствии со способом, описанным в примере 45. После этого проводили реакцию со вторым антителом, промывание и окрашивание в соответствии со способом, описанным в примере 45. Окрашивание полос, соответствующих белкам данного изобретения (А1), (А2), (А3), (А4), (А11), (А12), (А13), (А14) и (А15), а также белкам (А9) и (А10) данного изобретения детектировали на PDVF-мембране (А). Окрашивание полос, соответствующих белкам данного изобретения (А16), (А17), (А18), (А19), (А20), (А21), (А22), (А23), (А24) и (А25), детектировали на PDVF-мембране (В). Не детектировали окрашивание полосы с реагентом экстракта E. coli pKSN2, полученного в примере 4(2) (содержащим приблизительно 0,78 мг белка), PVDF-мембраны (А) и реагентом экстракта E. coli pKSN2, полученного в примере 67(2) (содержащего 0,8 мг белка), PVDF-мембраны (В).
Пример 74. Введение ДНК (А23)S данного изобретения в растение
(1) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А23)S данного изобретения, для прямого введения - часть 1
Плазмиду, содержащую химерную ДНК, в которой ДНК (А23)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах, конструировали в качестве плазмиды для введения ДНК (А23)S данного изобретения в растение способом с использованием ружья для частиц.
Сначала ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:398, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы pKSN1584soy, полученной в примере 70(2), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:397, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:398. В ПЦР использовали KOD-plus (Toyobo Company). ПЦР проводили после поддержания один раз 94°С в течение 2 минут; проведения 20 циклов, где каждый цикл включал поддержание 94°С в течение 30 секунд, затем 53°С в течение 30 секунд и затем 68°С в течение 90 секунд; и конечное поддержание при 68°С в течение 3 минут. Амплифицированную ДНК выделяли и очищали с использованием MagExtractor-PCR & Gel-Clean up (Toyobo Company) проведением процедур в соответствии с прилагаемым руководством. Обработкой полученной ДНК с использованием набора TaKaRa BKL (Takara Shuzo Company) в соответствии с прилагаемым руководством, ДНК затупляли и 5'-конец фосфорилировали. ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368, выделяли. После расщепления плазмиды pUC19 (Takara Shuzo Company) рестриктазой SmaI 5'-конец дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo). Плазмиду получали лигированием полученной дефосфорилированной ДНК и ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:368. После расщепления полученной плазмиды рестриктазами EcoТ22I и SacI выделяли ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368. После расщепления плазмиды pUCrSt657, полученной в примере 16(2), рестриктазами EcoT22I и SacI выделяли ДНК размером приблизительно 2,9 т.п.н., имеющую нуклеотидную последовательность, происходящую из pUC19, и последовательность, кодирующую хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack). Полученную ДНК и вышеупомянутую ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368, лигировали с получением pUCrSt1584soy (фиг. 54), содержащей химерную ДНК, в которой ДНК (А23)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Полученную плазмиду pUCrSt1584soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:368. Указанную ДНК встраивали между сайтом рестрикции BglII и сайтом рестрикции SacI плазмиды pNdG6-ΔТ, полученной в примере 16(2), с получением плазмиды pSUM-NdG6-rSt-1584soy (фиг. 55), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой указанная ДНК присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в этих ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt-1584soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:368.
(2) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А23)S данного изобретения, для прямого введения - часть 2
Конструировали плазмиду для введения ДНК (А23)S данного изобретения в растение способом с использованием ружья для частиц. Эта плазмида содержала химерную ДНК, в которой ДНК (А23)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Сначала ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы pKSN1584soy, полученной в примере 70, и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:399, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:398. В ПЦР использовали KOD-plus (Toyobo Company). ПЦР проводили после поддержания 94°С один раз в течение 2 минут следующим образом: проведение 25 циклов, где каждый цикл включал поддержание 94°С в течение 30 секунд, затем 46°С в течение 30 секунд и затем 68°С в течение 90 секунд; и конечное поддержание 68°С в течение 3 минут. Амплифицированную ДНК выделяли и очищали с использованием MagExtractor-PCR & Gel-Clean up (Toyobo Company) проведением процедур в соответствии с прилагаемым руководством. Обработкой полученной ДНК с использованием набора TaKaRa BKL (Takara Shuzo Company) в соответствии с прилагаемым руководством, ДНК затупляли и 5'-конец фосфорилировали. ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368, выделяли. После расщепления плазмиды pKF19 ΔBs, полученной в примере 15(3), рестриктазой SmaI 5'-конец дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo). Плазмиду получали лигированием полученной дефосфорилированной ДНК и ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:368. После расщепления полученной плазмиды рестриктазами BspHI и SacI выделяли ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:368. Затем плазмиду pKFrSt12-657, полученную в примере 16(3), расщепляли рестриктазами BspHI и SacI для выделения ДНК, полученной из плазмиды pKFrSt12. Указанную ДНК лигировали с ДНК, которая была расщеплена рестриктазами SacI и BspHI и которая содержит нуклеотидную последовательность, показанную в SEQ ID NO:368, с получением плазмиды pKFrSt12-1584soy (фиг. 56), содержащей химерную ДНК, в которой ДНК (А23)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах.
Полученную плазмиду pKFrSt12-1584soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:368. Указанную ДНК встраивали между сайтом рестриктазы BglII и сайтом рестриктазы SacI плазмиды pNdG6-ΔТ с получением плазмиды pSUM-NdG6-rSt12-1584soy (фиг. 57), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой указанная ДНК присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt12-1584soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:368.
(3) Введение ДНК (А23)S данного изобретения в сою
Глобулярные зародыши сои (сорта: Fayette и Jack) получали в соответствии со способом, описанным в примере 47(3).
Полученный глобулярный зародыш пересаживали в свежую среду для выращивания соматических зародышей и культивировали в течение 2-3 дней. В соответствии со способом, описанным в примере 17(2), плазмиду pSUM-NdG6-rSt-1584soy, полученную в примере 74(1), или плазмиду pSUM-NdG6-rSt12-1584soy, полученную в примере 74(2), вводили в указанные глобулярные зародыши.
(4) Отбор соматического зародыша с гигромицином
Отбор с использованием гигромицина глобулярного зародыша после введения гена, полученного в примере 74(3), проводили в соответствии со способом, описанным в примере 47(4).
(5) Отбор соматического зародыша с соединением (II)
Отбор с использованием соединения (II) глобулярного зародыша после введения гена, полученного в примере 74(3), проводили в соответствии со способом, описанным в примере 47(5).
(6) Регенерация растения из соматического зародыша, акклимация и культивирование растения
В соответствии со способом, описанным в примере 47(6), регенерацию растения проводили из глобулярных зародышей, отобранных в примере 74(4) или 74(5).
Растение с корнями и развитыми листьями подвергают акклимации и культивированию в соответствии со способом, описанным в примере 17(6), и собирают массу растения.
(7) Оценка устойчивости к гербицидному соединению (II)
Степень устойчивости против соединения (II) регенерированного растения, полученного в примере 74(6), оценивали в соответствии со способом, описанным в примере 17(4).
(8) Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А23)S данного изобретения, для введения с использованием Agrobacterium
Конструировали плазмиду для введения ДНК (А23)S данного изобретения в растение способом с использованием Agrobacterium. Плазмиду pSUM-NdG6-rSt-1584soy расщепляли рестриктазами HindIII и EcoRI для выделения химерной ДНК, в которой ДНК (А23)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах. Указанную ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI указанного выше бинарного плазмидного вектора pBI121S, полученного в примере 18, с получением плазмиды pBI-NdG6-rSt-1584soy (фиг. 58). Далее, плазмиду pSUM-NdG6-rSt12-1584soy расщепляли рестриктазой NotI с выделением химерной ДНК, в которой ДНК (А23)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Эту ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI указанного выше бинарного плазмидного вектора pBI121S с получением плазмиды pBI-NdG6-rSt12-1584soy (фиг. 59).
(9) Введение ДНК (А23)S данного изобретения в табак
ДНК (А23)S данного изобретения вводили в табак способом с применением Agrobacterium, с использованием плазмид pBI-NdG6-rSt-1584soy и pBI-NdG6-rSt12-1584soy, полученных в примере 74(8).
Сначала, в соответствии со способом, описанным в примере 19, каждую из плазмид pBI-NdG6-rSt-1584soy и pBI-NdG6-rSt12-1584soy вводили в Agrobacterium tumefaciens LBA4404 (Clontech Company). Выделяли каждую трансгенную агробактерию, несущую pBI-NdG6-rSt-1584soy или pBI-NdG6-rSt12-1584soy.
Затем указанные агробактерии, несущие эти плазмиды, использовали для введения генов в табак в соответствии со способом, описанным в примере 47(9), с получением, соответственно, трансгенных растений табака, которые включали район Т-ДНК pBI-NdG6-rSt-1584soy или pBI-NdG6-rSt12-1584soy.
(10) Оценка устойчивости с использованием кусочка листа трансгенного табака, имеющего ДНК (А23)S данного изобретения
Листья собирали из 35 трансгенных растений табака, полученных в примере 74(9). Каждый лист делили на кусочки, причем каждый кусочек имел ширину 5-7 мм. Кусочки листа высаживали на среду с агаром МС, содержащую соединение (II) или соединение (XII), и культивировали на свету при комнатной температуре. После нескольких дней культивирования наблюдали гербицидное повреждение каждого из этих кусочков листа. В качестве контроля использовали кусочки листьев табака дикого типа. Устойчивость трансгенных растений табака определяли оценкой в баллах кусочков листьев, которые непрерывно растут, кусочков листьев, которые имеют химическое повреждение, кусочков листьев, которые становились белыми и завядали.
Пример 75. Введение ДНК (А25)S данного изобретения в растение
(1) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А25)S данного изобретения, для прямого введения - часть 1
Плазмиду, содержащую химерную ДНК, в которой ДНК (А25)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах, конструировали в качестве плазмиды для введения ДНК (А25)S данного изобретения в растение способом с использованием ружья для частиц.
Сначала ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:393, амплифицировали при помощи ПЦР. ПЦР проводили с использованием в качестве матрицы pKSN1609soy, полученной в примере 71(2), и с использованием в качестве праймеров олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:400, и олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:401. В ПЦР использовали KOD-plus (Toyobo Company). ПЦР проводили после поддержания при 94°С в течение 2 минут следующим образом: проведение 20 циклов, где каждый цикл включал поддержание 94°С в течение 30 секунд, затем 53°С в течение 30 секунд и затем 68°С в течение 90 секунд; и конечное поддержание при 68°С в течение 3 минут. Амплифицированную ДНК выделяли и очищали с использованием MagExtractor-PCR & Gel-Clean up (Toyobo Company) проведением процедур в соответствии с прилагаемым руководством. Обработкой полученной ДНК с использованием набора TaKaRa BKL (Takara Shuzo Company) в соответствии с прилагаемым руководством, ДНК затупляли и 5'-конец фосфорилировали. ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:393, выделяли. После расщепления плазмиды pUC19 (Takara Shuzo Company) рестриктазой SmaI 5'-конец дефосфорилировали щелочной фосфатазой кишечника теленка (Takara Shuzo). Плазмиду получали лигированием полученной дефосфорилированной ДНК и ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:393. После расщепления полученной плазмиды рестриктазами EcoТ22I и SacI выделяли ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:393. После расщепления плазмиды pUCrSt657, полученной в примере 16(2), рестриктазами EcoT22I и SacI выделяли ДНК размером приблизительно 2,9 т.п.н., имеющую нуклеотидную последовательность, происходящую из pUC19, и последовательность, кодирующую хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack). Полученную ДНК и вышеупомянутую ДНК, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:393, лигировали с получением pUCrSt1609soy (фиг. 60), содержащей химерную ДНК, в которой ДНК (А25)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Полученную плазмиду pUCrSt1609soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:393. Указанную ДНК встраивали между сайтом рестрикции BglII и сайтом рестрикции SacI плазмиды pNdG6-ΔТ с получением плазмиды pSUM-NdG6-rSt-1609soy (фиг. 61), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой указанная ДНК присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в этих ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt-1609soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:393.
(2) Конструирование хлоропластной экспрессионной плазмиды, содержащей ДНК (А25)S данного изобретения, для прямого введения - часть 2
Конструировали плазмиду для введения ДНК (А25)S данного изобретения в растение способом с использованием ружья для частиц. Эта плазмида содержала химерную ДНК, в которой ДНК (А25)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Сначала использовали плазмиду pUCrSt1609soy, полученную в примере 75(1), встраивали в ее сайт рестрикции EcoT22I линкер EcoT22I-12-аа-EcoT22I (фиг. 62), полученный отжигом олигонуклеотида, имеющего нуклеотидную последовательность, показанную в SEQ ID NO:402, и олигонуклеотида, состоящего из нуклеотидной последовательности, показанной в SEQ ID NO:403. Получали плазмиду pUCrSt12-1609soy (фиг. 63), содержащую химерную ДНК, в которой ДНК (А25)S данного изобретения присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах.
Полученную плазмиду pUCrSt12-1609soy расщепляли рестриктазами BamHI и SacI для выделения ДНК, содержащей нуклеотидную последовательность, показанную в SEQ ID NO:393. Указанную ДНК встраивали между сайтом рестриктазы BglII и сайтом рестриктазы SacI плазмиды pNdG6-ΔТ, полученной в примере 16(2), с получением плазмиды pSUM-NdG6-rSt12-1609soy (фиг. 64), где промотор CR16G6 присоединен «справа» от химерной ДНК, в которой указанная ДНК присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах.
Затем эту плазмиду вводили в компетентные клетки E. coli DH5α (Takara Shuzo Company) и отбирали ампициллин-резистентные клетки. Далее, нуклеотидные последовательности плазмид, содержащихся в ампициллин-резистентных штаммах, определяли с использованием набора BigDye Terminator Cycle Sequencing Ready Reaction kit v3.0 (PE Applied Biosystems Company) и секвенатора ДНК 3100 (PE Applied Biosystems Company). В результате было подтверждено, что плазмида pSUM-NdG6-rSt12-1609soy имеет нуклеотидную последовательность, показанную в SEQ ID NO:393.
(3) Введение ДНК (А25)S данного изобретения в сою
Глобулярные зародыши сои (сорта: Fayette и Jack) получали в соответствии со способом, описанным в примере 47(3).
Полученный глобулярный зародыш пересаживали в свежую среду для выращивания соматических зародышей и культивировали в течение 2-3 дней. В соответствии со способом, описанным в примере 17(2), плазмиду pSUM-NdG6-rSt-1609soy, полученную в примере 75(1), или плазмиду pSUM-NdG6-rSt12-1609soy, полученную в примере 75(2), вводили в указанные глобулярные зародыши.
(4) Отбор соматического зародыша с гигромицином
Отбор с использованием гигромицина глобулярного зародыша после введения гена, полученного в примере 75(3), проводили в соответствии со способом, описанным в примере 47(4).
(5) Отбор соматического зародыша с соединением (II)
Отбор с использованием соединения (II) глобулярного зародыша после введения гена, полученного в примере 75(3), проводили в соответствии со способом, описанным в примере 47(5).
(6) Регенерация растения из соматического зародыша, акклимация и культивирование растения
В соответствии со способом, описанным в примере 47(6), регенерацию растения проводили из глобулярных зародышей, отобранных в примере 75(4) или 75(5).
Растение с корнями и развитыми листьями подвергают акклимации и культивированию в соответствии со способом, описанным в примере 17(6), и собирают массу растения.
(7) Оценка устойчивости к гербицидному соединению (II)
Степень устойчивости против соединения (II) регенерированного растения, полученного в примере 75(6), оценивали в соответствии со способом, описанным в примере 17(4).
(8) Конструирование хлоропластной экспрессионной плазмиды, имеющей ДНК (А25)S данного изобретения, для введения с использованием Agrobacterium
Конструировали плазмиду для введения ДНК (А25)S данного изобретения в растение способом с использованием Agrobacterium. Плазмиду pSUM-NdG6-rSt-1609soy расщепляли рестриктазами HindIII и EcoRI для выделения химерной ДНК, в которой ДНК (А25)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack), без изменения рамок считывания в кодонах. Указанную ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI указанного выше бинарного плазмидного вектора pBI121S, полученного в примере 18, с получением плазмиды pBI-NdG6-rSt-1609soy (фиг. 65). Далее, плазмиду pSUM-NdG6-rSt12-1609soy расщепляли рестриктазой NotI с выделением химерной ДНК, в которой ДНК (А25)S данного изобретения была присоединена непосредственно после нуклеотидной последовательности, кодирующей хлоропластный транзитный пептид малой субъединицы RuBPC сои (сорта Jack) и кодирующей после этого 12 аминокислот зрелого белка, без изменения рамок считывания в кодонах. Эту ДНК встраивали между сайтом рестрикции HindIII и сайтом рестрикции EcoRI указанного выше бинарного плазмидного вектора pBI121S с получением плазмиды pBI-NdG6-rSt12-1609soy (фиг. 66).
(9) Введение ДНК (А25)S данного изобретения в табак
ДНК (А25)S данного изобретения вводили в табак способом с применением Agrobacterium, с использованием плазмид pBI-NdG6-rSt-1609soy и pBI-NdG6-rSt12-1609soy, полученных в примере 75(8).
Сначала, в соответствии со способом, описанным в примере 19, каждую из плазмид pBI-NdG6-rSt-1609soy и pBI-NdG6-rSt12-1609soy вводили в Agrobacterium tumefaciens LBA4404 (Clontech Company). Выделяли каждую трансгенную агробактерию, несущую pBI-NdG6-rSt-1609soy или pBI-NdG6-rSt12-1609soy.
Затем указанные агробактерии, несущие эти плазмиды, использовали для введения генов в табак в соответствии со способом, описанным в примере 47(9), с получением, соответственно, трансгенных растений табака, которые включали район Т-ДНК pBI-NdG6-rSt-1609soy или pBI-NdG6-rSt12-1609soy.
(10) Оценка устойчивости с использованием кусочка листа трансгенного табака, имеющего ДНК (А25)S данного изобретения
Листья собирали из трансгенных растений табака, полученных в примере 75(9). Такие листья использовали для оценки устойчивости трансгенного табака против соединения (II) или соединения (XII) в соответствии со способом примера 74(10).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Посредством данного изобретения могут быть обеспечены белок, способный метаболизировать РРО-ингибирующее гербицидное соединение и превращать такое соединение в соединение более низкой гербицидной активности; ДНК, кодирующая такой белок; и растение, устойчивое к гербицидному соединению, экспрессирующее такой белок.
НАЗВАНИЯ ПРИВЕДЕННЫХ В СПИСКЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:35
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:36
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:37
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:38
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:39
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:40
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:41
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:42
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:43
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:44
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:45
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:46
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:47
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:48
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:49
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:50
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:51
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:52
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:53
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:54
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:55
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:56
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:57
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:58
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:59
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:60
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:61
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:62
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:63
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:64
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:65
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:66
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:67
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:68
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:70
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:71
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:72
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:73
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:74
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:75
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:76
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:77
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:79
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:80
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:81
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:82
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:83
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:86
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:87
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:89
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:90
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:91
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:92
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:93
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:94
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:95
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:96
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:97
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:98
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:99
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:100
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:101
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:102
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:103
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:104
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:105
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:106
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:107
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:114
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:115
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:116
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:117
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:118
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:119
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:120
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:121
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:122
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:123
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:124
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:125
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:126
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:127
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:128
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:129
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:130
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:131
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:132
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:133
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:134
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:135
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:161
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:162
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:163
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:164
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:165
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:166
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:167
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:168
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:169
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:170
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:171
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:172
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:173
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:174
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:175
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:176
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:177
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:178
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:179
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:180
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:181
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:182
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:183
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:184
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:185
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:186
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:187
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:188
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:189
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:190
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:191
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:192
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:193
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:194
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:195
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:196
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:197
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:198
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:199
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:200
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:201
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:202
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:203
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:204
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:205
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:206
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:207
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:208
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:209
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:210
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:211
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:212
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:213
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:214
Сконструированный полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO:1
SEQ ID NO:265
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:266
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:267
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:268
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:269
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:270
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:271
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:272
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:273
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:274
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:275
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:276
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:277
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:278
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:279
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:280
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:281
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:282
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:283
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:284
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:285
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:286
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:287
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:288
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:289
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:290
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:291
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:292
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:293
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:294
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:295
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:296
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:297
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:298
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:299
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:300
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:301
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:302
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:303
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:304
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:305
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:306
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:307
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:308
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:309
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:310
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:311
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:312
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:313
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:314
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:315
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:316
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:317
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:318
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:319
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:320
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:321
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:322
Сконструированный олигонуклеотидный праймер для секвенирования ДНК
SEQ ID NO:323
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:324
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:325
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:326
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:327
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:328
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:329
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:330
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:331
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:332
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:333
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:334
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:335
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:336
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:337
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:338
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:339
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:340
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:341
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:342
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:343
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:344
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:345
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:346
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:347
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:348
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:349
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:350
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:351
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:352
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:353
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:354
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:355
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:356
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:357
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:358
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:359
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:360
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:361
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:362
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:363
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:364
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:365
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:366
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:367
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:368
Сконструированный полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO:222
SEQ ID NO:369
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:370
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:371
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:372
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:373
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:374
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:375
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:376
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:377
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:378
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:379
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:380
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:381
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:382
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:383
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:384
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:385
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:386
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:387
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:388
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:389
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:390
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:391
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:392
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:393
Сконструированный полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO:224
SEQ ID NO:394
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:395
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:396
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:397
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:398
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:399
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:400
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:401
Сконструированный олигонуклеотидный праймер для ПЦР
SEQ ID NO:402
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
SEQ ID NO:403
Сконструированный олигонуклеотидный линкер для конструирования экспрессирующего вектора
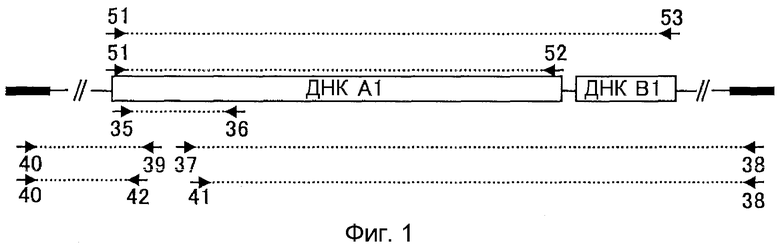
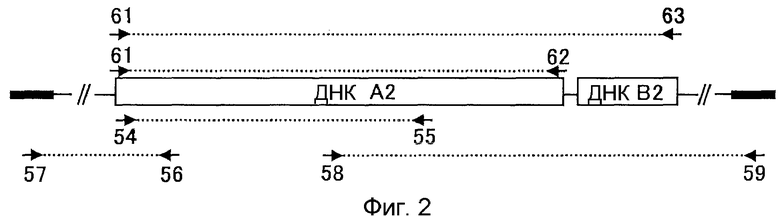
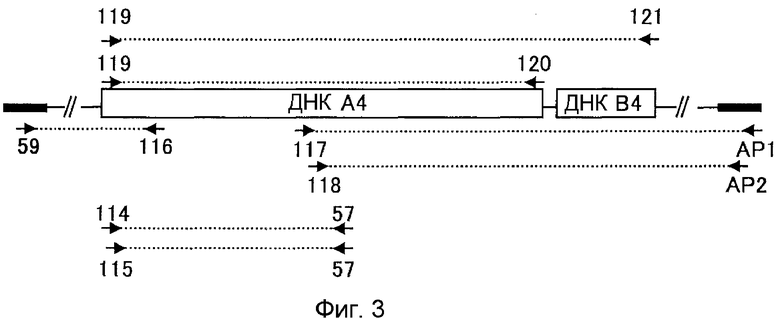

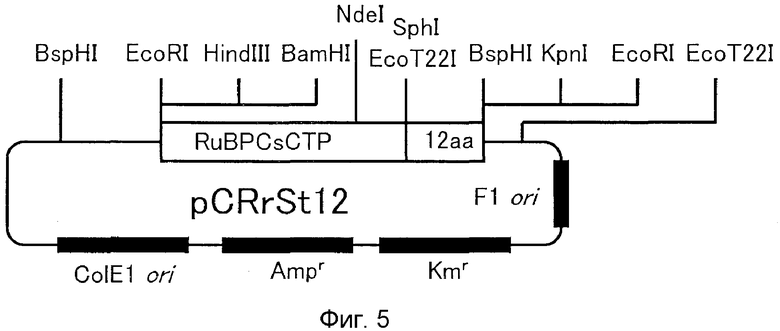
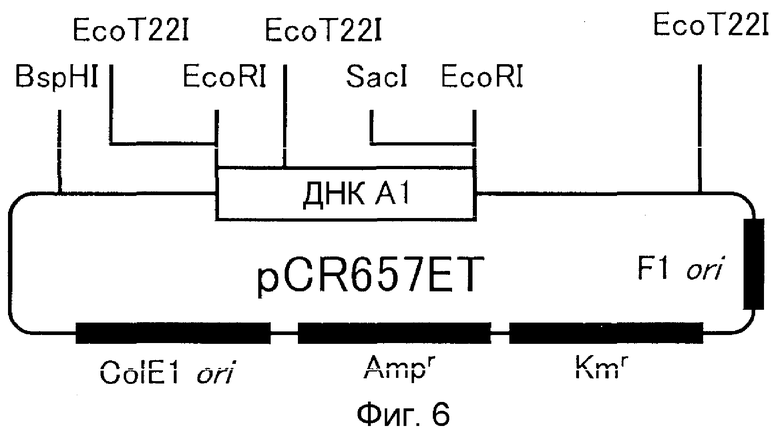

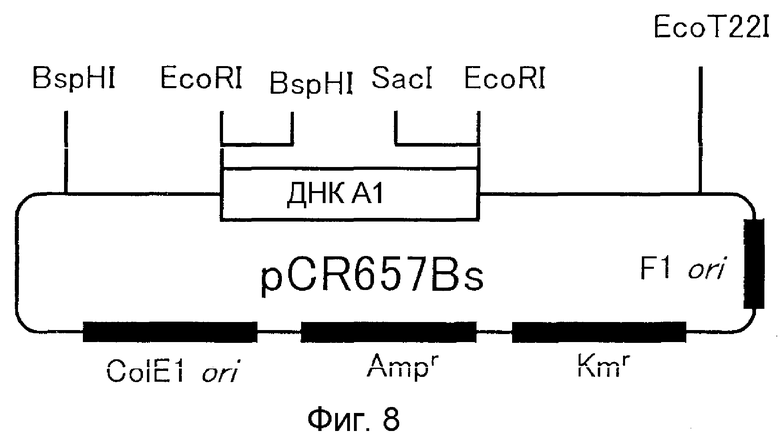
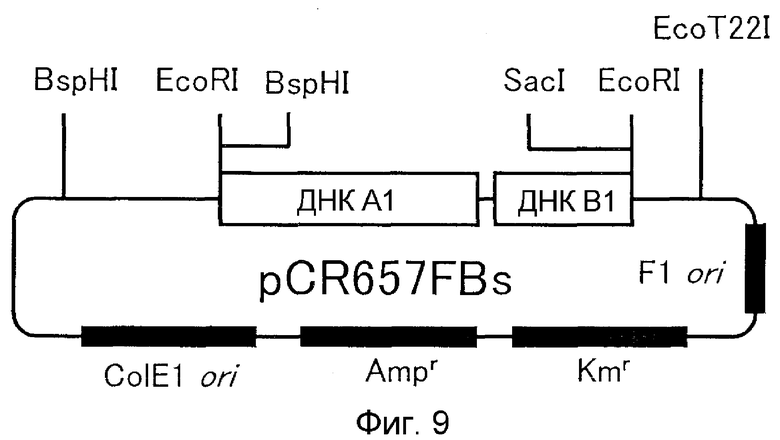


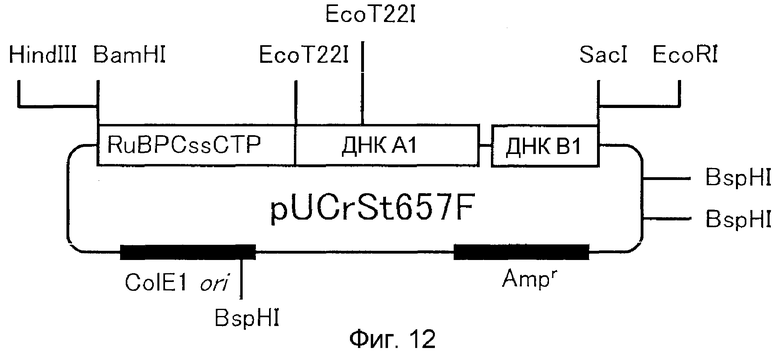
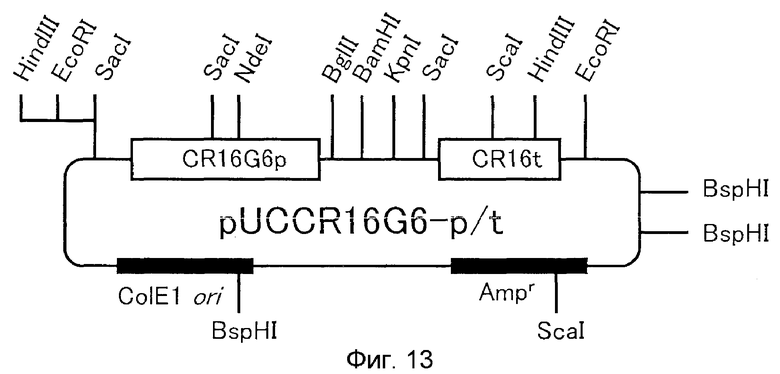

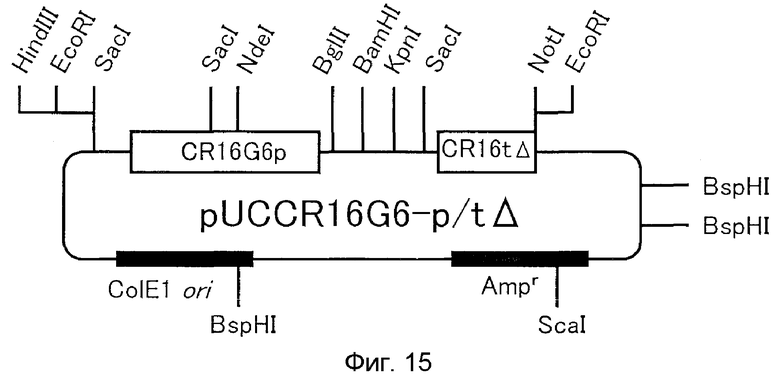
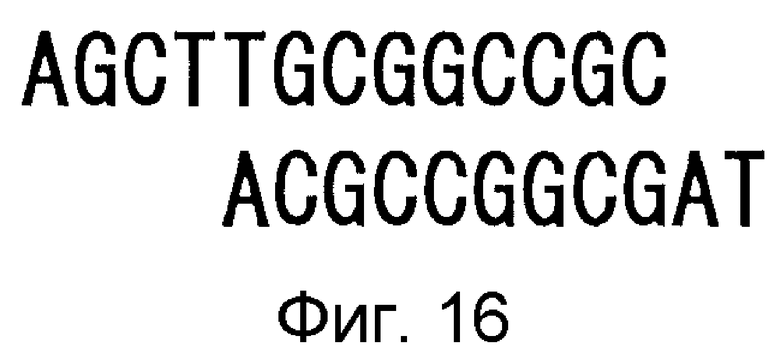
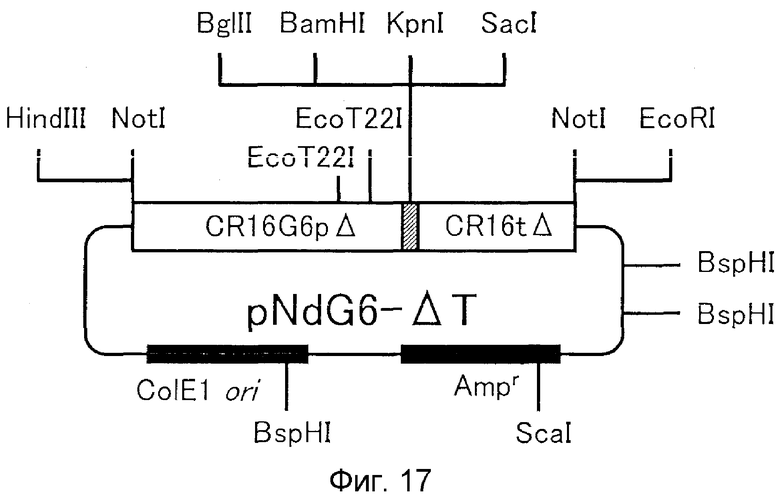
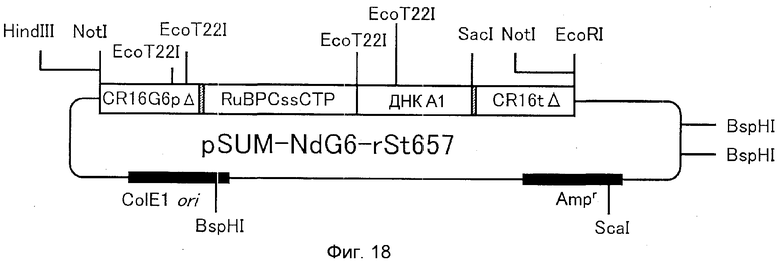


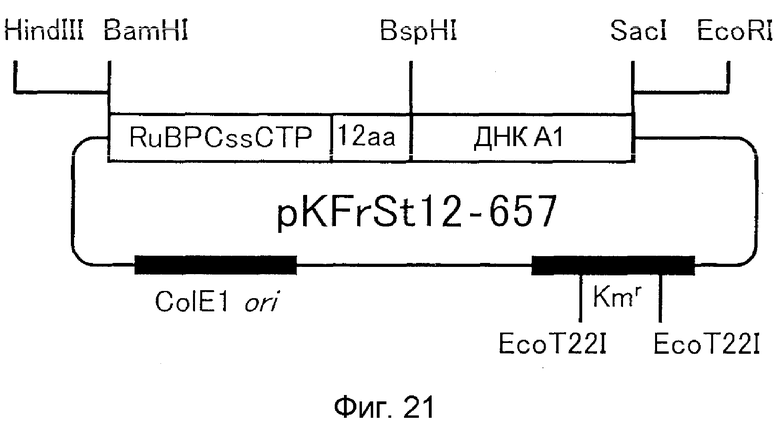
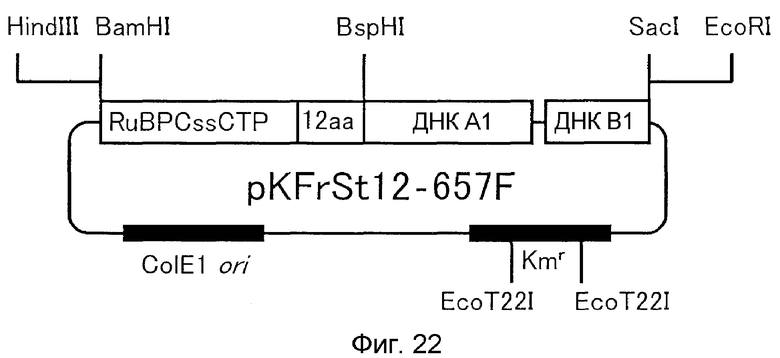

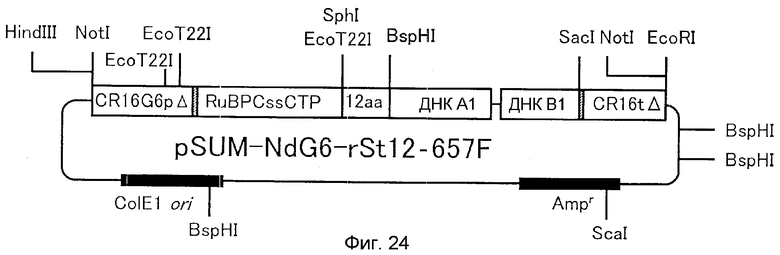

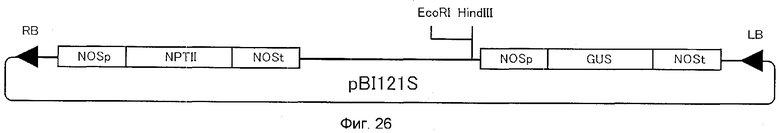
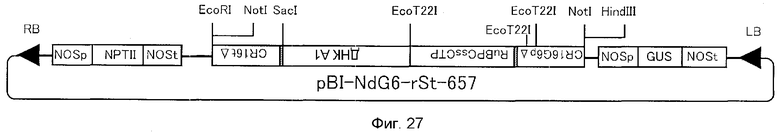

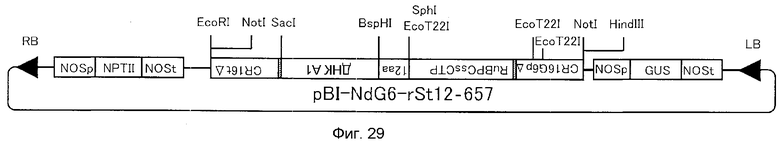
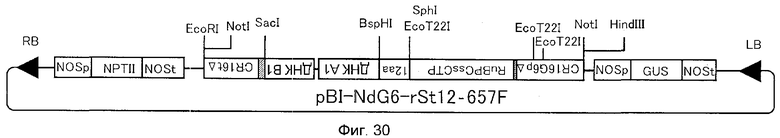

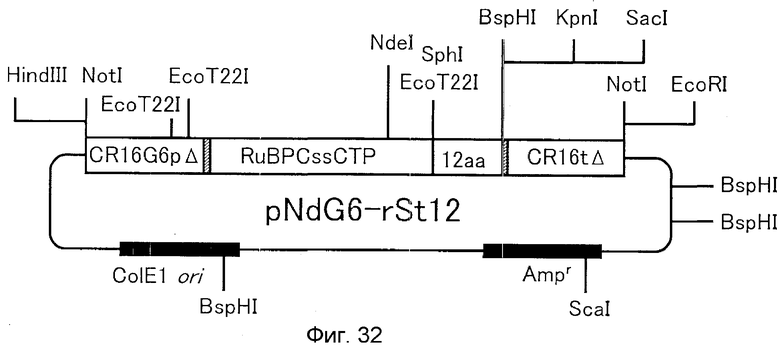
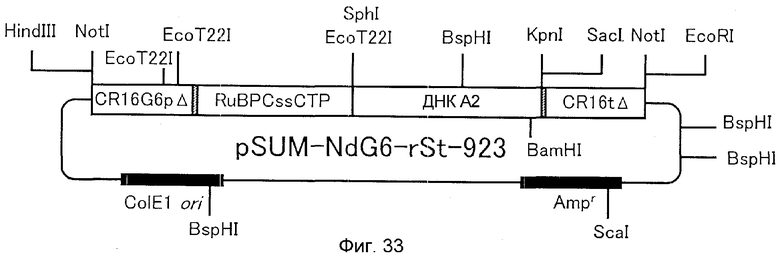
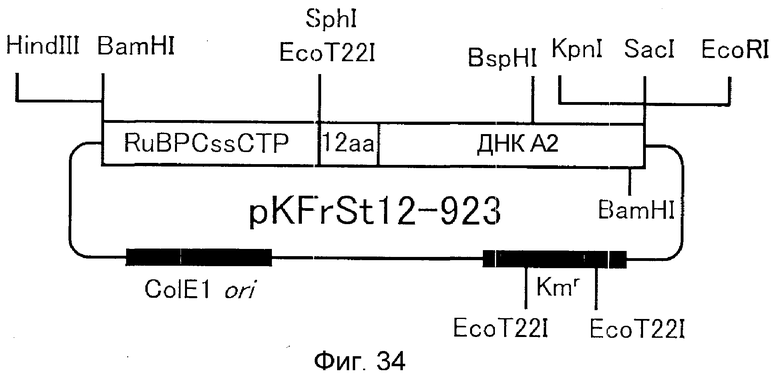
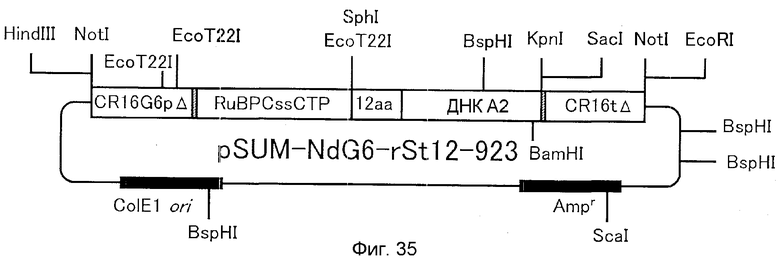
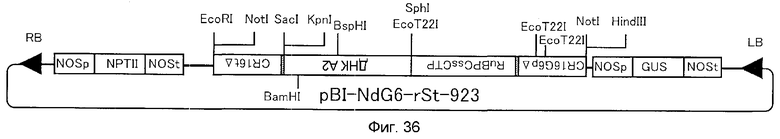
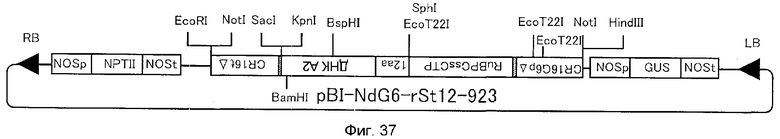

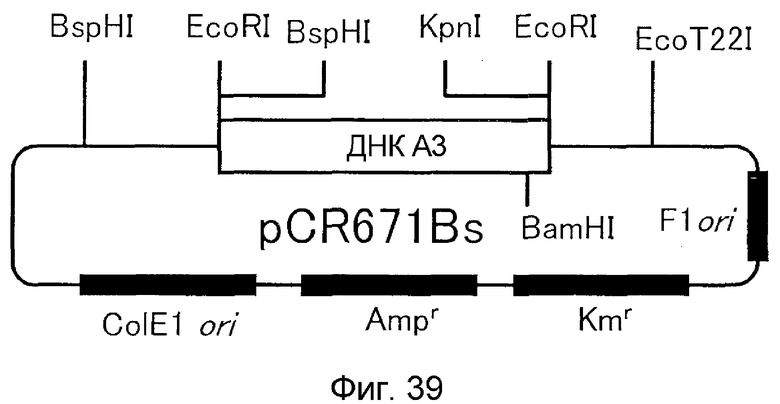
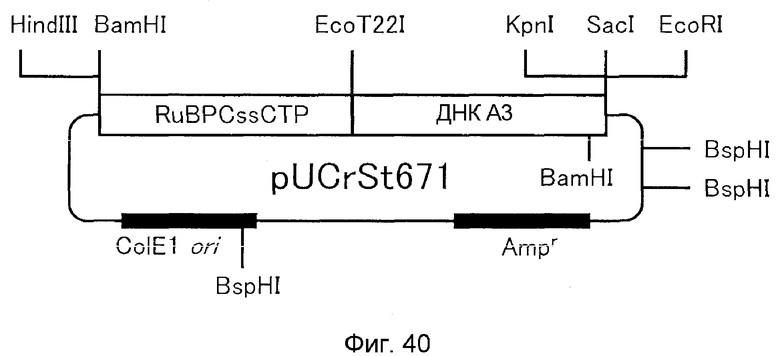

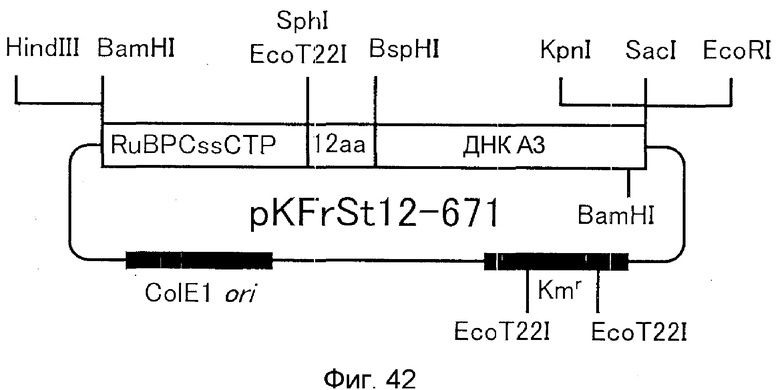
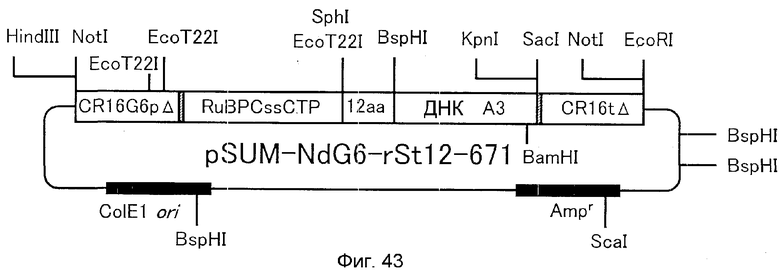


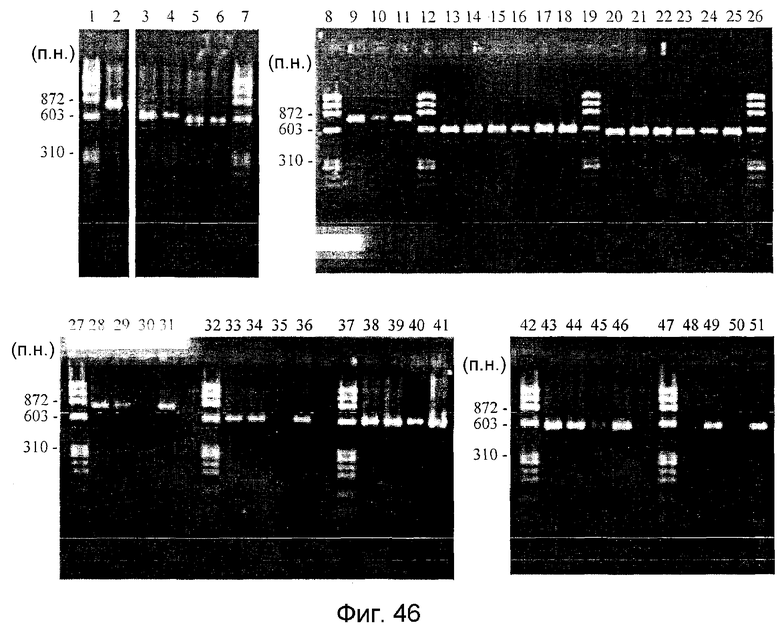
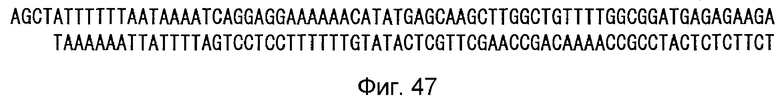



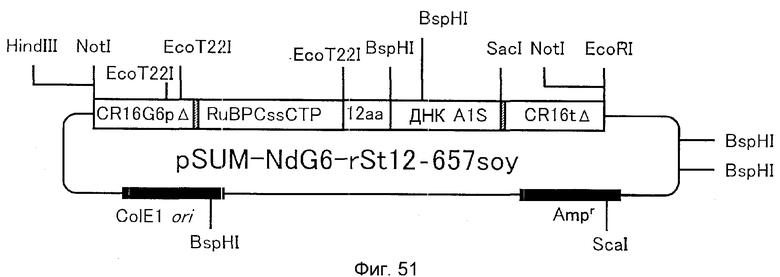


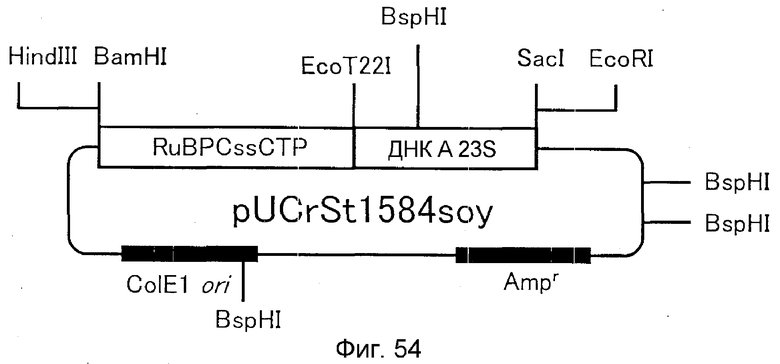
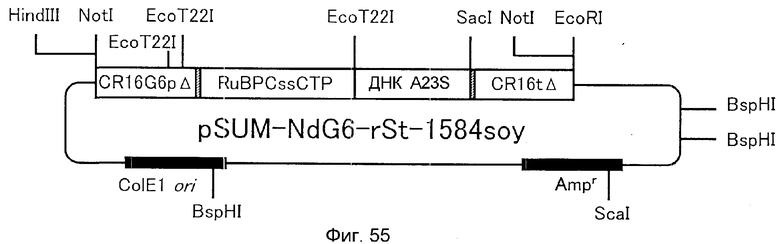




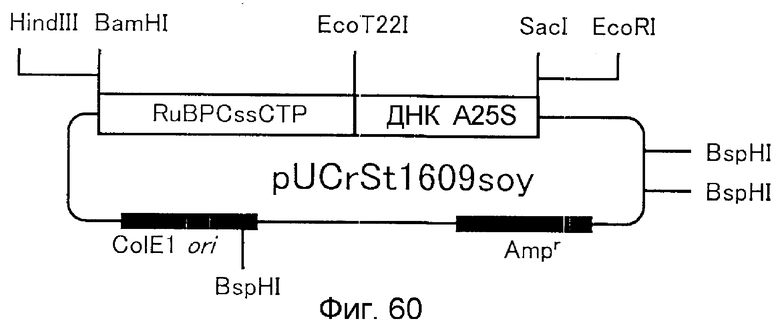


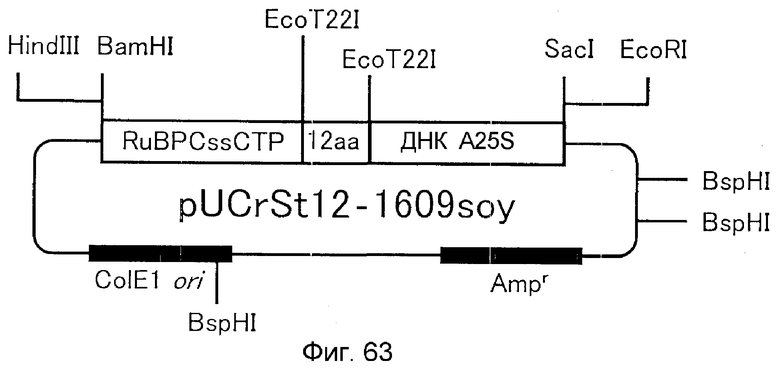

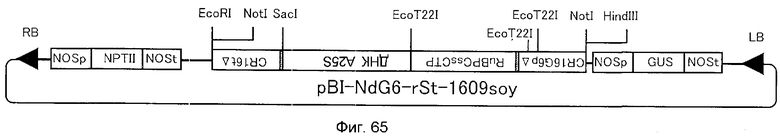

Обеспечивается ДНК, кодирующая белок, способный превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II), приведенной в описании изобретения, в соединение формулы (III), приведенной в описании изобретения. Белок способен метаболизировать гербициды. Введение ДНК в растение с экспрессией в нем указанного белка придает этому растению устойчивость к гербицидам. 19 н. и 6 з.п. ф-лы, 66 ил., 35 табл.
1. ДНК, кодирующая белок, способный превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II)

в соединение формулы (III)
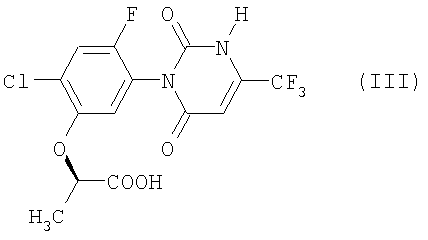
где указанный белок выбран из группы, состоящей из
(А11) белка, содержащего аминокислотную последовательность SEQ ID NO:159;
(A12) белка, содержащего аминокислотную последовательность SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, которая по меньшей мере на 80% идентична любой аминокислотной последовательности SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, которая по меньшей мере на 90% идентична любой аминокислотной последовательности SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(A27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, которая по меньшей мере на 90% идентична любой нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224.
2. ДНК по п.1, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из
(а5) нуклеотидной последовательности SEQ ID NO:139;
(а6) нуклеотидной последовательности SEQ ID NO:140;
(а7) нуклеотидной последовательности SEQ ID NO:141;
(а8) нуклеотидной последовательности SEQ ID NO:142;
(а9) нуклеотидной последовательности SEQ ID NO:143;
(а10) нуклеотидной последовательности SEQ ID NO:225;
(a11) нуклеотидной последовательности SEQ ID NO:226;
(а12) нуклеотидной последовательности SEQ ID NO:227;
(а13) нуклеотидной последовательности SEQ ID NO:228;
(а14) нуклеотидной последовательности SEQ ID NO:229;
(а15) нуклеотидной последовательности SEQ ID NO:230;
(а16) нуклеотидной последовательности SEQ ID NO:231;
(а17) нуклеотидной последовательности SEQ ID NO:232;
(а18) нуклеотидной последовательности SEQ ID NO:233;
(а19) нуклеотидной последовательности SEQ ID NO:234; и (а21) нуклеотидной последовательности, кодирующей аминокислотную последовательность белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), причем указанная нуклеотидная последовательность по меньшей мере на 90% идентична любой нуклеотидной последовательности SEQ ID NO:139, SEQ ID NO:140, SEQ ID NO:141, SEQ ID NO:142, SEQ ID NO:143, SEQ ID NO:225, SEQ ID NO:226, SEQ ID NO:227, SEQ ID NO:228, SEQ ID NO:229, SEQ ID NO:230, SEQ ID NO:231, SEQ ID NO:232, SEQ ID NO:233 или SEQ ID NO:234.
3. ДНК по п.1, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность указанного белка, где частота использования кодонов в указанной нуклеотидной последовательности находится в диапазоне плюс или минус 4% от частоты использования кодонов в генах того вида клетки-хозяина, в которую вводят ДНК, а GC-содержание указанной нуклеотидной последовательности составляет по меньшей мере 40% и максимально 60%.
4. ДНК по п.3, содержащая нуклеотидную последовательность SEQ ID NO:368.
5. ДНК по п.3, содержащая нуклеотидную последовательность SEQ ID NO:393.
6. ДНК, в которой ДНК, имеющая нуклеотидную последовательность, кодирующую транзитную сигнальную последовательность внутриклеточной органеллы, присоединена «слева» от ДНК по п.1 в рамке считывания.
7. ДНК, в которой ДНК по п.1 и промотор, функциональный в клетке-хозяине, функционально связаны.
8. Вектор клонирования, содержащий ДНК по п.1.
9. Вектор экспрессии, содержащий ДНК по п.1.
10. Способ получения вектора клонирования или экспрессии, включающий стадию введения ДНК по п.1 в вектор, реплицируемый в клетке-хозяине.
11. Клетка-хозяин, в которую введена ДНК по п.1 и которая экспрессирует указанную ДНК.
12. Клетка-хозяин по п.11, которая представляет собой микроорганизм или клетку растения.
13. Способ получения трансформанта, который экспрессирует ДНК по п.1, включающий стадию введения в клетку-хозяина ДНК по п.1.
14. Способ получения белка, способного превращать соединение формулы (II) в соединение формулы (III), причем указанный способ включает стадии культивирования трансформанта по п.12 и выделения полученного указанного белка.
15. Применение ДНК по п.1 для получения белка, способного превращать соединение формулы (II) в соединение формулы (III).
16. Способ придания растению резистентности к гербициду, включающий стадию введения в клетку растения ДНК по п.1 и экспрессию ДНК в клетке растения.
17. Полинуклеотид, который представляет собой праймер или зонд, при этом полинуклеотид имеет частичную нуклеотидную последовательность по меньшей мере из 20 нуклеотидов ДНК по п.1 или нуклеотидную последовательность, комплементарную указанной частичной нуклеотидной последовательности.
18. Способ обнаружения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), включающий стадию обнаружения ДНК, с которой гибридизуется зонд при гибридизации с использованием в качестве зонда ДНК по п.1 или полинуклеотида по п.17.
19. Способ обнаружения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), включающий стадию обнаружения ДНК, амплифицированной в полимеразной цепной реакции с полинуклеотидом по п.17 в качестве праймера.
20. Способ по п.19, где по меньшей мере один из праймеров выбран из группы, состоящей из полинуклеотида, содержащего любую нуклеотидную последовательность SEQ ID NO:124-SEQ ID NO:128, и полинуклеотида, содержащего нуклеотидную последовательность SEQ ID NO:129.
21. Способ получения ДНК, кодирующей белок, способный превращать соединение формулы (II) в соединение формулы (III), включающий стадию выделения ДНК, детектированной способом по п.18 или 19.
22. Способ скрининга клетки, имеющей ДНК, кодирующую белок, способный превращать соединение формулы (II) в соединение формулы (III), включающий стадию детектирования указанной ДНК из тест-клетки способом по п.18 или 19.
23. Белок, способный превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III), при этом указанный белок выбран из группы, состоящей из
(А11) белка, содержащего аминокислотную последовательность SEQ ID NO:159;
(А12) белка, содержащего аминокислотную последовательность SEQ ID NO:160;
(А13) белка, содержащего аминокислотную последовательность SEQ ID NO:136;
(А14) белка, содержащего аминокислотную последовательность SEQ ID NO:137;
(А15) белка, содержащего аминокислотную последовательность SEQ ID NO:138;
(А16) белка, содержащего аминокислотную последовательность SEQ ID NO:215;
(А17) белка, содержащего аминокислотную последовательность SEQ ID NO:216;
(А18) белка, содержащего аминокислотную последовательность SEQ ID NO:217;
(А19) белка, содержащего аминокислотную последовательность SEQ ID NO:218;
(А20) белка, содержащего аминокислотную последовательность SEQ ID NO:219;
(А21) белка, содержащего аминокислотную последовательность SEQ ID NO:220;
(А22) белка, содержащего аминокислотную последовательность SEQ ID NO:221;
(А23) белка, содержащего аминокислотную последовательность SEQ ID NO:222;
(А24) белка, содержащего аминокислотную последовательность SEQ ID NO:223;
(А25) белка, содержащего аминокислотную последовательность SEQ ID NO:224;
(А26) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, которая по меньшей мере на 80% идентична любой аминокислотной последовательности SEQ ID NO:159, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:217, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221 или SEQ ID NO:223, или аминокислотную последовательность, которая по меньшей мере на 90% идентична любой аминокислотной последовательности SEQ ID NO:160, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:218, SEQ ID NO:222 или SEQ ID NO:224; и
(A27) белка, способного превращать в присутствии системы транспорта электронов, содержащей донор электрона, соединение формулы (II) в соединение формулы (III) и содержащего аминокислотную последовательность, кодируемую нуклеотидной последовательностью, которая по меньшей мере на 90% идентична любой нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223 или SEQ ID NO:224.
24. Антитело, распознающее белок по п.23, где указанное антитело получено с использованием белка по п.23.
25. Способ обнаружения белка по п.23, включающий
(1) стадию контактирования тест-соединения с антителом, распознающим указанный белок, и
(2) стадию детектирования комплекса указанного белка и указанного антитела, возникающего в результате указанного контакта.
26. Набор для анализа или детектирования, содержащий антитело по п.24 и инструкцию по применению.
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| MOLECULAR MICROBIOLOGY, 1992, vol.6, no.15, pp.2125-2134. | |||
Авторы
Даты
2009-11-10—Публикация
2002-10-17—Подача