Данная заявка имеет приоритет согласно 35 USC § 119(e) по заявке на патент США № 60/578043, поданной 8 июня 2004 г., полное содержание которой включено сюда в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к фармацевтическим композициям.
УРОВЕНЬ ТЕХНИКИ
Заражение вирусом гепатита С («ВГС») представляет собой непреодолимую общественную медицинскую проблему. ВГС признается как причинный агент для большинства случаев не-А, не-В гепатитов при предполагаемой серо-распространенности у человека 3% в мировом масштабе [A.Alberti et al., “Natural History of Hepatitis C”, J.Hepatology, 31., (Suppl. 1), pp. 17-24 (1999)]. Почти четыре миллиона человек могут быть инфицированы только в Соединенных Штатах [M.J. Alter et al., “The Epidemiology of Viral Hepatitis in the United States, Gastroenterol. Clin. North Am. 23, pp. 437-455 (1994); M. J. Alter "Hepatitis С Virus Infection in the United States," J. Hepatology. 31., (Suppl. 1), pp. 88-91 (1999)].
При первом заражении ВГС только у около 20% инфицированных человек развивается острый клинический гепатит, в то время как у других кажется, что инфекция пропадает спонтанно. Однако практически в 70% случаев вирус вызывает хроническую инфекцию, которая сохраняется десятилетиями [S. Iwarson, “The Natural Course of Chronic Hepatitis,” FEMS Microbiology Reviews, 14, pp. 201-204 (1994); D. Lavanchy, "Global Surveillance and Control of Hepatitis C," J. Viral Hepatitis, 6, pp. 35-47 (1999)]. Это обычно приводит к рецидивному и прогрессивно ухудшающемуся воспалению печени, которое часто вызывает более тяжелые болезненные состояния, такие как цирроз и гепатоцеллюлярный рак [M.C. Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews, 14, pp. 211-220 (1994); I. Saito et. al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma." Proc. Natl. Acad. Sci. USA. 87, pp. 6547-6549 (1990)]. Предполагают, что ВГС инфицировано 170 миллионов человек во всем мире. В течение следующих десяти лет, так как большая часть зараженных в настоящее время пациентов вступит в третью декаду инфекции, ожидается, что количество смертей, вызванных гепатитом С, значительно увеличится. К сожалению, не существует распространенного способа лечения подрывающего здоровье развития хронического ВГС.
В настоящее время не существует полностью удовлетворительных анти-ВГС агентов или способов лечения. Для лечения ВГС применяют интерферон, а также ПЭГилированный интерферон, который также может назначаться в сочетании с Рибавирином. Известно, что любой режим лечения, включающий интерферон, имеет значительные побочные эффекты, и поэтому существует значительная неудовлетворенная медицинская потребность в безопасной, эффективной пероральной терапии для лечения вируса гепатита С. Более того, перспективы эффективных анти-ВГС вакцин остаются неопределенными.
VX-950 является конкурентоспособным обратимым пептидомиметическим ингибитором ВГС NS3/4A протеазы с устойчивым коэффициентом связывания (ki*) 3 нМ (и с Ki 8 нМ) [WO02/018369].
VX-950 практически нерастворим в воде.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении описаны формы и композиции VX-950, имеющие улучшенную биодоступность по отношению к кристаллическому VX-950. Эти формы и композиции применяются для лечения инфекции ВГС.
Следовательно, в одном аспекте данное изобретение относится к получению аморфного VX-950, например композиции VX-950, которая практически не содержит примесей и/или кристаллического VX-950. Например, в одном варианте данное изобретение относится к композициям, содержащим VX-950 в аморфной форме, которая улучшает метастабильную растворимость VX-950 по отношению к кристаллической форме, обеспечивая таким образом улучшенную биодоступность. Данное изобретение включает множество возможных композиций, которые все содержат VX-950 в аморфной форме.
В одном аспекте данное изобретение относится к композиции, включающей аморфный VX-950 и второй компонент. Второй компонент может быть выбран из множества компонентов, включая, например, поверхностно-активное вещество, полимер или инертное фармацевтически приемлемое вещество. В некоторых предпочтительных вариантах композиция включает твердую дисперсию, смесь или жидкую дисперсию. В некоторых вариантах композиция имеет форму твердого вещества (например, таблетки или капсулы).
В другом аспекте данное изобретение относится к твердой дисперсии аморфного VX-950.
В некоторых вариантах твердая дисперсия включает менее чем около 40% кристаллического VX-950 (например, менее чем около 35%, менее чем около 30%, менее чем около 20%, менее чем около 10%, менее чем около 5% или менее чем около 1%). Например, в некоторых вариантах твердая дисперсия практически не содержит кристаллический VX-950.
В некоторых вариантах твердая дисперсия также включает поверхностно-активное вещество, полимер или инертное фармацевтически приемлемое вещество. Например, твердая дисперсия может включать полимер, и полимер может включать один или более одного растворимого в воде полимера или частично растворимого в воде полимера.
В некоторых вариантах VX-950 имеет улучшенную физическую или химическую стабильность по отношению к аморфному VX-950 без присутствия полимера. В некоторых вариантах твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950. В некоторых вариантах VX-950 имеет скорость релаксации ниже, чем скорость релаксации чистого аморфного VX-950.
В некоторых вариантах твердая дисперсия включает полимер, который присутствует в достаточном количестве, таком, чтобы после введения твердой дисперсии уровень VX-950 в крови крысы был на около 20% выше, чем при введении VX-950, который не включает полимер, например, по крайней мере, на около 50% выше, по крайней мере, на около 100% выше, по крайней мере, на около 200% выше, по крайней мере, на около 300% выше или, по крайней мере, на около 400% выше.
В некоторых вариантах твердая дисперсия включает целлюлозный полимер, например полимер ГПМЦ или полимер САГПМЦ.
В некоторых вариантах полимер присутствует в твердой дисперсии в количестве от около 10% мас. до около 80% мас., например, от около 30% мас. до около 75% мас., например, около 70% мас., около 50% мас. или около 49,5% мас.
В некоторых вариантах VX-950 присутствует в твердой дисперсии в количестве от около 10% мас. до около 80% мас., например, от около 30% мас. до около 75% мас., например около 70% масс, около 50% масс или около 49,5% мас. В некоторых вариантах VX-950 присутствует в твердой дисперсии в количестве более около 80%.
В некоторых вариантах твердая дисперсия включает поверхностно-активное вещество, например, лаурилсульфат натрия или витамин Е TPGS.
Количество поверхностно-активного вещества в твердой композиции зависит от множества факторов, включая, например, химическую природу поверхностно-активного вещества. В некоторых вариантах поверхностно-активное вещество присутствует в количестве от около 0,1 до около 15%, например от около 0,1% до около 5%, предпочтительно, около 1%.
В некоторых вариантах практически весь VX-950 присутствует в твердой дисперсии в аморфной форме.
В некоторых вариантах VX-950 является смесью L-изомера и D-изомера.
В некоторых вариантах VX-950 является практически чистым L-изомером.
В некоторых вариантах твердую дисперсию получают распылительной сушкой.
В одном варианте в данном изобретении представлена твердая дисперсия VX-950, такая как аморфная твердая дисперсия. Например, представлена аморфная твердая дисперсия, включающая VX-950, по крайней мере, один полимер и, необязательно, одно или более улучшающее растворимость поверхностно-активное вещество. Дисперсия может улучшать растворимость в воде и биодоступность VX-950 при пероральном введении твердой дисперсии млекопитающему (например, крысе, собаке или человеку). В определенных аспектах, по крайней мере, часть VX-950 в твердой дисперсии находится в аморфном состоянии (например, по крайней мере, около 50%, по крайней мере, около 55%, по крайней мере, около 60%, по крайней мере, около 65%, по крайней мере, около 70%, по крайней мере, около 75%, по крайней мере, около 80%, по крайней мере, около 85%, по крайней мере, около 90%, по крайней мере, около 95%, по крайней мере, около 98% или, по крайней мере, около 99%). В предпочтительных вариантах твердая дисперсия полностью или практически свободна от кристаллического VX-950.
В определенных твердых дисперсиях VX-950 (например, аморфный VX-950) присутствует в количестве вплоть до около 99%, например вплоть до около 98%, вплоть до около 95%, вплоть до около 90%, вплоть до около 85%, вплоть до коло 80%, вплоть до около 70%, предпочтительно, вплоть до около 70%, вплоть до около 65%, вплоть до около 60%, вплоть до около 55% и более предпочтительно, вплоть до около 50% от общей массы твердой дисперсии. В других вариантах VX-950 присутствует в количестве, по крайней мере, около 1% от массы твердой дисперсии, например, по крайней мере, около 2%, по крайней мере, около 3%, по крайней мере, около 4%, предпочтительно, по крайней мере, около 5%, по крайней мере, около 6%, по крайней мере, около 7%, по крайней мере, около 8%, по крайней мере, около 9%, более предпочтительно, по крайней мере, 10%, и даже более предпочтительно, по крайней мере, около 50%. Как показано в примерах, твердая дисперсия, в которой VX-950 присутствует в количестве около 50% мас. (более конкретно, около 49,5%) включена в объем данного изобретения.
В некоторых вариантах, когда VX-950 присутствует в твердой дисперсии, по крайней мере, около 60% мас. VX-950 имеет аморфную форму, например, по крайней мере, около 65%, по крайней мере, около 70%, по крайней мере, около 75%, предпочтительно, по крайней мере, около 80%, по крайней мере, около 85%, по крайней мере, около 90%, по крайней мере, около 95%, по крайней мере, около 98% или по крайней мере, около 99%. Дисперсии, в которых весь или практически весь VX-950 имеет аморфную форму, также включены.
В некоторых вариантах дисперсия, включающая VX-950, включает смесь L-изомера и D-изомера (например, 1:1) VX-950, или VX-950 может быть в практически чистой форме любого изомера. Например, включены смеси около 60:40 L:D (±5%). В определенных вариантах VX-950 содержится в количестве около 95%, около 98% или более чем около 98% L-изомера.
Аморфная твердая дисперсия обычно имеет температуру стеклования, при которой дисперсия превращается из стекловидного твердого вещества в резиноподобную композицию. В общем, чем выше температура стеклования, тем больше физическая стабильность дисперсии. Существование температуры стеклования обычно указывает на то, что, по крайней мере, большая часть композиции (например, дисперсии) существует в аморфном состоянии. Температура стеклования (Tg) твердой дисперсии, подходящей для фармацевтического применения, обычно составляет, по крайней мере, около 50°С. В некоторых вариантах предпочтительны более высокие температуры. Поэтому в некоторых вариантах твердая дисперсия в соответствии с данным изобретением имеет Tg, по крайней мере, около 100°С (например, по крайней мере, около 100°С, по крайней мере, около 105°С, по крайней мере, около 110°С, по крайней мере, около 115°С, по крайней мере, около 120°С, по крайней мере, около 125°С, по крайней мере, около 130°С, по крайней мере, около 135°С, по крайней мере, около 140°С, по крайней мере, около 150°С, по крайней мере, около 160°С, по крайней мере, около 170°С, по крайней мере, около 175°С, по крайней мере, около 180°С или, по крайней мере, около 190°С). В некоторых предпочтительных вариантах Tg составляет вплоть до 200°С. Если не указано иначе, температуру стеклования, описанную здесь, измеряют в сухих условиях.
В другом аспекте в данном изобретении представлен аморфный VX-950. Аморфный VX-950, без добавления или присутствия любых полимеров или других наполнителей, улучшает растворимость в воде и биодоступность VX-950 (по сравнению с кристаллическим VX-950) при пероральном дозировании млекопитающим.
В другом аспекте в данном изобретении представлены фармацевтические композиции аморфного VX-950. В некоторых вариантах аморфный VX-950 практически не содержит кристаллический VX-950.
В другом аспекте данное изобретение относится к фармацевтической композиции, включающей аморфный VX-950 в виде твердой дисперсии и одно или более поверхностно-активное вещество, полимер, инертное фармацевтически приемлемое вещество или фармацевтически приемлемый носитель.
В некоторых вариантах композиция включает полимер, и полимер представляет собой один или более чем один растворимый в воде полимер или частично растворимый в воде полимер.
В некоторых вариантах VX-950 имеет улучшенную физическую или химическую стабильность по сравнению с кристаллическим VX-950. В некоторых вариантах твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950. В некоторых вариантах VX-950 имеет скорость релаксации ниже, чем скорость релаксации чистого аморфного VX-950.
В некоторых вариантах фармацевтическая композиция включает полимер в достаточном количестве, таком, чтобы после введения твердой дисперсии уровень VX-950 в крови крысы был на около 20% выше, чем при введении VX-950, который не включает полимер, например, по крайней мере, на около 50% выше, по крайней мере, на около 100% выше, по крайней мере, на около 200% выше, по крайней мере, на около 300% выше или, по крайней мере, на около 400% выше.
В некоторых вариантах полимер является целлюлозным полимером, таким как ГПМЦ или САГПМЦ.
В некоторых вариантах данное изобретение относится к фармацевтической композиции, включающей аморфную твердую дисперсию VX-950, где указанный VX-950 составляет 30-75% мас./мас. фармацевтической композиции, один или более полимер, выбранный из группы ГПМЦ и САГПМЦ, где указанный полимер составляет 30-75% мас./мас. фармацевтической композиции, и поверхностно-активное вещество, где поверхностно-активное вещество 0,5-2% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах полимером является ГПМЦ или САГПМЦ.
В некоторых вариантах поверхностно-активным веществом является лаурилсульфат натрия или витамин Е TPGS.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты: указанный VX-950 составляет 49,5% мас./мас. фармацевтической композиции, указанным полимером является ГПМЦ и он составляет около 49,5% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты: указанный VX-950 составляет около 49,5% мас./мас. фармацевтической композиции, указанным полимером является САГПМЦ и он составляет около 49,5% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты, где указанный VX-950 составляет около 70% мас./мас. фармацевтической композиции, указанным полимером является ГПМЦ или САГПМЦ и он составляет около 29% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В другом аспекте данное изобретение относится к фармацевтической композиции, включающей водную суспензию, включающую частицы аморфного VX-950 и полимер в растворе, выбранный из группы ГПМЦ и САГПМЦ.
В некоторых вариантах аморфный VX-950 в виде твердой дисперсии.
В некоторых вариантах фармацевтическая композиция также включает поверхностно-активное вещество либо в растворе, либо в качестве компонента частиц VX-950, или оба варианта. Поверхностно-активным веществом может быть, например, ЛСН или витамин Е TPGS.
В некоторых вариантах полимер находится либо в растворе, либо в виде компонента частиц VX-950, или оба варианта.
В некоторых вариантах водная суспензия включает от около 0,1% до около 20% мас. поверхностно-активного вещества. В некоторых вариантах водная суспензия включает от около 1 мг/мл до около 100 мг/мл мас. аморфного VX-950. В некоторых вариантах водная суспензия включает от около 0,1% до около 2,0% мас. полимера, например около 1% мас. полимера.
В некоторых вариантах данное изобретение включает способы получения формы, дисперсии, композиции или фармацевтической композиции, описанной здесь.
Следовательно, описан способ получения аморфной формы VX-950, включающий распылительную сушку. В одном варианте представлен способ получения аморфной формы VX-950 объединением VX-950 и подходящего растворителя с получением смеси и затем распылительной сушкой смеси с получением аморфной формы VX-950. Смесь может быть либо раствором, либо суспензией.
В другом аспекте данное изобретение относится к способу получения аморфной формы VX-950, включающему распылительную сушку VX-950 с получением аморфной формы VX-950.
В некоторых вариантах способ включает объединение VX-950 и подходящего растворителя с получением смеси и последующую распылительную сушку смеси с получением аморфной формы VX-950.
В некоторых вариантах способ включает
а) получение смеси VX-950, полимера и растворителя; и
b) распылительную сушку смеси с получением твердой дисперсии, содержащей VX-950.
В некоторых вариантах полимером является ГПМЦ или САГПМЦ.
В некоторых вариантах полимер присутствует в количестве от около 30% до около 70% мас. в твердой дисперсии.
В некоторых вариантах смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (ЛСН) или витамин Е TPGS.
В некоторых вариантах растворитель включает метиленхлорид. В некоторых вариантах растворитель включает ацетон. В некоторых вариантах растворитель включает смесь метиленхлорида и ацетона. Например, растворитель может включать от около 0% до коло 30% ацетона и от около 70% до около 100% метиленхлорида, или растворитель может включать от около 0% до около 40% ацетона и от около 60% до около 100% метиленхлорида. Другие типовые соотношения метиленхлорида к ацетону включают 80:20, 75:25 и 70:30.
В другом аспекте данное изобретение относится к твердой дисперсии, полученной описанным здесь способом.
В данном изобретении также представлен способ получения твердой дисперсии VX-950, включающий:
а) получение раствора VX-950, полимера (например, ингибирующего кристаллизацию или стабилизирующего полимера) и растворителя;
b) быстрое удаление раствора из растворителя с получением твердой аморфной дисперсии, содержащей VX-950 и ингибирующий кристаллизацию полимер. В определенных вариантах растворитель удаляют распылительной сушкой.
Понятно, что распылительная сушка может проводиться в присутствии инертного газа. В определенных вариантах способы, которые включают распылительную сушку, могут проводиться в присутствии сверхкритической жидкости, содержащей двуокись углерода или смесь двуокиси углерода.
Следовательно, в другом варианте данное изобретение относится к способу получения твердой дисперсии VX-950, включающему:
а) получение смеси VX-950, полимера (например, полимера подложки, ингибирующего кристаллизацию или стабилизирующего полимера) и растворителя; и
b) распылительную сушку смеси с получением твердой дисперсии, содержащей VX-950.
Эти способы могут применяться для получения композиции в соответствии с данным изобретением. Количества и характеристики компонентов, применяемых в способах, являются такими, как указано в данном описании.
В другом аспекте изобретение относится к способу лечения инфекции ВГС у млекопитающего. В одном варианте способ включает введение аморфного VX-950, как определено в данном описании. В другом варианте способ включает введение твердой дисперсии, представленной в данном описании.
В другом варианте способ включает введение дополнительного агента, выбранного из иммуномодулирующего агента; противовирусного агента; другого ингибитора NS3/4A протеазы ВГС; другого ингибитора IMPDH; ингибитора мишени в жизненном цикле ВГС, отличной от NS3/4А протеазы; ингибитора внутреннего рибосомального входа, ингибитора вирусов широкого спектра действия; ингибитора цитохрома Р-450; или их сочетаний.
В другом аспекте данное изобретение относится к фармацевтическим упаковкам или наборам, включающим композицию VX-950, представленную в данном описании, или аморфный VX-950.
Аморфная форма лекарственного средства может демонстрировать свойства, отличные от кристаллической формы (см. патент США 6627760). Варианты данного изобретения включают аморфный VX-950, который термодинамически имеет более высокий уровень энергии по сравнению с соответствующей кристаллической формой. Поэтому он более активен энергетически и поэтому часто демонстрирует более высокую метастабильную растворимость, более быстрое растворение, а также менее стабильные физические свойства. Первые два свойства улучшают растворимость в воде и биодоступность лекарственного средства, в то время как последнее свойство может быть нежелательным для достижения данной цели, давая менее стабильную композицию, где биодоступность может изменяться вследствие перекристаллизации лекарственного средства из аморфного состояния во время хранения, или при введении человеку или животным.
Для улучшения стабильности аморфного твердого вещества (которое обычно менее стабильно, чем кристаллическая форма) может применяться полимер или полимерная смесь для получения аморфной твердой диспергированной системы вместе с лекарственным средством. В некоторых вариантах может быть получен «твердый раствор», который представляет собой систему, фазы которой не разделяются во в течение времени, или твердая дисперсия, в которых перекристаллизация лекарственного средства эффективно ингибируется во время фармацевтически значительного периода времени (например, два года) при температуре окружающей среды.
В предпочтительных вариантах высвобождение полимера из твердой дисперсии, где твердая дисперсия содержит VX-950 и полимер, в водный раствор может снижать опосредованную раствором кристаллизацию VX-950, который солюбилизируется в водной среде после выделения из твердой дисперсии. Например, если твердая дисперсия VX-950 введена в водную биологическую жидкость, например, содержащуюся в желудке или тонком кишечнике, совместное высвобождение или увеличенное высвобождение полимера, например HMPC или HMPCAS, с аморфным VX-950 будет снижать кристаллизацию VX-950 в водной биологической жидкости, тем самым улучшая одно или более свойство из биодоступности, растворимости и абсорбции VX-950. Более того, включение такого полимера, либо в водной среде, либо в сочетании с VX-950 может снижать кристаллизацию VX-950 в водной среде in vitro, например, при получении жидких композиций VX-950.
Получению аморфной твердой дисперсии, содержащей VX-950, препятствуют несколько проблем. Во-первых, VX-950 не растворяется в сколько-нибудь значительном количестве в воде или большинстве других обычных органических растворителей, включая ацетон, этилацетат и ацетонитрил. Растворимость в воде VX-950 при комнатной температуре фактически неопределима ВЭЖХ, и растворимость в воде не зависит от рН. Во-вторых, VX-950 обладает химической реакционной способностью с некоторыми спиртами, например МеОН, EtOH и iPrOH, что делает эти растворители непригодными. В-третьих, температура плавления VX-950 составляет около 240°С, что делает методики погружения в расплав до некоторой степени невыполнимыми из-за потенциального разложения VX-950 при высокой температуре. Поэтому подходящий растворитель или смесь растворителей является критической для оптимизации обработки и получения твердой дисперсии.
Аморфные твердые дисперсии в соответствии с данным изобретением могут значительно улучшать пероральную биодоступность VX-950. В присутствии подходящего поверхностно-активного вещества или смеси поверхностно-активных веществ (например, ЛСН или витамин Е сукцинат d-альфа-токоферил полиэтиленгликоля 1000 (витамин Е TPGS)), биодоступность также может быть улучшена.
Аморфные твердые дисперсии в соответствии с данным изобретением могут обеспечивать улучшенную биодоступность VX-950 при пероральном введении по сравнению с введением кристаллического VX-950. В некоторых вариантах такие твердые дисперсии находятся в твердом состоянии и могут удобным образом храниться и вводиться. Получение твердых дисперсий может успешно проводиться и постепенно увеличиваться выбором органического растворителя или смеси растворителей (например, метиленхлорид, ацетон и т.д.) или сверхкритической жидкости (например, включающей двуокись углерода). В некоторых вариантах твердые дисперсии могут иметь улучшенную химическую и физическую стабильность. Например, в некоторых случаях твердые дисперсии могут быть химически и/или физически стабильны а течение, по крайней мере, двух лет при соответствующих условиях хранения (комнатная температура).
Более подробное описание одного или более вариантов данного изобретения представлено в описании ниже. Другие характеристики, объекты и преимущества данного изобретения станут очевидны из дальнейшего описания и формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлено сравнение различных композиций VX-950.
На фиг.2 представлено сравнение рК крысы для различных композиций, включающих VX-950.
На фиг. 3-6 представлено сравнение данных стабильности для различных суспензий, включая VX-950 и витамин Е TPGS.
На фиг. 7-10 представлено сравнение кинетических данных растворимости для различных суспензий, включающих VX-950 и витамин Е TPGS.
ПОДРОБНОЕ ОПИСАНИЕ
В общем, было обнаружено, что абсолютная биодоступность после перорального введения микронизированного кристаллического лекарственного порошка VX-950 крысам составляет менее 0,5%. Простые смеси VX-950 с обычными фармацевтическими наполнителями демонстрируют похожую низкую биодоступность при пероральном введении млекопитающим. Композиции, включающие VX-950 в кристаллической форме (т.е., где значительная смесь VX-950 находится в кристаллической форме), обычно не обеспечивают такую степень абсорбции лекарственного средства, которая дает значительный терапевтический эффект VX-950. Описанные здесь композиции обеспечивают сравнительно улучшенную биодоступность. Следовательно, в некоторых вариантах представлено получение аморфного VX-950. Примером является очищенный препарат, который практически не содержит примесей, включая кристаллический VX-950. В некоторых вариантах данное изобретение включает фармацевтическую композицию в виде твердой дисперсии, содержащей VX-950. Композиции в соответствии с данным изобретением являются стабильными, легки при введении и обладают высокой биодоступностью VX-950 при введении.
В определенных вариантах VX-950 присутствует в количестве от около 5% до около 90% мас., например от около 5% до около 70%, предпочтительно вплоть до около 50% мас. VX-950 представляет смесь D-изомера и L-изомера, или практически чистый продукт любого изомера. Предпочтительно, VX-950 является практически аморфным (например, по крайней мере, около 50% VX-950 является аморфным, по крайней мере, около 55% VX-950 является аморфным, по крайней мере, около 60% VX-950 является аморфным, по крайней мере, около 65% VX-950 является аморфным, по крайней мере, около 70% VX-950 является аморфным, по крайней мере, около 75% VX-950 является аморфным, по крайней мере, около 80% VX-950 является аморфным, по крайней мере, около 85% VX-950 является аморфным, по крайней мере, около 90% VX-950 является аморфным, по крайней мере, около 95% VX-950 является аморфным, по крайней мере, около 98% VX-950 является аморфным, по крайней мере, около 99% VX-950 является аморфным или практически весь VX-950 является аморфным).
В данном описании термин «аморфный» относится к твердому материалу, не имеющему дальнего порядка в положении его атомов. Аморфные твердые вещества обычно представляют собой переохлажденные жидкости, в которых молекулы расположены случайным образом так, что не имеют определенного расположения и дальнего порядка атомов. Аморфные твердые вещества обычно являются изотропными, т.е. обладают сходными свойствами во всех направлениях и не имеют определенных температур плавления. Например, аморфный материал представляет собой твердый материал, не имеющий острых характеристических кристаллических пиков в порошковой дифракционной рентгенограмме (ПДР) (т.е. кристаллы не определяются ПДР). Вместо этого в ПДР видны один или несколько широких пиков (т.е. ореолов). Широкие пики являются характерными для аморфного твердого вещества. См. патент США 2004/0006237 для сравнения ПДР аморфного материала и кристаллического материала.
В данном описании «кристаллическое твердое вещество» относится к соединениям или композициям, в которых структурные единицы расположены в фиксированном геометрическом порядке или матрице таким образом, что кристаллические твердые вещества имеют жесткий дальний порядок. Единицы, которые составляют кристаллическую структуру, могут быть атомами, молекулами или ионами. Кристаллические твердые вещества имеют определенные температуры плавления.
В данном описании «дисперсия» относится к диспергированной системе, в которой одно вещество, диспергированная фаза, распределено отдельными единицами, во второй структуре (однородная фаза или носитель). Размер диспергированной фазы может значительно варьироваться (например, коллоидные частицы размером от нанометра до нескольких микронов). В общем, диспергированные фазы могут быть твердыми веществами, жидкостями или газами. В случае твердой дисперсии диспергированная и однородная фазы обе являются твердыми веществами. В фармацевтических применениях твердая дисперсия может включать кристаллическое лекарственное средство (диспергированная фаза) в аморфном полимере (однородная фаза), или, альтернативно, аморфное лекарственное средство (диспергированная фаза) в аморфном полимере (однородная фаза). В некоторых вариантах аморфная твердая дисперсия включает полимер, составляющий диспергированную фазу, и лекарственное средство, составляющее однородную фазу.
Термин «аморфная твердая дисперсия» обычно относится к твердой дисперсии двух или более компонентов, обычно лекарственного средства и полимера, но, возможно, содержащей другие компоненты, такие как поверхностно-активные вещества или другие фармацевтические эксципиенты, где лекарственное средство находится в аморфной фазе, а физическая стабильность и/или растворение и/или растворимость аморфного лекарственного средства улучшается другими компонентами.
Представленная здесь твердая дисперсия является особенно предпочтительным вариантом данного изобретения. Твердые дисперсии обычно включают соединение, диспергированное в подходящем носителе, таком как твердый носитель. В одном варианте носитель в соответствии с данным изобретением включает полимер, предпочтительно, растворимый в воде полимер или частично растворимый в воде полимер. Должно быть понятно, что один или более чем один растворимый в воде полимер может применяться в твердой дисперсии в соответствии с данным изобретением.
Типовой твердой дисперсией является совместно осажденный или совместно расплавленный VX-950 с, по крайней мере, одним полимером. «Совместно осажденным» является продукт, полученный после растворения лекарственного средства и полимера в растворителе или смесь растворителей с последующим удалением растворителя или смеси растворителей. Иногда полимер может быть суспендирован в растворителе или смеси растворителей. Растворитель или смесь растворителей включает органические растворители и сверхкритические жидкости. «Совместно расплавленным» является продукт, полученный после нагревания лекарственного средства и полимера до расплава, необязательно в присутствии растворителя или смеси растворителей, с последующим смешиванием, удалением, по крайней мере, части растворителя, если применяется, и охлаждением до комнатной температуры при определенной скорости. В некоторых случаях твердые дисперсии получают добавлением раствора лекарственного средства и твердого полимера с последующим смешиванием и удалением растворителя. Для удаления растворителя применяют вакуумную сушку, распылительную сушку, лотковую сушку, лиофилизацию и другие методики сушки. Применение любого из этих способов с применением подходящих параметров обработки, в соответствии с данным изобретением, дает VX-950 в аморфном состоянии в конечной твердой дисперсии.
Получение аморфного VX-950
Любой метод получения аморфных форм и твердых дисперсий может применяться в данном изобретении, включая, например, методы, описанные в US 2003/0186952 (см. документы, представленные в параграфе 1092) и US 2003/0185891). В общем, применяемые методы включают такие, в которых применяется быстрое удаление растворителя из смеси или охлаждение расплавленного образца. Такие методы включают, но не ограничиваются ими, ротационное выпаривание, сушку сублимацией (например, лиофилизацию), вакуумную сушку, отверждение расплава и экструзию расплава. Однако предпочтительный вариант данного изобретения включает аморфную твердую дисперсию, полученную распылительной сушкой. Следовательно, в другом варианте данное изобретение относится к сушке продукта, осуществляемой распылительной сушкой для удаления растворителя.
Описанные здесь препаративные формы, например фармацевтические композиции, могут быть получены распылительной сушкой смеси, содержащей VX-950, подходящий полимер и соответствующий растворитель. Распылительная сушка представляет собой метод, который включает распыление жидкой смеси, содержащей, например, твердое вещество и растворитель, и удаление растворителя. Распыление может проводиться, например, через сопло или на вращающемся диске.
Распылительная сушка представляет собой процесс, который превращает жидкий поток в высушенные частицы. Необязательно, вторичный метод сушки, такой как сушка с псевдоожиженным слоем или вакуумная сушка, может применяться для уменьшения количества остаточных растворителей до фармацевтически приемлемых уровней. Обычно распылительная сушка включает контактирование сильно диспергированной жидкой суспензии или раствора и достаточного объема горячего воздуха, что вызывает испарение и сушку жидких капель. Композиция, подвергающаяся распылительной сушке, может включать любой раствор, грубодисперсную суспензию, суспензию, коллоидную дисперсию или пасту, которые могут быть распылены с применением выбранного аппарата распылительной сушки. Согласно стандартной методике композицию распыляют в поток теплого фильтрованного воздуха, который выпаривает растворитель и направляет высушенный продукт в сборник (например, циклон). Использованный воздух затем выпускают с растворителем или, альтернативно, использованный воздух посылают в конденсатор для сбора и последующего повторного применения растворителя. Коммерчески доступные типы аппаратов могут применяться для проведения распылительной сушки. Например, коммерческие распылительные сушки производства Buchi Ltd. и Niro (например, линия распылительных сушек PSD производства Niro) (см. US 2004/0105820; US 2003/0144257).
В распылительных сушках обычно применяется загрузка твердых веществ материала от около 5% до около 30% (т.е. лекарственное средство плюс наполнители), предпочтительно, по крайней мере, около 10%. В некоторых вариантах загрузка менее 10% может привести к плохому выходу и неожиданно длительному периоду обработки. В общем, верхний предел загрузки твердых веществ определяется вязкостью (т.е. способностью к накачиванию) полученного раствора и растворимостью компонентов в растворе. Обычно вязкость раствора может определять размер частиц в полученном порошковом продукте.
Методики и методы распылительной сушки можно найти в Perry's Chemical Engineering Handbook, 6th Ed., R.H. Perry, D.W. Green & J.O. Maloney, eds.), McGraw-Hill book со. (1984); и Marshall "Atomization and Spray-Drying" 50, Chem. Eng. Prog. Monogr. Series 2 (1954). В общем, распылительную сушку проводят при температуре на входе от около 60°С с до около 200°С, например от около 70°С до около 150°С, предпочтительно от около 80°С до около 110°С, например около 90°С. Распылительную сушку обычно проводят при температуре на выходе от около 40°С до около 100°С, например от около 50°С до около 65°С, например при около 56°С или 58°С.
Удаление растворителя может потребовать последующей стадии сушки, такой как лотковая сушка, сушка в псевдоожиженном слое (т.е. при температуре от комнатной температуры до около 100°С), вакуумная сушка, микроволновая сушка, барабанная сушка или биконическая вакуумная сушка (т.е. при температуре от комнатной температуры до около 200°С).
В некоторых случаях было обнаружено, что ПВП K29/32 может улавливать растворитель в твердом веществе. Существует прямая связь между объемной плотностью/потоком и остаточным растворителем; чем выше объемная плотность/лучше поток, тем выше количество остаточного растворителя. Может быть полезной оптимизация потока порошка и объемной плотности и применение вторичной сушки для удаления остаточного растворителя. В одном варианте данного изобретения твердую дисперсию сушат в псевдоожиженном слое. Было обнаружено, что сушка в псевдоожиженном слое при температуре около 75°С в течение около 8 часов является эффективной в определенных вариантах для получения оптимального эффекта в определенных твердых дисперсиях VX-950. В других вариантах, например, при применении САГПМЦ в качестве полимера в твердой дисперсии сушка в псевдоожиженном слое при температуре 45°С в течение около 4 часов является эффективной для получения приемлемых уровней остаточного растворителя в конечном продукте.
В предпочтительных процессах растворитель включает летучий растворитель. В некоторых вариантах растворитель включает смесь летучих растворителей. Предпочтительные растворители включают такие, которые могут растворять VX-950 и полимер. Подходящие растворители включают описанные выше, например метиленхлорид, ацетон и т.д. В некоторых предпочтительных процессах растворитель представляет собой смесь метиленхлорида и ацетона. Хотя в данном изобретении могут применяться спиртовые растворители, было обнаружено, что спирты взаимодействуют с VX-950 с образованием кеталей. Следовательно, предпочтительным является растворитель, который не взаимодействует с VX-950 (особенно с образованием кеталей). Такие растворители не должны содержать ОН группу или подобную реакционноспособную группу. Поэтому в некоторых способах предпочтительный растворитель отличен от спирта.
Из-за реакционной способности VX-950 предпочтительный полимер для применения в соответствии с данным изобретением должен отличаться от полиэтиленгликоля (например, ПЭГ 8000) (т.е. должен отличаться от полимера, имеющего свободные гидроксильные группы).
Интервалы размера частиц и температуры сушки могут быть модифицированы для получения оптимальной твердой дисперсии. Практикующим специалистам в данной области техники будет понятно, что небольшой размер частиц позволит повысить эффективность удаления растворителя. Авторами обнаружено однако, что меньшие размеры частиц могут дать пылевидные частицы, которые не позволяют получить оптимальные твердые дисперсии VX-950 для последующей обработки, такой как получение таблеток. При более высоких температурах может возникнуть кристаллизация или химическое разложение VX-950. При более низких температурах может не удалиться достаточное количество растворителя. Способы в соответствии с данным изобретением обеспечивают оптимальный размер частиц и оптимальную температуру сушки.
ПОЛИМЕРЫ
В данном изобретении представлены твердые дисперсии, включающие VX-950 и полимер (или твердый носитель).
В одном варианте полимер в соответствии с данным изобретением способен растворяться в водной среде. Растворимость полимеров может быть рН-независимой или рН-зависимой. Последние включают один или более энтеросолюбильный полимер. Термин «энтеросолюбильный полимер» относится к полимеру, который преимущественно растворяется в менее кислой среде кишечника по сравнению с более кислой средой желудка, например к полимеру, который нерастворим в кислой водной среде, но растворим при рН выше 5-6. Подходящий полимер должен быть химически и биологически инертным. Для улучшения физической стабильности твердых дисперсий температура стеклования (Tg) полимера должна быть максимально высокой. Например, предпочтительные полимеры имеют температуру стеклования, по крайней мере, равную или больше температуры стеклования лекарственного средства (например, VX-950). Другие предпочтительные полимеры имеют температуру стеклования от около 10 до около 15°С ниже по сравнению с лекарственным средством (например, VX-950). Примеры подходящих температур стеклования полимеров включают, по крайней мере, около 90°С, по крайней мере, около 95°С, по крайней мере, около 100°С, по крайней мере, около 105°С, по крайней мере, около 110°С, по крайней мере, около 115°С, по крайней мере, около 120°С, по крайней мере, около 125°С, по крайней мере, около 130°С, по крайней мере, около 135°С, по крайней мере, около 140°С, по крайней мере, около 145°С, по крайней мере, около 150°С, по крайней мере, около 155°С, по крайней мере, около 160°С, по крайней мере, около 165°С, по крайней мере, около 170°С или по крайней мере, около 175°С (измеренная в сухих условиях). Не желая быть связанными какой-либо теорией, полагают, что лежащий в основе механизм таков, что полимер с более высокой Tg обычно имеет меньшую молекулярную подвижность при комнатной температуре, что может быть критическим фактором в стабилизации физической стабильности аморфной твердой дисперсии.
Кроме того, гигроскопичность полимеров должна быть по возможности низкой. В целях сравнения в данной заявке, гигроскопичность полимера или композиции характеризуется при относительной влажности около 60%. В некоторых предпочтительных вариантах полимер обладает способностью абсорбировать воду в количестве менее 10%, например менее около 9%, менее около 8%, менее около 7%, менее около 6%, менее около 5%, менее около 4%, менее около 3% или менее около 2% абсорбции воды. Целлюлозные полимеры обычно абсорбируют менее 3% воды, в то время как ПВП обычно абсорбирует около 9% воды. Гигроскопичность также может влиять на физическую стабильность твердой дисперсии. Обычно влага, абсорбированная в полимер, может значительно снижать Tg полимеров а также полученных твердых дисперсий, что в дальнейшем снижает физическую стабильность твердых дисперсий, как описано выше.
В одном варианте полимером является один или более растворимый в воде полимер или частично растворимый в воде полимер. Растворимые в воде или частично растворимые в воде полимеры включают, но не ограничены ими, производные целлюлозы (например, гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу (HPC)) или этилцеллюлозу; поливинилпирролидоны (ПВП); полиэтиленгликоли (ПЭГ); поливиниловые спирты (ПВС); акрилаты, такие как полиметилакрилат (например, Eudragit® E); циклодекстрины (например, β-циклодекстрин) и сополимеры и их производные, включая, например, ПВП-ВА (поливинилпирролидон-винилацетат). В некоторых предпочтительных вариантах полимером является гидроксипропилметилцеллюлоза (ГПМЦ), такая как ГПМЦ Е50 или ГПМЦ Е15. Как описано выше, полимером является рН-зависимый энтеросолюбильный полимер. Такие рН-зависимые энтеросолюбильные полимеры включают, но не ограничены ими, производные целлюлозы (например, фталат ацетата целлюлозы (ФАЦ)), фталаты гидроксипропилметилцеллюлозы (ФГПМЦ), сукцинат ацетата гидроксипропилметилцеллюлозы (САГПМЦ), карбоксиметилцеллюлозу (КМЦ) или ее соль (например, натриевую соль, такую как КМЦ-Na)); тримеллитат ацетата целлюлозы (ТАЦ), фталат ацетата гидроксипропилцеллюлозы (ФАГПЦ), фталат ацетата гидроксипропилметилцеллюлозы (ФАГПМЦ) и фталат ацетата метилцеллюлозы (ФАМЦ), или полиметакрилаты (например, Eudragit® S). В некоторых предпочтительных вариантах полимером является сукцинат ацетата гидроксипропилметилцеллюлозы (САГПМЦ).
В еще одном варианте полимером является нерастворимый поперечно-сшитый полимер, например поливинилпирролидон (например, кросповидон).
В вариантах, в которых лекарственное средство образует твердую дисперсию с полимером, например VX-950 с ГПМУ или САГПМЦ, количество полимера по отношению к общей массе твердой дисперсии обычно составляет, по крайней мере, около 20%, предпочтительно, по крайней мере, 30%, например, по крайней мере, около 35%, по крайней мере, около 40%, по крайней мере, около 45% или около 50% (т.е. 49,5%). Количество обычно составляет около 99% или менее, предпочтительно около 80% или менее, например, около 75% или менее, около 70% или менее, около 65% или менее, около 60% или менее или около 55% или менее. В одном варианте полимер содержится в количестве вплоть до 50% от общей массы дисперсии (даже более предпочтительно, от около 48% до 52%, например около 49%, около 49,5%, около 50%, около 50,5% или около 51%).
В одном или более конкретных вариантах данного изобретения полимером является поливинилпирролидон (ПВП) (например, ПВП 29/32), который присутствует в количестве вплоть до около 50% (более конкретно, около 50%). Как описано выше, дисперсия, содержащая около 49,5% ПВП К29/32, включена в объем данного изобретения.
В другом варианте, данное изобретение включает твердую дисперсию VX-950 и целлюлозного полимера, например, ГПМЦ или САГПМЦ. В более предпочтительных вариантах лекарственное средство (например, VX-950) присутствует в количестве, по крайней мере, около 20% от массы дисперсии, например, по крайней мере, около 25%, по крайней мере, около 30%, по крайней мере, около 35%, по крайней мере, около 40%, по крайней мере, около 45%, по крайней мере, около 50% или даже больше. В некоторых предпочтительных вариантах лекарственное средство присутствует в количестве от около 48% до 52%, например около 49%, около 49,5%, около 50%, около 50,5% или около 51%. Как описано выше, полимер присутствует в количестве, по крайней мере, около 20%, предпочтительно, по крайней мере, 30%, например, по крайней мере, около 35%, по крайней мере, около 40%, по крайней мере, около 45% или около 50% (т.е. 49,5%). Количество обычно составляет около 99% или менее, предпочтительно около 80% или менее, например, около 75% или менее, около 70% или менее, около 65% или менее, около 60% или менее или около 55% или менее. В одном варианте полимер содержится в количестве вплоть до 50% от общей массы дисперсии (даже более предпочтительно, от около 48% до 52%, например, около 49%, около 49,5%, около 50%, около 50,5% или около 51%). В некоторых предпочтительных вариантах лекарственное средство и полимер присутствуют практически в равных количествах, например каждый из лекарственного средства и полимера составляет около половины массового процента дисперсии. В некоторых предпочтительных вариантах дисперсия также включает другие незначительные ингредиенты, такие как поверхностно-активное вещество (например, ЛСН или витамин Е TPGS). В некоторых предпочтительных вариантах поверхностно-активное вещество присутствует в количестве менее чем около 10% мас. от массы дисперсии, например менее чем около 9% мас., менее чем около 8% мас., менее чем около 7% мас., менее чем около 6% мас., менее чем около 5% мас., менее чем около 4% мас., менее чем около 3% мас., менее чем около 2% мас. или около 1% мас.
В вариантах, включающих полимер, полимер должен присутствовать в количестве, эффективном для стабилизации твердой дисперсии. Стабилизация включает ингибирование или предотвращение кристаллизации VX-950. Такая стабилизация будет ингибировать превращение VX-950 из аморфной в кристаллическую форму. Например, полимер позволяет предотвратить, по крайней мере, часть (например, около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75% или более) VX-950 от перехода из аморфной в кристаллическую форму. Стабилизация может быть оценена, например, измерением температуры стеклования твердой дисперсии, измерением скорости релаксации аморфного материала или измерением растворимости или биодоступности VX-950.
Подходящие полимеры для применения в сочетании с VX-950, например, с получением твердой дисперсии, такой как аморфная твердая дисперсия, должны иметь одно или более из следующих свойств.
1. Температура стеклования полимера должна быть не менее чем на 10-15°С ниже, чем температура стеклования VX-950. Предпочтительно, температура стеклования полимера больше температуры стеклования VX-950 и, в общем, на, по крайней мере, 50°С выше, чем желаемая температура хранения лекарственного средства. Например, по крайней мере, около 100°С, по крайней мере, около 105°С, по крайней мере, около 105°С, по крайней мере, около 110°С, по крайней мере, около 120°С, по крайней мере, около 130°С, по крайней мере, около 140°С, по крайней мере, около 150°С, по крайней мере, около 160°С или более.
2. Полимер должен быть относительно негигроскопичным. Например, полимер должен при хранении в стандартных условиях абсорбировать менее чем около 10% воды, например менее чем около 9%, менее чем около 8%, менее чем около 7%, менее чем около 6%, менее чем около 5%, менее чем около 4% или менее чем около 3% воды. Предпочтительно полимер должен при хранении в стандартных условиях практически не содержать абсорбированную воду.
3. Полимер должен иметь сходную или лучшую растворимость в растворителях, подходящих для распылительной сушки, по отношению к растворимости VX-950. В предпочтительных вариантах полимер должен растворяться в одном или более из тех же растворителей или систем растворителей, что и VX-950. Предпочтительно, чтобы полимер был растворим в, по крайней мере, одном растворителе, не содержащем гидроксигруппы, таком как метиленхлорид, ацетон или их сочетание.
4. Полимер при объединении с VX-950, например, в твердой дисперсии или жидкой суспензии должен увеличивать растворимость VX-950 в водной и физиологической среде либо по отношению к растворимости VX-950 при отсутствии полимера, либо относительно растворимости VX-950 при сочетании со ссылочным полимером. Например, полимер должен повышать растворимость аморфного VX-950 путем снижения количества аморфного VX-950, который превращается в кристаллический VX-950, либо в твердой аморфной дисперсии, либо в жидкой суспензии.
5. Полимер должен снижать скорость релаксации аморфного вещества.
6. Полимер должен увеличивать физическую и/или химическую стабильность VX-950.
7. Полимер должен улучшать возможность промышленного производства VX-950.
8. Полимер должен улучшать одно или более из свойств обрабатываемости, введения или хранения VX-950.
9. Полимер не должен вступать в неблагоприятное взаимодействие с другими фармацевтическими компонентами, например наполнителями.
Пригодность полимера (или другого компонента) может быть протестирована с применением методов распылительной сушки (или других методов), описанных выше для получения аморфной композиции. Тестируемую композицию необходимо сравнить на предмет стабильности, устойчивости к образованию кристаллов или других свойств, с ссылочной композицией, например композицией из 49,5% аморфного VX-950, 49,5% ГПМЦ или САГПМЦ и 1% поверхностно-активного вещества, например ЛСН или витамин Е TPGS; или кристаллическим VX-950. Например, тестируемая композиция должна быть протестирована для определения ингибирования наступления кристаллизации, опосредованной растворителем, или процента превращения в данный период времени при контролируемых условиях, по крайней мере, на 50%, 75%, 100% или 110% по сравнению с ссылочной композицией, или тестируемая композиция должна быть протестирована для определения наличия улучшенной биодоступности или растворимости по сравнению с кристаллическим VX-950.
Поверхностно-активные вещества
Твердая дисперсия или другая композиция может включать поверхностно-активное вещество. Поверхностно-активное вещество или смесь поверхностно-активных веществ обычно снижает межфазное натяжение между твердой дисперсией и водной средой. Подходящее поверхностно-активное вещество или смесь поверхностно-активных веществ также может улучшать растворимость в воде и биодоступность VX-950 из твердой дисперсии. Поверхностно-активные вещества в соответствии с данным изобретением включают, но не ограничены ими, сложные эфиры сорбита и жирной кислоты (например, Spans®), сложные эфиры полиоксиэтилена сорбита и жирной кислоты (например, Tweens®), лаурилсульфат натрия (ЛСН), додецилбензолсульфонат натрия (ДБСН), сульфосукцинат диоктила натрия (докузат), натриевую соль диоксихолевой кислоты (НСДК), моностеарат сорбитана, тристеарат сорбитана, бромид гексадецилтриметиламмония (БГТА), N-лауроилсаркозин натрия, олеат натрия, миристат натрия, стеарат натрия, пальмитат натрия, гелуцир 44/14, этилендиаминтетрауксусную кислоту (ЭДТК), витамин Е сукцинат d-альфа-токоферил полиэтиленгликоля 1000 (TPGS), лецитин, MW 677-692, моногидрат мононатриевой соли глутановой кислоты, лабразол, ПЭГ 8 каприловые/каприновые глицериды, транскутол, моноэтиловый эфир диэтиленгликоля, солутол HS-15, полиэтиленгликоль/гидроксистеарат, таурохолевую кислоту, Pluronic F68, Pluronic F108 и Pluronic F127 (или любые другие сополимеры полиоксиэтилена-полиоксипропилена (Pluronics®) или насыщенные полигликолизированные глицериды (Gelucirs®)). Конкретные примеры таких поверхностно-активных веществ, которые могут применяться в соответствии с данным изобретением, включают, но не ограничены ими, Span 65, Span 25, Tween 20, Capryol 90, Pluronic F108 лаурилсульфат натрия (ЛСН), витамин Е TPGS, плуроники и сополимеры. Предпочтительными являются ЛСН и витамин Е TPGS.
Количество поверхностно-активного вещества (например, ЛСН или витамин Е TPGS) по отношению к общей массе твердой дисперсии может быть от 0,1 до 15%. Предпочтительно оно равно от около 1 до около 10%, более предпочтительно от около 1 до около 5%, например около 1%, около 2%, около 3%, около 4% или около 5%.
В определенных вариантах количество поверхностно-активного вещества по отношению к общей массе твердой дисперсии составляет, по крайней мере, около 0,1, предпочтительно, по крайней мере, около 0,5% и более предпочтительно, по крайней мере, около 1% (например, около 1%). В этих вариантах поверхностно-активное вещество присутствует в количестве не более около 15%, предпочтительно не более около 12%, около 11%, около 10%, около 9%, около 8%, около 7%, около 6%, около 5%, около 4%, около 3%, около 2% или около 1%. Как показано в примерах, предпочтительным является вариант, в котором поверхностно-активное вещество присутствует в количестве около 1% мас.
Особенно предпочтительный вариант включает твердую дисперсию VX-950, ГПМЦ и поверхностно-активного вещества. Например, твердую дисперсию, включающую 49,5% VX-950, 49,5% полимера ГПМЦ, такого как ГПМУ Е50 и 1% поверхностно-активного вещества, такого как ЛСН.
Другой особенно предпочтительный вариант включает твердую дисперсию VX-950, САГПМЦ и поверхностно-активного вещества. Например, твердую дисперсию, включающую 49,5% VX-950, 49,5% полимера САГПМЦ, и 1% поверхностно-активного вещества, такого как ЛСН.
САГПМЦ доступен в различных сортах от ShinEtsu, включая AS-LF, AS-MF, AS-HF, AS-LG, AS-MG, AS-HG. Каждый из этих сортов отличается процентным замещением ацетата и сукцината.
Каждый вариант поверхностно-активного вещества (или другого компонента) должен быть протестирован на стабильность при применении в соответствии с данным изобретением по методикам тестирования полимеров.
Композиции/дозы/упаковка/применение
В данном изобретении также представлены фармацевтические композиции. Формы VX-950 и твердые дисперсии в соответствии с данным изобретением могут быть далее обработаны с получением фармацевтической композиции для введения пациенту. Хотя твердые дисперсии могут считаться фармацевтическими композициями, перед введением может быть необходима дальнейшая обработка (например, твердая дисперсия может быть сформирована в таблетки или жидкую суспензию). Все такие фармацевтические композиции, дозированные формы и фармацевтические композиции включены в объем данного изобретения (например, композиции с замедленным высвобождением или немедленным высвобождением). Композиции могут быть получены с применением известных компонентов по известным методикам (см. Handbook of Pharmaceutical Excipients). Понятно, что для фармацевтического введения часто предпочтительны пероральные композиции.
Следовательно, в данном изобретении представлена фармацевтическая композиция, содержащая VX-950. Такие композиции обычно содержат фармацевтически приемлемый носитель, разбавитель или наполнитель. В некоторых вариантах VX-950 имеет аморфную форму. В некоторых вариантах VX-950 имеет форму твердой дисперсии (например, аморфной твердой дисперсии). Такие формы и дисперсии VX-950 предпочтительно получают как описано в данном документе.
В одном варианте данное изобретение включает фармацевтическую композицию, которая представляет собой суспензию, включающую твердую дисперсию, суспендированную в жидком наполнителе. Также было обнаружено, что предпочтительными композициями являются такие, которые включают добавление, по крайней мере, одного полимера (например, целлюлозного полимера, такого как ГПМЦ или САГПМЦ), не обязательно в качестве компонента твердой дисперсии, но, возможно, в виде физической смеси или в растворе с жидким наполнителем.
В некоторых вариантах полимер помогает предотвратить кристаллизацию перенасыщенного VX-950 в растворе, например, если аморфный VX-950 суспендирован в жидком наполнителе (например, воде или другой водной среде). Например, полимер может быть добавлен в жидкий наполнитель (например, воду) и может помогать снижать или предотвращать кристаллизацию VX-950, солюбилизированного в жидком наполнителе, из жидкого наполнителя. Такая стабилизация может быть предпочтительной, так как она обеспечивает улучшенную устойчивость в жидких дозированных формах. Например, в некоторых вариантах жидкая суспензия, включающая полимер, полученная в нулевой момент времени с аморфной твердой дисперсией VX-950, будет сохранять VX-950 в аморфном состоянии и, тем самым, обеспечивать более высокую концентрацию солюбилизированного VX-950в жидком носителе (например, водной среде) через 2 часа, 4 часа, 12 часов или 24 часа, по сравнению с жидкой дисперсией, содержащей аморфный VX-950, но без добавления полимера в жидкий носитель, в те же интервалы времени. Улучшение устойчивости концентрации солюбилизированного аморфного VX-950 обычно происходит за счет ингибирования полимером кристаллизации перенасыщенного солюбилизированного VX-950 из жидкого носителя. В некоторых предпочтительных вариантах полимер может помочь предотвратить превращение аморфного VX-950 в жидкой суспензии в кристаллический VX-950 в течение, по крайней мере, около 2 часов, по крайней мере, 4 около часов, по крайней мере, 8 около часов, по крайней мере, 12 около часов или, по крайней мере, 24 около часов.
Поэтому в другом варианте, фармацевтическая композиция включает полимер, такой как целлюлозный полимер или ПВП, включенный в жидкую среду. Примеры подходящих полимеров в жидких диспергированных композициях включают полимеры, описанные для применения в твердых дисперсиях выше. ГПМЦ известны специалистам в данной области техники как полимеры, которые ингибируют кристаллизацию (см., например, US 2004/0030151).
В некоторых предпочтительных вариантах один или более из гидроксипропилметилцеллюлозных (ГПМЦ) полимеров присутствует в жидком наполнителе, применяемом для суспендирования твердой дисперсии. Например, ГПМЦ Е50 присутствует в жидком наполнителе в количестве менее чем около 10% мас. (например, около 7% мас., около 5% мас., около 3% мас., около 2% мас., около 1% мас., около 0,5% мас., около 0,25% мас., около 0,1% мас. или около 0,05% мас.). В некоторых предпочтительных вариантах жидкий наполнитель включает ГПМЦ полимер в количестве от около 0,1% до около 5% мас., например от около 0,2% до около 3% мас., предпочтительно от около 0,5% до около 1,5% мас., например около 1% мас. В некоторых более предпочтительных вариантах жидкий наполнитель включает САГПМЦ, например, менее чем около 10% мас. САГПМЦ (например, около 7% мас., около 5% мас., около 3% мас., около 2% мас., около 1% мас., около 0,5% мас., около 0,25% мас., около 0,1% мас. или около 0,05% мас.). В некоторых предпочтительных вариантах жидкий наполнитель включает САГПМЦ полимер в количестве от около 0,1% до около 5% мас., например от около 0,2% до около 3% мас., предпочтительно от около 0,5% до около 1,5% мас., например около 1% мас.
В некоторых вариантах жидкий носитель включает поверхностно-активное вещество. Такие поверхностно-активные вещества включают те, которые описаны для применения в твердых дисперсиях выше (например, Span 65, Span 25, Tween 20, Capryol 90, Pluronic F108, лаурилсульфат натрия (ЛСН) и витамин Е TPGS). Количество поверхностно-активного вещества в жидком носителе зависит от множества факторов, включая химическую природу поверхностно-активного вещества. Обычно поверхностно-активное вещество присутствует в количестве от около 0% до около 20% мас. (например, около 14% мас., около 13% мас., около 12% мас., около 11% мас., около 10% мас., около 9% мас., около 8% мас., около 7% мас., около 6% мас., около 5% мас., около 4% мас., около 3% мас., около 2% мас., около 1% мас. или ниже). В некоторых предпочтительных вариантах поверхностно-активным веществом является симетикон (предпочтительно, в количестве около 0,002% мас.), ЛСН (например, от около 0,25% до около 5% мас., предпочтительно около 1% мас.) или витамин Е TPGS (например, от около 0,1% до около 20% мас., предпочтительно около от 5% до около 10% мас.). Симетикон в основном добавляют для снижения пенообразования.
Композиции и способы в соответствии с данным изобретением могут необязательно включать один или более эксципиентов (см. USP 6720003, US 2004/0030151 и/или WO 99/02542). Эксципиент представляет собой вещество, применяемое в качестве носителя или наполнителя для дозированной формы, или его добавляют в фармацевтическую композицию для улучшения обрабатываемости, хранения или получения дозированной формы. Эксципиенты включают, но не ограничиваются ими, разбавители, разрыхляющие агенты, адгезивы, смачивающие агенты, смазывающие агенты, агенты, улучшающие скольжение, ингибиторы кристаллизации, агенты, модифицирующие поверхность, агенты, маскирующие или противодействующие неприятному вкусу или запаху, вкусовые добавки, красители, отдушки, наполнители, связующие агенты, стабилизаторы и вещества, улучшающие внешний вид композиции.
Также описаны способы получения композиции, содержащей аморфную форму VX-950 или его дисперсию или композицию, в дозированной форме, пригодной для введения млекопитающему. Предпочтительно, описана композиция, содержащая твердую дисперсию, полученную как описано в данном описании.
Следовательно, в другом варианте данного изобретения представлена композиция, содержащая VX-950 или его фармацевтически приемлемую соль. Согласно предпочтительному варианту VX-950 присутствует в количестве, эффективном для снижения количества вирусов в образце или у пациента (например, для снижения уровня вируса в плазме на, по крайней мере, около 3 лог, по крайней мере, около 4 лог или, по крайней мере, около 5 лог), и фармацевтически приемлемый носитель. Альтернативно, композиция в соответствии с данным изобретением включает другой дополнительный агент, представленный в данном описании (например, ингибитор CYP). Каждый компонент может присутствовать в отдельных композициях, в сочетании композиций или в одной композиции.
В данном описании термин «включающая» является открытым, тем самым указывая на возможность добавления других агентов в дополнение к указанным агентам.
В данном описании соединения в соответствии с данным изобретением, включая VX-950, определены как включающие их фармацевтически приемлемые производные или пролекарства. «Фармацевтически приемлемое производное или пролекарство» означает любую фармацевтически приемлемую соль, сложный эфир, соль сложного эфира или другое производное соединения в соответствии с данным изобретением (например, имидат сложного эфира амида), которая, при введении пациенту, способна давать (прямо или косвенно) соединение в соответствии с данным изобретением. Особенно предпочтительными производными и пролекарствами являются те, которые увеличивают биодоступность соединений в соответствии с данным изобретением при введении таких соединений млекопитающим (например, позволяют пероральной композиции более легко абсорбироваться в кровь), или которые улучшают доставку исходного соединения в биологическое отделение (например, печень, мозг или лимфатическую систему) по отношению к исходным видам. Предпочтительные пролекарства включают производные, в которых группа, которая улучшает растворимость в воде или активный транспорт через мембрану кишечника, добавлена в структуру формулы, описанной выше.
VX-950, применяемый в композициях и способах в соответствии с данным изобретением, также может быть модифицирован добавлением подходящих функциональных групп для улучшения селективных биологических свойств. Такие модификации известны в данной области техники и включают такие, которые позволяют увеличить биологическое проникновение в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), повысить пероральную доступность, повысить растворимость для введений инъекцией, изменить метаболизм и изменить скорость выведения.
Фармацевтически приемлемые носители, которые могут применяться в этих композициях, включают, но не ограничены ими, ионообменники, окись алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, частичные смеси глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидную двуокись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, парафины, полиэтилен-пролиоксипропилен блоксополимеры, полиэтиленгликоль и ланолин.
Фармацевтические композиции в соответствии с данным изобретением могут вводиться перорально в приемлемых для перорального введения лекарственных формах, включая, но не ограничиваясь ими, капсулы, таблетки, пилюли, порошки, гранулы, водные суспензии или растворы. В таблетках для перорального введения обычно применяют носители, включающие лактозу, микрокристаллическую целлюлозу, маннит, фосфат дикальция, карбонат кальция и кукурузный крахмал. Также обычно добавляют смазывающие агенты, такие как стеарат магния, стеарилфумарат натрия или стеариновую кислоту. Другие ингредиенты могут включать разрыхлители, такие как кроскармеллоза натрия или гликолят крахмала с натрием, добавки для улучшения текучести, такие как коллоидная двуокись кремния, и поверхностно-активные вещества, такие как ЛСН и витамин Е. Для пероральных капсул применяют разбавители, включающие лактозу, микрокристаллическую целлюлозу, маннит, фосфат дикальция, карбонат кальция и высушенный кукурузный крахмал. Так же, как и описанные выше таблетки, капсулы могут включать смазывающие агенты, разрыхлители, поверхностно-активные вещества или добавки, способствующие текучести. При пероральном применении водных суспензий активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При желании также могут быть добавлены определенные подсластители, вкусовые добавки или красители. Приемлемые жидкие дозированные формы включают эмульсии, растворы, суспензии, сиропы и эликсиры.
Согласно предпочтительному варианту композиции в соответствии с данным изобретением составляют для фармацевтического введения млекопитающим, предпочтительно человеку. Хотя формы VX-950 и содержащие его дисперсии предпочтительно составлены для перорального введения, могут быть получены другие композиции.
Другие фармацевтические композиции в соответствии с данным изобретением (а также композиции, применяемые в способах, комбинациях, наборах и упаковках в соответствии с данным изобретением) могут вводиться перорально, парентерально, подъязычно, ингаляцией, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин «парентерально» в данном описании включает подкожное, внутривенное, внутримышечное, внутрисуставное, внутригрудинное, интратекальное, внутрипеченочное, внутриочаговое и внутричерепное введение инъекцией или вливанием. Предпочтительно, композиции вводят перорально или внутривенно.
Дозы VX-950, составляющие от около 0,10 до около 100 мг/кг массы тела в сутки, предпочтительно от около 10 до около 100 мг/кг массы тела в сутки, применяют для профилактики и лечения заболеваний, медиированных ВГС. В некоторых вариантах дозы составляют от около 0,4 до около 10 г/сутки, например от около 1 до около 4 г/сутки, предпочтительно от около 2 до около 3,5 г/сутки для одного пациента (в расчете на средний вес пациента около 70 кг). Обычно фармацевтические композиции в соответствии с данным изобретением вводят от около 1 до около 5 раз в день, предпочтительно от около 1 до около 3 раз в день, или, альтернативно, непрерывным вливанием. В некоторых вариантах VX-950 вводят с применением композиции с контролируемым высвобождением. В некоторых вариантах это может помочь обеспечить относительно стабильные уровни VX-950 в крови.
Такое введение может применяться в качестве хронической или острой терапии. Количество активного ингредиента, которое может быть объединено с носителями с получением единичной дозированной формы, зависит от пациента, проходящего лечение и определенного способа введения. Обычная композиция содержит от около 5% до около 95% активного соединения (мас./мас.). Предпочтительно, такие композиции содержат от около 20% до около 80% активного соединения.
Если композиции или способы в соответствии с данным изобретением включают сочетание VX-950 и одного или более терапевтического или профилактического агента, соединение и дополнительный агент должны присутствовать в количествах от около 10 до 100%, более предпочтительно, от около 10 до 80% от дозы, обычно вводимой при монотерапии.
При улучшении состояния пациента может вводиться поддерживающая доза соединения, композиции или сочетания в соответствии с данным изобретением, при необходимости. Следовательно, доза и частота введения или оба параметра могут быть снижены до около Ѕ или ј от дозы или частоты введения, в зависимости от симптомов, при достижении уровня, при котором улучшенное состояние сохраняется на фоне облегчения симптомов до желаемого уровня, лечение должно быть превращено. Однако пациенту может потребоваться периодическое лечение на долговременной основе при любом рецидиве симптомов заболевания.
Также должно быть понятно, что определенные режимы дозирования и лечения для каждого конкретного пациента будут зависеть от множества факторов, включая активность определенного применяемого соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, скорости выведения, сочетание лекарственного средства и суждение лечащего врача и тяжести конкретного заболевания. Количество активных ингредиентов также зависит от определенного описанного соединения и присутствия или отсутствия и природы дополнительного противовирусного агента в композиции.
В данном изобретении также представлены фармацевтические упаковки и наборы, включающие аморфный VX-950, твердую дисперсию или фармацевтическую композицию по любому из представленных здесь вариантов.
В данном изобретении также представлены способы лечения или профилактики вирусной инфекции гепатита С у пациента, включающие введение пациенту фармацевтической композиции. Фармацевтическая композиция содержит любую форму VX-950, любую твердую дисперсию или любую композицию в соответствии с данным изобретением.
Согласно другому варианту в данном изобретении представлен способ лечения пациента, инфицированного вирусом, например ВГС, отличающегося кодированной вирусом серинпротеазы NS3/4A, которая необходима для жизненного цикла вируса, введением указанному пациенту любой формы VX-950, любой твердой дисперсии или композиции в соответствии с данным изобретением. Предпочтительно, способы в соответствии с данным изобретением применяют для лечения пациента, страдающего инфекцией ВГС. Такое лечение может полностью уничтожить вирусную инфекцию или снизить ее тяжесть. Более предпочтительно, пациентом является человек.
В еще одном варианте данное изобретение относится к способу предварительной обработки биологического вещества, предназначенного для введения пациенту, включающему стадию взаимодействия указанного биологического вещества с фармацевтически приемлемой композицией, включающей соединение в соответствии с данным изобретением. Такие биологические вещества включают, но не ограничены ими, кровь и ее компоненты, такие как плазма, тромбоциты, субпопуляции клеток крови и подобные; органы, такие как почки, печень, сердце, легкие и т.д.; сперму и яйцеклетки; костный мозг и его компоненты, и другие жидкости, вливаемые пациенту, такие как физиологический раствор, декстроза и т.д. В некоторых вариантах VX-950 может быть помещен в устройство, которое вводят пациенту.
Фармацевтические композиции также могут быть назначены пациенту в виде «упаковок для пациента», содержащих более одной дозы, предпочтительно, весь курс лечения, в одной упаковке (например, блистере). Упаковки для пациентов обладают преимуществами по сравнению с традиционными предписаниями, при которых фармаколог отделяет необходимое пациенту количество от общей большой упаковки, которые заключаются в том, что пациент всегда имеет доступ к аннотации, содержащейся в упаковке для пациента, обычно отсутствующей в традиционных назначениях. Было показано, что наличие аннотации улучшает соблюдение пациентом инструкций терапевта. Предпочтительно, лекарственное средство находится в пероральной дозированной форме.
Должно быть понятно, что введение композиции в соответствии с данным изобретением с помощью упаковки для пациента, или упаковок для пациента для каждой композиции, содержащейся аннотации с инструкциями пациенту относительно правильного применения данного изобретения, является желательной дополнительной характеристикой данного изобретения.
Согласно другому аспекту данного изобретения представлена упаковка, содержащая, по крайней мере, любую форму VX-950, любую твердую дисперсию или любую композицию в соответствии с данным изобретением, и информационную аннотацию, содержащую инструкции по применению композиции в соответствии с данным изобретением. В альтернативном варианте данного изобретения фармацевтическая упаковка также содержит один или более дополнительный агент, описанный в данном документе. Дополнительный агент или агенты могут быть представлены в той же упаковке или в отдельных упаковках.
Другой аспект данного изобретения относится к набору для ингибирования ВГС или для применения для лечения инфекции ВГС или профилактики инфекции ВГС у пациента, включающему одну или множество фармацевтических композиций каждого фармацевтического компонента; контейнер, содержащий фармацевтическую композицию (композиции) во время хранения и до введения; и инструкции по введению лекарственного средства по методике, эффективной для лечения или профилактики инфекции ВГС. Предпочтительно, лекарственное средство находится в пероральной дозированной форме.
Следовательно, в данном изобретении представлены наборы для одновременного или последовательного введения VX-950 (и необязательно дополнительного агента) или его производных, полученных обычным способом. Обычно такой набор содержит, например, композицию каждого ингибитора и необязательный дополнительный агент (агенты) в фармацевтически приемлемом носителе (и в одной или множестве фармацевтических композиций) и письменные инструкции по одновременному или последовательному введению. Предпочтительно, лекарственное средство находится в пероральной дозированной форме.
В другом варианте представлен набор, который содержит одну или более дозированную форму (предпочтительно, пероральную дозированную форму) для самостоятельного введения; контейнер, предпочтительно, герметично закрытый, для содержания дозированных форм во время хранения и перед применением; и инструкции для пациента по введению лекарственного средства. Инструкции обычно представляют собой письменные инструкции в аннотации, на наклейке и/или на другом компоненте набора, в которых описана дозированная форма или формы. Каждая дозированная форма может быть упакована отдельно, в виде пластины из металлической фольги и пластикового ламината, где каждая дозированная форма отделена от других в индивидуальных ячейках или выемках, или дозированная форма может быть помещена в единственный контейнер, такой как пластиковая бутылка или флакон. Данные наборы также обычно включают средства для упаковки отдельных компонентов набора, т.е. дозированных форм, контейнеров и письменных инструкций по применению. Такие упаковки могут иметь форму картонной или бумажной коробки, мешочка из пластика или фольги и т.д.
Варианты данного изобретения также могут включать дополнительные агенты. Поэтому способы в соответствии с данным изобретением могут включать стадии введения таких дополнительных агентов.
Комбинированная терапия
Способы в соответствии с данным изобретением также могут включать введение другого компонента, содержащего дополнительный агент, выбранный из иммуномодулирующего агента; антивирусного агента; ингибитора протеазы ВГС; ингибитора другой цели в жизненном цикле ВГС; ингибитора внутреннего рибосомального входа, ингибитора вирусов широкого спектра действия; другого ингибитора цитохрома Р-450; или их сочетания.
Следовательно, в другом варианте, в данном изобретении представлен способ, включающий введение любой формы VX-950, любой твердой дисперсии или любой композиции в соответствии с данным изобретением, ингибитора CYP и другого антивирусного агента, предпочтительно анти-ВГС агента. Такие антивирусные агенты включают, но не ограничены ими, иммуномодулирующие агенты, такие как α-, β- и γ-интерфероны, ПЭГилированные производные соединения α-интерферона, и тимозин; другие антивирусные агенты, такие как рибавирин, амантадин и телбивудин; другие ингибиторы протеаз гепатита С (ингибиторы NS2-NS3 и ингибиторы NS3/NS4); ингибиторы других целей жизненного цикла ВГС, включая ингибиторы геликазы, полимеразы и металлопротеазы; ингибиторы внутреннего рибосомального входа; ингибиторы вирусов широкого спектра действия, такие как ингибиторы IMPDH (например, соединения по патентам США 5807876, 6498178, 6344465, 6054472, WO 97/40028, WO 98/40381, WO 00/56331 и микофеноловая кислота и ее производные, и включая, но не ограничиваясь ими, VX-497, VX-148 и/или VX-944); или сочетания любых из представленных выше.
Каждый агент может быть в виде отдельных лекарственных форм. Альтернативно, для снижения количества лекарственных форм, вводимых пациенту, каждый агент может быть соединен с другим в любом сочетании. Например, VX-950 может быть получен в одной дозированной форме и любой дополнительный агент может быть получен вместе с ним или в другой дозированной форме. VX-950 может вводиться, например, до, после или во время введения дополнительного агента.
Способ в соответствии с данным изобретением также может включать стадию введения ингибитора монооксигеназы цитохрома Р450. Ингибиторы CYP могут быть полезны для повышения концентрации в печени и/или концентрации уровня в крови соединений (например, VX-950), которые ингибируются CYP.
Преимущества улучшения фармакокинетики лекарственного средства (например, введение ингибитора CYP) хорошо известны в данной области техники. Путем введения ингибитора CYP данное изобретение представляет пониженный метаболизм ингибитора протеазы, VX-950. Тем самым улучшается фармакокинетика ингибитора протеазы. Преимущества улучшения фармакокинетики лекарственного средства хорошо известны в данной области техники. Такие улучшения могут вызвать повышенные уровни в крови ингибитора протеазы. Что более важно для терапии ВГС, улучшение может вызвать увеличение концентрации ингибитора протеазы в печени.
В способе в соответствии с данным изобретением количество вводимого ингибитора CYP является достаточным для увеличения уровней VX-950 в крови по сравнению с уровнями этого ингибитора протеазы в крови в отсутствии ингибитора CYP. Преимущественно, в способе в соответствии с данным изобретением могут применяться даже более низкие дозы ингибитора протеазы (по отношению к введению ингибитора протеазы в отдельности).
Следовательно, в другом варианте данного изобретения представлен способ повышения уровней в крови или повышения концентрации в печени VX-950 у пациента, получающего VX-950, включающий введение пациенту терапевтически эффективного количества VX-950 и ингибитора монооксигеназы цитохрома Р450.
В дополнение к лечению пациентов, инфицированных гепатитом С, способы в соответствии с данным изобретением могут применяться для профилактики заражения пациента гепатитом С. Следовательно, в одном из вариантов данное изобретение относится к способу профилактики заражения вирусом гепатита С у пациента, включающему введение пациенту а) любой формы VX-950, любой твердой дисперсии или любой композиции VX-950; и b) ингибитора монооксигеназы цитохрома Р450.
Как должно быть понятно специалистам в данной области техники, если способ в соответствии с данным изобретением применяется для профилактического лечения пациента, и этот пациент заражается вирусом гепатита С, способ может применяться для лечения инфекции. Поэтому в одном из вариантов данное изобретение относится к любой форме VX-950, любой твердой дисперсии или любой композиции в соответствии с данным изобретением и ингибитору монооксигеназы цитохрома Р450, где ингибиторы сочетают в терапевтически эффективных количествах для лечения или профилактики инфекции гепатита С у пациента.
Если вариант данного изобретения включает ингибитор CYP, в способе по данному изобретению может применяться любой ингибитор CYP, который улучшает фармакокинетику VX-950. Такие ингибиторы CYP включают, но не ограничены ими, ритонавир (WO 94/14436), кетоконазол, тролеандромицин, 4-метилпиразол, циклоспорин, клометиазол, циметидин, итраконазол, флуконазол, миконазол, флувоксамин, флуоксетин, нефазодон, сертралин, индинавир, нелфинавир, ампренавир, фозампренавир, саквинавир, лопинавир, делавирдин, эритромицин, VX-944 и VX-497. Предпочтительные ингибиторы CYP включают ритонавир, кетоконазол, тролеандомицин, 4-метилпиразол, циклоспорин и клометиазол. Предпочтительные дозированные формы ритонавира представлены в патенте США 6037157 и указанных там документах: патент США 5484801, заявка на патент США 08/402690 и заявки на международный патент WO 95/07696 и WO 95/09614).
Структура VX-944 представлена ниже.
VX-497 является ингибитором IMPDH. Сочетание VX-497, ПЭГилированного IFN-α и рибавирина в настоящее время проходит клиническую разработку для лечения ВГС [W. Markland et al., Antimicrobial & Antiviral Chemotherapy, 44, p. 859 (2000); патент США №6541496].
Способы измерения способности соединения ингибировать активность монооксигеназы цитохрома Р450 известны (см. US 6037157 и Yun, et al. Drug Metabolism & Disposition, vol. 21, pp. 403-407 (1993).
Ингибитор CYP, применяемый в данном изобретении, может быть ингибитором только одного изофермента или более чем одного изофермента. Если ингибитор CYP ингибирует более одного изофермента, ингибитор, тем не менее, может ингибировать один изофермент более селективно, чем другой изофермент. Любые такие ингибиторы CYP могут применяться в способе в соответствии с данным изобретением.
В способе в соответствии с данным изобретением ингибитор CYP может вводиться вместе с любой формой VX-950, любой твердой дисперсией или любой композицией в соответствии с данным изобретением в той же дозированной форме или в отдельных дозированных формах.
Если ингибитор CYP и другие компоненты сочетания вводят отдельными лекарственными формами, такой ингибитор может вводиться одновременно. Альтернативно, ингибитор CYP может вводиться в любой период времени введения сочетания. То есть, ингибитор CYP может вводиться до, вместе с или после введения каждого компонента сочетания. Период введения должен быть таковым, чтобы ингибитор CYP оказывал влияние на метаболизм компонента сочетания, предпочтительно, VX-950. Например, если VX-950 вводят первым, ингибитор CYP должен вводиться до того, как VX-950 практически усвоится и/или выведется (например, в течение периода полувыведения VX-950).
Для того чтобы данное изобретение было более понятно, ниже представлены примеры. Эти примеры даны только для целей иллюстрации и не ограничивают объем данного изобретения.
ПРИМЕРЫ
VX-950 может быть получен способами, известными специалистам в данной области техники (см., например, WO 02/18369). Ингибирование ВГС может быть протестировано в анализах ВГС согласно известным методам.
Пример 1
Получают твердую дисперсию, содержащую следующие ингредиенты (в процентах от общей массы):
Композицию 1 получают растворением VX-950, ГПМЦ и ЛСН в метаноле:метиленхлориде (1:1) с последующим выпариванием растворителей на роторном испарителе в вакууме. Продукт измельчают до частиц со средним размером около 200 мкм.
Пример 2
Получают твердую дисперсию, содержащую следующие ингредиенты (в процентах от общей массы):
Композицию 2 получают растворением VX-950 и ГПЦ в метиленхлориде. ЛСН суспендируют в растворе. Затем растворитель выпаривают на роторном испарителе в вакууме. Продукт измельчают до частиц со средним размером около 200 мкм.
Пример 3
Получают твердую дисперсию, содержащую следующие ингредиенты (в процентах от общей массы):
Композицию 3 получают растворением VX-950, ПВП К30 и суспендированием ЛСН в метаноле:метиленхлориде с последующей Распылительной сушкой для удаления растворителя. Средний размер частиц продукта составляет около 150 мкм.
Пример 4
Получают твердую дисперсию, содержащую следующие ингредиенты (в процентах от общей массы):
Композицию 4 получают по методике примера 3. Средний размер частиц продукта составляет около 150 мкм.
Другие типы полимеров и поверхностно-активных вещество также тестируют (см. представленные ниже примеры). Соотношение VX-950 и полимеров и количества поверхностно-активных веществ также тестируют с помощью различных анализов (см. представленные ниже примеры).
Пример 5
Различные композиции VX-950 тестируют с применением анализа фармакокинетики (ФК) у крыс.
Данные фармакокинетики у крыс
Пример 6
Различные композиции VX-950 тестируют с применением анализа фармакокинетики у собак. В этом анализе тестируемое соединение VX-950 представляет собой 60:40 (± 5%) смесь L:D изомеров.
Данные фармакокинетики D/L смеси VX-950
(у собак: доза 15 мг/кг)
Пример 7
Тестируют физическую стабильность различных композиций. Результаты представлены в таблице 2.
Данные физической стабильности
1:1
МеС12
Пример 8
Тестируют хиральную стабильность различных композиций. Результаты представлены в таблице 3.
Данные хиральной стабильности
Пример 9
Тестируют растворимость различных композиций. Результаты представлены в таблице 4.
Данные растворимости
Pluronic F108
К30, 1:1, 2% Pluronic F108
К30, 1:1, 2% Pluronic F108
К30, 1:1, 2% ЛСН
К16, 1:1, 2% ЛСН
К16, 1:2, 2% ЛСН
К16, 1:1, 1% ЛСН
К30, 1:1, 2% ЛСН
Пример 10
Тестируют влияние концентрации ЛСН на видимую растворимость твердых дисперсий VX-950, результаты представлены в таблице 5.
Данные растворимости
Твердых дисперсий VX-950
Пример 11
Пероральную лекарственную форму получают следующим образом. VX-950 и ПВП К29/32 растворяют в метиленхлориде, затем добавляют лаурилсульфат натрия и диспергируют в растворе с получением гомогенной суспензии. Эту суспензию сушат распылением с применением температуры на входе 90°С и температуры на выходе 56°С, и продукт собирают из циклона. Высушенную распылением дисперсию сушат в псевдоожиженном слое при температуре 75°С в течение 8 часов.
Твердую дисперсию суспендируют в 1% ГПМЦ, 0,002% растворе симетикона с применением стального роторного миксера. Полученная суспензия является физически и химически стабильной в концентрациях 0,8-50 мг/мл VX-950 в течение, по крайней мере, 24 часов. Затем порошок суспендируют и дозируют в течение 24 часов, как описано в таблице.
Пример 12
Дозируют дисперсии в дозированных стеклянных флаконах, смешанные с 1% ГПМЦ. Твердый остаток, оставшийся во флаконах, составляет 0,8%-4% по сравнению с 28%-56% при дозировании в шприце, смешивая с водой (дозирование 20 января, представленное ниже). Дозируемые дисперсии представляют собой VX-950/ПВПК-30/ЛСН (токс. партия, восстановлена), VX-950/САГМПЦ/ЛСН/ДБСН (распылительная сушка при ISP, начиная с кристаллического DS, содержащего 5% ПВПК-30), VX-950/ГПМЦ Е15/10% Вит.Е TPGS, VX-950/ПВП-ВА/10% Вит. Е TPGS. Результаты исследований представлены ниже.
Как можно увидеть из представленной выше таблицы и из фиг.2, ГПМЦ Е-15/10% Вит. Е TPGS имеет наивысшее значение Сmax и %F (фиг.2). ПВП-ВА/10% вит. Е TPGS имеет следующее по величине значение Cmax и %F. САГПМЦ демонстрирует профиль частичного замедленного выделения с показателем Cmax, сравнимым с восстановленной дисперсией ПВПК-30 и с %F, сравнимым с ПВП-ВА.
Пример 13
Получают три композиции на распылительной сушилке SD Micro (100 г). Первые две композиции содержат одинаковые ингредиенты, но разное количество ацетона. Третья композиция содержит полимерную смесь ГПЦ и фталата ГПМЦ (2:1). Все три композиции содержат 1% ЛСН и 1% ДБСН и лекарственное вещество, которое содержит 5% ПВПК-30.
Растворение полимеров требует гомогенизации, и все 3 композиции сушат распылением очень легко. Все композиции содержат определяемое остаточное количество растворителя после получения, но оба растворителя легко удаляются при сушке в печи (60°С). Добавление ацетона, по всей вероятности, снижает исходное содержание метиленхлорида. остаточные уровни растворителей представлены ниже
полученных при ISP (шкала 100 г)
(ч/млн)
метилен-хлорид
метилен-хлорид
Пример 14
Жидкую дисперсию, содержащую ГПМЦЕ 50/1% ЛСН, экстенсивно исследуют в качеству суспензии в нескольких носителях при комнатной температуре или условиях замораживания следующим образом:
1. 1% ГПМЦ носитель с изменяющимися уровнями вит. Е TPGS при концентрации VX-950 3 мг/мл.
Растворимость и физическую стабильность дисперсии ГПМЦ Е50/1% ЛСН в суспензии, содержащей 0,067%, 1%, 5% и 10% Вит. Е TPGS оценивают с применением ВЭЖХ и ПР согласно нескольким методикам для стимулирования дозирования в действительных токс. исследованиях (дозирование b.i.d., через 8-12 часов).
Методика 1: Суспензии получают и хранят при КТ, оценивают через 1, 3, 24, 48 часов (перемешивают в течение 3 часов, затем хранят без перемешивания до 24 часов, когда их перемешивают в течение 15 минут перед отбором образцов).
Методика 2: Суспензии получают при КТ, но хранят при температуре 5°С в течение 3 часов, не перемешивая. В момент времени 24 часа суспензии перемешивают при температуре 5°С (на льду) перед отбором образцов.
Методика 3: Суспензии получают при КТ, но хранят при температуре 5°С в течение 3 часов, не перемешивая. В момент времени 24 часа суспензии перемешивают при КТ (нагревая) перед отбором образцов.
Методика 4: оценивают только носитель, содержащий 10% вит. Е TPGS. Суспензии получают и хранят при температуре 5°С и оценивают через 1, 3, 24, 48 часов (перемешивают в течение 3 часов, затем хранят без перемешивания до 24 часов, когда их перемешивают в течение 15 минут перед отбором образцов).
Для всего представленного выше оценивают кинетическую растворимость в стимулированной кишечной жидкости при температуре 37°С через 1 час после получения и через 24 часа хранения в указанных выше условиях.
Результаты:
А. Влияние уровня вит. Е TPGS в 1% носителе ГПМЦ на растворимость суспензии представлено на фиг. 3-6 для различных методик оценки/хранения.
Методика 1: Растворимость повышается как функция от % вит. Е TPGS (1 ч и 3 ч). Значительное снижение растворимости наблюдается через 1 час для суспензий с более высокими уровнями вит. Е TPGS (10% и 5%), хотя значения действительной растворимости остаются высокими, 600-700 мкг/мл. Собранные твердые остатки, высушенные в течение 24-48 часов, имеют некоторую кристалличность. Незначительное снижение растворимости, а также легкая кристалличность наблюдается у суспензий, содержащих 1% вит. Е TPGS. Снижение не наблюдается при 0,067% вит. Е TPGS и твердый остаток является аморфным.
Методика 2: Снижение (изменение) растворимости не наблюдается при любых уровнях вит. Е TPGS.
Методика 3 (нагревание): Снижение (изменение) растворимости не наблюдается при любых уровнях вит. Е TPGS, и значения такие же, как и для методики 2.
Методика 4: В 1 и 3 часа растворимость ниже по сравнению с данными методики 2 (т.е. когда получение происходит при температуре 5°С, а не КТ), вероятно из-за замедленной диффузии/более высокой вязкости при более низкой температуре. Снижение растворимости не наблюдается в 48 часов, и значения сравнимы со значениями методики 2 через 24 часа.
В. Влияние уровня вит. Е TPGS в 1% носителе ГПМЦ на кинетическую растворимость суспензий в SIF при температуре 37°С представлено на фиг. 7-9 для различных методик оценки/хранения (5 мл суспензии при 3 мг/мл VX-950 в 50 мл SIF, 37°С).
Методика 1, через 1 час: Значительное снижение растворимости наблюдается при 10% вит. Е TPGS через 1 час, и незначительное снижения наблюдается при 5% вит. Е TPGS только через 3 часа. При более низких уровнях снижение не наблюдается (1% и 0,067%) через 5 часов. Для сравнения, суспензия, содержащая 10% вит. Е TPGS, полученная и перемешанная на льду (5°С) в течение 1 часа не показывает снижение растворимости через 5 часов, однако, действительные значения растворимости значительно ниже, чем при КТ. Это может объяснить пониженный %F для последней у крыс.
Методика 1, через 24 часа: По сравнению с суспензией, полученной и оцененной через 1 час, растворимость/растворение значительно ниже для уровней 1% и 5% вит. Е TPGS. суспензия 0,067% демонстрирует исходную растворимость, подобную той, которую имеет свеже полученная суспензия (тестированная через 1 час), однако незначительное снижение растворимости наблюдается через 2 часа в SIF, которое не характерно для свежей суспензии.
Методика 2, 24 часа: результаты похожи на те, которые получены для методики 1, где суспензии, содержащие низкий % вит. Е TPGS (0,067% и 1%) не показали снижение растворимости/растворения через 5 часов, и абсолютные значения также равны тем, которые получены при тестировании через 1 час после получения.
Выводы: относительно растворимости и кинетической растворимости суспензий в SIF при температуре 37°С, суспензии, содержащие 0,067% вит. Е TPGS не демонстрируют изменение характеристик (не снижается растворимость суспензии через 24 часа и не снижается растворение через 5 часов для свежего и 24-часового образцов), независимо от температуры хранения КТ или 5°С. Такое же поведение наблюдают для суспензий, содержащих 1% и 5% вит. Е TPGS только при хранении при температуре 5°С (полученных при КТ).
На фиг.10 представлено сравнение кинетической растворимости в SIF (37°С) для всех 4 методик оценки/хранения для суспензии, содержащей 10% вит. Е TPGS в носителе. Постепенное снижение кинетической растворимости в SIF при температуре 37°С наблюдают через 5 часов для 24-часовых образцов после хранения при температуре 5°С независимо от того, нагревают ли их или нет перед оценкой. Суспензии, полученные при температуре 5°С, показали низкое растворение/растворимость в SIF при оценке через 1 час после получения, по сравнению с 24 часами, вероятно из-за продолжения растворения во время хранения при температуре 5°С.
Все цитированные документы представлены здесь в качестве ссылок.
Было описано множество вариантов данного изобретения. Однако должно быть понятно, что могут быть проведены различные модификации, не выходящие за рамки объема и сути данного изобретения. Следовательно, другие варианты также включены в объем представленной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ГЕПАТИТА С | 2013 |
|
RU2665365C2 |
| СТАБИЛИЗИРОВАННЫЕ АМОРФНЫЕ ФОРМЫ ИМАТИНИБА МЕЗИЛАТА | 2008 |
|
RU2489149C2 |
| Способ получения фармацевтической композиции с такролимусом (варианты) и фармацевтическая композиция, полученная указанными способами | 2022 |
|
RU2792098C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ИНГИБИТОРА ТИРОЗИНКИНАЗЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2007 |
|
RU2468788C2 |
| АМОРФНАЯ (5-ФТОР-2-МЕТИЛ-3-ХИНОЛИН-2-ИЛМЕТИЛИНДОЛ-1-ИЛ)-УКСУСНАЯ КИСЛОТА | 2012 |
|
RU2616000C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ МУКОВИСЦИДОЗНЫМ ТРАНСМЕМБРАННЫМ РЕГУЛЯТОРОМ ПРОВОДИМОСТИ | 2015 |
|
RU2744460C2 |
| ТВЕРДЫЕ ДИСПЕРСИИ, СОДЕРЖАЩИЕ ИНГИБИТОРЫ КИНАЗ | 2011 |
|
RU2566716C2 |
| ПОЛИМЕРНЫЕ КОМПОЗИЦИИ ИНГИБИТОРОВ СЕТР | 2007 |
|
RU2457841C2 |
| ТВЕРДАЯ ДИСПЕРСИЯ | 2012 |
|
RU2648448C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ И УЛУЧШЕННОЙ ОБРАБАТЫВАЕМОСТЬЮ | 2014 |
|
RU2656662C2 |
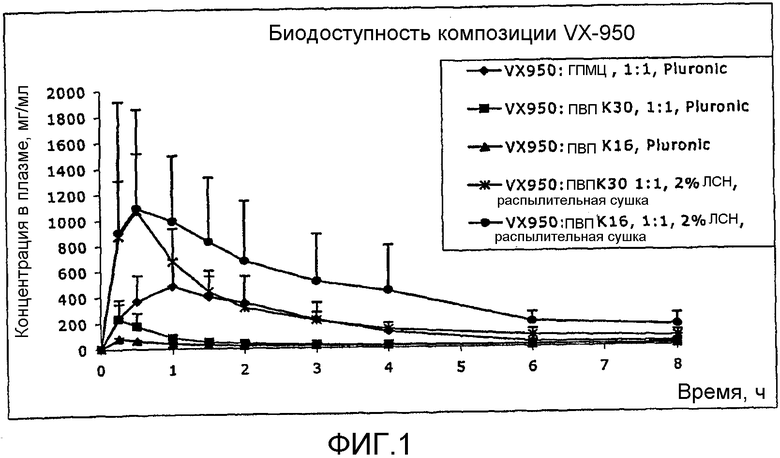

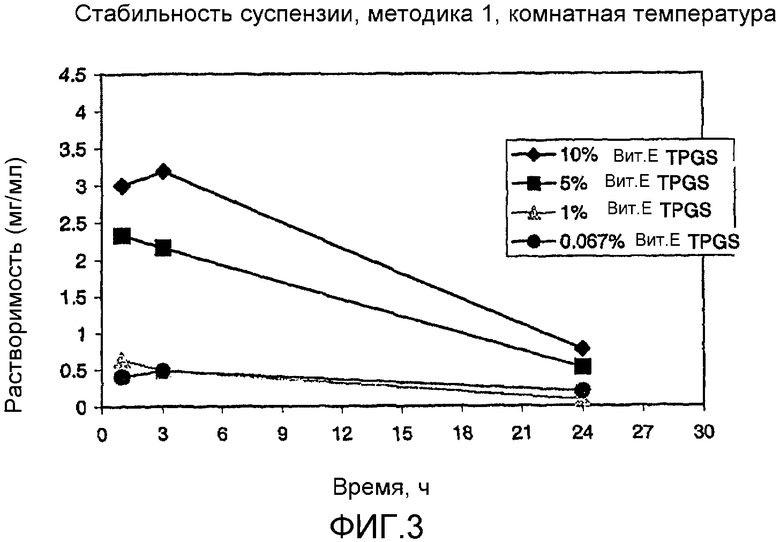
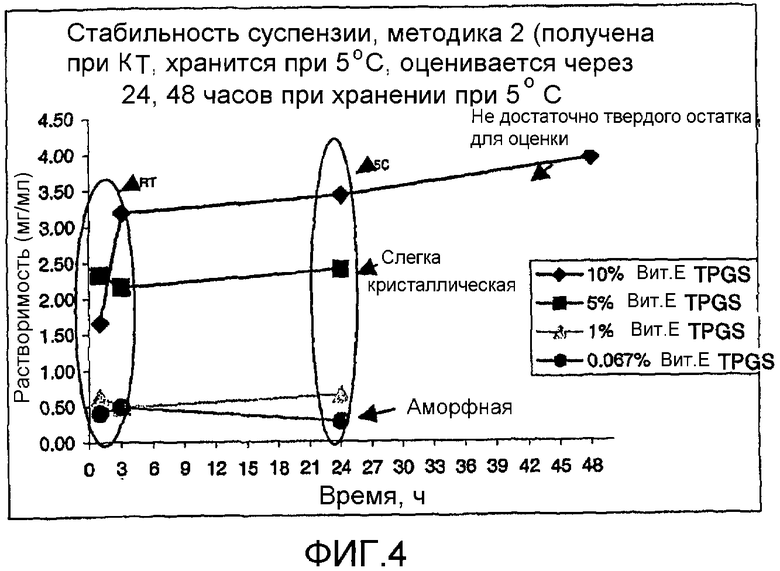
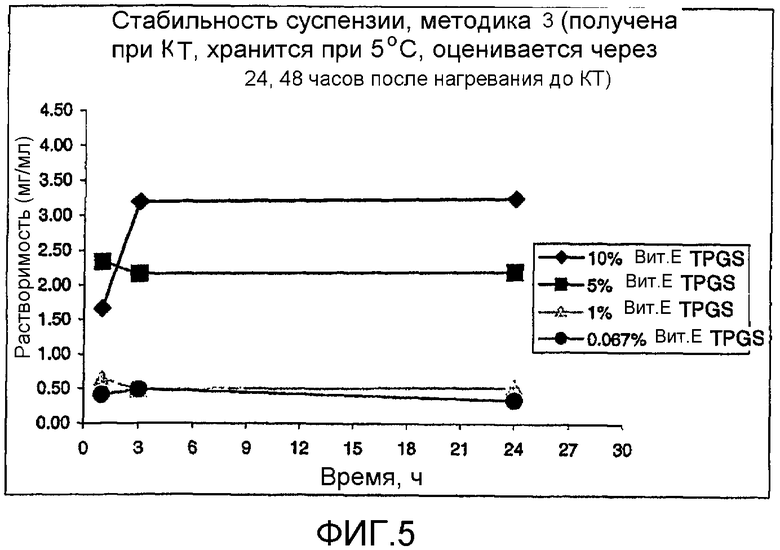

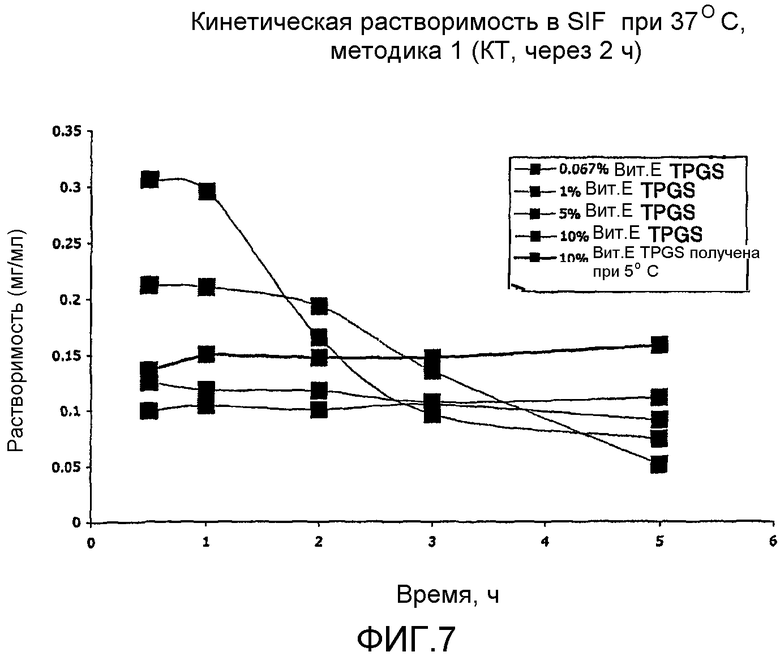

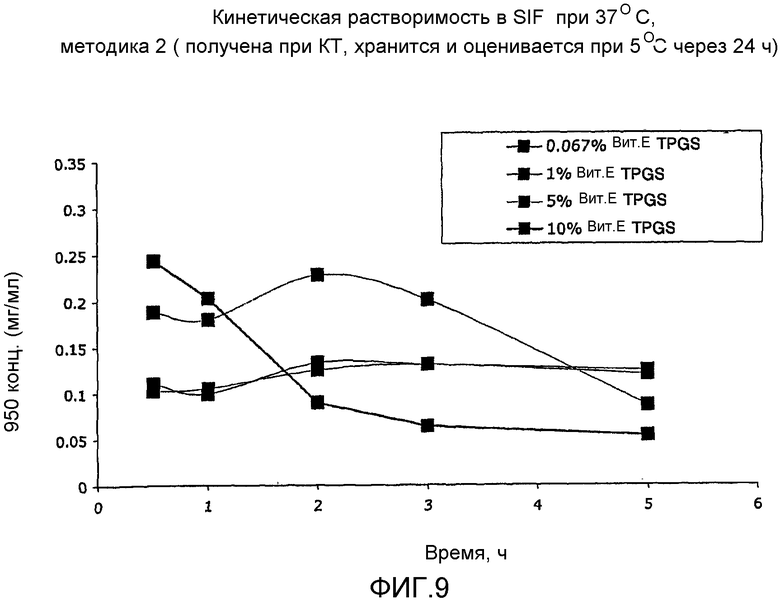
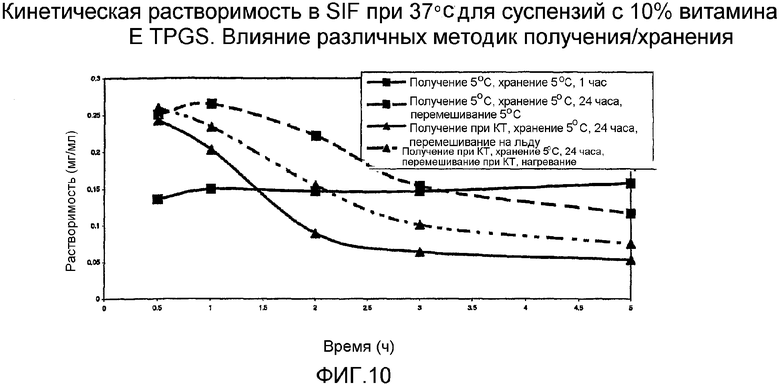
Изобретение относится к химико-фармацевтической промышленности и касается формы и композиции, содержащих аморфный VX-950, а также их применения для лечения вирусного гепатита С. Заявленное изобретение обеспечивает высокую биодоступность VX-950, а также хорошую стабильность композиции при хранении. 12 н. и 58 з.п. ф-лы, 10 табл., 10 ил.
1. Композиция для лечения вирусного гепатита С, содержащая аморфный VX-950 и второй компонент, выбранный из группы:
поверхностно-активное вещество, представляющее собой лаурилсульфат натрия или витамин Е TPGS, или полимер представляющий собой один или более из растворимых в воде полимеров или частично растворимых в воде полимеров.
2. Композиция по п.1, которая дополнительно может содержать инертное фармацевтически приемлемое вспомогательное вещество.
3. Композиция по п.1, где композиция представляет собой твердую дисперсию, смесь или жидкую дисперсию.
4. Композиция по п.1, где композиция является твердой дисперсией.
5. Твердая дисперсия для лечения вирусного гепатита С, содержащая композицию по п.1.
6. Твердая дисперсия по п.5, где твердая дисперсия содержит менее чем около 40% кристаллического VX-950.
7. Твердая дисперсия по п.5, где твердая дисперсия практически не содержит кристаллический VX-950.
8. Твердая дисперсия по п.5, где твердая дисперсия дополнительно содержит инертное фармацевтически приемлемое вещество.
9. Твердая дисперсия по п.5, где твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950.
10. Твердая дисперсия по п.5, где VX-950 имеет скорость релаксации, которая ниже, чем скорость релаксации чистого аморфного VX-950.
11. Твердая дисперсия по п.5, содержащая полимер, где полимер содержится в достаточном количестве, таком, чтобы при введении твердой дисперсии уровень VX-950 в крови крысы являлся, по крайней мере, на 20% более высоким, чем при введении VX-950, который не содержит полимер.
12. Твердая дисперсия по п.11, где уровень VX-950 в крови крысы является, по крайней мере, на около 200% более высоким, чем при введении VX-950, который не содержит полимер.
13. Твердая дисперсия по п.11, где уровень VX-950 в крови крысы является, по крайней мере, на около 400% более высоким, чем при введении VX-950, который не содержит полимер.
14. Твердая дисперсия по п.5, где полимером является гидроксипропилметилцеллюлоза (ГПМЦ).
15. Твердая дисперсия по п.5, где полимером является сукцинат ацетата гидроксипропилметилцеллюлозы (САГПМЦ).
16. Твердая дисперсия по п.5, где полимер присутствует в количестве от около 10 до около 80 мас.%.
17. Твердая дисперсия по п.16, где полимер присутствует в количестве от около 70 мас.%.
18. Твердая дисперсия по п.16, где полимер присутствует в количестве около 50 мас.%.
19. Твердая дисперсия по п.16, где полимер присутствует в количестве около 49,5 мас.%.
20. Твердая дисперсия по п.5, где VX-950 присутствует в количестве от около 10 до около 80 мас.%.
21. Твердая дисперсия по п.20, где VX-950 присутствует в количестве около 70 мас.%.
22. Твердая дисперсия по п.20, где VX-950 присутствует в количестве около 50 мас.%.
23. Твердая дисперсия по п.5, содержащая поверхностно-активное вещество.
24. Твердая дисперсия по п.23, где поверхностно-активное вещество присутствует в количестве от около 0,1 до около 15%.
25. Твердая дисперсия по п.24, где поверхностно-активное вещество присутствует в количестве от около 1 до около 5%.
26. Твердая дисперсия по п.5, где, по крайней мере, 80 мас.% VX-950 находится в аморфной форме.
27. Твердая дисперсия по п.26, где, по существу, весь VX-950 находится в аморфной форме.
28. Твердая дисперсия по п.5, где VX-950 представляет собой смесь L-изомера и D-изомера.
29. Твердая дисперсия по п.5, где VX-950 является, по существу, чистым L-изомером.
30. Твердая дисперсия по п.5, где твердую дисперсию получают распылительной сушкой.
31. Фармацевтическая композиция для лечения вирусного гепатита С, содержащая аморфный VX-950 и второй компонент, выбранный из группы поверхностно-активное вещество, представляющее собой лаурилсульфат натрия или витамин Е TPGS, или полимер, представляющий собой один или более из растворимых в воде полимеров или частично растворимых в воде полимеров.
32. Композиция по п.31, где аморфный VX-950, по существу, не содержит кристаллический VX-950.
33. Фармацевтическая композиция для лечения вирусного гепатита С, содержащая аморфный VX-950 в виде твердой дисперсии и одно или более из поверхностно-активных веществ, выбранных из группы, содержащей лаурилсульфат натрия или витамин Е TPGS, полимеров, выбранных из группы, содержащей один или более из растворимых в воде полимеров или частично растворимых в воде полимеров, и инертных фармацевтически приемлемых веществ или фармацевтически приемлемых носителей.
34. Фармацевтическая композиция по п.33, где твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950.
35. Фармацевтическая композиция по п.33, где VX-950 имеет скорость релаксации, которая ниже, чем скорость релаксации чистого аморфного VX-950.
36. Фармацевтическая композиция по п.33, содержащая полимер, где полимер содержится в достаточном количестве, таком, чтобы при введении твердой дисперсии уровень VX-950 в крови крысы составлял, по крайней мере, на 20% выше, чем при введении VX-950, который не содержит полимер.
37. Фармацевтическая композиция по п.33, где уровень VX-950 в крови крысы является, по крайней мере, на около 200% более высоким, чем при введении VX-950, который не содержит полимер.
38. Фармацевтическая композиция по п.33, где уровень VX-950 в крови крысы является, по крайней мере, на около 400% более высоким, чем при введении VX-950, который не содержит полимер.
39. Фармацевтическая композиция по п.33, где полимером является ГПМЦ.
40. Фармацевтическая композиция по п.33, где полимером является CAГПМЦ.
41. Фармацевтическая композиция для лечения вирусного гепатита С, содержащая
аморфную твердую дисперсию VX-950, где указанный VX-950 составляет около 30-75 мас.% от фармацевтической композиции, один или более полимер, выбранный из группы ГПМЦ и САГПМЦ, где указанный полимер составляет около 30-75 мас.% от фармацевтической композиции, и
поверхностно-активное вещество, выбранное из группы, содержащей лаурилсульфат натрия или витамин Е TPGS, где указанное поверхностно-активное вещество составляет около 0,5-2 мас.% от фармацевтической композиции.
42. Фармацевтическая композиция по п.41, где полимером является ГПМЦ.
43. Фармацевтическая композиция по п.41, где полимером является САГПМЦ.
44. Фармацевтическая композиция по п.41, где
указанный VX-950 составляет 49,5 мас.% от фармацевтической композиции,
указанным полимером является ГПМЦ, составляющая около 49,5 мас.% от фармацевтической композиции, и
указанным поверхностно-активным веществом является лаурилсульфат натрия или витамин Е TPGS и он составляет около 1 мас.% от фармацевтической композиции.
45. Фармацевтическая композиция по п.41, где указанный VX-950 составляет 49,5 мас.% от фармацевтической композиции,
указанным полимером является САГПМЦ, составляющая около 49,5 мас.% от фармацевтической композиции, и
указанным поверхностно-активным веществом является лаурилсульфат натрия или витамин Е TPGS и он составляет около 1 мас.% от фармацевтической композиции.
46. Фармацевтическая композиция по п.41, где аморфный VX-950 имеет форму твердой дисперсии.
47. Фармацевтическая композиция для лечения вирусного гепатита С, содержащая
VX-950 в количестве около 70 мас.% от фармацевтической композиции,
полимер, выбранный из ГПМЦ и САГПМЦ, который составляет около 29 мас.% от фармацевтической композиции, и
поверхностно-активное вещество, выбранное из лаурилсульфата натрия или витамина Е TPGS, который составляет около 1 мас.% от фармацевтической композиции.
48. Фармацевтическая композиция для лечения вирусного гепатита С, содержащая
водную суспензию, содержащую частицы аморфного VX-950 и полимер в растворе, выбранный из группы ГПМЦ и САГПМЦ.
49. Фармацевтическая композиция по п.47, дополнительно содержащая поверхностно-активное вещество либо в растворе, либо в виде компонента частиц VX-950, или оба варианта.
50. Фармацевтическая композиция по п.49, где поверхностно-активное вещество выбрано из группы ЛСН и витамина Е TPGS.
51. Фармацевтическая композиция по п.47, где полимер находится либо в растворе, либо в качестве компонента частиц VX-950, или оба варианта.
52. Фармацевтическая композиция по п.47, где водная суспензия содержит от около 0,1 до около 20 мас.% поверхностно-активного вещества.
53. Фармацевтическая композиция по п.47, где водная суспензия содержит от около 1 около 100 мг/мл аморфного VX-950.
54. Фармацевтическая композиция по п.47, где водная суспензия содержит от около 0,1 до около 2,0 мас.% полимера.
55. Фармацевтическая композиция по п.54, где водная суспензия содержит около 1 мас.% полимера.
56. Способ получения аморфной формы VX-950, включающий распылительную сушку VX-950 с получением аморфной формы VX-950.
57. Способ по п.56, включающий объединение VX-950 и подходящего растворителя с получением смеси и последующей распылительной сушкой смеси с получением аморфной формы VX-950.
58. Способ по п.56, включающий:
a) получение смеси, содержащей VX-950, полимер и растворитель;
b) распылительную сушку смеси с получением твердой дисперсии, включающей VX-950.
59. Способ по п.58, где полимер выбирают из ГПМЦ и САГПМЦ.
60. Способ по п.58, где полимер присутствует в количестве от около 30 до около 70 мас.% твердой дисперсии.
61. Способ по п.56, где смесь дополнительно содержит поверхностно-активное вещество.
62. Способ по п.61, где поверхностно-активным веществом является лаурилсульфат натрия (ЛСН) или витамин Е TPGS.
63. Способ по п.58, где растворитель включает метиленхлорид.
64. Способ по п.58, где растворитель включает ацетон.
65. Способ по п.58, где растворитель включает от около 0 до около 30% ацетона и от около 70 до около 100% метиленхлорида.
66. Способ по п.58, где растворитель включает от около 0 до около 40% ацетона и от около 60 до около 100% метиленхлорида.
67. Способ лечения инфекции вирусного гепатита С у млекопитающих, включающий введение композиции, содержащей аморфный VX-950 и второй компонент, выбранный из группы поверхностно-активное вещество, представляющее собой лаурилсульфат натрия или витамин Е TPGS, или полимер, представляющий собой один или более из растворимых в воде полимеров или частично растворимых в воде полимеров.
68. Способ лечения инфекции вирусного гепатита С у млекопитающих, включающий введение твердой дисперсии по п.5.
69. Фармацевтическая упаковка, содержащая аморфный VX-950 и второй компонент, выбранный из группы поверхностно-активное вещество, представляющее собой лаурилсульфат натрия или витамин Е TPGS, или полимер, представляющий собой один или более из растворимых в воде полимеров или частично растворимых в воде полимеров.
70. Фармацевтический набор, содержащий аморфный VX-950 и второй компонент, выбранный из группы поверхностно-активное вещество, представляющее собой лаурилсульфат натрия или витамин Е TPGS, или полимер, представляющий собой один или более из растворимых в воде полимеров или частично растворимых в воде полимеров.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 6548555 B1, 15.04.2003 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| СПОСОБ ЛЕЧЕНИЯ ГЕПАТИТА В | 1992 |
|
RU2104700C1 |
Авторы
Даты
2009-11-27—Публикация
2005-06-08—Подача