Изобретение относится к области биологии и медицины, а именно к способам подавления роста злокачественных опухолей.
Известен (международная заявка WO 97103666, A61K 31/40, 1997 г.) способ подавления опухолевого роста, включающий последовательное введение в опухолевую ткань комплексов кобальта или железа с замещенными фталоцианинами или нафталоцианинами и биогенного восстановителя, в качестве которого использовали, в частности, аскорбиновую кислоту. При этом мольное соотношение комплекс:восстановитель составляет от 1:5 до 1:50, а разовая доза октакарбоксифталоцианина кобальта - 75-100 мг/кг. Рассматриваемый способ позволяет подавить рост довольно широкого круга злокачественных новообразований, что показано на примерах как in vitro, так и in vivo. Недостатком этого способа является его невысокая противоопухолевая активность, повысить которую за счет увеличения дозы препарата не позволяет присутствие в нем аскорбиновой кислоты, которая при более высоких используемых дозах делает препарат токсичным.
Наиболее близким к предлагаемому изобретению является способ подавления опухолевого роста (патент РФ 2188054, A61N 7/00, A61K 31/40, 1999 г.). Этот способ включает в себя введение в опухоль октакарбоксифталоцианата кобальта (терафтал) и аскорбиновой кислоты и дополнительное воздействие на опухолевую ткань ультразвуковым облучением с частотой 0,5-3 МГц и интенсивностью 0,5-5 Вт/см2. При этом мольное соотношение комплекс:восстановитель составляет от 1:3 до 1:30, а разовая доза октакарбоксифталоцианина кобальта - 30-40 мг/кг. В оптимальном варианте использования способа показатель противоопухолевой активности - торможение роста опухоли (ТРО) составляет 65-68%. В данном техническом решении за счет снижения количества аскорбиновой кислоты частично преодолен недостаток вышеописанного аналогичного способа. Однако противоопухолевая активность используемых по прототипу препаратов остается неудовлетворительной и не может быть повышена из-за токсичности способа при более высоких дозах используемых препаратов.
Задачей настоящего изобретения является изыскание более эффективного и менее токсичного способа подавления опухолевого роста.
Поставленная задача была решена путем введения в опухолевую ткань октанатриевой соли октакарбоксифталоцианина цинка (далее, фталоцианин цинка) с последующим воздействием на нее ультразвука, что позволяет исключить токсическое действие аскорбиновой кислоты и приводит к существенному повышению терапевтической эффективности способа. При этом используемая доза фталоцианина цинка составляет 10-150 мг/кг, а воздействие на опухолевую ткань ультразвуком осуществляют при температуре опухолевых тканей 36-42°С через 1-3 часа после введения фталоцианина цинка.
Отличительной особенностью предложенного способа по сравнению с прототипом является использование для подавления опухолевого роста октанатриевой соли октакарбоксифталоцианина цинка, не проявляющей каталитической активности, присущей фталоцианиновым комплексам кобальта и железа, в сочетании с биогенным восстановителем. Это указывает, на существенное различие в механизмах воздействия используемого препарата на рост злокачественных опухолей по сравнению с известным способом. В случае прототипа введение октакарбоксифталоцианина кобальта и аскорбиновой кислоты приводит к образованию анион-радикалов супероксида, являющихся активным началом, и с чем, по-видимому, связана плохая переносимость известного способа, ввиду слабой контролируемости процесса. Имеющиеся экспериментальные данные свидетельствуют о том, что в предложенном способе фталоцианин цинка образует в опухоли твердую фазу, и поэтому можно предположить, что в данном случае реализуется механизм твердофазной соносенсибилизации и, соответственно, фталоцианин играет роль соносенсибилизатора, что и определяет высокую терапевтическую эффективность предложенного способа.
Интервал используемых доз октанатриевой соли октакарбоксифталоцианина цинка не только обеспечивает достижение максимального целевого эффекта, но и позволяет при необходимости варьировать концентрацию препарата в довольно широком диапазоне, что может быть существенным при лечении различных типов опухолей и индивидуальной переносимости препарата больными. При этом введение его в количестве, меньшем, чем 10 мг/кг нецелесообразно, поскольку не приводит к существенному подавлению роста опухолевой ткани. Применение же доз выше 150 мг/кг существенно увеличивает вероятность токсических эффектов.
Выбор температурных и временных режимов ультразвукового облучения обусловлен также необходимостью достижения максимального терапевтического эффекта. При этом при температуре опухолевых тканей ниже 36°С эффект воздействия практически не наблюдается, а использование температур выше 42°С приводит к повреждению здоровых тканей и утрате термосенсибилизирующего эффекта фталоцианина цинка.
Необходимость введения фталоцианина цинка в течение определенного временного интервала до ультразвукового воздействия также определяется необходимостью достижения максимального терапевтического эффекта, связанного со временем достижения препаратом клеточных мишеней. При этом ультразвуковое облучение раньше, чем за 1 час после введения фталоцианина цинка не обеспечивает необходимого терапевтического эффекта, а позднее, чем через 3 часа после введения фталоцианина цинка, ухудшает терапевтический эффект, за счет возможной деградации препарата и вывода его из организма.
Определение противоопухолевой активности предложенного способа было проведено на мышах с перевиваемыми опухолями (in vivo). Все эксперименты по оценке эффективности предложенного изобретения проводили на штаммах опухолей: меланома В 16 (примеры 1-14 и 22) и высокометастазирующей в легкие карциномы Льюиса (примеры 15-21).
Для оценки эффекта каждого воздействия по данному изобретению определяли время удвоения объема опухоли «τ». Для этого до и после воздействия в разные сроки измеряли и рассчитывали средний объем опухоли: V0 - объем опухоли до воздействия; Vt - объем опухоли в момент измерения. Затем вычисляли Vt/V0 и графическим способом определяли «τ» в сравниваемых группах. Об эффективности судили по коэффициенту (К), который вычисляли по формуле
K = «τ» контроля/ «τ» терапии,
где «τ» контроля - время удвоения объема опухоли в группе без специфического воздействия; «τ» терапии - время удвоения объема опухоли в группе, подвергшейся воздействию по данному изобретению.
Определение К, также как и определение показателя торможения роста опухоли (ТРО) в прототипе, является общепринятым, но более объективным показателем торможения роста опухоли.
Пример 1.
Эксперимент проводили следующим образом.
В опыте использованы мыши-самки гибридов BDF1 и линии В16 с массой тела 20-21 грамм с в/м трансплантированной меланомой В16. Методика перевивки опухоли 8±0,05 см3 и подготовки животных для эксперимента являлись общепринятыми.
Перед опытом мышей ранжировали по группам. Одну группу оставляли контрольной (число особей n=8) и вводили этим мышам внутривенно однократно физиологический раствор хлористого натрия. Основная группа получала фталоцианин цинка с облучением ультразвуком (n=6). Группы сравнения получали однократно УЗ (n=6) в оптимальных режимах применения.
Животное с опухолью В16 фиксировали на специальном держателе и лапку с опухолью погружали в контактную среду (воду). Затем внутривенно вводили фталоцианин цинка в количестве 50 мг/кг в объеме 0,2 мл физраствора. Через 2 часа после его введения проводили обработку ультразвуком в течение 10 минут. При этом параметры ультразвука были следующими: частота 2 МГц, интенсивность - 4 Вт/см2. Опухоль облучали равномерно, перемещая излучатель по всей опухоли. Температуру в опухоли, которая составляла 40°С, фиксировали термопарой.
Аналогичным образом проводили сравнительные эксперименты по воздействию только ультразвука и терафтала с аскорбиновой кислотой и ультразвука (по прототипу).
Результаты эксперимента по данному примеру приведены в таблице 1.
Примеры 2-6. Эксперименты проводили аналогично примеру 1, за исключением того, что количество фталоцианина цинка варьировалось в пределах 10-150 мг/кг, а время облучения от 5 до 20 мин. Результаты экспериментов также приведены в таблице 1.
Наблюдаемый терапевтический эффект, выраженный через коэффициент К, для мышей, подвергшихся лечению по предлагаемому способу (примеры 2-6), составляет 150-160% в сравнении с прототипом. Гибели животных от острой токсичности не наблюдалось.
Зависимость торможения роста меланомы В16 от дозы октанатриевой соли октакарбоксифталоцианина цинка (фталоцианина цинка) и времени облучения при воздействии ультразвуком (УЗ)
Примеры 7-14. Эксперименты проводили аналогично примеру 1, но температура обработки опухолевых тканей варьировались в пределах 36-43°С, а время от введения фталоцианина цинка до начала ультразвукового облучения от 1 до 3-х часов. При этом доза фталоцианина цинка составляла 50 мг/кг, время облучения ультразвуком - 10 мин, параметры ультразвукового облучения - частота 1,0 МГц, мощность - 4,0 Вт/см2.
Результаты, полученные по данным примерам, приведены в таблице 2.
Зависимость торможения роста опухоли меланомы В16 от температуры опухолевых тканей и времени от введения фталоцианина цинка до облучения ультразвуком.
Примеры 15-21. Эксперименты проводили аналогично примеру 1, однако в качестве перевиваемой опухоли использовали карциному Льюиса. Время облучения ультразвуком - 10 мин, параметры ультразвукового облучения - частота 1,0 МГц, мощность - 6,0 Вт/см.
Результаты, полученные по данным примерам, приведены в таблице 3.
Зависимость торможения роста опухоли карциномы Льюиса от количества введенного фталоцианина цинка, температуры опухолевых тканей и временного интервала от введения фталоцианина цинка до ультразвукового воздействия.
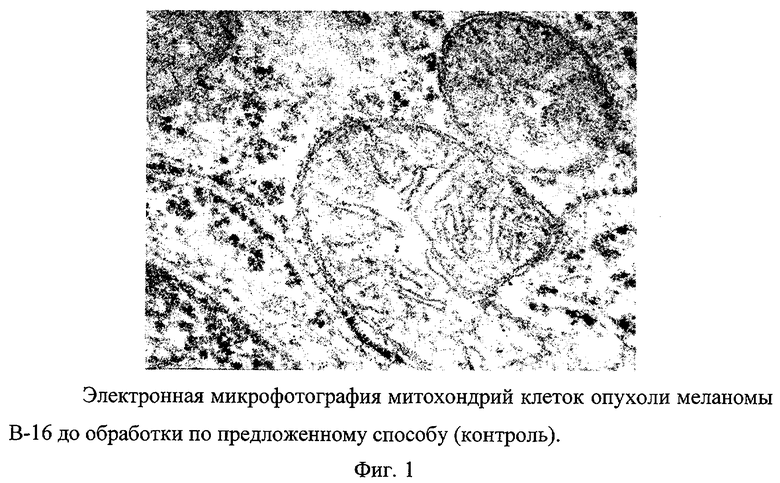
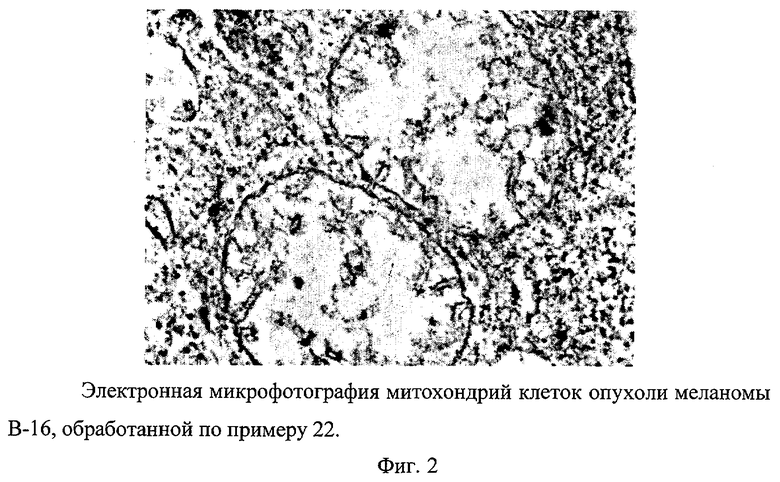
Пример 22. Эксперимент проводили аналогично примеру 1, за исключением того, что интенсивность ультразвука составляла 2 Вт/см2.
Через десять дней после окончания лечения по описанному примеру животных забивали и проводили морфологическое исследование опухолевых тканей.
Электронные микрофотографии митохондрий клеток опухоли меланомы В-16, соответствующие примеру 22, приведены на фиг.1 (контроль) и 2 (после лечения). На микрофотографии опухоли после лечения (фиг.2) отчетливо видны митохондрии с разрушенными кристами, что свидетельствует о гибели клеток.
Из вышеприведенных данных следует, что использование предлагаемого способа позволяет эффективно подавить рост ряда злокачественных опухолей, а именно, добиться торможения роста опухоли, а также понизить общую токсичность способа по сравнению с прототипом, в частности, за счет исключения биогенного восстановителя - аскорбиновой кислоты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2010 |
|
RU2447916C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1999 |
|
RU2188054C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2010 |
|
RU2446844C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2007 |
|
RU2339414C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2012 |
|
RU2491930C1 |
| ОКТА-4,5-КАРБОКСИФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2193563C2 |
| ЭФИРЫ ОКТА-4,5-КАРБОНОВОЙ КИСЛОТЫ ФТАЛОЦИАНИНА КОБАЛЬТА, ИХ КОМПЛЕКСЫ ВКЛЮЧЕНИЯ С ПРОПИЛЕНГЛИКОЛЕВЫМ ЭФИРОМ β-ЦИКЛОДЕКСТРИНА И СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2000 |
|
RU2172319C1 |
| НЕИНВАЗИВНЫЙ СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ ТКАНЕЙ И ИХ ОМЕРТВЛЕНИЯ | 2016 |
|
RU2665621C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1996 |
|
RU2114623C1 |
| СПОСОБ СОЧЕТАННОГО КОНСЕРВАТИВНОГО ВОЗДЕЙСТВИЯ НА ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ | 2008 |
|
RU2392935C1 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения опухолей. Способ включает введение в опухолевую ткань октакарбоксифталоцианина металла - октанатриевой соли октакарбоксифталоцианина цинка при дозе 10-150 мг/кг за 1-3 часа до ультразвукового облучения, при котором опухолевую ткань нагревают до температуры 36-42°С. Использование изобретения позволяет подавлять рост опухолевых клеток за счет твердофазной соносенсибилизации под действием октакарбоксифталоцианина металла и ультразвука. 3 табл., 2 ил.
Способ подавления опухолевого роста, включающий введение в опухолевую ткань октакарбоксифталоцианина металла и последующее воздействие на опухолевую ткань ультразвуковым облучением, отличающийся тем, что в качестве октакарбоксифталоцианина металла вводят октанатриевую соль октакарбоксифталоцианина цинка при дозе 10-150 мг/кг за 1-3 ч до ультразвукового облучения, а опухолевую ткань нагревают до температуры 36-42°С.
| ФОТОСЕНСИБИЛИЗАТОР, ЛИПОСОМАЛЬНАЯ ФОРМА ФОТОСЕНСИБИЛИЗАТОРА И СПОСОБ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2004 |
|
RU2257898C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОГО ВОЗДЕЙСТВИЯ НА ВИРУСЫ ИЛИ КЛЕТКИ | 2002 |
|
RU2291700C2 |
| ФОТОУЛЬТРАЗВУКОВОЕ УСТРОЙСТВО | 2001 |
|
RU2320381C2 |
| WO 2007000473, 04.01.2007 | |||
| СПОСОБ РЕГУЛИРОВАНИЯ ЭЛЕКТРИЧЕСКОЙ ПЕРЕДАЧИ ТЕПЛОВОЗА | 2010 |
|
RU2423252C1 |
| US 6511971, 28.01.2003 | |||
| МЕРЗЛЯКОВА О.Ю | |||
| Способы повышения эффективности термотерапии внутриглазных опухолей | |||
| Автореф | |||
| дисс.к.м.н., Москва, 2007, - С.3-21 | |||
| он лайн [найдено в Интернет на | |||
Авторы
Даты
2009-12-10—Публикация
2008-07-21—Подача