Изобретение относится к новому способу получения - 4-оксо-4H-хроменов с общей структурной формулой 1-5:
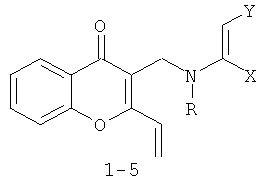
1 R=Me X=H Y=CO2Me
2 R=Me X=Y=CO2Me
3 R=Bn X=H Y=COMe
4 R=Bn X=H Y=СО2Ме
5 R=Bn X=Y=СО2Ме
Для синтеза производных 4-оксо-4H-хроменов разработано несколько способов. Реакция Симониса основана на конденсации β-кетоэфиров с фенолом (С.Сетна, Р.Пхадке, «Органические реакции», Москва, Издатинлит, 1956, сб.7, гл.1).
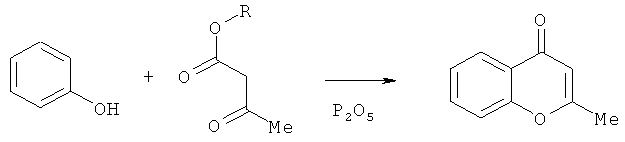
В другом способе проводят конденсацию о-гидроксиацетофенона с ацилирующим агентом, образовавшийся при этом β-дикетон циклизуют в кислой среде (T.A.Geissman, Journal American Chemistry Societe, 1949, 71, 1498).
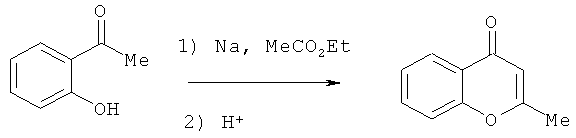
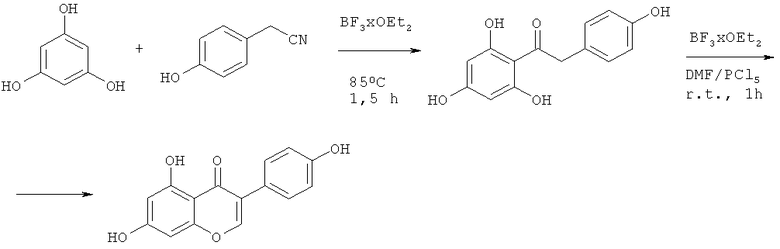
По реакции Хубена-Хёша получен природный 4-оксо-4H-хромен - флавоноид Genistein. В двухступенчатом синтезе в качестве исходных используют 1,3,5-триоксифенол и нитрил n-оксиэтановой кислоты (R.Gronheid, G.Lodder, T.Okuyama, Journal Organic Chemistry, 2002, 67, 693-702).
Техническим результатом, на решение которого направлено изобретение, является новый способ получения производных 4-оксо-4H-хроменов, содержащих винильную и енаминную группировки. 4-Оксо-4H-хромены могут представлять интерес в качестве соединений, проявляющих цитотоксическую активность (C.Pomtep, W.Suthep, S.Nongluksna, N.Nattaya, M.Chulabhom, R.Somsak, K.Prasat, Phytochemistry, 70 (1), p.121, Jan 2009). Соединения этого ряда обладают также антиатеросклеротическим и антитромботическим действием (Патент Российской Федерации №2118321 от 27.08.1998, заявитель Дзе Апджон Компани (US)).
Полученные соединения также имеют структурное сходство с простейшими природными хромонами, такими как эвгенин и пейценин, которые относятся к метил- и пропенилхромонам и выделены из дикого клевера.
Технический результат достигается тем, что способ получения производных 4-оксо-4H-хроменов, содержащих винильную и енаминную группировки, с общей структурной формулой:

1 R=Me X=H Y=СО2Ме
2 R=Me X=Y=CO2Me
3 R=Bn X=H Y=COMe
4 R=Bn X=H Y=CO2Me
5 R=Bn X=Y=CO2Me
заключается в том, что к 1,0 ммолю 1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она с общей структурной формулой:
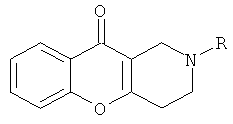
где R имеет указанное значение добавляют метанол и 1,2 ммоля метилпропиолата, ацетилацетилена или диметилдикарбоксилата и перемешивают при комнатной температуре в течение 1 часа до исчезновения осадка исходного соединения, затем растворитель упаривают досуха и оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации.
Таким образом, предложенный способ позволяет в один этап из 2-метил- и 2-бензил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-онов получить производные 4-оксо-4H-хроменов, содержащих винильную и енаминную группы.
Способ осуществляется следующим образом. К 1,0 ммолю 1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-онов добавляют 7 мл метанола и 1,2 ммоля метилпропиолата, ацетилацетилена или диметилацетилендикарбоксилата и перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель упаривают досуха, оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации.
Таким образом, 4-оксо-4H-хромены 1-5 получают из 1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-онов при взаимодействии с 1,2 мольным избытком метилпропиолата, ацетилацетилена или диметилацетилендикарбоксилата в один этап в метаноле при комнатной температуре:
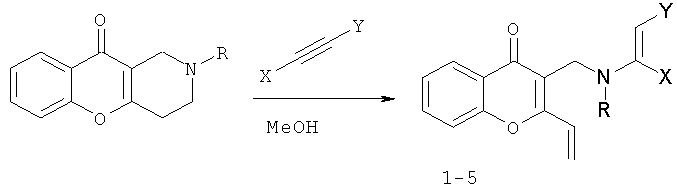
1 R=Me X=H Y=CO2Me
2 R=Me X=Y=CO2Me
3 R=Bn X=H Y=COMe
4 R=Bn X=H Y=CO2Me
5 R=Bn X=Y=CO2Me
Выходы 4-оксо-4H-хроменов 1-5 колеблются от 68 до 75%. Строение полученных соединений подтверждено методами масс-спектрометрии, ИК спектроскопии и спектроскопии ПМР.
Пример №1
К 0,215 г (1,0 ммоль) 2-метил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она добавляют 5 мл метанола и 0,10 г (1,2 ммоль) метилпропиолата, перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель упаривают досуха, оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации. Получают соединение 1 (0,22 г) в виде желтого кристаллического вещества.
(Е)-Метил 3-(метил((4-оксо-2-винил-4H-хромен-3-ил)метил)амино)акрилат (1): выход 75%, желтые кристаллы с т.пл. 108-110ºС, ИК спектр (в КВr): 1681, 1631 см-1. 1Н ЯМР (CDCl3, 400 МГц): δ=2.73 (с, 3Н, N-СН3), 3.63 (с, 3Н, ОСН3), 4.38 (с, 2Н, N-СН2), 4.58 (д, 1Н, J=13.1 Гц, СН=СН-СO2Ме), 5.83 (д, 1Н, J=11.1 Гц, CH=CH 2), 6.42 (д, 1Н, J=17.2 Гц, СН=СН 2), 6.78 (дд,1Н, J=11.1, 17.2 Гц, СН=СН2), 7.37 (т, 1Н, J=7.5 Гц, 7-Н), 7.46 (д, 1Н, J=8.9 Гц, 8-Н), 7.63 (д, 1Н, J=13.1 Гц, СН=СН-СО2Ме), 7.66 (дд, 1Н, J=2.1, 7.5 Гц, 6-Н), 8.10 (дд, 1Н, J=2.1, 8.9 Гц, 5-H). Масс-спектр, m/z: 299 (M+). C17H17NO4. Вычислено: N 4.68%, найдено: N 4.70%.
Пример №2
К 0,215 г (1,0 ммоль) 2-метил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она добавляют 5 мл метанола и 0,17 г (1,2 ммоль) диметилацетилендикарбоксилата, перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель упаривают досуха, оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации. Получают соединение 2 (0,26 г) в виде желтого кристаллического вещества.
(E)-Диметил 2-(метил((4-оксо-2-винил-4H-хромен-3-ил)метил)амино)малеат (2): выход 73%, желтые кристаллы с т.пл. 118-121ºС, ИК спектр (в КВr): 1698, 1740 см-1. 1Н ЯМР (CDCl3, 400 МГц): δ=2.64 (с, 3Н, N-СН3), 3.61 (с, 3Н, ОСН3), 3.92 (с, 3Н, ОСН3), 4.30 (с, 2Н, N-CH2), 4.74 (с, 1Н, =CН-СО2Ме), 5.84 (д, 1Н, J=11.1 Гц, СН=СН 2), 6.41 (д, 1Н, J=17.1 Гц, СН=СН 2), 6.87 (дд, 1Н, J=11.1, 17.1 Гц, СН=СН2), 7.37 (т, 1Н, J=7.5 Гц, 7-Н), 7.46 (д, 1Н, J=8.9 Гц, 8-Н), 7.66 (дд, 1Н, J=2.1, 7.5 Гц, 6-Н), 8.10 (дд, 1Н, J=2.1, 8.9 Гц, 5-Н). Масс-спектр, m/z: 357 (М+). С19Н19NO6. Вычислено: N 3.92%, найдено: N 3.89%.
Пример №3
К 0,29 г (1,0 ммоль) 2-бензил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она добавляют 5 мл метанола и 0,08 г (1,2 ммоль) ацетилацетилена, перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель удаляют и растирают оставшееся масло в смеси этилацетата с гексаном до его кристаллизации, получают соединение 3 (0,24 г) в виде желтого кристаллического вещества.
(E)-3-(бензил(3-оксобут-1-енил)амино)-2-винил-4H-хромен-4-он (3): выход 68%, желтые кристаллы с т.пл. 100-102ºС, ИК спектр (в КВr): 1643, 1559 см-1. 1Н ЯМР (CDCl3, 400 МГц): δ=2.04 (с, 3Н, СОМе), 4.31 (с, 2Н, N-СН2), 4.33 (с, 2Н, СН 2С6Н5), 5.22 (д, 1Н, J=13.1 Гц, СН=СН-СОМе), 5.73 (д, 1Н,.J=11.2 Гц, СН=СН 2), 6.34 (д, 1Н, J=16.8 Гц, СН=СН2), 6.62 (дд, 1Н, J=11.2, 16.8 Гц, СН=СН2), 7.07-7.18 (м, 5Н, СН2 С 6 Н 5), 7.29-7.60 (м, 3Н, 6-Н, 7-Н, 8-Н), 7.61 (д, 1Н, J=13.1 Гц, СН=СН-СОМе), 8.10 (дд, 1Н, J=1.9, 8.1 Гц, 5-Н). Масс-спектр, m/z: 359 (М+). C17H17NO4. Вычислено: N 3.90%, найдено: N 3.92%.
Пример №4
К 0,291 г (1,0 ммоль) 2-бензил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она добавляют 5 мл метанола и 0,10 г (1,2 ммоль) метилпропиолата, перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель удаляют и растирают оставшееся масло в смеси этилацетата с гексаном до его кристаллизации, получают соединение 4 (0,26 г) в виде розового кристаллического вещества.
(Е)-Метил 3-(бензил((4-оксо-2-винил-4H-хромен-3-ил)метил)амино)акрилат (4): выход 71%, розовые кристаллы с т.пл. 112-113ºС, ИК спектр (в КВr): 1643, 1559 см-1. 1Н ЯМР (СDСl3, 400 МГц): δ=3.64 (с, 3Н, ОМе), 4.31 (с, 2Н, N-CH2), 4.41 (с, 2Н, CH 2C6H5), 4.76 (д, 1Н, J=12.8 Гц, СН=СH-СO2Ме), 5.78 (д, 1Н, J=11.2 Гц, СН=СН 2), 6.39 (д, 1Н, J=16.5 Гц, СН=СН 2), 6.69 (дд, 1Н, J=11.2, 16.5 Гц, СН=СН2), 7.37 (т, 1Н, J=7.3 Гц, 7-Н), 7.44 (д, 1Н, J=8.2 Гц, 8-Н), 7.65 (т, 1Н, J=7.3 Гц, 6-Н), 7.78 (д, 1Н, J=12.8 Гц, СН=СН-СO2Ме), 8.16 (д, 1Н, J=8.2 Гц, 5-Н). Масс-спектр, m/z: 375 (М+). C23H21NO4. Вычислено: N 3.73%, найдено: N 3.70%.
Пример №5
К 0,291 г (1,0 ммоль) 2-бензил-1,2,3,4-тетрагидро-10H-хромено[3,2-с]пиридин-10-она добавляют 5 мл метанола и 0,17 г (1,2 ммоль) диметилацетилендикарбоксилата, перемешивают при комнатной температуре до исчезновения осадка исходного соединения в течение 1 часа. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. Затем растворитель удаляют и растирают оставшееся масло в смеси этилацетата с гексаном до его кристаллизации, получают соединение 5 (0,31 г) в виде розового кристаллического вещества.
(Е)-Диметил 2-(бензил((4-оксо-2-винил-4H-хромен-3-ил)метил)амино)малеат (5): выход 72%, розовые кристаллы с т.пл. 189ºС (с разложением), ИК спектр (в КВr): 1637, 1697 см-1. 1Н ЯМР (CDCl3, 400 МГц): δ=3.61 (с, 3Н, ОСН3), 3.93 (с, 3Н, ОСН3), 4.35 (с, 2Н, N-СН2), 4.43 (с, 2Н, СН 2С6Н5), 4.85 (с, 1Н, =СН-СO2Ме), 5.80 (д, 1Н, J=11.0 Гц, СН=СН 2), 6.36 (д, 1Н, J=16.5 Гц, СН=СН 2), 6.85 (дд, 1Н, J=11.0, 16.5 Гц, СН=CH2), 7.40-7.45 (м, 2Н, 7-Н, 8-Н), 7.60 (т, 1Н, J=7.6 Гц, 6-Н), 8.10 (т, 1Н, J=7.6 Гц, 5-Н). Масс-спектр, т/г: 433 (М+). С25Н23NO6. Вычислено: N 3.23%, найдено: N 3.26%.
| название | год | авторы | номер документа |
|---|---|---|---|
| CПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2,3,6-ТЕТРАГИДРОПИРРОЛО[1,2-d][1,4]ДИАЗОЦИНОВ | 2008 |
|
RU2378279C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4,5,6,9-ТЕТРАГИДРОТИЕНО[3,2-d]АЗОЦИНОВ | 2006 |
|
RU2320649C9 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО[7,8]АЗОНИНО[5,4-b]ИНДОЛОВ, 7,9-ЭТЕНОАЗЕЦИНО[5,4-b]ИНДОЛОВ И 7,9-ЭТАНОАЗЕЦИНО[5,4-b]ИНДОЛОВ | 2009 |
|
RU2397984C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3',4',5,6-ТЕТРАГИДРО-1Н-СПИРО[ПИРИДИН-4,5'-ТИЕНО[2,3-d]ПИРИМИДИНОВ] | 2011 |
|
RU2455306C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,8,9,10-ТЕТРАГИДРОПИРИМИДО[4,5-d]АЗОЦИНОВ, ИМЕЮЩИХ В 4-М ПОЛОЖЕНИИ ТРИФЛАТНУЮ, ВТОРИЧНУЮ И ТРЕТИЧНУЮ АМИНОГРУППЫ | 2011 |
|
RU2478637C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| КАТАЛИЗАТОР МЕТАТЕЗИСНОЙ ПОЛИМЕРИЗАЦИИ ДИЦИКЛОПЕНТАДИЕНА, СОДЕРЖАЩИЙ АЦЕТАМИДНЫЙ ФРАГМЕНТ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2574718C1 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ПИРРОЛОПИРИДИНОНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2001 |
|
RU2267490C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
Данное изобретение к способу получения новых производных 4-оксо-4Н-хроменов, содержащих винильную и енаминную группировки с общей структурной формулой:
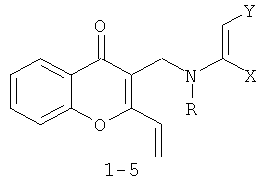
1 R-Me X=H Y=CO2Me; 2 R=Me X=Y=CO2Me; 3 R=Bn X=H Y=COMe; 4 R=Bn X=H Y=CO2Me; 5 R=Bn X=Y=CO2Me, который заключается в том, что к 1,0 ммолю 1,2,3,4-тетрагидро-10Н-хромено[3,2-с]пиридин-10-она с общей структурной формулой: 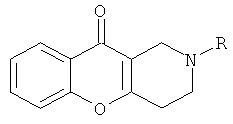
где R имеет указанное значение, добавляют метанол и 1,2 ммоля метилпропиолата, ацетилацетилена или диметилдикарбоксилата и перемешивают при комнатной температуре в течение 1 часа до исчезновения осадка исходного соединения, затем растворитель упаривают досуха и оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации. Технический результат - получение новых соединений, которые могут представлять интерес в качестве соединений, проявляющих цитотоксическую активность, а также обладающих антисклеротическим действием. 5 пр.
Способ получения производных 4-оксо-4Н-хроменов, содержащих винильную и енаминную группировки, с общей структурной формулой

где 1. R=Me; X-H; Y=CO2Me;
2. R=Me; Х=Y=СO2Ме;
3. R=Bn; X-H Y=COMe;
4. R=Bn; X=H Y=CO2Me;
5. R=Bn; Х=Y=СO2Ме,
заключается в том, что к 1,0 ммоль 1,2,3,4-тетрагидро-10Н-хромено[3,2-с]пиридин-10-она с общей структурной формулой

где R имеет указанное значение,
добавляют метанол и 1,2 ммоль метилпропиолата, ацетилацетилена или диметилдикарбоксилата и перемешивают при комнатной температуре в течение 1 ч до исчезновения осадка исходного соединения, затем растворитель упаривают досуха и оставшееся масло растирают в смеси этилацетата с гексаном до его кристаллизации.
| R.Gronhield et al | |||
| J.Org | |||
| Chemistry, 2002, v.67, p.693-702 | |||
| ПРОИЗВОДНЫЕ ХРОМАНОНА | 2001 |
|
RU2273638C2 |
| Способ получения замещенных 2-винилхромонов или их солей | 1978 |
|
SU938743A3 |
| JP 0009003055 A, 07.01.1997 | |||
| Способ получения 2-замещенных производных 4Н-1-бензопиран-4-она | 1990 |
|
SU1721052A1 |
| 2-(4-ОКСИ-3-МЕТОКСИ)-СТИРИЛХРОМОН, ОБЛАДАЮЩИЙ АНТИГИПОКСИЧЕСКОЙ, ГИПОТЕНЗИВНОЙ И АНТИАЛЛЕРГИЧЕСКОЙ АКТИВНОСТЬЮ | 1990 |
|
SU1732656A1 |
| ЗАМЕЩЕННЫЕ БЕНЗОПИРАНОНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ГИДРАТЫ | 1989 |
|
RU2118321C1 |
Авторы
Даты
2012-11-27—Публикация
2011-10-06—Подача