Изобретение относится к медицине, конкретно к веществам, оказывающим противотромботическое действие, а именно к веществам-антиагрегантам, которые угнетают функции тромбоцитов. В медицине существует потребность в веществах, препятствующих образованию артериальных тромбов, опосредованных тромбоцитами. Известна антиагрегантная активность ацетилсалициловой кислоты, аспирина (Awtry Е.Н., Lozcaizo J. Aspirin. Circulation 2000, Vol.101, pp.1206-1218).
Это соединение применяется для предупреждения тромбообразования, связанного с активацией тромбоцитов. Ацетилсалициловая кислота угнетает тромбоциты путем химической реакции, заключающейся в ацетилировании синтетазы простагландина Н2. В результате в тромбоците ослабляется образование тромбоксана А2, выступающего в качестве вторичного активатора тромбоцитов. Антиагрегантное действие ацетилсалициловой кислоты проявляется только в ситуациях, когда тромбоциты активируются с участием указанного фермента. Известны антиагрегантные соединения тиенопиридиновой природы: тиклопидин, клопидогрель (Patrono С., Coller В., Dalen J.E., Fuster V., Gent М., Harker L.A., Hirsh J., Roth G. Platelet-active drugs: the relstionships among dose, effectiveness, and side effects. Chest 1998, Vol.114, pp.470-488).
Непосредственно эти соединения не действуют на тромбоциты, в кровяном русле антиагрегантную активность проявляет их метаболит, содержащий химически активную сульфгидрильную группу. Метаболит угнетает на поверхности тромбоцита пуриновый рецептор за счет химической реакции с его сульфгидрильной группой и таким образом подавляет агрегацию, вызываемую аденозиндифосфорной кислотой (АДФ). Проявление антиагрегантной активности только в результате метаболических превращений осложняет применение тиенопиридовых антиагрегантов.
Известен класс антиагрегантных веществ, представляющих собой хлорзамещенные фрагменты белков, а именно N-хлорпроизводные пептидов, аминокислот, иминокислот, таурина и некоторых родственных соединений. В молекулах этих веществ химически активной частью является хлораминовая или хлориминовая группа атомов (Мурина М.А., Сергиенко В.И., Рощупкин Д.И. Средство для снижения агрегации тромбоцитов. Патент СССР №18346593). Эти вещества относятся к соединениям биологического происхождения, образуются в организме при активации фагоцитов. Недостатком указанных веществ является низкая устойчивость, так что срок хранения составляет несколько часов, невозможность получения активного агента в сухом виде.
Наиболее близким к настоящему изобретению является средство, описанное в патенте (Мурина М.А., Рощупкин Д.И., Сергиенко В.И. Средство для угнетения активности тромбоцитов. Патент РФ №2161483.4). Это антиагрегантное соединение N,N-дихлор-2-аминоэтансульфоновая кислота (синоним N,N-дихлортаурин). Она обладает выраженной способностью угнетать функции тромбоцитов и повышенной устойчивостью. Активность N,N-дихлор-2-аминоэтансульфоновой кислоты обусловлена химической модификацией плазматической мембраны тромбоцитов путем химического взаимодействия с серосодержащими группами атомов: тиоэфирными группами остатка метионина и сульфгидрильными группами. Со стороны N,N-дихлор-2-аминоэтансульфоновой кислоты в этом взаимодействии участвует активный атом хлора хлораминовой группы. У N,N-дихлор-2-аминоэтансульфоновой кислоты имеется недостаток, состоящий в том, что реакция с тиоэфирными группами метионина протекает медленно. Это приводит к тому, что в крови это вещество реагирует с тромбоцитами замедленно и одновременно быстро связывается с сывороточным альбумином.
Целью настоящего изобретения является получение нового соединения, характеризующегося высокой скоростью реакции с серосодержащими группами атомов компонентов тромбоцитов и эффективно угнетающего активность тромбоцитов.
Указанная цель изобретения, во-первых, достигается тем, что синтезируют новое, не описанное ранее соединение, которое родственно N-хлор-2-аминоэтансульфоновой кислоте (хлорамину таурина), относящейся к веществам биологического происхождения. Общая формула заявленного соединения следующая:
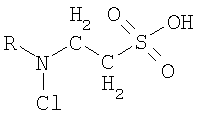
где R - алкил, который замещает атом водорода хлораминовой группы хлорамина таурина. Заявленное соединение синтезируют путем введения в водный раствор гипохлорита натрия водного раствора исходного вещества общей формулы

Смешивание проводят при комнатной температуре, при перемешивании, из расчета не более 1 моля активного хлора на 1 моль исходного вещества.
Примеры полученного соединения: N-хлор-N-метил-2-аминоэтансульфоновая кислота (синоним N-метил-N-хлортаурин) (1), N-хлор-N-изобутил-2-аминоэтансульфоновая кислота (синоним-N-изобутил-N-хлортаурин) (2), N-хлор-N-изопропил-2-аминоэтансульфоновая кислота (синоним N-изопропил-N-хлортаурин) (3).
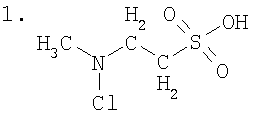

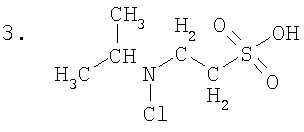
В заявленном соединении химически активной является хлориминовая группа атомов (-NCl). Алкил R обеспечивает повышенную устойчивость заявленного соединения и обеспечивает его необходимую реакционную способность. Заявленное соединение реагирует намного быстрее с тиоэфирными атомными группами компонентов крови, чем известное вещество N,N-дихлор-2-аминоэтансульфоновая кислота.
Цель изобретения также решается тем, что созданное соединение используют в качестве антиагреганта. Благодаря наличию хлориминовой атомной группы, в которой атом хлора способен участвовать в реакциях окисления серосодержащих атомных групп, заявленное соединение угнетает функции тромбоцитов в крови.
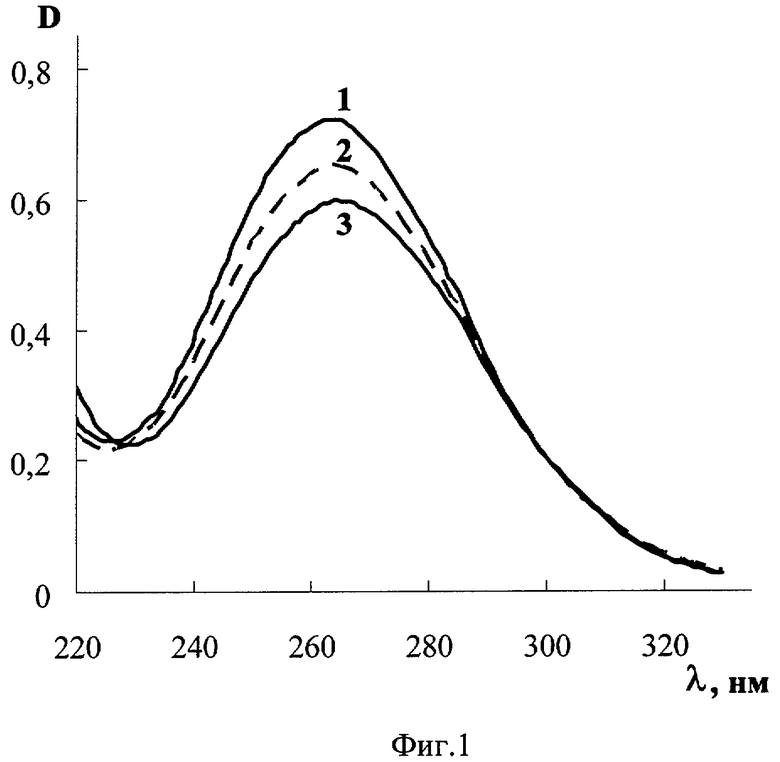
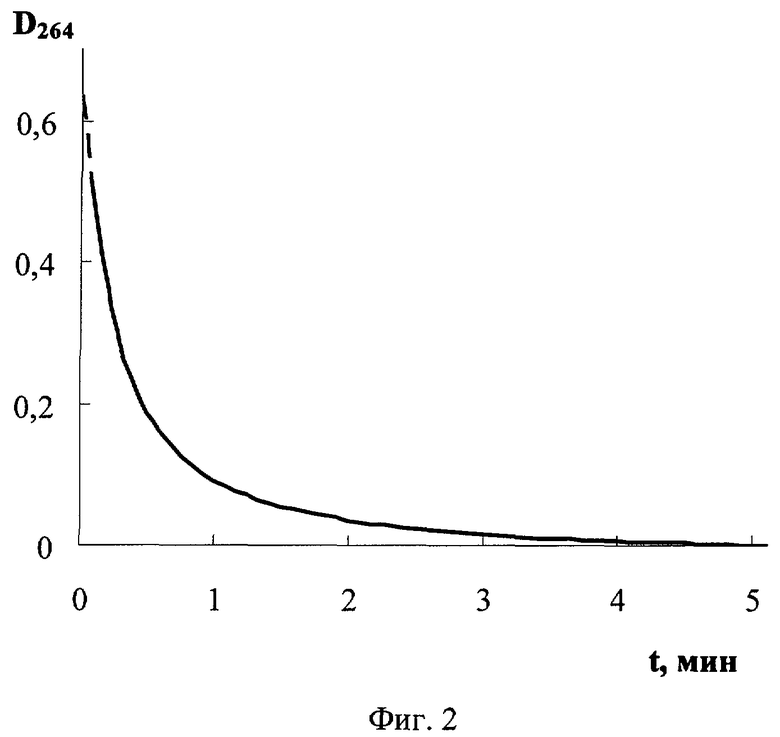
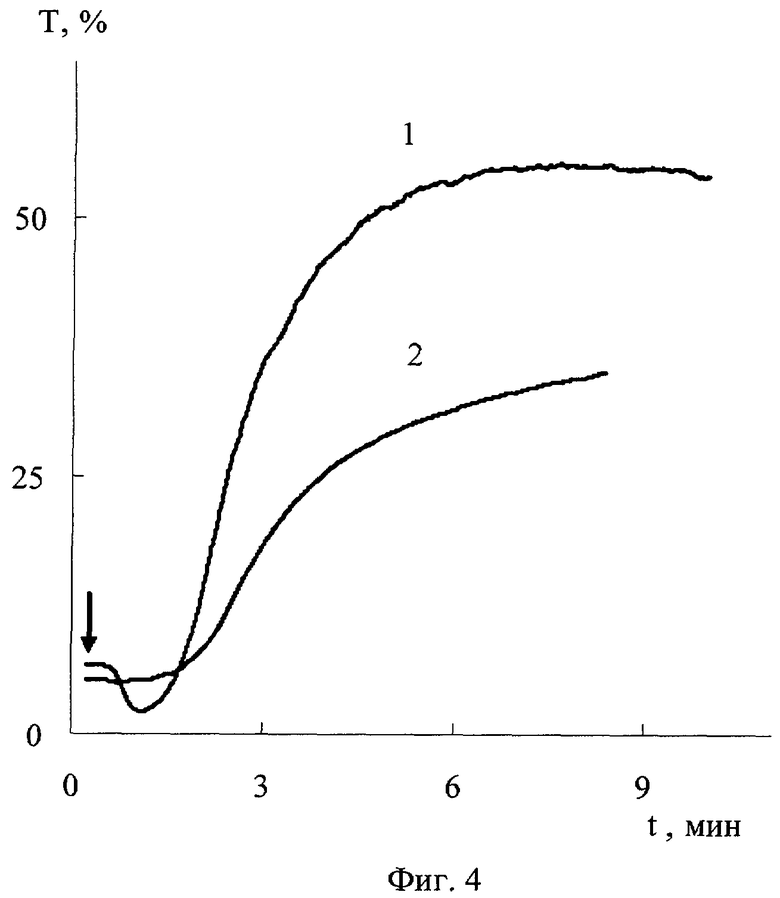
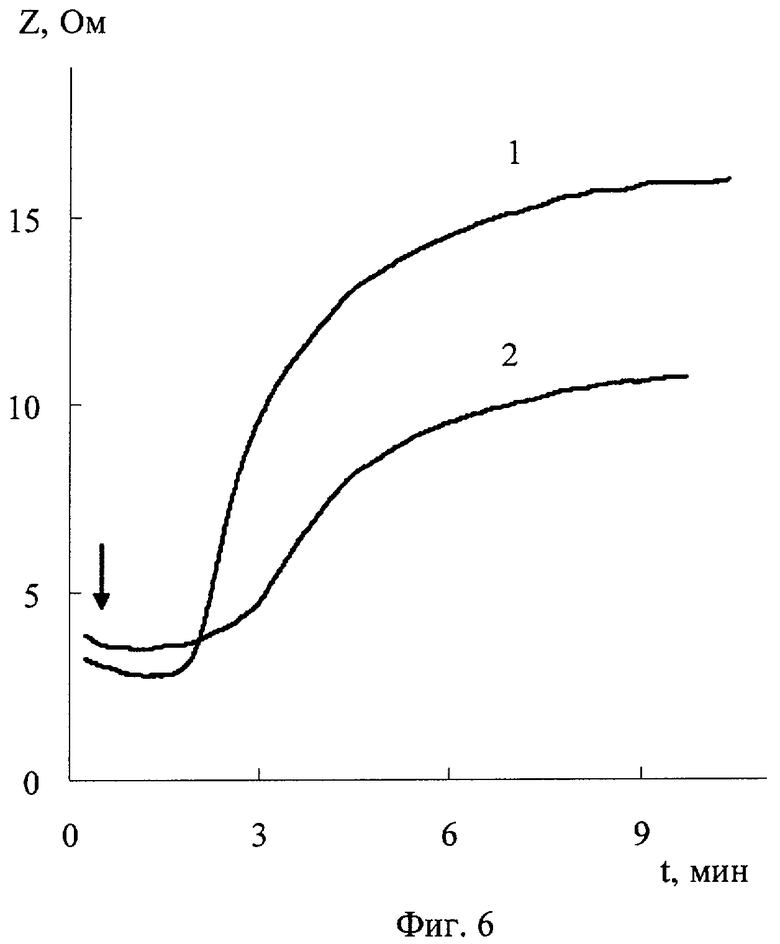
На фиг.1 дана иллюстрация спектра поглощения N-хлор-N-метил-2-аминоэтансульфоновой кислоты, иллюстрация спектра поглощения N-хлор-N-изопропил-2-аминоэтансульфоновой кислоты и иллюстрация спектра поглощения N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты; на фиг.2 - иллюстрация зависимости от времени оптической плотности при 264 нм N-хлор-N-метил-2-аминоэтансульфоновой кислоты в смеси с метионином и иллюстрация зависимости от времени оптической плотности N,N-дихлор-2-аминоэтансульфоновой кислоты в смеси с метионином; на фиг.3 - спектр поглощения свежеприготовленного раствора N-хлор-N-метил-2-аминоэтансульфоновой кислоты и спектр поглощения после хранения раствора N-хлор-N-метил-2-аминоэтансульфоновой кислоты после хранения; на фиг.4 - иллюстрация зависимости от времени коэффициента светопропускания богатой тромбоцитами плазмы крови с добавкой N-хлор-N-метил-2-аминоэтансульфоновой кислоты и без нее; на фиг.5 - зависимость от времени интенсивности пучка света, прошедшего с отклонением в пределах 0,5-10 градусов через образец богатой тромбоцитами плазмы крови человека с добавкой N-хлор-N-метил-2-аминоэтансульфоновой кислоты и без нее; на фиг.6 - зависимость от времени электрического сопротивления крови для переменного тока с добавкой N-хлор-N-метил-2-аминоэтансульфоновой кислоты и без нее.
Создание заявленного соединения, характеризующегося повышенной скоростью взаимодействия с серосодержащими атомными группами и обладающего способностью угнетать агрегационную функцию тромбоцитов, подтверждается следующими примерами.
Пример 1
Путем введения в водный раствор гипохлорита натрия водного раствора исходного соединения N-метил-2-аминоэтансульфоновой кислоты, либо N-изопропил-2-аминоэтансульфоновой кислоты, либо N-изобутил-2-аминоэтансульфоновой кислоты получили соответственно N-xлоp-N-метил-2-аминоэтансульфоновую кислоту, N-хлор-N-изопропил-2-аминоэтансульфоновуюй кислоту и N-хлор-N-изобутил-2-аминоэтансульфоновую кислоту. Смешивание проводили из расчета не более 1 моля активного хлора на 1 моль исходного вещества. Измерили зависимости оптической плотности (D) от длины волны (λ), т.е. спектры поглощения образовавшихся соединений на спектрофотометре DU-720 (Beckman-Coulter, США) (фиг.1, кривая 1 - спектр поглощения N-хлор-N-метил-2-аминоэтансульфоновой кислоты, кривая 2 - спектр поглощения N-хлор-N-изопропил-2-аминоэтансульфоновой кислоты, кривая 3 - спектр поглощения N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты). В каждом спектре имеется полоса поглощения 230-320 нм, характерная для хлориминовой группы атомов. Максимум этой полосы поглощения располагается при 264 нм. Молярные коэффициенты поглощения в максимуме полосы поглощения N-хлор-N-метил-2-аминоэтансульфоновой кислоты, N-хлор-N-изопропил-2-аминоэтансульфоновой кислоты и N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты равны соответственно 340±7,3, 320±3,9 и 310±3,5 л/(моль·см).
Пример 2
Получили N-хлор-N-метил-2-аминоэтансульфоновую кислоту, N-хлор-N-изобутил-2-аминоэтансульфоновую кислоту и N-хлор-N-изопропил-2-аминоэтансульфоновуюй кислоту, как описано в примере 1. Смешали водные растворы N-хлор-N-метил-2-аминоэтансульфоновой кислоты и аминокислоты метионина в конечной концентрации соответственно 2 и 2 мМ. Для этой смеси измерили на спектрофотометре DU-720 зависимость от времени (t) оптической плотности при 264 нм (D264), которая прямо пропорциональна концентрации N-хлор-Н-метил-2-аминоэтансульфоновой кислоты (фиг.2). Провели такие же измерения смеси метионина и других соединений. Во всех случаях происходило быстрое уменьшение оптической плотности вследствие реакции заявленного соединения с тиоэфирной группой метионина. Для точного количественного описания скорости взаимодействия заявленного соединения с метионином определили константы скорости (k) бимолекулярной реакции по данным уменьшения оптической плотности после начала реакции. Расчет проводили по формуле
k=AC/(ΔtC1С2); ΔC=ΔD/εl,
ΔD и ΔC - изменение за период Δt оптической плотности и соответствующее ей изменение концентрации соединения; ε - молярный коэффициент поглощения соединения соединения; l - толщина образца раствора. Изменения указанных величин брали в виде положительных значений. Использовали данные изменения оптической плотности в пределах не более 15%. Точно так же определили константы скорости реакции соединений с сульфгидрильной группой трипептида восстановленного глутатиона. Для сравнения получили N,N-дихлор-2-аминоэтансульфоновую кислоту путем введения раствора 2-аминоэтансульфоновой кислоты в раствор гипохлорита натрия из расчета 2 моля активного хлора на 1 моль этой кислоты. Смешали водные растворы N,N-дихлор-2-аминоэтансульфоновой кислоты и метионина в конечной концентрации соответственно 2 и 2 мМ. Путем измерения зависимости от времени оптической плотности (D302) смеси при 302 нм (фиг.3), где находится максимум спектра поглощения дихлораминовой группы атомов, и определили константу скорости реакции N,N-дихлор-2-аминоэтансульфоновой кислоты с тиоэфирной группой метионина.
N-Хлор-N-метил-2-аминоэтансульфоновая кислота, N-xлоp-N-изобутил-2-аминоэтансульфоновая кислота и N-хлор-N-изопропил-2-аминоэтансульфоновая кислота характеризуются высокой константой скорости реакции с метионином. Заявленное соединение реагирует с метионином с константой скорости в несколько раз более высокой, чем известное вещество N,N-дихлор-2-аминоэтансульфоновая кислота (см. таблицу). Заявленное соединение также быстро реагирует с сульфгидрильной группой восстановленного глютатиона, судя по величине констант скоростей (см. таблицу). Таким образом, заявленное соединение обладает способностью реагировать с серосодержащими группами атомов компонентов крови.
Пример 3
Получили описанным в примере 1 способом N-хлор-N-метил-2-аминоэтансульфоновую кислоту, N-хлор-N-изобутил-2-аминоэтансульфоновую кислоту. Хранили растворы этих соединений в концентрации 2 мМ при 10°С. Измерили по величине оптической плотности в максимуме спектра поглощения при 264 нм содержание вещества в растворах после хранения. Концентрация N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты после хранения 2 месяца составляла 1,86 мМ. Через 3 и 4 месяца хранения концентрация N-хлор-N-метил-2-аминоэтансульфоновой кислоты была равна соответственно не менее 1,94 и 1,88 мМ. Таким образом, заявленное соединение характеризуется длительным сроком хранения.
Пример 4
Получили кровь кролика из краевой вены уха, стабилизированную 3,8% раствором цитрата натрия (9:1 по объему). Центрифугировали кровь при 460 g в течение 15 мин. Супернатант, представляющий собой богатую тромбоцитами плазму (БТП) крови, использовали для анализа агрегации тромбоцитов. Этот анализ проводили с помощью турбидиметрического агрегометра фирмы Chrono-Log (США). Измерили кинетическую кривую агрегации тромбоцитов, т.е. зависимость коэффициента светопропускания (Т) от времени (t) в контроле (фиг.4, кривая 1) и при действии N-xлоp-N-метил-2-аминоэтансульфоновой кислоты (фиг.4, кривая 2) при конечной концентрации 1,5 мМ. Агрегацию вызывали аденозиндифосфорной кислотой (АДФ) в конечной концентрации 4,27 мкг в 1 мл. Стрелка на фиг.4 показывает момент введения АДФ в богатую тромбоцитами плазму. Провели такие же измерения с введением в богатую тромбоцитами плазму крови N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты и N-хлор-N-изопропил-2-аминоэтансульфоновой кислоты; их получили, как описано в примере 1. Все исследованные соединения инкубировали 5 мин с богатой тромбоцитами плазмой до введения АДФ. Количественным показателем агрегации тромбоцитов служило изменение коэффициента светопропускания образца через 5 мин после введения АДФ. Степень агрегации тромбоцитов при действии заявленного соединения характеризовали величиной ΔТ/ΔТ0, где ΔТ и ΔТ0 - изменение коэффициента светопропускания соответственно богатой тромбоцитами плазмы, содержащей заявленное соединение, и контрольного образца. N-Хлор-N-изобутилтаурин, N-хлор-N-метилтаурин, N-хлор-N-изопропилтаурин, введенные в богатуюй тромбоцитами плазму в конечной концентрации 1,5 мМ, значительно снижали агрегационную активность тромбоцитов, степень агрегации составляла соответственно 72±7, 59±7, 55±2% от контроля. Таким образом, заявленное соединение обладает антиагрегантной активностью в тесте с богатой тромбоцитами плазмой крови.
Пример 5
Получили богатую тромбоцитами плазму крови, как описано в примере 4. Измерили коагуляцию плазмы, вызванную последовательным введением богатой тромбоцитами плазмы коллагена в конечной концентрации 15 мкг/мл и затем хлорида кальция в конечной концентрации 8 мМ. Измерение было проведено нефелометрическим способом (Рощупкин Д.И., Мурина М.А. и др. Способ определения агрегации тромбоцитов в плазме крови и времени ее коагуляции. Патент РФ №2006132298.5). Источником света служил гелий-неоновый лазер с длиной волны 632,8 нм. Образец богатой тромбоцитами плазмы помещали в прямоугольную кювету толщиной 4 мм, перемешивали магнитной мешалкой. Регистрировали зависимость от времени интенсивности света (I, усл.ед.), рассеянного в пределах малых углов (фиг.5, кривая 1 в контроле, кривая 2 в присутствии 1,5 мМ N-xлоp-N-изопропилтаурина). Детектором света был фотодиод, аналоговый сигнал преобразовывали в цифровые данные аналого-цифровым преобразователем и записывали их в виде электронной таблицы. Момент коагуляции плазмы фиксировали на зависимости интенсивности рассеянного от времени в виде резкого снижения этой величины (фиг.5, стрелки в конце кривых). Для сравнения коагуляцию исследуемого образца контролировали также визуально, при этом временем ее окончания служил момент остановки вращения мешалки. Время коагуляции - период от момента введения коллагена и ионов кальция (фиг.5, стрелка снизу) до момента коагуляции плазмы. N-Хлор-N-изобутилтаурин, N-хлор-N-метилтаурин, N-xлоp-N-изопропилтаурин, полученные согласно примеру 1 и введенные в богатую тромбоцитами плазму в конечной концентрации 1,5 мМ до добавления коллагена и ионов кальция, резко тормозили коагуляцию плазмы. Время коагуляции в контроле было равно 6,2±0,5, а в присутствии указанных соединений составляло соответственно 7,9±1,6, 14±2,4 и 19,6±0,4 мин. Таким образом, заявленное соединение угнетает активность тромбоцитов в богатую тромбоцитами плазму при ее регистрации по эффекту коагуляции плазмы.
Пример 6
Получили описанным в примере 4 способом кровь кролика. Разбавили ее в 2 раза физиологическим раствором и использовали для анализа агрегации тромбоцитов с помощью импедансного агрегометра фирмы Chrono-Log (США). Измерили кинетическую кривую агрегации тромбоцитов, т.е. зависимость сопротивления переменному току Z крови от времени (t) в контроле (фиг.6, кривая 1) и при действии N-хлор-N-метил-2-аминоэтансульфоновой кислоты (фиг.6, кривая 2) при конечной концентрации 1,5 миллимоль/л. Агрегацию вызывали последовательным введением коллагена в конечной концентрации 14 мкг в 1 мл и затем хлорида кальция в конечной концентрации 2 мМ. Стрелка на фиг.6 показывает момент их введения в кровь. Провели такие же измерения с добавкой в кровь N-хлор-N-изобутил-2-аминоэтансульфоновой кислоты и N-хлор-N-изопропил-2-аминоэтансульфоновой кислоты; их получили, как описано в примере 1. Все исследованные соединения инкубировали 5 мин с кровью до введения коллагена и хлорида кальция. Количественным показателем агрегации тромбоцитов служило максимальное изменение электрического сопротивления образца крови через 6 мин после введения хлорида кальция. Степень агрегации тромбоцитов при действии заявленного соединения характеризовали величиной ΔZ/ΔZ0, где ΔZ и ΔZ0 - изменение импеданса соответственно крови, содержащей заявленное вещество, и контрольного образца. N-Хлор-N-изобутилтаурин, N-хлор-N-метилтаурин, N-Хлор-N-изопропилтаурин, введенные в кровь в конечной концентрации 1,5 мМ, значительно снижали агрегационную активность тромбоцитов, степень агрегации составляла соответственно 60±9, 55±13, 46±10% от контроля. Таким образом, заявленное соединение обладает антиагрегантной активностью в образцах крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ, РЕАГИРУЮЩЕЕ С ТИОЛЬНОЙ ГРУППОЙ АТОМОВ И УГНЕТАЮЩЕЕ ФУНКЦИИ ТРОМБОЦИТОВ | 2010 |
|
RU2452727C1 |
| ВЕЩЕСТВО, НЕОБРАТИМО УГНЕТАЮЩЕЕ ФУНКЦИИ ТРОМБОЦИТОВ | 2017 |
|
RU2675630C1 |
| АНТИАГРЕГАНТНОЕ ВЕЩЕСТВО | 2023 |
|
RU2808529C1 |
| СРЕДСТВО ДЛЯ УГНЕТЕНИЯ АКТИВНОСТИ ТРОМБОЦИТОВ | 1998 |
|
RU2161483C2 |
| 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-2)- И 2-ПИПЕРИДИНО-5-(ТИЕНИЛ-3)-6Н-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2445310C2 |
| Дикалиевая соль N-(4-гидроксибензоил)таурина, обладающая антиагрегантной и антитромботической активностью | 2019 |
|
RU2731106C1 |
| Дикалиевая соль N-(3-гидроксибензоил)таурина, обладающая антиагрегантной и антитромботической активностью в сочетании с церебропротективным действием | 2019 |
|
RU2730835C1 |
| Бромиды 1-замещенных-3-{ [2-(3,5-ди-трет-4-гидроксифенил)-2-оксоэтил]} -2-аминобензимидазолия, обладающие антиагрегантными и антиоксидантными свойствами | 2016 |
|
RU2623439C1 |
| Средство, обладающее антиагрегантной активностью | 2019 |
|
RU2696583C1 |
| Аминоалкилдезоксипроизводное целлюлозы, способ его получения и средство, обладающее антитромбоцитарной активностью | 2018 |
|
RU2694342C1 |


Изобретение относится к соединению общей формулы
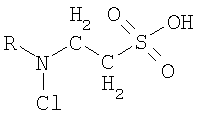 , где R представляет собой насыщенную линейную или разветвленную углеводородную цепь атомов. Изобретение также относится к применению этих соединений в качестве средства для угнетения агрегации тромбоцитов. Технический результат - получение нового соединения, характеризующегося высокой скоростью реакции с серосодержащими группами атомов компонентов тромбоцитов, эффективно угнетающего активность тромбоцитов, обладающего высокой устойчивостью. 2 н.п. ф-лы, 6 ил., 1 табл.
, где R представляет собой насыщенную линейную или разветвленную углеводородную цепь атомов. Изобретение также относится к применению этих соединений в качестве средства для угнетения агрегации тромбоцитов. Технический результат - получение нового соединения, характеризующегося высокой скоростью реакции с серосодержащими группами атомов компонентов тромбоцитов, эффективно угнетающего активность тромбоцитов, обладающего высокой устойчивостью. 2 н.п. ф-лы, 6 ил., 1 табл.
1. Соединение общей формулы
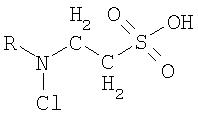 ,
,
где R представляет собой насыщенную линейную или разветвленную углеводородную цепь атомов.
2. Применение соединения по п.1 в качестве средства для угнетения агрегации тромбоцитов.
| СРЕДСТВО ДЛЯ УГНЕТЕНИЯ АКТИВНОСТИ ТРОМБОЦИТОВ | 1998 |
|
RU2161483C2 |
| Средство для снижения агрегации тромбоцитов | 1988 |
|
SU1834659A3 |
Авторы
Даты
2010-02-27—Публикация
2008-09-09—Подача