Настоящее изобретение относится к укороченным аналогам PYY3-36 формулы (I)
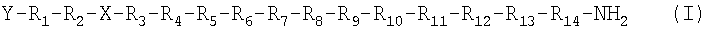 ,
,
в которой Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин, Y обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный (низш.)алкил, замещенный или незамещенный арил, замещенную или незамещенную алкоксигруппу или поли(этилен)гликольную группу, R1 обозначает Ile, Ala, (D)Ile, N-метилIle, Aib, 1-1 Aic, 2-2 Aic, Ach или Аср, R2 обозначает Lys, Ala, (D)Lys, NMelys, Nie или (Lys-Gly), R3 обозначает Arg, Ala, (D)Arg, N-метилArg, Phe, 3,4,5-трифторРhе или 2,3,4,5,6-пентафторРhе, R4 обозначает His, Ala, (D)His, N-метилHis, 4-МеОАрс, 3-Pal или 4-Pal, R5 обозначает Tyr, Ala, (D)Tyr, N-метилTyr, Trp, Tic, Bip, Dip, (1)Nal, (2)Nal, 3,4,5-трифторPhe или 2,3,4,5,6-петафторPhe, R6 обозначает Leu, Ala, (D)Leu или N-метилLeu, R7 обозначает Asn, Ala или (D)Asn, R8 обозначает Leu, Ala, (D)Leu или N-метилLeu, R9 обозначает Val, Ala, (D)Val или N-метилVal, R10 обозначает Thr, Ala или N-метилТhr, R11 обозначает Arg, (D)Arg или N-метилArg, R12 обозначает Gln или Ala, R13 обозначает Arg, (D)Arg или N-метилArg и R14 обозначает Tyr, (D)Tyr или N-метилTyr, или их фармацевтически приемлемым солям.
Аналоги являются агонистами рецептора нейропептида-2 и их можно применять для лечения метаболических нарушений, таких, например, как ожирение. Все процитированные в настоящем описании документы специально включены в него в качестве ссылки.
Общепризнанно, что ожирение представляет собой серьезную проблему для здоровья в развитых странах, и оно достигло эпидемического статуса в Соединенных Штатах Америки. Согласно современным исследованиям более 50% населения США имеет избыточный вес, при этом более чем у 25% диагностировано клиническое ожирение и наличие значительного риска развития сердечного заболевания, инсулин-независимого сахарного диабета (ИНСД), гипертензии и определенных типов рака. Этот эпидемический статус в настоящее время является серьезной проблемой для системы медико-санитарной помощи, поскольку по прогнозам ежегодная стоимость лечения ожирения только в США может составлять более 70 миллиардов долларов. Стратегии лечения ожирения включают снижение потребления пищи и повышение расхода энергии индивидуумом.
Нейропептид Y (NPY), который представляет собой состоящий из 36 аминокислот пептидный нейромедиатор, является представителем панкреатических пептидов из класса нейромедиаторов/нейрогормонов, который к настоящему времени обнаружен как в периферической, так и в центральной нервной системе. NPY является одним из наиболее эффективных среди известных возбуждающих аппетит агентов, и установлено, что он играет основную роль в регуляции потребления пищи у животных, включая человека.
Было клонировано 5 рецепторов нейропептида Y (NPY), подразделяемых на подтипы Y1, Y2, Y3, Y4 и Y5 и Y6, которые принадлежат к родопсинподобным, сшитым с G-протеином, 7-трансмембранным спиралевидным рецепторам (GPCR). Рецептор NPY Y2 (Y2R) представляет собой состоящий из 381 аминокислоты белок, который ингибирует активацию аденилциклазы посредством Gi, причем он обладает низким уровнем гомологии с другими известными NPY-рецепторами. Обнаружен высокий уровень консервативности между крысиным и человеческим Y2-рецептором, характеризующийся 98%-ной идентичностью аминокислотных последовательностей.
Рецептор Y2R широко распространен в центральной нервной системе грызунов и людей. В гипоталамусе мРНК Y2 локализована в дугообразном ядре, предоптическом ядре и дорсомедиальном ядре. В головном мозге человека Y2R является доминирующим подтипом Y-рецептора. В дугообразном ядре в более чем 80% NPY-нейронов происходит совместная экспрессия мРНК Y2R. Было установлено, что применение избирательного агониста Y2 снижает высвобождение NPY из срезов гипоталамуса in vitro, в то время как не относящийся к пептидам антагонист Y2 BIIE0246 повышает высвобождение NPY. Эти данные подтверждают роль Y2R в качестве пресинаптического ауторецептора, который регулирует высвобождение NPY и поэтому может участвовать в регуляции питания (Poter Е.K. и др., Eur. J. Pharmac. 267, 1994, cc.253-262).
Пептид YY3-36 (PYY3-36) представляет собой состоящий из 33 аминокислот линейный пептид, который обладает специфической агонистической активностью в отношении рецептора нейропептида Y2 (NPY2R). Было продемонстрировано, что внутричерепная инъекция в дугу (IC) или внутрибрюшинная инъекция (IP) PYY3-36 снижала потребление корма крысами и при длительном воздействии снижала прибавление веса тела. Внутривенная инфузия (IV) PYY3-36 (0,8 пмоля/кг/мин) в течение 90 мин снижала на 33% потребление пищи у страдающих ожирением и здоровых людей в течение 24 ч. Эти данные позволяют предположить, что система PYY может являться мишенью для терапевтического воздействия при лечении ожирения (Bloom S. и др., Nature, т.418, 8 августа 2002 г., cc.650-654). Кроме того, установлено, что циклизованная версия PYY Cys2-(D)Cys27, в которой остатки 5-24 заменены на метиленовую цепь длиной 5-8 атомов углерода, активирует расположенный в кишечнике PYY-рецептор, о чем свидетельствует пониженный ток через слизистую мембрану тощей кишки крыс в препаратах с фиксацией напряжения (Krstenansky и др., в Peptides, Proceedings of the Twelfth American Peptide Symposium, под ред. J.Smith и J.Rivier, ESCOM. Leiden, cc.136-137).
Кроме того, продемонстрирована ковалентная модификация белков с помощью поли(этиленгликоля) или поли(этиленоксида) (оба обозначены как ПЭГ), таких как супероксиддисмутаза (Somack R. и др., Free Rad Res Commun 12-13, 1991, cc.553-562; US 5283317 и 5468478), и других типов белков, например, цитокинов (Saifer M.G.P. и др., Polym Preprints 38, 1997, cc.576-577; Sherman M.R. и др. в Poly(ethyleneglycol) Chemistry and Biological Applications, ACS Symposium Series 680, под ред. J.M.Harris и др., изд-во American Chemical Society, Washington, D.C., 1997, cc.155-169).
Однако существует потребность в создании новых аналогов PYY, которые имеют существенно более низкую молекулярную массу, но сохраняют при этом такую же или более высокую эффективность, фармакокинетические характеристики и фармакологические характеристики, что и существующие агонисты Y2R. Существует также необходимость в пэгилированных аналогах PYY, например, для повышения времени полужизни пептида и снижения иммуногенности для индивидуумов, которые нуждаются в применении таких агонистов.
Соединения, предлагаемые в изобретении, обладают также преимуществами, поскольку они представляют собой укороченные версии PYY3-36. Так, использование более коротких пептидов не только облегчает синтез и очистку соединений, но также улучшает и снижает количество процессов и стоимость производства. Кроме того, соединения, предлагаемые в изобретении, взаимодействуют преимущественно с PYY-рецепторами и не взаимодействуют с гомологичными рецепторами, такими как рецепторы Y1, Y4 и Y5 NPY. Тем самым минимизируются нежелательные агонистические или антагонистические побочные реакции.
На чертежах показано:
на фиг.1 - ЖХВР-хроматограмма соединения, предлагаемого в настоящем изобретении;
на фиг.2 - ЖХВР-хроматограмма соединения, предлагаемого в настоящем изобретении;
на фиг.3 - результаты MALDI-TOF-анализа соединения, предлагаемого в настоящем изобретении;
на фиг.4 - ЖХВР-хроматограмма другого соединения, предлагаемого в настоящем изобретении;
на фиг.5 - ЖХВР хроматограмма соединения, предлагаемого в настоящем изобретении;
на фиг.6 - результаты MALDI-TOF-анализа соединения, предлагаемого в настоящем изобретении;
на фиг.7 - диаграмма, характеризующая воздействия соединения, предлагаемого в настоящем изобретении, на потребление пищи после его введения;
на фиг.8 - диаграмма, характеризующая воздействия другого соединения, предлагаемого в настоящем изобретении, на потребление пищи после его введения;
на фиг.9 - диаграмма, характеризующая воздействия еще одного соединения, предлагаемого в настоящем изобретении, на потребление пищи после его введения;
на фиг.10 - диаграмма, характеризующая воздействия на потребление пищи еще одного соединения, предлагаемого в настоящем изобретении, после его введения.
Все упомянутые в настоящем описании пептидные последовательности обозначены согласно принятой конвенции, т.е. N-концевая аминокислота расположена слева, а С-концевая аминокислота расположена справа, если не указано иное. Короткая черта между двумя аминокислотными остатками обозначает пептидную связь. Если аминокислота имеет изомерные формы, то представлена L-форма аминокислоты, если специально не указано иное. Для удобства в описании настоящего изобретения используют принятые и нетрадиционные сокращения для различных применяемых аминокислот. Эти сокращения известны специалистам в данной области, но для простоты изложения перечислены ниже:
Asp=D=аспарагиновая кислота; Ala=А=аланин; Arg=R=аргинин; Asn=N=аспарагин; Gly=G=глицин; Glu=Е=глутаминовая кислота; Gln=Q=глутамин; His=Н=гистидин; Ile=I=изолейцин; Leu=L=лейцин; Lys=К=лизин; Met=М=метионин; Phe=F=фенилаланин; Pro=Р=пролин; Ser=S=серин; Thr=Т=треонин; Trp=W=триптофан; Tyr=Y=тирозин и Val=V=валин.
Также для удобства в описании настоящего изобретения использованы следующие сокращения или символы для обозначения групп, реагентов, и т.п., которые хорошо известны специалистам в данной области:
В контексте настоящего описания понятие «алкил» означает разветвленный или неразветвленный циклический или ациклический насыщенный или ненасыщенный (например, алкенил или алкинил) углеводородный радикал, который может быть замещенным или незамещенным. Если алкильная группа является циклической, то она предпочтительно представляет собой С3-С12-, более предпочтительно С5-С10-, более предпочтительно С5-С7-группу. Если алкильная группа является ациклической, то она предпочтительно представляет собой С1-С10-, более предпочтительно C1-С6-группу, более предпочтительно метил, этил, пропил (н-пропил или изопропил), бутил (н-бутил, изобутил или трет-бутил) или пентил (включая н-пентил и изопентил), более предпочтительно метил. Таким образом, должно быть очевидно, что понятие «алкил» в контексте настоящего описания включает алкил (разветвленный или неразветвленный), замещенный алкил (разветвленный или неразветвленный), алкенил (разветвленный или неразветвленный), замещенный алкенил (разветвленный или неразветвленный), алкинил (разветвленный или неразветвленный), замещенный алкинил (разветвленный или неразветвленный), циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, циклоалкинил и замещенный циклоалкинил.
В контексте настоящего описания понятие «(низш.)алкил» означает разветвленный или неразветвленный циклический или ациклический насыщенный или ненасыщенный (например, алкенил или алкинил) углеводородный радикал, в котором циклическая (низш.)алкильная группа обозначает C5-, С6- или С7-группу, а ациклическая (низш.)алкильная группа обозначает C1-, С2-, С3- или С4-группу и предпочтительно обозначает метил, этил, пропил (н-пропил или изопропил) или бутил (н-бутил, изобутил или трет-бутил). Таким образом, должно быть очевидно, что понятие «(низш.)алкил» в контексте настоящего описания включает (низш.)алкил (разветвленный или неразветвленный), (низш.)алкенил (разветвленный или неразветвленный), (низш.)алкинил (разветвленный или неразветвленный), цикло(низш.)алкил, цикло(низш.)алкенил и цикло(низш.)алкинил.
В контексте настоящего описания понятие «арил» означает замещенную или незамещенную карбоциклическую ароматическую группу, такую как фенил или нафтил, или замещенную или незамещенную гетероароматическую группу, содержащую один или несколько, предпочтительно один гетероатом, такую как пиридил, пирролил, фуранил, тиенил, тиазолил, изотиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, пиразолил, имидазолил, триазолил, пиримидинил, пиридазинил, пиразинил, триазинил, индолил, индазолил, хинолил, хиназолил, бензимидазолил, бензотиазолил, бензизоксазолил и бензизотиазолил.
Алкильные и арильные группы могут быть замещенными или незамещенными. Когда они являются замещенными, в них присутствуют 1-3 заместителя, предпочтительно 1 заместитель. Заместители могут представлять собой углеродсодержащие группы, такие как алкил, арил, арилалкил (например, замещенный и незамещенный фенил, замещенный и незамещенный бензил); атомы галогена и галогенсодержащие группы, такие как галоалкил (например, трифторметил); кислородсодержащие группы, такие как спирты (например, гидроксил, гидроксиалкил, арил(гидроксил)алкил), простые эфиры (например, алкоксигруппа, арилоксигруппа, алкоксиалкил, арилоксиалкил), альдегиды (например, карбоксальдегид), кетоны (например, алкилкарбонил, алкилкарбонилалкил, арилкарбонил, арилалкилкарбонил, арилкарбонилалкил), кислоты (например, карбоксигруппа, карбоксиалкил), производные кислот, такие как эфиры (например, алкоксикарбонил, алкоксикарбонилалкил, алкилкарбонилоксигруппа, алкилкарбонилоксиалкил), амиды (например, аминокарбонил, моно- или диалкиламинокарбонил, аминокарбонилалкил, моно- или диалкиламинокарбонилалкил, ариламинокарбонил), карбаматы (например, алкоксикарбониламиногруппа, арилоксикарбониламиногруппа, аминокарбонилоксигруппа, моно- или диалкиламинокарбонилоксигруппа, ариламинокарбонилоксигруппа) и мочевины (например, моно- или диалкиламинокарбониламиногруппа или ариламинокарбониламиногруппа); азотсодержащие группы, такие как амины (например, аминогруппа, моно- или диалкиламиногруппа, аминоалкил, моно- или диалкиламиноалкил), азиды, нитрилы (например, цианогруппа, цианалкил), нитрогруппы; серосодержащие группы, такие как тиолы, простые тиоэфиры, сульфоксиды и сульфоны (например, алкилтиогруппа, алкилсульфинил, алкилсульфонил, алкилтиоалкил, алкилсульфинилалкил, алкилсульфонилалкил, арилтиогруппа, арилсульфинил, арилсульфонил, арилтиоалкил, арилсульфинилалкил, арилсульфонилалкил), и гетероциклические группы, содержащие один или несколько, предпочтительно один, гетероатом (например, тиенил, фуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, оксадиазолил, тиадиазолил, азиридинил, азетидинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, тетрагидрофуранил, пиранил, пиронил, пиридил, пиразинил, пиридазинил, пиперидил, гексагидроазепинил, пиперазинил, морфолинил, тианафтил, бензофуранил, изобензофуранил, индолил, оксииндолил, изоиндолил, индазолил, индолинил, 7-азаиндолил, бензопиранил, кумаринил, изокумаринил, хинолинил, изохинолинил, нафтридинил, циннолинил, хиназолинил, пиридопиридил, безоксазинил, хиноксалинил, хроменил, хроманил, изохроманил, фталазинил и карболинил).
(Низш.)алкильные группы могут быть замещенными или незамещенными, предпочтительно являются незамещенными. Когда они являются замещенными, то, как правило, содержат 1-3 заместителя, предпочтительно 1 заместитель. Заместителями являются перечисленные выше группы заместителей, отличные от алкила, арила и арилалкила.
В контексте настоящего описания понятие «алкоксигруппа» означает алкил-О-группу, а «алкоил» означает алкил-CO-группу. Заместители, представляющие собой алкоксигруппу, или заместители, содержащие алкоксигруппу, могут быть замещены одной или несколькими алкильными группами.
В контексте настоящего описания понятие «галоген» означает радикал фтора, хлора, брома или йода, предпочтительно радикал фтора, хлора или брома и более предпочтительно радикал фтора или хлора.
В контексте настоящего описания понятие «фармацевтически приемлемая соль» означает любую фармацевтически приемлемую соль соединения формулы (I). Соли можно получать из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические и органические кислоты и основания. Такие кислоты представляют собой уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этенсульфоновую, дихлоруксусную, муравьиную, фумаровую, глюконовую, глутаминовую, гиппуровую, бромистоводородную, соляную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, щавелевую, памовую, пантотеновую, фосфорную, янтарную, серную, винную, щавелевую, пара-толуолсульфоновую кислоту и т.п. Особенно предпочтительными являются фумаровая, соляная, бромистоводородная, фосфорная, янтарная, серная и метансульфоновая кислоты. Приемлемые соли присоединения оснований представляют собой соли щелочных металлов (например, натрия, калия), щелочно-земельных металлов (например, кальция, магния) и алюминия.
Одним из вариантов осуществления настоящего изобретения является агонист рецептора нейропептида-2 формулы (I):
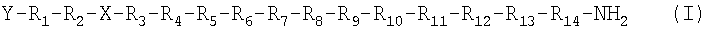 ,
,
в которой Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин, Y обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный (низш.)алкил, замещенный или незамещенный арил, замещенную или незамещенную алкоксигруппу или поли(этилен)гликольную группу, R1 обозначает Ile, Ala, (D)Ile, N-метил Ile, Aib, 1-1 Aic, 2-2 Aic, Ach или Аср, R2 обозначает Lys, Ala, (D)Lys, NMelys, Nle или (Lys-Gly), R3 обозначает Arg, Ala, (D)Arg, N-метилArg, Phe, 3,4,5-трифторPhe или 2,3,4,5,6-пентафторРhe, R4 обозначает His, Ala, (D)His, N-метилHis, 4-MeOApc, 3-Pal или 4-Pal, R5 обозначает Tyr, Ala, (D)Tyr, N-метилTyr, Trp, Tic, Bip, Dip, (1)Nal, (2)Nal, 3,4,5-трифторPhe или 2,3,4,5,6-пентафторPhe, R6 обозначает Leu, Ala, (D)Leu или N-метилLeu, R7 обозначает Asn, Ala или (D)Asn, R8 обозначает Leu, Ala, (D)Leu или N-метилLeu, R9 обозначает Val, Ala, (D)Val или N-метилVal, R10 обозначает Thr, Ala или N-метилТhr, R11 обозначает Arg, (D)Arg или N-метилArg, R12 обозначает Gln или Ala, R13 обозначает Arg, (D)Arg или N-метилArg и R14 обозначает Tyr, (D)Tyr или N-метилTyr, или его фармацевтически приемлемая соль.
Следующим вариантом осуществления настоящего изобретения является агонист рецептора нейропептида-2 формулы (II):
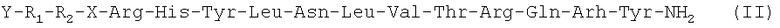
(SEQ ID NO: 1),
в которой X обозначает фрагмент, выбранный из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин, Y обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный (низш.)алкил, замещенный или незамещенный арил, замещенную или незамещенную алкоксигруппу или поли(этилен)гликольную группу, R1 обозначает Ile, Ala, (D)Ile, N-метилIle, Aib, 1-1 Aic, 2-2 Aic, Ach или Аср и R2 обозначает Lys, Ala, (D)Lys, NMelys, Nle или (Lys-Gly), или его фармацевтически приемлемая соль.
Следующим вариантом осуществления настоящего изобретения является агонист рецептора нейропептида-2 формулы (III):
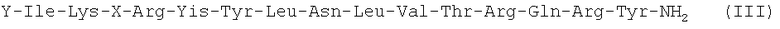 ,
,
(SEQ ID NO: 2),
в которой X выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин, и Y обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный (низш.)алкил, замещенный или незамещенный арил, замещенную или незамещенную алкоксигруппу или поли(этилен)гликольную группу, или его фармацевтически приемлемая соль.
Предпочтительными агонистами рецептора нейропептида-2 являются указанные выше антагонисты, в которых Х обозначает Pqa. Другими предпочтительными агонистами рецептора нейропептида-2 являются указанные выше агонисты, в которых Х обозначает Cms. Предпочтительно Y обозначает Н или C1-С6алкил, более предпочтительно Y обозначает C1-С6алкильную группу.
Предпочтительными агонистами рецептора нейропептида-2, как они определены выше, являются агонисты, выбранные из группы, включающей
IK-Pqa-RHYLNLVTRQRY,
Ac-IK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRARY,
IK-Pqa-RHYLNLVARQRY,
IK-Pqa-RHYLNLATRQRY,
IK-Pqa-RHYLNAVTRQRY,
IK-Pqa-RHYLALVTRQRY,
IK-Pqa-RHYANLVTRQRY,
IK-Pqa-RHALNLVTRQRY,
IK-Pqa-RAYLNLVTRQRY,
IK-Pqa-AHYLNLVTRQRY,
IA-Pqa-RHYLNLVTRQRY,
Ac-IA-Pqa-RHYLNLVTRQRY,
AK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(D)Y,
IK-Pqa-RHYLNLVTRQ(D)RY,
IK-Pqa-RHYLNLVT(D)RQRY,
IK-Pqa-RHYLNL(D)VTRQRY,
IK-Pqa-RHYLN(D)LVTRQRY,
IK-Pqa-RHYL(D)NLVTRQRY,
IK-Pqa-RHY(D)LNLVTRQRY,
IK-Pqa-RH(D)YLNLVTRQRY,
IK-Pqa-R(D)HYLNLVTRQRY,
IK-Pqa-(D)RHYLNLVTRQRY,
I(D)K-Pqa-RHYLNLVTRQRY,
(D)IK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(N-метил)Y,
IK-Pqa-RHYLNLVTRQ(N-метил)RY,
IK-Pqa-RHYLNLVT(N-метил)RQRY,
IK-Pqa-RHYLNLV(N-метил)TRQRY,
IK-Pqa-RHYLNL(N-метил)VTRQRY,
IK-Pqa-RHYLN(N-метил)LVTRQRY,
IK-Pqa-RHY(N-метил)LNLVTRQRY,
IK-Pqa-RH(N-метил)YLNLVTRQRY,
IK-Pqa-R(N-метил)HYLNLVTRQRY,
IK-Pqa-(N-метил)RHYLNLVTRQRY,
I(N-метил)K-Pqa-RHYLNLVTRQRY,
(N-метил)IK-Pqa-RHYLNLVTRQRY,
INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-FHYLNLVTRQRY,
IK-Pqa-RHWLNLVTRQRY,
IK-Pqa-AHWLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQR(D)Y,
Ac-INle-Pqa-RHYLNLVTRQR(N-метил)Y,
Ac-INle-Pqa-RHYLys(28)NLVAsp(32)RQRY(циклоLys-Asp),
IK-Cms-RHYLNLVTRQRY,
IKG-Cms-RHYLNLVTRQRY,
Ac-INle-Cms-RHYLys(28)NLVAsp(32)RQRY(циклоLys-Asp),
Ac-INle-Pqa-RHTicLNLVTRQRY,
Ac-INle-Pqa-RHBipLNLVTRQRY,
Ac-INle-Pqa-RHDipLNLVTRQRY,
Ac-INle-Pqa-RH(1)NalLNLVTRQRY,
Ac-INle-Pqa-RH(2)NalLNLVTRQRY,
Ac-INle-Pqa-RH(3,4,5-трифторPhe)LNLVTRQRY,
Ас-IМlе-Рqа-RН(2,3,4,5,6-пентафторPhe)LNLVТRQRY,
Ac-INle-Pqa-R(4-MeOApc)YLNLVTRQRY,
Ac-INle-Pqa-R(3-Pal)YLNLVTRQRY,
Ac-INle-Pqa-R(4-Pal)YLNLVTRQRY,
Ас-INlе-Рqа-(3,4,5-трифторPhe)HYLNLVTRQRY,
Ас-INlе-Рqа-(2,3,4,5,6-пентафторPhе)HYLNLVTRQRY,
Ac-Aib-Nle-Pqa-RHYLNLVTRQRT,
Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac-2-2Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac-Ach-Nle-Pqa-RHYLNLVTRQRT,
Ac-Acp-Nle-Pqa-RHYLNLVTRQRT,
H-INle-Pqa-RHYLNLVTRQRY,
(ПЭГ-10000)-INle-Pqa-RHYLNLVTRQRY и
(ПЭГ-30000)-INle-Pqa-RHYLNLVTRQRY.
Более предпочтительными агонистами рецептора нейропептида-2, как они определены выше, являются агонисты, выбранные из группы, включающей
IK-Pqa-RHYLNLVTRQRY,
Ac-IK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(N-метил)Y,
IK-Pqa-RHYLNLVTRQ(N-метил)RY,
INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQRY и
(ПЭГ-30000)-INle-Pqa-RHYLNLVTRQRY.
Каждый из всех перечисленных выше агонистов рецептора нейропептида-2 представляет собой индивидуальный предпочтительный вариант осуществления настоящего изобретения.
Следующим вариантом осуществления настоящего изобретения является способ лечения ожирения у пациента, который нуждается в этом, заключающийся в том, что осуществляют стадию введения пациенту в терапевтически эффективном количестве агониста рецептора нейропептида-2 формулы (I):
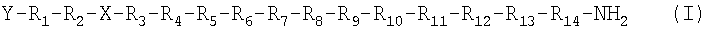 ,
,
в которой Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин, Y обозначает Н, замещенный или незамещенный алкил, замещенный или незамещенный (низш.)алкил, замещенный или незамещенный арил, замещенную или незамещенную алкоксигруппу или поли(этилен)гликольную группу, R1 обозначает Ile, Ala, (D)Ile, N-метилIle, Aib, 1-lAic, 2-2 Aic, Ach или Аср, R2 обозначает Lys, Ala, (D)Lys, NMelys, Nle или (Lys-Gly), R3 обозначает Arg, Ala, (D)Arg, N-метилArg, Phe, 3,4,5-трифторPhe или 2,3,4,5,6-пентафторPhe, R4 обозначает His, Ala, (D)His, N-метилHis, 4-MeOApc, 3-Pal или 4-Pal, R5 обозначает Tyr, Ala, (D)Tyr, N-метилTyr, Trp, Tic, Bip, Dip, (l)Nal, (2)Nal, 3,4,5-трифторPhe или 2,3,4,5,6-пентафторPhe, R6 обозначает Leu, Ala, (D)Leu или N-метилLeu, R7 обозначает Asn, Ala или (D)Asn, R8 обозначает Leu, Ala, (D)Leu или N-метилLeu, R9 обозначает Val, Ala, (D)Val или N-метилVal, R10 обозначает Thr, Ala или N-метилТhr, R11 обозначает Arg, (D)Arg или N-метилArg, R12 обозначает Gln или Ala, R13 обозначает Arg, (D)Arg или N-метилArg и R14 обозначает Тyr, (D)Tyr или N-метилTyr, или его фармацевтически приемлемую соль.
Предпочтительным является вариант описанного выше способа, в котором агонист рецептора нейропептида-2 вводят пациенту один раз в три дня. Предпочтительно агонист рецептора нейропептида-2 вводят пациенту один раз в неделю.
Предпочтительным является описанный выше вариант способа, в котором агонист рецептора нейропептида-2 вводят пациенту орально, интраназально, внутривенно, подкожно, парентерально, трансдермально, внутрибрюшинно или ректально. Предпочтительно агонист рецептора нейропептида-2 вводят интраназально. Предпочтительно также агонист рецептора нейропептида-2 вводят подкожно.
Предпочтительным является вариант описанного выше способа, в котором агонист рецептора нейропептида-2 вводят в дозе, составляющей от примерно 2,5 до примерно 10 мг/кг, более предпочтительно от примерно 2,5 до примерно 5 мг/кг. Предпочтительным является также вариант способа, в котором агонист рецептора нейропептида-2 вводят в дозе от примерно 5 до примерно 10 мг/кг.
В описанных выше вариантах способа предпочтительными являются агонисты рецептора нейропептида-2, в которых Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa), N-(5-O-карбоксиметил)серотонин (Cms), 4-(2-аминометил)-6-дибензофуранпропановую кислоту, 4-(1-пиперидин-4-ил)бутановую кислоту и 4-(2-аминоэтил)-1-карбоксиметилпиперазин.
Следующим вариантом осуществления настоящего изобретения является агонист рецептора нейропептида-2, который содержит производное RYY3-36, в котором аминокислотные остатки 5-24 заменены группой, имеющей в длину от примерно 8 до примерно 11 ангстрем.
Ниже изобретение проиллюстрировано с помощью приведенного подробного описания и прилагаемых чертежей, в которых проиллюстрированы дополнительные варианты осуществления изобретения, признаки и преимущества изобретения.
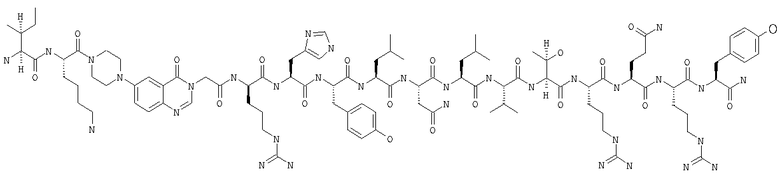
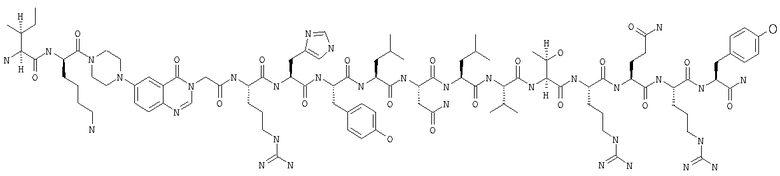
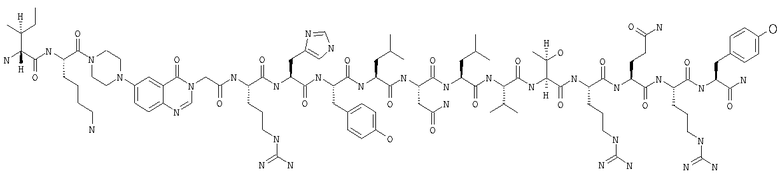
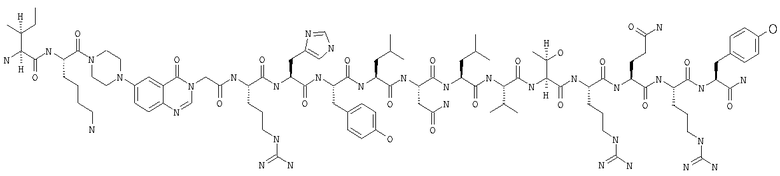
Настоящее изобретение относится к аналогам RYY3-36, в которых аминокислотные остатки 5-24 заменены группой, такой, например, как Pqa или Cms. Например, в изобретении предложены соединения формулы PYY3-4-Pqa-PYY25-36:
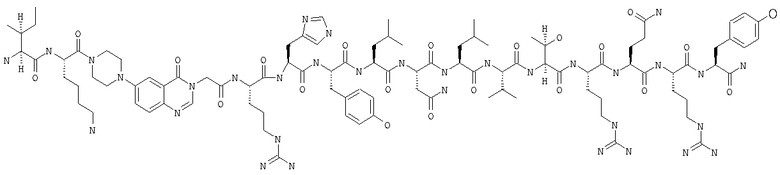
и формулы PYY3-4-Cms-PYY25-36:
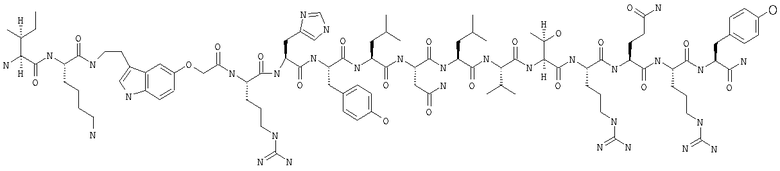
В изобретении предложены также соединения формулы:
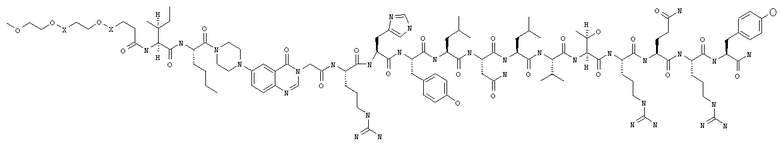
В приведенных выше структурных формулах группа -Х-СН2-СН2-О-Х- согласно общепринятой номенклатуре обозначает повторяющиеся гликольные звенья полиэтиленгликольного фрагмента, т.е. группы -(СН2-СН2-O)n-. Число «n» выбирают в зависимости от массы требуемого полиэтиленгликольного звена, составляющей предпочтительно примерно 10000 Да (n обозначает примерно 227) или примерно 30000 Да (n обозначает примерно 682). На основе полученных с помощью ЯМР данных о структуре нативного RYY3-36 получены предлагаемые в изобретении аналоги, в которых присутствует фрагмент, замещающий аминокислотные остатки 5-24 PYY3-36. Примеры таких фрагментов включают N-пиперазин-1-ил-4-(3Н)-хиназолинон-3-уксусную кислоту (Pqa) и N-(5-O-карбоксиметил)серотонин (Cms). Фрагмент, как правило, является жестким и предпочтительно может стабилизировать третичную структуру молекулы, что позволяет получать укороченные аналоги с требуемой эффективностью и фармакокинтическими и фармакологическими характеристиками. Фрагмент, как правило, имеет длину от примерно 8 до примерно 11 ангстрем, предпочтительно длину от примерно 9 до примерно 11 ангстрем, более предпочтительно длину от примерно 9 до примерно 10 ангстрем, еще более предпочтительно длину от примерно 8 до примерно 10 ангстрем и еще более предпочтительно длину от примерно 8 до примерно 9 ангстрем.
Должно быть очевидно, что изобретение не ограничено представленными в настоящем описании конкретными вариантами его осуществления, поскольку могут быть получены модификации конкретных вариантов осуществления изобретения, которые подпадают также под объем прилагаемой формулы изобретения. Должно быть очевидно также, что терминологию, применяемую для описания конкретных вариантов осуществления изобретения, не следует рассматривать как ограничивающую. Таким образом, объем настоящего изобретения определяется прилагаемой формулой изобретения.
Хотя для воплощения на практике или для оценки изобретения можно использовать любые методы, устройства и материалы, аналогичные или эквивалентные представленным в настоящем описании, ниже приведены предпочтительные методы, устройства и материалы.
Репрезентативные соединения, предлагаемые в настоящем изобретении, легко синтезировать с помощью любого общепринятого метода, пригодного для формирования пептидной связи между аминокислотами. Такие общепринятые методы включают, например, любую осуществляемую в жидкой фазе процедуру, обеспечивающую конденсацию между свободной альфа-аминогруппой аминокислоты или ее остатка, в которых защищены карбоксильная группа и другие реакционноспособные группы, со свободной первичной карбоксильной группой другой аминокислоты или ее остатка, в которых защищены аминогруппа или другие реакционноспособные группы.
Такие общепринятые методы, применяемые для синтеза новых соединений, предлагаемых в настоящем изобретении, включают, например, любой метод твердофазного пептидного синтеза. При осуществлении такого метода синтеза новых соединений можно последовательно включать требуемые аминокислотные остатки в процессе удлинения пептидной цепи согласно общим принципам методов твердофазного синтеза. Такие методы описаны, например, у Merrifield R.B., J. Amer. Chem. Soc. 85, 1963, cc.2149-2154; Barany и др., The Peptides, Analysis, Synthesis and Biology, т.2, под ред. Gross Е. и Meienhofer J., изд-во Academic Press, 1980, cc.1-284, которые включены в настоящее описание в качестве ссылки.
При химическом синтезе пептидов общая стратегия заключается в защите реакционноспособных боковых групп различных аминокислотных остатков приемлемыми защитными группами, которые должны препятствовать осуществлению в этом сайте химической реакции до тех пор, пока защитная группа не удалена. Общей стратегией является также защита альфа-аминогруппы на аминокислоте или ее фрагменте до тех пор, пока происходит взаимодействие с карбоксильной группой, с последующим избирательным удалением защитной группы альфа-аминогруппы, что позволяет в дальнейшем происходить реакции в этом сайте. Хотя в настоящем описании представлены защитные группы, которые применяют в методе твердофазного синтеза, следует отметить, что каждую аминокислоту можно защищать с помощью защитной группы, которую обычно используют для защиты соответствующей аминокислоты при синтезе в жидкой фазе.
Альфа-аминогруппы можно защищать с помощью приемлемых защитных групп, выбранных из ароматических защитных групп уретанового типа, таких как аллилоксикарбонил, бензилоксикарбонил (Z) и замещенный бензилоксикарбонил, такой как пара-хлорбензилоксикарбонил, пара-нитробензилоксикарбонил, пара-бромбензилоксикарбонил, пара-бифенилизопропилоксикарбонил, 9-флуоренилметилоксикарбонил (Fmoc) и пара-метоксибензилоксикарбонил (Moz); алифатических защитных групп уретанового типа, таких как трет-бутилоксикарбонил (Вос), диизопропилметилоксикарбонил, изопропилоксикарбонил и аллилоксикарбонил. В контексте настоящего описания наиболее предпочтительной группой для альфа-аминокислот является Fmoc.
Гуанидиногруппы можно защищать приемлемой защитной группой, выбранной из нитрогруппы, пара-толуолсульфонила (Tos), (Z), пентаметилхромансульфонила (Pmc), 4-метокси-2,3,6-триметилбензолсульфонила (Mtr), наиболее предпочтительными для аргинина (Arg) являются (Pmc) и (Mtr).
ε-Аминогруппы можно защищать приемлемой защитной группой, выбранной из 2-хлорбензилоксикарбонила (2-Cl-Z), 2-бромбензилоксикарбонила (2-Br-Z) и трет-бутилоксикарбонила (Вос). Вос является наиболее предпочтительным для (Lys).
Гидроксильные группы (ОН) можно защищать приемлемой защитной группой, выбранной из бензила (Bz1), 2,6-дихлорбензила (2,6-диСl-Вz1) и трет-бутила (t-Bu), (tBu) является наиболее предпочтительным для (Tyr), (Ser) и (Thr).
β- и γ-Амидные группы можно защищать приемлемой защитной группой, выбранной из 4-метилтритила (Mtt), 2,4,6-триметоксибензила (Tmob), 4,4-диметоксидитилбис(4-метоксифенил)метила (Dod) и тритила (Trt). Trt является наиболее предпочтительным для (Asn) и (Gln).
Индольную группу можно защищать приемлемой защитной группой, выбранной из формила (For), мезитил-2-сульфонила (Mts) и трет-бутилоксикарбонила (Воc). Вое является наиболее предпочтительным для (Тrp).
Имидазольную группу можно защищать приемлемой защитной группой, выбранной из бензила (Bzl), трет-бутилоксикарбонила (Вос) и тритила (Trt). Trt является наиболее предпочтительным для (His).
Все растворители, а именно изопропанол (iPrOH), метиленхлорид (СН2Сl2), диметилформамид (ДМФ) и N-метилпирролидон (NMП) получали от фирмы Fisher или Burdick & Jackson и применяли без дополнительной дистилляции. Трифторуксусную кислоту получали от фирмы Halocarbon или Fluka и применяли без дополнительной очистки.
Диизопропилкарбодиимид (ДИК) и диизопропилэтиламин (ДИПЭА) получали от фирмы Fluka или Aldrich и применяли без дополнительной очистки. Гидроксибензотриазол (ГОБТ), диметилсульфид (ДМС) и 1,2-этандитиол (ЭДТ) получали от фирмы Sigma Chemical Co. и применяли без дополнительной очистки. Защищенные аминокислоты, как правило, имели L-конфигурацию и их получали от фирмы Bachem или Neosystem. Чистоту этих реагентов подтверждали до их применения с помощью тонкослойной хроматографии, ЯМР и путем определения температуры плавления. Бензгидриламиносмола (ВНА) представляла собой сополимер стирола - 1% дивинилбензола (100-200 или 200-400 меш), и ее получали от фирмы Bachem или Advanced Chemtech. Общее содержание азота в этих смолах, как правило, составляло 0,3-1,2 миллиэквивалента (мэкв)/г.
Высокоэффективную жидкостную хроматогафию (ЖХВР) осуществляли на устройстве типа LDC, состоящем из насосов с постоянным напором I и III, программируемого устройства для создания градиента растворителя типа Gradient Master solvent и смесителя и снабженного спектромонитором (Spectromonitor III) УФ-детектора волн различной длины. Аналитическую ЖХВР осуществляли методом обращенной фазы, используя C18-колонки типа Vydac (0,4×30 см). Разделение с помощью препаративной ЖХВР осуществляли на колонках типа Vaydac (2×25 см).
В предпочтительных вариантах осуществления изобретения пептиды получали с помощью твердофазного синтеза с использованием метода, описанного в целом у Merrifield (J. Amer. Chem. Soc., 85, 1963, с.2149), хотя, как было отмечено выше, можно применять другие эквивалентные методы химического синтеза. Твердофазный синтез начинают с С-конца пептида путем сочетания защищенной альфа-аминокислоты с приемлемой смолой. Такой исходный продукт можно получать путем присоединения альфа-аминозащищенной аминокислоты с помощью сложноэфирной связи к пара-бензилоксибензиловому спирту (Ванг) смолы или путем создания амидной связи между Fmoc-линкером, таким как пара-((R,S)-α-(1-(9Н-флуорен-9-ил)метоксиформамидо)-2,4-диметилоксибензил)феноксиуксусная кислота (линкер Ринка), для присоединения к бензгидриламиносмоле (ВНА-смола). Получение гидроксиметиловой смолы хорошо известно в данной области. Подложки типа Fmoc-линкер-ВНА-смола поступают в продажу и их обычно используют, когда пептид, который требуется синтезировать, несет незамещенный амид на С-конце.
Как правило, аминокислоты или их миметики сочетают с Fmoc-линкером-ВНА-смолой с использованием защищенной Fmoc формы аминокислоты или миметика, применяя 2-5 эквивалентов аминокислоты и приемлемый связывающий агент. После сочетания смолу можно промывать и сушить под вакуумом. Уровень аминокислоты в смоле можно определять путем анализа аминокислот в аликвоте Fmoc-аминокислотной смолы или путем определения Fmoc-групп с помощью УФ-анализа. Любые непрореагировавшие аминогруппы можно улавливать путем взаимодействия смолы с уксусным ангидридом и диизопропилэтиламином в метиленхлориде.
Смолы подвергают нескольким повторным циклам для последовательного добавления аминокислот. Защитные Fmoc-группы альфа-аминокислот удаляют в оснòвных условиях. Для этой цели можно использовать пиперидин, пиперазин или морфолин (20-40 об.%) в ДМФ. Предпочтительно применяют 40%-ный пиперидин в ДМФ.
После удаления альфа-аминозащитной группы поэтапно осуществляют в требуемом порядке сочетание последующих защищенных аминокислот с получением промежуточного продукта, а именно защищенный пептид-смола. Активирующие реагенты, применяемые для сочетания аминокислот в твердофазном синтезе пептидов, хорошо известны в данной области. Например, приемлемыми реагентами для такого синтеза являются гексафторфосфат бензотриазол-1-илокситри(диметиламино)фосфония (БОП), гексафторфосфат бромтриспирролидинофосфония (ПиБроФ), гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (ГБТУ) и диизопропилкарбодиимид (ДИК). В контексте настоящего описания предпочтительными являются ГБТУ и ДИК. Можно применять другие активирующие агенты, описанные у Ваrany и Merrifield в The Peptides, т.2, под ред. J.Meienhofer, изд-во Academic Press, 1979, cc.1-284. Различные реагенты, такие как 1-гидроксибензотриазол (ГОБТ), N-гидроксисукцинимид (ГОСИ) и 3,4-дигидро-3-гидрокси-4-оксо-1, 2, 3-бензотриазол (ГООБТ), можно добавлять к предназначенным для сочетания смесям с целью оптимизации циклов синтеза. В контексте настоящего описания предпочтительным является ГОБТ. Ниже приведен протокол типичного цикла синтеза:
Протокол 1
Растворители для всех отмывок и сочетаний использовали в объеме 10-20 мл/г смолы. Мониторинг реакций сочетания в процессе синтеза осуществляли с использованием нингидринового теста Кайзера для определения степени их завершения (Kaiser и др., Anal. Biochem. 34, 1970, cc.595-598). Обнаружена медленная кинетика реакции при использовании Fmoc-Arg(Pmc) и при сочетании с вторичными аминами из-за наличия кислот со стерическими помехами. Продукты любых неполных реакций сочетания либо подвергали повторному сочетанию с использованием свежеприготовленной активированной аминокислоты, либо улавливали путем описанной выше обработки пептидной смолы уксусным ангидридом. Полностью собранный продукт в виде пептида-смолы сушили под вакуумом в течение нескольких часов.
Для каждого соединения блокирующие группы удаляли и пептид отщепляли от смолы. Например, содержащие пептид смолы обрабатывали из расчета 100 мкл этандитиола, 100 мкл диметилсульфида, 300 мкл анизола и 9,5 мл трифторуксусной кислоты на 1 грамм смолы при комнатной температуре в течение 180 мин. Или в другом варианте содержащие пептид смолы обрабатывали из расчета 1,0 мл триизопропилсилана и 9,5 мл трифторуксусной кислоты на 1 грамм смолы при комнатной температуре в течение 180 мин. Смолу отделяли фильтрацией и фильтраты осаждали в охлажденном простом этиловом эфире. Осадки центрифугировали и эфирный слой отбрасывали.
Смолу промывали 2 или 3 объемами Et2O и повторно центрифугировали.
Неочищенные продукты сушили под вакуумом.
Очистку неочищенных пептидов осуществляли с использованием системы Shimadzu LC-8A путем высокоэффективной жидкостной хроматографии (ЖХВР) на C18-колонке с обращенной фазой типа Vydac (50×250 мм, 300 Å, 10-15 мкм). Пептиды инъецировали в колонки в минимальном объеме либо 0,1 AcOH/H2O, либо СН3СН/H2O. Градиентную элюцию, как правило, начинали с использованием 2% буфера Б, 2% - 70% буфера Б в течение 70 мин (буфер А: 0,1% ТФК/Н2О, буфер Б: 0,1% ТФК/СН3CN) при скорости потока 50 мл/мин.
УФ-обнаружение осуществляли при 220/280 нм. Фракции, содержащие продукты, отделяли и их частоту подтверждали с помощью аналитической системы Shimadzu LC-10AT с использованием C18-колонки с обращенной фазой типа Асе (4,6×50 мм) при скорости потока 2 мл/мин, градиент (2-70%) в течение 10 мин (буфер А: 0,1% ТФК/H2O, буфер Б: 0,1% ТФК/СН3СN). Фракции, для которых подтверждена высокая чистота, объединяли и лиофилизировали.
Чистоту конечных продуктов оценивали с помощью аналитической ЖХВР на колонке с обращенной фазой согласно описанному выше методу. Установлено, что чистота всех продуктов составляла примерно 95-99%. Все конечные продукты анализировали также с помощью масс-спектрометрии с использованием бомбардировки быстрыми атомами (FAB-MC) или масс-спектрометрии с использованием электронного пучка (ES-MC). Все продукты давали ожидаемые родительские ионы М+Н ions в приемлемых пределах.
Агонисты Y2R вызывали снижение потребления корма при моделировании ожирения человека на мышах. Следовательно, введение этих соединений оказывает агонистическое действие на активность У2-рецептора, что является важным для снижения потребления корма и регуляции веса тела. Согласно данным экспериментов, описанных в примере 78, по оценке активности in vivo, снижение потребления пищи продемонстрировано при использовании выбранных аналогов, предлагаемых в изобретении (которые представлены в примерах 5, 44, 73 и 74), эти результаты обобщены на фиг.7, 8, 9 и 10.
Соединения, предлагаемые в настоящем изобретении, можно получать в форме фармацевтически приемлемых солей. Примерами предпочтительных солей являются соли, полученные с фармацевтически приемлемыми органическими кислотами, такими, например, как уксусная, молочная, малеиновая, лимонная, яблочная, аскорбиновая, янтарная, бензойная, салициловая, метансульфоновая, толуолсульфоновая, трифторуксусная или памовая кислота, а также с полимерными кислотами, такими, например, как дубильная кислота, или карбоксиметилцеллюлоза, и соли с неорганическими кислотами, такими как галогенводороды (например, соляная кислота), серная кислота или фосфорная кислота и т.п. Для получения фармацевтически приемлемой соли можно применять любую процедуру, известную специалисту в данной области.
Как указано выше, установлено, что новые соединения, предлагаемые в настоящем изобретении, являются агонистами рецептора нейропептида-2. Следовательно, соединения, предлагаемые в настоящем изобретении, можно применять для лечения и/или профилактики заболеваний, которые модулируются агонистами рецептора нейропептида-2, прежде всего ожирения.
Таким образом, изобретение относится также к фармацевтическим композициям, содержащим указанное выше соединение и фармацевтически приемлемый носитель и/или адъювант.
Изобретение относится также к указанным выше соединениям, предназначенным для применения в качестве терапевтически активных субстанций, прежде всего терапевтически активных субстанций, предназначенных для лечения и/или профилактики заболеваний, которые модулируются агонистами рецептора нейропептида-2, прежде всего терапевтически активных субстанций, предназначенных для лечения и/или профилактики ожирения.
Другим предпочтительным вариантом осуществления изобретения является способ терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистом рецептора нейропептида-2, прежде всего терапевтического и/или профилактического лечения ожирения, заключающийся в том, что указанное выше соединение вводят человеку или животному.
Изобретение относится также к применению указанных выше соединений для терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистами рецептора нейропептида-2, прежде всего для терапевтического и/или профилактического лечения ожирения.
Изобретение относится также к применению указанных выше соединений для приготовления лекарственных средств, предназначенных для терапевтического и/или профилактического лечения заболеваний, которые модулируются агонистами рецептора нейропептида-2, прежде всего для терапевтического и/или профилактического лечения ожирения. Такие лекарственные средства содержат указанное выше соединение.
При воплощении на практике способа, предлагаемого в настоящем изобретении, вводят в эффективном количестве любой из пептидов, предлагаемых в настоящем изобретении, или комбинацию любых пептидов, предлагаемых в настоящем изобретение, или их фармацевтически приемлемую соль с помощью общепринятых и приемлемых методов, известных в данной области, либо индивидуально, либо в сочетании. Так, соединения или композиции можно вводить орально (например, в щечный карман), подъязычно, парентерально (например, внутримышечно, внутривенно или подкожно), ректально (например, с помощью суппозиториев и растворов для промывания), трансдермально (например, путем кожной электропорации) или путем ингаляции (например, с помощью аэрозоля), и в форме твердых, жидких или газообразных доз, включая таблетки и суспензии. Введение можно осуществлять в виде стандартной дозы лекарственного средства при продолжительном лечении или в виде лекарственного средства на один прием, которое принимается при необходимости, при использовании такой формы терапии. Терапевтическая композиция может также иметь форму масляной эмульсии или дисперсии в сочетании с липофильной солью, такой как соль памовой кислоты, или в форме биоразложимой композиции с пролонгированным высвобождением для подкожного или внутримышечного введения.
Таким образом, способ, предлагаемый в настоящем изобретении, применяют на практике, когда существует или возможно возникновение конкретной необходимости в облегчении симптомов. В другом варианте способ, предлагаемый в настоящем изобретении, применяют на практике для эффективного продолжительного или профилактического лечения.
Фармацевтические носители, которые можно применять для приготовления композиций, могут быть твердыми, жидкими или газообразными; таким образом, композиции могут иметь форму таблеток, пилюль, капсул, суппозиториев, порошков, форм с энтеросолюбильным или иным защитным покрытием (например, связанных с ионообменными смолами или упакованных в липидно-белковые везикулы), форм с пролонгированным высвобождением, растворов, суспензий, эликсиров, аэрозолей и т.п. Носитель можно выбирать из различных масел, включая полученные из нефти масла, масла животного, растительного происхождения или полученные путем синтеза, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Предпочтительными жидкими носителями являются вода, физиологический раствор, водная декстроза и гликоли, которые применяют прежде всего (когда требуется изотоничность с кровью) для растворов для инъекций. Например, формы для внутривенного введения содержат стерильные водные растворы действующих(его) веществ(а), которые получают путем растворения твердых(ого) действующих(его) веществ(а) в воде для приготовления водного раствора, и стерилизуют раствор. Приемлемыми фармацевтическими эксципиентами являются крахмал, целлюлоза, тальк, глюкоза, лактоза, желатин, солод, рис, мука, мел, кремнезем, стеарат магния, стеарат натрия, глицеринмоностеарат, хлорид натрия, обезжиренное сухое молоко, глицерин, пропиленгликоль, вода, этанол и т.п. В композиции можно вводить общепринятые фармацевтические добавки, такие как консерванты, стабилизаторы, смачивающие или эмульгирующие агенты, соли для регулирования осмотического давления, буферы и т.п. Приемлемые фармацевтические носители и их формы описаны в Remington's Pharmaceutical Sciences, под. ред. Е.W.Martin. В любом случае такие композиции должны содержать действующее вещество в эффективном количестве в сочетании с приемлемым носителем для получения соответствующей формы лекарственного средства, предназначенной для соответствующего введения реципиенту.
Доза соединения, предлагаемого в настоящем изобретении, зависит от целого ряда факторов, таких, например, как путь введения, возраст и вес тела индивидуума и состояние индивидуума, подлежащее лечению, и окончательное решение должен принимать лечащий врач или ветеринар. Такое количество действующего вещества, которое определено лечащим врачом или ветеринаром, обозначают в контексте настоящего описания как «эффективное количество». Например, доза для интраназального введения, как правило, составляет от примерно 1 до примерно 100 мг/кг веса тела, а доза для подкожного введения, как правило, составляет от примерно 0,001 до примерно 50 мг/кг веса тела.
Предпочтительно доза соединения, предлагаемого в настоящем изобретении, составляет от примерно 2,5 до примерно 10 мг/кг. Наиболее предпочтительно дозы составляют примерно 2,5, примерно 5 и примерно 10 мг/кг.
Ниже изобретение дополнительно описано с помощью примеров, которые даны только с целью иллюстрации и не ограничивают объем изобретения.
Примеры
Пример 1
Получение Fmoc-линкер-ВНА-смолы
Поперечно-сшитой бензгидриламиносмоле, которая представляла собой сополимер стирола - 1% дивинилбензола (10,0 г, 9,3 мэкв, 100-200 ASTM-меш, фирма Advanced ChemTech), давали набухать в 100 мл СН2Сl2, фильтровали и промывали последовательно, используя по 100 мл каждого из перечисленных ниже соединений: СН2Cl2, 6% ДИПЭА/СН2Сl2 (дважды), СН2Сl2 (дважды). Смолу обрабатывали пара-((R,S)-α-(1-(9Н-флуорен-9-ил)метоксиформамидо)-2,4-диметоксибензил)феноксиуксусной кислотой (Fmoc-линкер) (7,01 г, 13,0 ммолей), N-гидроксибензотриазолом (2,16 г, 16,0 ммолей) и диизопропилкарбодиимидом (2,04 мл, 13,0 ммолей) в 100 мл 25% ДМФ/СН2Cl2 в течение 24 ч при комнатной температуре. Смолу фильтровали и промывали последовательно, используя по 100 мл каждого из следующих соединений: СН2Сl2 (дважды), изопропанол (дважды), ДМФ и СН2Сl2 (трижды). Результаты нингидринового теста Кайзера были отрицательными. Смолу сушили под вакуумом, получая 16,12 г Fmoc-линкер-ВНА-смолы. В порции этой смолы (3,5 г) удаляли защитную группу Fmoc и количественно оценивали с помощью УФ-анализа, который показал загрузку на уровне 0,56 ммоля/г.
Пример 2
Протокол синтеза пептидов с помощью синтезатора типа Applied Biosystem 433А с использованием химии на основе флуоренилметилоксикарбонила (Fmoc)
Для пептидного синтеза в масштабе 0,25 ммоля с помощью синтезатора типа Applied Biosystem 433A (Фостер Сити, шт.Калифорния), применяли циклы с использованием 0,25 ммоля FastMoc либо с образцом смолы, либо без смолы, которые проводили в реакционном сосуде объемом 41 мл. Смолу, содержащую Fmoc-аминокислоту, растворяли в 2,1 г ММФ, 2 г 0,45М ГОБТ/ГБТУ в ДМФ и 2М ДИЭА, затем переносили в реакционный сосуд.
Основной цикл FastMoc-сочетания обозначен модулем «BADEIFD», в котором каждая буква обозначает стадию (модуль).
Например:
«В» обозначает модуль удаления защитной группы Fmoc с помощью 20% пиперидина/NМФ и соответствующих промывок и регистрации данных в течение 30 мин (либо на основе УФ-мониторинга, либо на основе измерения проводимости);
«А» обозначает модуль активации аминокислоты в картриджах с помощью 0,45М ГБТУ/ГОБТ и 2,0М ДИЭА и перемешивания при барботировании N2;
«D» обозначает модуль промывки смолы с помощью NМФ в реакционном сосуде;
«Е» обозначает модуль переноса активированной аминокислоты в реакционный сосуд для сочетания;
«I» обозначает модуль 10-минутного периода ожидания при встряхивании реакционного сосуда или без встряхивания и
«F» обозначает модуль очистки картриджа, сочетания в течение примерно 10 мин и сушки реакционного сосуда.
Продукты сочетания, как правило, удлиняли путем добавления модуля «I» один или несколько раз. Например, для получения двойных сочетаний осуществляли процедуру «BADEIIADEIFD». Возможно применение других модулей, таких как «с» для промывок метиленхлоридом и «С» для улавливания с помощью уксусного ангидрида. Индивидуальные модули модифицировали также, например, путем изменения времени осуществления различных функций, таких как время переноса, для изменения количества переносимого растворителя или реагентов.
Указанные выше циклы, как правило, использовали для сочетания одной аминокислоты. Однако для синтеза тетрапептидов циклы повторяли и объединяли. Например, для сочетания первой аминокислоты использовали процедуру «BADEIIADEIFD», затем для сочетания второй аминокислоты использовали процедуру «BADEIIADEIFD», для сочетания третьей аминокислоты использовали процедуру «BADEIIADEIFD», для сочетания четвертой аминокислоты использовали процедуру «BADEIIADEIFD» с последующим использованием процедуры «BIDDcc» для конечного удаления защитных групп и промывки.
Пример 3
Получение H-Tyr-Pro-Ile-Lys-Pro-Glu-Ala-Pro-Gly-Glu-Asp-Ala-Ser-Pro-Glu-Glu-Leu-Asn-Arg-Tyr-Tyr-Ala-Ser-Leu-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (PYY1-36)(SEQ ID NO:3)
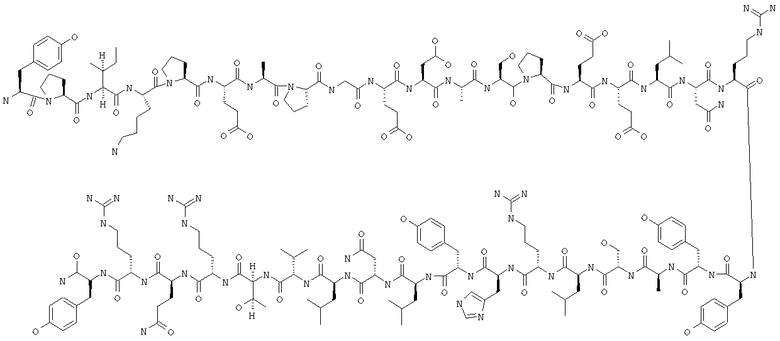
Вышеуказанный пептид синтезировали с использованием химии, основанной на применении Fmoc, с помощью синтезатора типа Applied Biosystem 433A. Синтезатор был запрограммирован на осуществление двойного сочетания с использованием модулей, описанных в примере 2. Синтез осуществляли в масштабе 0,25 ммоля с использованием Fmoc-линкер-ВНА-смолы (450 мг, 0,25 ммоля), полученной согласно методу, описанному в примере 1. В конце синтеза смолу переносили в реакционный сосуд, снабженный шейкером, для расщепления. Пептид отщепляли от смолы с помощью 13,5 мл 97% ТФК/3%Н2О и 1,5 мл триизопропилсилана в течение 180 мин при комнатной температуре. Добавляли раствор для удаления защитных групп к 100 мл охлажденного Еt2О и промывали с использованием 1 мл ТФК и 30 мл охлажденного Еt2О для осаждения пептида. Пептид центрифугировали в двух полипропиленовых пробирках объемом 50 мл (2×50 мл). Осадки из каждой пробирки объединяли в одну пробирку и промывали трижды охлажденным Еt2О и сушили в эксикаторе с использованием подведенного в помещение вакуума.
Неочищенный продукт очищали препаративной ЖХВР на C18-колонке типа Pursuit (250×50 мм, размер частиц 10 мкм) и элюировали с использованием линейного градиента 2-70% буфера Б (буфер А: 0,1% ТФК/Н2О; буфер Б: 0,1% ТФК/СН3СN) в течение 90 мин, скорость потока 60 мл/мин и обнаружение при 220/280 нм. Фракции собирали и оценивали с помощью аналитической ЖХВР. Фракции, содержащие чистый продукт, объединяли и лиофилизировали, получая 65 мг (6%) аморфного порошка белого цвета. (ES)+-ЖХ (жидкостная хроматография)/МС m/е рассчитано (рассчит.) для C194H295N55O57 4309,85, обнаружено 4309,15.
Пример 4
Получение H-Ile-Lys-Pro-Glu-Ala-Pro-Gly-Glu-Asp-Ala-Ser-Pro-Glu-Glu-Leu-Asn-Arg-Tyr-Tyr-Ala-Ser-Leu-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (PYY3-36) (SEQ ID NO:4)
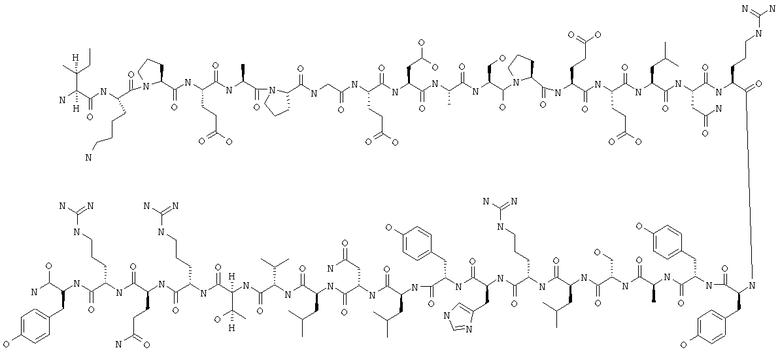
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу и очищали согласно процедуре, описанной в примере 3, получая 151 мг (15%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C180H279N53O54 4049,55, 5 обнаружено 4050,40.
Пример 5
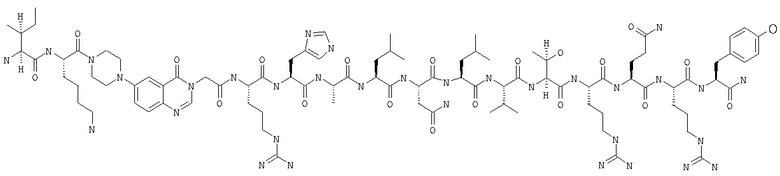
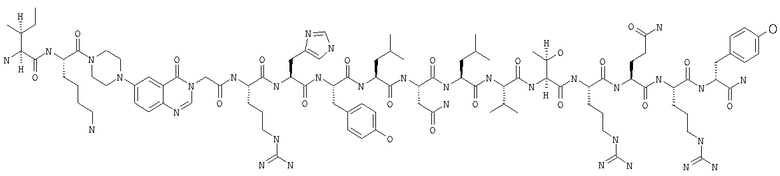
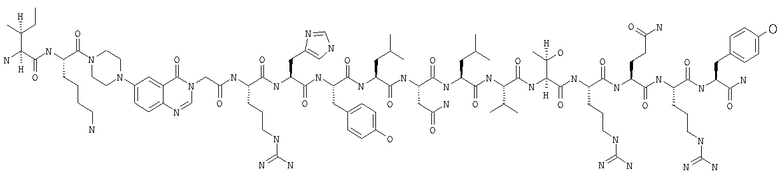
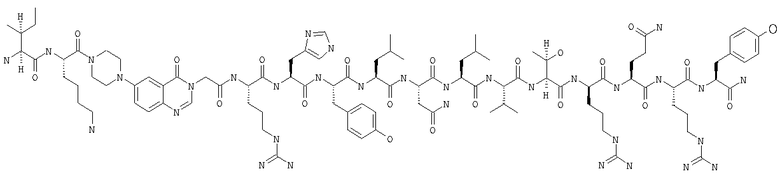
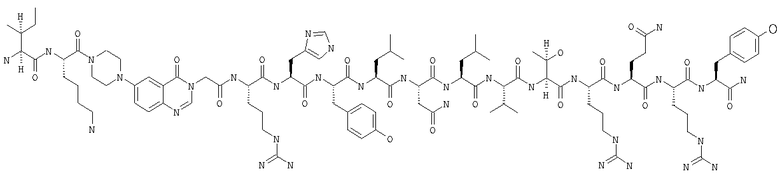
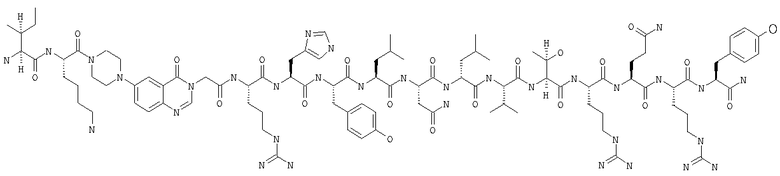
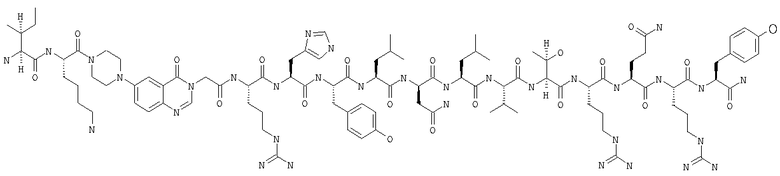
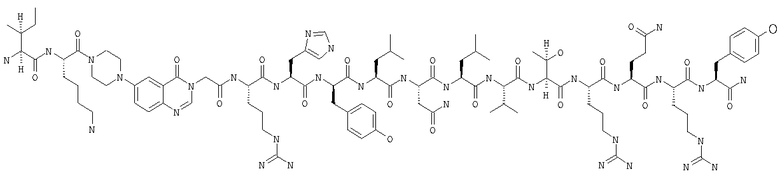
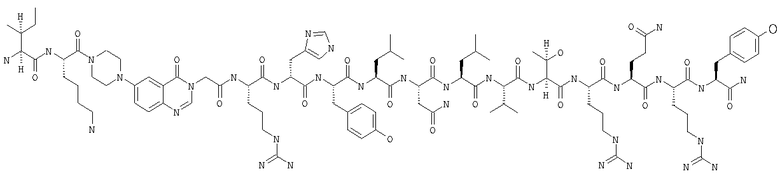
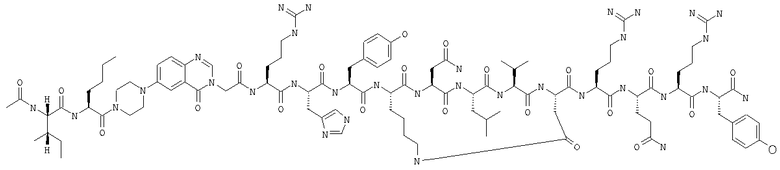
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу и очищали согласно процедуре, описанной в примере 3, получая 148 мг (9%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H155N33O21 2131,53, обнаружено 2130,56.
Пример 6
Получение Ac-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
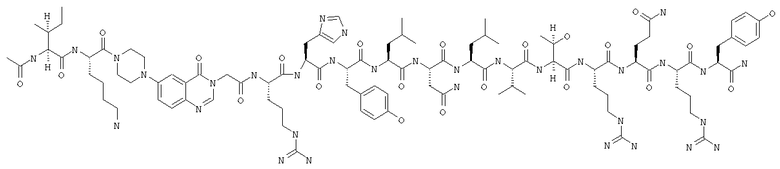
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (к ABI-протоколу добавляли цикл ацилирования) и очищали согласно процедуре, описанной в примере 3, получая 150 мг (27%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/е: рассчит. для C100H157N33O22 2171,57, обнаружено 2171,4.
Пример 7
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Ala-Arg-Tyr-NH2 (SEQ ID NO:6)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 34 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 142 мг (27%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C96H150N32O20 2072,47, обнаружено 2072,4.
Пример 8
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Ala-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:7)
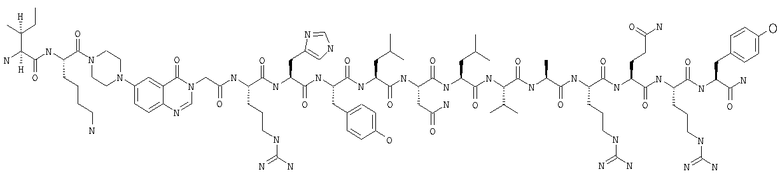
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 32 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 167 мг (32%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C97H151N33O20 2099,49, обнаружено 2100,3.
Пример 9
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Ala-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:8)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали А1а в положение 31 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 105 мг (20%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C96H149N33O21 2101,47, обнаружено 2102,1.
Пример 10
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Ala-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:9)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 30 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 167 мг (27%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C95H147N33O21 2087,44, обнаружено 2087,7.
Пример 11
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Ala-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:10)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 29 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 142 мг (27%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C97H152N32O20 2086,50, обнаружено 2086,50.
Пример 12
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Ala-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:11)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 28 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 164 мг (31%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C95H147N33O21 2087,44, обнаружено 2087,40.
Пример 13
Получение H-Ile-Lys-Pqa-Arg-His-Ala-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:12)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали А1а в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 132 мг (26%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C92H149N33O20 2037,42, обнаружено 2037,60.
Пример 14
Получение H-Ile-Lys-Pqa-Arg-Ala-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:13)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 76 мг (15%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C95H151N31O21 2063,46, обнаружено 2064,0.
Пример 15
Получение H-Ile-Lys-Pqa-Ala-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:14)
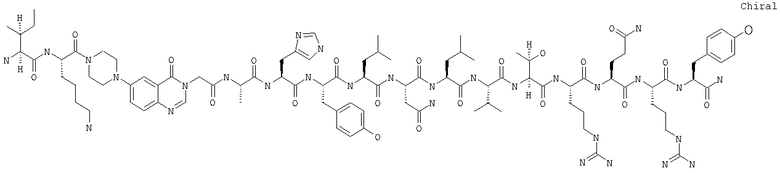
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали А1а в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 152 мг (30%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C95H146N30O21 2043,13, обнаружено 2043,4.
Пример 16
Получение H-Ile-Ala-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
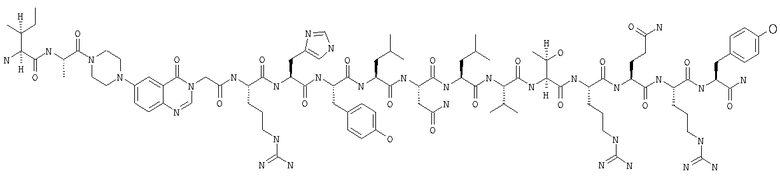
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 4 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 72 мг (14%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/c: рассчит. для C95H146N32O21 2072,44, обнаружено 2071,2.
Пример 17
Получение Ac-Ile-Ala-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу, при этом к протоколу добавляли цикл ацилирования и очищали согласно процедуре, описанной в примере 3, получая 234 мг (44%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C97H148N32O22 2114,46, обнаружено 2114,7.
Пример 18
Получение Н-Ala-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
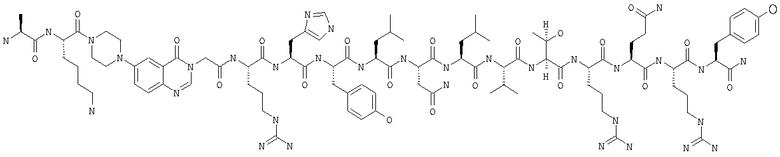
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аlа в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 196 мг (38%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C95H147N33O21 2087,45, обнаружено 2086,5.
Пример 19
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-(D)Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Tyr в положение 34 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 114 мг (21%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H153N33O21 2129,52, обнаружено 2129,10.
Пример 20
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-(D)Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Arg в положение 35 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 221 мг (42%) аморфного порошка белого цвета. (ES)+-ЖХ/MC m/e: рассчит. для C98H153N33O21 2129,52, обнаружено 2129,10.
Пример 21
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-(D)Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Arg в положение 33 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 174 мг (32%) аморфного порошка белого цвета. (ES)+-ЖХ/MC m/e: рассчит. для C98H153N33O21 2129,52, обнаружено 2128,4.
Пример 22
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-(D)Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Val в положение 31 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 67 мг (12%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C98H153N33O21 2129,52, обнаружено 2129,10.
Пример 23
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-(D)Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Leu в положение 30 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 190 мг (36%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/e: рассчит. для C98H153N33O21 2129,52, обнаружено 2129,10.
Пример 24
Получение H-Ile-Lvs-Pqa-Arg-His-Tyr-Leu-(D)Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Asn в положение 29 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 50 мг (10%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для С98Н153Н33O21 2129,53, обнаружено 2128,80.
Пример 25
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-(D)Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-NH2

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Leu в положение 30 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 188 мг (35%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/e: рассчит. для C98H153N33O21 2129,53, обнаружено 2129,40.
Пример 26
Получение H-Ile-Lys-Pqa-Arg-His-(D)Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Tyr в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 119 мг (22%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/е: рассчит. для С98Н153N33O21 2129,53, обнаружено 2129,70.
Пример 27
Получение H-Ile-Lys-Pqa-Arg-(D)His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)His в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 84 мг (16%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для С98Н153N33O21 2129,53, обнаружено 2128,80.
Пример 28
Получение H-Ile-Lys-Pqa-(D)Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Arg в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 85 мг (16%) аморфного порошка белого цвета. (ЕS)+-ЖХ/МС m/e: рассчит. для C98H153N33O21 2129,53, обнаружено 2128,80.
Пример 29
Получение H-Ile-(D)Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Lys в положение 4 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 165 мг (31%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H153N33O21 2129,53, обнаружено 2129,10.
Пример 30
Получение Н-(D)Ile-Lvs-Pga-Arg-His-Tvr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Ile в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 84 мг (8%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H153N33O21 2129,53, обнаружено 2129,40.
Пример 31
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-(NMe)Tyr-NH2 (SEO ID NO:15)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилTyr в положение 36 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 90 мг (17%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H157N33O21 2143,56, обнаружено 2143,50.
Пример 32
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-(NMe)Arg-Tyr-NH2 (SEQ ID NO:16)
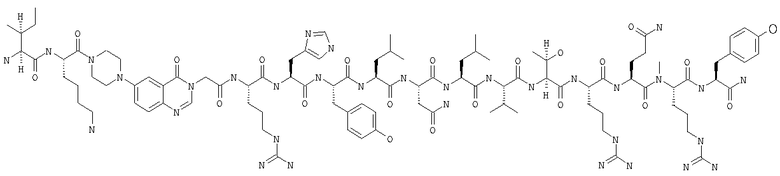
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилArg в положение 35 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 32 мг (6%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,50.
Пример 33
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-(NMe)Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:17)
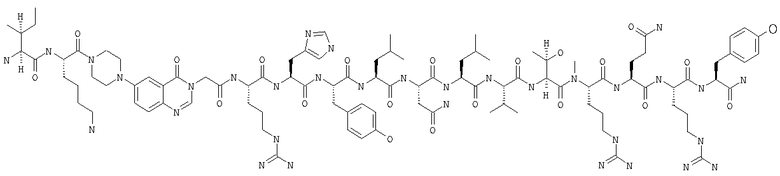
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилArg в положение 33 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 40 мг (7%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,20.
Пример 34
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-(NMe)Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:18)
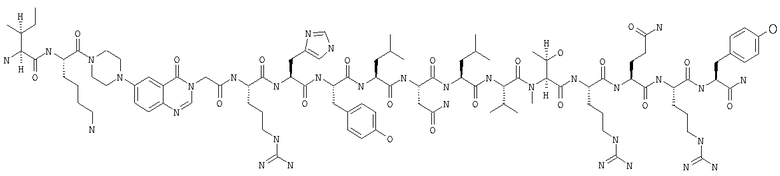
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилТhr в положение 32 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 115 мг (21%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,20.
Пример 35
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-(NMe)Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:19)
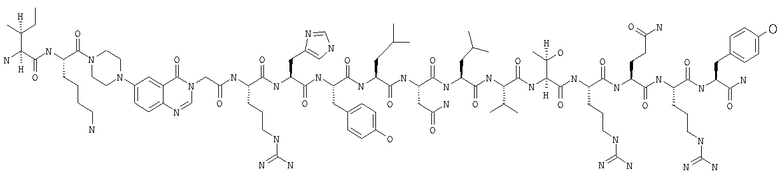
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилVal в положение 31 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 60 мг (11%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,20.
Пример 36
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-Leu-Asn-(NMe)Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:20)
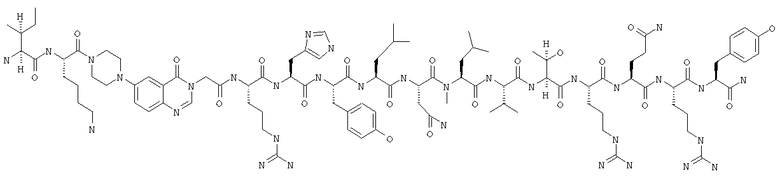
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилLeu в положение 30 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 91 мг (17%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2142,90.
Пример 37
Получение H-Ile-Lys-Pqa-Arg-His-Tyr-(NMe)Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:21)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилLeu в положение 28 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 153 мг (28%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C99H155N33O21 2143,56, обнаружено 2142,90.
Пример 38
Получение H-Ile-Lys-Pqa-Arg-His-(NMe)Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:22)
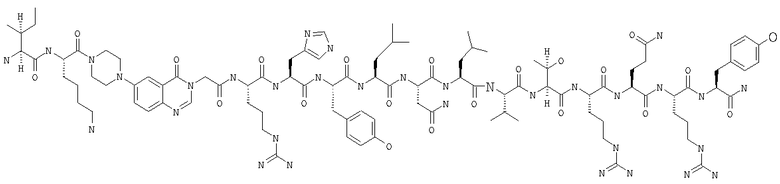
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилTyr в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 76 мг (14%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2142,90.
Пример 39
Получение H-Ile-Lvs-Pqa-Arg-(NMe)His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:23)
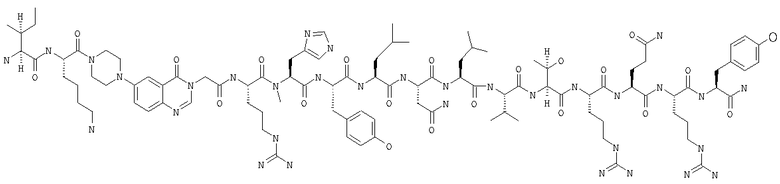
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Н-метилHis в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 93 мг (7%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,53, обнаружено 2143,50.
Пример 40
Получение H-Ile-Lys-Pqa-(NMe)Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:24)
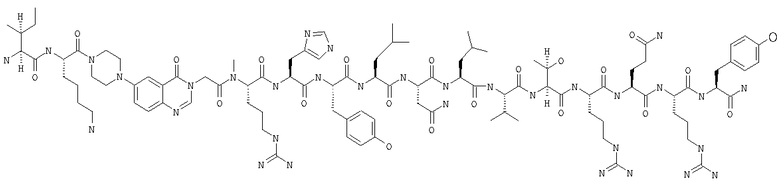
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилArg в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 33 мг (6%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,50.
Пример 41
Получение H-Ile-NMeLys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилLys в положение 4 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 156 мг (29%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,20.
Пример 42
Получение H-NMeIle-Lys-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилIle в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 203 мг (38%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C99H155N33O21 2143,56, обнаружено 2143,20.
Пример 43
Получение H-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Nle в положение 4 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 60 мг (11%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H153N32O21 2114,52, обнаружено 2113,80.
Пример 44
Получение Aс-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (к протоколу добавляли цикл ацилирования) и очищали согласно процедуре, описанной в примере 3, получая 41 мг (8%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/е: рассчит. для C100H154N32O22 2156,56, обнаружено 2156,10.
Пример 45
Получение Ас-Ile-Nle-Pqa-Phe-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:25)
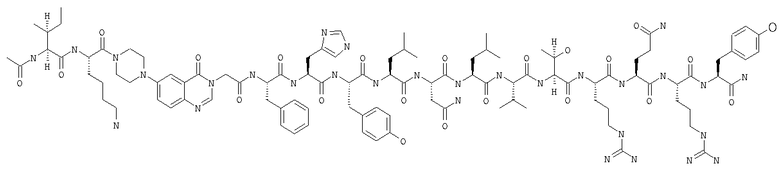
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Phe в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 92 мг (7%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C103H151N29O22 2147,53, обнаружено 2148,00.
Пример 46
Получение Н-Ile-Lys-Pqa-Arg-His-Trp-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:26)
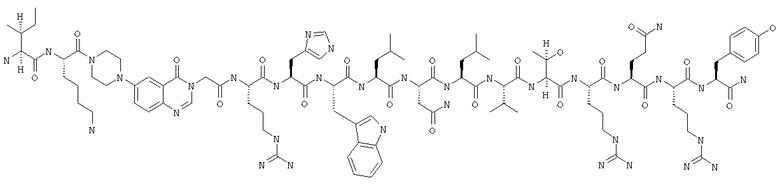
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Тrр в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 30 мг (6%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C100H154N34O20 2153,56, обнаружено 2152,20.
Пример 47
Получение H-Ile-Lys-Pqa-Ala-His-Trp-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:27)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали в последовательность Аlа 25 и Тrр 27) и очищали согласно процедуре, описанной в примере 3, получая 50 мг (9%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C97H147N31O20 2067,46, обнаружено 2067,30.
Пример 48
Получение Ac-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-(D)Tyr-NH2
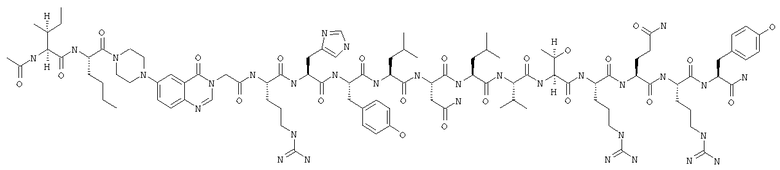
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (D)Tyr в положение 36 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 104 мг (19%) аморфного порошка белого цвета. (ES)+-ЖX/MC m/е: рассчит. для C100H154N32O22 2156,54, обнаружено 2157,00.
Пример 49
Получение Ac-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-N-метилTyr-NH2 (SEQ ID NO:15)
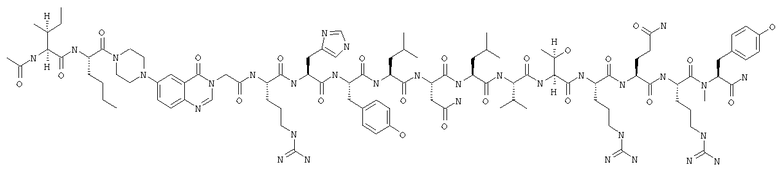
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали N-метилTyr в положение 36 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 28 мг (5%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C101H156N32O22 2170,57, обнаружено 2170,50.
Пример 50
Получение циклоLys28-Asp32 Ac-Ile-Nle-Pqa-Arg-His-Tyr-Lys-Asn-Leu-Val-Asp-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:28)
Пептид получали путем комбинации автоматического синтеза с использованием стандартного протокола для синтезатора ABI 433 и синтеза вручную в масштабе 0,25 мМ. Фрагмент Fmoc-Asn(Trt)-Leu-Val-Asp(2Pip)-Arg(Pmc)-Gln(Trt)-Arg(Pmc)-Tyr(OBut)-BHA-CMonbi (SEQ ID NO:29) синтезировали с помощью ABI-протокола и затем удлиняли вручную, получая Fmoc-Ile-Nle-Pqa-Arg(Pmc)-His(Trt)-Tyr(OBut)-Lys-Asn(Trt)-Leu-Val-Asp-Arg(Pmc)-Gln(Trt)-rg(Pmc)-Tyr(OBut)-BHA-смолу (SEQ ID NO:30). После завершения автоматического синтеза пептидную смолу переносили в сосуд для осуществления твердофазного синтеза вручную и промывали несколько раз метиленхлоридом и ДМФ. Добавляли Fmoc-Lys(Mtt) в виде твердого вещества в количестве 1,2 г (2,0 мМ, 8 экв) и 15 мл ДМФ, а затем 1,2 мл ДИК (7 мМ, 28 экв). Реакции сочетания давали проходить вплоть до получения отрицательного или практически отрицательного результата нингидринового теста. При получении отрицательного нингидринового теста смолу ацетилировали, используя 6 мл Ас2O, 1 мл ДИЭА и 18 мл ДМФ, в течение 30 мин и завершение реакции оценивали с помощью нингидрина. Затем смолу промывали 3×ДМФ и 4×СН2Сl2. Удаляли защитные группы Lys(Mtt) и Asp(2Pip), 10-кратно используя 2% ТФК в СН2Сl2. После удаления защитных групп пептидную смолу промывали 2×CH2Cl2; 2×6% ТФК/СН2Сl2; 2×6% ДИЭА/ДМФ и 2×ДМФ. Боковую цепь циклизировали с помощью ГАТУ (240 мг, 0,625 мМ (2,5 экв)) и ДИЭА (175 мкл, 1,0 мМ (4 экв)) и оценивали с помощью нингидринового теста до получения отрицательного результата.
После завершения циклизации пептидную смолу переносили в ABI-сосуд для удлинения с получением Fmoc-Arg(Pmc)-His(Trt)-Tyr(OBut)-Lys-Asn(Trt)-Leu-Val-Asp-Arg(Pmc)-Gln(Trt)-Arg(Pmc)-Tyr(OBut)-BHA-смолы (SEQ ID NO:30). Добавляли Fmoc-Pga-OH (160 мг, 313 мМ (1,25 экв)) и ГОБТ (5 мг, 313 мМ (1,25 экв)) в виде твердых веществ и 15 мл ДМФ, а затем 1,2 мл ДИК (7 мМ, 28 экв). Реакции сочетания давали проходить в течение ночи (как правило, в течение 18 ч) при комнатной температуре. После 4-кратной промывки ДМФ осуществляли мониторинг реакций сочетания с помощью нингидринового теста и, как правило, результат был отрицательным. После стандартных процедур удаления защитных групп и промывки Fmoc-Nle-OH (1,2 г, 3,0 мМ (12 экв)) предварительно активировали с помощью 6,6 мл 0,45М НВТТ/ГОБТ в ДМФ в течение 3 мин и добавляли к пептидной смоле. Реакции сочетания давали проходить в течение 3-4 ч, реакционный сосуд осушали и четырежды промывали ДМФ. Мониторинг этой реакции сочетания осуществляли с помощью хлориналя (2% ацетальдегида в DMAc и 2% тетрахлор-1,4-бензохинона). Если установлено, что реакция сочетания не завершена, смолу подвергали повторному сочетанию в течение ночи. После завершения реакции сочетания у смолы удаляли защитные группы и промывали и Fmoc-Ile (1,2 г, 3,0 мМ (12 экв)) предварительно активировали с помощью 6,6 мл 0,45М НВТТ/ГОБТ в ДМФ в течение 3 мин и добавляли к пептидной смоле. Реакции сочетания давали проходить в течение 3-4 ч, реакционный сосуд осушали и четырежды промывали ДМФ. Мониторинг этой реакции сочетания осуществляли с помощью нингидринового теста и, как правило, результат был отрицательным. У смолы удаляли защитные группы и промывали и ацетилировали с помощью 6 мл Ас2О, 1 мл ДИЭА и 18 мл ДМФ в течение 30 мин и осуществляли мониторинг до получения отрицательных или практически отрицательных результатов нингидринового теста. При получении отрицательного результата нингидринового теста смолу ацетилировали с помощью 6 мл Ас2О, 1 мл ДИЭА и 18 мл ДМФ в течение 30 мин и завершение реакции оценивали с помощью нингидрина.
После завершения синтеза смолу промывали четырежды СН2Сl2 и сушили в потоке N2. У пептида удаляли защитные группы и отщепляли от смолы с помощью 1,5 мл триизопропилсилана и 13,5 мл 97% ТФК/3% Н2О в течение 180 мин. Раствор для удаления защитных групп добавляли к 100 мл охлажденного Еt2О и промывали 1 мл ТФК и 30 мл охлажденного ET2O для осаждения пептида, затем центрифугировали и сушили в эксикаторе с использованием подведенного в помещение вакуума.
Неочищенный пептид очищали и лиофилизировали с помощью процедуры, описанной в примере 3, получая 49 мг (9%) аморфного порошка белого цвета. (ES)+-LC/MS m/e рассчит. для С100Н151N33O22 2167,53, обнаружено 2167,80.
Пример 51
Получение H-Ile-Lys-Cms-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
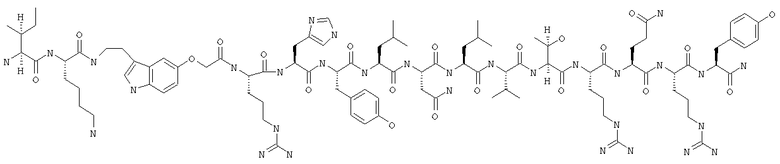
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу и очищали согласно процедуре, описанной в примере 3, получая 44 мг (8%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C96H151N31O21 2075,47, обнаружено 2074,80.
Пример 52
Получение H-Ile-Lys-Gly-Cms-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу и очищали согласно процедуре, описанной в примере 3, получая 129 мг (24%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H154N32O22 2132,52, обнаружено 2133,00.
Пример 53
Получение циклоLys28-Aspu32 Ac-Ile-Nle-Cms-Arg-His-Tyr-Lys-Asn-Leu-Val-Asp-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:28)
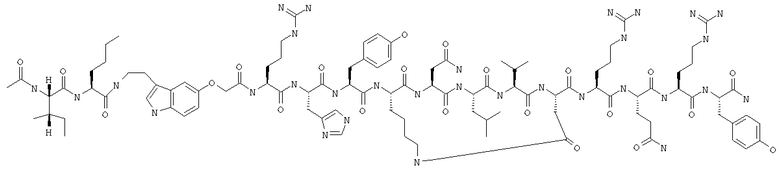
Этот пептид получали путем комбинации автоматического синтеза на синтезаторе ABI 433 и синтеза вручную в масштабе 0,25 мМ согласно методу, описанному в примере 50. Fmoc-Cms-OH (151 мг, 313 мМ (1,25 экв)) и ГОБТ (45 мг, 313 мМ (1,25 экв)) добавляли в виде твердых веществ и 15 мл ДМФ с последующим добавлением 1,2 мл ДИК (7 мМ, 28 экв). Реакции сочетания давали проходить в течение ночи (как правило, в течение 18 ч) при комнатной температуре.
Очищенный пептид очищали и лиофилизировали, получая 19 мг (9%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C98H149N31O22 2113,47, обнаружено 2113,80.
Пример 54
Получение Ac-Ile-Nle-Pqa-Arg-His-Tic-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:31)
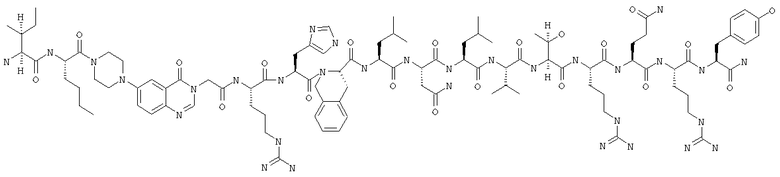
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Tic в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 87 мг (16%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/c: рассчит. для C101H154N32O21 2152,56, обнаружено 2152,50.
Пример 55
Получение Ac-Ile-Nle-Pqa-Arg-His-Bip-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:32)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Bip в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 90 мг (16%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/c: рассчит. для C106H158N32O21 2216,64, обнаружено 2217,00.
Пример 56
Получение Ac-Ile-Nle-Pqa-Arg-His-Dip-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:33)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Dip в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 84 мг (15%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C106H158N32O21 2216,64, обнаружено 2217,30.
Пример 57
Получение Ac-Ile-Nle-Pqa-Arg-His-(1)Nal-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:34)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (1)Nal в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 88 мг (16%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C104H156N32O21 2190,60, обнаружено 2190,61.
Пример 58
Получение Ac-Ile-Nle-Pqa-Arg-His-(2)Nal-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:35)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (2)Nal в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 40 мг (7%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C104H156N32O21 2190,60, обнаружено 2191,20.
Пример 59
Получение Ac-Ile-Nle-Pqa-Arg-His-(3,4,5-трифторPhe)-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:36)
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали 3,4,5-трифторPhe в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 101,4 мг (18%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C100H151F3N32O21 2194,52, обнаружено 2194,20.
Пример 60
Получение Ac-Ile-Nle-Pqa-Arg-His-(2,3,4,5,6-пентафторPhe)-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:37)
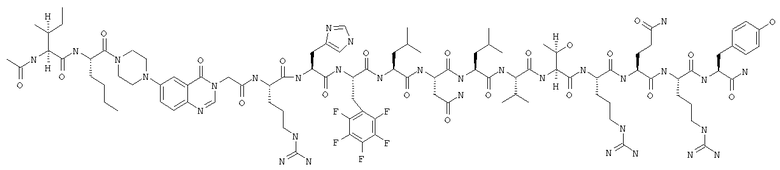
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали 2,3,4,5,6-пентафторРhе в положение 27 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 122,5 мг (22%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C100H149F5N32O21 2230,50, обнаружено 2230,50.
Пример 61
Получение Ac-Ile-Nle-Pqa-Arg-(4-MeOApc)-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:38)
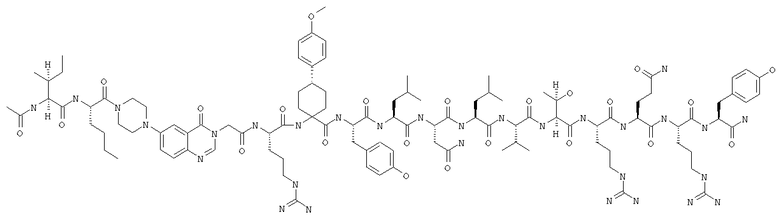
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (4-МеО-Арс) в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 43 мг (8%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C108H164N30O23 2250,70, обнаружено 2250,60.
Пример 62
Получение Ac-Ile-Nle-Pqa-Arg-(3-Pal)-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:39)
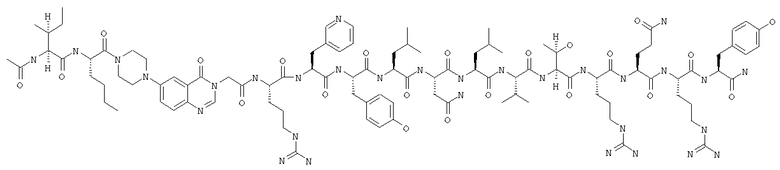
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (3-Pal) в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 112 мг (21%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C102H155N31O22 2167,57, обнаружено 2167,20.
Пример 63
Получение Ac-Ile-Nle-Pqa-Arg-(4-Pal)-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:40)
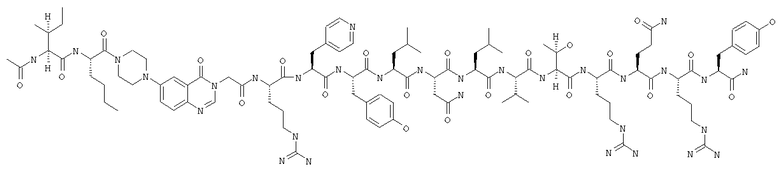
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (4-Pal) в положение 26 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 146 мг (27%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C102H155N31O22 2167,57, обнаружено 2167,20.
Пример 64
Получение Ac-Ile-Nle-Pqa-(3,4,5-трифторPhe)-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:41)
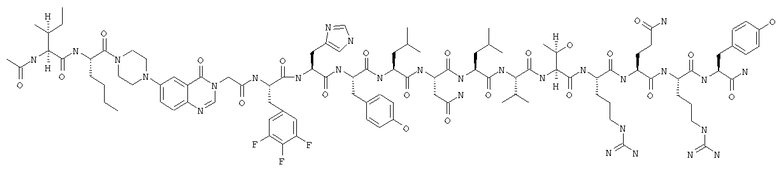
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (3,4,5-трифторPhe) в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 55 мг (10%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C103H148F3N29O22 2201,50, обнаружено 2201,40.
Пример 65
Получение Ac-lle-Nle-Pqa-(2,3,4,5,6-пентафторPhe)-His Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:42)
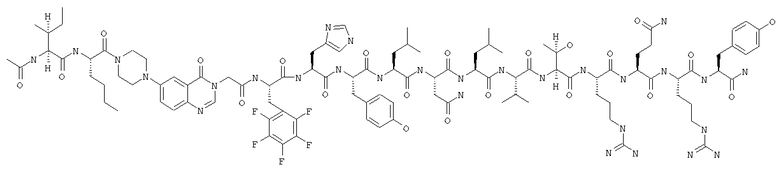
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (2,3,4,5,6-пентафторPhe) в положение 25 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 65 мг (12%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C103H146F5N29O22 2237,49, обнаружено 2237,70.
Пример 66
Получение Ас-Aib-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
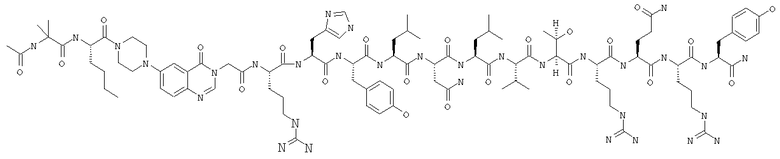
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (Aib) в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 32 мг (6%) аморфного порошка белого цвета. (ES)+-МС m/e: рассчит. для C98H150N32O22 2128,49, обнаружено 2128,00.
Пример 67
Получение Ac-1,1-Aic-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
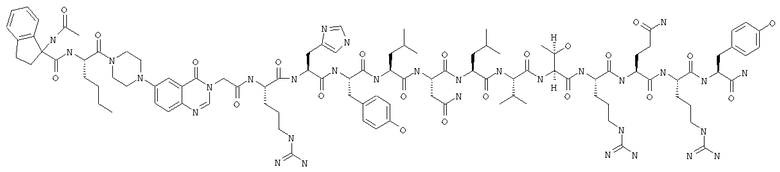
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (1,1-Aic) в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая рацемическую смесь, которую разделяли с получением пика А: 31 мг (6%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для
C104H152N32O22 2202,57, обнаружено 2202,60.
Пример 68
Получение Ac-1,1-Aic-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)

Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (1,1 Aic) в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая рацемическую смесь, которую разделяли с получением пика Б: 46 мг (8%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для пика Б C104H152N32O22 2202,57, обнаружено, 2202,60.
Пример 69
Получение Ac-2,2-Aic-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
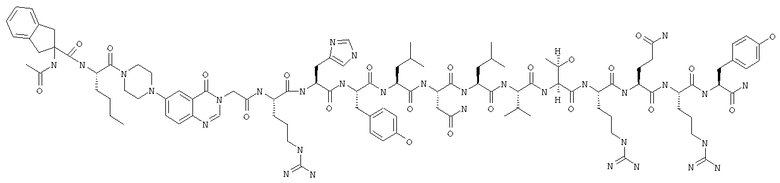
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали (2,2-Aic) в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 103 мг (19%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C104H152N32O22 2202,57, обнаружено 2202,30.
Пример 70
Получение Ас-Ach-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEO ID NO:5)
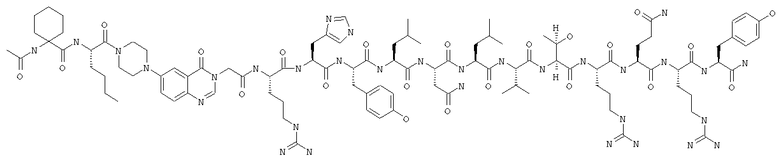
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Ach в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 81 мг (15%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C101H154N32O22 2168,55, обнаружено 2168,10.
Пример 71
Получение Ас-Aср-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
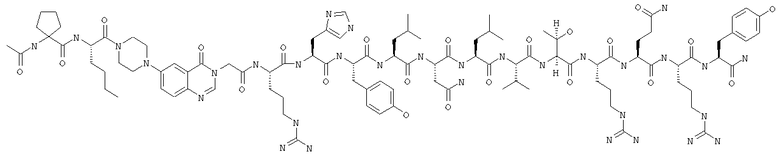
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу (встраивали Аср в положение 3 последовательности) и очищали согласно процедуре, описанной в примере 3, получая 95 мг (18%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/е: рассчит. для C100H152N32O22 2154,53, обнаружено 2154,30.
Пример 72
Получение H-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:5)
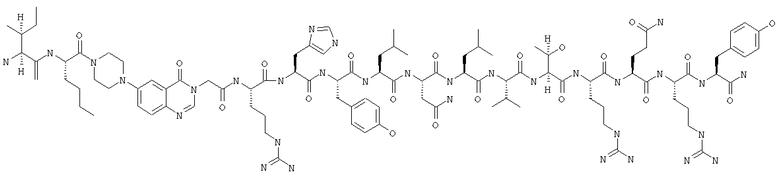
Fmoc-линкер-ВНА-смолу (450 мг, 0,25 ммоля), полученную согласно методу, описанному в примере 1, подвергали твердофазному синтезу и очищали согласно процедуре, описанной в примере 3, получая 80 мг (15%) аморфного порошка белого цвета. (ES)+-ЖХ/МС m/e: рассчит. для C98H152N32O21 2114,51, обнаружено 2113,80.
Пример 73
Получение ПЭГ (10000)-Ile-Nle-Pqa-Arg-His-Tyr-Leu-Asn-Leu-Val-Thr-Arg-GIn-Arg-Tyr-NH2 (SEO ID NO:5)
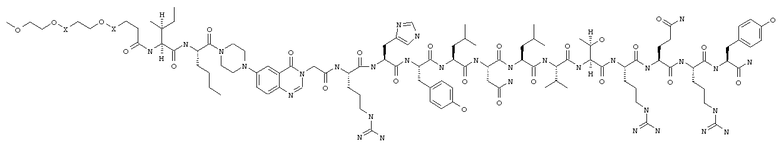
В указанной выше структурной формуле группа -Х-СН2-СН2-О-Х- согласно общепринятой номенклатуре означает повторяющиеся гликольные звенья полиэтиленгликольного фрагмента, т.е. группу -(СН2-СН2-O)n-, где «n» выбирают в зависимости от требуемой массы требуемого полиэтиленгликольного звена. Взвешивали 15 мг пептида, указанного в примере 72, и растворяли в 50 мМ боратном буфере, pH 7,4. Взвешивали 107 мг ПЭГ-SPA-NHS с молекулярной массой 10 кДа (фирма Nektar) для получения молярного соотношения ПЭГ : пептид 2:1 и добавляли к растворенному пептиду. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем ее разводили в 10 раз 20 мМ NaOAc-буфером, pH 4,5, и очищали катионообменной хроматографией на S-Сефарозе (фирма Amersham). На фиг.1 представлена ЖХВР-хроматограмма 10 кДа-ПЭГ-РYY-пептида. Реакционный выход 10 кДа-пептида составил 67,8%.
Монопэгилированный PYY-пептид элюировали с использованием градиента NaCl. Как правило, элюция монопэгилированного пептида происходила при концентрации NaCl 125 мМ. Элюированный ПЭГ-PYY-подобный пептид концентрировали в устройстве для ультрафильтрации типа Amicon с использованием мембраны с частотой отсечки ММ 10 кДа. Затем его подвергали диафильтрации однократно в противотоке 10-кратного избытка ЗФР.
Концентрированный пептид, указанный в примере 73, анализировали, оценивали и хранили при -20°С. На фиг.2 представлена ЖХВР-хроматограмма очищенного 10 кДа-ПЭГ-РYY-пептида. Установлено, что чистота 30 кДа-пептида составляла 97,6%. А на фиг.3 представлено графическое изображение, полученное с помощью анализа методом MALDI-TOF, 30 кДа-ПЭГ-PYY-пептида, который осуществляли для подтверждения молекулярной массы.
Пример 74
Получение ПЭГ (30000)-Ile-Nle-Pqa-Arg-His-Tvr-Leu-Asn-Leu-Val-Thr-Arg-GIn-Arg-Tyr-NH2 (SEO ID NO:5)
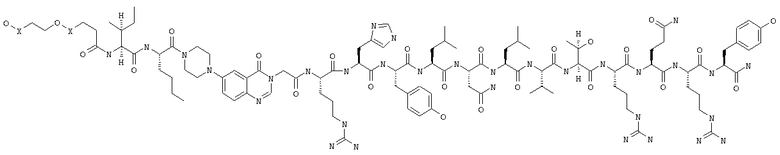
В указанной выше структурной формуле группа -Х-СН2-СН2-О-Х- согласно общепринятой номенклатуре означает повторяющиеся гликольные звенья полиэтиленгликольного фрагмента, т.е. группу -(СН2-СН2-O)n-. Где «n» выбирают в зависимости от требуемой массы требуемого полиэтиленгликольного звена. Взвешивали 15 мг пептида, указанного в примере 72, и растворяли в 50 мМ боратном буфере, pH 7,4. Взвешивали 244 мг ПЭГ-SPA-NHS с молекулярной массой 30 кДа для получения молярного соотношения ПЭГ : пептид 2:1 и добавляли к растворенному пептиду. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч (фиг 4.), а затем ее разводили в 10 раз 20 мМ NaOAc-буфером, pH 4,5, и очищали катионообменной хроматографией на S-Сефарозе (фирма Amersham). На фиг.4 представлена ЖХВР-хроматограмма 30 кДа-ПЭГ-PYY-пептида. Реакционный выход 30 кДа-пептида составил 88,3%.
Монопэгилированный PYY-пептид элюировали с использованием градиента NaCl. Как правило, элюция монопэгилированного пептида происходила при концентрации NaCl 125 мМ. Элюированный ПЭГ-PYY-подобный пептид концентрировали в устройстве для ультрафильтрации типа Amicon с использованием мембраны с частотой отсечки ММ 10 кДа. Затем его подвергали диафильтрации (сочетание диализа и фильтрации) однократно в противотоке 10-кратного избытка ЗФР. Концентрированный пептид анализировали, оценивали и хранили при -20°С. На фиг.5 представлена ЖХВР-хроматограмма очищенного 30 кДа-ПЭГ-RYY-пептида. Установлено, что чистота 30 кДа-пептида составляла 98,4%. А на фиг.6 представлено графическое изображение, полученное с помощью анализа методом MALDI-TOF, 10 кДа-ПЭГ-РYY-пептида, который осуществляли для подтверждения молекулярной массы.
Пример 75
Стабильность в плазме соединения, указанного в примере 49
Оценивали стабильность пептида, указанного в примере 49, в человеческой и мышиной плазме. В этом примере 140 мкг пептида, указанного в примере 49, инкубировали с 300 мкл либо человеческой, либо мышиной плазмы в течение 0, 40, 90 и 150 мин при 37,5°С. После POSR-инкубации каждый образец разводили в 50 раз 0,1%-ной уксусной кислотой в воде. Образцы после разведения анализировали с помощью ЖХ/УФ/МС и обнаружена стабильность в них соединения.
Пример 76
Стабильность в плазме соединения, указанного в примере 32
Оценивали стабильность пептида, указанного в примере 32, в человеческой и мышиной плазме. В этом примере 51 мкг пептида, указанного в примере 32, инкубировали с 300 мкл либо человеческой, либо мышиной плазмы в течение 0, 40, 90 и 150 мин при 37,5°С. После POSR-инкубации каждый образец разводили в 50 раз 0,1%-ной уксусной кислотой в воде. Образцы после разведения анализировали с помощью ЖХ/УФ/МС и обнаружена стабильность в них соединения.
Пример 77
Анализ активности в качестве агониста цАМФ
В этом примере использовали следующие материалы: 384-луночный планшет; набор для скрининга цАМФ типа Tropix; систему для цАМФ-ELISA (фирма Applied Biosystems, каталожный номер Т1505; CS 20000); форсколин (фирма Calbiochem, каталожный номер 344270); клетки: HEK293/hNPY2R; питательная среда: модифицированная по методу Дульбекко среда Игла (D-МЕМ, фирма Gibco); 10% фетальной бычьей сыворотки (ФБС, фирма Gibco), инактивированной тепловой обработкой; 1% пенициллина/стрептомицина (Pen 10000 ед./мл: Strep 10000 мг/мл, фирма Gibco); 500 мг/мл G418 (генетицин, фирма Gibco, каталожный номер 11811-031); и среда для чашек Петри: DMEM/F12 w/o (эмульсия типа «вода в масле»), феноловый красный (фирма Gibco); 10% ФБС (фирма Gibco, каталожный номер 10082-147), инактивированной нагреванием; 1% пенициллина/стрептомицина (фирма Gibco, каталожный номер 15140-122); 500 мг/мл G418 (генетицин, фирма Gibco, каталожный номер 11811-031).
В первый день среду отбрасывали и клеточные монослои промывали, используя 10 мл ЗФР на колбу (типа Т225). После декантирования ЗФР применяли 5 мл Версена (VERSENE) (фирма Gibco, каталожный номер 1504006) для отделения клеток (5 мин, 37°С). Из колбы осторожно выпускали жидкость и клеточную суспензию объединяли. Каждую колбу промывали 10 мл среды для чашек Петри и центрифугировали при 1000 об/мин в течение 5 мин. Суспензию объединяли и определяли ее количество.
Суспензию повторно суспендировали в среде для чашек Петри при плотности 2,0×105 клеток/мл среды HEK293/hNPY2R. 50 мкл клеток (HEK293/hNPY2R - 10000 клеток/лунку) переносили в 384-луночный планшет с помощью диспенсера типа Multi-drop. Планшеты инкубировали в течение ночи при 37°С.
На второй день проверяли, достигла ли конфлюэнтность клеток 75-85%. Давали дойти температуре сред и реагентов до комнатной температуры. Перед приготовлением разведении маточному раствору стимулирующего соединения в диметилсульфоксиде (ДМСО, фирма Sigma, каталожный номер D2650) давали нагреться до 32°С в течение 5-10 мин. Разведения готовили в среде DMEM/F12, дополненной 0,5 мМ 3-изобутил-1-метилксантином (ИБМК, фирма Calbiochem, каталожный номер 410957) и 0,5 мг/мл БСА. Конечная концентрация ДМСО в стимулирующей среде составляла 1,1%, при этом концентрация форсколина составляла 5 мкМ.
Среду для клеток удаляли путем осторожного переворачивания планшета с клетками на бумажное полотенце. В каждую лунку вносили по 50 мкл стимулирующей среды (каждую концентрацию анализировали в 4 повторностях). Планшеты инкубировали при комнатной температуре в течение 30 мин и клетки анализировали с помощью микроскопа для оценки токсичности для них изучаемого соединения.
Через 30 мин после обработки стимулирующие среды отбрасывали и добавляли 50 мкл/лунку буфера для лизиса (входящего в набор типа Tropix). Планшеты инкубировали в течение 45 мин при 37°С.
20 мкл лизата переносили из планшетов, в которых осуществляли стимуляцию, в предварительно сенсибилизированные антителом планшеты (384-луночные), входящие в набор типа Tropix. Добавляли 10 мкл конъюгата с щелочной фосфатазой (ЩФ) и 20 мкл антитела к цАМФ. Планшеты инкубировали при комнатной температуре при встряхивании в течение 1 ч. Затем планшеты пятикратного промывали буфером для промывки, используя по 70 мкл на лунку для каждой промывки. Сливали досуха среду с планшетов. Добавляли 30 мкл /лунку раствора субстрата/энхансера CSPD/Saphire-II RTU и инкубировали в течение 45 мин при КТ (при встряхивании). С помощью люминометра (VICTOR-V) оценивали сигнал в течение 1 с/лунку.
Пример 78
Анализ снижения потребления корма in vivo
В этом примере соединения, указанные в примерах 5, 44, 73 и 74, вводили четырем группам мышей в четырех различных экспериментах для оценки воздействия на потребление корма. В экспериментах использовали самцов мышей линии C57BL/6J или самцов мышей линии DIO (обусловленное диетой ожирение) по 8 мышей на экспериментальную группу. Мышей содержали при регулярном световом цикле (свет включали в 6 ч утра и выключали в 6 ч вечера (6 AM - ON; 6 РМ - OFF)). Мышам не давали корм в течение 24 ч перед опытом, при этом они имели свободный доступ к воде. На время опыта каждую мышь помещали в индивидуальный садок.
Соединения, указанные в примерах 5 и 44, вводили внутрибрюшинно, а соединения, указанные в примерах 73 и 74, вводили подкожно. Потребление корма оценивали через 1, 2, 4, 6 и 24 ч после обработки, и полученные результаты представлены на фиг.7-10. Для соединений, указанных в примерах 73 и 74, потребление корма оценивали в течение более длительных интервалов времени, и эти результаты представлены на фиг.9 и 10. На каждом чертеже представлены данные о кумулятивном потреблении корма в указанные интервалы времени для каждой мыши. Для каждого интервала времени определяли среднее потребление корма и рассчитывали процент изменения по сравнению с мышами, которым давали корм с наполнителем. Данные анализировали с помощью двустороннего t-критерия Стьюдента. Из фиг.7-10 видно, что соединения, предлагаемые в настоящем изобретении, эффективно снижали потребление корма по сравнению с контролями.
Пример 79
Анализ потока Са
Клетки линии Hek-293 стабильно трансфектировали химерой G-протеина Gaqi9 и геном, обусловливающим устойчивость к гигромицину-В, и, кроме того, трансфектировали человеческим рецептором NPY2 и предназначенным для селекции антибиотиком G418. После селекции как гигромицином, так и G418 оценивали ответ индивидуальных клонов на PYY. Трансфектированные клетки культивировали в среде DMEM, дополненной 10% фетальной бычьей сыворотки, 50 мкг/мл гигромицина-В, 2 мМ глутамином, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 250 мкг/мл G418. Клетки собирали с помощью трипсина-ЭДТК и осуществляли их подсчет с помощью реагента ViaCount. Объем клеточной суспензии доводили до
4,8×105 клеток/мл с помощью полной питательной среды. Аликвоты по 25 мкл вносили в 384-луночные черные/прозрачные микропланшеты, сенсибилизированные поли-В-лизином (фирма Falcon) и микропланшеты выдерживали в течение ночи при 37°С в СО2-инкубаторе.
Буфер для загрузки (набор для анализа типа Calcium-3, фирма Molecular Devices) приготавливали путем растворения содержимого одного пузырька (набор Express) в 1000 мл сбалансированного солевого раствора Хэнкса, содержащего 20 мМ HEPES и 5 мМ пробенецид. В лунки планшета с клетками вносили по 25 мкл разведенного красителя и затем планшеты инкубировали в течение 1 ч при 37°С.
Во время осуществления инкубации готовили раствор тестируемых соединений в концентрации, превышающей в 3,5 раза требуемую концентрацию, в HBSS (20 мМ HEPES)/0,05% БСА/1% ДМСО и переносили в 384-луночный планшет для применения в анализе потока Са (FLIPR).
После инкубации как планшеты с клетками, так и планшеты с соединением переносили в устройство для осуществления FLIPR и 20 мкл разбавленных соединений переносили в планшеты с клетками с помощью устройства для осуществления FLIPR. В процессе анализа определяли флуоресцентность одновременно всех 384 лунок планшета с клетками каждые 1,5 с. Для построения стабильной базисной линии использовали 5 результатов и затем по 20 мкл образца быстро (со скоростью 30 мкл/с) и одновременно добавляли в каждую лунку планшета с клетками. Мониторинг флуоресценции осуществляли до, в процессе и после добавления образца всего в течение 100 с. Определяли ответы (увеличение пика флуоресценции) в каждой лунке после добавления. Начальный уровень флуоресценции в каждой лунке перед стимуляцией лигандом принимали за нулевой базисный уровень для данной лунки. Ответы выражали в виде процента от максимального ответа положительного контроля.
Соединения, предлагаемые в настоящем изобретении, обладали избирательной активностью в отношении рецептора нейропептида-2 in vitro, что продемонстрировано при анализе цАМФ (пример 77) и анализе потока Са (FLIPR) (пример 78). Обобщение полученных in vitro результатов в виде значений IС50 и ЕС50 для соединений, указанных в примерах 3-74, проиллюстрировано в таблице.
ЕС50 (нМ)
IC50 (нМ)
EC50 (нМ)
ЕС50 (нМ)
Должно быть очевидно, что изобретение не ограничено конкретными описанными выше вариантами осуществления, поскольку можно получать модификации конкретных вариантов осуществления изобретения, которые все еще подпадают под объем прилагаемой формулы изобретения.
Пример А
Филмтаблетки, содержащие следующие ингредиенты, можно получать общепринятым методом:
Действующее вещество просеивали и смешивали с микрокристаллической целлюлозой и смесь гранулировали с раствором поливинилпирролидона в воде. Гранулы смешивали с натрийгликолятом крахмала и стеаратом магния и прессовали с получением ядер массой 120 или 350 мг соответственно. На ядра наносили лаковое покрытие с использованием водного раствора/суспензии вышеуказанного пленочного покрытия.
Пример Б
Капсулы, содержащие следующие ингредиенты, можно получать общепринятым методом:
Компоненты просеивали и смешивали, заполняли ими капсулы размера 2.
Пример В
Растворы для инъекции могут иметь следующий состав:
Действующее вещество растворяли в смеси полиэтиленгликоля 400 и части воды для инъекций. Значение рН доводили до 5,0 с помощью уксусной кислоты. Объем доводили до 1,0 мл, добавляя оставшееся количество воды. Раствор фильтровали, заполняли им флаконы с помощью соответствующего устройства и стерилизовали.
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, можно получать общепринятым методом:
Содержимое капсулы:
Желатиновая капсула:
Действующее вещество растворяли в теплом расплаве других ингредиентов и смесью заполняли мягкие желатиновые капсулы соответствующего размера. Заполненные мягкие желатиновые капсулы обрабатывали согласно общепринятым методам.
Пример Д
Саше, содержащие следующие ингредиенты, можно получать
общепринятым методом:
Действующее вещество смешивали с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой и гранулировали со смесью поливинилпирролидона и воды. Гранулы смешивали со стеаратом магния и корригентами и заполняли ими саше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ С ВЫСОКОЙ СТЕПЕНЬЮ ПРОНИКНОВЕНИЯ НА ОСНОВЕ ПЕПТИДОВ И РОДСТВЕННЫХ ПЕПТИДАМ СОЕДИНЕНИЙ | 2010 |
|
RU2627065C2 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2095368C1 |
| ПЕПТИДНЫЕ АНАЛОГИ GH-RH С АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ, СПОСОБ СНИЖЕНИЯ УРОВНЯ GH, СПОСОБ СНИЖЕНИЯ УРОВНЯ IGF-I И IGF-II, ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ РОСТА РАКОВЫХ КЛЕТОК, ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2004 |
|
RU2335506C2 |
| ЛИНКЕРЫ НА ОСНОВЕ СУЛЬФОМАЛЕИМИДА И СООТВЕТСТВУЮЩИЕ КОНЪЮГАТЫ | 2019 |
|
RU2815199C2 |
| АГОНИСТЫ РЕЦЕПТОРА НЕЙРОПЕПТИДА-2 | 2006 |
|
RU2430108C2 |
| ГЛИКОЗИЛИРОВАННЫЙ ПЕПТИД GLP-1 | 2009 |
|
RU2543157C2 |
| ПЕПТИД GLP-1 С ПРИСОЕДИНЕННОЙ ОЛИГОСАХАРИДНОЙ ЦЕПЬЮ | 2008 |
|
RU2539829C2 |
| ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ С ВЫСОКОЙ СТЕПЕНЬЮ ПРОНИКНОВЕНИЯ НА ОСНОВЕ ПЕПТИДОВ И РОДСТВЕННЫХ ПЕПТИДАМ СОЕДИНЕНИЙ | 2010 |
|
RU2767051C2 |
| Способ получения пептидов | 1985 |
|
SU1530097A3 |
| Способ получения пептидов | 1984 |
|
SU1435157A3 |




















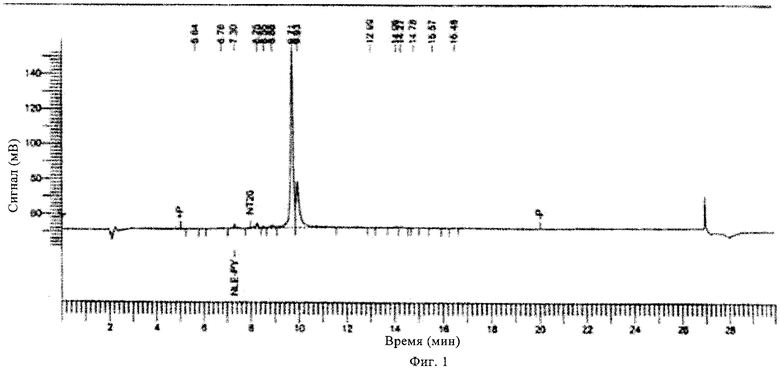
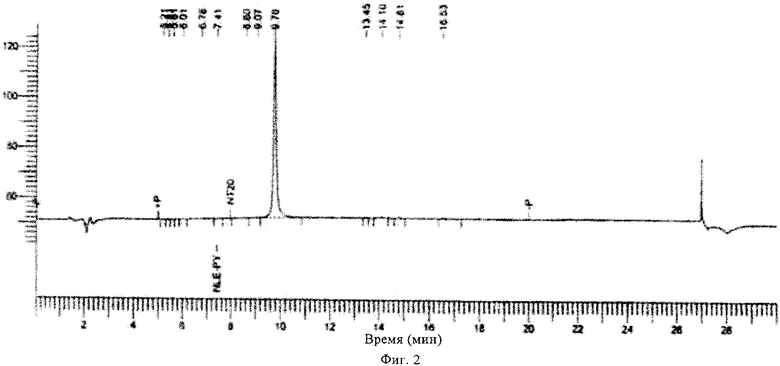
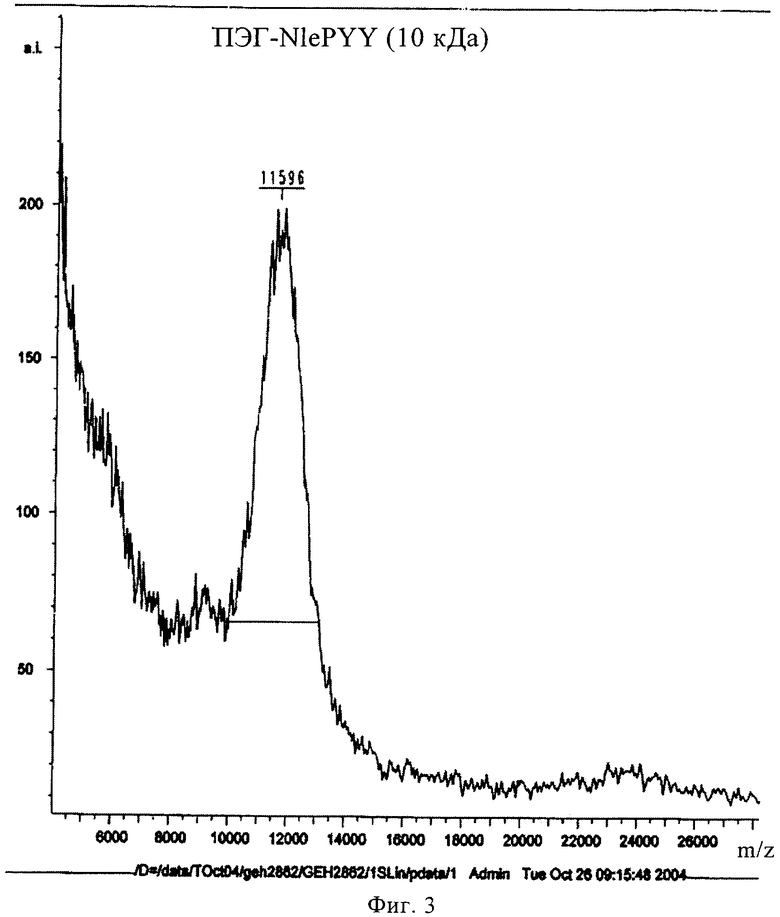

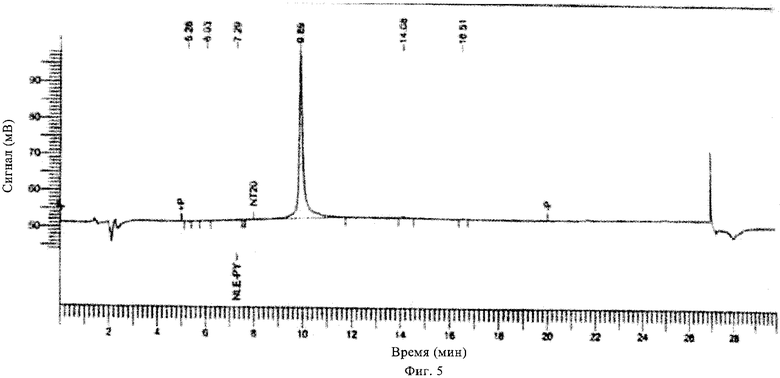
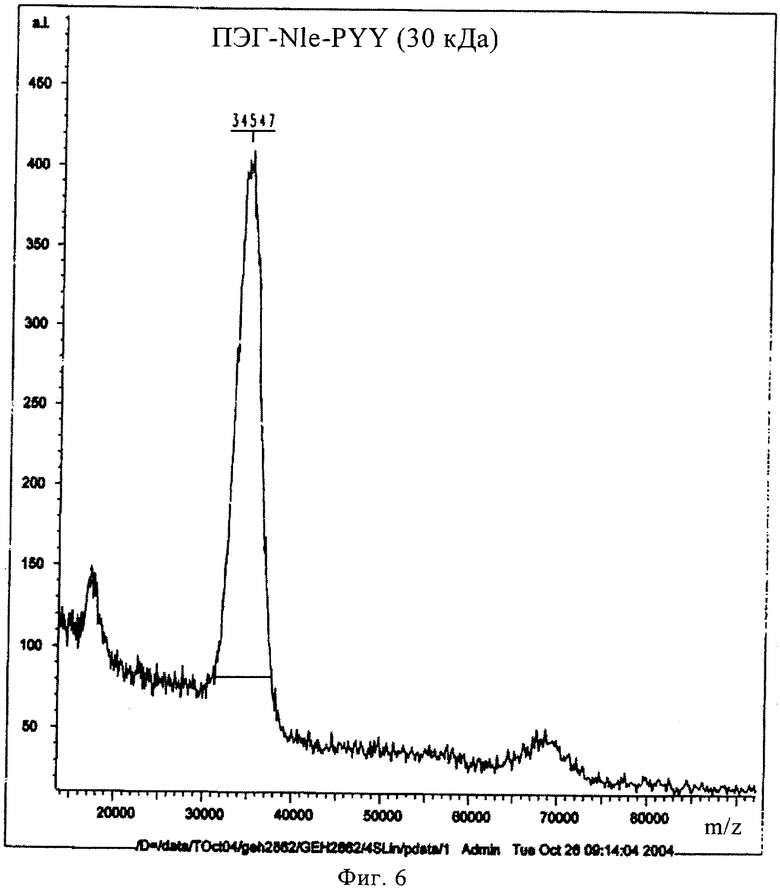
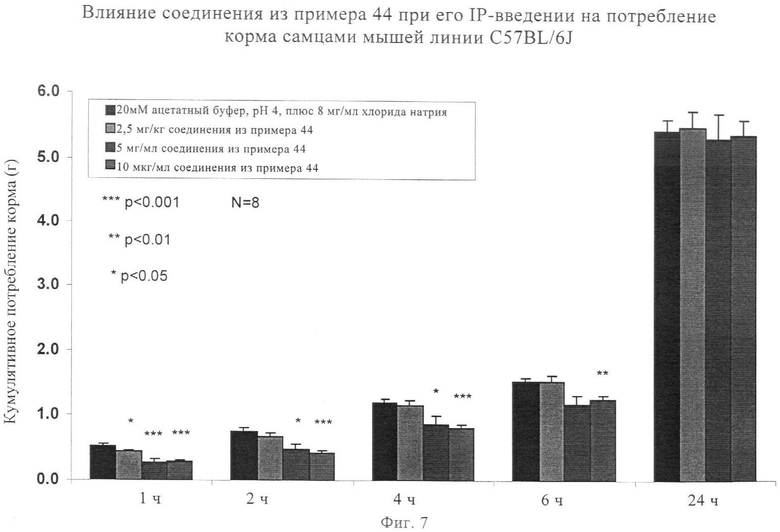
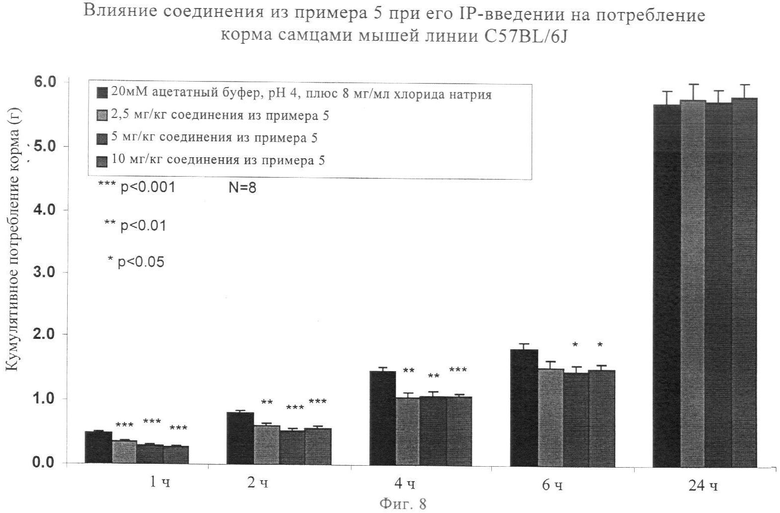

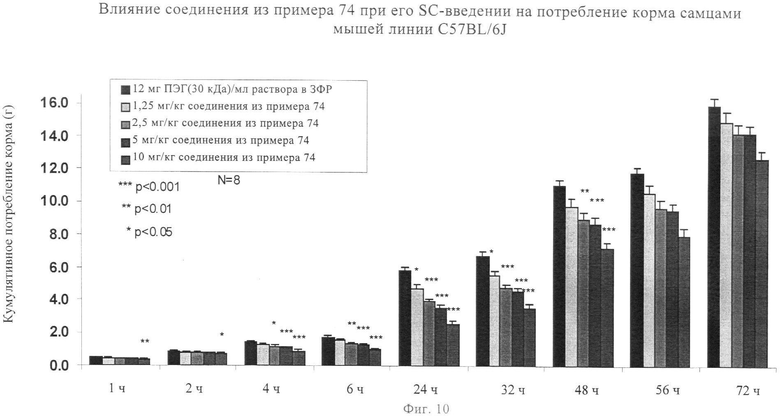
Изобретение относится к агонистам рецептора нейропептида-2 формулы (I):
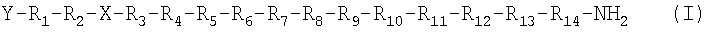
а также к их фармацевтически приемлемым солям, производным и фрагментам, в которых заместители имеют значения, указанные в описании. Эти соединения и содержащие их фармацевтические композиции могут быть предназначены для лечения заболеваний, которые модулируются агонистами нейропептида-2, прежде всего ожирения. 4 н. и 9 з.п. ф-лы, 10 ил., 1 табл.
1. Агонист рецептора нейропептида-2 формулы (I):
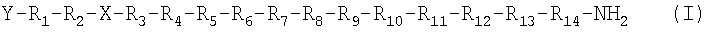 ,
,
в которой
Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa) или N-(5-O-карбоксиметил)серотонин (Cms),
Y обозначает Н, ацетил, поли(этилен)гликольную группу размером 10 или 30 кДа,
R1 обозначает Ile, Ala, (D)Ile, N-метилIlе, Aib, 1-1Aic, 2-2Aic, Ach или Аср,
R2 обозначает Lys, Ala, (D)Lys, NMelys, Nle или (Lys-Gly),
R3 обозначает Arg, Ala, (D)Arg, N-метилArg, Phe, 3,4,5-трифторPhe или 2,3,4,5,6-пентафторPhe,
R4 обозначает His, Ala, (D)His, N-метилHis, 4-МеОАрс, 3-Pal или 4-Pal,
R5 обозначает Tyr, Ala, (D)Tyr, N-метилTyr, Trp, Tic, Bip, Dip, (1)Nal, (2)Nal, 3,4,5-трифторРhе или 2,3,4,5,6-пентафторPhe,
R6 обозначает Leu, Ala, (D)Leu или N-метилLeu,
R7 обозначает Asn, Ala или (D)Asn,
R8 обозначает Leu, Ala, (D)Leu или N-метилLeu,
R9 обозначает Val, Ala, (D)Val или N-метилVal,
R10 обозначает Thr, Ala или N-метилNhr,
R11 обозначает Arg, (D)Arg или N-метилArg,
R12 обозначает Gin или Ala,
R13 обозначает Arg, (D)Arg или N-метилArg и
R14 обозначает Tyr, (D)Tyr или N-метилTyr,
или его фармацевтически приемлемая соль.
2. Агонист рецептора нейропептида-2 по п.1, в котором Х обозначает Pqa.
3. Агонист рецептора нейропептида-2 по п.1, в котором Х обозначает Cms.
4. Агонист рецептора нейропептида-2 формулы (II):
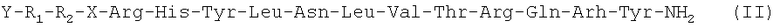 ,
,
в которой:
Х обозначает группу, выбранную из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa) или N-(5-O-карбоксиметил)серотонин (Cms),
Y обозначает Н или ацетил,
R1 обозначает Ilе, Ala, (D)Ile, N-метилIlе, Aib, 1-1Aic, 2-2Aic, Ach или Аср и
R2 обозначает Lys, Ala, (D)Lys, N-Melys, Nle или (Lys-Gly), или его фармацевтически приемлемая соль.
5. Агонист рецептора нейропептида-2 по п.4, в котором Х обозначает Pqa.
6. Агонист рецептора нейропептида-2 по п.4, в котором Х обозначает Cms.
7. Агонист рецептора нейропептида-2 формулы (III):
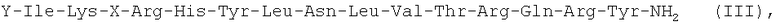
в которой
Х выбран из группы, включающей N-пиперазин-1-ил-4(3Н)-хинозолинон-3-уксусную кислоту (Pqa) или N-(5-O-карбоксиметил)серотонин (Cms),
Y обозначает Н или ацетил,
или его фармацевтически приемлемая соль.
8. Агонист рецептора нейропептида-2 по п.7, в котором Х обозначает Pqa.
9. Агонист рецептора нейропептида-2 по п.7, в котором Х обозначает Cms.
10. Агонист рецептора нейропептида-2 по одному из пп.1-9, выбранный из группы, включающей
IK Pqa RHYLNLVTRQRY,
Ac IK Pqa RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRARY,
IK-Pqa-RHYLNLVARQRY,
IK-Pqa-RHYLNLATRQRY,
IK-Pqa- RHYLNAVTRQRY,
IK-Pqa-RHYLALVTRQRY,
IK-Pqa-RHYANLVTRQRY,
IK-Pqa-RHALNLVTRQRY,
IK Pqa RAYLNLVTRQRY,
IK-Pqa-AHYLNLVTRQRY,
lA-Pqa-RHYLNLVTRQRY,
Ac-IA-Pqa RHYLNLVTRQRY,
AK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(D)Y,
IK-Pqa-RHYLNLVTRQ(D)RY,
IK-Pqa-RHYLNLVT(D)RQRY,
IK-Pqa-RHYLNL(D)VTRQRY,
IK-Pqa-RHYLN(D)LVTRQRY,
IK-Pqa-RHYL(D)NLVTRQRY,
IK-Pqa-RHY(D)LNLVTRQRY,
IK-Pqa-RH(D)YLNLVTRQRY,
IK-Pqa-R(D)HYLNLVTRQRY,
IK-Pqa-(D)RHYLNLVTRQRY,
I(D)K-Pqa RHYLNLVTRQRY,
(D)IK-Pqa RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(N-метил)Y,
IK-Pqa-RHYLNLVTRQ(N-метил)RY,
IK-Pqa-RHYLNLVT(N-метил)RQRY,
IK-Pqa-RHYLNLV(N-метил)TRQRY,
IK-Pqa-RHYLNL(N-метил)VTRQRY,
IK-Pqa-RHYLN(N-метил)LVTRQRY,
IK-Pqa-RHY(N-метил)LNLVTRQRY,
IK-Pqa-RH(N-метил)YLNLVTRQRY,
IK-Pqa-R(N-метил)HYLNLVTRQRY,
IK-Pqa (N-метил)RHYLNLVTRQRY,
I(N-мeтил)K-Pqa-RHYLNLVTRQRY,
(N-метил)IK-Pqa-RHYLNLVTRQRY,
INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-FHYLNLVTRQRY,
IK-Pqa-RHWLNLVTRQRY,
IK-Pqa-AHWLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQR(D)Y,
Ac-INle-Pqa-RHYLNLVTRQR(NMeTM)Y,
IK-Cms-RHYLNLVTRQRY,
IKG-Cms-RHYLNLVTRQRY,
Ac-INle-Pqa-RHTicLNLVTRQRY,
Ac-INle-Pqa-RHBipLNLVTRQRY,
Ac-INle-Pqa-RHDipLNLVTRQRY,
Ac-INle-Pqa-RH(1)NalLNLVTRQRY,
Ac-INle-Pqa-RH(2)NalLNLVTRQRY,
Ac-INle-Pqa-RH(3,4,5-тpифтopPhe)LNLVTRQRY,
Ac-INle-Pqa-RH(2,3,4,5,6-пентафторPhe)LNLVTRQRY,
Ac-INle-Pqa-R(4-MeOApc)YLNLVTRQRY,
Ac-INle-Pqa-R(3-Pal)YLNLVTRQRY,
Ac-INle-Pqa-R(4-Pal)YLNLVTRQRY,
Ac-INle-Pqa-(3,4,5-тpифтopPhe)HYLNLVTRQRY,
Ас-INle-Pqa-(2,3,4,5,6-пентафторРhе)HYLNLVTRQRY,
Ac-Aib-Nle-Pqa-RHYLNLVTRQRT,
Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac1-1-Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac-2-2Aic-Nle-Pqa-RHYLNLVTRQRT,
Ac-Ach-Nle-Pqa-RHYLNLVTRQRT,
Ac-Acp-Nle-Pqa- RHYLNLVTRQRT,
H-INle-Pqa-RHYLNLVTRQRY,
(ПЭГ-10000) INle-Pqa-RHYLNLVTRQRY и
(ПЭГ-30000) INle-Pqa-RHYLNLVTRQRY.
11. Агонист рецептора нейропептида-2 по одному из пп.1-10, выбранный из группы, включающей
IK-Pqa-RHYLNLVTRQRY,
Ac-IK-Pqa-RHYLNLVTRQRY,
IK-Pqa-RHYLNLVTRQR(N-метил)Y,
IK-Pqa-RHYLNLVTRQ(N-метил)RY,
INle-Pqa-RHYLNLVTRQRY,
Ac-INle-Pqa-RHYLNLVTRQRY и
(ПЭГ-30000)INle-Pqa-RHYLNLVTRQRY.
12. Фармацевтическая композиция, обладающая агонистической активностью в отношении рецептора нейропептида-2, содержащая эффективное количество соединения по одному из пп.1-11 и фармацевтически приемлемый носитель и/или адъювант.
13. Соединение по одному из пп.1-11, предназначенные для применения в качестве терапевтически активных субстанций для лечения заболеваний, которые модулируются агонистами нейропептида-2, прежде всего, ожирения.
| ПРОИЗВОДНЫЕ АМИНОВ ИЛИ АМИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ АНТАГОНИЗИРОВАНИЯ РЕЦЕПТОРА Y5 НЕЙРОПЕПТИДА NPY | 2000 |
|
RU2228927C2 |
| WO 9422467 A1, 13.10.1994 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| BECK A; ET AL, "HIGHLY POTENT AND SMALL NEUROPEPTIDE Y AGONIST OBTAINED BY LINKING NPY 1-4 VIA SPASER TO ALPHA-HELICAL NPY | |||
Авторы
Даты
2010-03-10—Публикация
2006-01-11—Подача