Изобретение относится к области медицины и касается многокомпонентного фармацевтического состава, обладающего противотуберкулезной активностью и пригодного для лечения туберкулеза, вызванного изониазид-резистентными штаммами М.tuberculosis.
Изменение социально-экономических условий и экологической обстановки в России привело в последние 10-15 лет к росту заболеваемости туберкулезом, которая в отдельных районах начинает принимать характер эпидемии.
Фтизиатры отмечают не только рост заболеваемости, но и полирезистентность (устойчивость) возбудителя к однокомпонентным туберкулостатическим лекарственным средствам.
Из уровня техники известны основные химиотерапевтические средства для лечения различных форм туберкулеза - производные изоникотиновой кислоты, прежде всего изониазид, а также антибиотики широкого спектра действия: стрептомицин, канамицин, рифампицин, обладающие высокой бактериостатической активностью в отношении микобактерий туберкулеза (Справочник Видаль Лекарственные препараты в России. Изд. 12-е переработанное, исправленное и дополненное. Астра Фарм Сервис, 2006 г., стр.1497, 1551, 1554). Благодаря высокой бактериостатической активности основным препаратом для лечения туберкулеза является изониазид. Особенностью терапии туберкулеза в настоящее время является одновременное назначение нескольких туберкулостатических лекарственных средств различных химических групп и механизмов действия. Достижение стойкого лечебного эффекта обеспечивается длительным курсом химиотерапии, который составляет от 6 до 12 месяцев; профилактические курсы проводят 2 раза в год продолжительностью 2-3 месяца (Фтизиатрия. Национальное руководство под ред. М.И.Прельмана, М.: ГЭОТАР-Медиа, 2007, стр.414-426). В связи с этим для обеспечения комфортности лечения больных целесообразно создание комплексных многокомпонентных лекарственных средств.
Известны аналоги изобретения капсулы рифампицина, таблетки изониазида, таблетки пиразинамида (Справочник Видаль Лекарственные препараты в России. Изд. 12-е переработанное, исправленное и дополненное. Астра Фарм Сервис, 2006 г., стр.1497, 1551, 1554).
Прототипом изобретения являются таблетки изониазида.
Недостатками прототипа являются высокая токсичность, быстрая элиминация из организма, а также неудобство для применения больными, которое заключается в многократном ежедневном приеме нескольких таблеток в течение нескольких месяцев.
В патенте РФ №2146130, 2000 г. описана композиция для лечения туберкулеза, содержащая 0,1 г изониазида и 0,01 г вспомогательных веществ на одну таблетку. В качестве вспомогательных веществ в таблетки включены крахмал картофельный или кукурузный, вода. В описании изобретения приведен следующий пример композиции:
изониазида - 75,0
крахмальный клейстер 10% - 11,5
крахмал картофельный - 5,8
кислота стеариновая - 0,4
Субстанции изониазида, пиразинамида и рифампицина не обладают способностью к прямому таблетированию (Патент РФ №2146130, 2000 г.) и поэтому данная композиция является нестабильной. Для создания стабильного, удовлетворяющего фармакопейным требованиям лекарственного препарата необходимо использовать вспомогательные вещества, индифферентные для организма в количествах, обеспечивающих оптимальные биофармацевтические характеристики лекарственных веществ.
Технической задачей предлагаемого изобретения является создание отечественного многокомпонентного состава для лечения туберкулеза, обладающего длительным сроком годности, высокой туберкулостатической активностью по отношению к микобактерии туберкулеза, устойчивых к изониазиду, а так же пониженной токсичностью.
Данная техническая задача достигается за счет синергизма действующих веществ, введенных в композицию ингредиентов в гранулах на 100 г:
А также путем введения в качестве вспомогательных веществ пектина и поливинилпирролидона, которые обеспечат пролонгирование действия лекарственных веществ и понизят гепатотоксичность изониазида (Л.А.Саджая. Биохимическое обоснование путей снижения гепатотоксичности изониазида на основе сочетания с полисахаридами. Дис. канд. фармац. наук. - Пятигорск, 1999. - 120 с.).
В заявляемый состав входят изониазид, пиразинамид, рифампицин и вспомогательные вещества, взятые в количестве от 10 до 40% от общей массы. В качестве вспомогательных веществ используют пектин в количестве от 10 до 30% от массы действующих веществ. Поливинилпирролидон вводится в количестве от 10 до 35% от массы действующего вещества, сахар молочный вводится в количестве от 10 до 30%. Фармацевтический состав выполнен в виде гранул. Состав соответствует требованиям, предъявляемым к фармацевтическим средствам, и обладает повышенной стабильностью при хранении.
Пример 1
Приготовление гранул осуществляется методом влажного гранулирования продавливанием с использованием технологического приема раздельного влажного гранулирования изониазида, пиразинамида и рифампицина.
Изониазид в количестве 0,500 кг предварительно измельчали в барабане шаровой мельницы вместе с шарами при оптимальной скорости в течение 5-8 минут. Измельченный продукт просеивали через сито-капрон №38 с диаметром отверстия 0,16±0,025 мм.
Для приготовления увлажнителя на весах отвешивали 0,327 кг спирта этилового 95% и 0,173 кг воды и помещали их в емкость для приготовления увлажнителя. 0,500 кг пектина просеивали через сито №2. В смеситель с сигмаобразными лопастями загружали пектин и изониазид. Смесь перемешивали 5-8 минут. Затем из емкости для приготовления увлажнителя частями добавляли увлажнитель при постоянном перемешивании.
Однородность и увлажненность массы контролировали органолептической пробой. Масса с оптимальной влажностью представляет собой влажную, компактную смесь, не прилипающую к пальцам руки, но рассыпающуюся на отдельные комочки при сдавливании. Далее осуществляли влажное гранулирование в грануляторе методом продавливания через сетку с диаметром отверстия 4 мм. Гранулят выгружали в лотки из нержавеющей стали тонким слоем 1-2 см. Сушку гранул производили в вакуум-сушильном шкафу при периодическом перемешивании при температуре 30-40°С и вакууме 0,7-0,8 кгс/см2. Продолжительность сушки 30-40 минут до остаточной влажности 2,5-3,0%.
Рифампицин в количестве 0,750 кг измельчали в барабане шаровой мельницы вместе с шарами при оптимальной скорости в течение 5-8 минут. Измельченный продукт просеивали через сито-капрон №38 с диаметром отверстия 0,16±0,025 мм. Для приготовления увлажнителя на весах отвешивали 0,327 кг спирта этилового 95% и 0,173 кг воды и помещали их в емкость для приготовления увлажнителя. В смеситель с сигмаобразными лопастями загружали 0,500 кг пектина, предварительно просеянного через сито №2, и рифампицин. Смесь перемешивали 5-8 минут. Затем из емкости для приготовления увлажнителя частями при постоянном перемешивании добавляли увлажнитель. Однородность и увлажненность массы контролировали органолептической пробой. Далее осуществляли влажное гранулирование методом продавливания через гранулятор с диаметром отверстия 4 мм. Гранулят выгружали в лотки из нержавеющей стали тонким слоем 1-2 см. Сушку гранул производили в вакуум-сушильном шкафу при периодическом перемешивании при температуре 30-40°С и вакууме 0,7-0,8 кгс/см2. Продолжительность сушки 30-40 минут до остаточной влажности 2,5-3,0%.
Пиразинамид в количестве 1,750 кг измельчали в барабане шаровой мельницы вместе с шарами при оптимальной скорости в течение 5-8 минут. Измельченный продукт просеивали через сито-капрон №38 с диаметром отверстия 0,16±0,025 мм. Для приготовления увлажнителя в смеситель отвешивали 0,175 кг поливинилпирролидона, мерником отмеривали рассчитанное количество спирта этилового 95% и перемешивали до полного растворения поливинилпирролидона. В смеситель с сигмаобразными лопастями помещали подготовленный пиразинамид и 1,500 кг измельченного сахара молочного и смешивали в течение 5-8 минут. Затем из емкости для приготовления увлажнителя при постоянном перемешивании частями добавляли раствор поливинилпирролидона. Однородность и увлажненность массы контролировали органолептической пробой. Далее осуществляли влажное гранулирование методом продавливания через гранулятор с диаметром отверстия 4 мм. Гранулят выгружали в лотки из нержавеющей стали тонким слоем 1-2 см. Сушку гранул производили в вакуум-сушильном шкафу при периодическом перемешивании при температуре 30-40°С и вакууме 0,7-0,8 кгс/см2. Продолжительность сушки 30-40 минут до остаточной влажности 2,5-3,0%.
Полученные гранулы пиразинамида по основному технологическому параметру - насыпной плотности - соответствовали гранулам рифампицина и изониазида, что послужило основанием для дальнейшего совместного сухого гранулирования.
Совместное сухое гранулирование осуществляли на универсальном грануляторе через сетку с диаметром отверстий 2 мм.
Гранулы представляли собой смесь красно-коричневых и белых частичек неправильной формы, обладающие необходимой механической прочностью, масса полученных гранул составляла 4,75 кг, выход - 95%.
Установление сроков годности гранул проводили методом «ускоренного старения» в двух температурных режимах при 40 и 60°С, а также в естественных условиях («Инструкция по проведению работ с целью определения сроков годности лекарственных средств на основе метода «ускоренного старения» при повышенной температуре И 42-2-82»). В качестве опытных образцов использовали 3 серии гранул, а также таблетки пиразинамида, капсулы рифампицина, таблетки изониазида. О стабильности ингредиентов заявляемого фармацевтического состава и прототипов судили по содержанию посторонних примесей и количественному содержанию лекарственных веществ в испытуемых образцах. Контроль качества проводили через равные промежутки времени, эквивалентные 6 месяцам хранения. Для гранул срок хранения составил 3 года, для таблеток изониазида - 4 года, для таблеток пиразинамида - 3 года, для капсул рифампицина - 2 года.
Для изучения специфической антимикробной активности патентуемого состава по отношению к изониазид-резистентным штаммам M.tuberculosis использовали метод абсолютных концентраций на среде Левенштейна-Йенсена (приказ МЗ РФ №109 от 21.03.2003 г.). Опыты проводили на трех сериях гранул в трехкратной повторности. Определение проводили на 10 штаммах M.tuberculosis, выделенных от больных. Определение специфической антимикробной активности патентуемого состава проводили в сравнении с антимикробной активностью прототипов. При этом дозы действующих лекарственных веществ в гранулах и прототипах эквивалентны.
Результаты представлены в таблице 1, где «-» показывает отсутствие роста, которое свидетельствует о чувствительности к лекарственному препарату; «+» - рост микрофлоры на среде свидетельствует об устойчивости к лекарственному препарату.
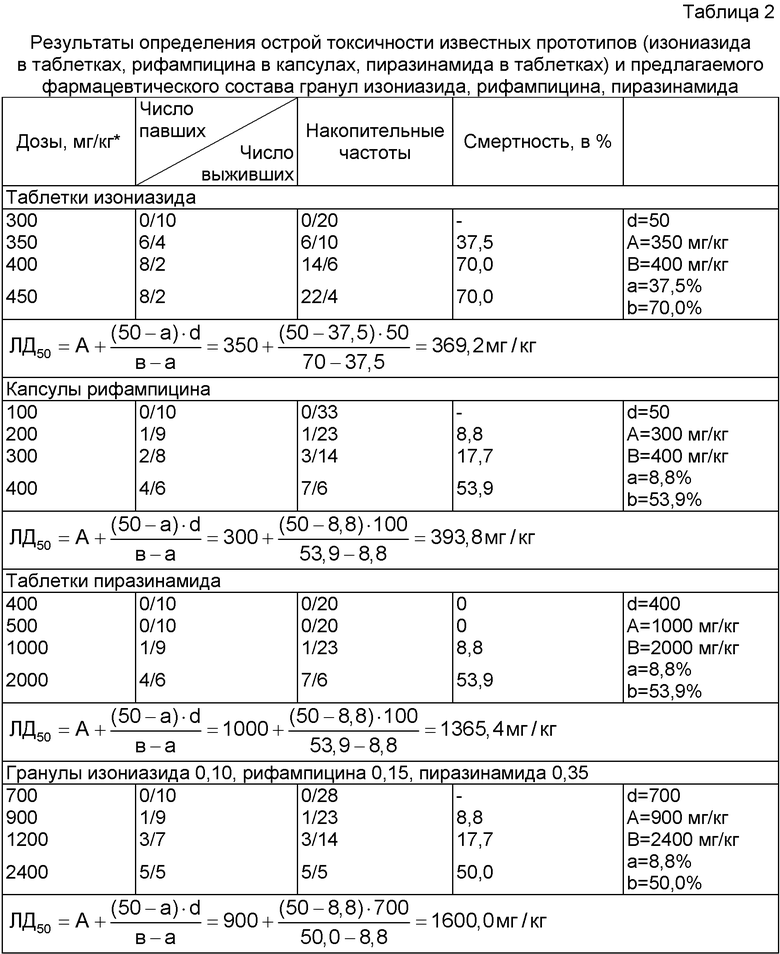
Анализ данных, представленных в таблице 1, свидетельствует о том, что патентуемый многокомпонентный фармацевтический состав в виде гранул обладает туберкулостатической активностью по отношению к 9 штаммам M.tuberculosis, устойчивых к действию изониазида, рифампицина и пиразинамида, применяемых индивидуально, следовательно, проявляемая туберкулостатическая активность обусловлена совместным воздействием на микобактерии туберкулеза трех лекарственных веществ. Определение острой токсичности гранул изониазида, рифампицина и пиразинамида, а также прототипов (таблеток изониазида, таблеток пиразинамида, капсул рифампицина) проводили на белых беспородных мышах обоего пола массой 18±2 г. Первой группе животных перорально вводили суспензию таблеток изониазида, диспергированных в 0,9% растворе натрия хлорида; второй группе - суспензию рифампицина в 0,9% растворе натрия хлорида; третьей - суспензию таблеток пиразинамида в 0,9% растворе натрия хлорида; четвертой - суспензию патентуемого многокомпонентного фармацевтического состава гранул изониазида, рифампицина и пиразинамида. Наблюдение за поведением и состоянием животных проводили в течение 10 дней. Далее рассчитывали величину ЛД50 по методике Беренса (М.Л.Беленький. Элементы количественного учета фармакологического эффекта. СПб.: Мед. лит., 1963. - 250 с). Результаты эксперимента представлены в таблице 2. В таблице приведены дозы лекарственных препаратов в пересчете на действующие вещества.
Анализ полученных данных свидетельствует о том, что токсичность лекарственных веществ, введенных в виде гранул патентуемого фармацевтического состава, в 4,3 раза, 4,1 раза и в 1,2 раза ниже таковой для прототипов, а именно изониазида в таблетках, рифампицина в капсулах, пиразинамида в таблетках.
Хроническую токсичность заявляемого фармацевтического состава, а также прототипов определяли на беспородных белых крысах с массой тела 200-250 г. Хроническую токсичность определяли на 5 группах животных по 10 крыс в каждой. Испытуемые вещества вводили перорально ежедневно в течение 6 месяцев. Первая группа крыс получала заявляемый фармацевтический состав, содержащий 40 мг/кг изониазида, 60 мг/кг рифампицина, 140 мг/кг пиразинамида, в виде суспензии в 0,9% растворе натрия хлорида. Вторая группа получала суспензию таблеточной массы таблеток изониазида в 0,9% растворе натрия хлорида в дозе 40 мг/кг в пересчете на действующее вещество. Третья группа получала суспензию рифампицина в 0,9% растворе натрия хлорида в дозе 60 мг/кг в пересчете на действующее вещество. Четвертая группа получала суспензию таблеток пиразинамида в 0,9% растворе натрия хлорида в дозе 140 мг/кг в пересчете на действующее вещество. Пятая группа - контрольная.
В процессе эксперимента наблюдали за поведением и состоянием животных.
После завершения опыта проводили биохимический и клинический анализ крови животных, а также гистологическое исследование печени, сердца, почек. В таблицах 3 и 4 представлены полученные результаты (среднее значение из 10 определений). Достоверность результатов по отношению к контролю составляет р<0,05.
Результаты гематологических исследований крови животных, получавших заявляемый фармацевтический состав в виде гранул, свидетельствуют об отсутствии грубых отклонений от нормы и от соответствующих показателей в контроле.
Понижение содержания альбумина в сыворотке крови крыс, получавших изониазид и рифампицин, свидетельствует о развитии хронической печеночной недостаточности. Увеличение содержания в сыворотке крови животных, получавших изониазид и рифампицин, аспартатаминотрансферазы (ACT) и аланинаминотрансферазы (АЛТ) и щелочной фосфатазы свидетельствует о некрозе клеток печени и о развитии у крыс гепатита. Снижение уровня холестерина (норма 3,9-7,2 мМ/л) может свидетельствовать о развитии острого гепатита у крыс, получавших изониазид и рифампицин. Следовательно, введение изониазида и рифампицина вызывает токсическое поражение печени. В сыворотке крыс, получавших гранулы изониазида, рифампицина, пиразинамида, как биохимические, так и клинические показатели крови в норме, что свидетельствует об отсутствии токсического влияния гранул на организм животных.
При макро- и микроскопическом исследовании внутренних органов подопытных животных, получавших изониазид и рифампицин, отмечены грубые деструктивные изменения в печени. Кроме того, наблюдаются деструктивные изменения в почках крыс, получавших рифампицин.
Во внутренних органах крыс, получавших гранулы изониазида, рифампицина, пиразинамида, деструктивные изменения отсутствуют.
Применение предлагаемого комбинированного состава, обладающего выраженной туберкулостатической активностью и пониженной токсичностью, позволяет повысить эффективность совместного применения изониазида, рифампицина и пиразинамида, а также уменьшить побочные эффекты лекарственных веществ, входящих в состав гранул.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, ОБЛАДАЮЩИЙ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2332216C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2478389C2 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2007 |
|
RU2354378C1 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2009 |
|
RU2430724C2 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ 4-ТИОУРЕИДОИМИНОМЕТИЛПИРИДИНИЯ ПЕРХЛОРАТА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 2010 |
|
RU2423977C1 |
| КОМБИНИРОВАННОЕ ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2182483C1 |
| КОМБИНИРОВАННЫЙ СОСТАВ С ПРОТИВОТУБЕРКУЛЁЗНЫМ ДЕЙСТВИЕМ | 2003 |
|
RU2247560C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ ФОРМ ИЗОНИАЗИДА, ОБЛАДАЮЩИХ ПОНИЖЕННОЙ ГЕПАТОТОКСИЧНОСТЬЮ | 1999 |
|
RU2153878C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2413517C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2468802C2 |
Изобретение относится к медицине, а именно к фармацевтической промышленности, и касается композиции, обладающей высокой туберкулостатической активностью, позволяет понизить токсичность, а следовательно, и побочные эффекты входящих в него ингредиентов: изониазида, рифампицина и пиразинамида. 4 табл.
Комбинированный состав, обладающий противотуберкулезной активностью, содержащий изониазид, отличающийся тем, что дополнительно содержит рифампицин, пиразинамид, пектин, поливинилпирролидон, сахар при следующем соотношении ингредиентов, г на 100 г:
| Справочник Видаль | |||
| Лекарственные препараты в России | |||
| Изд | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| - М.: Астра Фарм Сервис, 2006, с | |||
| Плунжерный насос | 1924 |
|
SU1497A1 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2006 |
|
RU2315598C1 |
Авторы
Даты
2010-03-20—Публикация
2008-04-15—Подача