Область техники
Изобретение относится к области химико-фармацевтической промышленности, конкретно к новому противотуберкулезному лекарственному средству, которое содержит в качестве активного вещества 4-тиоуреидоиминометилпиридиния перхлорат в терапевтически эффективном и безопасном количестве, а также фармацевтически приемлемые вспомогательные вещества. Кроме того, изобретение относится к способу получения вышеуказанного лекарственного средства (варианты) и способу лечения всех форм легочного и внелегочного туберкулеза, а также профилактике в составе комбинированной терапии туберкулеза.
Предшествующий уровень техники
На сегодняшний день остро стоит проблема смертности от туберкулеза (ТБ). По данным Всемирной организации здравоохранения (ВОЗ) в 2007 г. во всем мире насчитывалось 9,27 миллиона случаев заболевания ТБ. Это представляет собой увеличение по сравнению с 9,24 миллиона случаев в 2006 г., 8,3 миллиона случаев в 2000 г. и 6,6 миллиона случаев в 1990 г. Большинство предполагаемых случаев в 2007 г. произошли в Азии (55%) и Африке (31%), с небольшой долей случаев в Регионе Восточного Средиземноморья (6%), Европейском регионе (5%) и Регионе стран Америки (3%). Пятью первыми странами по общему числу случаев заболевания в 2007 г. являются Индия (2,0 миллиона), Китай (1,3 миллиона), Индонезия (0,53 миллиона), Нигерия (0,46 миллиона) и Южная Африка (0,46 миллиона). Согласно оценкам из 9,27 миллиона случаев заболевания 1,37 миллиона (15%) были ВИЧ-положительными; 79% из этих ВИЧ-положительных случаев были в Африканском регионе и 11% - в Регионе Юго-Восточной Азии.
Хотя общее число случаев заболевания ТБ в абсолютном выражении увеличивается в результате роста численности населения, число таких случаев на душу населения падает. Темпы этого снижения являются медленными, менее чем на 1% в год. Частота случаев заболевания в мире в 2004 г. достигла пика и составляла 142 случая на 100000 человек. В 2007 г. эта цифра составляла приблизительно 139 случаев заболевания на 100000 человек. Частота случаев заболевания падает в пяти из шести регионов ВОЗ (исключением является Европейский регион, в котором коэффициенты являются практически стабильными).
В 2007 г. насчитывалось приблизительно 0,5 миллиона случаев ТБ с множественной лекарственной устойчивостью (ТБ-МЛУ). На 27 стран (из которых 15 - в Европейском регионе) приходится 85% таких случаев. Пятью странами с наибольшим числом случаев ТБ-МЛУ являются Индия (131000), Китай (112000), Российская Федерация (43000), Южная Африка (16000) и Бангладеш (15000). К концу 2008 г. 55 стран и территорий сообщили по крайней мере об одном случае ТБ с широкой лекарственной устойчивостью (ТБ-ШЛУ) [1].
Наиболее важные достижения в лечении больных ТБ связаны с химиотерапией. В настоящее время из уровня техники известно большое количество противотуберкулезных средств. Первые химиопрепараты появились в конце 40-х годов (стрептомицин, натрия пара-аминосалицилат, тибон). Затем были созданы фтивазид, изониазид и новые эффективные химиопрепараты - этионамид, канамицин, флоримицин, циклосерин, протионамид. Это позволило осуществлять выбор химиопрепаратов, наиболее показанных для лечения конкретных больных. Далее появились очень эффективные препараты - рифампицин, этамбутол, микобутин. Однако одновременно с появлением новых противотуберкулезных препаратов (ПТП) расширяется развитие устойчивости микобактерий туберкулеза (МБТ) к ним.
В стандартной химиотерапии ТБ (при лечении всех форм) в качестве основных и наиболее эффективных противотуберкулезных препаратов применяются изониазид (гидразид изоникотиновой кислоты - ГИНК) [2], который принят нами в качестве прототипа, а также рифампицин [2, 3]. Изониазид обладает высокой терапевтической эффективностью, однако является высокотоксичным (LD50 равно 150 мг/кг), кроме того, при применении данного препарата в курсе длительного лечения у пациента, как правило, возникают расстройства пищеварения, деятельности почек, нервно-психические, гематологические, аллергические проявления и токсические гепатиты. Помимо этого, основным его недостатком является быстрое развитие лекарственной устойчивости микобактерий туберкулеза. Резистентность микобактерий туберкулеза к изониазиду развивается у 70% больных, а 30% пациентов переходят в разряд хронических больных. Полусинтетический антибиотик рифампицин также обладает высокой активностью в отношении МБТ и сильным токсическим эффектом. Кроме того, его основным недостатком, как и для изониазида, является быстрое развитие лекарственной резистентности микобактерий туберкулеза, что существенно снижает его эффективность. Резистентность микобактерий туберкулеза к рифампицину развивается у 40-50% больных. При развитии устойчивости возбудителя к данному антибиотику его следует сочетать с другими ПТП (стрептомицином, изониазидом, этамбутолом и другими препаратами [2]. В связи с проблемой развития резистентности микобактерий туберкулеза к имеющимся препаратам возникает необходимость разработки новых ПТП и их комбинаций.
Авторы настоящего изобретения поставили перед собой задачу разработки нового высокоэффективного противотуберкулезного средства с минимальными токсическими эффектами и стабильного в процессе хранения.
Подробное описание осуществления изобретения
Поставленная задача решается тем, что авторами настоящего изобретения было разработано получение нового оригинального противотуберкулезного лекарственного средства, включающего активное вещество 4-тиоуреидоиминометилпиридиния перхлорат в эффективном и безопасном количестве и фармацевтически приемлемые вспомогательные вещества.
Получают 4-тиоуреидоиминометилпиридиния перхлорат способом, который ранее был разработан авторами настоящего изобретения и заключается во взаимодействии 4-пиридинальдегида (в избытке) с тиосемикарбазидом в присутствии 48-55%-ной хлорной кислоты в водно-этанольном растворе при 80-85°С [4].
Согласно изобретению предлагаемое противотуберкулезное лекарственное средство содержит активного вещества в количестве от 5,0 до 90,0% от массы лекарственной формы, а также фармацевтически приемлемые вспомогательные вещества в количестве от 11,0 до 100,0% от массы действующего вещества. В пересчете на массу всей лекарственной формы противотуберкулезное лекарственное средство содержит от 5,0 до 90,0 мас.% 4-тиоуреидоиминометилпиридиния перхлората от массы лекарственной формы и фармацевтически приемлемые вспомогательные вещества до 100 мас.%.
Эффективное количество активного вещества в лекарственной форме составляет от 5 до 1000 мг.
Предпочтительно, что заявляемое противотуберкулезное лекарственное средство дополнительно содержит, по меньшей мере, еще одно противотуберкулезное средство для достижения синергетического действия.
Лекарственное средство в качестве дополнительного противотуберкулезного лекарственного средства может содержать одно из таких активных веществ, как изониазид, пиразинамид, рифампицин, рифабутин, амикацин, этамбутол, антибиотик группы фторхинолонов или их комбинации.
Предпочтительно лекарственное средство может быть изготовлено в виде таблеток (кишечно-растворимых, с модифицированным высвобождением), комбинированных таблеток, капсул, драже, гранул, покрытых оболочкой, суппозиторий, суспензий. Лекарственные формы могут быть выполнены традиционным способом [5].
Средство по изобретению может вводиться обычным образом перорально или парентерально. Дозировка зависит от возраста, состояния и веса пациента, а также от вида введения.
Наряду с активным веществом лекарственное средство может при этом содержать обычные вспомогательные вещества, принятые в технологии приготовления лекарственных средств, такие как связующие, наполнители, консерванты, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, антиокислители и/или пропелленты, пролонгаторы действия [6].
В одном из вариантов осуществления настоящего изобретения предпочтительно в качестве целевых добавок используют сахарозу, повидон, целлюлозу микрокристаллическую, кремния диоксид коллоидный, этилцеллюлозу, сополимеры метакриловой кислоты и этилакрилата, триэтилцитрат, макрагол, тальк, краситель железа оксида при следующем соотношении компонентов, % от действующего вещества:
Сахароза - 3,1-50,4
Повидон - 0,9-14,4
Целлюлоза микрокристаллическая - 1,1-18,0
Кремния диоксид коллоидный - 0,2-3,6
Этилцеллюлоза - 0,2-3,6
Наиболее распространенными способами получения таблеток являются три технологические схемы: с влажным гранулированием, сухим гранулированием и прямым прессованием.
В соответствии с настоящим изобретением предложен способ получения нового противотуберкулезного лекарственного средства.
Наиболее близким по технической сущности к предлагаемому объекту является способ с влажным гранулированием, включающий следующие этапы: смешивание ингредиентов, увлажнение, гранулирование, сушка, опудривание, таблетирование [7].
Способ получения заявленного лекарственного средства включает следующие этапы:
а) раздельно просеивают через сито порошки 4-тиоуреидоиминометилпиридиния перхлората, кремния диоксид коллоидный, кросповидона, магния стеарата, повидона, целлюлозы микрокристаллической, гипромелозы (гидроксипропилметилцеллюлоза), гипромелозы (гидроксипропилметилцеллюлоза), талька, полиэтиленгликоля, пропиленгликоля, титана диоксида, железа оксида желтого;
б) в реактор для приготовления увлажнителя загружают холодную воду очищенную и повидон, перемешивают в течение 30 минут при температуре 60°С до получения прозрачного, однородного, бледно-желтого раствора;
в) для получения массы для таблетирования в смеситель загружают 4-тиоуреидоиминометилпиридиния перхлорат и целлюлозу микрокристаллическую и перемешивают в течение 15 мин, после окончания перемешивания заливают увлажнитель, увлажнение и перемешивание проводят в течение не менее 15 мин до равномерного распределения увлажнителя и получения однородной массы;
г) осуществляют влажное гранулирование массы, полученной на стадии в);
д) влажный гранулят, полученный на стадии г), сушат в течение 20 мин при давлении 0,2 мПа и температуре 55±2°С до остаточной влажности 1,0-2,0%;
е) осуществляют опудривание и сухое гранулирование полученного на стадии д) высушенного гранулята, загружая его в бункер вибросита и затем загружая в смеситель сухой гранулят и опудриватель (аэросил, кросповидон, магния стеарат), избегая пылеобразования, перемешивают полупродукт в течение 15 мин, получают массу для таблетирования;
ж) полученную на стадии е) массу таблетируют на таблет-прессе;
з) на таблетки-ядра наносят водную суспензию пленочной оболочки, состоящей из смеси гипромеллозы, железа оксида желтого, макрогола, талька, пропиленгликоля и титана диоксида, и получают заявленное лекарственное средство.
Полученные таблетки лекарственного средства по изобретению покрыты оболочкой от желтого до темно-желтого цвета, овальной формы, двояковыпуклые. На изломе таблетка от светло-желтого до желтого со слабым зеленоватым оттенком цвета.
Выход на стадии составляет 99,47%. Таким образом, способ позволяет получить заявленное лекарственное средство с максимально возможным выходом.
Также в соответствии с настоящим изобретением предложен альтернативный способ получения нового противотуберкулезного лекарственного средства.
Наиболее близким по технической сущности к предлагаемому объекту является способ прямого прессования, а также с влажным гранулированием, включающий следующие этапы: смешивание ингредиентов, увлажнение, гранулирование, обкатка и наращивание гранул, нанесение пленочного покрытия и сушку [7].
Альтернативный способ получения нового противотуберкулезного состава включает следующие этапы. Порошок 4-тиоуреидоиминометилпиридиния перхлората смешивают с кремнием диоксидом коллоидным, микрокристаллической целлюлозой и этилцеллюлозой, увлажняют 3,0-5,0% водным раствором повидона и 30,0-35,0% сахарным сиропом, гранулируют и обкатывают полученные гранулы. Гранулы сушат при 40-45°С до остаточной влажности 1,5-4,5%.
Покрытие на гранулы-ядра наносят известным способом из 20% водного раствора метакриловой кислоты и этилакрилата сополимер и суспензии пигментов талька и красителя железа оксида.
Также в соответствии с настоящим изобретением заявляется способ лечения всех форм легочного и внелегочного туберкулеза, а также профилактики в составе комбинированной терапии.
Согласно заявляемому способу лекарственное средство по настоящему изобретению применяют перорально или парентерально (подкожно, внутривенно, внутримышечно, внутрибрюшинно), кратность приема - 1 раз в сутки; разовая суточная доза - 20 мг/кг (1200 мг/сутки); максимальная разовая доза - 30 мг/кг (1800 мг/сутки).
Для замедления развития устойчивости микобактерий назначают совместно с другими противотуберкулезными препаратами или их комбинациями (изониазид, пиразинамид, рифампицин, рифабутин, амикацин, этамбутол, антибиотики группы фторхинолонов).
Биологическая активность лекарственного средства по изобретению
МАТЕРИАЛЫ И МЕТОДЫ ИЗУЧЕНИЯ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТИ ЛЕКАРСТВЕННОГО СРЕДСТВА ПО ИЗОБРЕТЕНИЮ
1. Оценка действия in vitro (культуры микроорганизмов и методики)
Использованные штаммы микроорганизмов:
1) лабораторные тест-штаммы, входящие в Mycobacterium tuberculosis complex, полученные из Федерального Государственного учреждения «НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А.Тарасовича», чувствительные к существующим противотуберкулезным препаратам:
- М. tuberculosis Erdman;
- М. tuberculosis H37Rv;
- М. tuberculosis «Academia»;
- M. bovis bovinus 8;
2) культуры с множественной лекарственной устойчивостью, выделенные от больных с впервые выявленным туберкулезом (всего 14 штаммов):
- №5419 СПбНИИФ, устойчивость к изониазиду (10 мкг/мл), рифампицину (40 мкг/мл) и стрептомицину (50 мкг/мл);
- №2483 СПбНИИФ, устойчивость к изониазиду (1 мкг/мл), рифампицину (40 мкг/мл), стрептомицину (5 и 10 мкг/мл), рифабутину (40 мкг/мл), этамбутолу (2 мкг/мл);
- №3485 и №3589 СПбНИИФ, устойчивы к изониазиду (1 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину (50 мкг/мл), канамицину (30 мкг/мл), этамбутолу (2 мкг/мл); этионамиду (30 мкг/мл);
- №3019 СПбНИИФ, устойчивость к изониазиду (1 и 25 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину и канамицину (30 и 50 мкг/мл соответственно), этионамиду (30 мкг/мл);
- №3655 СПбНИИФ, устойчивость к изониазиду (1 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину (50 мкг/мл), канамицину и этамбутолу (30 мкг/мл);
- №3689 СПбНИИФ, устойчивость к изониазиду (1 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину (50 мкг/мл), канамицину (30 мкг/мл);
- №3910 СПбНИИФ, устойчивость к изониазиду (1 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину (50 мкг/мл), канамицину и этионамиду (30 мкг/мл);
- №1201 СПбНИИФ, устойчивость к изониазиду (1 мкг/мл), рифампицину (20 мкг/мл), стрептомицину (50 мкг/мл), канамицину (30 мкг/мл), этамбутолу (2 мкг/мл);
- №41 и №779 СПбНИИФ, устойчивы к изониазиду (1 мкг/мл), рифампицину (20 и 50 мкг/мл), стрептомицину (50 мкг/мл);
- №1081 СПбНИИФ, устойчивость к рифампицину (20 мкг/мл), стрептомицину (50 мкг/мл);
- №1719 и №1279 СПбНИИФ, устойчивы к изониазиду (1 мкг/мл), рифампицину (20 мкг/мл), стрептомицину (50 мкг/мл) канамицину и этионамиду (30 мкг/мл);
3) неспецифические микроорганизмы, чувствительные к антимикробным препаратам (из коллекции ФГУ «СПб НИИФ Росздрава»)
- грамотрицательные палочки - Е. coli;
- грамположительные кокки - Staphylococcus aureus, Streptococcus aureus, Corynebacterium pseudodiphtericum (дифтероид).
Антибактериальную активность перхлозона изучали стандартным методом двукратных серийных разведений в питательных средах с учетом биологических свойств тест-штаммов:
- синтетическая среда Сотона с 10% нормальной сывороткой (для микобактерий);
- сахарный бульон (для грамположительных и грамотрицательных бактерий).
Микробную суспензию готовили ex tempore, рабочая концентрация - 5×106 клеток/мл.
Диапазон исследуемых доз перхлозона составил от 100 до 0,19 мкг/мл, с каждой культурой выполняли по 3 повторных исследования. Суспензию тест-штаммов вносили по 0,2 мл в опытные и контрольные пробирки: микобактериальную взвесь методом поверхностного наслоения, взвесь неспецифических бактерий - методом глубинного посева. Интенсивность роста неспецифических микробов учитывали через 24 часа, микобактериальной пленки - через 7-10 дней. Критерием активности служила величина минимальной концентрации средства по изобретению в питательной среде, полностью ингибирующая рост микроорганизмов (МИК, мкг/мл).
Для моделирования экспериментального туберкулеза использовали штамм М.bovis bovinus 8, чувствительный к противотуберкулезным препаратам.
Оценка терапевтического эффекта средства по изобретению. Использовали индекс эффективности лечения ИЭ (%) - долевая разница показателей тяжести течения туберкулезной инфекции в контрольных группах и в группах животных, получавших средство по изобретению. Индекс эффективности определяли по формуле

где nк и no - средние значения показателей соответственно в контрольной и опытной группах.
Положительное значение ИЭ (плюс-эффект) указывает на снижение показателя пораженности или повышение терапевтической активности композиции противотуберкулезных препаратов под действием средства по изобретению.
Отрицательное значение ИЭ (минус-эффект) свидетельствует об увеличении показателя пораженности или ослаблении терапевтического действия композиции противотуберкулезных препаратов под влиянием средства по изобретению.
При оценке действия препаратов сравнения эффекты рассчитывали аналогично и обозначали их в соответствии с общепринятой символикой (по первой букве препарата).
Степень связи в вариации полученных терапевтических эффектов определяли по коэффициенту корреляции (r), количественно измеряли по коэффициентам регрессии в у/х. Для этого использовали стандартные методы расчетов Стьюдента - Фишера.
2. Антибактериальная активность средства по изобретению in vitro
Результаты изучения влияния средства по изобретению на рост стандартных тест-штаммов, входящих в Mycobacterium tuberculosis complex, чувствительных к существующим противотуберкулезным препаратам, приведены в таблице 1.
Как видно из таблицы 1, средство по изобретению подавляло рост тестируемых штаммов в диапазоне концентраций от 1,56 до 6,25 мкг/мл. Наибольшую ингибирующую активность средство по изобретению проявило в отношении М.bovis bovinus 8, начальная ингибиция роста (++) обнаружена при концентрации 0,19 мкг/мл, полное угнетение роста (МИК) - при концентрации 1,56 мкг/мл. Далее в порядке ослабления ингибирующего эффекта штаммы распределились следующим образом:
- М. tuberculosis Erdman (МИК=3,125 мкг/мл)
- M. tuberculosis H37RV u М. tuberculosis «Academia» (МИК=6,25 мкг/мл)
С целью выявления широты спектра антибактериальной активности перхлозона изучено его действие в отношении грамположительных кокков (Staphylococcus aureus, Streptococcus aureus), а также грамположительных и грамотрицательных палочек (E. coli и дифтероида). Результаты исследования представлены в таблице 2.
Как видно из приведенных в таблице 2 данных, средство по изобретению даже при высоких концентрациях в питательной среде (100 мкг/мл) не оказывало влияния на рост грамположительных и грамотрицательных культур микроорганизмов.
Ингибирующее действие средства по изобретению в отношении лекарственно-чувствительных микобактерий изучено на 14 клинических изолятах, из них у 2 (14,3%) выявлена резистентность к 6 противотуберкулезным препаратам (ПТП), у 7 (50%) - к 5 ПТП, у 1 (7,1%) - к 4 ПТП, у 3 (21,4%) - к 3 ПТП, у 1 (7,1%) - к 2 ПТП (таблица 3).
Тестирование показало, что средство по изобретению ингибировало рост всех лекарственно-устойчивых клинических изолятов:
- 14,3% (2 штамма) - в дозе 1,56 мкг/мл;
- 50,0% (7 штаммов) - в дозе 3,125 мкг/мл;
- 28,6% (4 штамма) - в дозе 6,25 мкг/мл;
- 7,1% (1 штамм) - в дозе 50,0 мкг/мл.
Необходимо отметить эффективность ингибирующего действия средства по изобретению в отношении штаммов, устойчивых к 5-6 противотуберкулезным препаратам, где МИК для 88,8% культур составляла 3,125-6,25 мкг/мл.
Таким образом, в результате проведенных исследований in vitro установлено, что средство по изобретению:
- имеет избирательную антимикробную активность, действуя только на жизнеспособность микобактерий туберкулеза;
- обладает выраженным противотуберкулезным действием как в отношении чувствительных, так и устойчивых штаммов МБТ.
1.2. Эффективность монотерапии средством по изобретению при экспериментальном туберкулезе у мышей
Исследование выполнено на 200 белых нелинейных мышах-самцах массой 18-20 г. У мышей штамм М. bovis bovinus 8 вызывал клиническую картину генерализованного туберкулеза, на 11-й день после инфицирования в легких визуализированы очаги специфического воспаления. С этого дня животным опытных групп начато введение исследуемых препаратов.
На 52-й день после заражения летальность в группе контроля (зараженные, нелеченные животные) составила 95,8% (таблица 4).
Средство по изобретению в дозе 10 мг/кг снизило летальность на 31,6%, а в дозах 20 мг/кг и 30 мг/кг - на 73,9% и на 97,5% соответственно (см. таблицу 4). Защитное действие средства по изобретению проявилось также и в виде уменьшения потери массы тела больных мышей. В дозе 10 мг/кг средство по изобретению сократило падение массы тела на 5,3%, а в дозах 20 мг/кг и 30 мг/кг - на 21,5% и на 19,0% (см. таблицу 4).
Таким образом, высокие протективные и терапевтические показатели средства по изобретению в условиях монотерапии мышей с экспериментальным туберкулезом характеризуют его как эффективное антимикобактериальное средство. Эти результаты соответствуют способности средства по изобретению подавлять рост тест-штамма М. bovis bovinus 8 in vitro (см. таблицу 1).
2. Эффективность монотерапии средства по изобретению при экспериментальном туберкулезе у кроликов
Исследование выполнено на 18 кроликах-самцах породы шиншилла, инфицированных в краевую ушную вену тест-штаммом М. bovis bovinus 8. Средство по изобретению начинали вводить животным (n=6) в день заражения в дозе 20 мг/кг перорально, длительность курса - 2 месяца.
Группы сравнения: зараженные нелеченные кролики (контроль заражения, n=6) и зараженные, леченные изониазидом (15 мг/кг, перорально, n=6). Результаты эксперимента представлены в таблице 5.
Как следует из данных таблицы 5, средство по изобретению эффективнее, чем изониазид, предотвращало гибель кроликов от туберкулезной инфекции, способствовало повышению их массы тела (в среднем на 77,17% против 74,67% для изониазида).
2.1. Влияние средства по изобретению на лечебный эффект противотуберкулезных препаратов при экспериментальном туберкулезе у мышей
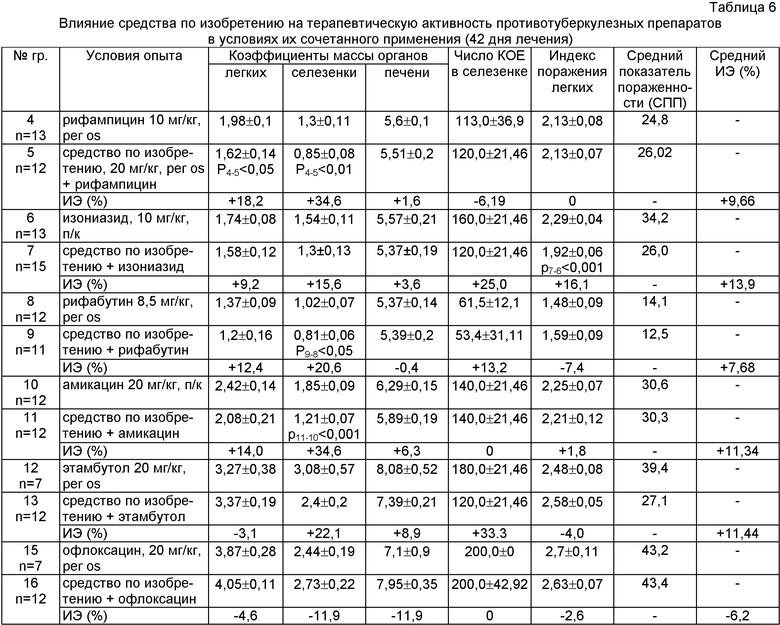
Исследование выполнено на 250 белых нелинейных мышах-самцах. Проведена оценка 6 комбинаций средства по изобретению (20 мг/кг, перорально) с противотуберкулезными препаратами (ПТП), обладающими различной специфической активностью. В группах сравнения проводили монотерапию исследуемыми ПТП в средних терапевтических дозах. Лечение начинали во всех группах на 12-й день после инфицирования на фоне подтвержденного специфического воспалительного процесса в легких при вскрытии мышей из группы контроля заражения. Результаты опыта учитывали через 42 дня (6 недель) терапии.
Влияние средства по изобретению на терапевтическое действие ПТП по показателям пораженности органов варьировало в зависимости от свойств используемых препаратов (таблица 6). В зависимости от особенностей результата взаимодействия со средством по изобретению ПТП распределены на 3 группы.
Группа 1. ПТП, проявляющие синергидное взаимодействие со средством по изобретению (усиление лечебного эффекта по всем показателям пораженности органов):
- Изониазид - повышение терапевтической активности в среднем на 13,9% с вариацией от 3,6% (снижение коэффициента массы печени) до 25% (уменьшение массивности КОЕ в селезенке);
- Амикацин - увеличение эффективности в среднем на 11,34% с вариацией от 34,6% (снижение коэффициента массы селезенки, р<0,001) до 1,8% (уменьшение индекса поражения легких).
Группа 2. ПТП, у которых терапевтическая активность усиливается по большинству показателей пораженности (три из пяти):
- Рифампицин - прирост эффективности на 9,66% за счет снижения коэффициентов массы легких (на 18,2%, р<0,05), селезенки (на 34,6%, р<0,01) и печени (на 1,6%) при увеличении числа КОЕ на 6,19%;
- Рифабутин - прирост эффективности на 7,68% за счет уменьшения коэффициентов массы легких (на 12,4%) и селезенки (на 20,6%, р<0,05), снижения высеваемости МБТ из селезенки (на 13,2%), но при этом повышались два показателя - коэффициент массы печени и индекс поражения легких (на 0,4% и 7,4% соответственно);
- Этамбутол - прирост эффективности на 11,44% за счет уменьшения коэффициентов массы селезенки (на 22,1%), печени (8,9%) и числа КОЕ в селезенке (на 33,3%) при увеличении индекса поражения легких и их массы (на 4,0 и 3,1% соответственно).
Группа 3. Препараты, взаимодействующие со средством по изобретению преимущественно по типу антагонизма:
- Офлоксацин - снижение эффективности на 6,2% с вариацией показателей от 4,65 до 11,9%, за исключением индекса поражения легких с положительным лечебным эффектом в 2,6%.
Состояние фагоцитарной функции пМф в группах наблюдения представлено в таблице 7. Как видно из таблицы, средняя макрофагальная активность пМф при монотерапии средством по изобретению была на уровне интактных мышей (132,41 против 154,97). Активирующее действие средства по изобретению распространялось на те препараты, которые снижали эффективность фагоцитоза при монотерапии. Под влиянием средства по изобретению регистрировали активацию фагоцитоза в комплексе с 3 ПТП: рифампицином - в 1,4 раза (с 71,43 до 99,12), рифабутином - в 1,3 раза (с 66,88 до 83,55), офлоксацином - в 1,2 раза (с 95,14 до 111,66). У трех ПТП наблюдали снижение активности пМф при сочетанном применении со средством по изобретению. Так, уменьшение средней макрофагальной активности на фоне средства по изобретению отмечено у изониазида в 1,2 раза (с 77,66 до 66,54); у этамбутола - в 1,3 раза (со 106,35 до 81,95), у амикацина - в 2,8 раза (с 193,42 до 68,29).
Морфологические показатели в условиях моноприменения шести противотуберкулезных препаратов и в композиции со средством по изобретению приведены в таблице 7. По совокупности тестируемых показателей средство по изобретению способствовало уменьшению степени пораженности легочной ткани при сочетанном применении с рифампицином - на 16,9%, с изониазидом - на 10,1%, с офлоксацином - на 3,24%, с этамбутолом - на 3,19%, с амикацином - на 2,56%. Повышение показателей поврежденности легких отмечено только при совместном назначении средства по изобретению с рифабутином (на 15,9%).
Классификация ПТП по выраженности терапевтического действия на фоне средства по изобретению, учтенная по семи наиболее информативным тестам, установленным с помощью корреляционного анализа, представлена в таблице 8. Можно отметить три композиции с наибольшим положительным эффектом по семи тестам поражения (20 случаям). Из этого числа лидируют композиции рифабутин + средство по изобретению и рифампицин + средство по изобретению (в 7 случаях каждая). Реже встречаются композиции амикацин + средство по изобретению (в 4 случаях) и изониазид + средство по изобретению (в 2 случаях). Слабое действие отмечено в композициях средства по изобретению с офлоксацином и этамбутолом.
Подводя итоги, можно с уверенностью сказать, что средство по изобретению обладает выраженным, строго избирательным ингибирующим действием на жизнеспособность микобактерий туберкулеза, чувствительных и устойчивых к существующим противотуберкулезным препаратам. Средство по изобретению является малотоксичным веществом, не оказывает существенных структурно-функциональных нарушений жизненно важных органов и систем, а также раздражающего действия на слизистые оболочки желудочно-кишечного тракта.
Средство по изобретению обладает умеренной эмбриотоксичностью, преимущественно при введении его в период органогенеза, действует избирательно в зависимости от индивидуальной восприимчивости к нему отдельных особей. Тератогенное действие средство по изобретению проявляет только в дозе 100 мг/кг (в пять раз превышающей терапевтическую) при введении в период органогенеза в виде увеличения нежизнеопасных аномалий скелета, замедления оссификации грудины и костей конечностей, а также появления отеков и подкожных кровоизлияний. Нарушений в развитии плаценты и сдвигов в формировании пола не происходит. Средство по изобретению при длительном введении животным не нарушает репродуктивную функцию, не влияет на качество развития потомства.
Средство по изобретению не проявляет аллергенных, иммунотоксических, мутагенных свойств.
Таким образом, учитывая вышеприведенные экспериментальные данные можно с уверенностью отметить, что технический результат заявленного изобретения заключается в создании нового лекарственного средства, обладающего повышенной туберкулостатической активностью (в 200 раз более высокой) и в 2,4 раза меньшей токсичностью, по сравнению с лекарственным средством по прототипу.
Кроме того, средство по изобретению в сочетании с другими ПТП (комбинации с рифабутином, рифампицином, изониазидом, амикацином и этамбутолом) способствовало увеличению терапевтической эффективности по сравнению с монотерапией средством по изобретению.
Заявленное лекарственное средство стабильно в процессе хранения, не меняет внешний вид, физические характеристики и биологические свойства в течение 3 лет.
Представленные ниже примеры иллюстрируют (без ограничения объема притязаний) наиболее предпочтительные варианты осуществления изобретения, а также подтверждают возможность получения заявляемого лекарственного средства.
Пример 1.
Лекарственное средство, выполненное в форме таблетки, имеет следующий состав и соотношение компонентов, мас.% (соотношения всех компонентов даны в пересчете на 100 мас.% ядра таблетки).
Состав на одну таблетку:
Таблетки с модифицированным высвобождением 100, 200, 400, 800, 1000 мг
Состав на одну таблетку, мг:
Таблетки, покрытые кишечнорастворимой оболочкой 200, 400, 500, 600, 800 мг
Состав на одну таблетку, мг:
Пример 2.
Лекарственное средство выполняется в виде твердой лекарственной формы, покрытой оболочкой в виде гранул. Наличие оболочки заявленного состава придает стабильность композиции в ходе хранения, хороший внешний вид и улучшает органолептические свойства.
Гранулы лекарственного средства по изобретению, покрытые оболочкой
Состав на 100 г:
В качестве оболочки предлагается следующая композиция при соотношении компонентов, мас.% от массы гранул-ядра:
Метакриловой кислоты и этилакрилата сополимеры - 3,0-4,0
Триэтилцитрат - 0,8-1,8
Макрагол - 0,2-0,4
Тальк - 0,9-1,3
Краситель железа оксида - 0,2-0,3
Пример 3.
Лекарственное средство выполняется в виде драже 100, 200, 300, 400 мг
Состав на одно драже:
Пример 4.
Лекарственное средство выполняется в виде капсул, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг
Состав на одну капсулу:
Пример 5.
Лекарственное средство выполняется в виде суспензии.
Порошок 4-тиоуреидоиминометилпиридиния перхлората для приготовления пероральной суспензии
(флаконы 100 мл) 200 мг/5 мл, 300 мг/5 мл, 400 мг/5 мл
Состав на 100 мл:

Все компоненты и их соотношение найдены экспериментальным путем, являются оптимальными, позволяя получить фармацевтический противотуберкулезный препарат, отвечающий требованиям государственной фармакопеи.
Пример 6.
Лекарственное средство выполняется в виде ректальных суппозиториев 50 мг, 100 мг, 200 мг, 300 мг.
Пример 7.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 44,5 мас.%)
Просеянные порошки 4-тиоуреидоиминометилпиридиния перхлората в количестве 70,0 г, целлюлозы микрокристаллической в количестве 5,0 г, кремния диоксида коллоидного в количестве 1,0 г, этилцеллюлозы в количестве 1,0 г загружают в смеситель, перемешивают 5-10 мин при скорости 25 об/мин. Полученную смесь увлажняют водным раствором повидона и сахарозы, полученным из 4,0 г повидона, 14,0 г сахарозы и 28 мл воды, пропускают влажную массу через гранулятор, влажные гранулы обкатывают, наращивают и сушат при 40-45°С до содержания влаги в гранулах 1,5-4,5%. Полученные гранулы-ядра просеивают через набор сит с размером ячейки от 1,0 мм до 3,0 мм. На ядра гранулы размером от 1,0 до 3,0 мм наносят подготовленную пленкообразующую суспензию на основе сополимеров метакриловой кислоты.
0,85 г талька и 0,2 г красителя железа оксида измельчают с 0,2 г макрагола и 5 мл воды до сметанообразной консистенции и смешивают с 3,0 г сополимера метакриловой кислоты, диспергированной в 15 мл воды. Нанесение пленочного покрытия на гранулы-ядра ведут после их нагрева до 45-50°С при постоянном перемешивании и одновременной сушке горячим воздухом до получения 100,0 г равномерно покрытых гранул. Полученные гранулы соответствуют всем требованиям государственной фармакопеи.
Пример 8.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 11,0 мас.%)
Целевые добавки берут в том же составе, что и в примере 6, но в разном количестве. Просеянные порошки 4-тиоуреидоиминометилпиридиния перхлората в количестве 90,0 г, целлюлозы микрокристаллической в количестве 1,0 г, кремния диоксида коллоидного в количестве 0,2 г, этилцеллюлозы в количестве 0,2 г загружают в смеситель, перемешивают 5-10 мин при скорости 25 об/мин. Полученную смесь увлажняют водным раствором повидона и сахарозы, полученным из 0,8 г повидона, 2,8 г сахарозы и 6 мл воды, пропускают влажную массу через гранулятор, влажные гранулы обкатывают, наращивают и сушат при 40-45°С до содержания влаги в гранулах 1,5-4,5%. Полученные гранулы-ядра просеивают через набор сит с размером ячейки от 1,0 до 3,0 мм. На ядра гранулы размером от 1,0 до 3,0 мм наносят подготовленную пленкообразующую суспензию на основе сополимеров метакриловой кислоты.
0,85 г талька и 0,2 г красителя железа оксида измельчают с 0,2 г макрагола и 5 мл воды до сметанообразной консистенции и смешивают с 3,0 г сополимера метакриловой кислоты, диспергированной в 15 мл воды.
Нанесение пленочного покрытия на гранулы-ядра ведут после их нагрева до 45-50°С, при постоянном перемешивании и одновременной сушке горячим воздухом до получения 100,0 г равномерно покрытых гранул. Полученные гранулы желтого или красного цвета, круглой или неправильной формы соответствуют всем требованиям государственной фармакопеи.
Пример 9.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 100,0 мас.%)
Целевые добавки берут в том же составе, что и в примере 6, но в разном количестве. Просеянные порошки 4-тиоуреидоиминометилпиридиния перхлората в количестве 50,0 г, целлюлозы микрокристаллической в количестве 9,0 г, кремния диоксида коллоидного в количестве 1,8 г, этилцеллюлозы в количестве 1,8 г загружают в смеситель, перемешивают 5-10 мин при скорости 25 об/мин. Полученную смесь увлажняют водным раствором повидона и сахарозы, полученным из 7,2 г повидона, 25,2 г сахарозы и 50 мл воды, пропускают влажную массу через гранулятор, влажные гранулы обкатывают, наращивают и сушат при 40-45°С до содержания влаги в гранулах 1,5-4,5%. Полученные гранулы-ядра просеивают через набор сит с размером ячейки от 1,0 до 3,0 мм. На ядра гранулы размером от 1,0 до 3,0 мм наносят подготовленную пленкообразующую суспензию на основе сополимеров метакриловой кислоты. 0,85 г талька и 0,2 г красителя железа оксида измельчают с 0,2 г макрагола и 5 мл воды до сметанообразной консистенции и смешивают с 3,0 г сополимера метакриловой кислоты, диспергированной в 15 мл воды.
Нанесение пленочного покрытия на гранулы-ядра ведут после их нагрева до 45-50°С, при постоянном перемешивании и одновременной сушке горячим воздухом до получения 100,0 г равномерно покрытых гранул. Полученные гранулы соответствуют всем требованиям государственной фармакопеи.
Пример 10.
Раздельно просеивают через сито порошки 4-тиоуреидоиминометилпиридиния перхлората, кремния диоксида коллоидного, кросповидона, магния стеарата, повидона, целлюлозы микрокристаллической, гипромелозы, талька, макрогола, пропиленгликоля, титана диоксида, железа оксида желтого, взятых в необходимых количествах согласно примеру 1.
В реактор для приготовления увлажнителя загружают расчетное количество холодной воды очищенной и повидона, перемешивают в течение 30 минут при температуре 60°С до получения прозрачного, однородного, бледно-желтого раствора. Загружают в смеситель расчетное количество 4-тиоуреидоиминометилпиридиния перхлората и целлюлозы микрокристаллической и перемешивают в течение 15 мин, после окончания перемешивания загружают увлажнитель, увлажнение и перемешивание проводят в течение не менее 15 мин до равномерного распределения увлажнителя и получения однородной массы. Осуществляют влажное гранулирование массы, влажный гранулят сушат в течение 20 мин при давлении 0,2 мПа и температуре 55±2°С до остаточной влажности 1,0-2,0%. Осуществляют опудривание и сухое гранулирование высушенного гранулята, загружают его в бункер вибросита и затем загружают в смеситель сухой гранулят и опудриватель (кремния диоксид коллоидный, кросповидон, магния стеарат), избегая пылеобразования, перемешивают полупродукт в течение 15 мин, получают массу для таблетирования. Полученную массу таблетируют на таблет-прессе.
На таблетки-ядра наносят водную суспензию пленочной оболочки, состоящей из смеси гипромеллозы, железа оксида желтого, макрогола, талька, пропиленгликоля и титана диоксида и получают лекарственное средство по п.1.
Пример 11.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 20 мас.%)
Просеянные порошки 4-тиоуреидоиминометилпиридиния перхлората в количестве 200,0 г, крахмала картофельного сухого в количестве 16,0 г, целлюлозы микрокристаллической в количестве 12,0 г, кросповидона в количестве 8,0 г, кремния диоксида коллоидного в количестве 2,0 г и стеарата магния в количестве 2,0 г загружают в смеситель, перемешивают 5-10 мин при скорости 50 об/мин до однородного распределения активного ингредиента в массе. Содержание влаги в смеси 1-3%. Полученную массу загружают в автомат для капсулирования и наполняют капсулы. Капсулы обеспыливают и упаковывают в банки полимерные или контурные односторонние упаковки. Получают 1000 капсул лекарственного средства по изобретению с общей массой содержимого 240,0 г или 0,24 г ± 10% каждая капсула с содержимым активного ингредиента 0,20 г ± 10%. Полученные капсулы удовлетворяют всем требованиям на фармацевтическое средство.
Пример 12.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 33,3 мас.%)
Целевые добавки берут в том же количестве, что и в примере 1, но вместо крахмала картофельного берут кукурузный, а количество 4-тиоуреидоиминометилпиридиния перхлората - 180 г. Получают 1000 капсул лекарственного средства по изобретению с общей массой содержимого 240,0 г или 0,24 г ± 10% каждая капсула с содержимым активного ингредиента 0,20 г ± 10%. Полученные капсулы удовлетворяют всем требованиям на фармацевтическое средство.
Пример 13.
(Целевые добавки: 4-тиоуреидоиминометилпиридиния перхлората - 9,1 мас.%)
Целевые добавки берут в том же количестве, что и в примере 1, но вместо стеарата магния берут стеарат кальция, а количество 4-тиоуреидоиминометилпиридиния перхлората - 220 г. Получают 1000 капсул лекарственного средства по изобретению с общей массой содержимого 240,0 г или 0,24 г ± 10% каждая капсула с содержимым активного ингредиента 0,20 г ± 10%. Полученные капсулы удовлетворяют всем требованиям на фармацевтическое средство.
Пример 14.
Используют способ получения суппозиторий методом выливания. Рассчитывают количество ингредиентов для получения 100 суппозиторий. В измельчитель загружают 4-тиоуреидоиминометилпиридиния перхлората в количестве 5,0 г, β-циклодекстрина в количестве 4,0 г, глицерола в количестве 1,0 г и измельчают в течение 30 минут. Полученную суспензию смешивают в реакторе с 15,0 г суппозиторной основы и макрогола, нагретой до 45°С. Полученный концентрат охлаждают и размалывают с помощью трехвальцовых мазетерок в течение 3 часов до получения необходимой степени дисперсности лекарственного средства по изобретению. Готовый концентрат смешивают с 35,0 г суппозиторной основы и макрогола при температуре 48°С до однородности и производят формование путем выливания в формы и упаковку суппозиторий. Получают 100 суппозиторий, отвечающим требованиям: средняя масса и однородность по массе - 0,60 г ± 5%, температура плавления - не выше 37°С, количественное содержание 4-тиоуреидоиминометилпиридиния перхлората в суппозитории - 0,05 (0,046-0,054).
Пример 15.
Просеянные порошки 4-тиоуреидоиминометилпиридиния перхлората в количестве 4,0 г, β-циклодекстрина в количестве 0,40 г и повидона в количестве 1,40 г загружают в шаровую мельницу и измельчают в течение 3 часов. К полученному комплексу загружают просеянные порошки сахарозы в количестве 3,95 г, лимонной кислоты в количестве 0,20 г и ароматизатора ванилинового в количестве 0,01 г и измельчают в течение 1 часа. Измельченную массу порошка выгружают в смеситель, к нему загружают кремния диоксида коллоидного в количестве 0,04 г и смешивают в течение 5-10 мин до однородности при скорости 50 об/мин. Полученную смесь расфасовывают на автомате в флаконы по 10,0 г. Флаконы герметично укупоривают крышкой и укладывают в коробку с мерной ложкой на 5 мл. Полученная суспензия отвечает требованиям: отклонение массы содержимого флакона от 9,7 до 10,3 г, содержание воды в порошке - не более 2%, рН 5-8, время седиментационной устойчивости суспензии - не менее 24 часов.
Для внутреннего применения порошок растворяют 90 мл воды до метки и применяют мерной ложкой 5 мл на прием. В 100 мл содержится 20 доз по 200 мг активного ингредиента 4-тиоуреидоиминометилпиридиния перхлората.
Пример 16.
Комбинированное лекарственное средство выполняется в виде капсул 100 мг + 100 мг, 150 мг + 200 мг (рифампицин + перхлозон)
Состав на одну капсулу:
Источники информации
1. Доклад Всемирной организации здравоохранения (ВОЗ) за 2009 г. (найдено в сети Интернет по адресу http://www.who.int/tb/publications/global_report/2009/key_points/ru/index.html).
2. Машковский М.Д. «Лекарственные средства», т.2, Харьков, «Торсинг», 1997, с.с.332-333, 341-342.
3. Хоменко А.Г. «Химиотерапия туберкулеза легких». - М., Медицина, 1980. - 279 с.
4. Патент РФ №2265014 от 13.05.2004.
5. «Фармацевтическая технология. Технология лекарственных форм», 2-е изд., М., 2006.
6. Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991.
7. Технология лекарственных форм./Под ред. Л.А. Ивановой. - М.: Медицина, 1991, т.2, с.142, с.223.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ПРОТИВОТУБЕРКУЛЕЗНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2431487C2 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ | 2010 |
|
RU2449797C1 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2009 |
|
RU2430724C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2240795C9 |
| Способ оценки антимикобактериального действия противотуберкулезных препаратов с использованием биологического материала пациентов, больных туберкулезом легких | 2017 |
|
RU2677972C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2478389C2 |
| КОМБИНИРОВАННЫЙ ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2007 |
|
RU2354378C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2413517C1 |
| КОМБИНИРОВАННАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2468802C2 |
| СИНЕРГИЧЕСКАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЦИКЛОСЕРИН И ЦИНКОСОДЕРЖАЩЕЕ СОЕДИНЕНИЕ | 2016 |
|
RU2620857C1 |
Изобретение относится к области химико-фармацевтической промышленности, конкретно к новому противотуберкулезному лекарственному средству. Предложенное лекарственное средство содержит в качестве активного вещества 4-тиоуреидоиминометилпиридиния перхлорат в эффективном и безопасном количестве и фармацевтически приемлемые вспомогательные вещества. Также предложен способ его получения, который позволяет получить целевой продукт с высоким выходом. Новое лекарственное средство, полученное заявленным способом, обладает высокой туберкулостатической активностью и низкой токсичностью, сохраняет свою стабильность при длительном хранении. Изобретение может быть использовано для лечения всех форм легочного и внелегочного туберкулеза, а также профилактики в составе комбинированной терапии туберкулеза. 4 н. и 8 з.п. ф-лы, 8 табл.
1. Противотуберкулезное лекарственное средство, включающее активное вещество и фармацевтически приемлемые вспомогательные вещества, отличающееся тем, что в качестве активного вещества оно содержит 4-тиоуреидоиминометилпиридиния перхлорат в терапевтически эффективном и безопасном количестве.
2. Противотуберкулезное лекарственное средство по п.1, отличающееся тем, что оно содержит от 5,0 до 90,0 масс.% 4-тиоуреидоиминометилпиридиния перхлората от массы лекарственной формы и фармацевтически приемлемые вспомогательные вещества до 100 мас.%.
3. Противотуберкулезное лекарственное средство по п.1, отличающееся тем, что в качестве фармацевтически приемлемых вспомогательных веществ оно содержит сахарозу, повидон, целлюлозу микрокристаллическую, кремния диоксид коллоидный и этилцеллюлозу при следующем соотношении ингредиентов, % от массы ядра таблетки:
4. Противотуберкулезное лекарственное средство по п.1, отличающееся тем, что оно покрыто оболочкой, содержащей сополимер метакриловой кислоты и этилакрилата, триэтилцитрат, макрогол, тальк, краситель железа оксид при следующем соотношении ингредиентов, % от массы ядра таблетки:
5. Противотуберкулезное лекарственное средство по п.1, отличающееся тем, что оно дополнительно содержит, по меньшей мере, одно противотуберкулезное средство, суммарное содержание которых не превышает 90,0 мас.% от массы лекарственного средства по п.1.
6. Противотуберкулезное лекарственное средство по п.5, отличающееся тем, что в качестве дополнительного противотуберкулезного средства оно содержит изониазид, пиразинамид, рифампицин, рифабутин, амикацин, этамбутол, антибиотик группы фторхинолонов или их комбинации.
7. Противотуберкулезное лекарственное средство по п.1, отличающееся тем, что оно изготовлено в виде таблеток, комбинированных таблеток, капсул, драже, гранул, покрытых оболочкой, суппозиторий, суспензий.
8. Способ получения противотуберкулезного лекарственного средства по любому из пп.1-7, включающий в себя просеивание и смешение порошков действующего вещества и целевых добавок с последующим прессованием или увлажнение, гранулирование влажной массы, сушку гранулята, сухую грануляцию, опудривание, формирование таблетки-ядра с последующим покрытием оболочкой, отличающийся тем, что
а) в качестве способа получения массы для таблетирования используется метод влажного гранулирования;
б) в качестве способа получения ядер таблеток используется метод прессования;
в) в качестве способа нанесения оболочки используется метод нанесения оболочки в виде водорастворимой суспензии.
9. Способ получения противотуберкулезного лекарственного средства по любому из пп.1-7, включающий в себя смешивание ингредиентов, увлажнение, гранулирование, обкатку и наращивание гранул, нанесение пленочного покрытия и сушку, отличающийся тем, что
а) в качестве способа получения гранул используется метод наращивания гранул смесью повидона и сахарного сиропа с последующей сушкой;
б) в качестве способа нанесения оболочки используется метод нанесения оболочки в виде водорастворимой суспензии.
10. Способ лечения и/или профилактики всех форм легочного и внелегочного туберкулеза, отличающийся тем, что осуществляют введение лекарственного средства по любому из пп.1-7 в терапевтически эффективном количестве.
11. Способ по п.10, отличающийся тем, что введение лекарственного средства осуществляют перорально или парентерально.
12. Способ по п.10, отличающийся тем, что применяют однократное суточное введение лекарственного средства по любому из пп.1-4 в дозе 20 мг/кг.
| Перхлорат 4-тиоуреидоиминометилпиридиния, обладающий туберкулостатической активностью | 1989 |
|
SU1621449A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРХЛОРАТА 4-ТИОУРЕИДОИМИНОМЕТИЛПИРИДИНИЯ, ОБЛАДАЮЩЕГО ТУБЕРКУЛОСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2265014C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2240795C9 |
| ТУБЕРКУЛОСТАТИЧЕСКОЕ СРЕДСТВО | 2001 |
|
RU2185170C1 |
| 2000 |
|
RU2168986C |
Авторы
Даты
2011-07-20—Публикация
2010-04-20—Подача