Изобретение относится к биотехнологии, а именно к способу получения фибробластоподобных клеток из пупочного канатика и их применению. Полученные фибробласты могут найти широкое применение в медицинской практике.
В настоящее время пупочный канатик считается источником получения нескольких типов клеток, среди которых эндотелиальные клетки вены пупочного канатика человека (HUVEC) и фибробласты (FPC). HUVEC представляют собой модель, широко используемую большим количеством исследовательских групп по всему миру. Для фармакологических, фармакокинетических и др. исследований используют эндотелиальные клетки, как правило, нулевого пассажа (непассированные).
Известен способ получения аллогенных фибробластов из пуповины новорожденного после нормальных родов, для чего подготавливают фрагмент пуповины. Вены пуповины канюлируют с обеих сторон и промывают сначала раствором Хенкса, а затем 0,1%-ным раствором коллагеназы 1 типа, приготовленным на среде DMEM, и инкубируют при 37°С в течение 30 мин, затем осуществляют механическое воздействие на ткани пуповины, собирают отделившиеся клетки, промывая их раствором Хенкса, полученную после механического воздействия и промывания суспензию клеток центрифугируют при 1000 об/мин в течение 5 мин, получая осадок клеток, который ресуспензируют в ростовой среде DMEM, содержащей 10% фетальной сыворотки крупного рогатого скота, 100 ед./мл пенициллина, 100 ед./мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия, 10 нг/мл основного фактора роста фибробластов bFGF, ресуспензированный осадок клеток в ростовой среде DMEM переносят в культуральные чашки и культивируют до формирования монослоя, сменяя ростовую среду DMEM 2 раза в неделю, и при достижении монослоя клетки пересевают в соотношении 1:3. Данный способ описан в RU 2308957, 27.10.2007 и принят нами в качестве ближайшего аналога. К недостаткам способа следует отнести: во-первых, низкий выход получаемых фибробластов, во-вторых, удается получить только фибробласты вены пупочного канатика, что является ограничением на их дальнейшие дифференцировочные способности и применение.
Нами была поставлена задача разработать простой метод получения фибробластоподобных клеток из всей ткани пупочного канатика, позволяющий выделить как фибробласты из вены, так и мезенхимальные, дермальные и стромальные фибробласты.
В результате проведенной работы был предложен способ получения фибробластоподобных клеток из пупочного канатика новорожденного, сущность которого заключается в поведении следующих этапов:
1. Подготовки фрагмента пупочного канатика.
2. Гомогенизации подготовленного фрагмента.
3. Обработки гомогената раствором, содержащим ферменты: коллагеназу типа I и коллагеназу типа IV, при соотношении концентраций ферментов 1:1, в объемной пропорции гомогената к раствору ферментов 1:5.
4. Фильтрования и центрифугирования фильтрата с получением осадка фибробластоподобных клеток.
Предлагаемый нами способ получения фибробластоподобных клеток позволяет не только повысить выход фибробластов, тем самым обеспечить эффективное использование дорогостоящего сырья - пупочного канатика, но и получить широкий спектр эмбриональных фибробластоподобных клеток, таких как мезенхимальные, стромальные и дермальные фибробласты. Широкий спектр выделяемых клеток позволяет в дальнейшем проводить их дифференцировку в клетки мезенхимальноного ряда, такие как, например, кардиомиоциты, стромальные фибробласты могут дифференцироваться в дальнейшем под влиянием добавленных факторов в клетки хряща, мышц, кости и другие, такие как нейрональные или инсулин-продуцирующие. Эмбриональные дермальные фибробластоподобные клетки могут дифференцироваться в кератиноциты и фибробласты кожи. Таким образом, предлагаемый способ и полученные клетки могут быть использованы для получения вышеперечисленных клеток.
Этап подготовки фрагмента пупочного канатика, как частный случай, может предусматривать дополнительное выделение из вены пупочного канатика эндотелиальных клеток. При этом может быть получено 2 и более типов клеток из одного образца.
Способ осуществляют следующим образом.
Пупочный канатик человека получают после нормальных родов в роддомах с добровольного информированного согласия роженицы.
Забор биоматериала осуществляют с соблюдением всех правил асептики и антисептики после проведения предварительного обязательного анализа крови на ВИЧ, RW и маркеры гепатита В и С и получения отрицательных анализов на инфицированность.
Противопоказанием к забору материала является инфицированность по одному из агентов.
Вся дальнейшая работа с биоматериалом ведется в лаборатории, которая предназначена только для работы с человеческим биоматериалом.
Работа с человеческим биоматериалом должна осуществляется в соответствии с рекомендациями «Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов консервированного костного мозга, кровезаменителей и консервирующих растворов» - Минздрав №4-42-4-85 от 17.09.1985 г.
Все работы с биоматериалом проводятся в стерильных условиях ламинарного бокса II-го класса биологической защиты.
Подготовка фрагмента пупочного канатика обычно предусматривает следующие процедуры.
1. Отмывание его от сгустков крови и слизи в растворе Хенкса.
2. Промывание вены пупочного канатика с помощью шприца раствором Хенкса с добавлением антибиотика и фунгизона.
3. Разрезание пупочного канатика на куски по 2 см длиной. Каждый из полученных кусков разрезают продольно, промывают раствором Хенкса.
Выделение фибробластоподобных клеток из пупочного канатика проводят следующим образом:
1. Гомогенизируют подготовленные фрагменты пупочного канатика.
2. Переносят полученную массу в пробирки, добавляют смесь рабочих растворов коллагеазы I и коллагеназы IV (соотношение концентраций ферментов 1:1) в объемной пропорции 1:5.
3. Ферментируют материал, периодически перемешивая содержимое пробирок. Продолжительность инкубации зависит от концентрации ферментов в растворе и от их активности.
4. Суспензию после ферментирования пропускают через двойное сито для очистки от остатков неферментированных кусков ткани и избытка коллагена.
5. Переносят полученную после фильтрования суспензию в центрифужные пробирки и центрифугируют с получением осадка фибробластов.
Целесообразно при подготовке фрагмента пупочного канатика выделить эндотелиальные клетки, для этого можно после отмывания пупочного канатика и промывания вены дополнительно провести этапы:
1. Зафиксировать один край пуповины, заполнить вену раствором фермента (раствор диспазы - 2,5 мг/мл). Второй конец также зафиксировать, проверяя герметичность вены.
2. Поместить в СО2 инкубатор на 15 минут.
3. Массировать пуповину для улучшения доступа фермента ко всем участкам венозной стенки.
4. Содержимое вены промыть дважды стерильным раствором Хенкса, а затем ростовой средой.
5. Полученную суспензию клеток пипетировать и затем центрифугировать с получением осадка эндотелиальных клеток.
Возможность осуществления способа подтверждают следующие примеры его конкретного выполнения.
Пример 1. Получение фибробластоподобных клеток
В стерильных условиях ламинарного бокса перекладывают привезенный пупочный канатик (фрагмент 7-10 см) из контейнера в отечественную чашку Петри с раствором Хенкса (фирмы ПанЭко или аналогичный) с добавлением антибиотика и фунгизона. Отмывают материал от сгустков крови и слизи в растворе Хенкса (фирмы ПанЭко или аналогичный), меняя раствор три раза. Определив расположение вены пупочного канатика, расширяют ее края стерильным пинцетом и вводят в вену носик шприца объемом 2 мл с раствором Хенкса. Дважды промывают вену стерильным раствором Хенкса (фирмы ПанЭко или аналогичный) с добавлением антибиотика и фунгизона. Разрезают пупочный канатик на куски по 2 см длиной. Каждый из полученных кусков разрезают продольно, промывают раствором Хенкса и измельчают гомогенизатором до однородной массы. Переносят полученную массу в 2 центрифужные пробирки по 15 мл (или 1 центрифужную пробирку по 50 мл) и добавляют смесь 0,075% рабочих растворов коллагеазы I и коллагеназы IV при соотношении 1:1 в объемной пропорции 1:5. Для получения рабочих растворов ферменты разводят в жидкой ростовой среде DMEM без сыворотки и глутамина (фирмы ПанЭко или аналогичный).
Ферментируют материал в течение 8-10 часов при 37°С, периодически перемешивая содержимое пробирок. Степень полноты обработки ферментами определяют по изменению вязкости суспензии, инкубирование необходимо прекратить после значительного увеличения вязкости. Момент резкого возрастания вязкости суспензии определяют визуально.
Суспензию после ферментирования пропускают через двойное сито для очистки от остатков неферментированных кусков ткани и избытка коллагена. Промывают пробирку и сито раствором Хенкса (фирмы ПанЭко или аналогичный). Переносят полученную после фильтрования суспензию в новые 15-мл центрифужные пробирки (или 50-мл центрифужную пробирку) и центрифугируют 8 минут, 1000 об/мин, g=90. В результате получают осадок фибробластоподобных клеток.
Пример 2. Последовательное получение эндотелиальных и фибробластоподобных клеток
Проводят этапы, как описано в примере 1. Дополнительно после промывания вены пупочного канатика фиксируют один край пуповины корнцангом. Аккуратно придерживая образец, заполняют вену раствором фермента (раствор диспазы - 2,5 мг/мл). Для получения раствора фермент разводят ростовой средой без сыворотки и глутамина. Второй конец также фиксируют, проверяя герметичность вены. Помещают образец в отечественную чашку Петри и переносят в СО2 инкубатор на 15 минут. Каждые 5 минут пуповину массируют для улучшения доступа фермента ко всем участкам венозной стенки. Через 15 минут образец переносят в ламинар, снимают корнцанги, а содержимое вены промывают дважды стерильным раствором Хенкса (фирмы ПанЭко или аналогичный), а затем ростовой средой. Полученную суспензию клеток пипетируют и затем центрифугируют в течение 5 мин при 1000 об/мин. Получают осадок эндотелиальных клеток.
Оставшийся после выделения эндотелиальных клеток фрагмент пупочного канатика перекладывают в новую стерильную чашку Петри с раствором Хенкса (фирмы ПанЭко или аналогичный) с добавлением антибиотика и фунгизона. Отмывают в растворе Хенкса, меняя раствор два раза. Разрезают пупочный канатик на куски по 2 см длиной. Далее проводят выделение фибробластов, как описано в примере 1.
Следует отметить, что продолжительность обработки ферментами зависит от концентрации ферментов в растворе, от активности ферментных препаратов различных производителей и ряда других факторов. Примечательным является то, что обработку прекращают в момент визуально определяемого резкого возрастания вязкости суспензии.
Пример 3. Культивирование фибробластов и эндотелиальных клеток
Осадки клеток, полученные после центрифугирования, ресуспендируют в ростовой среде, подсчитывают количество выделенных клеток с помощью камеры Горяева. Помещают полученные суспензии в чашки Петри Greiner или Corning.
Для культивирования фибробластоподобных клеток, выделенных из пупочного канатика, может быть использована любая пригодная для этого ростовая среда, например, следующего состава: жидкая среда DMEM/F12 1:1 (фирмы ПанЭко или аналогичный), сыворотка Fetal Clone I - 10% (фирма Hyclone или аналогичная). 1Х 1Т8 (фирма Hyclone или аналогичная), bFGF 1нг/мл (фирмы Chemicon или аналогичный), гепарин 5 U/мл (фирмы ПанЭко или аналогичный), гетамицип 50 мг/мл (фирмы ПанЭко или аналогичный). Все компоненты вносят из расчета на 1 л среды DMEM/F12.
Для культивирования эндотелиальных клеток, выделенных из вены пупочного канатика, может быть использована любая пригодная для этого ростовая среда, например, следующего состава: среда 199 с солями Эрла (фирмы ПанЭко или аналогичный), сыворотка Fetal Clone 1-20% (фирма Hyclone или аналогичная), антибиотик - 1% (фирмы ПанЭко или аналогичный), эпидермальный фактор роста - 2.5 нг/ мл (фирмы Chemicon или аналогичный), раствор HEPES (фирмы ПанЭко или аналогичный), 7% раствор NaHCO3 (фирмы ПанЭко или аналогичный).
Эндотелиальные клетки высевают в плотности 5·103 клеток /см2, а фибробластоподобные клетки в плотности 10 тыс. клеток/см2.
Культивируют клетки в стандартных условиях: при 37°С и 5% СО2, со сменой среды каждые 2-3 дня. Культуры пассируют при достижении клетками 70-80% конфлюентности. Перед пассированием сливают среду, 3 раза промывают чашку раствором Версена (фирмы ПанЭко или аналогичный). На 4-7 минут заливают содержимое чашки 0,25% раствором трипсина. Полученную суспензию клеток, равномерно перемешав, распределяют на новые чашки Петри Greiner или Corning в плотности 8-15 тыс. клеток/см2. Первое пассирование проводят через 12-14 дней после посадки. В дальнейшем удвоение количества фибробластоподобных клеток происходит каждые 48-72 часа. Соответственно, начиная со второго пассажа, между пассажами проходит 2-3 суток.
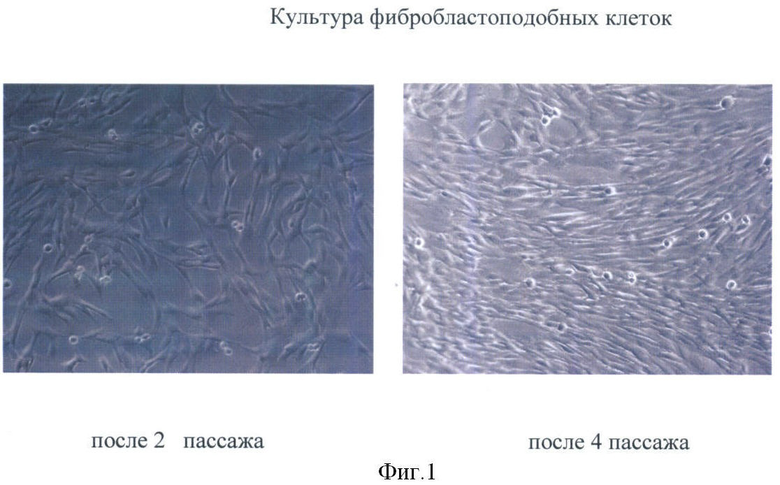
Фибробластоподобные клетки в культуре растут только в прикрепленном к поверхности культуральной посуды (чашки Петри или культуральные флаконы) состоянии. На всех сроках культивирования сохраняют диплоидный кариотип и высокую пролиферативную активность в течение 4-6 пассажей (Фиг.1).
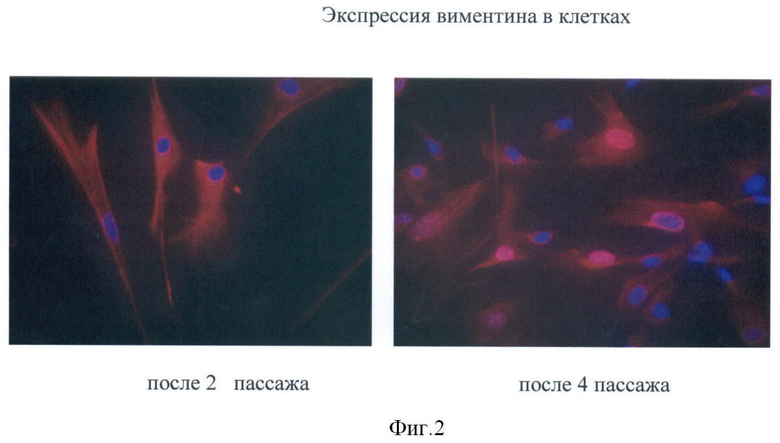
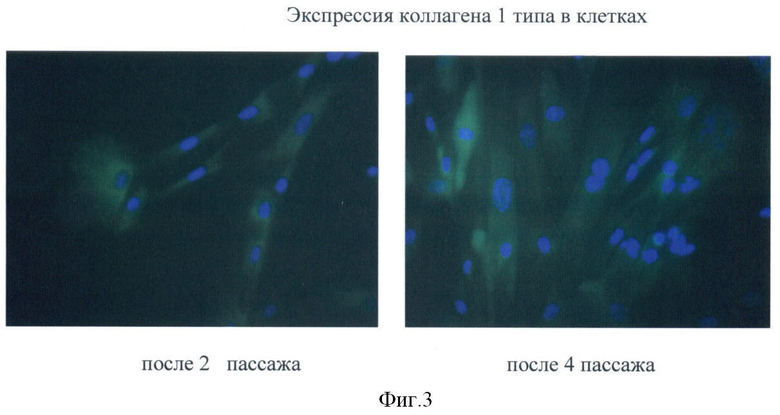
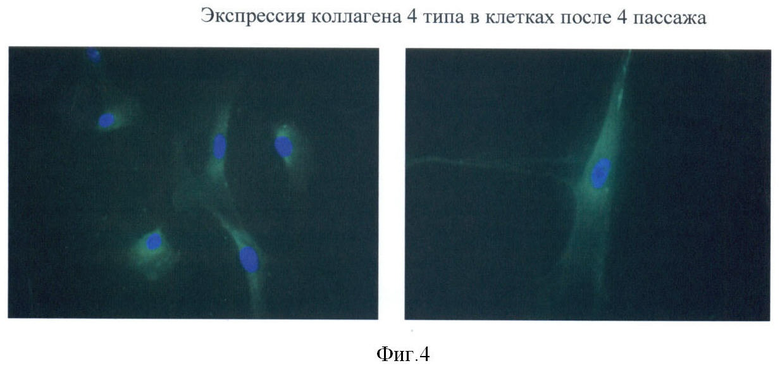
Культивируемые фибробластоподобные клетки, полученные из пупочного канатика человека, экспрессируют виментин, коллаген 1 и 4 типа (Фиг.2-4), альфа-актин и др. (хондроитин сульфат, эластин, фибронектин, кератин 18, кератин 19, гепарин сульфат), не экспрессируют CD45, CD11b, CD14, имеют низкую экспрессию антигенов гистосовместимости.
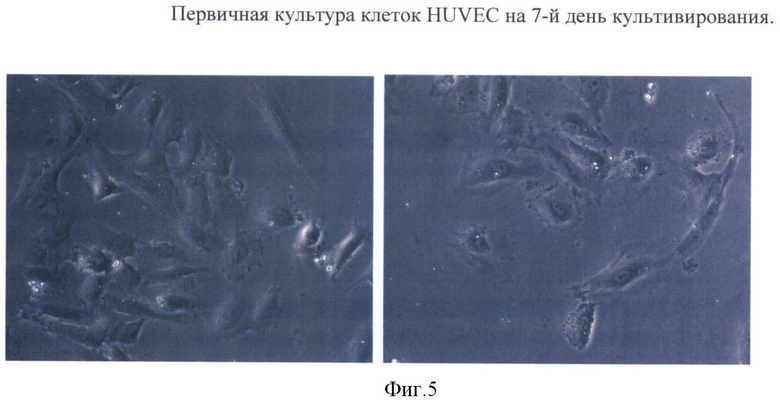
Как правило, используют эндотелиальные клетки вены пупочного канатика нулевою пассажа (непассированные). Эндотелиальные клетки характеризуются ростом в культуре только в прикрепленном к поверхности культуральной посуды (чашки Петри или культуральные флаконы) состоянии и имеют характерный для эндотелиоцитов фенотип (Фиг.5).
Пример 4. Криоконсервация фибробластов
После достижения культурой фибробластоподобных клеток четвертого пассажа клетки замораживают в криопробирках по 10 миллионов.
Чтобы полностью исключить риск возможного инфицирования бактериальными и вирусными агентами, перед криоконсервацией часть клеток подвергается тщательному бактериологическому и вирусологическому контролю (выходной инфекционный контроль), остальные замораживают.
Тестирование проводится на:
- стерильность клеток в отношении бактерий;
- стерильность клеток в отношении микроскопических грибов;
- наличие в клетках ДНК вируса гепатита В;
- наличие в клетках РНК вируса гепатита С;
- наличие в клетках провирусной ДНК вируса иммунодефицита человека 1-го типа;
- наличие в клетках провирусной ДНК вируса иммунодефицита человека 2-го типа;
- наличие в клетках ДНК вируса простого герпеса 1-го типа;
- наличие в клетках ДНК вируса простого герпеса 2-го типа;
- наличие в клетках ДНК цитомегаловируса;
- наличие в клетках ДНК токсоплазмы;
- наличие в клетках ДНК микоплазмы.
Для замораживания из чашек Петри с конфлюентной монослойной культурой отбирают конденсированную среду. Культуру клеток троекратно отмывают раствором Версена и трипсинизируют при 37°С, 5% СО2 10 минут. Полученную в результате суспензию гомогенизируют и осуществляют подсчет клеток с помощью камеры Горяева. Гомогенат центрифугируют в течение 10 мин при 1000 об/мин. Надосадочную жидкость удаляют, клетки ресуспендируют в среде для замораживания (сыворотка пуповинной крови человека Феталклон 1+7% диметилсульфоксида) в концентрации 10 млн клеток в 1 мл среды для замораживания. Клеточную суспензию переносят в 2-мл криопробирки с помощью 5-мл пипетки. Криопробирки маркируют согласно установленному образцу. Клеточный материал подвергается программному замораживанию в специальной установке до -80°С и переносится затем на хранение в дюары с жидким азотом в криохранилище.
С 7-10 см пуповины можно на 4-ом пассаже получить до 200 млн фибробластоподобных клеток. Получение и криоконсервирование 200 млн фибробластоподобных клеток можно осуществить примерно через 25-30 дней после поступления материала в лабораторию.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ПУПОЧНОГО КАНАТИКА НОВОРОЖДЕННОГО | 2020 |
|
RU2744301C1 |
| Способ получения и культивирования фибробластоподобных клеток из пуповины новорожденного | 2019 |
|
RU2710263C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО МАТЕРИАЛА ИЗ ПЛАЦЕНТЫ ЧЕЛОВЕКА | 2015 |
|
RU2599418C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕРУБЦОВОЙ АЛОПЕЦИИ | 2018 |
|
RU2695364C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ МЕЗОТЕРАПИИ И ПРЕПАРАТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ (ВАРИАНТЫ) | 2006 |
|
RU2308957C1 |
| Способ получения и культивирования фибробластоподобных клеток из пульпы молочных зубов | 2020 |
|
RU2726554C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕЧЕБНЫХ ПРЕПАРАТОВ ИЗ ПУПОВИНЫ ПЛОДА | 2010 |
|
RU2428997C1 |
| Способ получения биорезорбируемого сетчатого имплантата для пластики стенок малого таза и брюшной полости | 2016 |
|
RU2648355C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
Изобретение относится к биотехнологии. Способ получения фибробластоподооных клеток из пупочного канатика новорожденного включает следующие стадии. Сначала осуществляют подготовку фрагмента пупочного канатика человека. Потом проводят гомогенизацию и выделение фибробластоподобных клеток смесью 0,075% растворов коллагеназы типа I и коллагеназы типа IV при соотношении концентраций ферментов 1:1 в объемной пропорции гомогената к рабочему раствору ферментов 1:5. Обработку ведут до резкого возрастания вязкости. Способ обеспечивает получение фибробластоподобных клеток с высоким выходом. 1 з.п. ф-лы, 5 ил.
1. Способ получения фибробластоподобных клеток из пупочного канатика новорожденного, предусматривающий подготовку фрагмента пупочного канатика человека, выделение фибробластоподобных клеток обработкой раствором коллагеназы типа I и центрифугированием, отличающийся тем, что подготовленный фрагмент пупочного канатика гомогенизируют, а обработку гомогената проводят смесью 0,075% растворов коллагеназы типа I и коллагеназы типа IV при соотношении концентраций ферментов 1:1 в объемной пропорции гомогената к рабочему раствору ферментов 1:5 до резкого возрастания вязкости.
2. Способ по п.1, отличающийся тем, что в процессе подготовки фрагмента пупочною канатика выделяют эндотелиальные клетки из вены пупочного канатика.
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ МЕЗОТЕРАПИИ И ПРЕПАРАТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ (ВАРИАНТЫ) | 2006 |
|
RU2308957C1 |
| СОЛОВЬЕВА Н.И | |||
| и др | |||
| Коллагеназы I и IV типов и их эндогенные регуляторы в иммортализованных и трансформированных фибробластах, Вопросы медицинской химии, №1, 2001 | |||
| Способ удаления хлора и фтора из окисленного цинк-свинецсодержащего сырья | 1990 |
|
SU1786154A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ФИБРОБЛАСТОВ ДЛЯ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2006 |
|
RU2320720C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛОНИРОВАННЫХ ЭМБРИОНОВ ЧЕЛОВЕКА ПУТЕМ ПРИМЕНЕНИЯ СПОСОБА МЕЖВИДОВОЙ ТРАНСПЛАНТАЦИИ ЯДЕР | 2000 |
|
RU2216591C2 |
| Машина для запайки стеклянных ампул | 1953 |
|
SU100793A1 |
Авторы
Даты
2010-03-20—Публикация
2008-03-27—Подача