Текст описания приведен в факсимильном виде.


























































































































































| название | год | авторы | номер документа |
|---|---|---|---|
| ИНСУЛИН-ОЛИГОМЕРНЫЕ КОНЪЮГАТЫ, ИХ ПРЕПАРАТЫ И ПРИМЕНЕНИЯ | 2005 |
|
RU2527893C2 |
| ТВЕРДАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ КОНТРОЛЯ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ С ЕЕ ПОМОЩЬЮ, СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ (ВАРИАНТЫ), ТАБЛЕТКА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ АМФОРНЫХ ЧАСТИЦ | 2008 |
|
RU2453332C2 |
| САЙТ-СПЕЦИФИЧНЫЙ КОНЪЮГАТ ИНСУЛИНА | 2014 |
|
RU2677800C2 |
| СВОБОДНЫЕ ОТ ЦИНКА И ОБЕДНЕННЫЕ ЦИНКОМ ИНСУЛИНОВЫЕ КОМПОЗИЦИИ С ПОВЫШЕННОЙ СТАБИЛЬНОСТЬЮ | 2002 |
|
RU2311922C2 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| МОДИФИЦИРОВАННЫЕ УГЛЕВОДАМИ ЧАСТИЦЫ И ПОРОШКООБРАЗНЫЕ КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2016 |
|
RU2752620C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ ПЕПТИДОВ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2007 |
|
RU2456018C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ АНАЛОГ ЧЕЛОВЕЧЕСКОГО ИНСУЛИНА, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1995 |
|
RU2152399C2 |
| ИНСУЛИН, СТАБИЛИЗИРОВАННЫЙ ГАЛОГЕНОМ | 2009 |
|
RU2555557C2 |



































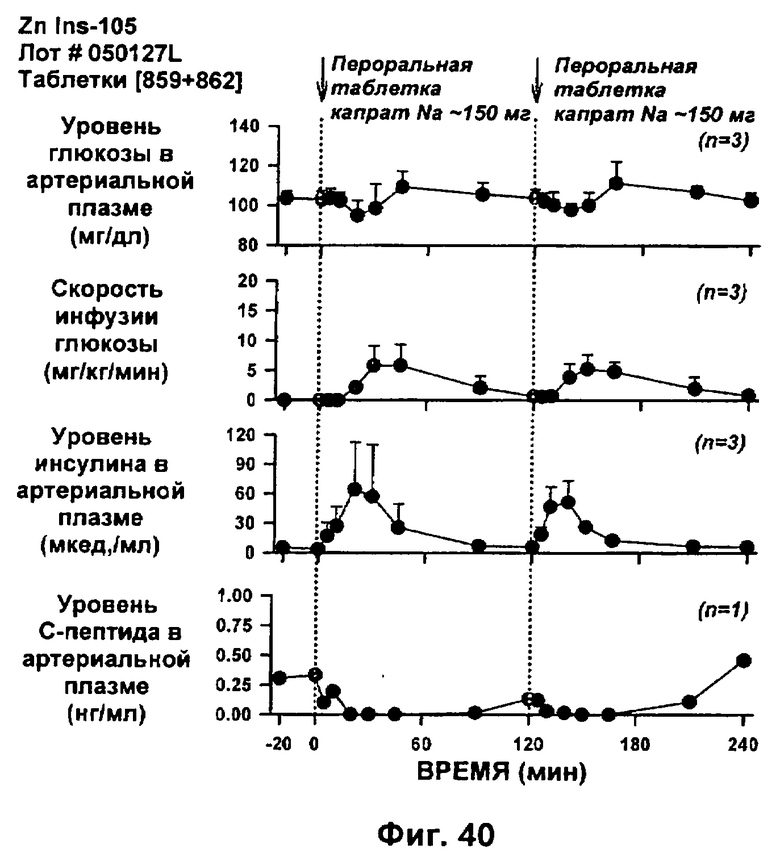
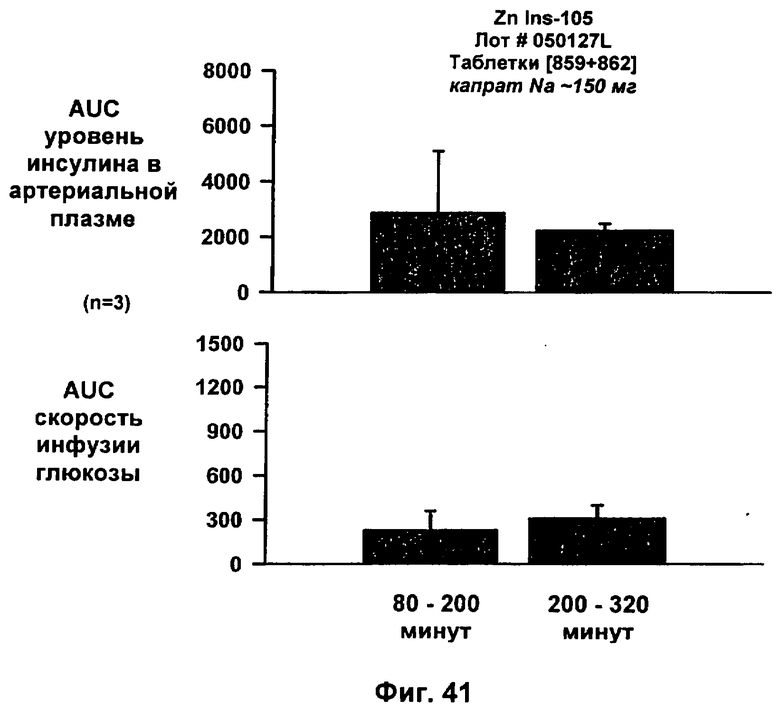

Изобретение относится к комплексу, включающему конъюгат инсулина, содержащий нативный инсулин или его полипептидный аналог, конъюгированные с модифицирующей группировкой, где полипептидный аналог проявляет сходную активность относительно нативного инсулина, и где модифицирующая группировка содержит полиалкиленгликолевый (PAG) компонент и алкильный компонент, и катион, где конъюгат инсулина образует комплекс с двухвалентным катионом металла группы II или переходного металла. Изобретение также относится к фармацевтическим композициям, содержащим такие комплексы, их способам получения. Изобретение также относится к композициям жирных кислот для введения комплексов конъюгатов соединений инсулинов по изобретению. 6 н. и 54 з.п. ф-лы, 42 ил.
1. Комплекс, включающий:
конъюгат инсулина, содержащий нативный инсулин или его полипептидный аналог, конъюгированные с модифицирующей группировкой, где полипептидный аналог проявляет сходную активность относительно нативного инсулина, и где модифицирующая группировка содержит полиалкиленгликолевый (PAG) компонент и алкильный компонент, и
катион, где конъюгат инсулина образует комплекс с двухвалентным катионом металла группы II или переходного металла.
2. Комплекс по п.1, где полипептидный аналог выбран из группы, состоящей из нативного проинсулина, искусственного проинсулина, препроинсулина, содержащего проинсулин и лидерный пептид или белок-носитель, соединенный с С-концом или N-концом проинсулина; и минипроинсулина.
3. Комплекс по п.2, где полипептидный аналог имеет лидерный пептид, который является отщепляемым или неотщепляемым.
4. Комплекс по п.1, где полипептидный аналог представляет собой одноцепочечный предшественник инсулина, содержащий А-цепь-В-цепь инсулина, где А-цепь и/или В-цепь может быть укорочена в точке присоединения к другой цепи на 1, 2 или 3 аминокислоты.
5. Комплекс по п.1, где модифицирующая группировка выбрана так, чтобы сделать конъюгат инсулина более гидрофильным или более амфифильным, чем соответствующий неконъюгированный инсулин.
6. Комплекс по п.1, где гидрофильность конъюгата инсулина уменьшена путем добавления цинка.
7. Комплекс по п.6, где:
модифицирующая группировка выбрана так, чтобы сделать конъюгат инсулина таким же или более растворимым, чем соответствующий неконъюгированный инсулин; и
растворимость в воде конъюгата инсулина уменьшена путем добавления цинка.
8. Комплекс по п.7, где:
конъюгат инсулина представляет собой ацилированный инсулин; катион представляет собой цинк; и
растворимость в воде конъюгата инсулина уменьшена путем добавления цинка.
9. Комплекс по п.1, где относительная липофильность конъюгата инсулина по отношению к соответствующему исходному инсулину равна 1 или меньше 1.
10. Комплекс по п.1, где модифицирующая группировка содержит от 2 до 10 полиалкаленгликолевых группировок.
11. Комплекс по п.1, где растворимость комплекса конъюгата инсулина с катионом при рН приблизительно 7,4 меньше, равна или больше растворимости конъюгата инсулина.
12. Комплекс по п.1, представляющий собой твердое вещество.
13. Комплекс по п.1, где:
(а) растворимость комплекса конъюгата инсулина с катионом при рН приблизительно 7,4 по существу меньше растворимости конъюгата инсулина в растворе при рН приблизительно 7,4, и
(б) конъюгат инсулина с катионом остается растворимым при концентрации более чем приблизительно 1 г/л в водном растворе в диапазоне pH от 5,8 до приблизительно 8,5.
14. Комплекс по п.1, где:
(а) этот комплекс представляет собой Zn-комплекс R-типа, содержащий протамин; и
(б) при pH приблизительно 7,4 растворимость комплекса в воде составляет от приблизительно 10 до приблизительно 110 г/л, от приблизительно 20 до приблизительно 85 г/л или от приблизительно 30 до приблизительно 70 г/л.
15. Комплекс по п.1, где:
(а) этот комплекс представляет собой Zn-комплекс Т-типа, содержащий протамин; и
(б) при pH приблизительно 7,4 растворимость комплекса в воде составляет от приблизительно 10 до приблизительно 150 г/л, от приблизительно 20 до приблизительно 130 г/л, от приблизительно 30 до приблизительно 110 г/л или от приблизительно 35 до приблизительно 60 г/л.
16. Комплекс по п.1, где:
(а) конъюгат инсулина представляет собой моноконъюгат; и
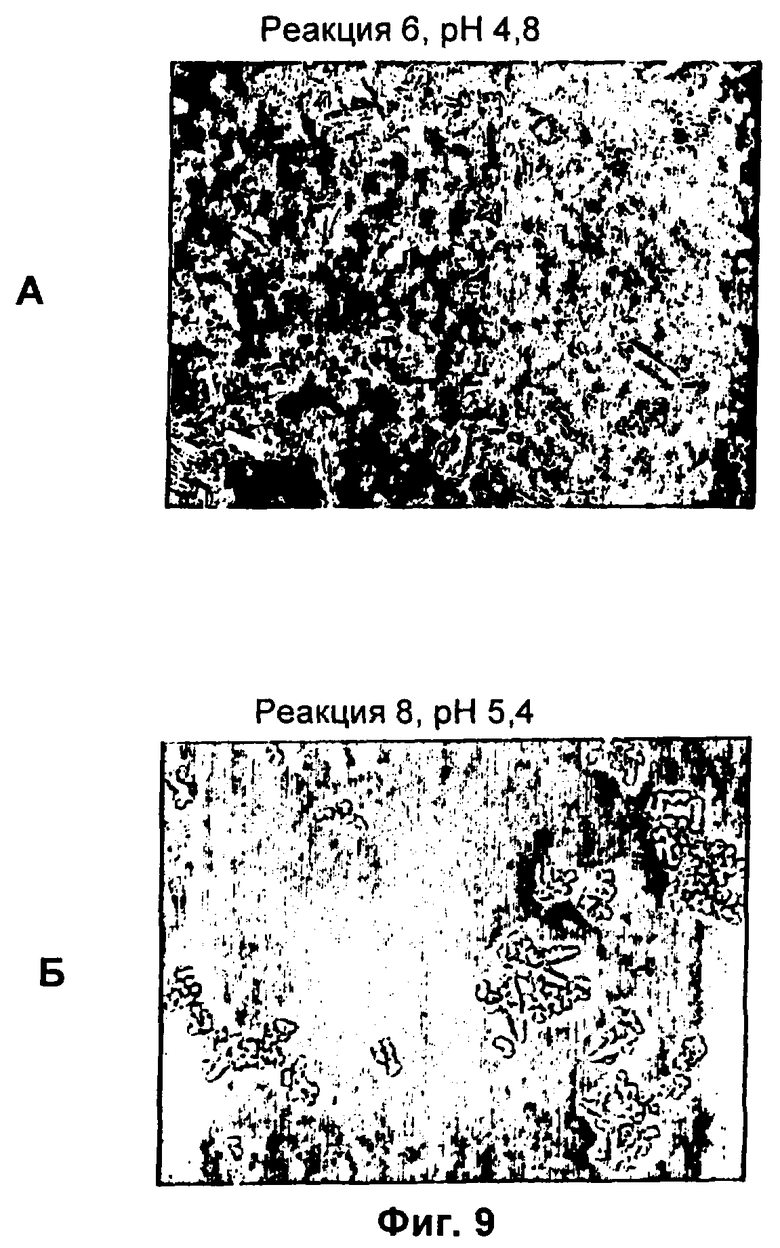
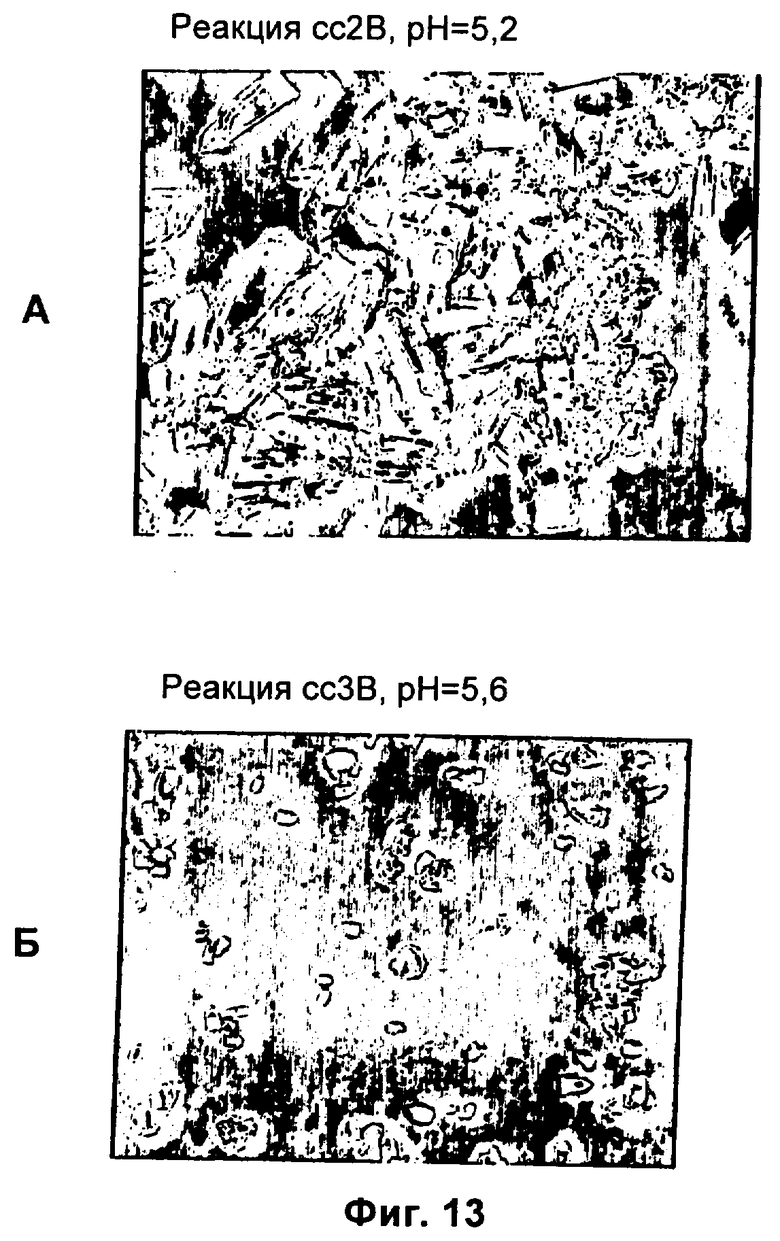
(б) комплекс образует кристаллы в водном растворе при pH от приблизительно 4 до менее 6,5.
17. Комплекс по п.1, где конъюгат инсулина образует кристаллы в водном растворе при pH, равном pI плюс или минус 2,5.
18. Комплекс по п.1, где:
(а) PAG (полиалкиленгликоль) и/или PAG-компонент связан с липофильным компонентом, где данный липофильный компонент выбран из группы, состоящей из алкилов, жирных кислот и линейных или разветвленных липидов, и
(б) где либо PAG-компонент, либо липофильный компонент связан с одной или более аминогруппами в нативном инсулине или его полипептидном аналоге.
19. Комплекс по п.4, где модифицирующая группировка связана с карбоксильным концом А-цепи, и/или модифицирующая группировка связана с карбоксильным концом В-цепи нативного инсулина или его полипептидного аналога.
20. Комплекс по п.18, где:
(а) нативный инсулин или его полипептидный аналог содержит аминогруппу в положении A1, B1 и/или В29; и
(б) по меньшей мере одна модифицирующая группировка связана с одиночной аминогруппой в нативном инсулине или его полипептидном аналоге в одном или более положениях, выбранных из группы, состоящей из А1, В1 и В29.
21. Комплекс по п.18, где модифицирующая группировка связана со свободной аминогруппой в нативном инсулине или его полипептидном аналоге с образованием карбаматной связи.
22. Комплекс по п.18, где:
(а) нативный инсулин или его полипептидный аналог содержит свободную гидроксильную группу, и
(б) модифицирующая группировка связана со свободной гидроксильной группой с образованием карбоксильной, простой эфирной или карбонатной связи.
23. Комплекс по п.1, где катионный компонент содержит катион металла, выбранный из группы, состоящей из Zn++, Mn++, Ca++, Fe++, Ni++, Cu++, Со++ и Mg++.
24. Комплекс по п.1, где катионный компонент содержит Zn++.
25. Комплекс по п.1, где молярное отношение конъюгата инсулина к катионному компоненту составляет от приблизительно 1:1 до приблизительно 1:100, от приблизительно 1:2 до приблизительно 1:12 или от приблизительно 1:2 до приблизительно 1:7.
26. Комплекс по п.1, где устойчивость к расщеплению химотрипсином находящегося в комплексе конъюгата инсулина выше, чем устойчивость к расщеплению химотрипсином соответствующего не находящегося в комплексе конъюгата инсулина.
27. Комплекс по п.1, где устойчивость к расщеплению химотрипсином находящегося в комплексе конъюгата инсулина выше, чем устойчивость к расщеплению химотрипсином соответствующего находящегося в комплексе, но неконъюгированного инсулина.
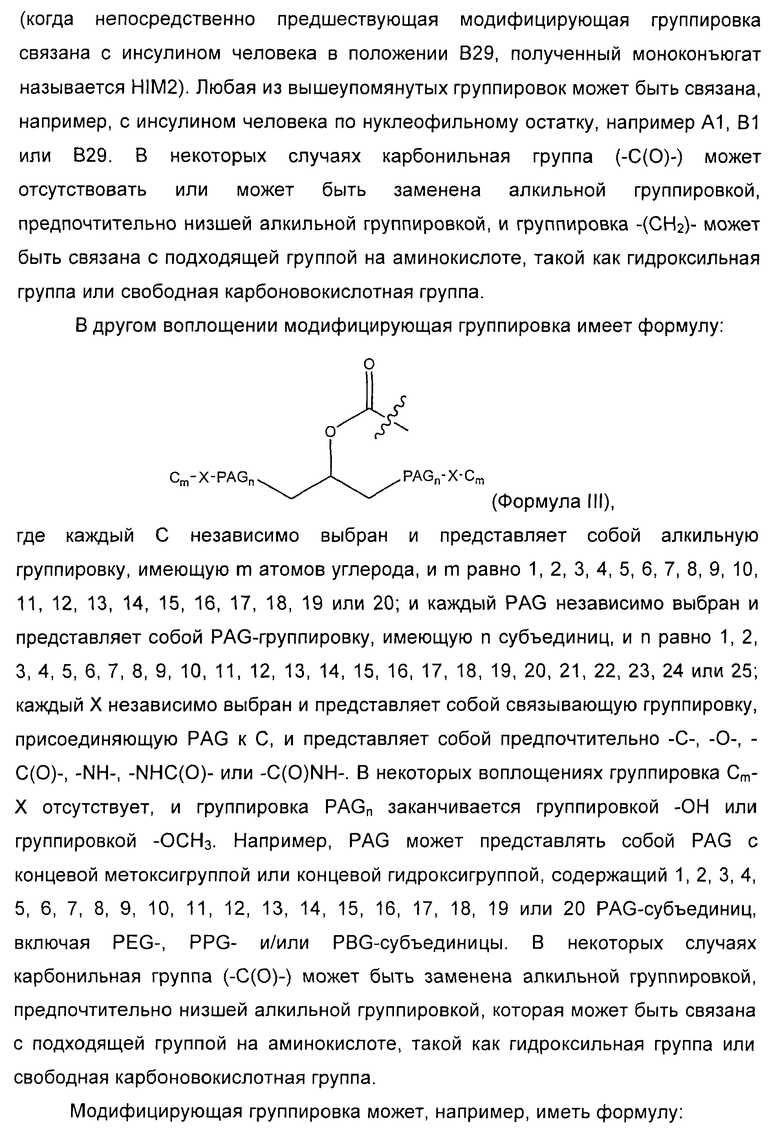
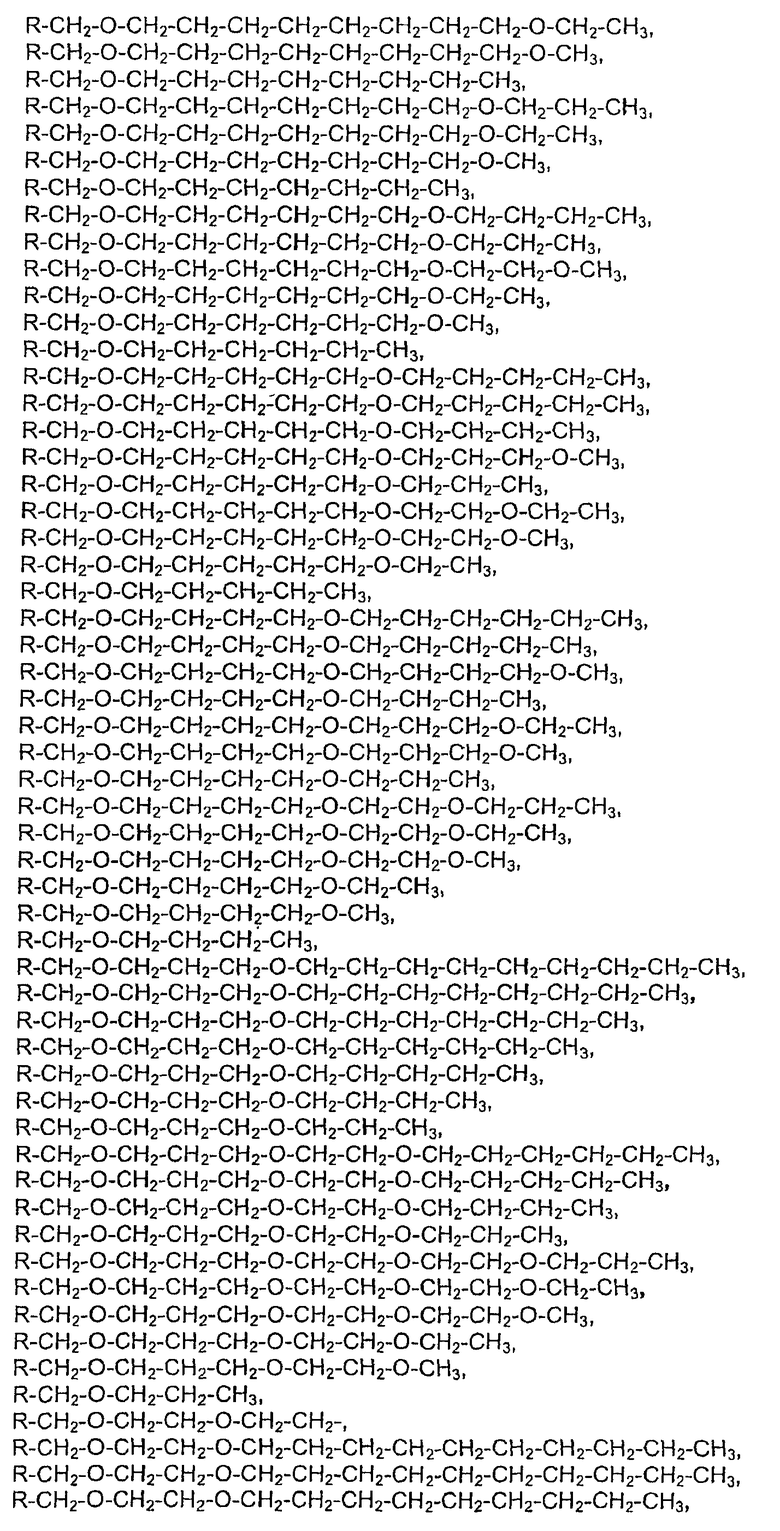
28. Комплекс по п.1, где конъюгат инсулина состоит из инсулина человека, связанного в положении A1, B1 и/или В29 с модифицирующей группировкой, имеющей структуру, выбранную из группы, состоящей из:
 ;
;
 ;
;
 ;
;
 ;
;
 ,
,
где m равно от 1 до 20, и n равно от 1 до 20;

где PAG представляет собой PAG-группировку, имеющую m субъединиц, и m равно от 1 до 20, и n равно от 1 до 20;
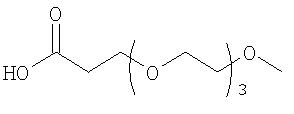 ;
;
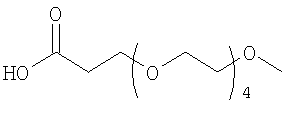 ;
;
 ;
;
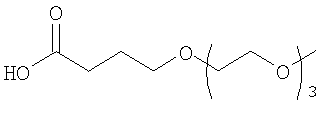 ;
;
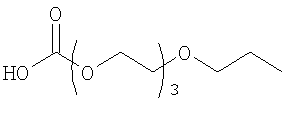 ;
;
 ;
;
 ;
;
 ;
;
 ;
;
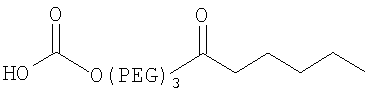 ;
;
 ;
;
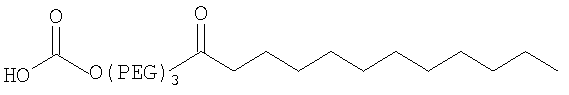 ;
;
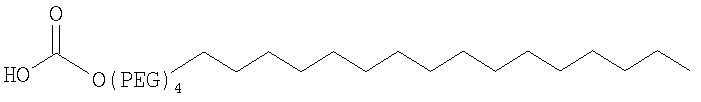 ;
;
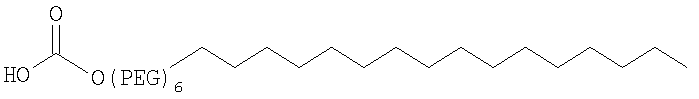 ;
;
 и
и

29. Комплекс по п.1, где конъюгат инсулина связан в положении A1, B1 и/или В29 с линейной или разветвленной PEG-группировкой, содержащей от 2 до 20 PEG-субъединиц, от 2 до 15 PEG-субъединиц или от 2 до 10 PEG-субъединиц.
30. Композиция для лечения недостаточности инсулина у человека, содержащая терапевтически эффективное количество по меньшей мере одного из комплексов по пп.1-29 и фармацевтически приемлемый носитель.
31. Композиция по п.30, дополнительно содержащая второй компонент, содержащий конъюгат инсулина или неконъюгированный инсулин.
32. Композиция по п.31, где комплекс представляет собой форму, выбранную из группы, состоящей из кристаллического твердого вещества, аморфного твердого вещества и сокристалла, содержащего по меньшей мере два конъюгата инсулинов, причем данные конъюгаты инсулинов являются одинаковыми или разными.
33. Композиция по п.30, представленная в виде лиофилизованного порошка, твердой смеси или гибридного комплекса.
34. Композиция по п.30, содержащая более одного комплекса, где конъюгаты инсулина данных комплексов содержат разные инсулины или разные конъюгаты инсулина.
35. Композиция по п.34, где разные конъюгаты инсулина имеют разные характеристики, выбранные из группы, состоящей из разных растворимостей, разных периодов полувыведения из кровотока и разных модифицирующих группировок.
36. Композиция по п.35, где один из комплексов имеет профиль быстрого действия; а другой из комплексов имеет профиль от среднего до длительного действия.
37. Композиция по п.35, где один из комплексов имеет профиль, подходящий для базального контроля инсулина, а другой из комплексов имеет профиль, подходящий для постпрандиального контроля глюкозы.
38. Композиция по п.31, представляющая собой сокристалл по меньшей мере двух компонентов, выбранных из группы, состоящей из HIM2, инсулина и IN105.
39. Композиция по п.31, представляющая собой сокристалл, имеющий PK/PD (фармакокинетический/фармакодинамический) профиль, подходящий для постпрандиального контроля глюкозы или для ночного базального контроля инсулина.
40. Композиция по п.31, содержащая неконъюгированный инсулин, выбранный из группы, состоящей из инсулина человека или лизпроинсулина.
41. Композиция по п.30, дополнительно содержащая комплексообразующий агент.
42. Композиция по п.41, где комплексообразующий агент выбран из группы, состоящей из протаминов, сурфена, глобиновых белков, спермина, спермидина, альбумина, аминокислот, карбоновых кислот, поликатионных полимерных соединений, катионных полипептидов, полилизина, анионных полипептидов, нуклеотидов и антисмысловых последовательностей.
43. Композиция по п.30, по существу не содержащая протамина.
44. Композиция по п.32, где комплекс находится в форме кристаллического твердого вещества, палочковидного кристалла, кристалла, имеющего нерегулярную морфологию, смеси аморфных и кристаллических твердых веществ или порошка.
45. Композиция по п.30 в форме порошка, содержащего твердый конъюгат инсулина с катионом и один или более дополнительных фармацевтически приемлемых компонентов.
46. Композиция по п.30, где в сухом состоянии твердое вещество содержит:
более чем приблизительно 71% мас./мас. конъюгата инсулина и от приблизительно 0,5 до приблизительно 4% мас./мас. Zn++, и возможно от приблизительно 0,1 до приблизительно 5% мас./мас. фенола.
47. Композиция по п.45, содержащая стабилизирующий агент, выбранный из группы, состоящей из фенола, мета-крезола и парабена.
48. Применение комплексов или композиций по пп.1-46 в изготовлении лекарства для лечения диабета.
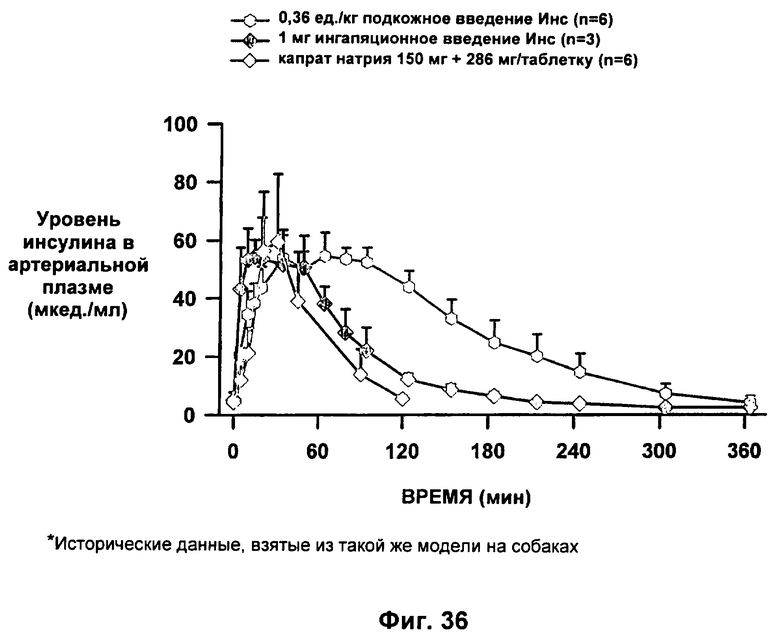
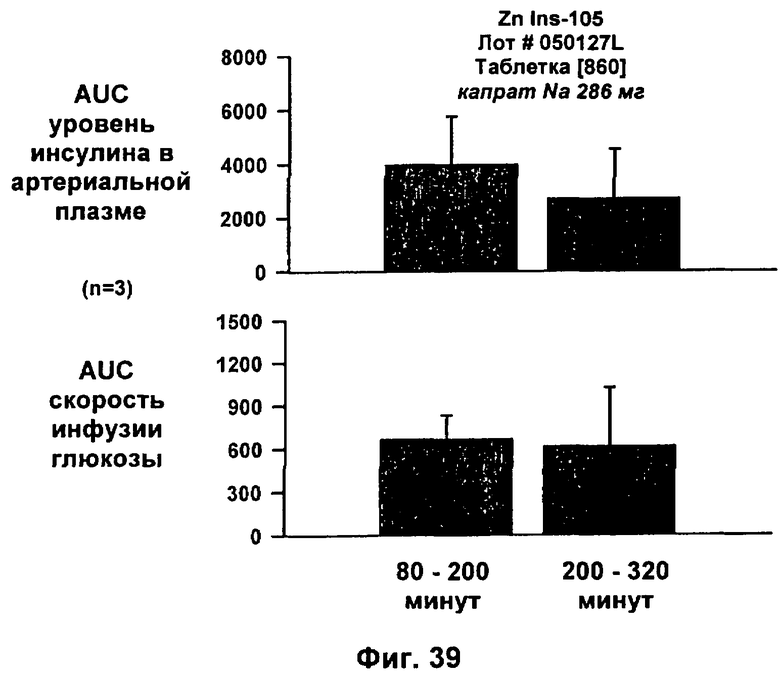
49. Применение по п.48, где композицию приготавливают для доставки путем, выбранным из группы, состоящей из перорального, перорального проглатывания внутрь, парентерального, трансбуккального, сублингвального, назального, ингаляционного и трансдермального.
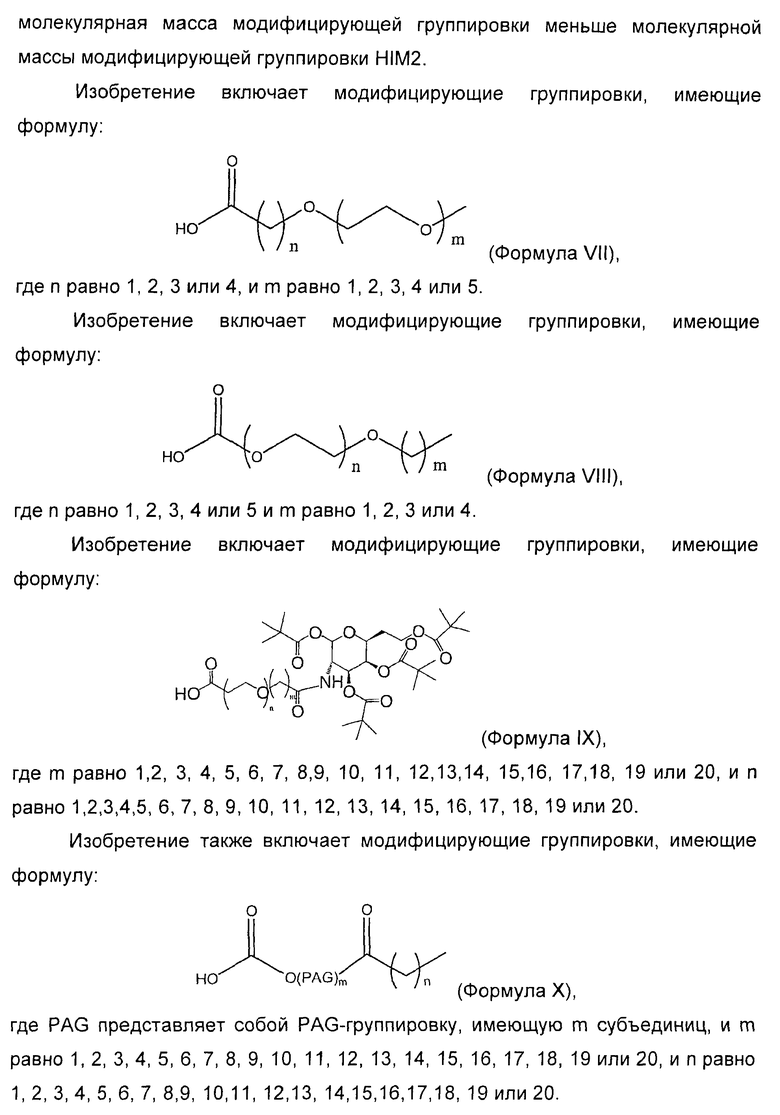
50. Кристаллический Zn комплекс, содержащий конъюгат инсулина, находящийся в комплексе с Zn, где конъюгат инсулина содержит нативный инсулин или его полипептидный аналог, связанные с модифицирующей группировкой, выбранной из группы, состоящей из:
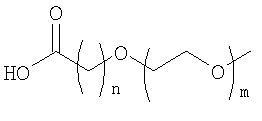
где n равно от 1 до 4, и m равно от 1 до 5;
 ;
;
 ;
;
 ;
;
 ;
;
 ,
,
где n равно 1, 2, 3, 4 или 5, и m равно 1, 2, 3 или 4;
 и
и
 .
.
51. Кристаллический Zn комплекс по п.50, где модифицирующая группировка выбрана так, чтобы сделать конъюгат инсулина таким же или более растворимым, чем соответствующий неконъюгированный инсулин.
52. Кристаллический Zn комплекс по п.50, где растворимость в воде конъюгата инсулина уменьшена путем добавления цинка.
53. Способ конъюгирования нативного инсулина или его полипептидного аналога, включающий активирование модифицирующей группировки по п.50 и связывание активированной модифицирующей группировки с нативным инсулином или его полипептидным аналогом.
54. Твердая или жидкая фармацевтическая композиция, приготовленная в виде препарата для перорального введения путем проглатывания внутрь, содержащая:
от приблизительно 40 до приблизительно 60% мас./мас. жирно-кислотного компонента, где данный жирно-кислотный компонент содержит насыщенные или ненасыщенные С4-12 жирные кислоты и/или соли таких жирных кислот;
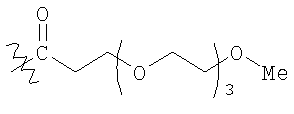
терапевтически эффективное количество комплекса инсулина, содержащего нативный инсулин или его полипептидный аналог, конъюгированный с модифицирующей группировкой, выбранной из группы, состоящей из:
 ;
;
 ;
;
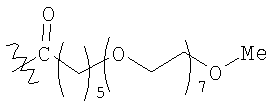 ;
;
 ,
,
где PAG представляет собой PAG-группировку, имеющую m субъединиц, и m равно от 1 до 20, и n равно от 1 до 20;
 ;
;
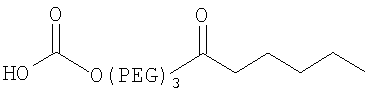 ;
;
 ;
;
 ;
;
 и
и
 ,
,
где модифицирующая группировка связана с инсулином по аминокислотным остаткам A1, B1 и/или В29.
55. Фармацевтическая композиция по п.54, содержащая фармацевтически приемлемый разбавитель, выбранный из группы, состоящей из связующих веществ, разрыхлителей, наполнителей, разбавителей, смазывающих веществ, скользящих веществ, усилителей текучести, вспомогательных веществ для прессования, красителей, подсластителей, консервантов, суспензирующих агентов, диспергирующих агентов, пленкообразующих веществ, покрытий, корригентов, типографских красок, целлюлоз, сахаров, маннитов, лактоз, усилителей растворения и кроскармеллоз.
56. Фармацевтическая композиция по п.55, приготовленная в форме, выбранной из группы, состоящей из таблеток, мини-таблеток, порошков, твердых желатиновых капсул или мягких желатиновых капсул.
57. Фармацевтическая композиция по п.54, где жирно-кислотный компонент представляет собой каприновую кислоту и/или лауриновую кислоту, и/или соли каприновой кислоты и/или лауриновой кислоты.
58. Фармацевтическая композиция по п.54, содержащая буферную соль, выбранную из группы, состоящей из фосфатного буфера, фосфата натрия, трио-буфера, лимонно-кислого буфера и этаноламинового буфера.
59. Фармацевтическая композиция по п.58, содержащая буферную соль, выбранную для достижения буферной емкости в месте абсорбции для поддержания локального pH от приблизительно 4,8 до приблизительно 9,5 или от приблизительно 5 до приблизительно 8.
60. Фармацевтическая композиция по п.54, дополнительно содержащая цинк, где растворимость в воде конъюгата инсулина уменьшена путем добавления цинка.
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНОГО КРИСТАЛЛИЧЕСКОГО АНАЛОГА ЦИНК-ИНСУЛИНА | 1995 |
|
RU2156257C2 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 2003087808 A1, 08.05.2003 | |||
| US 2003118510B A1, 26.06.2003 | |||
| US 2003083232 A1, 01.05.2003. | |||
Авторы
Даты
2010-06-27—Публикация
2005-07-19—Подача