Ссылки на родственные заявки
Настоящая заявка претендует на приоритет Предварительной заявки США №61/085,212, поданной 31 июля 2008 года.
Разработка изобретения была осуществлена при поддержке правительства по соглашению о сотрудничестве и поддержана грантами Национального института здравоохранения №№ DK40949 и DK074176. Правительство США может иметь определенные права на изобретение.
Уровень техники
Изобретение относится к аналогам полипептида, которые устойчивы к термическому разложению. В частности, настоящее изобретение относится к термостабильным аналогам инсулина. В частности, настоящее изобретение относится к аналогам инсулина, химически и термически стабилизированным включением фтора, хлора или брома в аминокислоту аналога инсулина. Эти элементы классифицируют как галогены, они отличаются от обычных компонентов белков атомным радиусом, электроотрицательностью, стереоэлектронным распределением частичных зарядов и воздействием на стереоэлектронные свойства соседних атомов в молекуле.
Создание сверх-стабильных белков, в том числе терапевтических агентов и вакцин, может быть особенно полезно для развивающихся стран, где электричество и охлаждение препаратов не всегда доступны. Примером используемого в терапии белка, чувствительного к термической деструкции, является инсулин. Проблемы, связанные с его химической и физической деградацией, углубляются в ожидании эпидемии сахарного диабета в Африке и Азии. Поскольку скорость химической деградации аналогов инсулина обратно коррелирует с их относительной стабильностью, разработка сверх-стабильных композиций может повысить безопасность и эффективность заместительной инсулиновой терапии в таких проблемных регионах.
Полезность фторирования низкомолекулярных органических веществ известна в медицинской химии. Фторированные функциональные группы имеют ключевое значение для эффективности таких широко описанных низкомолекулярных препаратов как аторвастатин (Liptor™), который является ингибитором биосинтеза холестерина, и гидрохлорид флуоксетина (Prozac™), который является селективным ингибитором обратного захвата серотонина, используемым в лечении депрессии и других аффективных расстройств. Хотя радиус атома фтора близок радиусу атома водорода, его больший индуктивный эффект изменяет стереоэлектронные свойства указанных веществ, что, в свою очередь, повышает их биологическую активность. Аналогичные физико-химические соображения для органических веществ относятся к включению больших атомов галогенов, таких как хлор и бром. Низкомолекулярный монтелукаст натрия (Singulair™) является ингибитором лейкотриенов, фармацевтические свойства которого усиливаются за счет ковалентного включения атома хлора.
Ранее внимание исследователей было сосредоточено на использовании полифторированных алифатических боковых цепей (таких, как трифтор-γ-CF3-Val, трифтор-δ-CF3-Val, трифтор-δ-CF3-Ile, гексафтор-γ1,2-CF3-Val и гексафтор-δ1,2-CF3-Leu) для максимального усиления гидрофобности, связанного с этой модификацией. Примером может служить стабилизация гомодимерной модели а-спирального мотива переплетенных спиралей типа coiled coil. Интерфазные алифатические цепи в данной структуре были заменены на трифторированные аналоги, стабильность полученного фторированного ядра повысилась на 0,3-2,0 ккал/моль. Степень стабилизации на атом фтора составляет <0,1 ккал/моль. Большая стабилизация на атом фтора была достигнута для неродственного α-спирального домена при замещении одного внутреннего Phe на пентафтор-Phe (F5-Phe) (ΔΔGu (изменение свободной энергии Гиббса разворачивания белка) составило 0,6 ккал/моль на пять атомов фтора). Стабилизация затрагивает только одну конкретную позицию в белке, что предполагает наличие конкретного пространственного окружения для реализации механизма стабилизации. Структура F5-Phe-модифицированного домена идентична не модифицированному домену. Однако структурная стабилизация является только частью требований к биологически активному полипептиду. Полипептид также должен сохранять, по меньшей мере, значительную часть своей активности.
В литературе широко описано использование фторсодержащих меток в белках в качестве 19F-ЯМР-зондов. Хотя такие метки обычно рассматриваются как не влияющие на изучаемый объект, при применении фторсодержащих аминокислот в белковой инженерии исследователи стремятся использовать их измененные физико-химические свойства. Исследование модели α-спиральной складки (субдомен головки виллина), содержащей одну замену F5-Phe, показало, что сам факт и степень влияния такой модификации на стабильность белка зависит от деталей структурного окружения. Действительно, кажущаяся стабильность этой модели складки была повышена за счет введения F5-Phe только в одну из семи исследованных позиций в ядре. Следует отметить, однако, что указанный стабилизирующий эффект был продемонстрирован только на нестандартном аналоге полипептида, содержащем атом серы в основной цепи рядом с местом фторирования; по данным авторов изобретения описанное F5-Phe замещение в субдомене головки виллина с нативной полипептидной основной цепью не влияет на ее стабильность. Таким образом, по нашим данным в литературе ранее не приводилось bona fide данных, демонстрирующих повышение стабильности белка из-за галогенирования ароматических остатков в нативном белке. Указанные наблюдения позволяют предположить, что в целом гидрофобное окружение само по себе не является гарантией того, что модификация приведет к стабилизации белка. Поскольку белки часто стабилизированы взаимодействиями между ароматическими остатками, характеризующимися определенными расстояниями и углами, набор стабилизирующих F5-Phe замен может соответствовать особенно благоприятному геометрическому расположению перфторарильных/арильных групп. Такие взаимодействия возникают в результате асимметричного распределения частичных зарядов в этих ароматических системах. Изменение химических, физических и биологических свойств белков с помощью сайт-специфического включения атомов хлора и брома в модифицированные остатки аминокислот в меньшей степени описано в научной литературе по сравнению с приведенными выше эффектами включения атомов фтора.
Ароматические боковые цепи могут участвовать в различных слабых полярных взаимодействиях с участием не только соседних ароматических колец, но также и других источников положительного или отрицательного электростатического потенциала. Примеры включают карбонильные и амидные группы пептидных связей в основной цепи.
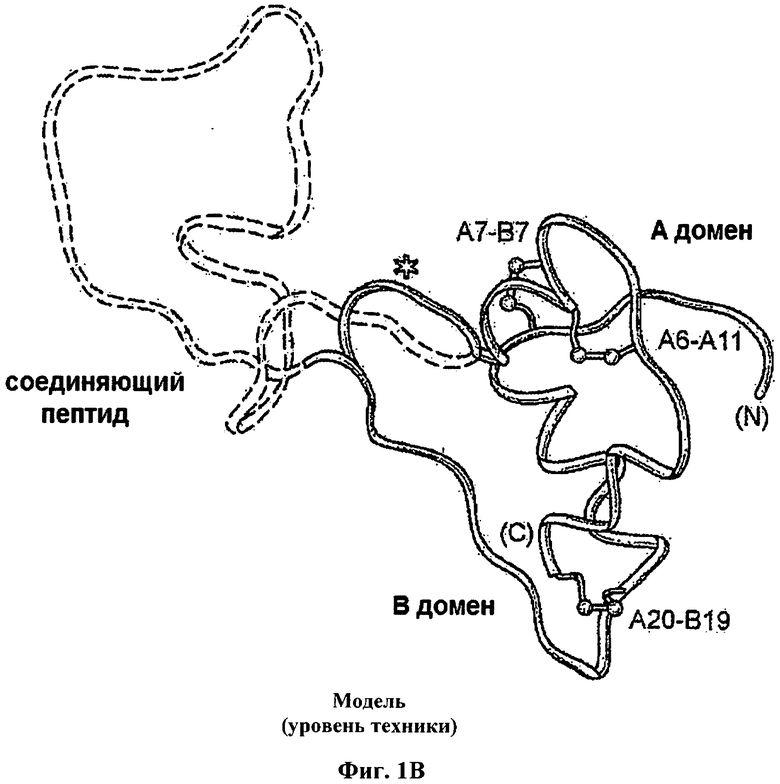
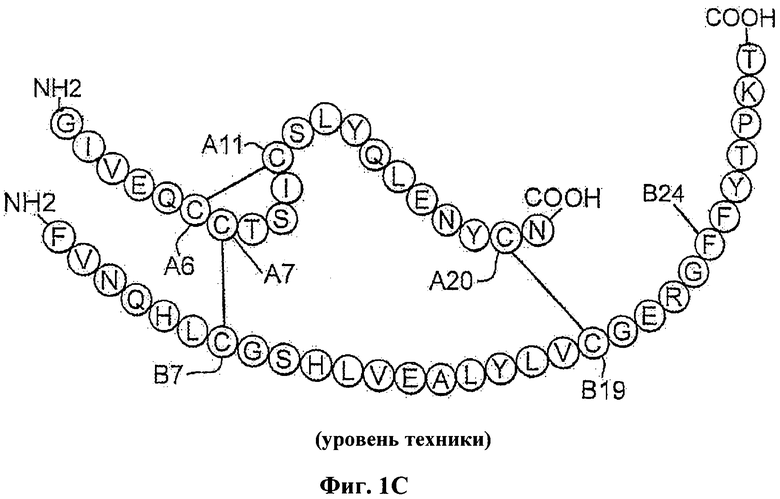
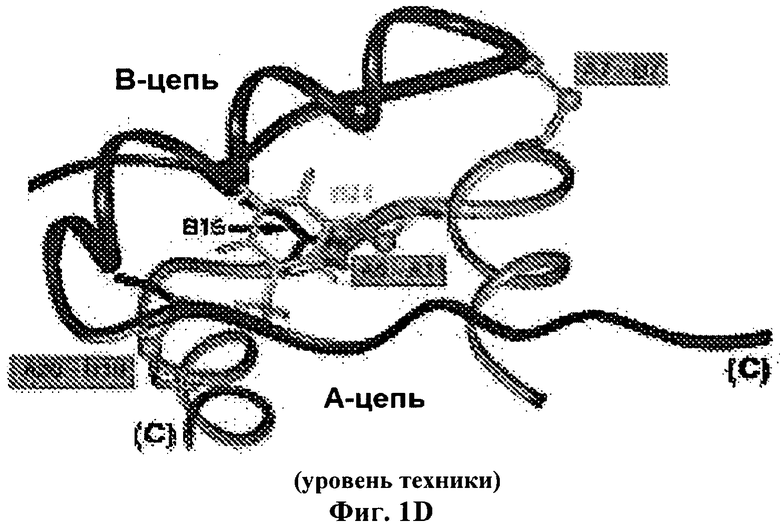
Введение инсулина уже давно используют для лечения сахарного диабета. Инсулин представляет собой небольшой глобулярный белок, который играет центральную роль в обмене веществ у позвоночных. Инсулин состоит из двух цепей: А-цепи, содержащей 21 остаток, и В-цепи, содержащей 30 остатков. Гормон депонирован в β-клетках поджелудочной железы в виде Zn2+-стабилизированного гексамера, но функционирует в виде свободных от Zn2+ мономеров в кровотоке. Инсулин является продуктом одноцепочечного предшественника, проинсулина, в котором соединяющий район (35 остатков) связывает С-концевой остаток В-цепи (остаток В30) с N-концевым остатком А-цепи (Фиг.1А). Хотя структура проинсулина не была определена, существуют различные доказательства того, что она состоит из инсулиноподобного ядра и неупорядоченного соединяющего пептида (Фиг.1В). Формирование трех специфичных дисульфидных мостиков (А6-А11, А7-В7 и А20-В19; Фиг.1А и 1В.) считается связанным с окислительным фолдингом проинсулина в полости шероховатого эндоплазматического ретикулума (ЭР). Проинсулин образует растворимые Zn2+-скоординированные гексамеры вскоре после экспорта из ЭР в аппарат Гольджи. Эндопротеолитическое расщепление и превращение в инсулин происходит в незрелых секреторных гранулах с последующей морфологической конденсацией. Кристаллы гексамеров связанного с цинком инсулина, хранящиеся в зрелых гранулах, были визуализированы с помощью электронной микроскопии (ЭМ).
Различные аминокислотные замены в инсулине были исследованы на предмет влияния на термодинамическую стабильность и биологическую активность. При этом каких-либо устойчивых связей между стабильностью и активностью установлено не было. Некоторые замены, которые увеличивают термодинамическую стабильность, также повышают связывание с рецепторами инсулина, другие замены, которые повышают стабильность, препятствуют такому связыванию. Описаны эффекты замещения ThrA8 на ряд других аминокислот, установленные на человеческом инсулине дикого типа и инженерных мономерах инсулина, содержащих три не связанных замены в В-цепи (HisB10→Asp, ProB28→Lys и LysB29→Pro). Также в уровне техники известны примеры замен, ускоряющих или замедляющих динамику поглощения. Такие замены (например. AspB28 в Novalog® и [LysB28, ProB29] в Humalog®) зачастую могут быть связаны с ускоренным формированием фибрилл и уменьшенной физической стабильностью. На склонность к образованию фибрилл была протестирована серия из десяти аналогов человеческого инсулина, включая AspB28-инсулин и AspB10-инсулин. Все десять аналогов оказались более склонны к образованию фибрилл при рН 7,4 и 37°С по сравнению с человеческим инсулином. Десять исследованных замен локализовались в различных частях молекулы инсулина и, вероятно, были связаны с широким набором изменений в классической термодинамической устойчивости. Хотя был описан широкий диапазон эффектов, не было выявлено корреляции между активностью и термодинамической стабильностью аналогов.
Инсулин является небольшим глобулярным белком, который легко может быть получен химическим синтезом и полусинтезом, что облегчает включение нестандартных боковых цепей. Инсулин включает три остатка фенилаланина (позиции B1, B24 и В25) и структурно подобного тирозина в положении В26. Ароматическое кольцо PheB24, консервативное в инсулинах позвоночных и инсулиноподобных факторах роста, расположено напротив (но не внутри) гидрофобного ядра для стабилизации супер-вторичной структуры В-цепи. PheB24 лежит на классической рецептор-связывающей поверхности, было предположено, что он направляет изменение конформации при связывании с рецептором. Остаток PheB25 расположен на поверхности мономера инсулина, в то время как TyrB26 взаимодействует с рядом алифатических боковых цепей (IleA2, ValA2, и ValB12) на одном из краев ядра. Связанные с B24 конформационные изменения, как предполагают, позволяют PheB25 и TyrB26 связывать различные домены инсулинового рецептора.
Современная теория образования белковых фибрилл утверждает, что механизм формирования фибрилл протекает через частично структурированное промежуточное состояние, которое в свою очередь, агрегирует с образованием амилоидогенного ядра. Согласно этой теории, аминокислотные замены, которые стабилизируют нативное состояние, могут стабилизировать или могут не стабилизировать частично структурированное промежуточное состояние и могут увеличивать или не увеличивать (или уменьшать) барьер свободной энергии между нативным состоянием и промежуточным состоянием. Таким образом, современная теория указывает, что склонность данной аминокислотной замены в молекуле инсулина увеличивать или уменьшить риск образования фибрилл является весьма непредсказуемой.
Образование фибрилл, которое является серьезной проблемой при производстве, хранении и использовании инсулина и аналогов инсулина для лечения диабета, усиливается при повышенной температуре, пониженном рН, перемешивании или в присутствии мочевины, гуанидина, этанола в качестве сорастворителя, или гидрофобных поверхностей. Действующие правила оборота лекарственных средств в США указывают, что инсулин не может быть использован, если процент образования фибрилл составляет приблизительно один процент или более. Поскольку образование фибрилл усиливается при более высоких температурах, страдающие диабетом лица должны держать инсулин в охлажденном состоянии до использования. Образование фибрилл инсулина или аналога инсулина может составлять особую проблему для пациентов с сахарным диабетом, использующих внешнюю инсулиновую помпу, которая вводит в тело пациента небольшие количества инсулина или аналога инсулина через определенные промежутки времени. При таком способе применения инсулин или аналог инсулина не сохраняется в охлажденном состоянии в насосе и образование фибрилл инсулина может привести к блокировке катетера для введения инсулина или аналога инсулина пациенту, что потенциально может привести к непредсказуемым колебаниям уровня глюкозы в крови или даже опасной гипергликемии. По меньшей мере один недавний доклад показал, что инсулин лизпро (аналог инсулина, в котором остатки на позициях В28 и В29 поменяли местами по сравнению с остатками в человеческом инсулине дикого типа; аналог продают под торговой маркой Humalog®) может быть особенно склонен к образованию фибрилл и может приводить к выходу из строя катетера инсулинового насоса.
Образование фибрилл инсулина доставляет еще большее беспокойство при использовании имплантируемой инсулиновой помпы, где инсулин находится в имплантате в течение 1-3 месяцев при высокой концентрации и при физиологической температуре (т.е. при 37°С), а не при температуре окружающей среды, как в случае внешней помпы. Кроме того, перемешивание, вызванное нормальным движением, также приводит к ускорению образования фибрилл инсулина. Несмотря на повышенную склонность к образованию фибрилл инсулина имплантируемые инсулиновые помпы все еще являются предметом научно-исследовательских работ в связи с потенциальными преимуществами таких систем. Эти преимущества включают интраперитонеальное введение инсулина в портальную систему кровообращения, что точнее имитирует нормальную физиологическую доставку инсулина по сравнению с подкожными инъекциями, которые обеспечивают доставку инсулина пациенту через системное кровообращение. Интраперитонеальное введение обеспечивает более быстрое и постоянное во времени поглощение инсулина по сравнению с подкожной инъекцией, при которой уровень поглощения и деградации инсулина может варьировать от одного места инъекции к другому. Введение инсулина с помощью имплантируемой помпы также потенциально может сделать введение более комфортным для пациентов. Несмотря на то, что усилия по предотвращению образованию фибрилл, такие как добавление поверхностно-активного вещества в резервуар, привели к некоторому улучшению, его до сих пор считали недостаточным для обеспечения надежного использования имплантируемых инсулиновых помп пациентами с сахарным диабетом в отсутствие строго контролируемых условий клинических испытаний.
Как отмечалось выше, в развивающихся странах стоит задача относительно безопасного хранения, доставки и использования лекарственных препаратов и вакцин. Эта проблема затрудняет использование чувствительных к температуре композиций инсулина в регионах Африки и Азии, в которых отсутствует постоянный доступ к электричеству и холодильному оборудованию, причем проблема может усугубиться в условиях надвигающейся эпидемии диабета в развивающихся странах. Скорость деградации инсулина увеличивается в 10 и более раз при увеличении температуры на каждые 10°С выше 25°С, рекомендованная температура хранения <30°С, предпочтительно хранить при охлаждении. При более высоких температурах инсулин подвергается химической деградации (изменения ковалентной структуры, такие как формирование изо-аспарагиновой кислоты, перестройка дисульфидных мостиков и формирование ковалентных полимеров) и физической деградации (ненативной агрегации и образованию фибрилл).
Были описаны аминокислотные замены в инсулине, стабилизирующие белок и увеличивающие его связывание с рецептором инсулина (IR) и перекрестное связывание с гомологичным рецептором инсулиноподобного фактора роста (IGFR), что приводит к риску развития рака. Известным в уровне техники примером является замена HisB10 на аспарагиновую кислоту. Хотя AspB10-инсулин обладает предпочтительными фармацевтическими свойствами в части стабильности и фармакокинетики, его усиленное связывание с рецептором вызывало опухоли у крыс линии Спрэг-Доули. Хотя существует множество потенциальных замен в А- или В-цепи, которые могут быть введены в AspB10-инсулин или его аналоги для уменьшения его связывания с рецептором инсулина (IR) и рецептором инсулиноподобного фактора роста (IGFR) до уровней, аналогичных человеческому инсулину, такие замены обычно уменьшают устойчивость инсулина (или аналогов инсулина) и повышают его восприимчивость к химической и физической деградации. Было бы желательно разработать метод модификации инсулина и аналогов инсулина, позволяющий увеличить аффинность к рецептору и в то же время повысить стабильность и устойчивость к образованию фибрилл. Это потребует введения ряда стабилизирующих модификаций, которые в различной степени уменьшат связывание с IR и IGFR, чтобы уменьшить потенциальную канцерогенность сверхактивных с точки зрения связывания рецептора аналогов.
Таким образом, существует потребность в аналогах инсулина, стабилизированных введением нестандартных аминокислот, содержащих атом галогена в качестве нестандартной функциональной группы, и сохраняющих, по меньшей мере, часть биологической активности.
Краткое описание изобретения
Одним из аспектов настоящего изобретения является аналог инсулина, характеризующийся увеличенной стабильностью за счет введения галогена в аминокислоту, где аналог проявляет, по меньшей мере, часть биологической активности соответствующего негалогенированного инсулина или аналога инсулина.
В настоящем изобретении предусмотрен аналог инсулина, включающий полипептидную цепь В, которая включает галогенированный фенилаланин в положении В24, В25 или В2б. В одном из вариантов галогенированный фенилаланин находится в положении В24. В другом варианте галогенированный фенилаланин представляет собой орто-монофторфенилаланин, орто-монобромфенилаланин или орто-монохлорфенилаланин. В другом варианте аналог инсулина представляет собой аналог инсулина млекопитающего, такой как аналог человеческого инсулина. В некоторых вариантах полипептидная цепь В имеет аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ. ID. NOS. 4-8 и последовательностей, имеющих три или менее дополнительных аминокислотных замен.
Также предусмотрены молекулы нуклеиновой кислоты, кодирующие аналог инсулина, включающий полипептидную цепь В, которая включает галогенированный фенилаланин в положении В24, В25 или В26. В одном примере галогенированный фенилаланин кодируется стоп-кодоном, таким как TAG. Такие молекулы нуклеиновой кислоты могут содержаться в векторе экспрессии, а такой вектор экспрессии может содержаться в клетке-хозяине.
В изобретении также предусмотрен способ лечения пациента. Способ включает введение физиологически эффективного количества аналога инсулина или его физиологически приемлемой соли пациенту, где аналог инсулина или его физиологически приемлемая соль включает полипептидную цепь В, содержащую галогенированный фенилаланин в положении В24, В25 или В26. В одном из вариантов галогенированный фенилаланин в вводимом пациенту аналоге инсулина находится в положении В24. В другом варианте галогенированный фенилаланин представляет собой орто-монофторфенилаланин, орто-монобромфенилаланин или орто-монохлорфенилаланин. В еще одном варианте аналог инсулина представляет собой аналог инсулина млекопитающего, такой как аналог человеческого инсулина. В некоторых вариантах полипептидная цепь В имеет аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ. ID. NOS. 4-8 и последовательностей, имеющих три или менее дополнительных аминокислотных замен.
Краткое описание фигур
На Фиг.1А схематически представлена последовательность человеческого проинсулина, включающая А-цепь, В-цепь и соединяющий район, фланкированный сайтами расщепления из двух основных остатков (темные кружки), сам С-пептид показан не закрашенными кружками.
На Фиг.1В приведена структурная модель проинсулина, состоящая из инсулиноподобной части и неупорядоченного соединяющего пептида (пунктирная линия).
На Фиг.1C схематически представлена последовательность человеческого инсулина с указанием положения остатка В24 в В-цепи.
На Фиг.1D приведена модель мономера инсулина, показан ароматический остаток PheB24 относительно трех дисульфидных мостиков. Показаны соседние боковые цепи LeuB15 (стрелка) и PheB24. А-цепь и В-цепь показаны светло-серым и темно-серым, соответственно, атомы серы цистеина показаны в виде кругов.
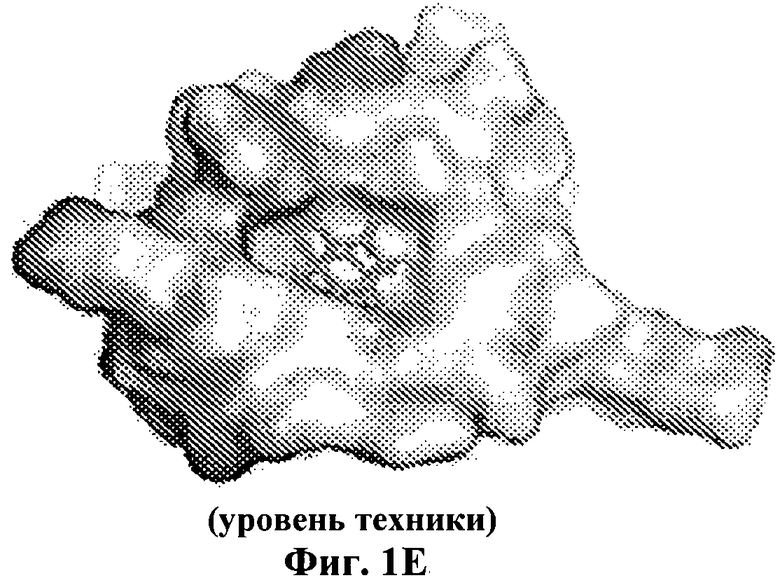
На Фиг.1Е приведена модель инсулина, показан PheB24 с боковой цепью в кармане на краю гидрофобного ядра.
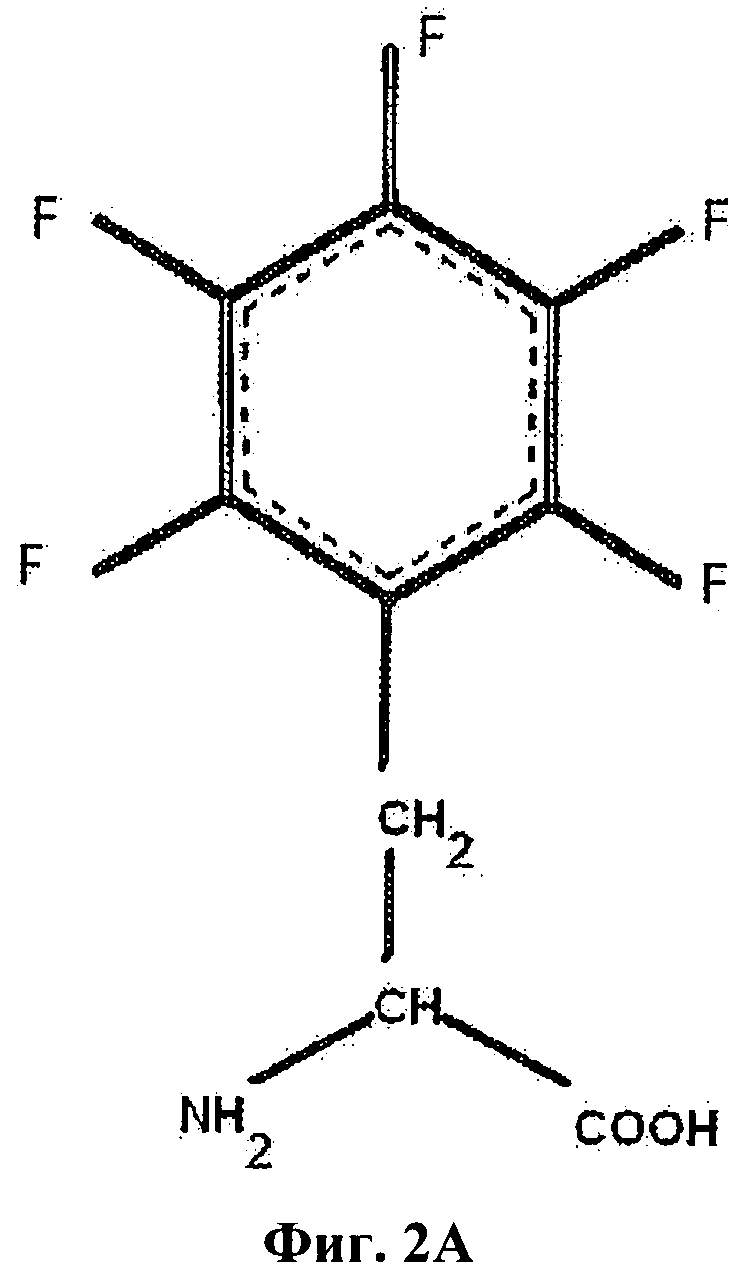
На Фиг.2А приведен пентафтор-фенилаланин (F5-Phe).
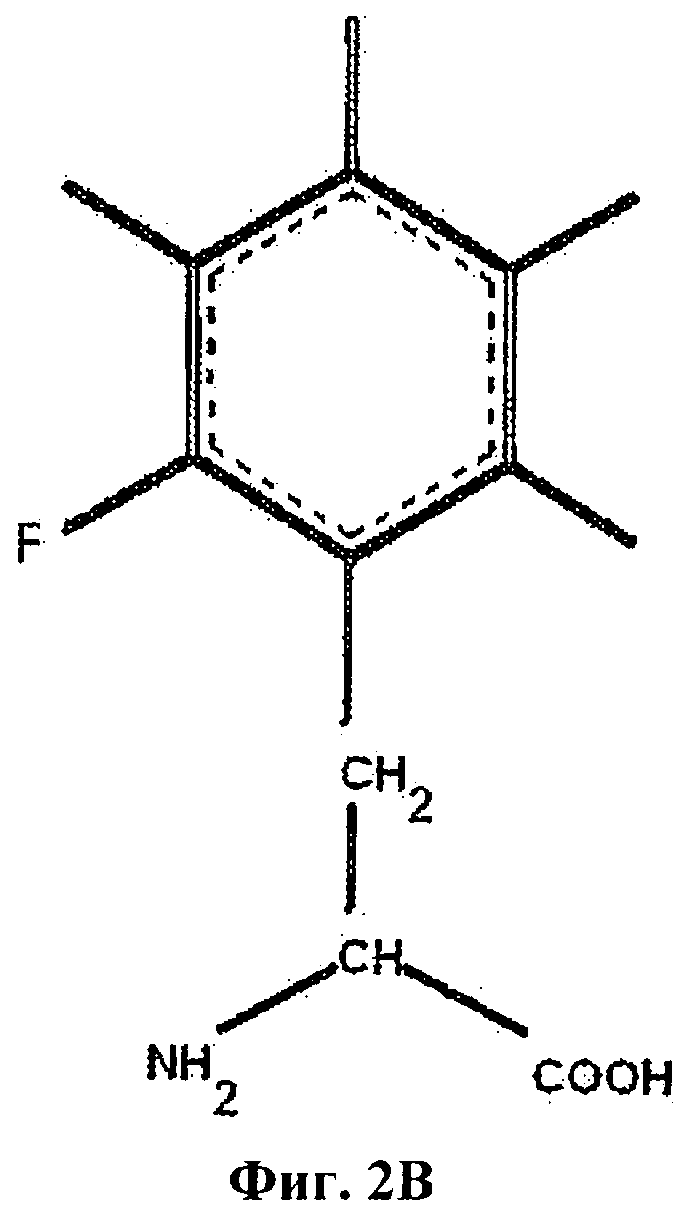
На Фиг.2В приведен орто-монофторфенилаланин (2F-Phe).
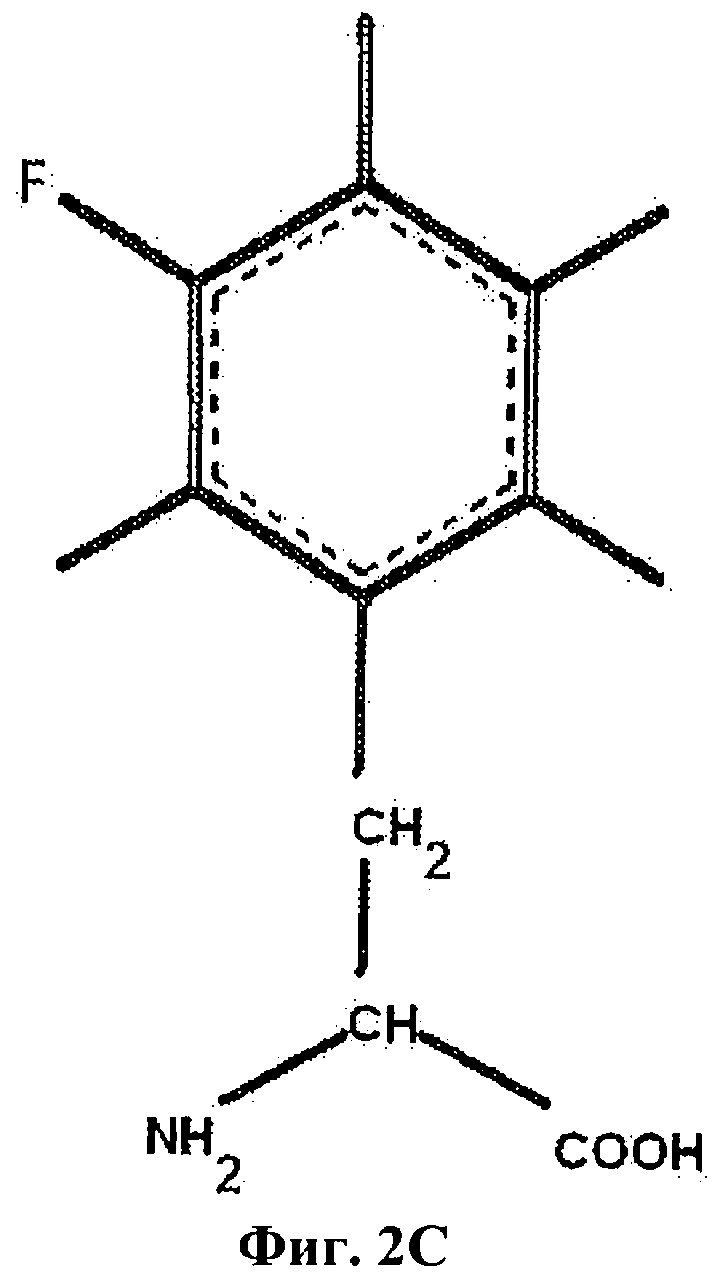
На Фиг.2С приведен мета-монофторфенилаланин (3F-Phe).
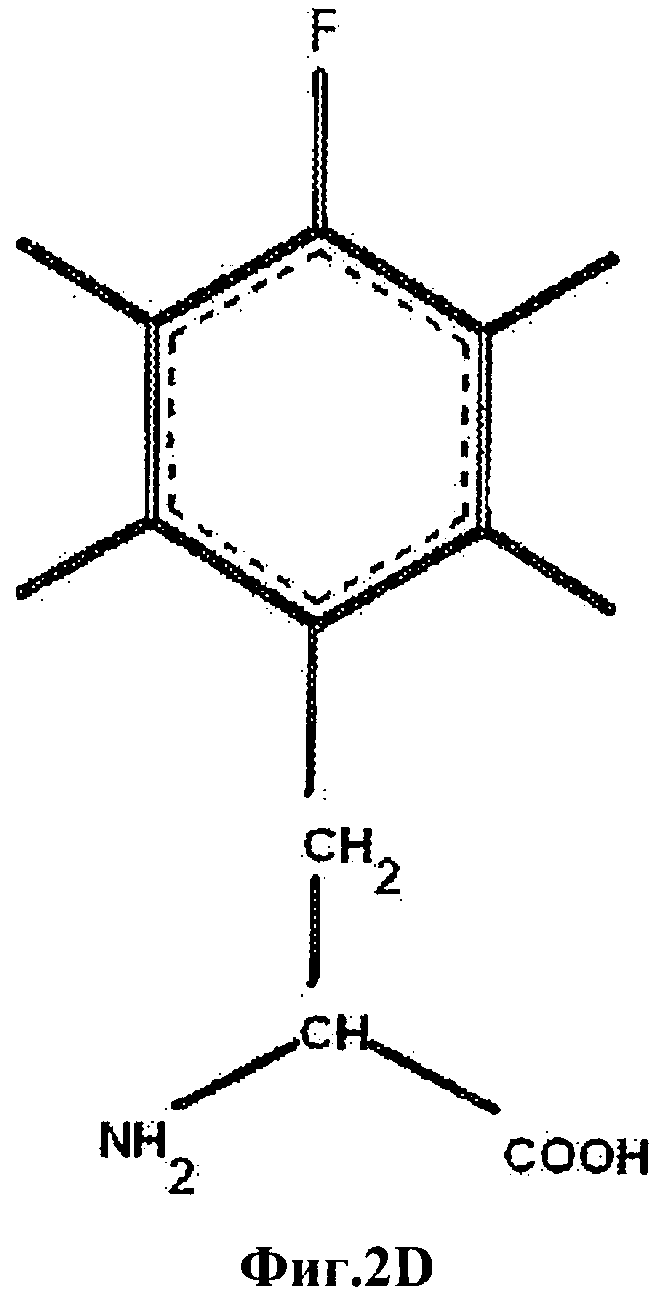
На Фиг.2D приведен пара-монофторфенилаланин (4F-Phe).
На Фиг.3 приведен набор из четырех спектров кругового дихроизма (КД) для длин волн в области дальнего УФ. Панель А: DKP-инсулин (сплошная черная линия) и 2F-PheB24-DKP-инсулин (□); панель В: DKP-инсулин (сплошная черная линия) и 3F-PheB24-DKP-инсулин (▲); панель С: DKP-инсулин (сплошная черная линия) и 4F-PheB24-DKP-инсулин (▼); панель D: DKP-инсулин (сплошная черная линия) и F5-PheB24-DKP-инсулин (●)
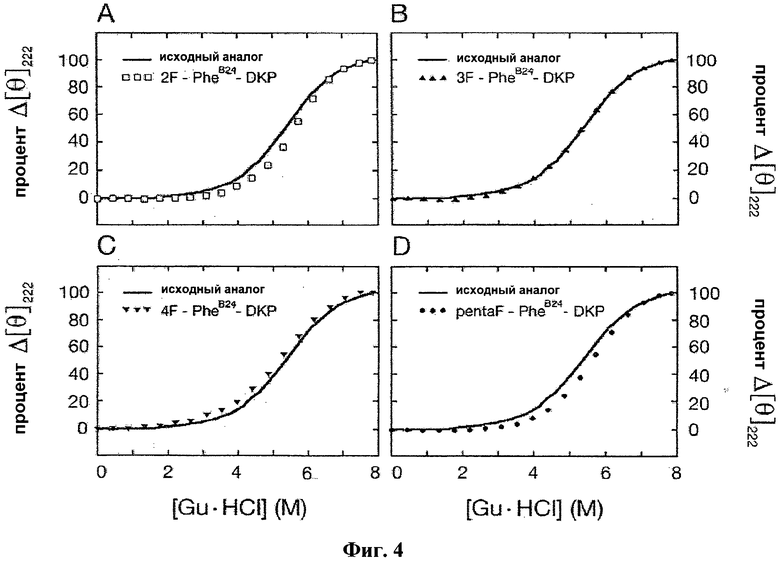
На Фиг.4 приведен набор из четырех графиков КД, отражающих денатурацию под действием гуанидина. Панель А: DKP-инсулин (сплошная черная линия) и 2F-PheB24-DKP-инсулин (□); панель В: DKP-инсулин (сплошная черная линия) и 3F-PheB24-DKP-инсулин (▲); панель С: DKP инсулин (сплошная черная линия) и 4F- PheB24-DKP-инсулин (▼); панель D: DKP-инсулин (сплошная черная линия) и F5-PheB24-DKP-инсулин (●)
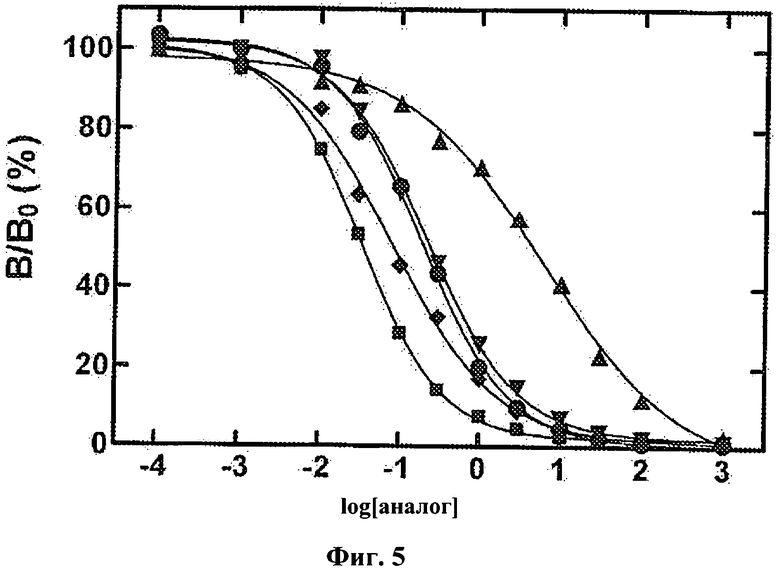
На Фиг.5 приведен график, показывающий результаты исследования аналогов инсулина на связывание рецептора. Относительную активность определяли с помощью анализа с конкуренцией за связывание, в котором связанный с рецептором 125I-меченый человеческий инсулин вытесняли увеличивающимися концентрациями DKP-инсулина (■) или его аналогов: пентафтор-PheB24 (▲), 2F-PheB24 (▼), 3F-PheB24 (♦) и 4F-PheB24-инсулина (●).
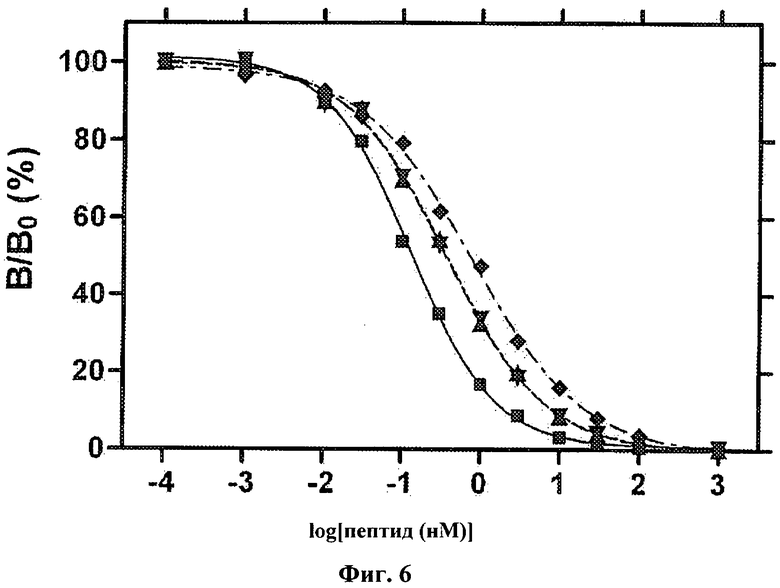
На Фиг.6 приведен график, показывающий результаты исследования аналогов инсулина на связывание рецептора. Относительную активность определяли с помощью анализа с конкуренцией за связывание, в котором связанный с рецептором 125I-меченый человеческий инсулин вытесняли увеличивающимися концентрациями KP-инсулина (■) или его аналогов: 2Bг-PheB24-KP-инсулина (▲), 2Cl-PheB24-KP-инсулина (▼), 2F-PheB24-KP-инсулина (♦) и 4F-PheB24-KP-инсулина (●). В анализе использовали В-изоформу рецептора инсулина и 125I-TyrA14-человеческий инсулин в качестве трейсера.
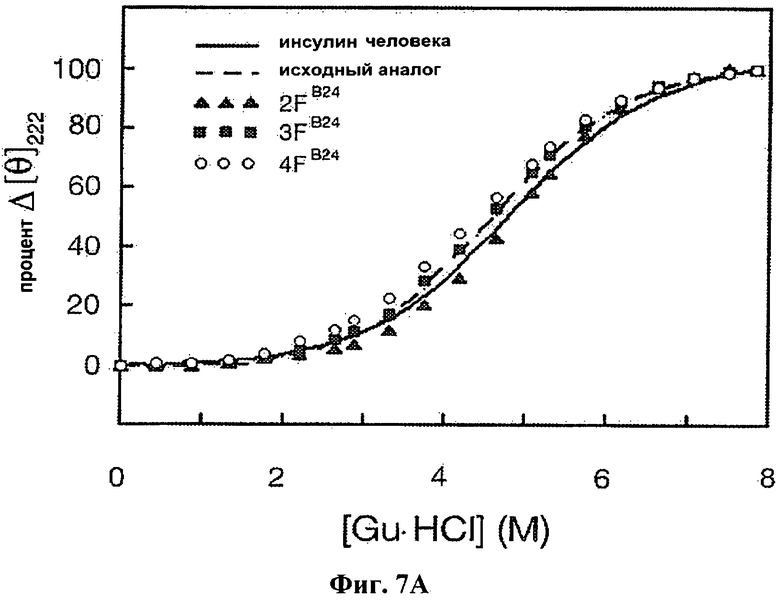
На Фиг.7А приведен график КД, отражающий денатурацию под действием гуанидина человеческого инсулина (сплошная линия), KP-инсулина (пунктирная линия), монофторзамещенных аналогов KP-инсулина 2F-PheB24-KP-инсулина (▲), 3F-PheB24-KP-инсулина (■) и 4F-PheB24-KP-инсулина (●).
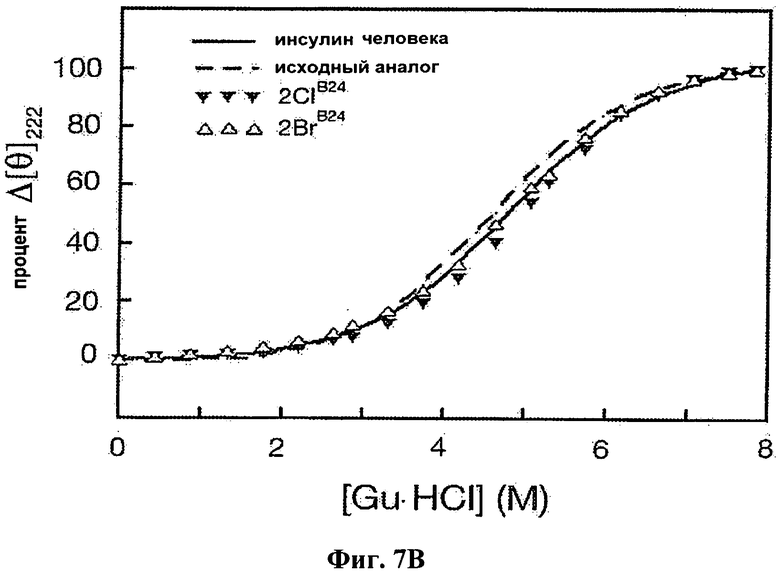
На Фиг.7В приведен график КД, отражающий денатурацию под действием гуанидина человеческого инсулина (сплошная линия), KP-инсулина (пунктирная линия), 2-Cl-PheB24-KP-инсулина (▼) и 2-Br-PheB24-KP-инсулина (Δ).
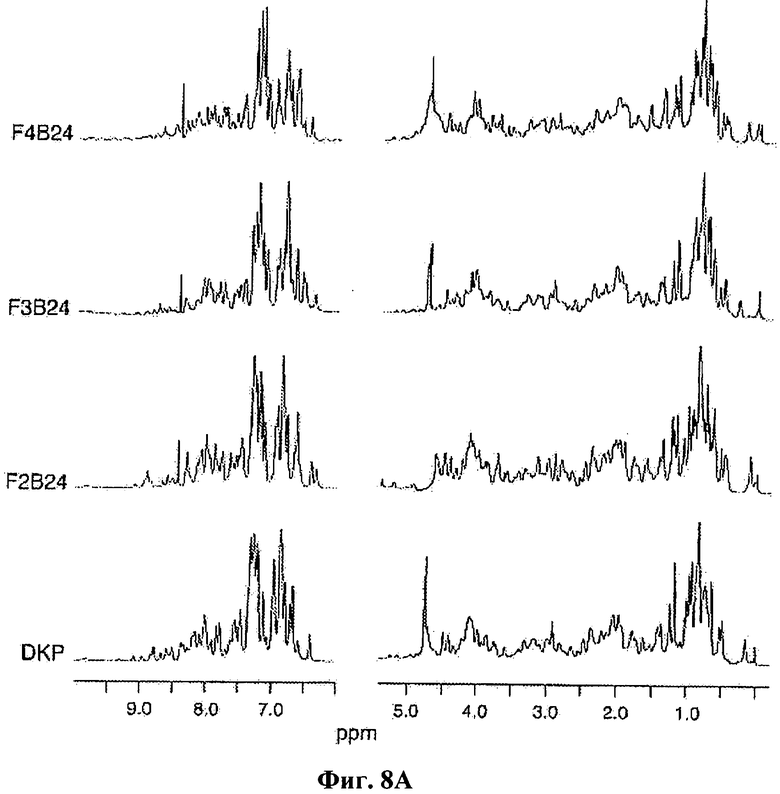
На Фиг.8А приведены 1Н-ЯМР спектры для сравнения монофторзамещенных в положениях 2, 3, и 4 PheB24 аналогов DKP-инсулина с DKP-инсулином, снятые при частоте 700 МГц при 32°С и pD 7,0.
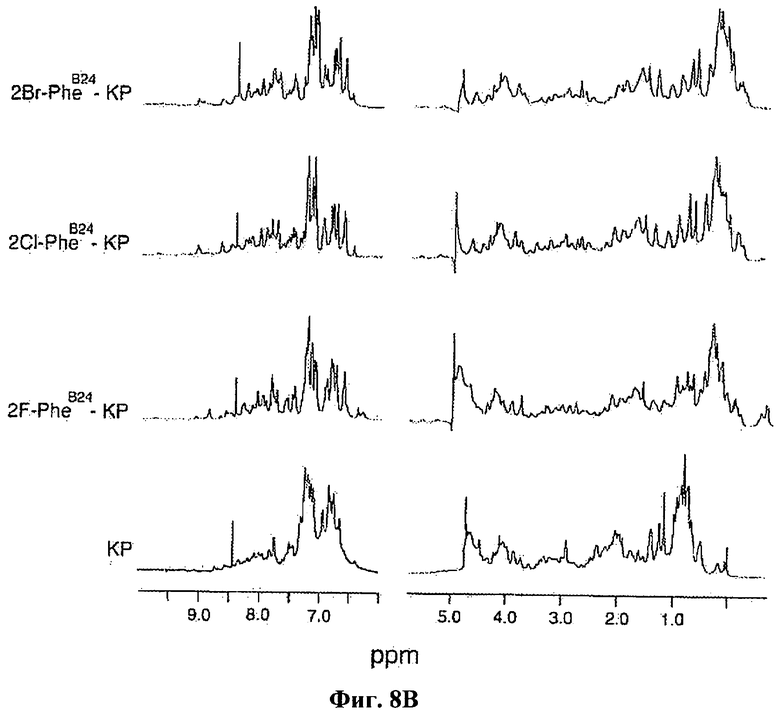
На Фиг.8В приведены спектры ЯМР для сравнения фтор-, бром- и хлорзамещенных в положении 2 PheB24 аналогов KP-инсулина с KP-инсулином, снятые при частоте 700 МГц при 32°С и pD 7,0.
Раскрытие изобретения
Настоящее изобретение относится к аналогам инсулина с увеличенной за счет введения галогена в аминокислоту стабильностью, где аналог сохраняет, по меньшей мере, часть биологической активности соответствующего негалогенированного инсулина или аналога инсулина. В частности, в настоящем изобретении предусмотрены аналоги инсулина с увеличенной стабильностью за счет введения галогена в одну аминокислоту, где аналог сохраняет, по меньшей мере, часть биологической активности соответствующего негалогенированного инсулина или аналога инсулина. В одном примере в настоящем изобретении предусмотрен аналог инсулина с увеличенной стабильностью за счет введения фтора, хлора или брома в аминокислоту, где аналог сохраняет, по меньшей мере, часть биологической активности соответствующего негалогенированного инсулина или аналога инсулина. Одной из потенциальных целей изобретения является увеличение химической и физической устойчивости аналога инсулина при сохранении части его биологической активности; другая цель относится к изменению связывания рецептора аналогом инсулина, при этом связывание аналога не должно превышать таковое человеческого инсулина. Для достижения этих целей в настоящем изобретении предусмотрены аналоги инсулина, содержащие замену на остаток галогенированного фенилаланина (Phe) в положении В24, В25 и В26. Замены на галогенированный фенилаланин в положениях В24 и В25 не изменяют основной аминокислотной последовательности инсулина или аналога инсулина, а при введении галогенированного фенилаланина в положение В26 инсулина происходит замещение тирозина (Tyr), находящегося в этом положении в последовательности инсулина дикого типа.
Настоящее изобретение, однако, не ограничивается человеческим инсулином и его аналогами. Также предусмотрено, что описанные замены могут быть введены в инсулины животных, включая, но не ограничиваясь, инсулином свиньи, бычьим инсулином, лошадиным и собачьим инсулинами.
Кроме того в силу сходства между человеческим инсулином и инсулинами животных и использования в прошлом инсулинов животных для пациентов с сахарным диабетом также предусмотрено, что в последовательность инсулина могут быть введены другие незначительные изменения, особенно могут быть введены замены, которые считают "консервативными". Например, могут быть введены дополнительные аминокислотные замены в пределах групп аминокислот с аналогичными боковыми цепями. К нейтральным гидрофобным аминокислотам относят аланин (Ala или А), валин (Val или V), лейцин (Leu или L), изолейцин (Ile или I), пролин (Pro или Р), триптофан (Trp или W), фенилаланин (Phe или F) и метионин (Met или М). К нейтральным полярным аминокислотам, которые могут заменять друг друга в рамках своей группы, относят глицин (Gly или G), серии (Ser или S), треонин (Thr или Т), тирозин (Tyr или Y), цистеин (Cys или С), глутамин (Glu или Q) и аспарагин (Asn или N). Основные аминокислоты включают лизин (Lys или K), аргинин (Arg или R) и гистидин (His или Н). Кислые аминокислоты включают аспарагиновую кислоту (Asp или D) и глутаминовую кислоту (Glu или Е). Если иное не указано отдельно или не очевидно из контекста, все аминокислоты, упомянутые в данном документе, являются L-аминокислотами. В одном примере аналог инсулина по изобретению включает три или менее консервативных замен кроме введения галогенированного Phe по изобретению. В другом примере аналог инсулина по изобретению включает одну или менее консервативных замен кроме введения галогенированного Phe по изобретению.
В настоящем описании и Формуле изобретения различные аминокислоты в инсулине или аналоге инсулина могут быть обозначены с указанием аминокислотного остатка с последующим указанием аминокислотной позиции, необязательно надстрочным шрифтом. Указание положения аминокислоты включает указание А- или В-цепи инсулина, в которой находится замена. Таким образом, PheB24 обозначает фенилаланин двадцать четвертом положении в В-цепи инсулина, а PheB25 обозначает фенилаланин в двадцать пятом положении в В-цепи инсулина и PheB26 обозначает замену тирозина на фенилаланин в двадцать шестом положении в В-цепи инсулина. Фторсодержащие аминокислоты могут быть указаны с префиксом "F-", бромированные аминокислоты могут быть указаны с префиксом "Br-" и хлорированные аминокислоты могут быть указаны с префиксом "Cl-". Таким образом, фторированный фенилаланин может быть обозначен как "F-Phe," хлорированный фенилаланин может быть обозначен как "Cl-Phe" и бромированный фенилаланин может быть обозначен как "Br-Phe". В случае фенилаланина положение галоидных заместителей или заместителей в фенильной боковой цепи может быть далее указано номером атома углерода, к которому присоединен галоген. Таким образом, орто-монофторфенилаланин (приведен на Фиг.2В) может быть обозначен аббревиатурой "2F-Phe", мета-монофторфенилаланин (приведен на Фиг.2С) может быть обозначен "3F-Phe" и пара-монофторфенилаланин (приведен на Фиг.2D) может быть обозначен "4F-Phe". Пентафторфенилаланин (приведен на Фиг.2А) может быть обозначен аббревиатурой "F5-Phe". Кроме того, орто-монобромфенилаланин может быть обозначен "2Br-Phe" и орто-монохлорфенилаланин может быть обозначен аббревиатурой "2Cl-Phe".
Фенилаланин в положении В24 является инвариантной аминокислотой для функционального инсулина и содержит ароматическую боковую цепь. О биологическом значении PheB24 в инсулине свидетельствует известная в клинике мутация (SerB24), являющаяся причиной сахарного диабета у человека. Как показано на Фиг.1D и 1Е, считается, что PheB24 расположен на краю гидрофобного ядра на классической молекулярной поверхности, ответственной за связывание с рецептором. Модели основаны на кристаллографических исследованиях протомеров (2-Zn молекула 1; идентификатор банка данных белков 4INS). PheB24 находится в С-концевом β-тяже В-цепи (остатки В24-В28) и примыкает к центральной α-спирали (остатки В9-В19). Одна сторона и край ароматического кольца расположены в неглубоком кармане, образованном LeuB15 и CysB19; другая сторона и край экспонированы растворителю (Фиг.1Е). Это карман частично окружен карбонильными и амидными группами главной цепи, что создает сложное и асимметричное электростатическое окружение. В описании приведены эффекты введения почти симметричного заместителя тетрафторфенилаланина (F5-PheB24) (при его увеличенной общей гидрофобности и фторарил-арильных взаимодействиях) (Фиг.2) и эффекты его "несбалансированных" аналогов, содержащих одну замену на фтор в орто-, мета- или пара-положении (обозначенных 2F-Phe, 3F-Phe или 4F-Phe, Фиг.2B-2D, соответственно) на стабильность инсулина.
Как полагают, PheB25 лежит на поверхности мономера инсулина и в растворе обращен в растворитель, обладая меньшей структурной организацией, чем PheB24. О его биологическом значении также свидетельствует известная в клинике мутация (LeuB25), приводящая к диабету у человека. TyrB26 как PheB24 лежит на краю гидрофобного ядра вблизи неполярных остатков IleA2, ValA3 и ValB12. Исследования с помощью перекрестного фото-сшивания показывают, что боковые цепи каждого из остатков В24, В25 и В26 контактируют с рецептором инсулина. В димерах и гексамерах инсулина остатки В24-В26 и симметричные остатки В24'-В26', как полагают, участвуют в образовании межмолекулярного анти-параллельного β-листа. Ароматические боковые цепи на этих позициях, как полагают, стабилизируют границу β-листа и упаковку мономеров.
Предполагается, что замены по настоящему изобретению могут быть введены в любой из существующих аналогов инсулина. Например, предусмотренные в настоящем документе замены на галогенированный фенилаланин (X-Phe) могут быть введены в дополнение к человеческому инсулину в аналоги инсулина, такие как инсулин лизпро, инсулин аспарт, другие модифицированные инсулины или аналоги инсулина, или в инсулины из различных фармацевтических препаратов, такие как регулярный инсулин, инсулин NPH, инсулин Ленте или инсулин Ультраленте. Инсулин аспарт включает замену AspB28 и продается под торговой маркой Novalog®, инсулин лизпро включает замены LysB28 и ProB29 и продается под торговой маркой Humalog®. Эти аналоги описаны в патентах США №№5149777 и 5474978, описания которых включены в настоящий документ в качестве ссылки. Оба указанных аналога известны как быстродействующие инсулины.
Замены на галогенированный Phe в положениях В24, В25 и/или В26 также могут быть введены в аналоги человеческого инсулина, которые ранее не использовали в клинике, но которые могут быть полезны в научных целях, такие как инсулин DKP, более подробно описанный ниже, или минипроинсулин, аналог проинсулина, содержащий дипептидный (Ala-Lys) линкер между А-цепью и В-цепью инсулина вместо нормального соединяющего района между С-концевьм остатком В-цепи и N-концевым остатком А-цепи из 35 аминокислот. Включение галогенированных ароматических остатков в позиции В24, В25 или В26 в DKP-инсулин (или другой аналог инсулина, который содержат AspB10 или проявляет большую аффинность к рецептору, чем человеческий инсулин) может уменьшить его аффинность к рецептору до сходной с аффинностью человеческого инсулина или меньшей аффинности, что потенциально позволит использовать его в клинике. Таким образом, перекрестное связывание аналогов инсулина с митогенным IGFR также может быть уменьшено.
Для сравнения в SEQ. ID. NO. 1 приведена аминокислотная последовательность человеческого проинсулина.
SEQ. ID. NO. 1 (проинсулин)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr-Arg-Arg-Glu-Ala-Glu-Asp-Leu-Gln-Val-Gly-Gln-Val-Glu-Leu-Gly-Gly-Gly-Pro-Gly-Ala-Gly-Ser-Leu-Gln-Pro-Leu-Ala-Leu-Glu-Gly-Ser-Leu-Gln-Lys-Arg-Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
Аминокислотная последовательность А-цепи человеческого инсулина приведена в SEQ. ID. NO. 2.
SEQ. ID. NO. 2 (А-цепь)
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
Аминокислотная последовательность В-цепи человеческого инсулина приведена в SEQ. ID. NO. 3.
SEQ. ID. NO. 3 (В-цепь)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr
Аминокислотная последовательность В-цепи человеческого инсулина может быть модифицирована заменой на галогенированный Phe в положении В24, В25 или В26. Пример такой последовательности приведен в SEQ. ID. NO 4, где Хаа представляет собой Tyr или Phe. Галоген, используемый в любой из указанных замен, может представлять собой, например, фтор, хлор или бром.
SEQ. ID. NO. 4
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Xaa-Thr-Pro-Lys-Thr [Хаа представляет собой Tyr или Phe]
Комбинации с другими заменами также подпадают под настоящее изобретение. Предусматривается, что замены по настоящему изобретению также могут быть комбинированы с заменами из известных аналогов инсулина. Например, аминокислотная последовательность аналога В-цепи инсулина человека, содержащая замены LysB28 ProB29 инсулина лизпро (Humalog®), в которую также может быть введена одна из замен на галогенированный Phe, приведена в SEQ. ID. NO. 5. Кроме того, аминокислотная последовательность аналога В-цепи инсулина человека, содержащая замену AspB28 инсулина аспарт, в которую также может быть введена замена F-PheB24, приведена в SEQ. ID. NO. 6.
SEQ. ID. NO. 5
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Xaa-Thr-Lys-Pro-Thr [Хаа представляет собой Tyr или Phe]
SEQ. ID. NO. 6
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Xaa-Thr-Asp-Lys-Thr [Хаа представляет собой Tyr или Phe]
Замена F-PheB24 также может быть введена в сочетании с другими заменами аналога инсулина, например, заменами остатков А4, А8 и/или В1 на His, как описано более подробно в находящейся в совместном рассмотрении Международной заявке № PCT/US07/00320 и заявке США №12/160,187, описания которых приведены в качестве ссылки в настоящем документе. Например, замена F-PheB24 может сопровождаться заменами [HisA4, HisA8] и/или HisB1 в аналоге инсулина или аналоге проинсулина с аминокислотной последовательностью, приведенной в SEQ. ID. NO. 7.
SEQ. ID. NO. 7
Rl-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-R2-Thr-R3-R4-Thr-Xaa0-35-Gly-Ile-Val-R5-Gln-Cys-Cys-R6-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn;
где R1 представляет собой His или Phe; R2 представляет собой Tyr или Phe, R3 представляет собой Pro, Lys или Asp, R4 представляет собой Lys или Pro; R5 представляет собой His или Glu; R6 представляет собой His или Thr и где Хаа0-35 представляет собой 0-35 любых аминокислот или разрыв в аминокислотной цепи,
и где присутствует, по меньшей мере, одна замена, выбранная из следующей группы аминокислотных замен:
R1 представляет собой His; и
R6 представляет собой His; и
R5 и R6 вместе представляют собой His.
Замены на галогенированный Phe в положениях В24, В25 или В26 могут быть также введены в одноцепочечный аналог инсулина, как описано в находящейся в совместном рассмотрении предварительной заявке США №60/828,153, описание которой включено в настоящий документ в качестве ссылки.
Замены на фторированные аминокислоты были введены в генноинженерный высокоактивный мономерный инсулин, DKP-инсулин, который содержит замены AspB10 (D), LysB28 (K) и ProB29 (P). Эти три замены на поверхности В-цепи, как полагают, препятствуют образованию димеров и гексамеров инсулина. Использование генноинженерного мономерного инсулина обходит искажающие эффекты самоассоциации при анализе стабильности инсулина. Структура DKP-инсулина напоминает кристаллическую структуру протомера. Последовательность полипептидной цепи В инсулина DKP приведена в SEQ. ID. NO. 8, где Хаа представляет собой Tyr или Phe.
SEQ. ID. NO. 8 (последовательность В-цепи DKP)
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-Asp-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Xaa-Thr-Lys-Pro-Thr
Аналоги DKP-инсулина были получены полусинтетически с помощью катализа трипсином с очисткой с помощью высокоэффективной жидкостной хроматографии (Mirmira, R. G., Tager H. S., 1989 J. Biol. Chem., 264: 6349-6354). В методе использовали (1) синтетический октапептид (N)-F*FYTKPT (включающий модифицированный остаток (F*) и замену "KP" (подчеркнуто); SEQ ID NO 9) и (2) усеченный аналог des-октапептид[B23-В30]-AspB10-инсулин (SEQ. ID. NO. 16). Так как октапептид отличается от последовательности В23-В30 дикого типа (GFFYTPKT; SEQ ID NO 10) заменой ProB28 и LysB29 (курсив), при обработке трипсином защита ε-аминогруппы лизина не требовалась. Des-октапептид (15 мг) и октапептид (15 мг) растворяли в смеси диметилацетамид/1,4-бутандиол/0,2 М Трис-ацетат (рН 8), содержащей 10 мМ ацетата кальция и 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА) (35:35:30 по объему, 0,4 мл). Конечное значение рН доводили до 7,0 10 мкл N-метилморфолина. Раствор охлаждали до 12°С и добавляли 1,5 мг ТРСК-трипсина, после чего инкубировали в течение 2 дней при 12°С. Дополнительные 1,5 мг трипсина добавляли через 24 часа. Реакционную смесь закисляли 0,1% трифторуксусной кислотой и продукт очищали препаративной обратнофазной ВЭЖХ (С4). Анализ с помощью масс-спектрометрии с ассоциированной с матрицей лазерной десорбцией/ионизацией с детектором времени пролета (MALDI-TOF; Applied Biosystems, Фостер Сити, Калифорния) в каждом конкретном случае дал ожидаемые значения (данные не приведены). Общий протокол для твердофазного синтеза см. Merrifield и др., 1982 г.Biochemistry. 21: 5020-5031. 9-флуорен-9-ил-метокси-карбонил (F-moc)-защищенные аналоги фенилаланина были приобретены у Chem-Impex International (Вуд Дейл, Иллинойс).
Спектры кругового дихроизма (КД) были сняты при 4°С и 25°C с использованием спектрополяриметра Aviv (Weiss и др., Biochemistry. 39: 15429-15440). Образцы содержали приблизительно 25 мкМ DKP-инсулина или его аналога в 50 мМ фосфате калия (рН 7,4); образцы разводили до 5 мкМ для исследования индуцированной гуанидином денатурации при 25°С. Для измерения свободной энергии разворачивания белка денатурационный переход аппроксимировали моделью с двумя состояниями нелинейным методом наименьших квадратов, как описано в работе Sosnick и др., Methods Enzymol. 317: 393-409. Полученные методом КД данные θ(x), где х обозначает концентрацию денатуранта, аппроксимировали нелинейным методом наименьших квадратов уравнением

где x обозначает концентрацию гуанидина и θA и θB представляют собой значения базовой линии для нативного и развернутого состояний. Базовую линию аппроксимировали прямыми 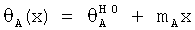 и
и 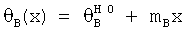 до и после перехода. Значения m, полученные аппроксимацией переходов разворачивания вариантов, оказались ниже значения m, полученного аппроксимацией кривой разворачивания инсулина дикого типа. Чтобы проверить, является ли полученное различие и очевидное изменение ΔGU результатом неспособности измерить сигнал КД в полностью развернутом состоянии, были проведены расчеты, данные для которых были получены экстраполяцией значений КД до уровня плато при более высоких концентрациях гуанидина; при этом были получены идентичные оценки m и ΔGU.
до и после перехода. Значения m, полученные аппроксимацией переходов разворачивания вариантов, оказались ниже значения m, полученного аппроксимацией кривой разворачивания инсулина дикого типа. Чтобы проверить, является ли полученное различие и очевидное изменение ΔGU результатом неспособности измерить сигнал КД в полностью развернутом состоянии, были проведены расчеты, данные для которых были получены экстраполяцией значений КД до уровня плато при более высоких концентрациях гуанидина; при этом были получены идентичные оценки m и ΔGU.
Относительную активность определяется как отношение количества аналога инсулина к количеству человеческого инсулина дикого типа, необходимого для вытеснения 50 процентов специфически связанного 125I-человеческого инсулина. Были использованы препараты мембран человеческой плаценты, содержащие рецептор инсулина (IR), как известно в уровне техники. Мембранные фрагменты (0,025 мг белка/пробу) инкубировали с 125I-меченым инсулином (активность приблизительно 30000 импульсов в минуту) в присутствии выбранной концентрации немеченого аналога в течение 18 часов при 4°С в конечном объеме 0,25 мл 0,05 М Трис-HCl с 0,25% (масса/объем) бычьего сывороточного альбумина при рН 8. После инкубации смесь разводили 1 мл ледяного буфера и центрифугировали (10000 g) в течение 5 мин при 4°С. Супернатант удаляли аспирацией и в осадке мембран измеряли радиоактивность. Полученные данные корректировали на неспецифическое связывание (остаточная радиоактивность мембраны в присутствии 1 мкМ человеческого инсулина). Чтобы избежать артефактов, связанных с истощением лиганда, во всех анализах процент связанного в отсутствие конкурирующих лигандов трейсера составлял менее 15%. Для мониторинга изменений активности аналога инсулина в ходе инкубации при 37°С проводили дополнительные анализы на связывание инсулинового рецептора с использованием известного в уровне техники анализа с захватом антителами в планшете для микротитрования. Планшеты для микротитрования (Nunc Maxisorb) инкубировали в течение ночи при 4°C с AU5 IgG (100 мкл/лунку 40 мг/мл раствора в фосфатно-солевом буфере). Данные по связыванию анализировали с помощью модели с последовательным связыванием в двух сайтах. Соответствующий анализ с антителами в планшете для микротитрования с использованием рецепторов IGF I типа использовали для оценки перекрестного связывания с этим гомологичным рецептором.
Спектры кругового дихроизма (КД) в дальнем ультрафиолете монофторированных аналогов идентичны спектру исходного аналога (Фиг.3), небольшое искажение наблюдается в спектре F5-PheB24 аналога (Фиг.3, панель D). Стабильность и активность аналогов по связыванию рецептора представлены в Таблице 1. Модифицированные В24 остатки были введены в DKP-инсулин. Приведенные значения активности измерены по отношению констант диссоциации комплексов гормон-рецептор относительно человеческого инсулина; активность человеческого инсулина, таким образом, равна 1,0 по определению. Стандартные ошибки значений активности составляют менее 25%. Свободные энергии разворачивания (ΔGU) при 25°С оценивали на основе модели с двумя состояниями при экстраполяции к нулевой концентрации денатуранта. Время запаздывания указывает время (в днях), необходимое для начала образования фибрилл белка при легком перемешивании при 37°С в фосфатно-солевом буфере без цинка (рН 7,4).
Замена PheB24 на F5-Phe увеличивает стабильность DKP-инсулина на 0,8±0,1 ккал/моль при 25°С (Фиг.4, панель D). Несмотря на такое благоприятное воздействие на стабильность активность аналога незначительна (аффинность к рецептору составляет менее 1% по сравнению с исходным аналогом; Табл. 1 и Фиг.5.). Это уменьшение более значительно по сравнению с обычно наблюдаемым уменьшением при стандартной замене одной аминокислоты. Напротив, каждый монозамещенный аналог сохранил значительную активность: орто-замещенный - 37% по сравнению с человеческим инсулином, мета-замещенный - 100% и пара-замещенный - 43%. Указанные значения активности выше порога в 10% (соответствующего константе диссоциации гормона от рецептора <1 нм), как правило, достаточного для проявления терапевтической эффективности. 3F-PheB24 и 4F-PheB24 аналоги инсулина не являлись более стабильными (и, возможно, являлись незначительно менее стабильными) по сравнению с исходным аналогом (см. Фиг.4 и Таблицу 1), а 2F-PheB24-DKP-инсулин обладал, по меньшей мере, такой же стабильностью, как F5-Phe аналог (ΔΔGU=0,9±0,1 ккал/моль). Физическую стабильность аналогов оценивали в трех повторностях при инкубации в 60 мкМ фосфатно-солевом буфере (PBS) при рН 7,4, 37°С и легком помешивании. За состоянием образцов наблюдали в течение 20 дней или до появления осадка или помутнения в стеклянном флаконе. В образцах, содержащих аналоги F5-, 2F- и 3F-PheB24-DKP-инсулин (но не 4F-PheB24-DKP-инсулин) в течение более продолжительного времени (по отношению к исходному аналогу) не образовывались белковые фибриллы (Табл. 1). Таким образом, введение одного атома фтора способно увеличить стабильность мономерного аналога инсулина при сохранении сниженной, но клинически значимой активности; модификация может также увеличить время, в течение которого не происходит образование белковых фибрилл при легком перемешивании при рН 7,4 и 37°С.
В то время как замена F5-PheB24 сильно стабилизирует белок, модифицированный аналог инсулина не проявляет биологической активности. Примечательно, что региоспецифичные модификация 2F-PheB24 в равной степени увеличивает стабильность белка при сохранении существенной (хотя и уменьшенной) аффинности к рецептору инсулина.
Замены на фтор в виде орто-, мета-, пара- и пента-фторфенилаланина были введены в положения В24, В25 и В26 инсулина лизпро, как описано выше (в аналог инсулина, дополнительно содержащий замены LysB28, ProB29 (коммерческое название Humalog®)). Аналоги, содержащие орто-, мета-, пара- и пента-фторфенилаланин в положении В24 обозначены 2F-PheB24-KP-инсулин, 3F-PheB24-KP-инсулин, 4F-PheB24-KP-инсулина и F5-PheB24-KP-инсулин, соответственно. Аналоги, содержащие орто-, мета-, пара- и пента-фторфенилаланин в положении В25 обозначены 2F-PheB25-KP-инсулин, 3F-PheB25-KP-инсулин, 4F-PheB25-KP-инсулина и F5-PheB25-KP-инсулин, соответственно. Аналоги, содержащие орто-, мета-, пара- и пента-фторфенилаланин в положении В26 обозначены 2F-PheB26-KP-инсулин, 3F-PheB26-KP-инсулин, 4Р-PheB26-KP-инсулина и F5-PheB26-KP-инсулин, соответственно. Кроме того, в положение В24 инсулина лизпро были введены замены на орто-бромфенилаланин и орто-хлорфенилаланин. Эти аналоги обозначены 2Bг-PheB24-KP-инсулин и 2Cl-PheB24-KP-инсулин, соответственно. Обозначения соответствующих аналогов KP-инсулина и DKP-инсулина сокращены в Таблицах и Фигурах до KP и DKP, слово "инсулин" для краткости опущено.
Для введения галогенированной замены в положение В24 использовали синтетический октапептид (N)-F*FYTKPT (включающий модифицированный остаток (F*) и замену "KP" (подчеркнуто); SEQ ID NO 9) и усеченный аналог des-октапептид[В23-В30]-инсулин (аминокислота в положении В 10 соответствует аминокислоте в инсулине дикого типа, SEQ. ID. NO. 17). Для введения фторированной замены в положение В25 использовали синтетический октапептид (N)-FF*YTKPT (фторированный остаток (F*) и замена "KP" (подчеркнуто); SEQ ID N0 9) и усеченный аналог des-октапептид[В23-В30]-инсулин (аминокислота в положении В 10 соответствует аминокислоте в инсулине дикого типа, SEQ. ID. NO. 17). Для введения замены на фторированный фенилаланин в положение В26 использовали синтетический октапептид (N)-FFF*TKPT (фторированный остаток (F*) и замена "KP" (подчеркнуто); SEQ ID NO 18) и усеченный аналог des-октапептид[В23-В30]-инсулин (аминокислота в положении В10 соответствует аминокислоте в инсулине дикого типа, SEQ. ID. NO. 17). Для введения замен на хлорированный и бромированный фенилаланин в положение В24 (2Cl и 2Br) использовали синтетический октапептид (N)-FF*YTKPT (фторированный остаток (F*) и замена "KP" (подчеркнуто); SEQ ID NO 9) и усеченный аналог des-октапептид[В23-В30]-инсулин (аминокислота в положении В10 соответствует аминокислоте в инсулине дикого типа, SEQ. ID. NO. 17). Des-октапептид (15 мг) и октапептид (15 мг) растворяли в смеси диметилацетамид/1,4-бутандиол/0,2 М Трис-ацетат (рН 8), содержащей 10 мМ ацетата кальция и 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА) (35:35:30 по объему, 0,4 мл). Конечное значение рН доводили до 7,0 10 мкл N-метилморфолина. Раствор охлаждали до 12°С и добавляли 1,5 мг ТРСК-трипсина, после чего инкубировали в течение 2 дней при 12°С. Дополнительные 1,5 мг трипсина добавляли через 24 часа. Реакционную смесь закисляли 0,1% трифторуксусной кислотой и продукт очищали препаративной обратнофазной ВЭЖХ (С4). Анализ с помощью масс-спектрометрии с ассоциированной с матрицей лазерной десорбцией/ионизацией с детектором времени пролета (MALDI-TOF; Applied Biosystems, Фостер Сити, Калифорния) в каждом конкретном случае дал ожидаемые значения Относительную активность и константы диссоциации определяли, как описано выше.
Полученные для аналогов с заменой на фторированный фенилаланин в положении В24 данные представлены в Таблице 2. Для сравнения при тех же условиях при 37°С были получены данные для инсулина дикого типа и 2F-PheB24-DKP-инсулина. Данные эксперимента при 37°С приведены ниже в Таблице 3. Данные для аналогов инсулина лизпро с заменами на фторированный фенилаланин в положениях В24, В25 и В26 и заменами на бром- и хлор-фенилаланин представлены ниже в Таблице 4.
Данные по связыванию рецептора для аналогов инсулина лизпро, полученные в анализе с конкурентным вытеснением, также представлены на Фиг.6. Для анализа использовали В-изоформу рецептора инсулина и 125I-TyrA14-человеческий инсулин в качестве трейсера.
Аналоги инсулина лизпро, содержащие замену на хлор- или бром-фенилаланин в положении В24 (2Cl-PheB24-KP-инсулин и 2Bг-PheB24-KP-инсулин, соответственно), исследовали на способность понижать уровень сахара в крови у крыс с диабетом, измеренную активность сравнивали с негалогенированным инсулином лизпро (KP). У самцов крыс линии Льюис (вес тела ~250 г) с помощью стрептозотоцина вызывали диабет. Аналоги инсулина лизпро 2Cl-PheB24-KP-инсулин и 2Bг-PheB24-KP-инсулин очищали с помощью ВЭЖХ, сушили до порошкообразного состояния и растворяли в разбавителе для инсулина (Eli Lilly Corp). Аналог инсулина в количестве 20 мкг или 6,7 мкг вводили крысам подкожно в момент времени = 0 в 100 мкл разбавителя. Кровь собирали из обрезанного кончика хвоста в момент времени 0 и через каждые 10 мин до 90 мин. Уровень глюкозы в крови измеряли с помощью глюкометра Hypoguard Advance Micro-Draw. Изменения концентрации глюкозы в крови (в миллиграммах (мг) на декалитр (дл) в час (ч)) приведены в Таблицах 5 и 6 (исследования проводили с различными партиями крыс, поэтому в экспериментах различается фармакодинамический ответ при контрольной инъекции КР-инсулина; верхняя строка в каждой Таблице).
Как видно из Таблиц 5 и 6, содержащие галогенированный фенилаланин аналоги инсулина за исключением 2F-PheB24-KP-инсулина равны или превосходят по своей активности инсулин лизпро (Humalog®). Активность 2F-PheB24 аналога инсулина может быть восстановлена до уровня активности KP-инсулина путем включения в 2F-PheB24-DKP-аналог замены AspB10 (строка 2 Таблицы 6). Кроме того, наличие галогенированного фенилаланина в положении В24 увеличивает время, необходимое для образования фибрилл в три - четыре раза, то есть в описанных выше экспериментальных условиях KP-инсулин образует фибриллы приблизительно через 3 дня, у аналогов с заменой PheB24 на 2F-PheB24, 2Cl-PheB24 или 2Bг-PheB24 время образования фибрилл составляет 10-12 дней. Введенные модификации также увеличивают термодинамическую стабильность белка (при исследовании денатурации под действием гуанидина) в пределах от 0,5 до 1 ккал/моль (Табл.4).
Константы диссоциации (Кд) были определены с помощью анализа с конкурентным вытеснением с использованием 125I-TyrA14-инсулина (любезно предоставленного компанией Ново-Нордиск) и очищенного и солюбилизированного рецептора инсулина (изоформа В) в анализе с захватом антителами в планшете, как описано Whittaker и Whittaker (2005 J. Biol. Chem. 280: 20932-20936), с незначительными изменениями; на С-конце генно-инженерных рецепторов была добавлена метка в виде тройного повтора эпитопа FLAG (DYKDDDDK; SEQ ID NO 11) и в планшете для микротитрования были сорбированы анти-Flag М2 моноклональные антитела (Sigma). Чтобы избежать артефактов, связанных с истощением лиганда, процент связанного в отсутствие конкурирующих лигандов трейсера составлял менее 15%. Для получения константы диссоциации данные по связыванию анализировали методом нелинейной регрессии с использованием гетерологичной модели конкуренции (Wans, 1995, FEBS Lett 360: 111-114).
Результаты измерения перекрестного связывания выбранных аналогов инсулина с рецептором IGF приведены в Таблице 7. Человеческий инсулин в указанных условиях связывается с IGFR в 260 раз слабее, чем IGF-I. Перекрестное связывание AspB10-инсулина с IGFR увеличено в два раза, а перекрестное связывание широко используемого в клинике аналога ArgB31, ArgB32, GlyA21-инсулина (инсулин Гларгин™; Лантус™) увеличено в три раза. Такое увеличение перекрестного связывания с IGFR нежелательно, так как введение крысам линии Спрэг-Доули AspB10-инсулина связано с увеличением вероятности возникновения опухолей молочных желез, а недавние клинические исследования дают возможность предположить, что использование пациентами инсулина Лантус приводит к дозозависимому увеличению риска развития различных видов рака. (Последовательность IGF-I содержит Glu в позиции В 10, аналогичный по отрицательному заряду AspB10. Считается, что увеличенное перекрестное связывание инсулина Лантус обусловлено также двумя основными остатками на С-конце В-цепи. Поскольку IGF-I также содержит Lys в положении В28 и Pro в положении В29, вполне возможно, что KP-инсулин может демонстрировать небольшое увеличение перекрестного связывания, но полученные данные не являются достаточно четкими, чтобы доказать это.) DKP-инсулин обладает увеличенным в шесть раз перекрестным связыванием с IGFR. Примечательно, что это увеличение может быть скомпенсировано заменой на орто-монофторфенилаланин в положении В24: 2F-PheB24-DKP-инсулин проявляет такой же низкий уровень перекрестного связывания, как и человеческий инсулин дикого типа. Его способность снижать содержание глюкозы в крови крыс с диабетом аналогично способности человеческого инсулина (Табл. 6). Поскольку 2F-PheB24-DKP-инсулин является мономерным даже при концентрации белка >0,5 мМ, этот аналог потенциально может быть полезен как сверхбыстродействующий и сверхстабильный препарат инсулина для клинического использования. Аффинность перекрестного связывания 2Cl-PheB24-KP-инсулина и 2Bг-PheB24-KP-инсулина также низка и аналогична аффинности человеческого инсулина. Эти аналоги также полностью активны при введении крысам с диабетом (Табл.5).
Были получены спектры КД для человеческого инсулина, KP-инсулина (лизпро) и аналогов инсулина с галогенированным PheB24, как описано выше. На Фиг.7А и 7В приведены результаты исследования денатурации белка под действием различных концентраций гуанидингидрохлорида, полученные методом КД. На Фиг.7а приведены результаты сравнения человеческого инсулина (сплошная линия) и KP-инсулина (пунктирная линия, "исходный" аналог) с аналогами KP-инсулина, содержащими замены на монофторированный по 2, 3 или 4 положению фенилаланин в позиции В24 инсулина (темные треугольники, темные квадраты и незаполненные круги, соответственно). На Фиг.7В приведены результаты сравнения человеческого инсулина (сплошная линия) и KP-инсулина (пунктирная линия, "исходный" аналог) с аналогами, содержащими замены на 2Cl- или 2Br-PheB24 (темные перевернутые треугольники и незакрашенные треугольники, соответственно). Рассчитанные термодинамические параметры приведены выше в Таблице 4. За частичным разворачиванием следили по средней остаточной эллиптичности при 222 нм и 25°С.
Чтобы продемонстрировать, что галогенированные замены вписываются в структуру инсулина и не вызывают обширных конформационных возмущений, с помощью ЯМР были получены структуры отдельных аналогов инсулина. 1Н-ЯМР-спектры представлены на Фиг.8А и 8В. Полученная методом ЯМР структура мономера 2Cl-PheB24-KP-инсулина в растворе аналогична структуре KP-инсулина; также, полученная методом ЯМР структура 2F-PheB24-DKP-инсулина (также в виде мономера в растворе) аналогична структуре DKP-инсулина. Качественный анализ ЯМР-спектров 2F-PheB24-KP-инсулина и 2Bг-PheB24-KP-инсулина также указывает на то, что их структура аналогична нативной.
Была также определена кристаллическая структура 2F-PheB24-KP-инсулина и 4F-PheB24-KP-инсулина в форме стабилизированных цинком гексамеров в присутствии консерванта фенола (данные не приведены). Структуры аналогичны тем, которые ранее были получены для KP-инсулина в форме стабилизированных цинком гексамеров в присутствии фенола. В каждом случае конформация гексамера представляет собой T3Rf 3, гексамер содержит два осевых иона цинка и три связанных молекулы фенола. Хорошо заметна электронная плотность, соответствующая атому галогена. Структура поверхностей, необходимых для формирования димера и тримера, не изменена в галогенированных аналогах, что позволяет предположить, что с использованием описанных аналогов могут быть получены фармацевтические препараты, аналогичные тем, которые получают для KP-инсулина и других быстродействующих аналогов инсулина.
В изобретении предусмотрен способ лечения пациента, включающий введение галогенированного аналога инсулина пациенту. В одном примере галогенированный аналог инсулина представляет собой аналог инсулина, содержащий галогенированный фенилаланин, такой как фторированный, хлорированный и бромированный фенилаланин. В одном конкретном примере галогенированный фенилаланин представляет собой 2F-PheB24, 2F-PheB25 или 2F-PheB26. В другом примере галогензамещенный аналог инсулина дополнительно содержит одну или несколько дополнительных замен в молекуле инсулина, направленных на изменение скорости действия аналога инсулина при введении пациенту. В еще одном примере аналог инсулина вводят с помощью внешней или имплантируемой инсулиновой помпы. Аналог инсулина по настоящему изобретению может также содержать другие модификации, например, С-конец В-цепи может быть соединен с N-концом А-цепи, как описано более подробно в находящейся в совместном рассмотрении Международной заявке № PCT/US07/080467, раскрытие которой включено в настоящий документ в качестве ссылки.
В изобретении предусмотрены фармацевтические композиции, которые могут включать описанные аналоги инсулина и которые могут дополнительно включать цинк. Ионы цинка могут быть включены в такие композиции при молярном соотношении к гексамеру аналога инсулина от 2,2 до 3,0. В такой композиции концентрация аналога инсулина, как правило, составляет приблизительно от 0,1 до 3 мМ; концентрация до 3 мМ может быть использована в резервуаре инсулиновой помпы. Модифицированные аналоги инсулина для приема во время еды могут быть включены в фармацевтическую композицию, как описано для (а) "регулярных" композиций инсулина Humulin™ (Eli Lilly and Co), Humalog™ (Eli Lilly and Co), Novalin™ (Ново-Нордиск) и Novalog™ (Ново-Нордиск) и Других быстродействующих композиций инсулина, одобренных в настоящее время для использования человеком, (б) для композиции "NPH" и других аналогов инсулина и (в) смесей таких композиций.
Вспомогательные вещества могут включать глицерин, глицин, буферы и соли, антимикробные консерванты, такие как фенол и мета-крезол; как известно, последний консервант повышает стабильность гексамеров инсулина. Такие фармацевтические композиции могут быть использованы для лечения пациентов с сахарным диабетом или других медицинских состояний путем введения физиологически эффективного количества композиции пациенту.
Также предусмотрены нуклеиновые кислоты, включающие последовательность, которая кодирует полипептид аналога инсулина, и содержит последовательность, кодирующую, по меньшей мере, В-цепь инсулина с фторированным фенилаланином в положении В24, В25 и В26. Это может быть достигнуто путем введения стоп-кодона (такого как амбер-кодон TAG) в положение В24 в сочетании с супрессорной тРНК (амбер-супрессор, использующий амбер-кодон) и соответствующей тРНК-синтетазой, что приводит к включению нестандартной аминокислоты в полипептид в ответ на стоп-кодон, как описано Furter, 1998, Protein Sci. 7: 419-426; Xie и др., 2005, Methods. 36: 227-238. Конкретная последовательность может зависеть от предпочтительно используемых кодонов для того вида, в который будет введена последовательность нуклеиновой кислоты. Нуклеиновая кислота может также кодировать другие модификации инсулина дикого типа. Нуклеиновая кислота может кодировать модифицированную последовательность А- или В-цепи, содержащую дополнительные замены или вставки в последовательность полипептида, или модифицированные аналоги проинсулина. Нуклеиновая кислота также может быть частью вектора экспрессии, такой вектор может быть введен в клетку-хозяина, такую как прокариотическая клетка-хозяин, например, в Е.coli, или эукариотическая клетка, такая как клетка штамма или линии S.cereviciae или Pischia pastoris.
Например, предусматривается, что для экспрессии полипептида В-цепи в дрожжах Pischia pastoris и других микроорганизмах могут быть получены синтетические гены. Нуклеотидная последовательность В-цепи со стоп-кодоном в положении В24 для включения галогенированного фенилаланина в это положение может представлять собой любой из следующих вариантов:
(а) с ко донами, предпочтительными для человека:
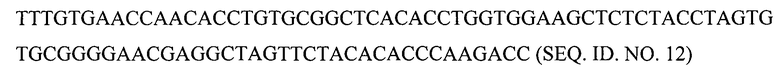
(б) с кодонами, предпочтительными для Pischia:
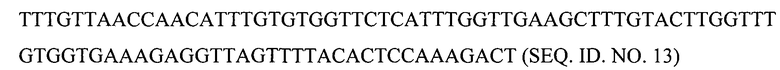
Аналогичным образом, полноразмерная кДНК проинсулина с предпочтительными для человека кодонами и стоп-кодоном в положении В24 для включения галогенированного фенилаланина в это положение может иметь последовательность SEQ. ID NO. 14.

Кроме того, полноразмерная кДНК человеческого проинсулина со стоп-кодоном в положении В24 для включения галогенированного фенилаланина в это положение и с предпочтительными для Р.pastoris кодонами, может иметь последовательность SEQ. ID. NO. 15

Аналогичным образом, нуклеотидная последовательность В-цепи со стоп-кодоном в положении В25 для включения галогенированного фенилаланина в это положение может представлять собой любой из следующих вариантов:
(а) с кодонами, предпочтительными для человека
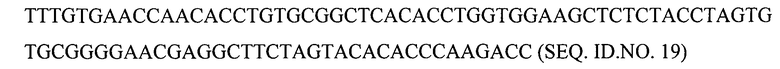
(б) с кодонами, предпочтительными для Pischia

Полноразмерная кДНК проинсулина с предпочтительными для человека кодонами и стоп-кодоном в положении В25 для включения галогенированного фенилаланина, такого как фторированный фенилаланин, в это положение может иметь последовательность SEQ. ID NO. 21.

Кроме того, полноразмерная кДНК человеческого проинсулина со стоп-кодоном в положении В25 для включения галогенированного фенилаланина, такого как фторированный фенилаланин, в это положение и с предпочтительными для Р.pastoris кодонами, может иметь последовательность SEQ. ID. NO. 22.

Кроме того, нуклеотидная последовательность В-цепи со стоп-кодоном в положении В26 для включения галогенированного фенилаланина в это положение может представлять собой любой из следующих вариантов:
(а) с кодонами, предпочтительными для человека
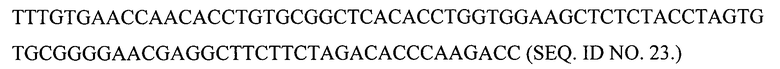
(б) с кодонами, предпочтительными для Pischia
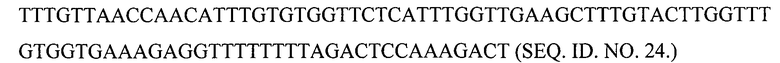
Полноразмерная кДНК проинсулина с предпочтительными для человека кодонами и стоп-кодоном в положении В26 для включения галогенированного фенилаланина в это положение может иметь последовательность SEQ. ID NO. 25.

Кроме того, полноразмерная кДНК человеческого проинсулина со стоп-кодоном в положении В26 для включения галогенированного фенилаланина в это положение и с предпочтительными для Р.pastoris кодонами, может иметь последовательность SEQ. ID. NO. 26.

Возможны другие варианты этих последовательностей, кодирующие те же полипептидные последовательности с учетом синонимов в генетическом коде.
На основании вышеприведенного описания изобретения очевидно, что галогенированные аналоги инсулина являются объектами настоящего изобретения. Описанные аналоги инсулина характеризуются увеличенной термодинамической стабильностью, стабильностью к образованию фибрилл и способностью снижать уровень глюкозы в крови. Содержащие галогенированный фенилаланин аналоги инсулина также характеризуются уменьшенной перекрестной реактивностью с инсулиноподобным фактором роста (IGFR). Следует понимать, что в изобретение могут быть введены любые изменения, очевидно находящиеся в рамках настоящего изобретения и, таким образом, без отхода от духа раскрытого и описанного здесь изобретения может быть сделан выбор конкретных его элементов и компонентов.
Чтобы продемонстрировать, что методы тестирования и анализа, описанные в настоящем документе, хорошо понятны специалистам в данной области, приведен следующий список литературы.
Furter, R., 1998. Expansion of the genetic code: Site-directed p-fluoro-phenylalanine incorporation in Escherichia coli. Protein Sci. 7: 419-426.
Merrifield, R.В., Vizioli, L.D. и Boman, H.G., 1982. Synthesis of antibacterial peptide cecropin A (1-33). Biochemistry. 21: 5020-5031.
Mirmira, R.G., and Tager, H.S. 1989. Role of the phenylalanine B24 side chain in directing insulin interaction with its receptor: Importance of main chain conformation. J. Biol. Chem. 264: 6349-6354.
Sosnick, Т.R., Fang, X., и Shelton, V.M. 2000. Application of circular dichroism to study RNA folding transitions. Methods Enzymol. 317: 393-409.
Wang, Z.X. 1995. An exact mathematical expression for describing competitive biding of two different ligands to a protein molecule. FEBS Lett. 360: 111-114.
Weiss, M.A., Hua, Q.X., Jia, W., Chu, Y.C., Wang, R.Y. and Katsoyannis, P.G. 2000. Hierarchiacal protein "un-design": insulin's intrachain disulfide bridge tethers a recognition α-helix. Biochemistry 39: 15429-15440.
Whittaker, J. and Whittaker, L. 2005. Characterization of the functional insulin binding epitopes of the full length insulin receptor. J. Biol. Chem. 280: 20932-20936.
Xie, J. and Schultz, P.G. 2005. An expanding genetic code. Methods. 36: 227-238.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ИНСУЛИНА, ХАРАКТЕРИЗУЮЩИЕСЯ СНИЖЕННОЙ АФФИННОСТЬЮ СВЯЗЫВАНИЯ С РЕЦЕПТОРАМИ ИНСУЛИНА | 2019 |
|
RU2816595C2 |
| КОНЪЮГАТЫ ИНСУЛИНА | 2019 |
|
RU2809189C2 |
| Аналоги инсулина | 2017 |
|
RU2769476C2 |
| Аналоги инсулина с пониженной аффинностью к рецептору инсулина и их применение | 2017 |
|
RU2764197C1 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| Конъюгат физиологически активного вещества длительного действия и его применение | 2018 |
|
RU2773823C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2019 |
|
RU2796019C2 |
| ВАРИАНТ ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-2 ИЛИ ЕГО ПРОИЗВОДНОЕ | 2019 |
|
RU2799437C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА IGF-1 | 2021 |
|
RU2836869C1 |
| КОМПОЗИЦИИ IL-12, НАЦЕЛЕННЫЕ НА EDB | 2019 |
|
RU2758143C1 |








Изобретение относится к области биотехнологии, конкретно к получению аналогов инсулина, и может быть использовано в медицине в качестве лекарственного средства для снижения уровня глюкозы в крови у пациента. Аналог инсулина содержит полипептидную В-цепь, включающую галогенированный фенилаланин в положении В24, что обеспечивает увеличенную стабильность по сравнению с негалогенированным инсулином или аналогом инсулина. При этом галогенированный фенилаланин представляет собой орто-монофторфенилаланин, орто-монобромфенилаланин или орто-монохлорфенилаланин. Обусловленная галогенированием стабилизация инсулина позволяет упростить лечение пациентов с сахарным диабетом в развивающихся странах, где отсутствует доступ к холодильному оборудованию. 5 н. и 6 з.п. ф-лы, 8 ил., 7 табл.
1. Аналог инсулина, содержащий полипептидную В-цепь, включающую галогенированный фенилаланин в положении В24, что обеспечивает увеличенную стабильность по сравнению с негалогенированным инсулином или аналогом инсулина, где галогенированный фенилаланин представляет собой орто-монофторфенилаланин, орто-монобромфенилаланин или орто-монохлорфенилаланин.
2. Аналог инсулина по п. 1, где аналог представляет собой аналог инсулина млекопитающего.
3. Аналог инсулина по п. 2, где аналог представляет собой аналог человеческого инсулина.
4. Аналог инсулина по п. 2, где аминокислотная последовательность полипептидной цепи В выбрана из группы, состоящей из SEQ ID NO: 4-8, где Хаа в положении В26 является Tyr.
5. Нуклеиновая кислота, кодирующая аналог инсулина по пп. 1-4, где галогенированный фенилаланин кодируется стоп-кодоном, причем нуклеиновая кислота экспрессирует аналог инсулина в сочетании с супрессорной тРНК и соответствующей тРНК-синтетазой.
6. Нуклеиновая кислота по п. 5, где стоп-кодон представляет собой последовательность TAG.
7. Нуклеиновая кислота по п. 6, включающая последовательность, приведенную в любой из SEQ ID NO: 12-15.
8. Вектор экспрессии, содержащий последовательность нуклеиновой кислоты по пп. 5, 6 или 7.
9. Клетка-хозяин, трансформированная вектором экспрессии по п. 8, для продуцирования аналога инсулина по пп. 1-4.
10. Применение аналога инсулина по п. 1, В-цепь которого включает галогенированный фенилаланин в положении В24, в качестве лекарственного средства для снижения уровня глюкозы в крови у пациента, где галогенированный фенилаланин представляет собой орто-монофторфенилаланин, орто-монобромфенилаланин или орто-монохлорфенилаланин.
11. Применение по п. 10, где аминокислотная последовательность полипептидной В-цепи выбрана из группы, состоящей из SEQ ID NO: 4-8, где Хаа в положении В26 является Tyr.
| RAGHAVENDRA G | |||
| MIRMIRA ET AL., Disposition of the phenylalanine B25 side chain during insulin-receptor and insulin-insulin interactions, BIOCHEMISTRY, 1991, v.30, n.33, p.8222-8229 | |||
| RAGHAVENDRA G | |||
| MIRMIRA ET AL., Importance of the character and configuration of residues B24, B25, and B26 in insulin-receptor interactions, J | |||
| OF BIOL | |||
| CHEM., 1991, v.266, n.3, p.1428-1436 | |||
| ИНСУЛИНОВЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ УГЛЕВОДЫ | 1997 |
|
RU2204411C2 |
Авторы
Даты
2015-07-10—Публикация
2009-07-31—Подача